DENGAN EKSTRUDER ULIR GANDA TANPA
DIE
INNEKE KUSUMAWATY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Fisikokimia Protein dari Bekatul Padi yang Distabilisasi dengan Ekstruder Ulir Ganda TanpaDie adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Inneke Kusumawaty
INNEKE KUSUMAWATY. Isolasi dan Karakterisasi Fisikokimia Protein dari Bekatul Padi yang Distabilisasi dengan Ekstruder Ulir Ganda TanpaDie. Dibimbing oleh DEDI FARDIAZ, NURI ANDARWULAN, SRI WIDOWATI, dan SLAMET BUDIJANTO.
Tahun 2013, produksi padi nasional mencapai 71.900.000 ton. Jika jumlah ini dikonversi menjadi beras maka akan diproduksi sekitar 7.190.000 ton bekatul padi. Bekatul yang kaya protein dan minyak merupakan sumber pangan yang potensial bagi manusia. Namun, bekatul mudah tengik. Dengan proporsi asam lemak tak jenuh pada minyak lebih dari 70%, bekatul padi menjadi sangat rentan terhadap oksidasi oleh lipoksigenase dan lipase. Oleh karena itu, stabilisasi dengan pemanasan perlu segera dilakukan untuk menonaktifkan enzim dalam bekatul padi dan mencegah proses ketengikan. Ekstruder ulir ganda tanpadiedigunakan dalam penelitian untuk stabilisasi bekatul padi dengan pemanasan sebelum dilakukan isolasi protein. Pemanasan dapat menurunkan kualitas gizi dan sifat fungsional protein sehingga perlu dilakukan optimasi proses ekstrusi berdasarkan kombinasi suhu dan kecepatan ulir. Untuk melaksanakan penelitian ini, padi diperoleh dari unit penggilingan padi di Sumedang. Proses penggilingan dan penyosohan padi dilakukan di F-Technopark, Institut Pertanian Bogor. Bekatul mengandung 12.0-15.6% protein dengan komposisi asam amino yang mirip dengan konsentrat protein kedelai. Isolasi protein memungkinkan penggunaannya dalam formulasi makanan dan pengembangan produk makanan baru. Sehubungan dengan hal tersebut, tujuan dari penelitian ini adalah: 1) untuk menentukan kondisi optimum proses stabilisasi bekatul padi dengan ekstruder ulir ganda tanpadie; 2) untuk mempelajari stabilitas oksidatif bekatul; 3) untuk mempelajari sifat fisikokimia konsentrat protein dari bekatul yang distabilisasi dengan ekstruder ulir ganda tanpadie; dan 4) untuk mempelajari pengaruh stabilisasi bekatul padi dengan ekstruder ulir ganda tanpa die terhadap fraksi proteinnya. Penelitian tahap satu dan dua menggunakan bekatul padi dari varietas Ciherang. Penelitian tahap tiga dan empat menggunakan bekatul padi dari varietas Pandanwangi dan Ciherang.
Optimasi proses stabilisasi bekatul padi dengan ekstruder ulir ganda tanpa die
dilakukan dengan menggunakan Response Surface Methodology (RSM), untuk mendapatkan kondisi optimum yaitu suhu 130.96oC dan kecepatan ulir 26.65 Hz (91 rpm). Stabilisasi bekatul padi mengakibatkan penurunan kelarutan protein yang diikuti dengan penurunan rendemen isolasi protein.
Kondisi proses stabilisasi bekatul padi dengan ekstruder ulir ganda tanpadieyang diterapkan pada bekatul padi dapat menurunkan aktivitas lipoksigenase dan lipase, serta meningkatkan stabilitas oksidatif minyak bekatul padi tanpa menyebabkan kerusakan lebih lanjut pada komponen protein.
Differential Scanning Calorimetry(DSC) menunjukkan bahwa entalpi konsentrat
Hasil penelitian menunjukkan bahwa berat molekul protein bekatul berkisar 11.19-60.29 kDa. Tiga fraksi protein telah diidentifikasi, yaitu albumin, globulin, dan glutelin. Kadar protein terlarut pada fraksi glutelin dari konsentrat protein bekatul Pandanwangi lebih besar daripada Ciherang. Dua fraksi glutelin dipisahkan, yaitu α-glutelin (30-39 kDa) dan β-α-glutelin (19-25 kDa).
Sifat fungsional dan berat molekul fraksi protein dari konsentrat protein dari bekatul padi yang distabilisasi tetap sama dengan yang tidak distabilisasi. Pola kelarutan, aktivitas dan stabillitas emulsi, kapasitas dan stabilitas buih, kemampuan menahan air dan minyak konsentrat protein dari bekatul Ciherang dan Pandanwangi yang distabilisasi sama dengan yang tidak distabilisasi. Hasil ini menunjukkan bahwa konsentrat protein yang diisolasi dari bekatul padi yang distabilisasi berpotensi sebagai ingredien makanan.
Kata Kunci: Bekatul padi, ekstruder ulir ganda tanpadie,respons surface methodology,
INNEKE KUSUMAWATY. Isolation and Characterization Physicochemical Protein from Stabilized Rice Bran using No Die Double Screw Extruder. Under direction of DEDI FARDIAZ, NURI ANDARWULAN, SRI WIDOWATI, and SLAMET BUDIJANTO.
It is estimated the national production of paddy is 71.9 million tons. If this amount of paddy is converted to rice, approximately 7.19 million tons of rice bran will be produced. Rice bran which is rich in protein and oil is a potential source of human food; however, its use is still limited because it becomes rancid easily. With unsaturated fatty acids proportion of more than 70% rice bran oil is susceptible to oxidation by endogenous lipoxygenase and lipase.Therefore, immediate heat stabilization is needed to inactivate the enzyme in rice bran and thereby prevent oil rancidity. No die double screw extrusion was used in this research to heat stabilize the rice bran before its protein isolated. Because the heat may decrease nutritional and functional properties of protein, the extrusion process is optimized based on temperature and screw speed combination. For the purpose of this study, paddy was obtained from rice milling unit located in Sumedang and further dehulled and debranned at F-Technopark, Bogor Agricultural University.
Rice bran contains 12.0 to 15.6% protein with amino acids composition similar to soy protein concentrate. Isolation of proteins allows their use in food formulation and development of new food products. In relation to that, the purpose of this study were: 1) to determine the optimum conditions of rice bran stabilization with no die double screw extruder; 2) to study the oxidative stability of rice bran; 3) to study the physicochemical properties of protein concentrates isolated from stabilized rice bran; and 4) to study the effect of stabilization with no die double screw extruder on rice bran protein fraction. Rice bran of Ciherang variety was used in the first and second study. Rice bran of Ciherang and Pandanwangi varieties were used in the third and fourth study.
Rice bran stabilization with no die double screw extruder was optimized using response surface method to provide optimum conditions, which were temperature of 130.96oC and a screw speed of 26.65 Hz (91 rpm). Stabilization of rice bran resulted in a decrease in protein solubility, followed by a decrease in the yield of protein isolation.
Heat stabilization with no die double screw extruder applied in rice bran is found to be able to decrease lipoxygenase and lipase activities and thereby improve the oxidative stability of rice bran oil without causing further damage to the protein component.
Differential Scanning Calorimetry (DSC) test showed that the enthalpy of protein concentrates isolated from stabilized rice bran of Ciherang and Pandanwangi variety were 200.98 J/g and 173.14 J/g, greater than protein concentrates isolated from unstabilized rice bran of Ciherang and Pandanwangi variety were 136.03 J/g and 109.72 J/g. Heating in the extrusion process had resulted in protein denaturation thus increasing the heat absorption capacity.
bran protein concentrates remain the same as those of unstabilized rice bran protein concentrates. The pattern in solubility, emulsion activity and stabillity, foam capacity and stability, water and oil absorption capacity of stabilized rice bran protein concentrates from Ciherang and Pandanwangi are similar with those of unstabilized protein concentrates. These results show that the protein concentrate isolated from stabilized rice bran is a potential source for food ingredient.
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Pangan
DENGAN EKSTRUDER ULIR GANDA TANPA
DIE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor
2. Dr. Ir. Bram Kusbiantoro, MS
Balai Besar Penelitian Tanaman Padi, Kementerian Pertanian
Penguji pada Ujian Terbuka : 1. Dr. Ir. S. Joni Munarso, MS
Balai Besar Penelitian dan Pengembangan Pascapanen, Kementerian Pertanian 2. Dr. Ir. Dahrul Syah, M.Sc. Agr
NRP : F 261100061
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Dedi Fardiaz, M.Sc Ketua
Prof. Dr. Ir. Nuri Andarwulan, M.Si Anggota
Prof. Dr. Ir. Sri Widowati, M.App.Sc Anggota
Prof. Dr. Ir. Slamet Budijanto, M.Agr Anggota
Diketahui
Ketua Program Studi Ilmu Pangan
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Ratih Dewanti Hariyadi, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr.
Tanggal Ujian: 26 Agustus 2014
Puji dan syukur kepada Allahsubhanahu wa ta’alaatas segala karunia-Nya
sehingga disertasi dengan judul “Isolasi dan Karakterisasi Fisikokimia Protein dari Bekatul Padi yang Distabilisasi dengan Ekstruder Ulir Ganda Tanpa Die” dapat diselesaikan. Disertasi ini merupakan salah satu syarat untuk mencapai gelar Doktor pada Program Studi Ilmu Pangan, Sekolah Pascasarjana Institut Pertanian Bogor.
Sebagian hasil penelitian dalam disertasi ini telah diajukan sebagai artikel ilmiah pada beberapa jurnal, yaitu 1) Stabilisasi Bekatul dengan Ekstruder Ulir Ganda menggunakan Response Surface Methodology telah diterbitkan dalam Jurnal Penelitian Pascapanen Vol 10 (1) tahun 2013; dan 2) Characterization of Physicochemical Properties of Rice Bran Protein Concentrates From
Heat-Stabilized Rice Bran sedang dalam proses telaah pada Pakistan Journal
Agricultural and Sciences.
Terima kasih yang tulus disampaikan kepada Prof. Dr. Ir. Dedi Fardiaz, M.Sc selaku Ketua Komisi Pembimbing, Prof. Dr. Ir. Nuri Andarwulan, M.Si., Prof. Dr. Ir. Sri Widowati, M.App.Sc, dan Prof. Dr. Ir. Slamet Budijanto, M.Agr selaku anggota Komisi Pembimbing yang telah banyak memberikan motivasi, arahan, dan bimbingan hingga terselesaikannya disertasi ini. Terima kasih disampaikan kepada Prof. Dr. Ir. Maggy Thenawidjaya Suhartono; Dr. Ir. Bram Kusbiantoro, MS; Dr. Ir. S. Joni Munarso, MS; dan Dr. Ir. Dahrul Syah, M.Sc. Agr, sebagai penguji luar komisi pada ujian tertutup dan ujian terbuka, serta Dr. Ir. Endang Prangdimurti, MS (PS IPN), Prof. Dr. Ir. Ratih Dewanti Hariyadi, M.Sc (Ketua PS IPN), dan Prof. Dr. Ir. Sugiyono, M.Sc (Wakil Dekan Fateta) yang telah memberikan masukan mendasar pada keseluruhan isi disertasi ini.
Terima kasih kepada Dr. Ir. Momon Rusmono, MS selaku Sekretaris Badan Penyuluhan dan Pengembangan SDM Pertanian Kementerian Pertanian atas kesempatan dan ijin belajar yang diberikan. Terima kasih kepada Kementerian Pertanian atas bantuan beasiswa pendidikan tahun 2010-2013 melalui Badan Penyuluhan dan Pengembangan SDM Pertanian. Terima kasih kepada Rektor dan Dekan Sekolah Pascasarjana (SPs) IPB atas kesempatan mengikuti pendidikan Program Doktor di SPs IPB. Terima kasih kepada Ketua Program Studi IPN beserta staf; pimpinan, staf, dan laboran F-Technopark, Seafast Center, Departemen Ilmu dan Teknologi Pangan IPB, serta teman-teman dari Program Studi Ilmu Pangan 2008-2010, juga semua pihak yang telah membantu dalam pelaksanaan penelitian dan penyusunan disertasi.
Akhirnya, ungkapan terima kasih yang mendalam dan tak terhingga kepada orang tua, suami, dan anak-anakku atas doa dan dukungannya. Semoga karya ilmiah ini bermanfaat untuk pengembangan ilmu pengetahuan di bidang Teknologi Pangan dan bidang terkait lainnya.
Bogor, Agustus 2014
Halaman DAFTAR ISI
1. PENDAHULUAN... 1
Latar Belakang... 3
Tujuan Penelitian... 3
Hipotesa... 3
Manfaat Penelitian... 4
Daftar Pustaka... 4
2. METODOLOGI PENELITIAN... 7
Tempat dan Waktu Penelitian... 7
Bahan dan Alat Penelitian... 7
Pelaksanaan penelitian... 7
Penelitian 1. Stabilisasi Bekatul dengan Ekstruder Ulir Ganda MenggunakanResponse Surface Methodology... 8 Penelitian 2. Stabilitas Oksidatif Bekatul yang Distabilisasi dengan Ekstruder Ulir Ganda TanpaDie...... 8
Penelitian 3. Characterization Physicochemical Properties of Rice Bran Protein Concentrates from Heat Stabilized Rice Bran... 8 Penelitian 4. Pengaruh Stabilisasi Bekatul dengan Ekstruder Ulir Ganda TanpaDieterhadap Fraksi Protein Bekatul... 9 Metode Analisis... 11
Daftar Pustaka... 21
3. STABILISASI BEKATUL DENGAN EKSTRUDER ULIR GANDA MENGGUNAKAN RESPONSE SURFACE METHODOLOGY... 23 Pendahuluan... 24
Bahan dan Metode... 25
Hasil dan Pembahasan... 28
Simpulan... 37
Daftar Pustaka... 38
4. STABILITAS OKSIDATIF BEKATUL YANG DISTABILISASI DENGAN EKSTRUDER ULIR GANDA TANPADIE...... 41 Pendahuluan... 41
Bahan dan Metode... 42
Hasil dan Pembahasan... 43
Simpulan... 46
STABILIZED RICE BRAN... 48
Introduction... 48
Material and Method... 49
Result and Discussion... 51
References... 57
6. PENGARUH STABILISASI BEKATUL DENGAN EKSTRUDER ULIR GANDA TANPADIETERHADAP FRAKSI PROTEIN BEKATUL... 60
Pendahuluan... 60
Bahan dan Metode... 61
Hasil dan Pembahasan... 63
Simpulan... 67
Daftar Pustaka... 67
7. PEMBAHASAN UMUM... 70
Karakteristik dan Komposisi Kimia Bekatul... 70
Optimasi Proses Stabilisasi Bekatul dengan Ekstruder Ulir Ganda TanpaDie... 71 Isolasi dan Karakterisasi Fisikokimia Protein Bekatul... 76
Fraksinasi Konsentrat Protein Bekatul... 80
Daftar Pustaka... 82
8. SIMPULAN DAN SARAN... 85
Simpulan... 85
Saran... 85
1
PENDAHULUAN
Latar Belakang
Bekatul merupakan hasil samping penggilingan gabah yang kaya nutrisi karena mengandung protein, lemak, serat, mineral, vitamin B (Juliano 1985), vitamin E, dan -oryzanol (Imsanguan et al. 2008). Beberapa komponen gizi dalam bekatul bahkan lebih tinggi daripada beras sebagai hasil utama penggilingan gabah. Penggilingan gabah menghasilkan beras giling (60-65%), sekam (15-20%), bekatul (8-12%), dan menir (+5%) (Widowati 2001). Tahun 2013, produksi gabah kering giling (GKG) mencapai 71.28 juta ton. Produksi padi tahun 2014 diperkirakan sebesar 69.87 juta ton GKG atau mengalami penurunan sebesar 1.41 juta ton (1.98 persen) dibandingkan tahun 2013. Penurunan produksi diperkirakan terjadi karena penurunan luas panen seluas 265.31 ribu hektar (1.92 persen) dan produktivitas sebesar 0.03 kuintal/hektar (0.06 persen) (BPS 2014). Dengan target produksi padi 69.87 juta ton pada tahun 2014 maka dapat dihasilkan bekatul sebanyak 6.99 juta ton. Ketersediaan bekatul yang melimpah sangat potensial dimanfaatkan sebagai bahan pangan seperti makanan fungsional, sereal sarapan, minyak makan, roti, biskuit, dan ingredien pangan.
Umumnya, masyarakat Indonesia menyukai konsumsi beras dari padi varietas aromatik, seperti Pandanwangi dan Sintanur, dan padi varietas non aromatik yang pulen seperti Ciherang, IR 64, Memberamo, Way Apoburu, dan Ciliwung. Tanaman padi Pandanwangi dan Ciherang disukai oleh petani karena produktivitasnya tinggi (Suprihatno et al. 2011). Menurut Ruskandar (2009), luas pertanaman padi di pulau Jawa didominasi oleh padi sawah seperti Ciherang (44.8-55.1%).
Keterbatasan pemanfaatan bekatul hingga saat ini disebabkan bekatul mudah tengik. Kandungan lemak pada bekatul dengan proporsi asam lemak tak jenuh lebih dari 70% (Ubaidillah 2010) mengakibatkan bekatul mudah mengalami ketengikan yang disebabkan oleh enzim lipase dan lipoksigenase (Malekian et al.
2000). Proses abrasif selama penggilingan mengakibatkan lipase dan lemak kontak sehingga proses hidrolisis berlangsung. Asam lemak yang dihasilkan akan dioksidasi oleh lipoksigenase menjadi hidroperoksida yang kemudian mengalami degradasi membentuk senyawa volatil seperti aldehid, keton, dan alkohol yang tercium sebagai bau tengik(Malekian et al. 2000). Oleh karena itu, lipase dan lipoksigenase dalam bekatul harus segera diinaktivasi pasca penggilingan gabah untuk mencegah ketengikan. Proses ini disebut stabilisasi bekatul (Randall et al. 1985). Stabilisasi bekatul menggunakan pemanasan telah dilaporkan, seperti
microwave (Malekian et al. 2000), pratanak (da Silva et al. 2006), uap panas (Pourali et al. 2009), ekstruder ulir tunggal (Malekian et al. 2000; Randall et al. 1985), dan ekstruder ulir ganda (Ubaidillah 2010; Fuh et al. 2001).
Stabilisasi menggunakan panas lebih efektif untuk bekatul yang akan digunakan sebagai bahan pangan. Proses pemasakan ekstrusi pada suhu tinggi (cooking extrusion) dalam waktu singkat (high temperature short time, HTST)
proses otomatis, dan cakupan bahan baku luas (Fellows 2009). Ekstruder ulir ganda berpotensi sebagai alat stabilisasi bekatul karena dapat digunakan secara kontinyu dan diskontinyu berintegrasi dengan mesin penggilingan gabah. Bahan akan memperoleh panas dari dinding barel dan kedua ulir yang bergesekan sehingga proses pencampuran bahan dan distribusi panas lebih merata (Harper JM 1982).
Umumnya stabilisasi bekatul dilakukan sebagai persiapan bahan baku ekstraksi minyak(Pourali et al. 2009; Thanonkaew et al. 2012) dan produk yang dihasilkan berupa pelet karena adanya die (cetakan) pada bagian keluaran (Fuh & Chiang 2001). Sedangkan, stabilisasi bekatul dengan ekstruder ulir ganda tanpa
die sebagai persiapan bahan baku isolat protein belum pernah dilaporkan. Optimasi proses stabilisasi untuk mendapatkan kombinasi suhu dan kecepatan ulir yang tepat sangat penting karena penggunaan suhu ekstrusi yang tinggi dan waktu yang lama memungkinkan terjadi penurunan nutrisi dan protein kehilangan sifat fungsionalnya (Fellows 2009). Penggunaan suhu ekstrusi yang tinggi ( >135oC) dilaporkan mengakibatkan peningkatan nilai peroksida karena terjadi perpindahan logam dari ulir dan barel ke permukaan bahan (Artz et al. 1992).
Optimasi proses stabilisasi bekatul dapat dilakukan dengan menggunakan rancangan komposit terpusat (central composite design, CCD) dilanjutkan analisis dengan metode tanggap permukaan (response surface methodology, RSM) pada program Design Expert 7.0®. Beberapa penelitian menggunakan RSM untuk
menentukan kondisi optimum proses (Anuonye et al. 2007; Silpradit et al. 2010). Metode RSM dapat membantu merancang model penelitian, mengurangi jumlah perlakuan dalam penelitian dan membantu mengevaluasi interaksi perlakuan yang diberikan untuk mendapatkan proses yang optimal (Lenth 2009).
Pengukuran stabilitas bekatul terhadap oksidasi dapat dilakukan menggunakan uji Rancimat dengan menentukan periode induksi. Periode induksi dapat ditentukan karena produk-produk polar yang dihasilkan selama proses oksidasi dapat dimonitor menggunakan alat pengukur konduktivitas. Semakin lama periode induksi diperoleh suatu minyak semakin tahan minyak tersebut terhadap oksidasi (Velasco et al. 2004; Abramovic & Abram 2005; Madawala et al. 2012). Metode ini dapat menghemat waktu, penggunakan alat, dan bahan kimia di laboratorium (Farhoosh 2007).
Penelitian tentang isolasi dan karakterisasi fisikokimia protein dari bekatul yang distabilisasi masih sedikit dilaporkan (Zhang et al. 2012; Xia et al. 2012), dan pengaruh stabilisasi bekatul dengan ekstruder ulir ganda tanpa die terhadap kelarutan protein dan fraksi protein dalam isolat protein bekatul juga masih sangat terbatas. Metode isolasi protein bekatul pada kondisi alkali banyak digunakan karena kemampuan ekstraksi cukup tinggi mencapai 97% (Cagampang et al. 1966), 72,63% (Jiamyangyuen et al. 2005), 44,4% (Theerakulkait et al. 2006), 58,92% (Chandi & Sogi 2007), dan 32,9% (Zhang et al. 2011). Perbedaan rendemen protein yang diperoleh tersebut disebabkan oleh perbedaan perlakuan pendahuluan terhadap bahan baku seperti stabilisasi bekatul dan kondisi proses isolasi.
Umumnya fraksinasi protein dilakukan terhadap bahan baku protein seperti tepung gandum (Zilic et al. 2011), beras (Agboola et al. 2005; Khan et al. 2010), sorgum (Ali et al. 2009), bekatul (Hamada 1997). Fraksinasi bekatul dengan metode Osborne menggunakan pelarut air (fraksi albumin), 2% NaCl (fraksi globulin), 70% etanol (fraksi prolamin), 0.1 M asam asetat (fraksi glutelin), dan 0.1 M NaOH (fraksi glutelin) menghasilkan fraksi albumin dengan total protein (analisis Kjeldahl) tertinggi, diikuti fraksi globulin, glutelin, dan prolamin (Hamada 1997; Cao et al. 2009). Namun, persentase protein terlarut dari masing-masing fraksi tidak dilaporkan.
Proses stabilisasi bekatul dengan ekstruder ulir ganda tanpa die dan pengaruhnya terhadap sifat fungsional protein dan fraksi protein bekatul berperan penting dalam pengolahan bahan pangan sehingga perlu dilakukan suatu penelitian. Penelitian difokuskan pada penentuan kondisi optimum stabilisasi bekatul dengan ekstruder ulir ganda tanpa die dan mempelajari karakter fisikokimia konsentrat protein dari bekatul yang distabilisasi, serta profil fraksi protein bekatul. Karakter fisikokimia protein seperti berat molekul, komposisi asam amino, struktur, dan stabilitas terhadap panas akan berpengaruh terhadap sifat fungsional protein bekatul dan menentukan aplikasinya dalam pangan (Zhang
et al. 2012; Xia et al. 2012; Jiamyangyuen et al. 2005; Chandi & Sogi 2007; Yeom et al. 2010).
Tujuan Penelitian
Penelitian ini bertujuan untuk : (1) menentukan kondisi optimum stabilisasi bekatul dengan ekstruder ulir ganda tanpa die sebagai bahan baku isolat protein; (2) mempelajari stabilitas oksidatif bekatul yang telah distabilisasi dengan ekstruder ulir ganda tanpa die; (3) mempelajari karakter fisikokimia protein bekatul yang distabilisasi dengan ekstruder ulir ganda tanpa die; dan (4) mempelajari pengaruh stabilisasi bekatul dengan ekstruder ulir ganda tanpa die
terhadap fraksi protein bekatul.
Hipotesis Penelitian
2. Bekatul yang distabilisasi dengan ekstruder ulir ganda tanpa die memiliki stabilitas oksidatif yang lebih tinggi daripada yang tidak distabilisasi.
3. Karakter fisikokimia protein bekatul dan fraksi protein dalam isolat protein yang dihasilkan dipengaruhi oleh perlakuan stabilisasi bekatul.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai karakter fisikokimia protein dari bekatul padi yang distabilisasi dengan ekstruder ulir ganda tanpa die dan kondisi proses ekstrusi yang optimum untuk stabilisasi bekatul padi sebagai bahan baku isolat protein.
Bekatul yang telah distabilisasi dengan ekstruder ulir ganda tanpa die
berpotensi dimanfaatkan sebagai pangan fungsional, snack, sereal sarapan, minyak makan, dan sumber protein ingredien pangan karena lebih stabil selama penyimpanan, nilai gizi yang terkandung didalamnya, serta ketersediaan yang melimpah sepanjang tahun.
Daftar Pustaka
Abramovic H, Abram V. 2005. Physico-chemical properties, composition and oxidative stability of Camelina sativa oil. Food Tech. Biotech. 43(1): 63-70 Agboola S, Darren Ng, Mills D. 2005. Characterization and functional properties
of Australian rice protein isolates. J. Cereal Sci. 41: 283-290
Ali NMM, El Tinay AH, Elkhalifa AEO, Salih OA, Yousif NE. 2009. Effect of alkaline pretreatment and cooking on protein fractions of a high-tannin sorghum cultivar. Food Chem. 114: 649-651
Anuonye JC, Badifu GIO, Inyang CU, Akpapunam MA. 2007. Effect of extrusion process variables on the amylose and pasting characteristic of acha/soybean extrudates using response surface analysis. Am. J. Food Tech. 2 (5): 354-365
Artz WE, Rao SK, Sauer RM. 1992. Lipid oxidation in extruded product during storage as affected by extrusion temperature and selected antioxidant. Di dalam: Kokini JL, Ho C, Karwe MC, editor: Food Extrusion Science and Technology. Marcel Dekker. hlm 449-459
[BPS] Biro Pusat Statisitik. 2014. Produksi Padi, Jagung, dan Kedelai (Angka Ramalan I Tahun 2014). Berita Resmi Statistik No. 50/07/Th. XVII [1 Juli 2014].
Cagampang GB et al. 1966. Studies on the extraction and composition of rice protein. Cereal Chem. 43 (2) : 2145-155
Cao X, Wen H, Li C, Gu Z. 2009. Differences in functional and biochemical characteristic of congenetic rice protein. J. Cereal Sci. 50: 184-189
Chandi GK, Sogi DS. 2007. Functional properties of rice bran protein concentrates. J. Food Eng. 79: 592–597
Farhoosh R. 2007. The effect of operational parameter of the rancimat method on the determination of the oxidative stability measures and shelf-life prediction of soybean oil. JAOCS 84: 205-209
Fellows PJ. 2009. Food Processing Technology. Third Edition, CRC Press. Woodhead Publ. Ltd.
Fuh W, Chiang B. 2001. Dephytinisation of rice bran and manufacturing a new food ingredient. J. Sci. Food andAgric. 81:1419-1425
Hamada JS. 1997. Characterization of protein fractions of rice bran to devise effective methods of protein solubilization. Cereal Chem. 74 (5):662–668 Harper JM. 1982. A comparative analsis of single and twin-screw extruder. Di
dalam Kokini JL, Ho C, Karwe MC, editor. Food Extrusion Science and
Technology. Marcel Dekker. hlm 139-148
Imsanguan P et al.β008. Extraction of α-tocopherol and -oryzanol from rice bran.
LWT:1417-1424
Jiamyangyuen S, Srijesdaruk V, Harper WJ. 2005. Extraction of rice bran protein concentrate and its application in bread. Songklanakarin J. Sci. Technol. 27: 55-64
Juliano BO. 1985. Rice Bran. Di dalam: Juliano BO, editor. Rice: Chemistry and Technology. 2nd Edition, The American Association of Cereal Chemists, Inc. hlm :647-681
Kahlon TS, Chow FI, Sayre RN, Betschart AA. 1992. Cholesterol-lowering in hamsters fed rice bran at various levels, defatted rice bran and rice bran oil.
J. Nutr. 122: 513-519
Khan N, Ali N, Rabbani MA, Masood MS. 2010. Diversity of glutelin alpha subunits in rice varieties from Pakistan. Pak. J. Bot. 42 (3): 2051-2057 Lenth RV. 2009. Rensponse surface methods in R, using RSM. J. Stat. Soft. 32
(7) : 1-17
Madawala SRP, Kochhar SP, Dutta PC. 2012. Lipid components and oxidative status of selected speciality oils. Grasas Y Aceites 63 (2): 143-151
Malekian F et al. 2000. Lipase and lipoxygenase activity, functionality, and nutrient losses in rice bran during storage. Buletin 870, Louisiana State University Agricultural Center.
Pourali O, Asghari FS, Yoshida H. 2009. Simultaneous rice bran oil stabilization and extraction using sub critical water medium. J. Food Eng. 95: 510-516 Randall JM et al. 1985. Rice bran stabilization by extrusion cooking for
extraction of edible oil. J. Food Sci. 50 (2): 361-364, 368.
Ruskandar A. 2009. Varietas Ciherang Makin Mendominasi. Warta Penelitian
dan Pengembangan Pertanian 31 (6): 11-13
Ryan EP. 2011. Bioactive food component and health properties of rice bran. JAVMA 234 (5): 593-600
Silpradit K, Tadakittasarn S, Rimkeeree H, Supanida S, Haruthaithanasan V. 2010. Optimization of rice bran protein hydrolysate production using alcalase.
Research Article As. J. Food Agro-Ind. 3(02): 221-231
Suprihatno B et al. 2011. Deskripsi Varietas Padi. Balai Besar Penelitian Tanaman Padi, Badan Litbang Pertanian, Kementerian Pertanian.
quality, and antioxidant properties of cold-pressed rice bran oil (Oryza saltiva L.). LWT Food Sci. Tech. 48: 231-236
Theerakulkait C, Chaiseri S, Mongkolkanchanasiri S. 2006. Extraction and some functional properties of protein extract from rice bran. Kasesart J. (Nat. Sci) 40: 209-214
Ubaidillah 2010. Stabilisasi bekatul dengan ekstrusi tanpa die [Thesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor
Velasco J, Andersen ML, Skibsted LH. 2004. Analytical, Nutritional and Clinical Methods: Evaluation of oxidative stability of vegetable oils by monitoring the tendency to radical formation. A comparison of electron spin resonance spectroscopy with the Rancimat method and differential scanning calorymetry. Food Chem. 85: 623-632
Wang M, Hettiarachchy NS, Qi M, Burks W, Siebenmorgen T. 1999. Preparation and functional properties of rice bran protein. J. Agric. Food Chem. 47: 411-416.
Widowati S. 2001. Pemanfaatan hasil penggilingan padi dalam menunjang sistem agroindustri di pedesaan. Buletin AgroBio 4(1) : 33 – 38
Xia N et al. 2012. Preparation and characterization of protein from heat stabilized rice bran using hydrothermal cooking combined with amylase pretreatment.
J. Food Eng. 110: 95-110.
Yeom H, Lee EH, Ha MS, Ha SD, Bae DH. 2010. Production and physicochemical properties of rice bran protein isolates prepared with autoclaving and enzymatic hydrolysis. J. Korean Soc. Appl. Biol. Chem. 53 (1): 62-70
Zhang HJ, Zhang H, Wang L, Guo XN. 2012. Preparation and functional properties of rice bran proteins from heat-stabilized defatted rice bran. Food Research Int. 47: 359-363.
2
METODOLOGI PENELITIAN
Tempat dan Waktu PenelitianPenelitian dilakukan di F-Technopark, Laboratorium Pusat Pengembangan Ilmu dan Teknologi Pangan dan Pertanian Asia Tenggara (SEAFAST Center), Laboratorium Departemen Ilmu dan Teknologi Pangan, Pusat Studi Satwa Primata di Institut Pertanian Bogor, Laboratorium Kimia di Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian Kementerian Pertanian, serta Pusat Sains dan Teknologi Bahan Maju di Badan Tenaga Nuklir Nasional (BATAN). Penelitian dilaksanakan pada bulan Desember 2012 sampai dengan Juli 2014.
Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini adalah bekatul varietas Ciherang dan Pandanwangi yang diperoleh dari Unit Penggilingan Gabah di Sumedang, Jawa Barat, standar asam linoleat (Wako), bovine serum albumin (Sigma), asam fitat (Sigma), minyak zaitun komersial, minyak kedelai komersial, konsentrat protein kedelai komersial, protein ladder 10-260 kDa (Fermentas), protein marker
7.5-230 kDa (Biorad Board Range 161-0318), bahan kimia standar analisis, dan bahan penunjang lainnya untuk analisis.
Alat-alat yang digunakan meliputi penggiling beras (Yanmar), penyosoh beras (Satake), ekstruder ulir ganda tanpa die (Berto), ayakan 100 mesh (Kotobuki), Metrohm 743 Rancimat (Metrohm AG, Herisau, Switzerland), rotary
evaporator (Buchi), pompa vakum, pengaduk magnetik (Stereomag), pemanas (Stereomag), homogenizer (Armfield L4R), sentrifus (Hermle Z 383 K), freeze drier (Labconco), spektrofotometer (UV 2450 Shimadzu), Fourier Transform Infrared Spectrophotometer (FTIR-Shimadzu Model IRPrestige-21), Differential Scanning Calorimetry (Perkin–Elmer DSC 7 Ver.9.01 2007), particel size analyzer Malvern (PSA), Mini-V 8.10 Vertical Gel Electrophoresis (Gibco BRL), Biorad Model 385 Gradient Former, Biorad Mini Protean II-Cell, High Pressure
Liquid Chromatography (HPLC), penangas goyang (Polyscience), timbangan, dan
alat gelas lainnya.
Pelaksanaan Penelitian
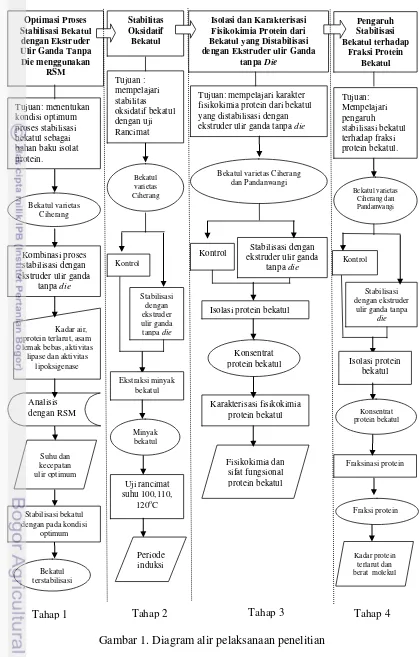
Penelitian 1. Optimasi Proses Stabilisasi Bekatul dengan Ekstruder Ulir Ganda Tanpa Die Menggunakan Response Surface Methodology
Gabah varietas Ciherang digiling dan disosoh untuk mendapatkan bekatul. Bekatul hasil penyosohan langsung distabilisasi dengan ekstruder ulir ganda tanpa
die dengan kombinasi perlakuan suhu dan kecepatan ulir, lalu diayak dengan pengayak 100 mesh. Optimasi proses stabilisasi bekatul menggunakan CCD dilanjutkan analisis dengan RSM menggunakan perangkat lunak Design Expert
7.0® (trial versión) dari Stat Ease (Lenth 2009). Proses stabilisasi bekatul dengan ekstruder merupakan kombinasi perlakuan suhu ekstruder (100-150oC) dan kecepatan ulir (15-35 Hz atau 50-117 rpm). Dengan CCD diperoleh 13 kombinasi perlakuan. Seluruh nilai respon diolah dengan RSM pada program Design Expert
7.0® yang akan memberikan model persamaan matematika pengaruh suhu dan kecepatan ulir terhadap setiap paramater yang diujikan. Model persamaan dapat dipergunakan untuk optimasi bila model dinyatakan signifikan (p<0.05) dan ketidaktepatan model dinyatakan tidak signifikan (p>0.05) pada taraf signifikansi 5% (Lenth 2009).
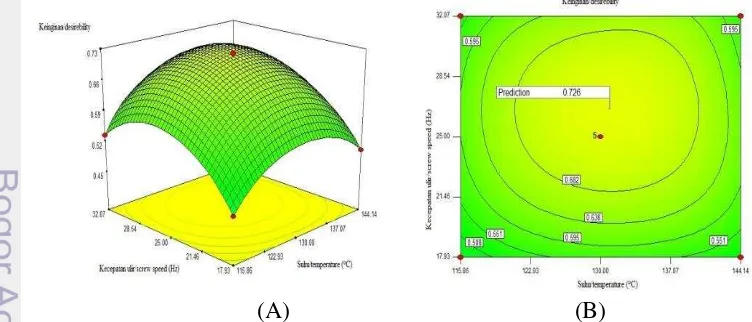
Respon dinyatakan optimal bila diperoleh nilai keinginan mendekati satu. Kondisi optimum yang diperoleh digunakan untuk produksi bekatul sebagai bahan baku tahapan penelitian selanjutnya. Bekatul yang telah distabilisasi dan bekatul kontrol disimpan pada suhu minus 20oCsampai dianalisis lebih lanjut.
Penelitian 2. Stabilitas Oksidatif Bekatul yang Distabilisasi dengan EkstruderUlir Ganda Tanpa Die
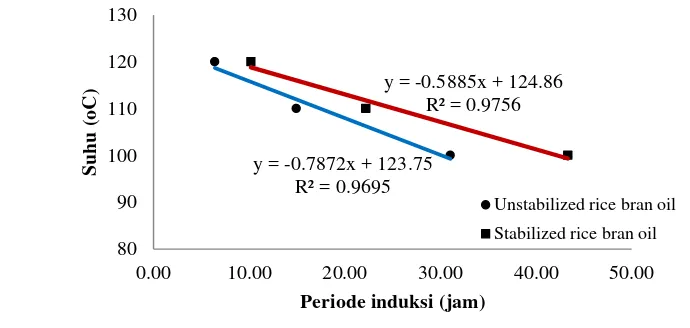
Pengujian stabilitas oksidatif bekatul menggunakan uji Rancimat pada minyak bekatul. Ekstraksi minyak bekatul dilakukan dengan menggunakan heksan yang diaduk dengan pengaduk magnetik selama 60 menit. Ekstraksi dilakukan sebanyak dua kali. Heksan dalam minyak dihilangkan dengan diuapkan menggunakan rotary evaporator lalu dihembus dengan gas nitrogen. Minyak bekatul dioksidasi pada suhu 100, 110, dan 120oC. Sebagai pembanding digunakan minyak dari bekatul yang tidak distabilisasi. Periode induksi dari tiga suhu tersebut diplot pada grafik dan diperoleh persamaan regresi linier. Melalui persamaan tersebut dapat diperkirakan periode induksi bahan pada suhu penyimpanan.
Penelitian 3. Isolasi dan Karakterisasi Fisikokimia Protein Bekatul yang Distabilisasi dengan Ekstruder Ulir Ganda Tanpa Die
Karakterisasi fisikokimia isolat protein bekatul meliputi analisis komposisi asam amino dengan HPLC, berat molekul (SDS PAGE), gugus fungsional pada struktur protein (FTIR), stabilitas protein terhadap pemanasan (DSC), dan distribusi ukuran partikel (PSA). Sifat fungsional isolat protein diuji pada variasi pH menggunakan bufer sitrat pH 2 dan bufer universal meliputi sifat kelarutan (pH 2-9), aktivitas dan stabilitas emulsi (pH 2, 4, 6, dan 8), kapasitas dan stabilitas buih (pH 2, 4, 6, dan 8), dan kapasitas penyerapan air dan minyak. Komponen antinutrisi asam fitat dianalisis untuk mengetahui kadar dalam bekatul dan isolat protein.
Penelitian 4. Pengaruh Stabilisasi Bekatul terhadap Fraksi Protein dalam Konsentrat Protein Bekatul
Fraksinasi terhadap konsentrat protein bekatul dilakukan untuk mengetahui pengaruhnya terhadap sifat fungsional protein yang diisolasi dari bekatul yang telah distabilisasi. Fraksinasi protein dilakukan menurut metode Osborne menggunakan lima pelarut, yaitu air, NaCl, etanol 70%, asam asetat, dan NaOH (Hamada et al. 1997). Supernatan dari masing-masing fraksi diukur kadar protein terlarut dengan metode Lowry (Lowry 1951) dan dianalisis berat molekul proteinnya dengan sodium dodecyl sulphat polyacrylamide gel electrophoresis
Gambar 1. Diagram alir pelaksanaan penelitian ekstruder ulir ganda tanpa die
Metode Analisis
Kadar air (AOAC 2005)
Cawan aluminium dikeringkan dengan oven pada suhu 105oC selama 60 menit, lalu didinginkan dalam desikator selama 30 menit. Cawan kering ditimbang sebelum digunakan. Sekitar 2 gram contoh bekatul ditimbang ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105oC selama 6 jam, lalu didinginkan dalam desikator dan ditimbang sampai diperoleh berat tetap. Kadar air dihitung dengan rumus sebagai berikut :
Kadar air (%bb) = a - (b - c) x 100 a
dengan: a = berat contoh awal (g); b = berat contoh dan cawan setelah dikeringkan (g); c = berat cawan kering kosong (g)
Kadar lemak (AOCS 2003)
Labu lemak dikeringkan dalam oven 105oC selama 60 menit, lalu ditimbang sampai diperoleh berat tetap. Sebanyak 10 g contoh bekatul dimasukkan dalam selongsong kertas saring lalu dimasukkan ke dalam alat soxhlet yang telah dihubungkan dengan labu lemak. Lemak dalam contoh diekstrak dengan heksan selama + 6 jam. Heksan diuapkan sehingga diperoleh ekstrak lemak lalu dikeringkan dalam oven 105oC selama 12 jam. Selanjutnya, didinginkan di dalam desikator dan ditimbang beratnya. Pengeringan diulangi sampai diperoleh berat tetap. Kadar lemak dihitung dalam basis basah (bb) dan basis kering (bk) dengan menggunakan rumus sebagai berikut :
Kadar lemak (%bb) = a - (b - c) x 100 a
Kadar lemak (%bk) = Kadar lemak (%bb) x 100 (100 - Kadar air)
dengan: a = berat contoh awal (g); b = berat contoh dan cawan setelah dikeringkan (g); c = berat cawan kering kosong (g)
Kadar protein (AOAC 2005)
Sebanyak 100 - 200 mg contoh dimasukkan ke dalam labu Kjeldahl, lalu ditambahkan 1.9 + 0.1 g K2SO4, 40 + 10 mg HgO, 2.0 + 0,1 mL H2SO4 pekat dan
2-3 butir batu didih. Bahan contoh dipanaskan sampai mendidih selama 1–1.5 jam sampai diperoleh cairan jernih. Setelah didinginkan, isi labu dipindahkan ke dalam labu destilasi dan dibilas menggunakan 1.0 – 2.0 mL air destilata sebanyak 5-6 kali. Air cucian dipindahkan ke labu destilata lalu ditambahkan 8.0-10 mL larutan 60% NaOH-5% Na2S2O3. Sebanyak 5.0 mL larutan H3BO3 dan 2-4 tetes
indikator merah metil-biru metil dimasukkan ke dalam erlemeyer dan diletakkan di bawah kondensor dengan ujung kondesor terendam di bawah larutan H3BO3.
dihitung dalam basis basah (bb) dan basis kering (bk) dengan menggunakan faktor koreksi 5.95 sebagai berikut :
Kadar N (%) = (v1 - v2) x N HCl x 14.007 x 100
w
dengan : v1 = volume larutan HCl untuk contoh (mL); v2 = volume larutan HCl
untuk blanko (mL); NHCl = konsentrasi larutan HCL (0.02 N); w = berat contoh
(mg)
Kadar protein (%bb) = %N x faktor koreksi (5.95)
Kadar protein (%bk) = Kadar protein (%bb) x 100
(100 - Kadar air)
Kadar asam lemak bebas (AOCS 2003)
Ekstraksi minyak bekatul dilakukan menurut Silpradit et al. (2010) yang dimodifikasi. Bekatul didispersikan dalam heksan (1:5 b/v) lalu diaduk dengan pengaduk magnet selama 60 menit. Selanjutnya dilakukan penyaringan vakum dengan kertas saring. Heksan dihilangkan dari presipitat menggunakan rotary
evaporator suhu 40oC selama 10-15 menit. Sisa heksan dalam minyak dihilangkan dengan dihembus gas N2.
Analisis kadar asam lemak bebas dilakukan menurut metode AOCS (2003). Sebanyak 2.0-2.5 gr minyak dimasukkan ke dalam erlenmeyer, lalu ditambahkan 25 mL alkohol 95% dan 3 tetes indikator fenolftalein, kemudian dititrasi dengan NaOH 0.1 N terstandarisasi hingga diperoleh warna pink tetap selama 10 detik. Volume titran (V) yang digunakan dicatat. Kadar asam lemak bebas dihitung sebagai asam oleat dengan persamaan:
Kadar asam lemak bebas sebagai oleat (%) = mL NaOH x N NAOH x 282
10x berat bahan
Kadar abu (AOAC 2005)
Kadar abu dianalisis menggunakan metode gravimetri. Cawan porselin kosong dan tutupnya dikeringkan dalam oven bersuhu 105oC hingga diperoleh berat tetap. Sebanyak 2 gram bahan ditimbang dalam cawan dan dimasukkan dalam tanur listrik bersuhu 550oC sampai pengabuan sempurna. Setelah pengabuan selesai, cawan didinginkan dalam desikator, lalu ditimbang hingga diperoleh berat tetap. Perhitungan kadar abu dilakukan dengan menggunakan rumus sebagai berikut :
Kadar abu (%bb) = Berat bahan akhir x100 Berat bahan awal
Kadar abu (%bk) = Kadar abu (%bb) x 100 (100 - Kadar air)
Kadar Karbohidrat
Kadar karbohidrat dihitung dalam basis basah (bb) dan kering (bk) dengan metode by difference.
Kadar protein terlarut (Lowry 1951)
Kurva standar protein merupakan seri konsentrasi bovine serum albumin
(BSA) 0.12; 0.24; 0.36; 0.48 dan 0.60 mg/mL, masing-masing sebanyak 4 mL ditambahkan 5.5 mL campuran 2% Na2CO3 dalam NaOH 0.1 N dan 1% CuSO4
dalam 2% NaK.Tartrat (1:50 v/v) dibiarkan selama 15 menit pada suhu kamar. Selanjutnya, ditambahkan 0.5 mL pereaksi folin ciocalteu. Campuran dibiarkan selama 30 menit. Absorbansi diukur dengan spektrofotometer pada 600 nm.
Bekatul bebas lemak didispersikan dalam air distilat (1:100 b/v) dan diaduk dengan pengaduk magnetik selama 30 menit lalu disentrifugasi 3000 g (3010 rpm) pada suhu 4oC selama 30 menit. Supernatan direaksikan dengan pereaksi Lowry dan diukur absorbansinya dengan spektrofotometer pada 600 nm.
Pembuatan bufer fosfat 0.05 M pH 7 (Sudarmadji et al. 1997)
Larutan 0.05 M NaH2PO4.H2O (berat molekul 137.97) (6.9 g dalam 1000 mL)
sebanyak 39 mL ditambahkan ke dalam 61 mL larutan 0.05 M Na2HPO4.2H2O
(berat molekul 177.97) (8.9 g dalam 1000 mL) lalu diaduk dengan pengaduk magnetik sampai homogen. Larutan ditepatkan sampai 200 mL dengan air deionisasi.
Pembuatan bufer borat 0.01 M pH 8.5 (Sudarmadji et al. 1997)
Larutan 0.01 M asam borat (berat molekul 61.82) (0.62 g dalam 1000 mL) sebanyak 50 mL ditambahkan ke dalam 17.5 mL larutan borax (berat molekul 381) (3.81 g dalam 1000 mL) lalu diaduk dengan dengan pengaduk magnetik sampai homogen. Larutan ditepatkan sampai 200 mL dengan air deionisasi.
Aktivitas lipase (Prabu et al. 1999 yang dimodifikasi)
Bekatul bebas lemak dalam bufer sodium fosfat 0.05 M pH 7 (1:10 b/v) diaduk dengan pengaduk magnetik selama 30 menit pada 10oC. Campuran disentrifugasi 2998 g (3010 rpm) pada suhu 4oC selama 20 menit. Supernatan merupakan ekstrak kasar lipase bekatul (Prabhu et al. 1999). Sebanyak 25 ml 7.5% (b/v) minyak zaitun dalam 7.5% (b/v) gum akasia dalam bufer sodium fosfat 0.05 M pH 7 dihomogenisasi membentuk emulsi. Ditambahkan 2 ml ekstrak kasar lipase ke dalam emulsi (Bhavani et al. 2012). Inkubasi dilakukan dalam penangas goyang 170 rpm selama 30 menit pada 30oC. Reaksi dihentikan dengan menambahkan 15 ml etanol. Selanjutnya, dititrasi dengan NaOH 0.05 N menggunakan indikator fenolftalein (Prabhu et al. 1999). Satu unit lipase setara dengan jumlah mol asam lemak yang dihasilkan dalam γ0 menit, yang dihitung berdasarkan banyaknya volume NaOH yang dibutuhkan dalam titrasi.
Aktivitas lipase ( mol asam lemak/menit) = (Vsampel - Vblanko) NNaOH x 1000
Vsubstrat
Aktivitas lipoksigenase (Malekian et al. 2000 yang dimodifikasi)
disentrifugasi pada 20.000 g selama 10 menit pada suhu 4oC. Supernatan dibuang dan endapan dikeringanginkan. Ke dalam endapan ditambahkan buffer fosfat 0.05 M pH 7 hingga 4 mL dan digunakan sebagai sumber enzim (Malekian et al. 2000).
Substrat dibuat dengan melarutkan 25 L asam linoleat dalam15 mL etanol dalam labu 25 mL. Air deionisasi ditambahkan sampai batas tera. Untuk pengujian, sebanyak 1 ml substrat ditambah 6 ml buffer borat pH 8.5 (konsentrasi 0.5 mM). Aktivitas enzim diukur dengan menggunakan spektrofotometer pada 234 nm, 25oC selama 3 menit. Kuvet contoh mengandung 2.9 mL larutan substrat dan 0.1 mL enzim. Pembentukan hidroperoksida dihitung dengan persamaan (Gardner 2001):
A234(AU/menit) = ɛ (liter/cm/mol) x c (mol/liter) x l (cm) Keterangan:
Aβγ4 = absorbansi pada βγ4
ɛ= koefisien molar 26.800 liter/cm/mL c= konsentrasi hidroperoksida (mol/liter) l = ketebalan cairan dalam kuvet (1 cm)
Uji Rancimat (AOCS 2003)
Stabilitas oksidatif bekatul ditentukan dengan mengukur periode induksi minyak bekatul pada alat Metrohm 743 Rancimat (Metrohm AG, Herisau, Switzerland). Skema alat disajikan pada Gambar 2. Minyak bekatul 5 g ditempatkan dalam tabung, pemanas diatur pada suhu perlakuan (100, 110, dan 120oC), dan kecepatan alir udara 20L/h air flow. Komponen oksidasi yang dihasilkan dialirkan dan ditampung dalam tabung yang berisi air deionisasi untuk diukur konduktivitasnya dengan detektor.
Gambar 2. Skema proses uji Rancimat (Bulletin Food and Beverage Asia 2010)
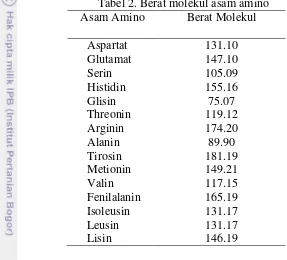
Analisis asam amino AOAC (2005)
Analisis asam amino menggunakan pereaksi ortoftalaldehid (OPA) yang dapat bereaksi dengan asam amino primer dalam suasana basa yang mengandung merkaptoetanol membentuk senyawa berfluoresensi, sehingga deteksi dapat dilakukan dengan detektor fluoresensi.
a. Persiapan bahan contoh
vakum; (4) udara dalam bahan dikeluarkan dengan mengeluarkan ampul dari dalam es kering-aseton agar mencair dan udara yang terlarut dapat keluar; (5) ampul divakum kembali selama 20 menit dan tutup; (6) ampul dimasukkan dalam oven suhu 110oC selama 24 jam; (7) ampul didinginkan dalam suhu kamar lalu dipindahkan bahan dalam labu evaporator 50 mL dan dibilas dengan 2 mL HCl 0.01 N. Sampel dikeringkan dengan freeze dryer dalam keadaan vakum. Sampel yang telah kering ditambah 5 mL HCl 0.01 N dan siap dianalisis.
b. Persiapan pereaksi
Pereaksi OPA dibuat dengan mencampurkan OPA (50 mg) dalam metanol ( 4 ml) dan merkaptoetanol (0.025 mL) lalu ditambahkan larutan brij-30 brij-30% (0.05 mL) dalam 1M bufer borat pH 10.4. Larutan disimpan dalam botol gelap pada suhu 4oC yang stabil selama 2 minggu. Pereaksi derivatisasi dibuat dengan mencampurkan larutan stok dan bufer kalium borat pH 10.4 (1:1) yang dibuat saat akan digunakan.
Fase mobil bufer A terdiri dari Na-Asetat pH 6.5 (0.025 M). Na-EDTA (0.05%), metanol (9.00%), dan tetrahidrofuran (1.00%) yang dilarutkan dalam 1 liter air kemurnian tinggi (high purity, HP) dan disaring dengan kertas
milipore 0.45 µm. Larutan ini stabil pada suhu kamar selama 5 hari dalam botol gelap yang diisi dengan gas He atau N. Bufer B terdiri atas metanol 95% dan air HP yang disaring dengan kertas milipore 0.45 µm.
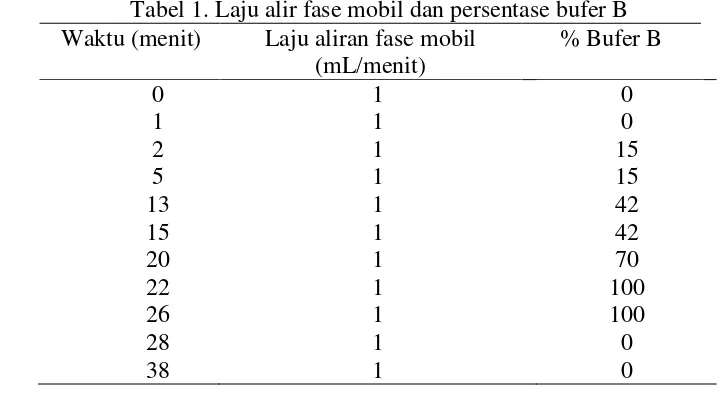
Analisis menggunakan HPLC tipe ICI dan kolom ODS dengan kondisi laju aliran fase mobil (1 mL/menit), detektor fluoresensi, dan fase mobil yaitu bufer A dan bufer B dengan gradien disajikan pada Tabel 1.
Tabel 1. Laju alir fase mobil dan persentase bufer B Waktu (menit) Laju aliran fase mobil
Perhitungan konsentrasi asam amino dalam bahan (dinyatakan dalam µmol AA) adalah:
= Luas puncak bahan x 0.5 µmol/mL x 5 mL Luas puncak standar
Persen asam amino total dalam bahan adalah: = µmol AA x Berat Molekul AA x 100
µg bahan
Tabel 2. Berat molekul asam amino
Analisis spektra FTIR (Adochitei & Drochioiu 2011)
Protein dianalisis menggunakan spektrofotometer IRPrestige-21. Protein (0.1 g) dihomogenisasi dengan KBr anhidrat, lalu diukur pada bilangan gelombang 400 - 4000 cm-1.
Analisis berat molekul konsentrat protein dengan SDS PAGE (Ahmed 2005) Analisis dengan SDS PAGE menggunakan 5% stacking gel dan 12%
separating gel. Sebanyak 100 L larutan protein 0.1% dimasukkan ke dalam ependof, ditambahkan 20 L bufer sampel lalu panaskan selama 2 menit dalam air mendidih 100°C. Sampel (10 L) dan protein ladder dengan berat molekul 10-260 KDa (Fermentas®)) (7 L) dipipetkan ke dalam gel. Running dilakukan pada 70 V selama 180 menit sampai migrasi pewarna tersisa sekitar 0.5 cm dari dasar.
Gel diangkat dan dipindahkan ke dalam wadah untuk pewarnaan (staining) (Gambar 3B). Pewarnaan dilakukan selama 60 menit. Gel diangkat dan dicuci menggunakan air distilat beberapa kali. Penghilangan warna (destaining) dilakukan selama 12 jam hingga latar belakang pita protein menjadi terang. Selanjutnya, larutan penghilang warna dibuang dan gel siap dianalisis.
Secara kualitatif, pita protein dapat dianalisis menggunakan ImageJ software 1.47. Secara kuantitatif, berat molekul protein sampel dapat dihitung dari persamaan regresi yang diperoleh dari kurva hubungan antara mobilitas relatif
Asam Amino Berat Molekul
Aspartat 131.10
Glutamat 147.10
Serin 105.09
Histidin 155.16
Glisin 75.07
Threonin 119.12
Arginin 174.20
Alanin 89.90
Tirosin 181.19
Metionin 149.21
Valin 117.15
Fenilalanin 165.19
Isoleusin 131.17
Leusin 131.17
protein penanda (Rf) dan logaritma berat molekul protein penanda. Mobilitas relatif protein dihitung dengan membandingkan jarak migrasi protein, diukur dari garis awal separating gel sampai ujung pita protein, dan jarak migrasi pewarna.
Mobilitas relatif tersebut dirumuskan sebagai berikut:
(A) (B)
Gambar 3. Proses elektroforesis: (A) running, (B) destaining gel
Larutan kerja yang diperlukan adalah:
a. Larutan A (Akrilamid 30%; 0.8 bisakrilamid) sebanyak 100 mL yang terdiri atas 30 g akrilamid dan 0.8 g N,N-metilen-bisakrilamid dilarutkan dalam 100 mL air distilat. Larutan disaring dengan filter 0.45 m.
b. Larutan B (Tris-HCl/SDS, pH 8.8) sebanyak 100 mL terdiri atas 18.17 g Tris base dan 4 mL SDS 10% dilarutkan dalam 40 mL air distilat. Larutan ditepatkan pada pH 8.8 dengan 1 N HCl, ditambahkan air distilat hingga volume 100 mL. Larutan disaring dengan filter 0.45 m.
c. Larutan C (Tris-HCl/SDS pH 6.8) sebanyak 100 mL terdiri atas 6.05 g Tris base dan 4 mL SDS 10% dilarutkan dalam 40 mL air distilat. Larutan ditepatkan pada pH 6.8 dengan 1 N HCl, ditambahkan air distilat hingga volume total 100 mL. Larutan disaring dengan filter 0.45 m.
d. Larutan 10% APS 0.5 mL dibuat dengan melarutkan 0.025 g amonium persulfat dalam 0.25 mL air distilat.
e. Buffer elektroforesis sebanyak 1 L terdiri atas 3 g Tris base, 14.4 g glisin dan 1 g SDS dilarutkan dalam air distilat dan tepatkan menjadi 1 L.
f. Bufer sampel sebanyak 100 mL terdiri atas 30 mL 10% SDS, 10 mL gliserol, 5 mL 2-merkaptoetanol, 12.5 mL Tris-HCl/SDS pH 6.8 dan 5-10 mg
bromphenol blue diaduk dengan pengaduk magnetik, lalu ditepatkan 100 mL dengan air distilat, dan disimpan pada suhu rendah.
g. Larutan pewarna (staining solution) yaitu 1 g coomasie brilliant blue R-250, dalam 450 mL methanol, 100 mL asam asetat glasial, dan 450 mL air distilat. h. Larutan penghilang warna (destaining solution), yaitu 100 mL metanol dan 100
mL asam asetat glasial dalam 800 mL air distilat.
Bufer KCl-HCl pH 2 (Sudarmadji et al. 1997)
Pembuatan larutan bufer pH 2 dilakukan dengan mencampurkan 50 mL larutan 0.2 M KCl (14.9 g dalam 1000 mL) ke dalam 10.6 mL larutan 0.2 M HCl. Selanjutnya, ditepatkan sampai 200 mL dengan air deionisasi.
Bufer universal pH 3-9 (Sudarmadji et al. 1997)
Sebanyak 100 mL larutan A yang mengandung asam sitrat (6.008 g), KH2PO4 (3.893 g), H3BO3 (1.769 g), dan dietilbarbiturat (5.266 g) diencerkan
sampai 1000 mL dengan air deionisasi. Untuk memperoleh pH 3-9, 100 ml larutan A ditambah dengan 0.2 N NaOH sebagaimana disajikan pada Tabel 3 di bawah ini.
Tabel 3. Formulasi bufer universal Larutan A (mL) NaOH 0.2 N (mL) pH
100 6.4 3
100 15.5 4
100 27.1 5
100 38.9 6
100 50.6 7
100 63.7 8
100 72.7 9
Indeks kelarutan nitrogen (Zhang et al. 2012 yang dimodifikasi)
Larutan protein (1% b/v) dalam bufer universal pH 2-9 diaduk dengan pengaduk magnetik pada suhu kamar selama 30 menit, lalu disentrifugasi pada 9096 g selama 20 menit (Zhang et al. 2012 yang dimodifikasi). Protein terlarut dalam supernatan ditentukan dengan menggunakan Metode Lowry (Lowry et al. 1951), dan persen kelarutan nitrogen dihitung sebagai berikut:
NSI (%) = Total kandungan protein dalam supernatan × 100% Total kandungan protein dalam sampel
Kapasitas dan stabilitas buih (Yeom et al. 2010yang dimodifikasi)
Kapasitas buih (foaming capacity, FC) dan stabilitas buih (foaming stability,
FS) ditentukan menurut Yeom et al. (2010) yang dimodifikasi. Sebanyak 25 mL larutan protein dengan konsentrasi 1% (b/v) dalam bufer universal pH 2, 4, 6, dan 8, diaduk dengan pengaduk magnetik skala maksimum selama 5 menit. Larutan contoh segera dituang ke dalam gelas ukur lalu volume buih yang terbentuk dicatat. Persentase FC dihitung dari persamaan berikut:
FC (%) = Volume setelah berbuih - Volume sebelum berbuih x 100 Volume sebelum berbuih
FS ditentukan oleh rasio volume buih pada menit ke-30 dan volume buih setelah berbuih pada suhu kamar (menit ke-0).
(A) (B)
Aktivitas dan stabilitas emulsi (Yeom et al. 2010 yang dimodifikasi)
Aktivitas pengemulsi (emulsifying activity, EA) dan stabilitas emulsi (emulsion stability, ES) ditentukan dengan metode turbidimetri. Minyak kedelai sebanyak 16 ml dan 48 ml larutan protein 1% (b/v) dalam bufer universal (pH 2, 4, 6, 8) dihomogenisasi dengan homogenizer skala maksimum selama 1 menit untuk menghasilkan emulsi. Sebanyak 50 µL bagian emulsi dipipet dari bawah wadah pada menit ke-0 dan 20 setelah dihomogenisasi dan dicampur dengan 5 mL 0.1% SDS. Absorbansi emulsi diukur pada 500 nm dengan UV-VIS Spektrofotometer.
Gambar 5. Suspensi emulsi minyak kedelai dalam larutan protein bekatul pH 2, 4, 6, dan 8
Teori hamburan cahaya oleh dispersi partikel menunjukkan kekeruhan yang memiliki hubungan dengan luas antar permukaan emulsi. Absorbansi yang diukur segera setelah pembentukan emulsi dinyatakan sebagai aktivitas pengemulsi dari protein, sedangkan stabilitas emulsi ditentukan sebagai berikut:
ES = T0× Δt
ΔT
dimana △T adalah perubahan kekeruhan (absorbansi) dari T0 dalam interval
waktu △ t, dan T0 adalah absorbansi emulsi setelah homogenisasi.
Kapasitas penyerapan air dan minyak (Marriod et al. 2010)
Konsentrat protein contoh (0.1 g) dicampur dengan 1 g air distilat atau minyak kedelai dalam ependof lalu digojog dengan alat vortex selama 5 menit. Selanjutnya, didiamkan selama 30 menit lalu disentrifugasi pada 5956 g (6000 rpm) selama 30 menit. Supernatan dibuang dan tabung dimiringkan 45o selama 30 menit. Gram air atau minyak yang tertahan dalam bahan contoh dihitung dalam per gram bahan contoh.
Stabilitas terhadap panas (Mariod et al. 2010)
Konsentrat protein conroh (0.065 g) disegel kedap udara dalam wadah aluminium, dipanaskan dari suhu 40°C sampai 150°C pada kecepatan 10°C/menit. Sifat termal direferensikan terhadap wadah tanpa contoh. Suhu puncak denaturasi (Tp) dan entalpi (ΔH) dihitung dengan perangkat lunak program analisis termal
(Pyris-I-DSC, Perkin-Elmer DSC 7 Ver.9.01 2007).
Analisis kadar fitat (Bhandari & Kawabata 2006)
fitatnya. Sebanyak 1 mL pereaksi Wade (0.03% FeCl3·6H2O mengandung 0.3%
asam sulfosalisilat dalam air distilat) ditambahkan dalam 3 mL larutan contoh diamkan selama 5 menit dan diukur absorbansi pada 500 nm. Kurva standar asam fitat dibuat seri konsentrasi yang mengandung 5–40 g/mL asam fitat dalam pelarut air distilat.
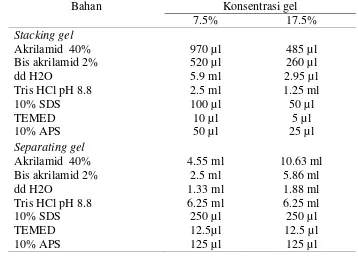
Analisis berat molekul fraksi protein dengan SDS PAGE (Ahmed 2005) Analisis dengan SDS PAGE menggunakan 7.5-17.5% stacking gel dan
gradient separating gel. Sebanyak 10-20 L supernatan dari masing-masing fraksi dimasukkan ke dalam ependof, ditambahkan bufer Laemmli (Sigma) (1:1 v/v), lalu dipanaskan 2 menit dalam air mendidih 100°C. Sebanyak 20 L contoh fraksi albumin dan globulin, 10 L contoh fraksi glutelin, dan 10 L protein penanda dipipetkan ke dalam kolom-kolom gel. Protein penanda yang digunakan merupakan Board Range Catalog 161-0318 Biorad Prestained Molecular Standar
yang mengandung 8 jenis protein standar yaitu myosin (230 kDa), -galaktosidase (118 kDa), bovine serum albumin (86 kDa), ovalbumin (51.6 kDa), karbonik anhidrase (34.1 kDa), soybean trypsin inhibitor (29 kDa), lisozim (19.2 kDa), dan aproitin (7.5 kDa). Running dilakukan pada 100 V selama 180 menit sampai migrasi pewarna tersisa sekitar 0.5 cm dari dasar.
Setelah migrasi pewarna tersisa sekitar 0.5 cm dari dasar, alat dimatikan lalu gel diangkat dan dipindahkan ke dalam wadah untuk pewarnaan (staining). Pewarnaan dilakukan selama 60 menit. Gel diangkat dan dicuci menggunakan air distilat beberapa kali. Penghilangan warna (destaining) dilakukan selama 12 jam hingga latar belakang pita protein menjadi terang. Selanjutnya, larutan penghilang warna dibuang dan gel siap dianalisis.
Secara kualitatif, pita protein dapat dianalisis menggunakan ImageJ software 1.47. Secara kuantitatif, berat molekul protein sampel dapat dihitung dari persamaan regresi yang diperoleh dari kurva hubungan antara mobilitas relatif protein penanda (Rf) dan logaritma berat molekul protein penanda. Mobilitas relatif protein dihitung dengan membandingkan jarak migrasi protein, diukur dari garis awal separating gel sampai ujung pita protein, dan jarak migrasi pewarna.
Mobilitas relatif tersebut dirumuskan sebagai berikut:
Pembuatan gradient gel menggunakan alat Biorad Model 385 Gradient Former (Gambar 6B) dengan formulasi bahan disajikan pada Tabel 4.
(A) (B)
Gambar 6. Gel elektroforesis: (A) stacking gel dan separating gel (Ahmed 2005) dan (B) gradient former Biorad
Tabel 4. Formulasi bahan separating dan stacking gel elektroforesis
Diameter partikel (Xia et al. 2012)
Pengukuran diameter partikel konsentrat protein menggunakan particle size
analyzer (Malvern Mastersizer MS2000) pada suhu 25oC menggunakan
pendispersi air.
Analisa Statistik
Pengujian dilakukan 2 kali ulangan dan nilainya di rata-rata. Perbedaan antar perlakuan dianalisis dengan uji t-test pada perangkat SPSS 16.0 dengan signifikasi p<0.05 antar nilai rata-rata.
Daftar Pustaka
Adochitei A, Drochioiu G. 2011. Rapid characterization of peptide secondary structure by FT-IR spectroscopy. Revue Roumaine de Chimie 56 (8): 783-791
Ahmed H. 2005. Principles and Reaction of Protein Extraction, Purification and Characterization. CRC Press LLC.
[AOCS] American Oil Chemists Society. 2003. Official Methods and Recommended Practices of the AOCS. 5th ed. Champaign, Illinois: AOCS [AOAC] Association of Official Analytical Chemists. 2005. Official Methods of
Analysis of the AOAC. Washington DC: AOAC
Bhandari MR, Kawabata J. 2006. Cooking effect on oxalate, phytate, trypsin and amylase inhibitors of wild yam tubers of Nepal. J. Food Composition Anal.
19 (6-7):524-530.
Bhavani M, Chowdary GV, David M, Archana G. 2012. Screening, isolation and biochemical characterization of novel lipase producing bacteria from soil samples. Int. J. Biol. Eng. 2(2): 18-22
Bahan Konsentrasi gel
7.5% 17.5%
Stacking gel
Akrilamid 40% 970 µl 485 µl
Bis akrilamid 2% 520 µl 260 µl
dd H2O 5.9 ml 2.95 µl
Tris HCl pH 8.8 2.5 ml 1.25 ml
10% SDS 100 µl 50 µl
TEMED 10 µl 5 µl
10% APS 50 µl 25 µl
Separating gel
Akrilamid 40% 4.55 ml 10.63 ml
Bis akrilamid 2% 2.5 ml 5.86 ml
dd H2O 1.33 ml 1.88 ml
Tris HCl pH 8.8 6.25 ml 6.25 ml
10% SDS 250 µl 250 µl
TEMED 12.5µl 12.5 µl
Gardner HW. 2001. Current protocols in food analytical chemistry: Analysis of lipoxygenase activity and products. Chapter 4.2.1-Chapter 4.2.16, John Wiley & Sons, Inc.
Hamada JS. 1997. Characterization of protein fractions of rice bran to devise effective methods of protein solubilization. Cereal Chem. 74 (5):662–668 Internet: Bulletin Food and Beverages Asia. 2010. Ingredient. January/February,
p: 56-59
Lenth RV. 2009. Rensponse surface methods in R, using RSM. J. Stat. Soft. 32 (7) : 1-17
Lowry OH, Rosenbrough NJ, Farr AL, Randal RJ. 1951. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193: 265-273
Malekian F et al. 2000. Lipase and lipoxygenase activity, functionality, and nutrient losses in rice bran during storage. Buletin 870, Louisiana State University Agricultural Center.
Mariod AA, Fathy SF, Ismail M. 2010. Preparation and characterization of protein concentrates from defatted kenaf seed. Food Chem. 123: 747-752.
Prabhu AV, Tambe SP, Gandhi NN, Sawant SB, Joshi JB. 1999. Rice bran lipase: extraction, activity, and stability. Biotechnol. Prog. 15:1083-1089
Silpradit K, Tadakittasarn S, Rimkeeree H, Supanida S, Haruthaithanasan V. 2010. Optimization of rice bran protein hydrolysate production using alcalase.
Research Article As. J. Food Agro-Ind. 3(02): 221-231
Sudarmadji S, Haryono B, Sihardi. 1997. Prosedur Analisa untuk Bahan Makanan dan Pertanian. Edisi keempat, Liberty, Yogyakarta.
Xia N et al. 2012. Preparation and characterization of protein from heat-stabilized rice bran using hydrothermal cooking combined with amylase-pretreatment.
J. Food Eng. 110: 95-101
Yeom H, Lee EH, Ha MS, Ha SD, Bae DH. 2010. Production and physicochemical properties of rice bran protein isolates prepared with autoclaving and enzymatic hydrolysis. J. Korean Soc. App. Biol. Chem. 53 (1): 62-70
3
STABILISASI BEKATUL DENGAN EKSTRUDER ULIR
GANDA MENGUNAKAN RESPONSE SURFACE
METHODOLOGY
Inneke Kusumawaty1, Dedi Fardiaz1, Nuri Andarwulan1, Sri Widowati2, dan Slamet Budijanto1
1
Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, IPB
2
Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian Bogor
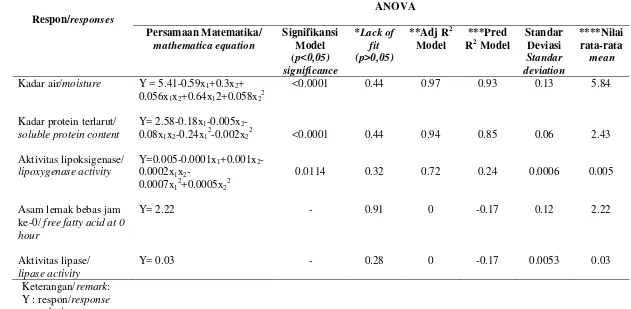
Keterbatasan pemanfaatan bekatul dalam pangan disebabkan oleh sifatnya yang mudah tengik sehingga perlu dilakukan stabilisasi. Penelitian ini bertujuan menentukan kondisi optimum stabilisasi bekatul dengan ekstruder ulir ganda tanpa die sebagai bahan baku ekstraksi protein. Optimasi kondisi stabilisasi bekatul dilakukan dengan menggunakan response surface methodology (RSM) dengan central composite design (CCD) dua faktor yaitu X1 (suhu/oC) dan X2
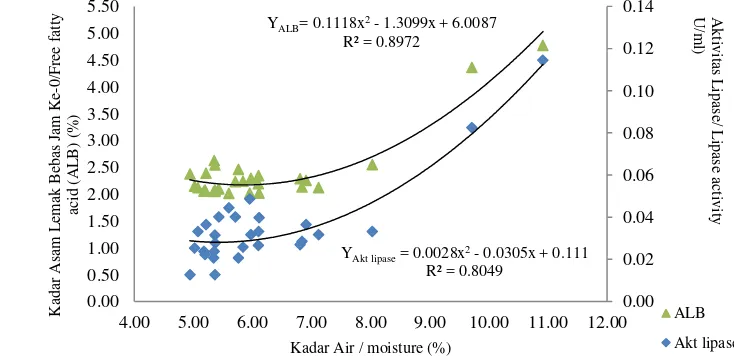
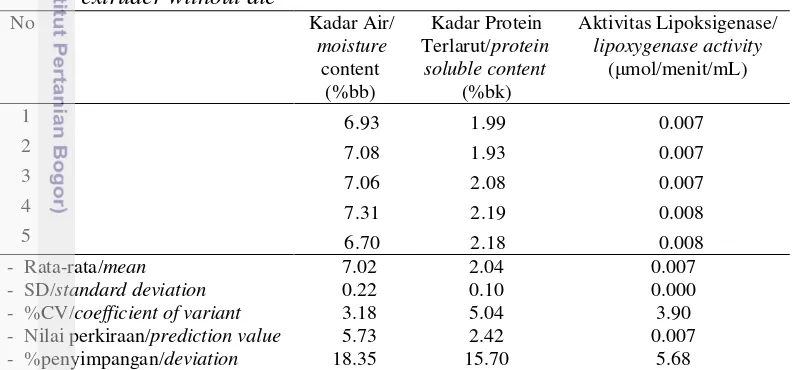
(kecepatan ulir/Hz). Pengolahan data menggunakan program Design Expert 7.0® yang memberikan model persamaan pengaruh suhu dan kecepatan ulir ekstruder terhadap respon kadar air, kadar protein terlarut, dan aktivitas lipoksigenase. Hasil optimasi memberikan kondisi suhu ekstrusi 130.96oC dan kecepatan ulir 26.65 Hz (91 rpm). Bekatul yang dihasilkan memiliki kadar air 7.02%, kadar protein terlarut 2.04% (bk), aktivitas lipoksigenase 0.007 mol/menit/ml, dan stabilitas oksidatif yang lebih tinggi yaitu 20.00 jam daripada bekatul yang tidak distabilisasi 13.50 jam.
Kata kunci: Stabilisasi bekatul, ekstruder ulir ganda, response surface methodology, stabilitas oksidatif
ABSTRACT. Inneke Kusumawaty, Dedi Fardiaz, Nuri Andarwulan, Sri Widowati, dan Slamet Budijanto. 2013. Rice bran stabilization with double screw extruder using response surface methodology. The use of rice bran in food is limited because the bran becomes easily rancid, therefore stabilization was needed. This study aimed to determine the optimum conditions for the stabilization of rice bran with double screw extruder without die for raw material protein extraction. Conditions optimization for rice bran stabilization were calculated using response surface method (RSM) with Central Composite Design (CCD) with two factors were X1 (temperature/oC) and X2 (screw speed/Hz). The data processed using Design Expert 7.0 ® program provided equation models for extruder temperature and the speed effect of the screw on moisture, soluble protein contents, and lipoxygenase activity. The results showed optimum extrusion temperature was 130.96oC and the screw speed was 26.65 Hz (91 rpm).This optimum condition resulted rice bran moisture content 7.02%, soluble protein was 2.04% (db), lipoxygenase activity was 0.007 mol/min/ml and oxidative stability was 20.00 hours higher than that of unstabilized rice bran 13.50 hours.
Key words: Rice bran stabilization, double screw extruder, response surface methodology, oxidative stability
PENDAHULUAN
Bekatul merupakan hasil samping penggilingan gabah yang pemanfaatannya didominasi untuk pakan ternak karena kandungan nutrisinya. Penggilingan gabah menghasilkan sekitar 8-12% bekatul dan 60-65% beras giling[1]. Produksi gabah nasional pada tahun 2012 yang mencapai 69.05 juta ton [2] dapat menghasilkan bekatul sebanyak 5.52 juta ton. Bekatul mengandung 12-15% protein dengan nilai PER (protein efficiency ratio) 2.0– 2.5 dan nilai cerna 90%[3]. Karena nilai gizinya ini, konsentrat protein bekatul dapat menyamai kasein[4] dan konsentrat protein kedelai sehingga berpotensi sebagai ingredient.
Kandungan lemak tidak jenuh pada bekatul lebih dari 70%, akibatnya bekatul mudah tengik[5]. Proses abrasif selama penggilingan mengakibatkan lipase dan lemak kontak sehingga proses hidrolisis dapat berlangsung. Asam lemak yang dihasilkan selanjutnya dioksidasi oleh lipoksigenase menjadi hidroperoksida yang kemudian mengalami degradasi membentuk senyawa volatil seperti aldehid, keton, dan alkohol yang tercium sebagai bau tengik[6]. Oleh karena itu, lipase dan lipoksigenase dalam bekatul harus segera diinaktivasi pasca penggilingan gabah untuk mencegah ketengikan dan memperpanjang masa simpan bekatul. Proses ini disebut stabilisasi bekatul [7].
Stabilisasi bekatul menggunakan pemanasan telah dilaporkan,seperti microwave[6,8], pratanak [9], uap panas[10], ohmic[11,13], ekstruder ulir tunggal[6,7] dan ekstruder ulir ganda [5,12]. Umumnya, stabilisasi bekatul dilakukan pada suhu tinggi [5] dan waktu yang cukup lama [7]. Stabilisasi bekatul dengan pratanak lebih sesuai untuk pemanfaatan seratnya sebagai pangan fungsional[9]. Stabilisasi bekatul dengan ekstrusi memiliki kelebihan dibandingkan yang lain karena kadar airnya, lipase inaktif, dan produknya kering sehingga sesuai untuk ingredien pangan. Namun, kondisi proses stabilisasi bekatul sebagai persiapan bahan baku ekstraksi protein belum pernah dilaporkan. Umumnya stabilisasi bekatul dilakukan sebagai persiapan bahan baku ekstraksi minyak[10,13,14]. Stabilitas oksidatif bekatul dapat diamati menggunakan metode AOM (Active Oxygen Method) dengan mengukur periode induksi bahan terhadap oksidasi. Semakin lama periode induksi, bahan memiliki stabilitas oksidatif yang lebih baik[15,16].
Optimasi proses stabilisasi bekatul dapat dilakukan dengan menggunakan CCD dilanjutkan analisis dengan RSM. Beberapa penelitian menggunakan RSM untuk optimasi proses, antara lain optimasi suhu, pH, waktu dan rasio pelarut dengan bahan untuk ekstraksi protein jagung[17], optimasi kecepatan ulir dan suhu ekstrusi terhadap karakter pasta tepung kedelai[18], dan optimasi produksi hidrolisat protein bekatul dengan alkalase[19]. Metode RSM dapat membantu merancang model penelitian, mengurangi jumlah perlakuan dalam penelitian dan membantu mengevaluasi interaksi perlakuan yangdiberikan untuk mendapatkan proses yang optimal.