HIDROLISIS ONGGOK DI BAWAH PENGARUH ULTRASONIKASI UNTUK MENGHASILKAN GULA REDUKSI DAN UJI
FERMENTASINYA MENJADI BIOETANOL
Oleh
LUH GEDE RAI PUTRI SEPTARINI
SKRIPSI
Sebagai salah satu syarat untuk mencapai gelar Sarjana Sains
pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
HYDROLYSIS OF CASSAVA WASTE UNDER ULTRASONICATION TREATMENT TO PRODUCE REDUCING SUGAR AND
FERMENTATION FOR BIOETHANOL PRODUCTION
By
LUH GEDE RAI PUTRI SEPTARINI
In this study, the potential of hydrolysis of cassava waste under ultrasonication treatment to produce reducing sugar was investigated. The reducing sugar was subsequently subjected to fermentation assay using the bark of Raru tree and Saccharomyces cerevisiae. Hydrolysis experiments were carried out at fixed ultrasound frequency 40 kHz, under varied pH, time, and temperature. The concentrations of reducing sugar in the hydrolyzates was determined by using spectrophotometry UV-Vis. The results of hydrolysis experiments showed that the highest concentration of reducing sugar was obtained by hydrolysis at pH 2 for 90 minutes and temperature of 80 0C, with the content of 801 mg/L. Fermentation of the hydrolizate which contains the highest sugar content indicated that the sugar can be converted into bioethanol. According to GC analysis, it was found that the concentrations of bioethanol from fermentation of filtrate and intact sample using the bark of Raru tree were 0,05% and 0,004, respectively, while using Saccharomyces cerevisiae were 0,17% and 0,26%, respectively.
ABSTRAK
HIDROLISIS ONGGOK DI BAWAH PENGARUH ULTRASONIKASI MENGHASILKAN GULA REDUKSI DAN UJI FERMENTASINYA
MENJADI BIOETANOL
Oleh
LUH GEDE RAI PUTRI SEPTARINI
Penelitian ini dilakukan untuk mempelajari potensi hidrolisis onggok di bawah pengaruh ultrasonikasi untuk menghasilkan gula reduksi, dan fermentasinya menjadi bioetanol. Hidrolisis onggok dilakukan di bawah pengaruh ultrasonikasi pada frekuensi tetap sebesar 40 kHz dan tiga variabel, yakni pH, waktu, dan suhu. Unjuk kerja percobaan diukur berdasarkan kadar gula reduksi yang terdapat dalam hidrolisat sampel, yang ditentukan dengan metode spektrofotometri UV-Vis. Hasil penelitian menunjukkan bahwa hidrolisis onggok dengan bantuan ultrasonikasi mampu menghasilkan gula reduksi yang kadarnya dipengaruhi oleh variabel yang digunakan. Kadar gula reduksi tertinggi terdapat dalam sampel yang dihidrolisis pada pH 2 selama 90 menit dan suhu 80 0C, dengan kadar sebesar 801 mg/L. Uji fermentasi terhadap sampel ini menggunakan serbuk kulit kayu raru dan Saccharomyces cerevisiae menunjukkan bahwa kedua agen fermentasi ini mampu mengubah gula reduksi hasil hidrolisis onggok. Analisis kadar etanol dengan metode kromatografi gas menunjukkan bahwa Saccharomyces cerevisiae mampu menghasilkan bioetanol dengan kadar 0,17% dari filtrat dan 0,26% dari sampel utuh, sedangkan serbuk kulit kayu raru mampu menghasilkan bioetanol dengan kadar masing-masing 0,05% dari filtrat dan 0,004% dari sampel utuh. Secara keseluruhan terlihat bahwa hidrolisat onggok lebih mudah difermentasi menggunakan Saccharomyces cerevisiae.
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
I. PENDAHULUAN ... 1
A.Latar Belakang ... 1
B.Tujuan Penelitian ... 5
C.Manfaat Penelitian ... 5
II. TINJAUAN PUSTAKA ... 6
A.Bioetanol ... 6
B.Hidrolisis Pati ... 9
C.Praperlakuan Hidrolisis ... 13
D.Ultrasonikasi ... 17
E. Analisis Gula Reduksi ... 19
F. Fermentasi Alkohol ... 22
G.Analisis Kadar Bioetanol dengan Kromatografi Gas ... 25
III. METODELOGI PENELITIAN ... 29
A.Waktu dan Tempat Penelitian ... 29
B.Alat dan Bahan ... 29
C.Prosedur Penelitian ... 30
1. Preparasi Onggok ... 30
2. Hidrolisis Onggok ... 30
3.1.Pengaruh pH ... 30
3.2.Pengaruh waktu ... 31
3.3.Pengaruh suhu ... 31
3. Analisis Gula Reduksi ... 31
3.1.Analisis kualitatif ... 31
3.2.Analisis kuantitatif ... 32
3.2.1.Pembuatan reagen DNS ... 32
3.2.2.Pembuatan kurva standar ... 32
3.2.3.Penentuan gula reduksi dalam sampel ... 32
4.1.Fermentasi dengan serbuk kulit kayu raru ... 33
4.2.Fermentasi dengan Saccharomyces cerevisiae ... 33
5. Analisis Kadar Bioetanol dengan Kromatografi Gas ... 34
IV. HASIL DAN PEMBAHASAN ... 36
A. Pengantar ... 36
B. Preparasi Onggok ... 36
C. Hidrolisis Onggok ... 37
1. Pengaruh pH ... 41
2. Pengaruh waktu ... 44
3. Pengaruh suhu ... 47
D. Fermentasi Hidrolisat Onggok ... 50
1. Persiapan serbuk kulit kayu raru ... 50
2. Fermentasi ... 51
V. SIMPULAN DAN SARAN ... 57
A. Simpulan ... 57
B. Saran ... 58
DAFTAR PUSTAKA ... 59
I. PENDAHULUAN
A. Latar Belakang
Salah satu masalah utama yang dihadapi di seluruh dunia dewasa ini adalah krisis energi karena cadangan energi fosil yang terus menurun. Mengantisipasi masalah krisis energi ini, upaya yang terus digiatkan adalah pengembangan bahan bakar alternatif dan terbarukan. Dewasa ini telah berhasil dikembangkan berbagai jenis sumber energi terbarukan, terutama biodiesel (Bosbaz, 2005; Seftaria, 2011), biogas (Usman et al., 2011; Elaiyaraju and Partha, 2012), dan bioetanol
(Trisnawati, 2008; Nicolić et al., 2010). Bioetanol merupakan salah satu sumber energi alternatif yang mendapat perhatian sangat besar karena memiliki banyak keuntungan, diantaranya dapat diperbarui dan emisi karbondioksida yang lebih sedikit sehingga lebih ramah lingkungan.
Keuntungan lain dari bioetanol adalah perkembangan teknologi yang
Bahan baku lain yang potensial untuk dimanfaatkan adalah onggok. Onggok merupakan bahan baku yang menarik karena limbah industri tapioka ini diketahui mengandung 50-70% pati (Pandey et al., 2000). Di samping itu, pertanian ubi kayu merupakan potensi yang dapat ditemukan di berbagai daerah di Indonesia, termasuk Provinsi Lampung. Berdasarkan data statistik tahun 2011, di Provinsi Lampung terdapat pertanian ubi kayu dengan luas sekitar 368.000 ha dengan produksi mencapai 9.200.000 ton/tahun (BPS Provinsi Lampung, 2012). Pengolahan ubi kayu menjadi tepung tapioka menghasilkan onggok sekitar 10-30% (Pandey et al., 2000). Hal ini berarti di Provinsi Lampung tersedia onggok sekitar 920.000-2.700.000 ton/tahun.
Dalam proses pengolahan ongggok menjadi bioetanol, masalah utamanya adalah bahan baku ini tidak dapat difermentasi secara langsung, tetapi harus dihidrolisis terlebih dahulu untuk memecah molekul pati menjadi gula reduksi. Dewasa ini ada dua metode hidrolisis untuk menghasilkan gula reduksi yang umum
digunakan, yakni hidrolisis asam (Zamora et al., 2010; Kim et al., 2012) dan hidrolisis enzimatis (Moxley et al., 2008; Collares et al., 2012). Kedua metode ini telah berhasil diterapkan dalam skala laboraturium, namun dalam skala industri metode hidrolisis asam lebih banyak dimanfaatkan dibandingkan dengan
Dewasa ini telah banyak dilakukan upaya praperlakuan sebagai tahap awal
sebelum tahap hidrolisis untuk mengubah karakteristik bahan baku sehingga lebih mudah dihidrolisis untuk mengoptimalkan pembentukan gula reduksi. Secara
umum, metode praperlakuan dikategorikan menjadi tiga jenis, yaitu metode
praperlakuan fisik, fisiko-kimia, dan kimia. Adapaun metode praperlakuan fisik
diantaranya adalah pengecilan ukuran secara mekanik seperti dicacah, ditumbuk, atau digiling (Zhang et al., 2007), radiasi sinar-γ (Yang et al., 2008), ultrasonikasi (Nityavardhana et al., 2008), radiasi dengan berkas elektron (Shin and Sung, 2008), dan gelombang mikro (Balcu et al., 2011). Metode praperlakuan
fisiko-kimia diantaranya adalah steam explosion (Agbor et al., 2011), ammonia fiber
explosion (AFEX) (Zheng et al., 2009), CO2 explosion (Kumar et al., 2009), dan
Liquid Hot Water (LHW) atau perlakuan dengan air panas (Mosier et al., 2005).
Metode praperlakuan kimia diantaranya adalah ozonolisis (Sun and Cheng, 2002)
dan pelarutan dalam pelarut organik (organosolv) (Pan et al., 2007).
Dalam penelitian ini, upaya yang dilakukan untuk meningkatkan rendemen gula
reduksi adalah dengan metode pengecilan ukuran bahan baku secara mekanik
dengan penggilingan bahan baku dan ultrasonikasi. Penggilingan bahan baku dimaksudkan untuk merusak kristalinitas pati, menurunkan derajat polimerisasi, dan meningkatkan luas permukaan molekul pati sehingga proses hidrolisis dapat berlangsung lebih cepat. Pengkajian metode ultrasonikasi didasarkan pada
penelitian sebelumnya (Trisnawati, 2008; Nicolić et al., 2010) yang menunjukkan
bahwa perlakuan ultrasonikasi dapat meningkatkan rendemen gula reduksi secara
signifikan. Berbeda dengan penelitian sebelumnya, pada penelitian ini
untuk menghidrolisis onggok secara langsung. Artinya, proses hidrolisis
dilakukan di bawah pengaruh ultrasonikasi dengan harapan metode ini mampu
meningkatkan rendemen gula reduksi secara signifikan.
Pada proses hidrolisis, ada beberapa faktor yang perlu diperhatikan seperti pH,
waktu, dan suhu hidrolisis. Untuk mempelajari pengaruh dari ketiga faktor
tersebut, maka dalam penelitian ini sampel dihidrolisis pada pH, waktu, dan suhu
yang berbeda-beda. Kemudian gula reduksi hasil hidrolisis dianalisis secara
kualitatif menggunakan metode Fehling dan secara kuantitatif menggunakan
metode spektrofotometri UV-Vis dengan pereaksi DNS. Kadar gula reduksi dihitung berdasarkan pengukuran absorbansi pada panjang gelombang 550 nm (Kusmiati dan Agustini, 2010) dengan bantuan kurva standar yang dihasilkan dari pengukuran absorbansi larutan glukosa.
B. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah sebagai berikut:
1. Mempelajari potensi hidrolisis onggok menjadi gula reduksi di bawah pengaruh ultrasonikasi.
2. Melakukan uji fermentasi hidrolisat onggok menggunakan serbuk kulit kayu raru dan Saccharomyces cerevisiae untuk menghasilkan bioetanol, sekaligus untuk mempelajari potensi kulit kayu raru.
C. Manfaat Penelitan
Hasil penelitian ini diharapkan dapat digunakan sebagai dasar untuk
II. TINJAUAN PUSTAKA
A. Bioetanol
Bioetanol adalah istilah yang digunakan untuk etanol yang dihasilkan dari proses fermentasi gula reduksi, untuk membedakannya dari etanol yang dihasilkan dengan cara sintesis. Bioetanol telah dikenal sejak lama, dan dewasa ini senyawa ini menarik perhatian yang sangat besar karena selain manfaat tradisionalnya, senyawa ini juga merupakan bahan bakar alternatif dan terbarukan. Sebagai bahan bakar, bioetanol dapat digunakan langsung atau dicampur dengan bahan bakar lain, terutama gasoline, dan campurannnya dikenal sebagai gasohol. Selain cara pemanfaatan di atas, bioetanol juga memiliki sejumlah keunggulan
dibandingkan bahan bakar fosil. Bioetanol termasuk bahan bakar ramah
lingkungan karena gas CO2 yang dihasilkan dari pembakarannya jauh lebih kecil dibandingkan CO2 yang dihasilkan dari pembakaran bahan bakar fosil. Sebagai contoh, reaksi pembakaran 1 mol etanol akan menghasilkan 2 mol gas CO2, sementara pembakaran 1 mol isooktana (kandungan utama pada gasoline) akan menghasilkan 8 mol CO2, seperti terlihat dalam reaksi berikut ini.
Energi yang dihasilkan dari pembakaran 1 mol etanol adalah sebesar 1381,38 kJ dan energi yang dihasilkan dari pembakaran 1 mol isooktana adalah sebesar 5460 kJ. Dilihat dari sisi CO2 yang dihasilkan, pembakaran 4 mol etanol setara dengan pembakaran 1 mol isooktana. Energi yang dihasilkan untuk pembakaran 4 mol etanol adalah sebesar 5525,52 kJ. Artinya dengan jumlah CO2 yang sama, pembakaran etanol menghasilkan energi yang jauh lebih besar daripada pembakaran isooktana, dengan selisih energi sebesar 65,52 kJ.
Keuntungan lain dari bioetanol adalah bersifat terbarukan, artinya dapat
dihasilkan dari bahan baku atau sumber yang dapat dibudidayakan, misalnya ubi kayu (Collares et al., 2012), jagung (Nicolić et al., 2010), gandum (Perez et al., 2007), dan sorgum (Herrera et al., 2003). Faktor lain yang sangat mendukung produksi bioetanol adalah perkembangan teknologi yang telah memungkinkan bioetanol dapat diproduksi dari karbohidrat yang bukan merupakan bahan pangan utama. Tiga diantaranya yang paling banyak dimanfaatkan adalah pati (Zamora et al., 2010; Anozie and Aderibigbe, 2011), selulosa (Yu and Zhang, 2004; Wyman, 2008), dan lignoselulosa (Sun and Cheng, 2002; Mosier et al., 2005).
pertanian ubi kayu dengan luas sekitar 368.000 ha dengan produksi mencapai 9.200.000 ton/tahun. Pengolahan ubi kayu menjadi tepung tapioka menghasilkan onggok sekitar 10-30% (Pandey et al., 2000). Hal ini berarti di Provinsi Lampung tersedia onggok sekitar 920.000-2.700.000 ton/tahun.
Dalam pemanfaatan onggok sebagai bahan baku bioetanol, langkah pertama adalah proses hidrolisis untuk memecah molekul pati menjadi gula reduksi yang selanjutnya dapat difermentasi menjadi bioetanol. Tahapan hidrolisis ini
diperlukan karena onggok tidak dapat difermentasi secara langsung. Hidrolisis pati menghasilkan gula reduksi dapat dilakukan karena pati memiliki struktur yang reaktif terhadap hidrolisis. Reaktifitas terhadap hidrolisis dimiliki oleh pati
karena adanya ikatan α-(1,4)-D-glikosidik, yang dapat dipecah menghasilkan gula
reduksi.
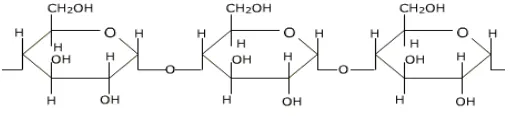
Berdasarkan struktur kimianya, pati dapat digolongkan menjadi dua jenis, yakni amilosa, dengan ciri utama memiliki rantai lurus, dan amilopektin, dengan ciri utama memiliki struktur bercabang, seperti ditunjukkan dalam Gambar 1 dan 2. Seperti terlihat dalam Gambar 1 dan 2, kedua jenis pati memiliki ikatan α -(1,4)-D-glikosidik, namun pada amilopektin terdapat percabangan pada posisi α -(1,6)-D-glikosidik.
Gambar 1. Struktur amilosa
Gambar 2. Struktur amilopektin
B. Metode Hidrolisis Pati
Untuk menghasilkan gula reduksi dari pati, dewasa ini telah dikenal berbagai jenis metode hidrolisis, yang secara umum dibedakan menjadi hidrolisis asam, dan enzimatik. Hidrolisis asam adalah reaksi pemecahan molekul polisakarida dengan air yang dikatalis oleh asam. Jenis asam yang paling banyak digunakan untuk proses ini adalah asam klorida (Barnali et al., 2008; Olorunsola et al., 2011) dan asam sulfat (Zamora et al., 2010; Kim et al., 2012). Selain jenis asam,
konsentrasi asam juga sangat penting untuk diperhatikan dalam proses hidrolisis. Hidrolisis dengan asam pekat menghasilkan kadar gula reduksi yang lebih tinggi dibandingkan hidrolisis dengan asam encer (Mishra et al., 2011).
[image:16.595.171.454.188.337.2]melakukan penelitian tentang hidrolisis pati dari tepung ubi kayu menggunakan katalis asam klorida encer. Dalam penelitian tersebut dilakukan percobaan pada suhu yang berbeda, yakni 60, 70, dan 80 oC, selama 20, 40, dan 60 menit, dengan dibantu agitasi menggunakan pengaduk magnetik dengan kecepatan 200, 250, dan 300 rpm. Hasil penelitian menunjukkan bahwa kondisi optimum hidrolisis adalah suhu 80 oC selama 60 menit dengan kecepatan 200 rpm, dan menghasilkan kadar gula reduksi sebesar 46,12 g/L atau setara dengan konversi pati sebesar 30,75%. Penelitian lain yang juga mempelajari kondisi optimum hidrolisis pati dilakukan oleh Barnali et al. (2008). Dalam penelitian tersebut, pati dari tepung gandum dihidrolisis menggunakan asam klorida encer selama 10 menit, dengan variasi suhu 75, 85, dan 95 oC, dan variasi pH 2, 3, 4, dan 5. Kondisi optimum dicapai pada suhu 95oC dan pH 3, dengan konversi sebesar 42%.
Selain dengan asam klorida, beberapa penelitian juga telah dilakukan
Selain dengan hidrolisis asam, metode lain yang juga banyak dikembangkan dewasa ini adalah hidrolisis enzimatik. Enzim adalah biomolekul berupa protein yang berfungsi sebagai katalis dalam suatu reaksi kimia organik. Enzim bereaksi dengan molekul substrat dan bekerja secara spesifik,artinya setiap enzim hanya dapat bekerja pada suatu reaksi biokimia tertentu dengan substrat yang sesuai. Sebagai contoh, dalam proses hidrolisis pati menjadi glukosa, enzim yang sesuai
untuk digunakan adalah α-amilase dan glukoamilase. Enzim α-amilase
merupakan endo-enzim yang bekerja dengan memutuskan ikatan α -1,4-D-glikosidik secara acak di bagian dalammolekul pati, baik amilosa maupun amilopektin (Purba, 2001). Enzim α-amilase berperan pada tahap likuifikasi, yaitu proses hidrolisis pati secara parsial pada suhu tinggi menghasilkan dekstrin dan oligosakarida bermonomer dua hingga enam (Shin et al., 2000). Enzim glukoamilase (amiloglukosidase) merupakan ekso-enzim yang bekerja
memutuskan ikatan α-1,4-D-glikosidik di bagian luar secara berurutan dari ujung gula non-pereduksi rantai amilosa maupun amilopektin, dan mampu memutuskan
ikatan α-1,6-D-glikosidik pada titik percabangan amilopektin. Enzim
glukoamilase berperan pada tahap sakarifikasi, yaitu proses lebih lanjut dari hidrolisis pada suhu rendah hingga dihasilkan glukosa (Shin et al., 2000).
Enzim α-amilase memiliki beberapa sisi aktif yang dapat mengikat 4 hingga 10
dan Aspergillus niger, dan ragi Saccharomyces diastaticus (Bemiller and Whistler, 2009).
Apar and Özbek (2004) melakukan penelitian hidrolisis pati secara enzimatik dari
bahan baku jagung, beras, dan gandum dengan variasi sumber enzim α-amilase.
Tiga jenis enzim α-amilase yang digunakan berasal dari mikroba Bacillus species,
Bacillus licheniformis, dan Aspergillus oryzae. Hidrolisis dilakukan di dalam reaktor curah pada suhu 40 oC selama 90 menit dengan kecepatan rotasi sebesar 300 rpm dan pH 6,5 ± 0,05. Konsentrasi pati yang digunakan adalah sebesar 10 g/L. Hasil percobaan menunjukkan bahwa enzim yang bekerja paling baik adalah yang diperoleh dari Bacillus licheniformis, menghasilkan gula reduksi sebesar 40,4% dari pati jagung, 48,1% dari pati beras, dan 58,1% dari pati gandum. Penelitian lain mengenai hidrolisis pati secara enzimatik juga dilaporkan oleh Rahmasari dan Putri (2011). Dalam penelitian tersebut, sumber pati yang
digunakan adalah onggok dan enzim yang digunakan adalah α-amilase,
glukoamilase, selulase, dan pektinase. Percobaan dilakukan dalam shaker incubator dengan suhu 30 oC dan kecepatan 150 rpm selama 60 jam. Dari hasil penelitian diperoleh bahwa hidrolisis menggunakan enzim glukoamilase selama 24 jam menghasilkan kadar gula reduksi yang paling tinggi, yaitu sebesar 115,89 g/L.
Dalam prakteknya, hidrolisis pati menjadi gula reduksi baik menggunakan asam ataupun secara enzimatik, berlangsung secara bertahap, seperti disajikan dalam reaksi di bawah ini.
Dari kedua metode hidrolisis yang telah dijelaskan di atas, dapat disimpulkan bahwa hidrolisis enzimatik bekerja dengan cukup baik, namun metode ini
memiliki beberapa kelemahan praktis, yaitu prosesnya lama, pengerjaannya harus dalam kondisi yang steril, dan biaya yang relatif mahal. Oleh karena itu, hingga dewasa ini metode hidrolisis asam masih lebih banyak diterapkan baik dalam penelitian maupun industri, dibanding dengan hidrolisis enzimatik. Dengan demikian, dalam penelitian ini digunakan metode hidrolisis asam.
Untuk meningkatkan rendemen gula reduksi dan bioetanol, dewasa ini telah
banyak dikembangkan metode praperlakuan sebagai perlakuan awal terhadap
bahan baku sebelum tahap hidrolisis dilakukan. Metode praperlakuan ini
dimaksudkan untuk mengubah karakteristik bahan baku sehingga lebih mudah
dihidrolisis.
C. Praperlakuan Hidrolisis
Berbagai macam metode praperlakuan telah dilakukan untuk mengoptimalkan
rendemen hidrolisis. Secara umum, metode praperlakuan dikategorikan menjadi
tiga jenis, yaitu metode praperlakuan fisik, fisiko-kimia, dan kimia (Sun and
Cheng, 2002; Balat et al., 2008).
Metode praperlakuan fisik dapat dilakukan dengan pengecilan ukuran secara
mekanik dengan dicacah, ditumbuk, atau digiling, dan radiasi berenergi tinggi. Metode pengecilan ukuran bahan baku bertujuan untuk merusak kristalinitas pati,
2007). Metode praperlakuan menggunakan radiasi berenergi tinggi yang pernah dilakukan antara lain dengan sinar-γ (Yang et al., 2008), ultrasonikasi
(Nityavardhana et al., 2008), radiasi dengan berkas elektron (Shin and Sung, 2008), dan gelombang mikro (Balcu et al., 2011). Praperlakuan dengan radiasi
berenergi tinggi ini dapat meningkatkan luas permukaan bahan baku karena dapat
merusak struktur polimer polisakarida.
Nicolić et al (2010) melakukan penelitian hidrolisis pati jagung untuk
memproduksi bioetanol dengan metode praperlakuan fisik, yaitu dengan
penggilingan dan ultrasonikasi. Mula-mula jagung digiling sampai ukuran
diameter partikelnya menjadi 0,2-1,7 mm. Kemudian sebanyak 100 gram sampel
jagung yang telah digiling dicampur dengan 300 mL akuades dan diultrasonikasi
pada frekuensi 40 kHz selama 0,5; 1; 3; 5; 10; 20; dan 30 menit pada suhu 30, 60,
dan 80 oC. Kadar gula reduksi tertinggi dihasilkan dari hidrolisis sampel dengan
praperlakuan ultrasonikasi selama 5 menit pada suhu 60 oC, yaitu sebesar 105 g/L.
Metode praperlakuan fisiko-kimia terdiri dari steam explosion (autohidrolisis),
ammonia fiber explosion (AFEX), CO2 explosion, dan Liquid Hot Water (LHW).
Metode steam explosion (autohidrolisis) dilakukan dengan cara menyemprotkan
sampel dengan uap air pada suhu dan tekanan tinggi, yaitu suhu antara 160-240 oC
dan tekanan antara 0,7-4,8 MPa, kemudian tekanannya diturunkan secara cepat
sehingga sampel mengalami dekompresi eksplosif (Agbor et al., 2011). Metode
praperlakuan dengan ammonia fiber explosion (AFEX) memiliki prinsip kerja
adalah proses AFEX menggunakan ammonia cair, sedangkan steam explosion
menggunakan uap air (Zheng et al., 2009).
Metode lainnya yang juga menggunakan prinsip kerja seperti steam explosion dan
AFEX adalah CO2 explosion, namun metode ini tidak dilakukan pada suhu tinggi.
Ketika terjadi dekompresi secara eksplosif, CO2 akan membentuk asam karbonat
dan dapat meningkatkan laju hidrolisis. Metode praperlakuan ini menghasilkan
rendemen yang lebih tinggi dibandingkan metode steam explosion, biaya yang
lebih ekonomis dibandingkan metode AFEX, dan tidak menyebabkan
pembentukkan inhibitor karena dilakukan pada suhu yang rendah. Akan tetapi,
metode ini memiliki kelemahan, yaitu cukup rumit dan prosesnya kompleks
(Kumar et al., 2009). Metode praperlakuan fisiko-kimia juga dapat dilakukan
tanpa proses dekompresi eksplosif, yakni dengan perebusan sampel dalam air
panas pada suhu 150-230 oC selama 5-20 menit. Dalam metode ini, pH larutan
harus berada pada rentang 5-7. Biasanya ke dalam larutan sampel perlu
ditambahkan suatu basa, misalnya KOH, agar pH tetap terkontrol. Metode
perebusan dengan pH terkontrol ini umumnya digunakan untuk bahan baku serat
jagung (Mosier et al., 2005)
Dien et al. (2008) telah menerapkan metode praperlakuan fisiko-kimia dalam
penelitiannya untuk menghidrolisis butir padi yang telah dikeringkan menjadi
gula reduksi. Metode fisiko-kimia yang digunakan adalah AFEX dan perebusan
dengan pH terkontrol. Rendemen gula reduksi yang dihasilkan dari hidrolisis
adalah 278 gram dan menggunakan metode perebusan dengan pH terkontrol
adalah 261 gram.
Metode praperlakuan kimia umumnya terdiri dari praperlakuan dengan ozonolisis,
dan pelarutan dalma pelarut organik (organosolv). Ozonolisis merupakan metode
praperlakuan dengan menggunakan ozon untuk memutuskan ikatan pada serat
selulosa sehingga komponen lignin tereduksi dan menghasilkan molekul yang
lebih sederhana (Garcia-Cubero et al., 2009). Ozon merupakan zat pengoksidasi
yang kuat, larut dalam air, dan kereaktifannya tinggi terhadap senyawa yang
memiliki ikatan rangkap terkonjugasi (Garcia-Cubero et al., 2009). Ozonolisis
memiliki keuntungan antara lain prosesnya dilakukan pada suhu dan tekanan yang
rendah dan tidak menghasilkan senyawa yang bersifat toksik, namun metode ini
memerlukan biaya yang relatif mahal (Sun and Cheng, 2002).
Pelarutan dalam senyawa organik (organosolv) merupakan proses delignifikasi menggunakan pelarut organik atau campuran pelarut organik dengan atau tanpa katalis asam/basa (Pan et al., 2007). Pelarut organik yang biasanya digunakan adalah metanol, etanol,butanol, etil glikol, gliserol, fenol, dan aseton (Pan et al.,
2007). Organosolv ini dilakukan pada rentang suhu 150–200 oC, dan pada suhu di
atas 185 oC, proses dapat dilangsungkan tanpa katalis. Metode ini menghasilkan
senyawa yang lebih murni dibandingkan dengan metode praperlakuan lainnya,
namun prosesnya kompleks dan memerlukan biaya yang mahal (Katzen et al.,
1995).
Banyak penelitian yang telah menggunakan metode praperlakuan kimia, salah
penelitian tersebut, bahan baku ampas tebu dihidrolisis secara enzimatik dengan
bantuan praperlakuan organosolv. Pelarut yang digunakan adalah campuran
etanol dan larutan NaOH. Proses organosolv dilakukan pada suhu, waktu, dan
konsentrasi etanol yang berbeda-beda. Kondisi optimum dari praperlakuan
organosolv adalah konsentrasi etanol 30% (v/v), pada suhu 195 oC selama 60
menit dan rendemen gula reduksi yang dihasilkan adalah 29,1 gram/ 100 gram
ampas tebu.
Dalam penelitian ini, metode yang digunakan untuk meningkatkan rendemen gula
reduksi adalah metode praperlakuan fisik, yaitu dengan metode pengecilan ukuran
bahan baku secara mekanik, dan ultrasonikasi. Pengecilan ukuran bahan baku
secara mekanik dilakukan dengan cara penggilingan. Pengkajian metode ultrasonikasi ini didasarkan pada penelitian sebelumnya (Trisnawati, 2008;
Nicolíc et al., 2010) yang menunjukkan bahwa perlakuan ultrasonikasi mampu
mengakibatkan terjadinya kavitasi sehingga molekul pati dapat lebih mudah
dihidrolisis.
D. Ultrasonikasi
ultrasonikasi (16–100 kHz), ultrasonikasi frekuensi tinggi (100 kHz–1 mHz), dan ultrasonikasi diagnostik (1–10 MHz) (Patist and Bates, 2008).
Gelombang ultrasonik lebih tinggi dibandingkan panjang gelombang molekul-molekul sehingga dapat terjadi interaksi di dalam medium cairan. Intensitas gelombang ultrasonik yang menjalar di dalam medium cair akan menurun karena adanya penyerapan energi terhadap medium dan menimbulkan adanya perbedaan tekanan sehingga dapat menimbulkan gelembung kecil dalam cairan. Ketika gelembung mencapai volume yang maksimal dan tidak mampu menyerap energi lagi, maka akan terjadi peristiwa kavitasi. Kavitasi adalah peristiwa
pembentukan, pertumbuhan, dan meledaknya gelembung di dalam cairan yang terjadi pada rentang frekuensi antara 20 kHz–10 MHz, dan melibatkan sejumlah energi yang sangat besar. Peristiwa meledaknya gelembung menghasilkan efek panas yang menyebar secara konveksi dalam medium akibat kenaikan temperatur yang sangat tinggi (5000 K pada tekanan 1000 atm dengan laju pemanasan dan pendinginan 1010 K/s). Pada kondisi tertentu, tekanan yang dihasilkan pun meningkat dan peristiwa ini terjadi berulang dalam waktu yang sangat singkat (dalam skala nano detik) seiring dengan bertambahnya waktu ultrasonikasi (Camarena and Martinez, 2006).
kesimpulan yang sama bahwa perlakuan ultrasonikasi dapat meningkatkan rendemen gula reduksi. Pada penelitian ini ultrasonikasi tidak dilakukan sebagai metode praperlakuan, tetapi dimanfaatkan untuk menghidrolisis onggok secara
langsung. Artinya, proses hidrolisis dilakukan di bawah pengaruh ultrasonikasi
dengan harapan metode ini mampu meningkatkan rendemen gula reduksi secara
signifikan.
E. Analisis Gula Reduksi
Gula reduksi yang dihasilkan dari proses hidrolisis dianalisis dua cara, yaitu analisis secara kualitatif dan kuantitatif. Analisis gula reduksi secara kualitatif digunakan untuk mengidentifikasi apakah sampel mengandung gula reduksi atau tidak, sedangkan analisis gula reduksi secara kuantitatif digunakan untuk
Mekanisme reaksi gula reduksi dan Fehling adalah sebagai berikut.
Analisis gula reduksi secara kuantitatif dapat dilakukan dengan berbagai cara, antara lain dengan metode Luff Schoorl (Kowalski et al., 2013), Nelson-Somogyi (Woiciechowski et al., 2002), dan DNS (Lone et al., 2012). Metode DNS
merupakan metode yang paling banyak digunakan untuk menentukan kadar gula reduksi. Dalam metode DNS digunakan pereaksi dinitrosalisilat (DNS). Bahan-bahan kimia yang diperlukan untuk membuat pereaksi DNS adalah asam 3,5-dinitrosalisilat, NaOH, Na2SO3, Na-K-tartarat, fenol, dan akuades. DNS merupakan senyawa aromatis yang dapat bereaksi dengan gula reduksi
membentuk asam 3-amino-5-nitrosalisilat, suatu senyawa yang mampu menyerap radiasi gelombang elektromagnetik pada panjang gelombang maksimum 550 nm (Kusmiati dan Agustini, 2010). Semakin tinggi kadar gula reduksi yang terdapat dalam sampel, maka akan semakin banyak pula molekul asam
3-amino-5-nitrosalisilat yang terbentuk, sehingga absorbansi sampel akan semakin tinggi.
Reaksi antara DNS dengan glukosa adalah sebagai berikut.
Sampel yang telah direaksikan dengan DNS selanjutnya ditentukan kadar gula reduksinya menggunakan spektrofotometer UV-Vis. Spektrofotometer UV-Vis adalah alat untuk mengukur transmitan atau absorbansi suatu sampel sebagai fungsi panjang gelombang. Alat ini menggunakan dua buah sumber cahaya yang berbeda, yaitu sumber cahaya UV menggunakan lampu Hidrogen atau Deuterium dan sumber cahaya tampak menggunakan lampu Tungsten. Larutan sampel yang akan dianalisis diukur absorbansi sinar ultra violet atau sinar tampaknya.
Konsentrasi larutan sampel yang dianalisis akan sebanding dengan jumlah sinar yang diserap oleh zat yang terdapat dalam larutan tersebut. Prinsip kerja
spektrofotometer UV-Vis ini didasarkan pada Hukum Lambert-Beer yang menyatakan hubungan antara absorbansi cahaya dengan konsentrasi zat dalam larutan. Secara sistematik, Hukum Lambert-Beer dapat dinyatakan dengan persamaan berikut.
A = - log T = log I0
It = ε . b . c
Dimana: A = absorbansi T = transmitansi
I0 = intensitas cahaya masuk
It = intensitas cahaya yang diteruskan oleh larutan sampel
ε = absorbtivitas molar (Lmol-1cm-1)
Agar dapat menentukan kadar gula reduksi pada sampel, terlebih dahulu dibuat kurva standar menggunakan larutan glukosa. Kurva standar dibuat dengan mengalurkan absorbansi pada panjang gelombang 550 nm dengan konsentrasi larutan standar (Kusmiati dan Agustini, 2010). Dari kurva standar tersebut akan didapatkan persamaan garis, yang menunjukkan hubungan antara konsentrasi dan absorbansi dengan persamaan umum:
y = ax + b
dimana y merupakan absorbansi, a merupakan slope, x merupakan konsentrasi sampel, dan b merupakan intersep. Dengan mensubstitusi nilai absorbansi sampel ke persamaan tersebut dan kemudian diplotkan terhadap kurva standar, maka dapat diketahui konsentrasi atau kadar gula reduksi pada sampel.
F. Fermentasi Alkohol
Fermentasi alkohol merupakan proses pengubahan gula reduksi menjadi bioetanol
dengan bantuan mikroorganisme seperti bakteri atau jamur. Reaksi
pembentukkan etanol secara umum dapat dituliskan sebagai berikut.
C6H12O6 2C2H5OH + 2CO2
mikroorganisme yang sangat penting, karena mikroorganisme hanya dapat tumbuh pada kisaran pH tertentu. Misalnya untuk Saccharomyces cerevisiae, pertumbuhan yang optimal berlangsung dalam media dengan pH 4,0-5,0.
Pada hakekatnya, fermentasi merupakan proses anaerobik. Oleh karena itu, kadar oksigen perlu dikendalikan agar proses berlangsung optimal. Pada umumnya, tekanan oksigen yang dianggap masih dapat ditoleransi oleh mikroorganisme adalah antara 0,05–1,0 mmHg. Jika tekanan oksigen yang diberikan lebih besar dari nilai tersebut, maka mikroorganisme lebih cenderung ke arah pertumbuhan sel dibanding dengan memproduksi etanol (Subekti, 2006).
Seperti halnya makhluk hidup lain, mikroorganisme juga membutuhkan asupan nutrisi yang cukup sebagai sumber energi untuk pertumbuhannya. Dengan kata lain, mikroorganisme memerlukan substrat yang mengandung nutrisi sesuai dengan kebutuhan yang diperlukan untuk pertumbuhannya.
Dalam bidang bioetanol, ada beberapa jenis mikroorganisme yang umum
digunakan, antara lain Zymomonas mobilis (Zhang and Feng, 2010), Aspergillus
niger (Ado et al., 2009), dan Saccharomyces cerevisiae (Hong et al., 2013). Dewasa ini, Saccharomyces cerevisiae merupakan jenis mikroorganisme yang paling banyak digunakan untuk fermentasi alkohol karena mampu menghasilkan etanol dengan rendemen yang lebih tinggi dibandingkan jenis mikroorganisme lainnya. Selain itu, mikroorganisme ini sangat mudah ditumbuhkan,
Saccharomyces cerevisiae adalah khamir bertunas yang termasuk dalam filum Ascomycota, dan paling umum digunakan dalam pembuatan roti dan fermentasi bir. Mikroorganisme ini tumbuh dengan baik pada suhu 30 oC dan pH 4,0–5,0. Pertumbuhan Saccharomyces cerevisiae dipengaruhi oleh adanya penambahan nutrisi yang mengandung karbon dan nitrogen, misalnya urea, ZA, ammonium dan pepton, mineral dan vitamin (Ikram et al., 2003).
Selain menggunakan Saccharomyces cerevisiae, altrnatif lain yang dapat digunakan untuk fermentasi alkohol adalah kulit kayu raru. Pemilihan jenis tanaman ini didasarkan pada pemanfaatannya secara tradisional oleh masyarakat etnis Batak, untuk memfermentasi air nira menjadi tuak. Tuak merupakan
minuman beralkohol yang dibuat dengan cara memasukkan serbuk kulit kayu raru ke dalam nira aren dan dibiarkan selama beberapa jam untuk berlangsungnya proses fermentasi (Wibowo dan Nauli, 2010). Pada penelitian Pasaribu (2009), diketahui ada empat jenis kulit kayu raru yang berasal dari Sumatera Utara dan Riau, yaitu Cotylelobium melanoxylon Pierre, Cotylelobium lanceolatum Craib, Shorea balanocarpoides Symington, dan Vatica perakensis King. Dari keempat jenis kayu raru tersebut, yang paling umum dimanfaatkan sebagai tuak adalah jenis Cotylelobium melanoxylon Pierre.
G. Analisis Kadar Bioetanol dengan Kromatografi Gas
Salah satu metode analisis bioetanol yang umum digunakan adalah kromatografi gas. Metode ini umum digunakan karena prosesnya mudah, cepat, sensitivitas tinggi, dan mampu memisahkan komponen-komponen dengan efisiensi yang tinggi, bahkan komponen dengan titik didih yang berdekatan dapat dipisahkan.
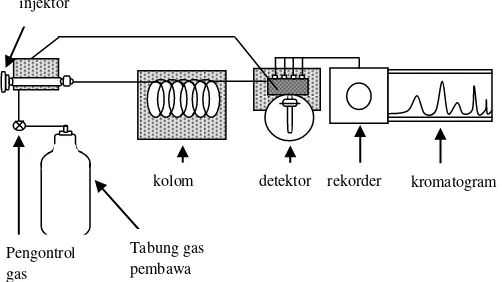
Secara garis besar, perangkat kromatografi gas terdiri dari beberapa komponen dengan fungsi yang berbeda. Untuk membawa sampel dari pangkalan injeksi melalui kolom menuju detektor diperlukan suatu gas pembawa. Gas pembawa harus bersifat inert, memiliki kemurnian yang tinggi, dan cocok dengan detektor yang digunakan. Gas pembawa yang biasanya digunakan adalah hidrogen, nitrogen, helium, dan argon. Gas pembawa ditempatkan dalam sebuah silinder yang bertekanan tinggi, umumnya 150 atm.
Komponen kromatografi gas yang berfungsi untuk memasukkan sampel adalah injektor. Injektor juga berfungsi untuk menguapkan sampel dan mencampurkan uap sampel dengan gas pembawa. Injektor dilengkapi dengan blok pemanas (heater block) yang digunakan untuk mengatur suhu injektor. Setelah sampel diinjeksikan, sampel tersebut dialirkan oleh gas pembawa menuju kolom. Kolom berfungsi sebagai fase diam dan merupakan tempat terjadinya proses pemisahan komponen-komponen dalam campuran berdasarkan perbedaan interaksi
komponen sampel dengan fasa diam. Ada 3 jenis kolom pada kromatografi gas yaitu kolom kemas (packing column), kolom kapiler (capillary column); dan kolom preparatif (preparative column). Komponen-komponen yang
jenis detektor yang sering digunakan dalam kromatografi gas, antara lain Flame Ionization Detector (FID), Thermal Conductivity Detector (TCD), Flame Photometric Detector (FPD), Flame Photometric Detector (FPD), dan Mass Spectrometer (MS).
Flame Ionization Detector (FID), yaitu detektor yang digunakan untuk mengukur komponen-komponen sampel yang memiliki gugus alkil. Di dalam FID
komponen-komponen sampel akan terionisasi, dan ion-ion yang dihasilkan akan dikumpulkan oleh ion pengumpul, kemudian arus yang dihasilkan akan dikonversi menjadi satuan tegangan. Semakin tinggi konsentrasi komponen, semakin banyak pula ion yang dihasilkan sehingga responnya juga akan semakin besar.
Thermal Conductivity Detector (TCD), yaitu detektor yang bekerja dengan prinsip mengukur daya hantar panas dari masing-masing komponen. TCD merupakan detektor yang paling umum digunakan karena semua komponen memiliki daya hantar panas.
Flame Photometric Detector (FPD), yaitu detektor khusus untuk mendeteksi senyawa yang mengandung sulfur, posfor, dan organotimah. Prinsip kerja jenis detektor ini adalah energi yang diemisikan dari pembakaran senyawa komponen akan dilewatkan pada filter tertentu, kemudian dideteksi oleh photomultiflier.
Mass Spectrometer (MS), jenis detektor yang prinsip kerjanya berdasarkan pemecahan komponen-komponen sampel menjadi ion-ion fragmen, lalu ion-ion fragmen tersebut dilewatkan pada Mass Analyzer untuk dipisahkan berdasarkan perbedaan massa/muatan. Selanjutnya diteruskan ke ion detektor untuk
mendeteksi jumlah ion yang dihasilkan.
Hasil deteksi selanjutnya dicatat oleh recorder sebagai kromatogram yang berupa puncak (peak). Secara sederhana, komponen-komponen kromatografi gas
[image:34.595.154.405.368.509.2]tersebut dapat digambarkan dalam skema alat kromatografi gas, seperti terlihat pada Gambar 3 berikut ini.
Gambar 3. Skema alat kromatografi gas
Dewasa ini telah banyak penelitian yang menggunakan kromatografi gas untuk menentukan kadar etanol hasil fermentasi. Najafpour et al (2004) melakukan penelitian menggunakan kromatografi gas untuk menentukan kadar etanol yang dihasilkan dari proses fermentasi glukosa menggunakan Saccharomyces
cerevisiae. Dalam penelitian tersebut, gas pembawa yang digunakan adalah nitrogen, detektor yang digunakan adalah FID dan kolom yang digunakan adalah kolom Porapak QS 100/120 mesh. Suhu oven pada kolom diatur sebesar 175 oC
injek
pengo
dete ord kol
tabung injektor
Tabung gas pembawa Pengontrol
gas
dan suhu detektor adalah 185 oC. Standar yang digunakan adalah isopropanol. Etanol yang diperoleh dari fermentasi gula reduksi sebanyak 150 g/L adalah sebesar 57 g/L atau setara dengan konversi gula reduksi sebesar 38%.
Subekti (2006) juga telah melakukan penelitian untuk memproduksi bioetanol dari hidrolisat tongkol jagung dengan bantuan Saccharomyces cerevisiae. Subekti menganalisis kadar etanol menggunakan metode kromatografi gas. Jenis kolom yang digunakan adalah kolom FFAP (crosslinked FFAP), detektor FID, dan gas pembawa helium. Kondisi perlakuan yang diterapkan yaitu suhu oven sebesar 60 oC selama 1 menit, 60–210 oC selama 5 menit, dan 210 oC selama 10 menit; suhu
detektor dan injektor sebesar 250 oC. Volume sampel yang diinjeksikan adalah sebesar 1 µL. Standar yang digunakan adalah etanol dengan konsentrasi 99,8 % (v/v). Kadar bioetanol optimum yang diperoleh dari fermentasi hidrolisat secara enzimatik adalah 14,22 g/L.
Dalam penelitian ini, untuk penentuan kadar etanol digunakan metode kromatografi gas dengan gas pembawa nitrogen (N), detektor FID (Flame Ionization Detector), dan kolom Carbowax 20M. Kolom Carbowax tipe HP-20M adalah salah satu jenis kolom dalam analisis kromatografi gas yang
III. METODELOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Mei sampai Agustus 2013 di Laboratorium Kimia Fisik, Laboratorium Biomassa, Laboratorium Biokimia, dan Laboratorium Instrumentasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung, serta di Laboratorium Afiliasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
B. Alat dan Bahan
Alat-alat yang digunakan yaitu ultrasonikator Bandelin Sonorex Technic,
spektrofotometer UV-Vis Varian Cary 100, autoklaf Kleinfeld-Germany HV-L25, laminar air flow ESCO AVC4A1, kromatografi gas GC-2010 AF Shimadzu, blender Philips, water bath Precisterm, neraca analitikWiggen Houser,
mikropipet Eppendorf, hot plate stirrer Stuart CB 162,indikator pH universal, dan alat-alat gelas yang umum digunakan di laboraturium. Bahan-bahan yang
C. Prosedur Penelitian
1. Preparasi Onggok
Persiapan onggok dilakukan dalam dua tahap, yaitu pengeringan dan penghalusan. Pengeringan onggok dilakukan di bawah sinar matahari selama tiga hari. Onggok yang telah kering dihaluskan menggunakan blender dan diayak, kemudian
disimpan di dalam wadah kedap udara.
2. Hidrolisis Onggok
Hidrolisis onggok dilakukan di bawah pengaruh ultrasonikasi dengan frekuensi tetap sebesar 40 kHz dengan pH, waktu, dan suhu yang berbeda sebagai dasar penentuan kondisi optimum.
2.1. Pengaruh pH
2.2.Pengaruh waktu
Untuk mempelajari pengaruh waktu, sampel disiapkan seperti dalam percobaan sebelumnya dan pH sampel diatur menjadi pH optimum, kemudian dihidrolisis pada suhu 50 oC selama 30 hingga 300 menit dengan interval waktu 30 menit. Kadar gula reduksi dari masing-masing perlakuan kemudian ditentukan untuk mendapatkan waktu optimum.
2.3. Pengaruh suhu
Untuk mempelajari pengaruh suhu, sampel disiapkan seperti dalam percobaan sebelumnya dan pH sampel diatur menjadi pH optimum, kemudian dihidrolisis selama waktu optimum pada suhu yang berbeda, yakni 50, 60, 70, dan 80 oC. Kadar gula reduksi dari masing-masing perlakuan kemudian ditentukan untuk mendapatkan suhu optimum.
3. Analisis Gula Reduksi
Dalam penelitian ini, analisis gula reduksi akan dilakukan secara kualitatif dan kuantitatif.
3.1. Analisis kualitatif
Analisis kualitatif dilakukan dengan metode Fehling. Untuk tujuan ini, ke dalam sebuah tabung reaksi dimasukkan larutan Fehling A dan Fehling B masing-masing sebanyak 1 mL, lalu ditambahkan 2 mL sampel dan dipanaskan dalam penangas air mendidih selama 10 menit. Uji positif adanya gula reduksi ditandai dengan terbentuknya endapan Cu2O yang berwarna merah bata, yang sekaligus
3.2. Analisis kuantitatif 3.2.1. Pembuatan reagen DNS
Sebanyak 1 gram asam 3,5-dinitrosalisilat dilarutkan dalam 20 mL akuades, kemudian dimasukkan ke dalam labu ukur 100 mL dan dihomogenkan.
Selanjutnya ke dalam labu ukur tersebut ditambahkan 1 gram NaOH; 0,2 gram fenol; 0,05 gram Na2SO3; dan 1 mL Na-K-tartarat 40%, kemudian ditambahkan akuades hingga batas miniskus, lalu dihomogenkan.
3.2.2. Pembuatan kurva standar
Pembuatan kurva standar dilakukan menggunakan larutan glukosa dengan konsentrasi 0, 200, 400, 600, 800, dan 1000 mg/L. Masing-masing larutan glukosa sebanyak 0,5 mL dimasukkan ke dalam tabung reaksi, kemudian ditambahkan dengan 0,5 mL akuades dan 2 mL reagen DNS. Tabung reaksi ditutup dengan alumunium foil dan dipanaskan dalam waterbath selama 10 menit pada suhu 100 oC. Larutan glukosa kemudian didinginkan hingga suhu kamar. Setelah itu dianalisis dengan spektrofotometer UV-Vis pada panjang gelombang 550 nm. Absorbansi dari masing-masing larutan glukosa diukur, kemudian nilai absorbansi yang diperoleh diplot terhadap konsentrasi untuk mendapatkan kurva standar dan persamaan garis yang menunjukkan hubungan antara absorbansi dengan konsentrasi glukosa.
3.2.3. Penentuan kadar gula reduksi dalam sampel
gula reduksi dalam sampel dihitung menggunakan persamaan garis yang didapatkan dari kurva standar.
4. Fermentasi Hidrolisat Onggok
4.1. Fermentasi dengan serbuk kulit kayu raru
Semua bahan dan alat yang digunakan disterilisasi menggunakan autoklaf pada suhu 121 0C dan tekanan 1 atm selama 15 menit, kecuali serbuk kulit kayu raru, kemudian didinginkan di dalam laminar air flow hingga suhu ruang. Setelah itu, sebanyak 100 mL hidrolisat dimasukkan ke dalam erlenmeyer 250 mL, lalu ditambahkan nira 5 mL. pH campuran kemudian diatur menjadi 5 dengan menambahkan larutan NaOH 0,1 M, lalu setelah pH tercapai, ke dalam sampel ditambahkan buffer fosfat pH 5 sebanyak 5 mL. Ke dalam campuran kemudian ditambahkan serbuk kulit kayu raru sebanyak 5 gram. Mulut erlenmeyer lalu ditutup dengan disumbat kapas, lalu erlenmeyer dibungkus dengan aluminium foil supaya sistem menjadi anaerob, kemudian dibiarkan pada suhu ruang selama 72 jam. Selanjutnya kadar bioetanol ditentukan dengan kromatogafi gas.
4.2. Fermentasi dengan Saccharomyces cerevisiae
5. Analisis Kadar Bioetanol dengan Kromatografi Gas
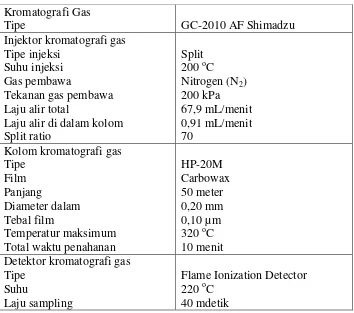
[image:41.595.115.469.260.573.2]Analisis kadar bioetanol dilakukan dengan metode kromatogafi gas yang ada di Laboratorium Afiliasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia, menggunakan kromatografi gas GC-2010 AF Shimadzu dengan rincian kondisi analisis seperti dalam Tabel 1.
Tabel 1. Parameter instrumen dan kondisi analisis kromatografi gas. Kromatografi Gas
Tipe GC-2010 AF Shimadzu
Injektor kromatografi gas Tipe injeksi
Suhu injeksi Gas pembawa
Tekanan gas pembawa Laju alir total
Laju alir di dalam kolom Split ratio
Split 200 oC Nitrogen (N2) 200 kPa 67,9 mL/menit 0,91 mL/menit 70
Kolom kromatografi gas Tipe Film Panjang Diameter dalam Tebal film Temperatur maksimum Total waktu penahanan
HP-20M Carbowax 50 meter 0,20 mm 0,10 µm 320 oC 10 menit Detektor kromatografi gas
Tipe Suhu
Laju sampling
Flame Ionization Detector 220 oC
40 mdetik
yang diperoleh dari kurva standar digunakan untuk menghitung kadar bioetanol sampel yang dihasilkan dari proses fermentasi.
Bioetanol hasil fermentasi sampel dianalisis dengan cara yang sama seperti kurva standar. Untuk mengetahui kadar bioetanol, luas puncak etanol yang dicatat sebagai kromatogam disubstitusi ke dalam persamaan yang dihasilkan dari kurva standar bioetanol, yang secara umum dinyatakan dengan persamaan:
y = ax + b
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat ditarik simpulan sebagai berikut.
1. Hidrolisis onggok menghasilkan gula reduksi dengan bantuan ultrasonikasi berpotensi untuk dikembangkan lebih lanjut menjadi metode hidrolisis alternatif.
2. Ketiga variabel yang dipelajari mempengaruhi kadar gula reduksi yang dihasilkan, dengan kadar tertinggi diperoleh dari hidrolisis pada pH 2 selama 90 menit dan suhu 80 0C, dengan kadar sebesar 801 mg/L.
3. Serbuk kulit kayu raru mampu mengubah gula reduksi hasil hidrolisis onggok menjadi bioetanol, namun efektivitasnya masih lebih rendah dibandingkan Saccharomyces cerevisiae.
B. Saran
Hal-hal yang disarankan untuk penelitian selanjutnya adalah sebagai berikut: 1. Dalam penelitian ini hidrolisis onggok di bawah pengaruh ultrasonikasi
dilakukan pada frekuensi tetap. Oleh karena itu, disarankan untuk melakukan penelitian dengan mempelajari pengaruh frekuensi terhadap hidrolisis
onggok.
2. Untuk memperjelas pengaruh pH, disarankan untuk melakukan penelitian dengan menambahkan buffer agar pH tetap selama proses hidrolisis berlangsung.
3. Dalam penelitian ini suhu optimum hidrolisis onggok belum didapatkan. Untuk itu, disarankan melakukan penelitian dengan memperluas rentang suhu hidrolisis sehingga diperoleh suhu optimum.
4. Gula reduksi yang diperoleh dari hasil percobaan hidrolisis onggok belum diketahui pasti jenisnya, sehingga perlu dilakukan identifikasi gula reduksi yang dihasilkan.
DAFTAR PUSTAKA
Ado, S. A., Olukotun G.B., Ameh J. B., and Yabaya A. 2009. Bioconversion Of Cassava Starch to Ethanol in A Simultaneous Saccharification and Fermentation Process by Co-Cultures of Aspergillus Niger and Saccharomyces Cerevisiae. Science World Journal, 4(1): 19-22. Agbor, V.B., Nazim C., Richard S., Alex B., and David B.L. 2011. Biomass
Pretreatment: Fundamentals Toward App.lication. Biotechnology Advances, 29: 675-685.
Aiyer, P.V. 2005. Amylases and Their Applications. African Journal of Biotechnology, 4(13): 1525-1529.
Anozie, A.N. and Aderibigbe A.F. 2011. Optimization Studies of Cassava Starch Hydrolysis using Response Surface Method. New Clues in Sciences, 1: 37-43.
Apar, D.C. and Özbek B. 2004. Corn, Rice, and Wheat Starch Hydrolysis by Using Various Alpha-Amylase Enzymes at Temperature 40 oC. Journal of Engineering and Natural Sciences, 2: 55-68.
Azizah, N., Al-Baarri A.N., and Mulyani S. 2012. Pengaruh Lama Fermentasi terhadap Kadar Alkohol, pH, dan Produksi Gas pada Proses Fermentasi Bioetanol dari Whey dengan Substitusi kulit Nanas. Jurnal Aplikasi Teknologi Pangan, 1(2): 72-77.
Badan Pusat Statistika (BPS) Provinsi Lampung. 2012. Lampung Dalam Angka 2011. http://www.lampung.bps.go.id, diakses pada 7 Desember 2012. Balat, M., Havva B., and Öz C. 2008. Progress in Bioethanol Processing.
Progress in Energy and Combustion Science, 34(5): 551-573.
Barnali, B., Basu R.K., and Ash S.N. 2008. Kinetic Study on Acid Catalytic Hydrolysis of Starch. Journal of Scientific and Industrial Research, 67: 295-298.
BeMiller, J.N. and Whistler R. 2009. Starch: Chemistry and Technology 3rd Edition. New York. Academic Press Incorporated.
Bozbas, K. 2005. Biodiesel as An Alternative Motor Fuel: Production and Policies in The European Union. Renewable and Sustainable Energy Reviews, 20: 1-12.
Camarena, F. and Martinez J.A. 2006. Potential of Ultrasound to Evaluate Turgidity and Hydration of The Orange. Journal Food Engineering, 75: 503-507.
Collares, R.M., Luiza V.S.M, Mariana M.B., Nina P.G.S., Marcio A.M., Dilson A.B., and Lisiane M.T. 2012. Optimization of Enzymatic Hydrolysis of Cassava to Obtain Fermentable Sugars. Journal of Zhejiang University-Science B (Biomedicine and Biotechnology), 13(7): 579-586.
Dien, B.S., Ximenes E.A., O’Brian B.J., Moniruzzaman M., Li X., Balan V., Dale B., and Cotta M.A. 2008. Enzyme Characterization for Hydrolysis of AFEX and Liquid Hot-Water Pretreated Distillers Grains and Their Conversion to Ethanol. Bioresource Technology, 99: 5216-5225. Elaiyaraju, P. and Partha N. 2012. Biogas Production from Co-Digestion of
Orange Peel Waste and Jatropha De-oiled Cake in An Anaerobic Batch Reactor. African Journal of Biotechnology, 11(14): 3339-3345.
Fregonesi, A., Moran-Paulo J., Joekes I., Augusto J., Rodrigues R., Tonella E., and Althoff K. 2007. Continuous Fermentation of Sugar Cane Syrup Using Immobilized Yeast Cells. Bioresource Bioengineering, 97: 48-52.
García-Cubero, M.T., González-Benito G., Indocoechea I., Coca M., and Bolado S. 2009. Effect of Ozonolysis Pretreatment on Enzymatic Digestibility of Wheat and Rye Straw. Bioresource Technology, 100(4): 1608-1613. Herrera A., Tellez-Luis S.J., and Ramirez J.A. 2003. Production of Xylose from
Sorghum Straw Using Hydrochloric Acid. Journal Cereal Science, 37: 267-274.
Hong, L.S., Ibrahim D., and Omar C.O. 2013. Effects of Physical Parameters on Second Generation of Bioethanol Production from Oil Palm Frond by Saccharomyces cerevisiae. Biosources, 8(1): 969-980.
Katzen, R., Madson P.W., and Monceaux D.A. 1995. Use of Cellulosic
Feedstocks for Alcohol Production (The Alcohols Textbook). Notingham University Press, 37-46.
Kim, H-Y., Ju H.L., Kim J-Y., Lim W-J, and Lim S-T. 2012. Characterization of Nanoparticles Prepared by Acid Hydrolysis of Various Starches.
Starch/Starke, 64: 367–373.
Kowalski, S., Marcin L., and Wiktor B. 2013. Applicabality of Physico-chemical Parameters of Honey for Identification of The Botanical Origin. Acta Scientiarum Polonorum, 2(1): 51-59.
Kumar, P., Barrett D.M., Michael J.D., and Pieter S. 2009. Methods for Pretreatment of Lignocellulosic Biomass for Efficient Hydrolysis and Biofuel Production. Industrial and Engineering Chemistry Research, 48(8): 3713-3729.
Kusmiati dan Agustini N.W.S. 2010. Pemanfaatan Limbah Onggok untuk Produksi Asam Sitrat dengan Penambahan Mineral Fe dan Mg pada Substrat Menggunakan Kapang Trichoderma Sp dan Aspergillus Niger. Seminar Nasional Biologi, 856-866.
Lida, Y., Tuziuti T., Yasui K., Towata A., and Kozuka T. 2008. Control of Viscosity in Starch and Polysaccharide Solution with Ultrasound After Gelatinization. Innovative Food Science and Emerging Technologies, 9: 140-146.
Lone, M.A., Wani M.R., Bhat N.A., Sheikh S.A. and Reshi M.A. 2012.
Evaluation of Cellulase Enzyme Secreted by Some Common and Stirring Rhizosphere Fungi of Juglans Regia L. by DNS Method. Journal of Enzyme Research, 3(1): 18-22.
Mathews, van H. and Ahern. 2000. Biochemistry 3rd Edition. San Francisco. Benjamin/Cummings, 278-310.
Mayasari, T.S. 2007. Pengaruh Lama Hidrolisa dan Konsentrasi Asam terhadap Rendemen dan Mutu Sirup Glukosa dari Pati Pisang Kepok (Musa paradisiacal L.). Skripsi. Universitas Sumatera Utara. Medan. Manwar, J., Kakasaheb M., and Anant P. 2013. Plackett-Burman Design: A
Statistical Method for The Optimization of Fermentation Process for The Yeast Sccharomyces cerevisiae Isolated from The Flower of Woodfordia Fruticosa. Fermentation Technology, 2(1): 1-6.
Mesa, L., Gonzáles E., Cara C., Gonzáles M., Castro E., and Mussatto S.I. 2011. The Effect of Organosolve Pretreatment Variables on Enzymatic
Hydrolysis of Sugarcane Baggasse. Chemical Engineering Journal, 168: 1157-1162.
Mishra, M.S., Chandrashekar B., Tanushree C., and Kanwal S. 2011. Production of Bioethanol from Jatropha Oilseed Cakes via Dilute Acid Hydrolysis and fermentation by Saccharomyces cerevisiae. International Journal of Biotechnology Applications. 3(1): 41-47.
Mosier, N S., Hendrickson, R., and Brewer, M. 2005. Industrial Scale-up of pH-Controlled Liquid Hot Water Pretreatment of Corn Fiber for Fuel Ethanol Production. Application Biochemistry Biotechnology, 125: 77-97.
Moxley, G., Zhu Z., and Zhang Y. H.P. 2008. Efficient Sugar Release by the Cellulose Solvent-Based Lignocellulose Fractionation Technology and Enzymatic Cellulose Hydrolysis. Journal Agricultural Food Chemistry, 56: 885-890.
Najafpour, G., Ideris A., Salmanpour S., and Norouzi M. 2007. Acid Hydrolysis of Pretreated Palm Oil Lignocellulosic Wastes. IJE Transaction B: Applications, 20(2): 147-156.
Najafpour, G., Younesi H., and Ku S. 2004. Ethanol Fermentation in An
Immobilized Cell Reactor using Saccharomyces cerevisiae. Bioresource Technology, 92: 251-260.
Nicolić, S., Mojovic L., Rakin M., Dušanka P., and Jelena P. 2010. Ultrasound-assisted Production of Bioethanol by Simultaneous Saccharification and Fermentation of Corn Meal. Food Chemistry, 122: 216-222.
Nityavardhana, S., Rakshit S K., and Grewell D. 2008. Ultrasound Pretreatment of Cassava Chip Slurry to Enhance Sugar Release for Subsequent Ethanol Production. Biotechnology Bioengineering,101: 487-496.
Olorunsola, E.O., Isah, A.B., and Allagh T.S. 2011. Effects of Varying Conditions of Acid Hydrolysis on Some Physicochemical Properties of Ipomoea Batatas Starch. Nigerian Journal of Pharmaceutical Sciences, 9(2): 73-80. Pan, X., Xie, D., and Kang, K.Y. 2007. Effect of Organosolv Ethanol
Pretreatment Variables on Physical Characteristics of Hybrid Poplar Substrates. Applications Biochemistry Biotechnology, 136(140): 367-377. Pandey, A., Carlos R.S., Poonam N., Vanete T.S., Luciana P.S.V., and
Pasaribu, G.T. 2009. Zat Ekstraktif Kayu Raru Dan Pengaruhnya Terhadap Penurun Kadar Gula Darah Secara In Vitro. Tesis. Institut Pertanian Bogor. Bogor.
Patist, A., and Bates, D. 2008. Ultrasonic Innovations in The Food Industry: From the Laboratory to Commercial Production. Innovative Food Science and Emerging Technologies, 9(2): 147-154.
Perez, J.A., Gonzalez A., and Oliva J.M. 2007. Effect of Process Variables on Liquid Hot Water Pretreatment of Wheat Straw for Bioconversion to Fuel-Ethanol In A Batch Reactor. Journal Chemistry Technology
Biotechnology, 82: 929-938.
Purba, E. 2001. Hidrolisi Pati Ubi Kayu (Manihot esculenta) dan Pati Ubi jalar (Ipomea batatas) Menjadi Glukosa secara Cold Process dengan Enzim Acid Fungal Amilase dan Glukoamilase. Skripsi. Universitas Lampung. Bandar Lampung.
Rahmasari, S. dan Putri K.P. 2011. Pengaruh Hidrolisis Enzim pada Produksi Ethanol dari Limbah Padat Tepung Tapioka (Onggok). Skripsi. Institut Teknologi Sepuluh November. Surabaya.
Rehman, M.S., Ilgook K., Yusuf C., and Jong-In H. 2013. Use of Ultrasound in The Production of Bioethanol from Lignocellulosic Biomass. Energy Education Science and Technology Part A: Energy Science and Research, 30(2): 1391-1410.
Seftaria, V. 2011. Studi Pendahuluan Transesterifikasi Minyak Kelapa dengan Katalis Heterogen Berbasis Silika Sekam Padi (Ti-Silika) dan Donor Gugus Metil Non-Alkohol (Dimetil Karbonat). Skripsi. Universitas Lampung. Bandar Lampung.
Shewale, S.D. and Pandit A.B. 2009. Enzymatic Production of Glucose from Different Qualities of Grain Sorghum and Application of Ultrasound to Enhance The Yield. Carbohydrate Resource, 344: 52-60.
Shin, H.K., Kong J.Y., Lee J.D., and Lee T.H. 2000. Synthesis of Hydroxy Benzyl-α-glucosides-catalysed Transglycosylation. Biotechnology Letters, 22: 321-325.
Shin, S.J. and Sung Y.J. 2008. Improving Enzymatic Hydrolysis of Industrial Hemp (Cannabis sativa L.) by Electron Beam Irradiation. Radiation Physical Chemistry,77: 1034-1038.
Subekti, H. 2006. Produksi Etanol dari Hidrolisat Fraksi Selulosa Tongkol Jagung oleh Saccharomyces cerevisiae. Skripsi. Institut Pertanian Bogor. Bogor. Sun, Y. and Cheng J.J. 2002. Hydrolysis of Lignocellulosic Materials for Ethanol
Production: A Review. Bioresource Technology, 83: 1-11.
Trisnawati, E. 2008. Pengaruh Ultrasonikasi Terhadap Hidrolisis Pati dan Onggok serta Kaitannya dengan Fermentasi Menggunakan Kulit Kayu Tanaman Raru. Skripsi. Universitas Lampung. Bandar Lampung.
Usman, M.A., Olanipekun O.O., and Kareem O.M. 2011. Biogas Generation from Domestic Solid Wastes in Mesophilic Anaerobic Digestion. International Journal of Research in Chemistry and Environment, 2: 200-205.
Velmurugan, R. and Muthukumar K. 2011. Utilization of Sugarcane Baggase for Bioethanol Production Sono-assisted Acid Hydrolysis Approach.
Bioresource Technology, 102(7): 119-123.
Walker, G. 2011. Fuel Alcohol: Current Production and Future Challenges (125th Anniversary Review). Journal Journal of the Institute of Brewing, 117: 3-22.
Wibowo, S. dan Nauli A. 2010. Pengembangan Bioenergi: Peluang dan
Tantangan. Balai Penelitian Kehutanan. Prosiding Seminar Sehari Hasil-Hasil Penelitian: Peran Penelitian dan Pengembangan pada
Pembangunan Kehutanan di Sumatera Utara, 211-217.
Woiciechowski, A.L., Nitsche S., Pandey A., and Soccol C.R. 2002. Acid and Enzymatic Hydrolysis to Recover Reducing Sugar from Cassava Baggase: An Economic Study. Brazilian Archieves of Biology and Technology, An International Journal, 45(3): 393-400.
Wyman C.E. 2008. Cellulosic Ethanol: A Unique Sustainable Liquid Transportation Fuel. MRS Bull, 33: 381-383.
Yang, C.P., Shen, Z Q., and Yu, G C. 2008. Effect and Aftereffect of Gamma Radiation Pretreatment on Enzymatic Hydrolysis of Wheat Straw. Bioresource Technology, 99: 6240-6245.
Zamora, L.L., Calderón J.A.G., Vázquez, E.T., and Reynoso E.B. 2010. Optimization of Ethanol Production Process from Cassava Starch by Surface Response. Journal Mexico Chemistry Society, 54(4): 198-203. Zhang, K. and Feng H. 2010. Fermentation Potentials of Zymomonas mobilis and
Zhang, W., Liang, M., and Lu, C. 2007. Morphological and Structural Development of Hardwood Cellulose During Mechanochemical
Pretreatment In Solid State Through Pan Milling. Cellulose, 14: 447-456. Zheng, Y., Zhongli P., and Zhang R. 2009. Overview of Biomass Pretreatment for