OPTIMALISASI PRODUKSI GULA REDUKSI DARI ONGGOK SEBAGAI BAHAN BAKU BIOETANOL DENGAN PRAPERLAKUAN
ULTRASONIKASI
Oleh
Juwita Ratna Sari
Skripsi
Sebagai salah satu syarat untuk mencapai gelar Sarjana Sains
pada Jurusan Kimia
Fakkultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
OPTIMALIZATION OF REDUCING SUGAR PRODUCTION FROM CASSAVA WASTE AS RAW MATERIAL OF BIOETHANOL WITH
ULTRASONICATION PRETREATMENT
By
Juwita Ratna Sari
This study was conducted in an effort to optimize the production of reducing sugar from cassava waste with the aid of ultrasonication pretreatment, with the main focuss to investigate the effect of ultrasonication time and hydrolysis time on the reducing sugar content of the hydrolizates. The hydrolizate with the highest reducing sugar content was subjected to fermentation experiments using the powdered bark of Raru tree and Saccharomyces cerevisiae. The bioethanol produced was analyzed by gas chromatography method using flame ionisation detector. The results obtained demosntrated that utasonication pretreatment led to imporoved hydrolysability of the sample, as indicated by very significant increased of reducing sugar produced compared to that produced from untreated sample. Fermentation experiments indicated that the reducing sugar produced can be converted into bioethanol by both fermenting agents, however the bark of Raru tree is less effective than Saccharomyces cerevisiae.
ABSTRAK
OPTIMALISASI PRODUKSI GULA REDUKSI DARI ONGGOK SEBAGAI BAHAN BAKU BIOETANOL DENGAN PRAPERLAKUAN
ULTRASONIKASI
Oleh
Juwita Ratna Sari
Penelitian ini dilakukan sebagai upaya untuk optimalisasi produksi gula reduksi sebagai bahan baku bioetanol dari onggok dengan praperlakuan ultrasonikasi, dengan fokus utama mempelajari pengaruh waktu ultrasonikasi terhadap kemudahan onggok untuk dihidrolisis, yang ditunjukkan dengan kadar gula reduksi dalam hidrolisat. Untuk mempelajari pengaruh waktu ultrasonikasi, serangkaian percobaan dilakukan menggunakan gelombang ultrasound dengan frekuensi 40 kHz dan suhu 30 oC, dengan waktu yang berbeda, yakni 1-7 jam. Untuk menentukan waktu ultrasonikasi optimum, kadar gula reduksi sampel setelah perlakuan dianalisis menggunakan metode spektrofotometri UV-Vis. Sampel yang diperoleh dengan waktu ultrasonikasi optimum selanjutnya dihidrolisis pada pH=2, suhu 90 oC selama 1-7 jam. Percobaan ini dilakukan untuk menentukan waktu hidrolisis optimum. Sampel yang dihasilkan dari perlakuan optimum selanjutnya difermentasi menggunakan serbuk kulit kayu raru dan Saccharomyces cerevisiae selama 72 jam. Kadar etanol yang dihasilkan ditentukan dengan kromatografi gas. Hasil penelitian menunjukkan bahwa waktu ultrasonikasi optimum adalah 3 jam dan waktu hidrolisis optimum adalah 2 jam. Hasil uji fermentasi menunjukkan bahwa kulit kayu raru mampu mengubah gula reduksi dalam hidrolisat menjadi bioetanol, namun unjuk kerjanya masih lebih rendah dibanding Saccharomyces cerevisiae.
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
I. PENDAHULUAN... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 4
C. Manfaat Penelitian ... 4
II. TINJAUAN PUSTAKA ... 5
A. Bioenergi ... 5
B. Bioetanol ... 6
C. Pati ... 8
D. Hidrolisis Onggok ... 9
E. Analisis Gula Reduksi ... 17
F. Fermentasi Alkohol ... 22
G. Analisis Bioetanol dengan Kromatografi Gas ... 25
III. METODELOGI PENELITIAN ... 29
A. Waktu dan Tempat Penelitian ... 29
C. Prosedur Kerja ... 30
1. Preparasi Onggok ... 30
2. Ultrasonikasi Onggok ... 30
3. Hidrolisis Onggok ... 30
4. Analisis Kadar Gula Reduksi ... 31
4.1. Analisis kualitatif ... 31
4.2. Analisis kuantitatif ... 31
4.2.1. Pembuatan reagen DNS ... 31
4.2.2. Pembuatan kurva standar ... 31
4.2.3. Penentuan kadar gula reduksi dalam sampel ... 32
5. Fermentasi Hidrolisat Onggok ... 32
5.1. Fermentasi dengan serbuk kulit kayu raru ... 32
5.2. Fermentasi dengan Saccharomyces cerevisiae ... 33
6. Analisis Kadar Bioetanol dengan Kromatografi Gas ... 33
IV. HASIL DAN PEMBAHASAN ... 35
A. Pengantar ... 35
B. Preparasi Onggok ... 35
C. Praperlakuan Ultrasonikasi Onggok ... 36
D. Hidrolisis Onggok ... 38
E. Analisis Gula Reduksi ... 39
F. Fermentasi Hidrolisat Onggok ... 45
1. Persiapan serbuk kulit kayu raru ... 45
I. PENDAHULUAN
A. Latar Belakang
Bioenergi adalah energi alternatif yang berasal dari sumber-sumber biologis. Penggunaan bioenergi memiliki keunggulan dalam hal meningkatkan kualitas lingkungan serta mengurangi ketergantungan terhadap bahan bakar fosil. Salah satu bentuk bioenergi yang terus dikembangkan dewasa ini adalah biofuel, yakni sumber energi yang dihasilkan dari biomassa, meliputi biodiesel, bioetanol dan biooil. Biomassa yang umum digunakan sebagai sumber biofuel adalah berasal
dari tanaman. Di Indonesia ada beberapa tanaman yang dapat dimanfaatkan sebagai sumber energi yang potensial sebagai penghasil bioenergi antara lain kelapa sawit, kelapa, jarak pagar, kapas, kanola, serta ubi kayu, ubi jalar, tebu, sorgum, sagu, aren, nipah, dan lontar. Selain potensial sebagai penghasil bioenergi, beberapa komoditas tersebut, seperti kelapa sawit, kelapa, kapas, ubi kayu, tebu, dan sagu, juga merupakan komoditas sumber bahan pangan dan pakan. Pemanfaatan komoditas sumber bahan pangan sebagai bahan baku bioenergi dipandang kurang etis karena berkompetisi dengan bahan pangan dan pakan (Wardhanu, 2011). Untuk mengurangi pemanfaatan bahan pangan sebagai bahan baku energi terbarukan, upaya yang terus dikembangkan adalah
yang berpotensi untuk dimanfaatkan adalah onggok sebagai bahan baku pembuatan bioetanol.
Onggok merupakan hasil samping pengolahan tepung tapioka dan diketahui mengandung pati sekitar 67,8%, di samping protein sebesar 1,57%, lemak sebesar 0,26%, serat kasar sebesar 10% dan air 20% (Winarno dkk., 1988). Di provinsi Lampung ubi kayu merupakan salah satu komoditi pertanian yang sangat penting karena didukung dengan luas lahan ubi kayu berdasarkan data pada tahun 2011 sekitar 368.000 ha dengan produksi pertahun mencapai 9.200.000 ton pertahun (BPS, 2012). Pengolahan ubi kayu menjadi tepung tapioka menghasilkan hasil samping berupa onggok yang jumlahnya sekitar 19,7% (Mariyono, 2007), ini berarti di Provinsi Lampung sendiri akan tersedia sekitar 1.800.000 ton onggok.
Dalam pemanfaatan ongggok sebagai bahan baku bioetanol, masalah utamanya adalah bahan baku ini tidak dapat difermentasi langsung, tetapi harus dihidrolisis terlebih dahulu untuk mengubah pati menjadi gula reduksi. Untuk tujuan tersebut, dewasa ini telah dikembangkan berbagai metode hidrolisis polisakarida, meliputi hidrolisis asam (Zamora et al., 2010), dan enzimatis (Zhao et al., 2008).
Meskipun metode di atas mampu menghasilkan gula reduksi namun gula reduksi yang dihasilkan belum optimal, sehingga diperlukan upaya praperlakuan untuk meningkatkan kemudahan pati untuk dihidrolisis.
mekanik seperti dicacah dan digiling (Zhang et al., 2007), radiasi dengan sinar-γ (Yang et al., 2008), ultrasonikasi (Nitayavardhana et al., 2008), radiasi dengan berkas elektron (Bak et al., 2009), serta penyinaran menggunakan sinar-UV (Dunlap et al., 1980). Praperlakuan kimia diantaranya pemecahan molekul menggunakan uap air dengan bantuan katalis (De et al., 2007), pelarutan dalam bahan organik (Pan et al., 2007), praperlakuan menggunakan air panas dengan pH tertentu (Mosier et al., 2005).
Dalam penelitian ini upaya peningkatan produksi gula reduksi dari onggok dilakukan dengan praperlakuan fisik meliputi penggilingan dan ultrasonikasi. Penggilingan dimaksudkan untuk merusak kristalinitas pati, menurunkan derajat polimerisasi dan meningkatkan luas permukaan molekul pati akibat
pemecahannya menjadi partikel yang lebih kecil. Praperlakuan dengan
ultrasonikasi dimaksudkan untuk menimbulkan kavitasi (rongga) pada molekul pati, sehingga lebih mudah diakses oleh asam pada saat dihidrolisis (Wardiyati, 2004). Dengan demikian praperlakuan ultrasonikasi yang diterapkan pada onggok dalam penelitian ini diharapkan dapat mengubah karakteristik pati sehingga menjadi lebih mudah untuk dihidrolisis menghasilkan gula reduksi. Untuk mengevaluasi efektifitas praperlakuan ultrasonikasi, dalam penelitian ini sampel diultrasonikasi dengan frekuensi 40 kHz dengan waktu yang berbeda, yakni 1; 2; 3; 4; dan 5 jam.
(Trisnawati, 2008). Setelah hidrolisis, kadar gula reduksi dalam filtrat ditentukan dengan metode UV-Vis menggunakan reagen dinitrosalisilat (DNS). Kadar gula reduksi dihitung berdasarkan pengukuran absorbansi pada panjang gelombang 550 nm (Kusmiati dan Agustini, 2010), dengan bantuan kurva standar yang dihasilkan dari pengukuran absorbansi larutan glukosa. Untuk mengevaluasi kemungkinan pembentukkan gula reduksi selama proses ultrasonikasi, kadar gula reduksi sebelum sampel dihidrolisis juga ditentukan dengan metode yang sama.
Aspek ketiga yang dipelajari dalam penelitian ini adalah fermentasi gula reduksi hasil hidrolisis onggok untuk menghasilkan bioetnol. Fermentasi dilakukan menggunakan Saccharomyces cerevisiae dan serbuk kulit kayu raru. Hasil fermentasi dianalisis dengan metode gas kromtografi untuk menentukan kadar etanol yang dihasilkan.
B. Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan mempelajari pengaruh waktu ultrasonikasi dan hidrolisis terhadap jumlah gula reduksi dari hidrolisis onggok dan kadar alkohol yang mampu dihasilkan dari fermentasi gula reduksi.
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Bioenergi
Bioenergi adalah energi alternatif yang berasal dari sumber-sumber biologis. Penggunaan bioenergi memiliki keunggulan dalam hal meningkatkan kualitas lingkungan, meningkatkan pertumbuhan ekonomi, serta mengurangi
ketergantungan terhadap bahan bakar fosil. Saat ini pengembangan bioenergi telah memanfaatkan bahan di luar pangan dan pakan diantaranya menggunakan limbah, selulosa dan tanaman yang dikhususkan sebagai bahan baku energi alternatif, misalnya residu biomassa, minyak nabati non-pangan.
Indonesia sebagai salah satu negara tropis memiliki beragam sumber daya alam yang sangat potensial sebagai bahan baku sumber energi alternatif. Sektor pertanian merupakan usaha yang sangat potensial untuk dikembangkan di Indonesia karena Indonesia memiliki potensi sumber daya lahan, iklim, dan sumber daya manusia yang cukup. Kondisi iklim tropis dengan curah hujan yang cukup, ketersediaan lahan yang masih luas, serta telah berkembangnya teknologi optimalisasi produksi merupakan faktor pendukung untuk pengembangan
Di Indonesia ada beberapa jenis tanaman yang dapat dimanfaatkan sebagai sumber energi diantaranya kelapa sawit (Chantara et al., 2012), kelapa (Leplus, 2003), dan jarak pagar (Antony et al., 2011) untuk pembuatan biodiesel. Sedangkan untuk pembuatan bioetanol diantaranya ubi kayu (Zamora et al., 2010), ubi jalar (Manrique and Roca, 2007), jagung (Nicolić et al., 2010), dan gandum (Perez et al., 2007). Salah satu bioenergi yang terus dikembangkan dewasa ini adalah bioetanol, karena dapat dibuat dari sumber daya alam
terbarukan dengan artian bahwa sumber daya alam tersebut dapat dibudidayakan.
B. Bioetanol
Bioetanol adalah alkohol yang diperoleh dari proses fermentasi gula reduksi. Etanol disebut juga sebagai etil alkohol, mempunyai sifat berupa cairan yang tidak stabil (volatile), mudah terbakar dan tidak berwarna dengan rumus molekul
C2H5OH yang merupakan alkohol berantai lurus. Etanol merupakan bahan bakar alternatif karena dapat diperbaharui, ramah lingkungan, serta menghasilkan gas buangan yang rendah dibandingkan dengan bensin atau sejenisnya.
Sebagai gambaran, reaksi pembakaran 1 mol etanol akan menghasilkan 2 mol gas CO2, sementara pembakaran 1 mol isooktana (kandungan utama pada gasoline) akan menghasilkan 8 mol CO2, seperti terlihat dalam reaksi berikut ini.
Energi yang dihasilkan dari pembakaran 1 mol etanol sebesar adalah 1381,38 kJ, dan energi yang dihasilkan dari pembakaran 1 mol isooktana sebesar adalah 5460 kJ. Jika dilihat dari sisi CO2, maka pembakaran 4 mol etanol menghasilkan CO2 dengan jumlah yang setara dengan hasil pembakaran 1 mol isooktana. Energi yang dihasilkan untuk pembakaran 4 mol etanol adalah sebesar 5525,52 kJ. Artinya dengan jumlah CO2 yang sama, pembakaran etanol menghasilkan energi yang jauh lebih besar daripada pembakaran isooktana, dengan selisih energi sebesar 65,52 kJ.
Seperti telah dipaparkan di atas, bioetanol dapat dibuat dengan cara fermentasi gula reduksi seperti molase (Gervásio et al., 2005), glukosa (Ubalua, 2007) dan fruktosa (Lin and Tanaka, 2006). Masalahnya adalah gula reduksi merupakan bahan pangan utama, sehingga penggunaannya sebagai bahan baku bioetanol akan berdampak pada ketersediaan bahan pangan.
Untuk menghindari masalah tersebut, dewasa ini pembuatan bioetanol dari polisakarida menjadi fokus penelitian. Dari berbagai polisakarida, yang paling banyak diteliti adalah pati (Srinorakutara et al., 2006) dan selulosa (Yu and Zhang, 2004). Pati dapat diperoleh dari tepung jagung (Shapouri et al., 2002), singkong (Zamora et al., 2010), dan kentang (Fadel, 2000), sedangkan selulosa dapat diperoleh dari kayu (Pimentel and Tad, 2005), dan limbah pengolahan kertas (Sathya and Navaneetha, 2011).
sekitar 49,76 % v/v. Shapouri et al. (2002) mengolah pati jagung menjadi bioetanol dan menemukan bahwa dari 3,0-3,2 kg jagung dapat diperoleh 1 L etanol. Dalam penelitian lain, (Fadel, 2000) didapatkan hasil bioetanol dengan konsentrasi alkohol 13,2% v/v dari bahan baku kentang.
Selain pati, bioetanol juga dapat dibuat dari selulosa. Sebagai contoh Sathya and Navaneetha (2011) mengolah limbah pengolahan kertas menjadi bioetanol dengan rendemen sekitar 0.097 g/g. Dalam penelitian lain, (Pimentel and Tad, 2005), dilaporkan bahwa 1 L etanol dapat dihasilkan dari 2,5 kg kayu.
Meskipun kedua jenis polisakarida di atas telah digunakan sebagai bahan baku pembuatan bioetanol, namun hingga dewasa ini, pati masih merupakan bahan baku yang paling banyak dimanfaatkan. Selain karena jumlahnya yang melimpah, pati lebih mudah dihidrolisis dibanding selulosa sehingga biaya pengolahan lebih rendah.
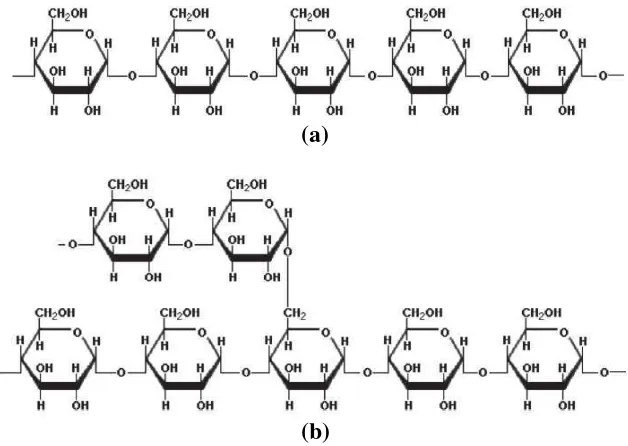
C. Pati
Amilosa memiliki berat molekul sekitar 104-106 Dalton dan amilopektin sekitar 107-108 Dalton (Saunders et al., 2011).
(a)
(b)
Gambar. 1. (a) struktur amilosa dan (b) struktur amilopektin.
Salah satu perbedaan paling penting antara amilosa dan amilopketin adalah
kemudahannya untuk dihidrolisis. Karena ikatan α-(1,4)-D-glikosida lebih mudah diputus dibanding dengan ikatan α-(1,6)-D-glikosida, maka amilosa lebih mudah terhidrolisis dibandingkan dengan amilopektin.
D. Hidrolisis Onggok
Di Indonesia, Provinsi Lampung khususnya, salah satu bahan dasar yang potensil untuk pembuatan bietanol berbasis pati adalah onggok, yang diketahui
mengandung pati dengan kadar cukup tinggi, yakni sekitar 50- 70% (Pandey et al., 2000). Masalahnya adalah pengolahan onggok menjadi bioetanol
[image:17.595.154.468.140.363.2]dibedakan menjadi hidrolisis asam dan hidrolisis enzimatik. Adapun tahapan hidrolisis pati baik menggunakan asam maupun enzim dapat dituliskan dalam reaksi sebagai berikut.
Pati → Dekstrin →Maltosa → Glukosa
Dalam penerapan metode hidrolisis asam, berbagai faktor telah diteliti dan secara umum ditemukan bahwa unjuk kerja metode ini dipengaruhi oleh jenis dan konsentrasi asam, suhu, waktu, serta sumber pati (substrat).
Berdasarkan literatur, dapat diketahui bahwa asam yang paling umum digunakan adalah asam klorida (Solomon et al., 2006), asam posfat (El-Tayeb et al., 2012), dan asam sulfat (Srinorakutara et al., 2006; Zamora et al., 2010; dan Mishra et al., 2011), dengan konsentrasi yang berbeda. Hasil penelitian tentang pengaruh konsentrasi asam secara umum menunjukkan bahwa asam pekat menghasilkan gula reduksi dengan rendemen yang lebih tinggi (Mishra et al., 2011), namun limbahnya bersifat lebih korosif sehingga berbahaya jika dilepaskan ke lingkungan.
Beberapa penelitian menjelaskan tentang faktor-faktor yang mempengaruhi hidrolisis asam seperti yang telah dijelaskan di atas. Sebagai contoh, dalam penelitian sebelumnya (Solomon et al., 2006) dilaporkan bahwa kondisi optimum untuk hidrolisis asam berbahan baku bubur tepung singkong dengan kadar pati 15% adalah suhu 70oC, waktu hidrolisis 1 jam, dan konsentrasi HCl 0,1M. Dalam penelitian lain, Mishra et al. (2011), melakukan hidrolisis biji kapas untuk menghasilkan glukosa menggunakan asam sulfat dengan konsentrasi yang
diperkirakan 0,52 mg/g sampel. Setelah hidrolisis, ditemukan bahwa kadar glukosa meningkat tajam seiring dengan kenaikan konsentrasi asam yang digunakan. Dengan penggunaan asam sulfat 2%, kadar glukosa naik menjadi 17,68 mg/g sampel, menjadi 17,90 mg/g sampel dengan penggunaan asam sulfat 3%, dan menjadi 18,60 mg/g sampel dengan penggunaan asam sulfat 5% .
El-Tayeb et al. ( 2012) melakukan penelitian untuk membandingkan efektifitas tiga jenis asam, yakni asam klorida, asam posfat, dan asam sulfat, untuk hidrolisis limbah pengolahan gula bit (sugar beet) dengan kandungan gula total sebesar 0,83% w/w. Hidrolisis dilakukan dengan kondisi yang sama, yakni konsentrasi asam sebesar 1 dan 5% v/v, suhu 90 oC, dan waktu 90 menit. Hasil penelitian menunjukkan bahwa untuk ketiga jenis asam, konsentrasi asam 5% menghasilkan gula reduksi yang lebih tinggi, dan asam sulfat bekerja lebih baik. Dalam
penelitian yang sama dipelajari juga pengaruh waktu, dengan melakukan
percobaan menggunakan ketiga jenis asam dengan konsentrasi yang sama, yakni 1% v/v, dengan waktu yang berbeda, yakni 15; 30; 60; 90; dan 120 menit. Hasil percobaan menunjukkan bahwa waktu hidrolisis hingga 90 menit menghasilkan gula reduksi dengan kadar yang meningkat, namun turun kembali pada waktu hidrolisis 120 menit. Dari hasil tersebut dapat disimpulkan bahwa secara umum, asam sulfat bekerja lebih efektif dibandingkan dengan dua jenis asam lainnya.
-amilase, karena enzim α-amilase merupakan enzim yang bekerja dengan
memutuskan ikatan α-1,4-D-glikosidik pada molekul pati, baik amilosa maupun amilopektin (Purba, 2001). Enzim α-amilase dapat dihasilkan dari beberapa mikroorganisme, seperti Bacillus subtilis, Rhizopus oligosporus, Bacillus species, Bacillus licheniformis, dan Aspergillus oryzae (Bemiller and Whistler, 2009)
Dalam bidang bioetanol, metode enzimatik ini telah dipelajari oleh banyak
peneliti. Metode ini telah digunakan oleh Leaes et al. (2013) untuk menghasilkan gula reduksi dari onggok singkong menggunakan enzim α-amilase dan
amiloglukosidase. Hasil penelitian menunjukkan kedua jenis enzim bekerja cukup baik menghasilkan gula reduksi sekitar 21,3-83 g/L dengan enzim α -amilase dan sekitar 32.8-116,1 g/L dengan enzim amiloglukosidase.
Meskipun hidrolisis enzimatik bekerja cukup baik, namun metode ini memiliki beberapa kelemahan praktis, seperti biaya yang relatif mahal, pengerjaannya memerlukan kondisi yang aseptik, dan membutuhkan waktu yang lama. Karena kelemahan tersebut, hingga dewasa ini hidrolisis asam masih lebih umum digunakan dalam industri bioetanol, karena dalam penerapanya lebih cepat dan efisien, tidak memerlukan kondisi aseptik, dan biaya yang digunakan relatif lebih murah. Oleh karena itu dalam penelitian ini digunakan metode hidrolisis asam untuk menghasilkan gula reduksi.
Untuk mengoptimalkan produksi bioetanol dari pati, langkah lain yang sedang dikembangkan adalah praperlakuan agar pati dapat dihidrolisis lebih mudah. Dalam penerapan praperlakuan ini beberapa syarat perlu diperhatikan yakni mampu meningkatkan laju pembentukan gula, tidak mengakibatkan degradasi atau kehilangan karbohidrat, tidak menghasilkan produk samping yang dapat menghambat proses hidrolisis dan fermentasi, serta biaya yang dikeluarkan harus seminimal mungkin (Sun and Cheng, 2002).
Praperlakuan dengan perebusan umumnya dilakukan dengan merebus bahan baku pada suhu dan tekanan tinggi (Brandon et al., 2008). Keuntungan utama metode ini adalah tidak menghasilkan hasil samping berupa inhibitor yang dapat
menghambat fermentasi gula (Perez et al., 2007), dan mampu meningkatkan kemudahan hidrolisis hingga mencapai konversi pati menjadi gula reduksi sampai 96 % (Perez et al., 2007).
Pengecilan ukuran secara mekanik dapat dilakukan dengan pencacahan, penumbukan, dan penggilingan yang bertujuan untuk merusak kristalinitas, menurunkan derajat polimerisasi, dan meningkatkan luas permukaan spesifik dari molekul pati sehingga dapat terhidrolisis lebih mudah. Metode ini telah
diterapkan oleh Zhang et al. (2007) terhadap hardwood dengan praperlakuan penggilingan menyebabkan rata-rata ukuran partikel menjadi 21 m dan meningkatkan luas permukaan spesifik menjadi 0,8 m2/g setelah 40 kali penggilingan. Penggilingan mekanik juga menyebabkan putusnya ikatan hidrogen, pengurangan kristalinitas, dan indeks kristalinitas bubuk selulosa menurun dari 65 menjadi 22.
Praperlakuan dengan radiasi berenergi tinggi juga telah dikembangkan dengan memanfaatkan beberapa jenis radiasi, antara lain sinar- γ (Yang et al., 2008), ultrasonikasi (Nityavardhana et al., 2008 dan Mojović et al., 2009), radiasi berkas elektron (Bak et al., 2009), dan gelombang mikro (Ma et al., 2009). Praperlakuan sebelum hidrolisis dengan radiasi berenergi tinggi dapat merubah struktur
polisakarida termasuk peningkatan luas permukaan, penurunan derajat
atas, praperlakuan dengan metode ultrasonikasi merupakan metode yang paling potensil, karena metode ini telah banyak diterapkan untuk berbagai tujuan. Sebagai gambaran Mojović et al. (2009) mempelajari efek praperlakuan ultasonikasi pati dengan frekuensi 40 kH selama 2,5 menit, kemudian sampel diberi perlakuan termal yang berbeda, yakni pada suhu 30; 50, dan 60 oC dalam water-batch selama 1 jam dan didinginkan sampai suhu 20 oC untuk kemudian dianalisis kadar total gula fermentasi dan gula tunggal seperti glukosa, maltosa, dan maltotriosa. Hasil analisis menunjukkan bahwa kadar total gula fermentasi dan gula tunggal meningkat seiring dengan meningkatnya suhu perlakuan termal. Pada suhu 60 oC yang merupakan suhu maksimum perlakuan termal, kadar total gula fermentasi diperoleh sebesar 52,70% per berat kering dan untuk tunggal, diperoleh glukosa sebesar 2,65%, maltosa 35,72%, dan 2,89% untuk maltrotriosa.
Berbeda dengan praperalakuan fisik, praperlakuan kimia diterapkan dengan menggunakan bahan kimia yang mampu mengubah karakteristik molekul pati hingga lebih mudah diuraikan pada saat hidrolisis. Praperlakuan kimia dapat digunakan karena dapat menurunkan derajat polimerisasi dan kristalinitas
komponen pollisakarida. Dua contoh praperlakuan kimia yang banyak digunakan adalah pelarutan dalam senyawa organik (organosolv) dan perebusan dalam suasana asam.
alkohol tetrahidrofurfuril, gliserol, larutan fenol, dan n-butanol (Taherzadeh and Karimi, 2008). Dari senyawa organik di atas, alkohol seperti etanol dan metanol merupakan pelarut yang paling banyak digunakan karena harga yang relatif murah (Sidiras and Koukios, 2004). Karena pelarut organik umumnya bersifat volatil, penerapan metode ini memerlukan peralatan bertekanan tinggi, sehingga memerlukan teknologi tinggi.
Praperlakuan perebusan dalam suasana asam berbeda dengan praperlakuan perebusan dalam air mendidih, dalam praperlakuan ini dilakukan penambahan bahan kimia sebagai katalis yang memiliki fungsi untuk mempertahankan nilai pH agar konstan di atas 5 dan di bawah 7, sehingga tidak menyebabkan unjuk kerja hidrolisis berkurang untuk menghasilkan monosakarida (Weil et al., 1998). Sebagai gambaran Mosier et al. (2005) mempelajari praperlakuan ini berbasis serat jagung pada suhu 160 oC dan pH di atas 4,0. Hasil yang diperoleh
menunjukkan bahwa dengan praperlakuan pada kondisi tersebut dapat melarutkan serat jagung sekitar 50% selama 20 menit, sehingga praperlakuan ini dapat
memudahkan hidrolisis enzimatik untuk mengurai polisakarida menjadi monosakarida.
Dalam penelitian ini upaya peningkatan produksi gula reduksi dari onggok akan dilakukan dengan praperlakuan fisik meliputi penggilingan dan ultrasonikasi Berdasarkan frekuensinya, gelombang ultrasonik dibagi menjadi tiga yaitu
ultrasonik frekuensi rendah (16–100 kHz), ultrasonik frekuensi tinggi (100 kHz–1 MHz), dan ultrasonik diagnostik (1–10 MHz) (Patist and Bates, 2008).
ini, gelombang ultrasonik yang digunkan masuk dalam jenis gelombang ultrasonik frekuensi rendah, yakni 40 kHz.
Penggilingan onggok dimaksudkan merusak kristalinitas pati, menurunkan derajat polimerisasi dan meningkatkan luas permukaan molekul akibat pemecahan
menjadi partikel yang lebih kecil. Praperlakuan dengan ultrasonikasi dimaksudkan untuk menimbulkan kavitasi (rongga) pada molekul pati, sehingga lebih mudah diakses oleh asam pada saat dihidrolisis (Nityavardhana et al., 2008; Nikolic´ et al., 2010).
E. Analisis Gula Reduksi
Gula reduksi hasil hidrolisis asam dapat dianalisis secara kualitatif untuk
mengidentifikasi apakah sampel mengandung gula reduksi atau tidak dan secara kuantitatif untuk menentukan kadar gula reduksi yang terbentuk. Untuk maksud tersebut, analisis gula reduksi secara kualitatif dapat dilakukan dengan uji Benedict, uji Fehling, uji Barfoed, uji Tollens, dan uji Molisch (Mathews et al., 2000), sedangkan analisis gula reduksi secara kuantitatif dapat dilakukan dengan beberapa metode seperti metode Luff Schoorl (Kowalski et al., 2013), Nelson-Somogyi (Woiciechowski et al., 2002), dan DNS (Lone et al., 2012).
Fehling B membentuk enediol, kemudian enediol bereaksi dengan Fehling A membentuk ion Cu2+ dan campuran asam-asam. Selanjutnya ion Cu2+ dalam suasana basa akan mengendap menjadi endapan Cu2O berwarna hijau, kuning-orange, atau merah bata tergantung jenis gula reduksi yang diuji
(Mathews et al., 2000). Adapun mekanisme reaksi antara gula reduksi dan reagen Fehling dapat dilihat dalam persamaan reaksi sebagai berikut.
Metode Luff-Schoorl merupakan metode analisis gula reduksi sebelum dan sesudah inversi. Prinsip metode ini adalah pengurangan ion tembaga (II) oleh gugus karbonil yang terdapat pada gula reduksi. Berkurangnya jumlah tembaga dihitung berdasarkan perbedaan volume tiosulfat yang digunakan sebelum dan sesudah uji (Kowalski et al., 2013).
Srinorakutara et al. (2006) mengukur kadar glukosa hasil hidrolisis onggok secara kuantitatif menggunakan metode Nelson Somogyi. Setelah sampel dicampur dengan reagen uji, absorbansi diukur pada 520 nm terhadap larutan blanko yang tepat dengan menggunakan spektrofotometer UVModel Uvikon-xs. Jumlah gula pereduksi ditentukan dengan kurva kalibrasi yang diperoleh dengan menggunakan D-glukosa sebagai standar.
dan ditambahkan 0,5 mL akuades. Kemudian tabung reaksi diinkubasi pada suhu kamar selama 5 menit, ditambahkan reagen DNS, dihomogenkan dan tabung reaksi dimasukkan dalam water-batch pada suhu 70 °C selama 10 menit. Tabung reaksi didinginkan dalam air dingin dan ditambahkan 40% Na-K tartrat untuk menjaga warna. Untuk blanko disiapkan 1 mL akuades dalam tabung reaksi. Larutan standar disiapkan dengan membuat larutan glukosa konsentrasi 0,2; 0,4; 0,6; 0,8 dan 1 gram per mL. kemudian masing-masing larutan standar glukosa dipreparasi seperti preparasi sampel di atas. Warna merah terang pada sampel setelah preparasi diukur pada panjang gelombang 540 nm. Hasil absorbansi yang diperoleh dibandingkan dengan kurva standar untuk mengetahui konsentrasi gula reduksi dalam sampel. Dengan cara ini kadar gula reduksi sebelum dan sesudah hidrolisis dapat diketahui.
Melihat unjuk kerja beberapa metode analisis kuantitatif gula reduksi di atas, metode analisis dengan reagen DNS terlihat lebih spesifik untuk mengetahui seberapa besar kadar gula reduksi yang terdapat dalam sampel. Selain itu metode analisis kadar gula reduksi menggunakan reagen DNS merupakan metode yang paling banyak digunakan untuk menentukan kadar gula reduksi.
dalam sampel, maka akan semakin banyak pula molekul asam 3-amino-5- nitrosalisilat yang terbentuk, sehingga absorbansi sampel akan semakin tinggi.
Reaksi gula reduksi dengan reagen DNS merupakan reaksi redoks dimana gugus aldehid gula yang bertindak sebagai pereduksi akan teroksidasi menjadi gugus karboksil, sedangkan DNS yang bertindak sebagai oksidator akan tereduksi membentuk asam 3-amino dan 5- nitrosalisilat. Bila terdapat gula reduksi pada sampel, maka larutan DNS yang awalnya berwarna kuning bereaksi dengan gula reduksi dalam suhu tertentu menimbulkan warna jingga kemerahan.
Reaksi ini biasanya berlangsung dalam suasana basa dan suhu tinggi sekitar 90-100 °C (Kusmiati dan Agustini, 2010). Adapun reaksi yang terjadi dapat dilihat dalam persamaan reaksi sebagai berikut.
Setelah sampel dipreparasi menggunakan DNS, warna yang timbul ditentukan serapannya menggunakan spektrofotometer UV-Vis. Spektrofotometer UV-Vis merupakan alat untuk mengukur absorbansi dan transmitansi suatu sampel pada panjang gelombang tertentu.
Spektrofotometer ini menggunakan dua buah sumber cahaya, yakni lampu
Hidrogen atau Deuterium sebagai sumber cahaya UV dan lampu Tungsten sebagai sumber cahaya tampak. Larutan sampel yang telah dipreparasi diukur
spektrofotometer UV-vis. Konsentrasi larutan sampel yang dianalisis akan sebanding dengan jumlah sinar yang diserap oleh zat yang terdapat dalam sampel.
Prinsip kerja spektrofotometer UV-Vis ini didasarkan pada Hukum Lambert-Beer yang menyatakan hubungan antara absorbansi cahaya dengan konsentrasi zat dalam larutan dengan persamaan berikut.
A = - log T = log = ε . b . c Dimana:
A = absorbansi T = transmitansi
I0 = intensitas cahaya masuk
It = intensitas cahaya yang diteruskan oleh larutan sampel ε = absorbtivitas molar (L mol-1cm-1)
b = ketebalan lapisan larutan sampel (panjang jalur absorbsi) (cm) c = konsentrasi sampel (mol L-1)
Kadar gula reduksi pada sampel dapat ditentukan dengan membuat kurva standar larutan glukosa. Kurva standar dipreparasi dengan reagen DNS seperti preparasi sampel di atas, kemudian absorbansinya diukur pada panjang gelombang
F. Fermentasi Alkohol
Fermentasi alkohol merupakan konversi gula reduksi menjadi alkohol oleh mikroorganisme seperti enzim, bakteri, atau jamur. Menurut Gervais (2008) proses fermentasi terjadi melalui serangkaian reaksi biokimiawi yang mengubah bahan kering menjadi energi (panas), molekul air (H2O) dan CO2. Perubahan dapat terjadi karena pertumbuhan mikroorganisme (bakteri asam laktat), proses dekomposisi substrat dan perubahan kadar air. Perubahan kadar air terjadi akibat evaporasi, hidrolisis substrat atau produksi air metabolik. Etanol merupakan salah satu jenis alkohol yang dihasilkan dari proses fermentasi. Etanol biasanya
terdapat dalam minuman beralkohol. Dalam kehidupan sehari-hari etanol dapat digunakan sebagai bahan bakar yang diperoleh dengan cara fermentasi oleh ragi. Etanol dan gas CO2 merupakan hasil dari fermentasi gula reduksi secara anaerob. Adapun reaksi yang terjadi adalah sebagai berikut.
Mikroba yang umum digunakan dalam fermentasi adalah bakteri, ragi dan kapang. Beberapa contoh proses fermentasi diantaranya adalah pembuatan tempe, tape, susu fermentasi dan sebagainya. Salah satu mikroba yang terlibat pada fermentasi alkohol adalah Saccharomyces cerevisiae. Fermentasi dapat dilakukan dengan menggunakan kultur murni ataupun alami serta dengan kultur tunggal ataupun campuran. Fermentasi dengan menggunakan kultur alami umumnya dilakukan pada proses fermentasi tradisional yang memanfaatkan mikroba yang ada di lingkungan.
Ada beberapa faktor yang dapat mengoptimalkan unjuk kerja proses fermentasi (Subekti, 2006). Adapun faktor- faktor tersebut adalah suhu, pH, oksigen, substrat. Suhu pertumbuhan mikroorganisme yang digunakan dalam proses fermentasi dipengaruhi oleh suhu pada saaat proses fermentasi berlangsung. Secara umum suhu optimal untuk proses fermentasi adalah 30-40 °C. Mikroorganisme dapat tumbuh pada kisaran pH tertentu yang sesuai
untuk pertumbuhannya. Seperti, Saccharomyces cerevisiae memerlukan pH 4-5, agar dapat tumbuh dengan baik. Oksigen merupakan faktor utama dalam
pengendalian fermentasi. Dalam proses fermentasi, oksigen yang digunakan harus dalam tekanan yang serendah mungkin, karena jika tekanan oksigen yang diberikan lebih besar, maka pertumbuhan mikroorganisme semakin meningkat sedangkan produksi etanol menurun. Dalam pertumbuhannya, mikroorganisme membutuhkan asupan makanan, makanan yang dibutuhkan mikroorganisme harus mengandung nutrisi dalam porsi yang sesuai untuk pertumbuhannya.
Berdasarkan beberapa faktor yang mempengaruhi proses fermentasi di atas, ada beberapa jenis mikroorganisme yang umum digunakan dalam fermentasi, antara lain Zymomonas mobilis (Zhang and Feng, 2010), Aspergillus niger (Manikandan and Viruthagiri, 2009), dan Saccharomyces cerevisiae (Oyeleke et al., 2012). Saccharomyces cerevisiae merupakan jenis mikroorganisme yang paling banyak
Saccharomyces cerevisiae merupakan khamir yang termasuk dalam filum
Ascomycota. Khamir tersebut dalam bidang bioteknologi konvensional telah
digunakan untuk memproduksi beberapa pangan tradisional seperti bir, anggur, wiski, sake, pengembangan roti, tape, dan sebagainya. Dalam bidang
bioteknologi modern khamir tersebut telah digunakan sebagai jasad inang
eukariotik untuk memproduksi protein-protein heterolog seperti vaksin hepatitis B yang telah ada di pasaran, hemoglobin, serum albumin dan glisin betain
(Rachmawati, 2004).
Khoridha (2006), berhasil mengkonversi ampas singkong menjadi etanol dengan kadar alkohol terendah 11,70% pada waktu fermentasi 9 hari dan dosis ragi 2g. Sedangkan kadar alkohol tertinggi 41,67% pada waktu fermentasi 15 hari dan dosis ragi 8 g. Dalam penelitian Tatik (2008), hasil fermentasi tepung singkong menjadi etanol diperoleh kadar alkohol tertinggi 30,60 % pada waktu fermentasi 7 hari dengan dosis ragi 100 g, sedangkan kadar alkohol terendah adalah 13,13 % pada waktu fermentasi 7 hari dengan dosis ragi 50 g. Hal ini menunjukkan semakin lama waktu fermentasi dan banyaknya dosis ragi yang diberikan maka semakin banyak kadar alkohol yang didapatkan.
potensi untuk dimanfaakan dalam fermentasi gula reduksi menjadi bioetanol. Indikasi inilah yang menjadi dasar penelitian ini sebagai kajian potensi kulit kayu raru menjadi alernatif mikroorganisme yang umum digunakan dalam industri bioetanol.
Dalam penelitian Pasaribu dan Setyawati (2011) disebutkan bahwa ada empat jenis raru yang terdapat di Sumatera Utara dan Riau, antara lain Cotylelobium melanoxylon Pierre, Shorea balanocarpoides Symington, Cotylelobium
lanceolatum Craib, dan Vatica perakensis King. Dalam penelitian tersebut jenis
raru Cotylelobium melanoxylon Pierre merupakan salah satu jenis kayu raru yang berasal dari Kabupaten Tapanuli Tengah. Kayu raru jenis ini memiliki komponen kimia kayu antara lain hemiselulosa 29,26%, alphaselulosa 37,35%, lignin
22,26%, dan pentosan 17,31%. Dalam penelitian yang sama, ditemukan kadar ekstraktif kayu raru yang dapat larut dalam air dingin 3,19%, air panas 9,08%, alkohol benzene 1,76%, dan NaOH 1-19,27%. Berdasarkan beberapa jenis kayu raru yang telah disebutkan di atas, maka dalam penelitan ini akan digunakan kulit kayu raru spesies Cotylelobium melanoxylon Pierre, yang didapatkan dari daerah tapanuli Tengah.
G. Analisis Bioetanol dengan Kromatogafi Gas
Analisis bioetanol dengan kromatogafi gas didasarkan pada prinsip kerja kromatogafi, yang mampu memisahkan komponen campuran sehingga dapat dideteksi secara individu. Secara garis besar, komponen kromatografi adalah gas pembawa, kolom, injektor, detektor, amplifier, dan recorder. Gas pembawa merupakan fase gerak yang dapat berupa berupa nitrogen, hidrogen, helium, argon. Gas pembawa berfungsi untuk membawa sampel yang akan dianalisis melalui kolom menuju detektor. Syarat yang harus dimiliki gas pembawa antara lain inert, murni, sesuai dengan detektor yang digunakan, murah dan, mudah didapat.
Kolom berfungsi sebagai jalur analit menuju detektor dan sekaligus tempat pemisahan komponen sampel hingga mencapai detektor pada waktu yang berbeda (waktu retensi). Kolom dapat terbuat dari logam tahan karat, gelas atau teflon, kolom yang baik untuk digunakan harus memiliki sifat daya pisah yang tinggi, efisien, analisis cepat, kepekaan tinggi, tidak mengotori detektor, tahan lama, inert, menjamin ketelitian yang tinggi. Di dalam kolom terdapat fase diam, yang berupa zat padat atau cair yang berperan memisahkan sampel menjadi
komponennya berdasarkan perbedaan interaksi komponen sample dengan fasa diam.
Injektor merupakan tempat untuk memasukan sampel ke dalam kolom
berfungsi untuk memperbesar respon yang berasal dari detektor. Recorder berfungsi untuk merekam hasil yang diberikan oleh ampliflier dan menampilkan hasilnya dalam bentuk kromatogram. Adapun gambar skematik alat kromatografi gas dapat dilihat pada Gambar 2 sebagai berikut.
Gambar. 2. Skema alat kromatografi gas
Dalam praktiknya, analisis sampel dengan kromatogafi gas memerlukan kondisi tertentu sesuai dengan sampel yang akan dianalisis, antara lain kolom, detektor, suhu, laju, dan fasa gerak. Solikhah (2010), mempelajari kromatogafi gas untuk analisis kadar etanol pada nira siwalan menggunakan kromatogafi gas dengan gas pembawa Helium (He), karena gas ini bersifat inert, murni, tidak mudah terbakar dan mempunyai konduktifitas panas yang tinggi, kolom MS (molecular sieve) 5A, dan detektor thermal conductivity detector (TCD).
Dalam penelitian lain, Bulan (2004) mempelajari tentang perbandingan metode kromatogafi gas dan berat jenis pada penetapan kadar etanol dalam minuman
injektor
pengontrol gas
detektor recorder
kolom kromatogram
III. METODELOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Mei sampai Agustus 2013 di Laboratorium Kimia Fisik, Laboratorium Biomassa, Laboratorium Biokimia, dan Laboratorium Instrumentasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung, Laboratorium Afiliasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
B. Alat dan Bahan
Alat-alat yang digunakan yaitu ultrasonikator Bandelin Sonorex Technic,
spektrofotometer UV-Vis Varian Cary 100, autoklaf Kleinfeld–Germany HV-L25, laminar air flow ESCO AVC4A1, kromatogafi gas GC-2010 AF Shimadzu,
blender Philips, hotplate-stirrer Stuart CB-162, water batch Precisterm, neraca
analitik Wiggen Houser, mikropipet Eppendorf, indikator pH universal/ pH-meter, dan alat-alat gelas yang umum digunakan di laboratorium. Bahan-bahan yang digunakan adalah onggok, akuades, H2SO4 pekat, glukosa, Fehling A dan Fehilng B, dinitrosalisilat (DNS), NaOH, Na-K-tartarat, Na2SO3, fenol, Saccharomyces cerevisiae dalam ragi roti fermipan, serbuk kulit kayu raru, nira, buffer fosfat pH
C. Prosedur Kerja
1. Preparasi Onggok
Persiapan onggok dilakukan dalam dua tahap, yaitu pengeringan dan penghalusan onggok. Pengeringan onggok dilakukan di bawah sinar matahari selama tiga hari. Onggok yang telah kering dihaluskan menggunakan blender dan disimpan di dalam wadah kedap udara agar tidak ditumbuhi mikroorganisme yang dapat merusak onggok.
2. Ultrasonikasi Onggok
Onggok halus ditimbang sebanyak 100 gram dimasukkan ke dalam 5 buah gelas piala 1L masing- masing sebanyak 20 gram. Ditambahkan akuades sampai tanda batas 500 mL. Kemudian larutan onggok diultrasonikasi pada suhu 30oC dan frekuensi 40 kHz, dengan waktu yang berbeda, yakni 1,2, 3, 4, 5, 6, dan 7 jam. Setelah perlakuan, sebanyak 10 mL filtrat diambil ke dalam botol sampel untuk analisis gula reduksi, dan sisa sampel digunakan untuk percobaan hidrolisis.
3. Hidrolisis Onggok
4. Analisis Kadar Gula Reduksi
Dalam penelitian ini, gula reduksi dianalisis secara kualitatif dan kuantitatif. 4.1. Analisis kualitatif
Analisis kualitatif dilakukan dengan metode Fehling. Untuk tujuan ini ke dalam sebuah tabung reaksi dimasukkan larutan Fehling A dan Fehling B masing- masing sebanyak 1 mL. Ke dalam tabung kemudian ditambahkan 1 mL sampel dan dipanaskan dalam penangas air mendidih selama 2-3 menit. Sebagai kontrol negatif digunakan akuades dan kontrol positif digunakan larutan glukosa 10 %. Adanya gula reduksi ditunjukkan dengan terbentuknya endapan Cu2O berwarna merah bata.
4.2. Analisis kuantitatif 4.2.1. Pembuatan reagen DNS
Sebanyak 1 gram asam 3,5-dinitrosalisilat dilarutkan dalam 20 mL akuades, dimasukkan dalam labu ukur 100 mL, lalu dihomogenkan. Ke dalam labu ukur ditambahkan 1 gram NaOH; 0,2 gram fenol; 0,05 gram Na2SO3, dan 1 mL NaK tartarat 40%. Kemudian ditambahkan akuades sampai batas miniskus dan dihomogenkan.
4.2.2. Pembuatan kurva standar
Pembuatan kurva standar dilakukan menggunakan larutan glukosa dengan
konsentrasi 0; 2; 4; 6; dan 8 mg/mL dari larutan stok 10 mg/mL. Absorbansi dari masing- masing larutan standar diukur pada panjang gelombang 550 nm.
mendapatkan kurva standar dan persamaan garis yang menunjukkan hubungan antara absorbansi dengan konsentrasi glukosa.
4.2.3. Penentuan gula reduksi dalam sampel
Untuk menentukan kadar gula reduksi dalam sampel, sebanyak 0,25 mL sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 0,25 mL akuades dan 1 mL reagen DNS. Tabung reaksi ditutup dengan alumunium foil dan dipanaskan dalam water-batch selama 10 menit pada suhu 100 oC. Sampel kemudian
didinginkan hingga suhu kamar. Sampel lalu dianalisis dengan spektrofotometer UV-vis untuk mendapatkan absorbansi pada panjang gelombang 550 nm. Kadar gula reduksi dalam sampel dihitung menggunakan persamaan garis yang
didapatkan dari kurva standar, yaitu y = a + bx, dimana y adalah absorbansi sampel (nm), x konsentrasi sampel (mg/mL), a merupakan intersep, dan b adalah slop.
5. Fermentasi Hidrolisat Onggok
5.1. Fermentasi dengan serbuk kulit kayu raru
Semua bahan dan alat yang digunakan disterilisasi menggunakan autoklaf pada suhu 121 oC dan tekanan 1 atm selama 15 menit kecuali serbuk kulit kayu raru, kemudian didinginkan di dalam laminar air flow hingga suhu ruang. Untuk percobaan fermentasi, sebanyak 100 mL hidrolisat dimasukkan ke dalam
erlenmeyer 250 mL, lalu ditambahkan nira 5 mL. pH campuran kemudian diatur menjadi 5 dengan menambahkan larutan NaOH 0,1 M, lalu setelah pH tercapai ke dalam sampel ditambahkan buffer fosfat pH 5 sebanyak 5 mL. Ke dalam
erlenmeyer lalu ditutup dengan disumbat kapas lalu erlenmeyer dbungkus dengan alumunium foil supaya sistem menjadi anaerob, lalu dibiarkan pada suhu ruang
selama 72 jam. Selanjutnya kadar bioetanol ditentukan dengan kromatogafi gas.
5.2. Fermentasi dengan Saccharomyces cerevisiae
Percobaan dengan Saccharomyces cerevisiae dilakukan dengan cara yang sama seperti fermentasi hidrolisat onggok dengan serbuk kulit kayu raru kecuali dalam percobaan ini sebanyak 0,1 gram Saccharomyces cerevisiae dilarutkan ke dalam 10 mL larutan NaCl 0,85 %, lalu campuran diinkubasi terlebih dahulu selama 1 jam.
6. Analisis Kadar Bioetanol dengan Kromatografi Gas
Analisis kadar bioetanol dilakukan dengan metode kromatografi gas yang ada di Laboratorium Afiliasi Fakultas Matematika dan Ilmu Pengetahuan Alam
[image:41.595.115.441.539.757.2]Universitas Indonesia, menggunakan kromatografi gas GC-2010 AF Shimadzu dengan rincian kondisi analisis seperti dalam Tabel 1.
Tabel 1. Parameter instrumen dan kondisi analisis kromatografi gas.
Kromatografi Gas
tipe GC-2010 AF Shimadzu
Injektor Kromatografi Gas Tipe injeksi
Suhu injeksi Gas pembawa
Tekanan gas pembawa Laju alir total
Laju alir di dalam kolom Split ratio
Split 200 oC Nitrogen (N2) 200 kPa 67,9 mL/menit 0,91 mL/menit 70
Diameter dalam Tebal film
Temperatur maksimum Total waktu penahanan
0,10 µm 320 oC 10 menit Detektor kromatografi gas
Tipe Suhu
Laju sampling
Flame Ionization Detector 220 oC
40 mdetik
Sebelum dilakukan analisis kadar bioetanol, terlebih dahulu dibuat larutan standar menggunakan etanol dengan konsentrasi sebesar 0,001; 0,003; 0,005; 0,008; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; dan 0,8 %. Larutan standar tersebut diinjeksikan sebanyak 1 µL pada kolom kromatografi gas. Selanjutnya luas puncak etanol yang
dihasilkan pada kromatogram dicatat lalu dibuat kurva standar etanol. Persamaan yang diperoleh dari kurva standar digunakan untuk menghitung kadar bioetanol yang dihasilkan dari proses fermentasi.
Bioetanol hasil fermentasi dianalisis dengan cara yang sama seperti kurva standar. Untuk mengetahui kadar bioetanol, luas puncak etanol yang dicatat sebagai kromatogram disubstitusi ke dalam persamaan yang dihasilkan dari kurva standar bioetanol, yang secara umum dinyatakan dengan persamaan:
y = ax + b
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Adapun kesimpulan yang diperoleh setelah dilakukannya penelitian adalah sebagai berikut:
1. Metode ultrasonikasi mampu meningkatkan kemudahan onggok untuk dihidrolisis, yang ditunjukkan dengan peningkatan kadar gula reduksi hingga 64 kali kadar gula reduksi yang diperoleh dari hidrolisis sampel tanpa
perlakuan ultrasonikasi.
2. Waktu ultrasonikasi optimum yang diperoleh adalah 3 jam dan waktu hidrolisis optimum yang adalah 2 jam dengan kadar gula reduksi yang dihasilkan sebesar 4,6152 mg/mL.
3. Gula reduksi hasil hidrolisis onggok dapat difermentasi menjadi bioetanol menggunakan Saccharomyces cerevisiae dan serbuk kulit kayu raru. 4. Uji fermentasi terhadap filtrat menghasilkan bioetanol dengan kadar etanol
sebesar 0,12% menggunakan Saccharomyces cerevisiae dan 0,03% menggunakan serbuk kulit kayu raru.
B. Saran
Untuk penelitian lebih lanjut disarankan untuk dilakukan hal- hal sebagai berikut:
1. Praperlakuan ultrasonikasi yang dilakukan pada penelitian ini menggunakan alat ultrasonikasi dengan frekuensi yang terbatas. Pada penelitian lebih lanjut disarankan menggunakan frekuensi yang berbeda untuk mempelajari
pengaruh frekuensi.
DAFTAR PUSTAKA
Anozie, A. N. and A. F. Aderibigbe. 2011. Optimization Studies of Cassava Starch Hydrolysis using Response Surface Method. New Clues in Sciences, 1: 37-43.
Antony, S. Raja., D. S. Robinson Smart., and C. Lindon Robert Lee. 2011.
Biodiesel Production from Jatropha Oil and its Characterization. Research Journal of Chemical Sciences, 1(1): 81-87.
Badan Pusat Statistika (BPS) Provinsi Lampung. 2012. Lampung Dalam Angka 2011. http://www.lampung.bps.go.id, diakses pada 7 Desember 2012. Bak, J. S., Ko. J. K., Han Y. H. 2009. Improved Enzymatic Hydrolysis Yield of
Rice Straw Using Electron Beam Irradiation Pretreatment. Bioresource Technology, 100: 1285-1290.
Bemiller, J. N. and Whistler R. 2009. Starch: Chemistry and Technology. New York: Academic Press Incorporated.
Baskar ,G., C. Muthukumaran., and S. Renganathan. 2008. Optimization of Enzymatic Hydrolysis of Manihot Esculenta Root Starch by Immobilized α-Amylase Using Response Surface Methodology. International Journal of Chemical and Biological Engineering, 1: 155-159.
Brandon, S. K., Eiteman M. A., Patel K. 2008. Hydrolysis of Tifton 85 bermudagrass in a pressurizea batch hot water reactor. Journal of the Chemical Technology and Biotechnology, 83: 505-512.
Bulan, R. 2004. Esterifikasi Patchouli Alkohol Hasil Isolasi Dari Minyak Daun Nilam (Patchouli Oil). http://www.library.usu.ac.id/modules.php.pdf diakses pada 6 April 2013.
De, Bari I., Nanna F., and G. Braccio. 2007. SO2-catalyzed Steam Fractionation of Aspen Chips for Bioethahnol Production: Optimization of The Catalyst Impregnation. Indian Engineering Chemical Resource, 46: 7711-7720. El-Tayeb, T. S., A. A. Abdelhafez., Al H. S., and E. M. Ramadan. 2012. Effect of
Acid Hydrolysis and Fungal Biotreatment on Agro-Industrial Wastes for Obtainment of Free Sugars for Bioethanol Production. Brazilian Journal Microbiology, 43(4): 1523-1535.
Fadel, M. 2000. Alcohol Production from Potato Industry Starchy Waste. Egyptian Journal Microbiology, 35: 273-287.
Garcia, Aparicio M. P., Ballesteros I., Gonzalez A., Jose Miguel O., Mercedes Ballesteros., and M. Jose Negro. 2006. Effect of Inhibitors Released During Steam-Explosion Pretreatment of Barley Straw on Enzymatic Hydrolysis. Applied Biochemistry and Biotechnology, 129(132): 278-288. Gervais, P. 2008. Water Relations in Solid State Fermentation. In: A. Pandey, C.
R. Soccol, & C. Larroche (Eds). Current Developments in Solid-state Fermentation. Asiatechnology Publisher Incorporated.
Gervásio, P. da Silva., Elza F. de Araújo., Daison O. Silva., and Walter V.
Guimarães. 2005. Ethanolic Fermentation of Sucrose, Sugarcane Juice and Molasses by Escherichia Coli Strain Ko11 and Klebsiella Oxytoca Strain P2. Brazilian Journal of Microbiology, 36: 395-404.
Khoridha, Ludfi Anindita. 2006. Pengaruh Waktu Fermentasi dan Dosis Ragi Terhadap Kadar Alkohol pada Ampas Umbi Ketela Pohon (Manihot utilissima Pohl). Skripsi. Jurusan Pendidikan Biologi Fakultas Keguruan Dan Ilmu Pendidikan. Surakarta: Universitas Muhammadiyah Surakarta. Kusmiati dan Agustini N. W. S. 2010. Pemanfaatan Limbah Onggok untuk
Produksi Asam Sitrat Dengan Penambahan Mineral Fe Dan Mg Pada Substrat Menggunakan Kapang Trichoderma Sp DAN Aspergillus Niger. Seminar Nasional Biologi, 856-466.
Leaes, Eloisa X., Eduardo Zimmermann., Matheus Souza., Adriana P. Ramon., Ethiane T. Mezadri., Valéria Dal Prá., Lisiane M. Terra., and Marcio A. Mazutti. 2013. Ultrasound-Assisted Enzymatic Hydrolysis of Cassava Waste to Obtain Fermentable Sugars. Biosystems Engineering, 115(1): 1-6. Leplus, A. 2003. Biofuel Energy from Coconut in the Pacific Islands. Thesis.
Netherlands: Wageningen University.
Lone M. A., Wani M. R., Bhat N. A., Sheikh S. A., and Reshi M. A. 2012. Evaluation of Cellulase Enzyme Secreted by Some Common and Stirring Rhizosphere Fungi of Juglans Regia L. by DNS Method. Journal of Enzyme Research, 3(1): 18-22.
Ma, H., Liu W. W., and Chen X. 2009. Enhanced Enzymatic Saccharification of Rice Straw by Microwave Pretreatment. Bioresource Technology, 100: 1279-1284.
Manikandan K. and Viruthagiri T. 2009. Simultaneous Saccharification and Fermentation of Wheat Bran Flour into Ethanol using Coculture of Amylolytic Aspergillus Niger and Thermotolerant Kluyveromyces Marxianus. Front. Chemical Engineering China, 3: 240–249.
Manrique, I. and Roca W. 2007. Potential of Sweetpotato (Ipomoea batatas) Biodiversity as a Functional Food in tthe Tropics. Workshop “Functional Foods and Medicinal Products Developments from Amazonian Crops”. Eulaff-Embrapa Workshop. Rio de Janeiro: Brazil.
Mathews, van Holde and Ahern. 2000. Biochemistry, 3rd edition. Benjamin/Cummings: San Fransisco, 278-310.
Mishra, Mohit S., Chandrashekhar B., Tanushree Chatterje., and Kanwal Singh. 2011. Production Of Bio-Ethanol From Jatropha Oilseed Cakes Via Dilute Acid Hydrolysis And Fermentation By Saccharomyces Cerevisiae.
International Journal of Biotechnology Applied, 3(1): 41-47.
Mojović, Ljiljana., Dušanka Pejin., Olgica Grujić., Siniša Markov., Jelena Pejin.,
Marica Rakin., Maja Vukašinović., Svetlana Nikolić., and Dragiša Savić. 2009. Progress In The Production Of Bioethanol On Starch-Based
Feedstocks. Chemical Industry & Chemical Engineering Quarterly, 15(4): 211-226.
Mosier, N. S., Hendrickson R., Brewer M., Nancy Ho., Sedlak Miroslav., Dreshel Richard., Welch Gary., Dien S. Bruce., Aden Andy., and Ladisch R. Michael. 2005a. Industrial scale-up of pH-controlled liquid hot water pretreatment of corn fiber for fuel ethanol production. Applied Biochemistry and Biotechnology, 125: 77-97.
Najafpour G., Younesi H., and Ku Syahidah. 2004. Ethanol Fermentation in An Immobilized Cell Reactor using Saccharomyces cerevisiae. Bioresource Technology, 92: 251-260.
Nicolić, Svetlana., Mojovic Ljiljana., Rakin Marica., Pejin Dušanka., and Pejin
Nitayavardhana, S., Rakshit S. K., Grewell D., Pometto III. A. L., van Leeuwen J., and Khanal. 2008. Ultrasound Pretreatment of Cassava Chip Slurry to Enhance Sugar Release for Subsequent Ethanol Production. Biotechnol Bioengineering, 101: 487-496.
Oyeleke, S. B., Dauda B. E. N., Oyewole O. A., Okoliegbe I. N., and Ojebode T. 2012. Production of Bioethanol From Cassava and Sweet Potato Peels. Advances in Environmental Biology, 6(1): 241-245.
Pan, X., Xie D., and Kang K. Y. 2007. Effect of Organosolv Ethanol Pretreatment Variables on Physical Characteristics of Hybrid Poplar Substrates. Applied Biochemistry and Biotechnology, 136(140): 367-377.
Pandey, A., Carlos R. Soccol, Poonam N., Vanete T., Soccol Luciana P. S. V., and Radjiskumar M. 2000. Biotechological Potential of Agro-Industrial Residues II: Cassava Baggase. Bioresource Techology, 74: 81-87. Pasaribu, Gunawan dan Titiek Setyawati. 2011. Aktivitas Antioksidan dan
Toksisitas Ekstrak Kulit Kayu Raru (Cotylelobium sp.) = Antioxidant andToxicity Activity of Raru (Cotylelobium sp.) Stem Bark. Pusat Penelitian dan Pengembangan Keteknikan Kehutanan dan Pengolahan Hasil Hutan: Bogor. Jurnal Penelitian Hasil Hutan, 29(4): 322-330.
Patist, A. and Bates D. 2008. Ultrasonic Innovations In The Food Industry: from The Laboratory to Commercial Production. Innovative Food Science and Energing Technologies, 9(2): 147-154.
Perez J. A., Gonzalez A., and Oliva J. M. 2007. Effect of Process Variables on Liquid Hot Water Pretreatment of Wheat Straw for Bioconversion to Fuel-Ethanol In A Batch Reactor. Journal Chemical Technology Biotechnology, 82: 929-938.
Pimentel, David and Tad W. Patzek. 2005. Ethanol Production Using Corn, Switchgrass, and Wood; Biodiesel Production Using Soybean and Sunflower. Natural Resources Research, 14(1): 65-76.
Purba, E. 2001. Hidrolisi Pati Ubi Kayu (Manihot esculenta) dan Pati Ubi jalar (Ipomea batatas) Menjadi Glukosa secara Cold Process dengan Enzim Acid Fungal Amilase dan Glukoamilase. Skripsi. Bandar Lampung: Universitas Lampung.
Rachmawati, Dewi. 2004. Uji Kemampuan Fermentasi Star Haploid
(Saccharomyces serevisie) Hasil Rekayasa pada Cairan Buah Belimbing Manis (Averhoa carambola). Skripsi. FKIP Biologi. Surakarta: UMS. Sadasivam and Manickam. 2008. Biochemical Methods, Third Edition, Published
Sanders, B. Edward., Alan I. Goldsmith., and Jeffrey I. Seeman. 2003. A Model that Distinguishes the Pyrolysis of D-glucose, D-fructose, and Sucrose from that cellulose. Application to Understanding of Cigarette Smoke Formation. Journal of Analytical and Applied Pyrolysis, 66: 29-50. Sathya, G. Geetha and A. Navaneetha Gopalakrishnan. 2011. Bioethanol
Production from Paper Fibre Residue Using Diluted Alkali Hydrolysis and the Fermentation Process. E-Journal of Chemistry, 8(4); 1951-1957. Saunders, Jessica., Marta Izydorczyk., and David B. Levin. 2011. Limitations and
Challenges for Wheat-Based Bioethanol Production, Economic Effects of Biofuel Production. Intechnology: Croatia, 429-452.
Shapouri, H., Duffield J., and Wang M. 2002. The Energy Balance of Corn Ethanol: An Update. United States Department of Agriculture: Office of Energy Policy and New Uses. Agricultural Economic Report, 814.
Sholikhah, Siti Mar’atus. 2010. Kajian Kadar Etanol Dan Asam Asetat dalam
Cairan Nira Siwalan (Borassus Flabellifer Linn) Menggunakan Metode Kromatografi Gas (GC). Skripsi. Universitas Islam Negeri (UIN) Maulana Malik Ibrahim Malang.
Sidiras, D., and Koukios E. 2004. Simulation of Acid-catalyzed Organosolv Fractionation of Wheat Straw. Bioresource Technology, 94: 91-98. Solomon, B. O., Aderibigbe A. F., Anozie A. N., and Betiku E. 2006. Effects of
Processing Conditions on Hydrolysis of Cassava Starch. Ife Journal of Science, 8(2): 115-126.
Srinorakutara, T., Lerdluk Kaewvimol., and La-aied Saengow. 2006. Approach of Cassava Waste Pretreatments for Fuel Ethanol Production in Thailand . Journal Scientific and Research, 31(1).
Subekti, Hendro. 2006. Produksi Etanol dari Hidrolisat Fraksi Selulosa Tongkol Jagung oleh Saccharomyces cerevisiae. Skripsi. Bogor: Institut Pertanian Bogor.
Sun, Y., and Cheng J. J. 2002. Hydrolysis of Lignocellulosic Materials for Ethanol Production: A Review. Bioresource Technology, 83: 1-11.
Taherzadeh, M. J., and Karimi K. 2008. Pretreatment of Lignocellulosic Wastes to Improve Ethanol and Biogas Production: A review. International Journal Mol Science, 9: 1621-1651.
Trisnawati, Evi. 2008. Pengaruh Ultrasonikasi Terhadap Hidrolisis Pati dan Onggok serta Kaitannya dengan Fermentasi Menggunakan Kulit Kayu Tanaman Raru. Skripsi. Bandar Lampung: Universitas Lampung. Ubalua, A. O. 2007. Cassava Wastes: Treatment Options and Value Addition
Alternatives. African Journal of Biotechnology, 6(18): 2065-2073.
Walker, G. 2011. Fuel Alcohol: Current Production and Future Challenges (125th Anniversary Review). Journal of the Institute of Brewing, 117: 3-22. Weil, J. R., Brewer M., and Hendrickson R. 1998. Continuous pH Monitoring
During Pretreatment of Yellow Poplar Wood Sawdust by Pressure Cooking in Water. Applied Biochemistry and Biotechnology, 70(72): 99-111.
Woiciechowski, A. L., Nitsche Saul., Pandey Ashok., and Soccol C. R. 2002. Acid and Enzymatic Hydrolysis to Recover Reducing Sugar from Cassava Baggase: An Economic Study. Brazilian Archieves of Biology and
Technology, An International Journal, 45(3): 393-400.
Wongsorn, C., Kangsadan T., Kongruang S., Burapatana V., and Pripanapong P. 2010. Ultrasonic Pretreatment Enchanced the Enzymatic Hydrolysis of Rice Straw. International Conference Chemistry and Chemical
Engineering (ICCCE), 20-23.
Yang, C. P., Shen Z. Q., and Yu G. C. 2008. Effect and Aftereffect of Gamma Radiation Pretreatment on Enzymatic Hydrolysis of Wheat Straw. Bioresource Technology, 99: 6240-6245.
Yu, Z. S. and Zhang H. X. 2004 Ethanol Fermentation of Acid-Hydrolyzed Cellulosic Pyrolysate with Saccharomyces Cerevisiae. Bioresource Technology, 93:199-204.
Zamora, L L., Calderón José Amir González., Vázquez Evangelina Trujillo., and Reynoso Eusebio Bolaños. 2010. Optimization of Ethanol Production Process from Cassava Starch by Surface Response. Journal of the Mexican Chemical Society, 54(4): 198-203.
Zhang, Kun and Hong Feng. 2010. Fermentation Potentials of Zymomonas mobilis and Its Application in Ethanol Production from Low-Cost Raw Sweet Potato. African Journal of Biotechnology, 9(37): 6122-6128. Zhang, W., Liang M., and Lu C. 2007. Morphological and structural development
Zhao, X. B., Wang L., and Liu D. H. 2008. Peracetic Acid Pretreatment of Sugarcane Bagasse for Enzymatic Hydrolysis: A Continued Work. Journal Chemical Technology Biotechnology, 83: 950-956.