KERAGAMAN GENETIK KELINCI RAS BERDASARKAN
ANALISIS PENANDA DAERAH D-LOOP
NINING MAULANA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
NINING MAULANA. Keragaman Genetik Kelinci Ras Berdasarkan Analisis Penanda Daerah D-Loop. Dibimbing oleh DEDY DURYADI SOLIHIN dan BRAM BRAHMANTIYO.
Persilangan antara kelinci Rex yang memiliki rambut halus dengan kelinci Satin yang memiliki rambut mengkilap menghasilkan kelinci Reza yang memiliki rambut halus mengkilap. Kelinci Medium Reza adalah hasil persilangan kelinci Flemish Giant dengan kelinci Reza untuk mendapatkan kelinci yang memiliki bobot medium dan rambut yang halus dan mengkilap. Identifikasi keragaman genetik melalui DNA mitokondria dilakukan untuk mempertahankan keragaman genetik yang tetap tinggi. Daerah D-loop dalam DNA mitokondria digunakan untuk penelaahan keragaman genetik dan hubungan kekerabatan di antara spesies hewan. Penelitian ini bertujuan untuk mengetahui hubungan kekerabatan beberapa ras kelinci berdasarkan sekuens DNA mitokondria pada daerah d-loop (non-coding). Sampel DNA yang diisolasi berasal dari sampel darah kelinci jantan ras Rex, Satin, Reza, dan Medium Reza yang kemudian digunakan dalam proses amplifikasi. Hasil amplifikasi berupa pita tunggal berukuran 510 bp. Delapan sampel berhasil diamplifikasi, tetapi hanya tujuh sampel yang berhasil dirunutkan dan dianalisis. Analisis hubungan kekerabatan genetik ras kelinci menunjukan ras kelinci Satin, Reza dan Medium Reza memiliki kekerabatan yang dekat. Kelinci Rex berada terpisah dari kelompok kelinci Satin, Reza, dan Medium Reza. Persilangan ini telah menghasilkan kelinci yang memiliki rambut halus mengkilap dan ukuran luas permukaan rambut yang lebih lebar.
Kata kunci : Rex, Satin, Reza, Medium Reza, DNA Mitokondria, Daerah D-Loop
ABSTRACT
NINING MAULANA. Genetic Diversity Of Breeds Rabbit Based On D-Loop Region Marker Analysis. Supervised by DEDY DURYADI SOLIHIN and BRAM BRAHMANTIYO.
Reza rabbit with soft and shiny fur was developed by crossing Rex rabbit (soft fur) and Satin rabbit (shiny fur). Cross breed Medium Reza was developed to produce Reza with higher body weight and wider fur. Identification of genetic diversity through mitochondrial DNA was conducted to maintain high genetic diversity. D-loop Region in a mitochondrial DNA used to study the genetic diversity and genetic relationship between species. This research is aimed at observing genetic relationship among several rabbit breeds based on mitochondrial DNA on D-Loop regions (non-coding). Samples of DNA isolated from rabbit blood of Rex, Satin, Reza, and Medium Reza were then applied for amplification. The amplification developed a single band product of 510 bp. Eight samples were amplified and only seven samples were successfully aligned and analyzed. Phylogenetic analysis of rabbit breed denoted that Satin, Reza and Medium Reza were closely related. Rex breed was separeted from the others. This crossing produced soft shiny fur of rabbit that has wider fur.
KERAGAMAN GENETIK KELINCI RAS BERDASARKAN
ANALISIS PENANDA DAERAH D-LOOP
NINING MAULANA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul penelitian : Keragaman Genetik Kelinci Ras Berdasarkan Analisis
Penanda Daerah D-Loop
Nama : Nining Maulana
NRP : G34061743
Disetujui :
Pembimbing I
Pembimbing II
Dr. Ir. Dedy Duryadi Solihin, DEA
Dr. Ir. Bram Brahmantiyo, M.Si
NIP : 19561102 198403 1003
NIP : 19650506 199003 1002
Diketahui :
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir. Ence Darmo Jaya Supena, M.Si
NIP : 19641002 198903 1002
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Judul karya ilmiah ini adalah Analisis Keragaman Genetik Kelinci Ras Berdasarkan Analisis Penanda Daerah D-Loop. Penelitian dilaksanakan pada bulan Febuari 2011- Juni 2012 di Laboratorium Biologi Molekuler Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Dedy Duryadi Solihin, DEA dan Bapak Dr. Ir. Bram Brahmantiyo, M.Si selaku pembimbing atas bimbingan, saran, dan dukungan selama penulis melaksanakan penelitian dan penyusunan karya ilmiah, serta Ibu Dr. Nisa Rachmania, M.Si selaku penguji yang telah memberikan masukan dan saran bagi perbaikan karya ilmiah ini. Penulis mengucapkan terima kasih kepada ibu Butet atas bimbingan dan dukungannya, Pak Hery dan teman-teman di Laboratium Biologi Molekuler PPSHB IPB (Dini, Gita, Ratna, Dewi, Feri) atas dukungan dan kerjasamanya.
Terima kasih yang tak terhingga penulis sampaikan kepada papi dan mami tercinta, kakak Cory Maulana, abang Nazarudin, adik Iqbal Maulana atas kasih sayang, doa, semangat dan motivasi yang tiada henti kepada penulis, serta Uda Rizal, Om Jasmi dan seluruh keluarga besar atas dukungannya. Terima kasih penulis ucapkan kepada sahabat kekeh (Eka, Mely, Ade, Mutia, Arius, Imam, Farid) atas segala dukungan, doa dan saat suka duka bersama yang tak terlupakan, terutama Eka Sumaryadi atas segala dukungan, bantuan, semangat dan doa yang tiada henti. Terima kasih kepada teman-teman Biologi 43 terutama Diana, Isnita, Christine, Sarah, dan Risya, serta teman-teman Wisma Arini (Aronika, Mila, Tutia, Sarlita) yang selalu memberikan dukungan, bantuan dan doa.
Penulis berharap semoga karya ilmiah dapat bermanfaat.
Bogor, November 2012
RIWAYAT HIDUP
Penulis dilahirkan di Pariaman tanggal 16 april 1988 dari ayah Indra Utama dan ibu Efri Yetti. Penulis merupakan anak kedua dari tiga bersaudara.
Tahun 2006 penulis lulus dari SMUN 109 Jakarta Selatan dan pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Tahun 2007 penulis diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 2
BAHAN DAN METODE Waktu dan Tempat ... 2
Bahan ... 2
Pengambilan Sampel ... 2
Isolasi dan Purifikasi DNA Total ... 2
Amplifikasi DNA Mitokondria Daerah D-Loop ... 3
Perunutan Produk PCR (Sekuensing) DNA Kelinci Daerah D-loop ... 3
Analisis Filogeni ... 4
HASIL Isolasi DNA Total ... 4
Amplifikasi Daerah D-Loop ... 4
Perunutan Produk PCR (Sekuensing) DNA Kelinci Daerah D-Loop ... 4
Analisis Filogeni ... 4
PEMBAHASAN Amplifikasi Daerah D-Loop ... 5
Analisis Filogeni ... 6
SIMPULAN DAN SARAN ... 6
DAFTAR PUSTAKA ... 6
DAFTAR GAMBAR
Halaman
1 Kelinci ras Rex ... 1
2 Kelinci ras Satin ... 1
3 Kelinci ras Reza ... 1
4 Kelinci ras Flemish Giant dan Medium Reza ... 1
5 Posisi penempelan primer ... 3
6 Hasil isolasi DNA total darah kelinci pada gel agarosa 1.2% ... 4
7 Hasil amplifikasi daerah d-loop pada gel agarosa 1.2% ... 4
8 Konstruksi pohon filogeni dengan metode boostrapped Neighboor Joining (NJ) 1000x pengulangan, berdasarkan p-distance dari runutan daerah d-loop (476 bp) ... 5
DAFTAR LAMPIRAN
Halaman
1 Persilangan antara kelinci flemish Giant (FG) dengan reza (RS) ... 10PENDAHULUAN Latar Belakang
Kelinci pada umumnya merupakan satwa herbivora yang sejak dahulu telah dikenal dan digunakan dalam bidang pendidikan kedokteran dan penelitian sebagai hewan percobaan, terutama untuk pengujian obat-obatan atau yang berkaitan dengan penyakit manusia. Kelinci termasuk ke dalam kingdom Animalia, phyllum Chordata, sub-phyllum Vertebrata, class Mamalia, Ordo
Lagomorpha, family Leporidae, genus
Oryctolagus, spesies Oryctolagus cuniculus
(Cheeke 1987). Kelinci merupakan hewan prolifik artinya menghasilkan anak lebih dari satu per kelahiran yaitu sekitar 6 ekor tergantung dari ras dan ketersediaan pakan yang diberikan. Sebagai salah satu hewan peliharaan yang banyak digemari masyarakat, kelinci memiliki ragam ras yang berbeda-beda. Terdapat beberapa jenis ras pada kelinci, di antaranya Rex, Satin, Angora, Lyon, American Chinchilla, Dutch, English Spot, dan Himalayan (Sarwono 2001).
Gambar 1 Kelinci ras Rex.
Kelinci Rex (RR) (Gambar 1) memiliki rambut yang halus seperti beludru, tumbuh tegak dan rambutnya sama panjang (Cheeke 1987). Menurut Brahmantiyo (2010) kelinci Rex (RR) didatangkan dari Amerika pada tahun 1988 melalui importasi oleh Balai Penelitian Ternak (BPT) – Ciawi dalam rangka introduksi jenis kelinci baru di Indonesia dan untuk produksi rambut kelinci.
Gambar 2 kelinci ras Satin.
Kelinci Satin (SS) (Gambar 2) memiliki rambut mengkilap (Lukefahr 1981). Ciri lain dari rambut kelinci Satin yaitu halus, padat, tebal, dan lembut. Kelinci Satin (SS) didatangkan dari Amerika pertama kali ke Indonesia (Balitnak-Ciawi) pada tahun 1996. Kelinci Reza (RS) (Gambar 3) merupakan
kelinci hasil persilangan Rex (RR) dan Satin (SS) untuk mendapatkan kelinci yang memiliki rambut yang halus kilap (Prasetyo 1999).
Gambar 3 Kelinci ras Reza.
Gambar 4 Kelinci ras Flemish Giant (a) dan Medium Reza (b).
Kelinci Medium Reza (FZRS) (Gambar 4b) adalah hasil persilangan kelinci
Flemish Giant (FG) (Gambar 4a) yang memiliki bobot badan besar (7-9 kg) dengan kelinci Reza (RS) yang memiliki bobot 2,5-3 kg. Hasil persilangan awal antara Flemish Giant (FG) dengan Reza (RS) menghasilkan keturunan pertama F1 (FZ) yang memiliki peningkatan bobot, namun rambut yang dihasilkan masih normal. Oleh karena itu keturunan pertama F1 (FZ) tersebut disilangkan kembali dengan Reza (RS) sehingga dihasilkan kelinci Medium Reza (FZRS) yang memiliki bobot medium dan rambut yang halus kilap (Lampiran 1) (Brahmantiyo 2011).
Usaha budidaya dan pemuliaan kelinci dilakukan dengan metode persilangan antar ras yang ada, sesuai dengan tujuan serta kriteria seleksi. Salah satu kendala dalam proses tersebut yaitu mempertahankan keragaman genetik yang tetap tinggi dan hasil persilangan sesuai harapan/tujuan pemuliaan. Oleh karena itu identifikasi keragaman genetik kelinci harus dilakukan sejak dini agar tujuan pemuliaan tercapai. Salah satu cara yang digunakan untuk melihat keragaman genetik adalah dengan analisis genom mitokondria (Muladno 2006). Genom mitokondria memperlihatkan pewarisan sifat genetik melalui garis maternal, artinya mtDNA hanya diwariskan dari garis keturunan induk betina. Selain itu mtDNA tidak mengalami rekombinasi dan mempunyai laju mutasi yang cepat. Oleh
karena itu mtDNA banyak digunakan sebagai penanda molekuler genetik pada hewan (MacHugh & Bradley 2001).
Keragaman genetik mtDNA dapat diketahui dengan cara mengamplifikasi mtDNA pada sekuen tertentu secara in vitro. Metode tersebut dikenal sebagai Polymerase Chain Reaction (PCR) pada fragmen target. PCR adalah reaksi untuk memperbanyak ruas DNA tertentu secara in vitro menggunakan sepasang pemancing oligonukleotida yang disebut primer. Masing-masing primer ini komplemen terhadap salah satu ujung DNA target (Dawson 1996). Di dalam genom mitokondria terdapat fragmen-fagmen penyandi protein dan bukan penyandi protein (Faizah 2008). Fragmen bukan penyandi protein (non–coding) di dalam genom mitokondria yang sering digunakan dalam penelaahan keragaman genetik dan hubungan kekerabatan di antara spesies hewan adalah daerah D-loop (Widayanti 2006). Genom mitokondria hewan relatif berukuran kecil dan terdapat dalam jumlah banyak maka eksplorasi dan penelaahannya lebih mudah (Solihin 1994). Hal inilah yang melatarbelakangi diadakannya penelitian ini, guna mengetahui dan mendapatkan kajian juga informasi yang lebih spesifik mengenai keragaman genetik pada kelinci di Indonesia, khususnya di Balai Penelitian Ternak (BPT) Ciawi berdasarkan marka D-Loop.
Tujuan
Penelitian ini bertujuan untuk mengetahui hubungan kekerabatan beberapa ras kelinci berdasarkan sekuens DNA mitokondria pada daerah d-loop ( non-coding).
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari 2011 – Juni 2012 di Laboratorium Biologi Molekuler Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB.
Bahan
Bahan yang digunakan pada penelitian ini adalah sampel darah kelinci jantan ras Rex (RR), Satin (SS), Reza (RS) dan Mediun Reza (FZRS), larutan Tris-EDTA (ethylenediaminetetra-acetic acid) konsentrasi rendah (Low TE) (1 mM EDTA pH 8.0, 10 mM Tris-HCl pH 8.0), alkohol absolut, larutan digestion buffer (200 mM
NaCl, 50 mM Tris HCl pH 9.0, 100 mM EDTA pH 8.0, 1% (v/v) SDS (Sodium Dodecyl Sulphate), 0.1 mg/ml RNAse, 0.5 mg/ml Proteinase K), larutan fenol (0,5 M Tris pH 8.0, 0,1 M Tris pH 8.0, 0,25 g
Hydroxyquinoline), larutan CIAA (Cloroform : Isoamil Alkohol = 24 : 1), alkohol 70%, larutan TE (0,5 M Tris-HCL, 1 M EDTA, pH 8.0), Gel agarosa, larutan 1xTAE (Tris-asetat 40 mM, EDTA 1 mM), ethidium bromide
(0.8 g/ml).
Pengambilan Sampel
DNA yang diisolasi berasal dari sampel darah kelinci jantan ras Rex (RR), Satin (SS), Reza (RS) (Rex x Satin) dan Medium Reza (FZRS) yang diperoleh dari Balai Penelitian Ternak (BPT) Ciawi (Lampiran 2). Sampel darah kelinci diambil dari tiga individu yang berbeda dari setip ras masing-masing satu kali pengambilan. Pengambilan sampel dilakukan pada pagi hari, hal ini untuk mengurangi tingkat stres pada kelinci. Sampel darah kelinci diambil sebanyak 0,3-0,5 ml dengan menggunakan jarum suntik berukuran 1 ml, darah diambil melalui pembuluh darah vena auricularis
pada bagian telinga kelinci. Sampel darah kelinci yang telah diambil dimasukkan ke tabung mikro 1,5 ml yang sudah ditambahkan alkohol absolut sebanyak 0,8 ml sebagai pengawet. Campuran kemudian dikocok hingga tercampur. Sampel kemudian disimpan pada suhu ruangan.
Isolasi dan Purifikasi DNA Total
Isolasi DNA dilakukan dengan modifikasi metode Solihin (1997). Sampel darah kelinci yang telah dicampur dengan alkohol absolut diambil sebanyak 200 µl, lalu dimasukkan ke dalam tabung mikro (1,5 ml). Sampel kemudian ditambahkan 1000 µl larutan low TE. Setelah itu dikocok dengan vortex sampai larutan tercampur. Campuran kemudian disentrifugasi dengan mesin mikrosentrifus (Eppendorf Centrifuge 5415 C) pada kecepatan 8000 rpm selama 5 menit dan supernatannya dibuang. Hal ini dilakukan sebanyak tiga kali dengan tujuan untuk menghilangkan kandungan alkohol yang terdapat di dalam sampel darah kelinci. Setelah itu endapan darah yang terbentuk dikeringkan pada kertas saring selama 15 menit, kemudian dimasukkan ke tabung mikro baru dan ditambahkan 400µl larutan
3
diinkubasi pada suhu 55 ºC selama 2 jam kemudian ditambahkan 400 µl fenol, 400 µl CIAA dan 40 µl NaCl 5M, lalu dikocok dengan tangan (membentuk angka delapan) selama 30 menit dan disentrifugasi dengan kecepatan 13.000 rpm selama 5 menit pada mesin mikrosentrifus. Supernatan dipindahkan ke tabung mikro baru, ditambah 800 µl etanol absolut dan 40 µl NaCl 5M kemudian dikocok sampai terlihat endapan putih (DNA) dan disimpan dalam freezer
selama semalam (freezing overnight). Setelah itu sampel disentrifugasi pada kecepatan 13.000 rpm selama 5 menit pada mesin mikrosentrifus dan supernatan dibuang. Endapan sampel ditambahkan 800 µl alkohol 70%. Sampel kemudian disentrifugasi kembali dengan mesin mikrosentrifus pada kecepatan 13.000 rpm selama 3 menit, lalu supernatan dibuang. DNA (endapan putih) selanjutnya dikeringkan dengan cara mendiamkan dalam keadaan terbuka selama 15-30 menit sampai alkohol hilang, kemudian ditambah larutan TE 35 µl dan dikocok dengan vortex selama 3 menit. Sampel kemudian diinkubasi dengan inkubator pada suhu 37 ºC selama 15 menit lalu disimpan dalam freezer untuk digunakan pada tahap selanjutnya.
Kualitas DNA dilihat dengan dimigrasikan pada gel agarosa 1,2 % dengan menggunakan buffer 1xTAE. Gel agarosa diberi ethidium bromide (0,8 g/ml) untuk pewarnaan DNA, sehingga DNA akan berpendar ketika diberi sinar UV. Sampel hasil purifikasi diambil sebanyak 5 µl, kemudian ditambahkan loading dye 1 µl. Campuran tersebut kemudian dimasukkan ke sumur gel agarosa, dimigrasikan selama 30 menit dengan voltase 85 volt pada mesin
Mini Submarine Electrophoresis. Hasil elektroforesis diamati dan difoto di bawah sinar UV (Ultra Violet, 400 nm).
Amplifikasi DNA Mitokondria Daerah D-Loop
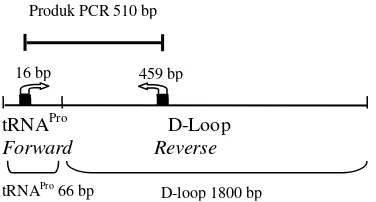
Amplifikasi mtDNA fragmen d-loop menggunakan sepasang primer koleksi Dr. Ir. Dedy Duryadi Solihin, DEA yaitu primer
forward DHF 5’-TAG CCC CAC CAT CAG CAC CCA AAG C-3’ dengan posisi penempelan pada urutan basa ke 16 di daerah t-RNA prolin (panjang t-RNA prolin adalah 66 bp) dan primer reverse DHR 5’-AAT GGG CCC GGA GCG AGA AGA GGT A-3’ dengan posisi penempelan pada urutan basa ke ke 459 didaerah d-loop (Gambar 5). Panjang daerah d-loop kelinci ialah 1800 bp.
tRNAPro D-Loop
Forward Reverse
Gambar 5 Posisi penempelan primer.
Amplifikasi fragmen d-loop dari DNA mitokondria dilakukan dengan metode
Polymerase Chain Reaction (PCR) pada mesin Thermocycler Veriti (Applied Biosystem VeritiTM 96-well Thermal Cycler). Kondisi PCR diawali dengan predenaturasi 94oC selama 5 menit. Siklus PCR dilakukan sebanyak 35 kali dengan kondisi denaturasi 94oC selama 30 detik, penempelan primer (annealing) pada suhu 53oC selama 45 detik, elongasi pada suhu 72oC selama 45 detik. Setelah itu post ekstensi 72oC selama 5 menit, dan penyimpanan pada suhu 15oC selama 5 menit. Komposisi PCR yang digunakan yaitu 12,5 µl 2x master mix green Taq polymerase, 6,5 µl ddH2O, 2 µl
enhancer, 0,5 µl primer masing–masing
forwad dan reverse 10 pmol/µl dan 3 µl DNA template. Pengecekan hasil PCR dilakukan dengan elektroforesis pada gel agarose 1,2% dengan menggunakan buffer 1xTAE. Gel agarosa diberi ethidium bromide (0,8 g/ml) untuk pewarnaan DNA. Sampel hasil PCR diambil sebanyak 3 µl, kemudian dimasukkan ke sumur gel agarosa, dimigrasikan selama 60 menit dengan voltase 85 volt. Hasil elektroforesis diamati dan difoto di bawah sinar UV (Ultra Violet, 400 nm). Hasil PCR yang diperoleh selanjutnya digunakan untuk proses perunutan DNA.
Perunutan Produk PCR (Sekuensing) DNA Kelinci Daerah D-Loop
Pembacaan sekuen DNA sebagai produk PCR menjadi alat penting dan utama dalam biologi molekular karena dapat mengetahui komposisi nukleotida dan asam amino suatu gen, juga menganalisis kekerabatan dan jalur evolusinya (Albert et al. 1994). Produk PCR fragmen d-loop dari penelitian ini berupa pita tunggal berukuran 510 bp. Analisis perunutan fragmen d-loop (sekuensing) dilakukan di PT Genetika Science, Jakarta. Terdapat dua metode sekuensing yang dikembangkan, yaitu metode Maxam-Gillbert dan metode sanger
16 bp 459 bp Produk PCR 510 bp
yang keduanya diperkenalkan pada tahun 1977. Karena lebih mudah dan praktis metode Sanger lebih sering digunakan. Prinsip sekuensing metode Sanger
menggunakan pendekatan sintesis molekul DNA baru dan pemberhentian sintesis tersebut pada basa tertentu (Muladno 2002).
Analisis Filogeni
Runutan nukleotida yang telah diedit kemudian disejajarkan (alignment) dengan menggunakan program Clustal W yang terdapat pada software MEGA 4.0 (Tamura et al 2007). Konstruksi pohon filogeni dilakukan dengan menggunakan program MEGA 4.0 (Moleculer Evolutionary Genetic Analysis) berdasarkan nilai p-distance yaitu jumlah nukleotida yang berbeda dibagi dengan jumlah total nukleotida yang dibandingkan. Konstruksi pohon filogeni menggunakan metode bootstrapped Neighbour-Joinning (NJ) dengan 1000 kali pengulangan (Nei & Kumar 2000).
HASIL Isolasi DNA Total
Penelitian ini menggunakan 8 sampel darah dari kelinci ras Rex (RR), Satin (SS), Reza (RS), dan Medium Reza (FZRS) yang bersal dari Balai Penelitian Ternak (BPT) Ciawi. Hasil purifikasi DNA total yang telah dimigrasikan pada gel agarosa 1,2 % dan dilihat dengan UV transilluminator
disajikan pada Gambar 6. DNA hasil purifikasi selanjutnya digunakan sebagai cetakan untuk amplifikasi daerah D-loop dengan teknik PCR.
1 2 3 4 5 6 7 8
Gambar 6 Hasil isolasi DNA total darah kelinci pada gel agarosa 1.2%. Keterangan : kolom 1-2= DNA total kelinci rex (RR1 dan RR3), kolom 3-4 = DNA total kelinci satin (SS2 dan SS3), kolom 5 = DNA total kelinci reza (RS3), kolom 6-8 = DNA total kelinci medium reza (FZRS1, FZRS2 dan FZRS3).
Amplifikasi Daerah D-Loop
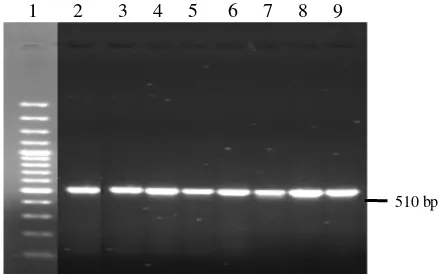
Amplifikasi daerah d-loop pada kelinci Rex (RR), Satin (SS), Reza (RS), dan Medium Reza (FZRS) menggunakan sepasang primer DHF dan DHR yang menghasilkan pita tunggal berukuran 510 bp (Gambar 7). Produk PCR tersebut selanjutnya digunakan pada proses sekuensing.
1 2 3 4 5 6 7 8 9
Gambar 7 Hasil amplifikasi daerah D-Loop pada gel agarosa 1.2%. Keterangan : kolom 1 = marker 100 bp, kolom 2-3= kelinci rex (RR1 dan RR3), kolom 4-5 = kelinci satin (SS2 dan SS3), kolom 6 = kelinci reza (RS3), kolom 7-9 = kelinci medium reza (FZRS1, FZRS2 dan FZRS3).
Perunutan Produk PCR (Sekuensing) DNA Kelinci Daerah D-Loop
Perunutan DNA dilakukan dua arah, yaitu forward dan reverse. Berdasarkan hasil amplifikasi panjang nukleotida pada tiap sampel ialah 510 bp. Panjang DNA hasil perunutan setelah diedit yaitu sepanjang 476 bp. Hal ini disebabkan oleh panjang nukleotida pada setiap sampel pada hasil perunutan berbeda, sehingga ketika di
alignment menghasilkan ukuran nukleotida yang lebih pendek. Sampel medium reza (FZRS3) menunjukan hasil yang kurang baik, karena memiliki banyak kesalahan pada pembacaaan basa nukleotida sehingga tidak diikutkan pada proses analisis. Berdasarkan hasil persejajaran berganda (multiple alignment) diperoleh susunan perbedaan basa nukleotida pada fragmen d-loop dengan nilai
conserved sebanyak 391 dan nilai variable
sebanyak 85 (Lampiran 2).
Analisis Filogeni
Hubungan kekerabatan ras kelinci Rex, Satin, Reza dan Medium Reza dapat dibandingkan berdasarkan jarak genetik
distance dari basa-basa nukleotidanya. Jarak genetik digunakan untuk melihat kedekatan hubunga genetik antar sampel yang dianalisis. Matriks jarak genetik antar ras kelinci yang berkisar antara 0.023-0.149 (Tabel 1). Jarak genetik yang paling besar ialah antara kelinci rex (RR3) dengan satin (SS2) yaitu 14,9%. Perbedaan susunan nukleotida hasil persejajaran berganda
fragmen d-loop dapat dilihat pada Lampiran 2. Data matriks Tabel 1 diolah dengan program MEGA 4.0 sehingga dihasilkan diagram pohon filogeni seperti pada Gambar 8. Gambar 8 menunjukkan konstruksi pohon filogeni kelinci berdasarkan metode p-distance dari basa-basa nukleotida fragmen d-loop.
Tabel 1 Matriks perbedaan rata-rata nukleotida p-distance berdasarkan metode pairwaise distance
daerah d-loop mitokondria pada kelinci ra Rex, Satin, Reza dan Medium reza (476 bp).
No Sampel 1 2 3 4 5 6 7
Konstruksi pohon filogeni yang dihasilkan menunjukan bahwa ras kelinci membentuk dua cabang utama. Kelinci Satin (SS2 dan SS3), Reza (RS3) dan Medium Reza (FZRS1 dan FZRS2) berada pada kelompok yang sama, sedangkan kelinci rex (RR1 dan RR3) berada pada kelompok yang terpisah. Hal ini menunjukan keragaman pada ras kelinci.
Gambar 8 Konstruksi pohon filogeni dengan metode Neighboor-Joining bootsrapped 1000x pengulangan
berdasarkan model p-distance
dari runutan fragmen d-loop (476 bp) pada kelinci ras.
PEMBAHASAN Amplifikasi Daerah D-loop
Amplifikasi daerah d-loop pada semua sampel kelinci menghasilkan pita tebal yang berukuran 510 bp. Keberhasilan
amplifikasi daerah d-loop sangat ditentukan oleh kondisi penempelan primer pada DNA genom, komposisi bahan pereaksi PCR, dan kemurnian DNA hasil purifikasi. Kondisi penempelan primer pada saat amplifikasi ialah 53oC. Suhu penempelan primer sangat penting dalam proses amplifikasi, karena pada tahap ini primer akan menempel secara spesifik pada DNA target (Nugroho 2011). Menurut Newton & Graham (1997) jika suhu penempelan primer terlalu tinggi dari suhu optimum, menyebabkan primer tidak menempel dengan cetakan DNA. Sebaliknya, jika suhu penempelan primer terlalu rendah dari suhu penempelan optimum menyebabkan mispriming, yaitu penempelan primer pada tempat yang salah pada DNA cetakan sehingga dihasilkan produk non spesifik. Oleh karena itu dilakukan optimasi terlebih dahulu terhadap suhu penempelan primer.
Terdapat beberapa hambatan yang sering terjadi selama proses amplifikasi pada penelitian ini yaitu hasil pita DNA yang dihasilkan terlalu tebal dan multistrand
(terdapat banyak pita yang bukan target). Hal ini diatasi dengan melakukan modifikasi pada komposisi PCR dan kondisi PCR. Modifikasi pada komposisi PCR dilakukan dengan menurunkan volume MgCl2 dan volume
primer yang digunakan. Sedangkan modifikasi yang dilakukan pada kondisi PCR
adalah dengan menaikan suhu anealing
(penempelan primer) dan mengubah waktu pada proses PCR sehingga didapatkan pita tunggal yang sesuai dengan target. Hal ini sesuai dengan yang telah dijelaskan oleh Newton dan Graham (1997).
Analisis Filogeni
Ras kelinci Satin (SS2, SS3), Reza (RS3) dan Medium Reza (FZRS1 dan FZRS2) berada dalam kelompok yang sama. Sedangkan sampel kelinci Rex (RR1 dan RR3) berada pada kelompok yang berbeda. Hal ini dapat disebabkan oleh persilangan yang dilakukan antara kelinci Rex (RR) dan Satin (SS) yang menghasilkan kelinci Reza (RS), sehingga kelinci Reza berada dekat degan Satin (SS2). Sampel kelinci Rex (RR1 dan RR3) berada terpisah dari kelompok sampel kelinci Reza (RS3) karena sampel kelinci Rex (RR1 dan RR3) diduga berasal dari induk betina yang berbeda dengan kelinci Reza (RS3). Sampel kelinci Satin (SS2) berada dekat dengan sampel kelinci Reza (RS3), hal ini membuktikan bahwa sampel kelinci Satin (SS2) dan kelinci Reza (RS3) berasal dari induk betina yang sama. Sesuai dengan teori Machugh & Bradley (2001) bahwa pewarisan sifat genetik pada genom mitokondria melalui garis maternal, artinya mtDNA hanya diwariskan dari garis keturunan induk betina. Sampel kelinci satin (SS3) berada terpisah dari sampel kelinci satin (SS2). Hal ini dapat disebabkan oleh perbedaan induk betina antara sampel kelinci SS2 dan SS3, sehingga kedua kelinci ini berada terpisah.
Sampel kelinci Medium Reza (FZRS1 dan FZRS2) adalah hasil persilangan antara kelinci Flemish Giant (FG) dengan kelinci Reza (RS). Berdasarkan konstruki pohon filogeni Sampel kelinci Medium Reza (FZRS1 dan FZRS2) berada pada kelompok yang sama dengan sampel kelinci Reza (RS3) dan Satin (SS2 dan SS3). Hal ini dapat disebabkan oleh sampel kelinci Medium Reza (FZRS1 dan FZRS2) berasal dari induk betina Reza (RS) yang memiliki kekerabatan melalui garis maternal dengan kelinci Reza (RS3). Kedekatan ini kemungkinan dapat terjadi karena adanya aliran gen yang terjadi akibat persilangan pada ras kelinci yang berada di Balai Penelitian Ternak (BPT) Ciawi. Nilai boostrap menjadi tolak ukur penentu tingkat kepercayaan pohon filogeni. Semakin besar nilai bootstrap, maka semakin tinggi pula tingkat kepercayaan topologi pohon hasil rekonstruksi tersebut (Nei &
Kumar 2000). Analisis filogenik memiliki beberapa tujuan di antaranya membantu dalam menentukan keputusan program pemuliaan, pelestarian, persilangan bangsa-bangsa, dan pola migrasi (Kidd & Pirchner 1974). Identifikasi gen-gen dari individu ternak akan membantu program pemuliaan (genetik) ternak, yang membedakan dari penampilan (fenotipe) yang tampak, yang dapat menentukan proses pemilihan tetua untuk generasi yang akan datang (seleksi buatan). Jika gen-gen untuk sifat produksi dapat diidentifikasi, ternak-ternak tersebut dapat diseleksi walaupun tidak diekspresikan oleh individu ternak yang bersangkutan. Pelestarian keragaman genetik ternak akan selalu diperlukan dalam pemuliaan di masa mendatang. Tanpa adanya keragaman genetik, pemuliaan ternak tidak mungkin dilaksanakan untuk mengantisipasi keperluan di masa mendatang (Subandriyo & Setiadi 2003).
SIMPULAN
Berdasarkan hasil sekuen DNA daerah d-loop keempat ras kelinci yang digunakan pada penelitian ini menunjukkan hubungan kekerabatan yang cukup dekat. Ras kelinci yang memiliki hubungan paling dekat berdasarkan konstruksi pohon filogeni ialah kelinci satin (SS2) dengan reza (RS3).
SARAN
Perlu dilakukan penelitian lebih lanjut mengenai ras kelinci dengan susunan induk dan tetua jantan yang jelas dan jumlah ras yang lebih banyak sehingga dapat diperoleh hasil dan informasi yang lebih lengkap. Hal ini akan mempermudah penentuan keragaman dan hubungan kekerabatan pada setiap ras kelinci.
DAFTAR PUSTAKA
Albert J, Wahlberg J, Leitner T, Escamilla D, Uhlen M. 1994. Analysis of a rape case by direct sequencing of the human immunodeficiency virus type 1 pol and gag genes. J Virol 68: 5018-24.
7
Brahmantiyo B, Raharjo YC. 2011. Peningkatan produktivitas kelinci rex, satin dan persilangannya melalui seleksi. JITV 16: 243-252. Cheeke PR, Patton NM, Lukefahr SD,
McNitt JI. 1987. Rabbit Production. 6th Ed. Danville: Interstate Pr. Dawson MT, R Powel, F Gannon. 1996.
Gene Technology. Oxford: BIOS Scientific Publisher.
Faizah U. 2008. Karakteristik marka genetik DNA mitokondria sebagai acuan konservasi genetik harimau sumatera [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Kidd KK, Osterhoff D, ErhardL, Stone WH. 1974. The use of genetic relationships among cattle breeds in the formulation of rational breeding policies: an example with South Devon (South Africa) and Gelbvieh (Germany). Anim Blood Groups Biochem Gen 5: 21-28.
Lukefahr SD. 1981. Coat color genetics of rabbit: The satin breed. J Appl Rabbit Res 4:106-114.
MacHugh DE, Bradley DG. 2001. Livestock genetic origins: goat buck the trend.
Proc Nact Acad Sci 98:5382-5384. Muladno. 2002. Teknologi Rekayasa Genetik.
Bogor : Pustaka Wirausaha Muda. Muladno. 2006. Aplikasi Teknologi
Molekuler dalam Upaya Peningkatan Produktivitas Hewan. Materi Pelatihan Teknik Diagnostik Molekuler untuk Peningkatan Produksi Peternakan dan Perikanan di Kawasan TimurIndonesia. Bogor: Pusat Studi Ilmu Hayati, Lembaga Penelitian dan Pemberdayaan Masyarakat Institut Pertanian Bogor dan Direktorat Jenderal Pendidikan Tinggi Depdiknas.
Nei M and S Kumar. 2000. Molecular Evolution and Phylogenetics. New York: Oxford University Press Inc. Newton CR, Graham A. 1997. PCR
Introduction to BIOtechnique. Ed ke- 2. Oxford: Bios Scientific Publisher Ltd.
Nugroho C. 2011. Variasi gen cytochrome oxidase subunit I (COI) DNA mitokondria pada lebah Apis cerana
[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Prasetyo RS. 1999. Kajian pembentukan bangsa kelinci berbulu halus kilap melalui persilangan bangsa kelinci rex dan satin [disertasi]. Bogor: Program Pascasajana, Institut Pertanian Bogor.
Sarwono B. 2001. Kelinci Potong dan Hias.
Jakarta : Agro Media Pustaka. Solihin DD. 1994. Ulas balik peran DNA
mitokondria (mtDNA) dalam studi keragaman genetik dan biologi populasi pada hewan. Hayati 1 : 1-4. Solihin DD. 1997. Isolasi dan Purifikasi Mitokondria (mtDNA). Bogor: Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor.
Subandriyo, Setiadi B. 2003. Pengelolaan plasma nutfah hewani sebagai aset dalam pemenuhan kebutuhan manusia. Lokakarya Pemantapan Pengelolaan Database dan Pengenalan Jejaring Kerja Plasma Nutfah Pertanian, Bogor, 21-28 Juli, 2003, Komisi Nasional Plasma Nutfah.
Tamura K, Dudley J, Nei M, Kumar S. 2007. MEGA 4: Molecular evolutionary genetics analysis software version 4.
J Mol Biol Evol 24: 1596-1599 Widayanti R. 2006. Kajian penanda genetik
9
Lampiran 1 Persilangan antara kelinci Flemish Giant (FG) dengan kelinci Reza (RS)
Keterangan gambar : FG = Flemish Giant RS = Reza
FZ = keturunan pertama hasil persilangan FG dan RS (50% FG, 50% RS) FZRS = Medium Reza (25% FG, 75% RS)
Flemish Giant (FG) dengan Reza (RS)
x
F1 x
FG
RS
FZRS RS
10
Lampiran 2 Persejajaran berganda nukleotida (476 bp) pada daerah D-loop mitokondria kelinci#MEGA
!Title mega compare; !Format
DataType=Nucleotide NSeqs=7 NSites=476
Identical=. Missing=? Indel=-;
!Domain=Data;
#Sekuen_RR1 CTTAAACTAC CCTCTGCTCT TTTACTTTAA TAAAACTCAA GTACTTCATC AGTACTGACA AAACTTACTA ACACACTATG #Sekuen_RR3 ...T... ... ... ... ... ... ...AG GA.TC.A.AA #Sekuen_SS2 ... T... ... C....T.... ..G.C.TG.. ....TCA.T. ...TT.T ..TTC... #Sekuen_SS3 ... ... ... ... ... ... ... ... #Sekuen_RS3 ... TT... ...C ...G .G... ... ...TT.T ..TTC... #sekuen_FZRS1 ... T... ...C ...G ... ... ...TT.T ..TTC...C. #Sekuen_FZRS2 ... T... ...C ...G ... ... ...TT.T ..TTC...
#Sekuen_RR1 TAATTCGTGC ATTAATGCTC GTCCCCATTA AAATGTATTA CAACAATAAA TTCATAACCA ACATTCAACA TATTATGCTT #Sekuen_RR3 A....TT..T .C.TCG.T.G ..TTTTCGGG ...GG..C ..C.C.C... ...T... ...TC.A. .T...A.. #Sekuen_SS2 ..T... ....G..T.. C...A....T GC...AC... G.T.C....G ..T..G.... ...T.... ..C....T.. #Sekuen_SS3 ... ... .C... ... ... ... ...T.... ..C....T.. #Sekuen_RS3 ..T... ....G..T.. C...A..A.. TC... G.T.C.A..G ..T..G.... ...T.... ..C....T.. #sekuen_FZRS1 ..T... ..AGGG.T.. C... ... ... ... ...T.... ..C....T.. #Sekuen_FZRS2 ..T... ....G... C...A... ... ... ... ...T.... ..C....T..
11
Lampiran 2 Lanjutan#Sekuen_RR1 CACACATAAT TCAACAAAAA ATCGACCCAA ACATGAATAT TCTCACCAAA AATCTAATGA TTGACTTGAC ATTGGACATT #Sekuen_RR3 ... ... ... ... ... ... ... ... #Sekuen_SS2 ... C... ..T... ... ... ... ... ..CA...C #Sekuen_SS3 ... C... ..T... ... ... ... ... ..CA...C #Sekuen_RS3 ... C... ..T... ... ... ... ... ..CA...C #sekuen_FZRS1 ... C... ..T... ... ... ... ... ..CA...C #Sekuen_FZRS2 ... C... ..T... ... ... ... ... ..CA...C
#Sekuen_RR1 AATTCCATAA TTAAACATAG ACCATCAAAT CTACACACAC CACTCAACCC TTACCCATAC GACTATCCCT CTCCCCCAGT #Sekuen_RR3 ... ... ... ... ... ... ... ... #Sekuen_SS2 ... ... ... ... ...T. ... ... ... #Sekuen_SS3 ... ... ... ... ...T. ... ... ... #Sekuen_RS3 ... ... ... ... ...T. ... ... ... #sekuen_FZRS1 ... ... ... ... ...T. ... ... ... #Sekuen_FZRS2 ... ... ... ... ...T. ... ... ...
#Sekuen_RR1 CCTCTCACAA CTTACCATCC TCCGTGAAAC CAACAACCCG CCCACCAAGG ATACCTCTAC TCGCTCCGGG CCCATT #Sekuen_RR3 ... ... ... ... ... ... ... ... #Sekuen_SS2 ... ... ... ... ... ... ... ... #Sekuen_SS3 ... ... ... ... ... ... ... ... #Sekuen_RS3 ... ... ... ... ... ...T. ... ... #sekuen_FZRS1 ... ... ... ... ... ...T. ... ... #Sekuen_FZRS2 ... ... ... ... ...C... ...T. ... ...
Urutan nukleotida dibaca secara vertikal/kolom. Angka-angka menunjukan situs nukleotida. (.) adalah nukleotida identik