ANALYSIS OF SOY-OLIGOSACCHARIDES CONTENT OF THE TWENTY PRODUCT COMMERCIAL SOY-BASED POWDER DRINKS
Lukman Saifatah, Didah Nur Faridah, and Nuri Andarwulan.
Department of Food Science and Technology, Faculty of Agricultural Technology. Bogor Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor, West Java, Indonesia.
Phone: +6285283760523, email: lukmansaifatah@yahoo.com ABSTRACT
Soy products such as powder drinks have superior nutritional characteristics in terms of high protein contents and serve as a low cost substitute to dairy milk and as a nutritive supplement for the lactose intolerance population and the allergy patient. Soybean, not only contain protein, but also oligosaccharides. Soy-oligosaccharides include raffinose and stachyose have been credited with many health-promoting function. This research’s aim was to analyze soy-oligosaccharides contents of the twenty commercial soy-based powder drink with HPLC method. The compounds were well separated on a Hypersil Carbohydrate Analysis column by using mobile phase consisting of acetonitrile and water (75:25 v/v at a flow rate of 1.5 ml/min).Twenty commercial products were sampled and grouped by consumer age, which are 3 year old above (adult), 1-3 year, and 0-1 year. Samples intended for 3 years old above consumers were further divided again into sample for special group of consumers and for ordinary consumers. Samples for consumers 3 years old above (ordinary consumer) had fructose (1.87-15.32 mg/g), glucose (2.26-17.28 mg/g), and sucrose (20.12-137.10 mg/g). Samples for special group of consumers had fructose (0.53-69.16 mg/g), glucose (0.74-36.35 mg/g), and sucrose (5.86-115.44 mg/g). Samples for 0-1 year, had glucose (26.44-38.34 mg/g) and sucrose (6.89-89.76 mg/g), and samples for 1-3 years had glucose (33.90-38.70 mg/g) and sucrose (91.37-91.78 mg/g). The results of analyze oligosaccharides showed that samples for consumers 3 years old above (ordinary consumer) had oligosaccharides content higher than samples for special group of consumers, indeed oligosaccharides content in the samples for 0-1 year and 1-3 years were not detected. Oligosaccharides content in the samples for consumers 3 years old above (ordinary consumer) were 20.99-27.44 mg/g (about 4.44-6.80 mg/g raffinose and 16.55-21.59 mg/g stachyose approximately) and oligosaccharides content in the samples for special group of consumers were 0.66-1.98 mg/g (about 0.23-6.32 mg/g raffinose and 0.68 mg/g stachyose approximately). This research also showed that ingredients affect the oligosaccharides content of the samples. Samples which soybean had higher oligosaccharides content than the samples which soy protein isolate as the raw material.
1
I.
PENDAHULUAN
A.
Latar Belakang
Pemanfaatan kedelai sebagai bahan baku produk pangan terus meningkat dibandingkan pangan nabati lainnya. Hal ini dikarenakan kandungan gizi pada kedelai, terutama protein, yang secara kualitatif dan kuantitatif lebih baik dari pangan nabati lainnya. Bahkan para ahli gizi dunia memasukkan kedelai kedalam lima kelompok makanan yang mengandung protein tinggi yaitu daging, ikan, telur, susu, dan kedelai (Liu, 1997). Menurut Koswara (1992) protein kedelai dapat mencapai 43% dari berat kering dan pada susu kedelai memiliki mutu protein sebesar 80% dari susu sapi jika diberikan sebagai makanan tunggal. Protein pada kedelai mempunyai susunan asam amino yang mirip dengan susu sapi, sehingga sangat baik digunakan sebagi pengganti susu sapi bagi mereka yang tidak toleran terhadap susu sapi (lactose intolerance), alergi, atau tidak menyukai susu sapi. Hal inilah yang banyak dimanfaatkan industri pangan dalam mengolah kedelai menjadi produk yang tinggi protein nabati khususnya bagi kelompok yang tidak dapat mengkonsumsi sumber protein hewani seperti susu sapi. Menurut Vesa et al (2000), lactose intolerance dapat terjadi akibat kurangnya enzim laktase atau adanya peradangan pada saluran pencernaan sehingga tidak dapat mencerna laktosa yang ada pada susu sapi dengan baik, sehingga akan mengalami gangguan pencernaan setiap kali mengkonsumsi susu sapi yang mengandung laktosa.
Pengolahan kedelai menjadi produk minuman menjadi kian digemari karena produk dalam bentuk cair lebih mudah untuk dikonsumsi khususnya bagi golongan tertentu seperti bayi dan orang yang sedang sakit. Penderita lactose intolerance dan alergi terhadap susu sapi pada masa pertumbuhan merupakan konsumen yang banyak memanfaatkan produk minuman kedelai. Hal ini dikarenakan kebutuhan protein pada usia bayi tidak dapat dipenuhi dari susu sapi, sehingga minuman yang berasal dari protein kedelai menjadi alternatif lain. Minuman bubuk berbasis kedelai juga banyak dikonsumsi oleh orang dewasa sebagai minuman kesehatan mengingat manfaat yang diberikan dari kedelai sangat baik untuk kesehatan seperti tinggi protein dan mengandung oligosakarida.
Oligosakarida termasuk salah satu komponen yang ada pada kedelai. Menurut Weijers et al.
2 Pemanfaatan kandungan gizi kedelai sudah dikembangkan pada beberapa produk pangan serta analisis terkait kandungannya seperti oligosakarida sudah semakin berkembang. Namun analisis oligosakarida pada produk minuman bubuk komersial berbasis kedelai yang banyak beredar di masyarakat belum dilakukan. Salah satu metode analisis oligosakarida yang dapat digunakan adalah teknik HPLC (High Performance Liquid Chromatography), yaitu dengan mengidentifikasi komponen yang berbeda berdasarkan berat molekul dan waktu retensi tiap komponen oligosakarida. Beberapa penelitian dengan menggunakan HPLC menunjukkan bahwa komponen oligosakarida pada kacang-kacangan dan produk olahannya dapat diidentifikasi berdasarkan berat molekul dan waktu retensinya. Wang et al. (2007) dapat mengidentifikasi kadar oligosakarida dengan menggunakan HPLC pada proses pengolahan kedelai menjadi kembang tahu. Selain itu Jangchud dan Bunnag (2001) juga melakukan penelitian terkait pengaruh perendaman dan pemasakan terhadap kandungan oligosakarida pada kacang merah dengan menggunakan HPLC. Penelitian yang sama juga dilakukan oleh Han dan Baik (2006) danRupérez (2006) pada beberapa jenis kacang-kacangan termasuk kedelai.
B.
Tujuan Penelitian
3
II.
TINJAUAN PUSTAKA
A.
Kedelai
(
Glycine max
)
Kedelai (Glycine max) termasuk dalam family Leguminosa, sub family Papillionaceae, dan genus Glycine L. Kacang kedelai merupakan bahan pangan sumber protein nabati untuk manusia dan hewan di berbagai negara. Secara fisik setiap biji kedelai berbeda dalam hal warna, ukuran, dan bentuk biji juga perbedaan komposisi kimia. Perbedaan sifat fisik dan kimia tersebut dipengaruhi oleh varietas dan kondisi dimana kedelai itu tumbuh. Berdasarkan warna kulit biji, kedelai terdiri dari 5 jenis yaitu kedelai putih, kedelai kuning, kedelai hitam, kedelai hijau, dan kedelai coklat. Kedelai memiliki biji yang pada umumnya berbentuk bulat hingga lonjong atau agak memanjang (Liu, 1997).
Tanaman kedelai merupakan tanaman berbiji ganda dan berakar tunggang. Kedelai termasuk tanaman semusim yang dapat diusahakan pada musim kemarau karena tidak memerlukan air dalam jumlah yang besar. Umumnya kedelai tumbuh di daerah dengan ketinggian 0-500 meter dari permukaan laut. Polong kedelai berisi 1-5 biji kedelai. Tanaman kedelai merupakan tanaman berumur pendek, dengan umur 90 hari (Liu, 1997). Kedelai masih dapat tumbuh dengan baik pada tanah dengan pH 4.5. Daerah pertumbuhannya tidak lebih 500 m di atas permukaan laut dengan iklim panas dan curah hujan rata-rata 200 mm/bulan. Umur tanaman kedelai berbeda-beda tergantung varietasnya, tetapi umumnya berkisar antara 75-100 hari (Koswara, 1992).
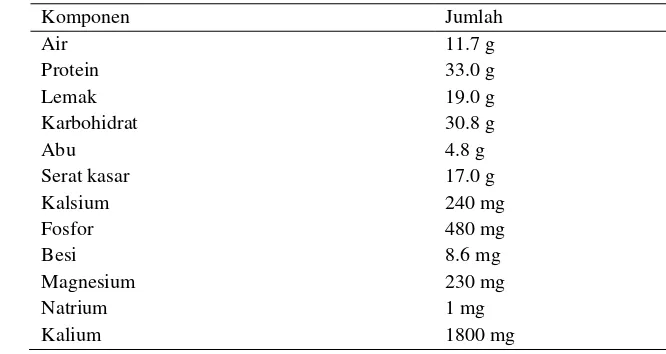
Kedelai, dilihat dari komposisinya, merupakan sumber pangan yang bernilai gizi tinggi. Kedelai terutama mengandung karbohidrat, protein, dan lemak. Menurut Liu (1997), kandungan gizi pada kedelai sangat bervariasi tergantung varietas, kesuburan tanah, dan kondisi iklim. Kedelai mengandung lemak sekitar 18 - 20 %, yang sebagian besar merupakan asam lemak tidak jenuh. Lemak kedelai mengandung asam lemak esensial, yaitu asam linoleat (Omega 6) serta linolenat (Omega 3) sehingga baik bagi kesehatan terutama dalam mengontrol kolesterol dan penyakit kardiovaskuler. Kedelai juga merupakan sumber serat yang dapat mencegah penyakit degeneratif seperti diabetes mellitus, berbagai kanker, osteoporosis, penyakit ginjal, dan lain-lain. Komposisi kacang kedelai menurut Sugano (2006) dapat dilihat pada Tabel 1.
4 Tabel 1. Komposisi zat gizi dalam 100 gram kacang kedelai
Komponen Jumlah
Air 11.7 g
Protein 33.0 g
Lemak 19.0 g
Karbohidrat 30.8 g
Abu 4.8 g
Serat kasar 17.0 g
Kalsium 240 mg
Fosfor 480 mg
Besi 8.6 mg
Magnesium 230 mg
Natrium 1 mg
Kalium 1800 mg
Sumber: Sugano (2006)
Kedelai dikenal sebagai sumber protein nabati karena memiliki kadar protein yang sangat tinggi dibandingkan pangan nabati lainnya, yaitu dapat mencapai 35% tergantung varietasnya. Protein kedelai sebagian besar terdiri dari globulin, dan bila dibandingkan dengan kacang-kacangan lain, kedelai memiliki susunan asam amino yang lebih lengkap dengan asam amino pembatas berupa metionin dan sistin, sedangkan kandungan lisin dan treoninnya sangat tinggi (Sugano, 2006). Hal tersebut sangat menguntungkan karena pada umumnya makanan pokok masyarakat seperti beras sangat rendah kandungan lisinnya. Selain kadarnya yang tinggi, protein kedelai juga memiliki kualitas yang hampir menyamai kualitas protein hewani. Menurut Koswara (1992) protein pada susu kedelai memiliki mutu protein sebesar 80% dari susu sapi jika diberikan sebagai makanan tunggal. Nilai gizi protein pada kedelai dibatasi oleh faktor antitripsin serta kompaknya struktur kuartener dan tersier protein kedelai (Liu, 1997).
Selain protein, kedelai juga mengandung karbohidrat yang cukup tinggi, yaitu sekitar 25-35%, namun hanya 12-14% saja yang dapat digunakan tubuh secara biologis (Koswara, 1992), sedangkan menurut Stevenson et al. (2007) kandungan karbohidrat yang dapat dicerna oleh tubuh dalam bentuk pati hanya mencapai 11% dari berat kering. Karbohidrat pada kedelai terdiri dari golongan monosakarida, oligosakarida, dan polisakarida. Golongan oligosakarida terdiri dari rafinosa, dan stakiosa yang larut dalam air, sedangkan golongan polisakarida terdiri dari erabinogalaktan dan selulosa yang tidak larut dalam air dan alkohol (Koswara, 1992). Komposisi karbohidrat pada kedelai dapat dilihat pada Tabel 2.
Tabel 2. Komposisi karbohidrat kedelai
Komponen Jumlah (g/100g)
Patia 11.7
Glukosa+fruktosab 0.14
Sukrosab 4.31
Rafinosab 0.75
Stakiosab 4.13
a
Stevenson et al. (2007)
5 Oligosakarida pada kedelai dapat mencapai sekitar 5% dari berat kering. Kandungan oligosakarida pada kedelai terutama dalah stakiosa (3.10-5.70%), rafinosa (0.50-0.74%), dan sedikit kandungan verbaskosa (0.12-0.20%) (Grieshop et al., 2003). Pada awalnya oligosakarida kedelai dikelompokkan sebagai senyawa antinutrisi karena dapat menyebabkan flatulensi, yaitu keadaan menumpuknya gas seperti metana dan hidrogen dalam saluran pencernaan. Gas tersebut terbentuk sebagai hasil metabolisme mikroorganisme yang ada pada saluran pencernaan. Namun, saat ini oligosakarida telah diketahui memberikan efek yang menguntungkan pada tubuh seperti menekan pertumbuhan bakteri yang merugikan serta mencegah kanker kolon.
Kedelai mengandung kadar abu sekitar 5%, yaitu terdiri dari komponen mineral yang terdapat pada kedelai. Mineral utama yang terdapat pada kedelai adalah kalium, kemudian fosfor, magnesium, sulfur, kalsium, klorida, dan natrium. Kandungannya rata-rata dapat mencapai 0.2-2.1%. Selain itu kedelai juga mengandung komponen mineral mikro, yaitu mineral dengan jumlah yang sangat kecil sekitar 0.01-140 ppm seperti silikon, besi, zink, mangan, kobalt, arsen, dan iodin. Seperti komponen lainnya, kandungan mineral pada kedelai juga sangat beragam tergantung dari varietas kedelai, lokasi pertumbuhan, dan musim (Liu, 1997).
B.
Produk Olahan Kedelai
Produk olahan kedelai pada umumnya memanfaatkan kandungan protein yang tinggi pada kedelai sehingga dapat digunakan untuk memenuhi kebutuhan protein. Salah satu produk olahan kedelai yang strategis adalah minuman bubuk kedelai. Minuman bubuk seperti kedelai bubuk atau susu formula berbasis protein kedelai, saat ini sudah banyak dikonsumsi karena melihat manfaat yang diberikan oleh produk tersebut seperti tidak menyebabkan diare pada penderita lactose intolerance
dan kandungan protein yang menyerupai protein susu sapi. Pangan dalam bentuk minuman lebih mudah untuk dikonsumsi khususnya oleh golongan tertentu seperti bayi dan orang yang sedang sakit.
Selain minuman bubuk, kedelai juga diubah menjadi produk isolat protein kedelai, yaitu produk antara yang berasal dari kedelai dan mempunyai kandungan protein yang tinggi sekitar 90%. Isolat protein kedelai biasanya digunakan sebagai bahan campuran dalam makanan olahan daging atau susu. Isolat protein kedelai baik digunakan dalam formulasi berbagai produk makanan, sebagai bahan pengikat, atau sebagai pengemulsi dalam produk-produk daging seperti produk analog dan campuran dalam susu kedelai (Santoso, 2005).
1.
Isolat Protein Kedelai
Isolat protein kedelai merupakan bentuk protein kedelai yang paling murni, karena kadar proteinnya minimum 90 % dalam berat kering. Produk ini hampir bebas dari karbohidrat, serat dan lemak sehingga sifat fungsionalnya jauh lebih baik dibandingkan dengan konsentrat dan tepung kedelai. Isolat protein kedelai dibuat dari kedelai bebas lemak dengan cara memisahkan protein kedelai dari karbohidrat yang terlarut maupun tak terlarut. Kemudian mengendapkan protein kedelai tersebut pada titik isoelektriknya sehingga protein dapat diisolasi dan dipisahkan dari bagian-bagian lainnya yang tidak diinginkan. Bagian protein yang mengendap tersebut kemudian dicuci dan dikeringkan (Winarsi, 2010).
6 yaitu pada pH 4.2 - 4.6 dan meningkat seiring meningkatnya pH. Selain itu, proses produksi protein kedelai juga sangat berpengaruh pada tingkat kelarutannya, seperti proses pemanasan dalam inaktifasi lipoksigenase dan tripsin inhibitor dapat mengurangi kelarutan protein kedelai (Liu, 1997).
2.
Minuman Bubuk Kedelai
Minuman bubuk kedelai dapat berupa susu kedelai bubuk atau susu formula berbasis protein kedelai. Susu kedelai bubuk dapat berupa kedelai yang ditepungkan atau susu kedelai cair yang dikeringkan. Kedelai bubuk merupakan produk yang berasal dari kacang kedelai yang ditepungkan sehingga komponen seperti serat, lemak, dan karbohidratnya masih tetap ada. Produk ini memang diharapkan demikian, sehingga manfaat dari kedelai masih tetap ada (Graaff, 2005). Menurut Koswara (1992), tahap pembuatan kedelai bubuk meliputi sortasi untuk memisahkan kedelai yang baik, perendaman selama 8-16 jam, perebusan biji kedelai hingga 30 menit, penghilangan kulit ari, pengeringan dalam oven 50-60oC, penggilingan, dan pengayakan. Proses pemanasan pada pembuatan kedelai bubuk bertujuan untuk menghilangkan senyawa antinutrisi pada kedelai, sedangkan proses penggilingan dan pengayakan bertujuan untuk membuat biji kedelai menjadi bubuk sehingga lebih mudah untuk dikonsumsi. Selain kedelai yang ditepungkan minuman bubuk kedelai juga dapat berupa susu kedelai yang dikeringkan. Susu kedelai diperoleh dengan cara penggilingan biji kedelai yang telah direndam dalam air kemudian disaring untuk mendapatkan filtrat dan dididihkan. Kemudian susu kedelai tersebut dilakukan pengeringan semprot (spray drying) untuk mendapatkan susu kedelai dalam bentuk bubuk (Koswara, 1992).
Kedelai dalam bentuk isolat protein kedelai banyak dimanfaatkan pada produk susu formula untuk bayi, khususnya bagi mereka yang tidak dapat mencerna laktosa, alergi, atau tidak menyukai susu sapi. Ketidakmampuan mencerna laktosa (lactose intolerance) terjadi karena kurangnya enzim laktase pada saluran pencernaan sehingga ketika mengkonsumsi susu sapi yang memiliki kadar laktosa sekitar 4.8% akan merasa kembung, sakit perut, diare, atau gangguan pencernaan lainnya (Rumin, 1992). Sedangkan alergi susu sapi merupakan suatu penyakit yang berdasarkan reaksi imunologis yang timbul sebagai akibat pemberian susu sapi atau makanan yang mengandung susu sapi. Alergi tersebut terjadi karena adanya sistem reaksi kekebalan tubuh yang abnormal terhadap protein yang terdapat dalam susu sapi. Sistem kekebalan tubuh bayi akan melawan protein yang terdapat dalam susu sapi sehingga gejala-gejala reaksi alergi pun akan muncul (Judarwanto, 2000). Pemberian susu formula dengan menggunakan kedelai menjadi salah satu alternatif untuk mengatasi masalah tersebut, karena selain bebas dari laktosa dan tidak menyebabkan gejala alergi bagi penderita alergi susu sapi, susu formula dengan kedelai juga memberikan kebutuhan protein dan kandungan gizi yang setara dengan susu sapi.
7
C.
Dekstrin
Dekstrin adalah produk hidrolisa zat pati, berbentuk zat amorf berwarna putih sampai kekuning-kuningan (SNI, 1992). Dekstrin merupakan produk degradasi pati yang dapat dihasilkan dengan beberapa cara yaitu memperlakukan suspensi pati dalam air dengan asam atau enzim pada kondisi tertentu atau degradasi pati dalam bentuk kering dengan menggunakan perlakuan panas atau kombinasi antara panas dan asam atau katalis lain. Dekstrin mempunyai rumus kimia (C6H10O5)n.
Berdasarkan reaksi warnanya dengan iodin, dekstrin dapat diklasifikasikan menjadi amilodekstrin, eritrodekstrin dan akrodekstrin. Pada tahap awal hidrolisis, akan dihasilkan amilodekstrin yang masih memberikan warna biru bila direaksikan dengan iodin. Bila hidrolisis dilanjutkan akan dihasilkan eritrodekstrin yang akan memberikan warna merah kecoklatan bila direaksikan dengan iodin. Sedangkan pada tahap akhir hidrolisis, akan dihasilkan akrodekstrin yang tidak memberikan warna bila direaksikan dengan iodin (Doublier dan Cuvelier, 2006).
Pada prinsipnya, pembuatan dekstrin dilakukan dengan memotong rantai panjang pati dengan katalis asam atau enzim menjadi molekul-molekul yang berantai pendek. Menurut Doublier dan Cuvelier (2006), dekstrin dapat dihasilkan dari hidrolisa pati dengan enzim-enzim tertentu atau dengan hidrolisis pati secara basah yang dikatalis dengan asam. Dekstrin mengandung dua bentuk polimer D-glukosa, yaitu linier (amilosa) dan bercabang (amilopektin), mempunyai sifat sangat larut dalam air dingin atau panas, dengan viskositas yang relatif rendah. Dekstrin memiliki struktur molekul yang lebih pendek dan lebih bercabang dibandingkan dengan pati. Struktur yang lebih pendek ini mengakibatkan dekstrin mempunyai sifat mudah larut dalam air (Tharanathan, 2002).
Dekstrin umumnya ditambahkan sebagai bahan pengisi dengan tujuan untuk meningkatkan jumlah total padatan dalam larutan. Peningkatan jumlah total padatan terutama pada produk cair yang dikeringkan diperlukan karena kandungan air yang sangat tinggi. Semua jenis pati dapat digunakan sebagai bahan baku dalam pembuatan dekstrin. Namun perlu diperhatikan bahwa sifat dasar pati akan mempengaruhi sifat dan mutu dekstrin yang dihasilkan (Tharanathan, 2002).
Maltodekstrin merupakan jenis dari dekstrin yang banyak dimanfaatkan pada produk bubuk. Selain maltodekstrin dikenal juga sirup glukosa padat yang juga merupakan hasil hidrolisis pati. Maltodekstrin didefinisikan sebagai produk hidrolisis pati yang mengandung α-D-glukosa unit yang sebagian besar terikat melalui ikatan (1-4) glikosidik dengan DE kurang dari 20. Maltodekstrin banyak digunakan dalam industri pangan sebagai bahan pengisi. Pada umumnya maltodekstrin sedikit berasa dan berbau, namun maltodekstrin dengan DE kurang dari 20 menghasilkan rasa yang manis. Maltodekstrin dapat diaplikasikan pada makanan low callory atau khusus untuk diet. Penambahan maltodekstrin dalam jumlah besar tidak akan meningkatkan kemanisan produk seperti halnya gula (Kennedy et al., 1995).
D.
Oligosakarida
Oligosakarida didefinisikan berbeda-beda berdasarkan jumlah unit sakaridanya. Menurut Manning et al. (2004), oligosakarida disebut juga sebagai rantai pendek polisakarida, yaitu kelompok gula dengan 2 hingga 20 unit sakarida seperti sukrosa, stakiosa, rafinosa, fruktooligosakarida, dan galaktooligosakarida. Sedangkan menurut Weijers et al. (2008), oligosakarida merupakan bagian dari polimer karbohidrat dengan berat molekul yang rendah dan mengandung molekul gula dengan 3 hingga 10 unit sakarida. Sako et al. (1999) menambahkan bahwa senyawa oligosakarida terdiri dari susunan monosakarida seperti glukosa, galaktosa, xylosa, dan fruktosa, serta memiliki berat molekul yang lebih rendah dibandingkan polisakarida.
8 trisakarida terdiri dari tiga buah, tetrasakarida terdiri dari empat buah dan seterusnya. Oligosakarida juga terdiri dari dua jenis, yaitu homooligosakarida dan heterooligosakarida. Homooligosakarida adalah tipe oligosakarida yang tersusun dari hanya satu jenis monosakarida seperti maltooligosakarida (MOS) yang tersusun dari glukosa, sedangkan heterooligosakarida terdiri dari dua atau lebih jenis monosakarida seperti fruktooligosakarida (FOS) dan galaktooligosakarida (GOS). Oligosakarida sangat mudah larut di dalam air dan pelarut polar lainnya (Patel dan Goyal, 2011).
Oligosakarida mempunyai tingkat kemanisan sebesar 0.3-0.6 kali dibandingkan sukrosa sehingga sering digunakan sebagai pengganti sukrosa atau sebagai bulking agent. Oligosakarida juga banyak dimanfaatkan sebagai humektan karena kemampuan oligosakarida dalam menjaga kelembaban tanpa meningkatkan kandungan airnya (Patel dan Goyal, 2011). Berdasarkan kemampuannya untuk dicerna, oligosakarida merupakan kelompok karbohidrat yang tidak dapat dicerna oleh tubuh manusia. Oligosakarida tidak dapat dihidrolisis dan diserap usus halus, karena mokusa mamalia tidak memiliki enzim pencernaan untuk oligosakarida (α-galaktosidase) (Muchtadi, 1989), tetapi bakteri seperti bifidobakteria dan laktobasili memiliki enzim pencernaan untuk mencerna oligosakarida menjadi komponen volatil seperti gas hidrogen dan metana.
Menurut Rupérez (2006), manusia tidak memiliki enzim α -galaktosidase yang dibutuhkan untuk memutuskan ikatan galaktosidik pada oligosakarida, sehingga oligosakarida yang dikonsumsi tidak dapat dicerna. Pada saluran pencernaan, oligosakarida tersebut difermentasi oleh bakteri yang menguntungkan seperti bifidobakteri yang memiliki enzim untuk mencernanya. Hasil fermentasi tersebut berupa gas seperti karbon dioksida, hidrogen, metana, dan asam lemak rantai pendek lainnya. Walaupun keberadaan gas tersebut cukup mengganggu karena dapat menyebabkan flatulensi, namun aktivitas bakteri tersebut dapat memberikan efek yang menguntungkan pada saluran pencernaan yaitu dapat meningkatkan sistem imun tubuh dan menekan pertumbuhan bakteri patogen.
Berbagai penelitian telah dilakukan berhubungan dengan pengaruh oligosakarida dalam tubuh. Menurut Tomomatsu (1994) oligosakarida dapat mempengaruhi pertumbuhan bakteri baik dalam saluran pencernaan, serta mencegah kanker dan menurunkan kolesterol darah. Nzeussea et al.
(2006) menambahkan bahwa oligosakarida juga berperan dalam mengatur respon imun tubuh dan meningkatkan penyerapan mineral.
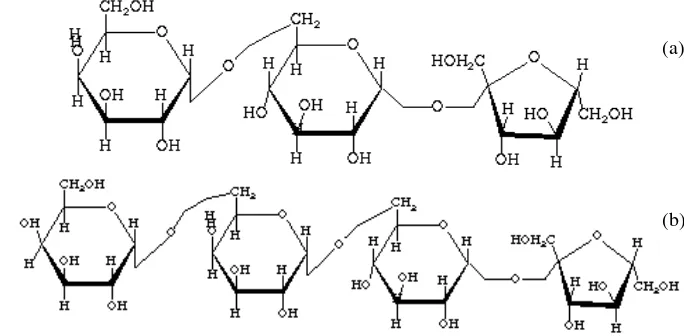
9 Gambar 2. Struktur molekul rafinosa (a) dan stakiosa (b)
(Anonim, 2005)
Menurut Chen et al. (2000) rafinosa dan stakiosa pada kedelai digolongkan kedalam Soybean Meal Oligosaccharides (SMO) yang mempunyai struktur molekul (galaktosa)n–glukosa–fruktosa.
Rafinosa dan stakiosa pada kedelai dapat menekan pertumbuhan bakteri patogen dalam saluran pencernaan dengan meningkatkan pertumbuhan bakteri menguntungkan seperti bifidobakteri, mengurangi stress oksidatif yang dapat menyebabkan kanker, serta mengurangi resiko penyakit jantung. Tenorio et al. (2010) melaporkan konsumsi stakiosa dan rafinosa dari kedelai sebanyak 120 mg/hari pada tikus dapat berperan sebagai prebiotik dan dapat meningkatkan penyerapan mineral seperti kalisum dan magnesium.
E.
HPLC (
High Performance Liquid Chromatography)
Kromatografi merupakan suatu pemisahan komponen secara fisik dengan unsur-unsur yang akan dipisahkan terdistribusikan antara dua fase, satu dari fase-fase ini membentuk suatu lapisan stasioner dengan luas permukaan yang besar, sedangkan fase lainnya merupakan fase diam yang dilewati oleh fase gerak. Berdasarkan jenis fase gerak dan diamnya, kromatografi dibedakan menjadi empat jenis, yaitu cair-padat, gas-padat, cair-cair, dan gas-cair (Jenke, 2005). HPLC merupakan salah satu jenis kromatografi yang tergolong dalam cair-cair karena fase gerak dan fase diamnya menggunakan zat cair.
Prinsip dari HPLC adalah pemisahan dengan baik dimana fase cair yang bergerak mengalir secara perlahan melewati kolom yang berisi fase diam. Pergerakan terjadi akibat adanya gravitasi. Pada metode HPLC digunakan kolom tabung gelas dengan diameter yang sesuai. Partikel dengan dimensi yang bervariasi digunakan sebagai penunjang stasioner. Pada umumnya HPLC menggunakan kolom dengan diameter kecil, yaitu sekitar 2-8 mm, sedangkan laju aliran diperbesar dan tekanan yang tinggi (Khopkar, 2003).
Sistem kerja HPLC terdiri dari beberapa bagian, yaitu sistem eluen, sistem tekanan, injeksi contoh, kolom, dan sistem deteksi. Sistem eluen pada HPLC dapat menggunakan berbagai jenis pelarut seperti air, metanol, atau pelarut lainnya. Eluen yang digunakan dapat berupa pelarut tunggal atau campuran dari dua atau lebih pelarut. Keadaan ini menyebabkan terdapat dua jenis elusi yaitu elusi isokratik jika tidak mengalami perubahan konsentrasi dan elusi gradien jika terdapat perubahan konsentrasi. Sistem tekanan menggunakan pompa bertekanan tinggi, yaitu dapat mencapai tekanan hingga 6000 psi serta dapat mengantarkan laju alir sebesar 0.01-1.0 atau 0.1-20 ml/menit.
(a)
10 Sistem injeksi pada HPLC menggunakan syringe dengan volume 5-50 µl. Terdapat dua jenis kolom, yaitu kolom pelindung (guard coloum) dan kolom pemisah. Kolom pelindung berfungsi untuk menyaring zat pengotor yang dapat menyumbat kolom pemisah. Kolom pelindung sering mengandung bahan yang serupa dengan kolom pemisah tetapi dengan ukuran butiran yang lebih keras dan besar (20-40 µm). Sedangkan kolom pemisah merupakan kolom utama dalam memisahkan komponen dalam sampel. Sistem deteksi pada HPLC terdapat beberapa jenis seperti detektor ultraviolet, detektor
11
III.
METODE PENELITIAN
A.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah kedelai, isolat protein kedelai, kedelai yang ditambahkan dekstrin, serta dua puluh produk minuman bubuk komersial berbasis kedelai, sedangkan bahan kimia yang digunakan untuk analisa oligosakarida adalah standar rafinosa (Sigma), standar stakiosa (Sigma), standar glukosa (Merck), standar sukrosa (Merck), standar fruktosa (Merck), heksana (Merck), etanol (Merck), air HPLC grade (Merck), acetonitril (Merck), gas N2, iodin, KI, dan
aquades. Alat yang digunakan pada penelitian ini adalah HPLC Agylent yang dilengkapi dengan degasser (model G1322A Agilent), pompa solvent (model G1310A Agilent), dan detektor refractive index (model G1362A Agilent), kolom HPLC untuk karbohidrat (ZORBAX Carbohydrate Analysis Columns) berukuran 5 m × 4.6 mm × 150 mm (Agilent), vacuum rotary evaporator, magnetic stirrer, kertas Whatman#41, membrane filter 0,45-µ m nylon, erlenmeyer, buret, gelas piala, neraca analitik, pipet tetes, penjepit cawan (gegep), cawan porselen, tabung reaksi, penangas air, gelas ukur, labu takar 10 ml, labu takar 50 ml, labu takar 100 ml, desikator, dan oven tanur.
B.
Metode Penelitian
Penelitian ini terdiri dari empat tahapan. Tahap pertama adalah persiapan sampel. Tahap kedua adalah melakukan validasi metode HPLC yang meliputi linieritas, penentuan limit of detection
(LOD), penentuan limit of quantification (LOQ), dan penentuan persenrecovery. Tahap ketiga adalah analisis kadar oligosakarida pada dua puluh minuman bubuk komersial berbasis kedelai dengan menggunakan metode HPLC dan tahap terakhir adalah analisis data.
1.
Persiapan sampel
Tahap awal dari persiapan sampel adalah mendata sebanyak-banyaknya minuman bubuk berbasis kedelai yang dijual di Indonesia. Tahap selanjutnya adalah mensurvei keberadaan produk-produk tersebut di pasaran. Survei dilakukan di Bogor, Semarang, dan Jakarta. Tahap selanjutnya adalah memilih sampel untuk penelitian hingga akhirnya terpilih dua puluh sampel. Sampel-sampel terpilih tersebut kemudian digolongkan berdasarkan usia konsumen, yaitu sampel yang ditujukan untuk konsumen diatas 3 tahun, untuk konsumen 1-3 tahun, dan untuk konsumen 0-1 tahun.
12
2.
Validasi metode HPLC
a.
Linearitas
Linearitas adalah kemampuan metode analisis yang memberikan respon yang secara langsung serta proporsional terhadap konsentrasi analit dalam sampel. Linieritas dinyatakan sebagai koefisien korelasi dari kurva standar (Harmita, 2004). Menurut Epshtein (2004) pembuatan kurva standar dilakukan dengan membuat stock standar dengan konsentrasi tertentu. Kemudian dilakukan pengenceran untuk konsentrasi standar berikutnya, sehingga diperoleh deret standar dengan konsentrasi yang berbeda. Selanjutnya deret standar tersebut dianalisis sehingga didapat kurva hubungan konsentrasi dan respon detektor. Linieritas dinyatakan sebagai koefisien korelasi dari kurva standar.
Menurut Papadoyanis dan Samanidou (2005), linieritas pada HPLC dapat ditentukan dengan melakukan tiga sampai enam kali injeksi pada lima atau lebih seri konsentrasi standar yang digunakan. Konsentrasi yang digunakan dapat berkisar antara 80-120% dari konsentrasi yang diharapkan, atau 50-150%, bahkan dapat dilakukan dengan 25-125%.
b.
Penentuan
limit of detection
(LOD) dan
limit of quantification
(LOQ)
Limit of detection (LOD) atau batas deteksi merupakan konsentrasi terendah dari suatu analit yang masih dapat dideteksi, sedangkan limit of quantification (LOQ) atau batas kuantitas adalah konsentrasi terendah dari suatu analit yang dapat diukur secara tepat dan teliti (Jenke, 2005). Menurut Epshtein (2004) LOD merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan, sedangkan LOQ merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama. LOD dan LOQ dapat diukur berdasarkan nilai standar deviasi dari konsentrasi terendah.
c.
Penentuan
persen recovery
Penentuan persen recovery bertujuan untuk mengetahui berapa banyak komponen yang dianalisis dapat hilang akibat proses preparasi, sehingga dapat menyatakan keakuratan metode yang digunakan. Semakin besar persen recovery, artinya semakin sedikit komponen yang hilang akibat preparasi yang dilakukan sehingga hasil yang diperoleh lebih akurat. Menurut Epshtein (2004) penentuan persen recovery dapat dilakukan dengan menambahkan sejumlah tertentu analit ke dalam sampel kemudian diperiksa dengan menggunakan metode analisis. Hasil tersebut kemudian dibandingkan dengan hasil analisis tanpa penambahan analit. Persen recovery dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya.
3.
Ekstraksi oligosakarida
Analisis oligosakarida dilakukan pada 20 produk minuman bubuk komersial berbasis kedelai. Selain itu dilakukan juga simulasi analisis oligosakarida pada bahan utama yang biasa digunakan pada produk-produk komersial, yaitu bubuk kedelai, isolat protein kedelai, serta bubuk kedelai yang ditambahkan dekstrin komersial. Pengujian pada 20 produk komersial dilakukan pada dua batch
produksi yang berbeda dengan dua kali ulangan. Hasil analisis tersebut kemudian dibandingkan dan dianalisis dengan menggunakan uji independent t-test pada program SPSS untuk mengetahui hasilnya berbeda nyata atau tidak.
13 tersebut berupa monosakarida, disakarida, dan oligosakarida. Ekstrasi dengan etanol 70% dilakukan pada suhu 70oC selama 1 jam, kemudian hasil ekstrak tersebut dianalisis dengan menggunakan HPLC.
4.
Analisis HPLC
Oligosakarida tepung kedelai yang telah diisolasi kemudian dianalisis dengan menggunakan HPLC. HPLC yang digunakan dilengkapi dengan peralatan sebagai berikut :
1. degasser (model G1322A Agilent), pompa solvent (model G1310A Agilent), dan detektor
refractive index (model G1362A Agilent).
2. Kolom (ZORBAX Carbohydrate Analysis Columns) berukuran 5 m × 4.6 mm × 150 mm yang dilapisi dengan 3-aminopropylsilane pada partikel silica.
3. Fase gerak yang digunakan adalah campuran dari acetonitrile dan air (75:25) dengan kecepatan aliran 1.5 ml/menit.
4. Standar pada pengujian oligosakarida adalah rafinosa dan stakiosa dari Sigma, serta standar gula sederhana berupa fruktosa, glukosa, dan sukrosa dari Merck.
5.
Uji kualitatif dekstrin
Uji kulitatif dekstrin dilakukan untuk mengetahui secara kualitatif apakah terdapat komponen dekstrin pada sampel. Hal ini dilakukan karena diduga terdapat beberapa sampel yang menambahkan dekstrin pada produknya namun tidak menyebutkannya dalam komposisi produk. Sampel yang mengandung dekstrin atau diduga mengandung dekstrin akan menghasilkan peak rafinosa yang besar sehingga dibutuhkan perhitungan tertentu untuk mengetahui komponen rafinosa yang sesungguhnya.
6.
Perhitungan kadar rafinosa pada sampel yang mengandung dekstrin atau
diduga mengandung dekstrin
Sampel yang mengandung dekstrin adalah sampel yang pada label kemasan mencantumkan dekstrin/maltodekstrin sebagai komposisinya, sedangkan sampel yang diduga mengandung dekstrin adalah sampel yang pada label kemasan tidak mencantumkan dekstrin/meltodekstrin sebagai komposisinya, namun berdasarkan uji kualitatif dekstrin dan hasil pembacaan HPLC diperoleh adanya kandungan dekstrin didalamnya.
Pada sampel yang mengandung dekstrin atau diduga mengandung dekstrin, kadar rafinosa yang diperoleh sangat besar, hal ini dikarenakan adanya kandungan dekstrin yang memiliki berat molekul yang sama dengan rafinosa sehingga menutupi peak rafinosa ketika dianalisis dengan HPLC. Oleh karena itu diperlukan perhitungan untuk menduga kadar rafinosa yang ada pada sampel tanpa pengaruh dari komponen dekstrin.
7.
Analisis data
14
C.
Prosedur Analisis
1.
Linearitas (Epshtein, 2004)
Menurut Epshtein (2004) penentuan linearitas dapat dilakukan dengan enam konsentrasi yang berbeda. Standar yang digunakan adalah rafinosa dan stakiosa. Penentuan konsentrasi standar dilakukan berdasarkan keterangan pada panduan penggunaan kolom HPLC. Keterangan tersebut menunjukkan kemampuan kolom dalam membaca standar. Konsentrasi standar rafinosa yang digunakan adalah 8.66 mg/ml sedangkan pada standar stakiosa sebesar 8.77 mg/ml. Konsentrasi tersebut kemudian dilakukan pengenceran sehingga diperoleh enam seri konsentarsi standar.
Larutan stock rafinosa dibuat dengan menimbang sebanyak 8.66 mg standar rafinosa kemudian ditepatkan dalam labu takar 10 ml dengan larutan acetoniril:air (1:1). Larutan stock stakiosa dibuat dengan dengan menimbang sebanyak 8.77 mg standar stakiosa kemudian ditepatkan dalam labu takar 10 ml dengan larutan acetoniril:air (1:1). Larutan stock tersebut kemudian dilakukan pengenceran dengan perbandingan 1:3, 1:2, 1:1, 2:1, dan 3:1 dengan larutan acetoniril:air (1:1) untuk membuat seri pengenceran pada standar rafinosa dan stakiosa. Sebanyak 20 l larutan dari setiap seri pengenceran standar dianalisis dengan HPLC dengan tiga kali ulangan untuk setiap konsentrasi. Linearitas ditentukan menggunakan metode regresi kuadrat linear dari kurva hubungan luas area dengan konsentrasi standar. Persamaan linearitas yang digunakan adalah y = a + bx dengan y
merupakan luas area dan x merupakan konsentrasi standar.
2.
Penentuan LOD dan LOQ (Epshtein, 2004)
Penentuan LOD dan LOQ dilakukan dengan mengukur respon detektor terhadap konsentrasi terendah sebanyak tujuh kali ulangan, kemudian ditentukan standar deviasi dari ulangan tersebut dan dilakukan perhitungan LOD dengan persamaan (2.1) dan LOQ dengan persamaan (2.2).
LOD = 3 x standar deviasi LOQ = 10 x standar deviasi
3.
Penentuan
persen recovery
(Epshtein, 2004)
Menurut Epshtein (2004) penentuan persen recovery dapat dilakukan dengan menambahkan sejumlah tertentu analit ke dalam sampel kemudian diperiksa dengan menggunakan metode analisis. Sebanyak 15 mg standar rafinosa dan 14 mg standar stakiosa ditambahkan ke dalam 2 gram isolat protein kedelai. Sampel tersebut kemudian dilakukan ekstraksi oligosakarida dan dianalisis dengan menggunakan HPLC. Selanjutnya persen recovery ditentukan dengan persamaan (3.1).
100%
Keterangan : A = konsentrasi standar pada sampel yang ditambahkan standar (mg/g) B = konsentrasi standar pada sampel tanpa penambahan standar (mg/g) C = konsentrasi standar yang ditambahkan (mg/g)
4.
Analisis kadar air metode oven (AOAC Official Method. 925.10, 2005)
Cawan aluminium kosong dikeringkan dalam oven suhu 105oC selama 15 menit lalu didinginkan dalam desikator selama 5 menit atau sampai tidak panas lagi. Cawan ditimbang dan dicatat beratnya. Sejumlah sampel (1 gram) dimasukkan ke dalam cawan kosong yang telah diketahui (2.1) (2.2)
15 beratnya. Cawan beserta isi dikeringkan di dalam oven bersuhu 1050C. Pengeringan dilakukan sampai diperoleh bobot konstan. Setelah dikeringkan, cawan dan isinya didinginkan di dalam desikator, ditimbang berat akhirnya, dan dihitung kadar airnya dengan persamaan (4.1).
% 100%
Keterangan : x = berat cawan dan sampel sebelum dikeringkan (g) y = berat cawan dan sampel setelah dikeringkan (g) a = berat cawan kosong (g)
5.
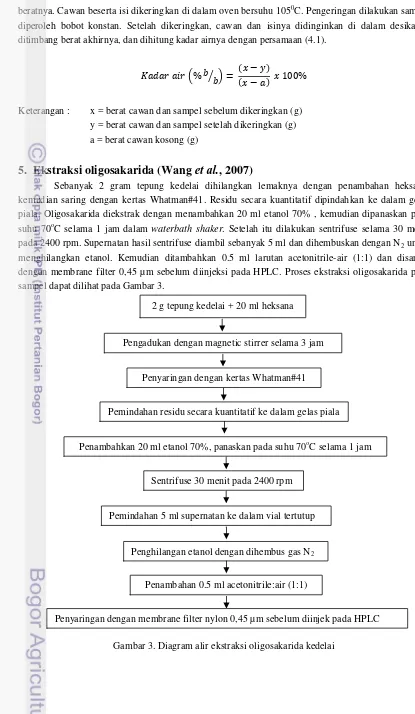
Ekstraksi oligosakarida (Wang
et al.
, 2007)
Sebanyak 2 gram tepung kedelai dihilangkan lemaknya dengan penambahan heksana, kemudian saring dengan kertas Whatman#41. Residu secara kuantitatif dipindahkan ke dalam gelas piala. Oligosakarida diekstrak dengan menambahkan 20 ml etanol 70% , kemudian dipanaskan pada suhu 70oC selama 1 jam dalam waterbath shaker. Setelah itu dilakukan sentrifuse selama 30 menit pada 2400 rpm. Supernatan hasil sentrifuse diambil sebanyak 5 ml dan dihembuskan dengan N2 untuk
menghilangkan etanol. Kemudian ditambahkan 0.5 ml larutan acetonitrile-air (1:1) dan disaring dengan membrane filter 0,45 µ m sebelum diinjeksi pada HPLC. Proses ekstraksi oligosakarida pada sampel dapat dilihat pada Gambar 3.
Gambar 3. Diagram alir ekstraksi oligosakarida kedelai 2 g tepung kedelai + 20 ml heksana
Pengadukan dengan magnetic stirrer selama 3 jam
Penambahkan 20 ml etanol 70%, panaskan pada suhu 70oC selama 1 jam Penyaringan dengan kertas Whatman#41
Pemindahan residu secara kuantitatif ke dalam gelas piala
Penyaringan dengan membrane filter nylon 0,45 µ m sebelum diinjek pada HPLC Penambahan 0.5 ml acetonitrile:air (1:1)
Penghilangan etanol dengan dihembus gas N2
Pemindahan 5 ml supernatan ke dalam vial tertutup Sentrifuse 30 menit pada 2400 rpm
16
6.
Uji kualitatif dekstrin (SNI 01-2593–1992)
Uji kualitatif dekstrin dilakukan dengan uji warna pada larutan lugol sesuai dengan SNI 01 - 2593 – 1992 tentang dekstrin pada industri pangan. Warna yang terjadi tergantung dari komposisi dekstrin. Pada umumnya akan menghasilkan warna ungu kecoklat-coklatan. Larutan lugol dibuat dengan menimbang 50 g iodin (I2) dan 100 g KI. Kemudian dilarutkan dalam 100 ml air suling.
Setelah larut diencerkan menjadi 1000 ml. Sebanyak 0.5 g contoh dimasukkan ke dalam erlenmeyer 100 ml. Kemudian ditambah 25 ml air suling dan ditetesi dengan larutan lugol, dan diamati perubahan warna yang terjadi.
7.
Perhitungan kadar rafinosa pada sampel yang mengandung dekstrin atau
diduga mengandung dekstrin
Perhitungan dilakukan dengan menggunakan perbandingan rafinosa dan stakiosa pada bahan baku yang digunakan yaitu kedelai atau isolat protein kedelai. Peak stakiosa pada pembacaan HPLC tidak terpengaruh dengan adanya komponen dekstrin, sehingga dapat digunakan untuk menduga kandungan rafinosa yang tertutupi oleh dekstrin. Hal ini dilakukan dengan asumsi perbandingan rafinosa dan stakiosa dari kedelai atau isolat protein kedelai adalah tetap. Perhitungan kadar rafinosa pada sampel dilakukan dengan persamaan (7.1).
!
Keterangan : = kadar rafinosa kedelai atau isolat protein kedelai (mg/g) = kadar stakiosa kedelai atau isolat protein kedelai (mg/g) ! = kadar stakiosa sampel (mg/g)
8.
Perhitungan konsentrasi gula sederhana (Drenthe, 2004)
Gula sederhana seperti fruktosa, glukosa, dan sukrosa pada sampel kedelai atau minuman bubuk berbasis kedelai dapat dihitung berdasarkan perbandingan luas area dan konsentrasi standar gula. Sejumlah tertentu standar gula seperti fruktosa (15 mg), glukosa (57 mg), dan sukrosa (57 mg) dilarutkan dengan larutan acetonitril:air (1:1) ke dalam labu takar 10 ml, kemudian injeksikan ke dalam HPLC untuk melihat luas area yang diperoleh. Luas area tersebut kemudian dibandingkan dengan luas area pada sampel untuk memperoleh konsentrasi gula pada sampel. Menurut Drenthe (2004), menghitung konsentrasi suatu komponen pada sampel dengan menggunakan perbandingan luas area suatu kromatografi dapat dilakukan dengan persamaan (8.1).
" "
Keterangan: = konsentrasi sampel (mg/l)
" = konsentrasi standar (mg/l)
= luas area pada sampel (nRIU.s)
" = luas area pada standar (nRIU.s)
(7.1)
17
IV.
HASIL DAN PEMBAHASAN
A.
Persiapan Sampel
Persiapan sampel dilakukan dengan mendata sebanyak-banyaknya minuman bubuk berbasis kedelai yang dijual di pasaran (di seluruh Indonesia) melalui internet dan mendatangi supermarket serta apotek di daerah Bogor, Semarang, dan Jakarta. Pada tahap tersebut diperoleh sebanyak 33 sampel. Tahap selanjutnya adalah mensurvei keberadaan produk-produk tersebut di pasaran. Survei dilakukan di supermarket dan apotek di wilayah Bogor, Semarang, dan Jakarta. Tiga belas sampel akhirnya tidak dipilih karena sulit dijumpai di pasaran (pembelian harus melalui pemesanan terlebih dahulu) sehingga akhirnya tersisa dua puluh sampel yang digunakan pada penelitian.
Kedua puluh sampel tersebut kemudian digolongkan berdasarkan usia konsumen dan informasi pada label kemasan. Berdasarkan usia konsumen, sampel digolongkan menjadi konsumen diatas 3 tahun, 1-3 tahun, dan 0-1 tahun. Kemudian berdasarkan informasi pada label kemasan, konsumen usia diatas 3 tahun dibagi lagi menjadi konsumen golongan khusus dan konsumen biasa. Golongan khusus pada penelitian ini adalah sampel yang ditujukan untuk orang yang sedang berdiet dan balita yang sedang dalam masa pertumbuhan. Informasi tersebut diperoleh dari keterangan pada label kemasan. Sampel yang ditujukan untuk konsumen biasa sebanyak 8 sampel, konsumen khusus sebanyak 5 sampel, konsumen usia 1-3 tahun sebanyak 2 sampel, dan konsumen usia 0-1 tahun sebanyak 5 sampel. Daftar komposisi kedua puluh sampel pada penelitian ini dapat dilihat pada Lampiran 5.
B.
Validasi Metode HPLC
1.
Linieritas
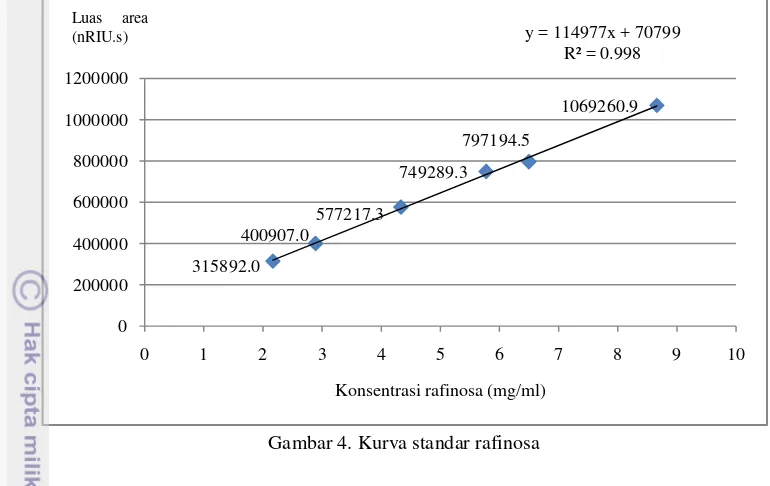
Linieritas menunjukkan kemampuan metode analisis untuk memperoleh hasil pengujian yang sesuai dengan konsentrasi analit dalam zat uji pada kisaran konsentrasi tertentu (AOAC, 2002). Uji linieritas dilakukan dengan cara membuat kurva hubungan antara konsentrasi standar dengan luas area yang dihasilkan. Larutan standar yang digunakan adalah rafinosa dan stakiosa dengan enam konsentrasi yang berbeda. Konsentrasi yang digunakan pada standar rafinosa adalah 2.16, 2.89, 4.33, 5.77, 6.50, dan 8.66 mg/ml sedangkan pada stakiosa adalah 2.19, 2.92, 4.38, 5.83, 6.58, dan 8.77 mg/ml. Linieritas dinyatakan dalam koefisien korelasi (r2) dari tiga ulangan yang dilakukan.
18 Gambar 4. Kurva standar rafinosa
Persamaan kurva standar stakiosa dapat dilihat pada gambar 5 yaitu y = 120993x + 67842 dengan koefisien korelasi (r2) sebesar 0.999. Koefisien korelasi yang dihasilkan pada standar stakiosa juga telah memenuhi persyaratan metode yang baik dari segi linieritas. Nilai kemiringan garis pada standar stakiosa yaitu sebesar 120993. Nilai kemiringan yang tinggi pada standar stakiosa menunjukkan tingkat sensitifitas yang tinggi pada pengukuran stakiosa dalam sampel, artinya perubahan konsentrasi stakiosa yang kecil akan sangat mempengaruhi sinyal detektor yang dihasilkan pada HPLC.
Gambar 5. Kurva standar stakiosa
315892.0 400907.0
577217.3
749289.3 797194.5
1069260.9 y = 114977x + 70799
R² = 0.998
0 200000 400000 600000 800000 1000000 1200000
0 1 2 3 4 5 6 7 8 9 10
Konsentrasi rafinosa (mg/ml)
338353.5 403306.7
607089.3
780268.0 869088.4
1120426.6 y = 120993x + 67842
R² = 0.999
0.0 200000.0 400000.0 600000.0 800000.0 1000000.0 1200000.0
0 1 2 3 4 5 6 7 8 9 10
Konsentrasi stakiosa (mg/ml)
Luas area
(nRIU.s)
Luas area
19
2.
Penentuan LOD dan LOQ
LOD (limit of detection) atau limit deteksi ditentukan untuk mengetahui konsentrasi analit terendah yang dapat diukur dan dapat dibedakan pada suatu alat analisis. Sedangkan LOQ (limit of quantification) atau limit kuantifikasi ditentukan untuk mengetahui konsentrasi terendah yang dapat ditentukan oleh suatu metode pada tingkat ketelitian dan ketepatan yang baik (Jenke, 2005). LOD dan LOQ dapat ditentukan berdasarkan simpangan baku dari respon detektor terhadap konsentrasi terendah.
Tabel 5. LOD dan LOQ pada standar rafinosa
Ulangan Luas Area(nRIU.s) Konsentrasi (mg/ml)
1 319700.0 2.16
2 316046.5 2.13
3 307495.2 2.06
4 320039.3 2.17
5 313614.0 2.11
6 315900.0 2.13
7 312075.0 2.10
Standar Deviasi 0.04
LOD 0.11
LOQ 0.38
Penentuan LOD dan LOQ pada rafinosa dapat dilihat pada Tabel 5. Konsentrasi yang digunakan adalah konsentrasi terendah dari seri konsentrasi rafinosa yang digunakan, yaitu 2.16 mg/ml. Pengulangan sebanyak tujuh kali terhadap sinyal detektor diperoleh LOD pada rafinosa sebesar 0.11 mg/ml dan LOQ sebesar 0.38 mg/ml. Hal menandakan bahwa konsentrasi terendah rafinosa yang dapat terdeteksi pada HPLC yang digunakan adalah sebesar 0.11 mg/ml sedangkan konsentrasi rafinosa yang dapat terkuantifikasi adalah 0.38 mg/ml.
Tabel 6. LOD dan LOQ pada standar stakiosa
Ulangan Luas Area(nRIU.s) Konsentrasi (mg/ml)
1 360732.6 2.44
2 334077.0 2.23
3 341325.4 2.29
4 307685.7 2.01
5 314457.3 2.07
6 320250.8 2.12
7 344360.7 2.31
Standar Deviasi 0.15
LOD 0.45
LOQ 1.52
20 menunjukkan bahwa konsentrasi terendah stakiosa yang dapat terdeteksi pada HPLC yang digunakan adalah sebesar 0.45 mg/ml sedangkan konsentrasi stakiosa yang dapat terkuantifikasi adalah 1.52 mg/ml.
Menurut Papadoyannis dan Samanidou (2005), sinyal standar masih dapat dibedakan pada konsentrasi terendah berupa nilai limit deteksi, namun tidak dapat dibedakan lagi jika konsentrasinya lebih rendah dari limit deteksi dan akan memiliki ketelitian yang kurang baik jika konsentrasinya lebih rendah dari limit kuantifikasi. Dalam hal ini, rafinosa tidak dapat dibedakan lagi jika konsentrasi pada sampel lebih kecil dari 0.11 mg/ml dan sebesar 0.45 mg/ml pada stakiosa, dan akan memberikan ketelitian yang kurang baik jika konsentrasi rafinosa pada sampel sebesar 0.38 mg/ml dan 1.52 mg/ml pada stakiosa.
3.
Penentuan
persen recovery
Menurut Papadoyannis dan Samanidou (2005), persen recovery (perolehan kembali) merupakan jumlah standar yang dapat diperoleh kembali akibat proses persiapan sampel, yaitu dilakukan dengan menambahkan sejumlah tertentu analit ke dalam matriks sampel, kemudian nilai yang dihasilkan dibandingkan dengan matriks sampel tanpa penambahan analit yang dilakukan dengan metode atau persiapan yang sama. Persen recovery dapat menggambarkan ketepatan suatu metode, yaitu dengan melihat seberapa banyak analit yang dapat terukur akibat proses preparasi yang dilakukan. Semakin besar persen recovery yang diperoleh semakin baik metode yang dilakukan, artinya ketepatannya semakin baik.
Penentuan persen recovery pada sampel dilakukan dengan menambahkan sejumlah tertentu standar rafinosa dan stakiosa yang digunakan ke dalam isolat protein kedelai kemudian dilakukan ekstraksi oligosakarida. Penentuan persen recovery dapat dilihat pada Tabel 7. Persen recovery yang diperoleh pada standar rafinosa sebesar 84.88%, sedangkan pada standar stakiosa sebesar 89.03%. Menurut Papadoyannis dan Samanidou (2005), persen recovery pada validasi HPLC yang baik berada pada kisaran 80%-120% dari target analit yang diharapkan, sehingga dapat dikatakan bahwa metode ini mempunyai persen recovery yang baik.
Tabel 7. Persenrecovery pada standar rafinosa dan stakiosa
Sampel Rafinosa (mg/g) Stakiosa (mg/g)
Isolat protein kedelai 0.77 ± 0.21 0.83 ± 0.07
Isolat protein kedelai+rafinosa+stakiosa 7.14 ± 0.63 7.06 ± 1.86
persenrecovery(%) 84.88 89.03
C.
Analisis Oligosakarida
1.
Analisis gula sederhana dan oligosakarida pada kedelai, isolat protein
kedelai, dan dekstrin
21 memberikan efek yang menguntungkan bagi kesehatan. Chen et al. (2000) melaporkan oligosakarida pada kedelai atau produk olahan kedelai dapat meningkatkan populasi bifidobakteria pada kolon sehingga dapat menurunkan perkembangan bakteri patogen dan mencegah kanker kolon, meningkatkan penyerapan mineral (Nzeusseu et al., 2006), menurunkan kadar racun dan enzim yang mengganggu, menjaga fungsi liver, menurunkan tekanan darah, dan juga dapat berperan sebagai antikanker (Pool-zobel et al., 2002). Pada kedelai kandungan oligosakaridanya dapat mencapai 5% dari berat kering. Kandungan oligosakarida pada kedelai terdiri dari stakiosa (3.10-5.70%), rafinosa (0.50-0.74%), dan verbaskosa (0.12-0.20%) (Grieshop et al., 2003).
Pengukuran kadar oligosakarida pada sampel dilakukan dengan menggunakan HPLC, yaitu dengan melihat luas area peak yang dihasilkan pada waktu retensi yang sesuai dengan standar yang digunakan, yaitu rafinosa dan stakiosa. Luas area yang diperoleh kemudian dikonversi menjadi konsentrasi dengan menggunakan persamaan kurva standar rafinosa dan stakiosa yang diperoleh pada tahap validasi. Persamaan kurva standar yang digunakan adalah y = 114977x + 70799 untuk rafinosa dan y = 120993x + 67842 untuk stakiosa, dimana x menunjukkan konsentrasi rafinosa atau stakiosa dan y menunjukkan luas area peak pada pembacaan HPLC.
Sebelum dilakukan analisis pada dua puluh produk minuman bubuk berbasis kedelai, dilakukan simulasi pada bahan utama yang biasa digunakan pada produk-produk komersial, yaitu bubuk kedelai, isolat protein kedelai, serta bubuk kedelai yang ditambahkan dekstrin komersial. Analisis tersebut bertujuan untuk mengetahui kandungan gula sederhana dan oligosakarida pada bahan baku yang biasa digunakan sebelum diolah menjadi produk minuman bubuk. Penggunaan bahan utama tersebut pada suatu produk disesuaikan dengan target konsumen atau fungsi dari produk tersebut. Produk yang menggunakan bubuk kedelai, pada umumnya ditujukan untuk konsumen dewasa, sedangkan produk yang menggunakan isolat protein kedelai ditujukan untuk konsumen bayi yang memerlukan asupan protein yang tinggi. Isolat protein kedelai juga digunakan pada produk yang ditujukan untuk konsumen khusus seperti orang yang sedang diet atau ibu hamil. Beberapa produk khususnya untuk konsumen bayi juga menggunakan dekstrin pada komposisi produknya. Dekstrin merupakan hasil hidrolisis pati yang biasa ditambahkan pada produk susu sebagai sumber karbohidrat yang bertujuan untuk meningkatkan daya cerna karbohidrat. Menurut Judarwanto (2000), karbohidrat dalam bentuk pati terhidrolisis seperti dekstrin atau maltodekstrin, lebih mudah dicerna dan dapat ditoleransi oleh sistem pencernaan bayi yang terluka saat mengalami diare ataupun oleh sistem pencernaan bayi yang memang alergi terhadap susu sapi. Hasil analisis kandungan gula sederhana pada bahan utama tersebut dapat dilihat pada Tabel 8.
Tabel 8. Kandungan gula sederhana pada beberapa produk kedelai (berdasarkan basis kering)
Sampel Fruktosa (mg/g) Glukosa (mg/g) Sukrosa (mg/g)
Kedelai 1.91 ± 0.10 3.11 ± 0.11 42.77 ± 1.24
Isolat protein kedelai 0.38 ± 0.05 0.40 ± 0.05 6.63 ± 0.14
Kedelai+dekstrin I a ttd 28.81 11.64
Kedelai+dekstrin II a ttd 27.00 10.29
a
Perbandingan kedelai : dekstrin = 1 : 4
22 mg/g). Konsentrasi gula sederhana tersebut menurun pada isolat protein kedelai. Hal ini dikarenakan proses pengolahan kedelai menjadi isolat protein kedelai menghilangkan sebagian besar komponen gula pada kedelai. Hasil tersebut tidak jauh berbeda dengan penelitian Middelbos dan Fahey (2008) yang menunjukan bahwa kedelai mengandung fruktosa sebesar 2.90 mg/g, glukosa sebesar 2.95 mg/g, dan sukrosa sebesar 63.00 mg/g, serta hasil penelitian Wang et al. (2007) yang menunjukan bahwa kedelai masih mengandung monosakarida berupa fruktosa dan glukosa sebesar 0.14 mg/g dan sukrosa sebesar 43.10 mg/g. Pada kedelai+dekstrin, konsentrasi glukosanya mengalami peningkatan, namun konsentrasi sukrosanya menurun dan tidak terdeteksi adanya fruktosa. Menurut Chaplin dan Buckle (1990) dekstrin merupakan hasil hidrolisis pati oleh enzim menjadi molekul sederhana dan mutunya ditentukan oleh tingkat konversi pati menjadi komponen gula-gula pereduksi seperti glukosa dan maltosa. Sehingga penambahan senyawa dekstrin pada kedelai akan meningkatkan kandungan gula-gula pereduksi seperti glukosa.
Tabel 9. Kandungan oligosakarida pada beberapa produk kedelai (berdasarkan basis kering)
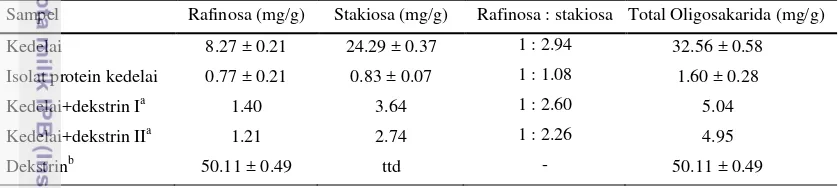
Sampel Rafinosa (mg/g) Stakiosa (mg/g) Rafinosa : stakiosa Total Oligosakarida (mg/g)
Kedelai 8.27 ± 0.21 24.29 ± 0.37 1 : 2.94 32.56 ± 0.58
Isolat protein kedelai 0.77 ± 0.21 0.83 ± 0.07 1 : 1.08 1.60 ± 0.28
Kedelai+dekstrin Ia 1.40 3.64 1 : 2.60 5.04
Kedelai+dekstrin IIa 1.21 2.74 1 : 2.26 4.95
Dekstrinb 50.11 ± 0.49 ttd - 50.11 ± 0.49
a Perbandingan kedelai : dekstrin = 1 : 4
b
Komponen dekstrin terbaca sebagai rafinosa
Tabel 9 menunjukkan kandungan oligosakarida pada bahan utama produk. Kandungan oligosakarida pada bubuk kedelai sebesar 32.56±0.58 mg/g, sedangkan kandungan oligosakarida pada isolat protein kedelai jauh lebih rendah yaitu sebesar 1.60±0.28 mg/g dengan ± merupakan standar deviasi dari 2 kali ulangan duplo. Kandungan oligosakarida pada isolat protein kedelai jauh lebih rendah karena isolat protein kedelai merupakan bentuk olahan kedelai yang mengandung protein lebih besar dari 90% berdasarkan berat keringnya (Endres, 2001). Isolat protein kedelai hampir bebas dari karbohidrat, lemak, dan serat sehingga kandungan oligosakaridanya pun sangat kecil.
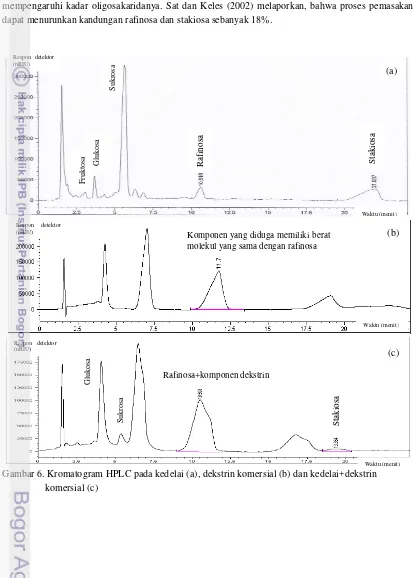
Kedelai yang ditambahkan dekstrin menghasilkan peak rafinosa yang cukup besar pada pembacaan HPLC sehingga terlihat mengandung kadar rafinosa yang tinggi jika dibandingkan dengan peak dari kedelai (Gambar 6). Peak rafinosa yang besar tersebut diduga terjadi karena adanya komponen dekstrin yang memiliki berat molekul yang sama dengan rafinosa sehingga komponen tersebut terbaca sebagai rafinosa. Dekstrin merupakan hasil hidrolisis pati dan masih memiliki sifat karbohidrat sehingga diduga terdapat komponen dekstrin yang memiliki berat molekul yang mirip dengan rafinosa. Hal tersebut dapat dilihat pada Gambar 6 yang menunjukkan terdapat komponen pada dekstrin yang memiliki waktu retensi yang sama dengan rafinosa pada kedelai. Kandungan rafinosa sesungguhnya pada kedelai yang ditambahkan dekstrin dapat diketahui dengan melakukan pengujian pada dekstrin murni yang digunakan sehingga diketahui konsentrasi komponen dekstrin yang diduga memiliki berat molekul yang sama dengan rafinosa.
23 dekstrin tidak dipengaruhi oleh komponen pada dekstrin sehingga peak yang muncul adalah peak dari stakiosa yang sesungguhnya. Oligosakarida total pada kedelai+dekstrin I adalah sebesar 5.04 mg/g dan pada kedelai+dekstrin II sebesar 4.95 mg/g. Perbedaan antara kedelai+dekstrin I dan II terjadi karena adanya perbedaan pemanasan pada sampel. Kedelai+dekstrin II mengalami proses pemanasan yang lebih tinggi dibandingkan dengan kedelai+dekstrin I pada proses pembuatannya sehingga mempengaruhi kadar oligosakaridanya. Sat dan Keles (2002) melaporkan, bahwa proses pemasakan dapat menurunkan kandungan rafinosa dan stakiosa sebanyak 18%.
Gambar 6. Kromatogram HPLC pada kedelai (a), dekstrin komersial (b) dan kedelai+dekstrin komersial (c)
Komponen yang diduga memiliki berat molekul yang sama dengan rafinosa
Ra
fi
n
o
sa
Rafinosa+komponen dekstrin
Waktu (menit) Waktu (menit) Waktu (menit) Respon detektor
(nRIU)
Respon detektor (nRIU)
Respon detektor (nRIU)
S
ta
k
io
sa
(a)
(b)
(c)
F
ru
k
to
sa Glu
k
o
sa
S
u
k
ro
sa
S
ta
k
io
sa
G
lu
k
o
sa
S
u
k
ro
24 Tabel 10. Kandungan gula sederhana dan oligosakarida sampel penelitian dan kacang-kacangan lain.
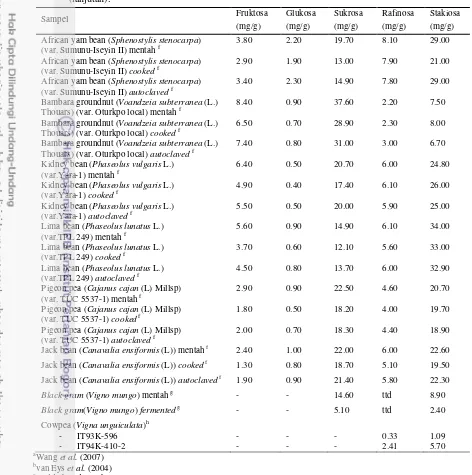
Sampel Fruktosa
(mg/g) Glukosa (mg/g) Sukrosa (mg/g) Rafinosa (mg/g) Stakiosa (mg/g)
Kedelai (sampel penelitian) 1.91 3.11 42.77 8.27 24.29
Kedelai a 0.14* 43.10 7.52 31.3
Kedelai b - - - 8-10 24-30
Kedelai c 2.90 2.95 63.00 9.50 27.00
Kedelai d - - - 60.10 35.0
Kedelai soakedd - - - 40.10 18.70
Kedelai soaked under ultrasoundd - - - 26.60 25.00
Kedelai cookedd - - - 36.20 29.70
Kedelai kuning e 7.20* 60.90 8.90 10.60
Kedelai hijau e 8.40* 8.50 Nd 14.30
Kembang tahu a 2.38* 11.30 4.05 22.60
Susu kedelai a 0.85* 36.10 6.87 37.90
Konsentrat protein kedelai b - - - < 2 10-13
Isolat protein kedelai (sampel penelitian) 0.38 0.40 6.63 0.77 0.83
Isolat protein kedelai b - - - <1 <2
Lentils (Lens culinaris)d
- Pardina - Crimson - - - - -
- 28.60
37.00
24.60 28.80
Chickpea (Cicer arietinum L.)d - - - 50.20 27.00
Yellow pea (Pisum sativum L.)d - - - 34.00 31.70
Green pea (P. sativum L.)d - - - 30.10 35.40
Kidney bean (Phaseolus vulgaris L.) (var. Pondo-6)mentahf
4.70 0.80 16.60 6.20 31.00
Kidney bean (Phaseolus vulgaris L.) (var. Pondo-6) cooked f
3.60 0.50 14.20 5.30 29.70
Kidney bean (Phaseolus vulgaris L.) (var. Pondo-6) autoclaved f
3.90 0.70 17.80 5.90 30.00
Lima bean (Phaseolus lunatus L.) (var.TPL 88)mentah f
7.50 0.70 15.80 7.50 29.50
Lima bean (Phaseolus lunatus L.) (var.TPL 88) cooked f
5.30 0.50 11.90 6.80 29.40
Lima bean (Phaseolus lunatus L.) (var.TPL 88) autoclaved f
6.80 0.60 15.30 7.10 25.70
African yam bean (Sphenostylis stenocarpa) (var. Sumunu-Iseyin I) mentah f
3.10 1.40 26.00 7.30 33.00
African yam bean (Sphenostylis stenocarpa) (var. Sumunu-Iseyin I) cooked f
2.30 1.00 18.40 6.40 28.60
African yam bean (Sphenostylis stenocarpa) (var. Sumunu-Iseyin I) autoclaved f
3.00 1.20 19.80 7.10 32.00
Bambara groundnut (Voandzeia subterranea (L.))
(var. KAB-3) mentah f
9.00 1.30 30.20 2.70 10.00
Bambara groundnut (Voandzeia subterranea (L.))
(var. KAB-3) cooked f
7.20 1.00 25.20 2.60 9.00
Bambara groundnut (Voandzeia subterranea (L.))
(var. KAB-3) autoclaved f
7.40 1.10 27.10 2.40 8.50
Pigeon pea (Cajanus cajan (L)) (var.Ex-Ibadan) mentah f
4.00 1.40 20.10 5.00 29.00
Pigeon pea (Cajanus cajan (L)) (var.Ex-Ibadan) cooked f
2.80 0.90 17.50 4.50 28.10
Pigeon pea (Cajanus cajan (L)) (var.Ex-Ibadan) autoclaved f
25 Tabel 10. Kandungan gula sederhana dan oligosakarida sampel penelitian dan kacang-kacangan lain
(lanjutan).
Sampel Fruktosa
(mg/g) Glukosa (mg/g) Sukrosa (mg/g) Rafinosa (mg/g) Stakiosa (mg/g)
African yam bean (Sphenostylis stenocarpa) (var. Sumunu-Iseyin II) mentah f
3.80 2.20 19.70 8.10 29.00
African yam bean (Sphenostylis stenocarpa) (var. Sumunu-Iseyin II) cooked f
2.90 1.90 13.00 7.90 21.00
African yam bean (Sphenostylis stenocarpa) (var. Sumunu-Iseyin II) autoclaved f
3.40 2.30 14.90 7.80 29.00
Bambara groundnut (Voandzeia subterranea (L.)
Thouars) (var. Oturkpo local) mentah f
8.40 0.90 37.60 2.20 7.50
Bambara groundnut (Voandzeia subterranea (L.)
Thouars) (var. Oturkpo local) cookedf
6.50 0.70 28.90 2.30 8.00
Bambara groundnut (Voandzeia subterranea (L.)
Thouars) (var. Oturkpo local) autoclaved f
7.40 0.80 31.00 3.00 6.70
Kidney bean (Phaseolus vulgaris L.) (var.Yara-1) mentah f
6.40 0.50 20.70 6.00 24.80
Kidney bean (Phaseolus vulgaris L.) (var.Yara-1) cooked f
4.90 0.40 17.40 6.10 26.00
Kidney bean (Phaseolus vulgaris L.) (var.Yara-1) autoclaved f
5.50 0.50 20.00 5.90 25.00
Lima bean (Phaseolus lunatus L.) (var.TPL 249) mentah f
5.60 0.90 14.90 6.10 34.00
Lima bean (Phaseolus lunatus L.) (var.TPL 249) cooked f
3.70 0.60 12.10 5.60 33.00
Lima bean (Phaseolus lunatus L.) (var.TPL 249) autoclaved f
4.50 0.80 13.70 6.00 32.90
Pigeon pea (Cajanus cajan (L) Millsp) (var. TUC 5537-1) mentah f
2.90 0.90 22.50 4.60 20.70
Pigeon pea (Cajanus cajan (L) Millsp) (var. TUC 5537-1) cooked f
1.80 0.50 18.20 4.00 19.70
Pigeon pea (Cajanus cajan (L) Millsp) (var. TUC 5537-1) autoclaved f
2.00 0.70 18.30 4.40 18.90
Jack bean (Canavalia ensiformis (L)) mentah f 2.40 1.00 22.00 6.00 22.60
Jack bean (Canavalia ensiformis (L)) cooked f 1.30 0.80 18.70 5.10 19.50
Jack bean (Canavalia ensiformis (L)) autoclaved f 1.90 0.90 21.40 5.80 22.30
Black gram (Vigno mungo) mentah g - - 14.60 ttd 8.90
Black gram(Vigno mungo) fermented g - - 5.10 ttd 2.40
Cowpea (Vigna unguiculata)h
- IT93K-596 - IT94K-410-2 - - - - - - 0.33 2.41 1.09 5.70 a
Wang et al. (2007)
b
van Eys et al. (2004)
c
Middelbos dan Fahey (2008)
d
Han dan Baik, (2006)
e
Ruperez (2006)
f
Apata (2008)
g
Reddy and Salunkhe (1980)
h
Agbenorhevi et al. (2007)
* Gula dalam bentuk monosakarida (fruktosa+glukosa)
26 sederhana dan oligosakarida, begitu pun pada pengolahan kedelai menjadi konsentrat atau isolat protein kedelai. Bahkan kandungan rafinosa dan stakiosa pada isolat protein kedelai sangat rendah, yaitu kurang dari 2 mg/g. Berdasarkan penelitian Apata (2008), proses cooking berupa perebusan pada beberapa jenis kacang-kacangan menurunkan kandungan gula dan oligosakarida lebih tinggi dibandingkan proses autoklaf. Hal ini menunjukkan bahwa proses pengolahan kacang-kacangan yang meliputi pemasakan atau pembuatan konsentrat dan isolat protein akan menghilangkan komponen gula dan oligosakarida pada produk.
2.
Uji kualitatif dekstrin pada dua puluh produk minuman bubuk komersial
berbasis kedelai
Pengujian kualitatif dekstrin dilakukan untuk mengetahui apakah terdapat komponen dekstrin pada sampel. Adanya komponen dekstrin pada sampel dapat mempengaruhi peak rafinosa karena komponen dekstrin akan terbaca sebagai rafinosa sehingga diperlukan perhitungan untuk mengetahui konsentrasi rafinosa sesungguhnya. Tabel 11 menunjukkan hasil uji kualitatif dekstrin yang dilakukan dengan melihat perubahan warna pada sampel setelah ditetesi larutan lugol. Perubahan warna pada 20 produk minuman bubuk berbasis kedelai memberikan hasil yang bervariasi mulai dari tidak memberikan warna, biru, hingga merah kecoklatan. Produk A hingga I dan produk R memberikan warna merah kecoklatan ketika dilakukan pengujian dengan lugol, artinya produk-produk tersebut mengandung dekstrin. Hal tersebut dicantumkan dalam label produk. Bahan yang ditambahkan pada produk A, E, F, H, I dan R berupa maltodekstrin, sedangkan pada produk C dan G berupa tepung jagung terhidrolisat, dan produk B dan D berupa sirup jagung padat. Tepung jagung terhidrolisat dan sirup jagung padat merupakan bahan yang diperoleh dari hidrolisis pati jagung, sehingga memiliki sifat yang serupa dengan dekstrin yang berasal dari hidrolisis pati.
Produk J hingga produk Q serta produk S dan T merupakan produk yang tidak menyebutkan senyawa dekstrin pada label komposisi produknya sehingga berdasarkan hasil uji lugol seharusnya tidak menghasilkan warna, namun produk K, produk S, dan produk T menghasilkan perubahan warna. Pengujian pada produk K menghasilkan warna biru, pada produk S menghasilkan warna merah kecoklatan, dan pada produk T menghasilkan warna biru kehitaman. Berdasarkan uji tersebut diketahui bahwa produk K, S, dan T diduga mengandung dekstrin atau senyawa yang mirip dekstrin pada produknya walaupun tidak menyebutkannya dalam komposisi produk.
Perbedaan warna pada produk tersebut karena adanya perbedaan komponen pada bahan yang ditambahkan. Menurut Doublier dan Cuvelier (2006), dalam hidrolisis pati menghasilkan tiga jenis dekstrin. Pada tahap awal hidrolisis menghasilkan amilodekstrin yang memberikan warna biru jika direaksikan dengan iodin, selanjutnya eritrodekstrin yang menghasilkan warna merah kecoklatan, dan terakhir akrodekstrin (maltodekstrin) yang tidak merubah warna jika direaksikan dengan larutan iodin. Menurut Hizukuri et al. (2006), warna biru pada dekstrin akan terbentuk bila polimer glukosa lebih besar dari dua puluh, bila polimernya kurang dari dua puluh akan membentuk warna coklat hingga merah dan tidak akan menghasilkan warna jika polimernya lebih kecil dari lima.
27 Tabel 11. Hasil uji kualitatif dekstrin pada dua puluh produk minuman bubuk komersial berbasis
kedelai
Usia konsumen
Sampel Sumber protein Sumber karbohidrat Uji kandungan dekstrin
pewarnaan dengan larutan lugol
Kesimpulan uji kandungan dekstrin
0-1 tahun A Isolat protein kedelai Sirup glukosa padat,
maltodekstrin
Merah kecoklatan (Positif)
Ba Isolat protein kedelai Sirup jagung padat Merah kecoklatan (Positif)
C Isolat protein kedelai Tepung jagung
terhidrolisat, sukrosa
Kuning kecoklatan (Positif)
D Isolat protein kedelai Sirup jagung padat,
sukrosa
Merah kecoklatan (Positif)
E Isolat protein kedelai Sukrosa, sirup
glukosa padat, maltodekstrin
Merah kecoklatan (Positif)
1-3 tahun F Isolat protein kedelai Sukrosa, sirup
glukosa padat, maltodekstrin
Merah kecoklatan (Positif)
G Isolat protein kedelai Tepung jagung
terhidrolisat, sukrosa
Kuning kecoklatan (Positif)
H Isolat protein kedelai,
susu skim
Sukrosa, maltodekstrin
Merah kecoklatan (Positif)
Diatas 3 tahun (konsumen biasa)
J Kedelai - Tidak menghasilkan warna - (Negatif)
M Kedelai - Tidak menghasilkan warna - (Negatif)
N Kedelai - Tidak menghasilkan warna - (Negatif)
O Kedelai - Tidak menghasilkan warna - (Negatif)
P Kedelai - Tidak menghasilkan warna - (Negatif)
S Kedelai Madu Merah kecoklatan (Positif)
T Kedelai Gula, tepung mata
beras
Biru-kehitaman (Positif)
Diatas 3 tahun (konsumen khusus)
I b Kedelai, susu skim Maltodekstrin Merah kecoklatan (Positif)
Kb Kedelai Sukrosa, maltose Biru (Positif)
Lb Isolat protein kedelai Fruktosa Tidak menghasilkan warna - (Negatif)
Qb Isolat protein kedelai,
whey protein
- Tidak menghasilkan warna - (Negatif)
Rc Isolat protein kedelai Sukrosa, sirup
glukosa padat maltodekstrin
Merah kecoklatan (Positif)
a
Sampel sudah tidak ditemukan dipasaran.
b Sampel ditujukan untuk konsumen yang sedang berdiet.
c Sampel berupa susu formula lanjutan untuk anak berusia 3 tahun ke atas.
3.
Analisis gula sederhana dan oligosakarida pada dua puluh produk minuman
bubuk komersial berbasis kedelai
28 Tabel 12. Kandungan gula sederhana dan oligosakarida pada dua puluh produk minuman bubuk berbasis kedelai (berdasarkan basis kering)
Usia konsumen
Sampel Sumber protein Sumber karbohidrat Fruktosa