MIKROBA SELULOLITIK DARI RUMPUT LAUT
UNTUK
PENINGKATAN MUTU HASIL SAMPING OLAHAN UBI
KAYU SEBAGAI BAHAN BAKU PAKAN IKAN
IRMA MELATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Mikroba Selulolitik dari Rumput Lautuntuk Peningkatan Mutu Hasil Samping Olahan Ubi Kayu sebagai Bahan Baku Pakan Ikan adalah benar karya saya sendiri yang merupakan bagian dari penelitian Kelompok Peneliti Nutrisi dan Teknologi Pakan Ikan Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT) tahun anggaran 2012/2013 dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Bogor, Juli 2014
Irma melati
RINGKASAN
IRMA MELATI. Mikroba Selulolitik dari Rumput Lautuntuk Peningkatan Mutu Hasil Samping Olahan Ubi Kayu sebagai Bahan Baku Pakan Ikan. Dibimbing oleh MARIA BINTANG dan MAS TRI DJOKO SUNARNO
Upaya untuk mendapatkan bahan baku pakan alternatif masih perlu dilakukan mengingat makin tingginya harga pakan ikan yang disebabkan tingginya harga bahan baku pakan khususnya sumber protein. Penggunaan protein pakan dapat diefisienkan jika pemanfaatan karbohidrat pakan dioptimalkan. Salah satu sumber karbohidrat adalah hasil samping olahan ubi kayu seperti kulit ubi kayu (KUK), daun ubi kayu (DUK) dan onggok (OGK). Pemakaian ke tiga bahan tersebut sebagai bahan baku pakan ikan belum optimal karena tingginya kadar serat kasar. Upaya pengoptimalannya dapat dilakukan antara lain melalui penambahan enzim selulase yang dihasilkan bakteri selulolitik. Salah satu sumber bakteri selulolitik adalah rumput laut, mengandung 15-25% serat selulosa. Tujuan penelitian ini untuk mendapatkan mikroba selulolitik dari rumput laut dengan aktifitas enzim selulase tertinggi, mengetahui waktu optimum produksi enzim selulase dari mikroba selulolitik terpilih dan mengevaluasi efektivitas enzim selulase untuk mendegradasi serat kasar hasil samping olahan ubi kayu.
Penelitian terbagi dalam tiga tahap, yaitu tahap pertama isolasi, seleksi dan identifikasi mikroba selulolitik dari rumput laut, tahap ke dua produksi enzim selulase yang dihasilkan dari mikroba terpilih dan tahap ketiga evaluasi efektivitas enzim selulase untuk mendegradasi serat kasar hasil samping olahan ubi kayu. Isolasi bakteri selulolitik dilakukan dengan metode pengenceran, streaking dan
spreading pada media carboxymethylcellulose (CMC). Penentuan waktu optimum produksi enzim selulase dilakukan dengan cara menginkubasi isolat terpilih selama rentang waktu inkubasi 24, 48, 72, 78 dan 96 jam. Evaluasi efektivitas enzim selulase isolat terpilih untuk mendegradasi serat kasar hasil samping olahan ubi kayu, menggunakan Rancangan Acak Lengkap terdiri atas tiga perlakuan dua ulangan. Perlakuannya adalah dosis enzim selulase dari mikroba terpilih yaitu: 0, 25, dan 50%.
Hasil penelitian didapat 22 isolat murni bakteri dengan tiga isolat yang mempunyai aktifitas selulolitik tinggi, yaitu TS2b, SS4a dan SS4b. Aktifitas selulase tertinggi diperoleh pada isolat TS2b. Hasil uji biokimia dan karakterisasi molekuler gen 16S-rRNA menunjukkan bahwa ketiga isolat tersebut adalah
Bacillus subtilis (B. subtilis), B. megaterium dan B. flexus. Waktu optimum untuk produksi enzim selulase isolat TS2b terjadi pada jam ke 78 setelah inkubasi. Daya hidrolisis enzim selulase tertinggi diperoleh pada substrat KUK dengan aktifitas enzim selulase dan kadar gula pereduksi yang dilepaskan berturut-turut sebesar 0.0179 U/mL dan 0.9701 mg/L. Dosis enzim selulase yang paling efektif menurunkan serat kasar KUK adalah 50% dengan besar penurunan kadar NDF, selulosa, dan hemiselulosa berturut-turut sebesar 16.60, 10.44 dan 39.82% dengan kadar gula pereduksi dan protein terlarut yang dilepaskan berturut-turut sebesar 1.28 mg/L dan 0.69 mg/mL
Kata kunci: enzim selulase, mikroba rumput laut, kulit ubi kayu
Comment [ O1] : deleted
Comment [ O2] : deleted
SUMMARY
IRMA MELATI. Cellulolytic Microbes from Seaweed for Increasing Quality of Cassava By Product as Fish Feed Ingredient. Supervised by MARIA BINTANG and MAS TRI DJOKO SUNARNO
Effort to find alternative fish feed ingredients are still needed to be done due to the increase of feed’s price ingredient especially sources of protein. The use of a source of protein in the diet can be made efficient if the utilization of carbohydrate can be optimized in fish feed formulation. One of the potencial sources of carbohydrate is cassava by product such as cassava peels (KUK), cassava leaves (DUK) and onggok (OGK). The problem is the high content of crude fibers especially cellulose in that ingredients, so that its use cannot be optimized. The use of cellulose enzyme from cellulolytic bacteria can be alternative to solve the problem. One source of cellulolytic bacteria is seaweed, contains 15-25% crude cellulose. A study proposing to get cellulolytic bacteria as a candidate for crude fiber degradation, to find out an optimal production of cellulose enzyme of cellulolytic bacteria and to evaluate effectiveness of cellulase enzyme for hydrolising crude fibre of cassava by product, therefore, was conducted in laboratory.
This study was divided in three experiments, the first was isolating, selecting and identifying cellulolytic microbes from seaweed, the second was producing cellulase enzymes from selected microbes and the last one was evaluating an effectiveness of cellulose enzyme of selected bacteria to improve quality of cassava by product. Cellulolytic bacteria were isolated from sea weed using dilution methods, streaking and spreading on media of carboxymethylcellulose (CMC). Optimal production of cellulose enzyme of selected bacteria was incubated at various incubation times of 24, 48, 72, 78 and 96 hours, respectively. Ability of cellulase enzyme to improve quality of cassava by product was designed using a completely randomized design having three treatments and two replications. The treatments various cellulase enzyme dosages of selected bacteria were 0, 25 and 50%, respectively.
The results show that there were 22 pure bacterial isolated and three of them had the higher cellulolytic activity, coded TS2b, SS4a and SS4b, respectively. TS2b had the highest cellulolytic activity. Based on biochemistry test and moleculer identification of the 16S-rRNA gene, bacterial spesies of TS2b, SS4a and SS4b was Bacillus subtilis, B. megaterium and B. flexus, repectively. Optimal time for producing cellulose enzyme of 0.0214 U/mL releasing glucose of 0.0231 mg/L was at 78 hours. The highest hydrolysing capability of cellulose enzyme was at substrate cassaca peel (KUK) with the values of cellulose enzyme activity and reducing sugar of 0.0179 U/mL and 0.9701 mg/L, respectively. Effect of cellulase enzyme to improve the quality of KUK show that the most effective dose of cellulase enzyme to reduce crude fiber of KUK was at 50 %, reducing NDF, cellulosa and hemicellulosa at a rate of 16.60, 10.44, and 39.82 %, respectively. Reducing sugars and soluble proteins were released successively by 1.28 mg/L and 0.69 mg/mL, respectively.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
MIKROBA SELULOLITIK DARI RUMPUT LAUT
UNTUK
PENINGKATAN MUTU HASIL SAMPING OLAHAN UBI
KAYU SEBAGAI BAHAN BAKU PAKAN IKAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Mikroba Selulolitik dari Rumput Laut untuk Peningkatan Mutu Hasil Samping Olahan Ubi Kayu sebagai Bahan Baku Pakan Ikan Nama : Irma Melati
NIM : G851120081
Disetujui oleh Komisi Pembimbing
Prof. Dr. drh. Maria Bintang, MS Ketua
Diketahui oleh
Dr. Ir. Mas Tri Djoko Sunarno, MS Anggota
Ketua Program Studi Biokimia
Prof. Dr. drh. Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc.Agr
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat, berkah, dan karunia-Nya sehingga penulis dapat menyelesaikan Tesis ini. Shalawat serta salam tercurah kepada Nabi Muhammad SAW, keluarga, sahabat, dan para pengikutnya hingga akhir zaman. Penelitian ini berjudul Mikroba Selulolitik dari Rumput Lautuntuk Peningkatan Mutu Hasil Samping Olahan Ubi Kayu sebagai Bahan Baku Pakan Ikan. Kegiatan penelitian yang merupakan salah satu syarat memperoleh gelar Magister Sains pada Departemen Biokimia ini dilakukan dari bulan Juli 2013 hingga April 2014 di Laboratorium Kimia Nutrisi dan Teknologi Pakan Ikan, Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT), Bogor.
Selesainya karya ilmiah ini tak lepas dari bantuan dan dorongan dari berbagai pihak. Penulis mengucapkan terima kasih kepada:
1. Prof. Dr. drh. Maria Bintang, MS dan Dr. Ir. Mas Tri Djoko Sunarno, MS sebagai Komisi Pembimbing yang banyak memberi bimbingan dan arahan kepada penulis dalam melakukan penelitian ini.
2. Kepala BPPBAT yang telah berkenan memberi kesempatan kepada penulis melanjutkan pendidikan program Magister
3. Kelompok Peneliti Nutrisi dan Teknologi Pakan Ikan BPPBAT yang telah memfasilitasi penulis untuk melakukan penelitian ini
4. Bakrie Center Foundation (BCF) yang telah memberikan beasiswa kepada
penulis
5. Khusus kepada kedua orang tua saya, suami dan anakku tercinta Joko Gumilang dan M. Raya Gumilang serta seluruh keluarga atas segala pengorbanan, dukungan, bantuan, pengertian, doa dan kasih sayangnya selama penulis mengikuti pendidikan di IPB
Semoga segala bantuan yang diberikan mendapat pahala yang berlipat ganda dari Allah SWT. Semoga hasil penelitian ini dapat memberi manfaat bagi kemajuan ilmu pengetahuan.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
1. PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan dan Manfaat Penelitian 3
2. BAHAN DAN METODE 4
Waktu dan Tempat 4
Alat dan Bahan 4
Tahapan Penelitian 4
Prosedur Penelitian 4
3. HASIL DAN PEMBAHASAN 9
4. SIMPULAN 24
DAFTAR PUSTAKA 24
LAMPIRAN 30
DAFTAR TABEL
1 Morfologi bakteri dari rumput laut Sargasum sp dan Turbinaria sp yang
tumbuh pada media CMC 1%
10 2 Aktivitas selulolitik (zona bening) dan indeks selulolitik hasil hidrolisis
CMC 1% dari bakteri asal Sargasum sp dan Turbinaria sp
10
3 Aktivitas enzim selulase (kuantitaif) dari isolat bakteri asal Sargasum
sp dan Turbinaria sp
11 4 Hasil identifikasi biokimia isolat bakteri selulolitik asal Sargasum sp
dan Turbinaria sp
12 5 Hasil uji patogenitas isolat bakteri selulolitik asal rumput laut Sargasum
sp dan Turbinaria sp pada ikan nila
12 6 Hasil BLAST dari bakteri selulolitik terpilih 14 7 Konsentrasi gula pereduksi pada berbagai waktu inkubasi 17 8 Kadar selulosa, hemiselulosa dan lignin pada KUK dan DUK 19 9 Kadar fraksi serat KUK pada berbagai dosis enzim selulase isolat TS2b 20
DAFTAR GAMBAR
1 Zona bening hasil hidrolisis CMC 1% 11
2 Morfologi Isolat TS2b (kiri) dan SS4b (kanan) 12
3 Hasil Amplifikasi Gen 16S rRNA 13
4 Sebagian sekuen DNA penyandi 16S-rRNA isolat TS2b 14
5 Kurva pertumbuhan isolat TS2b 16
6 Kurva aktifitas enzim selulase isolat TS2b 17 7 Aktifitas enzim selulase isolat TS2b pada berbagai substrat 18 8 Kadar gula pereduksi pada berbagai substrat 18 9 Kadar gula preduksi pada KUK yang dihidrolisis enzim selulase isolat
Ts2b dengan dosis berbeda
23 10 Kadar protein terlarut KUK yang dihidrolisis enzim selulase isolat
TS2b dengan dosis berbeda
23
DAFTAR LAMPIRAN
1 Prosedur pembuatan media dan reagen yang digunakan dalam penelitian 31
2 Kurva standar glukosa 32
1
PENDAHULUAN
Latar Belakang
Pencarian bahan baku alternatif untuk pakan ikan masih harus dilakukan mengingat makin tingginya harga pakan yang disebabkan tingginya harga bahan baku , khususnya sumber protein. Penggunaan protein pakan dapat diefisienkan jika pemanfaatan sumber karbohidrat pakan dioptimalkan. Hal ini bisa terjadi karena karbohidrat dapat berperan sebagai protein sparing effect yang berarti sebagian besar protein dapat dihemat untuk pertumbuhan sedangkan kebutuhan energi dipenuhi oleh karbohidrat (National Research Council 1983). Karbohidrat merupakan sumber energi yang murah dalam pakan ikan. Meskipun demikian, meningkatnya permintaan dan keterbatasan persediaan dapat menyebabkan sumber karbohidrat pakan pun menjadi mahal seperti dedak dan tepung terigu. Hal ini mengharuskan pembudidaya untuk mencari alternatif bahan baku sumber karbohidrat yang lebih murah dan mudah didapatkan serta pemakaiaannya tidak bersaing dengan manusia di antaranya hasil samping olahan ubi kayu seperti kulit ubi kayu (KUK), daun ubi kayu (DUK) dan onggok (OGK).
Potensi KUK, DUK dan OGK sangat tinggi mengingat Indonesia merupakan negara produsen ubi kayu terbesar ke empat dunia setelah Nigeria, Thailand dan Brazil (FAO 2011). Badan Pusat Statistik (BPS) 2013 mencatat produksi ubi kayu tahun 2011 di Indonesia mencapai 24 juta ton dan 20% dari produk tersebut adalah hasil samping yang terbuang (Busairi & Hersoelistyorini 2009). Ubi kayu jarang diperdagangkan dalam bentuk segar karena sifat produk yang mengembang (bulky). Ubi kayu banyak diperdagangkan dalam bentuk kering yang dikenal sebagai gaplek atau chips dan bentuk tepung yang disebut sebagai tapioka atau tepung tapioka (tapioca flour). Menurut Sandi (2010), dalam sekali panen pada umur 12 bulan dengan luas lahan 1 hektar dapat menghasilkan umbi segar sebanyak 17.5 ton, kulit 2.79 ton dan daun 2.30 ton, sedangkan dari pengolahan industri tapioka menghasilkan onggok 1.7 ton. Setiap kilogram ubi kayu dapat menghasilkan 15-20% kulit ubi kayu (Nurhayani et al. 2000). Haroen (1993) menyatakan bahwa industri tepung tapioka menghasilkan kulit luar, kulit dalam dan onggok berturut-turut sebesar 2, 15 dan 5-15%.
DUK, KUK dan OGK banyak digunakan sebagai bahan baku pakan ruminansia dan monogastrik dan hanya sedikit dimanfaatkan sebagai pakan ikan. Pemanfaatan ketiga bahan tersebut sebagai bahan baku pakan masih belum optimal mengingat rendahnya kadar protein dan tingginya serat kasar. Kadar protein daun dan kulit ubi kayu serta onggok berturut-turut sebesar 31-36, 5-8, dan 1.45-3.53% sedangkan kadar serat kasarnya berturut-turut sebesar 8-11, 12-15 dan 8.71-10.94% (Eggum 1970; Oboh 2006; Halid 1991; Haroen 1993). Upaya mengoptimalkan penggunaan ketiga bahan tersebut sebagai bahan baku dalam pakan dapat dilakukan melalui teknologi biokonversi. Teknologi biokonversi merupakan konversi bahan secara enzimatik melalui fermentasi yang dapat dimanfaatkan untuk meningkatkan nilai ekonomi suatu bahan. Upaya peningkatan nilai nutrisi KUK, DUK dan OGK sudah mulai dilakukan salah satunya dengan cara fermentasi, tetapi hasil yang diperoleh ternyata kurang memuaskan karena
Comment [ O4] : deleted
Comment [ O5] : deleted
Comment [ O6] : (2013)
Comment [ O7] : buang
Comment [ O8] : bersifat memenuhi tempat
2
pada umumnya fermentasi dengan menggunakan mikroba yang ada selama ini hanya bisa meningkatkan protein saja sedangkan serat kasar hanya sedikit mengalami penurunan bahkan ada beberapa penelitian yang cenderung meningkatkan serat kasar. Azwar et al. (2010) mencatat bahwa fermentasi tepung kulit ubi kayu menggunakan Aspergillus niger, ragi tape dan ragi tempe dapat meningkatkan kadar protein berturut-turut sebesar 253, 174 dan 56% serta peningkatan kadar serat kasar berturut-turut sebesar 21, 32 dan 59%. Penelitian Sandi (2010) memperlihatkan terjadi penurunan kadar serat kasar OGK, KUK dan DUK yang difermentasi menggunakan enzim cairan rumen dan Leuconostoc mesenteroides berturut-turut sebesar 3.86, 2.31 dan 0.51%. Hasil yang sama diperoleh Suhartono (2001) yang memperlihatkan terjadi penurunan kadar serat kasar OGK yang difermentasi Aspergillus niger dengan penambahan urea dan zeolit dari 8.40 menjadi 7.81%
Serat kasar merupakan salah satu komponen polisakarida non pati. Di dalam pakan ikan polisakarida non pati terutama selulosa tidak boleh terlalu tinggi karena di dalam beberapa saluran pencernaan ikan khususnya yang berjenis karnivora, tidak mempunyai mikroorganisme penghasil enzim selulase yang dapat memecah ikatan glikosidik ß 1.4 pada selulosa. Menurut Leeson & Zubair (2000), selulosa dapat mempengaruhi viscositas cairan usus yang berakibat terhadap penurunan kecepatan difusi substrat dan enzim pencernaan, sehingga menurunkan efisiensi penyerapan nutrien secara keseluruhan pada dinding usus, yang pada gilirannya akan berdampak langsung terhadap efisiensi pakan dan performa ternak. Diperlukan suatu upaya penanganan khusus untuk menjadikan DUK, KUK dan OGK sebagai bahan baku pakan ikan, salah satunya menggunakan enzim selulase yang berasal dari mikroba selulolitik.
Enzim selulase merupakan grup enzim yang dapat memecah selulosa menjadi monomer glukosa (Yi et al. 1999). Selulase menurut Kim et al. (2008) dibagi menjadi tiga kelas yaitu endoglukanase (EGs) (EC 3.2.1.4), eksoglukanase (EC 3.2.1.91) dan β-glukosidase (EC 3.2.1.21). Deng & Tabatabai (1994) menyatakan bahwa ketiga enzim selulase ini bekerja secara sinergis mendegradasi selulosa dan melepaskan gula reduksi (selubiosa dan glukosa) sebagai produk akhirnya. EGs merupakan selulase yang paling efisien berdasarkan kemampuannya dalam mendegradasi carboxymethylcellulose (CMC) (Hendksson
et al. 1999). Selulosa juga dapat dipecah melalui perlakuan fisik dan kimia, tetapi penggunaan enzim selulase lebih menguntungkan dibandingkan bahan kimia karena tidak menimbulkan masalah korosi dan polusi lingkungan.
3 yang dibutuhkan untuk produksi enzim lebih singkat, dan kondisi selama produksi tidak tergantung musim.
Enzim selulase dapat dihasilkan oleh mikroba selulolitik baik dari kelompok bakteri Aktinomycetes dan fungi yang dapat ditemukan pada tanah, air, rumen dan beberapa saluran pencernaan ikan gurame, bahkan dari tanaman. Beberapa mikroba yang berpotensi sebagai sumber enzim selulase adalah
Aspergillus aculeatus, Bacillus subtilis, Butyrivibrio fibrisolvens, Cellumonas fimi, Clostridium thermocellum, C. Cellulovorans, Humicola grisea, Pseudemonas flurescen subsp. Cellulosa, Tricoderma reesei, dan Xanthomnas campestris (Shimada et al. 1994). Enzim selulase yang tersedia selama ini hanya mampu memecah ikatan selulosa kristal menjadi selulosa Cx (Rahmadini 2012). Diperlukan skrening isolat yang menghasilkan isolat unggul yang mampu mendegradasi selulosa yang lebih baik yaitu bakteri yang berasal dari rumput laut mengingat rumput laut sendiri mengandung selulosa yang cukup tinggi yaitu sebesar 15-25% (Kim et al. 2008). Bakteri tersebut dapat mempertahankan hidupnya dengan menjadikan selulosa sebagai sumber nutrisi untuk pertumbuhannya. Sehingga diduga bakteri tersebut mempunyai enzim selulase untuk mendegradasi selulosa.
Perumusan Masalah
Berkurangnya ketersediaan bahan baku pakan sumber karbohidrat contohnya dedak dan tepung terigu menyebabkan peningkatan harga pakan ikan. Hal ini mengharuskan pembudidaya untuk mencari alternatif bahan baku lain yang lebih murah dan mudah didapatkan. Pemanfaatan hasil samping olahan ubi kayu seperti DUK, KUK dan OGK bisa dijadikan sebagai alternatif bahan baku pakan ikan sumber karbohidrat. Permasalahan yang muncul adalah tingginya kadar serat kasar dalam bahan baku tersebut yang menyebabkan rendahnya tingkat inklusi dalam formulasi pakan ikan. Penambahan ekstrak kasar enzim selulase yang disekresikan oleh mikroba selulolitik hasil isolasi dari rumput laut diharapkan dapat menurunkan kadar serat kasar bahan baku alternatif tersebut, sehingga pemanfaatan dalam formulasi pakan dapat ditingkatkan
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk :
1. Mendapatkan mikroba selulolitik dari rumput laut dengan aktifitas enzim selulase tertinggi.
2. Mengetahui waktu optimum produksi enzim selulase dari mikroba terpilih. 3. Mengevaluasi efektivitas enzim selulase dari mikroba terpilih untuk
mendegradasi serat kasar hasil samping olahan ubi kayu.
4
2
BAHAN DAN METODE
. Tempat dan Waktu Percobaan
Penelitian dilakukan mulai bulan Juli 2013 hingga April 2014 di Laboratorium Kimia Nutrisi dan Teknologi Pakan Ikan, Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor
Alat dan Bahan
Alat yang digunakan diantaranya inkubator (Vision), waterbath
(Memmert), spektrofotometer UV-Vis (Eppendorf), vortex mixer, laminar flow
(Esco), autoklaf (Hirayama), Sentrifuse (Hanil), pH meter, timbangan analitik (Ohaus), pipet mikro (eppendorf) dan alat-alat gelas yang biasa digunakan di laboratorium.
Bahan yang digunakan dalam penelitian ini adalah rumput laut Sargasum sp dan Turbinaria sp yang diambil dari KabupatenGunung Kidul, DI Yogyakarta dan kulit ubi kayu, daun ubi kayu, dan onggok yang diperoleh dari Kabupaten Bogor, Jawa Barat serta Carboxymethylcellulose (CMC), MgSO4.7H2O, KNO3, K2HPO4, FeSO4.7H2O, CaCl2.2H2O, ekstrak kamir, agar bakto, glukosa, sodium tartarat, asam dinitrosalisilat (DNS), buffer sitrat-fosfat pH 5, congo red, tryptone soy broth (TSB) dan fenoksi etanol.
Tahapan Penelitian
Penelitian ini terdiri atas tiga tahap, yaitu tahap pertama isolasi, seleksi dan identifikasi mikroba selulolitik dari rumput laut, tahap ke dua produksi enzim selulase yang dihasilkan dari mikroba terpilih dan tahap ketiga evaluasi efektivitas enzim selulase untuk mendegradasi serat kasar hasil samping olahan ubi kayu.
Prosedur Penelitian
Tahap Pertama : Isolasi, Seleksi dan Identifikasi Bakteri Selulolitik
Pada percobaan tahap ini sasaran yang ingin dicapai adalah mendapatkan bakteri selulolitik yang mampu mendegradasi bahan baku yang mengandung selulosa.
Isolasi bakteri dari Rumput Laut
5 g K2HPO4; 0.002 g FeSO4.7H2O; 0.004 g CaCl2.2H2O; 0.2 g ekstrak kamir, 1.5 g agar-agar bakto dan 0.1 g glukosa). Koloni bakteri yang tumbuh diidentifikasi berdasarkan perbedaan warna, bentuk dan ukurannya. Setiap jenis koloni yang didapat dimurnikan dengan metode penggoresan kuadran sampai didapatkan koloni bakteri yang tunggal dan seragam untuk selanjutnya diseleksi secara kualitatif, kuantitatif dan uji patogenitas.
Seleksi bakteri selulolitik secara kualitatif dan kuantitatif.
Seleksi bakteri selulolitik dilakukan dengan cara pengujian aktifitas selulase baik secara kualitatif maupun kuantitatif. Tujuan dari percobaan ini adalah untuk mengetahui ada atau tidaknya aktifitas selulolitik dari suatu isolat bakteri.
Uji Kualitatif Enzim Selulase
Uji kualitatif dilakukan dengan metode pewarnaan congo red 0.1% dan iodin 1%. Isolat mikroba selulolitik ditotolkan pada media CMC agar. Bakteri diinkubasi selama 3 hari pada suhu 370C. Kemudian dilakukan uji aktifitas bakteri dengan menambahkan congo red 0.1% sebanyak 15 mL dan didiamkan selama 30-60 menit. Setelah itu dibilas sebanyak 2-3 kali dengan 15 mL NaCl 1 M dan didiamkan selama 15 menit. Diameter zona bening dan diameter koloni yang terbetuk diukur. Uji aktifitas selulase dilihat dari indeks selulolitik yang terbentuk. Indeks selulolitik merupakan nisbah antara zona being dengan diameter koloni. Semakin besar indeks selulolitik yang dihasilkan maka semakin besar enzim yang dihasilkan oleh isolat bakteri tersebut. Indeks selulolitik atau indeks aktifitas selulase (IAS) diperoleh dengan menggunakan rumus sebagai berikut (Kader & Omar 1998):
Indeks Selulolitik =
diameter koloni (mm)
diameter zona bening (mm)-diameter koloni (mm)
Uji Kuantitatif Enzim Selulase.
6
sitrat fosfat pH 5. Aktifitas selulase dinyatakan dalam satuan internasional, yaitu U/mL. Satu unit merupakan jumlah enzim yang dibutuhkan untuk memecah 1 µmol selulosa menjadi gula pereduksi per menit pada kondisi pengujian. Kadar glukosa yang dihasilkan dari hidrolisis selulosa dengan enzim selulase berdasarkan nilai absorbansi pada λ 550 nm.
Absorbansi = ((As - Ab) - (Ak - Ab)) Keterangan : As = Absorbansi sampel Ab = Absorbansi blanko Ak = Absorbansi kontrol
Nilai absorbansi yang diperoleh kemudian dimasukkan ke dalam persamaan yang diperoleh dari kurva standar glukosa. Kemudian, aktifitas selulase dihitung berdasarkan rumus sebagai berikut (Irawan et al. 2008 dalam
Rahmadini 2012):
Aktifitas selulase (U/mL)=
V x t x BM
Kadar glukosa (mg/L) x 1000 Keterangan:
Uji ini dilakukan untuk mengetahui apakah kandidat bakteri selulolitik bersifat patogen atau tidak terhadap ikan. Uji patogenitas dimulai dengan mengkultur satu lup isolat ke dalam 10mL media cair Tryptone Soya Broth (TSB). Kultur diinkubasi pada suhu kamar selama 24 jam, kemudian 0.1 mL inokulum dengan kepadatan 108 cfu/mL disuntikan ke ikan nila (Oreochromis niloticus) dengan bobot 12 ± 0.04 g secara intraperitonial (digunakan 10 ekor ikan per isolat). Sebagai kontrol, digunakan TSB steril. Pengamatan terhadap ikan yang mati dan gejala klinis dilakukan selama 2 minggu. Bakteri dinyatakan tidak bersifat patogen jika bakteri tersebut tidak menyebabkan ikan nila sakit disertai gejala klinis dan mati pada saat uji patogenitas ini.
Identifikasi bakteri selulolitik terpilih
Bakteri yang mempunyai aktifitas tertinggi dari tahap 1 kemudian diidentifikasi menggunakan metode uji biokimia standar dan identifikasi secara molekuler (sekuensing). Uji biokimia standar diawali dengan pewarnaan Gram untuk mendeteksi morfologi awal dari bakteri. Kunci determinasi yang digunakan merujuk pada kunci determinasi Bergey’s Determinative Bacteriology dengan melakukan serangkaian uji morfologi dan biokimia yaitu bentuk bakteri, uji pewarnaan Gram, uji katalase, uji oksidatif/fermentatif (OF), dan motilitas
7 amplifikasi gen penyandi 16S-rRNA dengan PCR, c) verifikasi dengan elektroforesis gel agarosa, d) sequencing hasil PCR.
Isolasi DNA Total (Maniatis et al. 1989). Isolasi DNA total dilakukan dengan menggunakan kit Genomic DNA Purification (Fermentas Life Biosciences, EU). Isolat bakteri dikulturkan pada media kaldu nutrien selama 12-14 jam. Sebanyak 1.5 mL kultur dimasukkan ke dalam tabung mikro dan disentrifus selama 10 menit dengan kecepatan 9.000 x g. Supernatan dibuang dan ditambahkan kultur lagi berulang-ulang sampai diperoleh pelet dalam jumlah yang cukup. Ke dalam pelet ditambahkan 200 µ L bufer TE dan 50 µ L lisozim (10 mg dalam 167 mL), dibolak-balik dan diinkubasi selama semalam pada suhu 370C. Selanjutnya ke dalam tabung mikro ditambahkan 200 µ L bufer lisis, diinkubasi pada suhu 65 0C selama 10 menit (setiap 3 menit dilakukan inversi/tabung dibolak-balik). Kemudian ditambahkan 600 µ L kloroform, diinversi perlahan sampai terbentuk dua fase yaitu fase atas dan fase bawah. Selanjutnya disentrifus pada suhu 4 0C dengan kecepatan 13.000 x g selama 10 menit. Saat sedang dilakukan sentrifus, disiapkan larutan pengendapan dengan mencampurkan 80 µ L larutan pengendapan dengan 720 µ L air distilasi. Setelah sentrifugasi selesai dilanjutkan dengan mengambil fase atas/fase cair (aqueous phase) perlahan-lahan dan dimasukkan ke dalam larutan pengendapan. Pada saat dimasukkan ke dalam larutan pengendapan akan terlihat benang-benang DNA dan didiamkan selama 2 menit pada suhu ruang. Setelah itu, dilakukan sentrifus pada suhu 4 0C dengan kecepatan 13.000 x g selama 10 menit. Supernatan hasil sentrifugasi dibuang dan DNA yang mengendap ditambahkan dengan 100 µL NaCl dan dikocok kuat dengan vortex, ditambahkan 300 µL etanol absolut (100%) dan diinkubasi pada suhu 4 0C selama 20 menit. Kemudian disentrifus pada suhu 4 0C dengan kecepatan 13.000 x g selama 10 menit. Supernatan hasil sentrifugasi dibuang dan DNA yang mengendap ditambahkan dengan etanol 70% dan disentrifugasi kembali pada suhu 4 0C dengan kecepatan 13.000 x g selama 10 menit. Supernatan dibuang dan DNA yang mengendap dikeringkan sebelum diresuspensi dengan bufer TE untuk penyimpanan di dalam lemari es suhu 4 0C.
Amplifikasi Gen Penyandi 16S-rRNA dengan PCR (Suwanto et al. 2000). DNA template diamplifikasi dengan PCR menggunakan dua primer universal spesifik untuk bakteri yaitu 63f (5’-CAGGCCTAACACAGGCAAGTC) dan 1387r (5’GGGCGGWGTGTACAAGGC) (Marchesi et al. 1998). Ke dalam tabung mikro steril dimasukkan 18 µ L ddHO; 1.0 µL primer 63f; 1.0 µ L primer 1387r; dan 25 µ L Taq polymerase, kemudian dimasukkan ke dalam PCR. Kondisi PCR terdiri atas tahap pre-PCR (95 0C, 5 menit), denaturasi (95 0C, 1 menit),
annealing atau pelekatan primer (56 0C, 1 menit 15 detik), elongasi atau pemanjangan primer (72 0C, 1 menit 30 detik), post-PCR (72 0C, 7 menit), dan penyimpanan/pendinginan (40C). Proses PCR tersebut dilakukan sebanyak 30 siklus. Hasil PCR kemudian divisualisasi dengan elektroforesis 1% gel agarosa. Proses selanjutnya yaitu analisis sekuen parsial gen penyandi 16S-rRNA, dan
sequencing hasil PCR dilakukan oleh 1st base, Singapura. Tahap Dua: Produksi Enzim Kasar Selulase
8
Penentuan Waktu Optimum Produksi Enzim Selulase
Penentuan waktu optimum produksi enzim selulase diawali dengan penentuan waktu pertumbuhan bakteri pada inokulum yang akan digunakan. Penentuan waktu pertumbuhan eksponensial bakteri dilakukan dengan mengkultur 2 lup isolat ke dalam 50 mL media cair CMC. Kultur diinkubasi pada suhu 50 0C di dalam penangas goyang dengan kecepatan agitasi 150 rpm. Pengambilan sampel dilakukan pada jam ke 24, 48, 72, 78 dan 96 untuk diukur nilai Optical Density (OD) pada λ 600 nm dan setiap kali pengukuran dilakukan juga pengujian aktifitas enzim selulase pada λ 550 nm. Setelah itu, dibuat kurva pertumbuhan bakteri untuk menentukan waktu pertumbuhan bakteri tersebut. Waktu pertumbuhan dengan aktifitas enzim selulase tertinggi digunakan sebagai waktu optimum produksi enzim selulase.
Produksi enzim selulase
Produksi enzim selulase dilakukan berdasarkan prosedur dan waktu inkubasi yang telah diketahui aktifitas selulase tertinggi pada kurva aktifitas selulase yang dihasilkan. Media pertumbuhan produksi diinkubasi pada suhu 50 0C di dalam penangas goyang dengan kecepatan agitasi 150 rpm, kemudian enzim selulase dipanen selama waktu produksi tertinggi yang telah didapatkan sebelumnya. Kultur sel pada media produksi yang mengandung enzim selulase ekstraseluler disentrifugasi pada kecepatan 9.000 x g selama 10 menit untuk memisahkan larutan enzim dengan pelet bakteri. Supernatan hasil sentrifugasi kemudian disimpan pada suhu 10 0C sebagai ekstrak kasar.
Tahap Ketiga: Evaluasi Efektivitas Enzim Selulase dalam Meningkatkan Mutu Hasil Samping Olahan Ubi Kayu (DUK, KUK dan OGK)
Pada percobaan Tahap Tiga, sasaran yang ingin dicapai adalah untuk mendapatkan substrat yang paling cocok untuk enzim selulase yang dihasilkan bakteri terpilih yang selanjutnya di perlakukan lebih lanjut.
Uji aktifitas enzim pada berbagai substrat
9 Evaluasi lebih lanjut efektivitas enzim selulase mikroba terpilih pada substrat terbaik
Sasaran percobaan tahap ini adalah untuk mengetahui dosis efektif enzim selulase untuk meningkatkan kualitas nutrisi substrat pada Percobaan 3.1. Percobaan didesain menggunakan Rancangan Acak Lengkap, terdiri atas tiga perlakuan dan dua ulangan. Perlakuan yang diberikan adalah dosis enzim selulase dari mikroba terpilih yaitu: 0, 25 dan 50%. Preparasi substrat dilakukan dengan cara substrat direndam dengan air selama 24 jam dan dikeringkan pada suhu 70 °C dalam oven selama 3 hari. Kemudian substrat dihaluskan menggunakan alat blender dan diayak dengan saringan 100 mesh. Sebanyak 50 g substrat dimasukkan ke dalam wadah plastik, kemudian ditambahkan air sebanyak 150% dan dikukus selama 30 menit. Setelah dingin ditambahkan enzim kasar selulase sesuai perlakuan, dan kemudian diinkubasi selama 2 hari pada suhu 50 0C. Parameter yang diamati adalah fraksi serat (Neutral Detergen Fiber (NDF), Acid Detergen Fiber (ADF ), lignin, selulosa, dan hemiselulosa), kadar gula pereduksi dan protein terlarut (awal dan setelah dihidrolisis). Parameter dianalis menggunakan SPSS 16.0.
3
HASIL DAN PEMBAHASAN
Tahap 1: Isolasi, seleksi dan identifikasi mikroba selulolitik dari Sargasum sp dan Turbinaria sp
Hasil isolasi mikroba dari Sargasum sp dan Turninaria sp diperoleh 22 isolat yang memiliki kemampuan untuk tumbuh dalam media yang mengandung CMC, yaitu suatu polisakarida yang berfungsi sebagai indikator selulosa. Ciri morfologi dari koloni ke 22 isolat tersebut dapat dilihat pada Tabel 1. Dua puluh dua isolat yang dapat tumbuh dalam media CMC 1% kemudian diuji lebih lanjut untuk mengetahui aktifitas enzim selulolitiknya dengan metode zona bening.
10
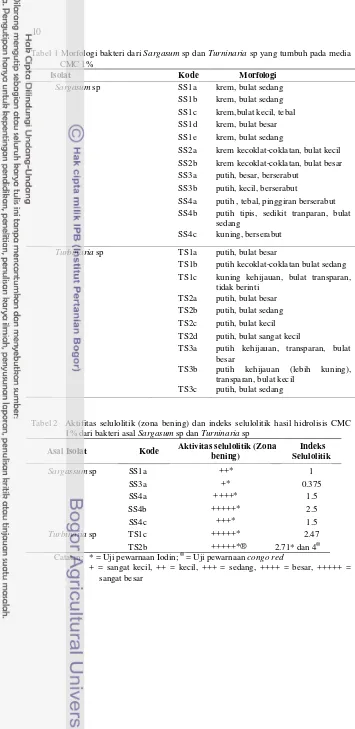
Tabel 1 Morfologi bakteri dari Sargasum sp dan Turninaria sp yang tumbuh pada media CMC 1%
SS2a krem kecoklat-coklatan, bulat kecil SS2b krem kecoklat-coklatan, bulat besar
SS3a putih, besar, berserabut
SS3b putih, kecil, berserabut
SS4a putih , tebal, pinggiran berserabut SS4b putih tipis, sedikit tranparan, bulat
sedang
SS4c kuning, berserabut
Turbinaria sp TS1a putih, bulat besar
TS1b putih kecoklat-coklatan bulat sedang
TS1c kuning kehijauan, bulat transparan,
tidak berinti
TS2a putih, bulat besar
TS2b putih, bulat sedang
TS2c putih, bulat kecil
TS2d putih, bulat sangat kecil
TS3a putih kehijauan, transparan, bulat
besar
TS3b putih kehijauan (lebih kuning),
transparan, bulat kecil
TS3c putih, bulat sedang
Tabel 2 Aktifitas selulolitik (zona bening) dan indeks selulolitik hasil hidrolisis CMC 1% dari bakteri asal Sargasum sp dan Turninaria sp
Asal Isolat Kode Aktivitas selulolitik (Zona
11 Indeks selulolitik tinggi didapatkan pada bakteri SS4b yaitu sebesar 2.5, TS2b 2.71 dan 4 serta TS1c 2.41. Karena pertumbuhan isolat TS1c relatif lambat dibanding isolat lain maka yang dipilih untuk identifikasi secara molekuler yaitu SS4b, TS2b dan SS4c. Indeks selulolitik ini menunjukkan kemampuan isolat tersebut dalam mendegradasi selulosa. Zona bening dari isolat SS4b dan TS2b disajikan pada Gambar 1.
A B C
Gambar 1. Zona bening hasil hidrolisis CMC 1% : A. Isolat TS2b (pewarnaan iodin), B. Isolat SS4b (pewarnaan iodin) dan C. Isolat TS2b (pewarnaan congo red)
Hasil uji aktifitas enzim secara kuantitatif menunjukkan bahwa aktifitas enzim selulolitik tertinggi adalah pada isolat TS2b yaitu 0.0099 U/mL (Tabel 3). Hal ini sejalan dengan uji kualitatif menggunakan metode zona bening di mana isolat TS2b memberikan zona bening paling tinggi dibandingkan isolat lainnya. Ketujuh isolat bakteri asal rumput laut yang mengasilkan zona bening, kemudian diidentifikasi secara morfologi dan biokimia dan hasilnya disajikan pada Tabel 4 dan Gambar 2.
Tabel 3 Aktifitas enzim selulase (kuantitatif) dari isolat bakteri asal Sargasum sp dan Turninaria sp
Isolat bakteri Aktifitas Enzim (U/mL)
SS1a 0.0031
SS3a 0.0021
SS4a 0.0030
SS4b 0.0037
SS4c 0.0029
TS1c 0.0043
TS2b 0.0099
12
Tabel 4 Hasil identifikasi biokimia isolat bakteri selulolitik asal Sargasum sp dan Turninaria sp
Gambar 2 Morfologi isolat TS2b (kiri) dan SS4b (kanan)
Isolat bakteri TS2b, SS4b dan SS4c yang memiliki aktifitas enzim selulolitik lebih tinggi dibandingkan isolat lain dilakukan uji patogenitas untuk mengetahui apakah isolat bakteri tersebut patogen atau tidak, selanjutnya dikarakterisasi secara molekuler (sekuensing) untuk mengetahui spesies bakteri tersebut. Berdasarkan hasil uji patogenitas menggunakan ikan nila diketahui bahwa pada masa uji patogeniatas selama dua minggu tidak ditemukan ikan mati baik perlakukan maupun kontrol (Tabel 5).
Tabel 5 Hasil uji patogenisitas isolat bakteri selulolitik dari rumput laut Sargasum sp dan Turbinaria sp pada ikan nila (Oreochromis. niloticus) selama 2 minggu
Jenis Bakteri Uji Patogenisitas (2 minggu) Ikan hidup (ekor) Ikan mati (ekor)
SS4b 10 0
SS4c 10 0
TS2b 10 0
Kontrol 10 0
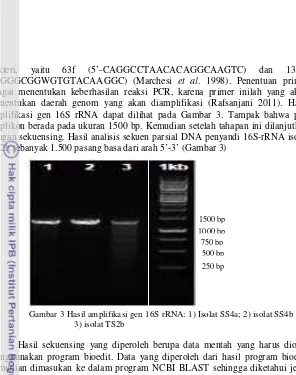
13 bakteri, yaitu 63f (5’-CAGGCCTAACACAGGCAAGTC) dan 1387r (5’GGGCGGWGTGTACAAGGC) (Marchesi et al. 1998). Penentuan primer sangat menentukan keberhasilan reaksi PCR, karena primer inilah yang akan menentukan daerah genom yang akan diamplifikasi (Rafsanjani 2011). Hasil amplifikasi gen 16S rRNA dapat dilihat pada Gambar 3. Tampak bahwa pita amplikon berada pada ukuran 1500 bp. Kemudian setelah tahapan ini dilanjutkan dengan sekuensing. Hasil analisis sekuen parsial DNA penyandi 16S-rRNA isolat TS2b sebanyak 1.500 pasang basa dari arah 5’-3’ (Gambar 3)
Gambar 3 Hasil amplifikasi gen 16S rRNA: 1) Isolat SS4a; 2) isolat SS4b dan 3) isolat TS2b
Hasil sekuensing yang diperoleh berupa data mentah yang harus diolah menggunakan program bioedit. Data yang diperoleh dari hasil program bioedit kemudian dimasukan ke dalam program NCBI BLAST sehingga diketahui jenis bakteri yang kita dapat. Hasil dari pembacaan pada program BLAST dapat dilihat pada Tabel 6.
Tabel 6 menunjukkan bahwa sampel mempunyai tingkat homologi yang tinggi berdasar pada urutan sekuen DNA yang tercover yaitu 96-99% dengan data yang ada di GeneBank. Tingkat kesamaan nukleotida sekitar 80% termasuk ke dalam tingkat kesamaan yang tinggi (Addinilia 2012). Teknik amplifikasi 16S rRNA merupakan teknik yang akurat, lebih sensitif, murah dan cepat dibandingkan dengan teknik identifikasi secara konvensional seperti morfologi, biokimia atau serologi tes. Identifikasi secara konvensional bisa menyebabkan spesies mempunyai kemiripan dalam fisiologi dan rentan terhadap perubahan lingkungan (Macrae 2000).
1000 bp
14
Gambar 4 Sebagian sekuen DNA penyandi 16S-rRNA isolat TS2b
Tabel 6 Hasil BLAST dari bakteri selulolitik terpilih
Kode sampel Cakupan (%) Deskripsi
TS2b 99 B. subtilis
SS4a SS4b
96 100
B. megaterium B. flexus
15 Menurut Deka et al. (2011), Bacillus spmerupakan bakteri yang banyak dimanfaatkan dalam bidang industri karena kemampuannya yang tinggi dalam produksi dan pengeluaran enzim ektraseluler dalam jumlah yang besar. Bacillus
spp. sangat potensial untuk dikembangkan dalam industri bioteknologi karena mempunyai sifat-sifat seperti memiliki kisaran suhu pertumbuhan yang luas, pembentuk spora, kosmopolit, tahan terhadap senyawa-senyawa antiseptik, bersifat aerob atau fakultatif anaerob, memiliki kemampuan enzimatik yang beragam, dan beberapa diantaranya mampu melakukan biodegradasi terhadap banyak senyawa xenobiotik serta tidak membutuhkan faktor tumbuh yang mahal.
Bacillus sp terdiri atas beberapa jenis dan tersebar luas diberbagai habitat. Jenis
Bacillus sp yang sudah dikenal di dunia industri di antaranya adalah Bacillus subtilis, B. megaterium dan B.flexus
B. subtilis merupakan bakteri Gram positif dengan katalase positif (Madigan & Martinko 2005). Bakteri ini berbentuk batang, mempunyai kemampuan membentuk endospora pelindung, sehingga memungkinkan bakteri ini dapat bertahan pada kondisi ekstrim (Nakano et al. 1998). B subtilis dilaporkan mempunyai aktifitas degradasi selulosa yang tinggi (Mawadza et al. 1996). B. subtilis strain AU-1 dapat menghasilkan carboxymethylcellulase (CMCase) dan avilase pada media yang mengandung berbagai karbohidrat sebagai sumber utama karbon untuk kehidupannya (Chan & Au 1987). Hal senada diungkapkan oleh Cantarel et al. (2009), B. subtilis bisa memanfaatkan mono, di, dan oligosakarida, gula amino dan turunan N-asetil, asam glikonik dan glikuronik, dan gula turunan polialkohol. Strain B. subtilis AS3 mempunyai kemampuan untuk mendegradasi substrat selulosa seperti sekam padi, ampas tebu, dan rumput liar (Deka et al. 2011).
Selulase B. subtilis dapat diproduksi pada medium yang murah seperti molase (Shabeb et al. 2010). B subtilis diketahui memiliki enzim pendegradasi polisakarida seperti α-amylase, pullulanase, endo-β-1,4-mannanase, levanase, glukan-1,4-α-maltohydrolase, pectate lyase, β-1,4-endoglukanase, β-1,3-1,4-endoglukanase, dan endo-1,4-β-xylanase. Enzim-enzim tersebut dapat memecah polisakarida ke dalam karbohidrat yang larut (Deutsche et al. 2002). Narasimhan
et al. (2013) melaporkan bahwa B.subtilis memiliki enzim kitinase dan β
1,3-Glukanase sehingga bakteri ini banyak digunakan sebagai agen biokontrol.
B.subtilis sangat menarik digunakan dalam industri karena pertumbuhannya yang cepat, mampu mensekresikan protein ke dalam medium, dan umumnya aman digunakan (Schallmey et al. 2004; Simonen & Palva 1993). B. subtilis juga merupakan salah satu model mikroorganisme yang banyak digunakan dalam studi pengembangan biokimia, genetik dan biologi molekular (Barbe et al. 2009; Kunst
et al. 1997). Hasil penelitian Manabe et al. (2013) mencatat terjadinya peningkatan produksi alkalin selulase pada B. subtilis strain MGB874 sampai sebesar 5,5g/L melalui fermentasi NH3-auksotat dan nilai ini merupakan jumlah tertinggi yang pernah dilaporkan.
B. subtilis merupakan inang yang sempurna untuk produksi berbagai
16
mengekspresikan gen selulase di B. subtilis yaitu dari vektor atau kromosom (Schumann 2007).
B. megaterium merupakan bakteri Gram positif bersifat aerobik dan
mempunyai kemampuan membentuk spora. B. megaterium banyak ditemukan dalam tanah, air laut, sedimen, sawah, makanan kering, madu, susu, isi rumen sapi serta limbah industri daging dan petrokimia (Andriani et al. 2012; Scholle et al.
2003). Nilai ekonomis penting dari bakteri ini adalah kemampuannya memproduksi vitamin B12 dan penisilin amidase serta mengekspresikan protein asing tanpa degradasi dan penggunaannya dalam diagnostik AIDS (Scholle et al.
2003). B. megterium mampu tumbuh pada berbagai sumber karbon dandilaporkan mempunyai beberapa enzim ektraseluler diantaranya enzim β-amilase, cyclodekstrin glukanotransferase, dextranase, selulase, cellulase-free xylanase
(Andriani et al. 2012; Sindhu et al. 2006; Priest 1977). B. megaterium dosis 1% dapat menurunkan serat kasar kulit umbi sebesar 30.14% (Andriani et al. 2012).
B. flexus merupakan bakteri Gram positif, membentuk spora, motil,
mempunyai pertumbuhan optimum pada pH 10 dan suhu 37 0C. B. flexus
dilaporkan mempunyai beberapa enzim ekstraseluler seperti selulase dan amilase
yang toleran terhadap alkali dan kadar garam (Zhao et al. 2008; Trivedi et al.
2011). B. flexus diketahui mempunyai kemampuan untuk menurunkan kadar COD sampai dengan 81.04% sehingga bakteri ini bisa digunakan dalam bioremediasi limbah alkalin (Wang & Zhao 2013)
Tahap 2: Produksi enzim selulase yang dihasilkan dari mikroba terpilih Dari hasil tahap satu diketahui isolat TS2b (B.subtilis) mempunyai atifitas enzim selulase paling tinggi, sehingga isolat ini digunakan untuk percobaan tahap selanjutnya. Pada percobaan penentuan waktu optimum produksi enzim selulase, isolat TS2b ditumbuhkan pada media CMC 1% pada suhu inkubasi 28 0C. Pertumbuhan bakteri dilihat dari nilai kerapatan optik yang dihasilkan pada setiap 24 jam pengukuran selama 96 jam pada λ 600 nm. Selain dilihat kerapatan optiknya, optimasi produksi enzim selulase dilihat dengan mengukur aktifitas selulase yang dihasilkan selama waktu inkubasi. Kurva pertumbuhan dan aktifitas enzim selulase isolat TS2b disajikan pada Gambar 5 dan 6. Puncak aktifitas dan waktu optimum untuk produksi enzim selulase terjadi pada jam ke 78 yaitu sebesar 0.0214 U/mL dengan kadar glukosa yang dilepaskan sebesar 0.0231 mg/L (Tabel 7). Waktu inilah yang digunakan untuk produksi enzim selulase pada tahap percobaan selanjutnya.
17 Isolat TS2b mengalami fase eksponensial pada jam 24 sampai dengan jam ke 72. Pada fase ini bakteri mengalami pertumbuhan yang cepat. Madigan et al.
(2009) menyatakan bahwa fase logaritmik merupakan fase pertumbuhan bakteri yang berlangsung sangat cepat karena terjadi penggandaan sel bakteri secara cepat. Pada jam ke 72-78, isolat TS2b mengalami fase stasioner, yaitu laju pertumbuhan sama dengan laju kematiannya sehingga jumlah bakteri keseluruhan akan tetap. Fase stationer dilanjutkan dengan fase kematian yaitu jam ke-78 sampai dengn jam ke-96. Pada fase ini bakteri tidak dapat mengalami pertumbuhan kembali.
Tabel 7 Konsentrasi gula pereduksi pada berbagai waktu inkubasi
Periode Inkubasi Konsentrasi gula pereduksi
(jam) (mg/mL)
24 0.02096
48 0.02139
72 0.02214
78 0.02311
96 0.02236
Gambar 6 Kurva aktifitas enzim selulase isolat TS2b
Setiap bakteri selulolitik menghasilkan komplek enzim yang berbeda-beda tergantung dari gen yang dimiliki dan sumber karbon yang digunakan (Maranatha 2008). Dalam penelitian ini isolat TS2b ditumbuhkan pada media cair CMC 1% sebagai komponen indusernya dan ditambahkan glukosa 0.1% dan ekstrak khamir 0.2% sebagai media pemacu tumbuh sel pada fase lag. Setelah glukosa pada media habis maka bakteri akan mulai memanfaatkan selulosa sebagai sumber energinya dengan mengeluarkan enzim selulase.
18
Pada fase kematian, kematian sel semakin cepat dan sel banyak yang mengalami lisis sehingga lebih banyak enzim protease intraseluler yang dihasilkan yang berakibat semakin menurunnya enzim selulase yang dihasilkan. Terjadinya peningkatan aktifitas enzim selulase menunjukkan bahwa isolat TS2b telah melakukan degradasi terhadap fraksi selulosa yang terdapat pada substrat untuk menghasilkan glukosa yang akan dipergunakan untuk metabolisme sel
Tahap 3: Evaluasi Efektivitas Enzim Selulase dalam Meningkatkan Mutu Hasil Samping Olahan Ubi Kayu (DUK, KUK dan OGK )
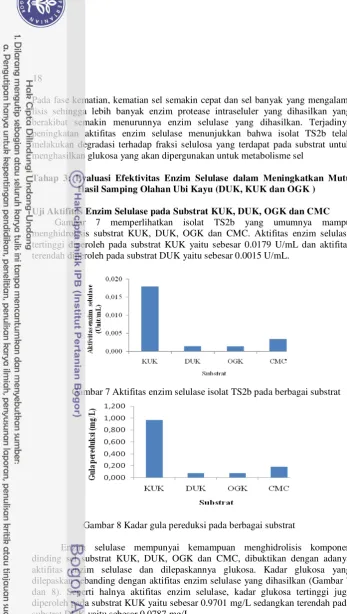
Uji Aktifitas Enzim Selulase pada Substrat KUK, DUK, OGK dan CMC Gambar 7 memperlihatkan isolat TS2b yang umumnya mampu menghidrolisis substrat KUK, DUK, OGK dan CMC. Aktifitas enzim selulase tertinggi diperoleh pada substrat KUK yaitu sebesar 0.0179 U/mL dan aktifitas terendah diperoleh pada substrat DUK yaitu sebesar 0.0015 U/mL.
Gambar 7 Aktifitas enzim selulase isolat TS2b pada berbagai substrat
Gambar 8 Kadar gula pereduksi pada berbagai substrat
19 Substrat KUK, DUK dan OGK merupakan substrat selulosa yang tidak murni. Selain mengandung selulosa, substrat ini mengandung komponen serat lain seperti hemiselulosa dan lignin (Tabel 8). Aktifitas selulase TS2b lebih tinggi pada substrat KUK dibanding pada DUK, OGK dan CMC. Hal ini kemungkinan disebabkan adanya enzim hemiselulolitik yang mampu mendegradasi hemiselulosa menjadi glukosa pada enzim kasar yang diproduksi oleh TS2b. Ada hubungan yang erat antara enzim selulase dengan hemiselulase. Ada beberapa bakteri yang selain menghasilkan selulase, juga dapat menghasilkan hemiselulase. Seperti yang diungkapkan Han et al. (2003) bahwa bakteri Clostridium
cellulovorant saat ditumbuhkan pada substrat selulosa ternyata dapat
menghasilkan enzim hemiselulolitik (xylA). Diduga bakteri TS2b juga menghasilkan enzim hemiselulolitik.
Di antara substrat yang diuji, aktifitas enzim selulase tertinggi diperoleh pada substrat KUK. Hal ini bisa disebabkan karena lebih rendahnya kadar lignin yang terkandung dalam KUK dibanding DUK. Pada Tabel 8 dapat dilihat bahwa kandungan lignin KUK dan DUK berturut-turut sebesar 8.54 dan 19.23%. Diduga kandungan lignin ini mempengaruhi kerja enzim selulase.
Tabel 8 Kadar selulosa, hemiselulosa dan lignin pada KUK dan DUK
Substrat Selulosa (%) Hemiselulosa (%) Lignin (%)
KUK 9.05 10.46 8.54
DUK 22.85 0.04 19.23
Selulosa terbungkus dan terikat pada matrik amorf lignin dan hemiselulosa. Lignin membungkus dan mengikat selulosa secara fisik sehingga menghalangi enzim selulase bekerja secara maksimal pada substrat. Adanya lignin tersebut dapat menyebabkan rendahnya biodegradasi selulosa dan hemisellulosa (Soliman et al. 2013). Hasil serupa diperoleh pada penelitian Maranatha (2008) yang memperlihatkan bahwa aktifitas enzim selulase isolat C5-1 lebih tinggi pada substrat kulit pisang dibanding CMC. Begitu pula aktifitasnya lebih tinggi pada kulit pisang daripada tongkol jagung. Hal ini diduga disebabkan oleh kadar lignin pada kulit pisang lebih sedikit dibanding pada tongkol jagung.
Dihasilkannya aktifitas selulase dan gula pereduksi menunjukkan bahwa selulosa dalam substrat telah terhidrolisis dan dirubah menjadi glukosa. Dengan bekurangnya kadar selulosa diharapkan dapat meningkatkan kecernaan bahan tersebut sehingga pemanfaatannya dalam formulasi pakan ikan lebih dapat dioptimalkan. Ikan mempunyai keterbatasan dalam mencerna serat kasar dalam pakan karena jumlah enzim pencernaan yang diproduksi oleh ikan hanya bersumber dari saluran pencernaan dan dari mikroflora yang terdapat dalam usus yang jumlahnya terbatas (Andriani et al. 2012). Menurut Leeson & Zubair (2000), selulosa dapat mempengaruhi viskositas cairan usus yang berakibat terhadap penurunan kecepatan difusi substrat dan enzim pencernaan, sehingga menurunkan efisiensi penyerapan nutrien secara keseluruhan pada dinding usus, yang pada gilirannya akan berdampak langsung terhadap efisiensi pakan dan performa ternak.
20
pengaruh yang berbeda terhadap pertambahan bobot dan panjang ikan nila (O. niloticus). Hal yang serupa yang ditemukan oleh Keong & Wee (1989) yang memperlihatkan bahwa tidak ada perbedaan antara pemanfaatan DUK secara segar ataupun kering terhadap pertumbuhan ikan nila tetapi semakin tinggi tingkat DUK dalam pakan cenderung menurunkan pertumbuhan dan efisiensi pakan. Bichi & Ahmad (2010) menunjukkan bahwa tingkat inklusi DUK terhadap maize meal sebesar 66.7% memberikan respon pertumbuhan terbaik pada ikan Clarias gariepinus. Penelitian Nnaji et al. (2010) memperlihatkan bahwa ikan nila (O.
niloticus) yang diberi pakan dengan DUK memberikan pertumbuhan, rasio
efiesiensi protein dan konversi pakan yang lebih baik dibanding pakan yang mengandung daun Gliricidia sepium dan Stylosanthes humilis. Menurut Azwar & Melati (2012), laju pertumbuhan spesifik ikan nila yang diberi pakan dengan menggunakan kulit ubi kayu terfermentasi hingga 16% tidak berbeda nyata dengan perlakuan kontrol (tanpa tepung kulit ubi kayu).
Uji Aktifitas Enzim Selulase Mikroba Terpilih (B. subtilis) pada Substrat Paling Cocok (KUK)
Dari hasil uji aktifitas selulase pada berbagai substrat, diketahui bahwa enzim selulase yang dihasilkan isolat TS2b efektif dalam menghidrolisis KUK, sehingga pada tahap ini dilihat lebih lanjut pengaruh enzim selulase terhadap kualitas nutrisi KUK. Hasil pengukuran parameter fraksi serat (NDF, ADF, Selulosa, hemiselulosa, dan lignin) KUK dengan pemberian dosis enzim selulase yang berbeda dapat dilihat pada Tabel 9.
Tabel 9 Kadar fraksi serat KUK pada berbagai dosis enzim selulase isolat TS2b Dosis
(%)
Kadar Fraksi Serat (%)a
NDF ADF Lignin Selulosa Hemiselulosa
0 39.75 ± 0.16a 24.19 ± 0.06a 8.74 ± 0.57a 14.85 ± 0.64a 15.57 ± 0.09a 25 33.28 ± 0.35b 23.96 ± 0.09ab 12.14 ± 0.03b 12.17 ± 0.04b 9.32 ± 0.45b
50 33.15 ± 0.43b 23.79 ± 0.13b 10.74 ± 0.38c 13.30 ± 0.10c 9.37 ± 0.56b aAngka-angka pada kolom yang sama yang dikuti oleh huruf yang sama tidak berbeda
nyata pada taraf uji 5% (P>0.05)
21 dari Tricoderma viride. Begitupun jagung yang diberi perlakuan dengan enzim selulase mempunyai kadar NDF yang lebih rendah dibandingkan dengan tanpa enzim selulase. Penelitian Alemawor et al. (2009) menunjukkan terjadinya penurunan kadar ADF dan NDF pada kulit coklat (cocoa pod husk) yang diberi enzim fibrolitik. Penurunan kadar NDF dan ADF disebabkan karena adanya pemutusan ikatan lignoselulosa (Akhmal 1994).
NDF merupakan komponen serat tanaman yang terdiri atas hemiselulosa, selulosa dan lignin yang tidak larut dari matrik dingding sel. Semakin tinggi kadar NDF dalam pakan maka terjadi kecenderungan penurunan komsumsi pakan. NDF dibutuhkan dalam pakan, jika kadar NDF terlalu rendah maka akan terjadi ganguan pencernaan seperti asidosis dan displasia abomasum. NDF biasanya banyak digunakan ahli gizi sebagai penanda keseimbangan pakan (Robinson et al.
1998).
ADF merupakan sub-fraksi dari NDF terdiri dari lignin dan selulosa. ADF merupakan bagian fraksi serat yang tidak larut dalam larutan detergen asam. ADF menentukan kecernaan beberapa hijauan, semakin tinggi kadar ADF maka semakin turun kualitas hijauan tersebut (Robinson et al. 1998). Menurut Van Soest et al. (1991) bahwa NDF dan ADF mempunyai korelasi yang negatif dengan kecernaan bahan pada hewan. Kemampuan hewan monogastrik dan ruminan sangat berbeda dalam mencerna serat kasar. Ruminan mempunyai kemampuan lebih baik dalam mencerna serat kasar karena mempunyai mikroorganisme dalam saluran pencernaannya yang bisa mencerna serat kasar. ADF mewakili selulosa dan lignin dingding sel tanaman. Analisis ADF dibutuhkan untuk evaluasi kualitas serat untuk pakan ternak ruminansia dan herbivora lain. Untuk ternak non ruminansia dengan kemampuan pemanfaatan serat yang kecil, hanya membutuhkan analisis NDF (Soeparjo 2004).
22
Kandungan lignin KUK yang diberi perlakuan enzim lebih tinggi dibandingkan kontrol. Hal yang sama terjadi pada penelitian Hidayat et al. (2005) di mana kadar lignin jerami padi mengalami peningkatan setelah diberi perlakuan enzim selulase komersial. Hal ini terjadi karena diduga enzim selulase yang dihasilkan dari bakteri TS2b tidak mempunyai aktifitas lignase sehingga penambahan enzim ini tidak mampu menurunkan kadar lignin pada KUK Terdapat dua sistem kerja enzim ektraseluler yang dihasilkan oleh mikroba: 1) sistem hidrolitik, yaitu sistem kerja enzim ekstraseluler yang menghasilkan enzim hidrolase yang bekerja merombak selulosa dan hemiselulosa, dan 2) sistem oksidatif dan sekresi lignase ekstraseluler dengan cara depolimerisasi lignin (Perez et al. 2002). Enzim selulase yang dihasilkan bakteri TS2b diduga merupakan tife enzim ekstraseluler dengan sistem kerja hidrolitik yang hanya bisa bekerja merombak selulosa dan hemiselulosa tetapi tidak untuk lignin. Van Soest (2006) menyatakan bahwa hanya jamur pelapuk putih yang mampu mendegradasi lignin secara efektif. Jamur pelapuk putih memproduksi enzim lignolitik yang mampu bekerja mengoksidasi pelepasan unit fenilpropanoid, demetilasi, mengubah gugus aldehid menjadi gugus karboksil, dan membuka cincin aromatik sehingga sempurna merombak lignin menjadi C02 dan H2O. Jamur ini menghasilkan tiga kelas enzim ekstraseluler perombak lignin yaitu lakase pengoksidasi fenol, peroksidase lignin dan oksidase mangan (Soeparjo 2004).
23
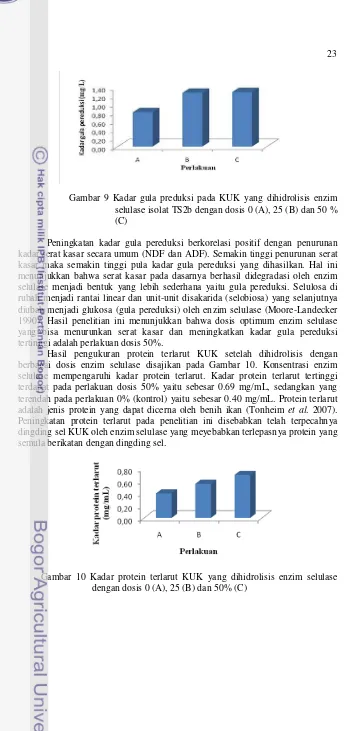
Gambar 9 Kadar gula preduksi pada KUK yang dihidrolisis enzim selulase isolat TS2b dengan dosis 0 (A), 25 (B) dan 50 % (C)
Peningkatan kadar gula pereduksi berkorelasi positif dengan penurunan kadar serat kasar secara umum (NDF dan ADF). Semakin tinggi penurunan serat kasar maka semakin tinggi pula kadar gula pereduksi yang dihasilkan. Hal ini menunjukkan bahwa serat kasar pada dasarnya berhasil didegradasi oleh enzim selulase menjadi bentuk yang lebih sederhana yaitu gula pereduksi. Selulosa di rubah menjadi rantai linear dan unit-unit disakarida (selobiosa) yang selanjutnya diubah menjadi glukosa (gula pereduksi) oleh enzim selulase (Moore-Landecker 1990). Hasil penelitian ini menunjukkan bahwa dosis optimum enzim selulase yang bisa menurunkan serat kasar dan meningkatkan kadar gula pereduksi tertinggi adalah perlakuan dosis 50%.
Hasil pengukuran protein terlarut KUK setelah dihidrolisis dengan berbagai dosis enzim selulase disajikan pada Gambar 10. Konsentrasi enzim selulase mempengaruhi kadar protein terlarut. Kadar protein terlarut tertinggi terdapat pada perlakuan dosis 50% yaitu sebesar 0.69 mg/mL, sedangkan yang terendah pada perlakuan 0% (kontrol) yaitu sebesar 0.40 mg/mL. Protein terlarut adalah jenis protein yang dapat dicerna oleh benih ikan (Tonheim et al. 2007). Peningkatan protein terlarut pada penelitian ini disebabkan telah terpecahnya dingding sel KUK oleh enzim selulase yang meyebabkan terlepasnya protein yang semula berikatan dengan dingding sel.
24
4
SIMPULAN
Dari hasil isolasi bakteri dari rumput laut Sargasum sp dan Turbinaria sp diperoleh 22 isolat dan tiga isolat di antaranya menghasilkan aktifitas enzim selulase yang tinggi yaitu isolat TS2b, SS4a dan SS4b. Hasil identifikasi secara biokimia dan molekuler gen 16S-rRNA diketahui bahwa ketiga isolat tersebut adalah B. subtilis, B. megaterium dan B. flexus dengan aktifitas enzim selulase tertinggi terdapat pada isolat TS2b (B. subtilis). Produksi enzim selulase maksimum oleh bakteri TS2b terjadi pada jam ke -78 setelah inkubasi. Daya hidrolisis enzim selulase tertinggi diperoleh pada substrat KUK dan daya hidrolisis terendah diperoleh pada substrat DUK. Dari hasil uji lebih lanjut dengan menggunakan beberapa dosis enzim selulase isolat TS2b terhadap substrat KUK diketahui bahwa dosis enzim selulase yang paling efektif meningkatkan mutu KUK secara umum adalah dosis 50% dengan besar penurunan fraksi serat NDF, selulosa, dan hemiselulosa berturut-turut sebesar 16.60, 10.44 dan 39.82%.
DAFTAR PUSTAKA
Addinilia D. 2012. Analisis karakter genetik gen cytocrome B pada sidat (Anguilla bicolor dan A.marmorata). Skripsi. Jatinangor (ID): Universitas Padjadjaran
Alemawor F, Dzogbefia VP, Oddoye EOK, Oldham JH. 2009. Enzymee cocktail for enhancing poultry utiulisation of cocoa pod husk. Scientific Research and Essay 4(6): 555-559
Akmal. 1994. Pemanfaatan Wastelage Jerami Padi sebagai Bahan Pakan sapi FH Jantan. Tesis. Pascasarjana Institut Pertanian Bogor, Bogor.
Andriani Y, Sastrawibawa S, Safitri R, Abun. 2012. Isolasi dan identifikasi mikroba selulolitik sebagai biodegradator serat kasar dalam bahan pakan dari limbah pertanian. IJAS 2(3). 6 hal.
Anindyawati T. 2010. Potensi Selulase Dalam Mendegradasi Lignoselulosa Limbah Pertanian Untuk Pupuk Organik. Pusat Penelitian Bioteknologi-LIPI Jl. Raya Bogor Km. 46 Cibinong 16911.
Azwar ZI, Melati I, Kurniasih T. 2010. Perbaikan kualitas bahan baku pakan dengan menggunakan teknologi dan mikroba Aspergillus niger. Laporan seminar hasil riset. Balai Riset Perikanan Budidaya Air Tawar, Bogor. Hal 125-135.
Azwar ZI, Melati I. 2012. Penggunaan tepung kulit ubi kayu fermentasi dalam formulasi pakan ikan nila. Jurnal Riset Akuakultur 7(3): 429-436
25 Barbe, V, Cruveiller S, Kunst F, Lenoble P, Meurice G, Sekowska A, Vallenet D, Wang T, Moszer I, Medigue C. 2009. From a consortium sequence to a unified sequence: the Bacillus subtilis 168 reference genome a decade later.
Microbiology. 155:1758 – 1775.
Bhat MK. 2000. Cellulases and related enzymes in biotechnology. Biotechnol Adv. 18: 355–383
Bichi AH, Ahmad MK. 2010. Growth performance and nutrient utilization of
African catfish (Clarias gariepinus) fed varying dietary levels of processed cassava leaves. Bayero Journal of pure and Apllied Science 3(1):118-122. Busairi AM, Hersoelistyorini W. 2009. Pengkayaan protein kulit ubi kayu
melalui proses fermentasi: optimasi nutrien-substrat menggunakan
responese surface methodology. Prosiding. Seminar Nasional Teknik Kimia Indonesia. Bandung:6 hal.
Cantarel BL, Coutinho PM, Rancurel C, Bernard T, Lombard V, Henrissat B. 2009. The Carbohydrate-Active Enzymes database (CAZy): an expert resource for g lycogenomics. Nucleic Acids Res. 37 : D233–D238.
Chan KY, Au KS. 1987. Studies on celliulase production by Bacillus subtilis.
PubMed. Gov. 53(2):125-136. PMID;3116921. www.ncbi.nlm..gov/pubmed Chhay T, Borin K, Sopharith N, Preston TR, Aye TM. 2010. Effect of sun-dried and fresh cassava leaves on growth of Tilapia (Oreochromis niloticus) fish fed basal diets of rice bran or rice bran mixed with cassava root meal. Livestock Research for Rural Development. Volume 22, Article 43.
http://www.lrrd.org/lrrd22/3/chha22043. Di unduh tanggal 18 Maret 2014. Deng SP, Tabatabai MA. 1994. Cellulase activity o f soils. Soil Biol Biochem.
26:1347-1354.
Deka D, Bhargavi P, Sharma A, Goyal D, Jawed M, Goyal A. 2011. Enhancement of cellulase activity from a new strain of Bacillus subtilis by medium optimization and analysis with various cellulosic substrates. Research Article. Indian Institut of Technologi Guwahati. India. 8 p
Deutsche J, Galinier A, Martin-Verstraete I. 2002. Carbohydrate uptake and metabolism. In Bacillus subtilisand its Closest Relatives: from Genes to Cells, pp. 129–150. Edited by A. L. Sonenshein, J. A. Hoch & R. Losick. Washington, DC: American Society for Microbiology.
Eggum BO. 1970. The protein quality of cassava leaves. J. Nutrition 25:761-768. FAO. 2011. The cassava transformation in Africa". The Food and Agriculture
Organization of the United Nations (FAO).
Halid I. 1991. Perubahan nilai gizi onggok yang diperkaya nitrogen bukan protein selama proses fermentasi dengan biakan kapan (Tesis). Bogor (ID):Institut Pertanian Bogor. Program Pasca Sarjana.
Han SO, Yukawa H, Inui M, Doi RH. 2003. Regulation of expression of cellulosomal cellulase and hemicellulase genes in Clostridium cellulovorans. J. Bacteriol 185 (20): 6067-6075.
26
Harfiah. 2010. Optimalisasi pakan berserat tinggi melalui sistem perenggangan ikatan lignoselulosa dalam meningkatkan kualitas limbah pertanian sebagai pakan ruminansia. Seminar Nasional Teknologi Peternakan dan Veteriner. 123-130
Hendksson G, Nutt A, Henriksson H, Pettersson B, Staehlberg J, Johansson G, Pettersson G. 1999. Endoglucanase 28 (Cell2A), a new Phanerochaete chrysosporium cellulose. Eur. J. Biochem. 259: 88.
Hedjazia S, Kordsachiab O, Patt R, Latibarid AJ, Tschirnere U. 2009 Alkaline sulfite–anthraquinone (AS/AQ) pulping of wheat straw and totally chlorine free (TCF) bleaching of pulps. J. Idustrial Crops and products 29: 27 – 36. Hidayat R, Wulandari S, Wiryawan KG, Suryahadi. 2005. Production and
utilization of cellulase from Trichoderma viride. Biotropia , 25 : 50 – 59 Kader AJ, Omar O. 1998. Isolation of cellulolytic fungi from Sayap-Kinabalu
Park, Sabah. Serawak. J. Biodiversity Bio-Conserv. (ARBEC): 1-6.
Keong W, Wee KL. 1989The nutritive value of cassava leaf meal in pelleted feed for Nile tilapia. . Aquaculture 83(1): 45-58.
Kim SJ, Lee CM, Han BR, Kim MY, Yeo YS, Yoon SH, Koo BS, Jun HK. 2008. Characterization of a gene encoding cellulase from uncultured soil bacteria.
FEMS Microbiol 282:44-51.
Kunst F, Ogasawara N, Moszer I, Albertini AM, Alloni G, Azevedo V, Bertero MG, Bessieres P, Bolotin A, Borchert S. 1997. The complete genome sequence of the gram-positive bacterium Bacillus subtilis. Nature 390:249– 256.
Lamid M. 2008. Optimalisasi Potensi Enzim Xilanase Produksi Mikroba Rumen dalam Biodegradasi Hemiselulosa pada Jerami padi sebagai Strategi Pemberian Pakan Ruminansia. Disertasi. Malang (ID): Pascasarjana Universitas Brawijaya, Malang
Leeson S, Zubair AK. 2000. Digestion in Poultry II: Carbohydrates, Vitamins and Mineral. Department of Animal and Poultry Science, University of Guelph Ontario.Canada.
Macrae A. 2000. The use of 16S rDNA methods in soil microbial ecology. Braz. J. Microbiol. 31:77-82.
Madigan MT, Martinko JM, Parker J. 2009. Brock Biology of Microorganisms. London: Prentice-Hall International (UK) Limited. hlm 991.
Madigan M, Martinko. 2005. Brock Biology of Microorganisms (11th ed.). Prentice Hall.
Maki M, Leung KT, Qin W. 2009. The prospects of cellulaseproducing bacteria for the bioconversion of lignocellulosic biomass. International Journal of Biological Siences 5(5): 500–516
Manabe K., Kageyama Y, Morimoto T, Shimizu E, Takashi H, Kanaya S, Ara K, Ozaki K, Ogasawara N. 2013. Improved production of secreted heterologous enzymee in Bacillus subtilis strain MGB874 via modification of glutamate metabolism and growth conditions. Jurnal Microbial Cell Factories 12:18. 10 p
27 Maranatha B. 2008. Aktivitas enzim selulase isolat asal Indonesia pada berbagai substrat limbah pertanian. Skripsi. Bogor (ID): Insitut Pertnian Bogor. 11 hal
Marchesi JR, Sato T, Andrew J, Weightman, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S-rRNA. Appl Environ Microbiol.
64 (2):795-799.
Martina A, Yuli N, Sutisna M. 2002. Optimasi beberapa faktor fisik terhadap laju degrdasi selulosa kayu albasia Paraserianthes falcataria (L) Nielsen dan Karboksimetilselulosa (CMC) secara enzimatik oleh jamur. J. Natur 4: 156-163
Mawadza C, Boogerd FC, Zvauya R, Verseveld HW. 1996. Influence of environmental factors on endo-ß1,4-glucanase production by Bacillus HR 68, isolated from a Zimbabwean hot spring. Antonie Van Leeuwe hoek
.vol.69
Meryandini A, Widosari W, Maranatha B, Sunarti TC, Rachmania N, Satria H. 2009. Isolasi bakteri selulolitik dan karakterisasi enzimnya. Jurnal Makara Sains 13 (1): 33-38.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 31: 426-428
Moore-Landecker E. 1990. Fundamentals of the Fungi. Fourth Edition. Prentice. Nakano, Michiko, Mm, Zuber, Peter .1998. Anaerobic Growth of A "Strict
Aerobe" (Bacillus Subtilis. Annual Review of Microbiology. 52: 165
Narasimhan A, Bist D, Suresh S, Shivakumar S. 2013. Optimization of mycolitic enzymes (Chitinase, B-1,3 –Glukanase and Cellulase) production by
Bacillus subtilis, a potensial biocontrol agen using one-factor approach.
Journal of Scientific and Industrial research 72:172-178
National Research Council. 1983. Nutrient requirement of warmwater fishes and shellfish; Revised Edition. National Academy Press, Washington D.C. 258p Nnaji JC, Okoye FC, Vo O. 2010. Screening of leaf meals as feed supplements in the culture of Oreochromis niloticus . African Journal of Food Agriculture Nutrition and Development 10(2): 2112-2123
Nurhayani HM, Nuryati J, I Nyoman PA. 2000. Peningkatan kandungan kulit ubi kayu melalui proses fermentasi. Jurnal Makara Sains 6 (1): 1-12.
Oboh G. 2006. Nutrient enrichmen of cassava peels using a mixed culture of
Saccharomyches cerevisiea and Lactobacillus spp solid media fermentation technique. Electronic Journal of Biotechnology 9 (1). 4 p.
Orth AB, Royse DJ, Tien M. 1993. Ubiquity of lignindegrading peroxidases among various wood-degrading fungi. Appl. Environ. Microbiol. 59:4017-4023
Paterson, A. 1986. Biodegradation of lignin and cellulosic material. Expert Consultation on Biotechnology for livestock Production and Health. Rome. AGA:Biot/86/24.