PENGAMATAN UJI DAYA BERKECAMBAH, OPTIMALISASI
SUBSTRAT PERKECAMBAHAN DAN PEMATAHAN DORMANSI
BENIH KECIPIR (
Psophocarpus tetragonolobus
(L.) DC)
ANGGIT DWI RAHAYU
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengamatan Uji Daya Berkecambah, Optimalisasi Substrat Perkecambahan dan Pematahan Dormansi Benih Kecipir (Psophocarpus tetragonolobus (L.) DC) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dcantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Anggit Dwi Rahayu
ABSTRAK
ANGGIT DWI RAHAYU Pengamatan Uji Daya Berkecambah, Optimalisasi Substrat Perkecambahan dan Pematahan Dormansi Benih Kecipir (Psophocarpus tetragonolobus (L.) DC). Dibimbing oleh TATIEK KARTIKA SUHARSI.
Ketersediaan sayuran indigenous masih terbatas. Pengujian mutu benih menjadi langkah dasar untuk meningkatkan produksi sayuran indigenous. Penelitian ini bertujuan untuk pengembangan metode uji daya berkecambah benih kecipir (aspek penentuan hitungan pertama dan kedua), pemilihan substrat perkecambahan, dan pemilihan teknik pematahan dormansi benih kecipir. Penelitian dilaksanakan di Laboratorium Penyimpanan dan Pengujian Mutu Benih IPB selama 5 bulan. Pengembangan metode uji perkecambahan yang diperoleh dari penelitian ini yaitu pengamatan uji daya berkecambah benih kecipir menggunakan alat pengecambah tipe
eco-germinator dilakukan pada hari ke-6 untuk hitungan pertama dan hari ke-8 untuk hitungan kedua. Kertas cd buram dapat digunakan sebagai substrat kertas alternatif pada metode UKDdp. Substrat pasir (in sand) merupakan substrat terbaik apabila pengujian benih tidak menggunakan substrat kertas. Skarifikasi menggunakan amplas merupakan teknik pematahan dormansi terbaik untuk benih kecipir. Sterilisasi permukaan benih menggunakan natrium hipoklorit perlu dilakukan sebelum benih dikecambahkan.
Kata kunci: hitungan pertama, hitungan kedua, kertas CD, amplas, pasir
ABSTRACT
ANGGIT DWI RAHAYU Evaluation of Seeds Germination, Optimization Germination Substrates and Dormancy Breaking of Winged Bean Seed (Psophocarpus tetragonolobus (L.) DC). Supervised by TATIEK KARTIKA SUHARSI.
Availability of indigenous vegetable is still limited. Seed testing become fundamental to increase production of indigenous vegetable. The objectives of this
research were to evaluate the development of winged bean’s germination methods (first
PENGAMATAN UJI DAYA BERKECAMBAH, OPTIMALISASI
SUBSTRAT PERKECAMBAHAN DAN PEMATAHAN DORMANSI
BENIH KECIPIR (
Psophocarpus tetragonolobus
(L.) DC)
ANGGIT DWI RAHAYU
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah ini. Kegiatan penelitian berjudul Pengamatan Uji Daya Berkecambah, Optimalisasi Substrat Perkecambahan dan Pematahan Dormansi Benih Kecipir (Psophocarpus tetragonolobus (L.) DC) yang dilaksanakan sejak bulan Januari 2015 hingga Mei 2015.
Penulis menyampaikan ucapan terima kasih kepada:
1. Dr Tatiek Kartika Suharsi, MS selaku dosen pembimbing skripsi dan dosen pembimbing akademik yang telah memberikan arahan, bimbingan, dan motivasi selama pelaksanaan penelitian hingga penulisan karya ilmiah ini
2. Dr Ir Faiza Chairani Suwarno, MS dan Juang Gema Kartika, SP MSi selaku dosen penguji yang telah memberikan koreksi dan saran terhadap karya ilmiah ini
3. Bapak Karjan, Ibu Siti Rahayu, dan adik Rafidan Triadji yang selalu memberikan kasih sayang, doa, dan dukungannya bagi penulis
4. Semua teman-teman Agronomi dan Hortikultura angkatan 48 yang telah membantu dan memberikan dukungan dalam menyelesaikan rangkaian kegiatan penelitian ini serta seluruh pihak yang telah membantu dalam kelancaran penulisan karya ilmiah.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Hipotesis 2
TINJAUAN PUSTAKA 2
Kecipir (Psophocarpus tetragonolobus (L.) DC) 2 Pengamatan Uji Daya Berkecambah 3 Substrat Perkecambahan Benih 4
Dormansi Benih 5
METODE PENELITIAN 5
Lokasi Penelitian dan Waktu Penelitian 5
Bahan 5
Alat 6
Prosedur Penelittian 6
Pengamatan 7
Analisis Data 9
HASIL DAN PEMBAHASAN 10
Kondisi Umum Benih dan Viabilitas Awal 10 Penentuan Hari Pengamatan dalam Uji Daya Berkecambah 11 Optimalisasi Substrat Perkecambahan 15
Pematahan Dormansi 19
KESIMPULAN DAN SARAN 23
Kesimpulan 23
Saran 23
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Daya berkecambah benih kecipir tanpa skarifikasi 13 2 Penentuan hitungan pertama pada benih kecipir 14 3 Rekapitulasi hasil sidik ragam pengaruh media terhadap tolok ukur vigor
dan viabilitas benih kecipir 15 4 Nilai rataan tolok ukur viabilitas dan vigor pada pembandingan substrat
kontrol kertas saring 16
5 Nilai rataan tolok ukur viabilitas dan vigor pada pembandingan substrat
kontrol pasir (in sand) 17
6 Rekapitulasi hasil sidik ragam pengaruh perlakuan pematahan dormansi
terhadap tolok ukur vigor dan viabilitas benih kecipir 20 7 Nilai rataan tolok ukur viabilitas dan vigor benih pada perlakuan pematahan
dormansi 21
DAFTAR GAMBAR
1 Kriteria kecambah normal benih kecipir 8 2 Keragaan benih kecipir lokal Cilacap 10 3 Kecambah kecipir pada 14 HST 12 4 Jumlah kecambah normal harian selama 14 hari pengamatan tanpa
skarifikasi 12
5 Jumlah kecambah normal harian selama 14 hari pengamatan setelah
skarifikasi 14
6 Struktur kecambah benih kecipir 15 7 Perbandingan kecambah normal yang dihasilkan dari substrat arang sekam
dengan substrat lainnya 18
8 Jumlah benih keras (hard seed) pada hitungan keduadari setiap perlakuan 22
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Sayuran indigenous adalah sayuran lokal/daerah yang diusahakan oleh masyarakat atau sayuran yang berasal dari introduksi dan sudah dikenal oleh masyarakat (Diperta Jabar 2012). Saat ini, pemanfaatan sayuran indigenous belum dikenal secara luas oleh masyarakat dan ketersediaannnya di pasaran masih terbatas. Kecipir (Psophocarpus tetragonolobus (L.) DC) merupakan salah satu jenis sayuran
indigenous yang dibudidayakan di Indonesia. Kecipir merupakan tanaman legum potensial yang dapat dibudidayakan di daerah tropis dengan kandungan protein dan minyak yang tinggi pada bijinya (Mohanty et al. 2013). Kecipir merupakan tanaman multifungsi karena hampir seluruh bagian tanaman dapat dimanfaatkan mulai dari polong muda, umbi, daun muda, bunga dan bijinya. Komposisi nutrisi yang terdapat pada polong mudanya setara dengan tanaman kacang-kacangan lainnya (Krisnawati 2010).
Produksi kedelai terus mengalami penurunan sejak tahun 2009 hingga tahun 2012. Penurunan ini mengakibatkan defisit dengan rata-rata sebesar 20.38% per tahun. Produksi dalam negeri hanya mampu menyediakan 29% dari konsumsi total (Bappenas 2013). Biji kecipir diharapkan dapat menjadi solusi alternatif kesenjangan yang terjadi antara produksi nasional dan konsumsi nasional kedelai. Biji kecipir telah banyak diteliti untuk dimanfaatkan sebagai olahan pangan yang menggunakan kedelai sebagai bahan bakunya namun, budidaya tanaman kecipir masih sangat terbatas pada beberapa lokasi. Pemahaman proses perkecambahan menjadi dasar yang penting terkait pemenuhan dan keseimbangan antara kebutuhan produksi untuk konsumsi dan jumlah populasi untuk mencapai produksi yang maksimum (Copeland dan Donald 2001). Benih bermutu tinggi dapat berkecambah dengan baik ketika ditanam di lapangan sehingga dapat meningkatkan efisiensi dan mutu hasil produksi.
Pengujian mutu benih merupakan hal rutin yang dilakukan dalam rangka proses sertifikasi. Salah satu pengujian rutin yang dilakukan adalah pengujian daya berkecambah. Pengujian daya berkecambah memerlukan kondisi optimum pada media perkecambahan, suhu dan kelembaban. Berdasarkan penelitian Susanti (2010) terdapat perbedaan kecenderungan dari setiap jenis benih tanaman tentang media yang sesuai untuk perkecambahannya. Berdasarkan rekomendasi ISTA (2014), media yang digunakan untuk perkecambahan benih adalah media kertas (kertas saring, kertas
2
RH dan suhu yang cenderung fluktuatif. Hal ini mengakibatkan perbedaan lamanya pengujian berdasarkan rekomendasi ISTA dengan pengujian di Indonesia.
Aspek penting yang memengaruhi kualitas benih yang berhubungan dengan kacang-kacangan adalah adanya benih keras. Beberapa metode telah digunakan untuk mengatasi permasalahan benih keras, di antaranya mekanik, kimia, dan perlakuan air panas yang meliputi suhu konstan dan suhu berganti. Tingkat penyerapan air untuk proses perkecambahan oleh benih-benih yang secara individual berbeda, didasarkan pada kerusakan kulit benih atau pembukaan strophiole (Argel dan Paton 1999). Sinhababu dan Banerjee (2013) melaporkan bahwa perlakuan awal benih yang berupa pematahan dormansi pada empat tanaman legum diperlukan untuk meningkatkan permeabilitas air ke dalam benih dan menghilangkan penghalang metabolik agar daya berkecambahnya meningkat. Oleh karena itu, penelitian mengenai penentuan pengamatan daya berkecambah, optimalisasi substrat perkecambahan, dan pematahan dormansi penting untuk dilakukan agar dapat mengetahui kondisi pengujian yang tepat untuk mengetahui keragaan benih yang akan ditanam di lapangan sehingga dapat dihasilkan produksi yang maksimal untuk pemenuhan kebutuhan konsumsi.
Tujuan
Tujuan penelitian ini yaitu pengembangan metode uji daya berkecambah benih kecipir pada aspek penentuan pengamatan hitungan pertama dan kedua, pemilihan substrat alternatif untuk perkecambahan serta menentukan teknik pematahan dormansi benih kecipir.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini, yaitu:
1. Pengamatan uji daya berkecambah benih kecipir menggunakan alat pengecambah benih tipe eco germinator berlangsung lebih cepat dari rekomendasi pedoman ISTA,
2. Terdapat minimal satu substrat alternatif untuk perkecambahan benih kecipir, 3. Terdapat minimal satu teknik pematahan dormansi yang efektif untuk
mematahkan dormansi benih kecipir.
TINJAUAN PUSTAKA
Kecipir (Psophocarpus tetragonolobus (L.) DC)
Kecipir merupakan salah satu contoh sayuran indigenous selain kemangi, katuk, gambas/oyong, labu siam, leunca, paria, koro, dan selada air (Soetiarso 2010). Kecipir merupakan tanaman yang tergolong ke dalam famili Fabaceae (ITIS 2011).
3
P.tetragonolobus dan P.palustris yang digunakan sebagai makanan. Spesies lannya hampir tidak pernah dibudidayakan. Bahkan P.palustris adalah yang tersisa dari tanaman semi liar yang digunakan di Afrika Barat terutama saat kondisi kelaparan (NRC 1981).
Koleksi-koleksi kecipir di Asia yang berbeda pada beberapa bagian telah ditunjukkan secara luas pada berbagai tampilan fisik: bentuk dan ukuran daun; warna bunga; panjang, bentuk dan warna polong; tekstur permukaan dan bentuk sayap; warna, ukuran dan bentuk biji; waktu yang diperlukan benih untuk berkecambah, terbentuknya bunga, terbentuknya polong, kematangan biji, dan terbentuknya umbi. Terdapat variasi pada protein, minyak, dan komponen-komponen lainnya pada biji dan bagian lain pada tanaman. Banyak tipe dari kecipir yang belum tercatat di kawasan Asia, termasuk Bangladesh, Sri Lanka, Thailand dan Indonesia. Koleksi-koleksi terbaru dari kecipir terdapat lebih dari 500 tipe kecipir di Thailand, 200 di Bangladesh, dan lebih dari 100 di Indonesia (NRC 1981).
Kecipir dikelompokkan ke dalam dua jenis yaitu kecipir berbunga biru dan kecipir berbunga putih. Perbedaan antara keduanya terletak pada panjang buah dan ukuran biji. Kecipir berbunga putih memiliki buah lebih panjang sekitar 30-40 cm dengan biji yang kecil, sedangkan kecipir berbunga ungu memiliki buah lebih pendek yaitu 15-20 cm dan berbiji besar. Kecipir dapat ditumbuh baik pada dataran rendah maupun dataran tinggi (Kusmana et al. 2008). Polong seluruhnya berwarna hijau, tetapi pada kultivar tertentu memiliki polong berwarna ungu. Polong bersisi empat dan sepanjang polong terdapat sayap tipis yang tidak rata. Keragaman yang cukup banyak dari kecipir ditemukan di daerah Papua Nugini. Daerah pantai timur Afrika merupakan daerah yang diperkirakan daerah asal dari tanaman kecipir. Tidak menutup kemungkinan bahwa kecipir berasal dari daerah Asia Tropika. Asia Selatan, Asia Tenggara dan beberapa Kepulauan Pasifik lainnya adalah daerah yang menjadi tempat penyebaran tanaman kecipir (Rubatzky dan Yamaguchi 1999).
Perkembangbiakan tanaman kecipir biasanya dengan benih tetapi bisa juga melalui stek batang. Suhu optimum rata-rata untuk tumbuh bagi tanaman ini adalah 5-7 hari pada suhu 25 0C. Dalam satu polong terdapat 5-20 biji. Benih kecipir berbentuk bulat, diameternya sekitar 1 cm, rata-rata berat benih sekitar 250 mg. Biji berwarna putih atau hitam, tetapi terkadang ada yang berwarna coklat atau kuning (Rubatzky dan Yamaguchi 1999). Tanaman kecipir tidak terikat oleh musim dan tahan terhadap lahan kering sehingga cocok untuk dibudidayakan sebagai tanaman pagar atau tanaman pekarangan (Akhadiarto 1997).
Pengamatan Uji Daya Berkecambah
4
kondisi lingkungan yang optimum. Hal lain yang menjadi ciri dari pengujian daya berkecambah benih adalah evaluasi yang dilakukan dua kali (Irawan 2014). Benih yang dikecambahkan dalam alat pengecambah benih (APB) diamati dua kali untuk menumbuhkan kecambah secara optimal. Optimasi ini dilakukan untuk menghindarkan benih-benih lain dari benih yang terlampau kuat sehingga menyaingi perkecambahannya dan membuang benih-benih busuk yang biasanya dikerubuti jasad mikro (Sadjad 1994). Menurut Widajati (2012), tujuan dari pengamatan pertama yaitu untuk menjaga kondisi lingkungan perkecambahan tetap optimum selama periode pengujian, menghitung dan mengeluarkan kecambah yang sudah normal, membuang benih yang busuk dan bercendawan, dan menambah kelembaban media jika media kering. Pengamatan kedua bertujuan untuk mengevaluasi seluruh kecambah baik kecambah normal, kecambah abnormal, benih mati, dan benih segar tidak tumbuh serta menghitung daya berkecambah.
Waktu pengamatan ditentukan berdasarkan kurva kuadratik untuk bertambahnya persentase perkecambahan normal yang terjadi setiap hari. Hal ini dilakukan dengan menghitung pada saat terjadinya Y maksimum dari fungsi kuadratik tersebut. Hari yang menunjukkan persentase tambahan kecambah normal maksimum ditentukan sebagai pengamatan pertama. Pengamatan kedua ditentukan saat hari akumulasi persentase perkecambahan mencapai maksimum (Sadjad 1994).
Substrat Perkecambahan Benih
Media yang digunakan untuk pengujian perkecambahan adalah produk yang menyediakan cukup ruang pori untuk udara dan air, untuk sistem pertumbuhan akar dan untuk kontak dengan larutan (air) yang diperlukan untuk pertumbuhan tanaman. Beberapa hal yang menjadi spesifikasi untuk seluruh media perkecambahan dan harus dipenuhi adalah komposisi media, karakter retensi air, pH, konduktivitas, kebersihan dan bebas dari zat toksik, dan penggunaan ulang substrat (disarankan untuk digunakan hanya satu kali) (ISTA 2014).
Substrat atau media perkecambahan benih dapat berupa substrat kertas, substrat pasir atau substrat organik lainnya. Penelitian yang dilakukan oleh Purbojati dan Suwarno (2006) menunjukkan bahwa kertas stensil dapat digunakan sebagai substrat alternatif kertas saring dan kertas merang untuk benih yang dikecambahkan dengan metode UDK (Uji Diatas Kertas). Hasil yang sama juga ditunjukkan oleh penelitian Tambunan (2013) yang dilakukan pada benih kakao. Kertas stensil/koran memberikan pengaruh yang lebih baik terhadap panjang plumula benih kakao dibandingkan dengan kertas merang. Kertas stensil/koran dapat menggantikan penggunaan kertas merang untuk pengujian benih kakao di laboratorium. Substrat kertas lain digunakan sebagai pengganti kertas merang karena terdapat kendala yaitu kesulitan untuk mendapatkan kertas merang.
Penelitian lain mengenai media perkecambahan yang dilakukan oleh Gasparin
et al. (2013) memberikan kesimpulan bahwa substrat pasir dapat memberikan persentase perkecambahan tertinggi pada pengujian benih tanaman hutan
5
/blotter, vermikulit, dan kertas. Pada media pasir pengujian dapat berlangsung lebih cepat dan mencegah serta mengurangi infeksi patogen. Hal serupa ditunjukkan pula oleh penelitian Rusmin et al. (2014) pada benih purwoceng yang dikecambahkan pada media pasir. Benih yang ditanam pada media pasir memiliki bobot kering kecambah normal tertinggi pada suhu perkecambahan 23-250C. Hal ini disebabkan karena pasir
mengandung sedikit zat hara terutama fosfor dan lebih steril.
Dormansi Benih
Benih memerlukan kelembaban, kecocokan suhu dan pada banyak kasus memerlukan atmosfer aerob yang sesuai. Apabila satu atau lebih dari syarat ini tidak terpenuhi maka perkecambahan akan gagal. Kondisi ini disebut dengan dormansi (Bradbeer 2013). Berdasarkan Finkelstein et al. (2008), dormansi disebabkan oleh terhalangnya beberapa proses yang dibutuhkan dalam perkecambahan seperti keadaan istirahat, mobilisasi cadangan nutrisi, adanya jaringan-jaringan di sekeliling yang menjadi penghalang, mulainya perpanjangan, pembelahan, dan perkembangan sel.
Dormansi primer terjadi apabila benih yang terbentuk dari tanaman telah dalam kondisi dorman. Benih yang terbentuk dari tanaman dalam kondisi yang tidak dorman tetapi akan mengalami dormansi jika kondisi lingkungan untuk berkecambah tidak cocok disebut dengan dormansi sekunder. Terdapat dua tipe dormansi benih yang telah dikenali, yaitu dormansi akibat kulit benih dan dormansi embrio. Dormansi kulit benih adalah dormansi yang terjadi pada embrio akibat adanya kulit benih dan jaringan-jaringan yang menghalangi seperti endosperm, pericarp atau organ-organ ekstrafloral. Ada lima mekanisme dasar dari dormansi kulit benih, yaitu pencegahan pengambilan air, pembatas mekanik, gangguan pertukaran gas, adanya simpanan inhibitor, dan produksi inhibitor. Tipe kedua dari dormansi benih adalah dormansi embrio, yaitu dormansi yang hanya terjadi pada bagian embrio tanpa adanya pengaruh dari kulit benih atau jaringan lain di sekelilingnya (Taiz dan Zeiger 2010).
METODE PENELITIAN
Lokasi Penelitian dan Waktu PenelitianPenelitian dilaksanakan di Laboratorium Pengujian Mutu Benih dan Penyimpanan Benih, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Januari sampai dengan Mei 2015.
Bahan
6
natrium hipoklorit, kalium nitrat (KNO3), label, amplop kertas, amplas kasar, selotip
dan plastik PE.
Alat
Alat-alat yang digunakan antara lain spiral separator, alat pengecambah benih tipe IPB 72-1 (APB IPB 72-1), alat pengepres kertas tipe IPB 75-1, autoklaf, oven, gunting stek, saringan pasir, stoples kaca, glass jar (berdiameter 5.9 cm), wadah plastik, pemanas air, termohigrometer, dan alat tulis.
Prosedur Penelitian
Persiapan pendahuluan
Pelaksanaan percobaan diawali dengan sortasi benih kecipir menggunakan
spiral separator agar ukuran benih seragam. Benih yang telah disortasi kemudian diukur kadar airnya menggunakan metode oven suhu rendah. Selanjutnya untuk benih yang akan dikecambahkan dilakukan sterilisasi permukaan benih dengan merendam benih menggunakan natrium hipoklorit 1.5% selama 5 menit. Setelah itu benih dikeringanginkan kemudian dilakukan skarifikasi benih menggunakan amplas kasar. Skarifikasi dilakukan dengan cara menggosok bagian punggung dan pinggir benih. Benih yang telah diskarifikasi direndam kembali dalam natrium hipoklorit selama 10 detik.
Percobaan 1. Penentuan hari pengamatan dalam uji daya berkecambah
Percobaan 1 dilakukan dengan mengecambahkan 400 butir benih kecipir pada media kertas saring. Pengecambahan menggunakan kertas saring dilakukan dengan metode uji kertas digulung didirikan dilapisi plastik (UKDdP). Benih ditanam pada kertas saring yang telah dilembabkan menggunakan akuades. Benih yang ditanam sebanyak 25 butir pada setiap gulung. Setelah itu benih dikecambahkan pada alat pengecambah benih tipe IPB 72-1.
Percobaan 2. Optimalisasi substrat perkecambahan benih kecipir
Benih dikecambahkan pada empat macam substrat perkecambahan, yaitu substrat kertas merang, substrat kertas cd buram, substrat pasir (metode penanaman top of sand), dan substrat arang sekam dan 2 substrat sebagai kontrol, yaitu substrat kertas saring dan substrat pasir (metode penanaman in sand). Pada perlakuan yang menggunakan substrat pasir atau arang sekam, dilakukan perlakuan pendahuluan berupa sterilisasi substrat menggunakan autoklaf pada suhu 1210C pada tekanan 17.5
7
Benih yang dikecambahkan sebanyak 25 butir untuk setiap ulangan. Untuk substrat pasir perlakuan kontrol, benih ditanam dengan metode in sand, yaitu menanam benih dengan cara ditekan ke dalam pasir kemudian bagian atas benih dilapisi kembali dengan pasir lapisan tipis. Pengecambahan untuk perlakuan substrat pasir (non kontrol) dilakukan dengan metode top of sand, yaitu menanam benih hanya dengan menekan di permukaan media saja. Benih yang telah dikecambahkan dalam wadah plastik diletakkan pada rak dalam laboratorium benih untuk diamati proses perkecambahannya.
Perlakuan pengecambahan benih pada substrat kertas saring, kertas merang, dan kertas cd buram dilakukan dengan metode uji kertas digulung didirikan dilapisi plastik (UKDdp). Kertas dilembabkan menggunakan aquades kemudian ditiriskan. Bagian bawah kertas dilapisi plastik kemudian diletakkan 3 lembar kertas lembab. Benih dikecambahkan sebanyak 25 butir untuk setiap ulangan. Bagian atas ditutup kembali dengan 3 kertas lembab kemudian digulung dan diberi label. Selanjutnya seluruh perlakuan subsrat kertas dikecambahkan dalam alat pengecambah benih tipe IPB 72-1.
Percobaan 3. Pematahan dormansi benih kecipir
Pematahan dormansi dilakukan dengan skarifikasi digosok dan kimia. Perlakuan terdiri atas empat taraf, yaitu kontrol (tanpa skarifikasi), skarifikasi dengan amplas, direndam dengan KNO3 0.5% selama 24 jam dan direndam dengan air panas
bersuhu 50oC selama 30 menit. Sebelum diberi perlakuan, dilakukan sterilisasi permukaan benih terlebih dahulu menggunakan natrium hipoklorit 1.5%. Penggosokan menggunakan amplas kasar dilakukan pada bagian pinggir benih dan punggung benih. Pada setiap bagian benih dilakukan penggosokan sebanyak 3 kali. Perendaman benih dalam KNO3 0.5% dilakukan dengan cara melarutkan 5 gram KNO3 ke dalam 1 L
akuades, kemudian benih direndam dalam larutan KNO3 selama 24 jam. Skarifikasi
menggunakan air panas dilakukan dengan cara merendam benih dalam air panas bersuhu 50oC selama 30 menit. Setelah mendapat perlakuan, benih dikecambahkan
pada media kertas cd buram.
Pengamatan
Percobaan 1. Penentuan hari pengamatan dalam uji daya berkecambah
8
Gambar 1 Kriteria kecambah normal benih kecipir
Percobaan 2 dan 3. Optimalisasi substrat perkecambahan benih kecipir dan pematahan dormansi benih kecipir
Pengamatan pada percobaan 2 dan 3 dilakukan terhadap empat peubah yaitu viabilitas total dengan tolok ukur potensi tumbuh maksimum (PTM), viabilitas potensial dengan tolok ukur daya berkecambah (DB) dan berat kering kecambah normal (BKKN) serta vigor benih dengan indeks vigor (IV), keserempakan tumbuh (KST) dan kecepatan tumbuh (KCT).
1. Viabilitas Total
Pengujian viabilitas total benih dilakukan dengan tolok ukut potensi tumbuh maksimum (PTM). PTM dihitung berdasarkan jumlah kecambah normal pada hitungan pertama dan jumlah kecambah normal serta abnormal pada hitungan kedua.
PTM = kecambah normal I+kecambah normal dan abnormal II
jumlah total benih yang ditanam
x 100
2. Viabilitas Potensial
Pengujian benih pada peubah viabilitas potensial dilakukan dengan tolok ukur daya berkecambah (DB) dan berat kering kecambah normal (BKKN). Daya berkecambah dihitung berdasarkan persentase kecambah normal hitungan pertama (Ʃ KN I) dan kecambah normal pada hitungan kedua (Ʃ KN II) terhadap total jumlah benih yang ditanam. Hitungan pertama dan kedua dilakukan berdasarkan hasil dari percobaan I. Rumus yang digunakan dalam menghitung DB sebagai berikut:
DB = Ʃ KN I+ Ʃ KN II
total jumlah benih yang ditanam
x 100%
Berat kering kecambah normal dihitung dengan cara mengeringkan seluruh kecambah normal yang terdapat pada hitungan pertama dan kedua kemudian dikeringkan menggunakan oven dengan suhu 600C selama 3 x 24 jam. Kecambah normal yang telah diperoleh dari hitungan pertama disimpan di dalam kulkas pada suhu
≤ 50C agar tidak layu untuk kemudian digabung dengan kecambah normal hitungan kedua lalu dikeringkan menggunakan oven.
Akar primer Kotiledon Akar sekunder
9
3. Vigor Benih
Pengujian vigor benih dilakukan dengan tolok ukur indeks vigor (IV), keserempakan tumbuh (KST) dan kecepatan tumbuh (KCT). Indeks vigor diamati
dengan cara menghitung persentase kecambah normal yang tumbuh pada hitungan pertama (Ʃ KN I) terhadap total benih yang ditanam, dengan rumus:
IV = Ʃ KN I
total jumlah benih yang ditanam
x 100%
Kecepatan tumbuh (KCT) dihitung berdasarkan jumlah kecambah normal yang
dapat tumbuh setiap satu etmal (24 jam), dengan rumus:
KCT =∑i=n1=0% Kecambah normal/etmal.
Keserempakan tumbuh (KST) dihitung berdasarkan jumlah kecambah normal
yang tumbuh diantara hitungan pertama dan hitungan kedua (Ʃ KN antara). Hitungan pertama dan kedua yang digunakan berdasarkan hasil dari percobaan 1.
KST =
Ʃ KN antara
total jumlah benih yang ditanam
x 100%
Analisis Data
Penelitian dibagi ke dalam tiga percobaan. Percobaan 1 yaitu menghitung jumlah kecambah normal yang tumbuh setiap hari selama 14 hari. Data yang telah didapatkan pada percobaan 1 dianalisis menggunakan software Microsoft Excel 2013 untuk memperoleh puncak grafik. Puncak pertama pada kurva persentase tambahan perkecambahan setiap hari ditentukan sebagai hitungan pertama. Puncak pertama pada kurva persentase kumulatif perkecambahan setiap hari ditentukan sebagai hitungan kedua (Sadjad 1994). Selain analisis grafik, uji lain yang dilakukan adalah uji-t pada taraf 5% menggunakan software Minitab 16.
Percobaan 2 yaitu optimalisasi substrat dilakukan menggunakan rancangan acak lengkap (RAL) faktor tunggal menggunakan 4 substrat perkecambahan (kertas merang, kertas cd buram, pasir (top of sand), dan arang sekam) dan 2 substrat sebagai kontrol (kertas saring dan pasir (in sand)). Setiap perlakuan terdiri atas 4 ulangan sehingga menghasilkan 24 satuan percobaan.
Rumus umum model rancangan percobaan yang digunakan adalah: Yij= µ + τi + Ԑij
Yij = respon pengamatan perlakuan substrat ke-i, ulangan ke-j (1, 2, 3, 4)
µ = nilai tengah umum
τi = pengaruh perlakuan substrat ke-i
Ԑij = pengaruh galat percobaan perlakuan subsrat ke-i, ulangan ke j (1, 2, 3, 4)
10
selama 24 jam, dan perendaman air panas 50oC 30 menit) sehingga menghasilkan 16
satuan percobaan.
Rumus umum model rancangan percobaan yang akan digunakan adalah: Yij= µ + τi +βj+ Ԑij
Yij = respon pengamatan perlakuan pematahan dormansi ke-i, ulangan ke-j (1, 2,
3, 4)
µ = nilai tengah umum
τi = pengaruh perlakuan pematahan dormansi ke-i βj = pengaruh kelompok ke-j
Ԑij = pengaruh galat percobaan perlakuan pematahan dormansi ke-i, kelompok ke
-j
Data yang diperoleh pada percobaan 2 dan 3 dianalisis menggunakan uji F, karena hasil berpengaruh nyata maka dilanjutkan dengan uji lanjut t-Dunnett pada taraf 5%. Analisis data menggunakan software SAS 9.1.
HASIL DAN PEMBAHASAN
Kondisi Umum Benih dan Viabilitas Awal Benih Kecipir
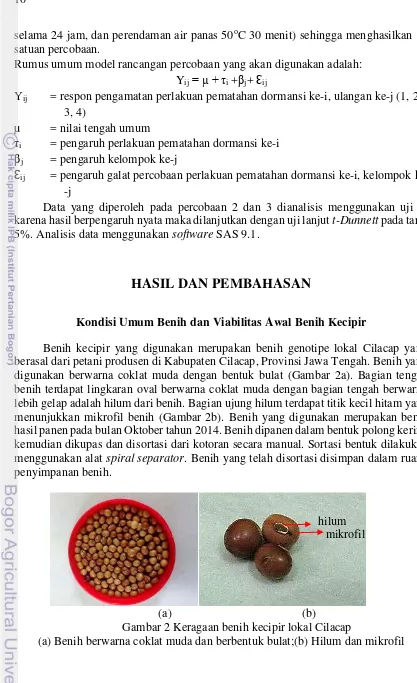
Benih kecipir yang digunakan merupakan benih genotipe lokal Cilacap yang berasal dari petani produsen di Kabupaten Cilacap, Provinsi Jawa Tengah. Benih yang digunakan berwarna coklat muda dengan bentuk bulat (Gambar 2a). Bagian tengah benih terdapat lingkaran oval berwarna coklat muda dengan bagian tengah berwarna lebih gelap adalah hilum dari benih. Bagian ujung hilum terdapat titik kecil hitam yang menunjukkan mikrofil benih (Gambar 2b). Benih yang digunakan merupakan benih hasil panen pada bulan Oktober tahun 2014. Benih dipanen dalam bentuk polong kering kemudian dikupas dan disortasi dari kotoran secara manual. Sortasi bentuk dilakukan menggunakan alat spiral separator. Benih yang telah disortasi disimpan dalam ruang penyimpanan benih.
(a) (b)
Gambar 2 Keragaan benih kecipir lokal Cilacap
(a) Benih berwarna coklat muda dan berbentuk bulat;(b) Hilum dan mikrofil hilum
11
Pengukuran kadar air benih dilakukan sebelum penyimpanan. Kondisi awal benih kecipir memiliki kadar air rata-rata sebesar 11.7% setelah mengalami proses pengeringan menggunakan sinar matahari selama satu hari. Kondisi ini tergolong kondisi kadar air yang aman untuk penyimpanan benih kecipir yang termasuk ke dalam kelompok benih ortodoks. Berdasarkan penelitian Indartono (2011) pada benih kedelai yang tergolong benih ortodoks, benih yang memiliki kadar air diatas 13% akan mengalami kemunduran lebih cepat. Benih memerlukan kadar air optimum untuk penyimpanannya. Sebagian besar benih memiliki kadar air optimum penyimpanan 6-11%. Purba et al. (2013) menyatakan bahwa kemunduran benih selama masa penyimpanan disebabkan oleh kadar air benih yang semakin tinggi. Hal ini mengakibatkan laju respirasi semakin cepat sehingga semakin banyak CO2 dan panas
yang dihasilkan. Aktifitas fisiologis ini dapat ditekan melalui kadar air penyimpanan yang ideal sehingga daya berkecambah benih masih dapat dipertahankan hingga waktunya benih dikecambahkan.
Ruang penyimpanan benih yang digunakan merupakan ruangan dengan suhu dan kelembaban terkontrol. Suhu ruang simpan berkisar antara 17-220C dengan kelembaban berkisar antara 54-62%. Penyimpanan benih bertujuan untuk mempertahankan viabilitas benih agar tetap tinggi sampai benih tersebut ditanam. Wadah yang digunakan untuk penyimpanan benih adalah toples kaca. Toples kaca dipilih sebagai wadah penyimpanan benih karena kedap udara sehingga dapat mempertahankan kadar air benih selama masa penyimpanan. Benih disimpan sejak bulan Oktober 2014 sampai dengan bulan Desember 2014. Alat pengecambah benih tipe IPB 72-1 yang digunakan memiliki kisaran suhu 27-28.5 oC dengan kelembaban relatif sebesar 92% dan kondisi ruangan laboratorium memiliki suhu rata-rata sebesar 27.8oC dengan kelembaban relatif lebih rendah yaitu 70.8%.
Daya berkecambah benih kecipir pada pengujian awal sebesar 62%. Hal ini dikategorikan daya berkecambah benih yang rendah. Standar daya berkecambah yang tergolong tinggi untuk hampir seluruh benih adalah ≥ 80%. Daya berkecambah benih yang rendah disebabkan oleh proses imbibisi yang tidak serempak pada benih sehingga pertumbuhan benih menjadi kecambah normal tidak serempak dan banyaknya serangan cendawan saat benih dikecambahkan. Timbulnya banyak cendawan kemungkinan diakibatkan oleh mikroorganisme terbawa benih karena substrat perkecambahan, alat pengecambah benih, dan air yang digunakan sudah dikondisikan dalam kondisi steril. Ghangaokar dan Kshirsagar (2013) mengemukakan bahwa mikroorganisme yang merupakan seedborne disease paling banyak ditemukan pada benih yang tidak mendapatkan perlakuan benih. Infestasi mikroorganisme membuat vigor dan daya berkecambah benih menjadi rendah.
Penentuan Hari Pengamatan dalam Uji Daya Berkecambah
12
menggunakan benih sebanyak 100 butir dan dikecambahkan dalam alat pengecambah benih (APB) IPB tipe 72-1. Pengujian menunjukkan hasil bahwa pada hari ke-4 belum ada kecambah normal yang muncul pada setiap ulangan.
Pengamatan hari ke-4 memperlihatkan struktur kecambah yang muncul hanya radikula. Pada hari ke-14 semua struktur kecambah normal mulai dari radikula, epikotil, hipokotil dan plumula sudah muncul. Namun, ukuran dari semua struktur kecambah normal sudah terlampau tinggi. Terdapat hipokotil yang sudah mengeluarkan cabang dan beberapa sudah mulai layu (Gambar 3). Ukuran kecambah normal yang terlampau tinggi dan hampir menyerupai ukuran bibit menunjukkan adanya ketidaksesuaian hari pengamatan yang direkomendasikan oleh ISTA pada media dan suhu perkecambahan yang sama. Oleh karena itu dilakukan pengujian dengan hitungan pertama dan hitugan kedua yang berbeda dengan ketentuan ISTA dalam uji daya berkecambah.
Gambar 3 Kecambah kecipir pada 14 HST
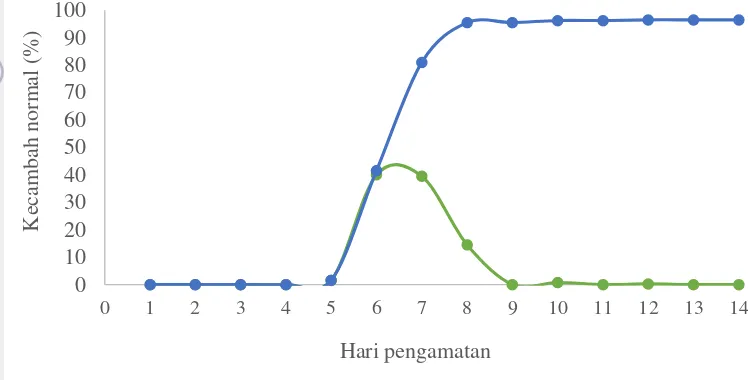
Penentuan hari pengamatan dalam uji daya berkecambah benih kecipir dilakukan menggunakan 400 butir benih dengan media kertas saring. Benih dikecambahkan dalam APB IPB tipe 72-1. Setelah 14 hari dikecambahkan, kecambah normal baru muncul pada hari ke-7 tetapi jumlahnya masih sangat sedikit. Kecambah normal terbanyak terdapat pada hari ke-8. Pada hari ke-9 dan hari ke-10 masih cukup banyak muncul kecambah normal namun jumlahnya lebih sedikit dari hari ke-8. Jumlah kecambah normal mulai menurun pada hari ke-11 hingga hari ke-14 (Gambar 4).
13
Daya berkecambah benih yang diuji masih dikategorikan rendah yaitu 71.25% (Tabel 1). Hal ini disebabkan oleh banyaknya kecambah abnormal dan benih keras. Kecambah abnormal yang terdapat pada setiap ulangan masih berpotensi untuk menjadi kecambah normal, namun keterlambatan imbibisi mengakibatkan lambatnya pertumbuhan kecambah sehingga di akhir pengamatan masih belum dapat dikategorikan sebagai kecambah normal.
Tabel 1 Daya berkecambah benih kecipir tanpa skarifikasi Ulangan
Keterangan: BSTT = Benih Segar Tidak Tumbuh
Benih keras yang jumlahnya cukup tinggi diakibatkan oleh permasalahan pada proses imbibisi. Benih kecipir memiliki kulit yang cukup keras sehingga proses imbibisi pada sebagian benih terhambat. Hambatan yang terjadi pada benih kecipir ini disebut dengan dormansi fisik. Dormansi fisik atau yang dikenal dengan sifat impermeabel kulit benih terhadap air berkaitan dengan penampilan jaringan dari kulit benih. Sejak masalah dormansi ini memberikan perbedaan waktu dan rentang terhadap proses perkecambahan, mekanisme dormansi ini menjadi penting secara ekologi. Tiga spesies tanaman akasia (famili Fabaceae) yaitu, Acacia aroma, Acacia. caven and Acacia atramentariamemiliki dormansi fisik. Dormansi ini disebabkan oleh kulit benihnya yang sangat tebal dan padat, parenkima bersklerenkim yang lebar dan
water gap untuk pengambilan air. Impermeabilitas kulit benih pada spesies ini utamanya karena terdapat karakteristtik berupa epidermis berlignin (Venier 2012). Metode pematahan dormansi fisik diperlukan agar dapat mempermudah proses imbibisi.
Pengujian penentuan hari pengamatan yang selanjutnya dilakukan dengan jumlah benih, media, dan alat pengecambah yang sama. Metode pematahan dormansi dilakukan pada pengujian ini yaitu dengan skarifikasi fisik menggunakan amplas kasar. Benih di amplas pada bagian punggung benih dan pinggir sehingga tidak mengenai bagian embrio. Benih diamplas menggunakan amplas kasar sebanyak tiga kali gosokan pada setiap bagiannya hingga terdapat sedikit luka dan warna kulitnya pudar. Proses imbibisi yang terjadi pada benih lebih serempak setelah dilakukan proses skarifikasi. Pada hari kedua setelah tanam semua benih telah mengalami proses imbibisi.
14
namun jumlahnya tidak sebanyak hari ke-6 dan hari ke-7. Setelah hari ke-8 jumlah kecambah normal terus mengalami penurunan hingga hari ke-14 (Gambar 5). Daya berkecambah pada pengujian ini jauh lebih baik dibandingkan sebelum dilakukan skarifikasi yaitu menjadi 96.5%.
Gambar 5 Jumlah kecambah normal harian selama 14 hari pengamatan setelah skarifikasi
Berdasarkan hasil uji-t, dua puncak kecambah normal pada hari 6 dan hari ke-7 tidak berbeda nyata (Tabel 2) sehingga dapat diambil hari pengamatan pertama atau hitungan pertama adalah hari ke-6. Hari pengamatan kedua atau hitungan dua yaitu pada hari ke-8 karena pada hari ke-8 telah mencapai akumulasi persentase perkecambahan maksimum (Sadjad 1994).
Tabel 2 Penentuan hitungan pertama pada benih kecipir
Hari pengamatan Jumlah kecambah normal
6 40 tn
7 39.5 tn
Keterangan: tn = tidak nyata berdasarkan uji-t pada taraf 5%
15
Gambar 6 Struktur kecambah benih kecipir
(a) Struktur kecambah normal; (b) struktur kecambah normal poliembrioni
Optimalisasi Substrat Perkecambahan
Hasil analisa sidik ragam pengaruh substrat perkecambahan terhadap semua peubah yang diamati disajikan pada Tabel 3. Hasil sidik ragam pengaruh substrat perkecambahan terhadap semua peubah yang diamati secara lengkap disajikan pada Lampiran 1. Faktor tunggal substrat perkecambahan berpengaruh sangat nyata terhadap hampir seluruh tolok ukur vigor dan viabilitas yang diamati yaitu daya berkecambah (DB), indeks vigor (IV), kecepatan tumbuh (KCT), keserempakan tumbuh
(KST), dan berat kering kecambah normal (BKKN). Hanya pada tolok ukur potensi
tumbuh maksimum (PTM) saja substrat berpengaruh nyata.
Tabel 3 Rekapitulasi hasil sidik ragam pengaruh subsrat perkecambahan terhadap tolok ukur vigor dan viabilitas benih kecipir
Tolok Ukur Substrat
PTM (%) 96.33*
DB (%) 82.67**
BKKN (g) 0.88**
IV*) (%) 37.33**
KCT (% etmal-1) 12.74**
KST (%) 71.83**
Keterangan: ** = sangat nyata; * = nyata berdasarkan uji t-Dunnett pada taraf 5%. PTM= Potensi tumbuh maksimum, PTM= Potensi tumbuh maksimum, DB= daya berkecambah, BKKN= Berat kering kecambah normal, IV= Indeks vigor, KCT=
Kecepatan tumbuh, KST= Keserempakan tumbuh; *) = data ditransformasikan ke
√� + 0.5.
Hal tersebut menunjukkan bahwa substrat perkecambahan sangat memengaruhi mutu fisiologis benih yang diuji. Substrat perkecambahan merupakan faktor penting
16
yang mendukung proses perkecambahan karena mensuplai air yang diperlukan selama proses perkecambahan berlangsung. Sadjad (2008) menyatakan bahwa media perkecambahan baik waktu maupun kondisi lingkungan perkecambahan harus optimal untuk memenuhi segala sesuatu yang diperlukan benih sehingga sesuai dan merepresentasikan pertumbuhan potensial dari benih pada kondisi lapang yang optimum.
Hasil pembandingan subsrat uji dengan substrat kontrol menunjukkan hasil bahwa pada tolok ukur daya berkecambah, substrat arang sekam berbeda nyata lebih rendah dari substrat kertas saring. Berdasarkan nilai rataan benih yang dikecambahkan pada substrat arang sekam memiliki daya berkecambah terendah dibandingkan dengan empat substrat uji lainnya. (Tabel 4). Indeks vigor yang baik dihasilkan oleh substrat pasir (in sand), kertas cd buram, dan kertas merang dibandingkan dengan kertas saring. Hasil uji tolok ukur kecepatan tumbuh menunjukkan bahwa substrat pasir (in sand) dan substrat kertas cd buram berbeda nyata lebih tinggi dengan substrat kertas saring dengan nilai rata-rata sebesar 18.7% dan 14.77% (Tabel 4). Substrat pasir (in sand), kertas merang, dan kertas cd buram berbeda nyata lebih tinggi dengan substrat kontrol kertas saring untuk keserempakan tumbuh.
Hasil pembandingan substrat uji terhadap substrat kontrol kertas saring menunjukkan bahwa substrat kertas cd buram berbeda nyata lebih tinggi pada tolok ukur IV, KCT, dan KST. Hal ini menunjukkan bahwa substrat kertas cd buram dapat
digunakan sebagai substrat alternatif dalam pengujian benih kecipir apabila ingin menggunakan metode uji kertas digulung didirikan dalam plastik (UKDdp).
Tabel 4 Nilai rataan tolok ukur viabilitas dan vigor pada pembandingan substrat kontrol kertas saring Keterangan: **= berbeda nyata dengan perlakuan kertas saring berdasarkan hasil uji t Dunnett
pada taraf 5%; tn= tidak berbeda nyata dengan perlakuan kertas saring berdasarkan hasil uji t Dunnett pada taraf 5%. PTM= Potensi tumbuh maksimum, DB= daya berkecambah, BKKN= Berat kering kecambah normal, IV= Indeks vigor, KCT= Kecepatan tumbuh, KST= Keserempakan tumbuh, TS = top of sand;
17
Selama proses perkecambahan berlangsung, kertas cd buram cukup mampu mempertahankan kelembaban. Hal ini sejalan dengan penelitian Suwarno dan Hapsari (2008) yang mengemukakan bahwa kertas cd memiliki kemampuan yang baik dalam kecepatan penyerapan air (2.5 cm/5 menit), mempertahankan air (jumlah air yang hilang selama 7 hari sebanyak 1.27 g air/unit media), dan menyerap air (28.14 g air/unit media). Kertas cd buram juga merupakan substrat yang lebih baik jika dibandingkan dengan kertas merang. Jika dibandingkan dengan kertas saring, kertas merang hanya memberikan hasil indeks vigor dan keserempakan tumbuh yang lebih tinggi sedangkan kertas cd buram memberikan hasil indeks vigor, kecepatan tumbuh, dan keserempakan tumbuh yang lebih tinggi. Penelitian Suwarno dan Santana (2009) menunjukkan bahwa penggunaan kertas cd sebagai substrat perkecambahan benih besar menghasilkan tingkat kesamaan 100% jika dibandingkan dengan kertas kertas merang pada tolok ukur daya berkecambah dan memiliki tingkat kesamaan 80% pada peubah berat kering kecambah normal.
Pembandingan dengan substrat pasir (in sand) menunjukkan bahwa kertas saring dan arang sekam memiliki nilai rataan terendah pada tolok ukur keserempakan tumbuh. Sama halnya dengan tolok ukur kecepatan tumbuh, tidak ada satu pun substrat uji yang menghasilkan indeks vigor yang lebih tinggi dari substrat pasir (in sand). Seluruh substrat uji berbeda nyata lebih rendah dengan perlakuan substrat kontrol pasir (in sand). Nilai indeks vigor yang dihasilkan pada perlakuan ini sebesar 98% (Tabel 5). Tabel 5 Nilai rataan tolok ukur viabilitas dan vigor pada pembandingan substrat berkecambah, BKKN= Berat kering kecambah normal, IV= Indeks vigor, KCT=
Kecepatan tumbuh, KST= Keserempakan tumbuh, TS= top of sand; *) = data
ditransformasikan ke √� + 0.5.
Nilai IV ini memperlihatkan bahwa benih kecipir yang dikecambahkan pada substrat pasir dengan metode in sand memiliki vigor yang sangat baik karena didukung lingkungan eksternalnya, dalam hal ini substrat, yang mampu mendukung proses perkecambahan dengan baik. Hal ini menunjukkan bahwa substrat pasir dengan metode
18
dikecambahkan dengan metode in sand dapat tumbuh lebih baik dibandingkan dengan metode top of sand karena kelembaban dalam substrat lebih terjaga. Benih mendapatkan kelembaban dari dua bagian, yaitu pasir lapisan bagian atas dan pasir lapisan bagian bawah. Pasir juga merupakan substrat yang porous sehingga mudah ditembus oleh akar kecambah.
Murniati dan Suminar (2006) mengemukakan bahwa setiap spesies benih memiliki media perkecambahan yang optimum dan spesifik untuk dapat mendukung proses perkecambahannya. Dalam penelitian ini, substrat pasir memiliki nilai yang cukup tinggi pada seluruh peubah pengamatan, namun hasil penelitian Yuniarti et al. (2000) menunjukkan bahwa benih tisuk yang dikecambahkan pada subsrat pasir memiliki daya berkecambah paling rendah jika dibandingkan dengan substrat vermikulit, sabut kelapa, tanah, dan campuran tanah + pasir. Berdasarkan hasil uji terhadap seluruh substrat perkecambahan, tidak ada substrat yang berbeda nyata dengan substrat kertas saring dan pasir (in sand) pada tolok ukur potensi tumbuh maksimum. Hanya arang sekam saja yang potensi tumbuh maksimumnya berbeda nyata lebih rendah dari substrat pasir (in sand). Hal ini disebabkan tolok ukur PTM hanya mengukur kemampuan benih untuk dapat tumbuh saja walaupun belum berkecambah normal, sehingga kurang menunjukkan perbedaan yang nyata dalam evaluasi hasil pengujian.
Arang sekam adalah perlakuan dengan hasil berat kering kecambah normal yang paling rendah jika dibandingkan dengan substrat pasir. Kecambah normal yang dihasilkan dari perlakuan substrat arang sekam berukuran lebih kurus terutama pada bagian radikula dan jumlahnya lebih sedikit (Gambar 7).
Gambar 7 Perbandingan kecambah normal yang dihasilkan dari substrat arang sekam dengan substrat lainnya
(A) substrat kertas saring; (B) substrat arang sekam; (C) subsrat pasir (in sand); (D) substrat kertas CD; (E) substrat kertas merang; (F) substrat pasir (top of sand)
A B C
E
19
Substrat arang sekam memberikan hasil yang nyata lebih rendah dibandingkan substrat kertas saring pada tolok ukur DB, KCT, KST dan BKKN. Keseluruhan hasil dari
tolok ukur vigor dan viabilitas yang dibandingkan dengan substrat pasir (in sand) menunjukkan bahwa arang sekam memiliki nilai yang terendah. Sangat banyak benih abnormal yang terdapat pada pengujian menggunakan substrat arang sekam. Hal yang sama juga ditunjukkan pada penelitian Murniati dan Suminar (2006) benih mengkudu yang dikecambahkan pada arang sekam memiliki nilai yang rendah pada tolok ukur PTM, DB, KCT relatif, dan vigor, walaupun perlakuan pra perkecambahan tidak
responsif. Benih mengkudu mengalami dormansi karena faktor lingkungan yaitu media perkecambahannya. Namun pada penelitian ini benih kecipir yang ditanam di arang sekam sudah mengalami proses pematahan dormansi sehingga rendahnya daya berkecambah diduga bukan karena dormansi faktor lingkungan (enforced dormancy).
Selain itu, nilai PTM yang dihasilkan cukup tinggi sehingga terhambatnya pertumbuhan menjadi kecambah normal diduga karena suplai air yang kurang untuk membuat benih tersebut menjadi kecambah normal. Arang sekam mampu memegang air cukup baik, namun air yang ada lebih banyak lolos sehingga tidak dapat diserap secara maksimal oleh benih. Arang sekam lebih mudah kering jika dibandingkan dengan substrat lainnya. Hal tersebut kurang mendukung untuk perkecambahan benih yang baik karena air sangat diperlukan oleh benih yang sedang berkecambah untuk mengaktifkan enzim stimulan perkecambahan. Terlebih benih kecipir adalah benih besar sehingga memerlukan jumlah air yang lebih banyak dalam proses perkecambahannya. Penelitian Rahayu et al. (2008) pada tanaman seledri yang menggunakan media arang sekam juga menunjukkan hasil yang sama, bahwa hasil pertumbuhan paling rendah terdapat pada seledri yang ditanam pada media arang sekam. Hal ini disebabkan karena penguapan pada media ini sangat tinggi karena pori-porinya yang berukuran besar sehingga banyak unsur hara yang hilang.
Pematahan Dormansi
Secara umum, benih kacang-kacangan memiliki sifat dormansi fisik dan tergolong benih ortodoks (Jayasuriya et al. 2013). Dormansi fisik pada benih ditujukkan kepada benih-benih yang impermeabel terhadap air. Pematahan dormansi pada familia Fabaceae, biasanya berasosiasi dengan struktur yang disebut lens (Souza
et al. 2012). Perlakuan pematahan dormansi yang dilakukan pada benih kecipir dilakukan agar air lebih mudah imbibisi ke dalam benih sehingga benih dapat tumbuh secara serempak. Hasil sidik ragam dari berbagai perlakuan pematahan dormansi disajikan secara lengkap pada Lampiran 2.
20
tanam akan mempengaruhi tingkat perkecambahan dari suatu benih. Salah satu perlakuan sebelum tanam yang pada umumnya dilakukan adalah pematahan dormansi. Tabel 6 Rekapitulasi sidik ragam perlakuan pematahan dormansi terhadap tolok ukur
vigor dan viabilitas benih kecipir
Tolok ukur Kuadrat Tengah Perlakuan
PTM (%) 198.87339 *
Keterangan: nilai yang tercantum merupakan nilai kuadrat tengah perlakuan, ** = sangat nyata; * = nyata berdasarkan uji t-Dunnett pada taraf 5%. PTM= Potensi tumbuh maksimum, DB= daya berkecambah, BKKN= Berat kering kecambah normal, IV= Indeks vigor, KCT= Kecepatan tumbuh, KST= Keserempakan tumbuh.
Perlakuan tidak berpengaruh nyata hanya pada tolok ukur berat kering kecambah normal (Tabel 6). Hal ini menunjukkan bahwa perlakuan pematahan dormansi tidak meningkatkan massa sel kecambah normal yang terbentuk. Hasil ini disebabkan oleh ukuran benih yang digunakan pada percobaan tidak seragam. Perbedaan ukuran tersebut mengakibatkan jumlah cadangan makanan dalam benih yang berbeda sehingga ketika benih dikecambahkan, cadangan makanan yang dirombak menjadi massa sel untuk kecambah normal terdapat perbedaan dalam berat keringnya. Perbedaan ukuran ini yang menyebabkan tidak adanya perbedaan berat kering kecambah normal antarperlakuan walaupun daya berkecambah benih yang dihasilkan berbeda.
Daya berkecambah benih yang nyata lebih tinggi diperoleh dari perlakuan penggosokan menggunakan amplas. Perlakuan pematahan dormansi dengan perendaman benih dalam KNO3 selama 24 jam dan perendaman benih dalam air panas
21
memungkinkan proses absorpsi air yang lebih besar bagi benih tersebut. Skarifikasi menggunakan kertas pasir (amplas) juga menjadi metode terbaik yang direkomendasikan untuk mematahkan dormansi benih Calopogonium mucunoides
(Morais 2014).
Hal yang sama juga terjadi pada perlakuan perendaman benih menggunakan KNO3 0.5% selama 24 jam. Indeks vigor, kecepatan tumbuh, dan keserempakan
tumbuh nyata lebih tinggi dibandingkan dengan kontrol (Tabel 7). Perendaman benih dalam waktu 24 jam membuat kulit benih menjadi lebih lunak sehingga proses imbibisi air menjadi lebih mudah. Garam kalium nitrat yang diberikan juga membantu dalam mengaktifkan enzim-enzim perkecambahan. Astari et al. (2011) mengemukakan bahwa pada perlakuan pematahan dormansi benih mucuna, kalium nitrat merupakan senyawa yang dapat mempercepat proses perkecambahan dan dapat mengaktifkan metabolisme sel. Penggunaan kalium nitrat pada benih mucuna juga menghasilkan kadar air biji tertinggi yang menunjukkan bahwa kalium nitrat mampu melunakkan kulit biji mucuna sehingga air mampu berimbibisi.
Perlakuan perendaman benih dalam air panas 50oC selama 30 menit nyata lebih tinggi hanya pada tolok ukur indeks vigor. Hasil ini menjadi indikator bahwa air panas dapat meningkatkan kecepatan imbibisi melalui pelunakan kulit benih sehingga benih yang berkecambah normal pada hitungan pertama jumlahnya lebih tinggi dibandingkan dengan kontrol. Tolok ukur kecepatan tumbuh dan keserempakan tumbuh tidak berbeda nyata dengan kontrol (Tabel 7).
Tabel 7 Nilai rataan tolok ukur viabilitas dan vigor benih pada masing-masing perlakuan pematahan dormansi
Keterangan: **= berbeda nyata lebih tinggi dengan perlakuan kontrol (tanpa perlakuan pematahan dormansi) berdasarkan hasil uji t Dunnett pada taraf 5%. PTM= Potensi tumbuh maksimum, DB= daya berkecambah, BKKN= Berat kering kecambah normal, IV= Indeks vigor, KCT= Kecepatan tumbuh, KST=
Keserempakan tumbuh. P1= kontrol (tanpa perlakuan pematahan dormansi); P2= skarifikasi dengan amplas; P3= perendaman dengan KNO3 0.5% selama 24 jam;
P4= perendaman dengan air panas 50oC selama 30 menit.
22
cukup lama agar dapat mematahkan dormansinya. Seperti halnya penelitian yang dilakukan oleh Sandi et al. (2012), pada benih pohon kuku (Pericopsis mooniaana) dilakukan perendaman benih pada suhu awal 80oC selama 48 jam atau pada penelitian Siregar (2013) yang melakukan pematahan dormansi benih andaliman (Zanthoxylum acanthopodium) yang berkulit keras dengan merendam dalam air panas bersuhu awal 60oC selama 24 jam. Farhana et al. (2013) melaporkan hal yang sama, pada benih kelapa sawit, daya berkecambah benih akan semakin meningkat sejalan dengan tingginya intensitas perendaman pada pematahan dormansi benih akibat kulitnya yang keras.
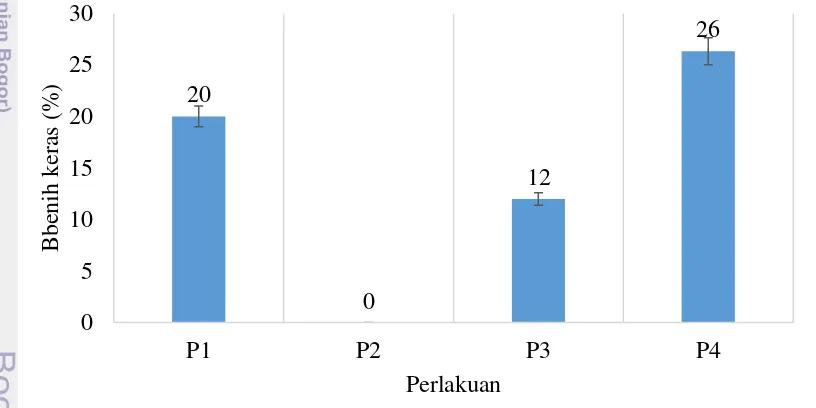
Keefektifan metode pematahan dormansi pada kulit benih yang keras tidak hanya dapat dilihat dari hasil uji tolok ukur vigor dan viabilitas benih. Jumlah benih keras yang terdapat di akhir pengamatan dapat menunjukkan seberapa efektif metode tersebut mampu melunakkan kulit benih sehingga air mampu berimbibisi. Skarifikasi kulit benih menggunakan amplas mampu menghilangkan jumlah benih keras yang terdapat pada setiap ulangan. Tidak terdapat benih keras di akhir pengamatan pada perlakuan ini. Persentase benih keras terbanyak dihasilkan oleh perendaman air panas 50oC selama 30 menit sebanyak 26%. Perlakuan perendaman benih dalam KNO3 0.5%
selama 24 jam memiliki persentase benih keras lebih rendah 8% jika dibandingkan dengan kontrol (Gambar 8).
Gambar 8 Jumlah benih keras (hard seed) pada hitungan kedua dari setiap perlakuan Keterangan: P1= kontrol (tanpa perlakuan pematahan dormansi); P2= skarifikasi dengan amplas; P3= perendaman dengan KNO3 0.5% selama 24 jam; P4= perendaman
dengan air panas 50oC selama 30 menit.
Beberapa hasil penelitian menunjukan hasil yang sama bahwa pada perlakuan pematahan dormansi menggunakan kertas pasir (amplas) memberikan hasil terbaik. Ali
et al. (2012) melaporkan bahwa metode skarifikasi menggunakan kertas pasir (amplas) merupakan metode yang paling efektif untuk mematahkan dormansi benih gulma
23
Rhynchosia capitata. Perkecambahan dengan metode ini dapat meningkatkan persentase perkecambahan benih menjadi 100%. Skarifikasi mekanik memberikan proses imbibisi tertinggi dan cepat. Talei et al. (2012) menyebutkan pematahan dormansi yang dilakukan pada benih sambiloto menggunakan kertas pasir (amplas) juga memberikan daya berkecambah tertinggi dan daya berkecambah tercepat jika dibandingkan dengan metode skarifikasi fisik dan kimia lainnya. Kertas pasir atau amplas memiliki permukaan yang kasar sehingga ketika digosokkan pada benih dapat membuat pelukaan pada benih atau jika penggosokan dilakukan secara halus membuat kulit benih menjadi tipis. Pelukaan dan penipisan kulit yang terdapat pada benih membuat kulit menjadi bersifat lebih permeable terhadap air.
KESIMPULAN DAN SARAN
Kesimpulan
Pengembangan metode uji yang diperoleh dari penelitian ini yaitu penentuan hitungan dalam pengamatan uji daya berkecambah benih kecipir menggunakan alat pengecambah tipe eco-germinator dilakukan pada hari ke-6 untuk hitungan pertama dan hari ke-8 untuk hitungan kedua. Kertas cd buram dapat digunakan sebagai substrat kertas alternatif apabila pengujian menggunakan metode UKDdp. Substrat pasir dengan metode penanaman in sand merupakan substrat terbaik apabila pengujian dilakukan tanpa menggunakan substrat kertas. Skarifikasi menggunakan amplas merupakan teknik pematahan dormansi terbaik untuk benih kecipir. Persiapan pendahuluan berupa sterilisasi permukaan benih menggunakan natrium hipoklorit perlu dilakukan sebelum benih kecipir dikecambahkan.
Saran
Sebaiknya dilakukan teknik pematahan dormansi pada benih kecipir yang lebih efisien mengingat proses skarifikasi fisik menggunakan amplas memakan waktu yang cukup lama dan memerlukan proses sterilisasi berulang.
DAFTAR PUSTAKA
24
Ali HH, Tanveer A. Nadeem MA, Asghar HN. 2012. Methods to break seed dormancy of Rhynchosia capitata, a summer annual weed. Chilean Journal of Agricultural Research [Internet]. [Diunduh 2015 Mei 21]; 7(3):483-487.Tersedia pada: http://www.scielo.cl/pdf/chiljar/v71n3/at21.pdf.
Anasthasia S. 2014. Viabilitas dan daya simpan benih lobak (Raphanus sativus L.) lokal dan impor setelah disimpan pada ruang simpan berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Argel PJ, Paton CJ. 1999. Forage seed production 2nd ed. Dalam Loch DS dan
Ferguson JE (Eds.). Tropical and Subtropical species. Wallingford (GB): CABI Publishing.
Astari RP, Rosmayati, Bayu ES. 2014. Pengaruh pematahan dormansi secara fisik dan kimia terhadap kemampuan berkecambah benih mucuna (Mucuna bracteata D.C). Jurnal Online Agroteknologi 2(2):803-812.
Azad MS, Biswas RK, Matin MA. 2012. Seed germination of Albizia procera (Roxb.) Benth in Bangladesh: a basis for seed source variation and pre-sowing treatment effect. For.Stud.China 14(2): 124-130.doi: 10.1007/s11632-012-0209-z.
[Bappenas] Badan Pembangunan Nasional. 2013. Rencana jangka panjang dan menengah bidang pangan dan pertanian 2015-2019 [internet]. [Diunduh 2014 Desember 18]. Tersedia pada: www.bappenas.go.id/index.php/download.../4925 Bradbeer JW. 2013. Seed Dormancy and Germination. New York: Springer Science &
Bussiness Media
Coelho MFB, Souza JWN, Lima AKB. 2014. Overcoming seed dormancy of Albizia lebbeck (L.) Benth. Journal of Global Biosciences [Internet]. [Diunduh 2015 Mei 21]; 3(2):488-493. Tersedia pada: http: //mutagens.co.in.
Copeland LO, Mc.Donald MB. 2001. Principles of Seed Science and Technology 4th
ed. London (UK): Kluwer Academic Publishers.
[Diperta Jabar]. Dinas Pertanian Jawa Barat (ID). 2012. Mengenal sayuran indigenous [internet]. [Diunduh 2014 Desember 7]. Tersedia pada: http://www.diperta.jabar prov.go.id /index.php/subMenu/informasi/artikel/detailartikel/211.
Farhana B, Ilyas S, Budiman LF. 2013. Pematahan dormansi benih kelapa sawit (Elaeis guineensis Jacq.) dengan perendaman dalam air panas dan variasi konsentrasi etephon. Bul. Agrohorti 1(1): 72-78.
Finkelstein R, Reeves W, Ariizumi T, Steber C. 2008. Molecular aspects of seed dormancy. Annu. Rev. Plant biol. 59:387-415.doi: 10.1146/annurev.arplant. 59.032607.092740.
Gasparin E, Araujo MM, Tolfo CV, Foltz DRB, Magistrali PR. 2013. Substrates for germination and physiological quality of storage seeds ofParapiptadenia rigida(Benth.) Brenan. Journal of Seed Science. 35(1): 77-85.doi: 10.1590/S2317-15372013000100011.
Ghangaokar NM, Kshirsagar AD. 2013. Study of seed borne fungi of different legumes. Science Journal [Internet]. [Diunduh pada 2015 Mei 22]; 2(1):32-35. Tersedia pada:http://sciencejournal.in /data/documents/TLS-2-1-8.pdf.
25
Irawan FF. 2014. Pelaksanaan dan pengamatan beberapa metode perkecambahan kakao [Internet]. [Diunduh pada 2015 Juli 4]. Tersedia pada:
http://ditjenbun.pertanian.go.id/bbpptpambon/berita-324-pelaksanaan-dan-pengamatan-beberapa-metode-perkecambahan-kakao.html
[ISTA] International Seed Testing Association. 2014. International Rules for Seed Testing. Switzerland (CH): ISTA.
[ITIS] Integrated Taxonomy Information System. 2011. Psophocarpus tetragonolobus (L.) DC [internet]. [Diunduh pada 2015 Agustus 31]. Tersedia pada: http://www. itis.gov/servlet/SingleRpt/SingleRpt?search_topic=TSN&search_value=506265 Kusmana, Hidayat IM, Kirana R, Gaswanto R. 2008. Petunjuk Teknis Budidaya dan Produksi Benih Beberapa Sayuran Indigenous. Bandung (ID): PPPH BPPT Departemen Pertanian.
Krisnawati A. 2010. Keragaman genetik dan potensi pengembangan kecipir (Psophocarpus tetranogolobus L.) di Indonesia. Jurnal Litbang Pertanian 29(3): 113-119.
Jayasuriya GKMG, Wijetunga ASTB, Baskin JM, Baskin CC. 2013. Seed dormancy and storage behavior in tropical Fabaceae: a study of 100 species from Sri Lanka. Seed Science Research 23(4): 257-269.doi: 10.1017/S0960258513000214. Mohanty CS, Verma S, Singh V, Khan S, Gaur P, Gupta P, Nizar MA, Dikshit N,
Pattanayak R, Sukhla A et al. 2013. Characterization of winged bean (Psophocarpus tetranogolobus (L.) DC) based on molecular, chemical and physiological parameters. American Journal of Molecular Biology 3 (2013): 187-197.doi: 10.4236/ajmb2013.34025.
Morais LF. Almeida JCC, Deminicis BB, Padua FT, Morenz MJF, Abreu JBR, Araujo RP, Nepomuceno DD. 2014. Methods for breaking dormancy of seeds of tropical forage legumes. American Journal of Plant Sciences 5(13): 1831-1835. doi:10.4236/ajps.2014.513196.
Murniati E, Suminar M. 2006. Pengaruh jenis media perkecambahan dan perlakuan pra perkecambahan terhadap viabilitas benih mengkudu (Morinda citrifolia L.) dan hubungannya dengan sifat dormansi benih. Bul. Agron. 34(2): 119-123.
[NRC] National Research Council. 1981. The Winged Bean A High-Protein Crop for The Tropics 2nd. Washington (US): National Academy Pr.
Purba HWS, Sitepu FE, Haryati. 2013. Viabilitas benih rosella (Hibiscussabdarifa L.) pada berbagai kadar air awal dan kemasan benih. Jurnal Online Agroteknologi
1(2): 318-326.
Purbojati L, Suwarno FC. 2006. Studi alternatif substrat kertas untuk pengujian viabilitas benih dengan metode uji diatas kertas. Bul.Agron. 34(1): 55-61. Rahayu M, Samanhudi, Widodo AS. 2008. Pengaruh macam media dan konsentrasi
pupuk fermentasi ampas tahu terhadap pertumbuhan dan hasil tanaman seledri (Apium graveolens L.) secara hidroponik. Jurnal Ilmiah Ilmu Tanah dan Agroklimatologi 5(2): 75-82.
26
Rusmin D, Suwarno FC, Darwati I, Ilyas S. 2014. Pengaruh suhu dan media perkecambahan terhadap viabilitas dan vigor benih purwoceng untuk menentukan metode pengujian benih. Bul.Littro 25(1): 45-51.
Sadjad S. 1994. Kuantifikasi Metabolisme Benih. Jakarta (ID): PT Gramedia Widiasarana Indonesia (Grasindo).
Sadjad S. 2008. The Phylosophy of Seed. Bogor (ID): IPB Pr.
Sandi ALI, Indriyanto, Duryat. 2014. Ukuran benih dan skarifikasi dengan air panas terhadap perkecambahan benih pohon kuku (Pericopsis mooniana). Jurnal Sylva Lestari 2(3): 83-92.
Sinhababu, A, Banerjee A. 2013. Optimization of seed germination of some multipurpose tree legumes by seed treatments. The Journal of Plant Physiology. [Internet]. [Diunduh 2015 Mei 31] 114:170-175. Tersedia pada: https://sites.google.com/site/photonxing/home/the-journal-of-plant-physiology. Siregar BL. 2013. Perkecambahan dan pematahan dormansi benih andaliman
(Zanthoxylum acanthopodium DC.). J.Agron.Indonesia 41(3): 249-254.
Soetiarso TA. 2010. Sayuran indigenous alternatif sumber pangan benilai gizi tinggi.
Iptek hortikutura (6):5-10.
Souza TV, Voltolini CH, Santos M, Paulilo MTS. 2012. Water absorption and dormancy breaking reqirements of physically dormant seeds of Schizolobium parahyba (Fabacecae-Caesalpiniodeae). Seed Science Research 22(3):169-176.doi: 10.1017/S0960258512000013.
Susanti M. 2010. Pengaruh media tanam dan perlakuan pra perkecambahan terhadap perkecambahan benih panggal buaya (Zanthoxylum rhetsa (Roxb.) D.C.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Suwarno FC, Hapsari I. 2008. Studi alternatif substrat kertas untuk pengujian viabilitas benih dengan metode UKDdp. Bul. Agron. 36(1): 84-91.
Suwarno FC, Santana DB. 2009. Efisiensi beberapa substrat dalam pengujian viabilitas benih berukuran besar dan kecil. J.Agron.Indonesia. 37(3): 249-255.
Taiz L, Zeiger E. 2010. Plant Physiology. Sunderland (US): Sinauer Associates Inc. Talei D, Valdiani A. Abdullah MP, Hassan SA. 2012. A rapid and effective method for
dormancy breakage and germination of King of Bitters (Andrographis paniculata Nees.) seeds. Cra-Journals Maydica [Internet]. [Diunduh 2015 Mei 21]; 57(2). Tersedia pada: http://cra-journals.cineca.it/index.php/maydica/article/view/696. Tambunan E. 2013. Respon pertumbuhan radikula benih kakao pada 3 jenis media
perkecambahan di laboratorium [internet]. [Diunduh 2015 Agustus 11]. http://ditjenbun.pertanian.go.id/bbpptpmedan/berita-268-respon-pertumbuhan-radikula-benih-kakao-.html.
Venier P, Funes G, Garcia CC. 2012. Physical dormancy and histological features of seeds of five Acacia species (Fabaceae) from xerophytic forests in central Argentina. J. Flora 207(1):39-46.doi: 10.1016/j.flora.2011.07.017.
Widajati E, Murniati E, Palupi ER, Kartika T, Suhartanto MR, Qadir A. 2012. Dasar Ilmu dan Teknologi Benih. Bogor (ID): IPB Pr.
27
28
Lampiran 1 Hasil analisis sidik ragam faktor substrat uji perkecambahan Karakter
pengama tan
Sumber
Keragaman db JK KT
F
hitung Pr > F KK DB Perlakuan 5 15101.33333 3020.26667 53.51 <.0001** 9.08825
Galat 18 1016.00000 56.44444
PTM Perlakuan 5 389.33333 77.86667 3.19 0.0311* 5.13232 Galat 18 440.00000 24.44444
IV*) Perlakuan 5 22365.33333 4473.06667 21.37 <.0001** 24.60468 Galat 18 3768.00000 209.33333
KCT Perlakuan 5 482.12708 96.42542 46.35 <.0001** 11.32474
Galat 18 37.44410 2.08023
BKKN Perlakuan 5 1.73918 0.34783 21.97 <.0001** 14.24372 Galat 18 0.28495 0.01583
KST Perlakuan 5 16075.33333 3215.06667 16.88 <.0001** 19.21136
Galat 18 3428.00000 190.44444 Keterangan: DB= daya berkecambah, PTM= Potensi tumbuh maksimum, IV= Indeks vigor,
KCT= Kecepatan tumbuh, BKKN= Berat kering kecambah normal, KST=
29
Lampiran 2 Hasil analisis sidik ragam faktor pematahan dormansi Karakter
pengamatan
Sumber
Keragaman db JK KT
F
hitung Pr > F KK DB Perlakuan 3 820.673075 273.55769 4.60 0.0324* 10.41 Ulangan 3 79.193075 26.39769 0.44 0.7275tn 10.41 Galat 9 535.259225 59.47325 IV Perlakuan 3 5317.279419 1772.42647 13.72 0.0010** 11.36 Ulangan 3 346.319419 115.43981 0.89 0.4810tn 11.36 Galat 9 1162.418256 129.15758 KST Perlakuan 3 1934.209769 644.73659 9.03 0.0045** 12.22
Ulangan 3 209.109769 69.70326 0.98 0.4461tn 12.22 Galat 9 642.889306 71.43215 KCT Perlakuan 3 66.908075 22.30269 6.44 0.0128* 14.01
Ulangan 3 2.065025 0.68834 0.20 0.8946tn 14.01 Galat 9 31.163075 3.46256
BKKN Perlakuan 3 0.06532 0.02177 3.11 0.0812tn 12.708 Ulangan 3 0.06736 0.02246 3.21 0.0760tn 12.708 Galat 9 0.06296 0.00700 PTM Perlakuan 3 596.62017 198.87339 4.06 0.0444* 7.968 Ulangan 3 36.14017 12.04672 0.25 0.8623tn 7.968 Galat 9 441.00051 49.00006 Keterangan: DB= daya berkecambah, IV= Indeks vigor, KST= Keserempakan tumbuh KCT= Kecepatan
30
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 10 April 1993 dari ayah Karjan dan ibu Siti Rahayu. Penulis adalah putri pertama dari dua bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 10 Bogor dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Talenta Masuk IPB (UTM IPB) dan diterima di Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Ilmu Tanaman Pangan tahun ajaran 2013/2014. Penulis juga aktif sebagai pengajar les privat mahasiswa Tingkat Persiapan Bersama (TPB). Penulis juga pernah mengikuti