SELEKSI BAKTERI ASAM LAKTAT DAN
PEMANFAATANNYA SEBAGAI STARTER KERING
MENGGUNAKAN MATRIKS TAPIOKA ASAM
IRA ERDIANDINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Seleksi Bakteri Asam Laktat dan Pemanfaatannya sebagai Starter Kering Menggunakan Matriks Tapioka Asam” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
Ira Erdiandini
RINGKASAN
IRA ERDIANDINI. Seleksi Bakteri Asam Laktat dan Pemanfaatannya sebagai Starter Kering Menggunakan Matriks Tapioka Asam. Dibimbing oleh ANJA MERYANDINI dan TITI CANDRA SUNARTI.
Starter merupakan sediaan mikroorganisme yang akan ditambahkan ke dalam bahan baku untuk menghasilkan produk pangan fermentasi. Starter digunakan untuk mempercepat proses fermentasi dan mereduksi resiko kegagalan selama proses fermentasi. Kultur starter dapat berbentuk cair maupun kering, namun penggunaan kultur kering lebih menguntungkan karena dapat disimpan dalam waktu yang lama tanpa perlu diregenerasi ulang. Bakteri yang paling banyak digunakan untuk produksi kultur starter ialah bakteri asam laktat (BAL). BAL yang digunakan sebagai starter harus aman bagi mikroorganisme lain dalam tubuh dan memiliki produktivitas fermentasi yang tinggi, oleh karena itu seleksi terhadap galur BAL yang digunakan sebagai starter penting dilakukan. Dua kriteria penting yang digunakan untuk seleksi yaitu kemampuan produksi asam laktat dan sensitivitas terhadap antibiotik. BAL yang digunakan untuk produksi kultur starter juga harus memiliki viabilitas sel yang tinggi setelah proses pengeringan dan selama penyimpanan, oleh karena itu teknik pengeringan dan penggunaan matriks yang tepat juga merupakan faktor penting untuk menghasilkan kultur starter yang baik. Tapioka asam merupakan pati termodifikasi dari tapioka alami yang dihasilkan melalui proses fermentasi. Tapioka asam berpotensi untuk digunakan sebagai matriks enkapsulasi BAL karena diproduksi melalui proses fermentasi oleh BAL, tidak mengandung bahan tambahan pangan (BTP) dan mengandung monosakarida hasil fermentasi yang dapat berperan sebagai pelindung (protectant) selama proses pengeringan dan penyimpanan. Bahan baku tapioka asam juga tersedia luas, ekonomis dan dapat diperbaharui sehingga potensial untuk dikembangkan sebagai matriks enkapsulasi. Penelitian ini bertujuan untuk memproduksi starter kering BAL menggunakan matriks tapioka asam dan mengkaji viabilitasnya selama penyimpanan.
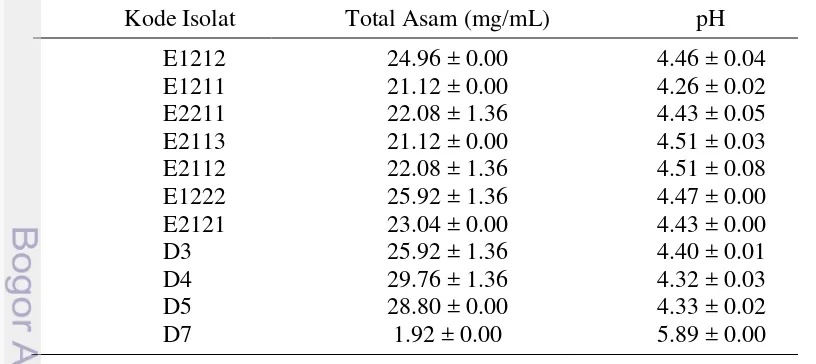
Sebelas isolat BAL lokal yang berasal dari fermentasi spontan komoditas karbohidrat pada penelitian sebelumnya, diseleksi berdasarkan kemampuan produksi asam dan sensitivitas antibiotik. Seleksi awal terhadap kemampuan produksi asam dilakukan dengan menghitung total asam tertitrasi dan pengukuran pH media kultur. Sensitivitas isolat terhadap antibiotik tetrasiklin, eritromisin dan kloramfenikol juga diuji dengan metode difusi cakram. Dari hasil seleksi awal kemudian dipilih isolat yang memiliki total asam tinggi dan tidak resisten terhadap antibiotik yang diujikan untuk diukur kemampuan produksi asam laktatnya menggunakan high performance liquid chromatography (HPLC). Isolat hasil seleksi yang dipilih ialah isolat yang memiliki kemampuan produksi asam laktat lebih tinggi. Isolat tersebut kemudian dikarakterisasi karakter morfologinya dan diamati kurva pertumbuhannya. Pengamatan karakter morfologi dilakukan menggunakan mikroskop cahaya meliputi pewarnaan Gram dan bentuk sel. Kurva tumbuh diamati dengan melakukan perhitungan jumlah sel (log CFU/mL) dan pengukuran terhadap optical density (OD) menggunakan spektrofotometer pada panjang gelombang ( ) 620 nm. Perhitungan jumlah sel dilakukan dengan metode
diinkubasi pada suhu 37oC selama 48 jam. Pengamatan dilakukan setiap jam hingga sel mencapai tingkat pertumbuhan spesifik maksimal (µm, h-1).
Produksi starter kering dari isolat terpilih dilakukan menggunakan freeze dryer (-50oC) dan spray dryer (suhu inlet 170oC, suhu outlet 70oC). Matriks yang digunakan ialah tapioka asam, sedangkan tapioka asam dengan penambahan 10% susu skim digunakan sebagai kontrol positif. Starter kering yang dihasilkan kemudian disimpan di dalam alumunium foil kedap udara untuk diukur kadar air (%), viabilitas sel (CFU/g) sekaligus tingkat ketahanan sel (%) setelah pengeringan. Pengujian stabilitas penyimpanan dilakukan terhadap hasil starter kering terbaik dengan menyimpannya selama empat minggu pada suhu dingin (4oC) dan suhu ruang (28oC). Parameter yang diukur yaitu viabilitas sel pada hari ke-0, 7, 14, 21 dan 28 setelah penyimpanan. Pengukuran viabilitas sel dilakukan dengan metode sebar (spread-plate method) pada media MRSA dan diinkubasi pada suhu 37 oC selama 48 jam.
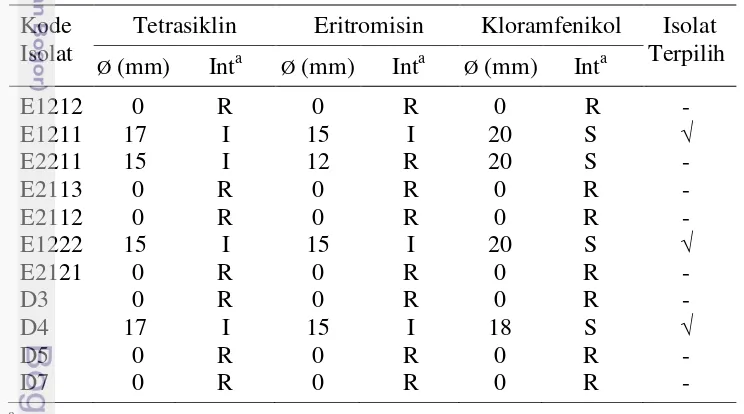
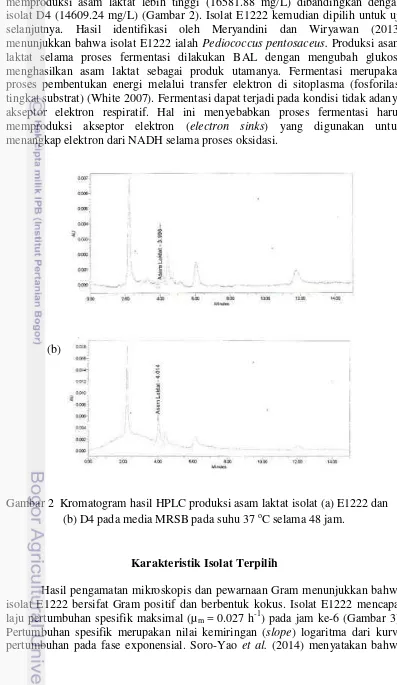
Hasil seleksi awal terhadap total asam tertitrasi dan sensitivitas terhadap antibiotik tetrasiklin, eritromisin dan kloramfenikol menunjukkan bahwa isolat E1222 dan D4 tidak resisten terhadap ketiga antibiotik yang diujikan serta memiliki total asam tertitrasi yang lebih tinggi. Hasil seleksi selanjutnya menggunakan HPLC menunjukkan bahwa isolat E1222 memproduksi asam laktat lebih tinggi (16581.88 mg/L) dibandingkan dengan isolat D4 (14609.24 mg/L). Isolat E1222 yang menunjukkan hasil terbaik tersebut telah teridentifikasi sebagai
Pediococcus pentosaceus. Hasil karakterisasi morfologi menunjukkan bahwa isolat E1222 termasuk kelompok Gram positif dan berbentuk kokus. Isolat E1222 mencapai laju pertumbuhan spesifik maksimal (µm = 0.027 h-1) pada jam ke-6, sehingga kultur isolat E1222 yang dikeringkan menggunakan freeze dryer dan
spray dryer ialah kultur berumur enam jam. Hasil pengeringan menunjukkan bahwa starter kering hasil pengeringan beku (freeze drying) mampu mempertahankan viabilitas sel lebih tinggi dibandingkan starter kering hasil pengeringan semprot (spray drying), yaitu masing-masing 10.34 log CFU/g dan 8.91 log CFU/g. Penggunaan matriks tapioka asam juga mampu mempertahankan viabilitas sel selama pengeringan mencapai 89% setelah pengeringan beku dan 76% setelah pengeringan semprot. Hasil uji stabilitas penyimpanan starter kering hasil pengeringan beku menunjukkan bahwa selama penyimpanan empat minggu, viabilitas sel mampu dipertahankan hingga 89.38% pada suhu dingin (4oC) dan mencapai 0% pada suhu ruang (28oC). Hasil penelitian ini menunjukkan bahwa starter kering isolat E1222 baik diproduksi menggunakan freeze dryer dan disimpan pada suhu dingin (4oC).
SUMMARY
IRA ERDIANDINI. Selection of Lactic Acid Bacteria and Its Application as Dried Starter using Sour Cassava Starch as Matrix. Supervised by ANJA MERYANDINI and TITI CANDRA SUNARTI.
Starter is a microbial preparation that will be added to the raw materials in production of fermented food products. It is used to accelerate the fermentation process and reduce the risk of failure during the fermentation. Although starter cultures could be in the liquid or dry forms, the dried culture is more advantageous due to its long stability without regenerated. The most widely used bacteria for starter cultures production is lactic acid bacteria (LAB). LAB as a starter should be safe for other natural microorganisms in human body and has a high fermentation productivity. Therefore, the strains selection of LAB which would be used as a starter is important to do. The important criterias for LAB selection are the ability of producing lactic acid and antibiotic sensitivity. LAB should also have a high cell viability after the drying process and during storage, meaning that drying techniques and proper matrix are also pivotal factors to produce a desirable starter cultures. Sour cassava starch is a modified starch which is produced from fermented tapioca. This material has promising properties for LAB encapsulation matrix because it is prepared using LAB-induced fermentation, and does not contain food chemical additives as well as contain fermented monosaccharides which can act as a protective agent (protectant) during drying and storage. Raw materials of sour cassava starch are widely available, economical and renewable. The aims this study were to produce LAB dried starter using sour cassava starch matrix and to study its viability after storage.
Eleven local LAB isolates obtained from spontaneous fermentation of carbohydrate commodity were selected based on their acid production ability and antibiotic sensitivity. The initial selection of the acid production ability was conducted by measuring the total acid and pH level of culture media. The isolate sensitivity to antibiotics tetracycline, erythromycin and chloramphenicol were tested by disc diffusion method. The isolate that produce high level of acid and is vulnerable to antiobiotics was selected and subsequently evaluated its lactic acid production using high performance liquid chromatography (HPLC). The isolate that have a higher production of lactic acid was choosen for this study. Furthermore, its morphological character and growth curve were observed. Morphological characters have been observed using a light microscope including Gram staining and cell shape observation. Growth curve was observed by calculation of cell numbers (log CFU/mL) while the optical density (OD) using a spectrophotometer at a wavelength ( ) 620 nm. Cell numbers was calculated using total plate count (TPC) on de Man Rogosa Sharpe agar (MRSA) medium were incubated at 37°C for 48 hours. Observation was conducted every hour until the cells reached a maximum specific growth rate ( m,h-1
).
control. Starter has been stored in an airtight aluminum foil for water content analysis (%), cell viability (log CFU/g) and survival rate (%) after drying. Storage stability of the best starter was evaluated in four weeks storage at a cold temperature (4°C) and room temperature (28°C). Cell viability was measured at 0, 7, 14, 21 and 28 days after storage. Cell viability was measured using spread-plate method on MRSA medium and incubated at 37°C for 48 hours. Results from the initial selection of the total acid titrated and sensitivity to antibiotics tetracycline, erythromycin and chloramphenicol showed that isolates E1222 and D4 were not resistant to all antibiotics tested and had higher total acid titrated. The selection result using HPLC showed that E1222 isolate produced higher lactic acid (16581.88 mg/L) than D4 isolate (14609.24 mg/L). E1222 isolate that showed the best result was identified as Pediococcus pentosaceus. Morphological characterization showed that E1222 isolate was Gram-positive and cocci. E1222 isolate achieved the maximum specific growth rate ( m = 0.027 h-1) at the 6th hour, thus E1222 isolate culture which was processed using spray dryer and freeze dryer was sixth hours culture. The results showed that freeze dried starter resulted in higher cell viability (10.34 log CFU/g) than spray dried starter (8.91 log CFU/g). Sour cassava starch matrix was also able to maintain cell viability during drying reaches 89% after freeze drying and 76% after spray drying. Tested result of storage stability of freeze dried starter showed that during the four weeks of storage, cell viability could be maintained up to 89.38% at cold temperature (4°C) and reaches 0% at room temperature (28°C). The results suggested that the dried starter E1222 isolate was best produced using freeze dryer and stored at cold temperature (4°C).
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SELEKSI BAKTERI ASAM LAKTAT DAN
PEMANFAATANNYA SEBAGAI STARTER KERING
MENGGUNAKAN MATRIKS TAPIOKA ASAM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak Juli 2013 hingga Oktober 2014 di Laboratorium PPSHB IPB. Tema yang dipilih dalam penelitian ini ialah starter kering, dengan judul Seleksi Bakteri Asam Laktat dan Pemanfaatannya sebagai Starter Kering Menggunakan Matriks Tapioka Asam.
Terima kasih penulis ucapkan kepada Prof Dr Anja Meryandini MS sebagai ketua komisi pembimbing dan Dr Ir Titi Candra Sunarti MSi sebagai anggota komisi pembimbing yang telah banyak memberikan motivasi, nasehat, waktu konsultasi dan solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini, serta terima kasih kepada penguji luar komisi Dr Suryani MSc dan Dr Nisa Rachmania Mubarik MSi sebagai perwakilan dari ketua jurusan yang telah memberikan saran dan nasehat untuk perbaikan karya ilmiah ini. Terima kasih juga penulis ucapkan kepada DIKTI melalui Beasiswa Unggulan selama menempuh pendidikan pascasarjana di IPB dan hibah penelitian tahun 2014 a.n. Dr Ir Titi Candra Sunarti MSi sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penghargaan penulis sampaikan kepada staf dan laboran di laboratorium Bioteknologi Hewan dan Biomedis, PPSHB IPB Ibu Dewi, Fitri, Fathin, Hamtini, Anik, Novianti, Lia, Ika, Rahmi, Debi, Wahyu serta seluruh teman-teman laboratorium Mikrobiologi IPB atas dukungan, motivasi dan bantuannya selama penelitian ini. Terima kasih penulis ucapkan kepada rekan-rekan di Pascasarjana Mikrobiologi IPB angkatan 2012 yang telah memberikan kebersamaan yang harmonis, bantuan, dukungan dan motivasi selama studi di IPB. Terima kasih penulis ucapkan kepada rekan-rekan HIMMPAS IPB Henny, Khusnul, Zahra, Ega, Utez, Rusdah dan lainnya, serta rekan-rekan BSC IPB Efa, Nadhirah, Retno, Nia, Edwin, Evan dan Dewi. Terima kasih penulis ucapkan kepada bapak Murniandy SE, ibu Erna Achjani SH (alm), ibu Atiek, mas Arie Erdiandani ST, mbak Retno Maulida ST, Rio Erdiantono SE, si kecil Rakha dan Naura, mas Edi Miarso ST serta keluarga besar Djafar Ani atas doa, dukungan, kasih sayang, motivasi dan semangat yang diberikan. Terima kasih penulis ucapkan kepada ibu Sumarsih dan anaknya Siti Kulsum serta seluruh pihak yang telah memberikan doa dan dukungan kepada penulis selama studi di IPB.
Semoga karya ilmiah ini bermanfaat dan menjadi amal sholeh.
Bogor, Juli 2015
DAFTAR ISI
DAFTAR TABEL xvi
DAFTAR GAMBAR xvi
DAFTAR LAMPIRAN xvi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA 3
Bakteri Asam Laktat 3
Enkapsulasi 4
Matriks 6
Tapioka Asam 7
METODOLOGI PENELITIAN 7
Tempat dan Waktu 7
Bahan dan Alat 7
Seleksi Isolat BAL 7
Karakterisasi Isolat Terpilih 8
Enkapsulasi BAL 8
Stabilitas Penyimpanan 9
Analisis Statistik 9
HASIL PEMBAHASAN 9
Isolat BAL Lokal Terbaik 9
Karakteristik Isolat Terpilih 12
Karakteristik BAL Terenkapsulasi 14
Stabilitas Starter selama Penyimpanan 17
SIMPULAN DAN SARAN 18
Simpulan 18
DAFTAR TABEL
1 Interpretasi diameter zona hambat antibiotik 8
2 Sensitivitas antibiotik isolat BAL 10
3 Kemampuan produksi asam isolat BAL yang dikulturkan pada media
MRSB pada suhu 37 oC selama 48 jam 11
4 Viabilitas sel bakteri dan kadar air kultur kering setelah enkapsulasi 15 5 Tingkat ketahanan sel (%) bakteri kultur kering setelah enkapsulasi 16
DAFTAR GAMBAR
1 Tipe bahan enkapsulan 6
2 Kromatogram hasil HPLC produksi asam laktat isolat E1222 dan D4 pada media MRSB pada suhu 37 oC selama 48 jam 12 3 Kurva tumbuh isolat E1222 pada media MRSB, suhu 37 oC 13 4 Stabilitas starter selama penyimpanan suhu 28 oC dan 4 oC serta
persentasenya 17
DAFTAR LAMPIRAN
1 Prosedur pengukuran total asam tertitrasi dan uji sensitivitas antibiotik 24 2 Prosedur pengukuran viabilitas sel dan kadar air 24 3 Starter kering hasil pengeringan beku dan pengeringan semprot
menggunakan matriks tapioka asam 25
4 Analisis statistik data viabilitas sel dan kadar air starter kering setelah
enkapsulasi 26
5 Analisis statistik data ketahanan sel bakteri (%) starter kering setelah
enkapsulasi 28
DAFTAR PUSTAKA 19
PENDAHULUAN
Latar Belakang
Bakteri asam laktat (BAL) merupakan bakteri Gram positif yang banyak digunakan sebagai starter fermentasi. BAL memproduksi asam laktat sebagai produk utama fermentasi yang berperan sebagai preservasi bahan makanan (Schnurer dan Magnusson 2005). Pemanfaatan BAL sebagai starter telah dilakukan dalam berbagai bentuk produk makanan terfermentasi seperti keju (Gomez-Ruiz et al. 2008), susu (Wang et al. 2012), daging (Liu et al. 2010) dan tepung (Putri et al. 2011). Seleksi terhadap galur BAL yang digunakan sebagai starter penting dilakukan untuk mengefektifkan proses fermentasi dan meningkatkan kualitas produk akhir (Stanbury dan Whitaker 1984). BAL yang digunakan sebagai starter harus memiliki produktivitas fermentasi yang tinggi dan tidak resisten terhadap antibiotik (Hummel et al. 2007). Kriteria tersebut dapat diketahui melalui kemampuan produksi asam laktat dan sensitivitas antibiotik. Beberapa dekade terakhir, BAL yang digunakan sebagai starter fermentasi diketahui dapat membawa gen resisten antibiotik (Mathur dan Singh 2005; Hummel et al. 2007). Toomey et al. (2010) menemukan bahwa sebelas galur
Enterococci, Lactobacilli dan Streptococci resisten eritromisin terdeteksi membawa gen erm(B) dan msrA/B. Kastner et al. (2006) menemukan adanya gen resisten tetrasiklin tet(W) pada galur yang digunakan sebagai kultur starter fermentasi daging. BAL resisten antibiotik dapat mentransfer gen resistennya pada bakteri patogen maupun bakteri asam laktat lain (Ammor et al. 2007; Toomey et al. 2010). Penggunaan BAL yang tidak resisten antibiotik sebagai starter fermentasi diharapkan dapat mengurangi penyebaran resistensi antibiotik terutama terhadap bakteri patogen.
Produksi starter BAL dalam bentuk kering dapat dilakukan dengan metode enkapsulasi. Enkapsulasi merupakan metode jerapan suatu substansi ke dalam substansi lain, menghasilkan partikel dalam ukuran nanometer (nm), mikrometer (µm) atau dalam skala millimeter (mm) (Lakkis 2007; Burgain et al. 2011). Enkapsulasi yang menghasilkan partikel dalam ukuran mikrometer juga dikenal sebagai mikroenkapsulasi. Mikroenkapsulasi dapat meliputi pengeringan sel bakteri yang bertujuan untuk memperpanjang waktu simpan (Nazzaro et al. 2012; Nupoor dan Rathore 2012). Teknik pengeringan yang digunakan merupakan faktor penting yang mempengaruhi kualitas starter kering yang dihasilkan. Starter kering BAL harus memiliki viabilitas sel yang tinggi setelah proses pengeringan dan relatif stabil selama proses penyimpanan (Carvalho et al. 2004; Peighambardoust et al. 2011). Teknik pengeringan kultur bakteri yang sering digunakan yaitu pengeringan beku dan pengeringan semprot (Morgan et al. 2006; Peighambardoust et al. 2011). Yao et al. (2009) memproduksi kultur starter fermentasi Gari menggunakan metode pengeringan beku dan mampu mempertahankan tingkat ketahanan sel (survival rate) Lactobacillus plantarum
G2/25 hingga mencapai 93.1%. Lian et al. (2002) mampu mempertahankan tingkat ketahanan sel Bifidobacteria setelah pengeringan semprot sebesar 82.6%.
2
sebagai pelindung bagi BAL, aman dikonsumsi dan harganya murah sehingga harga produk akhir menjadi ekonomis. Salah satu bahan baku matriks yang harganya ekonomis, tersedia melimpah, dapat diperbaharui, mudah terdegradasi dan non toksik ialah pati (De Vos et al. 2010, Winarti et al. 2013). Pati merupakan makromolekul organik yang terdiri atas rantai-rantai monomer yang dihubungkan oleh ikatan kovalen. Struktur kimia dan konformasi rantai monomer menjadikan pati memiliki kemampuan membentuk gel sehingga dapat digunakan sebagai matriks dalam proses enkapsulasi mikroorganisme (Gbassi dan Vandamme 2012). Tapioka asam merupakan pati termodifikasi dari tapioka alami yang diproduksi melalui proses fermentasi. Tapioka asam berpotensi untuk digunakan sebagai matriks enkapsulasi BAL karena memiliki beberapa kelebihan. Pertama, tapioka asam diproduksi melalui proses fermentasi oleh BAL sehingga dapat digunakan sebagai bahan enkapsulan yang baik juga bagi BAL. Kedua, cara produksi yang alami pada tapioka asam menyebabkan tidak adanya kandungan bahan tambahan pangan (BTP) yang berbahaya bagi mikroorganisme. Ketiga, proses fermentasi pada tapioka asam menyebabkan pemutusan polisakarida menjadi monosakarida yang bermanfaat sebagai protektan selama proses pengeringan dan penyimpanan. Keempat, tapioka asam memiliki kelarutan lebih tinggi dibandingkan tapioka alami. Hal ini menyebabkan starter fermentasi yang menggunakan matriks tapioka asam lebih mudah larut pada bahan baku fermentasi sehingga mempercepat proses aktivasi bakteri yang terperangkap. Berbagai kelebihan tapioka asam tersebut, sekaligus ketersediaan bahan baku yang melimpah menyebabkan tapioka asam potensial untuk digunakan sebagai matriks enkapsulasi, namun penelitian mengenai produksi starter kering BAL menggunakan matriks tapioka asam belum banyak dilakukan. Produksi starter kering BAL menggunakan matriks tapioka asam diharapkan dapat meningkatkan ketersediaan starter BAL yang ekonomis untuk fermentasi makanan.
Perumusan Masalah
3 Tujuan Penelitian
Tujuan penelitian ini adalah melakukan seleksi BAL lokal untuk diproduksi sebagai starter kering menggunakan matriks tapioka asam.
Manfaat Penelitian
Data yang diperoleh dapat memberikan informasi mengenai BAL lokal yang berpotensi dimanfaatkan untuk produksi starter kering menggunakan matriks tapioka asam, sekaligus metode dan suhu penyimpanan yang dapat digunakan.
Ruang Lingkup
Ruang lingkup penelitian ini adalah sebagai berikut :
1. Seleksi isolat BAL lokal berdasarkan kemampuan produksi asam dan sensitivitas terhadap antibiotik tetrasiklin, eritromisin dan kloramfenikol. 2. Pembuatan kultur kering isolat terpilih menggunakan matriks tapioka asam
dengan metode pengeringan bekudan pengeringan semprot.
3. Pengujian viabilitas sel setelah pengeringan dan stabilitas penyimpanan selama empat minggu pada suhu 28 oC dan 4 oC.
TINJAUAN PUSTAKA
Bakteri Asam Laktat
Bakteri asam laktat (BAL) merupakan kelompok mikroorganisme yang terdistribusi luas di alam dan berasosiasi dengan produk susu, sayuran dan daging (Carr et al. 2002). BAL bersifat Gram positif dan mampu memproduksi asam laktat sebagai produk utama hasil fermentasi. BAL secara taksonomi dibagi menjadi dua kelompok berdasarkan kandungan “GC”. Kelompok dengan kandungan “GC rendah” diantaranya yaitu genus Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Pediococcus dan Streptococcus. Kelompok dengan kandungan “GC tinggi” yaitu genus Bifidobacteria (Schleifer dan Ludwig 1995). Berdasarkan jenis asam yang dihasilkan selama fermentasi, BAL dibagi menjadi dua kelompok, yaitu BAL homofermentatif dan BAL heterofermentatif. BAL homofermentatif hanya memproduksi asam laktat sebagai produk utama fermentasi, sedangkan BAL heterofermentatif mampu memproduksi produk tambahan lain seperti karbondioksida, etanol dan asetat (Carr et al. 2002).
BAL merupakan kelompok bakteri yang paling banyak digunakan sebagai starter fermentasi. Penambahan starter bertujuan untuk mengontrol proses fermentasi (Stanbury dan Whitaker 1984). Fermentasi asam laktat juga memiliki peranan positif bagi kualitas makanan yang terfermentasi diantaranya yaitu menambahkan aroma (Kam et al. 2011), meningkatkan nutrisi (Nout 2009; Chelule et al. 2010), mengawetkan makanan (Schnurer dan Magnusson 2005) dan mampu menurunkan konsentrasi toksin pada makanan (Mokoena et al. 2006).
4
melalui saluran pencernaan manusia. Hal ini menyebabkan penggunaan BAL resisten antibiotik sebagai starter fermentasi dapat meningkatkan penyebaran bakteri resisten antibiotik, terutama pada bakteri patogen manusia. Penyebaran resistensi antibiotik ini pada bakteri patogen manusia dapat menyebabkan penurunan efektivitas penggunaan antibiotik dalam pengobatan. Hal ini menyebabkan pengujian resistensi galur BAL yang digunakan sebagai starter menjadi sangat penting (Mathur dan Singh 2005; Ammor et al. 2007).
Penyebaran resistensi antibiotik pada BAL dapat terjadi melalui dua cara yaitu melalui plasmid konjugasi pada BAL yang membawa kode gen resisten antibiotik dan melalui transposon konjugatif pada BAL. Plasmid konjugatif umum ditemukan pada Lactococci, Pediococci dan beberapa spesies Lactobacillus. Gen resisten antibiotik secara alami tidak terdapat pada plasmid konjugatif pada BAL. Gen resisten antibiotik diapit oleh elemen insertion sequence (IS) pada plasmid konjugatif yang umumnya berasal dari spesies Enterococcal dan Staphylococcal
(Ammor et al. 2007). Transposon merupakan elemen loncat yang membawa kode genetik dari satu DNA ke bagian DNA yang lain (Snyder dan Champness 2009). Transposon Enterococcal Tn916-Tn1545 yang membawa gen resistensi terhadap tetrasiklin, eritromisin dan kloramfenikol telah tertransfer secara luas pada bakteri Gram positif melalui konjugasi, diantaranya yaitu Lactococcus lactis subsp. lactis
dan Leuconostoc mesenteroides (Perreten et al. 1997).
Enkapsulasi
Penyimpanan kultur BAL untuk fermentasi dapat dilakukan dalam bentuk kering melalui metode enkapsulasi. Enkapsulasi merupakan metode jerapan suatu substansi ke dalam substansi lain, menghasilkan partikel dalam ukuran nanometer (nanoenkapsulasi), mikrometer (mikroenkapsulasi) atau dalam skala milimeter (Lakkis 2007; Burgain et al. 2011). Mikroenkapsulasi dapat meliputi pengeringan substansi aktif biologi (DNA atau sel) yang secara umum bertujuan untuk memperpanjang waktu penyimpanan (Nupoor dan Rathore 2012). Teknik pengeringan sel mikroorganisme yang sering digunakan yaitu pengeringan beku dan pengeringan semprot (Morgan et al. 2006; Peighambardoust etal. 2011).
5 Pengeringan semprot pertama kali dipatenkan oleh Samuel Percy pada tahun 1872. Pengeringan semprot melibatkan atomisasi materi yang akan dienkapsulasi menjadi tetesan yang akan dihubungkan dengan ruangan yang dialirkan air panas. Proses pembentukan partikel dan pengeringan menggunakan teknik pengeringan semprot terjadi pada waktu yang bersamaan sehingga prosesnya lebih efektif dan efisien untuk produksi berkelanjutan (Peighambardoust et al. 2011). Teknik ini memiliki beberapa keuntungan, yaitu (1) ekonomis karena hanya membutuhkan waktu singkat untuk kontak dengan alat pengering (Nupoor dan Rathore 2012); (2) efektif untuk produksi kultur starter dalam jumlah besar karena proses pengeringan cepat dan mampu memproduksi secara berkelanjutan (Peighambardoust et al. 2011); (3) fleksibel terhadap variasi matriks yang digunakan (Desai dan Park 2005) dan (4) partikel hasil produksi memiliki kualitas yang bagus dan dapat disimpan dalam waktu yang lama (Desai dan Park 2005; Peighambardoust etal. 2011).
6
Matriks
Substansi yang digunakan sebagai bahan enkapsulan biasa disebut membran mantel, kapsul, bahan penyalut, fase eksternal atau matriks. Bahan enkapsulan yang digunakan dalam produk makanan harus aman dikonsumsi dan harus dapat melindungi agen aktif dari lingkungannya. Bahan enkapsulan memiliki tiga tipe, yaitu tipe penyimpanan (reservoir), tipe matriks dan tipe matriks berlapis (Gambar 1). Tipe penyimpanan memiliki lapisan yang menyelimuti bahan inti yang disebut kapsul. Pada tipe matriks, agen aktif tersebar di bahan pembawa dan juga dapat ditemukan pada permukaan. Kombinasi dari kedua tipe tersebut ialah matriks berlapis, yaitu keberadaan agen aktif seperti berada di dalam kapsul yang dilindungi oleh lapisan tambahan (Zuidam dan Nedovic 2010).
(a) (b) (c)
Gambar 1 Tipe bahan enkapsulan (Zuidan dan Nedovic 2010) (a) tipe penyimpanan, (b) tipe matriks dan (c) tipe matriks berlapis.
Bahan enkapsulan yang digunakan antara lain yaitu polisakarida, ekstrak tanaman, ekstrak hasil laut, protein, lemak serta polisakarida yang berasal dari mikroorganisme dan hewan. Polisakarida yang dapat digunakan sebagai bahan enkapsulan yaitu pati dan turunannya seperti amilosa, amilopektin, dekstrin, maltodekstrin, polidekstrosa, sirup serta selulosa dan turunannya (O’Riordan et al.
2001; Semyonov et al. 2010). Ekstrak tanaman yang dapat digunakan sebagai bahan enkapsulan yaitu gum Arab, galaktomanan, pektin dan polikasarida terlarut yang terdapat dalam kedelai (Desmond et al. 2002). Ekstrak hasil laut yang dapat digunakan sebagai bahan enkapsulan yaitu karagenan dan alginat (Gbassi et al.
2010; Fu et al. 2011). Protein yang dapat digunakan sebagai bahan enkapsulan yaitu susu dan protein limbah tahu seperti kasein, gelatin dan gluten (Picot dan Lacroix 2004; Doherty et al. 2011; Khoramnia et al. 2011). Lemak yang dapat digunakan sebagai bahan enkapsulan yaitu asam lemak, gliserida dan fosfolipid (Hou et al. 2003).Polisakarida yang berasal dari mikroorganisme dan hewan yang dapat digunakan sebagai bahan enkapsulan yaitu dekstran dan kitosan (Hubalek 2003; Krasaekoopt et al. 2006). Pati merupakan salah satu bahan enkapsulan yang direkomendasikan karena harganya murah sehingga dapat menekan biaya produksi (De Vos et al. 2010).
7 Tapioka Asam
Tapioka asam (sour cassava starch) merupakan produk pati termodifikasi yang dihasilkan melalui fermentasi tapioka (native cassava starch) dan diikuti dengan pengeringan di bawah sinar matahari (Cardenas dan Buckle 1980). Fermentasi mampu meningkatkan kualitas tapioka alami sekaligus merubah struktur dan sifat fisiko-kimia pada tapioka asam. Perubahan struktural pati termodifikasi berpotensi untuk diaplikasikan sebagai matriks selama proses enkapsulasi (Winarti et al. 2013).
Pati yang baik digunakan sebagai matrik ialah pati yang memiliki kelarutan tinggi dan viskositas yang rendah. Modifikasi pada pati tapioka asam melalui proses fermentasi mampu meningkatkan kelarutan sekitar 10-30% dibandingkan tapioka alami (Putri et al. 2011), serta penurunan viskositas dibandingkan dengan tapioka alami (Putri et al. 2012). Dua faktor ini menyebabkan tapioka asam berpotensi untuk dijadikan matriks enkapsulasi.
METODOLOGI PENELITIAN
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Bioteknologi Hewan dan Biomedis PPSHB LPPM IPB pada bulan Juli 2013 – Oktober 2014.
Bahan dan Alat
Isolat bakteri asam laktat lokal yang digunakan dalam penelitian ini merupakan koleksi Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam IPB. Sebelas isolat BAL lokal tersebut telah diisolasi dari fermentasi spontan jagung (E1212, E1211, E2211, E2113.5, E2112, E1222, E2121) oleh Rosyidah (2013) dan fermentasi spontan tepung sagu (D3, D4, D5, D7) oleh Suseno (2015). Matriks yang digunakan untuk enkapsulasi ialah tepung tapioka asam. Peralatan yang digunakan dalam penelitian ini meliputi
freeze dryer, spray dryer, high performance liquid chromatography (HPLC), spektrofotometer, pH meter dan inkubator.
Seleksi Isolat BAL
8
tinggi, yang kemudian digunakan untuk uji selanjutnya. Prosedur pengukuran total asam tertitrasi dan uji sensitivitas antibiotik selengkapnya disajikan pada Lampiran 1.
Tabel 1 Interpretasi diameter zona hambat (Ø) antibiotik
Interpretasi Tetrasiklin (30 µg) Eritromisin (15 µg) Kloramfenikol (30 µg)
Sensitif (S) Ø ≥ 19 mm Ø ≥ 23 mm Ø ≥ 18 mm
Intermediet (I) 18 mm ≥ Ø ≥ 15 mm 22 mm ≥ Ø ≥ 14 mm 16 mm ≥ Ø ≥ 14 mm
Resisten (R) Ø ≤ 14 mm Ø ≤ 13 mm Ø ≤ 12 mm
a
Sumber : Johnson dan Case (2007).
Karakterisasi Isolat Terpilih
Karakterisasi isolat terpilih meliputi morfologi dan pembuatan kurva tumbuh. Pengamatan morfologi dilakukan menggunakan mikroskop cahaya meliputi pewarnaan Gram dan bentuk sel. Pembuatan kurva tumbuh dilakukan dengan menginokulasikan kultur bakteri berumur 24 jam pada media de Man Rogosa Sharpe broth (MRSB). Kurva tumbuh diamati dengan melakukan perhitungan jumlah sel (log CFU/mL) dan pengukuran terhadap optical density
(OD) menggunakan spektrofotometer pada panjang gelombang ( ) 620 nm. Perhitungan jumlah sel dilakukan dengan metode total plate count (TPC) pada media de Man Rogosa Sharpe agar (MRSA) yang diinkubasi pada suhu 37 oC selama 48 jam. Pengamatan dilakukan setiap satu jam hingga sel bakteri mencapai tingkat pertumbuhan spesifik maksimal (µm, h-1) yang dihitung berdasarkan persamaan berikut (Soro-Yao et al. 2014):
µm = ( ln Nt - ln N0 ) tt - t0
Nt merupakan jumlah sel pada waktu ke-t (CFU/mL). N0 merupakan jumlah sel awal. tt merupakan waktu ke-t dan t0 merupakan waktu awal.
Enkapsulasi BAL
Kultur kering isolat terpilih dienkapsulasi dengan teknik pengeringan pengeringan beku dan pengeringan semprot. Matriks yang digunakan ialah tapioka asam dan tapioka asam dengan penambahan 10% susu skim digunakan sebagai kontrol positif. Larutan matriks disiapkan dengan melarutkan 1% (b/v) tapioka asam ke dalam akuades. Sebanyak 500 mL sampel starter disiapkan dengan mencampurkan 450 mL larutan matriks steril dengan 50 mL kultur BAL dalam MRSB pada tahap pertumbuhan optimum. Susu skim yang digunakan sebelumnya dilarutkan ke dalam 50 mL akuades steril dan disterilisasi pada suhu 115 oC selama 10 menit (Pyar dan Peh 2014). Sampel dengan komposisi yang sama kemudian dikeringkan menggunakan alat freeze dryer pada suhu -50 oC dan
9 dihasilkan kemudian disimpan di dalam alumunium foil kedap udara untuk diukur kadar air dan dihitung jumlah sel bakterinya.
Perhitungan jumlah sel dilakukan dengan metode sebar (spread-plate method). Kultur kering disuspensikan dengan larutan garam fisiologis steril dan dihomogenkan dengan vortex selama 30 menit sebelum dibuat beberapa seri pengenceran. Seri pengenceran tersebut kemudian disebar sebanyak 100 µL pada media MRSA dan diinkubasi pada suhu 37 oC selama 48 jam. Jumlah koloni dihitung dan dinyatakan dalam log CFU/g. Pengukuran kadar air kultur kering dilakukan pada hari ke-0 setelah enkapsulasi. Kadar air sampel diukur setelah pengeringan pada suhu konstan 105 oC (AOAC 1995). Prosedur pengukuran viabilitas sel dan kadar air selengkapnya disajikan pada Lampiran 2.
Tingkat ketahanan BAL (%) setelah pengeringan dihitung menggunakan persamaan (N/No) x 100% (Leja et al. 2009). No merupakan jumlah sel (CFU/g) sebelum proses pengeringan. N merupakan jumlah sel (CFU/g) setelah pengeringan.
Stabilitas Penyimpanan
Kultur kering hasil pengeringan terpilih dikemas di dalam alumunium foil
kedap udara kemudian disimpan pada suhu dingin (4 oC) dan suhu ruang (28 oC) selama empat minggu. Viabilitas sel pada kultur kering dihitung pada hari ke-0, 7, 14, 21 dan 28 setelah penyimpanan. Jumlah koloni dinyatakan dalam log CFU/g.
Analisis Data
Data ditampilkan dalam bentuk rataan ± standar deviasi dari tiga ulangan perlakuan. Analisis statistik dihitung dengan analisis rancangan acak lengkap (RAL) faktorial menggunakan software statistical analytic software version 9.1 (SAS). Uji Duncan dilakukan sebagai uji lanjut untuk mengidentifikasi secara statistik perbedaan yang signifikan dalam percobaan (α = 0.05).
HASIL DAN PEMBAHASAN
Isolat BAL Lokal Terbaik
10
Beberapa mikroorganisme secara alami resisten terhadap antibiotik tertentu. Resistensi terhadap antibiotik tersebut dapat terjadi karena beberapa alasan. Pertama, organisme tidak memiliki struktur yang dihambat oleh antibiotik, sehingga resisten terhadap antibiotik tersebut. Hal ini terjadi pada mikoplasma yang tidak memiliki dinding sel sehingga secara alami resisten terhadap antibiotik yang menghancurkan dinding sel. Kedua, organisme tidak dapat ditembus (impermeable) oleh antibiotik. Hal ini terjadi pada mayoritas bakteri Gram negatif terhadap antibiotik penisilin G dan pletensimisin. Ketiga, organisme dapat mengubah antibiotik ke bentuk inaktiv. Hal ini terjadi pada
staphylococci yang memiliki enzim β-laktamase untuk memotong cincin β -laktam pada mayoritas penisilin. Keempat, organisme mampu memodifikasi target dari antibiotik. Resistensi seperti ini biasanya terjadi karena adanya mutasi pada gen kromosomal. Kelima, organisme mampu membangun jalur biokimia resisten. Hal ini terjadi pada mayoritas patogen yang dihambat produksi asam folatnya oleh antibiotik. Bakteri resisten mampu memodifikasi metabolismenya untuk mengambil bahan baku asam folat dari lingkungan untuk menghindari terhalangnya jalur produksi asam folat oleh antibiotik. Keenam, organisme mampu memompa keluar antibiotik yang masuk ke dalam sel. Proses ini juga disebut efflux (Madigan et al. 2012).
Tabel 2 Sensitivitas antibiotik isolat BAL yang ditumbuhkan pada media MRSA pada suhu 37 oC selama 48 jam
Kode Isolat
Tetrasiklin Eritromisin Kloramfenikol Isolat Terpilih
Sumber: Johnson dan Case (2007); Int: interpretasi, S: sensitif, I: intermediet, R: resisten merujuk pada Tabel 1.
11 antibiotik ke dalam sel atau memompa antibiotik keluar sel. Gen resisten antibiotik umumnya terdapat pada tranposon yang terinsersi ke dalam plasmid maupun gen kromosomal (Mathur dan Singh 2005). Resistensi kloramfenikol terjadi melalui mekanisme inaktivasi antibiotik dan memompa antibiotik keluar sel (efflux) (Madigan et al. 2012). Gen resisten kloramfenikol dikenal sebagai gen cat yang mensintesis enzim asetilase (Mathur dan Singh 2005). Gen cat
telah ditemukan keberadaannya pada plasmid pRE25 Enterococcus faecalis
RE25 (Schwatz et al. 2001). Resistensi eritromisin terjadi dengan mengubah target antibiotik dan memompa antibiotik keluar sel (efflux) (Madigan et al.
2012). Gen erm merupakan gen resisten eritromisin (Mathur dan Singh 2005). Gen erm telah diketahui keberadaannya pada plasmid yang dibawa oleh
Lactobacillus fermentum (Fons et al. 1997). Resistensi tetrasiklin terjadi dengan memompa antibiotik keluar sel (efflux) (Madigan et al. 2012). Gen tet
merupakan gen resisten tetrasiklin yang berperan untuk melindungi ribosom (Mathur dan Singh 2005). Plasmid yang membawa gen tet(M) telah diketahui keberadaannya pada Lactobacillus yang diisolasi dari fermentasi sosis (Gevers et al. 2002).
Transmisi gen resisten antibiotik dapat terjadi secara konjugasi diantara sesama BAL. Perreten et al. (1997) menyatakan bahwa transposon TnFO1 pada E. faecalis yang membawa gen tet(M) ditransfer secara konjugasi pada bakteri Gram positif lain. Toomey et al. (2010) juga menemukan bahwa gen tet(M) dari
Lactobacillus plantarum berhasil ditransfer kepada Lactococcus lactis BU-2-60 dan E. faecalis JH2-2 secara konjugasi.
Tabel 3 Kemampuan produksi asam isolat BAL yang dikulturkan pada media MRSB pada suhu 37 oC selama 48 jam
12
menggunakan HPLC. Hasil HPLC menunjukkan bahwa isolat E1222 memproduksi asam laktat lebih tinggi (16581.88 mg/L) dibandingkan dengan isolat D4 (14609.24 mg/L) (Gambar 2). Isolat E1222 kemudian dipilih untuk uji selanjutnya. Hasil identifikasi oleh Meryandini dan Wiryawan (2013) menunjukkan bahwa isolat E1222 ialah Pediococcus pentosaceus. Produksi asam laktat selama proses fermentasi dilakukan BAL dengan mengubah glukosa menghasilkan asam laktat sebagai produk utamanya. Fermentasi merupakan proses pembentukan energi melalui transfer elektron di sitoplasma (fosforilasi tingkat substrat) (White 2007).Fermentasi dapat terjadi pada kondisi tidak adanya akseptor elektron respiratif. Hal ini menyebabkan proses fermentasi harus memproduksi akseptor elektron (electron sinks) yang digunakan untuk menangkap elektron dari NADH selama proses oksidasi.
Gambar 2 Kromatogram hasil HPLC produksi asam laktat isolat (a) E1222 dan (b) D4 pada media MRSB pada suhu 37 oC selama 48 jam.
Karakteristik Isolat Terpilih
Hasil pengamatan mikroskopis dan pewarnaan Gram menunjukkan bahwa isolat E1222 bersifat Gram positif dan berbentuk kokus. Isolat E1222 mencapai laju pertumbuhan spesifik maksimal (µm = 0.027 h-1) pada jam ke-6 (Gambar 3). Pertumbuhan spesifik merupakan nilai kemiringan (slope) logaritma dari kurva pertumbuhan pada fase exponensial. Soro-Yao et al. (2014) menyatakan bahwa
(a)
13 parameter laju pertumbuhan spesifik maksimal (µm) BAL dan viabilitas sel setelah perlakuan stres dapat digunakan untuk memprediksi BAL potensial yang dapat digunakan sebagai kultur starter kering. Hal ini didukung dengan penelitiannya bahwa Lactobacillus fermentum yang memiliki laju pertumbuhan spesifik tertinggi (µm = 1.14 h-1) dibandingkan galur lain yang diujikan, memiliki tingkat ketahanan sel (%) tertinggi setelah pengeringan beku yaitu mencapai 31.03%.
Gambar 3 Kurva tumbuh isolat E1222 pada media MRSB, suhu 37 oC. stationer (Gambar 3). Salah satu faktor intrinsik yang mempengaruhi viabilitas dan ketahanan sel bakteri selama proses enkapsulasi ialah fase sel mikroorganisme. Pertumbuhan bakteri terdiri atas tiga fase, yaitu fase adaptasi (lag), fase eksponensial (log) dan fase stasioner. Fase adaptasi merupakan fase bakteri beradaptasi terhadap lingkungan dan persiapan pertumbuhan. Isolat E1222 mengalami fase adaptasi dari jam ke-0 hingga jam ke-1 (Gambar 2). Fase eksponensial merupakan fase pertumbuhan aktif sehingga terjadi peningkatan massa sel secara eksponensial terhadap waktu. Fase eksponensial isolat E1222 terjadi dari jam ke-1 hingga jam ke-6 (Gambar 2). Fase stasioner merupakan fase sel berhenti bertumbuh dan diakhiri dengan kematian sel (White 2007). Fase stasioner isolat E1222 dimulai dari jam ke-6 (Gambar 2). Fase sel yang baik digunakan untuk enkapsulasi yaitu fase stasioner, dimana sel mampu membangun mekanisme resisten stres akibat kondisi rendah glukosa (fase stationer) dengan mensintesis protein yang diinduksi oleh keterbatasan glukosa (Van de Guchte et al. 2002). Giard et al. (2001) melaporkan hasil karakterisasi protein yang diinduksi oleh keterbatasan glukosa pada E. faecalis yaitu manganase superoksida dismutase yang berperan sebagai pertahanan terhadap stres oksidatif. Giard et al.
(2002) juga melaporkan adanya gen ytgH pada E. faecalis dan L. lactis yang regulasinya diinduksi oleh lingkungan rendah glukosa serta stres akibat suhu tinggi, etanol, osmosis dan CdCl2. Sel BAL yang dipanen pada fase stationer diharapkan telah membangun mekanisme resisten stres sehingga lebih mampu
14
bertahan terhadap stres akibat suhu selama proses enkapsulasi dan stres oksidatif selama proses penyimpanan.
Karakteristik BAL Terenkapsulasi
Enkapsulasi merupakan metode immobilisasi BAL yang bertujuan melindungi sel dari pengaruh buruk lingkungan. Starter kering hasil pengeringan beku memiliki warna putih dengan tekstur agak kasar dan rapuh, sedangkan Starter kering hasil pengeringan semprot berwarna kuning dengan tekstur halus. Gambar starter kering hasil pengeringan beku dan pengeringan semprot dapat dilihat pada Lampiran 3.Starter kering P. pentosaceus setelah proses pengeringan mengalami penurunan viabilitas sel. Ada beberapa faktor yang mempengaruhi viabilitas sel setelah proses pengeringan. Pertama, faktor toleransi intrinsik kultur (galur) dimana setiap galur bakteri yang digunakan memiliki variasi secara genotip terutama terhadap jumlah protein stres yang diinduksi oleh suhu dan stres oksidatif. Kedua, faktor media dan kondisi pertumbuhan yaitu mayoritas BAL dapat tumbuh pada media MRS dan aktivitas fermentasinya tidak berubah. Kehadiran zat terlarut yang tepat pada media juga dapat meningkatkan viabilitas kultur starter. Ketiga, faktor respon stres dimana BAL dapat membangun mekanisme resisten stres yang diinduksi oleh kondisi lingkungan (suhu tinggi, keterbatasan glukosa, stres oksidatif). Keempat, kondisi pemanenan sel dimana waktu pemanenan sel untuk produksi kultur starter tergantung pada masing-masing organisme, namun pada umumnya BAL dipanen pada akhir fase log menuju awal fase stationer. Pemanenan pada waktu tersebut selain mendapatkan hasil yang maksimal juga dapat meningkatkan viabilitas sel setelah pengeringan. Kelima, faktor bahan enkapsulan (matriks) yang digunakan dan penambahan agen pelindung (protectant) pada kultur starter. Penambahan pelindung bertujuan untuk melindungi sel selama proses pengeringan dan penyimpanan. Keenam, faktor dehidrasi dimana viabilitas sel kultur starter kering dipengaruhi oleh suhu, waktu dan teknik pengeringan yang digunakan. Ketujuh, faktor enumerasi sel setelah pengeringan, dimana viabilitas sel kultur kering dipengaruhi oleh media yang digunakan karena sel yang telah terpapar stres selama proses pengeringan membutuhkan media yang tepat untuk pemulihan. Kedelapan, faktor kondisi selama penyimpanan dimana viabilitas sel selama penyimpanan dipengaruhi oleh suhu dan kadar air (Santivarangkna et al. 2007).
Viabilitas sel kultur kering setelah proses pengeringan beku lebih tinggi dibandingkan dengan pengeringan semprot (Tabel 4). Analisis statistik viabilitas sel dan kadar air kultur kering setelah enkapsulasi dapat dilihat pada Lampiran 3. Data tersebut menunjukkan bahwa P. pentosaceus lebih mampu bertahan terhadap kerusakan akibat suhu dingin dibandingkan suhu panas. Harmayani et al. (2001) juga melaporkan bahwa viabilitas sel kultur kering BAL hasil pengeringan beku lebih tinggi dibandingkan dengan viabilitas sel kultur kering hasil pengeringan semprot.Kerusakan sel selama proses pengeringan semprot dapat disebabkan oleh stres terhadap suhu tinggi dan dehidrasi (Fu dan Chen 2011). Paparan suhu tinggi menyebabkan perubahan struktur makromolekul seperti protein dan asam nukleat, sedangkan stres dehidrasi menyebabkan perubahan fluiditas membran sitoplasma yang mengakibatkan oksidasi lipid (Corcoran et al. 2008; Santivarangkna et al.
15 perubahan kondisi fisik lipid pada membran sel dan perubahan struktur protein yang sensitif di dalam sel (Carvalho et al. 2004). Perubahan tersebut menyebabkan sel mengalami perubahan fisiologi meliputi penurunan fluiditas membran sel serta penurunan stabilitas struktur sekunder RNA dan DNA yang menyebabkan terjadinya reduksi efisiensi translasi, transkripsi dan replikasi DNA (Santivarangkna et al. 2008b).
Tabel 4 Viabilitas sel bakteri dan kadar air kultur kering setelah enkapsulasi
Matriks
Viabilitas sel (log CFU/g) Kadar air (%)
Pengeringan
Salah satu faktor yang mempengaruhi tingkat ketahanan sel selama proses pengeringan ialah matriks. Matriks memberikan tingkat efek perlindungan yang berbeda pada sel-sel mikroorganisme uji yang terperangkap ketika mengalami proses pengeringan (Lian et al. 2002). Selama proses pengeringan air akan didehidrasi secara terus-menerus hingga kadar air menurun (Tabel 4). Kadar air merupakan salah satu faktor penting yang mempengaruhi kualitas starter kering. Proses dehidrasi dapat mempengaruhi viabilitas sel karena 80% reaksi fisiologis di dalam sel melibatkan molekul air, bahkan molekul air berperan untuk stabilitas protein, DNA dan lemak yang menyusun sel (Santivarangkna et al. 2008b). Penurunan kadar air dapat menyebabkan kerusakan komponen sel seperti DNA atau RNA dan protein. Membran sel yang tersusun atas protein juga merupakan bagian yang rentan mengalami kerusakan selama proses pengeringan dan dapat menyebabkan kebocoran sel. Padatan matriks yang terbentuk selama proses pengeringan dapat mencegah terjadinya kerusakan sel tersebut (Keivani et al. 2014).
16
membran sel yang berada pada fase gel di suhu ruang akan mengalami perubahan menjadi fase kristalin. Kedua, menekan peluang terjadinya kerusakan akibat suhu dingin, kerusakan akibat suhu panas dan kerusakan membran selama proses pengeringan (Santivarangkna et al. 2008a).
Tabel 5 Tingkat ketahanan sel (%) bakteri kultur kering setelah enkapsulasi
Matriks Tingkat ketahanan sel bakteri (%)
Pengeringan beku Pengeringan semprot
TAa 89 ± 0.002b 76 ± 0.026c
TA + 10% SSa 97 ± 0.091a 78 ± 0.097c
a
TA: tapioka asam, TA + 10% SS: tapioka asam + 10% susu skim.
Tingkat ketahanan sel (%) setelah pengeringan menggunakan metode pengeringan beku lebih tinggi dibandingkan dengan pengeringan semprot (Tabel 5). Hasil yang sama dilaporkan oleh Leja et al. (2009) bahwa tingkat ketahanan sel Lactobacillus rhamnosus GG tertinggi dihasilkan setelah pengeringan beku dibandingkan dengan pengeringan semprot. BAL selama proses pengeringan beku akan terpapar suhu dingin hingga mencapai -50oC. BAL melakukan adaptasi dengan mensintesis cold-induced proteins (CIPs) yang berperan sebagai penyusun struktur kromosom, sinyal transduksi dan adaptasi stres. BAL juga dapat mensintesis cold-adaptive response protein (CSP) yang berperan penting untuk meningkatkan kemampuan toleransi sel terhadap pembekuan, yaitu dengan melindungi asam nukleat. Faktor lain yang mempengaruhi tingkat ketahanan sel selama proses pengeringan beku yaitu fase pemanenan sel. Sel yang dipanen pada fase stasioner memiliki tingkat ketahanan sel (survival rate) 20 kali lebih tinggi meskipun tidak ada peningkatan level CSP (van de Guchte et al. 2002).
Jumlah sel hidup per unit massa dari kultur kering bakteri merupakan faktor penting dalam aplikasi komersil di bidang industri. Kultur kering bakteri harus memiliki jumlah sel minimal 107 CFU/g sebelum diaplikasikan (Kaliasapathy dan Chin 2000). Kultur kering hasil pengeringan semprot menggunakan matriks tapioka asam memiliki viabilitas lebih rendah dibandingkan kultur kering hasil pengeringan beku, namun viabilitas selnya masih memenuhi standar untuk diaplikasikan (108 CFU/g). Hal ini menunjukkan bahwa kultur kering hasil pengeringan semprot tetap dapat digunakan sebagai starter fermentasi, namun karena viabilitas selnya tidak terlalu tinggi dapat diaplikasikan secara langsung tanpa penyimpanan terlalu lama. Pengeringan semprot merupakan metode yang efisien untuk produksi starter kering bakteri di industri (Peighambardoust et al. 2011; Serna-Cock dan Vallejo-Castillo 2013). Proses pengeringan berlangsung cepat dan berkelanjutan sehingga pengeringan menggunakan spray dryer dapat dilakukan dalam jumlah besar (Peighambardoust
et al. 2011). Santivarangkna et al. (2007) juga menyatakan bahwa penggunaan
spray dryer dalam industri mampu mereduksi biaya produksi hingga mencapai 20% jika dibandingkan dengan penggunaan freeze dryer.
17 berpengaruh nyata. Pyar dan Peh (2014) menyatakan bahwa susu skim merupakan agen pelindung terbaik karena harganya ekonomis, mudah didapatkan dan mampu meningkatkan pertumbuhan sel bakteri secara signifikan. Lian et al. (2002) melaporkan bahwa retakan permukaan mikropartikel susu skim setelah spray-drying dapat memperantarai keluarnya panas dari dalam partikel setelah pengeringan. Hal ini menyebabkan cedera panas pada mikroorganisme yang terperangkap lebih sedikit sehingga viabilitas sel menjadi lebih tinggi dibandingkan dengan viabilitas sel starter hasil pengeringan semprot tanpa penambahan susu skim.
Stabilitas Starter selama Penyimpanan
Starter kering hasil pengeringan beku menunjukkan viabilitas dan tingkat ketahanan sel lebih tinggi dibandingkan dengan pengeringan semprot sehingga diuji lebih lanjut stabilitasnya selama penyimpanan pada suhu 4 oC dan 28 oC.
Viabilitas sel starter kering hasil pengeringan beku selama penyimpanan empat minggu pada suhu 4 oC masih dapat dipertahankan hingga 89.38% (Gambar 4). Hal ini berbeda dengan starter kering hasil pengeringan beku yang disimpan pada suhu 28 oC, dimana terjadi penurunan viabilitas sel hingga 0% selama empat minggu penyimpanan. Wang et al. (2004) mendapatkan hasil yang sama dalam penelitiannya bahwa kultur kering Streptococcus thermophillus dan Lactobacillus acidophillus menghasilkan viabilitas kultur lebih tinggi pada suhu penyimpanan 4oC.
Gambar 4 Stabilitas starterselama penyimpanan pada suhu 28 oC (-■-) dan 4 oC (-♦-) serta persentasenya pada suhu 28 oC (▬) dan 4 oC (-▲-).
Suhu penyimpanan starter kering merupakan faktor utama yang mempengaruhi penurunan viabilitas sel selama penyimpanan (Carvalho et al.
2004). Penyebab utama penurunan viabilitas sel selama penyimpanan ialah terjadinya oksidasi lipid (Santivarangkna et al. 2008b). Makromolekul yang
18
essensial seperti lipid dan protein mengalami oksidasi dan denaturasi selama proses penyimpanan. Oksidasi lipid semakin meningkat pada suhu yang lebih tinggi dan menyebabkan komposisi asam lemak jenuh pada membran sel meningkat. Hal ini menyebabkan fluiditas membran sel menurun sehingga terjadi kebocoran sel yang berakibat pada penurunan viabilitas sel selama penyimpanan. Penyimpanan pada suhu 4 oC dapat menghambat terjadinya oksidasi lipid dan kerusakan sel sehingga viabilitas sel menjadi lebih tinggi.
Faktor lain yang mempengaruhi viabilitas sel selama penyimpanan ialah kadar air (Santivarangkna et al. 2008b). Kadar air yang tinggi dapat meningkatkan paparan oksigen pada sel yang menyebabkan terjadinya peningkatan oksidasi lipid. Starter kering yang terpapar udara juga dapat mengalami peningkatan kadar air Salah satu cara mempertahankan kadar air starter kering ialah dengan melakukan penyimpanan pada kondisi kedap udara (alumunium foil). Dengan demikian oksidasi lipid pada starter kering dapat dikurangi dan sel mikroorganisme dapat bertahan lebih lama selama proses penyimpanan.
SIMPULAN DAN SARAN
Simpulan
Isolat terbaik hasil seleksi yang bersifat tidak resisten terhadap antibiotik tetrasiklin, eritromisin dan kloramfenikol serta mampu memproduksi asam laktat yang tinggi merupakan isolat E1222 yang teridentifikasi sebagai P. pentosaceus. Tapioka asam dapat digunakan sebagai matriks untuk enkapsulasi P. pentosaceus
dan penambahan susu skim agar mampu meningkatkan viabilitas sel starter yang dihasilkan. Metode dehidrasi menggunakan freeze dryer mampu mempertahankan viabilitas dan ketahanan sel yang masih tinggi, namun masih menghasilkan starter dengan kadar air yang tinggi. Viabilitas sel kultur kering hasil pengeringan beku selama penyimpanan pada suhu 4 oC selama empat minggu mencapai 89.38 %. Kultur kering hasil pengeringan beku P. pentosaceus direkomendasikan untuk disimpan pada suhu 4 oC.
Saran
19 DAFTAR PUSTAKA
Ammor MS, Florez AB, Mayo B. 2007. Antibiotic resistance in non-enterococcal lactic acid bacteria and bifidobacteria-review. Food Microbiol. 24:559-570. [AOAC] Association of Official Analytical Chemists. 1995. Official Methods of
Analysis.16th ed. New York (US):AOAC Int.
Brennan JG. 2006. Evaporation and dehydration. Di dalam Brennan JW, Editor.
Food Processing Handbook. Weinham (DE):Wiley-VCH. hlm 96-97. Burgain C, Gaiani C, Linder M, Scher J. 2011. Encapsulation of probiotic living
cells: from laboratory scale to industrial applications. J Food Eng. factors for the preparation of freeze-dried lactic acid bacteria. Int Dairy J.
14:835-847.
Chelule PK, Mbongwa HP, Carries S, Gqaleni N. 2010. Lactic acid fermentation improves the quality of amahewu, a traditional South African maize-based porridge. Food Chem. 122:656-661.
Corcoran BM, Stanton C, Fitzgerald G, Ross RP. 2008. Life under stress: the probiotic stress response and how it may be manipulated. Curr Pharm Design. 14:1382-1399.
De Vos P, Faas MM, Spasojevic M, Sikkema J. 2010. Encapsulation for preservation of functionally and targeted delivery of bioactive food components. Int Dairy J. 20:292-302.
Desai KGH, Park HJ. 2005. Recent developments in microencapsulation of food ingredients. Drying Technol. 23:1361-1394.
Desmond C, Ross RP, O’Callaghan E, Fitzgerald GF, Stanton C. 2002. Improved survival of Lactobacillus paracasei NFBC 338 in spray dried powders containing gum acacia. J Appl Microbiol. 93:1003-1011.
Doherty SB, Gee VL, Ross RP, Stanton C, Fitzgerald GF, Brodkorb A. 2011. Development and characterization of whey protein microbeads as potential matrices for probiotic protection. Food Hydrocol. 25:1604-1617.
Fons M, Hege T, Ladire M, Raibaud P, Ducluzeau R, Maguin E. 1997. Isolation and characterization of a plasmid from Lactobacillus fermentum conferring erythromycin resistance. Plasmid. 37:199-203.
Fu N, Chen XD. 2011. Towards maximal cell survival in convective thermal drying processes. Food Res Int. 44:1127-1149.
Fu S, Thacker A, Sperger DM, Boni RL, Buckner IS, Velankar S, Munson EJ, Block LH. 2011. Relevance of rheological properties of sodium alginate in solution to calcium alginate gel properties. AAPS Pharm Sci Tech. 12:453-460.
Gbassi GK, Vandamme T, Ennahar S, Marchioni E. 2010. Microencapsulation of
20
Gbassi GK, Vandamme T. 2012. Probiotic encapsulation technology from microencapsulation to release into the gut. Pharmaceutics. 4:149-163. Gevers D, Danielson M, Huys G, Swings J. 2002. Molecular characterization of
tet (M) genes in Lactobacillus isolates from different types of fermented dry sausage. Appl Environ Microbiol. 69:1270-1275.
Giard JC, Laplace JM, Rince A, Pichereau V, Benachour A, Leboeuf C, Flahaut S, Auffray Y, Hartke A. 2001. The stress proteome of Enterococcus faecalis. Electrophor. 22:2947-2954.
Giard JC, Verneuil N, Anffray Y, Hartke A. 2002. Characterization of genes homologous to the general stress-inducible gene gls24 in Enterococcus faecalis and Lactococcus lactis.FEMS Microbiol Lett. 206:235-239. Gomez-Ruiz JA, Cabezas L, Martinez-Castro I, Gonzales-Vinas MA, Poveda JM.
2008. Influence of a defined-galur starter and Lactobacillus plantarum as adjunct culture on volatile compounds and sensory characteristics of manchego cheese. Eur Food Res Technol. 227:181-190.
Harmayani E, Ngatirah, Rahayu ES, Utami T. 2001. Ketahanan dan viabilitas probiotik bakteri asam laktat selama proses pembuatan kultur kering dengan metode freeze dan pengeringan semprot. J Teknol Indust Pang.
12:126-132.
Hou RC, Lin MY, Wang MM, Tzen JT. 2003. Increase of viability of entrapped cells of Lactobacillus delbrueckii ssp. bulgaricus in artificial sesame oil emulsions. J Dairy Sci. 86:424-428.
Hubalek Z. 2003. Protectants used in the cryopreservation of microorganismes.
Cryobiol. 46:205-229.
Hummel AS, Hertel C, Holzapfel WH, Franz CMAP. 2007. Antibiotic resistances of starter and probiotic galurs of lactic acid bacteria. Appl Environ Microbiol. 73:730-739.
Johnson TR, Case CL. 2007. Laboratory Experiments in Microbiology. Ed ke-8. San Francisco (US):Pearson Benjamin Cummings.
Kailasapathy K, Chin J. 2000. Survival and therapeutic potential of probiotic organisme with reference to Lactobacillus acidophilus and
Bifidobacterium spp. Immunol Cell Biol. 78:80-88.
Kam WY, Wan Aida WM, Sahilah AM, Maskat MY. 2011. Volatile compounds and lactic acid bacteria in spontaneous fermented sourdough. Sains Malay.
40:135-138.
Kastner S, Perreten V, Bleuler H, Hugenschmidt G, Lacroix C, Meile L. 2006. Antibiotic susceptibility patterns and resistance genes of starter cultures and probiotic bacteria used in food. Syst Appl Microbiol. 29:145-155. Keivani F, Mokarram RR, Gholian MM, Benis KZ, Zendeboodi F, Zadeh SS.
2014. An encyclopedic approach to distinguish the survival of probiotic living cells during drying processes. Wudpecker J Med Sci. 3:001-007. Khoramnia A, Abdullah N, Liew SL, Sieo CC, Ramasarny K, Ho YW. 2011.
Enhancement of viability of a probiotic Lactobacillus galur for poultry during freeze-drying and storage using the response surface methodology.
Anim Sci J. 82:127-135.
21 Lakkis JM. 2007. Encapsulation and Controlled Release Technologies in Food
Systems. Lowa (US):Blackwell Scientific.
Le Corre D, Bras J, Dufresne A. 2010. Starch nanoparticles: a review.
Biomacromol. 11:1139-1153.
Leja K, Dembczynski R, Bialas W, Jankowski T. 2009. Production of dry
Lactobacillus rhamnosus GG preparations by pengeringan semprot and lyophilization in aqueous two-phase systems. Acta Sci Pol Technol Aliment. 8:39-49.
Lian WC, Hsiao HC, Chou CC. 2002. Survival bifidobacteria after spray-drying.
Int J Food Microbiol. 74:79-86.
Liu G, Griffiths MW, Shang N, Chen S, Li P. 2010. Applicability of bacteriocinogenic Lactobacillus pentosus 31-1 as a novel functional starter culture or coculturefor fermented sausage manufacture. J Food Protect.
73:292-298.
Madigan MT, Martinko JM, Stahl DA, Clark DP. 2012. Brock biology of microorganismes. 13rd ed. San Francisco (US):Benjamin Cummings. Mathur S, Singh R. 2005. Antibiotic resistance in food lactic acid bacteria-a
review. Int J Food Microbiol. 105:281-295.
Meryandini A, Wiryawan KG. 2013. Penapisan bakteri asam laktat sebagai probiotik ayam. Laporan penelitian unggulan Perguruan Tinggi sesuai mandat pusat LPPM IPB. Bogor (ID):IPB. (Belum dipublikasikan)
Mokoena MP, Chelule PK, Gqaleni N. 2006. The toxicity and decreased concentration of alfatoxin B1 in natural lactic acid fermented maize meal. J Appl Microbiol. 100:773-777.
Morgan CA, Herman N, White PA, Vesey G. 2006. Preservation of micro-organismes by drying; a review. J Microbiol Methods. 66:183-193.
Nazzaro F, Orlando P, Fratianni F, Coppola R. 2012. Microencapsulation in food science and biotechnology. Curr Opin Biotechnol. 23:182-186.
Nout MJR. 2009. Rich nutrition from the poorest – cereal fermentations in Africa and Asia. Food Microbiol. 26:685-692.
Nupoor S, Rathore KS. 2012. A review on microencapsulation: a new multiutility advanced technology. IJARPB. 1:477-489.
O’Riordan K, Andrews D, Buckle K, Conway P. 2001. Evaluation of microencapsulation of a Bifidobacterium galur with starch as an approach to prolonging viability during storage. J Appl Microbiol. 91:1059-1066. Peighambardoust SH, Tafti AG, Hesari J. 2011. Application of pengeringan
semprot for preservation of lactic acid starter cultures: a review. Trends Food Sci Technol. 22:215-224.
Perreten V, Kolloffel B, Teuber M. 1997. Conjugal transfer of the Tn916-like transposon TnFO1 from Enterococcus faecalis isolated from cheese to other Gram-positive bacteria. Syst Appl Microbiol. 20:27-38.
Picot A, Lacroix C. 2004. Encapsulation of Bifidobacteria in whey protein-based microcapsules and survival in simulated gastrointestinal conditions and in yogurt. Int Dairy J. 14:505-515.
22
Putri WDR, Haryadi DW, Marseno, Cahyanto MN. 2012. Role of lactic acid bacteria on structural and physicochemical properties of sour cassava starch. APCBEE Procedia. 2:104-109.
Pyar H, Peh KK. 2014. Cost effectiveness of cryoprotective agents and modified de-man rogosa sharpe medium on growth of Lactobacillus acidophilus. Pak J Biol Sci. 17:462-471.
Rosyidah E. 2013. Isolasi bakteri asam laktat dan selulolitik serta aplikasinya untuk meningkatkan kualitas tepung jagung [tesis]. Bogor (ID):Institut Pertanian Bogor.
Santivarangkna C, Kulozik U, Foerst P. 2007. Alternative drying processes for the industrial preservation of lactic acid starter cultures. Biotechnol Progr.
23:302-315.
Santivarangkna C, Higl B, Foerst P. 2008a. Protection mechanisms of sugars during different stages of preparation process of dried lactic acid starter cultures. Food Microbiol. 25:429-441.
Santivarangkna C, Kulozik U, Foerst P. 2008b. Inactivation mechanisms of lactic acid starter cultures cultures preserved by drying process. J Appl Microbiol.
105:1-13.
Schleifer KH, Ludwig W. 1995. Phylogenetic relationships of lactic acid bacteria. In: Wood BJB, Holzapfel WH. (Eds.) The Lactic Acid Bacteria. Vol. 2: The Genera of Lactic Acid Bacteria. Glasgow (GB):Blackie Academic and Professional. Hlm. 7-18.
Schnurer J, Magnusson J. 2005. Antifungal lactic acid bacteria as biopreservatives.
Trends Food Sci Technol. 16:70-78.
Schwatz FV, Perreten V, Teuber M. 2001. Sequence of the 50-kb conjugative multiresistance plasmid pRE25 from Enterococcus faecalis RE25. Plasmid.
46:170-187.
Semyonov D, Ramon O, Kaplun Z, Levin-Brener L, Gurevich N, Shimoni E. 2010. Microencapsulation of Lactobacillus paracasei by spray pengeringan beku. Food Res Int. 43:193-202.
Serna-Cock L, Vallejo-Castillo V. 2013. Probiotic encapsulation. Acad J. 7:4743-4753.
Snyder L, Champness W. 2009. Molecular genetics of bacteria. Edisi ke-3. Washington (US):ASM Pr.
Soro-Yao AA, Aka S, Thonart P, Dje KM. 2014. Assessment of the potential of lactic acid bacteria as dried starter culture for cereal fermentation. Open Biotechnol J. 8:1-5.
Stanbury PF, Whitaker A. 1984. Principles of Fermentation Technology. Oxford (GB):Pergamon Press.
Suseno D. 2015. Pemanfaatan isolat bakteri asam laktat indigenous sebagai starter untuk fermentasi sagu [tesis]. Bogor (ID):Institut Pertanian Bogor.
Toomey N, Bolton D, Fanning S. 2010. Characterisation and transferability of antibiotic resistance genes from lactic acid bacteria isolated from Irish pork and beef abattoirs. Res Microbiol. 161:127-135.
Van de Guchte M, Serror P, Chervanx C, Smokvina T, Ehrlich SD, Maguin E. 2002. Stress responses in lactic acid bacteria. Antonie van Leeuwenhoek.