i
POTENSI ANTIOKSIDAN, INHIBITOR TIROSINASE, DAN NILAI
TOKSISITAS DARI BEBERAPA SPESIES TANAMAN MANGROVE
DI INDONESIA
MAHISHA SAMPURNA ADHI BUDIYANTO
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Potensi Antioksidan, Inhibitor Tirosinase, dan Nilai Toksisitas dari Beberapa Spesies Tanaman Mangrove Di Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari Penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2015
Mahisha Sampurna Adhi B NIM C34100074
ABSTRAK
MAHISHA SAMPURNA ADHI. Potensi Antioksidan, Inhibitor Tirosinase , dan Nilai Toksisitas dari Beberapa Spesies Tanaman Mangrove Di Indonesia. Dibimbing oleh SRI PURWANINGSIH dan ELLA SALAMAH
Indonesia merupakan negara yang kaya akan keanekaragaman hayati. Mangrove merupakan tanaman yang cukup melimpah di Indonesia. Penelitian ini bertujuan untuk menentukan potensi antioksidan, inhibitor tirosinase, dan toksisitas dari beberapa jenis tanaman mangrove. Hasil penelitian menunjukkan bahwa rendemen ekstrak jenis kulit batang R. stylosa merupakan rendemen tertinggi dari ekstrak lainnya dengan nilai 18,07%. Ekstrak buah S. caseolaris memiliki nilai LC50 terendah dengan nilai 126,73 µg/mL. Ekstrak kulit batang S. caseolaris memiliki nilai antioksidan terbaik dengan IC50 sebesar 3,03 µg/mL. Ekstrak ini juga memiliki kemampuan inhibitor tirosinase terbaik dengan nilai IC50
117,67 μg/mL untuk monofenolase dan 364,99 μg/mL untuk difenolase. Komponen aktif yang terkandung dalam ekstrak kulit batang S. caseolaris adalah tanin, saponin, fenol hidrokuinon, dan flavonoid. Ekstrak kulit batang S. caseolaris merupakan ekstrak terbaik karena memiliki kemampuan antioksidan dan inhibitor tirosinase terbaik.
Kata kunci: antioksidan, ekstrak terbaik, inhibitor tirosinase, mangrove, toksisitas
ABSTRACT
MAHISHA SAMPURNA ADHI. Antioxidant, Tyrosinase Inhibitors, and Toxicity Potential from Some Species of Mangrove Plants in Indonesia. Supervised by SRI PURWANINGSIH and ELLA SALAMAH
Indonesia is a country rich in biodiversity. Mangrove is a plant that quite a lot in Indonesia. This research was conducted to determine potency of antioxidant, tyrosine inhibitors, and toxicity from some types of mangrove plants. The result showed that the yield of R. stylosa bark extract was 18.07% and it was the highest yield extract. S. caseolaris fruit extract had the lowest LC50 of toxicity (126.73 µg/mL). S. caseolaris bark extract had antioxidant best value with IC50 of 3.03 µg/mL. This extract also had the best potency of tyrosinase inhibitors with IC50 value of 117.67 mg/mL for monophenols and 364.99 mg/mL for diphenols. Active compounds detected in S. caseolaris extract were tannins, saponin, flavonoid, and phenol hydroquinone. S. caseolaris bark extract was the best extract due to the best ability of antioxidant activity and tyrosinase inhibitory activity.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
MAHISHA SAMPURNA ADHI BUDIYANTO
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2015
POTENSI ANTIOKSIDAN, INHIBITOR TIROSINASE, DAN
NILAI TOKSISITAS DARI BEBERAPA SPESIES TANAMAN
Disetujui oleh
Dr Ir Sri Purwaningsih, MSi Pembimbing I
Drs Ella Salamah, MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso, MSi Ketua Departemen
Tanggal Lulus:
Judul Skripsi : Potensi Antioksidan, Inhibitor Tirosinase, dan Nilai Toksisitas dari Beberapa Spesies Tanaman Mangrove di Indonesia
Nama : Mahisha Sampurna Adhi B
NIM : C34100074
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul : Potensi Antioksidan, Inhibitor Tirosinase, dan Nilai Toksisitas dari Ekstrak Beberapa Jenis Tanaman Mangrove di Indonesia
Penulis mengucapkan terimakasih kepada semua pihak yang telah membantu dalam proses penulisan karya ilmiah ini, terutama kepada:
1) Dr Ir Sri Purwaningsih, MSi dan Dra Ella Salamah, MSi selaku dosen pembimbing atas pengarahan yang diberikan kepada penulis
2) Dr Kustiariyah Tarman, SPi MSi selaku dosen penguji atas pengarahan yang diberikan kepada penulis
3) Prof Dr Ir Joko Santoso, MSi selaku Ketua Departemen Teknologi Hasil Perairan
4) Kedua orang tua saya ibu Priandini Nawangsari, ayah Dwi Budiyanto,dan adik perempuan saya Smita Tri Buanandari dan Gita Saraswati Hambarani yang telah mendoakan dan memberikan motivasi
5) Ema Masruroh SSi, Dini Indriani AMd, Saeful Bahri AMd, dan Bapak Eman yang telah membantu penulis selama penelitian di Laboratorium 6) Teman Laboratorium Mikrobiologi dan Biokimia (Ni Komang Ayu Oka
Padmi, Risvan, Dhio, Indah, dan Nisa), keluarga besar THP 47, THP 48, dan THP 49 atas segala bantuan, doa, semangat, dan dukungan yang telah diberikan.
Penulis menyadari bahwa karya ilmiah ini masih memiliki kekurangan. Penulis mengharapkan saran dan kritik yang bersifat membangun untuk perbaikan. Semoga karya ilmiah ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL... ii
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 2
Bahan ... 3
Alat ... 3
Prosedur Analisis Penelitian ... 3
Preparasi dan Karakterisasi Fisik ... 4
Metode Analisis ... 5
HASIL DAN PEMBAHASAN ... 8
Karakteristik Buah Tanaman Mangrove ... 9
Rendemen Ekstrak Tanaman Bakau ... 10
Nilai Toksisitas ... 11
Aktivitas Antioksidan ... 13
Inhibitor Tirosinase ... 14
Ekstrak Terbaik ... 15
Komponen Aktif Ekstrak Terbaik ... 17
KESIMPULAN DAN SARAN ... 19
Kesimpulan ... 19
Saran ... 19
DAFTAR PUSTAKA ... 20
LAMPIRAN ... 24
DAFTAR TABEL
1 Hasil pengukuran morfometrik daun mangrove ... 8
2 Hasil pengukuran morfometrik buah mangrove ... 10
3 Rendemen ekstrak ... 11
4 Hasil uji toksisitas ... 12
5 Hasil uji aktivitas antioksidan ... 13
6 Hasil uji inhibitor tirosinase ... 15
7 Hasil fitokimia ekstrak kasar kulit batang S. caseolaris ... 17
DAFTAR GAMBAR
1 Diagram alir penelitian daun dan kulit batang mangrove ... 4
2 Daun mangrove: (a) daun S. caseolaris, (b) daun B. gymnorhiza, (c)
4 Nilai antioksidan, inhibitor tirosinase, dan toksisitas, (A) kulit batang S.Caseolaris (B) Daun R. stylosa, (C) Daun R. mucronata, (D) Daun R. apiculata ... 16
DAFTAR LAMPIRAN
1 Perhitungan rendemen ekstrak ... 252 Contoh perhitungan rendemen ... 25
3 Tabel hasil uji toksisitas ... 25
4 Grafik hasil toksisitas ... 26
5 Hasil uji antioksidan ... 30
6 Contoh perhitungan antioksidan... 32
7 Hasil uji inhibitor tirosinase ... 32
8 Contoh perhitungan inhibitor tirosinase ... 32
9 Gambar uji inhibitor tirosinase... 32
10 Gambar uji antioksidan ... 33
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara yang kaya akan keanekaragaman jenis tanaman. Tanaman yang tumbuh di Indonesia meliputi tanaman terestrial maupun tanaman yang hidup di daerah pasang surut. Tanaman yang mampu hidup di daerah pasang surut adalah tanaman mangrove. Indonesia memiliki 202 jenis tanaman mangrove yang tercatat hingga saat ini (Noor et al. 2006). Tingginya keanekaragaman jenis tanaman mangrove ini didukung dengan luasnya hutan yang tersedia. Data FAO (2010) menunjukkan Indonesia memiliki hutan mangrove dengan total luas mencapai 94 juta Ha. Tanaman mangrove yang cukup dikenal di Indonesia adalah jenis tanaman Avicennia sp., Rhizopora sp., Bruguiera sp., dan Sonneratia sp.
Tanaman mangrove umumnya banyak mengandung senyawa aktif. Wu et al. (2009) menyatakan bahwa buah S. caseolaris memiliki kandungan yang tinggi akan triterpenoid. Suh et al. (2014) menyatakan kulit batang R. stylosa memiliki kandungan fenol yang cukup tinggi. Senyawa aktif yang cukup beragam di dalam tanaman mangrove berpotensi dimanfaatkan secara lebih lanjut menjadi bahan obat maupun suplemen berbasis herbal.
Uji toksisitas dilakukan untuk mengetahui bahan pangan yang boleh dikonsumsi. Uji toksisitas juga merupakan langkah awal untuk mendapatkan jenis obat-obatan yang berasal dari tumbuhan maupun hewan. Uji ini dilakukan untuk mengetahui senyawa yang bersifat toksik pada sel. Menurut Manilal et al. (2009) uji sitotoksik juga berkorelasi dengan aktivitas antitumor.
Tirosinase merupakan enzim yang berperan dalam biosintesis melanin. Melanin merupakan pigmen di kulit manusia yang membantu melindungi tubuh dari sinar ultraviolet (Saewan et al. 2011). Melanin yang berlebihan di dalam tubuh akan menimbulkan masalah terutama bagi kecantikan tubuh. Hal ini menyebabkan zat inhibitor tirosinase banyak dicari dari beberapa sumber bahan alam. Senyawa yeng berpotensi sebagai inhibitor tirosinase dapat mengobati gangguan pigmentasi yang abnormal dan untuk digunakan sebagai agen pemutih kulit dalam kosmetik (Lee et al. 2004)
Tumbuhan tingkat tinggi seperti tanaman mangrove memiliki potensi kandungan antioksidan. Antioksidan secara sederhana dapat didefinisikan sebagai senyawa yang dapat mengurangi dan menunda oksidasi. Antioksidan berguna bagi tubuh manusia. Antioksidan digunakan sebagai penangkap radikal bebas yang ada di dalam tubuh. Liu (2014) menyatakan bahwa radikal bebas akan membuat makromolekul tubuh seperti protein, lemak, dan DNA mengalami kerusakan. Hal ini yang dapat menyebabkan seseorang terkena kanker dan penyakit jantung koroner.
Perumusan Masalah
2
spesies tanaman mangrove diperlukan untuk informasi dasar pemanfaatan tanaman mangrove yang lebih lanjut.
Tujuan Penelitian
Tujuan yang ingin dicapai adalah untuk mendapatkan ektrak metanol, menentukan rendemennya, menentukan nilai toksisitas, menentukan aktivitas antioksidan, menentukan aktivitas inhibitor enzim tirosinase, menentukan komponen aktif yang ada pada beberapa jenis tanaman mangrove, dan menentukan ekstrak terbaik.
Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk memberi informasi tentang nilai toksisitas, aktivitas antioksidan, aktivitas inhibitor tirosinase, dan kandungan senyawa aktif yang ada di beberapa bagian dan jenis tanaman mangrove.
Ruang Lingkup Penelitian
Ruang lingkup dari penelitian ini adalah kajian antioksidan, aktivitas inhibitor tirosinase, dan toksisitas dari daun, kulit batang, dan buah tanaman mangrove. Analisis yang dilakukan meliputi ekstraksi (Peteros & Mylene 2012), analisis aktivitas antioksidan (Hanani et al. 2005 yang dimodifikasi), analisis aktivitas inhibitor tirosinase (Batubara et al. 2010), analisis nilai toksisitas (Meyer et al. 1982) dan analisis fitokimia (Harborne 1987).
Penelitian ini dimulai dengan preparasi sampel, yakni pencucian dan pengupasan kulit buah. Sampel kulit batang dan daun yang dikering anginkan hingga kadar air mencapai sekitar 10% kemudian dihaluskan hingga berbentuk serbuk. Sampel buah dijadikan serbuk halus dengan cara dikupas dan diblender. Sampel yang telah halus kemudian diekstrak menggunakan pelarut metanol. Sampel diekstrak dengan metode maserasi perbandingan 1:5 (b:v) selama 24 jam. Ekstrak kemudian difiltrasi dengan kertas saring Whatman no. 42, kemudian dihilangkan pelarutnya dengan rotary vaccum evaporator. Hasil ekstrak kasar ditimbang untuk mendapatkan rendemennya. Ekstrak selanjutnya dianalisis aktivitas antioksidan dan nilai toksisitas. Hasil terbaik kemudian dilanjutkan pada analisis penghambatan enzim tirosinase dan analisis fitokimia.
METODE PENELITIAN
3
Bahan
Bahan yang digunakan dalam penelitian ini adalah daun, kulit batang, dan buah dari 6 spesies mangrove (Avicennia marina, Bruguiera gymnorhiza, Rhizopora apiculata, Rhizopora mucronata, Rhizopora stylosa, dan Sonneratia caseolaris). Sampel diambil dari tiga tempat yang berbeda. Kawasan Mangrove Angke Kapuk, Pantai Indah Kapuk, Jakarta Utara (daun, buah, dan kulit batang A. marina dan S. caseolaris, daun dan kulit batang B. gymnorhiza, R. mucronata, dan R. apiculata), Pulau Untung Jawa, Kepulauan Seribu (daun, buah, dan kulit batang R. Stylosa, buah R. mucronata dan R. apiculata), dan pantai utara Surabaya, Jawa Timur (Buah B. gymnorhiza). Bahan yang digunakan dalam ekstraksi adalah larutan metanol. Bahan-bahan yang digunakan untuk pengujian senyawa fitokimia meliputi H2SO4 2 N, pereaksi Wagner, pereaksi Meyer, pereaksi Dragendorff, larutan FeCl3 1%, CHCl3, larutan anhidra asam asetat, larutan H2SO4, serbuk Mg, larutan amil alkohol, HCl 2 N, etanol, dan larutan FeCl3 5%. Bahan-bahan yang digunakan untuk uji BSLT adalah air laut, ekstrak kasar tumbuhan mangrove, dan Artemia salina Lach. Bahan yang digunakan untuk uji antioksidan adalah kristal 1,1-Diphenil-2-picryl hydrazil (DPPH), metanol p.a., dan asam askorbat. Bahan yang digunakan untuk uji inhibitor tirosinase adalah substrat L-Dopa, substrat L-Tirosin, enzim tirosinase, dan buffer fosfat.
Alat
Alat-alat yang digunakan dalam penelitian ini meliputi blender, cawan porselen, oven model DV-41, Labu Erlenmeyer, timbangan analitik (HF400 dan Max 410g) , alumunium foil, desikator, kertas saring Whatman 42, kapas bebas lemak, rotary vacuum evaporator, multipipette, micropipette, EpochTM Microplate, Spectrophotometer, inkubator, vortex, lampu TL, aerator, gelas ukur, sudip, labu takar, corong, tabung reaksi, rak tabung reaksi, dan microplate.
Prosedur Analisis Penelitian
4
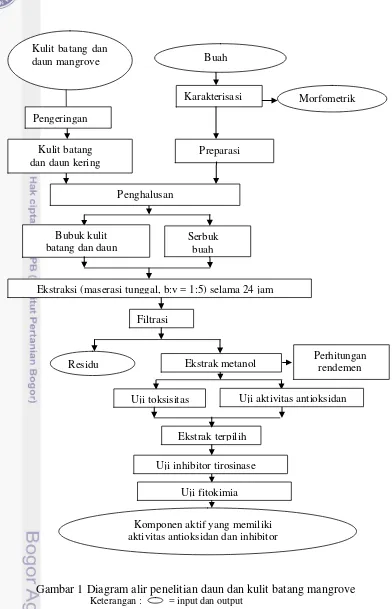
Gambar 1 Diagram alir penelitian daun dan kulit batang mangrove Keterangan : = input dan output
Ekstraksi (maserasi tunggal, b:v = 1:5) selama 24 jam
5
R. apiculata, R. mucronata, R. stylosa, dan S. caseolaris) segar. Daun dihitung lebar, panjang, dan bobotnya sebelum dipreparasi, sedangkan buah akan dihitung panjang, diameter, dan bobotnya.
Preparasi sampel dilakukan dengan mengeringkan sampel daun dan kulit batang pada suhu 40o C dengan menggunakan oven sampai kadar air sampel kurang lebih 10%. Daun dan kulit batang yang telah kering kemudian dihaluskan menggunakan blender hingga berbentuk serbuk. Serbuk ini diuji kadar airnya untuk mengetahui kadar air serbuk kering.
Buah mangrove tidak melalui proses pengeringan. Hal ini dikarenakan kandungan vitamin C pada beberapa buah mangrove dikhawatirkan hilang apabila dilakukan proses pengeringan. Buah dikupas kulitnya dan kemudian dihaluskan menggunakan blender kemudian digunakan dalam proses ekstraksi.
Ekstraksi Tanaman Mangrove
Daun, kulit batang dan buah mangrove diekstraksi dengan menggunakan pelarut metanol (Peteros & Mylene 2010) yang telah dimodifikasi. Modifikasi yang dilakukan adalah perbandingan pelarut metanol yang digunakan, yakni sebanyak 1:5 (b:v). Serbuk daun, serbuk kulit batang, dan buah segar ditimbang seberat 50 g kemudian dimasukkan ke dalam labu elenmeyer. Sampel kemudian ditutup kapas dan almunium foil untuk menghindari dari pengaruh lingkungan. Sampel kemudian dimaserasi dengan menggunakan orbital shaker selama 24 jam dengan kecepatan 180rpm. Larutan yang dihasilkan kemudian disaring dengan menggunakan kertas saring Whatman 42 untuk mendapatkan filtrat. Filtrat yang diperoleh kemudian dipekatkan menggunakan rotary vacum evaporator dengan suhu 40o C. Ekstrak kasar kemudian dimasukkan ke dalam botol ekstrak dan dilakukan penghitungan rendemen ekstrak. Rumus perhitungan rendemen adalah sebagai berikut:
Rendemen (%) =
Metode Analisis
a) Uji toksisitas brine shrimp lethality test (BSLT) (Meyer et al. 1982)
6
konsentrasi yang digunakan. Nilai x yang diperoleh merupakan konsentrasi larutan yang menyebabkan kematian terhadap 50% larva.
b) Uji antioksidan (Hanani et al. 2005) yang telah dimodifikasi
Uji antioksidan pada penelitian ini menggunakan metode 1,1-diphenyl -2-picrylhdrazyl (DPPH). Uji DPPH didasarkan dari teori hidrogen donor dari antioksidan. Efek penambahan antioksidan akan membuat hilangnya DPPH (Peteros & Mylene 2010). Uji antioksidan diawali dengan mempersiapkan larutan sampel. Sampel ekstrak kasar dari bagian mangrove masing masing dilarutkan dalam metanol dengan konsentrasi 0,5 ppm, 2,5 ppm, 12,5 ppm, 62,5 ppm, dan 312,5 ppm. Larutan blanko dengan konsentrasi 125 µM dibuat menggunakan kristal DPPH yang dilarutkan dalam etanol p.a. Proses pembuatan larutan DPPH dilakukan dalam kondisi terlindung dari cahaya matahari. Kontrol positif menggunakan larutan asam askorbat 100 ppm yang dibuat dengan cara melarutkan kristal Vitamin C pada etanol p.a. Larutan DPPH dengan konsentrasi 125 µM diambil sebanyak 100 µL dan ditambah dengan 100 µL ekstrak, kemudian dimasukkan ke dalam microplate yang telah disiapkan. Campuran larutan tersebut dihomogenkan dan diinkubasi pada suhu 37 oC selama 30 menit. Serapan yang dihasilkan diukur dengan menggunakan EpochTM Microplate Spectrophotometer pada panjang gelombang 517 nm. Hasil yang didapat secara langsung ditandai oleh perubahan warna ungu menjadi kuning (Molyneux 2004). Setelah itu, aktivitas antioksidan dari masing-masing sampel dan antioksidan pembanding Vitamin C dinyatakan dengan persen inhibisi yang dihitung dengan rumus berikut.
c) Uji inhibitor tirosinase (Batubara et al. 2010)
Ekstrak tanaman dari masing-masing bagian tanaman dilarutkan di dalam DMSO hingga konsentrasi 20 mg/mL. Larutan stok ekstrak disiapkan dengan cara melarutkan ekstrak pekat ke dalam bufer fosfat 50 mM (pH 6,5) sehingga diperoleh konsentrasi 60 µg/mL. Ekstrak diuji dengan konsentrasi 0−2000 µg/mL dan asam kojat sebagai kontrol positif yang juga diuji pada konsentrasi 0−2000 µg/mL dalam pelat tetes 96 sumur, 70 µl dari masing-masing ekstrak pengenceran ini digabungkan dengan 30 µ l enzim tirosinase (Sigma, 333 unit/mL dalam bufer fosfat). Pelat kemudian diinkubasi pada suhu kamar selama 5 menit. Pelat yang diinkubasi kemudian ditambahkan 110 µ l substrat L-tirosin 2 mM ke dalam sumur. Inkubasi selama 30 menit pada suhu kamar. Larutan pada masing-masing sumur diukur dengan menggunakan multi-well plate reader pada panjang gelombang 490 nm untuk menentukan persen inhibisi dan nilai konsentrasi hambat 50% (IC50). Persen inhibisi dihitung dengan cara membandingkan serapan sampel tanpa penambahan ekstrak dan sampel dengan penambahan ekstrak.
Inhibisi (%) = Keterangan:
A = absorbans pada 490 nm tanpa ekstrak
7
.
d) Penapisan komponen aktif (Harborne 1987)
Penapisan komponen aktif dilakukan melalui uji fitokimia yang meliputi pemeriksaan senyawa alkaloid, flavonoid, saponin, tanin, fenol hidrokuinon, dan steroid/triterpenoid pada ekstrak terpilih diantara daun, kulit batang, dan buah keenam jenis mangrove.
(1) Alkaloid
Sebanyak 0,1 mg sampel dimasukkan ke dalam tabung reaksi lalu dilakukan penambahan H2SO4 dan dikocok hingga benar-benar tercampur. Kemudian disaring dan dilakukan penambahan pereaksi Meyer dengan melihat endapan putih, Wagner dengan melihat endapan coklat dan Dragendorff dengan endapan jingga, jika terdapat endapan tersebut maka sampel dikatakan positif. (2) Flavonoid
Sebanyak 0,1 mg sampel ditambahkan serbuk Mg sebanyak 0,05 mg, setelah itu ditambahkan 0,2 mL amil alkohol dan 4 mL alkohol. Hasil uji positif bila larutan berwarna merah, kuning atau jingga pada lapisan amil alkohol.
(3) Saponin
Uji saponin dapat dideteksi dengan uji busa dalam air panas. Sampel sebanyak 0,1 mg diletakan dalam tabung reaksi. Kemudian ditambahkan air panas, dan tabung reaksi dikocok. Setelah tabung dikocok, dibiarkan 30 menit dan ditambahkan HCl 2 N sebanyak 1 tetes. Hasil positif uji saponin ditunjukan dengan adanya busa yang stabil.
(4) Tanin
Sebanyak 0,1 mg sampel diseduh dengan air panas yang telah didihkan selama 3 menit, sampel tersebut disaring setelah itu ditetesi dengan FeCl3 1%. Hasil uji positif jika larutan bewarna biru tua atau hijau kehitaman.
(5) Fenol hidrokuinon
Sebanyak 0,1 mg sampel dimasukkan ke dalam tabung reaksi. Kemudian dicampurkan dengan 0,25 mL etanol. Selanjutnya ditambahkan FeCl3 5% sebanyak 2 tetes. Reaksi positif ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
(6) Steroid/Triterpenoid
8
HASIL DAN PEMBAHASAN
Karakteristik Daun Tanaman Mangrove
Daun dapat dijadikan sebagai indikator keadaan dari suatu tanaman. Tanaman yang tumbuh pada lingkungan yang tidak optimal maka akan mempengaruhi bagian daunnya (Ai & Banyo 2011). Daun yang digunakan pada penelitian ini merupakan daun yang segar dan diambil dengan ukuran yang seragam. Daun diambil dari beberapa daerah di pesisir Utara Pulau Jawa. Gambar daun dari keenam jenis tanaman mangrove disajikan pada Gambar 2.
Gambar 2 Daun mangrove: (a) daun S. caseolaris, (b) daun B. gymnorhiza, (c) daun A. marina, (d) daun R. apiculata, (e) daun R. stylosa, (f) daun R. mucronata
Daun mangrove yang digunakan merupakan daun yang memiliki kondisi baik. Daun dihilangkan kotoran dan tangkainya kemudian diambil sebanyak 30 helai untuk dilakukan pengukuran morfometrik. Hasil morfometrik disajikan pada Tabel 1.
Tabel 1 Hasil pengukuran morfometrik daun mangrove
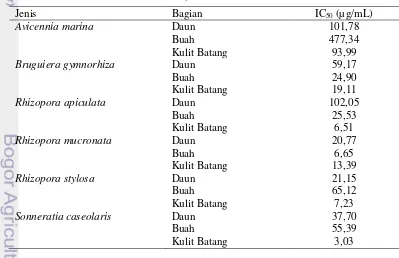
Sampel Panjang (cm) Lebar (cm) Bobot (g)
A. marina 7,70 ± 0,65 3,86 ± 0,31 0,66 ± 0,14
B. gymnorhiza 20,74 ± 1,58 8,02 ± 0,81 5,13 ± 0,71
R apiculata 17,01 ± 1,26 6,44 ± 0,48 3,29 ± 0,52
R .mucronata 18,38 ± 1,45 9,50 ± 0,88 5,99 ± 1,27
R. stylosa 11,47 ± 0,84 5,25 ± 0,38 3,15 ± 0,83
S. caseolaris 11,46 ± 1,26 4,45 ± 0,59 0,10 ± 0,23
Daun bakau yang diambil memiliki panjang dan lebar yang bervariasi sesuai dengan jenisnya. Data yang didapat menunjukkan daun yang digunakan merupakan daun yang cukup besar atau hampir dalam ukuran maksimal. Hal ini sesuai dengan apa yang dinyatakan FAO (2007) yakni daun B. gymnorhiza
d e f
9
memiki panjang berkisar 8-22 cm. Noor et al. (2006) menambahkan daun jenis
A. marina memiliki ukuran daun panjang 9 cm dan lebar 4,5 cm, jenis S. caseolaris memiliki panjang maksimal 13 cm dan lebar maksimal 5 cm, jenis
R. mucronata panjang maksimal mencapai 23 cm dan lebar maksimal 13 cm, dan jenis R. apiculata yang memiki panjang dan lebar maksimal 19 dan 8 cm. Daun jenis R. stylosa menurut Setyawan & Ulumudin (2012) memiliki panjang maksimal 12,5 cm dan lebar maksimal 7,5 cm.
Daun yang terpanjang di antara keenam jenis tanaman mangrove adalah daun jenis B. gymnorhiza dengan panjang rata-rata sebesar 20,74 cm dan lebar sebesar 8,02 cm. Panjang daun B. gymnorhiza tidak jauh berbeda dari apa yang dinyatakan FAO (2007) yakni daun B. gymnorhiza memiki panjang berkisar 8-22 cm.
Daun dengan ukuran terkecil dari seluruh sampel adalah jenis A. marina
yang memiliki panjang 7,7 cm dengan lebar 3,86 cm. Panjang daun jenis A. marina tidak jauh berbeda dari apa yang dinyatakan oleh Noor et al. (2006)
yakni daun A. marina memiliki panjang 9 cm dengan lebar 4,5 cm.
Karakteristik Buah Tanaman Mangrove
Buah merupakan bagian tanaman yang memiliki beberapa fungsi. Pada umumnya buah digunakan sebagai tempat menyimpan hasil fotosintesis, namun pada beberapa tanaman mangrove propagul buah digunakan sebagai alat reproduksi (Jamili et al. 2009). Buah bakau yang diuji dalam penelitian ini diambil dari tiga tempat yang berbeda. Gambar buah dari keenam jenis tanaman mangrove disajikan pada Gambar 3.
Gambar 3 Buah mangrove: (a) buah S. caseolaris, (b) buah B. gymnorhiza, (c) buah A. marina, (d) buah R. apiculata, (e) buah R. stylosa, (f) buah R. mucronata
Buah mangrove dibersihkan dan dipotong bagian tangkainya. Buah yang telah bersih kemudian diukur berat, panjang dan diameternya sebanyak masing
a b c
10
masing 30 buah. Hasil pengukran morfometrik buah mangrove disajikan pada Tabel 2
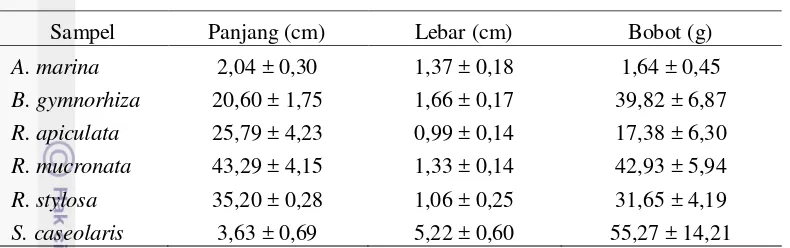
Tabel 2 Hasil pengukuran morfometrik buah mangrove
Sampel Panjang (cm) Lebar (cm) Bobot (g) A. marina memiliki bentuk seperti buah mangga dalam ukuran yang lebih kecil.
Buah jenis B. gymnorhiza memiliki panjang berkisar 15-25 cm dengan diameter 1.5-2 cm. Buah R. mucronata memiliki panjang antara 40-70 cm dengan diameter 1-2 cm, dan buah R. apiculata memiliki panjang 25-30 cm (FAO 2007). Noor et al. (2006) menyatakan buah mangrove jenis A. marina memiliki ukuran panjang 2-3 cm, buah R. stylosa memiliki panjang 20-35 cm dan diameter 1-2 cm, dan buah S. caseolaris memiliki diameter 5-8 cm. Hal ini menunjukkan buah yang digunakan dalam penelitian ini termasuk buah yang sudah matang.
Buah yang memiliki nilai panjang terbesar adalah buah jenis R. mucronata dengan panjang rata-rata 43,29 cm dan lebar 1,33 cm. Panjang dan lebar buah yang digunakan tidak jauh berbeda dari apa yang dinyatakan FAO (2007) yakni panjang buah R. mucronata berkisar 40-70 cm.
Buah yang memiliki ukuran terkecil adalah buah jenis A. marina. Buah A. marina yang didapat memiliki panjang 2,04 cm dan lebar 1,37 cm. Panjang dan
lebar buah A. marina tidak jauh berbeda dari apa yang dinyatakan beberapa penelitian. Noor et al. (2006) menyatakan buah jenis A. marina memiliki panjang 2-3 cm.
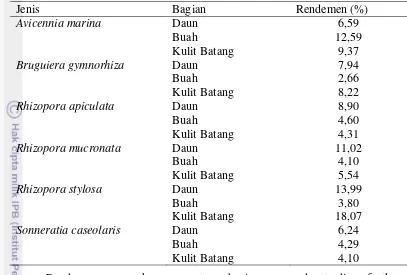
Rendemen Ekstrak Tanaman Bakau
11
Bruguiera gymnorhiza Daun 7,94
Buah 2,66
Kulit Batang 8,22
Rhizopora apiculata Daun 8,90
Buah 4,60
Kulit Batang 4,31
Rhizopora mucronata Daun 11,02
Buah 4,10
Kulit Batang 5,54
Rhizopora stylosa Daun 13,99
Buah 3,80
Kulit Batang 18,07
Sonneratia caseolaris Daun 6,24
Buah 4,29
Kulit Batang 4,10
Rendemen merupakan persentase bagian yang dapat dimanfaatkan. Berdasarkan hasil ekstraksi enam jenis tanaman mangrove, kulit batang R. stylosa yang memiliki rendemen paling tinggi yakni 18,07 %. Hal ini berbeda dari hasil yang ditunjukkan Batubara et al. (2010) yang menyatakan batang Rhizopora sp. memiliki rendemen 11 %.
Rendemen ekstrak dipengaruhi oleh jenis sampel, jenis pelarut, rasio pelarut, waktu dan suhu ekstraksi (Qusti et al. 2010). Perbedaan rendemen kulit batang Rhizopora stylosa diduga disebabkan perbedaan daerah pengambilan sampel. Tempat pengambilan sampel yang berbeda menyebabkan kandungan bahan berbeda satu sama lainnya.
Rendemen ekstrak buah Bruguiera gymnorhiza terendah dari semua jenis tanaman mangrove. Rendemen ekstrak buah B. gymnorhiza sebesar 2,66 %. Hasil ini berbeda dari hasil penelitian Sudirman (2013) yakni sebesar 9,94% untuk buah tua dan 6,83% untuk buah muda. Perbedaan ini diduga akibat perlakuan awal sampel yang berbeda. Sampel yang digunakan oleh Sudirman (2013) merupakan sampel kering dengan kadar air kurang lebih 10%, sedangkan sampel yang digunakan pada penelitian ini merupakan sampel segar. Bobot sampel segar tidak sama dengan bobot sampel kering karena masih tingginya kadar air di dalam sampel basah. Dugaan ini diperkuat dengan hasil penelitian Anwar et al. (2013), bahwa sampel yang dikeringkan menggunakan oven lebih tinggi rendemennya dibandingkan dengan sampel yang diangin-anginkan.
Nilai Toksisitas
12
merupakan cara untuk memprediksi aktivitas sitotoksik dan senyawa yang bersifat racun dengan mudah dan sederhana. Menurut Mesnage et al. (2011) sitotoksik memilki arti sifat senyawa yang memiliki kemampuan dalam membunuh sel. Hasil uji toksisitas dari beberapa bagian tanaman mangrove dapat dilihat pada Tabel 4.
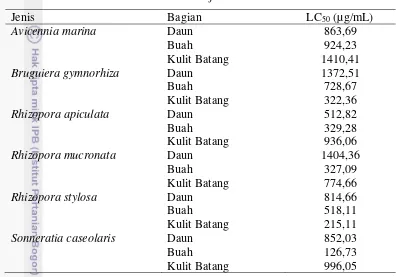
Tabel 4 Hasil uji toksisitas
Jenis Bagian LC50 (µg/mL)
Avicennia marina Daun 863,69
Buah 924,23
Kulit Batang 1410,41
Bruguiera gymnorhiza Daun 1372,51
Buah 728,67
Kulit Batang 322,36
Rhizopora apiculata Daun 512,82
Buah 329,28
Kulit Batang 936,06
Rhizopora mucronata Daun 1404,36
Buah 327,09
Kulit Batang 774,66
Rhizopora stylosa Daun 814,66
Buah 518,11
Kulit Batang 215,11
Sonneratia caseolaris Daun 852,03
Buah 126,73
Kulit Batang 996,05
Hasil dari pengujian nilai toksisitas menunjukkan buah S. caseolaris memiliki nilai LC50 terendah yakni sebesar 126,73 µg/mL. Hal ini dapat dikatakan buah S. caseolaris memiliki senyawa yang lebih toksik diantara jenis sampel lainnya. Menurut Mclaughlin et al. (1998) nilai LC50 antara 31-200 ppm dapat dinyatakan sebagai senyawa toksik. Nilai LC50 pada buah S. caseolaris sasuai dengan hasil penelitian Bandarayake (2002) yang menyatakan bahwa buah S. caseolaris bersifat toksik pada larva nyamuk.
Aktivitas toksik yang ditemukan dalam uji BSLT menunjukkan senyawa tersebut memiliki potensi sebagai senyawa antikanker dan antitumor baru (Peteros & Mylene 2010). Hasil dari uji BSLT adalah nilai LC50 yangmemiliki arti bahwa konsentrasi yang dapat membunuh 50 % dari populasi total. Nilai LC50 yang dihasilkan pada penelitian kali ini belum dapat dikatakan sebagai bahan yang berpotensi sebagai antitumor. Mojica & Micor (2007) mengungkapkan untuk menjadi zat yang efektif dalam menjadi obat kanker harus memiliki nilai LC50 diantara atau lebih rendah dari 30 ppm.
13
memiliki efek merusak organ perasa pada Artemia salina sehingga menghentikan asupan makanannya. Peteros & mylene (2010) menyatakan nilai LC50 bervariasi akibat perbedaan dalam jumlah zat aktif. Jenis zat aktif yang mempengaruhi nilai toksisitas adalah tanin, flavonoid, dan triterpenoid. Mojica & Micor (2007) dalam penelitiannya tentang tanaman pantai Barringtonia asiatica menambahkan nilai LC50 dipengaruhi oleh zat aktif saponin.
Aktivitas Antioksidan
Antioksidan merupakan senyawa yang dapat menunda dan memperlambat aktivitas oksidasi. Antioksidan juga membantu tubuh dalam menangkal radikal bebas yang ada di lingkungan. Molyneux (2004) menyatakan antioksidan bekerja berdasarkan mekanisme menyumbangkan satu atau lebih elektron untuk meredam radikal bebas. Astuti (2008) menambahkan radikal bebas yang berikatan dengan molekul protein maupun lemak di dalam sel akan menyebabkan kerusakan pada sel.
Antioksidan dapat diketahui aktivitasnya dengan menggunakan uji DPPH. Zheng et al. (2011) menyatakan aktivitas antioksidan dinyatakan dengan presentase penghambatan (inhibisi) yang diperoleh dari nilai absorbansi blanko dikurangi absorbansi sampel. Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah inhibitor concentration (IC50). Nilai IC50 menyatakan besarnya konsentrasi larutan sampel yang dibutuhkan untuk mereduksi radikal bebas DPPH sebesar 50%. Molyneux (2004) menyatakan bahwa semakin kecil nilai IC50 berarti aktivitas antioksidannya semakin tinggi. Hasil IC50 dari keenam jenis tanaman mangrove dapat dilihat pada Tabel 5.
Tabel 5 Hasil uji aktivitas antioksidan
Jenis Bagian IC50 (µg/mL)
Avicennia marina Daun 101,78
Buah 477,34
Kulit Batang 93,99
Bruguiera gymnorhiza Daun 59,17
Buah 24,90
Kulit Batang 19,11
Rhizopora apiculata Daun 102,05
Buah 25,53
Kulit Batang 6,51
Rhizopora mucronata Daun 20,77
Buah 6,65
Kulit Batang 13,39
Rhizopora stylosa Daun 21,15
Buah 65,12
Kulit Batang 7,23
Sonneratia caseolaris Daun 37,70
Buah 55,39
Kulit Batang 3,03
Ekstrak kulit batang S. caseolaris memiliki nilai IC50 yang cukup rendah
14
IC50sebesar 14 µg/mL. Menurut Molyneux (2004), nilai IC50 kurang dari 50 ppm dapat dinyatakan sebagai antioksidan sangat kuat.
Nilai aktivitas antioksidan banyak dipengaruhi oleh senyawa aktif yang ada di dalam suatu bahan. Salah satu senyawa aktif yang mampu berperan sebagai antioksidan adalah fenol. Hakim et al. (2008) menyatakan fenol merupakan kelompok antioksidan yang penting guna menghambat terjadinya oksidasi pada jaringan tubuh.
Kemampuan antioksidan kulit batang S. caseolaris diduga akibat tingginya kandungan fenol yang ada. Hasil penelitian Suh et al. (2004) yakni kandungan fenol di kulit batang S. caseolaris yang hampir mencapai dua kali lipat dari kandungan fenol teh hijau. Total fenol yang terkandung di dalam ekstrak metanol kulit batang S. caseolaris sebesar10,58 mg/g, sedangkan total fenol yang ada pada ekstrak metanol teh hijau sebesar 6,29 mg/g.
Nilai IC50 tertinggi dari seluruh sampel adalah buah Avicennia marina dengan nilai IC50 sebesar 477,34 µg/mL. Hasil ini dapat dikategorikan buah A. marina tidak memiliki kemampuan antioksidan. Hasil ini berbeda dengan hasil yang ditemukan oleh Bunyapraphatsara (2003) pada buah Avicennia alba. Nilai IC50 pada buah Avicennia alba adalah sebesar 20,67 µg/mL
Antioksidan dalam tanaman dipengaruhi oleh beberapa faktor-faktor internal maupun eksternal. Qusti et al. (2010) pada penelitiannya tentang antioksidan pada madu dan minyak zaitun menyatakan bahwa perbedaan aktivitas antioksidan dapat diakibatkan oleh beberapa faktor yakni varietas tanaman, kondisi tempat tumbuh, tingkat kematangan, musim, lokasi geografis yang berbeda, jenis tanah dan jumlah sinar matahari yang diterima. Yulianto & Widyaningsih (2013) menambahkan kandungan kimia dalam tanaman cincau hitam, jahe, dan kayu manis dipengaruhi oleh faktor cara pemeliharaan tanaman, cara pemanenan, kematangan pada waktu panen, dan kondisi penyimpanan setelah panen.
Hasil uji aktivitas antioksidan dipilih yang terbaik untuk kemudian dilakukan uji selanjutnya yakni uji inhibitor tirosinase. Uji inhibitor tirosinase dilakukan untuk mengetahui ekstrak yang mampu menghambat enzim tirosinase.
Sampel yang diuji inhibitor tirosinase adalah bagian daun R. stylosa, daun R. apiculata, daun R. mucronata dan kulit batang S. caseolaris.
Inhibitor Tirosinase
Uji aktivitas inhibitor tirosinase merupakan uji yang dilakukan untuk mengetahui kemampuan ekstrak dalam menghambat jalannya melanogenesis. Melanogenesis adalah seluruh proses yang mengarah pada pembentukan pigmen makromolekul gelap, yakni melanin (Chang 2009). Tirosinase yang merupakan enzim biosintesis melanin, akan dihambat sehingga menurunkan produksi melanin (Hartanti & Setiawan 2009). Hasil uji inhibitor tirosinase dinyatakan dengan nilai IC50. Nilai IC50 menunjukkan konsentrasi dimana ekstrak mampu menghambat aktivitas tirosinase sebesar 50%.
15
yang dinamakan aktivitas difenolase (Batubara et al. 2010). Hasil dari oksidasi keduanya akan menghasilkan pigmen berwarna hitam, merah, atau coklat. Hasil uji inhibitor tirosinase dari keempat jenis mangrove ditampilkan pada Tabel 6.
Tabel 6 Hasil uji inhibitor tirosinase
Jenis Bagian Monofenolase
Hasil inhibitor tirosinase yang ditunjukkan pada Tabel 6 memperlihatkan bahwa nilai inhibitor tirosinase tertinggi dimiliki oleh kulit batang S. caseolaris dengan nilai IC50 sebesar 117,674 µg/mL untuk monofenolase dan untuk difenolase sebesar 364,10 µg/mL. Hasil inhibitor tirosinase pada kulit batang tanaman mangrove jenis lain memiliki hasil yang berbeda. Hasil penelitian Batubara et al. (2010) menyatakan IC50 batang dari Rhizopora sp. dan jenis Xylocarpus granatum masing-masing sebesar 108,2 µg/mL dan 215,1 µg/mL untuk monofenolase, sedangkan untuk difenolase sebesar 124 µg/mL dan sebesar 199,7 µg/mL.
Nilai IC50 pada kulit batang S. caseolaris cukup baik, namun cukup berbeda jika dibandingkan asam kojat yang biasa digunakan sebagai pencerah kulit. Nilai IC50 monofenolase asam kojat sebesar 11,18 µg/mL dan difenolase sebesar 63,64 µg/mL. Perbedaan hasil ini diduga karena asam kojat merupakan senyawa murni sehingga memiliki kemampuan menghambat enzim tirosinase yang lebih baik.
Kemampuan suatu bahan baku untuk menghambat tirosinase dipengaruhi oleh komponen aktif yang terkandung di dalamnya. Flavonoid merupakan senyawa aktif yang memiliki kemampuan dalam menghambat enzim tirosinase. Simlai et al. (2014) menyatakan kandungan senyawa aktif tertinggi di dalam ekstrak kulit batang S. caseolaris adalah flavonoid sebesar 90,04 mg/g berat kering. Chang (2009) menyatakan flavonoid mampu bersifat kompetitor terhadap enzim tirosinase sehingga mampu menghambat tirosinase.
Ekstrak Terbaik
Ekstrak kasar dari enam jenis mangrove yakni jenis Avicennia marina,
Bruguiera gymnorhiza, Rhizopora stylosa, Rhizopora apiculata, Rhizopora mucronata, dan Sonneratia caseolaris diuji toksisitas dan antioksidan.
Hasil terbaik dari kedua uji tersebut yakni daun Rhizopora stylosa, daun Rhizophora apiculata, daun Rhizopora mucronata, dan kulit batang jenis
16
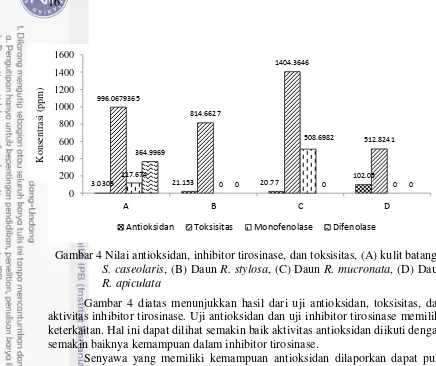
Gambar 4 Nilai antioksidan, inhibitor tirosinase, dan toksisitas, (A) kulit batang S. caseolaris, (B) Daun R. stylosa, (C) Daun R. mucronata, (D) Daun R. apiculata
Gambar 4 diatas menunjukkan hasil dari uji antioksidan, toksisitas, dan aktivitas inhibitor tirosinase. Uji antioksidan dan uji inhibitor tirosinase memiliki keterkaitan. Hal ini dapat dilihat semakin baik aktivitas antioksidan diikuti dengan semakin baiknya kemampuan dalam inhibitor tirosinase.
Senyawa yang memiliki kemampuan antioksidan dilaporkan dapat pula menghambat enzim tirosinase. Chang (2009) menyatakan penghambatan aktivitas enzim tirosinase dapat dilakukan dengan berbagai cara. Salah satunya adalah menghentikan proses oksidasi yang mengubah kembalinya dopa menjadi dopaquinon sehingga mengurangi terbentuknya dopakrom dan melanin. Senyawa yang melakukan penghambatan melalui proses ini salah satunya adalah asam askorbat.
Beberapa senyawa aktif yang ada pada kulit batang Sonneratia caseolaris memiliki kemampuan antioksidan, maupun inhibitor tirosinase. Redha (2010) menyatakan senyawa flavonoid memiliki kemampuan untuk mendonorkan atom hidrogennya sebagai antioksidan. Chang (2009) menambahkan senyawa flavonoid yang memiliki kamampuan sebagai antioksidan juga memiliki kemampuan dalam menghambat enzim tirosinase. Senyawa flavonoid yang merupakan golongan fenolik mampu digunakan sebagai inhibitor tirosinase.
Tanin juga merupakan senyawa aktif yang memiliki kemampuan dalam antioksidan maupun inhibitor tirosinase. Hagerman (1998) menyatakan senyawa tanin yang memiliki kemampuan antioksidan juga memiliki kemampuan dalam menghambat enzim tirosinase. Pernyataan ini diperkuat oleh Kim (2004) yakni golongan fenolik yang salah satunya tanin memiliki kemampuan dalam melakukan depigmentasi.
Gambar 4 menunjukkan ekstrak kulit batang Sonneratia caseolaris memiliki nilai toksisitas yang cukup rendah yakni 996,08 µg/mL. Menurut Mclaughlin et al. (1998) nilai LC50 201-1000 ppm dikategorikan sebagai toksik rendah. Kulit batang Sonneratia caseolaris yang memiliki nilai toksisitas rendah, dengan nilai antioksidan dan inhibitor tirosinase monofenolase maupun difenolase
3.0303 21.153 20.77
Antioksidan Toksisitas Monofenolase Difenolase
17
yang cukup baik menjadikan ektrak ini kandidat terbaik sebagai senyawa yang dapat digunakan bagi keperluan obat obatan.
Komponen Aktif Ekstrak Terbaik
Ekstrak kasar didapat dari proses maserasi menggunakan orbital shaker selama 24 jam menggunakan metanol. Hasil ekstrak kasar kemudian di uji fitokimia untuk mengetahui komponen aktifnya. Uji ini dilakukan untuk mengetahui senyawa yang terkandung pada ekstrak terbaik. Senyawa aktif atau yang biasa disebut metabolit sekunder adalah senyawa metabolit yang tidak esensial bagi pertumbuhan organisme dan ditemukan dalam bentuk yang unik atau berbeda-beda antara spesies yang satu dan lainnya (Rasyid 2012). Metabolit sekunder ini sangat berguna bagi manusia, salah satunya adalah sebagai obat-obatan. Uji komponen aktif yang dilakukan pada penelitian ini meliputi uji alkaloid, steroid, flavonoid, saponin, tanin, fenol hidrokuinon, dan triterpenoid. Hasil uji komponen aktif pada ekstrak kulit batang S. caseolaris dapat dilihat pada Tabel 7.
Tabel 7 Hasil fitokimia ekstrak kasar kulit batang S. caseolaris
Uji Hasil batang mengandung tannin, saponin, fenol hidrokuinon, dan flavonoid. Produksi metabolit sekunder banyak diakibatkan oleh tekanan dan rangsangan lingkungan. Verpoorte & Alfermann (2000) menjelaskan bahwa fungsi metabolit sekunder adalah untuk mempertahankan diri dari kondisi lingkungan yang kurang menguntungkan, misalnya untuk mengatasi hama dan penyakit, menarik polinator, dan sebagai molekul sinyal. Simlai et al. (2014) yang menyatakan bahwa ekstrak kulit batang Sonneratia caseolaris mengandung tannin, fenol, flavonoid, dan saponin.
18
caseolaris cukup tinggi. Total tanin yang dideteksi mencapai 48,04 mg/g berat kering.
Kandungan tanin yang cukup tinggi mempengaruhi hasil antioksidan yang didapat. Hagerman (1998) menyatakan bahwa tanin mempunyai kemampuan menangkap radikal bebas. Tanin sangat efektif sebagai pendonor elektron/atom hidrogen dan pengkelat logam, sebab senyawa ini memiliki gugus hidroksil dan ikatan rangkap terkonjugasi yang memungkinkan terjadinya delokalisasi elekron. Hal ini menyebabkan kulit batang memiliki aktivitas antioksidan yang cukup baik. Kulit batang Sonneratia caseolaris yang tinggi akan tanin juga memiliki pengaruh terhadap hasil inhibitor tirosinase. Tanin merupakan salah satu golongan polimer dari komponen fenolik (Harborne 1987). Golongan fenolik memiliki kemampuan depigmentasi, karena memiliki struktur kimia yang mirip dengan tirosin yang merupakan substrat dari reaksi tirosin-tirosinase (Kim et al. 2004).
Flavonoid merupakan senyawa kimia yang banyak ditemukan pada tanaman mangrove. Flavonoid memiliki fungsi sebagai pelindung tanaman dari kerusakan akibat sinar ultraviolet. Kandungan flavonoid pada tanaman lebih tinggi apabila tanaman terpapar sinar ultraviolet (uv) secara terus menerus (Sisa et al. 2010). Ekstrak kulit batang Sonneratia caseolaris diketahui memiliki kandungan flavonoid yang cukup tinggi. Menurut penelitian Simlai et al. (2014) kulit batang S. caseolaris kaya akan kandungan flavonoid yakni sebesar 90,04 mg/g berat kering.
Flavonoid merupakan senyawa golongan fenolik yang memiliki kemampuan dalam menangkal radikal bebas, maupun menghambat enzim tirosinase. Flavonoid mampu dikatakan sebagai sumber antioksidan akibat kemampuannya dalam mendonorkan atom hidrogen atau kemampuannya dalam mengkelat logam (Redha 2010). Akhlghi dan Bandy (2009) menambahkan bahwa falvonoid mampu mengkelat logam sehingga dapat mencegah terjadinya reaksi redoks yang menghasilkan senyawa radikal bebas.
Senyawa aktif flavonoid juga mampu menghambat enzim tirosinase. Menurut Chang (2009) tujuh grup dari flavonoid mampu menjadi inhibitor tirosinase. Flavonoid mampu bersifat kompetitor terhadap tirosinase pada saat oksidasi L-DOPA oleh enzim tirosinase
Uji komponen aktif pada ekstrak kulit batang Sonneratia caseolaris menunjukkan hasil positif pada uji saponin. Hasil positif ditunjukkan dengan adanya busa yang stabil setelah dilakukan pengocokan. Saponin dapat dideteksi berdasarkan kemampuannya dalam membentuk busa dan menghemolisis darah (Harborne 1987). Hasil positif saponin didapat pada kulit batang S. caseolaris. Hal ini sesuai dengan apa yang ditemukan oleh Simlai et al. (2014), yakni hasil kuantitatif dari saponin dalam ekstrak tanaman mangrove sebesar 0,80 mg/g berat kering.
Saponin merupakan zat aktif yang memiliki kemampuan membunuh beberapa jenis kapang, membunuh virus, dan juga antioksidan. Saponin dari ginseng diketahui memiliki gen superoksida dismutase. Kode gen ini merupakan adalah salah satu enzim antioksidan (Kim et al. 1996). Francis et al. (2002) juga menyatakan beberapa saponin memiliki aktivitas antioksidan dan reduksi. Saponin juga memiliki kemampuan dalam menghambat kinerja enzim. Zhang & Zhou (2013) menyatakan saponin mampu menghambat kecepatan maksimum enzim.
19
Komponen fenol terdeteksi positif pada ekstrak kasar kulit batang Sonneratia caseolaris. Hasil ini ditandai dengan terbentuknya warna hijau kebiruan pada ekstrak. Hasil positif pada komponen fenol sesuai dengan penelitian yang dilakukan Simlai et al. (2014), yakni total fenol yang ada pada ekstrak kulit batang Sonneratia caseolaris mencapai 50,70 mg/g berat kering.
Fenol merupakan senyawa yang banyak ada pada tumbuhan. Fenol hidrokuinon memiliki kemampuan antioksidan maupun kemampuan dalam menghambat enzim tirosinase. Hidrokuinon dan senyawa turunannya berfungsi sebagai inhibitor oksidatif untuk mengikat radikal bebas dan bereaksi dengan senyawa Reactive Oxygen Species (ROS) membentuk senyawa yang lebih stabil (Eastman 2009). Fenol hidrokuinon juga memiliki kemampuan dalam menghambat enzim tirosinase. Hal ini sesuai dengan pernyataan Kim et al. (2004) yakni beberapa komponen fenolik dikenal berperan sebagai agen depigmentasi, karena struktur kimianya yang mirip dengan tirosin.
KESIMPULAN DAN SARAN
Kesimpulan
Ekstrak yang memiliki nilai toksik akut terendah adalah buah S. caseolaris dengan nilai LC50 sebesar 126,73 µg/mL. Potensi aktivitas antioksidan terbaik adalah kulit batang Sonneratia caseolaris dengan nilai IC50 sebesar 3,03 µg/mL. Kulit batang Sonneratia caseolaris juga memiliki hasil uji inhibitor tirosinase terbaik dengan nilai IC50 117,674 µg/mL untuk monofenolase dan untuk difenolase sebesar 364,9969 µg/mL.
Saran
20
DAFTAR PUSTAKA
[FAO] Food and Agriculture Organization.2010. FAO Forestry paper 163. Rome (IT): FAO.
[FAO] Food and Agriculture Organization.2007. Trees and Shurbs of the Maldives. Bangkok (TH): FAO
Ai NS, Banyo Y. 2011. Konsentrasi klorofil daun sebagai indikator kekurangan air pada tanaman. Jurnal Ilmiah Sains. 11(2): 166-173.
Akhlaghi M, Bandy B. 2009. Mechanisms of flavonoid protection against myocardial ischemia-reperfusion injury. Journal of Molecular and Cellular Cardiology. 46: 309-317.
Anaya A, Mata R, Sims J, Coloma AC, Ortega RC, Guadano A, Bautistsa BE, Midland LS, Rios G, Pompa AG. 2003. Allelochemical potential of callicarpa acuminate. Journal of Chemical Ecology. 29(12):2761-2776 Anwar F, Kalsoom U, Sultana B, Mushtaq M, Mahmood T, Arshad HA. 2013.
Effect of drying method and extraction solvent on the total phenolics and antioxidant activity of cauliflower (Brassica oleracea L.) Extract. International Food Research Journal. 20(2) : 653-659.
Astuti. 2008. Isoflavon kedelai dan potensinya sebagai penangkap radikal bebas. Jurnal Teknologi Industri dan Hasil Pertanian. 13(2) : 126-136
Baba shigeyuki. 2011. Close group planting of mangrove on atolls and coral islands of the pasific. ISME/GLOMIS Electronic Journal. 9(4) : 11-12. Bandarayake S .2002. Bioactivities, bioactivity compound, and chemical
constituens of mangrove plants. Wetlands Ecology and Management. 10:421-452.
Banerjee D, Chakrabarti, Hazra A, Banerjee S, Ray J, dan Mukherjee B. 2008. Antioxidan activity and total phenolic of some mangroves in sundarbans. African Journal of Biotechnology. 7(6) : 805-810.
Batubara I, Darusman LK, Mitsunaga T, Rahminiwati M, Djauhari E. 2010. Potency of indonesian medicinal plants as tyrosinase inhibitor and antioxidant agent. Journal of Biological Sciences. 10(2):138-144.
Bunyapraphatsara, Jutivibonsuuk, Sornlek, therathanathorn R, Aksornkaew S, Fong H, Pezzuto J, Kosmeder J. 2003. Pharmacological studies of plants in the mangrove forest. Thai Journal of Phytopharmacy. 10(2): 1-12. Chang Te-Sheng. 2009. An update review of tyrosinase inhibitor. International
Journal Molecular Science. 10(6):2440-2475.
Clarke PJ, Myerscough J.1991. Floral biology and reproductive phenology of Avicennia marina in south-eastern australia. Australia Journal Botany. 39:283-293
Eastman. 2009. Hydroquinonen and Hydroquinon Derivates. Canada (CA): Eastman Chemical Company.
Francis, Kerem Z, Makkar H, Becker K. 2002. The biological action of saponin in animal system: a review. British Journal of Nutrition. 88:587-605.
21
Hakim EH, Syah YM, Juliawati LD, Mujahidin D. 2008. Aktifitas antioksidan dan inhibitor tirosinase beberapa stilbenoid dari tumbuhan Moraceae dan dipterocsrpaceae yang potensial untuk bahan kosmetik. Jurnal Matematika dan Sains. 13(2):33-42.
Hanani E, Munin A, Sekarini R. 2005. Identifikasi senyawa antioksidan dalam spons Callyspongia sp. dari Kepulauan Seribu. Majalah Ilmu Kefarmasian. 2(3): 127-133.
Handayani R, Sulistyo J. 2008. Sintesis senyawa flavonoid-α-glikosida secara reaksi transglikosilasi enzimatik dan aktivitasnya sebagai antioksidan. Biodiversitas. 9(1) : 1-4.
Harborne. 1987. Metode Fitokimia, Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Sudiro I, penerjemah. Bandung (ID): Penerbit ITB.Terjemahan dari: Phytochemical Methods.
Hartanti L, Setiawan HK. 2009. Inhibitory potential of some synthetic cinnamic acid derivates towards tyrosinase enzym. Indo Journal of Chemistry. 9(1) : 158-168.
Jamili, Setiadi, Qayim I, Guhardja E. 2009. Struktur dan komposisi mangrove di Pulau Kaledupa Taman Nasional Wakatobi, Sulawesi Tenggara. Ilmu Kelautan. 14(4):36-45.
Kim YH, Park KH, Rho HM. 1996. Transcriptional activation of the Cu, Zn-Superoxide Dismutase Gene Trough the AP2 site by Ginsenoside Rb2 Extracted From a Medicinal Plant, Panax ginseng. Journal of Biological Chemistry. 271 (4) : 24539-25453
Kim YJ, Kyung KJ, Lee JH, Chung HY. 2004. 4-4’-Dihydroxybiphenyl as a new potent tyrosinase inhibitor. Journal Biology Pharmbull. 28(2):323-327. Lee NK, Son K, Chang HW, Kang S, Park H, Heo M, Kim H. 2004. Prenylated
flavonoids as tyrosinase inhibitor. Arch Pharm Res. 27(11):1132-1135 Liu R H. 2014. Health benefits of fruit and vegetables are from additive and
synergistic combinations of phytochemicals. American Journal Clinical Nutrition. 78: 517s-20s.
Manilal A, Sujith S, Kiran S, Selvin J, Shakir C. 2009. Biopotential of mangroves collected from the southwest coast of India. Global Journal of Biotechnology & Biochemistry. 4(1) : 59-65
Mclaughlin J, Rogers L, Anderson J. 1998. The use of biological assays to evaluate botanical. Drug Information Journal. 32: 513-524.
Mesnage, Clair, Gress, Szekasc, Seralini. 2011. Cytotoxicity for human cell of cry1Ab and cry1Ac Bt insecticidal toxin alone or with a glyphosate base herbiside. Journal of Applied Toxicology. 5.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, Mclaughlin JL.1982. Brine shrimp: a convenient general bioassays for active plant constituents. Planta Medica. 45: 31-34.
Milon A, Muhit A, Goshwami D, Masud M, and Begum B.2012. Antioxidant, cytotoxic and antimicrobial activity of sonneratia alba bark. International Journal of Pharmaceutical Science and Research. 3(7) : 2233-2237. Mojica E, Micor J. 2007. Bioactivity study of Barringtonia asiatica (Linneus)
22
Molyneux P. 2004.The use of stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin Journal Sciences Technology. 26(2): 211-219.
Noor Y R, Khazali, Surdiputra I N. 2006. Panduan Pengenalan Mangrove di Indonesia. Bogor (ID). DIT-PHKA dan WI-IP.
Peteros N, Mylene Uy. 2010. Antioxidant and cytotoxic activities and phytochemical screening of four philippine medicinal plants. Journal of Medicinal Plants Research. 4(5): 407-414.
Qusti SY, Khatwa AA, Lahwa. 2010. Screening of antioxidant activity and phenolic content of selected food items cited in the holly quran. EJBS. 2(1): 40-51.
Rasyid Abdullah. 2012. Identifikasi senyawa metabolit sekunder serta uji aktivitas antibakteri dan antioksidan ekstrak methanol teripang Stichopus hermanii. Jurnal Ilmu dan Teknologi Kelautan Tropis. 4(2): 360-368.
Redha A. 2010. Flavonoids: Struktur, sifat antioksidatif dan pernanya dalam sistem biologis. Jurnal Belian. 9(2): 196-200.
Saewan N, Koysomboon S, Chantraproma K. 2011. Anti-tyrosinase and anti-cancer activities of flavonoids from Blumea balsafimera DC. Journal of Medicinal Plants Research. 5(6): 1018-1025
Setyawan AD, Ulumudin YI. 2012. Species diversity of Rhizopora in Tambelan Island, Natuna Sea, Indonesia. Biodiversity. 13(4):172-177.
Simlai A, Rai A, Mishra S, Mukherjee K, Roy A. 2014. Antimicrobial and Antioxidative Activities In the Bark Extracts of Sonneratia caseolaris, A Mangrove Plant. EXCLI Journal. 13 : 997 – 1010.
Sisa M, Bonnet S, Ferreira D, Westhuizen. 2010. Phytochemistry of Flavonoids. Journal Molecules. 15: 5196-5245.
Sudirman. 2013. Isolasi senyawa antioksidan sebagai penangkal radikal bebas dari buah lindur (Bruguiera gymnorrhiza) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Suh S, Hwang J, Park M, Park H, Lee TK. 2014. Phenol content, antioxidant, and tyrosinase inhibitory activity of mangrove plants in micronesia. Asian Pasific Journal of Tropical Medicine. 531-535.
Verpoorte, R., A.W. Alfermann. 2000. Metabolic engineering of plant secondary metabolism. Berlin (GE) : Springer 1-3pp.
Wu SB, Wen Y, Li XW, Zhao Y, Zhao Z, Hu JF. 2009. Chemical constituents from the fruits of Sonneratia caseolaris and Sonneratia ovata (Sonneratiaceae). Biochemical Systematics and Ecology. 1-5.
Yulianto R, Widyaningsih TR. 2013. Formulasi produk minuman herbal berbasis cincau hitam (Mesona palustris), Jahe (Zingiber officinale), Dan Kayu Manis (Cinnamomum Burmanni). Jurnal Pangan dan Agroindustri. 1(1) : 65-77.
Zhang H, Zhou Q. 2013.Tyrosinase inhibitory effects and antioxidative activities of saponins from Xanthoceras Sorbifolia nutshell. PLoS ONE. 8(8):1-6. Zheng X, Liu B, Li L, Zhu X. 2011. Microwave-assited extraction and antioxidant
23
25
Lampiran 1 Perhitungan rendemen ekstrak
Jenis sampel Bagian
Lampiran 2 Contoh perhitungan rendemen
Berat ekstrak = Berat botol isi sampel - Berat botol kosong = 108,735 – 107,61
Lampiran 3 Tabel hasil uji toksisitas
26
Lampiran 4 Grafik hasil toksisitas
y = 1.1416x + 1.9063
28
Kulit batang A. marina
30
Lampiran 5 Hasil uji antioksidan
Inhibisi (%)
Jenis Bagian Ulangan
31
Inhibisi (%)
Jenis Bagian Ulangan
312,5
32
Lampiran 6 Contoh perhitungan antioksidan y = 9,6619ln(x) + 11,007 50 = 9,6619ln(x) + 11,07 Ln(x) = (50-11,07)/ 9,6619 Ln(x) = 4,0357
X = 56,58
Lampiran 7 Hasil uji inhibitor tirosinase
Inhibisi(% )
Jenis 2430 810 270 90 30
R,stylosa monofenolase 44,841 33,758 32,484 29,172 27,261
difenolase 47,261 28,79 14,14 5,35 -4,968
R,mucronata monofenolase 61,816 58,085 40,547 34,328 30,1
difenolase 53,234 38,433 18,035 9,95 -1,493
R,apiculata monofenolase 38,62 31,477 28,571 26,029 24,455
difenolase 42,373 20,218 8,959 5,932 1,332
Lampiran 8 Contoh perhitungan inhibitor tirosinase y = 12,556ln(x) – 46,66
50 = 12,556ln(x) – 46,66 Ln(x) = (50 + 46,66)/ 12,556 Ln(x) = 7,698
X = 2204,662
33
Monofenolase
34
Lampiran 11 Hasil uji fitokimia
Komponen Aktif Ekstrak Metanol
Alkaloid (Meyer,Wagner, dragendorf) Flavonoid
35
Triterpenoid
36
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, pada tanggal 20 April 1992, Penulis adalah anak pertama dari tiga bersaudara dari Bapak Drs Dwi Budiyanto MSc dan Ibu Dra Priandini Nawangsari, Penulis memulai jenjang formal pada pendidikan Taman Kanak-kanak di TK Melur, Depok, Jawa Barat lalu penulis melanjutkan Sekolah Dasar Negeri Pekayon 18 Pagi Jakarta dan lulus pada tahun 2004,Penulis melanjutkan Sekolah Menengah Petama di SMP Negeri 103 Jakarta, dan lulus pada tahun 2007, kemudian penulis melanjutkan Sekolah Menengah Atas di SMA Negeri 39 Jakarta dan lulus pada tahun 2010,
Tahun 2010 penulis diterima sebagai mahasiswa Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur UTMI (Ujian Talenta Masuk IPB), Selama menjalani pendidikan akademik di IPB penulis pernah aktif sebagai Staff SKPP himpunan profesi HIMASILKAN tahun 2011 hingga 2012 dan Ketua fieldtrip THP Jawa-Bali,