INTERAKSI LANDAK LAUT DAN LAMUN
DI PULAU BARRANG LOMPO, KEPULAUAN SPERMONDE,
SULAWESI SELATAN
EKA HESDIANTI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Abstrak
EKA HESDIANTI. Interaksi Landak laut dan Lamun di Pulau Barrang Lompo, Kepulauan Spermonde, Sulawesi Selatan. Dibimbing oleh IBNUL QAYIM dan TRI HERU WIDARTO. Landak laut termasuk dalam kelompok invetebrata yang aktif melakukan perumputan lamun. Aktivitas merumput lamun oleh landak laut memimbulkan dampak tersendiri terhadap ekosistem padang lamun. Tujuan penelitian mengetahui interaksi landak laut herbivor dan lamun di Pulau Barrang Lompo, Sulawesi Selatan. Pengukuran kepadatan lamun dan landak laut diukur menggunakan metode transek linier kuadrat di 3 stasiun pengamatan, yaitu stasiun Utara, Barat, dan Selatan. Hubungan kepadatan lamun dan landak laut herbivor dianalisis menggunakan nilai korelasi Pearson. Analisis vegetasi lamun diperoleh INP terbesar Thalassia hemprincii (129,39), Enhalus acoroides (88,92), Cyomodecea rotundata (36,10), Halodula uninervis (28,26), Halophila ovalis (9,23) dan Syngirodium isoefolium (7,16). Kepadatan landak laut didominasi oleh Tripneustes gratilla (63.69 ind/m2), Diadema setosum (23.10 ind/m2), Echinotrix calamaris (6.10 ind/m2), Echinotrix diadema (2.47 ind/m2), Echinometra mathai (1.33 ind/m2), dan Mespilia globulus (1.33 ind/m2). Hubungan kepadatan lamun dan landak laut menunjukkan tidak ada
pengaruh yang signifikan (r= −0.111, P= 0.485) dikarenakan tidak semua landak laut di lokasi penelitian berperan sebagai herbivor. Hubungan pada tiga tahap pertumbuhan lamun juga menunjukkan hubungan yang tidak signifikan dikarenakan pola pertumbuhan lamun dan kandungan tanin yang tidak disukai landak laut. Kehadiran T. gratilla dan D. setosum sebagai herbivor utama tidak menunjukkan hubungan yang signifikan. D. setosum adaptif terhadap makanan dan T. gratilla memanfaatkan hanyutan daun lamun sebagai makanan dan perlindungan dari ombak dan predator.
Abstract
INTERAKSI LANDAK LAUT DAN LAMUN
DI PULAU BARRANG LOMPO, KEPULAUAN SPERMONDE,
SULAWESI SELATAN
EKA HESDIANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2011
Judul skripsi : Interaksi Landak laut dan Lamun Di Pulau Barrang Lompo,
Kepulauan Spermonde, Sulawesi Selatan
Nama
: Eka Hesdianti
NRP
: G34060653
Disetujui oleh,
Pembimbing I,
Pembimbing II,
(Dr. Ir. Ibnul Qayim)
(Dr. Ir. Tri Heru Widarto, M.Sc)
NIP.19650220 199002 1 001
NIP. 19620513 198703 1 002
Diketahui oleh,
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
(Dr. Ir. Ence Darmo Jaya Supena, M.Si)
NIP. 19641002 198903 1 002
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT karena atas segala karuniaNya skripsi ini dapat diselesaikan. Penelitian yang berjudul Interaksi Landak Laut dan Lamun Di Pulau Barrang Lompo, Kepulauan Spermonde, Sulawesi Selatan ini dilaksanakan pada Mei-Juni 2010 yang membahas interaksi landak laut herbivor terhadap lamun.
Terima kasih penulis ucapkan kepada Dr. Ir. Ibnul Qayim dan Dr. Ir. Tri Heru Widarto selaku pembimbing yang telah memberikan pengarahan dan bimbingan kepada penulis, dosen penguji Prof. Dr. Ir. Alex Hartana yang telah banyak memberikan masukan dan arahan kepada penulis, Bapak Khairul Amri beserta keluarga yang telah banyak membantu penulis selama penelitian, Yuke Puspitasari, rekan selama penelitian dan keluarga besar Biologi 43 atas kebersamaannya. Andri Febrian dan teman-teman di LAWALATA atas semangatnya. Selain itu, ungkapan terima kasih yang paling utama, disampaikan kepada ayah, ibu, Fika, serta seluruh
keluarga atas semua do‟a dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 26 Maret 1989 dari ayah Hestu Waluyo dan ibu Suryanti sebagai anak sulung dari dua bersaudara. Tahun 2006 penulis lulus dari SMA Negeri 3 Bogor dan masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih mayor Biologi, Fakultas Matematika dan Ilmu Pengetahuan alam.
Selama mengikuti perkuliahan, penulis aktif sebagai asisten praktikum mata kuliah Biologi Dasar 2010 dan bergabung dalam anggota Perkumpulan Mahasiswa Pecinta Alam LAWALATA IPB dan menjabat sebagai Sekertaris kegiatan Tapak Baduy (2008), Bendahara program Kampung Belajar di desa Calobak: Studi Kasus Kolaborasi Petani Poh-poh dengan Taman Nasional (TN) Halimun-Salak (2008-2009), Koordinator Kelompok Minat Bakat Terlatih dan anggota Divisi Gunung-Hutan (2008-2009), Humas program Kolaborasi Pembenahan dan Pengontrolan Jalur Pendakian Gunung Salak 1 bekerja sama dengan TN Gunung Halimun Salak, dan Ketua Pelaksana Ekspedisi Puteri Leuser, Aceh: Petualang Perempuan di Belantara Warisan Dunia (2010).
Pada bulan Juli- Agustus 2007 penulis mengikuti Studi Curik Bali di Habitat Baru, di Pulau Nusa Penida Bali dalam rangka Studi Lapang Akhir LAWALATA IPB. Pada tahun 2008, penulis mengikuti Eksplorasi dan Konservasi Hutan Mahasiswa Pecinta Alam Se-Indonesia yang diselenggarakan oleh Lembaga Ilmu Pengetahuan Indonesia (LIPI) dan Pelatihan Penulisan Terbatas yang diselenggarakan oleh Lembaga Alam Tropika Indonesia (LATIN). Pada tahun 2009 Penulis melaksanakan kegiatan Praktik Lapangan di Kebun Percobaan Balai Tanaman Obat dan Aromatik (Balitro), Sukabumi dengan judul “Konservasi Plasma Nutfah dan Tanaman Obat di
Kebun Percobaan Manoko, Bandung”. Pada tahun 2010, penulis mengikuti Dialog Panel Nasional
„Prospek, Tantangan, dan Perlindungan Hukum dalam Penerapan Sistem Kartu Tanda Penduduk (KTP) Berbasis Nomor Induk Kependudukan (NIK) Tunggal yang diselenggarakan oleh Program Studi Magister Ilmu Hukum Universitas Pakuan bekerjasama dengan Asosiasi Masyarakat Transparansi Kependudukan Indonesia dan workshop Peringatan Hari Konservasi Nasional yang diselenggarakan oleh Departemen Kehutanan. Pada tahun 2011, penulis mengikuti workshop Enterpreneur and Competition 2011 Mahasiswa se-Bogor oleh Indopos dan BakrieLand, serta menjadi fasilitator dalam peringatan Hari Bumi bagi SMA se-Bogor bersama RMI, Jerami, dan AMINEF.
Penulis juga aktif diberbagai kepanitian kegiatan lingkungan dan seminar seperti Seminar
“Revolusi Sains : Bangkitlah Peneliti Muda Indonesia” oleh Himpunan Mahasiswa Biologi
DAFTAR ISI
Halaman
Daftar Gambar ... i
Daftar Tabel ... i
Pendahuluan Latar belakang ... 1
Tujuan ... 2
Bahan dan Metode Waktu dan lokasi ... 2
Alat dan bahan... 2
Pengukuran parameter air laut ... 2
Pengukuran tekstur sedimen ... 2
Analisis vegetasi lamun ... 2
Kepadatan landak laut ... 3
Stuktur komunitas lamun dan landak laut ... 4
Hubungan kepadatan lamun dan landak laut ... 4
Hasil Kondisi lokasi penelitian ... 4
Kondisi fisik air laut ... 4
Tekstur sedimen ... 5
Vegetasi lamun ... 5
Kepadatan landak laut ... 7
Stuktur komunitas lamun dan landak laut ... 7
Hubungan kepadatan lamun dan landak laut ... 8
Pembahasan ... 8
Simpulan ... 11
DAFTAR TABEL
Halaman
1 Parameter fisik perairan dan metode pengukurannya ... 2
2 Klasifikasi tekstur sedimen ... 2
3 Hasil pengukuran parameter air laut dan kisarannya... 5
4 Persentase tekstur sedimen di tiap stasiun ... 5
5 Nilai struktur komunitas lamun dan landak laut ... 8
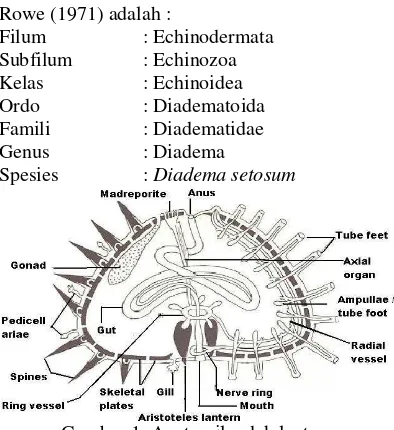
DAFTAR GAMBAR Halaman 1 Anatomi landak laut ... 1
2 Fase pertumbuhan lamun ... 2
3 Peta lokasi penelitian Pulau Barrang Lompo ... 5
4 Hasil analisis vegetasi lamun di Pulau Barrang Lompo ... 6
5 Hasil analisis vegetasi lamun di tiap stasiun ... 6
6 Analisis vegetasi lamun pada 3 tahap pertumbuhan di Pulau Barrang Lompo ... 6
7 Pola permudaan lamun ... 7
8 Kepadatan landak laut pada tiap stasiun ... 7
PENDAHULUAN
Latar belakang
Lamun (seagrass) termasuk kedalam kelompok tumbuhan air berbunga (Anthophyta) yang beradaptasi baik dengan kondisi terbenam dan bersalinitas tinggi. Lamun memiliki akar, batang, dan daun sejati dengan morfologi: daunnya panjang tipis menyerupai pita (kecuali jenis Halophila, daun berbentuk oval), berakar rimpang, pertumbuhan monopodial, dan berkembang biak secara vegetatif melalui rimpang yang beruas-ruas dan secara generatif melalui bunga dan biji.
Lamun termasuk divisi Anthophyta, Subkelas Monocotyledoneae, Ordo Helobiae (Den Hartog 1970; Philips&Menez 1988). Spesies lamun di dunia sedikitnya berjumlah 58 jenis yang berasal dari 12 genus dan 2 famili, yaitu famili Potamogetonaceae yang terdiri dari 9 genus dan famili Hydrocharitaceae yang terdiri dari 3 genus (Azkab 2006). Di Indonesia, terdapat 12 jenis lamun yang terdiri dari 7 genus dan 2 famili. Jenis lamun dari famili Potamogetonaceae meliputi Syringodium isoetifolium, Halodule pinifolia, H. uninervis, Cymodocea rotundata, C. serrulata, dan Thalassodendron ciliatum. Sedangkan dari famili Hydrocharitaceae meliputi Enhalus acoroides, Thalassia hemprichii, Halophila ovalis, dan H. minor ovalis, dan H. minor (Erfteimejer 1993).
Padang lamun (seagrass bed) merupakan hamparan vegetasi lamun yang menutup suatu area dengan berbagai tingkat kepadatan. Padang lamun dapat hanya terdiri dari satu jenis lamun atau campuran beberapa jenis lamun. Padang lamun termasuk ekosistem laut dangkal dengan produktivitas primer tertinggi.
Lamun secara ekonomi dapat dimanfaatkan sebagai bahan anyaman keranjang, kasur, pembuat atap, pupuk, dan dapat dibakar untuk di ambil kandungan garam dan soda, fiber untuk pembuatan nitroselulosa, mainan, obat, kertas, insulasi bunyi dan suhu, serta sumber berbagai bahan kimia yang berguna (Fotes 1990). Secara ekologi lamun berfungsi sebagai peredam arus, tempat berlindung dan pembesaran biota, penangkap sedimen, pendaur ulang zat hara, dan padang penggembalaan bagi
hewan-hewan herbivor seperti ikan, Crustacea, dan Echinodermata (Den Hartog 1970).
Landak laut dari kelompok Echinodermata termasuk salah satu invertebrata penghuni padang lamun. Tubuhnya berbentuk seperti bola dengan simetri petraradial dan tidak bertangan (Gambar 1). Hewan ini memiliki kaki tabung yang berasal dari membran peristomial dan pedicularia yang responsif terhadap keberadaan makanan dan predator. Spina atau duri-durinya yang panjang menutupi seluruh tubuh dan bisa digerakkan. Duri landak laut terbentuk dari kristal CaCO3 dan terdiri dari 2 macam yaitu duri utama yang panjang dan duri sekunder yang pendek. Pada sisi aboral terdapat anus, lubang genital, dan madreporit sebagai tempat keluar-masuk air. Mulut landak laut terletak pada bagian oral dengan 5 gigi tajam yang disebut lentera aristoteles. Lentera aristoteles berfungsi untuk mengunyah daun lamun yang merupakan makanan utamanya (Kasim 1999). Daun lamun yang terkena gigitan landak laut akan meninggalkan bekas.
Klasifikasi landak laut menurut Clark& Rowe (1971) adalah :
Filum : Echinodermata Subfilum : Echinozoa
Kelas : Echinoidea
Ordo : Diadematoida
Famili : Diadematidae Genus : Diadema
Spesies : Diadema setosum
Gambar 1. Anatomilandak laut (Sumber:www.metafysica.nl/turing/tecto_3)
padang lamun campuran akibat adanya preferensi makanan terhadap jenis lamun tertentu (Vonk et al. 2008). Perumputan juga memicu tumbuhnya tunas baru pada lamun T. ciliatum karena kepadatan lamun tersebut dikontrol oleh aktivitas merumput landak laut (Alcovero&Mariani 2002). Aktivitas merumput yang tinggi dapat menimbulkan area gundul (barren grounds area) di padang lamun. Oleh karena itu, interaksi landak laut dan lamun perlu dikaji terkait pentingnya peran ekologis padang lamun.
Tujuan
Penelitian ini bertujuan mengidentifikasi jenis lamun, landak laut dan mengkaji interaksi kepadatan landak laut herbivor terhadap kepadatan lamun di Pulau Barrang Lompo, Kepulauan Spermonde, Sulawesi Selatan.
BAHAN DAN METODE
Waktu dan lokasi
Penelitian dilaksanakan pada bulan Mei hingga Juni 2010 di Pulau Barrang Lompo, Kepulauan Spermonde, Sulawesi Selatan. Analisis pengukuran parameter air laut dilakukan di laboratorium Kimia Laut dan tekstur sedimen di laboratorium Geologi Laut, Universitas Hassanudin, Makassar.
Alat dan bahan
Objek dalam penelitian ini adalah lamun, landak laut dan ekosistemnya. Identifikasi lamun menggunakan buku identifikasi lamun Waycott et al. (2004). Landak laut diidentifikasi menggunakan buku identifikasi Clark&Rowe (1971). Alat yang digunakan antara lain: snorkel, GPS, meteran, tali rapia, jangka sorong, paralon untuk transek 50x50 cm2, termometer, refraktometer, pH meter, turbidimeter, DO meter, dan saringan bertingkat.
Pengukuran parameter air laut
Parameter fisik air laut diukur dengan berbagai metode dan alat yang sesuai untuk mengetahui kondisi lingkungan abiotik lokasi penelitian (Tabel 1).
Tabel 1 Parameter fisik perairan dan metode pengukurannya
Parameter Satuan Alat
Suhu 0C Termometer
Salinitas ppt Refraktometer
pH - pH meter
Kekeruhan NTU Turbidimeter
DO mg/l DO meter
Pengukuran tekstur sedimen
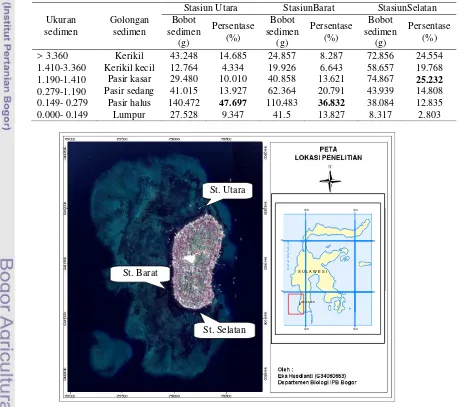
Tekstur sedimen diukur dengan menggunakan saringan bertingkat berdasarkan kriteria Michael (tabel 2) untuk mengetahui ukuran sedimen habitat lamun dan landak laut di lokasi penelitian.
Tabel 2 Klasifikasi Tekstur Sedimen (Michael 1994)
Ukuran sedimen (mm) Golongan sedimen
> 3.360 Kerikil
1.410-3.360 Kerikil kecil 1.190-1.410 Pasir kasar 0.279-1.190 Pasir sedang 0.149- 0.279 Pasir halus
0.000- 0.149 Lumpur
Analisis vegetasi lamun
Analisis vegetasi lamun dilakukan untuk mengetahui kepadatan dan penutupan jenis lamun secara keseluruhan dan struktur komunitas lamun pada fase juvenil, adolesens, dan senesens (Gambar 2). Fase juvenil merupakan fase awal pertumbuhan lamun yang ditandai tumbuhnya tunas baru pada bagian akar. Fase adolesens merupakan tahap perkembangan tunas menjadi lamun dewasa dengan ciri: daun masih muda, ukuran tubuh sedang dan perakaran kokoh. Lamun di fase senesens memiliki morfologi tubuh seperti fase adolesens dengan daun yang lebih tebal dan tua, perakaran yang kokoh, serta mampu bereproduksi secara seksual dengan pembentukan bunga. Analisis vegetasi menggunakan metode transek linier kuadrat (English et al. 1994) dengan plot berukuran 50 x 50 cm2. Hasil yang didapat dikonversi dalam satuan individu per meter kuadrat (ind/m2).
dibagi beberapa plot. Jarak antar plot disesuaikan dengan panjang padang lamun pada masing-masing stasiun. Total plot pengamatan berjumlah 42 plot. Padang lamun sepanjang 90 m di stasiun Utara dibuat 3 plot/transek dengan jarak antar plot 30 m. Di stasiun Selatan dibuat 6 plot/transek dengan jarak antar plot 60 m dan panjang padang lamun 360 m. Stasiun Barat terdapat 5 plot/transek dengan jarak antar plot 65 m di padang lamun sepanjang 325 m ke arah laut.
Parameter biotik yang dianalisis adalah: a. Kepadatan
Kepadatan jenis lamun adalah jumlah tegakan lamun yang ditemukan dalam luas area petak contoh
A Kepadatan relatif jenis lamun adalah perbandingan kepadatan jenis ke-i dengan kepadatan total jenis lamun.
0
∑K = Jumlah kepadatan seluruh jenis (ind/m2)
b. Frekuensi
Frekuensi adalah jumlah plot ditemukannya lamun jenis ke-i dalam total area pengambilan contoh.
P Frekuensi relatif jenis adalah perbandingan frekuensi jenis ke-i dan frekuensi jenis keseluruhan
FRi = Frekuensi relatif jenis ke-i Fi = Frekuensi jenis ke-i
∑F = Jumlah total frekuensi seluruh jenis
c. Luas Penutupan
Penutupan jenis adalah penutupan jenis lamun yang ditemukan dalam petak contoh di bagi total frekuensi jenis ke-i
i
P (Saito&Atobe 1970) Keterangan :
Pi = Penutupan jenis ke-i Mi = Presentase nilai tengah kelas
ke-i fi = Frekuensi
∑fi = Jumlah total frekuensi ke-i Penutupan relatif jenis adalah perbandingan penutupan jenis lamun ke-i dengan seluruh jenis lamun yang ditemukan dalam petak contoh.
0
PRi = Penutupan relatif jenis ke-i Pi = Penutupan jenis ke-i
∑C = Jumlah total penutupan d. Indeks Nilai Penting
Indeks Nilai Penting (INP) digunakan untuk menduga peranan suatu jenis dalam suatu komunitas. Semakin tinggi nilai INP, maka semakin tinggi jenis tersebut dalam
INP = Indeks Nilai Penting KRi = Kepadatan relatif jenis ke-i FRi = Frekuensi relatif jenis ke-i PRi = Penutupan relatif jenis ke-i
Kepadatan landak laut
Pengukuran kepadatan landak laut menggunakan metode yang sama dengan kepadatan lamun melalui metode transek garis dengan membuat plot berukuran 3x3 m2 di titik yang sama dengan plot pengukuran lamun. Jumlah dan jenis landak laut pada setiap plot akan dihitung menggunakan rumus: ni = Jumlah total individu dari jenis ke-i A = Luas area total pengambilan contoh.
Stuktur komunitas lamun dan landak laut
Struktur komunitas lamun dan landak laut didapatkan melalui perhitungan Indeks Keanekaragaman Shannon-Wiener, Indeks Keseragaman Simpson, dan Indeks Dominansi. Indeks keanekaragaman menggambarkan keadaan suatu populasi secara matematis untuk mengetahui informasi jenis dan jumlah individu setiap jenis yang menyusun suatu komunitas menggunakan persamaan
H′ = Indeks keanekaragaman Shannon- Wiener
Pi = ni/N
Ni = Jumlah individu jenis ke-i
N = Jumlah total individu seluruh jenis S = Jumlah jenis
Kriteria (Krebs 1989) :
H′ < 3.322 = rendah
3.322 ≤ H′ ≤ 9.966 = sedang
H′ > 9.966 = tinggi
Indeks Keseragaman menggambarkan komposisi tiap spesies dalam suatu komunitas. Persamaan yang digunakan adalah
Hmax
H'
E
(Krebs 1989)Keterangan :
E = Indeks keseragaman
H′ = Indeks keanekaragaman Shannon- Wiener
H max = log2 S S = Jumlah jenis Kriteria (Krebs 1989) :
0.00 < E ≤ 0.50 = Komunitas tertekan 0.50 < E ≤ 0.75 = Komunitas labil
0.75 < E ≤ 1.00 = Komunitas stabil
Indeks Dominansi menunjukkan dominansi suatu jenis dalam suatu komunitas dengan
ni = Jumlah individu jenis ke-i
N = Jumlah total individu seluruh jenis S = Jumlah jenis
Kriteria (Magurran 1988) :
0.00 < E ≤ 0.50 = Dominansi rendah 0.50 < E ≤ 0.75 = Dominansi sedang 0.75 < E ≤ 1.00 = Dominansi tinggi
Hubungan kepadatan lamun dan landak laut
Hubungan kepadatan lamun dan landak laut dianalisis menggunakan MINITAB 14 untuk mendapatkan nilai korelasi pearson dan signifikasi hubungan ditentukan pada selang kepercayaan 95%.
HASIL
Kondisi lokasi penelitian
Pulau Barrang Lompo termasuk dalam gugusan pulau-pulau kecil yang terletak di Kepulauan Spermonde, Sulawesi Selatan. Secara geografis pulau ini terletak pada 5003‟ S, 1190 20‟ E dengan luas 40 Ha dan jumlah penduduk sekitar 5000 jiwa. Sebelah Barat pulau berbatasan dengan Pulau Bone Tambun, Selatan dengan Pulau Barrang Caddi, Timur dengan gugusan pulau-pulau kecil, dan Utara dengan Pulau Bone Batang.Barrang Lompo memiliki padang lamun yang dapat dijumpai hampir di semua sisi pulau. Pengambilan sampel dilakukan di 3 stasiun pada sisi Barat, Utara, dan Selatan pulau. Sisi timur merupakan area darmaga dengan lalu lintas kapal yang padat dan perairannya relatif dalam sehingga pengambilan sampel sulit dilakukan. Tiap stasiun dibagi kedalam substasiun yang jumlahnya disesuaikan dengan panjang hamparan padang lamun. Gambar 3 menunjukkan posisi stasiun di Selatan dengan padang lamun sepanjang 360 m di atas hamparan pasir kasar dan pecahan karang. Sedimen pada stasiun Utara berupa pasir bercampur pecahan karang dengan panjang 90 m.
Kondisi fisik air laut
Tekstur sedimen
Tekstur sedimen di lokasi penelitian bervariasi dari lumpur hingga pasir kasar yang bercampur pecahan karang. Erftemeijer& Minddenburg (1993) melaporkan sedimen di Pulau Barrang lompo berupa pasir halus dengan pecahan foraminifera yang telah mati. Ukuran sedimen di tiap stasiun dapat diamati pada tabel 4.
Vegetasi lamun
Tipe vegetasi lamun di Pulau Barrang Lompo termasuk vegetasi campuran yang terdiri dari lebih satu jenis lamun. Pada lokasi penelitian ditemukan 6 jenis lamun yaitu: E. acoroides, T. hemprincii, S. isoefolium, H. uninervis, C.rotundata, dan H. ovalis.
Tabel 3 Hasil Pengukuran Parameter Air Laut dan kisarannya
Tabel 4 Persentase tekstur sedimen tiap stasiun
Gambar 3 Peta lokasi penelitian Pulau Barrang Lompo (Sumber : modifikasi dari google earth) Parameter Satuan St. Utara St. Barat St. Selatan Kisaran Optimal
Suhu 0C 33 33 33 28-32 (Supriadi 2007)
Salinitas ppt 27 27.67 27.67 29-34 (Dobo 2009)
pH 7.85 7.74 7.89 7.5-8.0 (Supriadi 2007)
Kekeruhan NTU 1.51 14.34 14.36 0.9-6.5 (Supriadi 2007)
DO mg/l 8.589 9.955 9.109 7.0-8.5 (Husain 1983)
Ukuran sedimen
Golongan sedimen
Stasiun Utara StasiunBarat StasiunSelatan Bobot
sedimen (g)
Persentase (%)
Bobot sedimen
(g)
Persentase (%)
Bobot sedimen
(g)
Persentase (%) > 3.360 Kerikil 43.248 14.685 24.857 8.287 72.856 24.554 1.410-3.360 Kerikil kecil 12.764 4.334 19.926 6.643 58.657 19.768 1.190-1.410 Pasir kasar 29.480 10.010 40.858 13.621 74.867 25.232
0.279-1.190 Pasir sedang 41.015 13.927 62.364 20.791 43.939 14.808 0.149- 0.279 Pasir halus 140.472 47.697 110.483 36.832 38.084 12.835
0.000- 0.149 Lumpur 27.528 9.347 41.5 13.827 8.317 2.803
5
S U L A W E SI
S
e
l
a
t
M
a
k
a
s
s
a
r
#M AK ASSA R
120
120
124
124
4 4
0 0
St. Utara
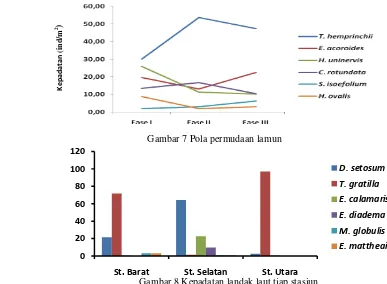
Kepadatan relatif (KRi), Penutupan Relatif (RPi), dan Frekuensi Relatif (FRi) yang besar menyebabkan lamun di Pulau Barrang Lompo didominansi oleh T. hemprinchii dengan Indeks Nilai Penting (INP) sebesar 131.86 dan E. acoroides 94.54 (Gambar 4 dan 5).
Analisis vegetasi lamun pada 3 tahap pertumbuhan dilakukan untuk mengetahui struktur kepadatan dan luas penutupan pada fase juvenil (fase I), adulensens (fase II), dan senesens (fase III). Hasil perhitungan didapat fase senesens dan adolesens INP 300 dan fase juvenil 286.34 yang masih didominasi oleh T. hemprinchii (Gambar 6).
Gambar 4 Hasil analisis vegetasi lamun di Pulau Barrang Lompo
Gambar 5 Hasil analisis vegetasi lamun di tiap stasiun
Gambar 6 Analisis vegetasi lamun pada 3 tahap pertumbuhan di Pulau Barrang Lompo
0 20 40 60 80 100 120 140
KRi FRi PRi INP
T. hemprinchii
E. acoroides
H. uninervis
C. rotundata
S. isoefolium
H. ovalis
0 20 40 60 80 100 120 140 160 180
KRi FRi PRi INP KRi FRi PRi INP KRi FRi PRi INP
T. hemprinchii
E. acoroides
H. uninervis
C. rotundata
S. isoefolium
H. ovalis
0 20 40 60 80 100 120 140 160
KRi PRi INP KRi PRi INP KRi PRi INP
T. hemprinchii
E. acoroides
H. uninervis
C. rotundata
S. isoefolium
Pola permudaan bertujuan mengetahui kesinambungan pergantian alamiah lamun. Pola permudaan menggunakan jenis static life table, yaitu cara untuk memperkirakan struktur umur pada suatu populasi dalam sekali pengukuran. Cara ini memungkinkan untuk memonitor dan mengukur variabilitas alami tanaman yang tumbuh dan bertahan (Begon et al. 1996). Gambar 7 menunjukkan bahwa produksi tunas yang rendah bukan faktor pembatas regenerasi lamun untuk tumbuh hingga fase senesens. Pola permudaan dipengaruhi oleh pembungaan, vegetatif dari akar, struktur lamun dewasa yang tahan terhadap cekaman lingkungan, dan perumputan oleh herbivor.
Kepadatan landak laut
Landak laut yang ditemukan di Pulau Barrang Lompo terdiri dari 6 jenis, yaitu Diadema setosum, Echinotrix diadema, Echinotrix calamaris, Echinometra mathaei, Tripneustes gratilla, dan Mespilia globulus yang termasuk dalam famili Toxopneustidae (T. gratilla), famili Diadematidae (D. setosum dan E.diadema ), famili Echinometridae (E. calamaris, E. mathaei), dan famili Temnopleuridae (M. globulus). Landak laut yang paling banyak ditemukan yaitu T. gratilla (335), D. setosum (132), E. calamaris (32), E. diadema (13), M. globulis (7), dan
E.matheai (7). Kepadatan landak laut (Gambar 8).
Landak laut T. gratilla dan D. setosum yang terbanyak ditemukan di Pulau Barrang Lompo termasuk dalam jenis landak laut yang melakukan grazing (merumput lamun). Hasil pengukuran kepadatan landak laut di Pulau Barrang Lompo diperoleh landak laut jenis T. gratilla (63.688 ind/m2), D. setosum (23.095 ind/m2), E. calamaris (6.084 ind/m2), E.diadema (2.472 ind/m2), E. mathaei (1.331 ind/m2), dan M. globulus (1.331 ind/m2).
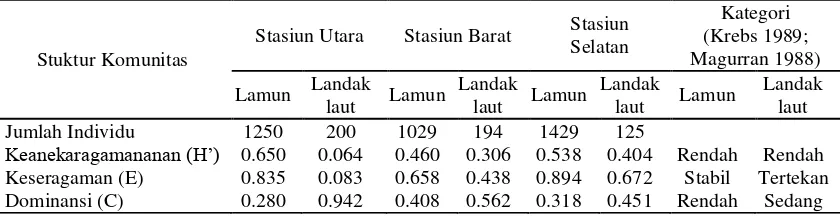
Struktur komunitas lamun dan landak laut Keanekaragaman jenis (H′) lamun di
Pulau Barrang Lompo termasuk rendah (H′ <
3.322) (Tabel 5). Rendahnya keanekaragaman jenis ini karena jumlah jenis lamun yang ditemukan hanya terdiri dari 6 jenis dari 58 jenis lamun di dunia, dan tidak semua jenis dapat ditemukan pada setiap stasiun pengamatan. Indeks Keseragaman jenis termasuk dalam kategori stabil dengan nilai mendekati 1 (0.835-0.894) kecuali pada stasiun Barat termasuk dalam kategori labil. Stasiun Barat memiliki jumlah spesies lamun yang terkecil dengan proporsi antar jenis memiliki rentang nilai yang lebar. Dominansi jenis (C) juga tergolong rendah, dengan nilai mendekati 0 (0.280-0.408) karena jumlah tegakan jenis lamun dominan tak beda jauh dengan jenis lamun lainnya.
Gambar 7 Pola permudaan lamun
Gambar 8 Kepadatan landak laut tiap stasiun
0
St. Barat St. Selatan St. Utara
Tabel 5 Nilai Struktur Komunitas Lamun dan Landak laut
Keanekaragaman landak laut tergolong
rendah (H′ < 3.222), nilai Keseragaman (E≤
0.500) menunjukkan bahwa komunitas landak laut tergolong tertekan, dan Dominansi termasuk dalam kisaran kategori sedang (0.65). Rendahnya keanekaragaman dan keseragaman karena jenis landak laut tidak tersebar merata pada setiap lokasi. Landak laut jenis D. setosum mendominasi wilayah pantai sedangkan wilayah tubir di dominasi oleh T. gratilla.
Hubungan kepadatan lamun dan landak laut
Analisis hubungan kepadatan lamun dan landak laut didapatkan kolerasi (r) = −0.111, P= 0.485. Hal ini menunjukkan tidak adanya hubungan yang signifikan antara kepadatan landak laut dan lamun.
Hubungan yang tidak signifikan juga terlihat pada kepadatan landak laut dan 3 fase pertumbuhan: fase juvenil (r = 0.272, P = 0.081), fase adolesens (r = −0.045, P = 0.777), dan fase senesens (r = −0.112, P = 0.480).
T. gratilla dan D. setosum termasuk jenis herbivor yang terbanyak ditemukan di lokasi penelitian. Keterkaitan kedua landak laut terhadap padang lamun menunjukkan bahwa tidak ada hubungan signifikan (D. setosum : liang), omnivora, ditemukan dalam jumlah sedikit, dan hidup soliter. Keterkaitan keempat landak laut tersebut menunjukkan bahwa tidak ada hubungan signifikan (E. calamaris: r = didominansi oleh T. hemprinchii dengan
Indeks Nilai Penting (INP) sebesar 131.86 dan E. acoroides 94.54. INP menunjukkan peranan suatu jenis tertentu di sebuah ekosistem. Nilai tersebut berarti T.hemprinchii memiliki peran ekologis yang penting seperti pemanfaatan sumber daya secara optimum atau adanya penguasaan ruang tertentu dalam ekosistem padang lamun di Pulau Barrang Lompo. Hal serupa didukung oleh Erftemeijer (1993) bahwa padang lamun di Barrang Lompo merupakan campuran dominan antara T. hemprinchii dan E. acoroides.
Kepadatan, komposisi, dan dominansi lamun ditentukan oleh sedimen, kekeruhan, dan struktur lamun. Sedimen mengandung nutrisi yang diserap melalui akar untuk pertumbuhan lamun. Sedimen halus mampu mengikat fosfat dan mempengaruhi standing crop lamun. Selain itu, kepadatan lamun tinggi ditemukan pada sedimen halus dan rendah pada sedimen kasar. Lamun E. acoroides dan T. hemprinchii cenderung membentuk kelompok besar pada daerah pantai (sedimen halus) dan membentuk kelompok yang lebih kecil atau jarang pada daerah mendekati tubir (sedimen kasar). Sedimen yang bervariasi mendukung untuk membentuk padang lamun campuran.
Kekeruhan menghalangi penetrasi cahaya untuk fotosintesis yang berpengaruh pada pertumbuhan dan produksi lamun. Semakin jernih perairan, maka makin beragam pula jenisnya. Perairan yang keruh seperti di Stasiun Barat didominasi oleh Enhalus karena jenis ini tahan terhadap kondisi lingkungan yang tidak menguntungkan.
Struktur lamun seperti Syringodium yang memiliki bentuk daun silindiris dengan ukuran tubuh sedang memiliki kepadatan lebih tinggi dan penutupan rendah. Sebaliknya, Enhalus dengan helaian daun yang panjang dan lebar serta ukuran tubuh besar memiliki penutupan yang tinggi dan kepadatan rendah. Morfologi tersebut juga membuat Enhalus tahan terpapar sinar matahari pada saat laut surut dan tidak Stuktur Komunitas
terganggu oleh lalu lalang kapal yang padat. Berbeda dengan daun Thalassia dan Syringodium yang tidak tahan kekeringan dan mudah gugur.
Lamun di Barrang Lompo banyak ditemukan pada fase adolesens dibandingkan fase lainnya. Hal ini berkaitan dengan laju pertumbuhan daun, kecepatan pulih, dan jangka hidup lamun. Pengukuran laju pertumbuhan, kecepatan pulih, dan jangka hidup lamun di Pulau Barrang Lompo menunjukkan jangka hidup T. hemprinchii 24-40 hari, laju pertumbuhan daun 0,6 cm/hari, dan kecepatan pulih 0.15 cm/hari (Supriadi 2007). Faktor tersebut mengakibatkan pada saat pengukuran lebih banyak ditemukan fase dewasa (adolesens dan senesens) dibanding fase muda (juvenil).
Kehadiran T. hemprinchii sebagai spesies dengan dominansi tertinggi di Pulau Barrang Lompo disebabkan lamun ini memiliki daya adaptasi tinggi yang dapat hidup disemua jenis sedimen.T. hemprinchii hidup pada sedimen yang bervariasi dan menyukai sedimen pasir halus hingga kasar serta ditemukan sampai kedalaman 5 m (Den Hartog 1970). Sedimen yang berupa pasir hingga pecahan karang yang tersebar di Pulau Barrang Lompo ini memungkinkan T. hemprincii dapat hidup dengan baik. Kehadiran T. hemprinci di Kepulauan Spermonde merupakan species klimaks (Vonk et al. 2008).
E. acoroides bisa ditemukan diseluruh lautan tropis, subtropis, dan beriklim sedang. Di Pulau Barrang Lompo, E. acoroides merupakan salah satu jenis lamun yang dominan (Supriadi 2007) dan dapat ditemukan hampir di tiap sisi pulau terutama tepi pantai dekat perumahan penduduk. Lamun ini hidup di zona intertidal hingga kedalaman 6 m.
Kehadiran C. rotundata yang cukup tinggi di Pulau Barrang Lompo berkaitan dengan sedimenpasir hingga pecahan karang yang disukai C. rotundata. Tomasick et al. (1997) menyebutkan bahwa C. rotundata hidup didaerah dangkal dan tahan dalam ditemukaan di daerah mendekati batas tubir karang.
Lamun H. ovalis dan S. isoefolium memiliki nilai kehadiran yang lebih kecil dibanding jenis lamun lainnya karena S. isoefolium tidak tahan dalam keadaan tidak
terbenam (Philips&Menez 1998). Di lokasi penelitian, lamun S. isoefolium hanya ditemukan di stasiun Utara yang relatif lebih dalam sehingga lamun tidak mengalami kekeringan pada keadaan surut. Lamun H. ovalis yang dikenal sebagai lamun perintis juga banyak ditemukan pada sedimen pasir hingga kedalaman 12 m, terutama di stasiun Utara yang memiliki daerah batas lamun dan karang terpendek.
Behren&Lafferty (2004) mengungkapkan kepadatan landak laut dipengaruhi oleh kelimpahan alga atau lamun, penyakit bakteri vibrio dan parasit, serta predatornya seperti ikan dan kepiting. Di Pulau Barrang lompo, tidak ada pemanfaatan landak laut baik secara ekonomi maupun sebagai sumber makanan. Kepadatan landak laut dipengaruhi predator, kejernihan, sedimen, kesediaan makanan dan kesukaan pada lamun tertentu, serta musim. Saat laut surut, padang lamun terpapar matahari sehingga banyak landak laut yang mati atau sulit ditemukan.
T. gratilla sebagai herbivor utama banyak ditemukan di stasiun Utara dan Selatan, terutama daerah mendekati tubir dan tidak ditemukan pada daerah pantai. Daerah tersebut mendukung landak laut untuk hidup karena memiliki tingkat kejernihan yang tinggi, sedimen berpasir bercampur pecahan karang, lamun yang beragam, tingkat aktivitas manusia rendah, dan kedalaman lebih tinggi. Tingkat kejernihan membuat lamun dilekati epifit yang sangat disukai landak laut. Faktor ketersediaan makanan turut mempengaruhi keberadaan landak laut. Landak laut juga menyukai lamun T. hemprinchii dan S. isoefolium (Bak&Nojima 1980). Aktivitas manusia seperti lalu lintas dan penambatan kapal, serta pembuangan limbah rumah tangga lebih rendah karena terpusat di pantai. Selain itu, kedalaman pada daerah ini relatif tinggi sehingga lamun dan landak laut selalu tergenang air laut pada saat surut. Suhu yang tinggi pada saat surut menyebabkan banyak landak laut yang mati (Aziz 1995).
berakibat tingkat kekeruhan relatif tinggi sehingga kepadatan D. setosum di kedua stasiun cenderung tinggi.
Landak laut memiliki kesukaan terhadap jenis lamun T. hemprinchii yang mendominasi di Pulau Barrang Lompo. Penelitian mengenai kesukaan T. gratilla terhadap lamun T. hemprincii dilaporkan oleh Kasim (1999). Berdasarkan analisis isi perut T. gratilla terdapat lamun jenis T. hemprichii rata-rata mencapai 55.6% dan E. acoroides 31,4% yang membuktikan bahwa landak laut melakukan perumputan lamun. Lamun ini disukai landak laut karena daun relatif pendek, lebar dengan serat lunak, dan kadar tanin yang rendah. Daun muda lebih sedikit ditemukan tanin (chicoric acid), asam p-coumaric, valinin, dan ferulic acid sedangkan daun tua mengandung gensiticacid, caffeic acid, dan cinnamic acid yang lebih tinggi (Haznedaroglu&Zeybek 2007). Tanin menghambat pencernaan herbivora dengan mengikat protein tanaman yang dikonsumsi sehingga lebih sulit dicerna.
Lamun dapat dimanfaatkan sebagai habitat bagi berbagai organisme menetap dan bergerak karena tidak memiliki pertahanan kimia yang kuat seperti senyawa fenol. Pada siang hari T. gratilla sering kali ditemukan memanfaatkan daun lamun untuk menahan ultraviolet, berlindung dari hempasan ombak serta bersembunyi dari predator seperti kepiting, keong, dan ikan (Gambar 9).
Gambar 9 Landak laut memanfaatkan lamun sebagai tempat berlindung
Dobo (2009) melaporkan di Kepulauan Banda, Maluku, kepadatan landak laut yang tinggi ditemukan pada kepadatan lamun yang rendah. Di Pulau Barrang Lompo, kepadatan landak laut ditemukan pada kondisi lamun yang rapat, terutama pada padang lamun yang didominasi oleh T. hemprinchii. Kondisi lamun tidak terpengaruh banyaknya landak laut disebabkan tidak semua landak laut di Barrang Lompo bersifat herbivor. Penelitian merumput landak laut tidak sama pada setiap tempat. Di Pulau Bone Batang, Kepulauan Spermonde, peningkatan aktivitas merumput T. gratilla tidak berpengaruh pada kepadatan dan kemampuan tumbuhnya tunas baru di bagian meristem apikal lamun. Perubahan dominansi T. hemprinchii oleh landak laut disebabkan perbedaan kemampuan bertahan pada preferensi makanan (Vonk et al. 2008).
Harrold&Reed (1985) dalam Behrens& Laferty (2004) menyebutkan aktivitas merumput dapat memicu tumbuhnya tunas baru dan dapat menumbuhkan kembali alga yang lebih resisten terhadap perumputan. Hubungan kepadatan landak laut pada fase pertumbuhan menunjukkan hubungan yang signifikan pada fase juvenil. Pernyataan yang sama disampaikan Valentine (1997) bahwa perumputan dapat menaikkan produksi tunas baru dibandingkan produksi daun baru. Pada area perumputan, produksi tunas baru mengakibatkan biomassa lamun bawah (rhizome, akar) tidak akan berkurang dan menghasilkan produktivitas yang sama dengan area yang tidak terkena perumputan. Hal ini disebabkan adanya perpindahan material agar lamun mengganti jaringan yang hilang dan bagian lamun yang bisa dimakan selama perumputan berlangsung (Valentine& Heck 1999). Herbivor berpengaruh negatif pada biomassa atas (daun) lamun yang dapat berkurang hingga 74% (Vonk et al 2008).
Aktivitas merumput landak laut jenis T. gratilla menguntungkan untuk spesies klimaks namun membuat biodiversitas lamun menurun (Vonk et al. 2008). Pengaruh aktivitas merumput lamun dapat mengubah komposisi lamun akibat preferensi makanan tertentu.
SIMPULAN
Lamun di Pulau Barrang Lompo termasuk dalam vegetasi campuran yang terdiri dari E. acoroides, T. hemprincii, S. isoefolium, H. uninervis, C. rotundata, dan H. ovalis. Dominansi tertinggi diperoleh T. hemprinchii dengan INP 129. Landak laut yang ditemukan di Pulau Barrang Lompo terdiri dari 6 jenis, yaitu D. setosum, E. diadema, E. calamaris, E. mathai, T. gratilla, dan M. globulus. Landak laut jenis T. gratilla memiliki kepadatan tertinggi 63,69 ind/m2.
Hubungan kepadatan lamun dan landak laut menunjukkan tidak ada pengaruh yang signifikan disebabkan tidak semua landak laut berperan sebagai herbivor. Hal serupa terjadi pada hubungan landak laut pada tiga tahap pertumbuhan. Hubungan yang tidak signifikan bisa disebabkan pola pertumbuhan lamun dan adaptasi lamun (kandungan tanin) terhadap pemangsa.
Landak laut jenis T. gratilla dan D. setosum termasuk herbivor utama di Barrang Lompo. Kehadiran landak laut tersebut tidak berpengaruh signifikan terhadap kepadatan lamun. T. gratilla yang memanfaatkan lamun secara langsung (makan dan tempat berlindung). D. setosum adaptif terhadap lingkungan.
DAFTAR PUSTAKA
Anonim. 2011. The Tectology Of Echinoderm. [terhubung berkala]. http://metafysica.nl./turing/tecto_3.html. [29 Maret 2011].
Alcovero T, Mariani S. 2002. Effects sea urchin grazing on seagrasses Thalassodendron ciliatum beds on Kenyan Lagoon. Mar. Ecol. 226: 255-263.
Aziz A. 1994. Tingkah laku landak laut di padang lamun. Oseana 19 (4) : 35-43. Aziz A. 1995. Kematian massal landak laut.
Oseana XX no.1 : 31-39.
Azkab MH. 2006. Ada apa dengan lamun. Oseana 31(3) : 45-55.
Bak HP, Nojima S. 1980. Immigration of a tropical sea urchin Astropiga radiata in a temperate eel grass Zostera marina L. Patch: its feeding habit and grazing effect of the patch. Amakusa Mar. Bio 5 (2) : 153-169.
Begon M, Mortimer M, Thompson JD. 1996. Population Ecology: A Unified Study Of Animals And Plants Third Ed. Cambringe : Blackwell science Ltd. Behrens MD, Lafferty KD. 2004. Effects of
marine reserves and urchin disease on Southern Californian Rocky Reef Communities. Mar Ecol 279: 129–139. Brower JE, Zar JH, Von Endo CN. 1977.
Field And Labolatory Methods For General Ecology. Boulevard USA : Wm C. Brown Publ.
Clark AM, Rowe FEW. 1971. Monograph Of Shallow Water Indo West Pasific Echinoderms. British Museum. London. Den Hartog. 1970. The Seagrass Of The
World. North Holland : Amsterdam. Dobo J. 2009. Tipologi Komunitas Lamun
Kaitannya dengan Populasi Landak laut Di Pulau Hatta, Kepulauan Banda, Maluku [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Erftemeijer PLA, Middelburg JJ. 1993.
Sediment-nutrient interaction in tropical seagrass beds: a comparison between a terrigenous and a carbonate sedementary environment in South Sulawesi (Indonesia). Mar Ecol 102 : 187-198. Erftemeijer PLA. 1993. Differences in
nutrient concentration and resources between seagrass communities on carbonate and terrigeneus sediments in South Sulawesi. Mar Sci 54 (1) : 403-419.
English S, Wilkinson C, Baker VJ. 1994. Survey Manual for Tropical Marine Resources. Australia : ASEAN-Australia Marine Project.
Fortes MD. 1990. Seagrass : A Resource Unknown In The ASEAN Regions. ICLARAM education series 5.
Haznedoroglu MZ, Zeybeck U. 2007. HPLC determination of chicoric acid in leaves of Posidonia oceanica. Pharmaceut Bio 45 (10) : 745-748.
Husain F. 1983. Studi Tentang Beberapa Aspek Bulu babi Di Perairan Pulau Barrang Lompo Kecamatan Ujung Tanah Kotamadya Ujung Pandang [skipsi]. Ujung Pandang : Universitas Hassanudin.
Kasim M. 1999. Aktivitas Merumput dan Pertumbuhan Landak laut (Tripneustes gratilla Linnaeus) pada Habitat Lamun di Perairan Bone-Bone, Kabupaten Buton, Provinsi Sulawesi Tenggara [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Klumpp D, Salita-Espinosa JT, Fortes MD. 1993. Feeding ecology and tropic role of sea urchin in a tropical seagrass community. Aquat Bot 45: 205-229. Krebs CJ. 1989. Ecological Methodology.
New York : Harper and Rowe Publisher. Magurran AE. 1988. Ecological Diversity And
Its Measurement. New Jersey : Princetown Press.
Michael. 1994. Ecological Method For Field And Labolatory Investigation. Mc Graw Publishing Company Ltd. New York. Philips RC, Menez EG. 1988. Seagrasess.
Smithsonian Institution Press : Washington DC.
Saito Y, Atobe S. 1970. Phytosociological study of intertidal marine algae. I. Usujiri Benten-Jima, Hokkaido. Bull. Fac. Fish. Hakkaido Univ., 21: 37-69. Sugiarto H, Supardi. 1995. Beberapa catatan
tentang landak laut marga Diadema. Oseana 20(4) : 35-41.
Supriadi.2007. Produktivitas Lamun Enhalus acoroides (LINN. F) Royle dan Thalassia hemprinchii (EHRENB.) Ascherson di Pulau Barrang Lompo, Makasar [tesis]. Bogor : Program Pascasarjana, Institut Pertanian Bogor. Tomascik T, Mah AJ, Nontji A, Moosa M.K.
1997. The Ecology of Indonesian Seas, Part I. Periplus Editions: Singapore. Vonk JA, Marjoelin HJ, Johan S. 2008. In situ
quantification of Tripneustes gratilla grazing and its effects on three co-occurring tropical seagrass species. Mar Ecol vol.360: 107-114.
Valentine JF, Heck KL, Busby J, Webb D. 1997. Experimental evidence that herbivory can increase shoot density in a subtropical turlegrass. Oceologia 112: 193-200.
Valentine JF, Heck KL. 1999. Seagrass herbivory: evidence for the continued grazing of marine seagrass. Mar Ecol 176: 291-302.
Waycott M, Mc Mahon K, Mellors J, Calladine A, Kleine D. 2004. A Guide To Tropical Of The Indo-West Pasific. James Cook University : Townsville.