LAMPIRAN
Lampiran 1. Komposisi media Posgate E (tiap 1000 ml)
Bahan Media Bakteri Pereduksi Sulfat pH 7.4
KH2PO4 0.5 g
NH4Cl 1.0 g
CaCl2.6H2O 1.0 g
MgCl2.7H2O 2.0 g
Sodium lactate 8.0 ml
Yeast extract 1.0 g
Ascorbic acid 1.0 g
Thioglycollic acid 0.76ml
FeSO4.7H2O 0.5 g
Na2SO4 1.0 g
Agar* 18.0 g
*Bahan untuk media padat Sumber : Posgate, 1984
Lampiran 2. Hasil Analisis Awal Tanah
Melampirkan hasil analisis dari PT. Nusa Pusaka Kencana
Lampiran 3. Kriteria pH tanah
Kriteria pH H2O
Sangat Masam < 4.5
Masam 4.5 - 5.5
Agak Masam 5.6 - 6.5
Netral 6.6 - 7.5
Agak Alkalis 7.6 - 8.5
Alkalis > 8.5
Lampiran 4. Foto Penelitian
Lokasi Pengambilan Sampel Pertama di Perkebunan PT. Napoli Raya
Lokasi Pengambilan Sampel Ketigadi Brastagi
Media Padat dan Cair Posgate Isolasi BPS di Laminar
Lampiran 5. Hasil Perubahan Warna Pada Berbagai pH (5.5 ; 4.5 ; 4 ; 3.5 ; 3 ; 2.5) Media Cair Posgate Setelah 14 hari inkubasi
Isolat TSM4 Isolat TSM5
Isolat TSM6 Isolat TSM1
Isolat LK2 Isolat LK6
Isolat LK1 Isolat LK3
Isolat AP10 Isolat AP7
Isolat AP6 Isolat AP8
Lampiran 6. Data pH Larutan Setelah Hari ke-14
Kode Isolat pH 5.5 Total Rataan
I II
AP 1 8.19 8.03 16.22 8.11
AP 3 8.22 8.38 16.60 8.30
AP 4 8.82 8.52 17.34 8.67
AP 6 8.35 8.34 16.69 8.35
AP 7 8.57 8.38 16.95 8.48
AP 8 8.14 8.16 16.30 8.15
AP 9 8.66 8.09 16.75 8.38
AP 10 8.33 8.42 16.75 8.38
LK 1 8.67 8.64 17.31 8.66
LK 2 7.32 8.55 15.87 7.94
LK 3 8.13 7.74 15.87 7.94
LK 4 8.36 8.25 16.61 8.31
LK 6 8.77 8.70 17.47 8.74
LK 7 8.14 8.34 16.48 8.24
TSM 1 8.64 8.14 16.78 8.39
TSM 2 8.67 8.28 16.95 8.48
TSM 3 8.20 8.43 16.63 8.32
TSM 4 8.32 8.30 16.62 8.31
TSM 5 8.16 6.85 15.01 7.51
TSM 6 7.84 8.01 15.85 7.93
Total 166.50 164.55 331.05
Rataan 8.33 8.23 16.55
Lampiran 7. Sidik Ragam Data pH Larutan Setelah Hari ke-14 Sidik
Ragam db JK KT Fh F.05 F.01
Blok 1 0.0951 0.0951 0.85 4.38 8.18 Perlakuan 19 3.2503 0.1711 1.53tn 2.17 3.03 Galat 19 2.1220 0.1117
Total 39 5.4673
KK = 2.02%
Keterangan : tn = tidak nyata
∗ = nyata pada taraf α 5%
Lampiran 8. Data pH Larutan Setelah Hari ke-14
Kode Isolat pH 5 Total Rataan
I II
AP 1 7.49 7.41 14.90 7.45
AP 3 8.27 8.03 16.30 8.15
AP 4 8.98 8.18 17.16 8.58
AP 6 7.73 7.86 15.59 7.80
AP 7 8.18 7.94 16.12 8.06
AP 8 8.04 7.97 16.01 8.01
AP 9 7.79 8.38 16.17 8.09
AP 10 8.4 7.97 16.37 8.19
LK 1 8.58 8.48 17.06 8.53
LK 2 8.35 8.22 16.57 8.29
LK 3 8.07 7.99 16.06 8.03
LK 4 8.21 8.32 16.53 8.27
LK 6 8.73 8.71 17.44 8.72
LK 7 8.01 8.35 16.36 8.18
TSM 1 8.03 8.16 16.19 8.10
TSM 2 8.15 8.32 16.47 8.24
TSM 3 8.16 8.03 16.19 8.10
TSM 4 7.69 7.38 15.07 7.54
TSM 5 8.03 7.85 15.88 7.94
TSM 6 7.79 7.09 14.88 7.44
Total 162.68 160.64 323.32
Rataan 8.13 8.03 16.17
Lampiran 9. Sidik Ragam Data pH Larutan Setelah Hari ke-14
Sidik Ragam db JK KT Fh F.05 F.01
Blok 1 0.1040 0.1040 2.03 4.38 8.18
Perlakuan 19 4.4029 0.2317 4.51** 2.17 3.03
Galat 19 0.9755 0.0513
Total 39 5.4824
KK = 1.40%
Keterangan : tn = tidak nyata
∗ = nyata pada taraf α 5%
Lampiran 10. Data pH Larutan Setelah Hari ke-14
Kode Isolat pH 4.5 Total Rataan
I II
AP 1 5.52 5.60 11.12 5.56
AP 3 8.21 4.86 13.07 6.54
AP 4 8.48 7.83 16.31 8.16
AP 6 7.95 7.4 15.35 7.68
AP 7 7.55 7.36 14.91 7.46
AP 8 7.30 7.21 14.51 7.26
AP 9 7.45 5.51 12.96 6.48
AP 10 8.06 7.99 16.05 8.03
LK 1 8.30 7.90 16.20 8.10
LK 2 8.00 7.55 15.55 7.78
LK 3 8.09 7.75 15.84 7.92
LK 4 8.39 7.84 16.23 8.12
LK 6 8.29 8.09 16.38 8.19
LK 7 7.71 8.49 16.20 8.10
TSM 1 7.75 7.82 15.57 7.79
TSM 2 7.75 7.87 15.62 7.81
TSM 3 7.25 7.02 14.27 7.14
TSM 4 7.16 6.81 13.97 6.99
TSM 5 7.03 6.90 13.93 6.97
TSM 6 7.04 6.93 13.97 6.99
Total 153.28 144.73 298.01
Rataan 7.66 7.24 14.90
Lampiran 11. Sidik Ragam Data pH Larutan Setelah Hari ke-14
Sidik Ragam db JK KT Fh F.05 F.01
Blok 1 1.8276 1.8276 5.05 4.38 8.18
Perlakuan 19 18.8732 0.9933 2.74* 2.17 3.03
Galat 19 6.8821 0.3622
Total 39 27.5829
KK = 4.04%
Keterangan : tn = tidak nyata
∗ = nyata pada taraf α 5%
Lampiran 12. Data pH Larutan Setelah Hari ke-14
Kode Isolat pH 4 Total Rataan
I II
AP 1 4.18 6.49 10.67 5.34
AP 3 5.73 5.63 11.36 5.68
AP 4 6.01 6.00 12.01 6.01
AP 6 5.73 5.58 11.31 5.66
AP 7 6.08 6.37 12.45 6.23
AP 8 5.41 5.53 10.94 5.47
AP 9 4.60 4.37 8.97 4.49
AP 10 6.71 6.70 13.41 6.71
LK 1 6.62 6.52 13.14 6.57
LK 2 6.81 6.31 13.12 6.56
LK 3 5.75 5.78 11.53 5.77
LK 4 6.11 6.11 12.22 6.11
LK 6 7.23 7.1 14.33 7.17
LK 7 6.87 6.73 13.60 6.80
TSM 1 6.4 6.72 13.12 6.56
TSM 2 4.23 6.62 10.85 5.43
TSM 3 5.52 5.67 11.19 5.60
TSM 4 4.17 4.16 8.33 4.17
TSM 5 4.19 4.14 8.33 4.17
TSM 6 4.20 4.19 8.39 4.20
Total 112.55 116.72 229.27
Rataan 5.63 5.84 11.46
Lampiran 13. Sidik Ragam Data pH Larutan Setelah Hari ke-14
Sidik Ragam db JK KT Fh F.05 F.01
Blok 1 0.4347 0.4347 1.53 4.38 8.18 Perlakuan 19 31.7041 1.6686 5.88** 2.17 3.03 Galat 19 5.3939 0.2839
Total 39 37.5328
KK = 4.65%
Keterangan : tn = tidak nyata
∗ = nyata pada taraf α 5%
Lampiran 14. Data pH Larutan Setelah Hari ke-14
Kode Isolat pH 3.5 Total Rataan
I II
AP 1 3.65 4.48 8.13 4.07
AP 3 4.58 4.53 9.11 4.56
AP 4 5.82 4.68 10.50 5.25
AP 6 4.83 5.06 9.89 4.95
AP 7 4.82 4.45 9.27 4.64
AP 8 4.72 4.68 9.40 4.70
AP 9 5.13 4.71 9.84 4.92
AP 10 4.78 4.77 9.55 4.78
LK 1 5.08 4.65 9.73 4.87
LK 2 5.07 4.58 9.65 4.83
LK 3 5.96 4.63 10.59 5.30
LK 4 4.86 5.22 10.08 5.04
LK 6 5.67 5.49 11.16 5.58
LK 7 4.5 4.67 9.17 4.59
TSM 1 4.84 4.81 9.65 4.83
TSM 2 4.63 4.66 9.29 4.65
TSM 3 4.63 4.76 9.39 4.70
TSM 4 3.68 3.62 7.30 3.65
TSM 5 3.62 3.68 7.30 3.65
TSM 6 3.68 3.67 7.35 3.68
Total 94.55 91.80 186.35
Rataan 4.73 4.59 9.32
Lampiran 15. Sidik Ragam Data pH Larutan Setelah Hari ke-14
Sidik Ragam db JK KT Fh F.05 F.01
Blok 1 0.1891 0.1891 1.64 4.38 8.18 Perlakuan 19 10.7708 0.5669 4.91** 2.17 3.03
Galat 19 2.1958 0.1156
Total 39 13.1556
KK = 3.65%
Keterangan : tn = tidak nyata
∗ = nyata pada taraf α 5%
Lampiran 16. Data pH Larutan Setelah Hari ke-14 Kode Isolat
pH 3 Total
Rataan
I II
AP 1 4.49 4.47 8.96 4.48
AP 3 4.34 4.46 8.80 4.40
AP 4 4.18 4.15 8.33 4.17
AP 6 4.27 4.14 8.41 4.21
AP 7 4.43 4.16 8.59 4.30
AP 8 3.22 4.2 7.42 3.71
AP 9 4.42 4.03 8.45 4.23
AP 10 4.32 4.17 8.49 4.25
LK 1 3.98 4.05 8.03 4.02
LK 2 4.08 3.96 8.04 4.02
LK 3 4.17 4.08 8.25 4.13
LK 4 4.08 4.18 8.26 4.13
LK 6 4.54 4.08 8.62 4.31
LK 7 4.36 4.15 8.51 4.26
TSM 1 4.31 4.21 8.52 4.26
TSM 2 4.49 4.29 8.78 4.39
TSM 3 4.26 4.25 8.51 4.26
TSM 4 3.18 3.48 6.66 3.33
TSM 5 3.22 3.18 6.40 3.20
TSM 6 3.17 3.16 6.33 3.17
Total 81.51 80.85 162.36
Rataan 4.08 4.04 8.12
Lampiran 17. Sidik Ragam Data pH Larutan Setelah Hari ke-14
Sidik Ragam db JK KT Fh F.05 F.01
Blok 1 0.0109 0.0109 0.25 4.38 8.18 Perlakuan 19 5.8739 0.3092 7.10** 2.17 3.03 Galat 19 0.8268 0.0435
Total 39 6.7116
KK = 2.57 %
Keterangan : tn = tidak nyata
∗ = nyata pada taraf α 5%
Lampiran 18. Data pH Larutan Setelah Hari ke-14
Kode Isolat pH 2.5 Total Rataan
I II
AP 1 3.92 3.93 7.85 3.93
AP 3 4.00 3.92 7.92 3.96
AP 4 4.13 4.02 8.15 4.08
AP 6 4.02 4.12 8.14 4.07
AP 7 2.85 2.81 5.66 2.83
AP 8 3.88 3.9 7.78 3.89
AP 9 3.99 3.96 7.95 3.98
AP 10 3.92 3.87 7.79 3.90
LK 1 3.75 3.92 7.67 3.84
LK 2 4.31 4.7 9.01 4.51
LK 3 4.01 3.78 7.79 3.90
LK 4 3.91 4.01 7.92 3.96
LK 6 3.95 3.9 7.85 3.93
LK 7 4.02 3.94 7.96 3.98
TSM 1 5.48 5.9 11.38 5.69
TSM 2 5.65 6.03 11.68 5.84
TSM 3 5.82 4.04 9.86 4.93
TSM 4 2.84 2.81 5.65 2.83
TSM 5 2.86 2.87 5.73 2.87
TSM 6 2.88 2.88 5.76 2.88
Total 80.19 79.31 159.50
Rataan 4.01 3.97 7.98
Lampiran 19. Sidik Ragam Data pH Larutan Setelah Hari ke-14
Sidik Ragam db JK KT Fh F.05 F.01
Blok 1 0.0194 0.0194 0.20 4.38 8.18
Perlakuan 19 25.4760 1.3408 13.63** 2.17 3.03
Galat 19 1.8691 0.0984
Total 39 27.3646
KK = 3.93%
Keterangan : tn = tidak nyata
∗ = nyata pada taraf α 5%
DAFTAR PUSTAKA
Alexander, M. 1977. Introduction to Soil Microbiology.2nded. John Willey & Son. New York.
Arisandi P. 2002. Limbah Pabrik KertasAncam Kesehatan Warga Surabaya. www.ecoton.or.id
Balai Penelitian Tanah, 2010. Tata Air untuk PertanamanPadi pada Tanah Sulfat Masam. Balai Besar Sumber Daya Lahan Pertanian, Departemen Pertanian.
Castro, H.F, N.H. Williams, A. Ogram. 2000. Phylogeny of Sulfate Reducing Bacteria. Microbiol Ecolog 31 :1-9.
Cypionka, H., F. Widdel, N. Pfenning. 1985. Survival of sulfate-reducing bacteria after oxygen stress, and growth in sulfate-free oxygen sulfide gradients. FEMS Microbiology and Ecology 31 : 39-45.
Doshi, S.M. 2006. Bioremediation of Acid Mine Drainage Using Sulfate Reducing Bacteria. National Network of Environmental Management Studies Fellow.
FAO, 2001. A Practical Manual Of Soil Microbiology Laboratory Methods. Soil Buletin.
Hanafiah, A.S, T. Sabrina, H. Guchi. 2009. Ekologi dan Biologi Tanah. USU Press. Medan.
Hards, B.C. and J.P. Higgins. 2004. Bioremediation of Acid Rock Drainage Using SRB. Jacques Whit Environment Limited. Ontario.
Icgen, B and S. Harrison. 2006. Identification of population dynamics in sulfate reducing consortia on exposure to sulfate. Research on Microbiology 157 : 922-927.
Khusna, H. 2012. Analisis Kandungan Kimia Dan PemanfaatanSludge Industri Kertas Sebagai Bahan PembuatanBatako. Skripsi. UNS. Semarang.
Koschorreck, M. 2008. Microbial sulphate reduction at a low pH. FEMS Microbiol Ecol 64 : 329–342.
Munir, E. 2006. Pemanfaatan Mikroba Dalam Bioremediasi : Suatu Teknologi Alternatif Untuk Pelestarian Lingkungan. Pidato Pengukuhan Guru Besar Tetap Dalam Bidang Mikrobiologi. USU e-Repository.
Muyzer, G and A.J.M. Stams. 2008. The Ecology and Biotechnology of Sulphate Reducing Bacteria. Microbiol 6 : 441-446.
Noor, M. 2004. Lahan Rawa : Sifat dan Pengelolaan Tanah Bermasalah Sulfat Masam. Raja Grafindo Persada. 241 hal
Sinha R. K, D. Valani, S. Sinha, S. Sing, S. Herat. 2009. Bioremediation Of Contaminated Sites: ALow-Cost Nature’s Biotechnology For Environmental Clean Up By Versatile Microbes, Plants & Earthworms. Suastika, I. W, W. Hartatik, dan I. G. M. Subiksa. 2008. Karakteristik dan
Teknologi Pengelolaan Lahan Sulfat Masam Mendukung Pertanian Ramah Lingkungan. Balai Penelitian dan Pengembangan Tanah.
Subiksa, I. G. M dan D. Setyorini. 2008. Pemanfaatan Fosfat Alam Untuk LahanSulfat Masam. Balai Penelitian dan Pengembangan Pertanian, Departemen Pertanian.
Suhartanti, D. 2004. Isolasi dan Identifikasi Bakteri Pereduksi Sulfat Dari Kawasan PLTP Kamojang Jawa Barat. Jurnal.unimus.ac.id
Suriadikarta, D. A. 2005. Pengelolaan Lahan Sulfat Masam Untuk Usaha Pertanian. Jurnal Litbang Pertanian 24(1).
Taroreh, F.L. F. F. Karwur, C. Jubhar, Mangimbulude. 2015. Reduksi Sulfat oleh Bakteri Termofilikdari Air Panas Sarongsong Kota Tomohon. Prosiding Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia.
Postgate, J.R. 1984. The Sulphate Reducing Bacteria. 2nd ed. Cambridge University Press. New York.
Widyati, E., I. Mansyur, C. Kusmana, I. Anas, E. Santoso. 2005. Pemanfaatan Sludge Industri Kertas sebagai Agen Pembenah Tanah pada Lahan Bekas Tambang Batubara. Litbang Hutan. I(2) :57-64.
Widyati, E. 2006. Bioremediasi Tanah Bekas tambang Batubara dengan Sludge Industri Kertas untuk Memacu Revegetasi Lahan. Disertasi. IPB. Bogor. Widyati, E. 2007. Pemanfaatan Bakteri Pereduksi Sulfat untuk Bioremediasi
Tanah Bekas Tambang Batubara. BIODIVERSITAS 8 (3): 283-286.
METODE PENELITIAN
Tempat dan Waktu
Pengambilan sampel yang digunakan sebagai sumber BPS diambil dari tiga lokasi yaitu dari air panas belerang Lau Sidebuk-debuk di Brastagi, limbah kertas dari Toba Pulp Lestari (TPL) di Porsea, tanah sulfat masam yang sudah teroksidasi dari PT. Napoli Raya di Aceh Tamiang. Untuk isolasi dan uji potensi dilakukan di Laboratorium Biologi Tanah dan Laboratorium Penyakit Tanaman Fakultas Pertanian, Universitas Sumatera Utara. Penelitian ini dilaksanakan pada bulan Februari 2016 sampai dengan September 2016.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah limbah sludge kertas, air belerang Lau Sidebuk-debuk, tanah sulfat masam yang sudah teroksidasi sebagai sumber bakteri yang akan diisolasi, media Postgate E (Postgate, 1984) yang terdiri atas (g/L) : KH2PO4(0.5) ; NH4Cl (1.0) ; Na2SO4 (1.0) ; CaCl2.6H2O (1.0) ; MgCl2.7H2O (2.0) ; Yeast extract (1.0) ; Ascorbic acid (1.0) ; FeSO4.7H2O(0.5) ; Agar (18.0) ; Sodium lactate (8 ml) ; Thioglycollic acid (0.76 ml) untuk pertumbuhan BPS, kit anaerob sebagai sumber CO2 BPS, label sebagai penanda tiap sampel, plastik sampel untuk tempat sampel, serta bahan –bahan lain yang mendukung penelitian.
Metode Penelitian
Penelitian ini terdiri dari tiga tahap yaitu 1) persiapan penelitian, 2) isolasi bakteri pereduksi sulfat dan 3) uji potensi pada media Postgate cair (pH dan perubahan warna).
Persiapan Penelitian
Pengambilan Sampel Sebagai Sumber Isolat Bakteri Pereduksi Sulfat
Sampel yang berasal dari air panas belerang Lau Sidebuk-debuk diambil dari dua titik aliran. Sampeldimasukkan ke dalam termos dan diberi label untuk mempertahankan suhu tetap stabil dan menjaga kondisi sampel bakteri hingga dibawa ke laboratorium. Setiap sampel harus diisi penuhuntuk meminimalkan udara. Tabel 3 dibawah menyajikan kondisi sampel BPS asal air panas belerang. Tabel 3. Kondisi pengambilan sampel isolat bakteri pereduksi sulfat asal air panas
belerang
Sampel Bakteri Pereduksi Sulfat Asal Air Panas Sumber Lokasi Kondisi Sampel
Titik 1 Anaerob
Titik 2 Anaerob
Sampel yang berasal dari limbah kertas tiga kolam saluran pengolahan. Sampel dimasukkan ke dalam botol, ditutup rapat dan diberi label, kemudian disimpan dalam kotak es untuk mempertahankan kondisi sampel bakteri hingga dibawa ke laboratorium. Tabel 4 dibawah menyajikan kondisi sampel BPS asal limbah kertas.
Tabel 4. Kondisi pengambilan sampel isolat bakteri pereduksi sulfat asal limbah kertas
Sampel Bakteri Pereduksi Sulfat Asal Limbah Kertas
Sumber Lokasi Kondisi Kolam
Kolam Pengolahan 1 Anaerob
Kolam Pengolahan 2 Anaerob
Sampel yang berasal dari tanah sulfat masam yang sudah teroksidasi diambil dari sepuluh titik sampel dimana masing-masing sampel yang diambil dibedakan berdasarkan kedalaman pengambilan (0-20 ;> 20) dan kedalaman pyrit (0-40 ;40-60), diberi label dan dimasukkan ke dalam plastik sampel, kemudian disimpan dalam kotak es untuk mempertahankan kondisi sampel bakteri hingga dibawa ke laboratorium. Tabel 5 dibawah menyajikan kondisi sampel BPS asal tanah sulfat masam.
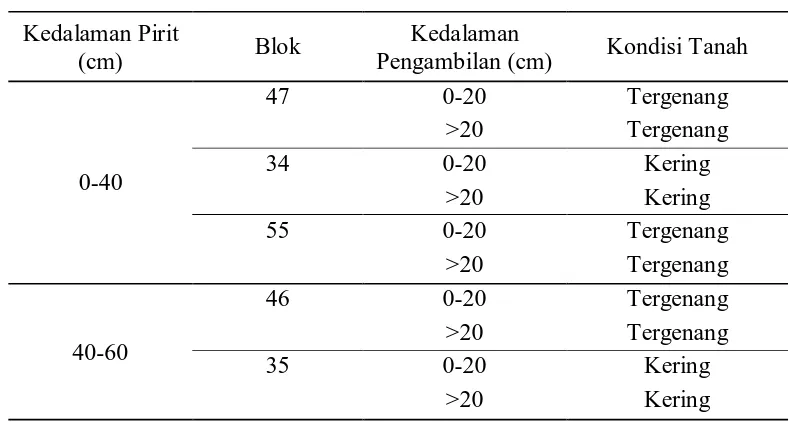
Tabel 5. Kondisi pengambilan sampel isolat bakteri pereduksi sulfat asal tanah sulfat masam
Bakteri Pereduksi Sulfat Asal Tanah Sulfat Masam Kedalaman Pirit
(cm) Blok
Kedalaman
Pengambilan (cm) Kondisi Tanah
0-40
47 0-20 Tergenang
>20 Tergenang
34 0-20 Kering
>20 Kering
55 0-20 Tergenang
>20 Tergenang
40-60
46 0-20 Tergenang
>20 Tergenang
35 0-20 Kering
>20 Kering
Sampel tanah sebagian dibawa ke laboratorium untuk dilakukan analisis awal berupa pH sebagai data pendukung.
Isolasi Bakteri Pereduksi Sulfat dari Berbagai Sumber
a. Persiapan Media Postgate
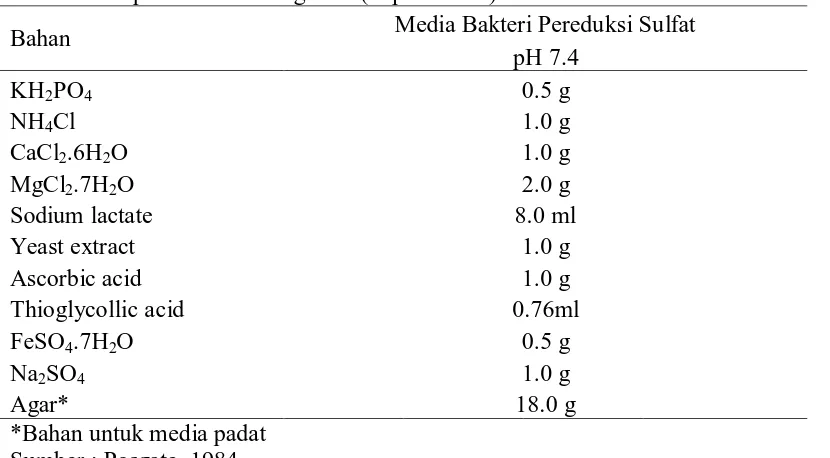
Tabel 6. Komposisi media Posgate E (tiap 1000 ml)
Bahan Media Bakteri Pereduksi Sulfat pH 7.4
KH2PO4 0.5 g
NH4Cl 1.0 g
CaCl2.6H2O 1.0 g
MgCl2.7H2O 2.0 g
Sodium lactate 8.0 ml
Yeast extract 1.0 g
Ascorbic acid 1.0 g
Thioglycollic acid 0.76ml
FeSO4.7H2O 0.5 g
Na2SO4 1.0 g
Agar* 18.0 g
*Bahan untuk media padat Sumber : Posgate, 1984
Bahan kimia tersebut dimasukkan ke dalam aquades 500 ml, diaduk hingga homogen dan dijadikan 1 l. Sebelum diautoklaf media sudahditetapkan pHnya terlebih dahulu yaitu 7.4, kemudian media disterilkan dengan autoklaf selama 15 menit pada suhu 1210C.
b. Penanganan Sampel Bakteri Pereduksi Sulfat
Uji kualitatif dilakukan dengan dua metode yaitu jika sampel dalam bentuk padatan dalam hal ini tanah maka, ditimbang 2 g tanah, dimasukkan ke dalam botol steril yang berukuran 10-20 ml, dipenuhkan dengan medium Posgate steril dan ditutup rapat. Kemudian diinkubasi pada suhu 350C sedangkan jika sampel dalam bentuk cairan dalam hal ini air panas belerang dan limbah kertas maka dipipet 2 ml cairan, dimasukkan ke dalam botol steril yang berukuran 10-20 ml, dipenuhkan dengan medium Posgate steril dan ditutup rapat. Kemudian masing-masing sampel diinkubasi pada suhu yang sama dengan sampel tanah. Maka, dalam waktu 5-6 hari sampel akan menunjukkan perubahan warna. Sampel yang mengalami perubahan warna, dilanjutkan ke uji kuantitatif. Uji kualitatif tersebut selain untuk media uji juga digunakan untuk media kultur selanjutnya.
BPS yang mengalami perubahan warna ditumbuhkan kembali ke dalam media pengayaan untuk dilakukan uji kuantitatif. Uji kuantitatif dilakukan dengan cara menyiapkan seri pengenceran yaitu dipipet 1 ml BPS dari medium pengayaanke dalam 9 ml larutan fisiologis setril (0.85% NaCl)kemudian divortex dan diambil kembali 1 ml dari larutan sebelumnya sampai seri pengenceran 10-8. Kemudian seri pengenceran terakhir sebanyak 1 ml dimasukkan dalam testube steril dan dituang dengan media posgate padat yang telah hangat tangan sebanyak 6 ml dan diinkubasi pada suhu 350C selama 5-6 hari. Maka media Posgate padat akan mengalami perubahan hingga ke dasar tabung. Isolat BPS dari masing-masing sumber yang telah terpilih akan dilanjutkan ke tahap isolasi.
c. Isolasi dan Purifikasi Bakteri Pereduksi Sulfat dari Berbagai Sumber
agar dengan cara dimasukkan jarum ose ke dalam testube dan digoreskan ke permukaan media Posgate padat dengan teknik zig-zag, dimana agar sudah terlebih dahulu dituang dan memadat. Petridish kembali ditutup dan diinkubasi dalam anaero jar yang berisi kit anaerob selama 5-6 hari, maka akan tampak koloni hitam yang tumbuh di dasar petridish.
Koloni tersebut kemudian dimurnikan dengan cara dipindahkan ke tabung reaksi yang berisi media posgate padat sesuai dengan isolat masing-masing dan diberi label. Koloni yang sudah berhasil dimurnikan, siap untuk dilanjutkan ke tahap uji potensi.
Uji Potensi Bakteri Pereduksi Sulfat Pada Media Postgate Cair
Parameter Pengamatan
Perubahan Warna Media
Pengamatan perubahan warna media menjadi hitam dilakukan pada akhir masa inkubasi (14 hari) yaitu secara kualitatif.
pH Larutan
HASIL DAN P+EMBAHASAN
Isolasi Bakteri Pereduksi Sulfat dari Berbagai Sumber
Uji Kualitatif Bakteri Pereduksi Sulfat
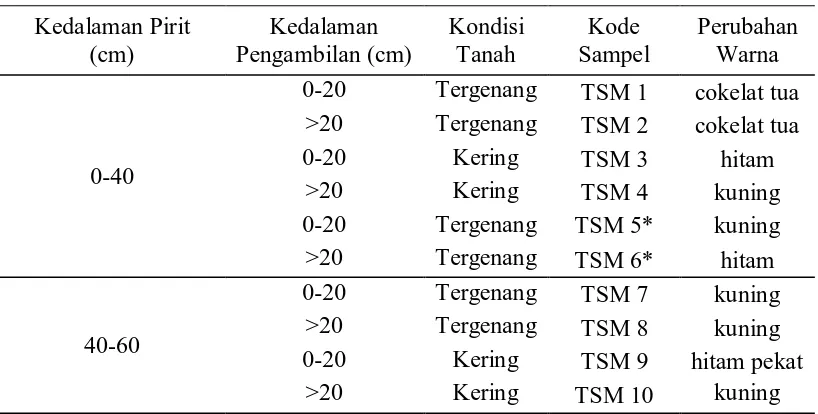
Uji kualitatif berguna untuk menseleksi isolat unggul yang tercepat tumbuhnya yang tampak dari perubahan warna media cair setelah 5-6 hari diinkubasi yang disajikan pada tabel berikut.Dari tanah sulfat masam terdapat 10 sampel bakteri pereduksi sulfat dan telah diuji kualitatifnya. Tabel 7 dibawah menyajikan hasil uji kualitatif BPS dari tanah sulfat masam.
Tabel 7. Uji kualitatif isolat bakteri pereduksi sulfat dari tanah sulfat masam Bakteri Pereduksi Sulfat Asal Tanah Sulfat Masam
Kedalaman Pirit (cm) Kedalaman Pengambilan (cm) Kondisi Tanah Kode Sampel Perubahan Warna 0-40
0-20 Tergenang TSM 1 cokelat tua >20 Tergenang TSM 2 cokelat tua 0-20 Kering TSM 3 hitam
>20 Kering TSM 4 kuning 0-20 Tergenang TSM 5* kuning >20 Tergenang TSM 6* hitam
40-60
0-20 Tergenang TSM 7 kuning >20 Tergenang TSM 8 kuning 0-20 Kering TSM 9 hitam pekat
>20 Kering TSM 10 kuning Ket : TSM (Tanah Sulfat Masam)
Hal ini sangat dipengaruhi oleh kondisi lingkungan, kemasaman lingkungan, kedalaman sedimen, ketersediaan energi dari bahan organikdan kandungan sulfat. Gambar 1 dan 2 dibawah menyajikan perubahan warna hasil uji kualitatif dari tanah sulfat masam.
Gbr 1. Tidak ada indikasi perubahan warna dari beberapa isolat TSM (TSM1, TSM2, TSM4, TSM5, TSM7, TSM8, TSM10)
Gbr 2. Adaindikasi perubahan warna dari beberapa isolat TSM (TSM3, TSM6, TSM9)
Dari Gambar 1 dan 2 diketahui bahwa ada perbedaan sepuluh sampel TSM yang telah diuji kualitatifnya. Tampak bahwa warna hitam pekat pada isolat TSM3, TSM6 dan TSM9 mengindikasikan adanya aktivitas BPS sedangkan isolat lainnya tidak.
kuning menjadi hitam pekat. Tabel 8 dibawah menyajikan uji kualitatif BPS dari limbah kertas.
Tabel 8. Uji kualitatif isolat bakteri pereduksi sulfat dari limbah kertas Sampel Bakteri Pereduksi Sulfat Asal Limbah Kertas
Sumber Lokasi Kondisi Kolam Kode Sampel Perubahan Warna Kolam Pengolahan 1 Anaerob LK 1 hitam pekat Kolam Pengolahan 2 Anaerob LK 2 hitam pekat Kolam Pengolahan 3 Anaerob LK 3 hitam pekat Ket : LK (Limbah Kertas)
Dari Tabel 8 diketahui bahwa semua isolat limbah kertas mengalami kecepatan pertumbuhan yang sama. Pertumbuhan BPS diindikasikan dengan perubahan warna. Perubahan warna isolat limbah kertas yaitu hitam pekat. Hasil penelitian Widyati (2007) menyatakan bahwa isolat BPS yang digunakan merupakan hasil seleksi berdasarkan kecepatan tumbuhnya yaitu berdasarkan banyaknya kepekatan endapan yang terbentuk. Gambar 3 dibawah menyajikan perubahan warna hasil uji kualitatif dari limbah kertas.
Gbr 3. Ada indikasi perubahan warna dari isolat LK
Dari air panas belerang didapatkan 2 sampel bakteri pereduksi sulfat yang telah diuji kualitatifnya. Tampak bahwa setiap sampel mengalami perubahan warna. Tabel 9 dibawah menyajikan uji kualitatif BPS dari air panas belerang. Tabel 9. Uji kualitatif isolat bakteri pereduksi sulfat dari air panas belerang
Sampel Bakteri Pereduksi Sulfat Asal Air Panas Belerang
Sumber Lokasi Kode Sampel Kode Sampel Perubahan Warna
Titik 1 Anaerob AP 1 hitam pekat
Titik 2 Anaerob AP2 hitam pekat
Ket : AP (Air Panas)
Dari Tabel 9 diketahui bahwa kedua sampel isolat dari air panas belerang mengalami perubahan warna menjadi hitam pekat. Perubahan warna hitam pekat merupakan indikator adanya aktivitas BPS (terbentuknya sulfida). Semakin pekat hitamnya, semakin berpotensi bakteri pereduksi sulfat. Hal ini sesuai dengan penelitian Widyati (2007) yang menyatakan isolat BPS yang digunakan merupakan hasil seleksi berdasarkan kecepatan tumbuhnya yaitu berdasarkan banyaknya kepekatan endapan yang terbentuk. Gambar 4 dibawah menyajikan perubahan warna hasil uji kualitatif dari air panas belerang.
Gbr 4. Ada indikasi perubahan warna dari isolat AP
Uji Kuantitatif Bakteri Pereduksi Sulfat
Uji kuantitatif merupakan uji pada media padat Posgate yang bertujuan untuk mengetahui jumlah populasi bakteri pereduksi sulfat dari setiap sumber isolat dengan melihat langsung secara visual perubahan warna media padat pada setiap tabung.
Dari setiap isolat tanah sulfat masam didapati bahwa setiap isolat mempunyai perbedaan kelimpahan populasi bakteri. Perbedaan tersebut diduga karena adanya perbedaan pada kedalaman pyrit, kedalaman pengambilan sampel dan kondisi tanah (Tabel 7). Isolat tanah sulfat masam tersebut yaitu TSM3 104, TSM6 106, TSM9 107. Tabel 10 dibawah menyajikan uji kuantitatif isolat dari tanah sulfat masam.
Tabel 10. Uji kuantitatif isolat bakteri pereduksi sulfat dari tanah sulfat masam Jumlah
Pengenceran
Isolat
TSM3 TSM6 TSM9
10-1 Hitam Pekat Hitam Pekat Hitam Pekat 10-2 Hitam Pekat Hitam Pekat Hitam Pekat 10-3 Hitam Pekat Hitam Pekat Hitam Pekat 10-4 Hitam Sedikit Hitam Pekat Hitam Pekat
10-5 tt Hitam Pekat Hitam Pekat
10-6 tt Hitam Pekat Hitam Sedikit
10-7 tt tt Hitam Sedikit
10-8 tt tt tt
Ket : tt (tidak tumbuh)
beberapa bakteri yang dapat bertahan hidup pada keadaan oksik tetapi tidak dalam jangka waktu yang lama.
Isolat TSM9 merupakan isolat yang jumlah populasinya tertinggi yaitu 107 kemudian diikuti isolat TSM6 106 dan terendah isolat TSM3 104. Isolat TSM9 dan TSM3 memiliki beberapa hal yang sama yaitu kondisi tanah yang kering dan kedalaman pengambilan contoh tetapi kedalaman pirit (FeS2) berbeda.Isolat TSM9 diambil pada kedalam pirit 40-60 cm. Noor (2004) menyatakan bahwa kedalaman pirit 50-100 cm termasuk aluvial bersulfida dalam. Kedalaman pirit tersebut merupakan habitat yang menguntungkan bagi bakteri tersebut karena bakteri pereduksi sulfat membutuhkan kondisi anoksik bahkan anoksik ekstrim untuk dapat hidup. Semakin dalam pirit maka semakin tinggi kandungan sulfat yang terkandungdalamnya. Hal ini diperkuat oleh pernyataan Jorgensen (1982) dalam Yusron et al., (2009) melaporkan bahwa jumlah dan aktivitas bakteri
pereduksi sulfat meningkat dengan ketebalan lapisan sedimen. Lebih lanjut Icgen dan Harrison (2006) juga menyatakan bahwa keragaman bakteri pereduksi
sulfat sangat dipengaruhi oleh beberapa hal salah satunya adalah kandungan sulfat.
5dibawah menyajikan perubahan warna uji kuantitatif isolat bakteri pereduksi dari tanah sulfat masam.
Gbr 5. Perubahan warna uji kuantitatif isolat tanah sulfat masam (TSM3, TSM6, TSM9)
Dari Gambar 5 dapat dilihat secara bertahap perbedaan warna di testube dari setiap pengenceran 10-1 sampai 10-8. Tampak bahwa semakin tinggi pengenceran, semakin berkurang warna hitam yang menandakan mulai berkurangnya populasi BPS pada setiap isolat. Tetapi jika dilihat sampai batasan pengenceran 10-6 , isolat TSM6 merupakan isolat yang bertahan.
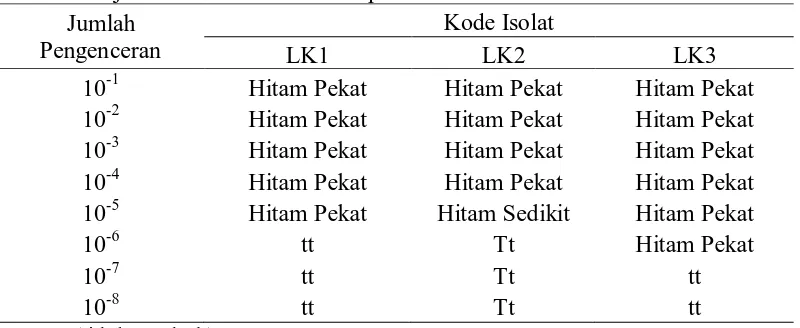
Tabel 11. Uji kuantitatif isolat bakteri pereduksi sulfat dari limbah kertas Jumlah
Pengenceran
Kode Isolat
LK1 LK2 LK3
10-1 Hitam Pekat Hitam Pekat Hitam Pekat 10-2 Hitam Pekat Hitam Pekat Hitam Pekat 10-3 Hitam Pekat Hitam Pekat Hitam Pekat 10-4 Hitam Pekat Hitam Pekat Hitam Pekat 10-5 Hitam Pekat Hitam Sedikit Hitam Pekat
10-6 tt Tt Hitam Pekat
10-7 tt Tt tt
10-8 tt Tt tt
Ket : tt (tidak tumbuh)
Telah disebutkan bahwa BPS dari kolam 3 mempunyai populasi yang tertinggisedangkan populasi pada kolam 1 dan kolam 2 rendah. Kolam pengolahan limbah sludge kertas PT. Toba Pulp mempunyai 3 kolam yang diolah secara anaerob dimana masing-masing kolam tersebut mempunyai temperatur yang berbeda. Pada kolam pengolahan 1 didapati bahwa suhu pengolahan masih sangat tinggi sehingga kurang sesuai untuk pertumbuhan BPS meskipun beberapa ditemukan. Pada kolam pengolahan 2 temperaturnya masih juga tinggi tetapi sudah mengalami penurunan sedangkan pada kolam pengolahan 3 didapati bahwa temperatur pengolahan sudah menurun dan sesuai untuk pertumbuhan BPS.Yani (2005) menyatakan bahwa salah satu parameter yang harus dijaga dalam pengolahan limbah sludge secara biologi adalah temperatur. Temperatur yang optimal untuk pertumbuhan bakteri adalah 360C -380C.
kondisi ekosistem tersebut.Gambar 6 dibawah menyajikan perubahan warna uji kuantitatif isolat bakteri pereduksi sulfat dari limbah kertas.
Gbr 6. Perubahan warna uji kuantitatif isolat limbah kertas (LK1, LK2, LK3)
Dari Gambar 6 dapat dilihat secara bertahap perbedaan warna di testube dari setiap pengenceran 10-1 sampai 10-8. Tampak bahwa semakin tinggi pengenceran, semakin berkurang warna hitam yang menandakan mulai berkurangnya populasi BPS pada setiap isolat. Tetapi jika dilihat sampai batasan pengenceran 10-6 , isolat LK3 merupakan isolat yang mempunyai jumlah populasi yang tinggi.
Tabel 12. Uji kuantitatif isolat bakteri pereduksi sulfat dari air panas belerang Jumlah Pengenceran Kode Isolat
AP1 AP2
10-1 Hitam Pekat Hitam Pekat
10-2 Hitam Pekat Hitam Pekat
10-3 Hitam Pekat Hitam Pekat
10-4 Hitam Pekat Hitam Pekat
10-5 Hitam Sedikit Hitam Sedikit 10-6 Hitam Sedikit Hitam Sedikit
10-7 tt tt
10-8 tt tt
Ket : tt (tidak tumbuh)
Dari Tabel 12 diketahui bahwa isolat yang berasal dari air panas belerang hanya mencapai 106 baik dari titik pengambilan pertama maupun titik kedua. Isolat pertama (AP1) langsung diambil dari mata air panas belerang sedangkan isolat kedua (AP2) diambil dari ujung aliran mata air panas belerang. Keragaman karakteristik bakteri pereduksi sulfat sangat dipengaruhi oleh kondisi lingkungan, kemasaman lingkungan, kedalaman sedimen, ketersediaan energi dari bahan organik dan kandungan sulfat.
Gbr 7. Perubahan warna uji kuantitatif isolat air panas belerang (AP1 dan AP2)
Dari Gambar 7 dapat dilihat secara bertahap perbedaan warna di testube dari setiap pengenceran 10-1 sampai 10-8. Tampak bahwa semakin tinggi pengenceran, semakin berkurang warna hitam yang menandakan mulai berkurangnya populasi BPS pada setiap isolat. Tetapi jika dilihat sampai batasan pengenceran 10-6 , kedua isolat mempunyai jumlah populasi yang sama.
Isolasi dan Purifikasi Bakteri Pereduksi Sulfat
dibawah menyajikan kondisi isolat dalam anaero jar dan pertumbuhan isolat dalam petridish.
Gbr 7. Kondisi isolat dalam anaero jar dan pertumbuhan isolat dalam petridish
Dari Gambar 7 dapat diketahui bahwa pertumbuhan koloni BPS berwarna hitam yang disebabkan reaksi dari reduksi sulfat yang digunakan sebagai aktivitas metaboliknya, koloni BPS juga tumbuh didasar cawan (pada bawah agar) karena BPS merupakan bakteri anaerob yang suka kondisi anoksik.
Dari keseluruhan isolat BPS baik dari tanah sulfat masam, limbah kertas maupun air panas belerang diperoleh 23 isolat BPS murni yaitu mencakup tanah sulfat masam sebanyak 6 isolat, limbah kertas sebanyak 7 isolat dan air panas belerang sebanyak 10 isolat.
BPS dapat bertahan hidup pada keadaan oksik tetapi tidak dalam jangka waktu yang lama. Cypionka et al., (1985) menyatakan bahwa bakteri pereduksi sulfat hanya mampu tumbuh dengan baik pada kondisi oksik selama tidak lebih dari 24 jam, setelah itu pertumbuhannya akan turun drastis. Sehingga isolat TSM6 tetap bertahan dan dilanjutkan ke purifikasi. Gambar 8 dibawah menyajikan isolat BPS dari tanah sulfat masam yang telah dipurifikasi.
Gbr 8. Isolat BPS dari tanah sulfat masam
Dari Gambar 8 diperoleh isolat murni BPS dari tanah sulfat masam sebanyak 6 isolat dimana telah disebutkan diatas bahwa isolat murni diperoleh dari TSM6. Masing-masing isolat murni diberi nama TSM1, TSM2, TSM3, TSM4, TSM5 dan TSM6.
memerlukan suhu inkubasi adalah suhu ruangan. Doshi (2006) menyatakan bahwa substrat, temperatur dan pH juga dapat menghambat pertumbuhan BPS.
Isolat LK2 dengan isolat LK3 mempunyai kesamaan dalam hal perubahan warna media dan kelimpahan jumlah populasi (Tabel 8), tetapi LK3 tidak dapat dilanjutkan ke tahap isolasi diduga karenaisolat mempunyai kemampuan mereduksi sulfat yang rendah dan kehilangan kemampuan bertahan ketika dilakukan beberapa kali pengkulturan dalam jangka waktu yang lama. Gambar 9 dibawah menyajikan isolat BPS dari limbah kertas yang telah dipurifikasi.
Gbr 9. Isolat BPS dari limbah kertas
Dari Gambar 9 diperoleh isolat murni BPS dari limbah kertas sebanyak 7 isolat dimana telah disebutkan diatas bahwa isolat murni diperoleh dari LK2. Masing-masing isolat murni diberi nama LK1, LK2, LK3, LK4, LK5, LK6 dan LK7.Tetapi ketika dilakukan purifikasi untuk dilanjutkan ke uji potensi satu isolat murni dari LK yaitu LK 5 mengalami kehilangan kemampuan mereduksi sehingga tidak dapat digunakan untuk uji potensi.
dengan isolat AP2 seperti pada isolat LK3, diduga karena isolat mempunyai kemampuan mereduksi sulfat yang rendah dan kehilangan kemampuan bertahan ketika dilakukan beberapa kali pengkulturan dalam jangka waktu yang lama. Gambar 10 dibawah menyajikan isolat BPS dari limbah kertas yang telah dipurifikasi.
Gbr 10. Isolat BPS dari air panas belerang
Dari Gambar 10 diperoleh isolat murni BPS dari air panas belerang sebanyak 10 isolat dimana telah disebutkan diatas bahwa isolat murni diperoleh dari AP1. Masing-masing isolat murni diberi nama AP1, AP2, AP3, AP4, AP5, AP6, AP7, AP8, AP9 dan AP10. Tetapi ketika dilakukan purifikasi untuk dilanjutkan ke uji potensi dua isolat murni dari AP yaitu AP2 dan AP5 mengalami kehilangan kemampuan mereduksi sehingga tidak dapat digunakan untuk uji potensi.
menguntungkan. 2) kehadiran bakteri lain dapat mengubah dan menghambat pertumbuhan bakteri pereduksi sulfat.
Uji Potensi Bakteri Pereduksi Sulfat dari Berbagai Sumber
a. Secara Kualitatif
[image:40.595.116.532.330.681.2]Untuk mengetahui kemampuan dari tiap-tiap isolat murni maka perlu dilakukan uji potensi pada media cair Posgate yang telah diatur dengan berbagai pH. Tabel 13 dibawah menyajikan hasil perubahan pH dari berbagai sumber bakteri pereduksi sulfat setelah 14 hari inkuba si.
Tabel 13. Perubahan pH dari berbagai sumber bakteri pereduksi sulfat setelah 14 hari inkubasi
Kode Isolat
pH
pH 5.5 pH 5 pH 4.5 pH 4 pH 3.5 pH 3 pH 2.5 AP 1 8.11 7.45 f 5.56 5.34def 4.07cd 4.48a 3.93c AP 3 8.30 8.15 bcd 6.54 5.68bcde 4.56bc 4.4a 3.96c AP 4 8.67 8.58 ab 8.16 6.01abcd 5.25ab 4.17ab 4.08c AP 6 8.35 7.795 def 7.68 5.66bcde 4.95ab 4.21a 4.07c AP 7 8.48 8.06 bcde 7.46 6.23abcd 4.64bc 4.30a 2.83d AP 8 8.15 8.01 cde 7.26 5.47cde 4.7bc 3.71bc 3.89c AP 9 8.38 8.09 bcd 6.48 4.49ef 4.92ab 4.23a 3.98c AP 10 8.38 8.19abcd 8.03 6.71abc 4.78abc 4.25a 3.90c LK 1 8.66 8.53abc 8.10 6.57abcd 4.87abc 4.02ab 3.84c LK 2 7.94 8.29abcd 7.78 6.56abcd 4.83abc 4.02ab 4.51bc LK 3 7.94 8.03bcde 7.92 5.77bcd 5.30ab 4.13ab 3.9c LK 4 8.31 8.27abcd 8.12 6.11abcd 5.04ab 4.13ab 3.96c LK 6 8.74 8.72a 8.19 7.17a 5.58a 4.31a 3.93c LK 7 8.24 8.18abcd 8.10 6.8ab 4.59bc 4.26a 3.98c TSM 1 8.39 8.10bcd 7.79 6.56abcd 4.83abc 4.26a 5.69a TSM 2 8.48 8.24abcd 7.81 5.43cde 4.65bc 4.39a 5.84a TSM 3 8.32 8.10bcd 7.14 5.60bcde 4.70bc 4.26a 4.93b TSM 4 8.31 7.54ef 6.99 4.17f 3.65d 3.33cd 2.83d TSM 5 7.51 7.94def 6.97 4.17f 3.65d 3.2d 2.87d TSM 6 7.93 7.44f 6.99 4.20f 3.68d 3.17d 2.88d Ket : Angka yang diikuti dengan huruf yang sama menunjukkan tidak berbeda nyata
Dari Tabel 13 dapat diketahui bahwa hampir keseluruhan isolat BPS baik dari tanah sulfat masam, limbah kertas, maupun air panas belerang mampu meningkatkan berbagai pH media dan ada beberapa isolat yang toleran terhadap pH rendah.
Pada pH 5.5 (masam) kenaikan pH tertinggi terdapat pada isolat LK6 yaitu sebesar 8.74 dan terendah terdapat pada TSM5 yaitu sebesar 7.51. Namun dapat diketahui bahwa semua isolat BPSyang diuji pada pH 5.5 mampu meningkatkan pH menjadi agak alkalis sampai alkalis (Lampiran 3) meskipun tidak nyata secara statistik.
Pada pH 5 (masam) isolat LK6 tetap merupakan isolat yang tertinggi dalam meningkatkan pH yaitu sebesar 8.72 tetapi tidak berbeda nyata dengan isolat AP4, AP10, LK1, LK2, LK4,LK7 dan TSM2, sedangkan yang terendah terdapat pada TSM 6 yaitu sebesar 7.44 tetapi tidak berbeda nyata dengan AP1, TSM4, TSM5 dan AP6. Namun dapat diketahui bahwa semua isolat BPSyang diuji pada pH 5 mampu meningkatkan pH menjadi netral sampai alkalis (Lampiran 3).
Pada pH 4.5 (masam) isolat LK6 tetap merupakan isolat yang tertinggi dalam meningkatkan pH yaitu sebesar 8.19 dan yang terendah terdapat pada AP1 yaitu sebesar 5.56. Meskipun tidak nyata secara statistik namun semua isolat BPS yang diuji pada pH 4.5mampu meningkatkan pH menjadi agak masam sampai agak alkalis (Lampiran 3) meskipun tidak nyata secara statistik.
(Lampiran 3), sedangkan yang terendah terdapat pada TSM 4 dan TSM5 yaitu sebesar 4.17 tetapi tidak berbeda nyata dengan AP1, AP 9 dan TSM6.
Pada pH 3.5 (sangat masam) isolat LK6 tetap merupakan isolat yang tertinggi dalam meningkatkan pH yaitu sebesar 5.8 tetapi tidak berbeda nyata dengan isolat AP4, AP6, AP9, AP10, LK1, LK2, LK3, LK4 dan TSM1. Isolat- isolat tersebut mampu menaikkan pH menjadi masam sampai agak masam (Lampiran 3), sedangkan yang terendah terdapat pada TSM 4 dan TSM5 yaitu sebesar 3.65 tetapi tidak berbeda nyata dengan AP1 dan AP 6.
Pada pH 3 (sangat masam) kenaikan pH tertinggi terdapat pada isolat AP1 yaitu sebesar 4.48 tetapi tidak berbeda nyata dengan AP3, AP4, AP6, AP7, AP9, AP10, LK1, LK2, LK3, LK4, LK5, LK6, LK7, TSM1, TSM2, TSM3.Meskipun peningkatan pH tidak terlalu mengalami peningkatan yang nyata, namun dapat diketahui bahwa hampir keseluruhan isolat BPS yang diuji mampu bertahan pada kondisi sangat masam, sedangkan isolat yang terendah terdapat pada TSM6 yaitu sebesar 3.17 tetapi tidak berbeda nyata dengan TSM4 dan TSM5.
Pada pH 2.5 (sangat masam) kenaikan pH tertinggi terdapat pada isolat TSM2 yaitu sebesar 5.84 tetapi tidak berbeda nyata dengan isolat TSM 1. Kedua isolat tersebut mampu menaikkan pH menjadi agak masam dan paling mampu bertahan dalam kondisi sangat masam. Sedangkan yang terendah terdapat pada AP7 dan TSM 4 yaitu sebesar 2.83 tetapi tidak berbeda nyata dengan TSM6 dan TSM5.
masam) isolat dari limbah kertas dan air panas belerang tidak terlalu efektif. Doshi (2006) menyatakan bahwa BPS dapat bertahan pada berbagai macam pH, tetapi kurang aktif di bawah pH tertentu. Selain itu, hambatan dari kemampuan isolat tersebut diduga berasal dari lingkungan habitat aslinya. Hasil penelitian Widyati (2012) menyatakan bahwa pH dari sludge industri kertas yaitu pH 4.17. Sehingga isolat BPS dari sludge kertas tersebut lebih sesuai dan lebih aktif diatas pH 4.
Berbeda dengan isolat dari tanah sulfat masam yang diketahui bahwa isolat tersebut mampu bertahan dalam kondisi sangat masam yang diperoleh oleh isolat TSM1 dan TSM2. Isolat BPS dari tanah sulfat masam bukan hanya dapat bertahan tetapi juga efektif pada pH diatas 4 dan dibawah 4 sampai 2.5, meskipun pada pH diatas 4 isolat dari tanah sulfat masam bukan isolat yang tertinggi dalam meningkatkan pH. Kemampuan isolat TSM diduga berasal dari lingkungan habitat aslinya (Lampiran 2). Lingkungan asli dari isolat ini, mempunyai pH sekitar 3.6 sehingga memungkinkan untuk bertahan dan lebih sesuai dalam kondisi sangat masam pada saat diuji di laboratorium.
Dari uraian Tabel 13 diatas juga diperoleh isolat yang unggul dari setiap sumber yang mampu meningkatkan pH dan toleran terhadap pH rendah. Isolat tanah sulfat masam yaitu TSM1 dan TSM2 mampu bertahan dan meningkatkan pH pada kondisi media sangat masam (2.5). Isolat limbah kertas yaitu LK6 dan LK2 yang merupakan isolat terbaik dalam meningkatkan pH diatas 4 sampai pH media 2.5 dan isolat air panas belerang yaitu AP4 dan AP6 merupakan isolat terbaik dalam meningkatkan pH diatas 4 sampai pH media 2.5.
bahwa keragaman BPS sangat dipengaruhi oleh kondisi lingkungan, kemasaman lingkungan, kedalaman sedimen, ketersediaan energi dari bahan organik dan kandungan sulfat. Namun ada faktor internal khusus yang mempengaruhi pertumbuhan BPS tersebut selama pengujian di laboratorium. Posgate (1984) menyatakan bahwa banyak hal penyebab terjadinya hambatan pertumbuhan bakteri pereduksi sulfat (bakteri anaerob) selama dalam pengkulturan tersebut. Salah satunya adalah kehadiran bakteri lain dapat mengubah dan menghambat pertumbuhannya. Penghambatan tersebut dijelaskan oleh Koschorreck (2008) menyatakan bahwa metabolisme H2S dan asam organik yang dapat menjadi toxic tergantung pada tingkatan pH, presipitasi logam sulfida dan kompetisi dengan bakteri lain dalam menggunakan elektron donor yaitu bakteri pereduksi besi dapat menghambat reduksi sulfat.
Sulfat merupakan sumber energi yang digunakan bakteri pereduksi sulfat sebagai aseptor elektron dan memanfaatkan bahan organik sebagai sumber karbon. Sumber karbon yang digunakan pada penelitian ini adalah laktat sesuai dengan komposisi media Posgate. Sumber karbon tidak hanya sebagai donor elektron namun sebagai bahan penyusun selnya juga (Groudev et al., 2001). Dalam prosesnya, BPS mereduksi sulfat menjadi sulfida yang tidak larut sebagai bagian dari aktivitas
metabolismenya. Sulfida mengendap, kandungan logam hilang dari air (Hard dan Higgins, 2004). Seperti tampak pada Tabel 13 bahwa setiap pH
Reaksi reduksi sulfat dapat meningkatkan pH karena aktivitas BPS dapat menangkap ion H+ penyebab pemasaman. Reaksi reduksi sulfat oleh BPS adalah sebagai berikut :
SO42- + H2O + 2 e- SO32- + 2 OH -SO32- + H2O + 6 e- S2- + 6 OH-
Sedangkan menurut Djurle (2004) jika BPS menggunakan elektron donor H2 dan sumber C (CO2) yang dapat diperoleh dari bahan organik maka reaksi reduksi sulfat oleh BPS adalah sebagai berikut :
SO42- + H2 + 2H+ H2S + 4H2O
Untuk membuktikan terbentuknya senyawa sulfida dapat dilihat pada Gambar 11. Pada media Posgate dibawah terdapat kerak berwarna hitam yang menandakan media dikoloni oleh BPS.
Gbr 11. Media posgate yang dikoloni BPS
b. Secara Kuantitatif
Dari Tabel 14 dapat diketahui bahwa terjadi perubahan warna pada setiap pH yang diuji dimana media awalnya adalah media berwarna putih kekuningan. Semakin alkalis pH nya, maka warnanya semakin hitam dan semakin masam pH nya, maka warnanya semakin berwarna kuning terang. Perubahan warna media tersebut dapat dilihat pada Lampiran 5.
Tabel 14. Perubahan warna media pada berbagai pH setelah 14 hari inkubasi Kode
Isolat
Perubahan Warna
pH 5.5 pH 5 pH 4.5 pH 4 pH 3.5 pH 3 pH 2.5
AP 1 HP H KT KT PK PK PK
AP 3 HP HP KT KT PK PK PK
AP 4 HP HP HP KT PK PK PK
AP 6 HP H H KT PK PK PK
AP 7 HP HP H KT PK PK PK
AP 8 HP HP H KT PK PK PK
AP 9 HP HP KT KT PK PK PK
AP 10 HP HP HP KT PK PK PK
LK 1 HP HP HP KT PK PK PK
LK 2 HP HP H KT PK PK PK
LK 3 H HP H KT PK PK PK
LK 4 HP HP HP KT PK PK PK
LK 6 HP HP HP H PK PK PK
LK 7 HP HP HP KT PK PK PK
TSM 1 HP HP H KT PK PK PK
TSM 2 HP HP H KT PK PK PK
TSM 3 HP HP H KT PK PK PK
TSM 4 HP H KT KT PK PK PK
TSM 5 H H KT KT PK PK PK
TSM 6 H H KT KT PK PK PK
Ket : HP ( Hitam Pekat) ; H (Hitam) ; PK (Putih Keruh) ; K (Kuning) ; KT (Kuning Terang)
KESIMPULAN DAN SARAN
Kesimpulan
1. Dari keseluruhan isolat bakteri pereduksi sulfat diperoleh 20 isolat murni yang mencakup tanah sulfat masam sebanyak 6 isolat, limbah kertas sebanyak 6 isolat dan air panas belerang sebanyak 8 isolat.
2. Diperoleh enam isolat unggul dari masing-masing sumber. Dua isolat (TSM1 dan TSM2) mampu tumbuh pada pH 2.5 dan empat isolat (LK6, LK2 dan AP4, AP6) mampu tumbuh pada pH diatas 4.
3. Isolat dari tanah sulfat masam mempunyai kemampuan tumbuh lebih baik
pada kondisi sangat masam (2.5) daripada isolat dari limbah kertas dan air panas belerang.
Saran
TINJAUAN PUSTAKA
Bakteri Pereduksi Sulfat (BPS)
Pengenalan BPS
Bakteri pereduksi sulfat merupakan bakteri obligat anaerob yang menggunakan H2 sebagai donor elektron (chemolithotrophic). BPS dapat mereduksi sulfat pada kondisi anaerob menjadi sulfida, selanjutnya H2S yang dihasilkan dapat mengendapkan logam-logam toksik (Cu, Zn, Cd) sebagai logam sulfida. BPS memerlukan substrat organik yang berasal dari asam organik berantai pendek seperti asam piruvat. Dalam kondisi alamiah, asam tersebut dihasilkan oleh aktivitas anaerob lainnya (Hanafiah et al., 2009).
Bakteri pereduksi sulfat tersebar luas di alam, mereka terdapat di tanah, di air, di sedimen dan limbah. Kekhususan dari bakteri pereduksi sulfat yaitu bakteri pereduksi sulfat menggunakan sulfat atau hidrogen sebagai akseptor elektron dan umumnya sangat diperlukan untuk mereduksi sulfat menjadi sulfida. Sehingga dalam kondisi anaerob, ketersediaan sulfat dalam tanah akan dibatasi terutama pada pH tanah di atas 5.5 (FAO, 2001). Tingginya jumlah BPS telah ditemukan di endapan danau dan lahan tergenang, rumen sapi, geothermal. BPS juga dapat berkembang dalam lingkungan manusia seperti sawah, pabrik kertas dan sungai yang dipengaruhi oleh limbah atau air asam tambang(Postgate, 1965 ;Doshi, 2006).
hilang dari air. Di samping itu, sejumlah spesies BPS dapat mengurangi beberapa logam yang sulit ditangani seperti mereduksi uranium (VI) (larut) menjadi uranium (IV) (tidak larut) (Hard and Higgins, 2004).
Jenis – Jenis BPS
BPS terdiri dari 2 genus, yaitu Desulfovibrio dan Desulfotomaculum.
Desulfovibrio hidup pada kisaran pH 6 sampai netral, sedangkan
Desulfotomaculum merupakan kelompok BPS yang termofil (menyukai suhu yang
tinggi). Bakteri pereduksi sulfat merupakan kelompok bakteri yang memiliki fisiologis yang kompleks dan berbagai kekayaan telah digunakan dalam klasifikasi tradisional. Serangkaian analisis rRNA telah diizinkan untuk membagi BPS dalam 4 grup (Alexander, 1977).
Castro et al., (2000), mengelompokkan BPS ke dalam empat kelompok berdasarkan analisis urutan rRNA :
1. Subdivisi proteobakteria terdiri BPS mesofilik gram negatif, termasuk dalamnya genera Desulfovibrio, Desulfomicrobium, Desulfobulbus, Desulfobacter, Desulfobacterium, Desulfococcus, Desulfosarcina,
Desulfomonile, Desulfonema, Desulfobutulus, dan Desulfoarculus. Bakteri ini
memliki temperatur pertumbuhan optimal berkisar antara 200 sampai 400 C. Grup ini berbeda, dengan bervariasi bentuk dan ciri-ciri fisiologi yang diwakili.
2. Bentuk BPS gram positif berspora terutama diwakili oleh genus Desulfomaculum, dan bentuk endospora tahan panas. Sebagian besar spesies
lingkungan yang sama dengan BPSProteobacteria, pembentukan spora memungkinkan kelompok ini bertahan untuk waktukondisi pengeringan dan oksikyang lama. Misalnya, Desulfotomaculum adalah genus umum dari BPS di sawah.
3. Grup BPS termofilik terdiri dari genera Thermodesulfobacterium dan Thermodesulfovibrio. Bakteri ini memiliki pertumbuhan optimal antara 650
sampai 700 C dan menetap pada lingkungan temperatur tinggi seperti panas geothermal.
4. BPS archaeal termofilik berkembang pada temperatur di atas 800 C dan telah ditemukan hanya di panas hidrotermal laut. Semua BPS di grup ini termasuk ke dalam genus Archaeoglobus.
Mekanisme BPS
Dalam melakukan reduksi sulfat, BPS menggunakan sulfat sebagai sumber energi yaitu sebagai akseptor elektron dan menggunakan bahan organik sebagai sumber karbon (C). Karbon tersebut berperan selain sebagai donor elekton dalam metabolisme juga merupakan bahan penyusun selnya. Pada kondisi anaerob bahan organik akan berperan sebagai donor elektron (Groudev et al., 2001 ; Widyati, 2006). Ketika sulfat menerima elektron dari bahan organik maka akan mengalami reduksi membentuk senyawa sulfida. Penurunan konsentrasi sulfat akan meningkatkan pH tanah. Hal ini terjadi karena beberapa proses yang saling berkaitan, yaitu karena penggenangan, penambahan bahan organik dan aktivitas BPS (Widyati, 2006).
menghasilkan hidrogen sulfida. Hidrogen sulfida akan segera berikatan dengan logam membentuk logam sulfida yang tidak larut sehingga ketersediaan logam turun. Keseluruhan reaksi reduksi sulfat dan logam yang melibatkan BPS (Widyati, 2007).
Meskipun BPS menggunakan sulfat sebagai terminal akseptor elektron, BPS juga mampu menggunakan berbagai jenis akseptor elektron untuk pertumbuhan dan memfermentasikan substrat yang tidak tersedia akseptor elektron inorganik. BPS dapat mereduksi senyawa sulfur lain (thiosulfat, sulfit, dan sulfur) menjadi sulfida atau dapat mereduksi nitrat menjadi amonium. Senyawa lain yang merupakan akseptor elektron untuk beberapa BPS termasuk besi (Fe(III)), uranium (U(VI)), selenat(Se(VI)), chromat (Cr(VI)), dan arsenat (As(VI)). Bagaimanapun, tidak semua proses reduksi sesuai untuk pertumbuhan (Muyzer dan Stams, 2008).
Faktor yang mempengaruhi
Kondisi anoksik merupakan persyaratan habitat BPS. Substrat, temperatur, pH juga dapat menentukan batasan dan telah menjadi subjek penelitian di laboratorium dan dilapangan (Doshi, 2006).
sederhana (seperti acetate, propionate). Lebih lanjut Doshi (2006) juga menegaskan bahwa ketika bahan organik digunakan sebagai sumber karbon, bakteri heterotrofik lainnya harus memecahnya menjadi senyawa karbon sederhana.
Bakteri yang toleransi masam bermanfaat untuk digunakan pada drainase masam.BPS dapat bertahan pada berbagai macam pH, tetapi kurang aktif di bawah pH tertentu. Namun pH yang lebih tinggi mungkin diperlukan untuk presipitasi logam yang efektif dan degragasi karbon organik (Doshi, 2006).
Suhu rendah memperlambat BPS dan demikian dengan laju reaksi. Dalam percobaan kolom, BPS efektif berfungsi sampai pada suhu 60C yitu suhu terendah yang diuji (Tsukamoto et al., 2004 ; Doshi, 2006).
Mikroorganisme yang dipilih untuk digunakan dalam bioremediasi tergantung pada tersedianya sumber energi dan karbon, kondisi lingkungan seperti temperatur, oksigen, kelembapan dan hadirnya zat pencemar berbahaya. Banyak bakteri yang menggunakan kontaminan sebagai sumber karbon dan energi. Awal terjadinya degradasi adalah terjadinya kontak antara bakteri dan kontaminan. Hal ini tidak mudah dicapai, apabila tidak ada mikroba atau kontaminan lain yang menyebar dalam tanah (Pal et al., 2010).
keduanya terjadi secara alami yang tersedia untuk bioremediasi. Bio-augmentasi adalah penambahan mikroorganisme yang dapat mentransform (biasanya logam beracun) atau mengurai (senyawa organik beracun) kontaminan tertentu (Sinha et al., 2009).
Masalah utama yang sering dijumpai dalam aplikasi mikroorganisme untuk bioremediasi adalah menurun atau hilangnya potensi mikroba. Walaupun dalam percobaan laboratorium mikroba menunjukkan aktivitas degradasi yang tinggi, ternyata tidak menunjukkan hasil yang memuaskan dalam percobaan di lapangan (in situ). Maka untuk meningkatkan keefektivan penggunaan mikroorganisme perlu dilakukan penambahan nutrisi untuk merangsang aktivitas mikroorganisme (biostimulation) dan mengintroduksi mikroba tertentu pada derah yang akan diremediasi (bioaugmentasi). Selain itu, pengaruh pH, temperatur, kelembapan tanah juga sangat menentukan keberhasilan bioremediasi (Munir, 2006).
Tanah Sulfat Masam
Luas lahan rawa di Indonesia diperkirakan 33.40 juta ha, yang terdiri atas
20 juta ha rawa pasang surut dan 13.40 juta ha rawa lebak. Lahan sulfat masam
merupakan bagian dari lahan rawa pasang surut dan luasnya sekitar 6.70 juta ha
(Suriadikarta, 2005). Lahan sulfat masam tergolong lahan yang marginal dan
fragile (rapuh) yang dicirikan oleh adanya lapisan tanah yang mengandung pirit 2,0 % atau lebih pada kedalaman kurang dari 50 cm (Suastika et al., 2008).
aktual (SMA). Tanah sulfat masammenjadi potensial apabila FeS pada kedalaman 0-50cm, belum terjadi proses oksidasi dan dalam keadaan tergenang akanbersifat stabil dan tidak membahayakantanaman. Tanah menjadi sulfat masam aktual apabila bahan sulfidanya telah mengalami proses oksidasi menjadi pirit (FeS2) yang bila kena udara akan terjadireaksi oksidasi membentuk asam sulfat dan oksida besi, sehingga mengubah tanah menjadi sangat masam dansusah digunakan untuk lahan pertanian (Balai Penelitian Tanah, 2010).
Pirit (FeS2) yang banyak terkandung di tanahsulfat masam bersifat stabil jika berada dalam kondisireduktif, tetapi jika tanah sufat masam dikeringkan/didrainase maka pirit akan mengalami oksidasisehingga menyebabkan terbentuknya senyawa H2SO4yang dapat meningkatkan kemasaman tanah, padakondisi ini pH tanah dapat mencapai kurangdari 3,5 (pH < 3,5).Berikut adalahpersamaan reaksi yangmenggambarkan terjadinya oksidasi pirit danmenyebabkan pemasaman tanah (Konsten et al.,1994 ; Susilawati dan Fahmi, 2013)
2 FeS2+ 7 O2+ 2 H2O 2 Fe2++ 4 H2SO4
dan K ke dalam larutan tanah yang selanjutnya dapat “tercuci” keluar karena dibawa hanyut oleh air yang mengalir. Tidak hanya pasokan K menjadi terbatas, tetapi juga mengakibatkan kahat unsur Ca dan Mg. 4) Secara ringkas, akibat penurunan pH tanah di bawah pH 3,5 terjadi keracunan ion H+, Al, SO42-, dan Fe3+, serta penurunan kesuburan tanah alami akibat hilangnya basa basa tanah. Tanah mengalami kahat P, K, Ca, dan Mg(Subiksa dan Setyorini, 2008).
Berdasarkan keberadaan pirit dalam tanah, sifat tanah sulfat masam terdiri dari enam tipologi, yaitu : (1) aluvial bersulfida dangkal, kedalaman pirit kuranfgdari 50 cm dan pH 3.5-4.0 ; (2) aluvial bersulfida dalam, kedalaman pirit kurang dari 50-100 cm dan pH lebih dari 4.0 ; (3) aluvial bersulfida sangat dalam, kedalaman pirit lebih dari 100 cm dan pH lebih dari 4.0-4.5 ; (4) aluvial bersulfat 1, kedalaman pirit kurang dari 100 cm dan belum ada ciri horison sulfurik, pH lebih dari 3.5 dan tampak bercak berpirit ; (5) aluvial bersulfat 2, kedalaman pirit kurang dari 100 cm dan adanya ciri horison sulfurik dan pH kurang dari 3.5 dan (6) aluvial bersulfat 3, kedalaman pirit lebih dari 100 cm dan menunjukkan adanya ciri horison sulfurik dan pH tanah kurang dari 3.5. tipologi aluvial bersulfat menunjukkan adanya lapisan (horison) sulfurik yang mengindikasikan pirit teroksidasi (Noor, 2004).
Limbah Sludge Kertas
korosif yangdihasilkan dari penggunaan asam dan basakuat dalam proses pembuburan kertas sertalimbah pewarna dan tinta yang mengandunglogam berat. Limbah pabrik kertasumumnya mengandung logam-logamberbahaya seperti merkuri/air raksa (Hg),cuprum/ tembaga (Cu), chromium/crom (Cr),plumbum/timah hitam (Pb), seng (Zn), dan nikel (Ni) (Arisandi, 2002).
Sludge industri kertas merupakan lumpur aktif yang diperoleh dari proses
pengolahan air limbah, yang terdiri atas padatan 90% dan air 10%. Karakteristik dari sludge industri kertas antara lain lembek, strukturnya lunak seperti bubur, berwarna abu-abu keruh atau kehitaman, dan berbau tidak sedap. Sifat kimia sludge industri kertas yaitu : pH 4.17 (sangat asam), C Organik(%) 14.7 (sangat
tinggi), P-tersedia 46.98 (sangat tinggi), P total 586.2 (tinggi), Fe 3.80 (cukup), Mn dan Cu (defisiensi) (Widyati, 2012).
[image:57.595.112.513.475.614.2]Berikut ini adalah komposisi kandungan senyawa sludge kertas hasil tes Laboratorium Penelitian dan Konsultasi Industri.
Tabel 1. Komposisi senyawa kimia limbah padat (sludge) kertas
Komposisi Kimia Kadar (%)
CaO 56.38
Al2O3 7.70
Fe2O3 1.68
MgO 3.62
SiO2 2.35
CO2 0.75
H2O 16.11
Sumber : Laboratorium Penelitian dan Konsultasi Industri (LPKI) Surabaya (2005) dalam Khusna (2012)
Air Panas Belerang
adanya gas hidrogen sulfida (H2S). Air panas belerang merupakan salah satu perairan yang banyak mengandung sulfat yang dikarenakan adanya aktivitas vulkanik. Makin asamnya air panas berasal dari interaksi antara air dengan sulfur, khlorin, flourida dan gas yang keluar banyak dari magma yang panas. Pengencerandari sulfur dan senyawa asam halogen dari gunung api seperti SO2, H2S, HCl dan HFakan menjadikan tanah lebih masam (Taroreh et al., 2015).
[image:58.595.110.511.429.658.2]Sumber air panas terutama yang banyak mengandung belerang juga merupakan bagian yang menguntungkan oleh adanya gunung berapi tersebut. Air panas berasal dari air tanah yang dipanasi oleh gejala volkanisme dalam batuan panas secara konveksi, konduksi dan radiasi atau air kondensasi yang berasal dari uap alam yang terbentuk di bagian dalam. Oleh karena itu belerang pada air panas tersebut sangat menonjol maka sering disebut dengan air belerang.
Tabel 2. Analisis kimia contoh air panas belerang
Zat kimia Kadar (ppm)
Bikarbonat 457.50
Silikat 0.01
Kalsium 91.58
Magnesium 98.42
Besi 0.15
Mangan 0.20
Tembaga 0.05
Khlorida 102.54
Sulfat 55.00
Sulfida 0.10
Khromium 0.07
Natrium 25.00
Kalium 28.70
PENDAHULUAN
Latar Belakang
Pada tahun 2007, Indonesia tercatat ada sekitar 13 ribu industri besar dan menengah yang berpotensi mencemari air permukaan dan air tanah. Dari sekian banyak industri yang ada, industri yang paling disorot karena kasus pencemarannya adalah industri pertambangan yang melepaskan gas S ke atmosfer akan mengakibatkan hujan asam dan air drainase yang bereaksi masam, industri migas yang menghasilkan residu dan logam-logam berat ke dalam tanah terutama logam As, Hg, Cu, Zn, Cr, industri pabrik kertas yang menambah reaksi kemasaman dalam tanah kerana banyak menggunakan asam-asam kuat selama dalam proses pembuburan kertas dan juga sektor pertanian dan perkebunan yang banyak menggunakan pupuk yang mengandung ada tidaknya sulfur.
Dampak dari kasus pencemaran lingkungan sudah sangat banyak menimbulkan masalah yang menuntun kepada terjadinya degradasi lahan. Degradasi juga dapat diakibatkan karena penggunaan lahan yang tidak sesuai dengan kemampuannya. Lahan sulfat masam merupakan lahan yang produktif jika lapisan pirit tetap dalam keadaan tergenang. Perkebunan PT. Napoli Raya di Aceh Tamiang merupakan salah satu perkebunan yang membuka lahan sulfat masam
secara besar-besaran untuk ditanam dengan kelapa sawit. Ketika lahan tersebut
masam tidak diperbaiki mengingat luasan lahan tersebut di Indonesia mencapai sekitar 6.70 juta ha.
. Kemasaman yang tinggi berdampak negatif terhadap sifat kimia dan aktivitas mikroba tanah karena tidak semua mikroba tanah mampu bertahan dalam kondisi tanah sangat masam. Maka, diperlukan suatu paket teknologi untuk dapat memperbaiki dan meningkatkan produktivitas lahan. Bakteri pereduksi sulfat dikenal merupakan bakteri yang suka dan sangat membutuhkan kemasaman (asidofil). Bakteri tersebut merupakan bakteri obligat anaerob, tumbuh pada kisaran pH 2 sampai pH 9 dan menggunakan ion sulfat untuk mendapatkan energinya. Mengingat bakteri pereduksi sulfat dapat ditemukan hampir di semua lingkungan di bumi termasuk tanah sulfat masam, limbah kertas dan sumber air panas belerang, maka mikroba tersebut dapat digunakan untuk memperbaiki kerusakan yang terjadi.
Hasil penelitian Widyati et al., (2005) menyatakan bahwa sludge kertas mengandung bakteri pereduksi sulfat dimana bakteri tersebut mampu menaikkan pH dan menurunkan konsentrasi sulfat pada kondisi masam. Hasil penelitian Mukhlis dan Lestari (2009) menyatakan 6 isolat BPS unggul terpilih pada lahan rawa sulfat masam mampu tumbuh pada media sangat masam (3.5), dapat meningkatkan pH menjadi 6.2-6.8. Penelitian Taroreh et al., (2015) yang mengisolasi bakteri pereduksi sulfat dari air panas belerang Sarongsong Kota Tomohon, menemukan hasil bahwa terjadi penurunan sulfat dari 203.5 menjadi 18.1 ppm, dari 211 menjadi 20 ppm dan dari 235 menjadi 38 ppm.
dan tanah sulfat masam, namun belum ada yang menggabungkan dan membandingkan potensi ketiga sumber isolat tersebut untuk dilakukan pengujian pada media pertumbuhan yang sama. Mengingat bahwa bakteri yang digunakan merupakan bakteri yang berbeda lokal maka, penelitian ini perlu dikembangkan dengan mengisolasi dan menguji potensi bakteri pereduksi sulfat dari berbagai sumber terhadap perubahan media tumbuh di laboratorium.
Tujuan Penelitian
1. Untuk mengisolasi bakteri pereduksi sulfat dari berbagai sumber di laboratorium.
2. Untuk menguji potensi bakteri pereduksi sulfat yang unggul dari berbagai sumber pada media cair Posgate di laboratorium.
Kegunaan Penelitian
1. Sebagai salah satu syarat untuk dapat memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara.
Bacteria (SRB) from Various Sources To Changes in Growth Media in the Laboratory. Supervised by Asmarlaili Sahar and Mariani Sembiring.
Industries pollution and land degradation often lead to increase the acidity of the soil. Acidity not only harmful to the plants, but also harmful for the survival of the soil microbes because not all of the microbes capable to survive in an very acidic soil. This study aimed to obtain the isolate and determine the potential for a superior sulfate reducing bacteria (SRB) from various sources tested on Posgate liquid media. The research activities carried out in the Laboratory of Soil Biology Faculty Agriculture, University of North Sumatra. The research consist of two experiments : isolation SRB from several sources namely acid sulfate soil, sludge paper, hot sulfur springs and potency test SRB in various pH (5.5 ; 5 ; 4.5 ; 4 ; 3.5 ; 3 ; 2.5) Posgate liquid media. Based in the results of laboratory research obtained 20 pure isolates SRB (6 isolates from acid sulfate soils, 6 isolates from sludge paper, 8 isolates from hot sulfur springs) and based on the test results obtained that the potential ability of sulfate reducing bacteria are diverse but all isolates could increase the pH. Isolates from acid sulfate soils are more tolerant to the conditions very acid than isolates the sludge paper and hot sulfur springs. Proved from two isolates of acid sulfate soils capable to grow and effective on pH medium 5.5 to 2.5, whereas isolates from sludge paper and hot sulfur springs capable to grow and effective in the medium above pH 4 in order to obtain six superior isolates sulfate reducing bacteria from various sources namely TSM1, TSM2, LK2, LK6, AP4 and AP6.
Berbagai Sumber Terhadap Perubahan Media Tumbuh di Laboratorium. Dibimbing oleh Asmarlali Sahar sebagai ketua komisi pembimbing dan Mariani Sembiring sebagai anggota komisi pembimbing.
Pencemaran industri dan degradasi lahan sering mengakibatkan semakin bertambahnya kemasaman tanah. Kemasaman tidak hanya berbahaya bagi tanaman, tetapi juga berbahaya bagi kelangsungan mikroba tanah karena tidak semua mikroba mampu bertahan dalam suasana tanah yang sangat masam.Penelitian ini bertujuan untuk mendapatkan isolat dan mengetahui potensi bakteri pereduksi sulfat yang unggul dari berbagai sumber yang diuji pada media cair Posgate. Kegiatan penelitian ini dilaksanakan di Laboratorium Biologi Tanah Fakultas Pertanian, Universitas Sumatera Utara. Penelitian terdiri dari dua eksperimen : isolasi bakteri pereduksi sulfat dari berbagai sumber yaitu tanah sulfat masam, sludge kertas, air panas belerang dan uji potensi pada berbagai pH (5.5 ; 5 ; 4.5 ; 4 ; 3.5 ; 3 ; 2.5) media cair Posgate. Berdasarkan hasil penelitian di laboratorium diperoleh 20 isolat murni BPS (6 isolat dari tanah sulfat masam, 6 isolat dari sludge kertas, 8 isolat dari air panas belerang) dan berdasarkan hasil uji potensi diperoleh bahwa kemampuan isolat bakteri pereduksi sulfat beragam namun semua isolat mampu meningkatkan pH. Isolat dari tanah sulfat masam lebih toleran terhadap kondisi sangat masam daripada isolat sludge kertas dan air panas belerang. Terbukti dari dua isolat tanah sulfat masam mampu tumbuh dan efektif pada pH media 5.5 sampai pH 2.5, sedangkan isolat dari sludge kertas dan air panas belerang mampu tumbuh dan efektif pada pH media diatas 4 sehingga diperoleh enam isolat bakteri pereduksi sulfat yang unggul dari berbagai sumber yaitu TSM1, TSM2, LK2, LK6, AP4 dan AP6.
SKRIPSI
MARTHA AGUSTINA SITINJAK
110301233 / ILMU TANAH
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
SKRIPSI
MARTHA AGUSTINA SITINJAK
110301233 / ILMU TANAH
Skripsi Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
NIM : 110301233 Minat : Ilmu Tanah Program Studi : Agroekoteknologi
Disetujui Oleh: Komisi Pembimbing
Ketua Anggota
Prof. Dr. Ir. Asmarlaili Sahar Hanafiah, MS. DAADr. Mariani Sembiring, SP. MP
Diketahui Oleh :
Bacteria (SRB) from Various Sources To Changes in Growth Media in the Laboratory. Supervised by Asmarlaili Sahar and Mariani Sembiring.
Industries pollution and land degradation often lead to increase the acidity of the soil. Acidity not only harmful to the plants, but also harmful for the survival of the soil microbes because not all of the microbes capable to survive in an very acidic soil. This study aimed to obtain the isolate and determine the potential for a superior sulfate reducing bacteria (SRB) from various sources tested on Posgate liquid media. The research activities carried out in the Laboratory of Soil Biology Faculty Agriculture, University of North Sumatra. The research consist of two experiments : isolation SRB from several sources namely acid sulfate soil, sludge paper, hot sulfur springs and potency test SRB in various pH (5.5 ; 5 ; 4.5 ; 4 ; 3.5 ; 3 ; 2.5) Posgate liquid media. Based in the results of laboratory research obtained 20 pure isolates SRB (6 isolates from acid sulfate soils, 6 isolates from sludge paper, 8 isolates from hot sulfur springs) and based on the test results obtained that the potential ability of sulfate reducing bacteria are diverse but all isolates could increase the pH. Isolates from acid sulfate soils are more tolerant to the conditions very acid than isolates the sludge paper and hot sulfur springs. Proved from two isolates of acid sulfate soils capable to grow and effective on pH medium 5.5 to 2.5, whereas isolates from sludge paper and hot sulfur springs capable to grow and effective in the medium above pH 4 in order to obtain six superior isolates sulfate reducing bacteria from various sources namely TSM1, TSM2, LK2, LK6, AP4 and AP6.
Berbagai Sumber Terhadap Perubahan Media Tumbuh di Laboratorium. Dibimbing oleh Asmarlali Sahar sebagai ketua komisi pembimbing dan Mariani Sembiring sebagai anggota komisi pembimbing.
Pencemaran industri dan degradasi lahan sering mengakibatkan semakin bertambahnya kemasaman tanah. Kemasaman tidak hanya berbahaya bagi tanaman, tetapi juga berbahaya bagi kelangsungan mikroba tanah karena tidak semua mikroba mampu bertahan dalam suasana tanah yang sangat masam.Penelitian ini bertujuan untuk mendapatkan isolat dan mengetahui potensi bakteri pereduksi sulfat yang unggul dari berbagai sumber yang diuji pada media cair Posgate. Kegiatan penelitian ini dilaksanakan di Laboratorium Biologi Tanah Fakultas Pertanian, Universitas Sumatera Utara. Penelitian terdiri dari dua eksperimen : isolasi bakteri pereduksi sulfat dari berbagai sumber yaitu tanah sulfat masam, sludge kertas, air panas belerang dan uji potensi pada berbagai pH (5.5 ; 5 ; 4.5 ; 4 ; 3.5 ; 3 ; 2.5) media cair Posgate. Berdasarkan hasil penelitian di laboratorium diperoleh 20 isolat murni BPS (6 isolat dari tanah sulfat masam, 6 isolat dari sludge kertas, 8 isolat dari air panas belerang) dan berdasarkan hasil uji potensi diperoleh bahwa kemampuan isolat bakteri pereduksi sulfat beragam namun semua isolat mampu meningkatkan pH. Isolat dari tanah sulfat masam lebih toleran terhadap kondisi sangat masam daripada isolat sludge kertas dan air panas belerang. Terbukti dari dua isolat tanah sulfat masam mampu tumbuh dan efektif pada pH media 5.5 sampai pH 2.5, sedangkan isolat dari sludge kertas dan air panas belerang mampu tumbuh dan efektif pada pH media diatas 4 sehingga diperoleh enam