KLONING FRAGMEN DNA GENOM YANG TERLIBAT DALAM
TOLERANSI ASAM-ALUMINIUM PADA Bradyrhizobium japonicum
MELALUI MUTAGENESIS DENGAN TRANSPOSON
Oleh:
Rika Indri Astuti
G34101047
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RIKA INDRI ASTUTI. Kloning Fragmen DNA Genom yang Terlibat dalam Toleransi Asam-Aluminium pada Bradyrhizobium japonicum melalui mutagenesis dengan transposon. Dibimbing oleh ARIS TRI WAHYUDI da n NISA RACHMANIA MUBARIK.
Bakteri bintil akar Bradyrhizobium japonicum sensitif asam-aluminium telah berhasil dikonstruksi melalui metode mutagenesis dengan transposon untuk mengetahui gen yang terlibat dalam toleransi asam-aluminium pada B. japonicum. pUTmini-Tn5Km1 yang dibawa oleh Escherichia coli S17 -1 (? pir) di transfer ke dalam sel B. japonicum toleran asam-Al melalui konjugasi dengan tiga waktu inkubasi mating yang berbeda. Mutan BJ 11 (25) diketahui tidak mampu tumbuh pada media Ayanaba (pH 4.5) yang ditambahkan 50 µM aluminium . Fragmen DNA sebesar 0.8 kb berhasil diisolasi dari genom BJ 11 (25) menggunakan teknik inverse polymerase chain reaction (Inverse PCR). Fragmen DNA tersebut kemudian diklon ke dalam plasmid Easy (~3 kb) menghasilkan plasmid rekombinan yang didesain sebagai pGEMT-11 (~3.8kb).
ABSTRACT
RIKA INDRI ASTUTI. Cloning of Genomic DNA Fragment Involved for Acid-Al Tolerance in Bradyrhizobium japonicum using transposon mutagenesis . Under supervision of ARIS TRI WAHYUDI and NISA RACHMANIA MUBARIK.
KLONING FRAGMEN DNA GENOM YANG TERLIBAT DALAM
TOLERANSI ASAM-ALUMINIUM PADA Bradyrhizobium japonicum
MELALUI MUTAGENESIS DENGAN TRANSPOSON
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Rika Indri Astuti
G34101047
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
JUDUL:KLONING FRAGMEN DNA YANG TERLIBAT DALAM TOLERANSI ASAM-ALUMINIUM PADA B radyrhizobium japonicum MELALUI MUTAGENESIS DENGAN TRANSPOSON
NAMA :RIKA INDRI ASTUTI NRP :G34101047
Menyetujui,
Pembimbing I Pembimbing II
Dr. Aris Tri Wahyudi , M.Si Dr. Nisa Rachmania M, M.Si
NIP: 131957319 NIP: 132045531
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Penget ahuan Alam
Dr. Ir. Yonny Koesmaryono NIP: 131473999
RIWAYAT HIDUP
Penulis dilahirkan di Ponorogo pada tanggal 10 Oktober 1983 sebagai anak pertama dari dua bersaudara, putri dari pasangan Sriyanto dan Sujiati.
Penulis menyelesaikan pendidikan dasar di SDN 07 Pagi Jakarta Selatan pada tahun 1995 kemudian melanjutkan ke SLTP 226 Jakarta Selatan hingga lulus pada tahun 1998. Pendidikan menengah ditempuh di SMU Negeri 34 Jakarta. Pada tahun 2001 penulis lulus SMU dan pada tahun yang sama diterima di Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan penulis menjadi asisten mata kuliah Biologi Dasar pada tahun ajaran 2003/2004, Biologi Alga dan Bryophyta pada semester genap tahun ajaran 2003/2004 dan 2004/2005, Mikrobiologi Dasar pada semester ganjil dan genap tahun ajaran 2004/2005, dan Fisiologi Mikroba pada tahun 2004/2005. Penulis melaksanankan Praktek Lapang (PL) di Lembaga Biologi Molekuler Eijkman Jakarta pada bulan Juni-Juli 2004.
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah berjudul Kloning Fragmen DNA Genom yang Terlibat dalam Toleransi Asam-Aluminium pada Bradyrhizobium japonicum Melalui Mutagenesis dengan Transposon ini disusun berdasarkan penelitian yang telah dilaksanakan mulai bulan Desember 2004 hingga Oktober 2005. Penelitian ini didanai oleh Proyek Hibah Bersaing XIII DIKTI tahun 2005-2007 kepada Dr. Aris Tri Wahyudi melalui LPPM IPB.
Pada kesempatan ini penulis menghaturkan ucapan ter imakasih yang mendalam kepada Dr. Aris Tri Wahyudi , M.Si selaku dosen pembimbing I atas bimbingan dan arahan dalam bidang molekuler yang sangat berharga bagi penulis serta kepada Dr. Nisa Rachmania Mubarik, M.Si selaku Pembimbing II yang telah banyak memberikan bimbingan dan saran selama pelaksanaan penelitian dan penyusunan karya ilmiah ini. Serta kepada Dr. Ir. Rika Raffiudin selaku dosen penguji dan wakil komisi pendidikan atas saran dan masukan yang berharga untuk perbaikan skripsi ini.
Penulis juga mengucapkan terima kasih kepada Dr. Iman Rusmana selaku Kepala Laboratorium Penelitian Mikrobiologi dan Prof. Dr. Antonius Suwanto selaku kepala Laboratorium Research Center for Microbial Diversity atas izin penggunaan sarana dan prasarana laboratorium, serta kepada seluruh staf laboratorium.
Rasa terimakasih juga penulis sampaikan kepada Bapak, Ibu, Andri dan dede Adji untuk doa, dukungan dan kasih sayangnya. Kepada sahabat setiaku Henry Kurniawan atas motivasi, perhatian, sedih, senang dan kebersamaany a, kepada Ibu Ani dan Mbak Dini untuk segala bantuan dan kerjasama yang menyenangkan, kepada Hesti, Aries, Wulan dan Mba Elsie untuk kebersamaannya di Laboratorium, juga kepada seluruh peneliti Laboratorium Mikrobiologi Departemen Biologi, Pak Joni, dan mahasiswa Biologi angkatan 38 yang telah banyak membantu penulis.
Semoga karya ilmiah ini dapat membawa manfaat.
Bogor , Desember 2005
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN... 1
Latar belakang... 1
Tujuan... 2
BAHAN DAN METODE ... 2
Waktu dan Tempat Penelitian ... 2
Bahan dan Alat... 2
Metode... 2
Peremajaan B. japonicum Toleran Asam-A l... 2
Mutagenesis dengan Transposon ... 3
Seleksi Mutan ... 3
Isolasi DNA Genom Mutan B. japonicum Sensitif Asam-A l ... 4
Amplifikasi DNA Genom Pengapit Transposon dengan Inverse PCR ... 4
Kloning Fragmen DNA Genom Pengapit Transposon ... 5
HASIL Peremajaan B. japonicum Toleran Asam-A l ... 7
Mutagenesis dengan Transposon ... 7
Seleksi Mutan... 7
Amplifikasi DNA Genom Pengapit Transposon dengan Inverse PCR ... 8
Kloning Fragmen DNA Genom Pengapit Transposon ... 8
PEMBAHASAN Peremajaan B. japonicum Toleran Asam-A l ... 9
Mutagenesis dengan Transposon ... 9
Seleksi Mutan... 10
Amplifikasi DNA Genom Pengapit Transposon dengan Inverse PCR ... 11
Kloning Fragmen DNA Genom Pengapit Transposon ... 12
SIMPULAN... 12
SARAN ... 13
DAFTAR TABEL
Halaman
1 Frekuensi transkonjugasi transposon mini-Tn5Km1 dari E. coli S 17-1 (? pir) ke B. japonicum pada berbagai waktu inkubasi mating ... 7
2 Persentase pembentukan mutan sensitif asam-A l... 8
DAFTAR GAMBAR
Halaman
1 a) Peta plasmid pUT mini-Tn5Km1 (7.055 kb) yang berada dalam sel E. coli S17-1 (λ pir), b) peta restriksi transposon mini-Tn5Km1 (1.835 kb) yang membawa gen resistensi kanamisin... 3
2 Skema proses amplifikasi fragmen DNA genom pengapit transposon. a) DNA genom B. japonicum mutan sensistif asam -Al yang dipotong dengan enzim EcoRV, b) Proses
sirkularisasi menggunakan enzim T4 DNA ligase, c) Proses amplifikasi DNA genom pengapit transposon dengan inverse PCR. ... 5
3 Penampilan koloni B. japonicum KDR 15, BJ 11, dan BJ 38 pada media YMA + MK 0.0025 % + Rif 50 µg/ml, setelah inkubasi 10 hari pada suhu ruang ... 7
4 Penampilan koloni transkonjugan B. japonicum BJ 11 pada media YMA + MK 0.0025% + Rif 50 µg/ml + Km 50 µg/ml... 7
5 Penampilan koloni mutan B. japonicum BJ 11 (umur 4 hari) pada media YMA + MK 0.0025% + Rif 50 µg/ml + Km 50 µg/ml digunakan sebagai master plate... 7
6 Penampilan koloni mutan B. japonicum BJ 11 di media Ayanaba ( umur 5 hari) yang diinkubasi selama lima hari pada suhu ruang.. ... 8
7 Hasil elektroforesis gel agarosa 1% dari DNA genom pengapit transposon yang diamplifikasi dengan inverse PCR dari genom mutan BJ 11. Sumur 1: marker DNA (1 kb ladder plus), sumur 2: DNA hasil inverse PCR (25). ... 8
8 Peta plasmid rekombinan pGEMT-11 (~3.8 kb) hasil ligasi fragmen DNA genom pengapit transposon (~0.8kb) dengan pGEM T - Easy (~3kb)... 8
9 Hasil elektroforesis plasmid pGEMT-11 yang dipotong dengan enzim EcoRI dan hasil verifikasi dengan PCR ... 9
DAFTAR LAMPIRAN
Halaman
1 Skema proses mutagenesis dengan transposon ... 18
PENDAHULUAN
Latar Belakang
Keasaman tanah merupakan salah satu faktor pembatas bagi pertumbuhan dan perkembangan tanaman maupun mikrobiota tanah. Faktor keasaman tanah ini disebabkan rendahnya konsentrasi fosfor (P) dan tingginya konsentrasi aluminium (Al). Pada tanah basa, Al berada dalam bentuk anion yakni Al(O H)4-,
sedangkan pada tanah asam Al terdapat dalam bentuk kation Al3+ dan hidroksi Al (Al (H2O)63+) yang bersifat toksik (Flis et al. 1992).
Pada keadaan tanah asam pengaruh Al lebih besar dibandingkan P maupun pH rendah (Keyser & Munns 1979).
Efektivitas sistem simbiosis antara bakteri bintil akar (BBA) dengan tanaman legum juga dipengaruhi oleh kondisi tanah. Keyser & Munns (1979) menyatakan bahwa Al dengan konsentrasi tinggi (50 µM) merupakan salah satu faktor cekaman yang dapat menghambat pertumbuhan dan memperpanjang fase lag BBA. Richardson et al. (1988) juga menyatakan bahwa konsentrasi Al sebesar 7.5 µM pada pH 4.8 dapat menghambat ekspresi gen nod pada BBA yang berperan untuk nodulasi. Selain itu, Goss et al. (1990) menyatakan bahwa tanah asam merupakan faktor pembatas bagi Rhizobium meliloti untuk menginvasi akar Medicago spp. dalam upaya membentuk bintil akar. Sealin itu, Johnson dan Wood (1990) menyatakan bahwa kation Al3+ dapat mengikat PO43- pada DNA sehingga
menghambat proses replikasi DNA BBA. Galur -galur BBA yang toleran terhadap tanah asam sangat penting digunakan sebagai inokulan tanaman legum pada lahan pertanian asam. BBA berperan dalam memfiksasi nitrogen (N2) dan mengubahnya menjadi amonium (NH4+) yang dapat digunakan oleh
tanaman sebagai simbionnya. Bradyrhizobium japonicum yang efektif dapat memenuhi 50% kebutuhan nitrogen tanaman kedelai (Tomkins et al. 2001)
Beberapa galur BBA kedelai tumbuh lambat (Glycine max (L) Merrill) dari bakteri B. japonicum telah diketahui mampu tumbuh pada media Keyser dan Munns dengan pH 4.5. Beberapa galur di antaranya toleran terhadap konsentrasi Al yang tinggi, dibuktikan dengan kemampuannya tumbuh pada media Ayanaba yang mengandung Al 50 µM pada pH 4.5 (Endarini 1995). Keyser & Munns (1979) menyatakan bahwa tidak semua rhizobia toleran asam (pH 4.5 - 6) memiliki sifat toleran terhadap konsentrasi Al tinggi (50 µM). Sifat toleran asam-Al pada B. japonicum disebabkan
oleh kemampuannya untuk memelihara kestabilan pH internalnya mendekati basa saat pH eksternal menurun (O’Hara et al. 1989), karena kemampuan ini maka bentuk Al yang toksik akan berkurang toksisitasnya jika masuk ke dalam sel (Flis et al. 199 2). Selain itu B. japonicum tahan asam-Al juga mampu mengekstraksi senyawa alkalin ke lingkungan untuk meningkatkan pH eksternal (Jordan 1984).
Penelitian mengenai B. japonicum toleran asam – Al indigenus telah banyak dilaporkan. Pada tahun 1995, Endarini et al. melakukan seleksi galur-galur B. japonicum indigenus toleran media asam-Al. Penelitian mengenai transfer gen inaZ pada beberapa galur B. japonicum toleran asam-Al dilakukan oleh Ariyani et al. (1999). Selain itu, pada tahun 2001 Sakinah et al . melakukan uji aktivitas ekstrak kasar enzim protokatekuat 3,4 dioksigenase dari beberapa galur B. japonicum. Namun demikian, telaah mengenai gen yang bertanggung jawab terhadap sifat toleran asam-Al B. japonicum indigenus belum dilakukan.
Saat ini, mutagenesis dengan transposon merupakan teknik yang bany ak digunakan untuk keperluan analisis genetika molekuler pada berbagai macam bakteri (Voelker & Dybvig 1998) dan fungi (Firon et al. 2003). Transposon merupakan elemen DNA yang dapat loncat atau menyisip dari satu tempat ke tempat lainnya dalam DNA (Snyder & Champness 2003). Mutagenesis dengan transposon telah digunakan oleh Autret et al. (2001) untuk mengidentifikasi gen yang terlibat dalam sifat virulensi bakteri patogen pada manusia, Listeria monocytogenes. Selain itu Wahyudi et al. (1998) menggunakan transposon untuk keperluan analisis gen-gen penanda molekuler pada B. japonicum. Teknik mutagenesis ini juga digunakan oleh Wahyudi et al. (2001) untuk mengisolasi mutan defektif dalam pembentukan partikel magnet pada Magnetospirillum magneticum guna mengetahui gen yang berperan dalam sintesis partikel magnet.
dalam penelitian ini ialah mini-Tn5Km1 yang membawa gen penanda resistensi terhadap kanamisin. Mini -Tn5Km1 merupakan salah satu tipe transposon turunan dari transposon Tn5 (de Lorenzo et al. 1990). Transposon ini dapat menyisip secara acak pada genom bakteri dan penyisipannya bersifat stabil (Herrero et al. 1990). Penyisipan mini-Tn5Km1 ke dalam genom akan menyebabkan bakteri tersebut memiliki sifat resisten terhadap kanamisin.
Dalam penelitian ini, mutagenesis dengan transposon digunakan untuk mendapatkan mutan B. japonicum yang sensitif asam-Al sedangkan untuk mengetahui daerah penyisipan transposon digunakan teknik inverse PCR (Huang et al. 2000; Wahyudi et al. 2001). Daerah sisipan (flanking DNA) merupakan lokasi gen yang diduga berperan dalam sifat toleran asam-Al. Selanjutnya, dilakukan kloning fragmen DNA pengapit transposon tersebut ke dalam sel E. coli DH5a dengan transformasi. Karakterisasi parsial tersebut diharapkan menjadi langkah awal untuk karakterisasi lebih lanjut guna memperoleh sekuen gen lengkap yang berperan dalam sifat toleransi asam-Al pada B. japonicum.
Tujuan
Melakukan kloning fragmen DNA genom B. japonicum yang terlibat dalam toleransi asam-Al melalui mutagenesis dengan transposon.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Desember 2004 hingga Oktober 2005 di Laboratorium Mikrobiologi dan Laboratorium Research Center for Microbial Diversity (RCMD),Departemen Biologi, FMIPA, IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini ialah B. japonicum toleran asam-Al galur KDR 15, BJ 11 , dan BJ 38. Galur -galur tersebut diperoleh dari hasil penelitian Tedja-Imas et al. (1994) dan Endarini et al. (1995). Escherichia coli yang membawa pUTmini-Tn5Km1 (E. coli S-17-1 (λ pir)) digunakan sebagai donor dalam proses transposon mutagenesis.
B. japonicum secara rutin ditumbuhkan pada media Yeast Extract Manitol Agar (YMA) (manitol 10 g/L, K2HPO4 0.5 g/L,
MgSO4.7H2O 0.2 g/L, NaCl 0.2 g/L, ekstrak
khamir 5 g/L) + merah kongo 0.0025%. Sedangkan E. coli S-17-1 (λ pir) secara rutin ditumbuhkan pada media Luria Agar (LA)
dengan komposisi media: tripton 10 g/L, NaCl 10 g/L, ekstrak khamir 5 g/L, agar-agar 15 g/L + kanamisin 50 µg/mL. Media lain yang digunakan ialah Luria Agar modifikasi dengan kadar NaCl 10% dari komposisi media LA (tripton 5 g/L, NaCl 1 g/L, ekstrak khamir 5 g/L, agar-agar 15 g/l). Selain itu juga digunakan media LB (komposisi media LA tanpa penambahan agar-agar), dan media LB modifikasi (komposisi media LA modifikasi tanpa penambahan agar-agar). Pada proses seleksi mutan digunakan media Ayanaba (Ayanaba et al. 1983).
Bahan kimia yang digunakan kanamisin (Km) 50 µg/mL, ampisilin (Ap) 50 µg/m L, rifampisin (Rif) 100µg/mL, merah kongo (MK), NaCl 0.85 %, etanol 70% dan 100%, alkohol 95%, etidium bromida, bufer TE 1X (10mM Tris pH 7.5-8.0; 1mM EDTA) dan agarosa. Bahan yang digunakan untuk tahapan inverse PCR dan persiapannya ialah sebagai berikut: (a) proses pemotongan DNA genom menggunakan satu unit enzim restriksi EcoRV (Promega); (b) bahan untuk PCR yang digunakan ialah ddH2O steril,
PCR buffer, dNTP, primer hulu KmO (5’-ACACTGATGAATGTTCCGTT G-3’) dan primer hilir KmI (5’-ACCTGCAG GCATGCAAGCTTC-3’) serta LA Taq Polymerase (Takara) (c) bahan yang digunakan untuk proses ligasi ialah enzim T4 DNA ligase, bufer ligasi, bovin serum albumin (BSA), dan ddH2O steril.
Proses transformasi dan persiapannya diawali dengan: purifikasi DNA dengan menggunakan metode Wizard® SV Gel & PCR Clean-up System (Promega, USA). Selanjutnya dilakukan proses ligasi .Komponen ligasi yang digunakan ialah bufer ligasi, enzim T4 DNA ligase (Promega), pGEMT-Easy (ampr; Promega)
dan DNA sisipan. Untuk penyiapan sel kompeten diperlukan isolat sel inang E. coli DH5a yang ditumbuhkan pada media LB, larutan CaCl2 dingin (CaCl2 0.1 M, Tris HCl
5 mM, MgCl2 5 mM pada pH 7). Untuk proses transformasi diperlukan larutan A (glukosa 50 mM, Tris-Cl [pH 8], EDTA 10 mM [pH 8]), larutan B (0.2 M NaOH; 1% (b/v) SDS), dan larutan C (CH3COOK 5M,
asam asetat glasial, akuades) Untuk proses seleksi transforman diperlukan media LA+ Ap 50 µg/mL + X -gal 40 µg/mL.
meter (Hanna Instruments, Jerman), mesin PCR 2400 (Perkin-Elmer), piranti elektroforesis (BioRad, USA), UV transilluminator, kamera (Polaroid DS-34, USA), dan alat laboratorium umum lainnya.
Metode
Peremajaan B. japonicum Toleran Asam-Al. B. japonicum yang berada dalam ruang penyimpanan diremajakan kembali dengan menginokulasikan koloni yang ada ke dalam agar miring YMA yang baru dan steril. Kondisi inkubasi dilakukan pada suhu ruang selama 7-8 hari, kemudian masing-masing biakan digoreskan pada cawan YMA+ merah kongo 0.0025 % + Rif 50 µg/ mL. B. japonicum diketahui resisten terhadap rifampisin (Wahyudi 1996).
Mutagenesis dengan Transposon.
Konstruksimutan B. japonicum sensitif asam-Al dilakukan dengan menyisipkan transposon mini-Tn5Km1, yang dibawa plasmid pUTmini-Tn5Km1 (Gambar 1) dalam E. coli S 17-1 (λ pir) ke dalam genom B. japonicum secara diparental mating (Lampiran 1). Pada proses mutagenesis ini, E. coli S 17-1 (λ pir) disebut sebagai donor (D) dan B. japonicum disebut sebagai resipien (R). Biakan R ditumbuhkan pada 50 mL Yeast Mannitol Broth (YMB) + Rif 100 µg/mL dalam erlenmeyer 250 mL. Selanj utnya diinkubasi pada inkubator bergoyang dengan kecepatan 140 rpm, pada suhu ruang selama 60 jam. Sementara itu biakan D ditumbuhkan pada media LB 50 mL + Km 50 µg/m L dalam erlenmeyer 250 m L. Inkubasi dilakukan dalam inkubator bergoyang dengan kecepatan 140 rpm, suhu 370C selama 18-20 jam.
Jum Lah sel R dan D pada masing-masing media kaldu dihitung dengan menggunakan hemasitometer Neubauer. Perbandingan ju mlah sel donor dengan resipien yang digunakan ialah 1:1 (pada kisaran 108:108). Sesuai dengan perbandingan tersebut diambil volume tertentu dari kultur dan dipanen selnya. Sel R dicuci dan diresupensi dalam garam fisiologis (NaCl 0.85%) sebanyak 3 kali dengan cara disentrifugasi selama 10 menit pada 17500 g. Supernatan yang didapat dibuang, dan pelet dicuci dengan garam fisiologis, demikian pula bagi sel D , namun sel D disentrifugasi pada 800 g selama 5 menit.
Pelet sel R yang telah dipanen ditambahkan LB modifikasi sebanyak 40µL. Suspensi sel R kemudian dipindahkan ke dalam tabung mikro 1.5 mL yang berisi pelet sel D . Suspensi campuran D dan R kemudian diresuspensi
perlahan dan dipindahkan ke atas membran milipore steril yang diletakkan di atas media LA modifikasi. Inkubasi dilakukan selama 12, 18 , dan 24 jam. Pelet sel donor dan resipien juga diletakkan di atas membran milipore sebagai kontrol negatif. Pada masing-masing jam inkubasi yang telah ditentukan, membran milipore diangkat dan dimasukkan ke dalam tabung mikro 1.5 mL yang berisi 1 mL garam fisiologis , kemudian dikocok dengan kocok untuk melepaskan sel dari membran. Tiap 100 µL suspensi disebarkan di atas media YMA + Rif 50 µg/mL + Km 50 µg/mL + MK 0.0025% dan diinkubasi selama 5-7 hari.
Gambar 1. a) P eta plasmid pUT mini-Tn5Km1 (7.055 kb) yang berada dalam sel E. coli S17-1 (λ pir), b) peta restriksi transposon mini-Tn5Km1 (1.835 kb) yang membawa gen resistensi kanamisin.
Seleksi Mutan. Sel transkonjugan yang tumbuh pada masing-masing cawan YMA + MK 0.0025% + Rif 50 µg/mL + Km 50 µg/mL dibuat replikanya pada media yang sama. Kemudian tiap koloni pada cawan replika dipindahkan pada media Ayanaba (pH 4.5) yang ditambahkan 50 µM Al (Lampiran 2). Penambahan NaOH atau HCl untuk penetapan pH media dilakukan sebelum dan setelah sterilisasi. Inkubasi dilakukan pada suhu 280C. Koloni yang tidak menampakkan pertumbuhan merupakan koloni B. japonicum yang sensitif terhadap asam dan Al.
a)
Selanjutnya setiap mutan B. japonicum sensitif asam-Al dilakukan verifikasi ulang pada media Ayanaba dengan menggoreskan satu lup penuh koloni mutan. Jika tidak terdapat pertumbuhan maka koloni B. japonicum tersebut yang akan digunakan untuk telaah molekuler.
Isolasi DNA Genom Mutan B. japonicum Sensitif Asam -Al. Isolasi DNA genom dilakukan dengan menggunakan metode CTAB (Sambrook & Russel 2001). Sel mutan B. japonicum terlebih dahulu diproduksi dengan menginokulasikan s atu lup penuh biakan ke dalam 50 mL media cair YMB + Rif 50 µg/mL + Kan 50 µg/mL yang diinkubasi selama 4-5 hari, pada suhu ruang di inkubator bergoyang dengan kecepatan 60 rpm.
Sebanyak 50 mL kultur sel mutan B. japonicum diambil dan dimasukkan ke dalam 2 tabung sentrifugasi 50 mL steril masing-masing 25 mL. Kemudian disentrifugasi selama 10 menit pada kecepatan 8500 g. Pelet yang didapat kemudian diresuspensi dengan 250 µl bufer TE (1X), dan dipindahkan ke dalam tabung mikro 1.5 mL steril. Kemudian disentrifugasi kembali pada kecepatan 9000 g. selama 10 menit, proses ini diulang 2-3 kali. Suspensi kemudian ditambahkan 5 µL lisozim, tabung mikro 1.5 mL dibolak-balik untuk mempercepat lisis sel. Selanjutnya, suspensi diinkubasi pada suhu 370C selama 30 menit. Proses lisis sel dilan jutkan dengan menambahkan 500 µL SDS 10% dan proteinase K sebanyak 10 µL, tabung mikro 1.5 mL kemudian dibolak-balik. Suspensi diinkubasi pada suhu 370C selama 60 menit. Sebanyak 80 µ L NaCl dan 100 µL CTAB 10% ditambahkan ke dalam suspensi, kemudian diinkubasi pada suhu 650C selama 20 menit, tabung kembali dibolak-balik.
Purifikasi DNA dan pengendapan debris sel dilakukan dengan menambahkan 650 µL fenol : kloroform : isoamilalkohol (25:24:1). DNA dipisahkan dari debris sel dengan cara disentrifugasi pada 13000 g selama 10 menit. Supernatan yang mengandung DNA dipurifikasi dengan menambahkan 650 µ L kloroform:isoamil alkohol (24:1) dan selanjutnya disentrifugasi pada 13000 g selama 10 menit. Untuk pengendapan DNA, supernatan yang didapat ditambahkan etanol absolut sebanyak 2 kali volume supernatan dan sodium asetat 3M 10 % volume, pengendapan dibantu dengan inkubasi di dalam mesin pembeku (-200C) selama 30 menit dan kemudian dilakukan sentrifugasi pada 13000 g selama 15 menit. Pelet yang didapatkan
ditambahkan 70% etanol dingin untuk mengikat air. Suspensi kembali disentrifugasi (13000 g; 15 menit), fase supernatan dibuang sedangkan pelet dikeringudarakan dengan cara membuka tutup tabung mikro 1.5 mL dan dibiarkan selama beberapa jam (2-3 jam). Kemudian pelet DNA dilarutkan dalam 20 µL ddH2O
steril.
Amplifikasi DNA Genom Pengapit Transposon dengan Inverse PCR. Proses amplifikasi dengan teknik inverse PCR ter diri atas 2 tahap yakni penyiapan DNA cetakan dan amplifikasi dengan inverse PCR.
DNA cetakan yang digunakan untuk inverse PCR ialah DNA hasil pemotongan dengan enzim EcoRV dan diligasi dengan enzim T4 DNA ligase. Pemotongan DNA dilakukan dengan mencampurkan berturut-turut bufer restriksi 2 µL, BSA 1 µL, dan enzim EcoRV 0.1 µ L, kemudian campuran ditera dengan ddH2O hingga volume akhir
20 µ L. Campuran diinkubasi pada suhu 370C selama 3 jam (Gambar 2a). DNA yang telah dipotong dengan enzim EcoRV kemudian diekstraksi dengan menggunakan metode ekstraksi fenol/kloroform.
Proses ekstraksi dilakukan dengan menambahkan 80 µL ddH2O pada tabung
mikro 1.5 mL yang berisi DNA hasil pemotongan dengan enzim EcoRV. Kemudian ditambahkan larutan fenol: kloroform: isoamilalkohol (25:24:1) satu kali volume DNA (100 µL). Suspensi tersebut kemudian disentrifugasi pada 13000 g selama 15 menit, fase aquosa kemudian dipindahkan pada tabung mikro 1.5 mL baru dan steril. Kemudian DNA dipresipitasi dengan etanol absolut dan 0.1 volume sodium asetat 3 M, untuk kemudian diinkubasi pada -200C selama 30 menit. DNA yang terpotong kemudian dicuci dua kali dengan menggunakan etanol 70% dan disentrifugasi pada 13000 g selama 15 menit. Pelet DNA kemudian dikeringudarakan selama 2-3 jam. Pelet DNA dilarutkan dalam 5 µL ddH2O steril.
DNA yang telah dipotong kemudian diligasi dengan menggunakan enzim T4 DNA ligase.
enzim T4 DNA ligase sebanyak 1 µ L, campuran dilarutkan dengan ddH2O hingga
volume reaksi 20 µL. Campuran kemudian diinkubasi pada suhu 40C selama semalam (Gambar 2b).
Fragmen DNA genom yang mengapit transposon pada mutan B. japonicum diamplifikasi dengan menggunakan teknik inverse PCR (Gambar 2c). Fragmen sirkuler DNA yang mengapit transposon mini-T n5Km1 diamplifikasi dengan menggunakan mesin PCR pada reaksi campuran dengan volume total 50 µl yang mengandung 8 µL dNTP, 25 µ L GC buffer II, 0.5 µ L LA Taq Polymerase, masing-masing 1µ L primer KmI dan KmO dengan konsentrasi 10 pmol kemudian ditambahkan DNA (hasil ligasi) sebanyak 6µ L. Campuran ditera dengan ddH2O hingga volume
akhir 50 µL. Proses denaturasi DNA cetakan dilakukan pada suhu 950C selama 2 menit, annealing pada 580C selama 1 menit dan elongasi pada suhu 720C selama 1 menit dan 10
menit untuk siklus terakhir. DNA diamplifikasi sebanyak 30 siklus. Produk PCR kemudian dielektroforesis pada 1% agarosa untuk mendeterminasi ukuran fragmen.
Kloning Fragmen DNA Genom Pengapit Transposon. Proses kloning fragmen DNA ini meliputi beberapa tahapan yakni purifikasi fragmen DNA hasil inverse PCR, ligasi DNA sisipan hasil purifikasi ke dalam plasmid pGEMT-Easy, transformasi plasmid
rekombinan ke dalam sel E. coli DH5a, dan verifikasi dengan memotong plasmid rekombinan dengan enzim EcoRI.
Purifikasi DNA dilakukan dengan menggunakan Wizard® SV Gel & PCR Clean-up System (Promega, USA). Metode purifikasi ini berperan dalam mengisolasi DNA dari gel agarosa hasil elektroforesis. Setelah elektroforesis, gel yang berisi pita DNA yang dikehendaki dipotong dan hasil cacahan dari gel tersebut dimasukkan ke dalam tabung mikro 1. 5 mL. Kemudian ke dalam tabung tersebut ditambahkan 10 µL membran e binding solution per 10 mg cacahan gel, lalu dikocok dan diinkubasi pada suhu 50-65oC sampai gel benar-benar
larut. Setelah melarutkan gel dilakukan pengikatan DNA dengan memasukkan campuran gel ke dalam tabung penampung yang dilengkapi dengan minikolom dan diinkubasi pada suhu ruang selama 1 menit. Selanjutnya tabung penampung tersebut disentrifugasi pada kecepatan 10000 g selama 1 menit, cairan yang melewati minikolom dibuang dan minikolom dimasukkan kembali pada tabung penampung. Proses pencucian dilakukan dengan menambahkan 700 µL membrane wash solution yang mengandung etanol dan disentifugasi pada kecepatan 10000 g selama 1 menit. Cairan dibuang dan minikolom dimasukkan kembali pada tabung penampung.
EcoRV c) b) EcoRV
EcoRV
Gambar 2. Skema proses amplifikasi fragmen DNA genom pengapit transposon. a) DNA genom B. japonicum mutan sensistif asam-Al yang dipotong dengan enzim EcoRV, b) Proses sirkularisasi menggunakan enzim T4 DNA ligase, c) Proses amplifikasi DNA genom pengapit transposon dengan inverse PCR.
a)
b)
c)
Tahap pencucian diulang dengan menambahkan 500 µL membrane wash solution dan disentrifugasi kembali pada kecepatan yang sama selama 5 menit. Untuk proses elusi, minikolom dipindahkan dengan hati-hati pada tabung mikro 1.5 mL yang baru dan ditambahkan 50 µL air bebas nuklease pada minikolom. Lalu diinkubasi pada suhu ruang selama 1 menit dan disentrifugasi pada kecepatan 10000 g selama 1 menit. Minikolom dibuang dan DNA yang tertampung pada tabung mikro 1.5 mL disimpan pada suhu 4oC atau –20oC.
DNA hasil purifikasi kemudian digunakan sebagai DNA sisipan untuk diligasikan ke dalam vektor plasmid pGEMT-Easy . Ligasi dilakukan dengan mencampurkan berturut -turut bufer ligase 2 µ L, DNA 2 µL, dan enzim T4 DNA ligase 1 µL. Campuran kemudian dilarutkan dengan ddH2O hingga volume reaksi
20 µL dan kemudian diinkubasi pada suhu optimum ligasi (40C, semalam).
Plasmid rekombinan yang terbentuk kemudian ditransformasi ke dalam sel E. coli DH5a. Tahap awal proses transformasi ialah penyiapan sel kompeten. Pembentukan sel kompeten dilakukan dengan menggunakan larutan CaCl2 dingin. Sebanyak satu lup sel E. coli DH5a ditumbuhkan p ada media LB 25 m L, dan diinkubasi selama 16 jam dan suhu 370C pada inkubator bergoyang 150 rpm. Sel E. coli DH5a kemudian disubkultur pada kondisi dan media yang sama selama 3 jam.
Sebanyak 1.5 m L kultur dimasukkan ke dalam tabung mikro 1.5 mL steril dan disentrifugasi pada 2300 g selama 2 menit. Supernatan yang terbentuk dibuang sedangkan pelet diresuspensi dengan larutan CaCl2 dan
diinkubasi di es 20 menit untuk kemudian disentrifugasi pada 2300 g selama 2 menit. Pelet kemudian dicuci dengan larutan CaCl2 dan diinkubasi di dalam es selama 10 menit.
Transformasi dilakukan dengan menggunakan metode renjatan panas (Sambrook & Russel 2001). Transformasi diawali dengan mencampurkan 200 µL sel kompeten dengan 3 µl plasmid rekombinan. Suspensi kemudian diinkubasi selama 1 menit pada suhu 420C (renjatan panas) dan dengan segera diinkubasi di es selama 2 menit.
Sebanyak 250 µL media LB ditambahkan ke dalam suspensi, untuk kemudian diinkubasi pada inkubator bergoyang (150 rpm) selama satu jam pada suhu 370C. Suspensi selanjutnya disentrifugasi pada 2300 g selama 2 menit, pelet yang terbentuk diresuspensi dengan 200 µ L LB. Sebanyak 100 µ L suspensi disebar pada media LA + Ap 50 µg/mL + X-gal 40µ g/mL.
Sel E. coli D H5a rekombinan akan menampilkan koloni berwarna putih.
Beberapa koloni putih yang terbentuk kemudian dikulturkan di media LB untuk keperluan isolasi plasmid dan verifikasi. Tahap awal isolasi plasmid dilakukan dengan memanen sel E. coli DH5a rekombinan dari 1.5 mL kultur. Pelet yang terbentuk ditambahkan 100µL larutan A dan kemudian dikocok. Suspensi kemudian ditambahkan 125 µ L larutan B dan 375 µ Llarutan C, tabung dibolak-balik perlahan untuk memacu lisis. Suspensi kemudian disentrifugasi (2300 g, 15 menit), supernatan yang terbentuk dipindahkan ke tabung mikro 1.5 mL baru. Presipitasi plasmid dilakukan dengan menambahkan etanol absolut dan sodium asetat 3 M (10 % volume total). Kemudian suspensi dicuci dengan etanol 70%. Plasmid rekombinan yang terisolasi dilarutkan dengan 10 µL ddH20.
Verifikasi dilakukan dengan melakukan proses digesti plasmid rekombinan dengan enzim EcoRI. Digesti dilakukan dengan mencampurkan 2 µL plasmid rekombinan, 2 µl bufer res triksi dan 0.5 µL enzim EcoRI. Suspensi kemudian diinkubasi pada suhu optimum enzim restriksi (370C selama 3 jam ). Visualisasi hasil restriksi dilakukan dengan cara elektroforesis pada gel agarosa 1%.
Hasil pemotongan plasmid rekombinan yang mencirikan keberadaan fragmen DNA insert (DNA pengapit transposon) kemudian diverifikasi kembali melaui PCR menggunakan primer KmO dan KmI, dengan plasmid rekombinan sebagai templateannealing. Verifikasi dengan PCR dilakukan pada 50µL reaksi yang terdiri dari 8 µ L dNTP, 25 µ L GC buffer I, 0.5 µ L LA Taq Polymerase, masing-masing 1µ L primer KmI dan KmO dengan konsentrasi 10 pmol kemudian ditambahkan DNA plasmid rekombinan sebanyak 1µ L. Campuran ditera dengan ddH2O hingga volume akhir 50 µL.
Tabel 1 Frekuensi transkonjugasi transposon mini-Tn5Km1 dari E. coli S 17-1 (? pir) ke B. japonicum pada berbagai waktu inkubasi mating
HASIL
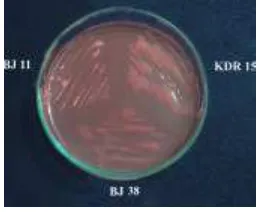
Peremajaan B. japonicum Toleran asam-Al B. japonicum galur KDR 15, BJ 11 dan BJ 38 telah berhasil diremajakan di dalam media YMA + merah kongo 0.0025 % + Rif 50 µg/mL (Gambar 3). Koloni ketiga galur B. japonicum ini berbentuk bulat, berwarna putih, elevasi cembung, dengan diameter koloni melebihi 1 mm setelah inkubasi 10 hari pada suhu ruang dan memiliki konsistensi lengket dan berlendir. Tipe koloni KDR 15, BJ 38 dan BJ 11 umumnya disebut dengan tipe large watery
Gambar 3. Penampilan koloni B. japonicum KDR 15, BJ 11, dan BJ 38 pada media YMA + MK 0.0025 % + Rif 50 µ g/mL setelah inkubasi 10 hari pada suhu ruang.
Mutagenesis dengan Transposon
Frekuensi transkonjugasi tertinggi untuk B. japonicum KDR 15 dan BJ 11 didapatkan pada waktu inkubasi 24 jam, sedangkan untuk B. japonicum BJ 38 didapatkan pada waktu inkubasi 18 jam. Rata-rata frekuensi konjugasi untuk ketiga galur berada pada kisaran 10-6-107
sel/ resipien (Tabel 1).
Pada proses mutagensesis ini didapatkan koloni transkonjugan yang cukup banyak (Gambar 4). Hasil sebar koloni transkonjugan B. japonicum galur KDR 15 dan BJ 38 memperlihatkan penampilan koloni yang sama. Sel transkonjugan merupakan sel B. japonicum yan g genomnya tersisipi mini - Tn5Km1 sehingga memiliki sifat resistensi kanamisin.
Gambar 4. Penampilan koloni transkonjugan B. japonicum BJ 11 pada media YMA + MK 0.0025% + Rif 50 µg/mL + Km 50 µg/mL.
Seleksi Mutan
Seleksi diawali dengan mereplika hasil sebar B. japonicum hasil mating pada pada media YMA + MK 0.0025% + Rif 50 µg/mL + Km 50 µg/mL (Gambar 5). Hanya sel B. japonicum yang tersisipi mini-Tn5 Km1 saja yang mampu tumbuh pada media tersebut.
Gambar 5. Penampilan koloni mutan B. japonicum BJ 11 (umur 4 hari) pada media YMA + M K 0.0025% + Rif 50 µg/m L + Km 50 µg/mL.
Hasil replika tersebut kemudian dijadikan master plate untuk koloni B. japonicum yang diuji ke media Ayanaba yang mengandung Al 50µM pada pH 4.5 (Gambar 6). Koloni B. japonicum yang tidak mampu tumbuh pada media Ayanaba dipilih untuk diuji lebih lanjut.
Konjugasi bakteri Frekuensi transkonjugasi
12 jam 18 jam 24 jam Rata- Rata
B. japonicum KDR 15 x E. coli S-17-1 (λ pir)
B. japonicum BJ 11 x E. coli S-17-1 (λ pir)
B. japonicum BJ 38 x E. coli S-17-1 (λ pir)
3.4 x 10 -6
6.7 x 10-7
6.1 x 10-8
5.1 x 10 -6
1.1 x 10-6
6.5 x 10 -7
6.3 x 10 -6
7.1 x 10-6
1.3 x 10 -7
4.9 x 10-6
3.0 x 10-6
1 0.85
~0.8 kb
1 2
12 kb
3
Gambar 6. Penampilan koloni mutan B. japonicum BJ 11 di media Ayanaba (umur 5 hari). Tanda X merupakan koloni B. japonicum BJ 11 yang sensitif asam-Al. WT: wild type.
Dari proses seleksi mutan didapatkan satu mutan sensitif asam-Al dari B. japonicum galur KDR 15, tiga mutan dari galur BJ 11 dan satu mutan dari BJ 38. Nomor sandi untuk mutan B. japonicum KDR 15 ialah KDR 15 (30), untuk BJ 11 ialah BJ 11 (24), BJ 11 (25), dan BJ 11 (37) dan untuk BJ 38 ialah BJ 38 (22). Persentase pembentukan mutan B. japonicum sensitif asam-Al terendah terjadi pada galur KDR 15, sedangkan tertinggi terjadi pada galur BJ38. Persentase pembentukan mutan ini sangat tergantung dari jumlah koloni transkonjugan yang didapatkan (Tabel 2).
Amplifikasi DNA Genom Pengapit
Transposon dengan Inverse PCR Pertumbuhan sel mutan BJ 11 (25) relatif
lebih mudah dibandingkan dengan sel mutan dari galur lain sehingga galur ini dipilih untuk telaah molekuler lebih lanjut. Hasil inverse PCR menunjukkan ukuran fragmen DN A sebesar 0.8 kb (Gambar 7) yang diduga memiliki peranan dalam sifat toleransi asam-Al B. japonicum galur BJ 11.
Gambar 7. Hasil elektroforesis gel agarosa 1% dari DNA genom pengapit transposon yang diamplifikasi dengan inverse PCR dari genom mutan BJ 11. Sumur 1: marker DNA (1 kb ladder plus), sumur 2: DNA hasil inverse PCR.
Kloning Fragmen DNA Genom Pengapit Transposon
Fragmen DNA pengapit transposon telah berhasil diligasi kedalam vektor plasmid pGEMT-Easy (~3 kb) membentuk plas mid rekombinan pGEMT-11 (~3.8 kb) (Gambar 8). pGEMT-11 juga telah berhasil ditransformasi ke dalam sel E. coli DH5a. Dua k oloni putih hasil transformasi dipilih untuk verifikasi plasmid rekombinan.
Gambar 8. Peta Plasmid rekombinan pGEMT-11 (~3.8 kb) hasil ligasi fragmen DNA genom pengapit transposon (~0.8kb) dengan pGEMT- Easy (~3kb).
B. japonicum Jumlah koloni transkonjugan
Jumlah mutan B. japonicum sensitif asam-Al
Persentase terbentuknya mutan sensitif asam-Al (%)
KDR 15 2057 1 0.04
BJ 11 BJ38
1293 141
3 1
0.22 0.71
X WT
Tabel 2 Persentase pembentukan mutan sensitif asam-A l
2 1.65
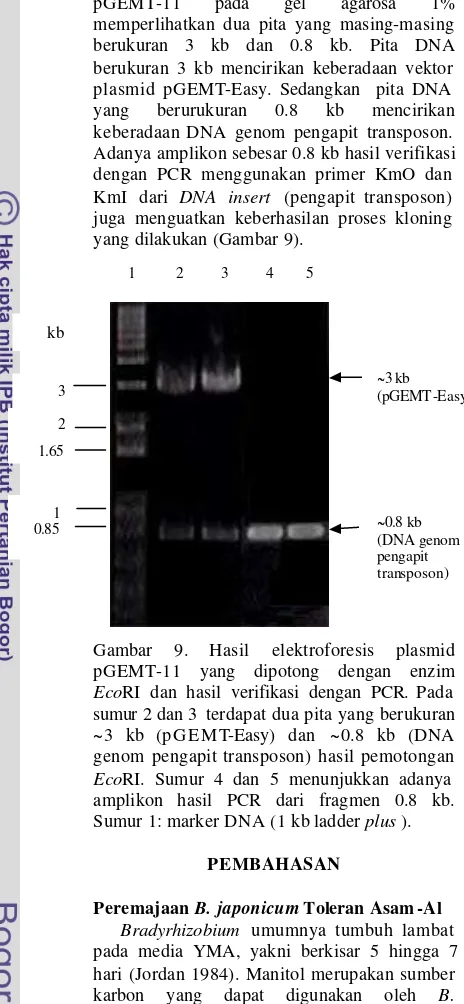
Hasil verifikasi plasmid rekombinan pGEMT-11 pada gel agarosa 1% memperlihatkan dua pita yang masing-masing berukuran 3 kb dan 0.8 kb. Pita DNA berukuran 3 kb mencirikan keberadaan vektor plasmid pGEMT-Easy. Sedangkan pita DNA yang berurukuran 0.8 kb mencirikan keberadaan DNA genom pengapit transposon. Adanya amplikon sebesar 0.8 kb hasil verifikasi dengan PCR menggunakan primer KmO dan KmI dari DNA insert (pengapit transposon) juga menguatkan keberhasilan proses kloning yang dilakukan (Gambar 9).
Gambar 9. Hasil elektroforesis plasmid pGEMT-11 yang dipotong dengan enzim EcoRI dan hasil verifikasi dengan PCR. Pada sumur 2 dan 3 terdapat dua pita yang berukuran ~3 kb (pGEMT-Easy) dan ~0.8 kb (DNA genom pengapit transposon) hasil pemotongan EcoRI. Sumur 4 dan 5 menunjukkan adanya amplikon hasil PCR dari fragmen 0.8 kb. Sumur 1: marker DNA (1 kbladder plus ).
PEMBAHASAN
Peremajaan B. japonicum Toleran Asam -Al Bradyrhizobium umumnya tumbuh lambat pada media YMA, yakni berkisar 5 hingga 7 hari (Jordan 1984). Manitol merupakan sumber karbon yang dapat digunakan oleh B. japonicum dalam media tersebut.
Merah kongo yang digunakan dalam media ini berperan dalam membedakan antara koloni B. japonicum dengan kontaminan. Menurut Somasegaran dan Hoben (1994), B. japonicum umumnya kurang atau tidak mampu menyerap warna merah kongo pada konsentrasi 0.0025% yang ditambahkan pada media YMA jika diinkubasi pada ruang gelap, sedangkan
organisme kontaminan akan menyerap kuat warna merah tersebut.
Konsistensi lengket dan berlendir yang dimiliki oleh B. japonicum disebabkan oleh adanya lendir pada permukaan selnya. Menurut Jordan (1984) lendir yang dihasilkan sebagian besar ialah lipopolisakarida ekstraselular. Ciri -ciri tipe koloni KDR 15, BJ 38 dan BJ 11 umumnya disebut dengan tipe large watery. Menurut Keyser & Munns (1979) galur-galur B. japonicum yang menghasilkan lendir banyak atau memiliki tipe koloni large watery lebih memiliki sifat toleran terhadap kondisi asam dibandingkan tipe koloni yang sedikit menghasilkan lendir atau yang biasa disebut dengan tipe koloni small dry (kering).
B. japonicum telah diketahui memiliki sifat resistensi terhadap antibiotik rifampisin (100 µg/ mL), tetrasiklin (100 µg/m L) dan ampisilin (100 µg/ mL). Namun, B. japonicum tidak mampu tumbuh pada media yang mengandung antibiotik kanamisin (50 dan 100 µ g/m L) (Wahyudi 1996). Sifat sensitivitas terhadap kanamisin ini merupakan salah satu alasan penggunaan transposon mini -Tn5Km1, dengan kanamisin digunakan untuk seleksi mutan.
Mutagenesis dengan Transposon
Waktu inkubasi konjugasi selama 24 jam memperlihatkan frekuensi konjugasi terbesar untuk B. japonicum KDR 15 dan BJ 11. Pada proses konjugasi B. japonicum KDR 15 dengan E. coli S 17-1 (? pir), konsentrasi sel B. japonicum dan E. coli yang digunakan berkisar 6.3 x 108 sel /m L. Sedangkan pada B. japonicum BJ 11 digunakan konsentrasi sel berkisar 1.9 x 108 sel /mL. Kisaran konsentrasi resipien yang sama (~108-109)
juga digunakan oleh Fodor et al. (2001) ketika melakukan konjugasi antara Thiocapsa roseopersicina dengan sel E. coli S 17-1 (? pir) yang membawa Tn5, dan dari hasil konjugasi ini didapatkan frekuensi transkonjugasi sebesar 10- 8. Wahyudi et al. (1998) juga melakukan mutagenesis dengan transposon pada B. japonicum asam-Al dengan nomor galur BJ 11, BJ 33 dan BJ 43. Frekuensi transkonjugasi yang didapatkan secara berurut ialah 3.6 x 10 -9, 2.8 x 10-9, dan 5.7 x 10-9 setelah inkubasi konjugasi selama semalam.
lama memungkinkan terjadinya konjugasi lebih banyak, dan meningkatkan keberhasilan transfer pUTmini-Tn5Km1 yang mengandung mini-Tn5 Km1 dari E. coli S17-1 (? pir) ke dalam sel B. japonicum.
Frekuensi trans konjugasi BJ 38 pada waktu inkubasi 24 jam yang lebih rendah dibandingkan waktu inkubasi 18 jam dapat disebabkan oleh banyak hal diantaranya, kondisi donor yang mudah kehilangan pili pada waktu resuspensi resipien dengan donor. Pili merupakan bagian penting dari sel donor yang berperan sebagai jalur transfer transposon (DNA) dari sel donor ke sel resipien (Willetts 1988).
Perbedaan frekuensi konjugasi antara B. japonicum KDR 15, BJ 11 dengan BJ 38 juga dapat disebabkan oleh perbedaan galur B. japonicum yang digunakan. Berdasarkan Sari (1998), walaupun di antara galur – galur B. japonicum terdapat ciri fisiologi yang sama namun secara genotip berbeda, hal ini didasarkan analisis profil DNA B. japonicum denngan teknik pulsed field gel electrophoresis (PFGE).
Wahyudi et al. (1998) yang juga melakukan proses konjugasi pada B. japonicum BJ 11 mendapatkan frekuensi transkonjugasi sebesar 3.6 x 10 -9. Frekuensi transkonjugasi ini didapatkan dengan melakukan proses konjugasi menggunakan perbandingan konsentrasi sel E. coli 17-1 (? pir) dengan B. japonicum sebesar 1:10. Pada penelitian ini digunakan perbandingan E. coli S17-1 (? pir) dengan B. japonicum sebesar 1:1, dan memperlihatkan frekuensi transkonjugasi yang lebih besar. Hal ini memperlihatkan bahwa perbandingan donor dengan resipiennya mempengaruhi hasil konjugasi.
Perbedaan frekuensi transkonjugasi baik antar galur B. japonicum maupun waktu inkubasi mating, juga dapat disebabkan keberhasilan transposisi yang dipengaruhi oleh DNA polimerase I, faktor terminasi transkripsi (Rho) dan protein serupa histon (Berg 1989). Menurut Braam et al. (1999) frekuensi transposisi juga ditentukan oleh aktivitas gen tnp yang menyandikan enzim transposase (53 kDa; 476 aa) yang berperan dalam proses eksisi transposon dari plasmid pembawanya.
Proses mutagenesis dengan menggunakan transposon mini-Tn5 Km1 yang dibawa oleh plasmid merupakan metode mutagenesis yang telah cukup banyak digunakan. Konstruksi mutan dilakukan dengan metode yang disebut cut and paste (Bhasin et al. 1999). Gen pir yang berada pada kromosom E. coli S 17-1 (? pir) merupakan gen yang berperan dalam
replikasi plasmid pUT mini-Tn5 Km1 ketika plasmid tersebut berada dalam sel donor. Ketiadaan gen tersebut pada genom resipien membuat plasmid tidak stabil dan transposonnya akan meloncat, sedangkan plasmid pembawanya (pUT) akan bunuh diri (suicide). Plasmid jenis ini umumnya disebut dengan suicide plasmid (Snyder & Champness 2003).Keberadan gen tra pada kromosom sel donor dan gen mob yang ada pada plasmid memungkinkan proses transfer plasmid dari sel donor ke sel resipien. Plasmid pUT mini-Tn5Km1 merupakan kelompok plasmid RP4 yang memiliki kisaran inang luas (Herrero et al. 1990), hal ini merupakan salah satu alasan penggunaan plasmid ini pada penelitian ini.
Frekuensi transkonjugasi pada B. japonicum ini dapat dikatakan cukup tinggi dibandingkan Fodor et al. (2001) yang juga menggunakan Tn5 untuk melakukan mutagenesis pada bakteri fotosintesis ungu sulfur, Thiocapsa roseopersicina dan mendapatkan frekuensi konjugasi sebesar 10- 8 (inkubasi konjugasi selama semalam). Frekuensi transposisi Tn5 pada R. meliloti hasil penelitian Simon et al. (1983) menunjukkan frekuensi yang lebih besar yakni 1 x 10- 5. Frekuensi transposisi yang hampir sama terlihat dari data hasil transposisi Tn5 pada R. japonicum sebesar 1 x 10-6 oleh Rostas et al. (1984).
Penyisipan mini -Tn5 Km1 pada B. japonicum KDR 15, BJ 11 dan BJ 38 terjadi pada DNA kromosom, hal ini karena ketiga galur B. japonicum tersebut tidak memiliki plasmid indigenus (Sari 1998). Gen yang berperan dalam sifat toleransi asam-Al pada B. japonicum tersebut akan lebih stabil jika dibandingkan apabila gen tersebut terdapat dalam plasmid. Beberapa galur BBA memiliki gen-gen yang berperan dalam nodulasi maupun pengikatan N2 yang berada
dalam plasmid maupun megaplasmid. Ketiadaan plasmid pada galur-galur B. japonicum yang ditelaah ini akan memudahkan analisis genetika molekulernya. Selain itu penyisipan mini-Tn5 Km1 akan lebih bersifat stabil karena menyisip pada DNA kromosom.
Seleksi Mutan
Keberadaan gen penyandi resistensi pada mini-Tn5 Km1 menyebabkan B. japonicum mutan memiliki kemampuan resistensi terhadap kanamisin. Hasil replika ini kemudian dijadikan master plate untuk koloni B. japonicum yang diuji ke media Ayanaba. Koloni B. japonicum yang tidak mampu tumbuh pada media Ayanaba yang dipilih untuk diuji lebih lanjut. Ketidakmampuan sel B. japonicum tumbuh pada media Ayanaba, diduga disebabkan oleh rusaknya gen yang berperan dalam sifat toleransi asam-Al akibat tersisipi transposon mini-Tn5 Km1.
Konjugasi dengan menggunakan mini-Tn5 Km1 bersifat stabil. Hal ini disebabkan adanya gen tnp* penyadi enzim transposase pada plasmid pUT mini -Tn5Km1 berada diluar transposon, sehingga setelah terjadi transposisi, transposon tersebut tidak mampu melakukan transposisi atau meloncat lagi (Herrero et al. 1990). Oleh karena itu sifat resisten terhadap kanamisin juga akan stabil berada dalam genom B. japonicum walaupun mutan ini ditumbuhkan pada berbagai macam media.
Komposisi lipopolisakarida, struktur luar membran, ekslusi proton (Chen et al. 1991, 1993), akumulasi senyawa poliamin selular (Fujihara & Yoneyama1993) dan sintesa acid shock protein (Hickey & Hirshfield 1990) merupakan beberapa faktor yang mempengaruhi pertumbuhan sel pada pH asam. Flis et al. (1992) juga menyatakan beberapa fungsi fisiologis untuk ketahanan rhizobia terhadap Al di antaranya ialah pengikatan ion Al3+ oleh eksopolisakarida untuk meminimalisasi toksisitas Al. Kerusakan pada gen yang berperan pada fungsi fisiologis tersebut dapat menyebabkan sel tidak mampu lagi toleran terhadap asam-Al. Lebih jauh Aarons & Graham ( 1991) menelaah pengaruh cekaman asam pada R. leguminosarum bv. Phaseoli, dan didapatkan hasil, bahwa konsentrasi ion potasium sitoplasmik dan glutamat akan tinggi jika BBA tersebut ditumbuhkan pada medium asam . Dari penelitian Goss et al. (1990) didapatkan empat mutan sensitif asam R. meliloti WSM419 dengan menggunakan Tn5 sebagai transposon melalui proses triparental mating dari konsentrasi sel R. meliloti 108 CFU/mL. Goss et al. (1990) juga melakukan proses mutagenesis dengan transposon Tn5 terhadap BBA toleran asam Rhizobium meliloti WSM419. Kerusakan pada gen yang bertanggung jawab terhadap sifat toleran asam yakni gen act (acid tolerance) akibat penyisipan Tn5 akan menyebabkan terhambatnya pertumbuhan dan pengaturan pH internal sel (pHi) pada R.
meliloti jika ditumbuhkan pada media asam (pH: 5.6).
Amplifikasi DNA Genom Pengapit Transposon dengan Inverse PCR
Isolasi genom dilakukan dengan met ode CTAB karena metode ini cukup efektif dilakukan untuk isolasi DNA genom bakteri gram negatif. Pada tahapan ini mutan diinkubasi pada inkubator bergoyang (140 rpm) selama 5 hari, pada suhu ruang. Inkubasi dilakukan selama 5 hari karena B. japonicum merupakan jenis rhizobia tumbuh lambat, yang akan mencapai fase log setelah diinkubasi pada kisaran waktu 4-5 hari. Menurut hasil penelitian Sari (1998), B. japonicum KDR 15, BJ 38 dan BJ 11 tidak memiliki plasmid oleh karena itu genom yang diisolasi hanya genom kromosom. Hal ini dapat dipastikan gen yang bertanggung jawab terhadap sifat toleransi asam-Al berada dalam kromosom, keadaan ini lebih memudahkan analisis, karena gen akan lebih stabil berada dalam kromosom dibandingkan dalam plasmid.
DNA genom B. japonicum USDA 110 memiliki ukuran sekitar 8.7 Mb (Tomkins et al. 2001) , dan diperkirakan ukuran genom B. japonicum yang digunakan dalam penelitian ini memiliki kisaran ukuran genom yang sama. Genom hasil isolasi kemudian dipotong dengan menggunakan enzim restriksi EcoRV. Enzim ini akan memotong DNA diluar daerah transposon, sehingga sifat resistensi terhadap kanamisin tidak rusak, karena gen resistensi ini akan dijadikan templateannealing primer spesifik yang akan digunakan pada proses inverse PCR.
Dengan menggunakan enzim T4 DNA ligase kemudian dilakukan self ligation pada fragmen DNA hasil pemotongan EcoR V menghasilkan lingkaran monomerik. Self ligation pada potongan DNA yang mengandung transposon akan digunakan sebagai DNA template untuk proses inverse PCR. Proses self ligation merupakan tahap penting dalam proses inverse PCR, karena jika tidak terbentuk lingkaran monomerik ini maka tidak akan terjadi proses amplifikasi dengan arah amplifikasi keluar dari masing-masing primer.
mengandung situs pemotongan enzim EcoRV. Hasil inverse PCR sebesar 0.8 kb kemungkinan besar belum mengindikasikan keseluruhan gen yang berperan dalam sifat toleransi asam-Al. Hal ini disebabkan oleh kemungkinan adanya sistem operon yang berperan dalam sifat toleransi ini. Namun hasil inverse PCR ini merupakan bukti kuat keberadaan gen toleransi asam-Al pada B. japonicum galur BJ 11, karena dengan adanya penyisipan mini -Tn5 Km1 pada daerah genom tersebut menyebabkan terganggunya sistem fisiologis yang berperan dalam sifat toleransi B. japonicum khususnya galur BJ 11.
Studi genetik pada sel rhizobia toleran asam memperk irakan sedikitnya dua lokus dari megaplasmid atau kromosom untuk gen pengatur pH yang diperlukan dalam pertumbuhan rhizobia pada pH rendah (Chen et al. 1991; 1993). Pada R. loti, sifat toleran pH rendah berhubungan dengan komposisi dan struktur membran. Pada galur R. loti yang toleran asam terdapat satu protein membran dengan ukuran 49.5 kDa dan tiga protein terlarut dengan ukuran 66.0, 85.0, dan 44.0 kDa yang menunjukkan peningkatan ekspresi protein ketika sel tumbuh pada pH 4.0. Sifat toleran R. loti pada kondisi asam diperkirakan melibatkan mekanisme konstitutif seperti permeabilitas membran luar dengan respon adaptif termasuk fase pertumbuhan sel dan perubahan ekspresi protein (Correa & Borneix 1997). Ricillo et al. (2000) melakukan mutagenesis dengan transposon Tn5 untuk menelaah fragmen DNA genom R. tropici yang terlibat dalam sifat toleransi pH. Fragmen DNA sebesar 0.9 kb yang didapatkan ternyata memiliki homologi dengan enzim glutation sintetase dari E. coli. Hal ini mengindikasikan adanya peranan enzim glutation sintetase dalam mekanisme toleransi R. topici.
Ukuran DNA yang didapatkan dari proses inverse PCR ini dapat saja berbeda jika pemotongan genom B. japonicum dilakukan oleh enzim restriksi selain EcoRV. Seperti hasil penelitian Goss et al. (1990) yang mengkarakterisasi mutan sensitif asam R. meliloti WSM419 dan mendapatkan fragmen genom yang dipotong oleh enzim EcoRI berukuran 4.4 kb, sebagai daerah flanking Tn5. Kerusakan pada daerah genom ini menyebabkan mutan tidak memiliki kemampuan untuk mengatur pH internal mendekati netral ketika pH eksternal kurang dari atau sama dengan 6. Wahyudi (2004) juga melakukan proses inverse PCR pada bakteri magnet Magnetospirillum magneticum untuk mengamplifikasi daerah flanking transposon
mini Tn5. Daerah flanking yang berhasil diamplifikasi berukuran masing-masing 4.2 kb dan 2.8 kb untuk M. magneticum NMA 15 dan 17 yang didigesti dengan menggunakan enzim restriksi EcoRV.
Kloning Fragmen DNA Genom Pengapit Transposon
Plasmid rekombinan hasil ligasi antara vektor pGEMT-Easy dengan DNA sisipan merupakan alat penting untuk telaah molekuler lebih lanjut. Plasmid rekombinan yang ditransformasi ke dalam sel E. coli DH5a ini dimaksudkan untuk pembentukan klon, yaitu sel-sel individu yang mengandung molekul DNA rekombinan yang dapat dipropagasi dan disimpan untuk memproduksi molekul DNA rekombinan dalam jum Lah besar sehingga dapat digunakan untuk mempelajari karakter fisiologis tertentu ataupun untuk mengkonservasi molekul DNA rekombinan dalam keadaan stabil (Dawson et al. 1996).
Penyisipan DNA insert pada vektor pGEMT-Easy terjadi pada multiple cloning site (MCS) situs enzim EcoRV yang berada pada gen LacZ. Penyisipan pada gen ini memungkinkan seleksi transforman dengan metode koloni biru -putih. Warna koloni putih menunjukkan tidak adanya pemecahan senyawa X-gal akibat tidak adanya a-komplementasi antara plasmid rekombinan dengan sel inang dalam pembentukan enzim ß-galactosidase. Pemecahan senyawa X-gal akan mengubah warna koloni menjadi biru (Turner et al. 1997)
Hasil verifikasi dua plasmid rekombinan yang dipotong dengan enzim EcoRI, masing-masing menunjukkan pola pita DNA yang sama, yakni pita DNA berukuran 3 kb (pGEMT-Easy) dan 0.8 kb (DNA sisipan). Hal ini menunjukkan proses kloning DNA sisipan dalam vektor pGEMT-Easy ke sel E. coli DH 5a telah berhasil dilakukan.
SIMPULAN
Frekuensi konjugasi rata-rata terbesar untuk galur BJ 11 dan KDR 15 terjadi pada waktu inkubasi 24 jam, sedangkan untuk Bj 38 terjadi pada waktu inkubasi 18 jam Frekuensi konjugasi rata-rata untuk B. japonicum KDR 15, BJ 38 dan BJ 11 berturut-turut sebesar 4.9 x 10-6, 3.0 x 10-6, dan 2.9 x 10-7.
japonicum BJ 11 telah berhasil diamplifikasi dengan inverse PCR dan diklon ke dalam plasmid pGEMT-Easy (~3 kb) membentuk plasmid rekombinan, pGEMT-11 yang berukuran ~3.8 kb.
SARAN
Sebaiknya dilakukan karakterisasi dan analisis gen lebih lanjut dari fragmen DNA pengapit transposon (DNA flanking) mutan B. japonicum sensitif asam-Al yang telah didapatkan dari penelitian ini. Beberapa hal yang perlu dilakukan ialah melakukan sekuensing DNA flanking dan karakterisasi protein yang berperan dalam toleransi asam -Al.
DAFTAR PUSTAKA
Aarons SR, Graham PH. 1991. Response of Rhizobium leguminosarum bv. phaseoli to acidity. Plant Soil 134:145-151.
Ariyani F, Tedja-Imas, Wahyudi AT. 1999. Transfer gen InaZ pada beberapa galur B. japonicum toleran asam dan aluminium. Hayati 6: 47-50.
Autret N, Dubail I, Trieu-Cuot P, Berche P, Charbit A. 2001. Identification of new genes involved in the virulence of Listeria monocytogenes by signature-t agged transposon mutagenesis. Infect Immun 4: 2054-2065.
Ayanaba A, Asanuma S, Munns DN. 1983. An Agar plaete method for rapid screening of Rhizobium for tolerance to acid-aluminium stress. Soil Sci Soc Am J 47: 256 -258.
Berg DE, Berg CM. 1983. The prokaryotic transposable element Tn5. Biotechnol 1:417 -435.
Berg DE. 1989. Transposon Tn5. Di dalam Berg DE, Howe MM (editor). Mobile DNA. Washington: Washington Press. hlm 185-210.
Bhasin A, Goryshin IY, Reznikoff WS. 1999. Hairpin formation in Tn5 transposition. J Biol Chem 274: 37021-37029.
Braam LAM, Goryshin IY, Reznikoff WS. 1999. A Mechanism for Tn5 Inhibition carboxyl-terminal dimerization. J Biol Chem 274: 86-92.
Bruijn FJ, Lupski JR. 1984. The use of transposon Tn 5mutagenesis in the rapid generation of correlated physical and geneticalmaps of DNA segments cloned into multicopy plasmids. A review. Gene 27:131-149.
Chen H, Gartner E, Rolfe BG. 1991. Involvement of genes on a megaplasmid in the acid-tolerant phenotype of Rhizobium leguminosarum biovar trifolii. Appl Environ Microbiol 59:1058-1064 [Abstrak].
Chen H, Richardson AE, Rolfe BG. 1993. Studies on the physiological and genetic basis of acid tolerance in Rhizobium leguminosarum biovar trifolii. Appl Environ Microbiol 59:1798-1800 [Abstrak].
Correa OS, Barneix AJ. 1997. Cellular mechanisms of pH tolerance in Rhizobium loti. World J Microbiol Biotechnol 13:153-157.
Dawson MT, Powell R, Gannon F. 1996. Gene Technology. Graham JM, Billington D, Gilmartin PM, editor. Oxford: BIOS Scientific Publ. Ltd. hlm 91-95.
De Lorenzo V, Herrero M, Jakubzik U, Timmis KN. 1990. Mini -Tn5 Transposon derivatives for insertion mutagenesis, promoter probing, and chromosomal insertion of cloned DNA in gram negative eubacteria. J Bacteriol 172: 6568-6572.
Endarini T. Wahyudi AT, Imas T. 1995. Seleksi galur-galur Bradyrhizobium japonicum indigenus toleran medium asam-Al. Hayati 2: 15-18.
Flis SE, Glenn AR, Dilworth MJ. 1992. The interaction between aluminium and root nodule bacteria. Soil Biol Biochem 25:403-417.
Fodor B, Rakhely G, Kovacs AT, Kovacs KL. 2001. Transposon mutagenesis in purple sulfur photosynthetic bacteria: identification of hypF, encoding a protein capable of processing [NiFe] hydrogenases in a ß and ? subdivisions of the proteobacteria. Appl Environ Microbiol 6: 2476-2483.
Fujihara S, Yoneyama T. 1993. Effects of pH and osmotic stress on cellular polyamine contents in the soybean rhizobia Rhizobium fredii p220 and Bradyrhizobium japonicum A 1017. Appl Environ Microbiol 59:1104-1109 [Abstrak].
Goryshin IY,Reznikoff WS. 1998. Tn5 in vitro transposition. J Biol Chem 273:7367-7374.
Goss TJ, O’Hara GW, Dilworth MJ, Glenn AR. 1990. Cloning, characterization, and complementation of lesions causing acid sensitivity in Tn5-induced mutants of Rhizobium meliloti WSM419. J Bacteriol 9: 5173-5179.
Herrero M, de Lorenzo V, Timmis KN.1990. Transposon vectors containing non-antibiotic resistance selestion markers for cloning and stable chromosomal insertion of foreign genes in gram negative bacteria. J bacteriol 172:6557 -6567.
Hickey EW, Hirshfield IN. 1990. Low -pH-induced effects on patterns of protein synthesis and on internal pH in Escherichia coli and Salmonella typhimurium. Appl Environ Microbiol 56:1038-1045.
Huang G, Zhang L, Birch RG. 2000. Rapid amplification and cloning of Tn5 flanking fragments by inverse PCR. Lett Appl Microbiol 31:149-153.
Johnson AC,Wood M. 1990. DNA, a possible site of action of aluminum in Rhizobium spp. Appl Environ Microb iol 56:3629-3633.
Jordan DC. 1984. Rhizobiaceae. Di dalam Krieg NR dan Holt JE, editor. Bergeys Manual of Systematic Bacteriology Vol 1. Baltimore: The Williams & Wilkin Co. hlm 177-366.
Keyser HH, Munns DN. 1979. Tolerance of Rhizobia to acidity, aluminum and phospate. Soil Sci Soc Am J 43:519-523.
O’Hara GW, Thomas JG, Michael JD, Andrew RG. 1989. Maintenance of intracelluler pH and acid tolerance in Rhizobium meliloti. Appl Environ Microbiol 55:1870-1876.
Rao NSS. 1995. Soil Microorganisms and Plant Growth. Ed ke-3. New Hampshire: Science Publishers Inc.
Ricillo PM et al. 2000. Glutathione in involved in environmental stress responses in Rhizobium tropici, including acid tolerance. J Bacteriol 182: 1748-1753.
Richardson AE, Simpson RJ, Djordjevic MA, Rolfe BJ. 1988. Expression of nodulation genes in Rhizobium leguminosarum bv. trifolii is affected by low pH and by Ca2+ and Al ions. Appl Environ Microbiol 54:2541-2548.
Rostas K, Sista DS, Stanley J, Verma DPS. 1984. Transposon mutagenesis of Rhiz obium japonicum. Mol Gen Genet 197: 230-235.
Sakinah, Tedja-Imas, Achmadi SS. 2001. Aktivitas ekstrak kasar enzim protokatekuat 3,4 dioksigenase dari beberapa galur B. japonicum. Hayati 2: 8-11.
Sambrook W, Russel DW. 2001. Molecular Cloning: A Laborator y Manual. Vol 1. Ed ke-3. New York: Cold Spring Harbor Laboratory Press.
Simon R, Priefer U, Puhler A. A broad host range mobilization system for in vivo genetic engineering: Transposon mutagenesis in gram negative bacteria. Bio/Technology 1: 784-791.
Somasegaran P, Hoben HJ. 1994. Handbook of Rhizobia. Methods in Legume Rhizobium Technology. New York: Springer-Verlag.
Snyder L, Champness W. 2003. Molecular Genetics of Bacteria. Washington DC: ASM Press.
Tedja-Imas , Wahyudi AT, Tjahjoleksono A, Saraswati R. 1994. Seleksi galur -galur bakteri bintil akar kedelai unggul pada cekaman pH rendah dan kekeringan. Laporan Penelitian. Pengembangan riset terpadu LIPI PAU Bioteknologi IPB. Bogor.
Tomkins JP et al. 2001. A marker-dense physical map of the Bradyrhizobium japonicum Genome. Genome Research 11: 1434-1440.
Turner PC, Mc Lennan, Bates AD, White MRH. 1997. Instant Notes in Molecular Biology. Washington: BIOS Scientific.
Voelker LL, Dybvig K. 1998. Transposon mutagenesis. Methods Mol Biol 104:235-238.
Wahyudi AT. 1996. Seleksi Galur -galur Bradyrhizobium japonicum toleran asam-aluminium:analisi gen – gen penanda molekuler dan kompetisi in planta [tesis]. Bogor: Departemen Biologi, FMIPA-IPB.
Wahyudi AT, Suwanto A, Tedja-Imas T, Tjahjoleksono A. 1998. Screening of acid-aluminium tolerant Bradyrhizobium japonicum strains: analysis of marker genes and competition in planta. Aspac J Mol Biol Biotechnol 6 : 13-20.
Wahyudi AT, Matsunaga T, Takeyama H. 2001. Isolation of Magnetospirillum magneticum AMB-1 Mutants Defective in Bacterial Magnetic Particle Synthesis by Transposon Mutagenesis. Appl Biochem Biotechnol 91-93:147-154.
Wahyudi AT. 2004. Genome-wide screening of genes involved in magnetite synthesis in magnetic bacterium Magnetospirillum magneticum AMB-1 using transposon mutagenesis [Disertasi]. Tokyo: Tokyo University of Agriculture and Technology.
Lampiran 1. Skema pros es mutagenesis dengan transposon
Keterangan:
Proses mutagenesis dengan transposon. Konjugasi dilakukan di atas filter milipore (0.45 µm) pada media LA modifikasi. Pada suspensi campuran donor (D) dengan resipien (R) akan terjadi serangkaian proses transfer dan penyisipan transposon. Sel E. coli S17-1 (? pir) (D) akan membentuk pili (mating pair formation) terhadap sel B. japonicum (R) sebagai jalur transfer plasmid pUT mini-Tn5Km1. Kemudian pada sel B. japonicum, dengan segera akan terinduksi kerja enzim transposase yang berperan dalam proses eksisi transposon mini-Tn5Km1 yang terdapat dalam pUTmini-Tn5Km1 dan menyisipkannya ke dalam genom B. japonicum. pUTminiTn5Km1 merupakan tipe plasmid bunuh diri (suicide plasmid) yang akan terdegradasi jika pada sel inang tidak ada aktivitas gen pir. Dari serangkaian proses tersebut maka akan didapatkan sel B. japonicum yangmemiliki sifat resisten terhadap kanamisin (Kmr) dari sel B. japonicum yang sebelumnya sensitif kanamisin (Kms) akibat tersisipi transposon.
Media LA modifikasi
E. coliS 17-1 (? pir) pili
B. japonicum
Kms K ms
Lampiran 2. Komposisi media Ayana ba (Ayanaba 1983)
Galaktosa, arabinosa dan KAlSO4 sebelum digunakan harus disterilisasi dengan membran filter
berdiameter pori-pori 0.25 µm (filtrasi).
Stok
Bahan g/L
[stok (M)] g/L
MgSO4.7H2O CaCl2 300µM FeEDTA 10µM
KCl 10µM Basal medium MnCl2 1µM (Keyser & Munns) ZnSO4. 7H2O 0.4µM
CuCl2. 2H2O 0.1µM Na2MO4 0.02µM
Co(NO3)2 0.001µM
Na glutamat KH2PO4 5µM KCl 1.5 mM Galaktosa Arabinosa BCG 0.005% KAlSO4 5mM Agar
0.074 0.00386 0.004 7.4 x 10-4 1.2 x 10-4 1.15 x 10-4 1.7 x 10-5 4.12 x 10-6 291.04 x 10-9
1.8 6.8 x 10-4 0.111 5 5
2.37 20
3 x 10-2 10-2 10-1 10-3 10-3 10-3 10-4 10-4
10-3
0.386 4 7.4 0.197 1.15 0.17 0.0412 0.291
0.68