PEMBUATAN NANOPROPOLIS ASAL INDONESIA
SEBAGAI BAHAN ANTIKANKER PAYUDARA
AKHMAD ENDANG ZAINAL HASAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul :
Pembuatan Nanopropolis Asal Indonesia sebagai Bahan Antikanker Payudara
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan pernyataan ini, saya melimpahkan hak cipta dari karya tulis ini kepada Institut Pertanian Bogor.
Indonesia sebagai Bahan Antikanker Payudara. Dibimbing oleh DJUMALI MANGUN-WIDJAJA, TITI CANDRA SUNARTI, ONO SUPARNO dan AGUS SETIYONO.
Propolis adalah salah satu produk lebah madu yang berguna untuk perlindungan diri terutama dari serangan mikroorganisme dan perubahan suhu di luar sarang lebah yang tidak menentu. Sekarang ini, istilah propolis merupakan sediaan obat hasil ekstraksi dari sarang lebah madu atau disebut juga raw atau crude propolis. Raw propolis tidak dapat dimanfaatkan secara langsung karena masih bercampur dengan komponen pengotor lain, sehingga perlu proses ekstraksi propolis yang merupakan kumpulan bahan aktif dalam raw propolis dengan menggunakan pelarut organik. Kandungan bahan aktif dalam propolis antara lain seperti flavonoid, alkaloid, tanin, steroid dan triterpenoid. Penggunaan pelarut etanol 70% dalam ekstraksi akan diperoleh propolis yang mengandung komponen flavonoid (terekstrak seluruhnya) dan terpisah dari bagian yang tidak terekstrak (balm). Propolis yang dihasilkan dalam teknik ekstraksi ini mempunyai sifat yang tidak larut dalam air tapi larut dalam etanol maupun propilen glikol, sehingga diperlukan bahan maupun penerapan teknologi yang tepat agar propolis dapat larut dalam air dan dapat digunakan sebagai obat dengan mudah.
Penelitian menunjukkan bahwa β-siklodekstrin dapat digunakan sebagai bahan penyalut bahan aktif pada proses pembuatan obat. Bentuk melingkar yang terdiri dari tujuh monomer glukosa, β-siklodekstrin dapat memasukkan dan mengikat bahan aktif pada berbagai sisi aktif. Dengan masuknya bahan aktif dalam gugus β-siklodekstrin maka diperkirakan pelepasan bahan aktif tersebut akan lebih lambat dibandingkan dengan bahan aktif bebas. Untuk meningkatkan proses penyalutan propolis maka pada penelitian ini dilakukan inklusi propolis pada β-siklodekstrin menggunakan proses inklusi, re-solubilisasi dan stabilisasi dengan rentang waktu antara 3.18 hingga 46.82 menit. Pada ketiga proses dilakukan pengadukan menggunakan homogenizer kecepatan tinggi. Dengan proses inklusi, resolubilisasi dan stabilisasi diharapkan terjadi peningkatan jumlah bahan aktif propolis yang terjerap dalam molekul β-siklodekstrin dan terjadi pengecilan ukuran partikel sehingga terbentuk partikel nano. Jumlah bahan aktif yang terjerap serta kemampuan menahan kerusakan bahan aktif karena proses pembuatan nanopropolis ini dapat ditunjukkan dengan aktifitas penghambatan proliferasi sel kanker Michigan Cancer Foundation-7 (MCF-7).
dilakukan uji terhadap penghambatan proliferasi sel lestari kanker payudara MCF-7 dan dilakukan proses analisis statistik dengan RSM untuk menentukan kondisi terbaik pembuatan nanopropolis tahap kedua. Selanjutnya dilakukan pengujian efikasi nanopropolis menggunakan hewan uji tikus putih betina strain Sprague Dawley yang diinduksi oleh 7,12-dimethyl-benz(a)anthracene (DMBA). Perkembangan tumor pada tikus dipelajari dengan cara melihat preparat mikroskop jaringan mamae.
Hasil terbaik ekstraksi propolis yang meliputi rendemen, kadar total flavonoid, kemampuan menghambat radikal bebas 1,1-diphenil -2-picrilhydrazil (DPPH), induksi apoptosis Saccharomyces cerevisiae dan antisitotoksik sel lestari kanker payudara MCF-7 secara berturut-turut diperoleh pada propolis asal Pekanbaru (19.97%), Kendal (46.60%), Pandeglang (68.94 µg ml-1), Kendal (81.44%), dan Makassar (47.71% sel hidup). Propolis hasil ekstraksi sarang lebah Trigona spp dari lima lokasi di Indonesia mengandung komponen senyawa flavonoid. Kemampuan induksi apoptosis sel S. cerevisiae terbaik ditunjukkan oleh propolis yang diekstrak dengan pelarut etanol 70% pada nisbah volume 20 serta pemanasan gelombang mikro 30 menit. Hasil verifikasi menunjukkan kemampuan induksi apoptosis dengan jumlah persentase sel petite 70.32% dengan rendemen sebanyak 12.67% (b/b). Propolis Trigona spp asal Pandeglang, Indonesia mempunyai aktivitas antioksidan (IC50) sebesar 75.34 µg ml-1 dan
mematikan 50% sel kanker MCF-7 pada konsentrasi 233 µg ml-1.
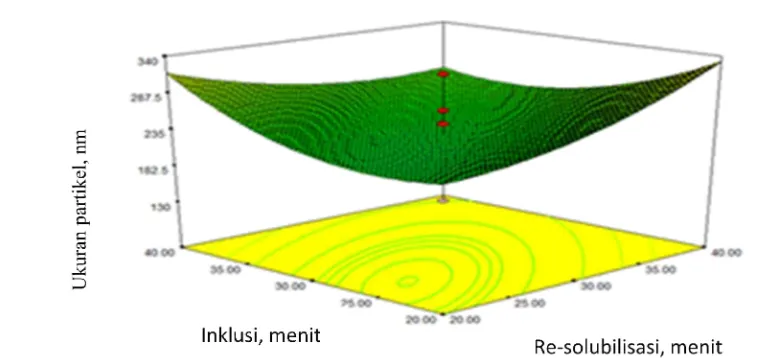
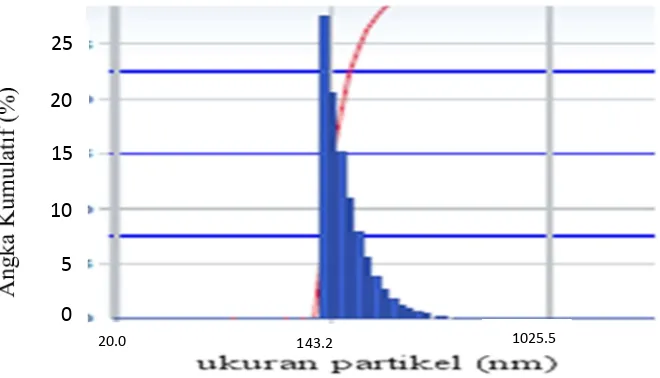
Hasil penelitian pembuatan nanopropolis dengan cara inklusi pada β-siklodekstrin diperoleh kondisi terbaik menghasilkan ukuran partikel (165.4±44.1 nm) dan kemampuan antisitotoksik terhadap sel lestari kanker payudara MCF-7 sebesar 83.45 (% sel mati) pada waktu inklusi, resolubility dan stabilisasi masing-masing 20, 20 dan 30 menit. Hasil penelitian pembuatan nanopropolis tahap kedua diperoleh kondisi terbaik sebagai bahan antiproliferasi sel lestari kanker payudara MCF-7 dengan menggunakan propolis sebanyak 30 mg dan 350 mg β-siklodekstrin. Hasil pengujian nanopropolis diperoleh nilai IC50 pada 10.2 µg ml-1
terhadap sel lestari kanker payudara MCF-7. Ukuran rata-rata partikel nanopropolis pada kondisi terbaik sebanyak 171 nm. Nanopropolis yang dihasilkan ini mempunyai tingkat kristalinitas 88.7% dan mengalami perubahan gugus fungsional terutama pada gugus –OH yang menjadi lebih lebar dibandingkan dengan propolis maupun β-siklodekstrin. Hal ini berarti bahwa komponen bahan aktif propolis masih ada dalam nanopropolis hasil pembuatan pada kondisi terbaik.
Pada uji aktivitas antikanker payudara nanopropolis pada tikus betina strain Sprague-Dawley yang diinduksi DMBA diperoleh bahwa dosis nanopropolis sebesar 32 µg ml-1 dan konsentrasi propolis 233 µg ml-1 sudah
AKHMAD ENDANG ZAINAL HASAN. Manufacture of Indonesia Nanopropolis as a Antibreastcancer Agents. Supervised by DJUMALI MANGUNWIDJAJA, TITI CANDRA SUNARTI, ONO SUPARNO dan AGUS SETIYONO
Propolis is a honeybee product that is useful for self-protection, especially from invading microorganisms and temperature changes outside the beehive. Today, the term drug dosage propolis is extracted from beehives called raw honey or propolis. Raw propolis can not be used directly, so it is necessary that the process of extracting propolis is a mixture of active ingredients using organic solvents. The active ingredients of propolis were flavonoids, alkaloids, tannins, steroids and triterpenoids. Raw propolis is extracted by 70% ethanol to obtain propolis flavonoid-containing components of raw propolis as a whole and separate from the balm. There have been many studies using maceration extraction, but the combination of maceration and heating by microwaves has not been done. Therefore, the process of separation of propolis from the beehive (raw propolis) by using maceration and microwave heating was undertaken in this study.
Many studies have shown that β-cyclodextrin can be used as a coating agent active ingredient in the drug manufacturing process. Circular shape consisted of seven glucose monomers, β-cyclodextrin can be inserted and bind the active ingredient in various side active. With the inclusion of the active ingredient in β-cyclodextrin group then expected release of the active ingredient will be much slower than the free active ingredient. Therefore, the inclusion of propolis research on β-cyclodextrin, so that the active ingredient in propolis out of filler slowly. To make the coating process of propolis more effectiveing the process was carried out by a high speed homogenizer. Therefore, this research was undertaken propolis inclusion in β-cyclodextrin using inclusion, resolubility and stabilisation with high speed homogenization as processing aid. With the inclusion, resolubility and stabilisation process was expected that there were active ingredient of propolis is adsorbed molecule β-cyclodextrin and particle size reduction occurs. In addition, the amount of propolis and β-cyclodextrin is used in the process of shaking on the inclusion process may be a factor in the rate of inclusion process, so there are differences in the amount of active ingredient present in propolis adsorbed in β-cyclodextrin. Adsorbed amount of active ingredient and the ability to withstand damage due to the active ingredient high speed could be demonstrated by the inhibition of cancer cell proliferation activity of Michigan Cancer Foundation-7 (MCF-7).
nanopropolis female white rats of Sprague Dawley strain induced by 7,12-dimethylbenz(a)anthracene (DMBA). After in-vivo study ended, the development of tumors in rats was studied by looking preparated mammary tissue under microscope.
Propolis from five locations in Indonesia showed the difference in extraction yield (% w/w), total flavonoid content (%), the ability to inhibit the oxidation of DPPH (IC50, μg ml-1), apoptosis induction for Saccharomyces
cerevisiae cells at concentrations of 50 mg ml-1, and inhibits cell proliferation sustainable MCF-7 breast cancer at a concentration of 100 μg ml-1. The best
results from yield of propolis extract was obtain from Pekanbaru, total flavonoid content was from Kendal, free radical scavenging of 1,1-diphenil -2-picrilhydrazil (DPPH) was from Pandeglang, Saccharomyces cerevisiae induces cell apoptosis was from Kendal, and inhibits proliferation of breast cancer cells MCF-7 was from Makassar with the value of 19.97 (%), 46.60 (%), 68.94 (μg ml-1), 81.44
(%), and 47.71 (% living cells), respectively . All propolis extracted from five locations in Indonesia based on phytochemical analysis showed that the propolis contains flavonoid compounds.
Results of statistical analysis showed that induction of apoptosis against S. cerevisiae cells as much as 85% was achieved at the best conditions of microwave heating time of 30 mins and the ratio of 70% ethanol-beehive of 20. Results of the verification process of extraction conditions selected showed that the percentage of cells petite was 70.32% smaller than the model, but the yield was higher than the models. Propolis Trigona spp originated Pandeglang had antioxidant activity (IC50) of 75.34 μg ml-1, 50% lethal cancer MCF-7 cells at a
concentration of 233 μg ml-1, with a value of cell apoptosis induction S. cerevisiae
of 6.02 μg ml-1.
The RSM analysis results nanopropolis predicted that the best conditions was propolis of 30 mg to 350 mg of β-cyclodextrin with IC50 at 10.2 μg ml-1. At
the best conditions, the propolis could cause the death of MCF-7 cells by as much as 48.61% and a yield of 18.657 g. Nanopropolis generated by inclusion in β-cyclodextrin showed that the change in crystallinity from 31% to 88.7% still approved flavonoids and organic acids on High Performance Liquid Chromatography (HPLC) analysis especially techtochrysin and caffeic acid; on Fourier Transform Infra Red (FTIR) analysis there has been a change in wave number, mainly on the functional group-OH. Nanopropolis average particle size distribution produced was 171 nm. .
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Teknologi Industri Pertanian
PEMBUATAN NANOPROPOLIS ASAL INDONESIA
SEBAGAI BAHAN ANTIKANKER PAYUDARA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Penguji pada Ujian Tertutup : Prof Dr Ir Erliza Noor
Dr drh Wiwin Winarsih, MSi
Judul Disertasi : Pembuatan Nanopropolis Asal Indonesia sebagai Bahan Antikanker Payudara
Nama : Akhmad Endang Zainal Hasan NIM : F361080091
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Djumali Mangunwidjaja, DEA
Ketua Dr Ir Titi Candra Sunarti, MSi Anggota
Prof Dr Ir Ono Suparno, MT
Anggota Dr drh Agus Setiyono, MS Anggota
Diketahui oleh
Ketua Program Studi Teknik Industri Pertanian
Dr Ir Machfud, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya, ni’mat hidup, ni’mat iman dan ni’mat sehat, dengan menghadapi tantangan dan hambatan telah dilalui sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2010 ini ialah propolis dan nanopropolis, dengan judul Pembuatan Nanopropolis Asal Indonesia sebagai Bahan Antikanker Payudara. Shalawat dan salam kami haturkan untuk junjungan kita Nabi Muhammad SAW oleh karenanya kita semangat, menghantar hidup dan kehidupan serta semoga kita selalu dalam barisannya hingga di kehidupan kelak.
Ungkapan terima kasih disampaikan kepada Apa (Nandang Rusnardi) dan Ema (Hj. Endang Poernomosasi), Bapak (H. Faisal) dan Ibu (Hj. Nurhusni) atas dukungan mereka, dorongan, keselamatan, dedikasi dan contoh hidup, etika, keadilan dan tekad.
Ungkapan terima kasih juga disampaikan kepada isteri (Efrini Faisal) dan anak-anakku (Riza, Rara, Ica dan Dafaa) serta seluruh keluarga handai taulan atas segala do’a, pengertian dan kasih sayangnya. Terima kasih ini disampaikan atas mereka karena kesabarannya, kebaikan, antusiasme dan kegembiraan hidup, tanpa mereka belum tentu penulis menyelesaikan disertasi ini.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Djumali Mangunwidjaja, DEA, Ibu Dr Ir Titi Candra Sunarti, MSi, Bapak Prof Dr Ono Suparno, MT dan Bapak Dr drh Agus Setiyono, MS yang telah banyak memberi bimbingan dan sarannya. Tanpa beliau saya tidak dapat berbuat banyak dan sulit menyelesaikan semua pekerjaan, tantangan dan hambatan yang dihadapi selama dalam menyelesaikan penelitian dan penulisan disertasi ini.
Di samping itu, penghargaan penulis sampaikan kepada Ibu Prof Dr Nastiti Siswi Indrasti Ketua Departemen Teknologi Industri Pertanian, Fateta IPB. Bapak Machfud sebagai ketua program studi TIP, juga Bapak Prof Dr Ir Irawadi Jamaran selaku ketua program Studi TIP saat penulis diterima di program studi ini. Terima kasih pula disampaikan kepada seluruh staf pengajar di Departemen Teknologi Industri Pertanian Fateta IPB atas semua ilmu dan bimbingannya.
Penulis mengucapkan terima kasih kepada Bapak Dr Ir I Made Artika, MappSc dan seluruh staff yang ada di Biokimia atas izin dan kesempatan yang diberikan kepada penulis untuk melanjutkan sekolah ini. Demikian juga penulis sampaikan kepada Bapak Dr Hasim, DEA dan Dr Ki Agus Dahlan yang telah memberi izin kepada penulis pada saat itu menjabat sebagai Dekan dan Wakil Dekan FMIPA, dan juga diucapkan terima kasih kepada Ibu Dr Ir Sri Nurdiati, MSc dan Dr Ki Agus Dahlan sebagai Dekan dan Wakil Dekan FMIPA yang telah memberi izin kepada penulis untuk meneruskan sekolah ini. Juga disampaikan terima kasih kepada Direktur Sekolah Pascasarjana IPB yang telah menerima penulis sebagai mahasiswa di Program Doktor di Program Studi Teknologi Industri Pertanian Fakultas Teknologi Pertanian IPB.
Bintang, MSc yang bersedia dan meluangkan waktunya sebagai penguji luar komisi pada ujian terbuka pada tanggal 19 Juli 2013.
Penulis juga ucapkan terimakasih kepada Direktur Direktorat Pendidikan Tinggi, Kementrian Pendidikan dan Kebudayaan atas dana beasiswa BPPS yang diberikan. Ucapan terima kasih juga penulis sampaikan untuk Direktur BIOTROP-SEAMEO dan Direktur PT Deltana Prima yang telah memberikan dana penelitian.
Untuk Direktur LapTIAB BPPT Serpong, Ibu Candra dan Bapak Candra Risdian, penulis ucapkan terima kasih atas kerjasamanya dalam menyiapkan sel lestari kanker payudara MCF-7.
Terima kasih penulis juga sampaikan kepada Ibu Aisyah Girindra, Bapak Irawadi Jamaran dan Ibu Tun Tedja Irawadi. Untuk saudaraku Ir Trijoko MB, Dr Joko Hermanianto, Dr Sugeng Budiharsono, Ir Uli Hasuri, Adi Fatwa Kusuma MSc, Muhammad Bahi PhD, Dimas Andrianto MSi dan semua teman-teman seperjuangan TIP angkatan 2008 serta teman-teman lainnya diucapkan terima kasih atas bantuan materil dan dorongan moril yang diberikan.
Untuk semua pihak baik perseorangan maupun kelompok (yang berhak menerima ucapan terima kasih penulis) dan yang telah banyak membantu dalam penelitian dan penulisan disertasi ini penulis ucapkan terima kasih.
Dengan semua ucapan terima kasih ini, penulis juga berdo’a semoga Allah subhanahu wa ta’ala membalas-Nya.
Semoga karya ilmiah ini bermanfaat bagi pengembangan keilmuan di Indonesia khususnya bagi peningkatan kesehatan masyarakat terutama tersedianya sediaan obat berbasis bahan alam Indonesia.
DAFTAR ISI
3 EKSTRAKSI DAN KARAKTERISASI PROPOLIS DARI SARANG LEBAH Trigona ASAL LIMA LOKASI DI
5 PEMBUATAN NANOPROPOLIS DENGAN CARA
DAFTAR TABEL
3.1 Hasil ekstrak propolis dan karakterisasinya 15 3.2 Hasil analisa fitokimia propolis dari lima lokasi di Indonesia 17 3.3 Parameter dan nilai skor pada penentuan lokasi sumber
propolis 19
4.1 Batasan dan taraf dari dua peubah 23
4.2 Hasil ekstrak propolis (%, b/b) dan hasil pengujian induksi
apoptosis (jumlah sel petite, %) 26
4.3 Komponen kimia propolis asal Pandeglang 30
5.1 Hasil rata-rata ukuran partikel nanopropolis dan pengaruhnya
terhadap kematian sel lestari kanker MCF-7 37 5.2 Kondisi pembuatan nanopropolis tahap 2 dan pengaruh
DAFTAR GAMBAR
2.1 Diagram alir penelitian pembuatan nanopropolis asal Indonesia
sebagai bahan antikanker payudara 7
3.1 Persentase sel S.cerevisiae petite karena perlakuan 50 µg ml-1
propolis dari lima lokasi di Indonesia 18
4.1 Diagram alir proses ekstraksi propolis dengan maserasi yang
dimodifikasi pemanasan gelombang mikro 24
4.2 Tampilan kromatogram FTIR propolis pada rentang 4000-400
cm-1 28
5.1 Diagram alir pembuatan nanopropolis tahap pertama 35 5.2 Pemetaan respon rata-rata ukuran partikel nanopropolis akibat
pengaruh waktu pengadukan pada tahap inklusi dan waktu re-solubilisasi
37
5.3 Pemetaan normalitas data rata-rata ukuran partikel
nanopro-polis (warna kotak menunjukkan satuan percobaan) 38 5.4 Distribusi ukuran partikel nanopropolis hasil pembuatan nano-
propolis pada kondisi terbaik tahap pertama 39 5.5 Pemetaan normalitas data jumlah kematian sel lestari MCF-7
akibat pemberian nanopropolis 40
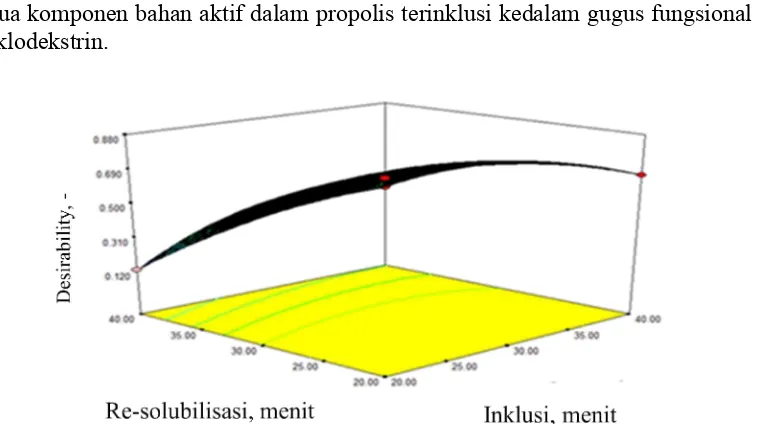
5.6 Hubungan antara waktu pengadukan pada tahap inklusi dan waktu pengadukan pada tahap re-solubilisasi terhadap nilai desirability pada kondisi terbaik
41
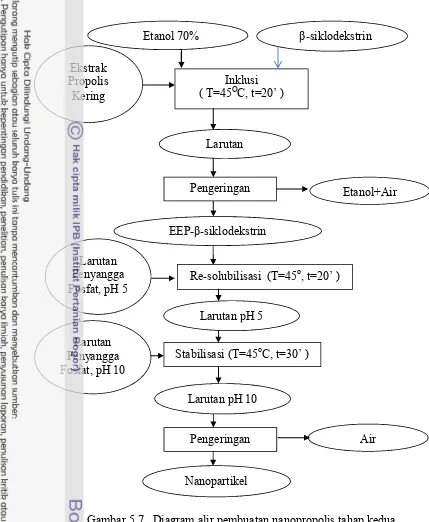
5.7 Diagram alir pembuatan nanopropolis tahap kedua 42 5.8 Pemetaan kemungkinan normalitas data jumlah kematian sel
MCF-7 (warna kotak menunjukkan satuan percobaan) 43 5.9 Pemetaan desirability jumlah kematian sel MCF-7 akibat
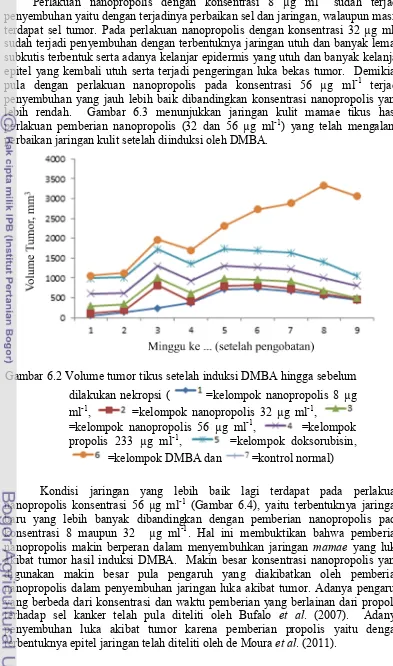
pemberian nanopropolis yang dibuat dari propolis dan β-siklodekstrin 5=kelompok doksorubisin, 6=kelompok DMBA dan 7=kelompok normal) DMBA dan mendapat perlakuan penyuntikkan a. nanopropolis (32 µg ml-1) dan b. nanopropolis (56 µg ml-1) (panah biru=epitel kulit, panah kuning=folikel rambut normal, panah putih=kapiler epidermis) (Pewarnaan HE, 200x)
50
6.4 a) Jaringan mamae tikus SD yang diinduksi DMBA dan diberi perlakuan nanopropolis 56 mg ml-1 setiap 7 hari sekali dalam
waktu 2 bulan, b) Jaringan mamae tikus SD yang diinduksi
DMBA tanpa diberi perlakuan nanopropolis maupun propolis dalam waktu 2 bulan setelah induksi (panah hitam= alveole, panah biru=alveole terisi plasma darah, panah putih=sel kanker, panah merah=jaringan ikat) (Pewarnaan HE, 200x) 6.5 a) Kondisi jaringan mamae yang telah mengalami
penyembuhan akibat penyuntikan nanopropolis 32 µg ml-1,
b ) kondisi tumor pada tikus betina akibat induksi DMBA tapi tidak dilakukan pengobatan baik dengan propolis maupun nanopropolis, dan c) kondisi tumor setelah 90 hari diinduksi DMBA sebagai awal perlakuan (panah kuning=bekas luka yang mengering panah putih=mamae yang membengkak karena tumor)
51
6.6 Jaringan kulit mamae tikus betina setelah diinduksi oleh DMBA dan mendapat perlakuan penyuntikkan (a) propolis (233 µg.ml-1) dan (b) Tanpa pengobatan (kontrol positif) (panah biru=epitel kulit, panah kuning=folikel rambut normal, panah putih=peradangan) (Pewarnaan HE, 200x)
7.1 Serbuk nanopropolis hasil pembuatan pada kondisi terbaik
tahap kedua 57
7.2 Hubungan antara respon sifat fisik rata-rata ukuran partikel terhadap jumlah sel lestari MCF-7 yang mengalami kematian akibat pemberian nanopropolis pada berbagai ukuran hasil perlakuan (20 satuan perlakuan)
58
7.3 Tampilan kromatogram XRD propolis (panah merah), nanopropolis (panah biru) dan komplek hasil campuran propolis dengan β-siklodekstrin dengan proses inklusi (panah kuning) pada rentang sudut 40 derajat
59
7.4 Tampilan kromatogram FTIR nanopropolis dan propolis pada rentang 400-4000 cm-1 (panah biru=nanopropolis dan panah kuning=ekstrak etanol propolis)
60
7.5 Grafik distribusi partikel nanopropolis pada kondisi terbaik
proses pembuatan nanopropolis tahap kedua 60
7.6 Tampilan penampakan mikroskopis menggunakan SEM nanopropolis hasil proses pembuatan nanopropolis pada kondisi terbaik (pembesaran 4000 x)
DAFTAR LAMPIRAN
1 Tatacara preparasi histopatologi 77
2 Perhitungan pengambilan keputusan pemilihan asal sarang lebah 78 3 Analisis sidik ragam model persamaan ragam matematika
penga-ruh pemanasan gelombang mikro dan nisbah pelarut etanol 70%-sarang lebah terhadap rendemen hasil ekstraksi (%, b/b)
78
4 Analisis sidik ragam model persamaan matematika pengaruh pe-manasan gelombang mikro dan nisbah pelarut etanol 70%-sarang lebah terhadap kemampuan propolis hasil ekstraksi menginduksi apoptosis sel S.cerevisiae
79
5 Grafik konsentrasi uji propolis untuk menentukan IC50 79
6 Data ukuran partikel menurut nomor urut satuan perlakuan 80 7 Analisis sidik ragam model persamaan matematika pengaruh
per-bedaan tahap homogenisasi terhadap rata-rata ukuran partikel na-nopropolis
83
8 Data hasil perlakuan nanopropolis 8 μg ml-1 dari berbagai satuan
percobaan terhadap sel lestari kanker MCF-7 hidup 84 9 Analisis sidik ragam model persamaan ragam matematika
penga-ruh propolis hasil perbedaan tahap homogenisasi terhadap jumlah sel lestari kanker payudara MCF-7 yang mati
85
10 Data pengaruh nanopropolis 8 µg ml-1 terhadap jumlah kematian
sel lestari kanker payudara MCF-7 (%) 85
11 Analisis sidik ragam model persamaan ragam matematika penga-ruh jumlah propolis dan β-siklodekstrin terhadap jumlah sel lestari kanker payudara MCF-7 yang mati
86
12 Bobot badan tikus (g) setelah 60 hari perlakuan atau setelah 150
hari induksi DMBA 86
13 Data hasil perhitungan volume tumor (mm3) pada jaringan mamae
DAFTAR SINGKATAN
FDA = Food and Drug Administration MCF-7 = Michigan Cancer Foundation-7 RPMI = Roswell Park Memorial Institute YEPD = Yeast Extract Potato Dextrose VCO = Virgin Coconut Oil
IC50 = Inhibitory Concentration 50%
SIRS = Sistem Informasi Rumah Sakit DMBA = 7,12-dimethylbenz(a)anthracene DPPH = 1,1-diphenyl-2-picrilhydrazil FBS = Fetal Bovine Serum
HPLC = High Performance Liquid Chromatography FTIR = Fourier Transform Infra Red
PSA = Particle Size Analyzer
TRAIL =Tumor necrosis factor Related Apoptosis Inducing Ligand NF-kB =Nuclear Factor-kappaB
MAPK/p38 =Mitogen-Associated Protein Kinase and p38 pathways Ask-1 =Apoptosis signal-regulating kinase 1
Bcl-2/Bcl-X =B-cell lymphoma 2 protein/X-protein IAP =Inhibitor of Apoptosis Proteins Bax =Bcl-2 associated X protein
1.1 Latar Belakang
Propolis merupakan nama generik dari resin lebah. Kata propolis berasal dari bahasa Yunani, yaitu “pro” artinya sebelum atau pertahanan dan “polis” artinya kota. Jadi, propolis adalah pertahanan kota atau memiliki arti sebagai sistem pertahanan pada sarang lebah. Karena sifatnya yang lengket seperti lem, propolis disebut sebagai beeglue (Anonim 2006). Menurut Gojmerac (1983), propolis adalah bahan perekat atau dempul yang bersifat resin yang dikumpulkan oleh lebah pekerja dari kuncup, kulit tumbuhan atau bagian-bagian lain dari tumbuhan. Resin-resin yang diperoleh dari bermacam-macam tumbuhan ini dicampur dengan saliva dan enzim lebah sehingga berbeda dari resin asalnya. Bentuk propolis dipengaruhi oleh suhu, pada suhu di bawah 15 ºC sifatnya keras dan rapuh, tapi pada suhu yang lebih tinggi (25-45ºC) sifatnya lembek. Propolis umumnya meleleh pada suhu 60-69ºC dan ada pula yang mempunyai titik leleh di atas 100ºC (Woo 2004).
Gojmerac (1983) menyatakan bahwa propolis mengandung bahan campuran kompleks malam, resin, balsam, minyak, dan sedikit polen. Komposisinya bervariasi tergantung dari tumbuhan asal. Propolis juga mengandung zat aromatik, zat wangi, dan berbagai mineral. Propolis dengan komponen senyawa-senyawa kimianya menunjukkan bermacam-macam efek biologis dan aktivitas farmakologis. Menurut Kasahara et al. (2004) dan Khismatullina (2005), lebih dari 180 senyawa yang terkandung di dalam propolis sudah diketahui. Unsur aktif yang penting dalam farmakologi dan aktivitas biologis adalah flavonoid (flavon, flavonol, flavonon) dan senyawa fenolat serta senyawa aromatik. Flavonoid berperan dalam pewarnaan tumbuhan. Sekurang-kurangnya ada 38 jenis flavonoid termasuk flavonol (galangin, kaemferol, quersetin), flavonon (pinocembrin dan pinosrobin), dan flavononol (pinobanksin), serta flavon (chrysin, acacetin, apigenin, ermanin). Beberapa senyawa fenolat yang terkandung di dalam propolis antara lain adalah hidroksisinamat, asam sinamat, vanilin, benzil alkohol, asam benzoat, kafeat, kumarat, serta asam ferulat. Kandungan flavonoid propolis setara dengan 500 jeruk (Khismatullina 2005). Menurut Matienzo dan Lamoreno (2004), propolis mengandung senyawa hidrokarbon aromatik, hidrokarbon alifatik, ester, aldehida, asam alifatik, sesquiterpena, amid, oksim, gula, gula alkohol dan asam uronat. Pino et al. (2006) melaporkan bahwa senyawa volatil pada stingles bee lebih tinggi daripada lebah Apis mellifera. Senyawa volatil yang dikandungnya antara lain α-pinene, β-pinene, trans-verbenol, α-copaene, β-bourbonene, β-caryophyllene, spathulenol dan caryophyllene oxide.
dalam air, tapi larut sempurna dalam propilen glikol dan etanol (Jang et al. 2009). Penambahan propilen glikol pada ekstrak propolis berfungsi sebagai zat yang dapat meningkatkan keefektifan propolis. Propolis sangat mudah teroksidasi. Untuk menjaga kestabilan komponen aktifnya, propolis dan hasil ekstraksinya disimpan pada suhu tidak lebih dari 35 ºC, ditempatkan di dalam tempat yang gelap dan tidak langsung terkena sinar matahari, serta dalam wadah yang tertutup.
Maserasi merupakan teknik yang umum dilakukan untuk mengekstrak bahan aktif. Pelarut yang umum digunakan dalam mengekstrak propolis adalah etanol yang dicampur dengan air (etanol 70%). Etanol merupakan senyawa yang memiliki sifat semipolar sehingga komponen aktif dengan kepolaran yang berbeda yang terkandung di dalam propolis dapat terekstrak. Menurut Woo (2004), propolis larut di dalam etanol dan sedikit larut air. Harborne (1987) menyatakan bahwa etanol 70% dapat mengekstrak flavonoid yang merupakan senyawa aktif terbanyak dan terpenting di dalam propolis. Menurut Cunha et al. (2004), ekstraksi propolis dengan cara maserasi menggunakan pelarut etanol 70% menghasilkan rendemen yang lebih tinggi dibandingkan pelarut etanol absolut dan tidak terekstraksi komponen lilinnya.
Teknik ekstraksi dengan maserasi dapat dimodifikasi dengan penambahan komponen panas untuk meningkatkan jumlah terekstrak. Menurut Trusheva et al. (2007) teknik ekstraksi menggunakan pemanasan gelombang mikro merupakan cara yang sangat cepat dalam menghasilkan asam fenolat dan flavonoid. Teknik ekstraksi dengan pemanasan gelombang mikro merupakan cara terbaik dibandingkan dengan teknik Soxhlet maupun pemanasan gelombang suara (Dean 1998). Demikian pula dengan pendapat Zhang et al. (2011) bahwa ekstraksi menggunakan pemanasan gelombang mikro merupakan cara yang dapat mengekstrak metabolit sekunder seperti flavonoid. Pemanasan dengan menggunakan gelombang mikro dapat membuat terbuka sel atau bagian penutup tempat metabolit sekunder berada, sehingga akan mengeluarkan bahan atau metabolit sekunder karena terdapat bagian pembungkus rusak dan mengakibatkan bahan terpisah dari asalnya. Secara prinsip, mekanisme kerja dan peralatan ekstraksi menggunakan pemanasan gelombang mikro lebih menguntungkan karena waktu relatif singkat, hasil ekstraksi yang tinggi dan penggunaan pelarut yang sedikit dibandingkan dengan cara konvensional.
Pembuatan partikel berukuran nano ini telah diperbolehkan oleh FDA dalam tujuan pengaliran obat dan pencapaian target jaringan yang terkena kanker, misalnya nanopartikel doksorubisin dan daunorubisin (Haley dan Frenkel 2008). Bahan lain yang telah dibuat berukuran nanometer adalah kurkumin (Das et al. 2010), propolis (Kim et al. 2008; Hasan et al. 2012), kamptokatekin (Cirpanli et al. 2009), paclitaxel (Bilensoy et al. 2007). Penelitian yang dilakukan Hasan et al. (2012) menunjukkan bahwa nanopropolis mempunyai konsentrasi hambat tumbuh bakteri minimum jauh lebih kecil dibandingkan dengan ekstrak etanol propolis bukan ukuran partikel nano. Kim et al. (2008) dalam penelitiannya menunjukkan bahwa propolis berbentuk partikel nano dapat mengatasi kanker.
Penelitian yang dilakukan oleh Hasan et al. (2006) menunjukkan bahwa ekstrak etanol propolis Trigona sp yang berasal dari Pandeglang memiliki aktivitas antibakteri, baik untuk bakteri Gram positif (Staphilococcus aureus dan Bacillus subtilis), maupun bakteri Gram negatif (Escherichia coli). Data lain mengenai kandungan kimia stingless bees diungkap oleh Matienzo dan Lamorena (2004) serta Pino et al. (2006). Hasil pengujian pendahuluan propolis Trigona sp sebagai antikanker telah dilakukan terhadap sel Murine leukemia P-388 dengan nilai IC50 18.1 µg ml-1. Hasil ini menunjukkan bahwa propolis Trigona spp mempunyai potensi untuk digunakan sebagai bahan antikanker, dan pembuatan nanopartikel merupakan salah satu alternatif untuk peningkatan daya efikasinya.
Untuk pengikatan bahan aktif dibutuhkan matriks yang berfungsi sebagai penginklusi, agen pengenkapsulasi dan dapat melepaskan bahan aktif secara perlahan. Bahan yang digunakan oleh Kim et al. (2008) adalah propolis berbentuk kopolimer antara N-isopropylacrylamide (NIPAAM) dengan N-vinyl-2-pyrrolidone (VP) poly (ethyleneglycol) monoacrylate (PEG-A). Pemakaian β-siklodekstrin sebagai penginklusi galangin telah dilakukan oleh Jullian (2009). Metode pembuatan nanopartikel berdasarkan Abbasalipourkabir et al. (2010) menggunakan komponen lipid berupa virgin coconut oil (VCO) dan asam stearat dari buah kelapa sawit sebagai agen pencegah bersatunya komponen penginkulsi dan mengurangi kerusakan akibat gesekan pada proses pembuatan nanopartikel. Menurut Aimi et al. (2009) dalam patennya mengungkapkan bahwa proses pembuatan nanopartikel herbal dapat menggunakan kasein susu tanpa penambahan surfaktan. Oligosakarida yang berbentuk siklik seperti β-siklodekstrin mempunyai sisi hidrofilik di bagian luar dan hidrofobik di bagian dalam sikliknya yang terbentuk dari tujuh monomer glukosa. Dengan bentuk dan komposisi seperti itu β-siklodekstrin dapat menginklusi suatu senyawa kimia (Cirpanli et al. 2009; Jullian 2009). Menurut penelitian yang dilakukan oleh Cirpanli et al. (2009) membuktikan bahwa nanopartikel camptothecin dalam bentuk nanopartikel dengan β-siklodektrin lebih aktif dibandingkan dengan bentuk nanopartikel poly(lactide-co-glycolide) (PLGA) atau poly-ε-caprolactone (PCL) terhadap sel kanker payudara MCF-7. Oleh karena itu, dalam penelitian ini digunakan β-siklodektrin sebagai bahan penginklusi dengan proses pembuatan nanopartikel memodifikasi metode Aimi et al. (2009). Bagian yang dimodifikasi adalah tiga tahap proses pembuatan nanopartikel dengan proses inklusi, re-solubilisasi dan stabilisasi, selain itu bahan penginklusi kasein diganti dengan β-siklodekstrin.
untuk kanker payudara menggunakan sel kanker MCF-7 dan dapat juga dilakukan pada hewan coba seperti tikus atau mencit yang telah diinduksi oleh senyawa karsinogen seperti DMBA maupun induksi dengan sel kanker yang berasal dari jaringan yang terkena kanker. Menurut Pray (2008) dan Ruckenstuhl et al. (2009), yeast ini dapat dijadikan model dalam proses terjadinya apoptosis dan stres akibat oksidasi (Laun et al. 2001). Demikian pula menurut Halazenotis et al. (2008) dan Lotti et al. (2011) bahwa yeast merupakan model yang cocok digunakan untuk melihat perkembangan kanker. Yeast ini telah dijadikan model untuk kanker yang berhubungan dengan regulasi reseptor hormon estrogen oleh Lyttle et al. (1992). Menurut Ayer et al. (1995), yeast ini terdapat pemodelan dengan mamalia dari repsesor sisi gen homolog Sin3. Sedangkan menurut Lotti et al. (2011) pada gen Pdr5p. Penelitian yang menyangkut perbedaan ukuran partikel propolis terhadap aktivitas antikapang telah dilakukan oleh Dota et al. (2011).
Sel lestari kanker MCF-7 merupakan sel hasil isolasi dari seorang wanita Kaukasian (69 tahun, golongan darah O dan RH+), sel MCF-7 pertama kali diisolasi pada tahun 1970. Sel ini merupakan cell line adherent, yang tumbuh melekat dengan karakter resisten terhadap agen kemoterapi, mengekspresikan reseptor estrogen (ER+), ekspresi berlebih Bcl-2, tidak mengekspresikan caspase-3, serta resisten terhadap doksorubisin. Sel MCF-7 dapat ditumbuhkan pada media mengandung Roswell Park Memorial Institute Medium (RPMI), Fetal Bovine Serum (FBS), dan perlu ditambahkan antibiotik dan antimikotik.
Tikus merupakan spesies hewan kedua yang paling sering digunakan dalam penelitian dan pengujian biomedis. Tikus telah digunakan sebagai hewan coba pengujian antitumor tamoxifen oleh Abbasalipourkabir et al. (2010). Demikian pula penelitian Padmavathi et al. (2006) menggunakan tikus Sprague Dawley yang diinduksi oleh DMBA dalam pengujian propolis dan paklitaksel sebagai bahan antikanker.
1.2 Tujuan Penelitian
Tujuan penelitian ini secara umum adalah pengembangan proses untuk me-ningkatkan nilai tambah propolis dan meme-ningkatkan kemampuan aktivitas pro-polis dalam bentuk partikel yang berukuran nano (nanopropro-polis) sebagai bahan antikanker payudara.
Secara khusus, tujuan penelitian ini diuraikan untuk setiap bab sebagai berikut :
1. Mendapatkan ekstrak propolis dari sarang lebah Trigona spp yang berasal dari lima lokasi di Indonesia dan karakteristik bahan aktifnya.
2. Mendapatkan kondisi terbaik untuk ekstraksi propolis menggunakan pelarut etanol 70% dan pemanasan gelombang mikro serta karakteristik hasil ekstraknya.
3. Mengkaji proses pembuatan nanopropolis Trigona spp dengan cara inklusi pada β-siklodekstrin dan karakteristiknya.
1.3 Ruang Lingkup Penelitian
Ruang lingkup pada penelitian ini adalah :
1. Bahan baku propolis berasal dari sarang lebah Trigona spp yang berasal dari lima lokasi di Indonesia (Pekanbaru, Pandeglang, Kendal, Banjarmasin dan Makassar).
2. Ekstraksi awal adalah pelarutan sarang lebah dalam pelarut etanol 70% (b/b, etanol absolut dengan air).
3. Proses pembuatan nanopropolis dilakukan dengan cara inkulusi pada β-siklodekstrin.
4. Pengujian secara in-vitro dilakukan terhadap sel lestari kanker MCF-7, sedangkan pengujian secara in-vivo menggunakan hewan coba tikus betina strain Sprague-Dawley yang diinduksi dengan DMBA.
1.4 Kebaruan
2 METODOLOGI PENELITIAN
2.1 Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Biokimia, FMIPA IPB, Laboratorium Pusat Penelitian Kimia, LIPI Bandung, Laboratorium Pengembangan Teknologi Industri Agro dan Biomedika, BPPT Serpong, dan Laboratorium Patologi dan Kandang Hewan di Departemen Klinik, Reproduksi dan Patologi Fakultas Kedokteran Hewan IPB. Penelitian ini dilaksanakan sejak bulan Juni 2010 sampai dengan Agustus 2012.
2.2 Bahan dan Alat
Bahan utama yang digunakan adalah raw propolis yang diambil dari sarang lebah Trigona spp dari lima lokasi di Indonesia (Banjarmasin, Kendal, Pandeglang, Pekanbaru dan Makassar). Bahan-bahan kimia yang digunakan adalah AlCl3, etanol, Saccharomyces cerevisiae, sel lestari kanker Michigan Cancer Foundation-7 (MCF-7), tikus betina strain Sprague-Dawley, media padat agar (yeast extract potato dextrose, YEPD), 1,1-diphenyl-2-picrilhydrazil (DPPH), 7,12-dimethylbenz(a)anthracene (DMBA), β-siklodekstrin, kuersetin, Na-asetat, minyak zaitun, NaCl, medium Roswell Park Memorial Institute (RPMI) 1640, Fetal Bovine Serum (FBS), metanol, KBr, pereaksi-pereaksi uji fitokimia, pereaksi 3-(4,5-dimethylthiazol-2yl)-2,5-diphenyltetrazolium bromide (MTT)-assay, KH2PO4, K2HPO4, Xylol, buffer neutral formalin (BNF) 10%, Haematoxyllin-Eosin, Dimehyl Sulfoxide (DMSO), Coomassie blue, fungizon, penisilin-streptomisin dan akuades.
Alat-alat yang digunakan ialah Homogenizer, Pemanas gelombang mikro (Microwave Processor, Kriss Microwave Oven frekuensi 2.450 MHz dan daya 800 Watt), laminar air flow cabinet, Kromatografi cair berperforma tinggi (high performance liquid chromatography, HPLC model JSA-65 10LA), inkubator anaerob 5% CO2, XRD Xray Difractometer (SHIMADZU), spektrofotometer, Fourier Transform Infra Red (FTIR), mikroskop, scanning electron microscopy (SEM), particle size analyzer (PSA, Delsa Nano C, Particle Analyzer, Beckman Coulter), rotavapor, tissue tec, pengering vakum, pembaca Enzyme-linked immunosorbent assay (ELISA reader), penghitung koloni dan beberapa alat gelas lainnya.
2.3 Metode
propolis dan jumlah β-siklodekstrin) pada kondisi terbaik tahap pertama, pengujian aktivitas antikanker payudara nanopropolis pada tikus betina strain Sprague-Dawley yang diinduksi DMBA.
Gambar 2.1 Diagram alir penelitian pembuatan nanopropolis asal Indonesia sebagai bahan antikanker
2.3.1 Ekstraksi dan Karakterisasi Propolis dari Sarang Lebah Trigona Asal Lima Lokasi di Indonesia
2.3.1.1 Ekstraksi Propolis. Proses ekstraksi propolis yang dilakukan merupakan hasil modifikasi metode dari Armstrong (1999), Trusheva et al. (2007), Li et al. (2010), Jang et al. (2009). Sebanyak 2 g sarang lebah Trigona spp direndam dengan 18 ml etanol 70%, ditutup lalu dikocok dengan orbital shaker selama 18 jam. Kemudian dipanaskan dengan pemanas gelombang mikro (frekuensi 2.450 MHz dan daya 800 Watt) selama 10 menit, lalu disaring. Filtrat yang diperoleh dipekatkan dengan menggunakan rotavapor pada suhu 50±2 C selama tiga jam atau hingga air dan etanol menguap sempurna. Ekstrak yang diperoleh kemudian ditimbang dan dihitung rendemennya. Rendemen ditentukan dengan rumus
Ekstraksi propolis dari lima lokasi di
Indonesia
Data Karakter Propolis dari Lima Lokasi di
Indonesia
Perbaikan Proses Ekstraksi
Pembuatan Nanopropolis Tahap 1
Pembuatan Nanopropolis Tahap 2
Uji Efikasi Nanopropolis secara In-Vivo
Desain Proses Ekstraksi Propolis dan
Karakter Propolis
Desain Proses Pembuatan Nanopropolis
sebagai berikut : Rendemen (%) = (bobot hasil ekstraksi/bobot raw propolis) x 100.
Hasil ekstraksi disimpan dalam botol gelap dan ditempatkan di ruang yang tidak terkena sinar matahari langsung. Untuk pengujian selanjutnya, ekstrak ini dilarutkan dalam etanol 70% sebanyak satu kali volumenya.
2.3.1.2 Karakterisasi ekstrak propolis dari lima lokasi di Indonesia.
Karakterisasi ekstrak propolis dari lima lokasi di Indonesia dilakukan meliputi komponen propolis (kandungan kualitatif komponen kimia dan kadar total flavonoid) dan kinerja propolis (aktivitas antioksidan, induksi apoptosis terhadap sel Saccharomyces cerevisiae, aktivitas antisitotoksik terhadap sel lestari kanker payudara MCF-7) sebagai bahan antikanker payudara.
2.3.1.2.1 Pengujian kualitatif komponen kimia. Uji kualitatif propolis Trigona spp meliputi uji keberadaan alkaloid, flavonoid, terpenoid, steroid, saponin dan tannin (Harborne 1987).
Uji alkaloid. Sebanyak 100 mg propolis dimasukkan dalam tabung reaksi, kemudian ditambahkan dua tetes ammonia dan 5 ml kloroform lalu disaring. Filtrat hasil penyaringan ditambahkan 1 ml H2SO4 2 M, kemudian fraksi asam ditambahkan pereaksi Dragendorf, Meyer dan Wagner. Keberadaan alkaloid dalam propolis ditunjukkan dengan terbentuknya endapan merah pada pereaksi Dragendorf, endapan putih pada pereaksi Meyer dan endapan coklat pada pereaksi Wagner.
Uji triterpenoid dan steroid. Sebanyak 100 mg propolis dimasukan dalam tabung reaksi, lalu ditambahkan etanol panas sebanyak 5 ml lalu disaring. Filtrat hasil penyaringan dievaporasi, kemudian ditambahkan 1 ml dietileter. Setelah dikocok dengan ‘vortex’, lalu ditambahkan 1 ml H2SO4 pekat dan 1 ml CH3COOH. Terbentuknya warna merah atau kelabu menunjukkan adanya triterpenoid dan warna hijau menunjukkan adanya steroid dalam propolis.
Uji flavonoid. Sebanyak 100 mg propolis dimasukkan dalam tabung reaksi lalu ditambahkan 5 ml air, lalu dilakukan penyaringan. Filtrat yang diperoleh ditambahkan bubuk Mg, 1 ml HCl pekat, dan 1 ml amilalkohol. Kemudian diaduk sempurna sehingga timbul lapiran yang berbeda. Warna yang terbentuk antara dua larutan amilalkohol menunjukkan adanya flavonoid.
Uji tanin. Sebanyak 100 mg propolis dimasukkan dalam tabung reaksi, lalu ditambahkan 5 ml air dan disaring. Fltrat hasil penyaringan ditambahkan 3 tetes FeCl3 1%. Terbentuknya warna biru atau hijau kehitam-hitaman menunjukkan adanya tannin dalam propolis.
Uji saponin. Sebanyak 100 mg propolis dimasukkan dalam tabung reaksi kemudian ditambahkan 5 ml air dan disaring. Fltrat hasil penyaringan dikocok dengan sempurna lalu dibiarkan selama 10 menit. Terbentuknya buih yang stabil menunjukkan adanya saponin dalam propolis.
2.3.1.2.2 Penentuan total flavonoid. Kandungan total flavonoid ditentukan dengan metoda Chang et al. (2002) dengan modifikasi. Pengujian dilakukan menggunakan AlCl3 yang diukur dengan metode pewarnaan.
dibiarkan selama 30 menit. Setelah itu larutan diukur absorbansinya pada panjang gelombang maksimal kuersetin. Absorban yang dihasilkan dimasukkan ke dalam persamaan regresi dari kurva standar kuersetin. Kemudian kadar flavonoid total dihitung dengan menggunakan rumus:
Kadar Flavonoid Total (%, b/b)
=kadar kuersetin (mg mlꜗ) x faktor pengenceran x volume (ml)x 1001000 x bobot contoh (mg)
2.3.1.2.3 Pengujian kemampuan antioksidan metode DPPH
Aktivitas antioksidan propolis diuji dengan metoda Cottica et al. (2011) yang dimodifikasi untuk melihat penghambatan oksidasi radikal bebas DPPH. Contoh propolis dilarutkan dalam etanol 70% dan dibuat dalam berbagai konsentrasi (500, 250, 125, 62.5, 31.25, 15.5 dan 7.75 mg ml-1). Setelah itu dikocok dengan vorteks. Kemudian diambil 100 µl ekstrak dan direaksikan dengan 100 µl DPPH 125 µmol. Kemudian diinkubasi selama 30 menit. Setelah itu diukur absorbansinya dengan menggunakan ELISA reader pada panjang gelombang 515 nm. Persentase penangkapan radikal bebas DPPH diukur menggunakan persamaan :
Penangkapan radikal bebas (%)
=absorbansi blanko − absorbansi contoh x 100absorbansi blanko
Setelah diketahui persentase penangkapan radikal bebas DPPH, dibuat kurva dan persamaan antara konsentrasi EEP (sumbu X) dan nilai persentase penangkapan radikal bebas DPPH (sumbu Y) diperoleh persamaan Y = aX + b. Untuk menghitung konsentrasi yang menghasilkan penangkapan radikal bebas sebanyak 50% adalah dengan cara memasukkan angka 50 pada sumbu Y kemudian diperoleh nilai konsentrasi EEP pada sumbu X dari kurva antara konsentrasi EEP dan nilai persentase penangkapan radikal bebas DPPH. Nilai konsentrasi EEP yang diperoleh merupakan nilai IC50 aktivitas antioksidan.
2.3.1.2.4 Pengujian kemampuan apoptosis terhadap sel Saccharomyces cerevisiae
Pengujian induksi apoptosis terhadap S. cerevisiae dilakukan sesuai dengan metoda Laun et al. (2001) yang dimodifikasi. Ke dalam media yeast agar ditambahkan propolis (50 µg ml-1) yang telah dituang 50 µl sel S. cerevisiae kemudian diinkubasikan pada suhu 30±2oC selama 2 x 24 jam dan dilihat pertumbuhan S. cerevisiae secara langsung dengan penghitung koloni. Jumlah sel yang mengalami petit dan sel normal dihitung, kemudian dihitung persentasenya.
2.3.1.2.5 Pengujian kemampuan antisitotoksik sel lestari kanker payudara MCF-7.
0C dalam inkubator dengan 5% CO
2. Jumlah sel yang bertahan hidup diukur menggunakan pembaca ELISA pada panjang gelombang 515 nm. Jumlah persentase sel hidup dihitung menggunakan persamaan :
Persentase Sel Hidup (%)
=absorbansi kontrol negatif terkoreksi absorbansi contoh terkoreksi 100
2.3.2 Ekstraksi Propolis Trigona SPP Asal Pandeglang Menggunakan Pelarut Etanol 70% dan Pemanasan Gelombang Mikro dan Karakterisasinya
Ekstraksi dilakukan terhadap sarang lebah yang terpilih pada tahap ekstraksi dan karakterisasi propolis asal lima lokasi di Indonesia (Subbab 2.3.1) dengan perubahan pada nisbah pelarut etanol 70%-sarang lebah dan lama waktu pemanasan gelombang mikro. Nisbah pelarut etanol 70%-sarang lebah dan lama waktu pemaansan gelombang mikro disesuaikan dengan perlakuan untuk menentukan kondisi terbaik dalam eksraksi propolis. Parameter yang dilihat adalah kemampuan menginduksi apoptosis yang diukur persentase jumlah sel Saccharomyces cerevisiae yang mengalami petite.
Persentase jumlah sel petite dianalisis menggunakan bantuan Design Expert 7.0.0 (free trial). Kondisi terbaik ditentukan dari persamaan model yang diperoleh, kemudian dilakukan validasi ekstraksi menggunakan peubah hasil terbaik. Hasil ekstraksi propolis pada kondisi terbaik, kemudian dilakukan karakterisasi yang meliputi kadar flavonoid, aktivitas antioksidan, identifikasi gugus fungsional, identifikasi kandungan senyawa propolis, uji induksi apoptosis terhadap S. cerevisiae dan uji efikasi in-vitro terhadap sel lestari kanker payudara (MCF-7).
2.3.3 Pembuatan Nanopropolis dengan Cara Inklusi pada β-Siklodekstrin
Pembuatan nanopropolis dimodifikasi dari Aimi et al. (2009), Bhaskar et al. (2009), Hasan et al. (2011), Chen et al. (2006), dan Kim et al (2008). Pada tahap ini proses pembuatan nanopropolis dilakukan dengan pengadukan menggunakan homogenizer kecepatan tinggi (22 000 rpm) dengan tiga peubah yaitu pengadukan pada proses inklusi, re-solubilisasi dan stabilisasi. Jumlah propolis dan β-siklodekstrin yang digunakan adalah sebanyak 50 mg dan 250 mg. Parameter yang dilihat adalah rata-rata ukuran partikel dan persentase sel lestari kanker MCF-7 yang mengalami kematian.
Proses pembuatan nanopropolis tahap kedua menggunakan peubah jumlah EEP dan β-siklodekstrin dengan waktu pengadukan pada proses inklusi, re-solubilisasi dan stabilisasi terbaik dari hasil penelitian sebelumnya. Tujuan penelitian pembuatan nanopropolis kedua ini untuk menentukan jumlah EEP dan β-siklodekstrin yang digunakan yang mempunyai kemampuan aktivitas proliferasi yang terbaik. Parameter yang dilihat adalah persentase jumlah sel lestari kanker MCF-7 yang mengalami kematian.
kemudian dilakukan validasi proses pembuatan nanopropolis pada kondisi terbaik. Pada analisis statistika proses pembuatan propolis tahap kedua ini pun dilakukan dengan menggunakan bantuan Design Expert 7.0.0 (free trial) terhadap parameter persentase jumlah sel lestari kanker MCF-7 yang mengalami kematian. Pada kondisi jumlah propolis dan β-siklodekstrin terbaik kemudian dilakukan proses pembuatan nanopropolis sebagai validasi terhadap kondisi proses tersebut dan dilakukan karakterisasi. Karakteristik yang dilihat meliputi uji tingkat kristalinitas, identifikasi gugus fungsional, analisis kandungan bahan kimia, uji penampakan secara SEM, pengukuran distribusi ukuran partikel dan aktivitas sitotoksik terhadap sel lestari kanker MCF-7 secara in-vitro.
2.3.4 Aktivitas Nanopropolis sebagai Antikanker Payudara pada Tikus Betina Strain Sprague-Dawley yang Diinduksi DMBA
3 EKSTRAKSI DAN KARAKTERISASI PROPOLIS DARI SARANG LEBAH Trigona ASAL LIMA LOKASI DI INDONESIA
3.1 Pendahuluan
Propolis adalah resin produk sarang lebah yang dikumpulkan oleh lebah madu (stingless bee atau honey bee) dan digunakan untuk membuat sarang serta untuk pertahanannya. Dengan demikian propolis ini berarti produk yang terlibat dalam komponen pertahanan masyarakat lebah (Salatino et al. 2005). Lebah madu Trigona sp tidak mempunyai sengat sebagai pertahanannya, tapi bukan berarti tidak mempunyai kekuatan dalam sistem pertahanan. Oleh karena itu menurut Caron (1988), Trigona mempunyai kemampuan memproduksi bahan kimia sebagai pertahanannya. Pino et al. (2006) melaporkan bahwa komponen mudah menguap dari stingless bees lebih banyak dibandingkan dengan Apis mellifera.
Sebagai bagian dari sarang lebah, propolis mempunyai fungsi melindungi sarang dari bakteri dan serangan serangga lain. Propolis telah digunakan dalam pengobatan sejak zaman dahulu kala dan studi terbaru telah dilakukan untuk mengungkap keuntungan dari propolis sebagai antibakteri, antikapang, antivirus, antiinflamasi, pembiusan lokal, hepatoprotektif, immunostimulan, antiparasit dan antitumor (Fearnley 2005, Yousef dan Salama 2009, Woo 2004). Telah diketahui lebih dari 180 bahan aktif dari propolis (Kasahara et al. 2004, Khismatullina 2005). Kandungan utama bahan aktif propolis seperti flavonoid, asam aromatik, terpenoid dan fenilpropanoid serta asam lemak telah diketahui pula (Lustosa et al. 2008). Lebih dari 40 tahun, banyak studi dan publikasi yang terfokus pada komposisi kimia, aktivitas biologis, farmakologi dan pengobatan menggunakan propolis (Khismatullina 2005).
Nunes et al. (2009) menyatakan bahwa komposisi propolis tergantung pada musim, vegetasi dan lokasi pengambilan sarang lebah. Salatino et al. (2005), Fernandes-Silva et al. (2013), Sawaya et al. (2009) juga menyatakan bahwa komposisi kimia propolis tergantung pada tumbuhan atau tanaman sumber resin yang dikumpulkan dan berakibat pada lokasi geografis sarang lebah. Menurut Franchi et al. (2010) bahwa perbedaan dalam kualitas propolis dapat dilihat dari warna sarang lebah dan lokasinya. Namun komposisi kimia propolis adalah sangat kompleks dan tidak dapat diprediksi dari dugaan awal (Teixiera et al. 2005). Saat ini, sebagian besar propolis yang digunakan untuk produksi komersial dalam upaya meningkatkan kesehatan dan mencegah penyakit berasal dari Eropa dan Amerika (terutama Kanada dan Brasil), serta sangat sedikit dari Asia.
3.2 Bahan dan Metode
3.2.1 Bahan dan Alat
Bahan yang digunakan adalah sarang lebah Trigona spp dari Pandeglang, Kendal, Banjarmasin, Makassar dan Pekanbaru, etanol 70% sebagai pelarut, larutan standar kuersetin, AlCl3, Na-Asetat, air suling, DPPH, media agar yeast, S. cerevisiae, sel lestari kanker MCF-7, DMSO, media RPMI-1640, ammonia, kloroform, H2SO4, pereaksi Dragendorf, Meyer dan Wagner, dietileter, CH3COOH, bubuk Mg, HCl pekat, amilalkohol dan FeCl3. Alat yang digunakan adalah autoclave, inkubator dengan 5% CO2, laminar air flow, UV-Vis Spectrophotometer, dan orbital shaker. pemanas gelombang mikro (KRIS MICROWAVE OVEN, 2450 MHz dan 800 Watt), rotary evaporator vakum, penghitung koloni, pembaca ELISA. Secara lengkap bahan dan alat yang digunakan dalam seluruh penelitian ini disajikan pada Subbab 2.2.
3.2.2 Metode
3.2.2.1 Ekstraksi Propolis. Proses ekstraksi propolis dilakukan seperti terdapat pada Subbab 2.3.1.
3.2.2.2 Penentuan Kadar Total Flavonoid. Penentuan kadar total flavonoid dilakukan sesuai dengan tatacara pada Subbab 2.3.1.2.2
3.2.2.3 Pengujian Antioksidan dengan metode DPPH. Pengujian antioksidan dengan metode DPPH dapat dilihat pada Subbab 2.3.1.2.3
3.2.2.4 Uji kemampuan apoptosis terhadap sel S. cerevisiae. Uji kemampuan apoptosis terhadap sel S cerevisiae dapat dilihat pada Subbab 2.3.1.2.4.
3.2.2.5 Uji kemampuan antisitotoksik terhadap sel lestari kanker MCF-7. Uji kemampuan antisitotoksik terhadap sel lestari kanker MCF-7 dapat dilihat pada Subbab 2.3.1.2.5.
3.2.2.6 Uji kualitatif komponen kimia. Uji kualitatif propolis Trigona spp meliputi uji keberadaan alkaloid, flavonoid, terpenoid, steroid, saponin dan tannin dapat dilihat pada Subbab 2.3.1.2.1.
3.3 Hasil dan Pembahasan
3.3.1 Ekstraksi Propolis
Propolis yang diekstrak dengan menggunakan perlakuan pemanasan gelombang mikro (Microwave-assisted extraction, MAE), yang dapat meningkatkan kontak antara pelarut dan contoh (Jang et al. 2009). Komponen aktif yang ada dalam raw propolis dapat terekstrak sempurna. Sebelum menggunakan pemanasan gelombang mikro, sarang lebah terlebih dahulu dimaserasi dengan etanol 70% selama 18 jam. Etanol dapat mengekstrak flavonoid yang merupakan komponen penting dalam propolis. Etanol 70% adalah pelarut semipolar yang dapat mengekstrak komponen aktif dengan perbedaan kepolaran dalam propolis (Cunha et al. 2004, Hasan et al. 2006, Sawaya et al. 2011) dan etanol dengan konsentrasi 70% merupakan konsentrasi optimum untuk mengekstrak flavonoid dalam kulit manggis (Hasan et al. 2013).
Pada penelitian yang dilakukan oleh Cunha et al. (2004) diketahui bahwa proses maserasi menggunakan pelarut etanol 70% juga merupakan pelarut yang paling besar kemampuannya dalam menghasilkan komponen kimia terlarut. Makin kecil jumlah etanol yang digunakan makin kecil pula hasil yang diperoleh. Demikian pula dengan hasil penelitian Hasan et al. (2013), makin kecil konsentrasi etanol dari 70% atau makin besar konsentrasi etanol dari 70% menunjukkan nilai hasil ekstrak dan konsentrasi flavonoid yang lebih kecil dibandingkan dengan hasil menggunakan etanol 70%.
Komposisi kimia propolis diperlihatkan dalam warna dan bau yang menyengat dipengaruhi oleh asal bahan serta umur sarang lebah yang dikumpulkan. Warna filtrat dari propolis yang dihasilkan asal dari lima lokasi adalah berwarna kuning cerah, kuning kehitaman, kuning kehitaman sampai ke warna coklat dan hitam. Komposisi propolis dari satu lokasi ke lokasi lain dipengaruhi oleh sarang ke sarang, lokasi, dari musim ke musim, dan karena tanaman dimana lebah mengambil resin sekitar sarang, dan komposisi propolis tergantung pada perbedaan lokasi atau geografi. Propolis yang berwarna pekat menunjukkan hasil yang banyak dibandingkan dengan yang berwarna lebih terang. Kadar flavonoid ditunjukkan oleh tingkat kepekatan warna (Woo 2004). Hasil penelitian yang dilakukan terhadap sarang lebah asal lima lokasi di Indonesia membuktikan bahwa pengaruh warna sarang lebah mempengaruhi rendemen hasil ekstraksi.
3.3.2 Kadar Total Flavonoid
Kadar total flavonoid dari lima lokasi tersebut menunjukkan perbedaan. Perbedaan lokasi menunjukkan jumlah dan jenis flavonoid telah dibuktikan dalam penelitian Syamsuddin et al. (2010), Chen et al. (2008), Daugsch et al. (2008), Paviani et al. (2011) dan Silva et al. (2008). Kandungan flavonoid ini berhubungan erat dengan kemampuan propolis sebagai antioksidan (Table 3.1). Flavonoid sebagai antioksidan dapat bereaksi dengan radikal bebas dengan membentuk ikatan hidrogen pada komponen radikal bebas tersebut (Ratnam et al. 2006). Hubungan antara total flavonoid dengan aktivitas antioksidan dapat dilihat dari hasil uji antioksidan. Flavonoid dari propolis mempunyai kapasitas antioksidan yang lebih besar dibandingkan dengan Vitamin C dan E (Prior dan Cao, 2000).
Tabel 3.1 Hasil ekstrak propolis dan karakterisasinya
Karakter
Lokasi
Makasar Pekanbaru Kendal Pandeglang Banjarmasin
Rendemen, % 1.85±0.51c 19.97±2.19a 7.28±1.59b 11.05±3.20b 8.38±0.70b
Total Flavonoid, µg. ml-1
38.78±1.62b 16.90±0.537e 46.60±0.78a 30.62±1.50c 24.60±0.73d
Aktivitas Antioksidan (IC50), µg.ml-1
1125.56±133b 308.88±12c 144.06±52.53d 68.935±5.63e 4162.61±845.9a
Aktivitas Antisitotoksik pada 100 µg ml-1, % sel
hidup
47.71±9.31c 76.35±1.48a 50.26±2.70c 70.64±1.21b 75.79±1.33a
3.3.3 Aktivitas Antioksidan
Penghambatan radikal dengan metoda DPPH merupakan salah satu metode untuk menentukkan aktivitas antioksidan. Parameter yang digunakan dalam uji DPPH adalah IC50, yaitu konsentrasi yang diperlukan untuk menghambat 50% dari radikal bebas DPPH. Nilai IC50 diperoleh dari persamaan hubungan antara konsentrasi ekstrak dengan persen penghambatan. Nilai IC50 yang kecil berarti kemampuan dalam menghambat radikal dari DPPH sangat besar. Hal ini menunjukkan kuatnya suatu bahan sebagai antioksidan. Klasifikasi aktivitas antioksidan ini dinyatakan oleh Chow et al. (2003) bahwa nilai IC50 menunjukkan kekuatan antivitas antioksidan, apabila nilai IC50 suatu ekstrak dibawah 50 µg ml-1 berarti kemampuannya sangat aktif sebagai antioksidan, nilai 51-100 µg ml-1 aktif sebagai antioksidan, nilai 100-150 µg ml-1 kurang aktif dan diatas 150 µg ml-1 tidak aktif sebagai antioksidan.
Propolis hasil ekstraksi yang sangat aktif sebagai antioksidan berasal dari Pandeglang pada konsentrasi 68.935 µg ml-1 (Tabel 3.1). Ekstrak propolis dari Pekanbaru, Makassar dan Banjarmasin tidak menunjukkan adanya antioksidan karena mempunyai nilai IC50 yang lebih besar dari 150 µg ml-1, sedangkan ekstrak propolis dari Kendal menujukkan kemampuan yang lemah karena nilai IC50 sedikit lebih kecil dari 150 µg ml-1. Perbedaan kemapuan aktivitas propolis dari lima lokasi di Indonesia ini sesuai dengan penelitian yang dilakukan oleh Mihai dan Marghitas (2010) bahwa lokasi asal pengambilan sarang lebah berpengaruh terhadap nilai antioksidan propolis. Perbedaan dalam aktivitas sebagai antioksidan terutama dari kandungan flavonoid ekstrak propolis atau komponen lain yang potensial sebagai antioksidan dan kandungan komponen yang dipengaruhi oleh tipe dan lamanya umur sarang lebah serta jenis tanaman sekitar sarang Trigona sp (Table 3.2). Bila dilihat dari hasil uji total flavonoid, nilai tertinggi dari Makassar tapi tidak mempunyai kemampuan sebagai antioksidan karena nilai IC50 lebih besar dari 150 µg ml-1. Variasi yang ada ini akan berpengaruh pada jenis flavonoid (Bankova et al. 2000, Miorin et al. 2003, Yang et al. 2007, Jasprica et al. 2007, Teixeira et al. 2005). Aktivitas antioksidan mempunyai hubungan dengan kandungan flavonoid (terutama kuersetin, apigenin dan kaempferol) dan konsentrasi asam kafeat (Coneac et al. 2008). Keberadaan tektokrisin (Lee et al. 2003) atau propolin (Chen et al. 2004) akan meningkatkan enzim yang berperan dalam aktivitas antioksidan.
dengan vegetasi di sekitar sarang lebah yang berbeda akan menimbulkan perbedaan komponen kimia secara umum, dan secara khusus perbedaan komponen kimia telah ditunjukkan dengan perbedaan kadar flavonoid dan kemampuan lainnya dari lima lokasi di Indonesia.
3.3.4 Induksi Apoptosis S. cerevisiae
Hasil pengukuran induksi apoptosis terhadap sel S. cerevisiae akibat perlakuan propolis dari Pekanbaru, Banjarmasin, Pandeglang, Makassar dan Kendal menunjukkan potensi induksi apoptosis dengan nilai 50.94, 65.08, 67.75, 71.09 dan 81.43 % (Gambar 3.2). Perbedaan ini dipengaruhi oleh jenis flavonoid yang dikandung oleh propolis (Miorin et al. 2003, Yang et al. 2011, Jasprica et al. 2007). Namun penelitian yang dilaporkan oleh Umthong et al. (2011), bahwa propolis Trigona dari Thailand menemukan komponen yang aktif sebagai bahan antiproliferasi terhadap kanker secara in-vitro tapi tidak terhadap sel normal. Artinya adalah bahwa propolis asal Thailand kemungkinan tidak menginduksi apoptosis terhadap sel S.cerevisiae, karena yeast ini merupakan sel normal. Perbedaan jenis dan jumlah flavonoid akan mengarah pada mekanisme propolis dalam mengapoptosis sel kanker.
Apoptosis, atau kematian terprogram, merupakan perkembangan dan kesehatan yang normal dari organisme sel banyak. Kematian sel merupakan akibat dari berbagai sebab dan selama terjadinya apoptosis kondisi organisme tersebut dalam kondisi mengatur diri atau terkendali. Hal ini yang membedakan dengan kematian sel yang disebut nekrosis, yaitu lisis sel yang tidak terkontrol akibat inflamasi dan masalah kesehatan yang serius (Granot 2003). Bhatia-Kissova dan Camougrand (2010) menyatakan bahwa mekanisme apoptosis dalam yeast karena penambahan rifampicin atau laktat yang terjadi dalam mitokondria dimulai dengan pembentukkan enzim caspase 1 (Yca1). Bahan kimia yang menimbulkan apoptosis dalam S. cerevisiae seperti glukosa, asam asetat dan propolis (Sukhanova et al. 2011). Proses terjadinya apoptosis dalam S. cerevisiae diuraikan oleh Lotti et al. (2011). Kandungan bahan yang terlibat dalam kematian
Tabel 3.2 Hasil analisa fitokimia propolis dari lima lokasi di Indonesia
No. Golongan Senyawa Lokasi Asal Sarang Lebah
Makassar Pekan baru Kendal Pande- glang masin
Banjar-1. Alkanoid - - - - -
2. Flavonoid + + + + +
3. Saponin - + + - -
4. Tannin - + + + -
5. Steroid - - - - -
sel karena pengaruh propolis pada S. cerevisiae menurut de Castro et al. (2011) adalah sitokrom c bukan endonuclease G (Nuc1p).
3.3.5 Aktivitas antisitotoksik sel lestari kanker MCF-7
Jumlah sel MCF-7 yang hidup terbanyak akibat perlakuan propolis berasal dari Pekanbaru, berbeda dengan propolis yang berasal dari Makassar yang mempunyai kapasitas yang besar sebagai bahan antikanker (Tabel 3.1). Hasil ini menunjukkan bahwa lokasi sarang lebah akan berpengaruh pada kualitas propolis yang dihasilkan. Penelitian yang dilakukan oleh Syamsuddin et al. (2010) menyimpulkan bahwa perbedaan hasil antikanker MCF-7 yang berbeda IC50 dari propolis asal Batang, Jawa Tengah, Lawang, Jawa Timur dan Sukabumi, Jawa Barat. Perbedaan hasil yang ditunjukkan karena perbedaan lokasi sarang lebah telah ditemukan oleh Daugsch et al. (2008) dan Monzote et al. (2012) dalam aktivitas antibakteri. Perbedaan dalam aktivitas propolis akibat perbedaan lokasi kemungkinan akibat adanya perbedaan kandungan bahan kimia (Zhu et al. 2011). Penghambatan pertumbuhan sel kanker ini diakibatkan oleh adanya aktivasi jalur enzim caspase dan jalur transkripsi protein (Madeo et al., 2004). Penelitian yang dilakukan oleh Huang et al. (2012), menemukan bahwa terdapat komponen propolis yang berfungsi sebagai pengatur proliferasi sel kanker dan pertahanan atau perbaikan dari kejadian tumor dalam gen pada sel normal. Penelitian in-vitro yang dilaporkan oleh Umthong et al. (2011), bahwa propolis Trigona asal Thailand mengandung komponen dengan aktivitas antiproliferasi sel kanker tapi tidak terhadap sel normal. Perbedaan ini disebabkan oleh perbedaan jenis dan jumlah flavonoid dalam asal bahan (Oddo et al. 2008, Miorin et al. 2003, Yang et al. 2011, Jasprica et al. 2007), seperti halnya krisin dan asam kafeat berpengaruh langsung terhadap perhambatan sel kanker (Sawicka et al. 2012). Sebagai tambahan, perbedaan jenis dan jumlah flavonoid akan mempengaruhi dalam mekanisme penghambatan (Sawicka et al. 2012 dan Watanabe et al. 2011). Perbedaan jumlah propolins (khususnya D, C, E, A dan B) akan menyebabkan perbedaan kekuatan sebagai antitumor (Chen et al. 2004).
Dengan data parameter ekstraksi propolis yang diperoleh yaitu rendemen, kadar total flavonoid, aktivitas antioksidan, aktivitas sitotoksik, dan induksi apoptosis dilakukan pembobotan dengan bobot yang sama (Tabel 3.3). Hasil pembobotan dari propolis hasil ekstraksi sarang lebah yang berasal dari lima lokasi di Indonesia dan dengan menggunakan sistem pengambilan keputusan diperoleh nilai 17, 16, 11, 10 dan 8 untuk Pandeglang, Kendal, Makassar, Pekanbaru dan Banjarmasin (Lampiran 2). Dengan demikian penelitian selanjutnya dipilih sarang lebah asal Pandeglang.
Tabel 3.3 Parameter dan nilai skor pada penentuan lokasi sumber propolis
Rendemen, % Nilai Skor Total Flavonoid, μg ml-1 Nilai Skor
1-4 1 0-10 1
5-8 2 11-20 2
9-12 3 21-30 3
13-16 4 31-40 4
17-20 5 41-50 5
Antioksidan, IC50 Nilai Skor Antisitoksik, % sel mati Nilai Skor
1-70 1 ≥79 1
71-140 2 71-78 2
141-210 3 63-70 3
211-280 4 55-62 4
281-350 5 47-54 5
351-420 6
≥ 421 7
Induksi Apoptosis, % sel petite Nilai Skor
30-65 1
66-95 2
≥96 3
3.4 Kesimpulan dan Saran
3.4.1 Kesimpulan
3.4.2 Saran
Perlu dilanjutkan penelitian terhadap sifat propolis lainnya terutama secara rinci kandungan flavonoid atau asam organik dalam propolis yang berasal dari lima lokasi di Indonesia sehingga dapat ditentukan penilaian dan standar yang dapat digunakan dalam menentukan mutu propolis di Indonesia. Dengan demikian, dapat ditentukan manfaat farmakologis propolis dari satu lokasi dengan lokasi lainnya secara jelas.
4 EKSTRAKSI PROPOLIS Trigona spp ASAL PANDEGLANG MENGGUNAKAN PELARUT ETANOL 70% DAN PEMANASAN
GELOMBANG MIKRO SERTA KARAKTERISASINYA
4.1 Pendahuluan
Propolis adalah resin yang dikumpulkan oleh lebah dari berbagai tumbuhan, yang bercampur dengan saliva dan berbagai enzim sehingga menghasilkan resin baru yang berbeda. Propolis mempunyai aktivitas antibakteri, antikapang, antivirus dan aktivitas biologis lain seperti antiinflamasi, anestesi lokal, hepatoprotektor, antitumor, dan imunostimulan (Bankova dan Popova, 2007; Fearnley, 2005; Lotfy, 2006). Daya antimikroba propolis telah dipergunakan oleh bangsa Yunani dan Romawi sejak berabad-abad yang lalu. Sifat unik propolis menarik perhatian para peneliti sejak akhir tahun 1960-an. Selama 40 tahun terakhir, telah dipublikasikan mengenai komposisi kimia, aktivitas biologis, farmakologis propolis dan terapi penggunaannya (Khismatullina, 2005).
Propolis pada umumnya diperoleh dengan cara mengekstrak sarang lebah yang berasal dari Apis sp. Selain Apis sp., ada salah satu jenis lebah yang dekat dengan manusia yaitu lebah madu Trigona sp. Lebah jenis ini diperkirakan menghasilkan jumlah propolis lebih banyak dibandingkan dengan Apis sp. dengan kandungan bahan aktif yang lebih baik. Penelitian yang dilakukan oleh Hasan et al. (2006) menunjukkan bahwa ekstrak etanol propolis Trigona sp yang berasal dari Pandeglang memiliki aktivitas antibakteri, baik untuk bakteri Gram positif (Staphilococcus aureus dan Bacillus subtilis), maupun bakteri Gram negatif (Escherichia coli). Data lain kandungan kimia stingless bees diungkap oleh Matienzo dan Lamorena (2004) serta Sawaya et al. (2009).
Ekstraksi propolis secara umum dilakukan dengan menggunakan pelarut organik atau fluida superkritik. Penelitian yang dilakukan oleh Park dan Ikegaki (1998) memperoleh bahwa etanol 70% mampu mengekstrak flavonoid jenis pinokembrin dan sakuranetin. Penggunaan etanol 70% lebih baik dibandingkan dengan etanol absolut (95%) karena perolehan ekstrak flavonoid lebih banyak. Ekstraksi propolis menggunakan etanol 70% berturut-turut telah dilakukan oleh para peneliti untuk beragam asal propolis seperti Eropa (Sawaya et al., 2004, Bankova et al., 2002, Cunha et al., 2006), Brazil (Cunha et al. 2004; da Silva et al. 2011; da Silva et al. 2011a; Sawaya et al. 2009, Silva et al. 2008), Transilvania (Mihai et al. 2009) dan Libia (El-Rahman, 2010). Sedangkan ekstraksi propolis dari Taiwan yang dilakukan oleh Chen et al. (2008) tidak menyebutkan konsentrasi etanol yang digunakannya.