1
AKTIVITAS AHL-LAKTONASE Bacillus cereus INT1c DAN
Bacillus thuringiensis SGT3g DALAM MENGHAMBAT
PATOGENITAS Xanthomonas oryzae pv. oryzae DAN
Pseudomonas syringae pv. glycinea
VITA ANGGUN CAHYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
1
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Aktivitas AHL-Laktonase Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g dalam Menghambat Patogenitas Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycinea adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2015
RINGKASAN
VITA ANGGUN CAHYANI. Aktivitas AHL-Laktonase Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g dalam Menghambat Patogenitas Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycinea. Dibimbing oleh IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Quorum sensing (QS) merupakan mekanisme komunikasi bakteri sebagai suatu pengaturan ekspresi gen yang bergantung pada jumlah populasi bakteri tersebut dan akumulasi senyawa autoinducer (AI). AI merupakan molekul sinyal yang disekresikan, diakumulasi, diserap kembali, dan dikenali oleh bakteri untuk meregulasi ekspresi gen target. QS pada bakteri Gram negatif menggunakan AI jenis N-acyl homoserin lactone (AHL) sebagai molekul sinyal. Jika AHL dalam sel tinggi, akan direspon oleh sel dengan mengaktifkan protein regulator. Protein regulator membantu ekspresi gen-gen pathogen.
Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycinea merupakan bakteri Gram negatif yang fitopatogen. Kedua bakteri ini melakukan proses quorum sensing menggunakan N-acylhomoserine lactone (AHL). AHL merupakan suatu sinyal untuk meregulasi ekspresi dari gen-gen fitopatogen. X. oryzae pv. oryzae menyebabkan penyakit hawar pada padi (Oryzae sativa) and P. syringae pv. glycinea menyebabkan penyakit leaf blight pada kedelai (Glycine max).
Salah satu pendekatan alami untuk mencegah adanya mekanisme quorum sensing yaitu dengan mendegradasi molekul sinyal menggunakan AHL-laktonase dari Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g. Studi ini bertujuan untuk menguji kemampuan aktivitas AHL-laktonase B. cereus INT1c dan B. thuringiensis SGT3g dalam mendegradasi AHL untuk mencegah patogenitas X. oryzae pv. oryzae dan P. syringae pv. glycinea.
Aktivitas degradasi AHL telah dikonfirmasi pada B. cereus INT1c and B. thuringiensis SGT3g menggunakan Chromobacterium violaceum sebagai bioindikator. Indeks degradasi AHL yang dihasilkan sebesar 0.23 untuk B. cereus INT1c dan 0.12 untuk B. thuringiensis SGT3g. Uji penghambatan fitopatogen pada tanaman tembakau bertujuan menentukan perlakuan yang lebih efektif dalam menghambat fitopatogen untuk diaplikasikan secara in vivo. B. cereus INT1c lebih efektif dalam menghambat patogenitas X. oryzae pv. oryzae (85.62%), sedangkan B. thuringiensis SGT3g lebih efektif menghambat patogenitas P. syringae pv. glycinea (90.51%).
Aktivitas penghambatan terbesar oleh B. cereus INT1c pada uji in vivo tanaman padi terlihat pada varietas IRBB7 (93.69%) dan terkecil pada varietas Kencana Bali (65.65%). Sementara itu, pada uji in vivo tanaman kedelai, B. thuringiensis SGT3g menunjukkan aktivitas penghamatan fitopatogen yang hampir sama pada varietas Anjasmara dan Wili, yaitu 96% untuk Anjasmara dan 95,35% untuk Wilis.
1
SUMMARY
VITA ANGGUN CAHYANI. Activity of Bacillus cereus INT1c and Bacillus thuringiensis SGT3g AHL-Lactonase on Xanthomonas oryzae pv. oryzae and Pseudomonas syringae pv. glycinea Patogenicity Inhibition. Supervised by IMAN RUSMANA and NISA RACHMANIA MUBARIK.
Quorum sensing (QS) is a mechanism of communication between bacterial cells mediated by autoinducer (AI) signal molecules and depend on density of bacterial cells. AI is a signal molecules that secreted, accumulated, reabsorbed, and recognized by bacteria to regulate the expressions of target genes. QS on Gram-negative bacteria use N-acyl homoserine lactone (AHL) AI types as signal molecules. The high level of AHL in the cell will be responded by activating cell regulatory protein. Regulatory proteins help the expression of pathogens genes.
Xanthomonas oryzae pv. oryzae and Pseudomonas syringae pv. glycinea are phytopatogenic Gram-negative bacteria that perform quorum sensing using N-acyl homoserine lactone (AHL) signal to regulate expression of their patogenicity genes. X. oryzae pv. oryzae causes pustule disease on paddy (Oryzae sativa) and P. syringae pv. glycinea cause leaf blight disease on soybean (Glycine max).
One of natural approaches to inactivate their quorum sensing mechanisms was by degrading the signal molecules using AHL-lactonase from Bacillus cereus INT1c and Bacillus thuringiensis SGT3g. This study was conducted to test the ability of B. cereus INT1c and B. thuringiensis SGT3g AHL lactonase activity in degrading AHL to inhibit X. oryzae pv. oryzae and P. syringae pv. glycinea patogenicity.
AHL degradation activity had been confirmed in B. cereus INT1c and B. thuringiensis SGT3g using Chromobacterium violaceum as bioindicator with inhibition index 0.23 and 0.12, respectively. Inhibition test by using tobacco plants was used to determine which is the most effective to inhibit phytopatogen in vivo. B. cereus INT1c was more effective to inhibit X. oryzae pv. oryzae patogenicity (85.62%) whereas B. thuringiensis SGT3g was more effective to inhibit P. syringae pv. glycinea pathogenicity, it was up to 90.51%. The highest inhibition activity of B. cereus INT1c was showed in IRBB7 varieties (93.69%) and the lowest was in Kencana Bali varieties (65.65%) on the in vivo test on paddy. Whereas in vivo on soybean test showed that B. thuringiensis SGT3g inhibition activity in Anjasmara and Wilis varieties were not much different, it was 96% and 95,35%, respectively.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
1
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
AKTIVITAS AHL-LAKTONASE Bacillus cereus INT1c DAN
Bacillus thuringiensis SGT3g DALAM MENGHAMBAT
PATOGENITAS Xanthomonas oryzae pv. oryzae DAN
Pseudomonas syringae pv. glycinea
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah yang berjudul Aktivitas AHL-Laktonase Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g dalam Menghambat Patogenitas Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycinea berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Iman Rusmana, M.Si sebagai ketua komisi pembimbing dan Dr.Nisa Rachmania Mubarik, M.Si sebagai anggota komisi pembimbing, yang telah banyak memberikan bimbingan, dukungan, saran, nasehat, motivasi dan kesabaran yang tiada henti-hentinya selama konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr. Ir. Abdjad Asih Nawangsih, M.Si dan Prof. Dr. Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Selain itu penulis ucapkan terima kasih kepada seluruh Dosen Program Studi Mikrobiologi yang telah memberikan ilmu dan pengalaman selama studi.
Penulis juga mengucapkan terima kasih kepada Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, Bapak Yadi Suryadi dari BB Biogen Cimanggu yang telah banyak membantu penelitian ini dan Kak Wulan, Anja, Eja, Rahmi, Hari, Dina, Asrianto, Asril, Aar, Gegek, Antri, Pak Adi, Pak Ade serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi dan bantuannya selama penelitian ini. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2012, teman-teman di Wisma Agung 3 serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Ucapan terima kasih tak terhingga penulis ucapkan kepada Kanjeng Mami atas seluruh kasih sayang, dukungan serta doa yang selalu menyertai, Babe atas dukungan dan semangat yang selalu diberikan, Ibuk dan Bapak Murtopo yang senantiasa memberikan dukungan, doa dan kasih sayang, Bapak Slamet Santosa beserta Mami atas dukungan, doa serta kasih sayang yang tiada henti, dek Glinduh atas bantuan serta dukungan serta semangat yang tak ada hentinya, mas Anang atas dukungan, kasih sayang serta kesabaran yang selalu diberikan, mas Yoyok atas doa yang tiada hentinya serta keluarga besar tersayang, atas doa, dukungan, kasih sayang, dan semangat yang diberikan.
Semoga karya ilmiah ini bermanfaat.
5
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Quorum Sensing 3
Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae
pv. glycinea 4
Anti Quorum Sensing 4
AHL-laktonase 5
Varietas Tanaman Tahan Patogen 7
METODE 8
Kerangka Penelitian 8
Waktu dan Tempat Penelitian 8
Bahan Penelitian 9
Purifikasi Isolat Bakteri 9
Konfirmasi Aktivitas Degradasi AHL 9
Kurva Tumbuh 10
Uji Penghambatan Patogenitas Bakteri Fitopatogen 10
Uji In Vivo pada Daun Kedelai 11
Uji In Vivo pada Daun Padi 11
HASIL DAN PEMBAHASAN 12
Hasil 12
Pembahasan 17
SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 25
DAFTAR TABEL
1 Penghambatan produksi violacein C. violaceum oleh B. cereus INT1c
dan B. thuringensis SGT3g 12
2 Kondisi daun tembakau yang tidak diinokulasi (kontrol negatif) dan yang diinokulasi patogen (INT1c, SGT3g, kontrol positif) 1 minggu
setelah inokulasi 13
3 Intensitas nekrotik berdasarkan luas dan warna/ keadaan jaringan pada daun tembakau pada pengamatan 1 minggu setelah inokulasi 14 4 Intensitas nekrotik, persentase gejala nekrotik (PGN), persentase
penghambatan nekrotik (PPN) berdasarkan luas nekrotik serta warna/ keadaan jaringan daun kedelai pada pengamatan 2 minggu setelah
inokulasi 15
5 Intensitas nekrotik, persentase gejala nekrotik (PGN), persentase penghambatan nekrotik (PPN) berdasarkan panjang nekrotik serta warna/ keadaan jaringan daun padi pada pengamatan 2 minggu setelah
inokulasi 17
DAFTAR GAMBAR
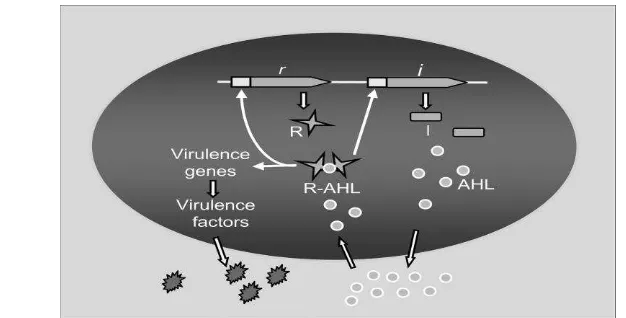
1 Mekanisme QS bakteri Gram negatif 3
2 Senyawa AHL-laktonase pendegradasi AHL 6
3 Diagram alir prosedur penelitian 8
4 Konfirmasi aktivitas degradasi AHL kultur C. violaceum oleh kontrol media LB, isolat B. cereus INT1c, dan isolat B. thuringensis SGT3g 12 5 Kurva pertumbuhan kultur B. cereus INT1c dan B. thuringensis SGT3g
pada media LB 13
6 Persentase luas jaringan nekrotik daun tembakau pada pengamatan 1
minggu setelah inokulasi 14
7 Kondisi daun kedelai varietas Anjasmara dan Wilis pada pengamatan 2 minggu setelah inokulasi P. syringae pv. glycinea 15 8 Kondisi daun padi varietas Kencana Bali, IRBB5, dan IRBB7 pada
pengamatan 2 minggu setelah inokulasi kultur X. oryzae pv. oryzae 16
DAFTAR LAMPIRAN
1 Komposisi media yang digunakan 25
1
PENDAHULUAN
Latar Belakang
Quorum sensing (QS) merupakan mekanisme komunikasi bakteri sebagai suatu pengaturan ekspresi gen yang bergantung pada jumlah populasi bakteri tersebut dan akumulasi senyawa autoinducer (AI). AI merupakan molekul sinyal yang disekresikan, diakumulasi, diserap kembali, dan dikenali oleh bakteri selama proses QS terjadi (Rukayadi dan Hwang 2009). QS pada bakteri Gram negatif menggunakan AI jenis N-acyl homoserin lactone (AHL) untuk mengaktifkan protein regulator. Jika AHL dalam sel tinggi, akan direspon oleh sel dengan mengaktifkan protein regulator. Protein regulator membantu ekspresi gen-gen patogen (Waters dan Bassler 2005).
Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycyne merupakan bakteri Gram negatif patogen pada tanaman. X. oryzae pv. oryzae merupakan bakteri penyebab penyakit hawar pada padi. Gejalanya adalah terdapat bintik-bintik kuning kecoklatan pada penampakan daun (Rukayadi 1998, Zuraidah 2011). Sementara itu, P. syringae pv. glycinea menyebabkan penyakit leaf blight (busuk daun) pada tanaman kedelai. Penyakit leaf blight merupakan penyakit yang menyerang struktur daun tanaman yang ditandai dengan adanya bercak coklat pada daun, bahkan dapat menyebabkan layu atau mati (Findy 2009).
Anti-Quorum sensing (Anti-QS) merupakan salah satu solusi yang ramah lingkungan untuk menghambat patogenitas X. oryzae pv. oryzae dan P. syringae pv. glycinea (Rukayadi dan Hwang 2009). Anti-QS merupakan senyawa atau molekul yang dapat mendegradasi autoinducer pada bakteri, sehingga dapat mencegah terjadinya QS pada bakteri. Prinsip pengendalian patogenitas bakteri Gram negatif dengan dasar QS ialah mencegah akumulasi AHL. Pencegahan akumulasi AHL dilakukan dengan mendegradasi AHL oleh bakteri. Salah satu enzim pendegradasi AHL ialah N-acyl homoserin lactonase (AHL-laktonase). AHL-laktonase mendegradasi ikatan lakton pada molekul AHL. Cincin homoserin lakton tanpa adanya ikatan lakton tidak dapat difungsikan lagi. Mekanisme QS terhambat dan gen-gen patogenetik tidak diekspresikan oleh bakteri patogen (Dong et al. 2002).
Bacillus cereus (Medina-Martinez et al. 2011) dan Bacillus thuringiensis (Cao et al. 2012) merupakan bakteri Gram positif yang dapat menghasilkan senyawa anti-QS berupa AHL-laktonase. Penelitian Lee et al. (2002) mendapatkan hasil adanya aktivitas degradasi AHL oleh B. thuringensis yang disandikan oleh gen aiiA. Dong et al. (2002) juga melaporkan B. thuringiensis dan B. cereus memiliki kemampuan untuk memproduksi laktonase. AHL-laktonase menjadi senyawa yang ampuh untuk melumpuhkan patogenitas bakteri. AHL-laktonase secara spesifik hanya akan mendegradasi cincin lakton pada AHL bakteri Gram negatif (Wang et al. 2004).
B. cereus INT1c dan B. thuringensis SGT3g secara in vivo untuk mencegah patogenitas Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycynea.
Tujuan
Tujuan dari penelitian ini adalah untuk menguji aktivitas AHL-laktonase Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g dalam mendegradasi AHL dan menghambat patogenitas Xanthomonas oryzae pv. oryzae (Xoo) dan Pseudomonas syringae pv. glycynea (Psg).
Manfaat Penelitian
Penelitian ini diharapkan memberi pembuktian ilmiah mengenai potensi bakteri pendegradasi N-acyl homoserine lactones (AHL) sebagai agen biokontrol dalam pengendalian bakteri patogen pada tanaman kedelai dan padi. Aplikasi bakteri pendegradasi AHL diharapkan juga dapat mengurangi dampak penggunaan pestisida maupun senyawa antimikrob yang dapat membuat bakteri bersifat resisten.
Ruang Lingkup Penelitian
3
TINJAUAN PUSTAKA
Quorum Sensing
Quorum sensing (QS) merupakan mekanisme komunikasi bakteri sebagai suatu pengaturan ekspresi gen yang bergantung pada jumlah populasi bakteri tersebut dan akumulasi senyawa autoinducer (AI) (Rukayadi dan Hwang 2009). QS juga disebut sebagai mekanisme komunikasi antara sel satu dengan sel lain yang melibatkan hormon AI. QS terlibat dalam regulasi fungsi biologi yang penting seperti luminescence, produksi antibiotik, transfer plasmid, motilitas, virulensi, pembentukan biofilm dan berperan dalam regulasi ekspresi gen-gen patogen (Dong et al. 2002).
AI merupakan molekul sinyal yang disekresikan, diakumulasi, diserap kembali, dan dikenali oleh bakteri selama proses QS terjadi (Rukayadi dan Hwang 2009). Jika kepadatan populasi bakteri tinggi, konsentrasi AI juga tinggi pada sel. Bakteri dapat mendeteksi akumulasi konsentrasi AI, sehingga dapat meregulasi protein regulator untuk aktif mengekspresikan gen-gen patogenitas. AI berbentuk molekul kecil yang berdifusi bebas melintasi membran sel karena ukurannya yang kecil (Belapurkar et al. 2014).
QS pada bakteri memiliki kesamaan dan perbedaan tergantung pada tipe sinyal, reseptor, sinyal transduksi dan target. Masing-masing sistem QS bakteri memiliki keunikan tensendiri dalam pelaksanaannya. QS pada bakteri Gram negatif menggunakan AI jenis N-acyl homoserin lactone (AHL) untuk mengaktifkan protein regulator. Jika AHL dalam sel tinggi, akan direspon oleh sel dengan mengaktifkan protein regulator. Protein regulator membantu ekspresi gen-gen patogen-gen (Snyder dan Champness 2007). QS pada bakteri Gram negatif melibatkan dua protein regulator yaitu LuxI dan LuxR. LuxI merupakan protein regulator yang bertugas untuk mensintesis AHL dari homocysteine yang merupakan bagian dari S-adenyosyl methionine. LuxR merupakan protein regulator yang bertugas sebagai pengatur proses transkripsi gen-gen patogen. Jika densitas populasi bakteri meningkat, AHL berikatan dengan sisi aktif LuxR hingga konsentrasi yang cukup dalam sitoplasma yang akan menginduksi ekspresi gen-gen patogen. Kompleks LuxR-AHL juga menginduksi ekspresi LuxI dan menyebabkan adanya autoinducing (Belapurkar et al. 2014).
Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycnea
Xanthomonas oryzae pv. oryzae (Xoo) dan Pseudomonas syringae pv. glycyne (Psg) merupakan bakteri Gram negatif. Xoo menyebabkan penyakit pada tanaman padi dan Psg menyebabkan penyakit pada tanaman kedelai. Kedua bakteri ini mengeluarkan molekul sinyal AHL untuk mengadakan komunikasi antar sel. Komunikasi antar sel bakteri memungkinkan ekspresi gen-gen patogen untuk merefleksi sinyal kepadatan populasi yang ditangkap oleh bakteri. Gen-gen patogen diekspresikan dengan memunculkan sifat-sifat patogen yang dapat merugikan inang.
Xoo merupakan bakteri penyebab penyakit hawar pada tanaman padi. Xoo termasuk dalam bakteri Gram negatif. Bakteri ini berbentuk batang dengan koloni berwarna kuning. Xoo memiliki virulensi yang bervariasi tergantung kemampuannya untuk menginfeksi varietas padi yang mempunyai gen resistensi berbeda. Penyakit hawar tidak hanya menyerang pada fase bibit, tetapi juga menyerang tanaman dewasa. Gejala yang ditimbulkan akibat serangan Xoo adalah infeksi sistemik dan nekrosis (Ratna 2000). Yamasaki et al. (2006) menyatakan ada dua tipe gejala, yaitu kresek dan hawar daun. Hawar daun ialah gejala yang timbul pada fase generatif, ditandai dengan munculnya garis pada ujung tepi daun. Garis tersebut semakin memanjang dan melebar, sehingga menyebabkan warna menjadi kuning sampai putih dan dapat menutup ujung daun. Akibatnya, tanaman yang terinfeksi berat akan menghasilkan gabah hampa, sehingga produksi rendah.
Psg menyebabkan penyakit leaf blight (busuk daun) pada tanaman kedelai. Psg masuk ke dalam ruang apoplas interseluler dalam jaringan daun tanaman. Psg mengeluarkan molekul signal AHL untuk mengadakan komunikasi antar sel. Komunikasi antar sel bakteri memungkinkan diekspresikannya gen patogen penyebab penyakit busuk daun. Gejala penyakit busuk daun ditandai bercak-bercak berwarna coklat pada daun. Jika tidak ada pencegahan, akan menimbulkan kebusukan pada daun (Findy 2009).
Patogenitas Xoo dan Psg merugikan petani padi dan kedelai karena menyebabkan terjadinya penurunan produktivitas. Para petani umumnya menggunakan senyawa antimikrob yang dapat menghambat patogenitas kedua bakteri fitopatogen tersebut. Penggunaan jangka panjang antimikrob menyebabkan munculnya bakteri mutan resisten antimikrob (Belapurker et al. 2014). Oleh karena itu, pengurangan penggunaan antimikrob dan pengembangan strategi baru yang efektif untuk mencegah dan mengobati infeksi patogen diperlukan (Ivanova et al. 2013).
Whitehead (2001) memaparkan bahwa patogenitas Xoo dan Psg, selain dapat dikendalikan dengan antimikrob, dapat juga dikendalikan dengan mengontrol QS pada kedua bakteri pathogen tersebut. Rukayadi dan Hwang (2009) menjelaskan anti-QS merupakan solusi yang lebih ramah lingkungan untuk menghambat patogenitas pada Xanthomonas oryzae dan Pseudomonas syringae.
Anti Quorum Sensing
5
dasar QS adalah mencegah akumulasi AHL. Pencegahan akumulasi AHL dilakukan dengan mendegradasi AHL pada bakteri. Anti-QS memiliki kelebihan dalam mengontrol infeksi bakteri, yaitu tidak mempengaruhi pertumbuhan, sehingga dapat menghindari timbulnya tekanan seleksi yang dapat menghasilkan generasi patogen resisten terhadap antibiotik. Beberapa enzim pendegradasi AHL telah diidentifikasi dari beberapa bakteri dan memiliki potensi sebagai anti-QS.
Penelitian Hentzer et al. (2012) meneliti tentang QS pada Pseudomonas aeruginosa. Bakteri Gram negatif ini menggunakan senyawa AHL bernama Oxo-dodecanoyl-homoserine lactone (OdDHL). Hentzer menemukan bahwa OdDHL-antagonis atau OdDHL dapat membentuk senyawa nonantibiotik, agen anti-patogen yang dapat mencegah komunikasi antar bakteri, sehingga dapat menurunkan faktor virulen bakteri.
Adonizio et al. (2006) melakukan penelitian tentang senyawa anti-QS. Senyawa anti-QS dapat diproduksi dari tanaman obat. Sekitar 50 spesies tanaman obat dapat digunakan sebagai anti-QS. Tanaman obat aman untuk mengendalikan faktor virulensi bakteri patogen tanpa harus membuat bakteri patogen mati atau resisten.
Adonizio et al. (2008) juga melakukan penelitian tentang QS pada P. aeruginosa. Adonizio menemukan bahwa Conocarpus erectus, Callistemon viminalis, Bucida buceras menghasilkan senyawa anti-QS yang dapat menghambat faktor virulensi bakteri P. aeruginosa. Ekstrak dari tanaman-tanaman tersebut secara signifikan dapat menghambat produksi LasA protease, LasB elastase, produksi pioverdin, dan pembentukan biofilm pada bakteri P. aeruginosa, sehingga secara signifikan dapat mereduksi ekspresi gen QS, mencegah molekul sinyal untuk komunikasi bakteri, dan mengurangi efek dari faktor virulensi P. aeruginosa. Ekstrak tanaman ini secara jangka panjang dapat digunakan untuk melawan virulensi bakteri P. aeruginosa dan bakteri lainnya yang sesuai.
Manefield et al. (2012) melakukan penelitian tentang senyawa anti-QS pada Delisea pulchra yang dapat menghambat QS pada Vibrio vischeri. Makroalga D. pulchra menghasilkan furanone terhalogenasi yang dapat menghambat furanosil borat diester pada V. vischeria. Furanon terhalogenasi dapat memutuskan ikatan karbon pada cincin furan. Cincin homoserin lakton tanpa adanya ikatan asil tidak dapat melakukan interaksi lagi, sehingga mekanisme QS terhambat dan patogenitas dapat dihambat pula.
Bakteri satu dengan yang lain memiliki mekanisme QS yang berbeda-beda demikian juga dengan senyawa penghambatan (anti-QS). Anti-QS juga merupakan salah satu strategi dari bakteri untuk bertahan hidup pada lingkungan (Anzhou et al. 2013). Senyawa anti-QS pada bakteri Gram negatif ada beberapa macam yaitu AHL-laktonase dan AHL-acylase. Jika senyawa AHL terpotong atau terdegradasi salah satu ikatan asil atau lakton, senyawa AHL tak dapat difungsikan lagi.
AHL-laktonase
interaksi lagi, sehingga mekanisme QS terhambat dan gen-gen patogenik tidak diekspresikan oleh bakteri pathogen (Gambar 2) (Dong et al. 2002).
Gambar 2 Senyawa AHL-laktonase pendegradasi AHL (Belapurkar et al. 2014) Enzim pendegradasi AHL seperti AHL-laktonase merupakan salah satu anti-QS yang berspektrum luas. AHL-laktonase termasuk salah satu jenis metalloprotein yang memiliki ion zinc pada sisi aktifnya. Ion Zn diperlukan sebagai katalisator dari AHL-laktonase. Beberapa spesies Bacillus mensekresi enzim yang disandikan oleh gen aiiA, yang dapat memisahkan ikatan lakton dari acyl homoserin lactones. Enzim ini akan mengakibatkan tidak aktifnya molekul AHL pada sinyal tranduksi. Gugus karbon karbonil pada AHL yang terganggu oleh serangan nukleofilik menjembatani dua ion Zn pada AHL-laktonase untuk berikatan. Cincin lakton dan oksigen karbonil dari AHL berinteraksi dengan ion Zn yang menyebabkan peningkatan polaritas dari ikatan karbonil. Peningkatan polaritas menyebabkan ikatan karbonil lebih rentan terhadap serangan neutrofilik. Serangan neutrofilik menyebabkan terbentuknya muatan negatif yang akan distabilisasi dengan interaksi ion Zn dari AHL-laktonase. Ikatan C=O pada cincin lakton dari AHL putus dan akan menyebabkan terbukanya cincin, sehingga cincin lakton terdegradasi (Belapurkar et al. 2014).
Anzhou et al. (2013) memaparkan bahwa Bacillus, Lysinibacillus, dan Pseudomonas memiliki aktivitas degradasi AHL yang tinggi. Beberapa bakteri Gram positif, seperti Bacillus, menarik untuk dipelajari sebagai agens biokontrol karena spesialisasi dari sifat kompetennya. Homolog enzim laktonase telah berhasil diidentifikasi pada B. cereus and B. thuringiensis, yang memiliki kemampuan untuk mendegradasi AHL.
7
Varietas Tanaman Tahan Patogen
Varietas tahan merupakan salah satu komponen penting sebagai pengendalian fitopatogen secara terpadu karena sangat ekonomis, efektif, dan tidak merusak lingkungan. Keefektivan varietas yang tahan ini dipengaruhi oleh interaksi antara gen pembawa sifat tahan yang dimilikinya dan gen virulensi patogen yang terdapat di suatu wilayah serta kondisi lingkungan (Yamasaki et al. 2006).
Usaha untuk mendapatkan varietas tahan dapat dilakukan melalui seleksi tidak langsung terhadap karakter morfologi tanaman maupun secara biokimia. Kriteria yang dapat digunakan untuk mengelompokkan ketahanan varietas menurut Santosa (2003) ialah (1) mekanisme karakter ketahanan, (2) ada tanaman inang, (3) jumlah gen yang mengatur ketahanan, (4) kemampuan dalam mencegah proses infeksi atau membatasi kolonisasi inang oleh patogen, (5) kemampuan dalam menunda atau menghambat laju epidemik penyakit, (6) kelestarian karakter ketahanan, dan (7) hubungan antara intensitas penyakit dengan penurunan hasil.
METODE
Kerangka Penelitian
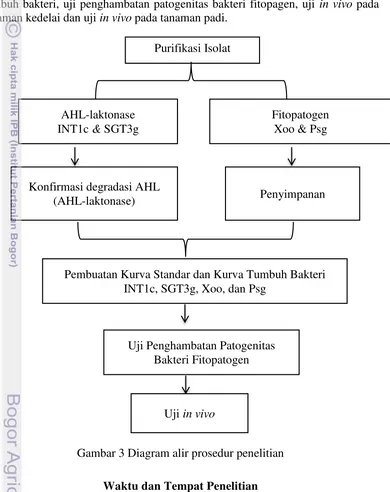
Kerangka penelitian ini (Gambar 3) meliputi purifikasi isolat, konfirmasi degradasi AHL, pembuatan kurva standar pertumbuhan bakteri, pembuatan kurva tumbuh bakteri, uji penghambatan patogenitas bakteri fitopagen, uji in vivo pada tanaman kedelai dan uji in vivo pada tanaman padi.
Gambar 3 Diagram alir prosedur penelitian
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari Oktober 2013 hingga Februari 2015, bertempat di Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB, Rumah Kaca Departemen Biologi FMIPA IPB, dan Rumah Kaca Balai Besar
Purifikasi Isolat
Konfirmasi degradasi AHL (AHL-laktonase)
Fitopatogen Xoo & Psg AHL-laktonase
INT1c & SGT3g
Penyimpanan
Pembuatan Kurva Standar dan Kurva Tumbuh Bakteri INT1c, SGT3g, Xoo, dan Psg
Uji Penghambatan Patogenitas Bakteri Fitopatogen
9
Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian Cimanggu.
Bahan Penelitian
Isolat bakteri yang digunakan dalam penelitian ini terdiri dari Bacillus cereus INT1c, Bacillus thuringiensis SGT3g, Chromobacterium violaceum (isolat koleksi Dr. Ir. Iman Rusmana, M.Si), fitopatogen Xanthomonas oryzae pv. oryzae (isolat koleksi Prof. Dr. Aris Tri Wahyudi, M.Si) dan Pseudomonas syringae pv. glycine (isolat koleksi Dr. Ir. Iman Rusmana, M.Si). Tanaman yang digunakan terdiri dari tanaman tembakau (umur 1.5 bulan), tanaman kedelai (umur 2 minggu), dan tanaman padi (umur 1 bulan). Dua varietas tanaman kedelai digunakan untuk uji in vivo. Varietas anjasmara yang tahan dan varietas Wilis yang rentan terhadap Pseudomonas syringae pv. glyicinea (benih berasal dari BB Biogen Cimanggu). Tiga varietas tanaman padi digunakan untuk uji in vivo. Varietas IRBB7 yang tahan, IRBB5 yang sedang dan Kencana Bali yang rentan terhadap Xanthomanas orizae pv. oryzae (benih berasal dari BB Biogen Cimanggu).
Purifikasi Isolat Bakteri
Kedua isolat Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g serta Chromobacterium violaceum diremajakan pada media agar-agar Luria Berthani agar (LB Agar) dan diperbanyak pada media cair Luria Berthani (LB Broth). Inkubasi kultur B. cereus INT1c dan B. thuringiensis SGT3g dilakukan selama 48 jam, sedangkan inkubasi C. violaceum dilakukan sampai kultur berwarna ungu (24 jam). Peremajaan kultur bakteri fitopatogen Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycinea dilakukan pada media Trypticase Soy Agar (TSA) dan perbanyakan kultur pada media Trypticase Soy Broth (TSB). Inkubasi kultur bakteri patogen dilakukan selama 48-72 jam. Penyimpanan biakan kerja C. violaceum dilakukan pada suhu ruang, sedangkan bakteri yang lainnya disimpan dalam lemari pendingin (Findy 2009).
Konfirmasi Aktivitas Degradasi AHL
IDA = Ø zona tidak ungu - Ø kertas cakram Ø kertas cakram
Keterangan: IDA = Indeks degradasi AHL
Ø zona tidak ungu = diameter zona tidak berwarna ungu (cm) Ø kertas cakram = diameter kertas cakram (cm)
Kurva Tumbuh Bakteri Uji
Biakan induk Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g disiapkan dengan cara menginokulasi satu lup biakan bakteri ke dalam 50 ml media LB (inokulum) lalu diinkubasi hingga kepadatan 108 CFU/ml (berdasarkan kurva standar isolat INT1c dan SGT3g) di atas shaker. Kemudian ke dalam 100 ml LB (media produksi) dimasukkan 1% biakan induk yang telah disiapkan. Inkubasi dilakukan di atas shaker (100 rpm) pada suhu 37ºC. Setiap 2 jam dilakukan pengukuran kekeruhan sel atau optical dencity (OD) pada panjang gelombang 600 nm dua kali ulangan (duplo) hingga terjadi penurunan OD (Kusumaningrum 2012).
Uji Penghambatan Patogenitas Bakteri Fitopatogen
Koloni dari Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g yang menunjukkan aktivitas degradasi AHL umur 48 jam diambil menggunakan ose lalu masing-masing disuspensikan dalam larutan garam fisiologis (NaCl 0.85 %) sampai diperoleh kepadatan 108 CFU/ml (berdasarkan kurva standar isolat INT1c dan SGT3g). Suspensi B. cereus INT1c dan B. thuringiensis SGT3g tersebut masing-masing disemprotkan ke daun tembakau umur 1.5 bulan. Penyemprotan supernatan dilakukan pada sore hari. Setelah disemprot, tanaman disungkup dengan plastik bening yang telah dilubangi untuk sirkulasi udara. Tiga hari kemudian, daun tanaman tembakau yang telah disemprot tersebut diinokulasi dengan 0.5 ml suspensi bakteri fitopatogen lalu disungkup kembali dengan plastik. Inokulasi fitopatogen dilakukan menggunakan syringe tanpa jarum. Setiap perlakuan dibuat 10 titik inokulasi sebagai ulangan dan setiap helai daun dibuat 20 titik inokulasi. Sebagai kontrol negatif, tanaman disemprot suspensi INT1c dan SGT3g, tetapi tidak diinokulasi dengan patogen. Sebagai kontrol positif, tanaman disemprot garam fisiologis lalu diinokulasi bakteri fitopatogen. Luas jaringan nekrotik pada daun diamati seminggu setelah inokulasi patogen (Rukayadi et al. 2000). Persentase gejala nekrosis dan persentase penghambatan nekrosis dihitung dengan menggunakan persamaan:
PGN= luas nekrosis (cm2) x100% luas daun (cm2)
PPN= PGN kontrol positif - PGN perlakuan fitopatogen x100%
PGN kontrol positif
Keterangan: PGN= persentase gejala nekrosis (%)
11
Uji In Vivo pada Daun Kedelai
Supernatan Bacillus thuringiensis SGT3g (108 CFU/ml) disemprotkan ke daun tanaman kedelai umur dua minggu. Penyemprotan supernatan dilakukan pada sore hari ketika sinar matahari tidak terlalu panas pada seluruh permukaan daun. Setelah disemprot, tanaman disungkup dengan plastik bening. Tiga hari kemudian, daun tanaman kedelai diinokulasi dengan 0.5 ml suspensi bakteri Pseudomonas syringae pv. glycinea lalu disungkup kembali dengan plastik. Inokulasi fitopatogen dilakukan menggunakan syringe tanpa jarum. Sebagai kontrol negatif, tanaman disemprot suspensi B. thuringiensis SGT3g, tetapi tidak diinokulasi dengan patogen. Sebagai kontrol positif, tanaman disemprot garam fisiologis lalu diinokulasi bakteri fitopatogen P. syringae pv. glycinea. Setiap perlakuan dibuat 20 kali ulangan. Luas jaringan nekrotik pada daun diamati pada minggu pertama dan kedua setelah inokulasi patogen (Rukayadi et al. 2000). Persentase gejala nekrosis dan persentase penghambatan nekrosis dihitung dengan menggunakan persamaan:
PGN= luas nekrosis (cm2) x100% luas daun (cm2)
PPN= PGN kontrol positif - PGN perlakuan fitopatogen x100%
PGN kontrol positif
Keterangan: PGN= persentase gejala nekrosis (%)
PPN= persentase penghambatan nekrosis (%)
Uji In Vivo pada Daun Padi
Supernatan Bacillus cereus INT1c (108 CFU/ml) disemprotkan ke daun tanaman padi umur satu bulan. Penyemprotan supernatan dilakukan pada sore hari ketika sinar matahari tidak terlalu panas pada seluruh permukaan daun. Setelah disemprot, tanaman disungkup dengan plastik bening. Tiga hari kemudian, daun tanaman kedelai diinokulasi dengan kultur bakteri Xanthomonas oryzae pv. oryzae dengan cara mencelupkan ujung gunting steril ke dalam kultur lalu diguntingkan pada ujung daun padi yang diberi perlakuan kemudian disungkup kembali dengan plastik. Sebagai kontrol negatif, tanaman disemprot suspensi B. cereus INT1c, tetapi tidak diinokulasi dengan patogen. Sebagai kontrol positif, tanaman disemprot garam fisiologis lalu diinokulasi bakteri fitopatogen X. oryzae pv. oryzae. Setiap perlakuan dibuat 20 kali ulangan. Luas jaringan nekrotik pada daun diamati pada minggu pertama dan kedua setelah inokulasi patogen (Zuraidah 2011). Persentase gejala nekrosis dan persentase penghambatan nekrosis dihitung dengan menggunakan persamaan:
PGN= panjang nekrosis (cm) x100% panjang daun (cm)
PPN= PGN kontrol positif - PGN perlakuan fitopatogen x100%
PGN kontrol positif
Keterangan: PGN= persentase gejala nekrosis (%)
HASIL DAN PEMBAHASAN
Hasil
Aktivitas Degradasi AHL
Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g dikonfirmasi memiliki aktivitas degradasi AHL pada Chromobacterium violaceum sebagai bioindikatornya. Aktivitas degradasi AHL ditandai dengan zona tidak berwarna ungu di sekitar kertas cakram pada kultur C. violaceum (Gambar 4). Aktivitas degradasi AHL oleh kedua isolat bakteri tersebut menghasilkan indeks degradasi AHL sebesar 0.23 untuk INT1c dan 0.12 untuk SGT3g (Tabel 1).
Gambar 4 Konfirmasi aktivitas degradasi AHL kultur C. violaceum oleh (a) kontrol negatif media LB, (b) isolat B. cereus INT1c, dan (c) isolat B. thuringiensis SGT3g
Tabel 1 Penghambatan produksi violacein C. violaceum oleh B. cereus INT1c dan B. thuringiensis SGT3g
Kode isolate Diameter zona degradasi AHL
(mm) Indeks degradasi AHL
INT1c 16 0.23
SGT3g 14.5 0.12
Kurva Pertumbuhan Bakteri
13
Gambar 5 Kurva pertumbuhan kultur B. cereus INT1c dan B. thuringiensis SGT3g pada media LB
Aktivitas Penghambatan Patogenitas Bakteri Fitopatogen
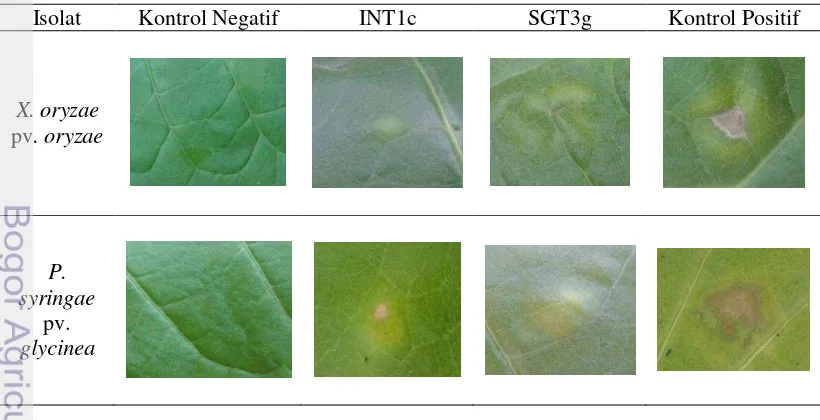
Penghambatan QS fitopatogen pada tanaman tembakau diamati dari warna dan luas jaringan daun yang terkena nekrotik pada titik-titik inokulasi. Hasil pengamatan menunjukkan daun pada tanaman kontrol negatif tidak mengalami gejala nekrotik, sedangkan daun pada tanaman kontrol positif menunjukkan adanya gejala nekrotik. Tanaman yang telah disemprot dengan supernatan B. cereus INT1c dan B. thuringiensis SGT3g menunjukkan intensitas yang lebih ringan dibandingkan kontrol positifnya (Tabel 2).
Tabel 2 Kondisi daun tembakau yang tidak diinokulasi (kontrol negatif) dan yang diinokulasi patogen (INT1c, SGT3g, kontrol positif) 1 minggu setelah inokulasi
Isolat Kontrol Negatif INT1c SGT3g Kontrol Positif
X. oryzae
Luas nekrotik terkecil pada perlakuan penghambatan X. oryzae pv. oryzae ditunjukkan oleh B. cereus INT1c dengan luas sebesar 0.1 cm2 (Tabel 3) dan persentase penghambatan 85.6% serta persentase gejala nekrotik 0.04% (Tabel 4).
Sementara itu, penghambatan P. syringae pv. glycinea terbesar ditunjukkan oleh B. thuringiensis SGT3g dengan luas nekrotik pada daun sebesar 0.1 cm2 dan persentase penghambatan 90.5% serta persentase gejala nekrotik 0.05% (Tabel 3). Berdasarkan hasil, isolat B. cereus INT1c berpotensi untuk diujikan secara in vivo ke tanaman padi untuk menghambat patogenitas X. oryzae pv. oryzae dan isolat B. thuringiensis SGT3g berpotensi untuk diujikan secara in vivo ke tanaman kedelai untuk menghambat P. syringae pv. glycinea.
Tabel 3 Intensitas nekrotik berdasarkan luas dan warna/ keadaan jaringan pada daun tembakau pada pengamatan 1 minggu setelah inokulasi
Perlakuan
PGN=Persentase Gejala Nekrotik, PPN=Persentase Penghambatan Nekrotik
Gambar 6 Persentase luas jaringan nekrotik daun tembakau pada pengamatan 1 minggu setelah inokulasi fitopatogen (Psg) Pseudomonas syringae pv. glycinea dan (Xoo) Xanthomonas oryzae pv. oryzae
15
Penghambatan Patogenitas P. syringae pv. glycinea In Vivo pada Daun Kedelai
Pengujian secara in vivo penghambatan patogenitas P. syringae pv. glycinea oleh B. thuringiensis SGT3g pada tanaman kedelai menunjukkan aktivitas penghambatan yang tidak jauh berbeda (Gambar 7). Persentase penghambatan nekrotik oleh B. thuringiensis SGT3g terhadap P. syringae pv. glycinea sebesar 96% dengan persentase gejala penyakit sebesar 0.1% ditunjukkan pada varietas Anjasmara sedangkan pada varietas Wilis menunjukkan persentase penghambatan nekrotik oleh B. thuringiensis SGT3g terhadap P. syringae pv. glycinea sebesar 95.4% dan dengan persentase gejala penyakit sebesar 0.2% (Tabel 4). Berdasarkan hasil dapat diketahui bahwa penghambatan patogenitas P. syringae pv. glycinea oleh B. thuringiensis SGT3g pada varietas Anjasmara dan Wilis tidak berbeda jauh.
Gambar 7 Kondisi daun kedelai varietas Anjasmara dan Wilis pada pengamatan 2 minggu setelah inokulasi P. syringae pv. glycinea
Tabel 4 Intensitas nekrotik, persentase gejala nekrotik (PGN), persentase penghambatan nekrotik (PPN) berdasarkan luas nekrotik serta warna/ keadaan jaringan daun kedelai pada pengamatan 2 minggu setelah inokulasi
Perlakuan Luas Nekrosis (cm2)
Warna Jaringan
Intensitas Nekrosis
PGN (%)
PPN (%) Anjasmara
Kontrol Positif 0.6 Coklat +++ 3.3 -
SGT3g 0.03 Kekuningan + 0.1 96
Wilis
Kontrol Positif 0.6 Coklat +++ 3.8 -
SGT3g 0.03 Kekuningan + 0.2 95.4
Keterangan : ++++ = berat ++ = ringan +++ = sedang + = sangat ringan
Penghambatan Patogenitas X. oryzae pv. oryzae In Vivo pada Daun Padi
Pengujian secara in vivo penghambatan patogenitas X. oryzae pv. oryzae oleh B. cereus INT1c pada tanaman padi menunjukkan adanya aktivitas penghambatan yang dapat dilihat pada gejala nekrotik tanaman padi kontrol positif lebih panjang daripada tanaman padi dengan perlakuan penyemprotan B. cereus INT1c (Gambar 8). Persentase penghambatan nekrotik terbesar oleh B. cereus INT1c terhadap X. oryzae pv. oryzae ditunjukkan pada varietas IRBB7 sebesar 93.6% dengan persentase gejala penyakit sebesar 1.5 % sedangkan persentase penghambatan nekrotik terkecil ditunjukkan pada varietas Kencana Bali sebesar 69.7% dan dengan persentase gejala penyakit sebesar 17.6% (Tabel 5). Berdasarkan hasil dapat diketahui bahwa penghambatan patogenitas X. oryzae pv. oryzae oleh B. cereus INT1c terbesar adalah pada varietas IRBB7 kemudian IRBB5 dan yang terkecil adalah Kencana Bali.
17
Tabel 5 Intensitas nekrotik, persentase gejala nekrotik (PGN), persentase penghambatan nekrotik (PPN) berdasarkan panjang nekrotik serta warna/ keadaan jaringan daun padi pada pengamatan 2 minggu setelah inokulasi
PGN=Persentase Gejala Nekrotik, PPN=Persentase Penghambatan Nekrotik
Pembahasan
Afiah (2011) melaporkan bahwa Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g terbukti positif memiliki kemampuan untuk mendegradasi AHL. Salah satu bioindikator untuk menyeleksi adanya aktivitas degradasi AHL pada isolat B. cereus INT1c dan B. thuringiensis SGT3g ialah dengan menggunakan Chromobacterium violaceum. C. violaceum merupakan bakteri Gram negatif yang melakukan quorum sensing dengan menggunakan senyawa AHL untuk menghasilkan pigmen berwarna ungu (violacein) (McClean et al. thuringiensis SGT3g dari kertas cakram ke media di sekitarnya menyebabkan degradasi senyawa AHL tersebut, sehingga C. violaceum yang tumbuh di sekitar paper disc tidak dapat berkomunikasi yang menyebabkan pigmen violacein tidak dapat diproduksi. AHL-laktonase secara spesifik menghidrolisis cincin lakton pada molekul AHL (Wang et al. 2004). Enzim ini stabil pada suhu 28-50ºC dan pH 6-9 (Sakr et al. 2013).
memaparkan bahwa B. thuringiensis menunjukkan aktivitas degradasi AHL yg tinggi. Sementara itu, penelitian Medina-Martinez et al. (2011) mendapatkan hasil bahwa B. cereus berkompeten dalam mendegradasi AHL.
Anzhou et al. (2013) memaparkan bahwa produksi AHL-laktonase oleh Bacillus sp. merupakan salah satu bentuk strategi bertahan hidup dalam lingkungan stres karena fluktuasi kondisi fisik dan ketersediaan nutrisi yang terbatas. Bacillus sp. menggunakan aktivitas anti-QS agar mendapatkan lebih banyak nutrisi, melalui penggangguan sinyal AHL sebagai bentuk kompetisi dengan bakteri lain atau degradasi molekul AHL sebagai sumber energi.
Sepanjang pertumbuhan kedua isolat bakteri, nilai log dari jumlah sel kultur isolat bakteri B. cereus INT1c dan B. thuringiensis SGT3g tidak jauh berbeda atau beriringan (Gambar 5). Namun fase lag pada kurva pertumbuhan kedua isolat tidak teramati. Hal ini mengindikasikan bahwa kedua isolat bakteri tersebut mampu beradaptasi dengan cepat. Fase lag merupakan fase adaptasi bakteri yang ditandai dengan tidak ada pertambahan nyata pada populasi sel, namun sel mengalami pertambahan massa dan komposisi kimiawi serta peningkatan aktivitas metabolisme (Dias 2003). Hal ini menunjukkan bahwa tingkat pertumbuhan B. cereus INT1c dan B. thuringensis SGT3g tidak jauh berbeda.
Bakteri Bacillus sp. merupakan bakteri Gram positif yang mampu membentuk endospora pada kondisi lingkungan yang tidak menguntungkan sehingga dapat bertahan hidup. Kemampuan dalam membentuk endospora menjadikan Bacillus sp. banyak digunakan dalam industri secara komersil karena dapat bertahan lama dan beradaptasi dengan formula dan bahan-bahan kimia yang diaplikasikan dalam tanah pertanian (Bai et al. 2003). Bakteri ini tergolong dalam bakteri aerob dan anaerob fakultatif (Holt et al. 1994). Bakteri Bacillus sp. mempunyai kemampuan sebagai biokontrol penyakit tanaman (Zuraidah 2011).
19
Luas nekrotik terkecil pada perlakuan penghambatan X. oryzae pv. oryzae ditunjukkan oleh isolat B. cereus INT1c dengan persentase penghambatan terbesar dan persentase gejala nekrotik terkecil. Sementara itu, pada perlakuan penghambatan P. syringae pv. glycinea, luas nekrotik terkecil ditunjukkan oleh isolat B. thuringiensis SGT3g dengan persentase penghambatan terbesar dan persentase gejala nekrotik terkecil. Hasil ini sejalan dengan penelitian Rukayadi dan Hwang (2009) yang memaparkan bahwa anti quorum sensing dapat menekan patogenitas bakteri patogen seperti X. oryzae dan P. syringae. Hasil pengujian aktivitas penghambatan patogenitas bakteri fitopatogen menunjukkan bahwa isolat B. cereus INT1c berpotensi untuk diujikan secara in vivo ke tanaman padi untuk menghambat patogenitas X. oryzae pv. oryzae dan isolat B. thuringiensis SGT3g berpotensi untuk diujikan secara in vivo ke tanaman kedelai untuk menghambat P. syringae pv. glycinea.
Pseudomonas syringae pv. glycynea merupakan bakteri Gram negatif patogen pada tanaman kedelai. P. syringae pv. glycinea menyebabkan penyakit leaf blight (busuk daun). Penyakit leaf blight merupakan penyakit yang menyerang struktur daun tanaman yang ditandai dengan adanya bercak coklat pada daun, bahkan dapat menyebabkan layu atau mati (Findy 2009). Pengujian aktivitas penghambatan yang dilakukan pada tanaman tembakau menunjukkan bahwa isolat bakteri B. thuringiensis SGT3g kompeten dalam menghambat patogenitas P. syringae pv. glycinea. Pengujian penghambatan patogenitas P. syringae pv. glycinea oleh B. thuringiensis SGT3g dilanjutkan secara in vivo pada tanaman kedelai. Dua varietas tanaman uji kedelai digunakan yaitu Anjasmara dan Wilis. Penggunaan dua varietas tanaman kedelai dimaksudkan untuk mengetahui aktivitas penghambatan patogenitas pada varietas yang rentan dan tahan terhadap penyakit busuk daun yang disebabkan oleh P. syringae pv. glycinea. Pengujian secara in vivo penghambatan patogenitas P. syringae pv. glycinea oleh B. thuringiensis SGT3g pada tanaman kedelai menunjukkan aktivitas penghambatan yang tidak jauh berbeda. Hasil pengujian penghambatan aktivitas fitopatogen pada varietas Anjasmara dan Wilis memiliki persentase penghambatan yang hampir sama yang menunjukkan bahwa isolat B. thuringiensis SGT3g dapat menghambat P. syringae pv. glycinea dengan baik pada kedua varietas. Hasil ini berbeda dengan laporan dari Balitkabi (2008) yang memaparkan bahwa varietas Anjasmara merupakan varietas kedelai yang tahan terhadap penyakit busuk daun dan hawar daun sedangkan varietas Wilis lebih rentan terhadap penyakit tersebut. Hal ini dapat disebabkan oleh suhu ruang simpan (Purwanti 2004), kelembapan dan radiasi sinar ultraviolet (Alexieva et al. 2001) yang dapat mempengaruhi kemampuan bakteri fitopatogen dalam menginfeksi tanaman inang. Herlina dan Silitonga (2011) juga memaparkan bahwa virulensi bakteri patogen dapat dipengaruhi oleh suhu dan kecukupan kelembapan udara di lingkungan sekitar bakteri. Suhu dan kelembapan berpengaruh terhadap kemampuan bakteri dalam menempel dan berpenetrasi masuk ke dalam jaringan tanaman.
gesekan antara daun yang terinfeksi hawar daun dengan daun yang sehat, percikan air hujan, dan aliran irigasi dari satu lahan ke lahan yang lainnya. Bakteri X. oryzae pv. oryzae dapat menginfeksi melalui luka yang diakibatkan oleh serangga, atau pada saat bibit padi akan ditanam biasanya bagian ujung daun digunting (Velusamy et al. 2006). Bakteri ini mampu menginfeksi tanaman padi melalui luka akibat pengguntingan kemudian bergerak dan bermultiplikasi menuju xilem. Akumulasi di dalam jaringan pembuluh menyebabkan terhambatnya pengangkutan air dan unsur hara yang diperlukan oleh tanaman, sehingga tanaman menjadi kering dan mati (Roos dan Hattingh 1987). Lubang-lubang alami pada daun seperti hidatoda juga dapat menjadi jalan masuknya X. oryzae pv. oryzae ke dalam tanaman padi (Mew et al. 1984). Namun, infeksi patogen melalui luka lebih mudah dibandingkan melalui hidatoda (Gnanamanickam et al. 1999).
Pengujian aktivitas penghambatan yang dilakukan pada tanaman tembakau menunjukkan bahwa isolat bakteri B. cereus INT1c kompeten dalam menghambat patogenitas X. oryzae pv. oryzae. Pengujian penghambatan patogenitas X. oryzae pv. oryzae oleh B. cereus INT1c dilanjutkan secara in vivo pada tanaman padi. Tiga varietas tanaman uji padi digunakan yaitu IRBB5, IRBB7, dan Kencana Bali. Penggunaan tiga varietas tanaman padi dimaksudkan untuk mengetahui aktivitas penghambatan patogenitas pada varietas yang rentan, sedang dan tahan terhadap penyakit hawar daun yang disebabkan oleh X. oryzae pv. oryzae. Aktivitas penghambatan ditunjukkan dengan gejala nekrotik tanaman padi kontrol positif lebih panjang daripada tanaman padi dengan perlakuan penyemprotan B. cereus INT1c (Gambar 5). Berdasarkan hasil dapat diketahui bahwa penghambatan patogenitas X. oryzae pv. oryzae oleh B. cereus INT1c terbesar adalah pada varietas IRBB7 kemudian IRBB5 dan yang terkecil adalah Kencana Bali. Dapat dilihat bahwa varietas IRBB7 merupakan varietas paling tahan, IRBB5 merupakan varietas sedang dan Kencana Bali merupakan varietas rentan. Hasil selaras dengan penelitian Tasliah et al. (2013) yang melaporkan bahwa varietas IRBB7 merupakan varietas yang lebih tahan terhadap X. oryzae pv. oryzae dibandingkan IRBB5 sedangkan Kencana Bali merupakan varietas yang paling rentan terhadap X. oryzae pv. oryzae. Herlina dan Silitonga (2011) juga memaparkan bahwa varietas IRBB7 memiliki resistensi yang lebih besar daripada varietas Kencana Bali terhadap penyakit hawar daun, sehingga varietas IRBB7 dimasukkan ke dalam varietas tahan dan varietas Kencana Bali dimasukkan dalam varietas rentan terhadap patogenitas X. oryzae pv. oryzae.
21
menghambat mikrob patogen daripada penggunaan bakterisida yang dapat memunculkan sifat resisten pada patogen(Anzhou et al. 2013).
SIMPULAN DAN SARAN
Simpulan
Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g memiliki aktivitas degradasi AHL sebesar 0.23 dan 0.12. Pada uji penghambatan patogenitas pada tanaman tembakau, B. cereus INT1c dan B. thuringiensis SGT3g menunjukkan aktivitas penghambatan terhadap Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycinea. Pada pengujian in vivo kedelai, B. thuringiensis SGT3g memiliki aktivitas penghamatan yang tidak jauh berbeda terhadap Pseudomonas syringae pv. glycinea pada varietas Anjasmara sebesar 96% dan Wilis sebesar 95.4%. Sedangkan pada pengujian in vivo padi, B. cereus INT1c memiliki aktivitas penghamatan tertinggi terhadap Xanthomonas oryzae pv. oryzae pada varietas IRBB7 sebesar 93.7%, sedangkan untuk varietas IRBB5 sebesar 85.5%, dan Kencana Bali paling kecil sebesar 69.7%.
Saran
Perlu dilakukan pemurnian AHL-laktonase untuk mendapatkan senyawa yang lebih murni, stabilisasi suhu dan pH, serta dilakukan uji in vivo secara sekala lapang dengan penyemprotan yang berkala untuk mengetahui pengaruh AHL-laktonase pada pertumbuhan serta produktivitas tanaman padi dan tanaman kedelai hingga pasca panen.
DAFTAR PUSTAKA
Adonizio AL, Downum K, Bennett BC, Mathree K. 2006. Anti-Quorum Sensing Activity of Medicinal Plants in Southern Florida. J Ethnopharmacol. 105(3): 427–435.
Adonizio A, Kong KF, Matheel K. 2008. Inhibition of Quorum Sensing-Controlled Virulence Factor Production in Pseudomonas aeruginosa by South Florida Plant Extracts. J Antimicrob Agents Chem. 52(6): 198–203. Afiah TSN. 2011. Isolasi dan karakterisasi bakteri penghasil acyl-homoserin lactonase (AHL-laktonase) asal lahan pertanian di Jawa [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Alexieva V, Sergiev I, Mapelli S, Karanov E. 2001. The effect of drought and ultraviolet radiation on growth and stress markers in pea and wheat. Plant, Cell and Environ. 24(12): 1337-1344.
Anzhou M, Di L, Xuliang Z, Guoqiang Z. 2013. Quorum quenching in culturable phyllosphere bacteria from tobacco. Int J Mol Sci. 14:14607-14619. Bai Y, Zhou X, Smith DL. 2003. Enhanced soybean plant growth resulting from
co inoculation of Bacillus strains with Bradyrhizobium japonicum. Crop Sci. 43: 1774-1781.
Balitkabi. 2008. Deskripsi Varietas Unggul Kacang-kacangan dan Umbi-umbian. Malang (ID): Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian.
Belapurker R, Tale VS, Madkaikar R. 2014. Exploiting quorum sensing to inhibit the bacterial pathogens. Int J Curr Microbiol Appl Sci. 3(8): 453-458. Cao Y, He S, Zhou Z, Zhang M, Mao W, Zhang H, Yao B. 2012. Orally
adminitered thermostable N-acyl homoserine lactonase from Bacillus sp. Strain AI96 attenuates Aeromonas hydrophila infection in Zebrafish. Appl Environ Microbiol. 78(6): 1899-1908.
Dias LP. 2003. Karakteristik morfologi dan kurva pertumbuhan Bacillus brevis dan Bacillus apiarus [skripsi]. Bogor (ID): Institut Pertanian Bogor. Dong YH, Gusti AR, Zhang Q, Xu Jl, Zhang LH. 2002. Identification of
quorum-quencing N-acyl homoserine lactones from Bacillus Species. Appl Environ Microbiol. 68(4): 1754-1759.
Findy K. 2009. Aktivitas penghambatan Bacillus sp. terhadap Xanthomonas oryzae, Pseudomonas syringae pv. glycine, dan Pseudomonas fluorescens [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Gnanamanickam SS, Priyadarisini VB, Narayanan NN, Vasudevan P, Kavitha S. 1999. An overview of bacterial blight disease of rice and strategies for its management. Curr Sci. 77(11): 1435-1443.
Goto M. 1998. Kresek and pale yellow leaf systemic symptoms of bacterial leaf blight of rice caused by Xanthomonas oryzae. PI Dis Rep. 48: 858-861. Hentzer M, Riedel K, Rasmussen TB, Heydorn A, Andersen JB, Parsek MR, Rice
SA, Eberl L, Molin S, Høiby N, Kjelleberg S, Givskov M. 2012. Inhibition of quorum sensing in Pseudomonas aeruginosa biofilm bacteria by a halogenated furanone compound. J Microbiol. 148: 87–102 Herlina L, Silitonga TS. 2011. Seleksi lapang ketahanan beberapa varietas padi
terhadap infeksi hawar daun bakteri strain IV dan VIII. Bul Plasma Nutfah. 17(2): 80-87.
Holt JG, Kreig NR, Sneath PHA, Staley JT, Williams ST. 1994. Bergey’s Manual of Determinative Bacteriology. Ed ke-9. Baltimore (MD): Williams & Wilkins.
Ivanova N, Sorokin A, Anderson I, Galleron N, Candelon B, Kapatral V, Bhattacharyya A, Reznik G, Mikhailova N, Lapidus A et al. 2003. Genome sequence of Bacillus cereus and comparative analysis with Bacillus anthracis. Nature. 423:87-91.
23
Manefield M., Rasmussen TB, Henzter M, Andersen JB, Steinberg P, Kjelleberg S, Givskov M. 2012. Halogenated furanones inhibit quorum sensing through accelerated LuxR turnover. J Microbiol. 148(6): 1119-1127. Mew TW, Mew C, Huang JS. 1984. Scanning electron microscopy of virulent and
avirulent strains of Xanthomonas campestris pv. oryzae on rice leaves. J Phytopathol. 74: 635-641.
Lee SJ, Yang PS, Ju LK, Young YD, Tag KB, Kee LJ. 2002. Genes encoding the N-acyl homoserine lactone-degrading enzyme are widespread in many subspecies of Bacillus thuringensis. Appl Environ Microbiol. 68(8): 3919-3924.
McClean KH, Winson MK, Fish L, TaylorA, Chhabra SR, Camara M, DaykinM, Lamb JH, Swift S, Bycroft BW, Stewart GSAB, Williams P.. 1997. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones. Microbiology. 143:3703-3711.
Medina-Martinez MS, Ulyttendaele M, Rajkovic A, Nadal P, Debevere J. 2011. Degradation of N-acyl homoserine lactones by Bacillus cereus in culture Media and pork extract. Appl Environ Microbiol. 73(7): 2329-2332. Purwanti S. 2004. Kajian suhu ruang simpan terhadap kuallitas benih kedelai
hitam dan kedelai kuning. J Ilmu Pertan. 1(11): 22-31.
Ratna AR. 2000. Kelompok bakteri Xanthomonas campestris pv. oryzae berdasarkan patogenitasnya pada varietas padi. J Penel Pertan Tan Pangan. 6:74-76.
Roos IMM, Hattingh MJ. 1987. Systemic invasion of plum leaves and shoots by P. syringae pv. syringae introduced into petioles. J Phytopathol. 77: 1253-1257.
Rukayadi Y. 1998. Konstruksi peta genetik parsial dan karakterisasi sintasan epifitik mutan non-patogenik dari Xanthomonas campestris pv. glycine YR32 [tesis]. Bogor (ID): Institut Pertanian Bogor.
Rukayadi Y, Hwang JK. 2009. Pencegahan quorum sensing: Suatu pendekatan baru dalam mengatasi infeksi bakteri. J Medicin. 22(5): 22-27.
Rukayadi Y, Suwanto A, Tjahjono IB, Harling. 2000. Survival and epiphytic of a nonpathogenic mutant of Xanthomonas campetris pv. glicine. Appl Environ Microbiol. 66(3): 1183-1189.
Sakr MM, Aboshanab KMA, Aboulwafa MM, Hassouna NAH. 2013. Characterization and complete sequence of lactonase enzyme from Bacillus weihenstephanensis isolat P65 with potential activity againt acyl homoserine lactone signal molecules. Biomed Res Int. 2013: 1-10.
Santosa B. 2003. Penyaringan galur kedelai terhadap penyakit karat daun isolat Arjasari di rumah kaca. Bul Plasma Nutfah. 9(1): 26-32
Snyder L, Champness W. 2007. Molecular Genetic of Bacteria. Ed ke-3. Washington DC (US): ASM Press.
Velusamy P, Immanuel JE, Gnanamanickam SS, Thomashow L. 2006. Biological control of bacterial blight by plant associated bacteria producing 2,4-diacetylphloroglucinol. Can J Microbiol. 52: 56-65.
Wang LH, Weng LX, Dong YH, Zhang LH. 2004. Specificity and enzyme kinetics of the quorum-quencing N-acyl homoserine lactone Lactonase (AHL-laktonase). J Biochem. 279(14): 13645-13651.
Waters CM, Bassler BL. 2005. Quorum sensing: cell-to-cell communication in bacteria. Annu Rev Cell Dev Biol. 21(1): 319-346.
Whitehead NA, Barnard AML, Slater H, Simpson NJL, Salmond GPC. 2001. Quorum-sensing in gram-negatif Bacteria. FEMS Microbiol Rev. 25(3): 365-404.
Widyawati A. 2008. Bacillus sp. asal rhizosfer kedelai yang berpotensi sebagai pemacu pertumbuhan tanaman dan biokontrol fungi patogen akar [tesis]. Bogor (ID): Institut Pertanian Bogor.
Zhu W, Magbanua MM, White FF. 2000. Identification of two novel hrpassociated genes in the hrp gene cluster of Xanthomonas oryzae pv. oryzae. J Bacteriol. 182(7): 1844-1853.
Yamasaki RAD, Murata N, Suwa T. 2006. Studies on the culture of Xanthomonas oryzae. J Bacteriol 42:946-949.
25
LAMPIRAN
Lampiran 1 Komposisi media yang digunakan A. Media Luria Berthani Agar (LB Agar)
- 1 g Trypton - 1 g NaCl
- 0.5 g yeast axtract - 0.1 g CaCO3 - 1.5 g agar-agar - 100 ml akuades
B. Media Luria Berthani Agar (LB Agar) semi padat - 1 g Trypton
- 1 g NaCl
- 0.5 g yeast extract - 0.1 g CaCO3 - 1 g agar-agar - 100 ml akuades
C. Media Luria Berthani Broth (LB Broth) - 1 g Trypton
- 1 g NaCl
- 0.5 g yeast extract - 100 ml akuades
D. Media Trypticase Soy Broth (TSB) - 3 g trypticase soy broth
- 100 ml akuades
E. Media Trypticase Soy Agar (TSA) - 3 g trypticase soy broth
1
RIWAYAT HIDUP
Penulis dilahirkan di Boyolali pada tanggal 17 Mei 1990 sebagai anak pertama dari dua bersaudara dari pasangan ayah Bardi dan ibu Marti. Pendidikan sarjana (S1) ditempuh di Program Studi Pendidikan Biologi, Fakultas Keguruan dan Ilmu Pendidikan Universitas Sebelas Maret, lulus pada tahun 2012. Pada tahun 2012, penulis diterima di Program Studi Mikrobiologi (MIK) pada Program Pascasarjana IPB.
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains (MSi), penulis melakukan penelitian dengan judul “Aktivitas AHL-Laktonase Bacillus cereus INT1c dan Bacillus thuringiensis SGT3g dalam Menghambat Patogenitas Xanthomonas oryzae pv. oryzae dan Pseudomonas syringae pv. glycinea” Penelitian ini dibimbing oleh Dr Ir Iman Rusmana, MSi dan Dr Nisa Rachmania Mubarik, MSi. Artikel penelitian ini telah diajukan ke Emirates Journal of Food and Agriculture dengan judul “Activity of Bacillus cereus INT1c and Bacillus thuringiensis SGT3g AHL-Lactonase againsts phytopatogen bacteria”.