EKSPLORASI BAKTERI LISIS SEBAGAI AGENS
PENGENDALIAN HAYATI PENYAKIT AKAR PUTIH
(
Rigidoporus lignosus
(KLOZTCH) IMAZEKI)
PADA
TANAMAN KARET
IYUN
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Eksplorasi Bakteri Lisis sebagai Agens Pengendalian Hayati Penyakit Akar Putih (Rigidoporus lignosus (Kloztch) Imazeki) pada Tanaman Karet adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Iyun
ABSTRAK
IYUN. Eksplorasi Bakteri Lisis sebagai Agens Pengendalian Hayati Penyakit Akar Putih (Rigidoporus lignosus (Kloztch) Imazeki) pada Tanaman Karet. Dibimbing oleh WIDODO.
Karet (Hevea brasiliensis) merupakan salah satu komoditas ekspor penting asal Indonesia. Salah satu penyebab turunnya produksi karet adalah penyakit akar putih yang disebabkan oleh cendawan Rigidoporus lignosus. Penelitian ini bertujuan untuk eksplorasi dan seleksi bakteri lisis dari rizosfer tanaman karet yang berpotensi sebagai agens pengendali hayati penyakit akar putih (R. lignosus). Penelitian ini dilakukan di Laboratorium WiSH, Dramaga, Bogor dan Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB pada Desember 2014 sampai Maret 2015. Bakteri yang diperoleh adalah 251 isolat terdiri atas 118 isolat selulolitik, 68 isolat selulolitik dan kitinolitik, dan 65 isolat non selulolitik dan non kitinolitik. Isolat bakteri lisis yang bersifat non patogenik berjumlah 147 berdasarkan reaksi hipersensitif pada tanaman tembakau. Isolat non patogenik yang mampu menghambat R. lignosus secara in vitro
sebanyak 30. Berdasarkan total skor indeks lisis, zona hambat, dan hambatan pertumbuhan radial, 13 isolat potensial sebagai agens pengendalian hayati R. lignosus.
ABSTRACT
IYUN. Lysis Bacterial Exploration for Biological Control Agens of White Root Disease (Rigidoporus Lignosus (Kloztch) Imazeki) on Rubber Plant. Supervised by WIDODO.
The hevea rubber (Hevea brasiliensis) is one of the important commodity in Indonesia for export purposes. One of the obstacles to be limiting in the production of hevea rubber is white root fungus disease caused by Rigidoporus lignosus. The purpose of this study was to explore and select a lysis bacteria from hevea rubber rhizosphere which have the potential as biological control agent of the disease. This research had been conducted in laboratory Wish, Dramaga, Bogor and laboratory Mycology, Departement of plant protection, faculty of agriculture, IPB on December 2014 until March 2015. Of the 251 isolates obtained in this study, 118 isolates on has the ability as cellulolytic, 68 isolates are cellulolytic and chitinolytic, and 65 isolates did have both of these properties. Out of the isolates that have lysis properties, 147 (79%) were not pathogenic based on the hypersensitivity test in tobacco plants. Among of those non-pathogenic isolates, 30 isolates could inhibit the radial growth R. lignosus in vitro testing. Based one the score of lysis index, inhibition zone, and growth inhibition, 13 isolates might be potential as biological control agents of R. lignosus.
©
Hak Cipta milik IPB, tahun 2015 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
EKSPLORASI BAKTERI LISIS SEBAGAI AGENS
PENGANDALIAN HAYATI PENYAKIT AKAR PUTIH
(
Rigidoporus lignosus
(KLOZTCH) IMAZEKI) PADA
TANAMAN KARET
IYUN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PRAKATA
Alhamdulillah puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan segala rahmat dan karunia-Nya sehingga penulis mampu menyelesaikan tugas akhir yang berjudul “Eksplorasi Bakteri Lisis sebagai Agens Pengendalian Hayati Penyakit Akar Putih (Rigidoporus lignosus (Kloztch) Imazeki) pada Tanaman Karet”. Penulisan tugas akhir penelitian ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Terima kasih penulis sampaikan kepada Dr. Ir. Widodo, M.S. selaku dosen pembimbing skripsi yang selalu memberikan bimbingan, pengetahuan, saran, arahan, dan masukan kepada penulis. Terima kasih kepada Prof. Dr. Ir. Aunu Rauf, M.Sc. selaku dosen penguji yang telah memberikan kritik dan saran untuk menyempurnakan penulisan tugas akhir ini. Terima kasih kepada Dr. Ir. Hermanu Triwidodo, M.Sc. yang telah memberi saran, semangat dan dukungan dalam pelaksanaan tugas akhir ini. Terima kasih kepada orang tua dan kakak yang selalu mendoakan dan memberikan semangat dalam belajar. Ucapan terima kasih juga ditujukan kepada teman-teman, khususnya rekan-rekan WiSH (Pak Din-din, Pak Adi tox’s, Asep, Mbak Saksak, Bu Diana, Kak Ali Wafa, Bang Rudi, Mas Wildan, Mba Dila, Listihani, Phor Bho Ayuwati, Siti Rizka Sagala), Mulvia Juniasari (IKK 48), Rudi Andul Gani (AGH 48), Riosena Eka Nursidiq (THP 48), Nurlailatul Yuktiani (INTP 48) dan teman-teman Proteksi Tanaman 48 (PTN sejati) yang tidak bisa disebutkan satu per satu serta pihak lain yang mendukung terlaksananya tugas akhir penulis.
Penulis menyadari masih banyak kekurangan dalam penulisan tugas akhir ini. Oleh karena itu, kritik dan saran yang bersifat membangun sangat diharapkan. Semoga karya tulis ini dapat bermanfaat bagi penulis maupun pembaca.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL Viii
DAFTAR GAMBAR Viii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
BAHAN DAN METODE 3
Tempat dan Waktu 3
Alat dan Bahan 3
Metode Penelitian 3
Isolasi Bakteri Lisis 3
Uji Hipersensitif Isolat Bakteri Lisis 4
Uji Indeks Lisis 4
Uji Antagonis Isolat Lisis terhadap R. lignosus 5
Analisis Data 6
HASIL DAN PEMBAHASAN 7
Penapisan Isolat Bakteri berdasarkan Sifat Kitinolitik dan Selulolitik 7
Uji Hipersensitif Isolat Bakteri Lisis 8
Indeks Lisis 9
Uji Antagonis Isolat Bakteri Lisis berdasarkan Zona Hambat 10 Hubungan antara Indeks Lisis dengan Zona Hambat 11
Isolat Bakteri Lisis Potensial 13
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR TABEL
1 Uji sifat kitinolitik dan selulolitik isolat bakteri hasil isolasi 7
2 Uji hipersensitif isolat bakteri lisis 9
3 Uji indeks lisis 9
4 Uji antagonis isolat bakteri lisis berdasarkan zona hambat 10 5 Uji chi square antara indeks lisis dengan zona hambat 11 6 Seleksi isolat bakteri lisis potensial sebagai agens pengendalian hayati 14
R. lignosus
DAFTAR GAMBAR
DAFTAR LAMPIRAN
1 Uji sifat kitinolitik isolat bakteri hasil isolasi di media agar kitin 4 2 Uji sifat selulolitik isolat bakteri hasil isolasi di media agar CMC 4 3 Uji indeks kitinolitik (a) dan indeks selulolitik (b) 5 4 Uji antagonis isolat bakteri lisis terhadap R. lignosus berdasarkan zona 6
hambat
5 Uji hipersensitif isolat bakteri lisis pada daun tembakau 8 7 Mikroskopis R. lignosus tanpa perlakuan isolat bakteri lisis (kontrol) 12
perbesaran 400 kali
8 Mikroskopis R. lignosus dengan perlakuan isolat bakteri lisis pada 12 perbesaran 400 kali
1 Uji sifat kitinolitik dan selulolitik isolat bakteri hasil isolasi 21
2 Uji hipersensitif isolat bakteri lisis 24
3 Uji indeks lisis dan uji antagonis isolat bakteri lisis 26 4 Uji khi kuadrat indeks selulolitik terhadap zona hambat di media PDA 37 5 Uji khi kuadrat indeks selulolitik terhadap zona hambat di media 37
Campuran
6 Uji khi kuadratindeks kitinolitik terhadap zona hambat di media PDA 38 7 Uji khi kuadrat indeks kitinolitik terhadap zona hambat di media 38
Campuran
PENDAHULUAN
Latar Belakang
Karet (Hevea brasiliensis) merupakan salah satu tanaman perkebunan yang mempunyai peran penting sebagai komoditas ekspor. Berdasarkan data Badan Pusat Statistik (2013), ekspor karet dalam bentuk remah tahun 2008 sampai 2013 cenderung berfluktuasi. Pada tahun 2009 dan 2012 ekspor karet menurun dibandingkan tahun sebelumnya. Penurunan tersebut sebesar 11.58% dan 3.93% dengan nilai ekspor 2 544.8 dan 3 685.7 juta US$. Penurunan tersebut salah satunya disebabkan oleh penurunan produksi yang dipengaruhi luas lahan dan kendala lain dalam pengelolaan perkebunan.
Kendala dalam pengelolaan perkebunaan karet terutama masalah penyakit. Penyakit yang umum ditemukan pada perkebunan karet di antaranya penyakit akar putih, penyakit akar merah, penyakit akar cokelat, penyakit akar hitam, kanker bercak, jamur upas, dan penyakit daun Colletotrichum sp. (Semangun 2000). Penyakit akar putih yang disebabkan oleh Rigidoporus lignosus merupakan penyakit utama. Patogen tersebut menginfeksi akar tanaman mulai dari persemaian, tanaman belum menghasilkan, tanaman menghasilkan sampai tanaman tua. Kehilangan hasil akibat penyakit tersebut mencapai 3% sampai 5% pada perkebunan besar dan 5% sampai 15% pada perkebunan rakyat (Balitri 2014).
Pengendalian yang perlu dilakukan untuk menekan kehilangan hasil akibat penyakit akar putih tidak hanya efektif tetapi juga ramah lingkungan, salah satunya dengan pengendalian hayati. Pengendalian hayati dilakukan melalui mekanisme pengendalian dengan melemahkan atau membunuh patogen tanaman secara langsung, kemampuan kompetisi ruang dan nutrisi, memproduksi antibiotik, memproduksi enzim untuk melawan komponen sel patogen, dan menginduksi respon ketahanan inang (Agrios 2005).
Pengendalian hayati melalui mekanisme produksi enzim yang melisis dinding sel patogen dan bahan organik sumber nutrisi patogen dapat dilakukan untuk pengendalian penyakit akar putih (R. lignosus). R. lignosus yang dinding selnya tersusun atas kitin dapat dilisis oleh bakteri kitinolitik. Bahan organik sebagai sumber nutrisi bagi R. Lignosus yang bersifat parasit fakultatif bisa dilisis oleh bakteri selulolitik. Bakteri kitinolitik didasarkan pada kemampuan menghasilkan enzim kitinase (Nildayanti 2011). Bakteri selulolitik didasarkan pada kemampuan menghasilkan enzim selulase (Meryandini et al. 2009). Bakteri yang dilaporkan memiliki aktivitas kitinase di antaranya Pseudomonas fluorescens dan Bacillus spp. (Giyanto et al. 2009). Bakteri yang dilaporkan memiliki aktivitas selulase di antaranya Cellulomonas sp., Cellvibrio sp.,
Cytophaga sp., dan Micrococcus sp. (Ekawati et al. 2012).
2
akan berhadapan selama menyebar dan menginfeksi akar. Mikroba antagonis ini sangat potensial dikembangkan sebagai agens pengendali hayati (Weller 1988). Oleh karena itu, eksplorasi bakteri lisis dilakukan pada rizosfer tanaman karet.
Tujuan Penelitian
Penelitian ini bertujuan mengeksplorasi dan menyeleksi bakteri lisis dari rizosfer tanaman karet yang berpotensi sebagai agens pengendali hayati penyakit akar putih (R. lignosus).
Manfaat Penelitian
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium WiSH, Dramaga, Bogor dan Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Sampel tanah diambil dari perkebunan karet berumur 28 tahun. Perkebunan tersebut merupakan milik Balai Penelitian Bioteknologi Perkebunan Indonesia yang terletak di Desa Ciaruteun Ilir, Kecamatan Cibungbulang, Bogor, Jawa Barat. Penelitian dilaksanakan pada Desember 2014 sampai Maret 2015.
Alat dan Bahan
Alat yang digunakan antara lain bor, sekop, pisau, plastik, rotary shaker,
vortex mixer, alat gelas (cawan petri, tabung reaksi, dan labu erlenmeyer), autoklaf, kompor, pembakar bunsen, panci, timbangan, laminar flow, sudip, micro pipet, eppendorf, jarum inokulasi, alat suntik, microwave, oven, penggaris, alat tulis, dan kamera. Bahan yang digunakan pada penelitian antara lain media agar kitin, agar carboxy methyl cellulose (CMC), tryptone soya agar (TSA), potato dextrose agar (PDA), nutrient agar (NA), media campuran (PDA dan NA dengan perbandingan 1:1 v/v), luria broth (LB), gliserol 40%, tembakau, alkohol 70%, spirtus, air aquades, aluminium foil, sil, tisue, kapas, dan isolat R. lignosus koleksi Laboratorium Klinik Tanaman, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB.
Metode Penelitian
Isolasi Bakteri Lisis
Sampel tanah diambil dari rizosfer pada 5 tanaman karet dengan menggunakan bor tanah (diameter 5 cm) pada kedalaman 10 cm sampai 20 cm. Pengeboran dilakukan 3 titik pada setiap tanaman. Sampel tanah yang diperoleh kemudian dikompositkan. Tanah hasil komposit tersebut ditimbang sebanyak 10 g untuk dilakukan metode pengenceran. Metode tersebut dilakukan dengan cara, tanah yang telah ditimbang dimasukkan ke dalam labu erlenmeyer yang berisi 90 ml air aquades. Selanjutnya dihomogenkan menggunkan alat rotary shaker selama 2 jam dengan kecepatan 100 rpm. Suspensi tanah diencerkan secara seri dengan cara mencampurkan 1 ml suspensi dengan 9 ml air aquades sampai pengenceran tingkat 10-7. Suspensi diambil 0.1 ml pada pengenceran 10-5, 10-6, dan 10-7 untuk
digunakan sebagai indikator degradasi selulosa pada media CMC untuk penapisan bakteri selulolitik (Gupta et al. 2012).
4
kitinolitik dan di media agar CMC merupakan bakteri selulolitik. Isolat bakteri yang diperoleh ditumbuhkan di media TSA untuk dimurnikan hingga diperoleh isolat tunggal. Isolat tersebut disimpan di media LB berdasarkan metode Kuklinsky-Sobra et al. (2004). Isolat disimpan di dalam eppendorf 1 ml berisi media LB yang ditambah 40% gliserol (v/v) dengan perbandingan 1:1 (v/v). Setelah itu, isolat disimpan pada suhu -20 oC. Semua isolat bakteri yang telah diisolasi diuji kembali di media agar kitin dan agar CMC untuk mengetahui isolat yang bersifat non kitinolitik dan non selulolitik, kitinolitik, selulolitik, serta kitinolitik dan selulolitik. Uji sifat kitinolitik ditunjukkan oleh gambar 1 sedangkan sifat selulolitik ditunjukkan oleh gambar 2. Pengujian tersebut dilakukan dengan cara, isolat diteteskan pada kertas saring di atas media selektif. Satu petri digunakan untuk menguji 10 sampai 12 isolat. Setiap isolat yang di uji diberi kode supaya tidak tertukar kemudian diamati pada 4 HSI. Isolat yang dipilih untuk penapisan berikutnya adalah isolat yang memiliki sifat lisis.
Uji Hipersensitif Isolat Bakteri Lisis
Isolat bakteri lisis yang disimpan di media lauria broth (LB) diambil sebanyak 0.1 ml kemudian dimasukkan pada 0.9 ml media LB. Setelah itu, dihomogenkan pada kecepatan 100 rpm selama 24 jam. Suspensi bakteri tersebut disuntikkan tanpa menggunakan jarum pada bagian lamina bawah daun tembakau. Pengujian setiap isolat bakteri dilakukan 2 kali ulangan. Media LB disuntikkan sebagai kontrol negatif. Pengamatan dilakukan 2 HSI. Bakteri patogenik akan menunjukkan gejala nekrotik pada daun tembakau sedangkan bakteri non patogenik tidak menunjukkan gejala nekrotik (Kusumadewi 2011).
Uji Indeks Lisis
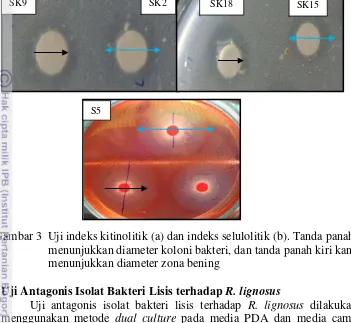
Isolat bakteri lisis diukur indeks lisisnya (Gambar 3). Indeks lisis merupakan perbandingan antara diameter zona bening dengan diameter koloni (Muharni dan Widjajanti 2011; Gupta et al. 2012 ). Pengujian indeks kitinolitik dilakukan dengan menumbuhkan isolat bakteri kitinolitik di media agar kitin (Gambar 3.a) sedangkan pengujian indeks selulolitik dilakukan dengan menumbuhkan isolat bakteri selulolitik pada media agar CMC (Gambar 3.b). Isolat yang tumbuh diukur diameter zona bening dan diameter koloni pada 4 HSI. Indeks lisis yang peroleh kemudian diberi skor dengan rentang nilai berdasarkan
Gambar 1 Uji sifat kitinolitik isolat bakteri hasil isolasi di media agar kitin
5
nilai indeks tertinggi. Skor 0 (tidak ada indeks lisis), 1 (0<x≤1), 2 (1<x≤2), 3 (2<x≤3), dan 4 (3<x≤4).
Gambar 3 Uji indeks kitinolitik (a) dan indeks selulolitik (b). Tanda panah menunjukkan diameter koloni bakteri, dan tanda panah kiri kanan menunjukkan diameter zona bening
Uji Antagonis Isolat Bakteri Lisis terhadap R. lignosus
Uji antagonis isolat bakteri lisis terhadap R. lignosus dilakukan dengan menggunakan metode dual culture pada media PDA dan media campuran. R. lignosus yang berumur 4 sampai 6 hari dengan diameter 7 mm diinokulasikan di tengah cawan petri berdiameter 90 mm dan empat isolat bakteri lisis digoreskan di sekitarnya dengan jarak 30 mm (Chernin et al. 1995). Uji antagonis ini ditunjukkan oleh gambar 4. Zona hambat disekitar koloni diukur pada 4 HSI kemudian diberi skor berdasarkan Zivkovic et al. (2010). Skor 0 (tidak ada zona hambat), 1 (0 mm<x≤5 mm), 2 (5 mm<x≤10 mm), 3 (10 mm<x≤15 mm), dan 4 (15 mm<x≤20 mm).
Gambar 4 Uji antagonis isolat bakteri lisis terhadap R. lignosus berdasarkan zona hambat. R adalah cendawan R. Lignosus. a, b, c, dan d adalah empat isolat bakteri lisis yang berbeda.
a
b
c d
R
SK9 9
SK2 3
SK18 SK23
SK15 9
6
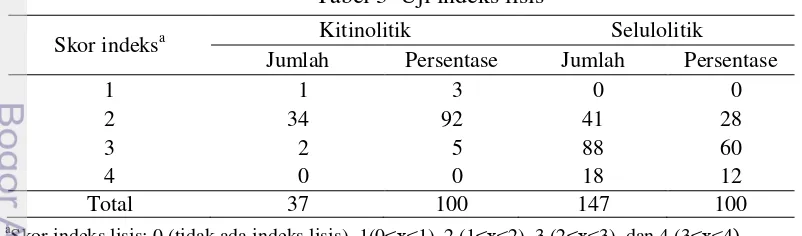
Isolat bakteri lisis yang mempunyai kemampuan membentuk zona hambat terhadap R. lignosus selanjutnya diuji persentase penghambatan pertumbuhan radialnya berdasarkan Kusumowardani (2008). Koloni R. lignosus yang berdiameter 7 mm diinokulasikan di tengah cawan petri berdiameter 90 mm dan satu isolat bakteri lisis digoreskan di sekitarnya dengan jarak 30 mm. Setiap isolat diuji dengan 3 kali ulangan. Uji antagonis ini ditunjukkan oleh gambar 5. Pengamatan dilakukan dengan mengukur jari-jari miselium R. lignosus yang menjauhi dan mendekati isolat bakteri lisis pada 4 HSI untuk mengetahui penghambatan pertumbuhan radial.
Gambar 5 Uji antagonis isolat bakteri lisis berdasarkan persentase penghambatan pertumbuhan radial pada 1 HSI (a) dan 4 HSI (b)
Persentase hambatan pertumbuhan radial dihitung dengan rumus: Penghambatan pertumbuhan radial =R1−R2
R1 x100%
Keterangan:
R1 adalah jari-jari miselium R. lignosus yang menjauhi isolat bakteri lisis R2 adalah jari-jari miselium R. lignosus yang mendekati isolat bakteri lisis
Persentase pertumbuhan radial diberi skor berdasarkan Zivkovic et al.
(2010). Skor 0 (tidak ada penghambatan), 1 (0%<x≤25%), 2 (25%<x≤50%), 3 (50%<x≤75%), dan 4 (75%<x≤100%).
Seleksi Isolat Bakteri Lisis Potensial
Seleksi isolat bakteri lisis non patogenik dilakukan berdasarkan total skor indeks lisis, zona hambat, dan penghambatan pertumbuhan radial. Isolat dengan total skor lebih besar dari total skor rata-rata isolat dikategorikan sebagai isolat bakteri lisis potensial.
Analisi Data
Data yang diperoleh diolah menggunakan Microsoft Office Excel 2007 kemudian dianalisis secara deskriptif dan uji khi kuadratuntuk data tertentu. Uji khi kuadratdilakukan berdasarkan Agresti (2007).
R I
R1 R2
HASIL DAN PEMBAHASAN
Penapisan Bakteri berdasarkan Sifat Kitinolitik dan Selulolitik
Kitinolitik adalah kemampuan untuk menghasilkan enzim kitinase (Haliza dan Suhartono 2012). Selulolitik adalah kemampuan untuk menghasilkan enzim selulase (Nuntavun et al. 2014). Kitinase merupakan enzim yang dapat mendegradasi atau melisis kitin. Kitinase dapat diperoleh dari berbagai mikroorganisme antara lain virus, bakteri, cendawan, serangga, tumbuhan tingkat tinggi, dan hewan (Haliza dan Suhartono 2012). Selulase adalah enzim yang dapat mendegradasi selulosa. Mikroorganisme yang mampu mendegradasi selulosa antara lain bakteri, cendawan, dan beberapa protozoa anaerobik (Perez et al.
2002). Umumnya baik mikroba penghasil kitinase maupun selulase melakukan hidrolisis substrat secara ekstraseluler (Haliza dan Suhartono 2012; Gupta et al.
2012). Hidrolisis substrat secara ekstraseluler artinya enzim dihasilkan di dalam sel tetapi dikeluarkan (sekresi) ke media pertumbuhan (substrat). Oleh sebab itu, mikroba penghasil kitinase dan selulase dapat diperoleh dengan menggunakan substrat yang mampu menginduksi enzim tersebut.
Enzim yang dihasilkan oleh bakteri memiliki fungsi yang berbeda dibandingkan dengan cendawan. Enzim yang dihasilkan bakteri berfungsi dalam hal nutrisi sedangkan cendawan berfungsi untuk melisis dinding sel yang tersusun atas glukan, menyimpan karbohidrat, memperoleh nutrisi, dan menguraikan kalosa pada tanaman (Soesanto 2008).
Bakteri yang berhasil diisolasi dari rizosfer tanaman karet berjumlah 251 isolat. Isolat ini dikelompokkan kedalam empat sifat, yaitu non kitinolitik dan non selulolitik, kitinolitik, selulolitik, serta kitinolitik dan selulolitik. Pengelompokkan dilakukan berdasarkan uji sifat kitinolitik dan selulolitik. Bakteri yang mampu menghasilkan enzim kitinase disebut bakteri kitinolitik (Nildayanti 2011). Bakteri yang mampu menghasilkan enzim selulase disebut bakteri selulolitik (Meryandini dan Wahyu 2009). Kemampuan bakteri untuk menghasilkan enzim ini ditunjukkan dengan terbentuknya zona bening di sekitar koloni bakteri pada media selektif. Hal ini sesuai dengan Nildayanti (2011) dan Ekawati et al. (2012) yang menyatakan bahwa bakteri kitinolitik membentuk zona bening pada media agar kitin sedangkan bakteri selulolitik membentuk zona bening pada media agar carboxy methyl cellulose (CMC).
Tabel 1 Uji sifat kitinolitik dan selulolitik bakteri hasil isolasi
Sifat isolat bakteri
Jumlah isolat Persentase jumlah isolat
Kitinolitik Selulolitik
8
enzim. Bakteri yang dilaporkan menghasilkan satu enzim adalah Pseudomonas fluorescens dan Bacillus sp. (Giyanto 2009). Bakteri tersebut menghasilkan enzim kitinase. Bakteri yang dilaporkan menghasilkan dua enzim adalah
Pseudomonas sp. (Sindhu dan Dadarwal 2001). Bakteri tersebut menghasilkan enzim kitinase dan selulase.
Penapisan pertama diperoleh bakteri non kitinolitik dan non selulolitik sebanyak 65 isolat (Tabel 1). Hal ini menunjukkan bahwa isolat bakteri yang diuji tidak semuanya dapat menghasilkan enzim kitinase dan selulase. Isolat tersebut kemungkinan tidak dapat menghasilkan enzim atau menghasilkan enzim lain. Enzim lain yang mungkin dihasilkan di antaranya glukanase karena menurut Soesanto (2008), enzim pengurai dinding sel selain kitinase adalah glukanase.
Isolat bakteri yang hanya bersifat kitinolitik tidak diperoleh pada penapisan pertama. Semua isolat bakteri yang bersifat kitinolitik dapat membentuk zona bening di media agar CMC atau mampu menghasilkan enzim selulase sehingga bersifat kitinolitik dan selulolitik. Tidak semua isolat bakteri selulolitik dapat membentuk zona bening di media agar kitin atau tidak menghasilkan ezim kitinase sehingga diperoleh isolat yang hanya bersifat selulolitik. Bakteri baik yang bersifat selulolitik maupun selulolitik dan kitinolitik sebanyak 186 isolat.
Isolat bakteri yang digunakan untuk penapisan berikutnya adalah isolat yang memiliki sifat lisis (Tabel 1). Isolat yang tidak dipilih bukan berarti tidak memiliki potensi sebagai agens pengendalian hayati tetapi penapisan dalam penelitian ini berdasarkan mekanisme lisis oleh enzim kitinase dan selulase. Isolat bakteri non kitinolitik dan non selulolitik memiliki potensi sebagai agens pengendalian hayati dengan mekanisme lain. Agens hayati memiliki banyak mekanisme dalam mengendalikan patogen tanaman. Menurut Sinaga (2006), agens antagonis berpotensi pengendalikan patogen dengan cara menekan inokulum, mencegah kolonisasi, melindungi perkecambahan biji dan akar tanaman dari infeksi patogen. Selain itu, secara langsung dapat menghambat patogen dengan sekresi antibiotik, kompetisi ruang dan nutrisi, dan menginduksi ketahanan tanaman.
Uji Hipersensitif Isolat Bakteri Lisis
Uji hipersensitif digunakan untuk mengetahui patogenisitas isolat bakteri lisis. Uji hipersensitif dilakukan pada tanaman tembakau. Wick (2010) menyatakan bahwa uji hipersensitif pada tanaman tembakau merupakan cara yang cepat dan praktis untuk mengetahui patogenisitas suatu kultur bakteri.
Gambar 6 Uji hipersensitif isolat bakteri kitinolitik dan selulolitik pada daun tembakau: bakteri non patogenik (a), dan bakteri patogenik (b)
9
Isolat bakteri non patogenik tidak menunjukkan gejala nekrotik pada daun tembakau (Gambar 6.a) sedangkan isolat bakteri patogenik menunjukkan gejala nekrotik (Gambar 6.b). Hal ini sesuai dengan hasil penelitian Kusumadewi (2011) yang menyatakan bahwa bakteri patogenik akan menunjukkan gejala nekrotik pada daun tembakau sedangkan bakteri non patogenik tidak menunjukkan gejala nekrotik. Menurut Agrios (2005), gejala nekrotik pada daun merupakan mekanisme pertahanan tanaman dari infeksi patogen melalui reaksi hipersensitif. Reaksi hipersensitif menyebabkan hancurnya semua membran seluler yang berkontak dengan bakteri patogen yang diikuti dengan pengeringan dan nekrosis jaringan daun yang terinfeksi bakteri tersebut.
Tabel 2 Uji hipersensitif isolat bakteri lisis
Sifat isolat bakteri Patogenik Non patogenik
Jumlah Persentase Jumlah Persentase
Selulolitik 10 5 110 59
Selulolitik dan kitinolitik 29 16 37 20
Total 39 21 147 79
Hasil uji hipersensitif isolat bakteri lisis menunjukkan reaksi non patogenik dan patogenik (Tabel 2). Jumlah bakteri lisis bersifat patogenik sebanyak 39 isolat (21%) dan non patogenik sebanyak 147 isolat (79%). Isolat bakteri yang bersifat non patogenik dipilih untuk penapisan berikutnya.
Indeks Lisis
Besarnya aktivitas kitinolitik dan selulolitik isolat bakteri lisis dapat ditentukan dengan menghitung indeks lisis. Indeks lisis merupakan perbandingan antara diameter zona bening dengan diameter koloni (Muharni dan Widjajanti 2011; Gupta et al. 2012). Zona bening yang dibentuk oleh isolat bakteri lisis merupakan daerah hidrolisis di sekitar koloni bakteri baik pada media agar kitin maupun agar CMC. Besarnya zona bening yang terbentuk berkorelasi positif dengan kemampuan bakteri untuk menghidrolisis.
Tabel 3 Uji indeks lisis
Skor indeksa Kitinolitik Selulolitik
N-10
asetilglukosamin. N-asetilglukosamin dihasilkan dari proses hidrolisis kitin dengan memutus ikatan 1.4 homopolimer N-asetilglukosamin. Semakin banyak jumlah monomer N-asetilglukosamin yang dihasilkan maka akan semakin besar zona bening yang terbentuk di sekitar koloni. Pada bakteri selulolitik, besarnya aktivitas enzim dipengaruhi oleh tiga enzim selulosa yang terdiri dari endo-1.4-β -glukanase, ekso-1.4-β-glukanase (selobiohidrolase), dan 1.4- β-glukosidase. Ketiga enzim ini bekerja secara sinergis memecah selulosa menjadi glukosa. Endo glukanase bekerja secara acak sepanjang rantai selulosa menghasilkan situs baru untuk selobiohidrolase dengan cara memotong bagian amorphous. Eksoglukanase melepas selobiosa dengan memotong bagian ujung rantai selulosa kristalin. Glukosidase berperan menghidrolisis selobiosa menjadi glukosa. Semakin banyak selulosa yang dihidrolisis menjadi glukosa maka zona bening yang terbentuk semakin luas (Meryandini et al. 2009; Nur et al. 2008; Perez et al. 2002).
Uji Antagonis Isolat Bakteri Lisis berdasarkan Zona Hambat
Uji antagonis isolat bakteri lisis terhadap R. lignosus dilakukan pada media PDA dan campuran yang diamati berdasarkan zona hambat (Tabel 4). Zona hambat merupakan jarak antara R. lignosus dengan bakteri lisis setelah beberapa hari diinkubasi pada biakan ganda (dual culture). Zona hambat yang terbentuk menunjukkan adanya mekanisme antagonis dari isolat bakteri lisis. Menurut Ferniah et al. (2004), bakteri antagonis memiliki beberapa mekanisme dalam menghambat cendawan patogen. Pertama, bakteri menghasilkan senyawa bioaktif yang merusak komponen struktural cendawan patogen. Perusakan komponen struktural cendawan terjadi oleh enzim-enzim hidrolitik, misalnya kitinase yang dihasilkan oleh bakteri kitinolitik. Ke dua, senyawa bioaktif yang dapat mempengaruhi permeabilitas membran sel cendawan sehingga transportasi zat-zat yang diperlukan untuk metabolisme terganggu. Ke tiga, senyawa yang dihasilkan bakteri dapat berfungsi sebagai inhibitor suatu enzim pada cendawan. Jika enzim cendawan tersebut berperan dalam metabolisme yang penting maka aktivitas enzimatis sel akan terganggu sehingga mengakibatkan pertumbuhan cendawan tertekan. Ke empat, senyawa yang menghambat sintesis protein cendawan. Sintesis protein yang terganggu menyebabkan cendawan kekurangan protein sehingga pertumbuhannya terhambat.
Tabel 4 Uji antagonis isolat bakteri lisis berdasarkan zona hambat
Skor zona hambata Jumlah isolat
11
hambat hingga skor 3. Skor zona hambat yang paling banyak dimiliki isolat di media PDA adalah 1 sedangkan di media campuran adalah 2. Besarnya zona hambat ini dipengaruhi beberapa faktor. Menurut Dewi (2011), zona hambat yang dibentuk bakteri kitinolitik dan selulolitik terhadap cendawan patogen dipengaruhi jumlah enzim yang dihasilkan, nutrisi medium, dan waktu inkubasi. Pengaruh nutrisi medium dapat dilihat dari jumlah isolat yang membentuk zona hambat di media campuran lebih banyak dibandingkan dengan di media PDA. Hal ini disebabkan oleh media PDA merupakan media umum yang nutrisinya lebih sesuai untuk pertumbuhan cendawan sedangkan media campuran nutrisinya sesuai untuk pertumbuhan bakteri maupun cendawan. Isolat bakteri yang mampu menghambat di media PDA termasuk isolat yang memiliki kemampuan antagonis tinggi karena pada lingkungan yang tidak terlalu mendukung untuk pertumbuhannya, bakteri tersebut bisa menghambat cendawan patogen. Tidak semua isolat bakteri yang mampu menghambat di media PDA dapat menghambat di media campuran karena media campuran tidak hanya memenuhi nutrisi bagi bakteri tetapi juga cendawan. Hal ini menyebabkan kemampuan antagonis bakteri meningkat dan kemampuan cendawan patogen untuk melawan isolat bakteri tersebut juga meningkat.
Hubungan antara Indeks Lisis dengan Zona Hambat
Hasil analisis khi kuadrat pada tabel 5 menunjukkan bahwaχ2 hitung lebih kecil dibandingkan dengan χ2 tabel, artinya indeks lisis isolat tidak ada hubungan dengan kemampuan untuk membentuk zona hambat atau kemampuan antagonis terhadap R. lignosus. Hal tersebut ditunjukkan oleh banyaknya isolat bakteri lisis yang tidak memiliki kemampuan antagonis (Tabel 4).
Tabel 5 Uji khi kuadrat antara indeks lisis dengan zona hambat
Indeks
Analisis hubungan antara indeks lisis dengan zona hambat menggunakan χ2pada taraf nyata
α=5%.
Menurut Giyanto et al. (2009), isolat yang memiliki aktivitas kitinolitik belum tentu memiliki sifat antagonis terhadap cendawan patogen. Hal tersebut disebabkan oleh perbedaan struktur pada substrat yang digunakan. Struktur kitin pada sel cendawan lebih kompleks dibandingkan dengan koloidal kitin yang digunakan sebagai sumber karbon dalam uji indeks kitinolitik (Novitasari 2013). Isolat bakteri selulolitik yang tidak membentuk zona hambat disebabkan oleh R. lignosus yang tidak tersusun oleh selulosa melainkan kitin dan glukan (Walker dan White 2005).
12
Mekanisme lisis isolat bakteri lisis yang tidak berkorelasi dengan zona hambat menunjukkan bahwa mekanisme lain yang mungkin terjadi adalah antibiosis.
Antibiosis adalah mekanisme antagonis bakteri dengan menghasilkan senyawa antibiotik yang menghambat pertumbuhan atau mematikan patogen. Antibiotik merupakan senyawa organik metabolit sekunder yang dihasilkan oleh mikroba dengan berat molekul rendah dan bersifat toksin bagi mikroba lain. Senyawa ini dalam konsentrasi rendah sangat berbahaya bagi pertumbuhan dan keaktifan metabolisme patogen atau mikroba lain (Soesanto 2008). Menurut Zivkovic (2010) antibiotik yang dihasilkan oleh bakteri antagonis dapat menembus sel cendawan patogen dan menghambat aktivitasnya.
Gambar 7 R. lignosus tanpa perlakuan isolat bakteri lisis (kontrol) dengan perbesaran 400 kali. Hifa tidak mengalami malformasi
(a) (d)
Gambar 8 R. lignosus dengan perlakuan isolat bakteri SK008 (a), S018 (b),
S076 (c), dan S085 dengan perbesaran 400 kali. R. lignosus mengalami malformasi atau perubahan bentuk berupa hifa yang membesar
(b)
13
Adanya mekanisme lain berupa antibiosis ditunjukkan oleh hasil pengamatan mikroskopis R. lignosus pada perbesaran 400 kali (Gambar 7 dan 8). Pengamatan tersebut bertujuan melihat bentuk hifa R. lignosus setelah 4 HSI baik tanpa perlakuan isolat bakteri lisis (kontrol) maupun perlakuan bakteri lisis. Hifa
R. lignosus tanpa perlakuan bakteri lisis tidak mengalami malformasi (Gambar 7) sedangkan hifa yang diberi perlakuan bakteri lisis mengalami malformasi (Gambar 8). Hifa yang pertumbuhannya terhambat tidak mengalami lisis dan dinding selnya terurai. Hal tersebut menunjukkan bahwa tidak terjadi mekanisme antagonis berupa lisis oleh enzim karena menurut Soesanto (2008), mekanisme lisis oleh enzim bakteri pada dinding sel cendawan ditandai oleh terurainya dinding sel.
Malformasi pada hifa R. lignosus yang diberi perlakuan bakteri lisis disebabkan oleh rusaknya struktural sel. Menurut Rahman et al. (2007), miselium cendawan patogen yang tertekan antibiotik bakteri antagonis akan mengalami malformasi karena antibiotik yang menembus sel cendawan patogen akan menyebabkan protoplasma rusak. Adanya kerusakan pada hifa akan menekan pertumbuhan R. lignosus sehingga isolat bakteri tersebut bisa digunakan sebagai agens hayati.
Mikroorganime yang dilaporkan mampu menghasilkan antibiotik untuk menekan patogen tanaman diantaranya antibiotik 2.4-diacetyl-phloroglucinol yang diproduksi oleh Pseudomonas fluorescens F113 dapat menghambat patogen
Pythium spp. penyebab penyakit rebah kecambah, antibiotik gliotoksin yang diproduksi oleh Trichoderma virens dapat menghambat patogen Rizoctobia solani
penyebab penyakit busuk akar, antibiotik bacillomycin yang dihasilkan oleh
Bacilus subtilis AU195 dapat menghambat Aspergillus flavus penyebab kontaminasi afla toksin (Pal dan Gardener 2006). Pada kasus tersebut antibiotik efektif menekan patogen tanaman baik secara in vitro maupun in planta. Supaya pengendaliannya efektif maka kuantitas antibiotik yang diproduksi harus cukup dan senyawa antibiotik yang dihasilkan lebih dari satu.
Isolat Bakteri Lisis Potensial
Bakteri lisis non patogenik yang memiliki kemampuan antagonis terhadap
R. lignosus pada uji in vitro berjumlah 30 isolat (Tabel 6). Isolat tersebut terdiri atas 17 isolat selulolitik dan 13 isolat bersifat selulolitik dan kitinolitik. Isolat diseleksi kembali untuk mengetahui isolat yang potensial sebagai agens pengendalian hayati R. lignosus.
Setiap isolat memiliki kemampuan lisis dan antagonis yang berbeda (Tabel 6). Hasil uji indeks lisis dan kemampuan antagonis dapat dilihat bahwa nilai indeks yang tinggi tidak selalu diikuti potensi antagonis yang tinggi terhadap R. lignosus begitupun sebaliknya. Isolat bakteri S085 memiliki skor indeks lisis tinggi tetapi skor kemampuan antagonisnya rendah, sebaliknya isolat S007 memiliki skor indeks rendah tetapi skor kemampuan antagonis tinggi. Selain itu, isolat bakteri yang memiliki indeks lisis sama tetapi kemampuan antagonisnya berbeda. Hal ini menunjukkan bahwa setiap isolat bakteri lisis memiliki kemampuan antagonis yang berbeda walaupun kemampuan lisisnya sama. Kamil
14
al. (2001), melisis hifa patogen hanya salah satu mekanisme pengendaliaan oleh bakteri kitinolitik. Oleh sebab itu, kemampuan lisis bakteri tidak berhubungan dengan sifat antagonisnya.
Tabel 6 Seleksi isolat bakteri lisis sebagai agens pengendalian hayati R. lignosus
Kode Isolat
Skor indeksd Skor zona hambate Skor penghambatan
pertumbuhan radialf Total Skor
Selulolitik Kitinolitik PDA Campuran PDA Campuran
Sa007c 2 0 2 2 2 3 11
aHuruf S merupakan kode isolat bakteri selulolitik.
bHuruf SK merupakan kode isolat bakteri selulolitik dan kitinolitik.
cKode isolat yang dicetak tebal merupakan isolat bakteri lisis yang potensial.
dSkor indeks: 0 (tidak ada indeks lisis), 1(0<x≤1), 2 (1<x≤2), 3 (2<x≤3), dan 4 (3<x≤4).
eSkor zona hambat: 1 (0 mm<x≤5 mm), 1 (5 mm<x≤10 mm), 3 (10 mm<x≤15 mm), 4 (15 mm<x≤20 mm) (Zivkovic et al. 2010).
fSkor penghambatan pertumbuhan radial: 0 (tidak ada penghambatan), 1 (0%<x≤25%), 2 (25%<x≤50%), 3 (50%<x≤75%), dan 4 (75%<x≤100%) (Zivkovic et al. 2010).
15
(Oomycetes). Cendawan Oomycetes tersebut dinding selnya tersusun oleh selulosa dan β-glukan (Walker dan White 2005). Selain itu, kemampuan bakteri selulolitik untuk melisis selulosa banyak diteliti untuk keperluan dekomposisi bahan organik. Nur et al. (2008) menggunakan bakteri selulolitik untuk dekomposisi jerami padi, Meryandini et al. (2009) menggunakan bakteri selulolitik untuk dekomposisi kulit pisang, dan Ekawati et al. (2012) menggunakan bakteri selulolitik untuk dekomposisi limbah dadu tebu.
Isolat bakteri lisis hasil seleksi merupakan isolat yang mampu menghambat
R. lignosus. Menurut Cook dan Baker (1989), kemampuan antagonis atau kemampuan menghambat perkembangan dan pertumbuhan organisme lain adalah salah satu syarat suatu organisme disebut agens hayati. Isolat bakteri lisis yang menghambat di media PDA dan campuran berbeda jumlahnya. Bakteri selulolitik yang mampu menghambat di media PDA sebanyak 6 isolat, di media campuran sebanyak 9 isolat, dan di kedua media sebanyak 2 isolat. Bakteri kitinolitik yang mampu menghambat di media PDA sebanyak 3 isolat, di media campuran sebanyak 6 isolat, dan di kedua media sebanyak 4 isolat. Isolat bakteri lisis yang mampu menghambat di media PDA sebagian besar memiliki skor 2, yaitu penghambatan pertumbuhan radial sebesar 25% sampai 50%. Skor penghambatan pertumbuhan radial ini cenderung meningkat ketika di media campuran dengan skor yang dimiliki sebagian besar isolat adalah 3, yaitu penghambatan pertumbuhan radial sebesar 50% sampai 75%.
Total skor isolat bakteri lisis terdiri atas skor 5 hingga 14. Skor yang banyak dimiliki oleh isolat secara berurutan adalah 8, 10, 6, 7, 9, 11, 13, dan 14. Skor 8 dimiliki oleh 8 isolat, skor 10 dimiliki oleh 6 isolat, skor 6 dan 7 dimiliki oleh 4, skor 9 dan 14 dimiliki oleh 2 isolat, skor 5, 11, 12, 13 dimiliki oleh 1 isolat. Berdasarkan kriteria seleksi, isolat bakteri lisis non patogenik yang memiliki total skor lebih dari total skor rata-rata terdiri atas S007, S022, SK007, SK009, SK014, SK015, SK017, SK024, SK018, SK023, SK059, SK060, dan SK062. Isolat bakteri lisis tersebut merupakan isolat potensial untuk pengendalian
16
SIMPULAN DAN SARAN
Simpulan
Bakteri yang diisolasi dari rizosfer tanaman karet berjumlah 251 isolat dengan jumlah bakteri lisis sebanyak 186 isolat. Jumlah isolat non patogenik yang mampu menghambat R. lignosus secara in vitro berjumlah 30 isolat. Berdasarkan total skor indeks lisis, zona hambat, dan penghambatan pertumbuhan radial diperoleh 13 isolat potensial untuk pengendalian hayati R. lignosus.
Saran
DAFTAR PUSTAKA
Agrious GN. 2005. Plant Pathology. Ed ke-5. San Diego (US): Elsevier Academi Press.
Agresti A. 2007. An Intoduction to Categorical Data Analysis. Ed ke-2. New York (US):Wiley.
Amaria W, Taufiq E, Harni R. 2013. Seleksi dan identifikasi jamur antagonis sebagai agens hayati jamur akar putih (Rigidoporus lignosus) pada tanaman karet. Buletin RISTI. 4(1):1-8.
[Balitri] Balai Penelitian Tanaman Industri dan Penyegar. 2014. Jamur akar putih (JAP) penyakit berbahaya pada perkebunan karet [Internet]. [diunduh 2014 Sep 06]. Tersedia pada: http://perkebunan.litbang.deptan.go.id/?p=8667 [BPS] Badan Pusat Statistik. 2013. Luas areal dan produksi perkebunan rakyat
menurut jenis tanaman, 2000-2013 [Internet]. [diunduh 2014 Sep 12]. Tersedia pada: http://bps.go.id/linkTabelStatis/view/id/1025
Boer WD, Gunnewiek PJ, Kowalchul GA, Veen JA. 2001. Growth of chitinolytic dune soil β-subclass Proteobacteria in response to invading fungal hypae.
Applied and Environmental Microbiology. 67(8):3358-3362. doi: 10.1128/AEM.67.8.3358-3362.2001.
Chernin L, Ismailov Z, Haran S, Chet I. 1995. Chitinolytic Enterobacter agglomerans antagonistic to fungal plant pathogens. Applied and Enviromental Microbiology. 61(5):1720-1726.
Cook RJ, Baker KF. 1989. The Nature and Practice of Biological Control of Plant Pathogen. Minnesota (USA): The American Phytopathological Society. Dewi RR. 2011. Pengendalian Saprolegnia sp. pada telur gurami (Osphronemus
gouramy) menggunakan isolat bakteri kitinoitik [tesis]. Medan (ID): Universitas Sumatera Utara.
Ekawati ER, Ni’matuzahroh, Tini S, Agus S. 2012. Eksplorasi dan identifikasi bakteri selulolitik pada limbah dadu tebu (Saccahrum officinarum L). Berkala Penelitian Hayati 18(2012):31-34.
Ferniah RS, Pujiyanto S, Purwantisari S. 2004. Potensi bakteri kitinolitik sebagai agens pengendali kapang Fusarium oxysporium penyebab penyakit busuk pangkal batang tanaman kentang. Seminar Nasional Hasil Penelitian.Yogyakarta (ID): [nama penerbit tidak diketahui]. [halaman tidak diketahui]. [Internet]. [diunduh 2014 Sep 04]. Tersedia pada:
http://eprints.undip.ac.id/23544/
Giyanto, Ace Suherman, Rustam. 2009. Kajian pembiakan bakteri kitinolitik
Pseudomonas fluorescens dan Bacillus sp. pada limbah organik dan formulasinya sebagai pestisida hayati (Bio-Pesticide). Di dalam: [tidak diketahui], editor. Bidang Teknologi dan Rekayasa Non Pangan. Prosiding Seminar Hasil-hasil Penelitian IPB; 2009 [bulan dan tanggal tidak diketahui] Bogor. Bogor (ID): [nama penerbit tidak diketahui]. [halaman tidak diketahui]. [Internet]. [diunduh 2014 Sep 04]. Tersedia pada:
18
Gupta P, Samant K, Sahu A. 2012. Isolation of cellulose-degrading bacteria and determination of their cellulolytic potential. International Journal of Microbiology. 2012(2012):1-5. doi: 10.1155/2012/578925.
Harni R, Amaria W. 2012. Potensi bakteri kitinolitik untuk pengendalian penyakit busuk pangkal batang lada (Phytophthora capsici). Buletin RISTRI. 3(1):7-12.
Haliza W, Suhartono MT. 2012. Buletin teknologi Pascapanen Pertanian. 8(1):1-14.
Kamil Z, Rizk M, Saleh M, Moustafa S. 2007. Isolasi and identification of rhizosphere soil chitinolytic bacteria and their potential in antifungal biocontrol. Global Journal of Moleculer Science. 2(2):57-66.
Kuklinsky-Sobral J, Araujo WL, Mendes R, Geraldi IO, Pizzirani-Kleiner AA, Azevedo JL. 2004. Isolation and characterization of soybean-associated Bacteria and their potential for plant growth promotion. Enviromental Microbiology. 6(12):1244-1251. doi:10.1111/j.1462-2920.2004.00658.x. Kusumadewi EA. 2011. Seleksi Plant growth promoting rhizobacteria untuk
pengendalian hayati penyakit embun bulu (Pseudoperonospora cubensis) pada tanaman mentimun [skripsi]. Bogor (ID): Institut Pertanian Bogor. Kusumowardani A. 2008. Kajian jenis limbah, suhu, dan lama penyimpanan
terhadap daya tahan dan potensi antagonisme (Pseudomonas fluorescens) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Meryandini A, Wahyu W, Besty M, Titi CS, Nisa R, Hasrul S. 2009. Isolasi bakteri selulolitik dan karakterisasi enzimnya. Makara, Sains. 13(1): 33-38. Muharni, Widjajanti H. 2011. Skrining bakeri kitinolitik antagonis terhadap
pertumbuhan jamur akar putih (Rigidoporus lignosus) dari rizosfir tanaman karet. Jurnal Penelitian Sains. 14(1):51-56.
Nildayanti. 2011. Peran bakteri kitinolitik dan fungi mikoriza arbuskula dalam pengendalian busuk pangkal batang kelapa sawit [tesis]. Bogor (ID): Institut Pertanian Bogor.
Novitasari P. 2013. Isolasi dan identifikasi bakteri kitinolitik penghambat pertumbuhan cendawan patogen asal kokon Cricula trifenestrata [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nuntavun R, Jutaporn S, Pornrapee S. 2014. Cellulolytic bacteria with plant growth promoting properties as an efficient microbial strategy for composting. 2014. Malaysian Journal of Microbial. 10(3):174-178.
Nur HS, Meryandini A, Hamim. 2008. Pemanfaatan bakteri selulolitik dan xilanolitik yang berpotensi untuk dekomposisi jerami padi. Jurnal Tanah Tropika. 14(1):71-80.
Pal KK, Gardener BM. 2006. Biological control of plant pathogens. The Plant Health Instructor. 1(2006):1-25. doi: 10.1094/PHI-A-2006-1117-02.
Perez J, Munoz DJ, Martinez J. 2002. Biodegradation and biologycal treatments of cellulose, hemicellulose and lignin. International Microbiology. 5(edisi tidak diketahui):53-63.doi:10.1007/s10123-002-0062-3.
Rahman MA, Kadir J, Mahmud TMM, Rahman RA, Begum MM. 2007. Screening of antagonistic bacteria for biocontrol activities on
Colletotrichum gloeosporioides in papaya. Asian Journal of Plant Science.
19
Semangun H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Ed ke-4. Yogyakarta (ID): Gadjah Mada University Press.
Sinaga MS. 2006. Dasar-dasar Penyakit Tumbuhan. Ed ke-2. Jakarta (ID): Penebar Swadaya.
Sindhu SS, Dadarwal KR. 2001. Chitinolytic and cellulolytic Pseudomonas sp. antagonistic to fungal pathogens enhances nodulation by Mesorhizobium sp.
Cicer in chickpea. Microbiological Research. 156(2001):353-358.
Singh PP, Shin YC, Park CS, Chung YR. 1999. Biological control of Fusarium wilt of cucumber by chitinolytic bacteria. Phytopathology. 89(1):93-99. Susi. 2002. Isolasi kitinase dari Scleroderma columnae dan Trichoderma
harzianum. Jurnal Ilmu Dasar. 3(1):30-35.
Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Ed ke-1. Jakarta (ID): PT Raja Grafindo Persada.
Walker GM, White NA. 2005. Fungi: Biology and Applications. Kavanagh K, editor. Chichester (UK): John Wiley & Sons Ltd.
Weller DM. 1988. Biological control of soil-borne pathogens in the rhizosphere with bacteria. Annual Review of Phytopathology. 26 (1988):379-407. doi: 10.1146/annurev.py.26.090188.002115.
Wick R. 2010. Tobacco hypersensitivity: the first test to screen bacteria for pathogenicity. [internet]. [diunduh 2015 Juni 9]. Tersedia pada: http://www.npdn.org/webfm_send/1230.
20
21
RIWAYAT HIDUP
Penulis dilahirkan di Garut pada tanggal 4 Maret 1993. Penulis sebagai anak kesepuluh dari sepuluh bersaudara, dari pasangan Ana dan Ecin. Pendidikan sekolah menengah ditempuh di SMA Negeri 16 Garut pada program IPA dan lulus pada tahun 2011. Pada tahun yang sama, penulis melanjutkan pendidikan sarjana di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) melalui jalur undangan. Selama S1, penulis mendapatkan beasiswa Bidikmisi dari pemerintah. Gelar Sarjana Pertanian (S.P) diperoleh pada tahun 2015.
21
Lampiran 1 Uji sifat kitinolitik dan selulolitik isolat bakteri hasil isolasi
Isolat Selulolitik Kitinolitik Isolat Selulolitik Kitinolitik Isolat Selulolitik Kitinolitik Isolat Selulolitik Kitinolitik
Sa
001 + - S033 + - S064 + - S129 + -
S002 + - S034 + - S066 + - S130 + -
S004 + - S035 + - S069 + - S132 + -
S005 + - S037 + - S073 + - S133 + -
S006 + - S038 + - S076 + - S136 + -
S007 + - S039 + - S078 + - S138 + -
S009 + - S041 + - S082 + - S141 + -
S010 + - S042 + - S085 + - S142 + -
S013 + - S044 + - S090 + - S143 + -
S016 + - S046 + - S093 + - S144 + -
S017 + - S047 + - S094 + - S145 + -
S018 + - S048 + - S106 + - S149 + -
S019 + - S049 + - S107 + - S150 + -
S020 + - S050 + - S108 + - S151 + -
S021 + - S051 + - S110 + - S157 + -
S022 + - S053 + - S118 + - S159 + -
S023 + - S054 + - S119 + - S160 + -
S024 + - S057 + - S120 + - S162 + -
S028 + - S058 + - S123 + - S164 + -
S029 + - S059 + - S124 + - S165 + -
S030 + - S060 + - S126 + - S166 + -
S031 + - S061 + - S127 + - S167 + -
22
Isolat Selulolitik Kitinolitik Isolat Selulolitik Kitinolitik Isolat Selulolitik Kitinolitik Isolat Selulolitik Kitinolitik
S172 + - S203 + - SK020 + + SK043 + +
S173 + - S204 + - SK021 + + SK044 + +
S174 + - S206 + - SK022 + + SK045 + +
S176 + - S207 + - SK023 + + SK046 + +
S177 + - S208 + - SK024 + + SK047 + +
S179 + - SKb
002 + + SK025 + + SK048 + +
S181 + - SK003 + + SK026 + + SK049 + +
S182 + - SK004 + + SK027 + + SK050 + +
S183 + - SK005 + + SK028 + + SK051 + +
S184 + - SK006 + + SK029 + + SK052 + +
S185 + - SK007 + + SK030 + + SK053 + +
S189 + - SK008 + + SK031 + + SK054 + +
S190 + - SK009 + + SK032 + + SK055 + +
S192 + - SK010 + + SK033 + + SK056 + +
S193 + - SK011 + + SK034 + + SK057 + +
S194 + - SK012 + + SK035 + + SK058 + +
S195 + - SK013 + + SK036 + + SK059 + +
S196 + - SK014 + + SK037 + + SK060 + +
S197 + - SK015 + + SK038 + + SK061 + +
S198 + - SK016 + + SK039 + + SK062 + +
S199 + - SK017 + + SK040 + + SK063 + +
S200 + - SK018 + + SK041 + + SK064 + +
23
Isolat Selulolitik Kitinolitik Isolat Selulolitik Kitinolitik Isolat Selulolitik Kitinolitik
SK067 + + S0K0 - - S0K0 - -
SK068 + + S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - - S0K0 - -
S0K0 - - S0K0 - -
S0K0 - - S0K0 - -
a
Huruf S merupakan kode isolat bakteri selulolitik.
b
24
Lampiran 2 Uji hipersensitif isolat bakteri lisis
Isolat Uji hipersensitif Isolat Uji hipersensitif Isolat Uji hipersensitif Isolat Uji hipersensitif
+ - + - + - + -
Selulolitik Sa
001 S017 Selulolitik S047 Selulolitik S094 Selulolitik S145
S002 S018 S048 S106 S149
S004 S019 S049 S107 S150
S005 S020 S050 S108 S151
S006 S021 S051 S110 S157
S007 S022 S053 S118 S159
S009 S023 S054 S119 S160
S010 S024 S057 S120 S162
S013 S028 S058 S123 S164
S016 S029 S059 S124 S165
S030 S060 S126 S166
S031 S061 S127 S167
S032 S062 S128 S170
S033 S064 S129 S172
S034 S066 S130 S173
S035 S069 S132 S174
S037 S073 S133 S176
S038 S076 S136 S177
S039 S078 S138 S179
S041 S082 S141 S181
S042 S085 S142 S182
S044 S090 S143 S183
25
Isolat Uji hipersensitif Isolat Uji hipersensitif Isolat Uji hipersensitif
+ - + - + -
Selulolitik S185 Selulolitik
dan Kitinolitik
SK007 SK036 Selulolitik
dan Kitinolitik
Huruf S merupakan kode isolat bakteri selulolitik.
b
26
Lampiran 3 Uji indeks lisis dan uji antagonis isolat bakteri lisis
Isolat
Selulolitik Kitinolitik PDA Campuran
27 Isolat
Selulolitik Kitinolitik PDA Campuran
28 Isolat
Selulolitik Kitinolitik PDA
29 Isolat
Selulolitik Kitinolitik PDA
30 Isolat
Selulolitik Kitinolitik PDA Campuran
31 Isolat
Selulolitik Kitinolitik PDA
32 Isolat
Selulolitik Kitinolitik PDA
33 Isolat
Selulolitik Kitinolitik PDA
34 Isolat
Selulolitik Kitinolitik PDA
35 Isolat
Selulolitik Kitinolitik PDA
36 Isolat
Selulolitik Kitinolitik PDA Campuran
Zona
Huruf S merupakan kode isolat bakteri selulolitik.
b
37
Lampiran 4 Uji khi kuadrat indeks selulolitik terhadap zona hambat di media PDA
Indeks selulolitik
Zona hambat
Total
0 п Eij χ2 1 п Eij χ2 2 п Eij χ2 3 п Eij χ2 4 5
1 0.000 0.000 0.000 0.000 0.00 0.000 0.000 0.000 0.00 0.000 0.000 0.000 0.00 0.000 0.000 0.000 0 0 0
2 25.85 0.170 24.993 0.029 0.68 0.010 1.517 0.462 1.00 0.006 0.948 0.179 0.00 0.003 0.379 0.379 0 0 41
3 53.74 0.365 53.644 0.000 3.4 0.022 3.257 0.067 1.36 0.014 2.035 0.224 1.36 0.006 0.814 0.366 0 0 88
4 10.02 0.075 10.973 0.083 1.36 0.005 0.666 0.657 0.68 0.003 0.416 0.167 0.00 0.001 0.167 0.167 0 0 18
Total 89.61 0.112 5.44 1.186 3.4 0.570 1.36 0.912 0 0 147
Lampiran 5 Uji khi kuadratselulolitik terhadap zona hambat di media campuran
Indeks selulolitik
Zona hambat
0 п Eij χ2 1 п Eij χ2 2 п Eij χ2 3 4 5 Total
1 0 0.000 0.000 0.000 0.00 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0 0 0 0
2 25.17 0.163 23.906 0.067 0.68 0.006 0.948 0.076 2.00 0.021 3.023 0.346 0 0 0 41
3 51.02 0.349 51.309 0.002 1.36 0.014 2.035 0.224 7.48 0.044 6.489 0.151 0 0 0 88
4 9.52 0.071 10.495 0.091 1.36 0.003 0.416 2.139 1.36 0.009 1.327 0.001 0 0 0 18
Total 85.71 0.159 3.4 2.439004 10.84 0.4985 0 0 0 147
ΣΣχ2
hitung 2.780
χ2
tabel 26.296
terima Ho tidak ada hubungan antara indeks Selulolitik dengan zona hambat
ΣΣχ2
hitung 3.097
χ2
tabel 26.296
38
Lampiran 6 Uji khi kuadrat kitinolitik terhadap zona hambat di media PDA
Indeks selulolitik
Zona hambat
Total
0 п Eij χ2 1 п Eij χ2 2 П Eij χ2 3 п Eij χ2 4 5
1 2.7 0.059 2.191 0.118 0.000 0.008 0.292 0.292 0 0.004 0.135 0.135 0.0 0.002 0.073 0.073 0 0 1
2 72.97 2.014 74.506 0.032 10.810 0.268 9.934 0.077 5 0.124 4.595 0.036 2.7 0.067 2.481 0.019 0 0 34
3 5.41 0.118 4.383 0.241 0.000 0.016 0.584 0.584 0 0.007 0.270 0.270 0.0 0.004 0.146 0.146 0 0 2
4 0.00 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0 0.000 0.000 0.000 0.0 0.000 0.000 0.000 0 0 0
Total 81.08 0.3905 10.81 0.954 5 0.441 2.7 0.238 0. 0 37
Lampiran 7 Uji khi kuadrat kitinolitik terhadap zona hambat di media campuran
Indeks selulolitik
Zona hambat
0 п Eij χ2 1 п Eij χ2 2 п Eij χ2 3 4 5 Total
1 3 0.053 1.972 0.269 0 0.004 0.146 0.146 0 0.020 0.730 0.730 0 0 0 1
2 65 1.812 67.054 0.072 5 0.134 4.971 0.039 27 0.671 24.811 0.193 0 0 0 34
3 5 0.107 3.944 0.545 0 0.008 0.292 0.292 0 0.039 1.459 1.459 0 0 0 2
4 0 0.000 0.000 0 0.000 0.000 0.477 0 0.000 0.000 0 0 0 0
Total 73 0.885 5 0.955 27 2.382 0 0 0 37
ΣΣχ2
hitung 2.024
χ2
tabel 26.296
terima Ho tidak ada hubungan antara indeks kitinolitik dengan zona hambat
ΣΣχ2
hitung 3.745
χ2
tabel 26.296