PEMANFAATAN MIKROBA PENGHIDROLISIS SELULOSA
UNTUK PRODUKSI GAS METANA DENGAN BAHAN
DASAR POME
(Palm Oil Mill Effluent)
LASMA ELIEZABETH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pemanfaatan Mikroba Penghidrolisis Selulosa untuk Produksi Gas Metana dengan Bahan Dasar POME (Palm Oil Mill Effluent) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2014
Lasma Eliezabeth NIM G84100024
ABSTRAK
LASMA ELIEZABETH. Pemanfaatan Mikroba Penghidrolisis Selulosa untuk Produksi Gas Metana dengan Bahan Dasar POME (Palm Oil Mill Effluent). Dibimbing oleh SYAMSUL FALAH dan I MADE SUDIANA.
Pemanfaatan POME (Palm Oil Mill Effluent) untuk produksi gas metana mempunyai dua keuntungan, yaitu meningkatkan kualitas effluent (air buangan) dan energi yang diperoleh dari proses methanogenesis. Mikroba penghidrolisis berperan sentral dalam menghidrolisis senyawa komplek polisakarida menjadi gula yang dapat difermentasi sehingga menghasilkan gas metana. Tujuan penelitian ini adalah memanfaatkan potensi mikroba penghidrolisis selulosa untuk meningkatkan produksi gas metana. Penelitian diawali dengan pengujian aktivitas hidrolisis selulosa pada medium menggunakan Carboxymethyl cellulose (CMC) menggunakan congo red sebagai indikator reaksi hidrolisis. Selanjutnya dilakukan uji kuantitatif aktivitas selulase terhadap kultur yang dikultivasi pada suhu 30C dan 50C serta analisis gas metana dalam sampel dengan menggunakan GC-FID. Kemampuan ATH 2147 diperoleh mampu menghidrolisis selulosa dan POME, serta Y34 mampu melakukan proses fermentasi. Berdasarkan hasil analisis produksi gas metana, campuran ATH 2147+Y34 menghasilkan produksi metan yang paling tinggi. Jumlah gas metana yang diproduksi dipengaruhi oleh jumlah biomasa yang berperan pada proses metanogenesis. Suhu optimum methanogenesis adalah 30°C.
Kata kunci: Hidrolisis, methanogenesis, Palm Oil Mill Effluent.
ABSTRACT
LASMA ELIEZABETH. Utilization of Hydrolizing Microbes for Methane Production from POME (Palm Oil Mill Effluent). SYAMSUL FALAH dan I MADE SUDIANA.
Utilization POME (Palm Oil Mill Effluent) for the production of methane gas has double advantages: increasing effluent quality and energy obtained from methanogenesis. Hydrolyzing microbes play key central role on hydrolyses of complex polysaccharide into fermentable sugar to produce methane gas. The objective of this research was to optimize hydrolyses process to enhance methane production by hidrolizing microbes. The experiment was started with determination of cellulolytic capacity on CMC media, and optimation of celulose activity, focused on the effect of temperature (30C and 50C) and methane gas in the sample analysis using GC-FID. Ability of ATH 2147 was able to hydrolyse cellulose, using CMC and POME substrates, while Y34 was able to ferment POME. Based on methane production consortia of ATH 2147 and Y34 was able to produce highest methane. Amount of methane produced dependent on amount of biomass and temperature. Optimum methanogenesis was at 30C.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PEMANFAATAN MIKROBA PENGHIDROLISIS SELULOSA
UNTUK PRODUKSI GAS METANA DENGAN BAHAN
DASAR POME
(Palm Oil Mill Effluent)
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Pemanfaatan Mikroba Penghidrolisis Selulosa untuk Produksi Gas Metana dengan Bahan Dasar POME (Palm Oil Mill Effluent). Nama : Lasma Eliezabeth
NIM : G84100024
Disetujui oleh
Dr Syamsul Falah, S.Hut. M.Si Pembimbing I
Prof. Dr. I Made Sudiana, M.Sc. Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji serta syukur penulis ucapkan pada Tuhan Yesus Kristus yang senantiasa menyertai dan memberikan hikmat, hingga penulis mampu menyelesaikan penelitian ini dengan lancar. Karya ilmiah yang berjudul “Pemanfaatan Mikroba Penghidrolisis Selulosa untuk Produksi Gas Metana dengan Bahan Dasar POME (Palm Oil Mill Effluent)” ini telah dilakukan sejak bulan Oktober 2013 hingga Maret 2014.
Terima kasih juga penulis ucapkan pada Bapak Dr. Syamsul Falah, S.Hut. M.Si dan Bapak Prof. Dr.I Made Sudiana, MSc atas bimbingan, arahan berikut kritik dan sarannya dalam penulisan hasil penelitian ini. Secara khusus juga penulis ucapkan terima kasih kepada kedua orang tua penulis Bapak Yansen Sibarani dan Tiurma Hasibuan atas doa dan dorongan semangat untuk penulis dapat sampai pada tahap ini. Penulis juga mengucapkan terima kasih kepada teman-teman Biokimia 47, teman-teman PMK IPB, dan keluarga lab fisiologi LIPI dengan doa, semangat, dan kasih yang diberikan kepada penulis sepanjang perjalanan penelitian hingga penyusunan karya ilmiah ini.
Semoga hasil penelitian ini berguna bagi ilmu pengetahuan khususnya dalam pengembangan dan penerapan ilmu biokimia dalam bidang pertanian serta menjadi berkat untuk bangsa Indonesia.
Bogor, April 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Waktu dan Lokasi Penelitian 2
Bahan dan Alat 2
Metode Penelitian 3
HASIL DAN PEMBAHASAN 5
Hasil 6
Pembahasan 11
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR TABEL
1 2 3
Produksi limbah palm oil mill effluent (POME) di Indonesia Indeks selulotik pada medium CMC
Konsentrasi gas metana pada mikroba campuran ATH 2147+Y34 di
Zona bening pada isolat bakteri selulotik Y34 dan ATH 2147 Aktivitas enzim endoglukanase hari kedua
Aktivitas enzim endoglukanase hari ketiga Aktivitas enzim endoglukanase hari kelima
Produksi gas metan pada perbandingan biomassa dengan sludge primer Produksi gas metan pada perbandingan suhu
Produksi gas metan pada perbandingan biomassa dengan sludge recycle Konsentrasi kemurnian gas metan terhadap total gas
Konsentrasi gas metan pada isolasi campuran ATH 2147+Y34 di medium yang digunakan
Penurunan total organik karbon (TOC)
Proses hidrolisis selulosa menjadi glukosa oleh kompleks enzim selulase
Perbedaan Biomassa dengan Sludge primer Perbedaan Biomassa dengan Sludge Primer Perbedaan Biomassa dengan Sludge Sekunder Perbedaan Suhu
Kurva standar gula reduksi
Aktivitas enzim selulase pada hari kedua Aktivitas enzim selulase pada hari ketiga Aktivitas enzim selulase pada hari kelima
Gas metan dengan perbandingan biomassa pada penambahan sludge primer
Gas metan dengan perbandingan suhu
Gas metan dengan perbandingan biomassa pada penambahan sludge sekunder
Gambar Kromatogram
Kurva standar Total Organik Karbon (TOC) Total Organik Karbon pada POME
Total Organik Karbon pada sampel dengan mikroba
PENDAHULUAN
Indonesia merupakan salah satu negara terbesar yang memproduksi dan mengekspor minyak sawit. Luas perkebunan kelapa sawit diperkirakan lebih dari 7 juta hektar pada tahun 2010. Selain itu, Indonesia adalah penghasil minyak kelapa sawit kedua dunia setelah Malaysia dan dalam kurun waktu kurang lebih 15 tahun terakhir produksi minyak kelapa sawit meningkat hampir lima kali lipat dari sebesar 4.8 juta ton minyak sawit mentah (CPO) pada tahun 1996 menjadi 19.8 juta ton pada tahun 2010 (Dirjen Jenderal Perkebunan 2010). Produksi minyak sawit juga menyebabkan meningkatnya produksi limbah cair dari proses pengolahan CPO (crude palm oil). Berikut adalah estimasi produksi limbah Palm Oil Mill Effluent (POME) di Indonesia pada rentang waktu 2009-2013.
Tabel 1 Produksi limbah palm oil mill effluent (POME) di Indonesia (Abdullah Oxygen Demand (BOD) (25000 mg/L) (Ahmad et al. 2003). Limbah POME dapat mempunyai dampak buruk terhadap lingkungan seperti perairan sungai apabila dibuang tanpa diolah terlebih dahulu. Hal ini dikarenakan, dalam memproduksi satu ton minyak kelapa sawit yang mentah membutuhkan air sekitar 5-6 ton dan berakhir dengan sekitar 3-4 ton POME. Limbah POME mengandung senyawa kompleks yang tinggi seperti karbohidrat, protein, lemak, dan mineral. Berdasarkan komposisi kimia limbah kelapa sawit, sebagian besar limbah merupakan senyawa polimer (polisakarida) yang tidak dapat dibuang langsung ke badan air (Wu et al. 2009).
Untuk meningkatkan kualitas air limbah buangan (effluent), perlu diolah menggunakan sistem pengolahan limbah. Beberapa teknologi telah banyak diperkenalkan dalam pengolahan air limbah khususnya limbah minyak kelapa sawit untuk memenuhi standar kualitas dari limbah cair. Sistem kolam merupakan salah satu teknologi yang telah banyak dikenal, namun sistem ini memerlukan biaya dan teknologi yang tinggi, kebutuhan terhadap lahan yang luas, tidak ada nilai tambah bagi lingkungan, dan pada kolam tertutup menghasilkan gas metan dan karbondioksida yang tidak terkendali (Hanum 2008). Oleh karena biaya operasional pengolahan limbah yang sangat mahal, maka diperlukan teknologi pengolahan limbah dengan menghasilkan nilai tambah.
2
gula terfermentasi menjadi asam organik. Proses ini dikenal sebagai fermentasi anaerobik (Drapco 2008). Kondisi anaerobik ini dilakukan karena baik untuk produksi biogas, menyediakan panas, mengurangi biaya operasional dan energi yang digunakan (Murto et al. 2004). Jika nilai redoks potential menurun sampai sekitar -350 mV maka akan terjadi methanogenesis dimana biogas diproduksi. Ada dua proses methanogenesis yaitu asetoklastik dan hidrogenotrofik (Karakashev et al. 2006). Jumlah produksi gas metana ditentukan oleh harmonisasi hidrolisis, fermentasi dan methanogenesis (Ritari et al. 2012). Fermentasi anaerobik akan mengkonversi bahan organik menjadi gas metan yang dilakukan oleh bakteri-bakteri dengan kemampuan sebagai bakteri fermentasi, bakteri asetogenik penghasil hidrogen, bakteri asetogenik pengguna hidrogen, bakteri metanogenik pereduksi CO2, dan bakteri methanogenik asetoclastic.
Bakteri fermentasi mengubah senyawa organik kompleks menjadi senyawa yang lebih sederhana. Bakteri asetogenik penghasil hidrogen mengubah VFA menjadi asam asetat dan CO2/H2. Bakteri metanogenik pereduksi karbondioksida
mengubah CO2/H2 menjadi metan dan bakteri methanogenik asetoclastic
mengubah asetat menjadi gas metan (Demirel & Scherer 2008).
Proses pembentukan gas metan dikontrol oleh mikroba yang tumbuh dan aktif pada sistem aerobik-anaerobik. Kemampuan mengontrol ketiga proses tersebut sangat diperlukan untuk operasional sistem pengolahan limbah POME yang efektif. Mikroba yang digunakan pada penelitian ini adalah ATH 2147 (Mucor sp.), Y34 (Candida sp.), dan campuran ATH 2147+Y34 dengan tambahan sludge. Inokulan mikroba untuk hidrolisis dan fermentasi POME ini efektif untuk meningkatkan produksi metana. Mikroba Flavodon flavus (ATH 2147) dan Candida sp. (Y34) ini termasuk Oleaginous microbes yaitu mikroba penghasil microbial oils atau Single Cell Oils (SCO) (Azocar et al. 2010).
Tujuan penelitian ini adalah optimasi proses hidrolisis dan methanogenesis oleh mikroba penghidrolisis selulosa dan methanogen untuk produksi gas metana yang paling optimal. Penelitian difokuskan kepada optimasi suhu dan jumlah biomassa mikroba yang berperan dalam proses methanogenesis.
Penelitian ini bermanfaat untuk memproduksi gas metan sebagai komposisi biogas melalui proses methanogenesis. Hal ini dilakukan untuk mengefektifkan pengolahan limbah POME dengan mengoptimalkan hidrolisis substrat POME supaya menghasilkan gula reduksi menjadi zat yang terfermentasi.
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilaksananakan mulai bulan Oktober 2013 hingga bulan Maret 2014 di Lembaga Ilmu Pengetahuan Indonesia (LIPI), Pusat Penelitian Biologi bidang Mikrobiologi, Cibinong-Jawa Barat.
Bahan dan Alat
3
solution (biotin, folic acid, pyridoxine-HCl, thiamine-HCl, riboflavin, nicotonic acid, Ca-pantothenate, p-Aminobenzoic acid, vitamin B12 dan air destilasi), trace
element solution, resazurin, cystein-HCl, Na2S2O3, aquades), agar murni, jumlah
mikroba dengan biomassa I (masing-masing substrat POME dengan 2 mL Y34, 2 mL ATH 2147, dan campuran kedua mikroba yaitu 1 mL Y34 dan 1 mL ATH 2147) dan jumlah mikroba dengan biomassa II (masing-masing substrat POME dengan 4 mL Y34, 4 mL ATH 2147, dan campuran kedua mikroba yaitu 2 mL Y34 dan 2 mL ATH 2147).
Alat yang digunakan dalam penelitian ini adalah autoklaf, sentrifus, spektrofotometer, tabung reaksi, tabung Eppendorf, pipet mikro dan tip, botol anaerob, tabung Erlenmeyer, gelas ukur, gelas piala, kapas, plastik, alumunium foil, neraca analitik, penangas air, alat bioshaker, pH meter, inkubator 30° dan 50°C stopwatch, corning, magnet stiren, spatula, tusuk sate, cawan Petri, syring, Kromatografi Gas-Spektrofotometri Massa (GC-FID Shimadzu 14B, Kyoto Japan).
Metode Penelitian
Pengujian Aktivitas Selulotik oleh Mikroba Penghidrolisis Selulosa secara Kualitatif (Pointing 1999)
Pengujian dilakukan dengan memindahkan isolat bakteri yang telah murni ke dalam media CMC padat pada cawan Petri menggunakan tusuk gigi steril. Kemudian bakteri diinkubasi dalam inkubator 30°C selama 3 x 24 jam. Setelah tumbuh dilakukan pengujian zona bening dengan menambahkan larutan congo red 1.5 mL secara merata dan dibiarkan selama 10 menit kemudian dicuci dengan larutan NaCl fisiologis 0.1 N steril dan sisa larutan dibuang. Selanjutnya dilakukan pengukuran indeks selulotik (IS) yang dihasilkan oleh bakteri. Pengukuran dilakukan dengan menggunakan mistar (penggaris). Zona jernih yang terbentuk di sekitar koloni dikalkulasi untuk penentuan indeks selulotik dengan rumus :
Penentuan Aktivitas Enzim Endoglukanase oleh Mikroba Penghidrolisis Selulosa secara Kuantitatif (Miller 1976)
4
Adapun Gt (perlakuan dengan inkubasi), sampel terlebih dahulu diinkubasi pada suhu 30oC selama 60 menit, setelah itu ditambahkan 0.2 mL larutan DNS dan dipanaskan selama 7 menit. Kemudian diukur dengan spektrofotometer pada panjang gelombang 540 nm.
Selanjutnya dari hasil pengukuran tersebut dibuat grafik lalu dicari persamaan garisnya. Persamaan garis yang diperoleh kemudian digunakan untuk menghitung konsentrasi glukosa (ppm).
Persamaan garis : y = ax + b y = absorbansi
x = konsentrasi (ppm)
Konsentrasi glukosa reduksi (ppm) ditentukan dengan rumus :
Dengan demikian, aktivitas enzim selulase yang didapat ditentukan dengan rumus:
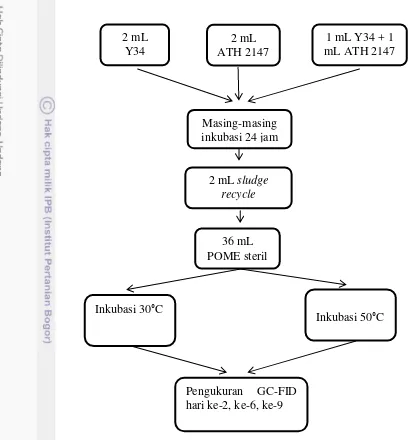
Penentuan Produksi Gas Metan dengan Perbandingan Biomassa pada Penambahan Sludge Primer (Sudiana et al. 2013)
Sampel dengan biomassa I dan biomassa II masing-masing diinkubasi selama 24 jam. Setelah itu, ditambahkan 2 mL sludge primer (sludge sebelum
dilakukan pengukuran gas dengan GC-FID.
Penentuan Produksi Gas Metan dengan Perbandingan Suhu (McHug et al. 2003)
Sampel dengan sludge primer (sludge sebelum perlakuan) setelah dihitung produksi metan pada hari kelima, disentrifus di wadah corning sebanyak 10 mL pada kecepatan 2000 rpm selama 15-20 menit, sehingga didapat supernatan dan pelet. Pelet yang dihasilkan sekitar 2 mL digunakan sebagai sludge pada perlakuan selanjutnya (sludge recycle).
Sampel terdiri 2 mL Y34, 2 mL ATH, dan campuran kedua mikroba yaitu 1 mL Y34 dan 1 mL ATH 2147. Masing-masing diinkubasi selama 24 jam. Setelah itu, sampel dengan masing-masing mikroba ditambahkan 2 mL sludge recycle lalu dipindahkan ke botol anaerob untuk kemudian dimasukkan POME steril sebanyak 20 mL pada masing-masing sampel. Sampel diinkubasi pada suhu 30°C. Perlakuan yang sama dilakukan juga pada inkubasi suhu 50°C. Pada hari kedua, keenam, dan kesembilan dilakukan pengukuran gas dengan GC-FID.
Total Gula Reduksi =Absorbansi saat t (Gt)-Absorbansi saat 0 (G0)
X =
5 Penentuan Produksi Gas Metan dengan Perbandingan Biomassa Pada Penambahan Sludge Recycle (Sudiana et al. 2013)
Sampel dengan biomassa I dan biomassa II masing-masing diinkubasi selama 24 jam. Setelah itu, masing-masing sampel ditambahkan 2 mL sludge recycle (sludge sesudah perlakuan) pada biomassa I dan 4 mL sludge recycle pada biomassa II lalu dipindahkan ke botol anaerob untuk kemudian dimasukkan POME steril sebanyak 20 mL pada masing-masing sampel. Sampel diinkubasi pada suhu 30°C. Pada hari kedua dan keenam dilakukan analisis konsentrasi gas metan (ppm) dan hari kesembilan dilakukan analisis konsentrasi gas metan terhadap total gas dalam sampel (%) melalui pengukuran dengan GC-FID.
Pengukuran Gas Metan dengan GC-FID (Breysse dan Lees 2003)
Gas yang dihasilkan oleh sampel diinjeksi sebanyak 100µl, lalu gas metan yang dihasilkan terdeteksi pada waktu retensi 0.3 – 0.4 pada alat.
Isolasi Mikrobia Methanogen (FFJ 2002)
Larutan 2 mL CH3COONa dimasukkan ke dalam botol anaerob. Sampel
dengan mikroba yang menghasilkan gas metan tertinggi sebanyak 1 mL dimasukkan ke dalam CH3COONa tersebut dengan cara diinjeksi dari tutup
tabung. Setelah itu, diinkubasi pada 30°C dan diukur gas metan pada hari ke-5. Selanjutnya, sampel tersebut diambil sebanyak 1 mL dan ditambahkan dengan 20 mL medium kemudian dimasukkan ke dalam botol anaerob dan gas yang ada di dalam dibuang dengan menggunakan syringe lalu ditukar dengan gas CO2 dan H2
lalu diinkubasi di 30°C. Pada hari ke-7 dilakukan pengukuran gas yang terbentuk dengan GC-FID.
Penurunan Total Organik Karbon (TOC) (Suligundi 2013)
Sampel pada perlakuan perbandingan suhu, masing-masing dibuat menjadi konsentrasi 1000 ppm dengan 5x ulangan. Sampel tersebut sebanyak 500 µl dimasukkan ke dalam tabung reaksi lalu ditambahkan 50 µl HCl dan dipanaskan selama 2 jam. Setelah itu ditambahkan 50 µl fenol dan 250 µl H2SO4 dan
dipanaskan kembali selama 1 jam. Kemudian diukur dengan spektrofotometer pada panjang gelombang 490 nm. Sebelum dilakukan pengukuran, kurva standar dibuat terlebih dahulu dengan konsentrasi 50,100, 200, 300, 400, dan 500 ppm, sehingga diperoleh persamaan garis y=0.1231x-0.0306, r=0.99 pada Gambar 12.
Keterangan :
TOC awal: pengukuran pada limbah POME tanpa perlakuan penambahan mikroba
TOC akhir: pengukuran pada limbah POME pada perlakuan penambahan mikroba dengan perbandingan suhu
6
HASIL DAN PEMBAHASAN
Hasil
Aktivitas Selulotik oleh Mikroba Penghidrolisis Selulosa secara Kualitatif Mikroba yang memiliki kemampuan selulotik ditandai dengan pertumbuhan di medium CMC dan adanya zona bening pada sekitar koloni setelah diteteskan dengan congo red. Dari hasil pengujian, mikroba ATH 2147 dan Y34 menghasilkan zona bening (Gambar 1). Berdasarkan hasil pengamatan, Y34 memiliki zona bening terbesar dibandingkan dengan ATH 2147, namun indeks selulotik (IS) tertinggi didapatkan oleh ATH 2147 (Tabel 1).
Tabel 2 Indeks selulotik mikroba pada medium CMC
Mikroba Diameter koloni (cm) Diameter zona
bening (cm) Indeks selulotik
Y34 3.00 4.25 1.42a
ATH 2.75 4.50 1.63b
* Huruf yang berbeda pada tabel di kolom yang sama menunjukkan berbeda nyata (P < 0.05)
(a) (b)
Gambar 1 Aktivitas selulotik pada mikroba dengan pembentukkan zona bening (a) Y34 (b) ATH 2147
Aktivitas Enzim Selulase oleh Mikroba Penghidrolisis Selulosa secara Kuantitatif
7
* Huruf-huruf pada diagram batang menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
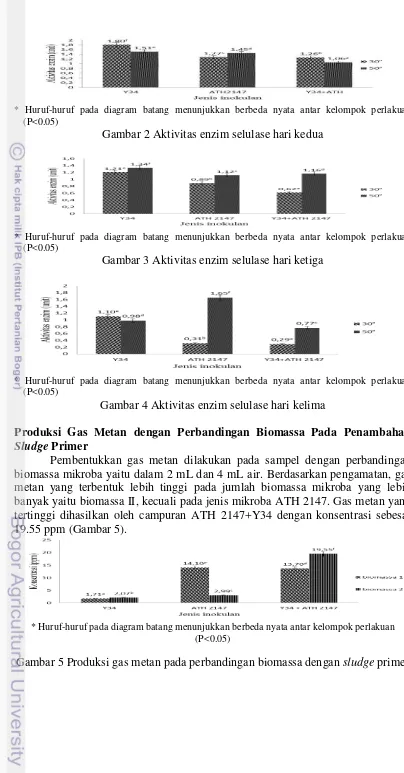
Gambar 2 Aktivitas enzim selulase hari kedua
* Huruf-huruf pada diagram batang menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
Gambar 3 Aktivitas enzim selulase hari ketiga
* Huruf-huruf pada diagram batang menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
Gambar 4 Aktivitas enzim selulase hari kelima
Produksi Gas Metan dengan Perbandingan Biomassa Pada Penambahan Sludge Primer
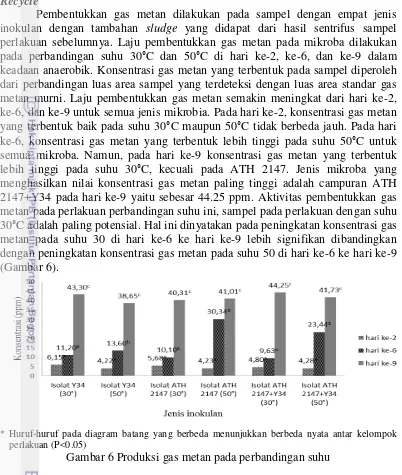
Pembentukkan gas metan dilakukan pada sampel dengan perbandingan biomassa mikroba yaitu dalam 2 mL dan 4 mL air. Berdasarkan pengamatan, gas metan yang terbentuk lebih tinggi pada jumlah biomassa mikroba yang lebih banyak yaitu biomassa II, kecuali pada jenis mikroba ATH 2147. Gas metan yang tertinggi dihasilkan oleh campuran ATH 2147+Y34 dengan konsentrasi sebesar 19.55 ppm (Gambar 5).
* Huruf-huruf pada diagram batang menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
8
Produksi Gas Metan pada Perbandingan Suhu dengan Penambahan Sludge Recycle
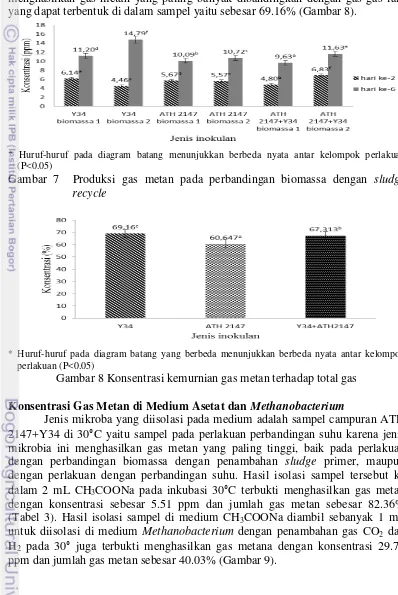
Pembentukkan gas metan dilakukan pada sampel dengan empat jenis inokulan dengan tambahan sludge yang didapat dari hasil sentrifus sampel perlakuan sebelumnya. Laju pembentukkan gas metan pada mikroba dilakukan pada perbandingan suhu 30°C dan 50°C di hari ke-2, ke-6, dan ke-9 dalam keadaan anaerobik. Konsentrasi gas metan yang terbentuk pada sampel diperoleh dari perbandingan luas area sampel yang terdeteksi dengan luas area standar gas metan murni. Laju pembentukkan gas metan semakin meningkat dari hari ke-2, ke-6, dan ke-9 untuk semua jenis mikrobia. Pada hari ke-2, konsentrasi gas metan yang terbentuk baik pada suhu 30°C maupun 50°C tidak berbeda jauh. Pada hari ke-6, konsentrasi gas metan yang terbentuk lebih tinggi pada suhu 50°C untuk semua mikroba. Namun, pada hari ke-9 konsentrasi gas metan yang terbentuk lebih tinggi pada suhu 30°C, kecuali pada ATH 2147. Jenis mikroba yang menghasilkan nilai konsentrasi gas metan paling tinggi adalah campuran ATH 2147+Y34 pada hari ke-9 yaitu sebesar 44.25 ppm. Aktivitas pembentukkan gas metan pada perlakuan perbandingan suhu ini, sampel pada perlakuan dengan suhu 30°C adalah paling potensial. Hal ini dinyatakan pada peningkatan konsentrasi gas metan pada suhu 30 di hari ke-6 ke hari ke-9 lebih signifikan dibandingkan dengan peningkatan konsentrasi gas metan pada suhu 50 di hari ke-6 ke hari ke-9 (Gambar 6).
* Huruf-huruf pada diagram batang yang berbeda menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
Gambar 6 Produksi gas metan pada perbandingan suhu
Produksi Gas Metan dengan Perbandingan Biomassa Pada Penambahan Sludge Recycle
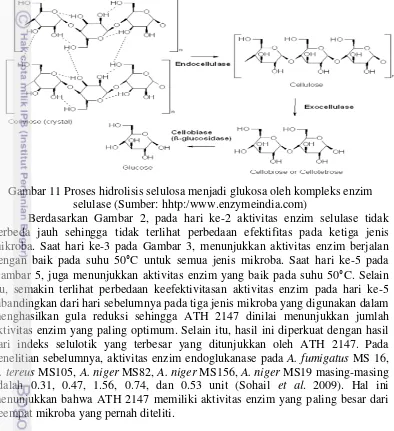
9 Y34 adalah mikroba yang paling tinggi menghasilkan gas metan pada hari ke-6 yaitu 14.79 ppm (Gambar 7).
Pada hari ke-9 dilakukan analisis konsentrasi kemurnian gas metan yang paling tinggi pada ATH 2147, Y34, dan campuran ATH 2147+Y34 dengan membandingkan luas area sampel dengan total area sampel tersebut. Berdasarkan perhitungan, mikroba Y34 memiliki peran yang paling baik dalam proses menghasilkan gas metan yang paling banyak dibandingkan dengan gas-gas lain yang dapat terbentuk di dalam sampel yaitu sebesar 69.16% (Gambar 8).
* Huruf-huruf pada diagram batang menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
Gambar 7 Produksi gas metan pada perbandingan biomassa dengan sludge recycle
* Huruf-huruf pada diagram batang yang berbeda menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
Gambar 8 Konsentrasi kemurnian gas metan terhadap total gas Konsentrasi Gas Metan di Medium Asetat dan Methanobacterium
Jenis mikroba yang diisolasi pada medium adalah sampel campuran ATH 2147+Y34 di 30°C yaitu sampel pada perlakuan perbandingan suhu karena jenis mikrobia ini menghasilkan gas metan yang paling tinggi, baik pada perlakuan dengan perbandingan biomassa dengan penambahan sludge primer, maupun dengan perlakuan dengan perbandingan suhu. Hasil isolasi sampel tersebut ke dalam 2 mL CH3COONa pada inkubasi 30°C terbukti menghasilkan gas metan
dengan konsentrasi sebesar 5.51 ppm dan jumlah gas metan sebesar 82.36% (Tabel 3). Hasil isolasi sampel di medium CH3COONa diambil sebanyak 1 mL
untuk diisolasi di medium Methanobacterium dengan penambahan gas CO2 dan
H2 pada 30° juga terbukti menghasilkan gas metana dengan konsentrasi 29.76
10
Tabel 3 Konsentrasi gas metan pada mikroba campuran Y34+ATH 2147 di medium metan
Perlakuan Area
sampel
Area standar
Total area Konsentrasi
(ppm)
Konsentrasi (%)
1. Medium CH3COONa 1559 2826143 1893 5.51 82.36
2.Medium
methanobacterium :
7934 2665849 19821 29.76 40.03
* Huruf-huruf pada diagram batang yang berbeda menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
Gambar 9 Konsentrasi gas metan pada isolasi campuran ATH 2147+Y34 di medium yang digunakan
Penurunan Total Organik Karbon (TOC)
Kadar TOC (Total Organik Karbon) diukur dengan menggunakan larutan HCl, fenol 5%, dan H2SO4 pekat. Berdasarkan penentuan total organik karbon
(TOC) pada sampel dengan perbandingan suhu, perlakuan pada suhu 30°C memiliki penurunan total karbon POME awal terhadap POME akhir yang paling baik dibandingkan dengan suhu 50°C, kecuali pada mikroba ATH 2147 yang memiliki nilai perbandingan penurunan total karbon yang tidak jauh berbeda antara dua suhu yaitu 36.75% dan 37.97%. Campuran Y34+ATH 2147 pada suhu 30°C memiliki jumlah penurunan total karbon yang paling tinggi yaitu sebesar 72.3% (Gambar 10).
* Huruf-huruf pada diagram batang menunjukkan berbeda nyata antar kelompok perlakuan (P<0.05)
11
Pembahasan
Aktivitas Selulotik oleh Mikroba Penghidrolisis Selulosa secara Kualitatif Aktivitas selulotik oleh mikroba secara kualitatif menunjukkan aktivitas enzim selulase pada mikroba yang dilakukan pada suhu 30oC dan 50oC di hari ke-2, ke-3, dan ke-5. Perlakuan dengan kondisi suhu yang berbeda tersebut serta lama inkubasi pengukuran ditentukan pada penelitian sebelumnya. Pada penelitian sebelumnya, dalam kondisi suhu 30oC dan 50oC mikroba dapat menghasilkan gula reduksi yang optimum, begitu pula pada lama inkubasi yang dilakukan sangat berpengaruh pada proses starvasi, semakin lama inkubasi semakin terlihat perbedaan keefektivitasan tiga jenis mikroba yang digunakan dalam menghasilkan gula reduksi (Eliezabeth L 2013).
Mikroorganisme selulotik memainkan peranan penting dalam mendaur-ulang selulosa (Tomei et al. 2009) dan memecahnya menjadi monomer-monomer glukosa. Mikroorganisme ini penting dalam proses fermentasi terutama dalam penghancuran limbah selulosa secara anaerob, sehingga menghasilkan lignoselulosa dengan presentase tinggi (Himmel et al. 2007). Aktivitas hidrolisis ditentukan melalui kemampuan selulotik pada mikroba ATH 2147 dan Y34 yang ditumbuhkan pada medium CMC dan menghasilkan nilai indeks selulotik yang berbeda-beda yang dipengaruhi oleh sifat genetis mikrobia dalam mengadsorbsi CMC (Carboxymethyl Cellulose).
Indeks selulotik yang dihasilkan oleh ATH 2147 adalah paling besar, hal ini menunjukkan tingginya aktivitas dalam menggunakan nutrien untuk kebutuhan sel pada mikroba tersebut. Hasil degradasi medium oleh enzim selulase terlihat sebagai zona bening setelah ditambahkan pewarna Congo Red dan pembilasan dengan NaCl 1% untuk menghilangkan warna, sedangkan medium agar yang masih mengandung selulosa terlihat berwarna merah karena adanya ikatan dengan pewarna Congo Red. Prinsip pada perlakuan ini adalah enzim selulase yang dihasilkan mikroba akan diubah menjadi glukosa dari hasil pemecahan CMC sehingga sel mengadsorbsi glukosa sebagai sumber karbon dalam pertumbuhan sel dan sumber energi. Penelitian sebelumnya telah menguji aktivitas enzim selulosa dari Aspergillus tereus memiliki indeks selulotik dengan medium CMC sebesar 1.32 (Sohail et al. 2009). Ini menunjukkan ATH 2147 memiliki aktivitas enzim selulosa yang tinggi.
Aktivitas Enzim Selulase oleh Mikroba Penghidrolisis Selulosa secara Kuantitatif
12
menghidrolisis turunan selulosa seperti Carboxymethyl Celullose (CMC),
selotriosa dan selopentosa. Eksoglukanase bekerja memecah ikatan β -1,4-glukosida pada molekul selulosa dari ujung rantai polimer dengan membebaskan D-glukosa dan D-selobiosa. Sementara, enzim endoglukanase akan memecah molekul selulosa secara acak (dari dalam atau tengah rantai polimer) menjadi oligosakarida (termasuk selobiosa) dan glukosa (Lynd et al. 2002). Enzim β -glukosidase berfungsi menguraikan selobiosa menjadi glukosa.
Gambar 11 Proses hidrolisis selulosa menjadi glukosa oleh kompleks enzim selulase (Sumber: hhtp:/www.enzymeindia.com)
Berdasarkan Gambar 2, pada hari ke-2 aktivitas enzim selulase tidak berbeda jauh sehingga tidak terlihat perbedaan efektifitas pada ketiga jenis mikroba. Saat hari ke-3 pada Gambar 3, menunjukkan aktivitas enzim berjalan dengan baik pada suhu 50°C untuk semua jenis mikroba. Saat hari ke-5 pada Gambar 5, juga menunjukkan aktivitas enzim yang baik pada suhu 50°C. Selain itu, semakin terlihat perbedaan keefektivitasan aktivitas enzim pada hari ke-5 dibandingkan dari hari sebelumnya pada tiga jenis mikroba yang digunakan dalam menghasilkan gula reduksi sehingga ATH 2147 dinilai menunjukkan jumlah aktivitas enzim yang paling optimum. Selain itu, hasil ini diperkuat dengan hasil dari indeks selulotik yang terbesar yang ditunjukkan oleh ATH 2147. Pada penelitian sebelumnya, aktivitas enzim endoglukanase pada A. fumigatus MS 16, A. tereus MS105, A. niger MS82, A. niger MS156, A. niger MS19 masing-masing adalah 0.31, 0.47, 1.56, 0.74, dan 0.53 unit (Sohail et al. 2009). Hal ini menunjukkan bahwa ATH 2147 memiliki aktivitas enzim yang paling besar dari keempat mikroba yang pernah diteliti.
Produksi Gas Metan dengan Perbandingan Biomassa Pada Penambahan Sludge Primer
13 fase gerak (gas), sample injector, kolom, detektor, dan recording system (Breysse dan Lees 2003).
Pembentukkan gas metana dilakukan dengan melihat pengaruh perbandingan jumlah biomassa yaitu jumlah masing-masing mikroba dalam air untuk menguraikan bahan organik menjadi gas metan dalam keadaan anaerob. Semakin banyak jumlah biomassa mikroba untuk menghidrolisis substrat organik yang ada pada limbah POME, maka semakin banyak juga gula sederhana dan senyawa-senyawa lainnya yang diperlukan untuk proses pembentukkan gas metan. Dalam proses pembentukkan gas metan dari substrat organik atau biometanasi, degradasi polisakarida yang ada pada substrat diubah untuk memproduksi gas metana dan diperlukan bakteri dengan kemampuan fermentasi (bacteria fermentative), asetogenesis (asetogenic bacteria), dan metanogenesis (metanogens bacteria) (FFJ 2002). Berdasarkan pengamatan pada perlakuan sampel dengan penambahan sludge primer (sludge yang belum diberikan perlakuan percobaan untuk menghasilkan gas metan) yang terlihat pada Gambar 5, konsentrasi gas metan yang diproduksi cenderung paling tinggi pada biomassa II. Peran jumlah biomassa mikroba yang lebih banyak mempengaruhi proses pembentukkan gas metan karena pertumbuhan mikroba dinilai dapat mengatasi mengatasi mikroba yang mungkin sudah tidak aktif dalam proses produksi gas metan di dalam sampel (Siregar 2005).
Selain itu, campuran ATH 2147+Y34 memiliki peran dalam menghasilkan produksi metan yang paling tinggi dari semua jenis inokulan yaitu sebesar 19.55 ppm dengan pengambilan sampel gas menggunakan jarum syringe sebanyak 100 µL. Penelitian terdahulu dihasilkan gas metan pada tandan kosong kelapa sawit tanpa perlakuan sebesar 20 ppm dengan pengambilan sampel gas menggunakan jarum syringe sebanyak 250 µL (Febrina et al. 2013). Saat ini konsentrasi gas metana di atmosfer 1.7 ppm per volume, lebih tinggi pada massa pra-industri 0.7 ppm. Hal ini membuktikan bahwa mikroba campuran ATH 2147+Y34 berpotensi menghasilkan konsentrasi gas metan yang besar di dalam POME dibandingkan dengan gas metana yang dihasilkan oleh tandan kosong kelapa sawit tanpa perlakuan.
Produksi Gas Metan pada Perbandingan Suhu dengan Penambahan Sludge Recycle
Aktivitas methanogenesis dengan pengukuran produksi gas metana dilakukan pada suhu 30oC dan 50oC di hari ke-2, ke-6, dan ke-9. Perlakuan dengan kondisi suhu yang berbeda tersebut untuk membuktikan efektifitas produksi gas metan dalam keadaan mesofilik (30oC) dan termofilik (50oC ) serta lama inkubasi pengukuran ditentukan pada penelitian sebelumnya. Pada penelitian sebelumnya, kinetika produksi gas tidak cukup jika diamati hanya pada 24 jam awal inkubasi, melainkan perlu waktu untuk mengevaluasi kinetika produksi gas pada pengamatan 72 jam hingga 96 jam (Kamalak et al. 2004). Oleh karena itu, pengukuran produksi gas metan ini dilakukan pada tiga kali pengukuran yaitu hari ke-2, ke-6, dan ke-9 untuk menilai laju produksi gas metan.
30-14
40°C (McMahon et al. 2004). Pada suatu penelitian juga tentang desain sederhana reaktor biogas sampah organik, berada dalam kondisi optimum menghasilkan gas metan pada suhu 36°C (Paulus et al. 2009). Suhu optimum pertumbuhan bakteri anaerobik berkisar antara 25-45°C (mesofilik), sedangkan suhu yang baik untuk proses fermentasi anaerobik berkisar antara 30-55°C (McHug et al. 2003). Namun, sebagian bakteri ada juga yang mampu untuk memproduksi metana pada tingkat suhu yang sangat rendah (0.6-1.2°C). Pada umumnya suhu terendah dimana mikroorganisme tumbuh adalah 11°C, dibawah -25°C aktivitas enzim akan terhenti (Deublein & Steinhauser 2008).
Selain itu, jenis mikroba yang menghasilkan nilai konsentrasi gas metan paling tinggi adalah campuran ATH 2147+Y34 pada hari ke-9 yaitu sebesar 44.25 ppm. Peran mikroba campuran ATH 2147+Y34 memproduksi metan paling tinggi dibandingkan dengan inokulan tunggal. Peran campuran mikroba atau dikenal dengan konsorsia, memiliki kemampuan yang lebih baik dibandingkan dengan mikrobia tunggal. Dalam suatu penelitian, ditunjukkan bahwa formulasi konsorsia mikrobia Rhizosfer dapat meningkatkan pertumbuhan dan produktivitas tanaman (Mulyana dan Sudrajat 2012). Peran tersebut menunjukkan hubungan antara ATH 2147 dan Y34 yang bersifat tidak antagonis. Keduanya mampu tumbuh dengan dibuktikan adanya zona bening yang terbentuk pada pengujian kemampuan selulotik di medium CMC. Meskipun keduanya berkompetisi dalam mendapatkan nutrien tetapi keduanya tidak mengeluarkan metabolit untuk menghambat pertumbuhan yang lain. Campuran ATH 2147 dan Y34 dapat tumbuh bersama-sama karena ATH 2147 berperan dalam menghidrolisis POME menjadi senyawa sederhana yang ditunjukkan pada aktivitas selulase untuk menghasilkan gula reduksi paling efektif dibandingkan dengan mikroba yang lainnya, kemudian Y34 berperan dalam proses fermentasi untuk mengasilkan gas metana.
Produksi Gas Metana dengan Perbandingan Biomassa Pada Penambahan Sludge Recycle
15 secara anaerobik karena sludge bermanfaat dalam proses konversi mikrobiologi dan stabilisasi proses pembentukkan gas metan (Oz et al. 2012)
Dalam menghasilkan kemurnian gas metan, peran Y34 adalah paling tinggi dalam menghasilkan kemurnian gas metan sebesar 69.16% dibandingan dengan komponen-komponen gas lain yang dapat terbentuk di dalam sampel. Pada suatu penelitian terhadap usia landfill yakni sistem pengolahan sampah dengan hanya membuang/menimbun sampah di suatu tempat tanpa ada perlakuan khusus selama 6-12 bulan dapat menghasilkan gas metan sebanyak 29% dari total gas yang dihasilkan (KPU 2009). Hal ini menunjukkan ketiga jenis inokulan pada sampel menghasilkan gas metan yang paling tinggi dibandingkan dengan limbah organik tanpa perlakuan, terutama Y34 yang memiliki peran paling baik untuk menghasilkan kemurnian gas metana. Beberapa penelitian terdahulu, komponen biogas yang ada pada sampah organik menghasilkan gas metan sebesar 55% (Paulus et al. 2009), pada kotoran sapi sebesar 65.7% serta pada campuran kotoran ternak dan sisa pertanian sebesar 54-70% (Simamora et al. 2006).
Konsentrasi Gas Metan di Medium Metanogen
Isolasi mikroba di medium metanogen dilakukan untuk menguji kemampuan campuran mikroba ATH 2147+Y34 dalam peranannya mengubah asetat (CH3COONa) menjadi metan (metanogenik asetoclastic) serta untuk
mengubah CO2/H2 sebagai formula gas yang diberikan saat isolasi di
methanobacterium menjadi metan (hidrogenotropik) dalam proses methanogenesis (Lee et al. 2010). Formula reaksi asetoklastik dan hidrogenotropik sebagai berikut:
CH3COONa CH4 + CO2
CO2 + 4H2 CH4 + 2H2O
Data pada Tabel 3, menunjukkan hasil yang positif bahwa pada sampel dengan campuran ATH 2147+Y34 yang diuji berpotensi dalam metanogenik asetoclastic dengan konsentrasi gas metan yang dihasilkan 5.516 ppm dan 82.36% gas metan serta sebagai metanogenik pereduksi CO2 dengan konsentrasi
gas metan 29.76 ppm dan 40.03% gas metan. Dalam pengolahan air limbah, 70% metan dihasilkan dari asetat dan 30% dihasilkan dari hidrogen dan karbondioksida (FFJ 2002). Dalam medium methanobacterium untuk mengisolasi campuran ATH 2147+Y34, medium tersebut mengandung buffer NaHCO3 yang bertujuan untuk
menghindari pembentukkan asam yang terlalu cepat yang dapat menyebabkan bakteri methanogenesis mati karena tidak tahan dengan suasana asam. Selain itu juga mengandung NH4Cl, yeast ekstrak, dan trace element. Yeast ekstrak
berfungsi sebagai sumber vitamin B yang dapat membantu pertumbuhan bakteri, NH4Cl merupakan sumber N sebagai nutrisi bagi bakteri, dan trace element
sebagai nutrisi esensial pada mikroorganisme. Dalam kebutuhan mikroorganisme dalam methanogenesis, kurangnya trace metal dalam proses anaerobik menyebabkan berkurangnya konversi propionat dan senyawa VFA lainnya menjadi metan sehingga menghambat proses anaerobik karena menumpuknya VFA dalam sistem (Osuna et al 2003).
Penurunan Total Organik Karbon (TOC)
16
paling potensial dalam penururan total karbon pada limbah POME awal terhadap limbah POME dengan kandungan COD yang tinggi yang telah dimanfaatkan untuk menghasilkan gas metan. Penurunan total karbon terbukti paling tinggi oleh sampel dengan inokulan ATH 2147+Y34 dibandingkan dengan inokulan tunggal Y34 atau ATH 2147. Kandungan total organik karbon (TOC) merupakan salah satu parameter penting bagi kriteria kualitas air. Total karbon organik terdiri atas bahan organik terlarut dan partikulat dengan perbandingan 10:1 (Effendi 2003). Pengukuran TOC pada penelitian ini, adalah modifikasi pada pengukuran TOC secara langsung, Direct TOC atau dikenal Non Purgable Organic Carbon (NPOC) ini dengan prinsip senyawa asam yang diperlukan untuk menghilangkan karbon IC (Inorganic Carbon). IC akan dioksidasi melalui proses pemanasan kemudian dengan spektrofotometer pada panjang gelombang 490 nm sisa karbon akan terbaca (Suligundi 2013). Pengukuran TOC serta pendeteksian karbon yang ada pada gas metana dapat dilakukan dengan menggunakan flame ionization detector [J.U.M Engineering 2009].
SIMPULAN DAN SARAN
Simpulan
Pengujian aktivitas hidrolisis Palm Oill Mill Effluent (POME) untuk menghasilkan gas metan dalam proses aerobik, optimum pada suhu 50°C yang ditunjukkan oleh keefektivitasan enzim selulase pada hari ke-5 untuk masing-masing sampel dengan aktivitas tertinggi pada ATH 2147 di hari tersebut sebesar 1.65 unit. Selanjutnya hasil dari proses hidrolisis mempengaruhi aktivitas methanogenesis secara anaerobik pada 30°C. Pemanfaatan mikroba penghidrolisis selulosa untuk produksi gas metana dengan bahan dasar POME dipengaruhi oleh biomassa yang lebih banyak dan inkubasi pada 30°C. Inokulan campuran ATH 2147 dan Y34 memiliki kemampuan dalam produksi konsentrasi gas metan yang paling tinggi pada perlakuan perbandingan biomassa dengan penambahan sludge primer yaitu 19.55 ppm dan perbandingan suhu yaitu 44.25 ppm pada hari ke-9. Selain itu, inokulan campuran ini dibuktikan memiliki kemampuan dalam reaksi metanogenik asetoclastic dengan konsentrasi gas metan 5.51 ppm dan 82.36% total gas metan serta dalam reaksi hidrogenotropik dengan konsentrasi gas metan 29.76 ppm dan 40.03% total gas metan. Dengan demikian, pemanfaatan mikroba Y34 dan ATH 2147 dapat digunakan dalam pembuatan biogas pada limbah POME.
Saran
Perlu dilakukan pengukuran derajat keasaman pH terbaik dalam produksi gas metan dalam biogas serta pengukuran konsentrasi sulfur yang dapat ditemukan pada suatu limbah dalam jumlah yang besar, karena H2S dapat
17
DAFTAR PUSTAKA
[FFJ] Forestry, and Fishieries, Japan, with the help of Asia Biomass Association. 2002. Handbook of Corynrbacterium glutamicum. Asian Biomass Handbook. 27(5): 135-161.
[J.U.M Engineering]. 2009. Portable high temperature total organic carbon and methane carbon FID-analyser model 3-900. Germany: Product Brochure FID Model 3-900.
Abdullah, N. and F. Sulaiman (2013). The Oil Palm Wastes in Malaysia, Biomass Now - SustainableGrowth and Use, Miodrag Darko Matovic (Ed.), ISBN:
978-953-51-1105-4, InTech, DOI:10.5772/55302. Available from:
http://www.intechopen.com/books/biomass-now-sustainable-growth-and-use/the-oil-palm-wastes-in-malaysia.
Ahmad A, Ismail S, Bhatia S. 2003. Water Recyling from Palm Oil Mill Effluent (POME) Using Mem Tech. Desalination. 157:87-95.
Azocar L, Ciudad G, Heipieper H, and Navia R. 2010. Biotechnological processes for biodiesel production using alternative oils, Appl. Microbiol. Biotechnol. 88, 621-636.
Demirel B & Scherer P. 2008. The roles of acetotrophic and hydrogenotropic methanogens during anaerobic conversion of biomass to methane. Rev in Envi Sci and Biotech. Vol 7 pp. 173-190.
Deublein D and Steinhauser A. 2008. Biogas From Waste and Renewable Resources, An Introduction. German: WILEY-VCH Verlag GmbH & Co. KgaA, Weinheim.
Dirjen Jenderal Perkebunan. 2010. Kementrian Pertanian. Jakarta.
Drapcho C, Nghiem J, Walker T. 2008. Biofuels Engineering Process Technology. United States of America. Mc. Graw-Hill Inc.
Effendi H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Yogyakarta: Kanisius.
Eliezabeth L. 2013. Penentuan Kandungan Lipid dan Gula Reduksi dari Substrat POME Melalui Hidrolisis Oleh Kapang Mucor sp. [Laporan Praktik Lapang]. Bogor: FMIPA, Institut Pertanian Bogor.
Febrina W, Soerawidjaja T, Purwadi R, Horvath I. 2013. Produksi gas metan dari tandan kosong kelapa sawit. Departement of Biotechnology University of Boras, Sweden, siap terbit.
Gayang. 2013. Konversi Lignoselulosa Tandan Kosong Kelapa Sawit Menjadi Gula Reduksi Menggunakan Enzim Xilanase dan Selulase Komersial. [Skripsi]. Bogor: Departemen Biokimia, Institut Pertanian Bogor.
Hanum F. 2008. Pengolahan limbah cair pabrik kelapa sawit dari unit deoiling ponds menggunakan membran mikrofiltrasi. [tesis]. Medan: Program Studi Teknik Kimia, Universitas Sumatera Utara, Medan.
18
Himmel M, Ding S, Johnson D, Adney W, Nimlos M, Brady J, and Foust T. 2007. Biomass recalcitrance: Engineering plants and enzymes for biofuels production. Science. Vol 315 pp. 804-807.
Jiang et al. 2006. Stable Isotope Evidence for Methane Seeps in Neoproterozoic Postglacial Cap Carbonates. Nature 426, 822-826.
Kamara, Dian Siti, Saadah Diana Rachman, dan Shabarni Gaffar. 2007. Degradasi Enzimatik Selulosa dari pohon pisang untuk produksi glukosa dengan bantuan aktivitas selulolitik Trichoderma viride. Laporan Penelitian Dasar, Univesitas Padjadjaran.
Karakashev D, Batstone D, Trably E, and Angelidaki I. 2006. Acetate oxidation is the dominant methanogenic pathway from acetate in the absence of Methanosaetaceae. App and Environ Microl. Vol 72 pp. 5138-5141
Kementrian Pekerjaan Umum. 2009. Pedoman Operasi dan Pemeliharaan Prasarana dan Sarana Persampahan. Direktorat Jenderal Cipta Karya.
Lee C, Kim J, Hwang K, Shin S, O’Flaherty V, and Hwang S. 2010. Quantitative
and qualitative transitions of methanogen community structure during the batch anaerobic digestion of cheese processing wastewater. App and Environ Microl. Vol 87 pp. 1963-1973.
McHug S, Carton M, Mahony T, and O’Flaherry V. 2003. Methanogenic
population structure in a variety of anaerobic bioreactors. FEMS Microbiology Letters. Vol 219 pp. 297-304.
McMahon, Zheng D, Stams A, Mackie R, and Raskin L. 2004. Microbial population dynamic during strat up and overload condition of anaerobic digester treating municipal solid waste and sewage sludge. Biotech and Bioeng. Vol 87 pp.823-834.
Miller, G. L. 1976. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Annalytic Chemistry. 31 : 426-428.
Mulyana N, Sudrajat D. 2012. Formulasi inokulan konsorsia mikroba rhizosfer berbasis kompos teriradiasi. Jurnal Penelitian. ISSN 0216-3128.
Murto M, Bjo¨rnsson L, and Mattiasson B. 2004. Impact of food industrial waste on anaerobic codigestion of sewage sludge and pig manure. Jou of Enviro Man. 70(2):101–107.
Osuna J, Garnacho M, Ortiz L, Jimenez, Barrero A, Garcia G, Bernabeu, and Gallego L. 2003. Teratment of multidrug-resistant Acinetobacter baumanni ventilator-associated pneumonia (VAP) with intravenous colistin: a
comparison with imipenem-susceptible VaP. Clin. Infect. Dis. 36:1111-1118. Oz N, Ince O, Turker G, and Ince B. 2012. Effect of seed sludge microbial
community and activity on the perfomance of anaerobic reactors during the start up period. World Jou of Micro and Biotec. Vol 28 pp. 637-647.
Paulus L, Dewang S, Pembonan, Wahab AW. 2009. Reaktor biogas sampah organik untuk menghasilkan gas metana. Jurnal Sains 2:99-104.
Ramanathan V, Cicerone H, Singh, and Kiehl. 1985. Trace gas trends and their potential role in climate change. J. Geophys. Res. 90: 5547-5566.
19 Seftian D, Antonius F, Faisal. 2012. Pembuatan etanol dari kulit pisang menggunakan metode hidrolisis enzimatik dan fermentasi. Jurnal Teknik Kimia. 18 (1): 10-16.
Simamora S, Slaundik, Wahyuni S, Surajudin. 2006. Membuat Biogas Pengganti Bahan Bakar Minyak Dan Gas dari Kotoran Ternak. Jakarta: Agro Media Pustaka.
Siregar S. 2005. Instalasi Pengolahan Air Limbah. Yogyakarta: Kanisius.
Sohail & Sherwani. 2009. Distribution of hydrolytic enzymes among native Fungi: Aspergillus. The Pre-Dominant Genus of Hydrolase Producer. Pakistan Journal Botani. 41 (5): 2567-2582.
Sudiana, Kanti A, Octavia S, Helbert. 2013. Hidrolyses of POME with fungi and yeast for methane production. Jou of Ap Sci in En San. ISSN 0126-2807. Suligundi. 2013. Penurunan kadar COD (Chemical Oxigen Demand) pada limbah
cair karet dengan menggunakan reaktor biosand filter yang dilanjutkan dengan reaktor activated carbon. Jurnal Teknik Sipil Untan. Vol 13 no 1: 29-44.
Tiemann T, Avila P, Ramirez G, Lascano C, Kreuzer M, and Hess H. 2008. In vitro ruminal fermentation of tanniniferous tropical plants: plant-spesific tannin effects and counteracting efficiency of PEG. Anim. Feed Sci. Technol. 146: 222-241.
Tomei M, Braguglia C, Cento G, and Maninni G. 2009. Modeling of anaerobic digestion of sludge. Cri Rev in Enviro Sci and Tech. Vol 39 pp. 1003-1051. Wu T, Mohammed A, Jamin J, Anuar N. 2009 A holistic approach to managing
20
21 Lampiran 1 Alur Penelitian
30°C
Pengujian Kuantitatif : Aktivitas Endoglukanase
Jumlah Biomassa 1x (Biomassa I)
Jumlah Biomassa 2x (Biomassa II) Pengujian
Kemampuan Methanogenesis Pengujian Kualitatif : Mikrobia Penghidrolisis
Selulosa (Zona Bening)
50°C
Jumlah Biomassa 1x (Biomassa I)
22
Lampiran 2
Perbedaan Biomassa dengan Sludge primer
Biomassa I
2 mL Y34
2 mL ATH 2147
1 mL Y34 + 1 mL ATH 2147
Biomassa II
4 mL Y34
2 mL ATH 2147
2 mL Y34 + 2 mL ATH 2147 Masing-masing
inkubasi 24 jam
2 mL sludge primer
36 mL POME steril
Masing-masing inkubasi 24 jam
2 mL sludge primer
23 Lampiran 3 Perbedaan Biomassa dengan Sludge Primer
Lampiran 4 Perbedaan Biomassa dengan Sludge Sekunder
24
Lampiran 5 Perbedaan Suhu
Lampiran 6 Kurva standar gula reduksi
Uji ini akan berwarna jingga kemerahan jika hasilnya positif. Perhitungan konsentrasi gula reduksi diperoleh dari perhitungan persamaan kurva standar glukosa pada konsentrasi 0, 100, 200, 400, 500, dan 1000 sehingga diperoleh nilai absorbannya 0, 0.194, 0.496, 1.064, 1.354, dan 2.774 sehingga didapat persamaan y=0.0028x-0.0515, r=0.9991, dapat terlihat pada gambar 5.
Gambar 11 Kurva standar gula reduksi Masing-masing inkubasi 24 jam
2 mL sludge recycle
36 mL POME steril 2 mL
Y34
1 mL Y34 + 1 mL ATH 2147 2 mL
ATH 2147
Inkubasi 30°C
Inkubasi 50°C
25 Lampiran 7 Aktivitas enzim selulase pada hari kedua
sampel Absorban
Lampiran 8 Aktivitas enzim selulase pada hari ketiga
sampel Absorban
Lampiran 9 Aktivitas enzim selulase pada hari kelima
sampel Absorban
Persamaan kurva standar gula reduksi y = 0.0028x-0.0515 y = 0.0028x-0.0515
0.85 = 0.0028x-0.0515
[Gula reduksi] = = 321.96 ppm Aktivitas enzim = [G.red]/180 = 1.80 unit
Lampiran 10 Gas metan dengan perbandingan biomassa pada penambahan sludge primer
Sampel area standar 40°C
biomassa 1 konsentrasi biomassa 2 konsentrasi
Y34 2665849 456 1.71 552 2.07
26
Campuran Y34 dan
ATH2147 594854 817 13.73 1163 19.55
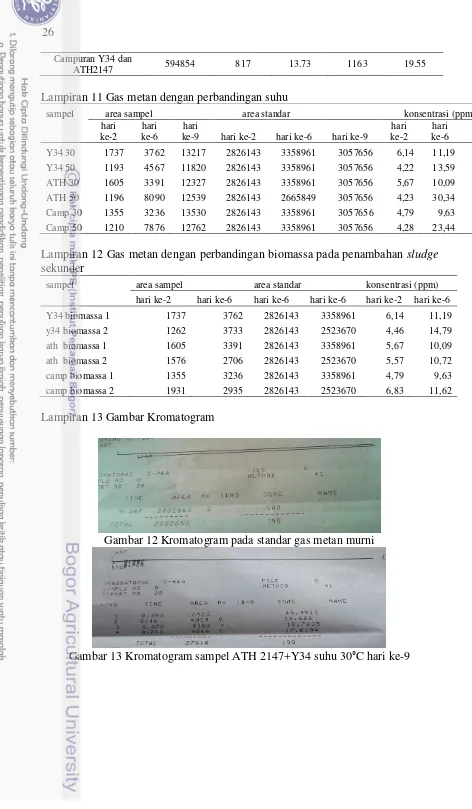
Lampiran 11 Gas metan dengan perbandingan suhu
sampel area sampel area standar konsentrasi (ppm)
hari ke-2
hari ke-6
hari
ke-9 hari ke-2 hari ke-6 hari ke-9
hari ke-2
hari ke-6
hari ke-9
Y34 30 1737 3762 13217 2826143 3358961 3057656 6,14 11,19 43,22
Y34 50 1193 4567 11820 2826143 3358961 3057656 4,22 13,59 38,65
ATH 30 1605 3391 12327 2826143 3358961 3057656 5,67 10,09 40,31
ATH 50 1196 8090 12539 2826143 2665849 3057656 4,23 30,34 41,00
Camp 30 1355 3236 13530 2826143 3358961 3057656 4,79 9,63 44,24
Camp 50 1210 7876 12762 2826143 3358961 3057656 4,28 23,44 41,73
Lampiran 12 Gas metan dengan perbandingan biomassa pada penambahan sludge sekunder
sampel area sampel area standar konsentrasi (ppm)
hari ke-2 hari ke-6 hari ke-6 hari ke-6 hari ke-2 hari ke-6
Y34 biomassa 1 1737 3762 2826143 3358961 6,14 11,19
y34 biomassa 2 1262 3733 2826143 2523670 4,46 14,79
ath biomassa 1 1605 3391 2826143 3358961 5,67 10,09
ath biomassa 2 1576 2706 2826143 2523670 5,57 10,72
camp biomassa 1 1355 3236 2826143 3358961 4,79 9,63
camp biomassa 2 1931 2935 2826143 2523670 6,83 11,62
Lampiran 13 Gambar Kromatogram
Gambar 12 Kromatogram pada standar gas metan murni
27
Gambar 14 Kromatogram kemurnian gas metan pada sampel Y34
Gambar 15 Kromatogram kemurnian gas metan pada sampel ATH 2147
Gambar 16 Kromatogram kemurnian gas metan pada sampel campuran ATH 2147+Y34
Gambar 17 Kromatogram sampel campuran ATH 2147+Y34 di medium methanobacterium dengan substrat CH3COOH
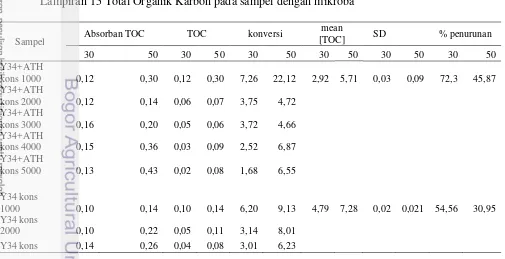
Lampiran 14 Kurva standar Total Organik Karbon (TOC)
28
Gambar 12 Kurva standar Total Organik Karbon (TOC) Lampiran 15 Total Organik Karbon pada POME
Sampel Absorban
Lampiran 15 Total Organik Karbon pada sampel dengan mikroba
Sampel Absorban TOC TOC konversi
29 3000
Y34 kons
4000 0,25 0,44 0,06 0,11 4,57 8,33
Y34 kons
5000 0,54 0,43 0,11 0,08 8,42 6,52
ATH kons
1000 0,12 0,12 0,12 0,12 7,26 7,91 6,66 6,54 0,01 0,01 36,75 37,97
ATH kons
2000 0,17 0,20 0,08 0,10 5,74 7,08
ATH kons
3000 0,31 0,25 0,10 0,08 7,59 5,96
ATH kons
4000 0,37 0,34 0,09 0,08 6,97 6,30
ATH kons
30
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 23 Agustus 1992 dari ayah Yansen Sibarani dan ibu Tiurma Hasibuan. Penulis adalah putri pertama dari tiga bersaudara. Penulis mengawali pendidikan kegiatan belajar dari TK Hamong Putra, SDN Klender 13 pagi, SMP Negeri 198 Jakarta dan pada tahun 2010 penulis lulus dari SMA Negeri 44 Jakarta dan pada tahun yang sama penulis lulus di dua Universitas Negeri yaitu IPB melalui seleksi masuk Institut Pertanian Bogor (IPB) dengan jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, serta Universitas Gadjah Mada (UGM) jurusan Agronomi melalui jalur masuk PBUTM UGM dan penulis memilih untuk mengikuti jenjang pendidikan S1 di Institut Pertanian Bogor.