IDENTIFIKASI GEN TERMOASIDOFILIK PDC DAN
ADH PADA
Bacillus
sp
-Pjv
SERTA OPTIMASI FERMENTASI
DENGAN SUBSTRAT GULA LONTAR
YULIA ATIKA MS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul Identifikasi Gen Termoasidofilik Piruvat Dekarboksilase dan Alkohol Dehidrogenase pada Bacillus sp-Pjv serta Optimasi Fermentasi dengan Substrat Gula Lontar adalah benar-benar hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
RINGKASAN
YULIA ATIKA MS. Identifikasi Gen Termoasidofilik Piruvat Dekarboksilase dan Alkohol Dehidrogenase pada Bacillus sp-Pjv serta Optimasi Fermentasi dengan Substrat Gula Lontar. Dibimbing oleh I MADE ARTIKA dan NOVIK NURHIDAYAT.
Indonesia merupakan salah satu produsen kelapa sawit terbesar di dunia. Industri ini menghasilkan produk samping berupa Tandan Kosong Kelapa Sawit (TKKS) yang mencapai 39.369.200 ton/tahun. Kandungan selulosa pada TKKS sebesar 46.51% sehingga potensial digunakan sebagai bahan baku bioetanol generasi kedua. Biokonversi TKKS menjadi bioetanol terdiri atas perlakuan awal untuk menurunkan kristalitas selulosa dan menghilangkan lignin, hidrolisis selulosa atau sakarifikasi enzimatis untuk menghasilkan gula yang dapat difermentasi dan fermentasi gula menjadi bioetanol.
Permasalahan dalam proses konversi biomassa menjadi bioetanol salah satunya adalah belum optimalnya proses dan teknologi konversi. Konversi dengan menggunakan metode sakarifikasi dan fermentasi serentak terkendala oleh perbedaan suhu optimal antara sakarifikasi enzimatis dan fermentasi. Hidrolisis memerlukan suhu termofilik dan pH asam supaya enzim selulase dapat bekerja optimal sedangkan fermentasi berlangsung pada suhu mesofilik. Oleh karena itu diperlukan enzim fermentatif termoasidofilik supaya proses tersebut dapat berlangsung serentak.
Piruvat dekarboksilase (PDC) dan alkohol dehidrogenase (ADH) merupakan enzim pada tahap akhir lintas fermentasi. PDC memecah senyawa intermediet piruvat menjadi asetaldehid dan CO2 kemudian ADH mereduksi asetaldehid menjadi etanol. Oleh karena itu, enzim PDC dan ADH menjadi salah satu indikator sifat fermentatif suatu mikroorganisme. Buah Protium javanicum, asal Lombok Timur Indonesia tumbuh pada temperatur cukup tinggi, memiliki rasa masam dan beraroma alkoholik sehingga diduga telah terjadi fermentasi oleh mikroorganisme dalam buah tersebut. Berdasarkan karakteristik itu, besar kemungkinan buah ini memiliki mikroorganisme termoasidofilik pembawa gen pdc dan adh.
dimasukkan ke dalam media fermentasi. Kemudian, optimasi fermentasi dengan tujuan mendapatkan kombinasi optimal dari faktor fermentasi dilakukan terhadap isolat yang paling potensial dengan menggunakan metode respon permukaan desain box Behnken dengan dua kali ulangan.
Hasil identifikasi gen pdc dan adh menunjukkan bahwa empat isolat dari buah ketimus (BS 1, BS2, BS 4, Bacillus sp-Pjv) memiliki gen pdc dan adh dengan amplifikasi gen adh paling awal oleh Bacillus sp-Pjv (Cq=14.68). Hasil uji fermentasi menunjukkan bahwa isolat Bacillus sp-Pjv menghasilkan etanol lebih tinggi dibandingkan dengan isolat lain. Optimasi fermentasi pada Bacillus sp-Pjv menunjukkan level optimum faktor fermentasi pada : waktu inkubasi 72 jam, 10% inokulum Bacillus sp-Pjv OD439nm 1 dan 10% gula lontar. Pada kombinasi itu, etanol yang dihasilkan sebesar 0.17% atau 1.3413 g/L.
SUMMARY
YULIA ATIKA MS. Gene Identification Thermoacidophilic Pyruvate decarboxylase and Alcohol Dehydrogenase Encoding Bacillus sp-Pjv and Optimization Fermentation with Lontar Sugar as Substrates. Supervised by I MADE ARTIKA and NOVIK NURHIDAYAT.
Indonesia is one of the largest palm oil producer in the world. This industry generates Oil Palm Empty Fruit Bunches (EFB) as by product and reached 39.3692 million tons every year. EFB contain cellulose up to 46.51% so that it has a great potency to be used for second-generation bioethanol feedstock. Bioconversion of EFB to bioethanol consists of pretreatment for reducing the crystallinity of cellulosic material and removing lignin, cellulosic hydrolysis or enzymatic saccharification for fermentable sugar production and fermentation of sugar to bioethanol.
The problems which being one of the constrains in the conversion process of biomass to bioethanol is the unoptimum technology for the conversion process. One of the causes is the difference between optimum temperature for enzymatic hydrolytic saccharification and for fermentation. Enzymatic hydrolysis requires high temperature and acidic pH, while fermentation operates at mild condition. Hence, thermophilic fermentative microbes are needed so that simultaneous saccharification and fermentation processes can be carried out.
Pyruvate decarboxylase (PDC) and alcohol dehydrogenase (ADH) are enzymes function in the final step of fermentation. The central intermediate pyruvate is cleaved to acetaldehyde and CO2 by PDC then ADH reducted acetaldehyde to ethanol. Therefore PDC and ADH being one indicator of fermentative microbes. Protium javanicum, a typical fruit from East Lombok Indonesia which grows at high temperature, has a sour taste, and alcoholic odor thus it allegedly had been fermented by microbes in the fruit. Based on these characteristics, this fruit might have thermoacidophilic microorganisms encoding PDC and ADH. This study was aimed to identify gene encoding PDC and ADH in Protium javanicum (Pjv) microbial isolates, to verify the capability of each microbe in bioethanol fermentation and optimize fermentation factor from the most potensial isolate.
Results of gene identification showed that four isolates tested (BS 1, BS2, BS4, Bacillus sp-Pjv) had pdc and adh gene and that of Bacillus sp-Pjv was the most efficiently amplified (Cq=14.68). Results of fermentation test also showed that the Bacillus sp-Pjv isolate was a better ethanol producer than the others. Fermentation optimization of Bacillus sp-Pjv generate the optimum level of fermentation factors, at 72 hours incubation, 10% lontar sugar and 10% inoculum of Bacillus sp-Pjv OD439nm 1. That combination produced ethanol of 0.17% or 1.3413 g/L.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
IDENTIFIKASI GEN TERMOASIDOFILIK PDC DAN
ADH PADA
Bacillus
sp
-Pjv
SERTA OPTIMASI FERMENTASI
DENGAN SUBSTRAT GULA LONTAR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Identifikasi Gen Termoasidofilik Piruvat Dekarboksilase dan Alkohol Dehidrogenase pada Bacillus sp-Pjv serta Optimasi Fermentasi dengan Substrat Gula Lontar
Nama : Yulia Atika MS
NIM : G851124011
Disetujui oleh Komisi Pembimbing
Dr Ir I Made Artika, MAppSc Ketua
Novik Nurhidayat,PhD Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan rahmat-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni sampai November 2014 ini adalah identifikasi gen termoasidofilik pdc dan adh, dengan judul Identifikasi Gen Termoasidofilik Piruvat Dekarboksilase dan Alkohol Dehidrogenase pada Bacillus sp-Pjv serta Optimasi Fermentasi dengan Substrat Gula Lontar.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. I Made Artika, M.App.Sc dan Bapak Novik Nurhidayat, Ph.D atas ilmu, kesempatan, pikiran dan motivasi yang mengantarkan penulis hingga selesai. Terima kasih pula penulis ucapkan kepada Ibu Wijiastuti, Bapak Yeremiah Rubin Camin, Bapak Ikna Suyatna yang telah bersedia berbagi ilmu dan pengalaman, juga kepada Ibu Nunik Sulistyaningsih, Ibu Ismu, Ibu Ratih MD dan Bapak Acun Samsuri atas kesabarannya dalam membimbing selama pelaksanaan penelitian. Penghargaan yang sebesar-besarnya penulis ucapkan kepada ucapkan kepada ayahanda Muhsinin AN SE, Ibunda Munaiyah S.Pd dan Adinda (Dewi Nur MS SE, M. Roby Muhari MS, M. Ridho Nurhakim MS) atas kasih sayang, kesabaran, doa, nasehat serta motivasi yang telah diberikan selama ini. Tidak lupa penulis ucapkan terima kasih kepada M. Kamal Insani SE atas bantuan dan dukungannya selama penyelesaian studi.
Terima kasih juga penulis ucapkan kepada teman-teman S2 Biokimia 2012 dan 2013 serta sahabat-sahabat Puri Hapsara atas kebersamaan dan kesediaannya untuk saling menguatkan selama proses studi berlangsung.
Semoga karya ilmiah ini bermanfaat tidak hanya bagi penulis tetapi juga bagi pengembangan bioenergi di Indonesia.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 3
Waktu dan Tempat 3
Alat dan Bahan 3
Lingkup Kerja 3
Seleksi Mikroorganisme Termofilik 3
Identifikasi Gen pdc dan adh 3
Uji Fermentasi 4
Optimasi Faktor Fermentasi 5
4 HASIL DAN PEMBAHASAN 7
Mikroorganisme Termofilik Terseleksi 7
Profil Amplifikasi Gen pdc dan adh 7
Hasil Fermentasi Termoasidofilik 10
Faktor Fermentasi yang Optimal 13
5 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 22
DAFTAR TABEL
1 Primer penyandi gen piruvat dekarboksilase dan alkohol dehidrogenase 4 2 Komposisi TKKS setelah pretreatment dengan NaOH 10% 5 3 Desain percobaan berdasarkan output response surface design box
Behnken 6
4 Nilai kuantitas (Cq) dari amplifikasi gen pdc empat isolat terseleksi 9 5 Nilai kuantitas (Cq) dari amplifikasi gen adh empat isolat terseleksi 10 6 Estimasi pengaruh variabel bebas terhadap kadar etanol 13 7 Analisis ragam model regresi terhadap respon kadar etanol 13
DAFTAR GAMBAR
1 Isolat yang tumbuh pada suhu 50°C 7
2 Hasil Pewarnaan sel isolat dengan safranin 7
3 Pola amplifikasi gen pdc dari tiap isolat terseleksi 8 4 Pola ampifikasi gen adh dari tiap isolat terseleksi 9
5 Hasil uji Gram dan pewarnaan spora pada BS 5 10
6 Grafik persentase kadar etanol hasil fermentasi oleh isolat buah Pjv 11 7 Kadar gula pereduksi pada media setelah fermentasi selama 48 jam 12
8 Fermentasi alkoholik pada S. cerevisiae 12
9 Kontur plot kadar etanol 14
10 Grafik penurunan kadar gula pereduksi 16
11 Jalur metabolisme glukosa pada G. thermoglucosidasius 17
DAFTAR LAMPIRAN
1 Diagram Alir penelitian 22
2 Hasil analisis kadar etanol setelah fermentasi selama 48 jam 23 3 Kromatogram BS 1 setelah fermentasi selama 48 jam 23 4 Kromatogram BS 2 setelah fermentasi selama 48 jam 23 5 Kromatogram BS 4 setelah fermentasi selama 48 jam 24 6 Kromatogram BS 5 setelah fermentasi selama 48 jam 24 7 Kromatogram hasil optimasi fermentasi Bacillus sp-Pjv selama 72 jam
1
PENDAHULUAN
Latar Belakang
Menipisnya cadangan bahan bakar fosil mendorong pemerintah mengembangkan bahan bakar alternatif salah satunya bioetanol. Hal ini termaktub dalam Inpres No. 1 tahun 2006 tentang Penyediaan dan Pemanfaatan Bahan Bakar Nabati dan Permen ESDM No 032 tahun 2008 tentang Kewajiban Mencampur BBM dengan Bahan Bakar Nabati. Bahan baku produksi bioetanol pada mulanya berbasis bahan makanan seperti pati dan gula sederhana, disebut bioetanol generasi pertama (G1). Akan tetapi, penggunaan G1 menimbulkan persaingan dengan bahan pangan sehingga dikembangkan bioetanol generasi kedua, G2. G2 merupakan bioetanol yang bahan bakunya berbasis lignoselulosa dan limbah pertanian. Bahan baku G2 tersedia melimpah di alam, murah dan tidak menimbulkan konflik dengan bahan pangan, namun proses konversi G2 lebih mahal dan kompleks dibandingkan dengan G1.
Indonesia merupakan salah satu produsen minyak kelapa sawit terbesar di dunia. Dalam prosesnya, industri kelapa sawit menghasilkan limbah padat salah satunya Tandan Kosong Kelapa Sawit (TKKS) dengan potensi limbah padat TKKS mencapai 39.369.200 ton/tahun. Akan tetapi, pengolahan limbah padat TKKS belum optimal. Limbah padat TKKS biasanya disebar di lahan perkebunan, dibakar di lahan dan menghasilkan abu yang digunakan sebagai pupuk tanaman. Saat ini pembakaran pun sudah dilarang karena asapnya berpotensi mencemari lingkungan (DNPI 2014). Kandungan selulosa pada TKKS mencapai 46.51% (Sudiyani et al. 2013) sehingga sangat potensial digunakan sebagai bahan baku bioetanol generasi kedua.
Proses konversi bioetanol G2 terdiri atas tiga tahap yaitu pretreatment (perlakuan pendahuluan), hidrolisis dan fermentasi. Pretreatment dan hidrolisis dapat dilakukan secara kimia dan biologi (enzimatis). Pretreatment bertujuan mereduksi lignin (delignifikasi) sementara hidrolisis bertujuan memecah polisakarida menjadi gula sederhana yang siap untuk difermentasi (Arshadi & Grundberg 2011). Hidrolisis secara enzimatis dibedakan menjadi dua yaitu sakarifikasi fermentasi terpisah (SFT) dan sakarifikasi fermentasi serentak (SFS). Metode SFS yang dilakukan secara serentak dalam satu reaktor lebih disukai dibandingkan dengan SHT karena menghasilkan etanol yang lebih banyak dan menghemat biaya produksi. Kondisi optimal enzim pada reaksi hidrolisis secara enzimatis adalah pada suasana asam pH 4.8 dengan temperatur 45-50ºC. Hal ini ditegaskan oleh Bhalla et al. (2013) yang mengemukakan bahwa proses hidrolisis enzimatis dengan enzim selulase, bekerja optimal pada suhu 50ºC.
2
untuk proses fermentasi. Hidrolisis enzimatis dilakukan pada suhu 50-52°C dengan pH 4.8-5.5 sementara fermentasi dilakukan pada suhu 32°C sehingga diperlukan pendinginan terlebih dahulu. Fermentasi mesofilik mudah mengalami kontaminasi, seperti yang dikemukakan oleh Bischoff et al. (2007) bahwa fermentasi pada suhu mesofilik mudah mengalami kontaminasi oleh spesies Lactobacilli. Oleh karena itu, diperlukan proses hidrolisis enzimatis dan fermentasi serentak pada suhu termofilik. Proses tersebut memerlukan mikroorganisme fermentatif termoasidofilik karena hidrolisis enzimatis optimal bekerja pada suhu tinggi dan pH asam.
Piruvat dekarboksilase dan alkohol dehidrogenase merupakan enzim yang berperan dalam proses fermentasi sehingga menjadi salah satu indikator sifat fermentatif suatu mikroorganisme. Piruvat dekarboksilase mengubah asam piruvat menjadi asetaldehid kemudian asetaldehid direduksi menjadi etanol oleh enzim alkohol dehidrogenase. Salah satu substrat yang diduga memiliki enzim tersebut adalah buah-buahan. Buah memiliki kandungan gula yang merupakan substrat fermentasi dan media pertumbuhan mikroba. Buah ketimus (Protium javanicum) memiliki karakteristik yang mendukung untuk diteliti. Buah yang berasal dari Lombok Timur Indonesia ini tumbuh pada temperatur yang cukup tinggi, ditemukan dalam kondisi terjatuh pada permukaan tanah, mengeluarkan aroma alkohol dan rasanya masam sehingga diduga telah terjadi fermentasi oleh mikroorganisme dalam buah tersebut. Berdasarkan latar belakang tersebut, besar kemungkinan buah ini memiliki mikroorganisme termoasidofilik pembawa gen pdc dan adh.
Perumusan Masalah
Menurut Wagiman (2012), keberlangsungan produksi bioetanol bergantung pada tiga pilar yakni ketersediaan bahan baku, manfaat ekonomis bagi stakeholders dan dampak positif terhadap lingkungan. Konversi biomassa menjadi bioetanol dengan metode sarifikasi dan fermentasi serentak masih memiliki keterbatasan dan menghasilkan kadar etanol yang rendah sehingga antara biaya produksi dan harga jual kurang sesuai. Hidrolisis enzimatis dengan metode SFS berlangsung optimal pada suhu 50ºC dengan pH 5 sehingga untuk proses SFS yang optimum diperlukan mikroorganisme fermentatif termoasidofilik.
Tujuan Penelitian
Berdasarkan perumusan masalah di atas, tujuan penelitian ini adalah:
1. Menyeleksi mikroorganisme termoasidofilik penghasil piruvat dekarboksilase dan alkohol dehidrogenase.
2. Menguji kemampuan isolat dalam fermentasi bioetanol.
3
Manfaat Penelitian
Manfaat dari penelitian ini yaitu memberikan alternatif mikroorganisme fermentatif termoasidofilik untuk produksi bioetanol secara SFS dengan kombinasi faktor fermentasi yang optimum.
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juni-November 2014 bertempat di Laboratorium Genetika Pusat Penelitian Biologi LIPI Cibinong.
Alat dan Bahan
Peralatan yang digunakan antara lain : Laminary air flow, spektrofotometer Shimadzu UV-Visible Pharmaspec 1700, real time PCR (Biorad CFX96), bioshaker, microwave Sanyo, vortex Maxi Mix II, autoklaf, sentrifuse eppendorf 5415 R, sentrifuse Kokusan H-1500F, penangas air, inkubator, kromatografi gas Shimadzu 14B, mikroskop Nikon Eclipse-50i, pH meter dan peralatan gelas yang lazim dipakai. Bahan yang digunakan antara lain: sampel buah ketimus, media pertumbuhan mikroba yakni media heterotrof (15 g bacto agar, 15 g pepton, 3 g tripton, 5 g NaCl, 2.5 g K2HPO4 dilarutkan dalam 1000 mL akuades) dan yeast manitol (15 g bacto agar, 3 g yeast ekstrak, 5 g pepton, MgSO4·7H2O 0.5 g, 1 g K2HPO4 dan 10 g glukosa yang dilarutkan dalam 1000 mL akuades). Bahan lain yang digunakan yaitu gula lontar, serbuk pretreatment TKKS dengan NaOH 10% (diperoleh dari Laboratorium Kimia, LIPI Serpong), reagen uji Gram dan pewarnaan spora, buffer asetat dengan pH 5, pereaksi DNS dan master mix real time PCR.
Lingkup Kerja
Penelitian ini terdiri atas empat tahap. Tahap pertama, menyeleksi mikroorganisme termofilik, kemudian mengidentifikasi gen pembawa gen pdc dan adh dengan mengamplifikasi DNA menggunakan primer spesifik. Tahap selanjutnya, melakukan uji fermentasi terhadap isolat terseleksi. Tahap terakhir yaitu mengoptimasi faktor-faktor fermentasi dari isolat yang paling potensial dengan menggunakan metode respon permukaan.
Seleksi Mikroorganisme Termofilik
a. Isolasi Mikrob
4
dan heterotrof) dengan cara sebar dan diinkubasi pada suhu 50ºC selama 24-48 jam. Setelah didapatkan isolat termofilik, dilakukan pengamatan bentuk morfologi yang dilakukan menggunakan mikroskop Nikon Eclipse-50i. Isolat khamir ditumbuhkan pada media padat yeast manitol (15 g bacto agar, 3 g yeast ekstrak, 5 g pepton, MgSO4·7H2O 0.5 g, 1 g K2HPO4, dan 10 g glukosa yang dilarutkan dalam 1000 mL akuades) dan isolat bakteri ditumbuhkan pada media padat heterotrof.
b. Penyiapan Starter
Penyiapan starter inokulum dilakukan dengan cara membiakkan kultur pada media cair. Sebanyak satu ose isolat yang ditumbuhkan pada media padat diinokulasikan ke dalam 50 ml media cair pada labu erlenmeyer dan diinkubasi pada suhu 50°C selama 48 jam. Media pertumbuhan khamir dikondisikan pada suasana asam pH 5 supaya khamir tumbuh optimal (Moat 2002). Konsentrasi sel inokulum ditentukan dengan mengukur optical density sel pada panjang gelombang tertentu.
Identifikasi Gen pdc dan adh
Starter yang ditumbuhkan pada media cair divortex kemudian ditentukan konsentrasi selnya hingga mencapai OD 0.5. Panjang gelombang yang dipakai, ditentukan dengan metode spektrum sehingga didapatkan panjang gelombang yang paling optimal. Ekstraksi DNA dilakukan dengan mengambil 1 mL suspensi tersebut kemudian diberi perlakuan heatshock pada suhu 90ºC selama 20 menit dan coldshock pada suhu -18ºC selama 20 menit. Supernatan yang mengandung DNA template direaksikan dengan master mix real time PCR. Komposisi mastermix antara lain: 10 µL SsoFast Eva Green supermix, primer alkohol dehidrogenase 1µL dengan konsentrasi 10µM, DNAse-free water dan DNA cetakan masing-masing sebanyak 1 µL yang dicukupkan dengan ddH2O sehingga total volume 20 µL. Mixing reagent tersebut dirunning pada mesin real time PCR yang diprogram untuk 40 siklus dengan pengaturan; pre denaturasi 95ºC 3 menit, denaturasi 95ºC 15 detik, annealing 55ºC 15 detik, elongasi 72ºC 15 detik dan elongasi tambahan 10 menit. Urutan nukleotida primer pdc dan adh terdapat pada Tabel 1.
Tabel 1 Primer penyandi gen piruvat dekarboksilase dan alkohol dehidrogenase
Uji Fermentasi Termoasidofilik
Primer Urutan nukleotida (5’ ––3’) Referensi Piruvat
dekarboksilase (PDC)
5
Uji Fermentasi
Fermentasi dilakukan untuk mengetahui kesesuaian profil amplifikasi gen dengan kemampuan masing-masing mikrob dalam fermentasi bioetanol. Pada media fermentasi terdapat serbuk TKKS yang telah didelignifikasi menggunakan NaOH 10% sesuai dengan metode yang dilakukan oleh Sudiyani et al. (2013). Setelah didelignifikasi, TKKS tersebut memiliki kandungan selulosa sebesar 68.86% dari berat kering (Tabel 2).
Tabel 2 Komposisi TKKS setelah pretreatment dengan NaOH 10%
No Komponen Persentase (%)
1 Lignin 11.02%
2 Selulosa 68.86%
3 Hemiselulosa 5.69%
Sumber : Sudiyani et al. (2013)
Selulosa yang dihasilkan dari proses delignifikasi dipecah menjadi gula monosakarida oleh enzim selulase. Karena ketiadaan enzim tersebut dalam media fermentasi, sebagai alternatif sumber glukosa digunakan gula lontar dengan persentase tertentu. Gula lontar merupakan salah satu bahan baku bioetanol generasi pertama dengan kandungan utama glukosa dan mineral. Oleh karena itu, gula lontar dipilih sebagai alternatif pengganti glukosa. Persentase gula lontar yang digunakan maksimal 10% dari total volume media fermentasi dengan asumsi persentase tersebut mendekati jumlah glukosa yang dihasilkan dari proses hidrolisis TKKS. Pada proses hidrolisis enzimatis, tidak semua TKKS dikonversi menjadi glukosa sehingga untuk mendekati kondisi tersebut, serbuk pretreatment TKKS dimasukkan ke dalam media fermentasi.
Fermentasi dilakukan dengan mentransfer media fermentasi pada labu erlenmeyer 100 mL dengan total volume media fermentasi sebesar 50 ml. Komposisi media fermentasi antara lain: 10% gula lontar, 0.1% serbuk pretreatment TKKS, 10% inokulum dengan OD 0.5. Media fermentasi dikondisikan berada pada pH 5 dengan cara menambahkan buffer asetat secara hati-hati pada media. Setelah itu, media fermentasi tersebut diinkubasi dalam bioshaker suhu 50°C dengan kecepatan 100 rpm selama 48 jam (Rouhullah et al. 2007). Setelah difermentasi, sebanyak 1 mL sampel dari media fermentasi disentrifugasi dengan kecepatan 10000 rpm selama 10 menit kemudian supernatan dipisahkan dari pelet. Analisis kadar etanol dilakukan dengan menginjeksikan 1 µL supernatan ke dalam kolom kromatografi gas Shimadzu GC 14 B dengan spesifikasi : detektor FID, integrator CR 6 chromatopac, temperatur kolom 180°C, temperatur injeksi 250°C dan waktu retensi 2 menit. Selanjutnya, kadar gula pereduksi yang dihasilkan ditentukan dengan metode DNS yang tercantum pada Bintang (2010).
Optimasi Faktor Fermentasi
6
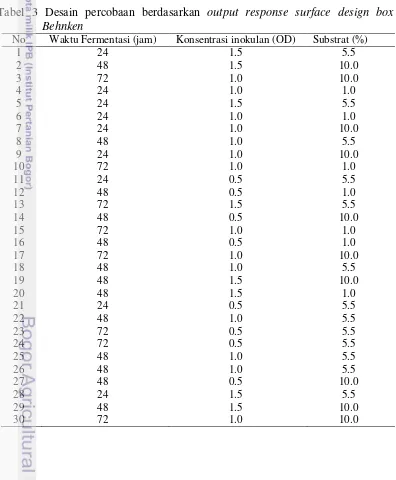
box Behnken dengan dua kali replikasi. Faktor-faktor (variabel) yang dioptimasi antara lain waktu fermentasi, konsentrasi inokulan yang diketahui dengan mengukur Optical Density (OD) dan persentase substrat dengan pengulangan sebanyak dua kali. Nilai interval dari tiap faktor perlu ditentukan terlebih dahulu untuk mendapatkan desain respon permukaan. Interval masing-masing faktor yaitu waktu fermentasi ( 24-72 jam), konsentrasi inokulan (OD 0.5-1.5) dan persentase substrat (1-10%). Data tersebut diinput ke dalam program minitab 16 dan akan muncul output response surface design (Tabel 2). Kemudian, fermentasi dilakukan berdasarkan output tersebut. Setelah fermentasi, kadar etanol yang dihasilkan dianalisis menggunakan kromatografi gas. Data tersebut ditabulasi ke dalam minitab 16 untuk dianalisis kombinasi yang paling optimal dan faktor yang berpengaruh signifikan.
Tabel 3 Desain percobaan berdasarkan output response surface design box Behnken
No Waktu Fermentasi (jam) Konsentrasi inokulan (OD) Substrat (%)
7
3
HASIL DAN PEMBAHASAN
Mikroorganisme Termofilik Terseleksi
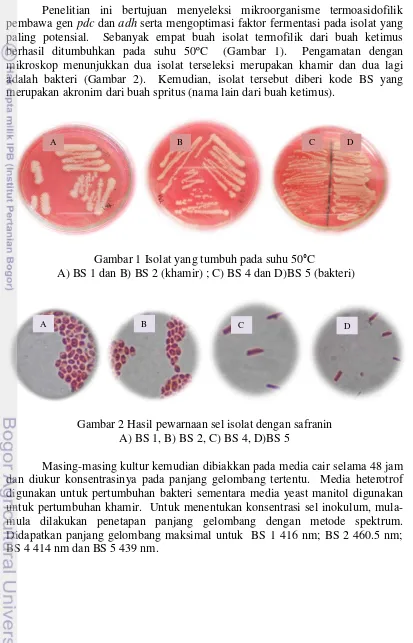
Penelitian ini bertujuan menyeleksi mikroorganisme termoasidofilik pembawa gen pdc dan adh serta mengoptimasi faktor fermentasi pada isolat yang paling potensial. Sebanyak empat buah isolat termofilik dari buah ketimus berhasil ditumbuhkan pada suhu 50ºC (Gambar 1). Pengamatan dengan mikroskop menunjukkan dua isolat terseleksi merupakan khamir dan dua lagi adalah bakteri (Gambar 2). Kemudian, isolat tersebut diberi kode BS yang merupakan akronim dari buah spritus (nama lain dari buah ketimus).
Gambar 1 Isolat yang tumbuh pada suhu 50°C
A) BS 1 dan B) BS 2 (khamir) ; C) BS 4 dan D)BS 5 (bakteri)
Gambar 2 Hasil pewarnaan sel isolat dengan safranin A) BS 1, B) BS 2, C) BS 4, D)BS 5
Masing-masing kultur kemudian dibiakkan pada media cair selama 48 jam dan diukur konsentrasinya pada panjang gelombang tertentu. Media heterotrof digunakan untuk pertumbuhan bakteri sementara media yeast manitol digunakan untuk pertumbuhan khamir. Untuk menentukan konsentrasi sel inokulum, mula-mula dilakukan penetapan panjang gelombang dengan metode spektrum. Didapatkan panjang gelombang maksimal untuk BS 1 416 nm; BS 2 460.5 nm; BS 4 414 nm dan BS 5 439 nm.
D C
B A
8
Profil Amplifikasi Gen pdc dan adh
Kultur yang telah dibiakkan pada media cair ditentukan konsentrasi selnya hingga mencapai OD 0.5. Setelah itu dilakukan ekstraksi DNA yang selanjutnya digunakan sebagai DNA template dan direaksikan dengan mastermix real time PCR. Untuk mengetahui apakah terjadi kontaminasi saat pencampuran DNA template dan reagen, digunakan kontrol negatif yang tidak berisi DNA template atau NTC (Non template Control). Jika mixing reagent tidak mengalami kontaminasi maka kontrol negatif akan tetap negatif (tidak diamplifikasi) sehingga hasil PCR dianggap dapat dipercaya. Sampel dianggap positif memiliki gen yang dimaksud apabila ia memiliki nilai fluoresens tertentu dan melewati garis ambang (threshold).
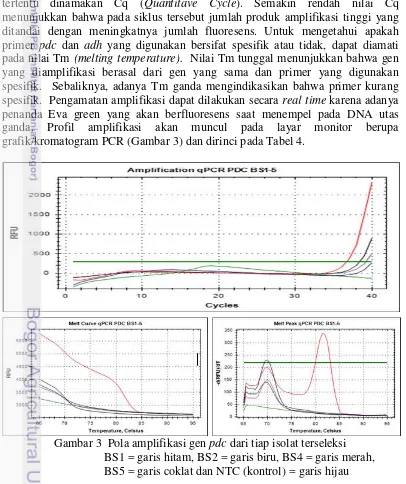
Jumlah siklus yang harus dilalui untuk mendapatkan respon fluoresens tertentu dinamakan Cq (Quantitave Cycle). Semakin rendah nilai Cq menunjukkan bahwa pada siklus tersebut jumlah produk amplifikasi tinggi yang ditandai dengan meningkatnya jumlah fluoresens. Untuk mengetahui apakah primer pdc dan adh yang digunakan bersifat spesifik atau tidak, dapat diamati pada nilai Tm (melting temperature). Nilai Tm tunggal menunjukkan bahwa gen yang diamplifikasi berasal dari gen yang sama dan primer yang digunakan spesifik. Sebaliknya, adanya Tm ganda mengindikasikan bahwa primer kurang spesifik. Pengamatan amplifikasi dapat dilakukan secara real time karena adanya penanda Eva green yang akan berfluoresens saat menempel pada DNA utas ganda. Profil amplifikasi akan muncul pada layar monitor berupa grafik/kromatogram PCR (Gambar 3) dan dirinci pada Tabel 4.
9 Tabel 4 Nilai kuantitas (Cq) dari amplifikasi gen pdc pada empat isolat terseleksi
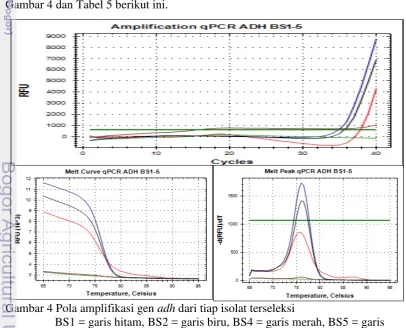
Pola amplifikasi gen pdc pada Gambar 3 dan Tabel 4 memperlihatkan bahwa keempat isolat terseleksi memerlukan siklus yang panjang untuk mengamplifikasi DNA, dengan nilai Cq mendekati 40. Rendahnya konsentrasi gen pdc pada isolat tersebut menyebabkan produk amplifikasi yang dihasilkan rendah sehingga kurva amplifikasi baru melewati garis threshold pada siklus-siklus akhir. Pada kurva amplifikasi BS 1, 2 dan 5 hanya terdapat satu peak tunggal sementara BS 4 memiliki peak ganda. Hal ini menunjukkan bahwa primer yang digunakan kurang spesifik untuk isolat BS 4. Amplikon pertama dari BS 4 memiliki nilai Tm yang sama yaitu 70°C sementara amplikon kedua memiliki nilai Tm 81.50°C. Walaupun demikian, gen pdc pada isolat BS 4 diamplifikasi lebih awal dibanding yang lain. Dengan nilai Cq BS 4 sebesar 36.67, mengindikasikan bahwa konsentrasi gen pdc pada BS 4 lebih tinggi dibanding yang lain sehingga produk amplifikasi lebih banyak, ditandai dengan meningkatnya jumlah fluoresens. Sementara itu, hasil amplifikasi oleh primer alkohol dehidrogenase menghasilkan profil amplifikasi yang ditunjukkan oleh Gambar 4 dan Tabel 5 berikut ini.
Gambar 4 Pola amplifikasi gen adh dari tiap isolat terseleksi
BS1 = garis hitam, BS2 = garis biru, BS4 = garis merah, BS5 = garis coklat dan NTC (kontrol) = garis hijau.
No Subyek Kode Isolat Cq Melting TᵒC
1 BS1 38.36 69.50
2 BS2 40 70.00
3 BS4 36.67 70 dan 81.50
4 BS5 39.20 70.00
10
Pola amplifikasi pada Gambar 4 memperlihatkan bahwa primer yang digunakan bersifat spesifik karena hanya terdapat satu peak pada masing-masing kurva isolat, hanya terdapat satu amplikon DNA. Data pada grafik (Gambar 4) dan Tabel 5 menunjukkan bahwa NTC tetap bernilai negatif sehingga hasil PCR dapat dipercaya.
Tabel 5 Nilai kuantitas (Cq) dari amplifikasi gen adh empat isolat terseleksi
Keempat isolat terseleksi memiliki nilai melting point yang sama yakni 76ºC (Tabel 5) sehingga disimpulkan gen yang diamplifikasi berasal dari gen yang sama. Dari keempat isolat tersebut, BS 5 memiliki nilai Cq paling rendah. Rendahnya nilai Cq BS 5 (14.68) menandakan bahwa pada konsentrasi sel yang sama, konsentrasi gen adh pada BS 5 lebih tinggi dibanding yang lain. Berdasarkan data tersebut, isolat BS 5 merupakan isolat yang paling potensial dibanding yang lain sehingga dilakukan uji lanjutan berupa pewarnaan Gram dan pewarnaan spora untuk mengidentifikasinya.
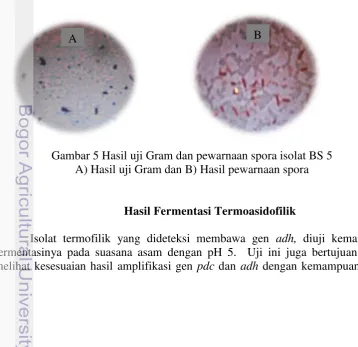
Hasil identifikasi menunjukkan bahwa BS 5 termasuk bakteri Gram positif yang memiliki bentuk batang (Gambar 5 a) dan memiliki spora (Gambar 5 b). Setelah melakukan konfirmasi ciri-ciri tersebut pada Bergey’s manual, BS 5 diklasifikasikan ke dalam genus Bacillus sehingga diberi kode Bacillus-spPjv karena berasal dari buah Protium javanicum (Pjv).
Gambar 5 Hasil uji Gram dan pewarnaan spora isolat BS 5 A) Hasil uji Gram dan B) Hasil pewarnaan spora
Hasil Fermentasi Termoasidofilik
Isolat termofilik yang dideteksi membawa gen adh, diuji kemampuan fermentasinya pada suasana asam dengan pH 5. Uji ini juga bertujuan untuk melihat kesesuaian hasil amplifikasi gen pdc dan adh dengan kemampuan isolat
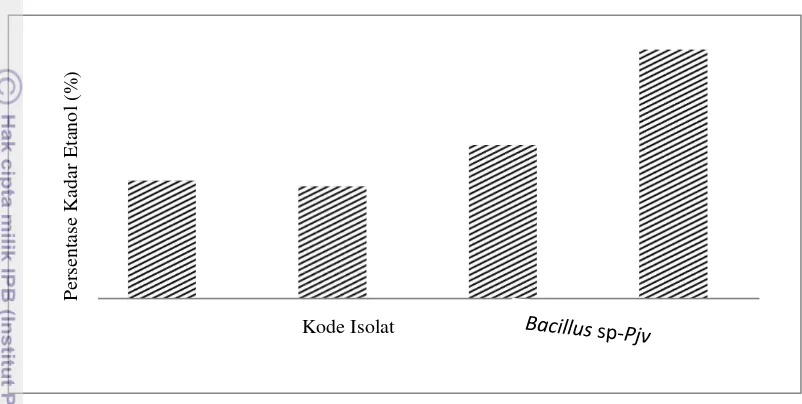
11 dalam fermentasi bioetanol. Berdasarkan profil amplifikasi gen pdc, nilai Cq antara keempat isolat tidak berbeda signifikan sementara nilai Cq pada amplifikasi gen adh menunjukkan isolat Bacillus sp-Pjv yang paling potensial. Setelah dilakukan fermentasi pada suhu termofilik selama 48 jam, kadar etanol dianalisis menggunakan kromatografi gas. Hasil analisis tersebut ditampilkan pada Gambar 6.
Gambar 6 Kadar etanol hasil fermentasi oleh isolat buah Pjv
Gambar 6 Kadar etanol hasil fermentasi oleh isolat buah Pjv
12
Gambar 7 Kadar gula pereduksi pada media setelah fermentasi selama 48 jam Khamir melakukan metabolisme glukosa melalui jalur glikolisis atau Embden-Meyerhof-Parnas (EMP) (Gambar 8). Fermentasi alkohol pada khamir, berbeda dengan respirasi aerob hanya pada tahap akhir. Pada respirasi aerob, piruvat diubah menjadi asetil KoA yang kemudian akan masuk ke dalam siklus Krebs sementara pada khamir, terdapat dua enzim utama fermentasi yaitu piruvat dekarboksilase (PDC) dan alkohol dehidrogenase (ADH). Pada reaksi ini, piruvat yang dihasilkan dari glikolisis kehilangan gugus karboksilnya oleh kerja piruvat dekarboksilase dengan melepaskan CO2. Reaksi ini merupakan reaksi irreversible dekarboksilase yang memerlukan Mg2+ dan koenzim tiamin pirofosfat. Pada tahap akhir, asetaldehida direduksi menjadi etanol dengan bantuan enzim alkohol dehidrogenase (Lehninger 1982).
.
Gambar 8 Fermentasi alkoholik pada S. cerevisiae (Pretorious 2000)
Bacillus sp-Pjv
Kad
ar
g
u
la
p
er
ed
u
k
si (
g
13
Faktor Fermentasi yang Optimal
Optimasi faktor fermentasi dilakukan menggunakan metode respon permukaan. Metode respon permukaan adalah teknik yang digunakan untuk memodelkan hubungan antara variabel respon dan faktor perlakuan. Metode ini dapat digunakan untuk menemukan bagian kombinasi yang menghasilkan respon maksimum (Montgomerry 2008). Dengan menentukan interval masing-masing faktor dan menginput data tersebut pada program minitab 16, akan didapatkan desain kombinasi percobaan. Kombinasi faktor fermentasi yang diujikan merujuk pada desain tersebut. Setelah itu, hasil fermentasi berupa data respon kadar etanol ditabulasi ke dalam program minitab 16 untuk dianalisis lebih lanjut. Hasil analisis berupa data estimasi koefisien regresi masing-masing variabel ditunjukkan oleh Tabel 6.
Tabel 6 Estimasi pengaruh variabel bebas terhadap kadar etanol
Variabel bebas Koefisien T P
Waktu fermentasi -0.003592 -2.362 0.027
OD inokulan 0.226276 3.101 0.005
Persentase substrat 0.006835 1.350 0.191
Waktu fermentasi*waktu fermentasi 0.000043 2.776 0.011
OD inokulan*OD inokulan -0.108584 -3.016 0.006
Persentase substrat*Persentase substrat -0.000154 -0.347 0.732
R-Sq = 64.84% R-Sq (adj) = 55.25%
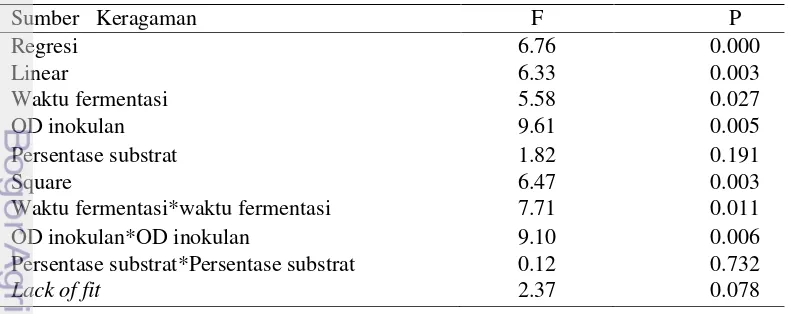
Data pada Tabel 6 memperlihatkan bahwa faktor yang memiliki pengaruh signifikan dengan nilai p kurang dari taraf α 0.05 adalah waktu fermentasi dan OD inokulan. Model regresi tersebut merupakan model regresi linear square dengan nilai lack of fit 0.078 yang dapat dilihat pada Tabel 7.
Tabel 7 Analisis ragam model regresi terhadap respon kadar etanol
Parameter kesesuaian model adalah nilai p dari model regresi dan nilai lack of fit. Nilai p dari model regresi ini adalah 0.000 kurang dari taraf α 0.05 (tabel 7) yang menunjukkan bahwa model berpengaruh signifikan. Selanjutnya, untuk menguji lack of fit, hipotesis yang digunakan dalam pengujian adalah:
Sumber Keragaman F P
Persentase substrat*Persentase substrat 0.12 0.732
14
H0 : Model regresi cocok (tidak ada lack of fit) H1 : Model regresi tidak cocok (ada lack of fit)
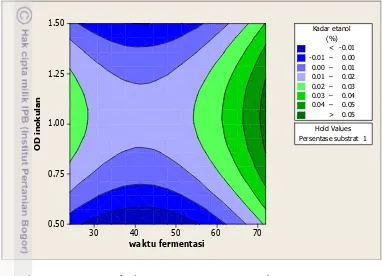
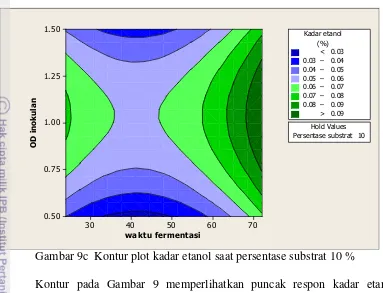
Model regresi ini memiliki nilai p lack of fit sebesar 0.078 yang lebih besar dari α 0.05 sehingga tidak ada alasan untuk menolak H0, dengan kata lain model regresi tersebut tepat. Optimasi faktor fermentasi dari Bacillus sp-Pjv menghasilkan etanol dengan kadar bervariasi seperti yang ditampilkan pada kontur plot (Gambar 9).
Gambar 9a Kontur plot kadar etanol saat persentase substrat gula lontar 1%
waktu fermentasi
15
Gambar 9c Kontur plot kadar etanol saat persentase substrat 10 %
Kontur pada Gambar 9 memperlihatkan puncak respon kadar etanol tertinggi yang dihasilkan ditandai oleh daerah dengan warna hijau gelap. Kadar etanol tertinggi (>0.09) dihasilkan ketika persentase substrat gula lontar 10%, waktu fermentasi 72 jam dengan nilai konsentrasi inokulan (OD) sebesar 1 (gambar 10c). Pada kombinasi tersebut, kadar etanol yang didapatkan mencapai 0.17%.
Analisis model regresi dari faktor fermentasi dan respon kadar etanol dilakukan untuk melihat hubungan antara variabel dan respon. Model regresi pada fermentasi ini adalah linear square dengan faktor yang berpengaruh signifikan yaitu waktu fermentasi dan konsentrasi inokulan. Sementara itu, faktor persentase substrat yang tidak berpengaruh signifikan menandakan bahwa peningkatan atau penurunan persentase substrat tidak berdampak signifikan terhadap respon kadar etanol, seperti yang terlihat pada Gambar 9 a, b dan c. Faktor waktu fermentasi memiliki nilai koefisien regresi negatif pada model linear dan positif pada model square. Pada tahap awal, fermentasi berlangsung dengan model regresi linear kemudian pada tahap akhir fermentasi berlangsung dengan model regresi square. Oleh karena itu, pada waktu fermentasi 72 jam terjadi peningkatan kadar etanol yang signifikan. Sebaliknya, konsentrasi inokulan memiliki nilai koefisien positif pada model regresi linear dan negatif pada model square. Hal ini menunjukkan bahwa pada awal fermentasi, peningkatan konsentrasi inokulan turut meningkatkan respon kadar etanol (koefisien regresi positif) namun ketika ditingkatkan terus menerus akan mengakibatkan penurunan respon kadar etanol (koefisien regresi negatif).
16
Gambar 10 Penurunan kadar gula pereduksi pada waktu 24 jam ( ) dan 72 jam ( )
Penurunan gula pereduksi terjadi karena glukosa dimetabolisme oleh mikroba dan mengalami fermentasi alkoholik. Grafik pada gambar 10 menunjukkan bahwa peningkatan persentase substrat hingga 10% tidak menunjukkan penurunan gula pereduksi yang signifikan. Hal ini sesuai dengan hasil kontur plot respon kadar etanol yang menunjukkan bahwa persentase substrat tidak berpengaruh signifikan terhadap kenaikan kadar etanol (Gambar 9a, b dan c).
Enzim yang bekerja pada tahap akhir fermentasi umumnya adalah PDC dan ADH. Piruvat dekarboksilase merupakan enzim tetramer dan tersebar luas pada tanaman, fungi dan eukariot tetapi jarang ditemukan pada bakteri (Konig katabolisme glukosa oleh Geobacillus thermoglucosidasius yang merupakan bakteri dari genus Bacillus, memperlihatkan bahwa enzim yang berperan pada pembentukan etanol adalah PFL (piruvat liase), AcDH (asil-koA dehidrogenase) dan ADH (alkohol dehidrogenase) (Gambar 11). Kemungkinan, Bacillus sp-Pjv memetabolisme glukosa melalui jalur yang sama pada G. thermoglucosidasius walaupun keberadaan enzim PFL dan AcDH belum diidentifikasi.
K
17
Gambar 11 Jalur metabolisme glukosa pada Geobacillus thermoglucosidasius (Extance et al. 2013)
Strategi konversi biomassa menjadi bioetanol dengan sistem termofilik SFS (Sakarifikasi dan Fermentasi Serentak) lebih menguntungkan karena mengurangi kontaminasi, tidak memerlukan pendinginan sehingga menghemat waktu dan menghemat enzim selulase. Selain itu, mikroorganisme termofilik memiliki keunggulan antara lain: dapat memfermentasi gula pentosa dan heksosa, resisten terhadap perubahan pH dan temperatur tinggi (Zaldivar et al. 2001; Hild et al. 2003; Takami et al. 2004). Penelitian Ou et al. (2009) menyatakan bahwa Bacillus coagulans lebih efektif dalam memfermentasi gula heksosa dan pentosa pada suhu 50-55ºC dan pH 5 dibandingkan dengan S. cerevisiae, Zymomonas mobilis dan Lactococcus lactis. Ia menurunkan penggunaan enzim selulase hingga tiga kali dibandingkan S. cerevisiae dan Z. mobilis dengan waktu fermentasi selama 48 jam.
18
thermoglucosidasius berhasil meningkatkan konsentrasi etanol menjadi 0.47 g/g (substrat xilosa), 0.42 g/g (substrat glukosa) dan 0.47 g/g (substrat selobiosa).
Faktor lain yang diduga mempengaruhi pembentukan etanol adalah pH optimal enzim. Enzim bekerja pada rentang pH tertentu yang terbatas dan pada pH tertentu aktivitas katalitik enzim akan mencapai kondisi optimal (pH optimal). pH yang digunakan pada fermentasi ini kemungkinan bukanlah pH optimal enzim ADH dalam mereduksi asetaldehid menjadi etanol. Su Yue et al. (2011) menemukan bahwa enzim ADH pada B. coagulans optimal dalam memfermentasi glukosa pada pH 7.0 dengan metabolit utama etanol mencapai 0.33 gram per gram glukosa. Hal ini senada dengan hasil penelitian Wales dan Fewson (1994) yang mengungkapkan bahwa enzim ADH pada prokariotik optimal mereduksi asetaldehid menjadi etanol pada pH 6.8.
Mekanisme termostabilitas enzim ADH pada Bacillus sp-Pjv belum dipelajari lebih lanjut. Namun bila dibandingkan dengan ADH pada S. cerevisiae, ADH G. thermoglucosidasius memiliki residu prolin yang lebih banyak yakni 11 residu prolin yang tersebar pada 10 beta turn. Sementara ADH S. cerevisiae memiliki 7 residu prolin yang tersebar pada 6 beta turn. Banyaknya residu prolin pada ADH G. thermoglucosidasius diduga menjadi alasan kestabilan enzim tersebut. Seperti yang dikemukakan oleh Zeikus et al. (1998) bahwa sifat termostabil dari enzim ditentukan oleh asam amino penyusunnya, adanya interaksi hidrofobik, jembatan garam, ikatan hidrogen dan stabilisasi oleh pembentukan loop. Kajian yang dilakukan oleh Extance et al. (2013) menunjukkan bahwa sifat termostabil alkohol dehidrogenase pada G. thermoglucosidasius disebabkan adanya loop yang lebih pendek dan lebih rigid dibandingkan dengan mesofilik ADH pada Escherichia coli. Hasil penelitian Ceccareli et al. (2014), ADH B. stearothermophilus (htADH) yang tumbuh optimal pada suhu 50-63ºC memiliki kesamaan sebesar 55% dengan ADH mesofilik dari E. coli (EcADH). Residu prolin 242 pada B. stearothermophilus sejajar dengan alanin 242 pada ADH E. coli. Adanya residu prolin pada loop menambah kekompakan dari rantai polipeptida yang menyebabkan enzim ADH B. stearothermophilus termostabil.
4
SIMPULAN DAN SARAN
Simpulan
19
Saran
Diperlukan optimasi fermentasi dengan menggunakan konsorsium mikroba terseleksi yang memiliki gen pdc dan adh paling unggul sehingga bisa meningkatkan etanol yang dihasilkan.
DAFTAR PUSTAKA
Arshadi, Grundberg. 2011. Biochemical Production of Bioethanol. Handbook of Biofuels Production. Sweden: Woodhead Publishing.
Bhalla A, Namita B, Sudhir K, K Bischoff, Rajesh KS. 2013. Improved lignocellulose conversion to biofuels with thermophilic bacteria and thermostable enzymes. Journal of Bioresource Technology 128 (2013) 751– 759. .doi.org/10.1016/j.biortech.2012.10.145
Bintang M. 2010. Teknik Penelitian Biokimia. Jakarta (ID): Erlangga.
Bischoff KM, Skinner N, Leathers T. 2007. Antimicrobial susceptibility of Lactobacillus species isolated from commercial ethanol plants. J. Industrial Microbiol Biotechnology 34, 739-744. doi. 10.1007/s10295.007.0250.4 Candy JM, Duggleby RG. 1998. Structure and properties of pyruvate
decarboxylase and site-directed mutagenesis of the Zymomonas mobilis enzyme. J. Biochim Biophys Acta 1385:323–338
Ceccarelli C, Zhao-Xun L, Michael S, Gerd P, Barry MG, Judith PK, Brian B. 2004. Crystal Structure and Amide H/D Exchange of Binary Complexes of Alcohol Dehydrogenase from Bacillus stearothermophilus: Insight into Thermostability and Cofactor Binding. Journal of Biochemistry, 43. 5266-5277. doi. 10.1021/bi049726p.
Cripps, K Eley, DJ Leak , B Rudd, M.Taylor, M Todd, S Boakes, S Martin, T Atkinson. 2009. Metabolic engineering of Geobacillus thermoglucosidasius for high yield ethanol production. Journal of metabolic engineering 11, 398-40. doi:10.1016/j.ymben.2009.08.005
[DNPI] Dewan Nasional Perubahan Iklim Republik Indonesia. 2014. Potensi Implementasi Teknologi Pengolahan Limbah Kelapa Sawit. Jakarta (ID): Kacindo Danatya.
Extance J, Crennell SJ, Eley K, Cripps R, Hough DW, Danson MJ. 2013. Structure of a bifunctional alcohol dehydrogenase involved in bioethanol generation in Geobacillus thermoglucosidasius. Journal of Acta Crystallographica Section D Biological Crystallography 69, 2104-2115. doi 10.1107/S0907444913020349.
Hild HM, Stuckey DC, Leak DJ. 2003. Effect of nutrient limitation on product formation during continuous fermentation of xylose with Thermoanaerobacter ethanolicus JW200 Fe (7). J. Appl Microbiol Biotechnol. 60, 679-686.doi 10.1007/s00253.002.1175.5
Konig S. 1998. Subunit structure, function and organisation of pyruvate decarboxylases from various organisms. J Biochim Biophys Acta 1385, 271– 286.
20
Littlechild JA, Isupov M.N, Guy JE. 2003. Hyperthermophilic Dehydrogenase Enzymes. J Biochemical Society Transactions Volume 32, part 2.
Montgomery C. 2008. Design and Analysis of Experiments (7th edition. Singapura (AU): Wiley and Sons Inc.
Moat A. 2002. Microbial Physiology. Singapura (SG): Wiley and Sons Inc. Ou M, N Mohammed , LO Ingram, KT Shanmugam. 2009. Thermophilic
Bacillus coagulans Requires Less Cellulases for Simultaneous Saccharification and Fermentation of Cellulose to Products than Mesophilic Microbial Biocatalysts. Journal of Applied Bioochemistry and Biotechnology 155, 76-82.
Pretorius IS. 2000. Tailoring wine yeast for the new millennium: novel approaches to the ancient art of winemaking. Singapura (SG): Wiley and Sons Inc.
Quintero Y, M Poblet, JM Guillamo, A Mas. 2008. Quantification of the expression of reference and alcohol dehydrogenase genes of some acetic acid bacteria in different growth conditions. Journal of Applied Microbiology 766, 1365-2672. doi:10.1111/j.1365-2672.2008.04046.x Riyanti I. 2010. Beberapa Gen pada Bakteri yang Bertanggung Jawab terhadap
Produksi Bioetanol. Jurnal Litbang Pertanian Bogor.
Rouhullah H, Nahvi I, Emtiazi G, Abedinifar S. 2007. Mixed sugar fermentation by Pichia stipitis, Saccharomyces cerevisiae, and an isolated xylose fermenting Kluyveromyces marxianus and their cocultures. African Journal of Biotechnology 6, 1110-1114.
Su Yue, Mun SR, LO. Ingram, KT Shanmugam. 2011. Physiological and fermentation properties of Bacillus coagulans and a mutant lacking fermentative lactate dehydrogenase activity. J Ind Microbiol Biotechnol 38:441–450. doi. 10.1007/s10295-010-0788-4.
Sudiyani Y, Dyah S, Eka T, Sudiyarmanto, Kiky C, Yosi A, Haznan, Min H. 2013. Utilization of biomass waste empty fruit bunch fiber of palm oil for bioethanol production using pilot – scale unit. J Energy Procedia 32, 31-38. doi: 10.1016/j.egypro.2013.05.005
Takami H, Takaki Y, Chee G, Nishi S,Shigeru S, Suzuki H, Matsui S, Uchiyama I. 2004. Thermodaptation trait revealed by the genome sequence of thermophilic Geobacillus kaustophilus. Oxford Journal 32, 6292-6303. Talarico, Malgorzata A. Gil, LP Yomano, LO Ingram, Julie A, Maupin-Furlow.
2005. Construction and expression of an ethanol production operon in Gram-positive bacteria. Journal of Microbiology 151, 4023–4031. doi 10.1099/mic.0.28375-0
Wagiman. 2012. Rancang bangun proses produksi bioetanol dari lignoselulosa sebagai energi terbarukan dengan pendekatan ekoefisiensi [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Walest M, Charles AF. 1994. NADP-dependent alcohol dehydrogenases in
bacteria and yeast: purification and partial characterization of the enzymes from Acinetobacter calcoaceticus and Saccharomyces cerevisiae. J of Microbiology 140, 173-183.
21 Zaldivar J, Nielson J, Olsson. 2001. Fuel ethanol production from lignocellulose: a challenge for metabolic engineering and process integration. J. Appl Microbiol Biotechnology 56, 17-34.doi 10.1007/s00253010062.
Zeikus GJ, Vicille C, Savchenko. 1998. Thermozymes: Biotechnology and
22
Lampiran 1 Diagram alir penelitian
23 Lampiran 2 Hasil analisis kadar etanol setelah fermentasi selama 48 jam
Luas area standar etanol 0.1 % = 13565.4
Sampel Luas area Luas area
standar
Kadar Etanol (%)
BS 5 7580 13565.4 0.055877453
BS 4 4695 13565.4 0.034610111
BS 2 3428 13565.4 0.025270173
BS 1 3612 13565.4 0.026626565
Lampiran 3 Kromatogram BS 1 setelah fermentasi selama 48 jam
24
Lampiran 5 Kromatogram BS 4 setelah fermentasi selama 48 jam
25 Lampiran 7 Kromatogram hasil optimasi fermentasi Bacillus sp-Pjv selama 72
26
RIWAYAT HIDUP
Penulis dilahirkan di Lampung, 10 Juli 1990. Penulis merupakan anak pertama dari empat bersaudara pasangan Bapak Muhsinin AN SE dan Ibu Munaiyah S.Pd. Pendidikan formal ditempuh di SDN 2 Bumi Agung, SMPN 19 Bandar Lampung dan SMA Negeri 9 Bandar Lampung. Pada tahun 2007, penulis mengambil mayor S1 Pendidikan Kimia di Universitas Lampung. Kemudian pada tahun 2013, penulis mengambil mayor S2 Biokimia di Institut Pertanian Bogor melalui jalur mandiri.
Sebagai salah satu syarat untuk memperoleh gelar magister pada Program Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, penulis menulis artikel pada jurnal Berita Biologi dengan judul
“Identifikasi Gen Termoasidofilik Alkohol Dehidrogenase pada Bacillus