OPTIMASI AGITASI DAN AERASI PADA PRODUKSI
XILANASE
Bacillus halodurans
CM1 DENGAN METODE
PERMUKAAN RESPON
INDAH WIDIYA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Optimasi Agitasi dan Aerasi Pada Produksi Xilanase Bacillus halodurans CM1 Dengan Metode Permukaan Respon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
INDAH WIDIYA. Optimasi Agitasi dan Aerasi Pada Produksi Xilanase Bacillus halodurans CM1 Dengan Metode Permukaan Respon. Dibimbing oleh ANI SURYANI dan BUDIASIH WAHYUNTARI.
Xilanase merupakan enzim ekstra seluler yang dapat menghidrolisis xilan (hemiselulosa) menjadi xilosa dan xilooligosakarida. Penelitian ini bertujuan untuk mendapatkan kondisi optimum produksi xilanase Bacillus halodurans CM1 dengan menggunakan pendekatan statistik menggunakan metode permukaan respon serta mendapatkan model persamaan kondisi optimum tersebut. Variabel yang digunakan dalam penelitian ini adalah laju aerasi (X1) dan laju agitasi (X2).
Desain dua level faktorial menunjukkan bahwa laju agitasi dan aerasi merupakan faktor yang mempengaruhi produksi xilanase, sehingga kemudian dilakukan optimasi dengan menggunakan rancangan komposit terpusat (CCD). Sebanyak 13 percobaan CCD dilakukan dengan menggunakan berbagai variasi agitasi dan aerasi pada fermentor 10 liter dengan volume kerja 8 liter. Hasil penelitian ini menunjukkan bahwa kecepatan agitasi dan interaksi antara kecepatan agitasi dan laju aerasi bersifat signifikan. Model ini dapat digunakan untuk menavigasi desain ruang. Konsentrasi batas atas dan batas bawah agitasi yang diamati adalah 150; 270 (rpm) dan aerasi adalah 0.51; 1.48 (vvm). Model persamaan optimasi aktivitas xilanase berdasarkan hasil penelitian yaitu Y= 344.18 – 37.19X1 + 249.21X2 – 94.48X1X2. Kecepatan agitasi dan laju aerasi yang optimum untuk produksi xilanase adalah 0.67 vvm dan 249.87 rpm. Kondisi ini diuji dan divalidasi secara eksperimental dengan hasil perkiraan aktivitas xilanase secara teoritis adalah 707.51 U/mL dan nilai hasil validasi menunjukkan aktivitas xilanase sebesar 728.67 U/mL, dengan demikian hasil validasi ini menunjukkan bahwa model persamaan optimum adalah valid.
SUMMARY
INDAH WIDIYA. Optimization of Agitation and Aeration on Xylanase Production by Bacillus halodurans CM1 Using Response Surface Method. Supervised by ANI SURYANI and BUDIASIH WAHYUNTARI.
Xylanase is an extracellular enzyme that can hydrolyze xylan (hemicellulose) into short chain xylooligosacharides and xylose. This research aims to obtain optimum conditions xylanase production by using statistical approaches of response surface design (RSM) and to get a model equation of the optimum conditions. The variables involved in this study were aeration (X1) and
agitation (X2) rates.
A two level factorial design identified aeration and agitation rates as the significant variables that affect xylanase production, and therefore, these variables would be optimized by Central Composite Design (CCD) matrix of RSM. A 13 central composite experimental design was performed with the aim of optimizing the production of xylanase in 10 L fermentor with working volume of 8 L. The experimental result showed the model agitatioan and the interaction between aeration and agitation rates was significant. The model could be used to navigate the design space. The upper and lower aeration and agitation rates observed was 0.51; 1.48(vvm) and 150; 270 (rpm) respectively. The optimum equation based on the experimental RSM result was xylanase activity Y= 344.18 – 37.19X1 +
249.21X2 – 94.48X1X2. The optimum aeration and agitation rates was 0.67 (vvm)
and 249.87 (rpm) respectively. Under these conditions, the model predicted xylanase activity 707.51 U/mL and the validation result showed xylanase activity of 728.67 U/mL, it can be concluded that the model was valid.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
OPTIMASI AGITASI DAN AERASI PRODUKSI XILANASE
Bacillus halodurans
CM1 DENGAN METODE
PERMUKAAN RESPON
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Optimasi Agitasi dan Aerasi Pada Produksi Xilanase Bacillus halodurans CM1 dengan Metode Permukaan Respon
Nama : Indah widiya NIM : P051130111
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Ani Suryani, DEA Ketua
Dr Budiasih Wahyuntari Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2014 sampai September 2015 ini adalah Optimasi Agitasi dan Aerasi Produksi Xilanase Bacillus halodurans CM1 Dengan Metode Permukaan Respon.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ani Suryani, DEA dan Ibu Dr Budiasih Wahyuntari selaku pembimbing yang telah banyak memberi saran, motivasi, dan solusi dari setiap permasalahan yang penulis hadapi selama melakukan penelitian ini. Penulis juga mengucapkan terima kasih kepada Prof Dr Ir Suharsono, DEA selaku ketua Program Studi Bioteknologi. Kepada DIKTI penulis mengucapkan terima kasih atas kepercayaannya untuk memberikan beasiswa selama menempuh pendidikan di Sekolah Pascasarjana IPB melalui Beasiswa Unggulan tahun 2013/2014. Penulis mengucapkan terimakasih kepada suami Eko Santoso, ST dan keluarga atas dukungan yang diberikan.
Terima kasih kepada seluruh staf Laboratorium Teknologi Bioindustri Badan Pengkajian dan Penerapan Teknologi yang telah membantu selama pengumpulan data, serta kepada rekan-rekan sesama mahasiswa penelitian di Laboratorium, untuk masukan, kerjasama dan kebersamaanya selama penelitian. Terakhir penulis juga mengucapkan terimakasih kepada teman-teman Bioteknologi angkatan 2013 dan semua pihak yang berperan serta dalam membantu penulis selama ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesa 2
2 TINJAUAN PUSTAKA 3
3 METODE 9
Waktu dan Tempat 9
Alat dan Bahan 9
Cara Kerja 9
Desain Penelitian 12
Analisis Statistik 12
4 HASIL DAN PEMBAHASAN 13
5 KESIMPULAN 22
DAFTAR PUSTAKA 23
LAMPIRAN 26
DAFTAR TABEL
1 Hasil analisis ragam (ANOVA) desain faktorial dua level 13 2 Lanjutan hasil analisis ragam (ANOVA) desain faktorial dua level 13 3 Pengkodean level dan nilai level eksperimen CCD 14 4 Pemilihan model berdasarkan uraian jumlah kuadrat dari urutan model 15 5 Pemilihan model berdasarkan pengujian ketidaktepatan model 15 6 Pemilihan model berdasarkan ringkasan model secara statistik 15 7 Hasil uji analisa ragam (ANOVA) dari desain eksperimen CCD 16 8 Lanjutan hasil uji analisa ragam (ANOVA) dari desain eksperimen
CCD
16 9 Validasi model berdasarkan solusi desain model 18
DAFTAR GAMBAR
1 Ilustrasi reaktor pemroses dan perlengkapannya 6 2 Contoh grafik permukaan respon secara teoritis 7 3 Distribusi sebaran nilai aktual dan prediksi produksi xilanase 17 4 Respon permukaan dan kontur plot pengaruh Aerasi dan Agitasi
dengan level terkodekan terhadap produksi xilanase
17 5 Kurva hubungan jumlah sel B. Halodurans CM1 dan aktivitas
produksi xilanase pada 50 ºC pH 9 selama waktu inkubasi
19 6 Kurva hubungan antara kadar protein xilanase dan aktivitas xilanase
pada 50 ºC pH 9 terhadap waktu inkubasi
20 7 Kurva hubungan antara aktivitas dan aktivitas spesifik xilanase pada
50 ºC pH 9 terhadap waktu inkubasi
21
DAFTAR LAMPIRAN
1 Matriks Percobaan faktorial 2k pengaruh agitasi dan aerasi terhadap produksi xilanase B. halodurans CM1
26 2 Matriks Central Composite Design (CCD) agitasi dan aerasi terhadap
produksi xilanase B. halodurans CM1
1
PENDAHULUAN
Latar Belakang
Enzim merupakan biokatalis di dalam sel yang dapat mempercepat reaksi kimiawi tanpa mengubah strukturnya. Enzim banyak dimanfaatkan dalam industri sebagai alternatif dari penggunaan bahan-bahan kimia yang mencemari lingkungan. Salah satu enzim yang banyak dimanfaatkan dalam kegiatan industri seperti industri pangan, pakan ternak, pemutih kertas dan biokonversi lignoselulosa untuk bahan bakar adalah xilanase. Xilanase termasuk kelompok enzim xilanolitik yang merupakan enzim ekstraseluler yang dapat menghidrolisis xilan menjadi xilooligosakarida dan xilosa. Enzim ini terdiri atas endo-β-xilanase
(EC 3.2.1.8) dan β-xylosidases (EC 3.2.1.37). Xilanase dapat dihasilkan oleh mikroba melalui proses fermentasi.
Salah satu manfaat xilanase yang banyak dikembangkan adalah dalam proses bleaching pulp dan kertas di industri kertas. Aplikasi utama xilanase dalam industri kertas adalah menggantikan agen pemutihan kimia, sehingga menghasilkan kecerahan yang lebih besar (Sangvhi et al. 2014). Proses bleaching pulp dilakukan pada pH dan suhu yang tinggi. Oleh karena itu diperlukan xilanase yang bersifat alkalo termofilik. Untuk memenuhi kebutuhan industri yang spesifik, xilanase yang ideal harus dilengkapi dengan sifat tertentu, seperti memiliki stabilitas termal, aktivitas spesifik yang tinggi, dan resistensi yang kuat untuk kation logam dan bahan kimia. Lin et al (1999) menyatakan bahwa beberapa kelompok mikroorganisme yang telah diketahui dapat menghasilkan xilanase antara lain adalah kelompok bakteri dan cendawan. Bakteri penghasil xilanase antara lain Bacillus spp., B.stearothermophilus, B. circulans, Clostridium stercorarium, Thermonospora fusca, dan Thermatoga sp.
2
Selain pH dan komposisi medium yang digunakan, produksi enzim juga dipengaruhi oleh kondisi fermentasi. Pengaturan kondisi bioproses (fermentasi) terbaik sangat penting, khususnya dalam memahami pengaruh agitasi dan aerasi sebagai langkah kunci untuk melakukan scale up produksi xilanase sampai ketingkat industri. Menurut Karimi et.al (2013) transfer oksigen seringkali menjadi faktor pembatas dalam proses aerobik yang disebabkan oleh rendahnya kelarutan oksigen di dalam medium, sehingga aerasi menjadi faktor yang kritis pada industri fermentasi aerobik. Pada bioreaktor tangki berpengaduk, perpindahan massa oksigen merupakan fungsi dari banyak variabel, seperti sifat fisik cairan (viskositas, tegangan permukaan), geometri bejana dan pengaduk, jenis sparger dan kondisi operasional. Richana et al (2000) menyatakan bahwa aerasi berfungsi mempertahankan kondisi aerobik karena aerasi berperan dalam transfer oksigen di dalam medium, sedangkan agitasi berfungsi untuk meningkatkan daya aduk (shear), sehingga kondisi fermentasi berlangsung homogen.
Optimasi agitasi dan aerasi dilakukan dalam bioreaktor 10 liter dengan volume kerja 8 liter. Optimasi kondisi fermentasi produksi xilanase dilaksanakan dengan teknik optimasi response surface method (RSM). Teknik optimasi RSM digunakan untuk mendapatkan kombinasi agitasi dan aerasi terbaik. Box dan Draper (1987) menyatakan bahwa RSM merupakan alat optimasi yang memungkinkan untuk mendapatkan penjelasan menyeluruh mulai dari desain penelitian, pengolahan data dan solusi optimasi.
Perumusan Masalah
Berdasarkan uraian pada latar belakang, maka dapat dirumuskan permasalahan sebagai berikut yaitu bagaimana pengaruh besarnya kombinasi agitasi dan aerasi terhadap fermentasi produksi xilanase dari B. halodurans CM1 pada fermentor 10 liter dengan volume kerja 8 liter.
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mendapatkan kondisi optimum produksi xilanase B. halodurans CM1 dengan kombinasi terbaik dari variasi agitasi dan aerasi.
2. Mendapatkan model persamaan kondisi optimum produksi xilanase B. halodurans CM1 dengan menggunakan metode permukaan respon.
Hipotesa
1. Kombinasi agitasi dan aerasi diduga berpengaruh terhadap produksi xilanase pada fermentor oleh B halondurans CM1.
3
2
TINJAUAN PUSTAKA
Xilanase
Hemiselulosa sebagian besar terdiri dari xilan yang merupakan heteropolimer yang tersusun atas β-1-4-D-xilosa dan memiliki cabang arabinosa, asam glukoronik, mannosa dan sisa acetil. Xilan adalah komponen penting hemiselulosa dan bersama selulosa merupakan polisakarida terbaharui yang berlimpah di alam. Xilan merupakan komponen utama dari hemiselulosa yang berikatan secara kovalen dan non kovalen dengan selulosa, lignin, pektin dan polisakarida lain untuk menyusun dinding sel tanaman. Xilan disusun oleh unit-unit kerangka utama ikatan β-1,4-D-xilopiranosa dengan rantai samping yang pendek dari arabinofuranosa, asam glukuronat, asam metil glukuronat dan asetil (Meryandini et al. 2008).
Xilanase merupakan enzim yang penting dalam mendegradasi komponen dinding sel pada tumbuhan seperti hemiselulosa. Xilanase (1,4 β -D-xylanohidrolase; EC 3.2.1.8) adalah enzim ekstraseluler yang dapat menghidrolisis xilan menjadi xilooligosakarida dan xilosa (Heck et al. 2005). Enzim pendegradasi xilan meliputi endo-1,4 β-xilanase, β-D-xilosidase,
asetilxilan esterase, arabinase dan α-glukoronidase. Endo-1,4 β-xilanase menghidrolisis xilooligosakarida menjadi xilosa. Asetilxilan esterase memisahkan O-asetil dari posisi 2 atau 3 pada β-D-xilopiranosil. Arabinase memisahkan L-arabinosa yang tersubtitusi pada posisi 2 atau 3 dari β-D-xilopiranosil. α
-glukoronidase menghidrolisis asam glukoronik dengan β-D-xilopiranosil.
Xilanase diklasifikasikan berdasarkan substrat yang dihidrolisis yaitu β -xilosidase, eksoxilanase, dan endoxilanase (Beg et al. 2001; Richana 2002). β -xilosidase memiliki kemampuan menghidrolisis xilooligosakarida menjadi xilosa. Aktivitas enzim akan menurun dengan meningkatnya rantai xilooligosakarida. Eksoxilanase memutus rantai polimer xilan pada ujung reduksi, sehingga menghasilkan xilosa sebagai produk utama dan sejumlah oligosakarida rantai
pendek seperti xilobiosa. Endoxilanase memutus ikatan β-1,4 pada bagian dalam rantai xilan secara teratur menjadi xilooligosakarida (Richana 2002).
Endoxilanase mampu memutus ikatan β-(1,4) pada bagian dalam rantai xilan secara acak. Ikatan yang diputus ditentukan berdasarkan panjang rantai substrat, derajat percabangan, ada atau tidaknya gugus subtitusi, dan pola pemutusan dari enzim hidrolase tersebut.
Xilanase memiliki banyak peranan dalam kegiatan industri. Salah satu peranan xilanase dalam industri yaitu digunakan dalam proses prebleaching pulp. Penggunaan xilanase pada industri pulp dan kertas meningkat tajam sejak ditemukan pertama kali oleh Viikari et al. (1994), digunakan pada proses awal pemutihan pulp pada industri pulp dan kertas (Septiningrum dan Moeis, 2009). Pada pembuatan kertas, xilanase digunakan untuk menghilangkan hemiselulosa dalam proses bleaching. Enzim ini sebagai pengganti cara kimia sehingga pencemaran racun limbah kimia dapat dihindari.
4
karena ramah lingkungan. Penggunaan xilanase dalam proses biobleaching diharapkan dapat meminimalisasi penggunaan klorin. Xilanase yang digunakan dalam proses biobleaching adalah xilanase termoalkalistabil yang tahan terhadap suhu dan keasaman tinggi (Nakamura et al. 1993).
Penggunaan enzim termostabil dalam bioteknologi dapat meningkatkan kecepatan reaksi-reaksinya. Nilai ekonomis yang dimiliki xilanase yang dikehendaki dalam proses industri antara lain yaitu stabil selama penyimpanan, reaksi berlangsung pada suhu tinggi sehingga akan mengurangi kontaminasi oleh bakteri mesofilik, lebih tahan terhadap pelarut, detergen, dan senyawa denaturan, pemisahan produk yang mudah menguap akan lebih cepat (Suhartono 1989).
Selain dimanfaatkan dalam industri kertas, xilanase juga dapat digunakan untuk menghidrolisis xilan (hemiselulosa) menjadi gula xilosa. Pengembangan proses hidrolisis secara enzimatis merupakan prospek baru untuk penanganan limbah hemiselulosa (Biely, 1985; Rani dan Nand, 1996; Beg et al., 2001). dalam industri makanan, seperti aditif untuk pakan ternak, xilanase juga digunakan dalam pembuatan roti untuk meningkatkan volume dan adsorpsi air, pada ekstraksi industri jus dan wine.
Xilanase dapat ditemukan pada alga laut, protozoa, crustacea, insekta, siput dan biji tanaman. Fungi penghasil xilanase antara lain Trichoderma, Aspergillus, Cephalosporium dan Penicillium. Bakteri penghasil xilanase antara lain Bacillus, Paenibacillus, Escherichia coli, dan Aeromonas sp (Kubata et all. 1992).
Bakteri Penghasil Xilanase
Bakteri penghasil xilanase alkalotermofilik yang dibutuhkan dalam industri kertas adalah bakteri yang biasanya bersifat alkalotermofilik. Bakteri alkalotermofilik adalah bakteri yang dapat hidup pada pH basa dan di atas suhu 45oC. Bakteri ini biasanya ditemukan pada lingkungan ekstrim seperti sumber air panas, lingkungan industri panas, tumbuhan yang membusuk, tanah dan laut yang terpapar matahari (Collin 2005). Menurut Sutiamiharja (2008), bakteri termofil menghasilkan enzim termostabil yang sangat penting dalam proses industri dan bioteknologi, seperti dalam teknik-teknik biologi molekuler untuk kegunaan penelitian dan diagnostik (enzim yang memproses DNA dan RNA) dan kemampuan enzim dalam pengelolaan sampah, pembuatan kertas dan sintesis zat-zat organik.
Ketahanan bakteri terhadap suhu tinggi disebabkan oleh adanya enzim-enzim dan protein yang tahan terhadap panas. Selain itu, pada membran sel bakteri tersebut terdapat asam-asam lemak jenuh yang memungkinkan membran sel berfungsi dengan baik dan stabil pada suhu tinggi.
5 bulat dan berwarna putih kecoklatan dan Berdasarkan analisis 16S rRNA urutan kesamaan karakteristik dan biokimia, dikelompokkan ke dalam kelompok yang sama dengan spesies Bacillus halodurans C-125 dengan identitas kesamaan 99%. Dengan demikian isolat bakteri tersebut dinamakan sebagai Bacillus halodurans CM1.
Reaktor
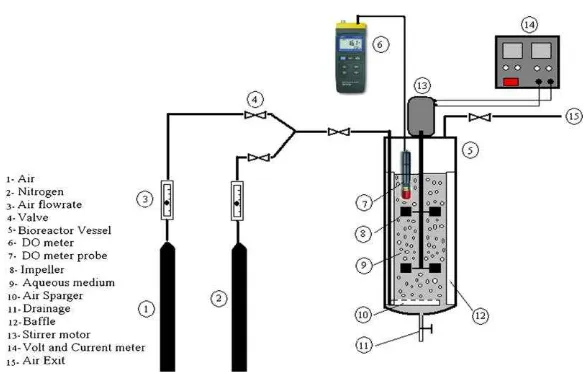
Selama kegiatan produksi enzim, terdapat dua faktor penting yaitu sel bakteri yang digunakan dan kondisi lingkungan. Kedua proses tersebut berguna agar proses yang terjadi berlangsung sempurna. Lingkungan optimal dapat dicapai dengan menempatkan sel pada suatu wahana yang disebut bioreaktor. Oleh karena itu, bioreaktor dirancang sebaik mungkin agar proses yang berlangsung dapat terjadi secara optimal (Mangunwidjaja dan Suryani 1994).
Fungsi dasar bioreaktor adalah memberikan lingkungan yang terkontrol (suhu, pH, O2 terlarut) untuk pertumbuhan mikroba dalam menghasilkan produk
yang diinginkan. Optimasi pertumbuhan biokatalis/pembentukan produk dapat dicapai dengan memasok:
1. Sumber energi
2. Nutrisi (hara) penting untuk memenuhi semua kebutuhan mikroba 3. Inokulum
4. Penghilangan komponen penghambat dari media 5. Kondisi fisikokimiawi yang optimal
Pada bioreaktor yang menjalankan proses fermentasi aerob, maka pengadukan/agitasi dan sirkulasi oksigen/aerasi menjadi hal yang penting. Adapun fungsi sistem agitasi adalah:
1. Agar pencampuran merata sehingga meningkatkan laju perpindahan massa menembus film pembatas cairan dan gelembung udara
2. Memberikan kondisi "shear" yang dibutuhkan untuk memecah gelembung udara sehingga luas permukaan pindah massa lebih besar
3. Sistem agitasi terdiri dari : agitator dan baffle.
Baffle digunakan untuk memecah aliran cairan dalam rangka meningkatkan turbulensi dan efisiensi pencampuran.
Sistem pemasokan oksigen pada bioreaktor terdiri dari:
1. Kompressor yang menekan udara masuk ke dalam bioreaktor 2. Sistem sterilisasi udara masuk (inlet)
3. Sparger udara
4. Sistem sterilisasi udara keluar
Aerasi berfungsi untuk mempertahankan kondisi aerobik dan mengatur temperatur substrat tetap konstan. Kondisi aerobik dipertahankan dengan mengatur tingkat oksigen yang dibutuhkan untuk sintesis produk, jumlah panas metabolik yang harus dihilangkan dari bahan, ketebalan lapisan substrat, tingkat CO2 dan metabolit-metabolit lain yang mudah menguap harus dihilangkan, dan
6
Gambar 1 Ilustrasi reaktor pemroses dan perlengkapannya (Karimi et al. 2013) Bioreaktor tangki berpengaduk memberikan nilai massa dan kecepatan transfer panas yang tinggi dan pencampuran yang sangat baik. Dalam sistem ini, tingginya jumlah variabel mempengaruhi perpindahan massa dan pencampuran, tapi yang paling penting diantaranya adalah kecepatan pengaduk, jenis dan jumlah pengaduk dan laju alir gas yang digunakan.
Response Surface Methodology (RSM)
Response surface methodology (RSM) merupakan serangkaian teknik matematika dan statistika yang digunakan untuk membuat model secara empirik. Dengan desain percobaan yang cermat, tujuannya adalah untuk mengoptimalkan respon (variabel output) yang memiliki pengaruh terhadap variabel bebas (input variabel). Percobaan merupakan serangkaian tes, yang disebut dengan runs, yang mana perubahan yang dibuat dalam input variabel dalam rangka mengidentifikasi alasan perubahan respon keluaran. Aplikasi optimasi dengan menggunakan desain RSM bertujuan untuk mengurangi biaya yang mahal dari metode analisis (seperti metode finite element atau analisis Center Fractional Design (CFD) dan berhubungan dengan banyaknya angka (Box dan Draper 2007).
Menurut Wibowo (2008), RSM merupakan sekumpulan teknik matematika dan statistika yang berguna untuk menganalisis permasalahan dimana beberapa variabel independen mempengaruhi variabel respon dan tujuan akhirnya adalah untuk mengoptimalkan respon. Ide dasar metode ini adalah memanfaatkan desain eksperimen berbantuan statistika untuk mencari nilai optimal dari suatu respon.
7
Gambar 2 Contoh grafik permukaan respon secara teoritis (Box dan Draper 2007) Aspek yang penting dalam RSM adalah desain eksperimen yang biasanya disingkat dengan DoE. Strategi ini berasal dari pengembangan untuk model penyesuaian dalam percobaan fisik, tapi dapat juga diaplikasikan ke dalam percobaan numerik. Tujuan DoE adalah untuk menyeleksi poin dimana respon harus dievaluasi. Langkah pertama dari RSM adalah menemukan hubungan antara respon y dan faktor x melalui persamaan polinomial orde pertama dan digunakan model regresi linear, atau yang lebih dikenal dengan first-order model (model orde pertama):
∑ (1) Rancangan eksperimen orde pertama yang sesuai untuk tahap penyaring faktor adalah rancangan faktorial 2k (Two Level Factorial Design). Selanjutnya untuk model orde kedua, biasanya terdapat kelengkungan dan digunakan model polinomial orde kedua yang fungsinya kuadratik :
∑ ∑ ∑ (2) Keterangan :
Y = Respon pengamatan
Βo = Intersep
Βi = Koefisien linier
Βii = Koefisien kuadratik
Βij = Koefisien interaksi perlakuan Xi = Kode perlakuan untuk faktor ke-i Xj = Kode perlakuan untuk faktor ke-j K = Jumlah faktor yang dicobakan
8
dalam CCD yang harus ditentukan yaitu besarnya α (nilai aksial) dari percobaan
aksial dari pusat rancangan dan nilai titik pusat nc. Rancangan komposit pusat
berotasi dengan α yang dipilih. Nilai α untuk berotasi tergantung pada nilai dari titik dalam ukuran rancangan faktorial. Nilai α = (nf)1/4 menghasilkan sebuah
rancangan komposit pusat rotatable dimana nf adalah angka dari titik yang digunakan dalam bagian rancangan faktorial.
9
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan November 2014 sampai September 2015 bertempat di Laboratoria Pengembangan Industri Agro-Biomedika (LAPTIAB), Badan Pengkajian dan Penerapan Teknologi (BPPT), Kawasan PUSPIPTEK Serpong, Tangerang Selatan.
Alat
Peralatan yang digunakan dalam penelitian adalah Fermentor dengan volume 10 liter, Refrigerated Centrifuge [Hitachi CR226], Rotor RIOA2, Cold Microsentrifuge Sorvall, Fresco, [Hettich Zentrifugenmicro 200R], deep freezer -800 C [LG Expresscool], Inlab pH meters (USA), Autoclaf sterilisasi [ALP KT-40], Laminar airflow Cabinet [ESCO], Inkubator shaker [Kuhner UNIMAX], Water bath, Spectrophotometer Genesys UV-10, erlenmeyer 500 ml [Iwaky PYREX®], gelas beaker 250 ml [Iwaky PYREX®].
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah bacto pepton [Merck], Yeast ekstrak [Himedika], tongkol jagung, KH2PO4, MgSO4_7H2O,
Na2CO3, NaCl, CaCl2, gliserol 70% , NaOH 2 M, HCl 5N, pure agar powder,
Tris-base, mili-Q water, alkohol 70%, Aseton, xilosa, BSA, DNS, Tepung ikan P.
Mikroorganisme
Mikroorganisme yang digunakan B. halodurans CM1 dari koleksi laboratorium Teknologi Bioindustri, BPP Teknologi.
Cara Kerja Penyiapan Isolat dan Inokulum
Isolat B. halodurans CM1 yang telah menghasilkan zona bening dan disimpan dalam gliserol stok pada suhu -80 oC direfresh dengan mengambil sebanyak 200 µL ke dalam 10 mL media tumbuh Horikoshi (1999) dengan komposisi 1% pepton, 0.5% yeast ekstrak, 0.1% KH2PO4 dan 0.5% Na2CO3
dalam erlenmeyer 100 ml, biarkan selama 6 jam kemudian digores pada media nutrient agar miring sebagai working culture dan digores pada media nutrient agar plate sebagai stock culture. Tabung dan plate agar kemudian diinkubasi dalam inkubator pada suhu 700 C selama 24 jam setelah itu koloni bakteri B. halodurans CM1 yang tumbuh disimpan di freezer suhu -80 oC.
Isolat B. halodurans CM1 ditumbuhkan pada media starter Horikoshi (1999) dengan komposisi 1% pepton, 0.5% yeast ekstrak, 0.1% KH2PO4 dan
10
starter diinokulasi dengan suspensi bakteri 108/mL. Propagasi dilakukan di dalam erlenmeyer pada suhu 500 C dengan kecepatan agitasi 150 rpm selama 4 jam.
Pembuatan Substrat Tongkol Jagung
Tongkol jagung diambil dari limbah pertanian. Tongkol jagung yang telah dikeringkan dan digiling dengan hammer mill dengan ukuran 10 mesh dipisahkan antara bagian berat dan bagian ringan dengan cara di tampi. Tongkol jagung berat, kemudian di haluskan dengan menggunakan disc mill hingga berukuran 70 mesh. Tongkol jagung berukuran 70 mesh ini yang akan digunakan sebagai substrat produksi xilanse.
Pembuatan Media Produksi Modifikasi
Media produksi dibuat dengan menggunakan media Mamo et al (2006) yang dimodifikasi oleh Wibowo (2014). 0.1% KH2PO4, 1% Na2CO3, 0.2% NaCl,
0.01% MgSO4, 0.01% CaCl2, tepung ikan (P) sebanyak 140 g dan tongkol jagung
349.6 g. Komposisi media dicampur kemudian dilarutkan dalam 5 liter air RO, kemudian dihomogenkan. Setelah medium larut, pH diatur dengan penambahan HCl 5N hingga pH 9, kemudian volume media ditambahkan hingga 8 liter, media disterilisasi dalam autoklaf 121 oC selama 20 menit.
Optimasi Agitasi dan Aerasi Produksi Xilanase
Tahapan optimasi RSM yang pertama yaitu desain eksperimen dengan 2-level faktorial, untuk mendapatkan konsentrasi batas bawah dan batas atas masing-masing variabel (Lampiran 1). Dilanjutkan dengan tahapan optimasi yang kedua yaitu dengan menggunakan desain eksperimen dengan Central Composite Design (CCD). Produksi xilanase dilakukan sesuai dengan variasi kombinasi yang ditentukan oleh RSM (Lampiran 2) dalam fermentor 10 L, berisi 8 L media produksi. Kemudian diinokulasikan kultur bakteri yang berada di media starter sebanyak 800 mL. Kondisi fermentor dipertahankan pada 50 oC dengan kombinasi agitasi dan aerasi sesuai RSM. Sampling dilakukan setiap 6 jam dimulai sejak inkubasi awal, fermentasi berlangsung selama 36 jam.
Penghitungan Jumlah Bakteri
11
Pengukuran Aktivitas Xilanase
Aktivitas xilanase diukur dengan metode Bailey (1992) yang dimodifikasi yaitu dengan mengukur kadar gula pereduksi yang dibebaskan selama reaksi hidrolisis xilan oleh xilanase pada kondisi reaksi optimum enzim yaitu pada suhu 70 0C (Syifa 2014). Sebanyak 50 μl enzim kasar dicampur dengan 450 μL substrat xylan 0.5% dalam buffer Tris-HCl pH 9. Campuran diinkubasi dalam thermomixer selama 5 menit pada suhu 70 °C dengan kecepatan 300 rpm. Kemudian ditambahkan 50 μl enzim kasar dan diinkubasi kembali selama 5 menit pada suhu 70 °C dengan kecepatan 300 rpm. Reaksi dihentikan dengan
penambahan 750 μL (Dinitrosalicylic) DNS. Campuran kemudian diinkubasi selama 5 menit pada air mendidih dan didinginkan pada suhu kamar, kemudian ditambahkan air RO sebanyak 250 μl dan dihomogenkan. Pengukuran absorbansi dilakukan pada panjang gelombang 540 nm.
Kontrol dibuat dengan menginkubasi 450 μl substrat xilan 0.5% dalam buffer Tris-HCl pH 9 pada suhu 70 °C selama 5 menit. Reaksi dihentikan dengan
menambahkan 750 μl DNS, lalu ditambahkan 50 μl enzim kasar. Campuran diinkubasi dalam air mendidih selama 5 menit. Pengukuran absorbansi dilakukan pada panjang gelombang 540 nm. Penentuan aktifitas xilanase menggunakan kurva standar xilosa dengan membuat variasi konsentrasi standar xilosa di dalam larutan buffer Tris-HCl pH 9 konsentrasi 0-1 mg/ml. Kurva standar xilosa adalah grafik hubungan absorbansi dengan variasi konsentrasi xilosa.
Satu unit aktivitas xilanase didefinisikan sebagai banyaknya enzim yang dapat memproduksi 1 μmol xilosa/menit/mL pada kondisi tertentu. Aktivitas xilanase dihitung berdasarkan rumus berikut :
Dimana GP adalah gula pereduksi dan FP adalah faktor pengenceran
Pembuatan Kurva Standar Xilosa
Kurva standar xilosa dibuat dengan cara membuat variasi konsentrasi standar xilosa di dalam larutan buffer Tris-HCl pH 9. Variasi konsentrasi xilosa yang digunakan yaitu 0-1 mg/mL. Larutan xilosa dari masing-masing konsentrasi diambil sebanyak 50 μL dimasukkan ke dalam tabung eppendorf kemudian ditambahkan 450 μL substrat xilan 0.5% dalam buffer Tris-HCl pH 9. Campuran diinkubasi selama 5 menit pada suhu 70 oC, kemudian ditambahkan DNS sebanyak 750 μL dan diinkubasi ke dalam air mendidih selama 5 menit. Pengukuran absorbansi dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 540 nm. Kurva standar xilosa diperoleh dari grafik hubungan absorbansi dengan variasi konsentrasi xilosa.
Penentuan Kadar Protein
12
pereaksi Bradford yang telah diencerkan 5 kali pada tabung reaksi. Campuran dihomogenkan dengan vorteks dan diinkubasi pada suhu kamar selama 20 menit. Pengukuran absorbansi dilakukan pada panjang gelombang 595 nm. Konsentrasi protein ditentukan dengan menggunakan kurva standar bovine serum albumin (BSA). Metode Bradford merupakan salah satu teknik penentuan kadar protein yang berdasarkan pada pengikatan secara langsung zat warna Coomassine Brilliant Blue G250 (CBBG) oleh protein pada kondisi pH asam. Hubungan antara konsentrasi larutan standar dan absorbansinya dinyatakan sebagai persamaan regresi linier: Y = a + bx. Kurva standar BSA adalah grafik hubungan konsentrasi protein standar (BSA dengan variasi konsentrasi) dengan nilai absorbansi pada panjang gelombang 595 nm.
Pembuatan Kurva Standar BSA
Kurva standar BSA dibuat dengan membuat variasi konsentrasi standar BSA di dalam larutan buffer Tris-HCl pH 9. Setiap konsentrasi standar BSA diambil sebanyak 30 μl kemudian dicampurkan dengan 1.5 mL larutan Bradford dalam tabung reaksi. Larutan kemudian dihomogenkan dengan vorteks dan diinkubasi selama 30 menit pada suhu kamar. Pengukuran absorbansi dilakukan dengan spektrofotometer pada panjang gelombang 595 nm. Kurva standar adalah grafik hubungan konsentrasi protein standar dengan nilai absorbansi pada panjang gelombang 595 nm.
Desain Penelitian
Penelitian ini merupakan penelitian eksperimental yang dilakukan dengan teknik optimasi response surface methodology (RSM), sebuah metodologi atau alat optimasi yang memungkinkan untuk memperoleh penjelasan menyeluruh mulai dari desain penelitian, analisis data dan optimasi. Optimasi RSM meliputi : (a) Penentuan faktor optimum besaran campuran dan respon optimasi, (b) Pencampuran kombinasi taraf faktor yang diberikan RSM, (c) Pencarian solusi terbaik (kombinasi optimum). Desain faktorial dilakukan untuk menentukan kondisi yang optimal untuk produksi xilanase oleh B. halodurans CM1. Variabel dependen dipilih untuk penelitian ini adalah aktivitas enzim sedangkan variabel independen yang dipilih adalah agitasi dan aerasi. Faktor yang dioptimasi untuk kegiatan enzim sebagai berikut : X1 untuk agitasi dan X2 untuk aerasi.
Analisis Statistik
13
4
HASIL DAN PEMBAHASAN
Untuk mendapatkan produksi xilanase yang optimal pada skala fermentor maka perlu dilakukan optimasi agitasi dan aerasi. Pada tahap optimasi ini akan diperoleh titik-titik optimum produksi. Optimasi menggunakan metode permukaan respon dilakukan untuk penyeleksian kondisi agitasi dan aerasi yang terbaik dalam proses fermentasi produksi enzim xilanase. Tahapan eksperimen dengan metode permukaan respon meliputi dua desain eksperimen yaitu desain eksperimen faktorial dua level (2k) dan desain eksperimen Central Composite Design.
Respon yang dianalisis menggunakan ANOVA adalah aktivitas xilanase selama waktu produksi. Model ANOVA yang digunakan dipilih sesuai dengan model yang direkomendasikan oleh program yaitu model yang mempunyai nilai signifikan pada ANOVA dan memiliki nilai nonsignifikan pada lack of fit.
Desain Eksperimen Faktorial Dua level
Desain faktorial dua level digunakan untuk menentukan faktor-faktor yang berpengaruh dalam produksi enzim xilanase dan faktor-faktor yang diamati. Tingkat aerasi (X1) untuk batas atas 1.75 vvm dan batas bawah 0.67 vvm,
sedangkan agitasi (X2) untuk batas atas 250 rpm dan batas bawah 150 rpm.
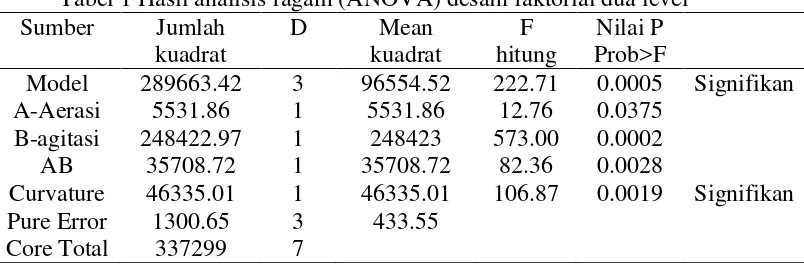
Dengan menggunakan desain eksperimen faktorial dua level dengan menggunakan dua faktor maka dihasilkan total 8 perlakuan berbeda yang dapat dilihat pada Lampiran 3 dan Lampiran 4. Respon aktivitas xilanase diamati pada jam ke-6, ke-12, ke-18, ke-24, ke-30 dan ke-36. Hasilnya dianalisa menggunakan ANOVA. Hasil analisa dapat dilihat pada Tabel 1 dan 2.
Tabel 1 Hasil analisis ragam (ANOVA) desain faktorial dua level Sumber Jumlah
Curvature 46335.01 1 46335.01 106.87 0.0019 Signifikan Pure Error 1300.65 3 433.55
Core Total 337299 7
Tabel 2 Lanjutan hasil uji analisa ragam (ANOVA) desain faktorial dua level Std. Dev. 20.82 R-Kuadrat 0.9955
Mean 268.08 Akar R-Kuadrat 0.9911 C.V.% 7.77 Prediksi R-Kuadrat N/A Press N/A Adeq Precision 41.758
14
ditunjukkan dari nilai Fhitung dari model lebih besar dari Ftabel dan untuk p-value =
0.0005 <α =0.05. Nilai koefisien determinan R2 = 0.9955 pada tabel menunjukkan adanya hubungan korelasi yang tinggi antara pengaruh variabel faktor terhadap respon. Nilai Adeq Precision menunjukkan rasio 41.758 > 4 (desirability), yang artinya bahwa model persamaan regresi dapat digunakan untuk menavigasi desain ruang:
Y= 344.18 – 37.19X1 + 249.21X2 – 94.48X1X2 ... (1)
Keterangan : Y : aktivitas xilanase (U/mL)
X1 : Aerasi (vvm)
X2 : Agitasi (rpm)
Desain Eksperimen Central Composite Design (CCD)
Rancangan RSM yang digunakan dalam penelitian ini adalah Central Composite Design (CCD) yang merupakan desain fraksional dan nilai tengah (center point) yang diperbesar dengan sekelompok start point untuk menentukan titik lengkung kurva. Nilai tengah diperoleh dari nilai optimum acuan dari analisa persamaan desain eksperimen dua level sebelumnya. Agitasi untuk batas atas adalah 270.7 rpm dan batas bawah 129.29 rpm, sedangkan laju aerasi untuk batas atas adalah 2.197 vvm dan batas bawah 0.675 vvm. Pengkodean level dan nilai level dari variabel independen pada rancangan desain CCD dapat diketahui pada Tabel 3.
Tabel 3 Pengkodean level dan nilai level eksperimen CCD
Variabel Independen simbol level
-1.41421 -1 0 1 1.41421
Aerasi (vvm) X1 3.76 5 1.44 11 12.24
Agitasi (Rpm) X2 129.29 150 200 250 270.711
Total perlakuan yang dihasilkan dari kombinasi antara faktor X1 dan X2
dengan menggunakan CCD adalah sebanyak 13 perlakuan (Lampiran 5). Respon produksi xilanse diamati pada jam ke-6, ke-12, ke-18, ke-24, ke-20, dan ke-36. Hasilnya dianalisa dengan menggunakan Analysis of Variance (ANOVA).
Analisis pemilihan model ini dilakukan berdasarkan jumlah kuadrat dari urutan model (Sequential Model Sum of Squares), pengujian ketidaktepatan model (Lack of Fit Tests) dan ringkasan model secara statistik (Model Summary Statistics). Model yang mungkin terpilih dari metoda permukaan respon adalah linier, 2FI (antara dua faktor), dan kuadratik.
1. Pemilihan model berdasarkan uraian jumlah kuadrat dari urutan model
15 dimaksud. Model 2FI vs Linier tersebut berstatus disarankan (digaris bawahi) oleh program yang digunakan.
Tabel 4 Pemilihan model berdasarkan uraian jumlah kuadrat dari urutan model Sumber Cubic vs Quadratic 1577.5851 2 788.7926 0.044674 0.9567 Residual 88283.12 5 17656.63
Total 2020790.709 13 155445.4
2. Pemilihan model berdasarkan pengujian ketidaktepatan model
Pada pemilihan model ini dianggap tepat apabila ketidaktepatan model berpengaruh tidak nyata dengan nilai P yang paling tinggi dan model tersebut berstatus disarankan. Hasil pemilihan model berdasarkan pengujian ketidaktepatan model dapat dilihat pada Tabel 5.
Tabel 5 Pemilihan model berdasarkan pengujian ketidaktepatan model Sumber Quadratic 1577.585 2 788.7926 0.044674 0.9567
Cubic 0 0
Pure Error 88283.12 5 17656.63
3. Pemilihan model berdasarkan ringkasan model secara statistik
Proses pemilihan model ini berdasarkan ringkasan model secara statistik. Parameter statistik yang digunakan untuk memilih model yang tepat difokuskan pada akar R-kuadrat dan prediksi R-kuadrat terendah. Hasil pemilihan model berdasarkan ringkasan model secara statistik dapat dilihat pada Tabel 6.
Tabel 6 Pemilihan model berdasarkan ringkasan model secara statistik Sumber Linear 122.2973 0.646303 0.575563 0.380933 261782.1
2FI 99.9305 0.787462 0.716615 0.737101 111171 Disarankan Quadratic 113.3015 0.787496 0.635707 0.666249 141131.7
Cubic 132.8782 0.791226 0.498943
16
bahwa model tersebut disarankan untuk digunakan. Persamaan berikut merupakan bentuk umum persamaan regresi untuk model 2FI :
Y = 317.43 – 14.28X1– 1903.11X2 – 904.85X1X2 ... (2) merupakan interaksi 2 faktor dan linier.
Hasil analisa ragam dengan α = 0.05, diketahui bahwa faktor yang
signifikan adalah agitasi (X2), dan interaksi antara aerasi dan agitasi (X1X2)
karena Pvalue< 5%. Hasil analisa ragam ini dapat dilihat pada tabel 7.
Tabel 7 Hasil uji analisa ragam (ANOVA) dari desain eksperimen CCD Sumber
Lack of Fit 1591.993 4 397.9983 0.022541 0.9987 Tidak signifikan Pure Error 88283.12 5 17656.63
Cor Total 422865.3 12
Tabel 8 Lanjutan hasil uji analisa ragam (ANOVA) dari desain eksperimen CCD
Hasil analisa model dengan nilai Pvalue< 5% juga menunjukkan nilai signifikan yang berarti model dapat digunakan untuk proses optimasi produksi xilanase. Selain itu dari hasil uji Lack of Fit terhadap model dapat diketahui bahwa tidak ada ketidaktepatan model, hal ini dapat dibuktikan dari nilai Lack of Fit diperoleh Pvalue = 0.9987 (Not significant) > derajat signifikansi α = 0.05 artinya model regresi diterima (Tabel 7). Nilai koefisien determinasi yang diperoleh berdasarkan uji ANOVA yaitu sebesar R2 = 0.787462 menunjukkan bahwa hubungan korelasi 78% variabel respon pada produksi xilanase dipengaruhi oleh variabel independen.
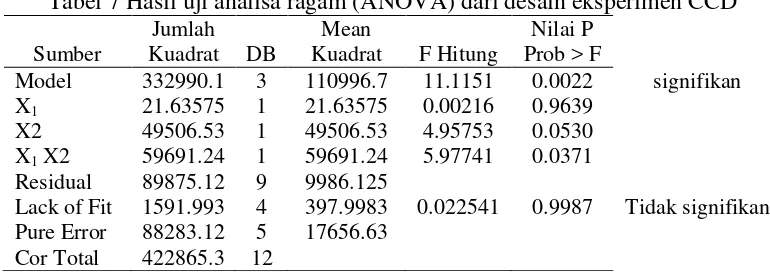
Keakuratan model juga dapat diketahui dari perbandingan nilai aktual penelitian dengan prediksi model. Pada gambar 3 dapat dilihat bahwa nilai aktual dan prediksi tersebar mendekati garis linier.
17
Gambar 3 Distribusi sebaran nilai aktual dan prediksi produksi xilanase Dengan menggunakan persamaan (2) dapat diprediksikan level optimum agitasi dan aerasi untuk produksi xilanase. Gambar 4 menunjukkan respon permukaan dan plot kontur 3D pada optimasi fermentasi produksi xilanase.
Gambar 4 Respon permukaan dan kontur plot pengaruh aerasi dan agitasi dengan level terkodekan terhadap produksi xilanase
18
Analisis menggunakan ANOVA memperlihatkan bahwa aerasi tidak menunjukkan nilai yang signifikan, artinya penambahan laju aerasi tidak berpengaruh nyata terhadap peningkatan aktivitas xilanase selama masa produksi. Hal ini mungkin disebabkan karena, kebutuhan bakteri terhadap oksigen didalam media produksi sudah tercukupi untuk melakukan metabolisme.
Peningkatan aerasi dari 0.5 vvm hingga 1 vvm akan meningkatkan aktivitas enzim, namun peningkatan aerasi lebih dari 1 vvm akan menyebabkan turunnya aktivitas enzim (Bakri et al. 2011; Cabiscol et al. 2000). Calik et al. (2000) menyatakan bahwa aerasi dimaksudkan untuk menyediakan oksigen dalam medium fermentasi. Metabolisme bakteri akan terganggu jika konsentrasi oksigen terlarut berada dibawah tingkat kritisnya. Peningkatan kelarutan oksigen dalam medium kultivasi akan meningkatkan laju konsumsi oksigen spesifik oleh bakteri sampai nilai tertentu, setelah itu peningkatan oksigen terlarut tidak berpengaruh terhadap laju konsumsi oksigen spesifik.
Interaksi antara aerasi dan agitasi menunjukkan hasil yang signifikan, artinya bahwa hubungan keduanya memiliki pengaruh dalam meningkatkan aktivitas xilanase. Hal ini disebabkan karena interaksi aerasi dan agitasi dapat meningkatkan ketersediaaan oksigen oleh adanya pengadukan sehingga pencampuran dapat terjadi secara maksimal. Bakri et al. (2011) mengatakan bahwa efisiensi aerasi dapat ditingkatkan dengan agitasi, yang mengakibatkan peningkatan tegangan antar muka antara gas dan cairan. Agitasi akan menyebabkan gelembung udara pecah sehingga menjadi gelembung-gelembung udara yang lebih kecil.
Optimasi dan Validasi
Setelah dilakukan analisis dari dua variabel faktor yaitu aerasi dan agitasi terhadap aktivitas xilanase serta penentuan range yang telah disesuaikan, program
Design Expert 7.00 merekomendasikan 20 formula solusi optimasi. Formula paling optimal yaitu formula dengan nilai desirability paling tinggi. Menurut Raissi dan Farzani (2009), nilai desirability merupakan nilai fungsi tujuan optimasi yang menunjukkan kemampuan program untuk memenuhi keinginan berdasarkan kriteria yang ditetapkan pada produk akhir.
Validasi model dilakukan dengan mengoptimalkan nilai laju agitasi, sedangkan laju aerasi berada pada nilai minimal. Berdasarkan hasil validasi diketahui nilai perkiraan titik optimum secara teoritis dan secara aktual seperti tertera pada tabel 9.
Tabel 9 Validasi model berdasarkan solusi dari desain model Aerasi (vvm) Agitasi (rpm) Prediksi produksi
xilanase (U/mL)
19 dibandingkan dengan nilai perkiraan titik optimum. Namun ketika agitasi dinaikkan hingga 269.7 rpm, nilai validasi aktual jauh lebih kecil dibandingkan dengan nilai perkiraan titik optimumnya. Hal ini menunjukkan bahwa peningkatan agitasi lebih dari 253.89 rpm akan menyebabkan penurunan aktivitas enzim yang berarti model persamaan yang didapat sudah tidak valid. Hal ini diduga karena agitasi yang tinggi akan mengganggu metabolisme bakteri serta ditimbulkannya busa yang berlebih di dalam media fermentasi yang memungkinkan terjadinya kontaminasi media. Menurut Benz (2008), tingkat agitasi yang diberikan berpengaruh terhadap pertumbuhan mikroba, sehingga berakibat terhadap jumlah metabolik yang dihasilkan. Luis et al. (2005) menjelaskan bahwa pemberian agitasi yang terlalu tinggi menyebabkan pertumbuhan bakteri tidak optimal sehingga terjadi penurunan terhadap produksi enzim.
Selama waktu produksi enzim, dilakukan pula pengukuran terhadap jumlah sel dan kadar protein enzim. Waktu produksi xilanase optimum dapat diketahui
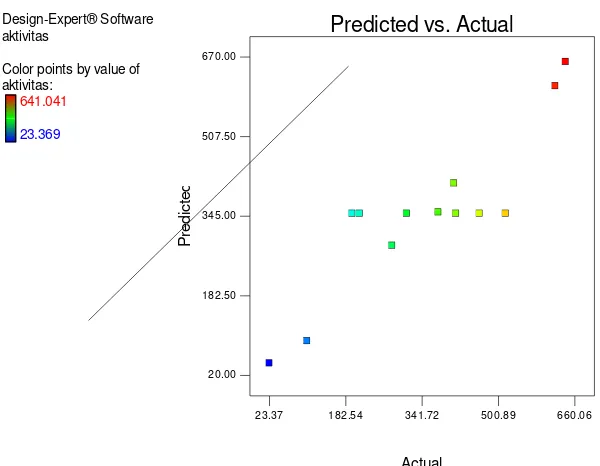
melalui hubungan antara aktivitas enzim dan laju pertumbuhan biomassa. Hubungan antara aktivitas enzim dan jumlah sel dapat dilihat pada Gambar 5.
Gambar 5 Kurva hubungan antara jumlah sel B. halodurans CM1 dan aktivitas xilanase pada 50 oC pH 9 selama waktu inkubasi
20
dan pada jam ke-30 bakteri mengalami penurunan jumlah sel yang cukup besar, namun pada jam ke-36 kembali mengalami peningkatan jumlah sel jika dibandingkan dengan jam ke-30. Adanya penurunan aktivitas xilanase pada jam ke-30 ini mungkin disebabkan adanya produk akhir proses enzimatik seperti xilosa yang berperan sebagai inhibitor umpan balik pada konsentrasi yang tinggi sehingga produksi xilanase terhambat (Kulkarni et al. 1999). Menurut Brock et al. (1994), enzim yang dihasilkan pada fase log akan terakumulasi pada fase stasioner. Waktu produksi enzim yang optimum adalah pada jam ke-24.
Gambar 6 Kurva hubungan antara kadar protein dan aktivitas xilanase pada 50 oC pH 9 selama waktu inkubasi
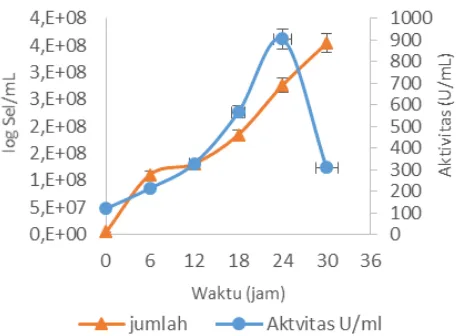
Gambar 6 menunjukkan hubungan antara kadar protein dan aktivitas xilanase selama waktu produksi. Perubahan kadar protein yang terukur selama waktu produksi tidak menunjukkan perubahan yang cukup signifikan namun cenderung statis. Hal ini dimungkan terjadi karena protein yang terukur merupakan protein total yang terdapat dalam media produksi, bukan hanya protein dari enzim xilanase. Kadar protein dari media tepung ikan yang cukup tinggi yang diduga menyebabkan kadar protein di dalam media cenderung statis.
21
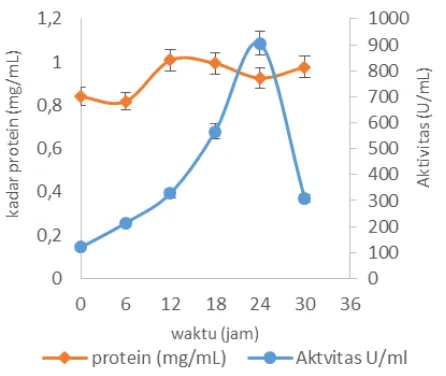
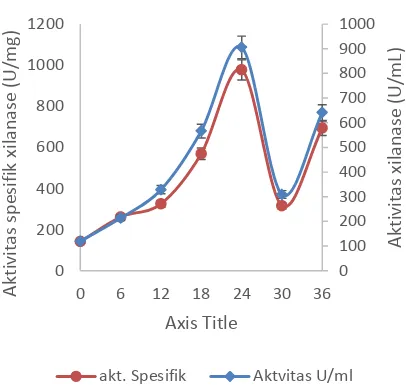
Gambar 7 Kurva hubungan antara aktivitas dan aktivitas spesifik xilanase pada 50 ºC pH 9 terhadap waktu inkubasi
Gambar 7 memperlihatkan hubungan aktivitas enzim dan aktivitas spesifik dari B. halodurans CM1, aktivitas spesifik berbanding lurus terhadap aktivitas xilanase. Hal ini menunjukkan bahwa xilanase merupakan produk metabolit primer yang berkaitan dengan pertumbuhan sel yang berlangsung di dalam fermentor selama waktu inkubasi.
Xilanase yang dihasilkan oleh B. halodurans CM1 merupakan enzim yang terinduksi, artinya bahwa dibutuhkan penginduksi di dalam media selama waktu inkubasi. Xilan merupakan penginduksi dari xilanase B. halodurans CM1 yang dalam penelitian ini diperoleh dari media tongkol jagung. Menurut Bauman (2004) keberadaan induser (xilan) penting di dalam media produksi, mekanisme induksi diatur oleh represor. Jika di dalam suatu media terdapat substrat (penginduksi xilan) maka protein represor akan menjadi tidak aktif sehingga terjadi proses biosintesis enzim penghidrolisis substrat. Namun dengan habisnya penginduksi xilan dalam suatu media akan menyebabkan protein represor aktif sehingga sintesis enzim penghidrolisis xilan ditekan sehingga produksi xilanase turun. Beg et al. (2001) menyatakan bahwa xilan merupakan penginduksi dari xilanase karena xilanase dapat diinduksi oleh media yang mengandung residu xilan murni, xilooligosakarida, xilosa, dan residu lignoselulosa.
22
34.8%. Sedangkan berdasarkan penelitian Garcia et al. (2002) tongkol jagung mengandung xilan 15-30%.
Dalam proses fermentasi, agitasi dan aerasi merupakan faktor yang penting untuk memasok oksigen bagi mikroorganisme. Efisiensi agitasi dan aerasi tergantung pada kelarutan oksigen dan kecepatan difusi oksigen ke dalam media serta kapasitas bioreaktor dalam memenuhi kebutuhan oksigen dari populasi mikroba. Produksi secara fermentasi beberapa metabolit penting dipengaruhi oleh adanya agitasi dan aerasi (Santisteban dan Filho 2005). Hasil penelitian yang dilakukan menunjukkan bahwa agitasi dan aerasi memiliki peranan dalam produksi xilanase selama waktu inkubasi pada rentang waktu tertentu. Agitasi dan aerasi adalah parameter yang sangat kritikal dan penting untuk proses scale up dalam produksi enzim. Hasil penelitian menunjukkan kombinasi terbaik produksi xilanase berada pada kondisi agitasi dan aerasi masing-masing sebesar 249.87 rpm dan 0.67 vvm. Pada kondisi ini dihasilkan aktivitas xilanase yang tertinggi selama waktu produksi. Hal ini menunjukkan bahwa kombinasi agitasi dan erasi memberikan efek yang positif terhadap produksi xilanase. Kecepatan agitasi dapat meningkatkan jumlah oksigen terlarut dan dispersi makromolekul dalam medium. Namun demikian, agitasi dan aerasi dapat menimbulkan dampak negatif apabila laju agitasi dan aerasi ditingkatkan melebihi batas optimal sehingga tidak menyebabkan peningkatan aktivitas produksi enzim melainkan dapat mengakibatkan penurunan aktivitas enzim. Pada penelitian ini percobaan validasi dilakukan untuk memverifikasi ketersediaan dan akurasi model, dan hasilnya menunjukkan bahwa nilai validasi prediksi yang cukup baik dengan nilai-nilai ekperimental yang dicobakan.
Efek pengadukan yang ditimbulkan oleh kecepatan agitasi yang tinggi akan menyebabkan pengaruh negatif terhadap pembentukan sel dan stabilitas enzim ( Feng et al. 2003). Menurut hasil penelitian yang dilakukan oleh Bakri et al. (2011) peningkatan aerasi lebih besar dari 1 vvm akan menyebabkan penurunan aktivitas enzim sama halnya apabila agitasi ditingkatkan dengan kecepatan pengadukan yang tinggi sehingga dapat menyebabkan gangguan pada sel mikroorganisme. Begitu pula menurut hasil penelitian Techapun et al. (2003) bahwa peningkatan aerasi lebih dari 1 vvm dan peningkatan agitasi lebih dari 150 rpm akan menurunkan produksi enzim.
KESIMPULAN
23
DAFTAR PUSTAKA
Bailey MJ. 1992. Interlaboratory testing of methods for assay of xylanase activity. J. Biotechnol. 23: 257-270.
Bakri Y, Alaa M, Amal K. 2011. Influence of agitation speed and aeration rates on the xylanase activity of Aspergillus niger SS7. J. Brazilian archieves of Biology and Technology. 4: 659-664.
Bauman RW. 2004. Microbiology.Toronto(CA): Benjamin Cummings.
Beg QK, Kapoor M, Mahajan L, Hoondal GS. 2001. Microbial xylanases and their industrial aplications:a review. J. Appl. Micribiol. Biotechnol. 56:326-338.
Benz GT. 2008. Piloting bioreactors for agitation scaling up. Benz Technology International, Inc.
Box GEP, Draper NR. 2007. Response Surfaces, Mixtures, and Ridge Analyses: Second Edition. Jhon Wiley & Sons: New Jersey.
Bradford MM. 1976. A rapid and sensitive method for the quantitation on microgram quantities of protein in utilizing the principle of protein dye binding. Anal. Biochem. 72: 248—254.
Brock TD, Madigan MT, Martinko JM, Parker J. 1994. Ed ke-7. Biology of microorganism. New Jersey (US): Prentice Hallinc.
Collin T, Gerday C, Feller G. 2005. Xylanase, xylanase families and extremophilic xylanases. FEMS Microbiol. 29: 3 – 23.
Cabiscol E. Tamarit J. and Ros J. 2000.Oxidative stress in bacteria and protein damage by reactive oxygen species. Int. Microbiol. 3: 3-8.
Calik P, Calik G, Odzamar TH. 2000. Oxygen-transfer strategy and its regulation effects in serine alkaline protease production by Bacillus licheniformis. J. Biotechnology and Bioengineering 69: 301-3011.
Feng Y, He Z, Ong SL, Hu J, Zhang Z, Ng WJ. 2003. Optimization of agitation, aeration, and temperature conditions for maximum β-mannanase production. J. Enzyme and Microb. Technol. 32:282-289.
Garcia RB, Ganter Joana LMS, Carvalho RR. 2000. Solution properties of Ɗ -xylans from corn cobs. European Polymer Journal 36: 783-787.
Heck JX, Soares LH, Ayub MA. 2005. Optimization of xylanase and mannanase production by Bacillus circulans strain BL53 on solid-state cultivation. J. Enzyme and Microbial Technology 37: 417–423.
Horikoshi K. 1999. Alkaliphilies: some Applications of Their Product for Biotechnology. Microbiology and Molecular Biology Reviews 63(4):735-750.
Karimi A, Golbabaei F, Mehrnia MR, Neghab M, Mohammad K, Nikpey A, Pourmand MR. 2013. Oxygen mass transfer in a stirred tank bioreactor using different impeller configurations for environmental purposes. J. Environmental Health Sciences & Engineering 10: 6-10.
24
Kubata, K.B., H. Horitsu, K. Kawai, K. Takamizawa, dan T. Suzuki. 1992. Xilanase I of Aeromonascaviae ME-1 isolated from the intensine of a herbivorous insect (Samiacynthiapryeri). Bioscience Biotechnol. Biochem. 56(9): 1463-1464.
Kulkarni N, Shendye A, Rao M. 1999. Molecular and biotechnological aspectsof xylanase. FEMS Microbiological Reviews. 23: 411-456.
Lin J, Ndlovu LM, Singh S, Pillay B. 1999. Purification and biochemical characteristics of -D-xylanase from thermophilic fungus, Thermomyces lanuginosus-SSBP. Biotechnol Appl Biochem. 30: 73-79.
Luis SJT, Moldes AB, Alonso JL, and Varquez M. 2003. Optimization of lactic acid production by Lactobacillus delbrueckii through response surface methodology. J. of Food Science 68: 1454 – 1458.
Mamo G, Rajni HK, Mattiason B. 2006. A thermostable alkaline active endo-β1-4 xylanase from Bacillus halodurans S7: purification and characterization.
Enzyme and Microbial Technol 39(7):1492-1498.
doi:10.1016/j.enzimtec.2006.03.040.
Mangunwidjaja D, Suryani A. 1994. Teknologi bioproses. Penebar Swadaya. Jakarta.
Meryandini A, Widhyastuti N, Lestari Y. 2008. Pemurnian dan karakterisasi xilanase Streptomyces sp. SKK1-8. Makara Sains 12(2): 55-60.
Montgomery DC . 2001. Design and Analysis of Experiments. Fifth edition, John Willy & Sons, inc.
Myers RH. 1971. Respone surface methodology. Bostom: Allyn and Bacon
Nakamura S, Ishiguro Y, Nakai R, Wakabayashi K, Aono R, Horikoshi K.1993. Purification and characterization of a thermophilic alkaline xylanase from thermoalkaliphilic Bacillus sp. Strain TAR-1. J of Moleculer catalysis-Elsevier.1:7-15
Raissi dan Farzani RE. 2009. Statistical process optimization through multi-response surface methodology. World Academy of Science, Engineering and Technology Pp. 267-271.
Rani, S. dan K. Nand. 1996. Development of cellulose-free xylanase-producing anaerobic consortia for the use of lignocellilosic wastes. Enzyme Microbial Technol. 18: 23-28
Richana N, Lestina P, Irawadi TT. 1994. Karakterisasi lignoselulosa dari limbah tanaman pangan dan pemanfaatannya untuk pertumbuhan bakteri RXA III-5 penghasil xilanase. Jurnal Penelitian Pertanian Tanaman Pangan. 23(3):171-176.
Richana N, Lestari P, Thontowi A, Rosmimik. 2000. Seleksi isolat bakteri lokal penghasil xilanase. JurnalMikrobiologi Indonesia. 5(2): 54-56.
Richana N. 2002. Produksi dan prospek enzim xilanase dalam pengembangan bioindustri di Indonesia. AgroBio 5(1): 29-36
Sanghvi G, Mehul, Nirav P, Heta J, Govinal BS, Shivani P. 2014. Purification and Characterization of Haloalkaline, Organic Solvent Stable Xylanase from Newly Isolated Halophilic Bacterium-OKH. International Scholarly Research Notices. Volume 2014, Article ID 198251.
25 Septiningrum K, Moeis MR. 2009. Isolasi dan karakterisasi xilanase dari Bacillus
circulans. BS: 44 (1): 31 – 40.
Suhartono MT. 1989. Enzim dan Bioteknologi. Departemen Pendidikan dan Kebudayaan. Bogor (ID):IPB Press.
Susilowati PE, Raharjo S, Kurniawati D, Rahim R, Sumarlin, Ardiansyah. 2012. Produksi Xilanase dari Isolat Sumber Air Panas Sonai, Sulawesi Tenggara, menggunakan Limbah Pertanian. Jurnal Natur Indonesia 14(3): 199-204 Sutiamiharja. 2008. Isolasi Bakteri dan Uji Aktifitas Amilase Kasar Termofilik
dari Sumber Air Panas Gurukinayan Karo Sumatera Utara [Tesis]. Medan (ID):Universitas Sumatera Utara.
Syifadelima P. 2014. Karakterisasi xilanase Bacillus halodurans CM1 [Skripsi]. Jakarta (ID): Universitas Islam Negeri Syarif Hidayatullah.
Techapun C, Poosaran N, Watanabe M, Sasaki K. 2003. Optimization of aeration and agitation rates to improve cellulase-free xylanase production by thermotolerant Steptomyces sp. Ab 106 and repeated fed-batch cultivation using agricultural waste. J. Bioscience and Bioengineering. 95(3): 298-301. Ulfah M, Helianti I , Wahyuntari B, Nurhayati N. 2011. Characterization of a new thermoalkalophilic xylanase-producing bacterial strain isolated from Cimanggu hot spring,West Java, Indonesia. Jurnal Microbiologi Indonesia 5(3): 139-143 [on line]. DOI: 10.5454/mi.5.3.7
Viikari, L., A. Kantelinen, J. Sundquist dan M. Linko. 1994. Xylanases in bleaching: from an idea to the industry. FEMS Microbiology Reviews 13(2-3): 335-350.
Wibowo HS. 2008. Optimalisasi Respon Ganda Pada Metode Permukaan Respon (Response Surface) Dengan Pendekatan Fungsi Desirability [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Wibowo SG. 2014. Optimasi Produksi Enzim Xilanase Dari Bakteri Bacillus halodurans CM1 dengan Metode Permukaan respon [Tesis]. Bogor (ID): Institut Pertanian Bogor.
26
LAMPIRAN
Lampiran 1. Matriks Percobaan faktorial 2k pengaruh agitasi dan aerasi terhadap produksi xilanase B. halodurans CM1
Std Run Block Factor 1 A: aerasi (vvm)
Faktor 2 B: agitasi
(rpm)
1 1 Block 1 0.67 100.00
4 2 Block 1 1.75 250.00
8 3 Block 1 1.21 175.00
3 4 Block 1 0.67 250.00
5 5 Block 1 1.31 175.00
7 6 Block 1 1.21 175.00
2 7 Block 1 1.75 100.00
6 8 Block 1 1.21 175.00
Lampiran 2. Matriks Central Composite Design (CCD) pengaruh agitasi dan aerasi terhadap produksi xilanase B. halodurans CM1
Std Run Block Factor 1 A: aerasi (vvm)
Faktor 2 B: agitasi
(rpm)
4 1 Block 1 1.48 250.00
2 2 Block 1 1.48 150.00
9 3 Block 1 1.08 200.00
12 4 Block 1 1.08 200.00
5 5 Block 1 0.52 200.00
1 6 Block 1 0.67 150.00
10 7 Block 1 1.08 200.00
3 8 Block 1 0.67 250.00
6 9 Block 1 1.65 200.00
27 Lampiran 3. Data eksperimen desain 2 level faktorial jam ke-36
Lampiran 4. Rancangan percobaan 2 level faktorial dengan level terkodekan
Lampiran 5. Data eksperimen desain central composite design (CCD) jam ke-36 std run
Coded levels Xylanase activity (U/ml)
28
DAFTAR RIWAYAT HIDUP