OPTIMASI PRODUKSI XILANASE
DARI
Bacillus halodurans
CM1 DENGAN METODE
PERMUKAAN RESPON
SARA GUSTIA WIBOWO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Optimasi Produksi Xilanase dari Bacillus halodurans CM1 dengan Metode Permukaan Respon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014
Sara Gustia Wibowo
RINGKASAN
SARA GUSTIA WIBOWO. Optimasi Produksi Xilanase Dari Bacillus halodurans CM1 dengan Metode Permukaan Respon. Dibimbing oleh ANI SURYANI dan BUDIASIH WAHYUNTARI.
Xilanase, (EC 3.2.1.8) adalah enzim ekstraseluler yang dapat menghidrolisis xilan (hemiselulosa) menjadi rantai pendek xilosa dan xilooligosakarida.
Optimasi produksi enzim xilanase alkalitermofilik dari Bacillus halodurans
CM1 dalam fermentasi dilakukan dengan menggunakan pendekatan statistik. Tujuan dari penelitian ini adalah untuk memilih komposisi media yang memberikan produksi enzim optimal menggunakan metode permukaan respon (RSM). Tongkol jagung dan tepung ikan P masing-masing digunakan sebagai sumber xilan dan nitrogen. Variabel yang terlibat dalam penelitian ini adalah konsentrasi sumber xilan tongkol jagung (X1), konsentrasi tepung ikan P (X2) dan pH (X3).
Desain faktorial dua level menunjukkan bahwa konsentrasi xilan tongkol jagung dan tepung ikan P serta pH merupakan faktor yang mempengaruhi produksi xilanase, oleh karena itu dilakukan pengoptimasian dengan rancangan komposit terpusat (CCD). Sebanyak 20 percobaan desain CCD dilakukan dengan tujuan untuk mengoptimalkan produksi xilanase dengan tongkol jagung pada media cair. Berbagai variasi konsentrasi karbon dan sumber nitrogen serta pH secara berurutan dioptimalkan. Dalam 100 mL medium terpilih yang terdiri atas variasi konsentrasi tongkol jagung dan tepung ikan P, KH2PO4 0.2 g, Na2CO3 1 g, NaCl 0.2 g, MgSO4 0.01 g, dan CaCl2 0.01 g menghasilkan enzim tertinggi setelah 24 jam inkubasi pada pH 9, suhu 50 ºC dan 120 rpm kecepatan agitasi. Hasil penelitian menunjukkan bahwa dalam kisaran model yang diamati, konsentrasi tongkol jagung dan interaksi konsentrasi tongkol jagung dan pH menunjukkan pengaruh yang signifikan. Model ini dapat digunakan untuk menavigasi desain ruang. Konsentrasi batas atas dan batas bawah dari tongkol jagung dan tepung ikan P yang diamati masing-masing 0.53;8.23% (b/v) dan 0.23;1.75% (b/v). Model persamaan optimasi aktivitas xilanase berdasarkan penelitian diperoleh (Y) = -18.9555+ 0.61884X1+ 4.3449X3- 0.058046X1X3- 0.22536X32. Konsentrasi xilan tongkol jagung dan tepung ikan P yang optimum masing-masing adalah 4.37% (b/v) dan 1.75% (b/v) pada pH optimum 9 dan waktu fermentasi 24 jam. Kondisi ini diuji dan divalidasi secara eksperimental dengan hasil perkiraan aktivitas xilanase secara teoritis pada model estimasi prediksinya adalah sebesar 521.32 U/mL dan nilai hasil validasi menunjukkan aktivitas xilanase sebesar 522±26.6 U/mL. Hasil validasi menunjukkan bahwa model persamaan kondisi optimum adalah valid.
SUMMARY
SARA GUSTIA WIBOW0. Optimization of Xylanase Production by Bacillus halodurans CM1 using Response Surface Method. Supervised by ANI SURYANI and BUDIASIH WAHYUNTARI.
Xylanase (EC 3.2.1.8) is an extracellular enzyme that can hydrolyze xylan (hemicellulose) into short chain xilose and xylooligosacharide.
Production of thermo-alkaline stable xylanase of Bacillus halodurans CM1 was optimized in a batch fermentation using statistical approaches. The aim of this experiment was to select medium composition that gave the highest enzyme activity and to optimize the enzyme production. Corn cob and fish powder P was selected as a carbon source and nitrogen source repectively. The variables involved in this study were xylan source concentration (X1), Fish powder concentration (X2) and pH (X3).
A two level factorial design identified corn cobs xylan concentration, fish powder P concentration and pH as the significant variables that affect xylanase production, and therefore, these variables would be optimized by Central Composite Design (CCD) matrix of Response Surface Design (RSM). A 20 central composite experimental design was performed with the aim of optimizing the production of xylanase on corn cobs in submerged cultures. Various carbon, nitrogen sources and pH were consecutively optimized. In 100 mL of the selected medium that consisted corn cobs xylan, Fish powder P, 0.29 g KH2PO4, 1 g Na2CO3, 0.2 g NaCI, 0.01 g MgSO4, 0.01 g CaCI2, produced the highest enzyme activity after 24 hour incubation at pH 9, 50 oC, 120 rpm agitation. The experimental results showed that the model of corn cobs concentration and the interaction between corn cobs concentration and pH value was significant so was the curvature F value. The model could be used to navigate the design space. The upper and lower concentration of corn cobs and fish powder P observed was 0.53;8.23% (b/v) and 0.23;1.75% (b/v) respectively. The optimum equation based on the experimental RSM result was xylanase activity (Y) = -18.9555+ 0.61884X1+ 4.3449X3- 0.058046X1X3- 0.22536X32. The optimum corn cobs and fish powder P concentration was 4.37% (b/v) and 1.75% (b/v) the optimum pH and fermentation time was pH 9 and 24 h respectively. Under these conditions, the model predicted xylanase activity of 521.3 U/mL and the validation result showed xylanase activity of 522±26.6 U/mL. It can be concluded that the model was valid.
© Hak Cipta Milik IPB, Tahun 2014 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
OPTIMASI PRODUKSI XILANASE
DARI
Bacillus halodurans
CM1 DENGAN METODE
PERMUKAAN RESPON
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Optimasi Produksi Xilanase dari Bacillus halodurans CM1 dengan Metode Permukaan Respon
Nama : Sara Gustia Wibowo NIM : P051114011
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Ani Suryani, DEA Ketua
Dr Ir Budiasih Wahyuntari, MSc Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 27 Agustus 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 ini adalah optimasi produksi enzim, dengan judul Optimasi Produksi Xilanase dari Bacillus halodurans CM1 dengan Metode Permukaan Respon.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ani Suryani, DEA dan Ibu Dr Budiasih Wahyuntari, MSc selaku pembimbing yang telah banyak memberi saran. Prof Dr Ir Suharsono DEA selaku ketua program studi Bioteknologi, disamping itu penghargaan penulis sampaikan kepada Ibu Dr Is Helianti, MSc dan seluruh staf Laboratorium Teknologi Bioindustri dari Badan Pengkajian dan Penerapan Teknologi yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada papa Kompol Sardan Raden Kemala, mama Ratna Juita (Almh), Raden Permata, SH., Arini Tri Kemala, Novela Safitri serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Hipotesa 3
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 3
3 METODE 15
Waktu dan Tempat 15
Alat dan Bahan 15
Mikroorganisme 16
Tahapan Penelitian 16
Desain Penelitian 19
Analisis Statistik 20
4 HASIL DAN PEMBAHASAN 21
5 SIMPULAN DAN SARAN 36
Simpulan 36
Saran 36
DAFTAR PUSTAKA 37
LAMPIRAN 41
DAFTAR TABEL
1 Kelarutan xilan dalam beberapa pelarut (Richana et al. 2004) 7 2 Komposisi Kimia Tongkol Jagung (Johnson 1991) 8 3 kandungan lignoselulosa pada bagasse (Howard et al. 2003) 10 4 Hasil uji analisa ragam (ANOVA) desain faktorial dua level 24 5 Lanjutan hasil uji analisa ragam (ANOVA) desain faktorial dua level 24 6 Pengkodean level dan nilai level Experimen CCD 25 7 Pemilihan model berdasarkan uraian jumlah kuadrat dari urutan
model 26
8 Pemilihan model berdasarkan pengujian ketidaktepatan model 26 9 Pemilihan model berdasarkan ringkasan model secara statistik 27 10 Hasil uji analisa ragam (ANOVA) dari desain eksperimen CCD 27 11 Lanjutan hasil uji analisa ragam (ANOVA) dari desain eksperimen
CCD 27
12 Validasi model berdasarkan solusi dari desain model 31
DAFTAR GAMBAR
1 Konfigurasi dinding sel tanaman (Perez et al. 2002) 4 2 Struktur xilan dengan residu pengganti dan letak ikatan yang dipecah
oleh enzim xilanolitik 7
3 Suhu pertumbuhan mikroorganisme (Prescott 2005) 11 4 Produksi xilanase dari berbagai komposisi media dan jenis sumber
karbon 21
5 Produksi xilanase dengan berbagai jenis sumber nitrogen menggunakan media Mamo et al. (2006) dengan sumber nitrogen berbeda, pepton (-♦-), tepung ikan N (-■-) dan tepung ikan P (-▲-)
Pada Inkubasi 22 jam, suhu 50 ºC dan pH 9 22
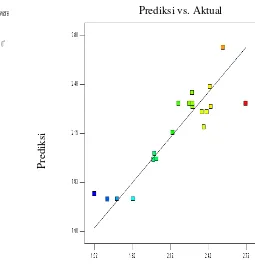
6 Distribusi sebaran nilai aktual dan prediksi produksi xilanase 28 7 Pengaruh pH dan tongkol jagung dengan level terkodekan terhadap
produksi xilanase 29
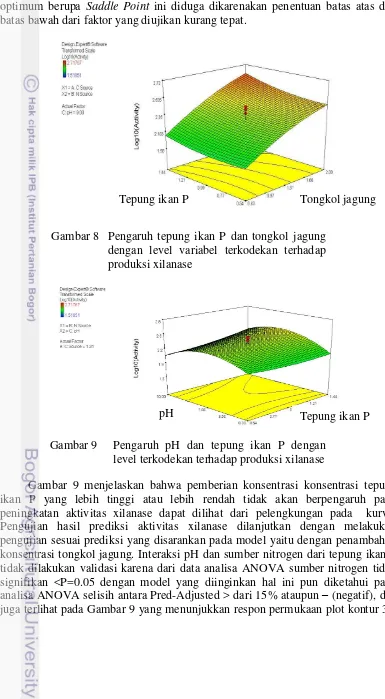
8 Pengaruh tepung ikan P dan tongkol jagung dengan level variabel
terkodekan terhadap produksi xilanase 30
9 Pengaruh pH dan tepung ikan P dengan level terkodekan terhadap
produksi xilanase 30
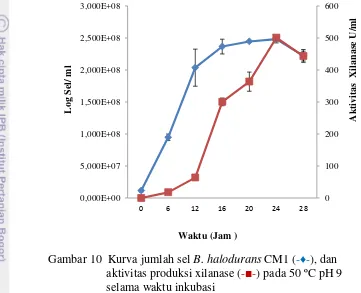
10 Kurva jumlah sel B. halodurans CM1 (-♦-), dan aktivitas produksi xilanase (-■-) pada 50 ºC pH 9 selama waktu inkubasi 33 11 Kurva hubungan antara kadar protein xilanase (-♦-), dan aktivitas
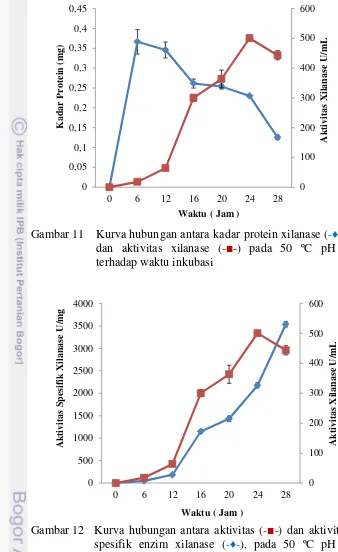
xilanase (-■-) pada 50 ºC pH 9 terhadap waktu inkubasi 34 12 Kurva hubungan antara aktivitas (-■-) dan aktivitas spesifik enzim
DAFTAR LAMPIRAN
1 Data eksperimen desain 2 level faktorial jam ke-21 41 2 Rancangan percobaan 2 level faktorial dengan level terkodekan 41 3 Data eksperimen desain central composite design (CCD) jam ke-24 42 4 Rancangan percobaan CCD dengan level terkodekan 42 5 Komposisi media produksi xilanase dari B. halodurans CM1 43 6 Komposisi kimia bahan substitusi sumber xilan 43 7 Analisis proksimat bahan substitusi sumber nitrogen 44
1 PENDAHULUAN
Latar Belakang
Teknologi proses dalam industri kertas umumnya dilakukan pada suhu dan pH tinggi, terutama pada proses pulping yaitu proses kraft, proses sulfat serta proses pemutihan dengan khlorin. Menurut Viikari et al. (1994) jumlah khlorin yang digunakan dalam industri kertas memiliki dampak yang buruk jika dibuang ke lingkungan, karena memiliki kandungan senyawa khlor organik (dioksin dan furan) yang bersifat toksik, mutagenik, persisten, bioakumulatif sehingga menimbulkan persoalan lingkungan yang sangat serius. Oleh karena itu dibutuhkan suatu metode alternatif untuk mengurangi dampak lingkungan yang ditimbulkan oleh penggunaan khlor. Pemanfaatan bioteknologi dapat dilakukan dengan aplikasi biobleaching yang merupakan salah satu penerapan bioteknologi dalam industri kertas yang dianggap dapat mengatasi masalah lingkungan.
Biobleaching adalah proses pemutihan pulp dengan memanfaatkan enzim. Penggunaan enzim yang dapat memberikan dampak yang baik terhadap kelestarian lingkungan untuk menggantikan atau mengurangi jumlah khlorin yang digunakan dalam proses pemutihan bubur kertas (pulp) yaitu menggunakan enzim xilanase. Enzim xilanase (1.4-β-D-xilan hidrolase, E.C 3.2.1.8) merupakan kelompok enzim yang memiliki kemampuan menghidrolisis xilan. Enzim ini digunakan dalam proses pra-pemutihan (pre-bleaching) pulp kimia (Kirk dan Jeffries 1996). Menurut Kulkarni et al. (1999) dalam proses pemutihan kertas (pulp) memerlukan suhu 80 ºC dengan kisaran pH 6-9. Oleh karena itu, dibutuhkan xilanase yang bersifat alkalitermofilik (Nakamura et al. 1995), berupa endoxilanase (Viikari et al. 1994) dan bebas aktivitas selulase. Xilanase merupakan enzim ekstraselular yang memiliki kemampuan menghidrolisis xilan yang merupakan salah satu komponen utama hemiselulosa yang memiliki tulang punggung rantai D-xilanopiranosa dengan ikatan glikosidik β-1.4. Xilanase merupakan kelompok enzim yang memiliki kemampuan menghidrolisis xilan menjadi xilosa dan xilooligosakarida. Hemiselulosa merupakan karbohidrat dengan bobot molekul lebih rendah dari pada selulose dan tersusun atas satuan-satuan gula pentosa dan hexosa. Polimer hemiselulosa terdiri dari monomer gula yg dikelompokkan pada hexosa (glukosa, manosa, dan galaktosa), pentosa (xilosa, arabinopiranosa, arabinofuranosa) (Kulkarni et al. 1999).
Xilanase mampu meningkatkan proses bleaching pulp dengan meningkatkan akses dari bahan kimia bleaching ke serat-serat pulp. Serat yang terbuka (Uncoated fibers) ternyata lebih rentan terhadap bahan kimia bleaching
2
Mekanisme enzim xilanase adalah melakukan pemindahan ganda (double displacement mechanism) yang akan mengikat intermediet reaktif. Hal ini memudahkan enzim xilanase untuk melakukan reaksi transglikosilasi. Dalam proses bleaching pulp, penggunaan enzim xilanase mampu mengurangi kebutuhan bahan kimia untuk bleaching. Proses bleaching menurut Bajpai (2006) terjadi dalam tiga tahap yaitu tahap penambahan xilanase, tahap ekstraksi awal dan tahap penambahan klorindioksida awal.
Bacillus halodurans CM1 merupakan mikroba penghasil xilanase dan telah berhasil diisolasi oleh Ulfah et al. (2011) dari sumber air panas Cimanggu, Jawa Barat. B. halodurans CM1 merupakan bakteri penghasil enzim ekstrasellular yang potensial. B. halodurans CM1 adalah bakteri gram positif yang dapat menghasilkan xilanase alkalitermofilik yang ditumbuhkan dengan sistem fermentasi cair. Namun kondisi optimum yang meliputi pH, sumber karbon dan sumber nitrogen untuk memproduksi enzim tersebut belum dioptimasi. Penggunaan komposisi medium produksi xilanase mengakibatkan perubahan mekanisme proses yang terjadi sehingga hasil yang didapat akan berubah oleh karena itu perlu dilakukan optimasi pH, sumber C dan sumber N yang digunakan untuk produksi enzim.
Berdasarkan penelitian pendahuluan yang telah dilakukan di Laboratorium Teknologi Bioindustri, Badan Pengkajian dan Penerapan Teknologi (BPPT), B. halodurans CM1 hanya memproduksi xilanase apabila terdapat senyawa penginduksi (xilan) didalam medium (Ulfah et al. 2011). Oleh karena itu untuk produksi xilanase digunakan sumber xilan. Mengingat hasil penelitian ini direncanakan untuk dilanjutkan hingga ke skala industri sehingga penginduksi xilan akan disubstitusi dengan sumber xilan dari limbah pertanian yang mengandung xilan (tongkol jagung dan bagas tebu) serta substitusi sumber nitrogen dengan tepung ikan.
Percobaan optimasi kondisi produksi dari xilanase dilaksanakan menggunakan teknik optimasi Response Surface Methodology (RSM). Teknik optimasi RSM digunakan untuk mendapatkan solusi terbaik dari kombinasi pH dan sumber xilan serta sumber nitrogen. RSM merupakan alat optimasi yang memungkinkan kita mendapatkan penjelasan menyeluruh mulai dari desain penelitian, pengolahan data, dan solusi optimasi. Kelebihan teknik optimasi RSM adalah minimalnya dalam penggunaan waktu, tenaga dan biaya dibandingkan menggunakan teknik optimasi lain (Box dan Draper 1987). Teknik optimasi RSM telah banyak digunakan untuk optimasi proses maupun optimasi produk di industri.
Perumusan Masalah
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mendapatkan komposisi media fermentasi optimal untuk produksi xilanase dengan kombinasi terbaik dari variasi sumber C, sumber N dan pH.
2. Mendapatkan model persamaan kondisi optimum produksi xilanase B. halodurans CM1 dengan menggunakan metode permukaan respon
Hipotesa
1. Perbandingan sumber xilan sebagai sumber karbon, sumber nitrogen dari tepung ikan diduga berpengaruh terhadap produksi xilanase oleh B. halodurans CM1.
2. Aktivitas xilanase tertinggi diduga akan dicapai pada perbandingan konsentrasi tertentu dari masing–masing komponen penyusun media produksi.
Ruang Lingkup Penelitian
Ruang lingkup penelitian seleksi dan optimalisasi media fermentasi untuk produksi xilanase dari B. halodurans CM1 adalah sebagai berikut :
1. Penyiapan inokulum B. halodurans CM1 yang meliputi penyegaran sel, perbanyakan sel pada media padat dan propagasi pada media cair.
2. Penyiapan media fermentasi untuk seleksi dan optimalisasi media sesuai dengan rancangan percobaan.
3. Fermentasi produksi xilanase dengan kultur kocok dalam erlenmeyer 500 mL dengan volume kerja 100 mL pada suhu 50 ºC, pengocokan 120 rpm.
4. Analisis parameter produksi yang meliputi aktivitas xilanase, kadar protein dan jumlah sel bakteri.
2 TINJAUAN PUSTAKA
Xilan
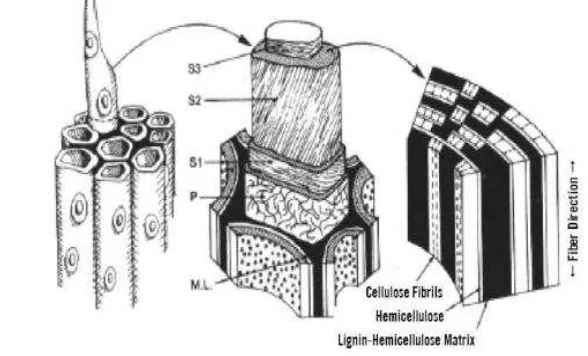
Xilan merupakan bagian hemiselulosa yang merupakan komponen penyusun dinding sel tanaman kedua terbesar setelah selulosa. Susunan dinding sel tanaman terdiri atas lamela tengah (ML), dinding primer (P), serta dinding sekunder (S) yang terbentuk selama pertumbuhan dan pendewasaan sel yang terdiri atas lamela transisi (S1), dinding sekunder utama (S2) dan dinding sekunder bagian dalam (S3) (Gambar 1).
Hemiselulosa mengikat lembaran serat selulosa membentuk mikrofibril yang meningkatkan stabilitas dinding sel. Hemiselulosa juga berikatan silang membentuk jaringan kompleks dan memberikan struktur yang kuat.
4
bersama dengan arabinan, galaktan, manan, dan asam glukuronat (Leeson dan Summers 2001). Xilan terikat pada selulosa, pektin, lignin, dan polisakarida lainnya dalam angiosperma untuk membentuk dinding sel tanaman.
Gambar 1 Konfigurasi dinding sel tanaman (Perez et al. 2002)
Xilan terdapat hampir pada semua tanaman, kebanyakan dijumpai pada tanaman tahunan dan limbah-limbah pertanian seperti tongkol jagung, bagas tebu, jerami padi, dedak gandum, dan biji kapas (Subramaniyan dan Prema 2002). Xilan sebagai komponen utama penyusun polisakarida hemiselulosa pada tanaman kandungannya mencapai sekitar 30-35% berat kering totalnya (Beg et al. 2001). Menurut Deutschman dan Dekker (2012), hemiselulosa merupakan kompleks cabang heteropolisakarida, sebagian besar rantai hemiselulosa yang dibentuk oleh β 1-4 unit monomer D-xilopiranoside disebut xilan. Xilan dan hemiselulosa lain (glukomannans, arabinogalactans) terkait erat dengan fibril selulosa, yang memberikan kekakuan pada tanaman yaitu lignin. Selulosa merupakan polimer linier dari D-glukosa yang terikat pada ikatan 1.4 glikosidik dan sangat erat berasosiasi dengan hemiselulosa dan lignin. Hemiselulosa merupakan salah satu penyusun dinding sel tumbuhan yang terdiri dari kumpulan beberapa unit gula atau heteropolisakarida dan dikelompokkan berdasarkan residu gula utama sebagai penyusunnya seperti xilan, mannan, galactan dan glucan (Fengel dan Wegener 1995; Gillbert et al. 1993). Menurut Perez et al. (2002), hemiselulosa mempunyai berat molekul rendah dibandingkan dengan selulosa dan terdiri dari D-xilosa, D-mannosa, D-galaktosa, D-glukosa, L-arabinosa, 4-0-metil glukoronat, D-galakturonat dan asam D-glukoronat. Lignin merupakan polimer aromatik yang berasosiasi dengan polisakarida pada dinding sel sekunder tanaman. Pada umumnya, lignin mengandung tiga jenis alkohol aromatik yaitu
coniferyl, sinapyl dan p-coumaryl (Howard et al. 2003). Enzim Xilanase
Enzim xilanase (1.4-β-D-xylan xylanohidrolase, EC 3.2.1.8) merupakan enzim ekstraselular yang dapat menghidrolisis secara acak ikatan glikosidik
internal (β-1.4) rantai utama xilan (hemiselulosa) menjadi gula penyusunnya yaitu
glikosidik internal pada pada kerangka xilan dan β-xilosidase melepaskan residu xilosil melalui pemotongan bagian ujung dari xiloooligosakarida (Saha 2003).
Xilanase dapat diklasifikasikan berdasarkan substrat yang dihidrolisis, yaitu xilanase yang memecah rantai utama xilan β-xilosidase (β-1.4 xilobiosa), eksoxilanase, dan endoxilanase (endo β-1.4 xilanase) dan xilanase yang memecah rantai samping xilan -L-arabinofuranidase, -glukoronidase serta esterase.
Enzim β-xilosidase mampu menghidrolisis xilooligosakarida rantai pendek
menjadi xilosa. Eksoxilanase memutus rantai polimer xilosa (xilan) pada ujung pereduksi, sehingga menghasilkan xilosa sebagai produk utama dan sejumlah oligosakarida rantai pendek. Xilanase yang dapat memecah xilan menjadi dua satuan monosakarida adalah endo-1.4- β–xilanase yang mampu memecah rantai utama xilan bagian tengah secara acak namun hasilnya tidak sempurna yaitu berupa dimer atau xilooligosakarida (Himmel 2008). Xilanase pada umumnya merupakan protein kecil dengan berat molekul 15-30 kDa, aktif pada suhu 55 ºC dengan pH 9 (Yu et al. 1991).
Enzim xilanase termostabil memiliki beberapa nilai ekonomis yaitu: (1) stabil selama penyimpanan yang akan mengurangi biaya produk; (2) reaksi berlangsung pada suhu tinggi sehingga akan mengurangi kontaminasi oleh bakteri mesofilik; (3) lebih tahan terhadap pelarut, detergen, dan senyawa denaturan; (4) pada suhu tinggi proses fermentasi akan lebih cepat karena reaksi enzim akan meningkat sampai pada rentangan suhu tertentu; (5) pemisahan produk yang mudah menguap akan lebih cepat. Pemakaian enzim termostabil disamping tahan terhadap denaturasi panas, juga dapat meminimalkan risiko kontaminan dan dapat menggeser reaksi kearah pembentukan produk (Suhartono 1989).
Penggunaan enzim termostabil dalam bioteknologi telah dapat menurunkan biaya operasi, disamping dapat meningkatkan kecepatan reaksi-reaksi biokimianya (Wiryawan 2011). Cara kerja enzim dipengaruhi oleh berbagai faktor diantaranya adalah suhu, pH, jumlah enzim, jumlah substrat dan keberadaan aktivator serta inhibitor enzim (Sutiamiharja 2008).
Istilah termostabil dapat didefinisikan dalam sejumlah arti dan bersifat relatif. Definisi termostabil umumnya dihubungkan dengan sifat alami dari enzim dan sumber penghasil enzim. Enzim termostabil sering dikenal dengan sebutan termozim merupakan enzim yang dihasilkan oleh mikroorganisme termofilik. Enzim ini tidak mengalami denaturasi akibat naiknya suhu lingkungan dan menunjukkan aktivitas optimum pada suhu tinggi (60-120 ºC). Enzim termostabil biasanya digunakan untuk meneliti beberapa hal, seperti evolusi enzim, mekanisme molekuler, termostabil protein dan batas suhu maksimum. Enzim termostabil secara struktur maupun fungsi memiliki keunikan tersendiri, berbeda dengan enzim yang berasal dari bakteri mesofilik. Hal ini diakibatkan karena enzim ini menunjukkan ketahanan terhadap suhu tinggi yang sangat baik (Dirnawan 2011).
Enzim termostabil memiliki mekanisme katalitik yang sama dengan enzim mesofilik. Namun, sifat ketahanannya terhadap suhu menyebabkan enzim termostabil memiliki nilai komersial yang sangat besar. Penggunaannya dalam bidang industri umumnya digunakan dalam industri tekstil, farmasi dan industri makanan (Wiryawan 2011).
6
jumlah substrat, dan keberadaan aktivator serta inhibitor enzim (Sutiamiharja, 2008).
Suhu sangat berpengaruh terhadap kerja enzim, karena enzim terdiri atas protein. Enzim dapat menjalankan aktivitasnya pada kisaran suhu tertentu. Semakin tinggi suhu reaksi kimia akan semakin cepat, akan tetapi enzim akan mengalami denaturasi jika suhu terlalu tinggi. Apabila enzim terdenaturasi maka terjadi perubahan susunan molekul enzim sehingga enzim menjadi tidak aktif. Suhu optimum untuk setiap enzim berbeda-beda. Enzim membutuhkan pH tertentu untuk menjalankan aktivitasnya. Setiap enzim membutuhkan pH yang berbeda-beda. Pengaruh pH berhubungan dengan perubahan status ionik antara asam amino penyusun enzim dengan molekul substrat. Sebagian besar enzim intraseluler menunjukkan aktivitas optimal pada pH antara 5 dan 9. Hubungan aktivitas dan konsentrasi ion hidrogen menunjukkan keseimbangan antara denaturasi enzim dan pH yang rendah atau tinggi dan pengaruh pada status muatan enzim, substrat dan keduanya. Jika pH terlalu tinggi atau terlalu rendah enzim akan mengalami denaturasi dan ini akan mengakibatkan menurunnya aktivitas enzim. Kecepatan enzim bereaksi dipengaruhi oleh konsentrasi enzim yang berfungsi sebagai katalisator. Jika konsentrasi enzim dengan substrat sudah seimbang, maka kecepatan reaksi kimia akan relatif konstan. Demikian juga dengan adanya aktivator yang berfungsi mengaktifkan enzim dan pada umumnya berasal dari bahan yang tahan panas dan berberat molekul yang relatif rendah. Mekanisme kerja enzim juga ditentukan oleh jumlah atau konsentrasi substrat yang tersedia. Jika jumlah substratnya sedikit, kecepatan kerja enzim juga rendah. Sebaliknya, jika jumlah substrat yang tersedia banyak, kerja enzim juga cepat. Pada keadaan substrat berlebih, kerja enzim tidak sampai menurun tetapi konstan.
Aktivator merupakan molekul yang mempermudah ikatan antara enzim dengan substratnya, misalnya ion klorida yang bekerja pada enzim amilase. Inhibitor merupakan suatu molekul yang menghambat ikatan enzim dengan substratnya. Inhibitor akan berikatan dengan enzim membentuk kompleks enzim-inhibitor.
Mekanisme Pemecahan Xilan
Aktivitas enzim xilanase menyebabkan proses hidrolisis xilan. Secara umum proses hidrolisis merupakan hasil dari retensi atau inversi pusat anomerik monomer gula pereduksi dari rantai karbohidrat. Hal ini akan melibatkan satu atau dua kondisi transisi kimiawi. Transfer glikosil pada umumnya adalah hasil dari substitusi nukleofil pada karbon jenuh dari pusat anomer dan digantikan baik oleh retensi ataupun inversi dari konfigurasi anomerik. Sebagian besar enzim penghidrolisis polisakarida, seperti selulase dan xilanase dikenal sebagai enzim yang menghidrolisis substratnya dengan cara retensi atom C1 dari konfigurasi anomeriknya. Hal ini melibatkan mekanisme pemindahan ganda untuk retensi anomerik produk (Kulkarni et al. 1999).
kedua sisi melalui kondisi transisi yang melibatkan ion–ion oksokarbonium; (5) berbagai variasi interaksi non kovalen lebih banyak menyebabkan laju pendegradasian (Subramaniyan dan Prema 2002).
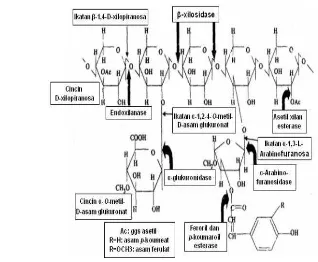
Struktur xilan dan mekanisme pemecahannya oleh enzim disajikan pada Gambar 2.
Gambar 2 Struktur xilan dengan residu pengganti dan letak ikatan yang dipecah oleh enzim xilanolitik (Beg et al. 2001)
Kelarutan Xilan
Tabel 1 menunjukkan bahwa xilan larut sempurna dalam basa (NaOH 1%) dan air panas, tetapi hanya sedikit larut pada air dingin dan tidak larut dalam asam (HCl 1 N). Menurut Austin (1984), kelarutan suatu polimer (termasuk karbohidrat) akan berkurang dengan bertambahnya bobot molekul. Xilan sukar larut dalam air dingin, tetapi larut dalam air yang dipanaskan pada suhu 100 oC (Vandamme dan Derycke 1983). Berdasarkan hasil tersebut, xilan tongkol jagung dapat dimanfaatkan dalam medium cair untuk bakteri alkalofilik, karena bersifat larut dalam basa, serta dalam air panas maupun dingin.
Tabel 1 Kelarutan xilan dalam beberapa pelarut (Richana et al. 2004)
Pelarut Kelarutan
NaOH 1% +++ (sangat larut)
Air Panas ++ (larut)
Air Dingin + (sedikit larut)
8
Tongkol Jagung
Dalam satu dekade terakhir ini, produksi jagung (Zea mays) mengalami peningkatan yang cukup besar meskipun sedikit berfluktuasi. Pada tahun
1989−1993 produksi mencapai 6.7 juta ton/tahun dengan produktivitas 2.2 ton/ha
(Subandi et al. 1998). Pada tahun 2003 mencapai 9.66 juta ton/tahun, atau meningkat sebesar 1.42% dibandingkan dengan tahun 2002 yang sebesar 9.53 juta ton/tahun. Ditahun 2004, produksi jagung diperkirakan telah mencapai 11.75 juta ton/tahun dengan produktivitas 3.8 ton/ha (Deptan 2009). Tongkol jagung merupakan salah satu limbah hasil pertanian dari jagung. Jagung terdiri dari 30% bagian berupa tongkol jagung, sedangkan sisanya adalah biji dan kulit (Koswara 1991).
Menurut (Yang et al. 2005), limbah tongkol jagung mengandung selulosa (35.0%), xilan (30.2%), dan lignin (14%). Komponen selulosa, hemiselulosa, dan lignin dalam tongkol jagung terikat satu sama lain dengan ikatan yang kompleks seperti terlihat pada Gambar 2. Selulosa secara alami terlindungi dari degradasi dengan adanya hemiselulosa dan lignin. Sampai saat ini tongkol jagung sudah dimanfaatkan untuk menghasilkan beberapa produk bernilai tambah seperti bioetanol, pakan ternak, maupun pengganti bahan bakar secara langsung. Karakteristik dan dan komposisi tongkol jagung dapat dilihat di Tabel 2. Selulosa merupakan komponen penyusun dinding sel tanaman yang tidak pernah ditemukan secara murni di alam, tetapi berikatan dengan bahan lain, yaitu lignin dan hemiselulosa.
Tabel 2 Komposisi Kimia Tongkol Jagung (Johnson 1991)
Komponen % b.k Komponen % b.k meningkat. Peningkatan produksi dan kebutuhan jagung berarti pula peningkatan limbah baik berupa jerami maupun tongkol jagung. Saat ini, penggunaan jerami jagung semakin populer untuk pakan ternak, sementara tongkol jagung belum dimanfaatkan. Padahal, tongkol jagung merupakan bagian terbesar dari limbah
jagung, yaitu sekitar 50−60% dari jagung bertongkol, bergantung pada
varietasnya. Oleh karena itu, dapat diperkirakan jika produksi jagung 11.75 juta ton, akan dihasilkan limbah tongkol jagung sekitar 12 juta ton/tahun.
et al. 2004). Ekstrak xilan dari tongkol jagung dapat dimanfaatkan di antaranya sebagai sumber karbon dalam medium fermentasi bakteri penghasil xilanase.
Xilanase merupakan kelompok enzim ekstraselular yang memiliki kemampuan menghidrolisis hemiselulosa (xilan) menjadi xilosa dan xilo-oligosakarida. Berdasarkan substrat yang dipecahnya, enzim xilanase digolongkan menjadi 3 kelompok, yaitu β-xilosidase, eksoxilanase, dan endoxilanase. Beberapa mikroorganisme diketahui mampu menghasilkan xilanase secara ekstraselular. Beberapa penelitian yang telah dilaporkan antara lain xilanase dari bakteri (Kumar dan Satyanarayana 2011; Heck et al. 2006), kapang (Sunna & Antranikan 1997), Actinomycetes (Beg et al. 2000), dan khamir (Liu et al. 1999). Xilanase dari bakteri alkalofilik diharapkan dapat digunakan sebagai pemutih kertas. Produksi xilanase oleh mikroorganisme menggunakan substrat xilan. Xilan merupakan polimer yang kompleks dengan xilosa sebagai komponen utama. Pada percobaan skala laboratorium substrat yang digunakan sebagai medium pertumbuhan mikroorganisme penghasil xilanase adalah xilan komersial dari Sigma yang harganya mahal sehingga tidak ekonomis bila digunakan dalam skala pabrik. Untuk mengantisipasi masalah tersebut, perlu dicari bahan baku terbarukan (renewable raw material) dari bahan berlignoselulosa limbah pertanian lokal, salah satunya adalah tongkol jagung. Karena itu, penelitian ini bertujuan memanfaatkan xilan dari tongkol jagung sebagai medium pertumbuhan B. halodurans CM1 penghasil xilanase sehingga akan meningkatkan nilai guna limbah jagung.
Bagas Tebu
Bagasse (ampas tebu) merupakan residu limbah berserat yang diperoleh dari hasil samping proses penggilingan tanaman tebu (Saccharum oficinarum) setelah diekstrak niranya pada industri pemurnian gula. Ampas ini sebagian besar mengandung bahan-bahan lignoselulosa. Bagasse mengandung air 48-52%, gula rata-rata 3.3%, dan serat rata-rata 47.7%. Serat bagasse sebagian besar terdiri dari selulosa, hemiselulosa dan lignin dan tidak dapat larut dalam air. Menurut Lavarack et al. (2002), bagasse merupakan hasil samping proses pembuatan gula tebu (sugarcane) mengandung residu berupa serat, minimal 50% serat bagasse
diperlukan sebagai bahan bakar boiler, sedangkan 50% sisanya hanya ditimbun sebagai buangan yang memiliki nilai ekonomi rendah. Rata-rata ampas yang diperoleh 35-40% dari setiap tebu yang diproses, dengan produksi tebu di Indonesia pada tahun 2007 sebesar 21 juta ton potensi ampas yang dihasilkan sekitar 6 juta ton ampas per tahun (Witono 2007). Penimbunan bagasse dalam kurun waktu tertentu akan menimbulkan permasalahan bagi pabrik. Mengingat bahan ini berpotensi mudah terbakar mengotori lingkungan sekitar, dan menyita lahan yang cukup luas untuk penyimpanannya. Potensi bagasse di Indonesia sangat melimpah khususnya di luar pulau jawa. Menurut Pusat Penelitian Perkebunan gula Indonesia (P3GI) (Deptan 2009), komposisi hasil samping industri gula di Indonesia terdiri dari limbah cair 52.9%, ampas tebu (bagas) 32.0%, tetes tebu (molasses) 4.5%, dan gula 7.05% serta abu 0.1%.
10
Tabel 3 Kandungan lignoselulosa pada bagasse (Howard et al. 2003)
Nama Bahan Jumlah (%) Bakteri B. halodurans CM1
B. halodurans CM1 merupakan bakteri thermoalkalophilik koleksi laboratorium Teknologi Bioindustri, BPP Teknologi Puspitek, Serpong. Bakteri ini diisolasi dari sedimen sumber air panas Cimanggu, Jawa Barat Indonesia. Isolat telah diketahui menghasilkan xilanase ekstraseluler. Suhu tempat adalah 60 ºC dan pH adalah 8. Bakteri bisa hidup pada pH 11 dan suhu 55 ºC, dan menghasilkan xilanase yang memiliki aktivitas optimal pada pH basa 9 dan suhu tinggi 70 ºC. Berdasarkan analisis 16S rRNA urutan kesamaan karakteristik dan biokimia, strain Bacillus sp. CM1 ini dikelompokkan ke dalam kelompok yang sama spesies dengan identitas 99% untuk Bacillus halodurans C-125. Isolat
Bacillus sp. CM1 juga menunjukkan aktivitas enzim lain seperti amilase, protease, dan gelatinase, yang menjanjikan potensinya sebagai produser dalam industri enzim (Ulfah et al. 2011).
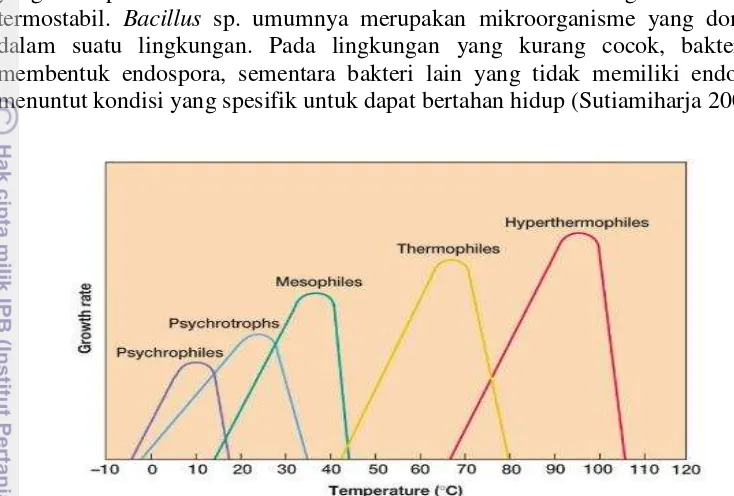
Bakteri termofilik dikelompokan berdasarkan suhu optimum pertumbuhan, Mikroorganisme secara umum dibedakan atas mikroorganisme psikrofil, psikotrop, mesofil, termofil, dan hipertermofil (Gambar 3). Bakteri psikrofil hidup pada kisaran suhu 0-20 ºC dan Bakteri psikotrop dapat tumbuh pada suhu 0-35 ºC. Bakteri mesofil dapat tumbuh pada suhu 20-45 ºC dan bakteri termofil tumbuh pada suhu 45-65 ºC. Bakteri hipertermofil hidup pada suhu pada suhu di atas 90 ºC dan maksimal pada suhu 100 ºC, namun pada beberapa bakteri dapat hidup pada suhu 80-113 ºC (Prescott 2005). Organisme termofilik secara umum diartikan sebagai organisme yang hidup pada suhu di atas 45 ºC. Organisme ini telah memberikan pengetahuan baru selama beberapa tahun terakhir. Minat para ilmuwan terhadap organisme termofil semakin tinggi terutama adanya penemuan bakteri-bakteri yang dapat hidup pada suhu didih air atau bahkan lebih tinggi (Lestari 2000). Indonesia sebagai negara tropis mempunyai banyak daerah dengan aktivitas geotermal, seperti daerah pegunungan berapi, sumber air panas dan cadangan minyak bumi dan batubara. Beberapa kondisi lingkungan yang berbeda dalam setiap lokasi memungkinkan adanya heterogenitas bakteri termofil yang tinggi (Indrajaya et al. 2003).
Bakteri termofil menghasilkan enzim termostabil yang sangat penting dalam proses industri dan bioteknologi, seperti dalam teknik-teknik biologi molekuler untuk kegunaan penelitian dan diagnostik (enzim yang memproses DNA dan RNA) dan kemampuan enzim untuk mengubah tepung, makanan, pengelolaan sampah, pembuatan kertas dan sintesis zat-zat organik (Sutiamiharja 2008; Dirnawan 2000).
air Gedong Songo dengan metode analisis gen 16S rRNA. Hasil penelitian menunjukkan bahwa terdapat kesamaan yang ditunjukkan oleh bakteri
Geobacillus thermoleovourans yang dapat tumbuh pada kisaran suhu antara 65 ºC sampai 75 ºC. Brock (1978) menemukan bakteri Thermus aquaticus, suatu bakteri yang mampu tumbuh di atas suhu 70 ºC. Bakteri ini menghasilkan enzim termostabil. Bacillus sp. umumnya merupakan mikroorganisme yang dominan dalam suatu lingkungan. Pada lingkungan yang kurang cocok, bakteri ini membentuk endospora, sementara bakteri lain yang tidak memiliki endospora menuntut kondisi yang spesifik untuk dapat bertahan hidup (Sutiamiharja 2008).
Gambar 3 Suhu pertumbuhan mikroorganisme (Prescott2005)
Kemampuan hidup mikroorganisme termofil ini berhubungan dengan struktur selnya yang memiliki beberapa kelebihan (de Rossa et al. 2008), yaitu: (1) struktur membran sel membran sel setiap mahkluk hidup tersusun atas senyawa lipid dan protein yang disebut lipoprotein. Pada umumnya bagian lipid dari membran sel mahkluk hidup dihubungkan oleh ikatan ester, sedangkan pada organisme termofil senyawa lipid membran selnya mengandung ikatan eter yang terbentuk lewat proses kondensasi dari gliserol atau senyawa poliol kompleks lainnya dengan alkohol isoprenoid yang mengandung 20, 25 atau 40 atom karbon. Lebih jauh lagi senyawa eter gliserol pada Archaebacteria ini mengandung 2.3 O-sn-gliserol yang menyebabkan struktur lipoprotein dari membran sel termofil tersebut lebih stabil (Dessy 2008); (2) chaperonin yang merupakan jenis protein yang sangat jarang dijumpai pada protein-protein fungsional lainnya di dalam sel. Protein ini berperan dalam mempertahankan kembali struktur tiga dimensi dari protein fungsional sel dari denaturasi suhu lingkungan yang bersifat ekstrim.
12
dalam mengontrol topologi DNA suatu sel dan memegang peran penting dalam proses replikasi dalam transkripsi DNA. Semua jenis topoisomerase dapat merelaksasikan DNA tetapi hanya DNA girase yang dapat mempertahankan struktur DNA tetapi berbentuk supercoil. DNA girase disusun oleh 90-150 pasangan basa-N DNA. DNA girase ini juga selalu dijumpai pada organisme yang hidup dilingkungan di atas suhu 70 ºC dan juga dapat dijumpai pada organisme yang hidup pada kisaran suhu sekitar 60 ºC. DNA ini merupakan salah satu kelengkapan sel dari organisme termofilik (Dessy 2008).
1. Klasifikasi
Species : Bacillus halodurans
2. Morfologi B. halodurans CM1
Secara makroskopik maupun mikroskopik B. halodurans memiliki bentuk sel berbentuk batang (basil), dengan ukuran sel 2.7-5.5 μm. Koloni bakteri B. halodurans mempunyai bentuk koloni yang bulat berwarna putih kecoklatan (Ulfah et al. 2011).
3. Biosintesis Metabolit
Secara umum hasil metabolisme mikroba berupa metabolit primer dan sekunder. Pembentukan senyawa metabolit ini dipengaruhi oleh jenis dan jumlah nutrisi yang tersedia pada medium fermentasi (Stanburry dan Whittaker 1987). Metabolit primer adalah hasil metabolisme bakteri yang merupakan kebutuhan pokok untuk hidup dan tumbuh.
Produksi metabolit primer sejalan dengan pertumbuhan sel bakteri, karena metabolit primer yang dihasilkan bakteri digunakan untuk menyusun struktur tubuh bakteri agar menjadi besar.
Metabolit sekunder adalah hasil metabolisme bakteri yang tidak digunakan secara langsung untuk pertumbuhan bakteri, akan tetapi digunakan sebagai nutrien darurat untuk mempertahankan diri dari bahaya lingkungannya dan bervariasi jenisnya pada setiap bakteri. Menurut Stanburry dan Whittaker (1987), metabolit sekunder pada mikroba dapat bersifat sebagai antimikroba, inhibitor spesifik suatu enzim, pemacu pertumbuhan atau mempunyai sifat farmakologi.
Optimalisasi Media
media fermentasi bisa saja menjadi penelitian berbiaya tinggi,memakan waktu dan
open ended. Pada industri berbasis fermentasi bahkan perlu dilakukan optimalisasi media terus menerus karena adanya galur dan mutan baru yang ditemukan.
Ada dua strategi yang didapat dilakukan untuk mengefisienkan penelitian optimalisasi media menurut Kennedy dan Krouse (1999) yaitu strategi terbuka dan strategi tertutup. Strategi tertutup dilakukan dengan tujuan mencari kombinasi terbaik dari komponen media yang sudah ada. Strategi ini sangat sederhana karena tidak perlu mencari komponen penyusun media, akan tetapi strategi ini menghilangkan kemungkinan ada komponen lain yang tidak termasuk didalam komposisi ternyata mempunyai pengaruh yang signifikan terhadap produksi. Strategi kedua adalah strategi yang harus dapat menjawab pertanyaan kombinasi seperti apa dari semua komponen yang tersedia dapat menghasilkan produk tertinggi. Strategi terbuka menjadi optimalisasi media lebih rumit karena rancangan percobaan tidak dengan mudah dapat diterapkan. Terdapat tiga hal utama yang perlu diperhatikan sebelum rancangan media dikerjakan : 1) pengaruh rancangan media terhadap seleksi galur, 2) seberapa baik data rancangan media pada kultur kocok untuk digandakan skala dan 3) variabel apa yang akan dijadikan target untuk diperbaiki.
Optimalisasi secara matematis didefinisikan sebagai pemaksimalan atau penimimalan suatu fungsi tertentu yang memungkinkan untuk mengatakan bahwa media yang memberikan hasil terbaik sebagai media optimal, dan dapat dikatakan sebagai media yang sudah diperbaiki atau media yang ditingkatkan performanya. Menurut Kennedy dan Krouse (1999), ada beberapa strategi yang dapat digunakan untuk meningkatkan performa media fermentasi yaitu: a) berdasarkan pustaka yang ada, b) substitusi salah satu komponen media, c) strategi kesetimbangan massa sel, d) variasi satu variabel dengan menjaga variabel yang lain tetap, e) penggunaan rancangan penelitian.
Response Surface Methodology (RSM)
14
respon, yaitu berapa bagian yang disebabkan oleh perlakuan, berapa bagian yang disebabkan oleh lingkungan dan berapa bagian yang ditimbulkan oleh berbagai pengaruh yang tidak dapat dianalisis dengan jelas. Untuk memahami seberapa jauh suatu proses yang optimum dipengaruhi oleh sejumlah variabel, sering diperlukan data-data percobaan dalam jumlah besar dan membutuhkan waktu lama, yang secara otomatis juga akan memerlukan biaya dalam jumlah yang besar. Beberapa teknik statistika dan matematika sering dipakai untuk melakukan pendekatan guna memperoleh pemahaman terhadap kondisi optimum dari suatu proses, tanpa memerlukan data yang terlampau banyak. Diantara metode yang sering dipakai adalah metode permukaan respon.
Metode permukaan respon (response surface methodology) merupakan sekumpulan teknik matematika dan statistika yang berguna untuk menganalisis permasalahan dimana beberapa variabel independen mempengaruhi variabel respon dan tujuan akhirnya adalah untuk mengoptimalkan respon. Salah satu ciri khas dari metode RSM, yaitu mampu melihat interaksi antar parameter, sehingga RSM dapat memvariasikan semua parameter bersamaan. Kemampuan RSM dalam mengoptimasi berbagai macam variabel secara bersamaan dan meninjau interaksi antar variabel yang divariasikan, membuat optimasi menggunakan RSM menjadi lebih baik dan cepat (Box dan Draper 1987) .
Ide dasar metode ini adalah memanfaatkan desain eksperimen berbantuan statistika untuk mencari nilai optimal dari suatu respon dan sampai saat ini telah banyak dimanfaatkan baik dalam dunia penelitian maupun aplikasi industri. Misalnya, dengan menyusun suatu model matematika, peneliti dapat mengetahui nilai variabel-variabel independen yang menyebabkan nilai variabel respon menjadi optimal. Terdapat tiga variabel independen yang diperhatikan sebagai variabel yang mempengaruhi produksi enzim xilanase, yaitu sumber karbon (X2), sumber nitrogen (X2) dan pH (X3). Desain eksperimen yang digunakan dalam eksperimen tahap I adalah desain faktorial dua level (2k) ditambah dengan empat center point (Lampiran 2). Sedangkan pada eksperimen tahap II digunakan
Central Composite Design (CCD) (Lampiran 4). Data pada eksperimen tahap I maupun tahap II ini merupakan data simulasi dan disajikan pada Lampiran 1 dan Lampiran 3.
Tujuan metode ini adalah untuk mengoptimalkan hasil atau respon (variabel output) yang dipengaruhi oleh beberapa variabel bebas (variabel input). Sejumlah seri perlakuan diuji (run) dan variasi yang dilakukan pada variabel input akan menjadi faktor yang mempengaruhi perubahan respon (output). RSM merupakan model perlakuan matematika. Pada percobaan praktikal, ketidaktepatan dapat terjadi, sementara itu percobaan dengan komputer penyimpangan matematis dihasilkan dari penghubung yang tidak sempurna dari suatu proses, mengurangi error fenomena fisik, dan pada RSM galat (error) yang terjadi diasumsikan secara acak (Box dan Draper 2007).
diperlukan fungsi respon ordo kedua dengan menggunakan rancangan komposit terpusat dalam mengumpulkan data percobaan. Penentuan kondisi optimum proses dilakukan menggunakan analisis kanonik dari analisis plot kontur permukaan. Analisis kanonik dalam metode permukaan respon adalah mentransformasikan pemukaan respon dalam bentuk kanonik. Sedangkan kontur adalah suatu seri garis atau kurva yang mengidentifikasikan nilai-nilai peubah uji pada respon yang konstan. Kontur memegang peranan penting dalam mempelajari analisis permukaan. Ada beberapa hal penting yang perlu diketahui dalam melakukan optimasi antara lain dalam pengujian model pada teknik optimasi untuk mengetahui ketepatan model didasarkan atas uji penyimpangan model (lack of fit), koefisien determinasi (R2), uji signifikansi model, dan uji asumsi residual. Ketepatan model yang dianggap tepat jika uji simpangan model (lack of fit) bersifat tidak nyata secara statistik. Sebaliknya, jika bersifat nyata maka suatu model dianggap tidak cocok untuk menerangkan fenomena sistem yang dipelajari; walaupun kriteria lain cukup baik (Box dan Drapper 1987). Nilai R2 merupakan ukuran kesesuaian model dalam kemampuannya untuk menerangkan keragaman nilai peubah Y. Uji signifikansi model dan uji asumsi residual dilakukan untuk mengetahui pengaruh peubah bebas terhadap respon.
3 METODOLOGI
Waktu dan Tempat
Penelitian ini telah dilaksanakan mulai Maret 2013 sampai Februari 2014 bertempat di Laboratorium Teknologi Bioindustri, Laboratoria Pengembangan Teknologi Industri Agro-Biomedika (LAPTIAB), Badan Pengkajian dan Penerapan Teknologi (BPPT), Kawasan PUSPIPTEK Serpong, Tangerang Selatan.
Alat dan Bahan
16
Mikroorganisme
Mikroorganisme yang digunakan Bacillus halodurans CM1 dari koleksi laboratorium Teknologi Bioindustri, BPP Teknologi.
Tahapan Penelitian
Penelitian ini terdiri atas beberapa tahap utama yaitu (1) pemilihan komposisi media (2) seleksi substitusi sumber xilan (3) seleksi substitusi sumber nitrogen (4) optimalisasi menggunakan RSM
Penyimpanan Isolat
Isolat B. halodurans CM1 yang telah menghasilkan zona bening pada medium agar yang mengandung xilan disimpan dalam gliserol stok pada suhu -80 ºC direfresh dengan mengambil sebanyak 200 µl kedalam media tumbuh erlenmeyer 10 mL biarkan selama 6 jam, kemudian digores pada media nutrien agar miring sebagai working culture dan digores pada media nutrien agar plate sebagai stock culture. Tabung dan plate agar kemudian diinkubasi dalam inkubator pada suhu 70 °C selama 24 jam setelah itu koloni bakteri B. halodurans
CM1 yang tumbuh disimpan di ruang penyimpanan coldroom. Isolat B. halodurans CM1 disimpan dalam agar miring (Slant) dengan komposisi media menurut Nakamura et al. (1995). Komposisi media per 100 mL terdiri dari 1.0 g xilan, 0.25 g pepton, 0.25 g yeast ekstrak, 0.05 g MgSO4, 1.0 g Na2CO3, 0.05 g KH2PO4 dan 2 g agar yang dilarutkan dalam air bebas mineral. Isolat disimpan pada suhu 4 ºC, dan disegarkan kembali pada saat akan digunakan.
Penyiapan Inokulum
Isolat B. halodurans CM1 ditumbuhkan pada media starter Nakamura et al.
(1995) pada labu erlenmeyer 100 mL dengan volume kerja 10 mL. Media starter diinokulasi dengan suspensi bakteri 108/mL. Propagasi dilakukan didalam labu erlenmeyer dengan kecepatan agitasi 150 rpm suhu 50 ºC selama 4 jam.
Pembuatan Ekstraksi Xilan dari Tongkol Jagung
supernatan yang mengandung xilan dan disimpan diruang penyimpanan coldroom
(±5 oC).
Seleksi Medium Fermentasi
Media produksi dibuat dengan menggunakan 3 komposisi medium fermentasi (Lampiran 5) berdasarkan Nakamura et al. (1995), Kumar dan Satyanarayana (2011), dan Mamo et al. (2006). Masing-masing komposisi media dicampur kemudian dilarutkan dalam 90 mL air Reverse Osmosis (RO) dalam erlenmeyer 500 mL, dihomogenkan dengan magnetic stirrer. Setelah medium larut, pH diatur dengan penambahan HCl 2 M hingga pH 9, kemudian disterilisasi dalam autoklaf 121 oC selama 20 menit. Seleksi media produksi dilakukan berdasarkan acuan pustaka tentang komposisi medium bakteri genus
Bacillus sp. alkalotermotoleran dan dipilih 3 komposisi media untuk bakteri penghasil xilanase. Media pertama adalah berdasarkan Kumar (2011) dengan komposisi sebagai berikut : dalam 100 mL medium mengandung xilan beechwood 0.5 g, pepton 0.5 g, yeast ekstrak 0.5 g, KH2PO4 0.1 g, MgSO4.7H2O 0.02 g, dan Na2CO3 1 g. Media kedua menurut Nakamura et al. (1995) dengan komposisi sebagai berikut : dalam 100 mL mengandung xilan beechwood 1 g, pepton 0.25 g, yeast ekstrak 0.25 g, MgSO4,7H2O 0.01 g, dan KH2PO4.3H2O 0.05 g. Media ketiga menurut Mamo et al. (2006) dengan komposisi sebagai berikut: dalam 100 mL medium mengandung xilan beechwood 0.5 g, pepton 0.5 g, KH2PO4 0.1 g, Na2CO3 1 g, NaCl 0.2 g, MgSO4 0.01 g, dan CaCl2 0.01 g.
Pemilihan Substitusi Sumber Karbon dan Sumber Nitrogen Terbaik
Empat macam sumber karbon (xilan) dicoba digunakan untuk fermentasi B. halodurans CM1 adalah bagas tebu, xilan bagas, tongkol jagung, dan xilan tongkol jagung (Lampiran 6) serta sumber nitrogen pengganti pepton yaitu tepung ikan P dan tepung ikan N (Lampiran 7). Sebelum digunakan kadar xilan dan nitrogen dari masing-masing sumber ditetapkan sehingga dapat disusun komposisi media dengan kadar xilan dan nitrogen yang sama. Berbagai jenis sumber xilan dan sumber nitrogen dicoba untuk mendapatkan seleksi penghasil produksi xilanase terbaik dari masing-masing komposisi substitusi. Percobaan dilakukan dengan konsentrasi yang bervariasi. Proses fermentasi produksi xilanase dengan media terpilih dilakukan dengan kultur kocok menggunakan labu erlenmeyer 500 mL volume kerja 100 mL pada suhu 50 ºC kecepatan agitasi 120 rpm selama 27 jam.
Optimasi Komposisi Media untuk Produksi Xilanase
18
kombinasi yang ditentukan oleh RSM dalam Erlenmeyer 500 mL, berisi 90 mL media produksi. Kemudian diinokulasikan 10 mL, 4x108 sel/ml sel bakteri. Inkubasi kultur dalam erlenmeyer dipertahankan pada 50 ºC, 150 rpm selama 24, 48, atau 72 jam hingga aktivitas enzim menurun, sampling dilakukan setiap 6 jam dimulai sejak inkubasi awal dan setelah jam ke-18 sampling dilakukan setiap 3 jam.
Penghitungan Jumlah Bakteri
Jumlah sel B. halodurans CM1 dihitung dengan metode penghitungan langsung mengunakan Neubauer counting chambert berdasarkan Black (1999).
Neubauer counting chambert terdiri dari sebuah slide mikroskop kaca tebal dengan lekukan persegi panjang yang menciptakan sebuah kamar. Ruangan ini adalah diukir dengan laser-grid tergores garis tegak lurus. Perangkat ini dibuat dengan hati-hati sehingga daerah yang dibatasi oleh garis diketahui, dan kedalaman ruang ini juga dikenal.
Ruang hitung terdiri dari 9 kotak besar dengan luas 1 mm². Satu kotak besar di tengah, dibagi menjadi 25 kotak sedang dengan panjang 0.05 mm. Satu kotak sedang dibagi lagi menjadi 16 kotak kecil, sehingga satu kotak besar tersebut berisi 400 kotak kecil. Tebal dari ruang hitung ini adalah 0.1 mm. Sel bakteri yang tersuspensi akan memenuhi volume ruang hitung tersebut sehingga jumlah bakteri per satuan volume dapat diketahui.
Pengukuran Aktivitas Xilanase
Aktivitas xilanase diukur dengan metode Bailey (1992) yang dimodifikasi yaitu dengan mengukur kadar gula pereduksi yang dibebaskan selama reaksi hidrolisis xilan oleh xilanase. Berdasarkan penelitian Ulfah et al. (2011), aktivitas optimum xilanase yang dihasilkan oleh B halodurans CM1 adalah pada suhu 70 C, pH 9. Sebanyak 50 μl enzim kasar dicampur dengan 450 μl substrat xylan
0.5% dalam dapar Tris-HCl pH 9. Campuran diinkubasi dalam thermomixer
selama 5 menit pada suhu 70 °C. Reaksi dihentikan dengan penambahan 750 μl
Dinitrosalicylic (DNS). Campuran kemudian diinkubasi selama 5 menit pada air mendidih dan didinginkan pada suhu kamar. Pengukuran absorbansi dilakukan
pada panjang gelombang 540 nm. Kontrol dibuat dengan menginkubasi 450 μl
substrat xilan 0.5 % dalam dapar Tris-HCl pH 9 pada suhu 70 °C selama 5 menit.
Reaksi dihentikan dengan menambahkan 750 μl DNS, lalu ditambahkan 50 μl
enzim kasar. Campuran diinkubasi dalam air mendidih selama 5 menit. Di ukur panjang gelombang 540 nm. Satu unit aktivitas xilanase didefinisikan sebagai banyaknya enzim yang dapat memproduksi 1 µmol xilosa/menit/mL pada kondisi tertentu. Kadar xilosa yang terkandung dalam masing-masing sampel dan kontrol ditentukan berdasarkan kurva standar xilosa yang dihitung menggunakan regresi linier. Aktivitas enzim xilanase dihitung berdasarkan rumus sebagai berikut :
Aktivitas xilanase (U/ml) ) )
Pembuatan Kurva Standar Xilosa
Kurva standar xilosa dilakukan dengan membuat variasi konsentrasi standar xilosa di dalam larutan dapar Tris-HCl pH 9. Sebanyak 50 μl larutan xilosa dari masing-masing konsentrasi 0-1 mg/ml dimasukkan kedalam tabung eppendorf dan
ditambah dengan 450 μl substrat xilan 0.5% dalam dapar Tris-HCl pH 9.
Campuran diinkubasi selama 5 menit pada suhu 70 °C, lalu ditambahkan 750 μl DNS dan diinkubasi kembali dalam air mendidih selama 5 menit. Pengukuran absorbansi dilakukan pada panjang gelombang 540 nm. Kurva standar xilosa adalah grafik hubungan absorbansi dengan variasi konsentrasi xilosa.
Penentuan Kadar Protein
Kadar protein enzim ditentukan dengan metode Bradford (1976) yang telah
dimodifikasi. Sebanyak 30 μl enzim kasar direaksikan dengan 1.5 ml larutan
pereaksi Bradford yang telah diencerkan 5 kali pada tabung reaksi. Campuran dihomogenkan dengan vorteks dan diinkubasi pada suhu kamar selama 20 menit. Pengukuran absorbansi dilakukan pada panjang gelombang 595 nm. Konsentrasi protein ditentukan dengan menggunakan kurva standar bovine serum albumin
(BSA). Metode Bradford merupakan salah satu teknik penentuan kadar protein yang berdasarkan pada pengikatan secara langsung zat warna Coomassine Brilliant Blue G250 (CBBG) oleh protein pada kondisi pH asam. Grup trifenilmetana mengikat struktur non polar protein dan grup anion sulfonat berinteraksi dengan rantai samping protein kation (protein bermuatan positif). Jumlah CBBG yang terikat pada protein proporsional dengan muatan positif yang ditemukan pada protein. Reagen CBBG bebas berwarna merah-kecoklatan ( maks 465 nm), sedangkan dalam suasana asam reagen CBBG akan berada dalam bentuk anion yang akan mengikat protein membentuk warna biru (maks 595 nm) (Bradford 1976). Hubungan antara konsentrasi larutan standar dan absorbansinya dinyatakan sebagai persamaan regresi linier: Y = a + bx.
Pembuatan Kurva Standar BSA
Pembuatan kurva standar bovine serum albumin (BSA) dilakukan dengan membuat membuat variasi konsentrasi standar BSA didalam larutan dapar Tris-HCl pH 9. Setiap variasi konsentrasi standar BSA diambil sebanyak 30 μl kemudian dicampur dengan 1.5 mL larutan Bradford dalam tabung reaksi. Larutan yang telah dicampur dihomogenkan dengan vorteks, kemudian diinkubasi selama 20 menit pada suhu kamar. Pengukuran absorbansi dilakukan pada panjang gelombang 595 nm. Kurva standar BSA adalah grafik hubungan konsentrasi protein standar (BSA dengan variasi konsentrasi) dengan nilai absorbansi pada panjang gelombang 595 nm.
Desain penelitian
20
mulai dari desain penelitian, analisis data dan optimasi. Optimasi RSM meliputi : (a) Penentuan faktor optimum besaran campuran dan respon optimasi, (b). Pencampuran kombinasi level faktor yang diberikan RSM, (c) Pencarian solusi terbaik (kombinasi optimum). Desain faktorial dilakukan untuk menentukan kondisi yang optimum untuk produksi xilanase oleh B. halodurans CM1. Variabel dependen dipilih untuk penelitian ini adalah aktivitas enzim dan variabel independen yang dipilih adalah konsentrasi sumber xilan, konsentrasi tepung ikan, dan pH. Faktor yang dioptimasi untuk kegiatan enzim sebagai berikut : X1 untuk konsentrasi sumber karbon, X2 untuk konsentrasi sumber N yaitu Tepung ikan, X3 untuk pH. Teknik optimasi RSM telah banyak digunakan untuk optimasi proses maupun optimasi produk dalam industri (Box dan Draper 1987).
Sebelum melakukan optimasi konsentrasi sumber xilan, nitrogen dan pH dilakukan penelitian pendahuluan yaitu seleksi komposisi medium, sumber xilan dan nitrogen. Setelah didapatkan substitusi sumber karbon, substitusi sumber nitrogen dan komposisi media produksi terbaik dilanjutkan dengan teknik RSM. Pengunaan metode RSM untuk dapat mengetahui model empirik yang menyatakan hubungan antara variabel-variabel independen dengan variabel respon, serta dapat diketahui nilai-nilai variabel independen yang dapat menyebabkan nilai variabel respon menjadi optimal. Adanya beberapa tahapan dalam RSM intinya adalah untuk mencari fungsi yang menyatakan hubungan antara variabel respon dan variabel independen, mengestimasi parameter-parameter dari fungsi aproximasi yang diperoleh dengan metode kuadrat terkecil, dan analisis ketidak tepatan model. Karakteristik metode RSM digunakan untuk menentukan titik stasioner maksimum, minimum, atau titik pelana. Eksperimen dengan metode RSM dilakukan dalam 2 tahapan yaitu tahap I desain eksperimen yang digunakan adalah desain faktorial 2 level dan tahap II desain eksperimen yang digunakan adalah central composite design (CCD), suatu rancangan dengan tiga taraf faktor yang dikodekan dari selang konsentrasi untuk tiap faktor dan level konsentrasi tiap faktor sebelum dikodekan. Pengujian ini dilakukan untuk mengetahui secara jelas bentuk atau pola permukaan responnya. Percobaan ini terdiri dari suatu rancangan faktorial 23, yang diperbesar dengan 6 starting point, dan 6 center point.
Hasil percobaan diplotkan pada suatu persamaan polinomial ordo kedua dan diolah dengan program Design Expert versi 5.0. Model matematis yang muncul dari percobaan ini adalah sebagai berikut :
Y= a0+a1X1+a2X2+a3X3+a12X1X2+a13X1X3+a23X2X3+a11X12+a22X22+a33X32 Dimana Y adalah respon yang muncul dari masing-masing perlakuan dalam hal ini adalah aktivitas enzim, a0 adalah konstanta, a1, a2, a3 adalah koefisien untuk pengaruh linier masing-masing faktor a12, a13, a23 adalah koefisien untuk pengaruh interaksi antar faktor a11, a22, a33 adalah koefisien untuk pengaruh kuadratik masing-masing faktor.
Analisis Statistik
dibantu dengan Software Design Expert 5 Version 5.05 dari stat-ease Corporation Minneapolis, USA.
4 HASIL DAN PEMBAHASAN
Seleksi Komposisi Media Produksi dan Sumber Karbon
Produksi xilanase membutuhkan suatu medium yang menghasilkan xilanase dengan jumlah aktivitas yang tinggi. Komposisi suatu media produksi dalam proses fermentasi sangat mempengaruhi aktivitas mikroba dalam menghasilkan enzim secara maksimal. Seleksi media produksi dilakukan dengan studi literatur dan dipilih 3 komposisi media yang diperkirakan cocok untuk aktivitas B. halodurans CM1 dalam menghasilkan xilanase. Media pertama Kumar dan Satyanarayana (2011) dengan komposisi sebagai berikut : dalam 100 mL medium mengandung xilan beechwood 0.5 g, pepton 0.5 g, yeast ekstrak 0.5 g, KH2PO4 0.1 g, MgSO4.7H2O 0.02 g, dan Na2CO3 1 g. Media kedua Nakamura et al. (1995) dengan komposisi sebagai berikut : dalam 100 mL mengandung xilan beechwood
1 g, pepton 0.25 g, yeast ekstrak 0.25 g, MgSO4,7H2O 0.01 g, dan KH2PO4.3H2O 0.05 g. Media ketiga Mamo et al. (2006) dengan komposisi sebagai berikut : dalam 100 mL medium mengandung xilan beechwood 0.5 g, pepton 0.5 g, KH2PO4 0.1 g, Na2CO3 1 g, NaCl 0.2 g, MgSO4 0.01 g, dan CaCl2 0.01 g.
Gambar 4 Produksi xilanase dari berbagai komposisi media dan jenis sumber karbon, Nakamura et al. (1995), Mamo et al. (2006), dan Kumar dan Satyanarayana (2011) sumber karbon bagas tebu (█), Xilan bagas tebu (█), tongkol jagung (█), dan xilan tongkol jagung (█), pada suhu 50 ºC, pH 9 selama 24 jam inkubasi
22
Sumber karbon berfungsi dalam penyediaan kebutuhan energi untuk pertumbuhan mikroba dan juga dapat berfungsi sebagai substrat untuk enzim yang diproduksi oleh mikroba, sedangkan sumber nitrogen berfungsi sebagai penyedia protein dan asam amino bagi nutrisi bakteri (Riadi 2007).
Variasi sumber karbon yang digunakan dalam proses seleksi substitusi terbaik pada penelitian ini adalah xilan bagas tebu, xilan tongkol jagung, bagas tebu dan tongkol jagung. Dari ketiga komposisi media dan berbagai sumber karbon didapatkan data produksi xilanase yang sajikan pada Gambar 4.
Komposisi media menurut Mamo et al. (2006) menunjukkan hasil produksi xilanase yang tinggi pada semua sumber xilan yang diujikan dibanding komposisi media lainnya, dan produksi tertinggi menggunakan sumber karbon dari tongkol jagung yaitu sebesar 234.5 U/mL. Diikuti dengan media Kumar dan Satyanarayana (2011) dengan produksi xilanase tertinggi menggunakan bagas tebu sebesar 118.43 U/mL dan media Nakamura et al. (1995) dengan produksi xilanase tertinggi menggunakan sumber karbon dari tongkol jagung sebesar 94.22 U/mL. Optimasi komposisi media fermentasi submerged ini dilakukan dengan perlakuan kondisi yang sama pada setiap media seleksi. Setelah diperoleh hasil seleksi komposisi media fermentasi dengan hasil produksi enzim xilanase tertinggi yaitu media menurut Mamo et al. (2006), maka dilanjutkan seleksi penentuan sumber nitrogen.
Seleksi Penentuan Sumber Nitrogen
Pemilihan komposisi medium yang tepat digunakan untuk membentuk produk seperti enzim, sebagai pemeliharaan sel dan untuk memenuhi kebutuhan pertumbuhan optimal sel yang meliputi sumber karbon dan nitrogen. Sedangkan sumber nitrogen substitusi yang akan diseleksi antara lain tepung ikan N dan tepung ikan P. Hasil penentuan nitrogen disajikan pada Gambar 5 di bawah ini.
Produksi xilanase tertinggi pada jam ke 22 terdapat pada penggunaan substitusi sumber nitrogen tepung ikan P (98.17 U/mL) dibandingkan dengan sumber nitrogen dari tepung ikan N (53.51 U/mL) (Gambar 5). Sumber karbon dan sumber nitrogen terpilih juga diuji dengan kontrol. Kontrol terdiri dari sumber karbon berupa xilan beechwood 0.5% (b/v) dan sumber nitrogen berupa pepton 0.5% (b/v).
Tepung ikan N dan P didapat dari perusahaan produsen tepung ikan, CV. Karunia Artha Mandiri, Paciran Lamongan, Jawa Timur. Tepung ikan yang digunakan adalah hasil dari pengolahan sisa ikan runcah atau pun limbah sisa-sisa pengolahan ikan yang tidak layak untuk konsumsi. Kadar protein total masing-masing tepung ikan N dan P adalah 0.1713% (b/b) dan 0.128% (b/b), sedangkan kadar protein total pepton sebagai pembanding sebesar 0.0947% (b/b).
Aktivitas tertinggi didapat dengan penggunaan substitusi tepung ikan P. Hal ini dimungkinkan Tepung ikan P memiliki komposisi mineral yang dibutuhkan sebagai kofaktor enzim. Bahan mineral yang dimiliki tepung ikan P meliputi Ca 145727.25 ppm , Mg 19826.10 ppm, K 4093.33 ppm, dan Na 74.99 ppm (Lampiran 8). Bahan mineral berfungsi sebagai kofaktor yang diperlukan untuk meningkatkan aktivitas enzim. Kandungan fosfor yang tinggi juga diduga menyebabkan produksis enzim meningkat hal ini sesuai dengan teori yang disampaikan Becker (1994), produksi enzim akan tinggi jika komposisi nitrogen rendah sedangkan komposisi fosfor tinggi.
Menurut Stanburry dan Whittaker (1987) sumber nitrogen organik terdiri dari asam amino yang komplek yaitu tidak seragam dan dapat secara langsung dimanfaatkan oleh bakteri untuk metabolisme sel. Pada beberapa kasus pertumbuhan mikroba menjadi lebih cepat dengan ketersediaan sumber nitrogen organik karena sebagian besar dalam bentuk asam amino penyusun protein. Tepung ikan P dan tepung ikan N yang digunakan dalam penelitian ini dianalisa pada Balai Besar Industri Agro, Bogor berturut-turut memiliki kadar fosfor (P) total 19% (b/v) dan 4.14% (b/v) . Tahapan proses pengolahan pembuatan tepung ikan P dimungkinkan yang menyebabkan struktur protein yang terdapat pada tepung ikan menjadi struktur asam amino yang sederhana sehingga dapat langsung dimanfaatkan oleh bakteri untuk metabolisme sel dan menghasilkan enzim xilanase.
Optimasi Menggunakan Response Surface Methodology
24
sukses digunakan pada optimasi komposisi medium, kondisi hidrolisis enzimatik dan optimasi proses fermentasi (Vohra dan Satyanarayana 2001). Berikut dijelaskan 2 tahapan desain eksperimen.
Desain eksperimen faktorial dua level (2k)
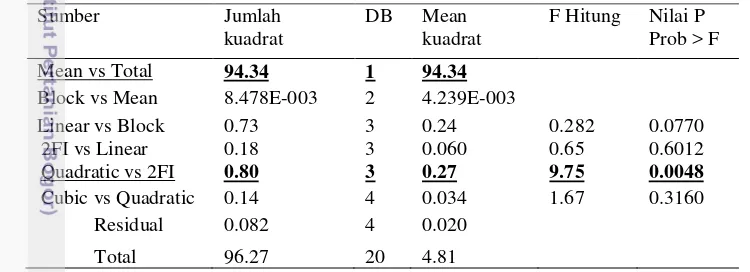
Desain faktorial dua level didefinisikan untuk menentukan faktor-faktor yang mempengaruhi produksi enzim dan faktor-faktor yang diamati (Screening factor). Konsentrasi xilan tongkol jagung (X1), untuk batas atas 1% (b/v) dan batas bawah 0.25% (b/v), sedangkan konsentrasi tepung ikan P (X2), untuk batas atas adalah 0.54% (b/v) dan batas bawah 0.18% (b/v) untuk batas pH (X3) adalah 10-8. Dengan menggunakan desain faktorial dua level menggunakan 3 faktor xilan (X1), Tepung ikan P (X2), dan pH (X3) maka dihasilkan total 12 perlakuan kombinasi konsentrasi tongkol jagung, konsentrasi tepung ikan p dan pH yang berbeda terlihat pada tabel pada lampiran. Respon aktivitas enzim xilanase diamati pada jam ke -6, ke-12, ke-18, ke-21, dan ke-24. Hasilnya dianalisa menggunakan Analysis of Variance (ANOVA). Hasil analisa pada Tabel 4 dan Tabel 5 menunjukkan bahwa model interaksi antara konsentrasi xilan, konsentrasi tepung ikan P dan nilai pH menunjukkan hasil yang signifikan.
Tabel 4 Hasil uji analisa ragam (ANOVA) desain faktorial dua level
Sumber Jumlah
Curvature significant 529.22 1 529.22 33.4 0.0103
Pure Error 47.40 3 15.80
Cor Total 2560.43 11
Tabel 5 Lanjutan hasil uji analisa ragam (ANOVA) desain faktorial dua level
Std.Dev. 3.97 R-kuadrat 0.9767
Mean 61.71 Akar R-Kuadrat 0.9222
C.V.% 6.44 Prediksi R-Kuadrat N/A
PRESS N/A Adeq Precision 14.089
Dari hasil analisa ragam pada Tabel 4, nilai dari Fhitung dari model lebih besar dari Ftabel (17.94>3.97) dan p-value = 0.0187 <= 0.05 menunjukkan model signifikan atau dapat diterima untuk melihat perkiraan pengaruh setiap peubah dan interaksi faktor dengan respon. Nilai koefisien determinasi R2 = 0.9767 pada Tabel 5 menunjukkan adanya hubungan korelasi yang tinggi antara pengaruh variabel faktor terhadap respon. Adeq Precision menunjukkan rasio 14.089 > 4
Signifikan