ADSORPSI DPPH
UNING RINININGSIH EM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Korelasi Antara Aktivitas Antioksidan Zeolit Sintetis Terpilar Titanium Dioksida Dan Besi (III) Oksida Dengan Adsorpsi DPPH adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
DPPH. Dibimbing oleh SRI SUGIARTI dan KOMAR SUTRIAH .
Penyakit degeneratif akibat berlebihnya radikal bebas di dalam tubuh merupakan penyebab kematian tertinggi di dunia. Radikal bebas dalam tubuh mengakibatkan penuaan dini dengan merusak jaringan lemak yang berada di bawah kulit sehingga menghilangkan kekencangan kulit dan kulit menjadi keriput. Salah satu cara untuk menanggulangi kelebihan radikal bebas adalah dengan menambahkan antioksidan alami pada produk farmasi dan bahan pangan. Zeolit merupakan salah satu material yang berpotensi sebagai antioksidan. Zeolit bekerja sebagai antioksidan dengan cara memerangkap radikal bebas dalam strukturnya sehingga radikal bebas menjadi tidak aktif dan aman dihilangkan dari tubuh. Kinerja zeolit sebagai antioksidan dapat ditingkatkan dengan memilar zeolit dengan oksida logam misalnya TiO2 atau Fe2O3 .
Tujuan dari penelitian ini adalah mensintesis zeolit dari kaolin Bangka Belitung, kemudian dipilar dengan TiO2 dan Fe2O3 serta mengamati korelasi
antara aktivitas antioksidan dengan adsorpsi DPPH. Metode dalam penelitian ini dimulai dengan kalsinasi kaolin pada suhu 700 °C selama 6 jam. Kemudian hasil kalsinasi (metakaolin) direaksikan dengan basa NaOH 2 M dan dipanaskan pada suhu 40 °C selama 6 jam. Pemanasan dilanjutkan pada suhu 100 °C selama 24 jam. Zeolit sintetis yang diperoleh dicuci dengan aquades bebas ion sampai pH netral kemudian dikeringkan pada suhu 100 °C selama 24 jam . Zeolit yang diperoleh kemudian dipanaskan lagi pada suhu 300 °C dan ada yang dipilar dengan TiO2 dan Fe2O3. Pemilaran dilakukan dengan 2 cara yaitu secara fisik dan
hidrotermal. Zeolit sintesis dan kompositnya dikarakterisasi dengan metode difraksi sinar X (XRD), Scaning Electron Microscopy (SEM) dan Energy Dispersive X-Ray Spectroscopy ( EDS ). Hasil karakterisasi dengan XRD menunjukkan bahwa zeolit sintetis yang terbentuk adalah zeolit tipe A. Keberhasilan pemilaran diperlihatkan dengan adanya puncak baru pemilar pada zeolit sintetis saat dikarakterisasi dengan XRD.
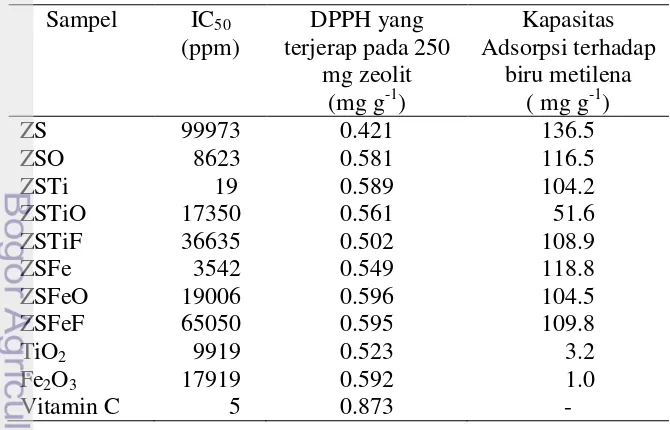
Analisis uji aktivitas antioksidan menggunakan spektrofotometer ultra violet– tampak dengan panjang gelombang 517.5nm sedangkan kapasitas adsorpsi diukur pada panjang gelombang 664.5nm. Aktivitas antioksidan diukur sebagai penurunan serapan larutan DPPH dan dinyatakan dalam IC50. Semakin rendah
IC50 maka aktivitas antioksidan zeolit semakin tinggi. Nilai IC50 terendah
diperlihatkan oleh ZSTi, yaitu sebesar 19ppm. Nilai IC50 ini masih 4 kali lebih
besar daripada vitamin C, namun jauh lebih rendah dibandingkan zeolit sintetis (99973 ppm) maupun zeolit sintetis yang dipilar dengan Fe2O3 (IC50 : 3542 ppm).
Nilai korelasi antar variabel (IC50 dan nilai adsorpsi terhadap DPPH)
diperoleh nilai korelasi Pearson sebesar – 0.531 dengan P value 0.093. Nilai korelasi Pearson yang diperoleh dalam penelitian ini sebesar – 0.531 menjauhi nilai – 1, sedangkan nilai P value yang diperoleh 0.093 lebih besar dari α = 0.05. Nilai korelasi antar variabel (IC50 dan nilai kapasitas adsorpsi biru metilena)
diperoleh nilai korelasi Pearson sebesar 0.239 dengan P value 0.569. Dengan demikian dapat disimpulkan tidak terdapat korelasi antar variabel IC50 dengan
nilai adsorpsi terhadap DPPH maupun terhadap kapasitas adsorpsi biru metilena.
DPPH. Supervised by SRI SUGIARTI and KOMAR SUTRIAH.
Degenerative diseases caused by the excess of free radicals in the body are the highest causes of death in the world. Free radicals in the body bring about premature aging by damaging the fatty tissue under the skin, decreasing skin firmness and causing wrinkled skin. One way to cope with the excess of free radicals is by adding natural antioxidants to pharmaceutical and food products. Zeolite is one material that has the potential as an antioxidant. Zeolite acts as an antioxidant by means of trapping free radicals in its structure so that free radicals become inactive and are safely removed from the body. Zeolit performance as an antioxidant can be improved by pillaring zeolite with metal oxides, for example TiO2 or Fe2O3.
The objective of this study was to synthesize zeolite from the kaolin of Bangka Belitung, which was then pillared with TiO2 and Fe2O3 and to observe the
correlation between antioxidant activity and DPPH adsorption. The method in this study began with kaolin calcination at a temperature of 700 °C for 6 hours. Then the result of calcination (metakaolin) was made to react with NaOH 2M and heated at 40 °C for 6 hours. The heating was continued at 100 °C for 24 hours. The synthetic zeolite obtained was washed with deionized aquades until the pH was neutral before being dried at 100 °C for 24 hours. The zeolites obtained were then heated again at 300 °C and there were some pillared by TiO2 and Fe2O3. The
pillar making was done in 2 ways: physically and hydrothermally. Synthetic zeolite and its composite were characterized by diffracted X-ray method (XRD), Scanning Electron Microscopy (SEM) and Energy Dispersive X-Ray Spectroscopy (EDS). The characterization result by XRD showed that the synthetic zeolite which was formed was zeolite of type A. The success of the pillar making was demonstrated by the presence of a new peak of a pillar maker on synthetic zeolit when characterized by XRD.
Analysis of the antioxidant activity test using UV spectrophotometer was indicated by a wave length of 517.5nm, while the adsorption capacity was measured at a wavelength of 664.5nm. The antioxidant activity was measured as a decrease in absorbance of DPPH solution and expressed in IC50. The lower the
IC50 is, the higher the zeolite antioxidant activity will be. The lowest IC50 value
was shown by ZSTi, that is, 19 ppm. This IC50 value is still 4 times greater than
vitamin C, but much lower than synthetic zeolite (99973ppm) and synthetic zeolite which were pillared with Fe2O3 (IC50:3542 ppm).
(monolayer).
Based on correlation value between the variables (IC50 and the adsorption
value on DPPH), the value of Pearson’s correlation obtained was -0.531 with a P value of 0.093. The value of Pearson’s correlation obtained in this research was -0.531 going farther than -1, while P value obtained was 0.093 higher than α = 0.05. Based on the correlation value between the variables (IC50 and the capacity of blue
methylene), the value of Pearson’s correlation obtained was 0.239 with a P value of 0.569. Therefore, it can be concluded that there was no correlation between variable IC50 and both adsorption value on DPPH and the capacity of blue
methylene.
Key words : DPPH, Fe2O3, Methylene Blue, Synthetic zeolite type A and TiO2.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
TERPILAR TITANIUM DIOKSIDA DAN BESI (III) OKSIDA DENGAN
ADSORPSI DPPH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
DPPH
Nama : Uning Rininingsih EM
NRP : G451110061
Disetujui oleh
Komisi Pembimbing
Sri Sugiarti, PhD Ketua
Dr. Komar Sutriah M.Si Anggota
Diketahui oleh
Ketua Program Studi Kimia
Prof Dr Dyah Iswantini Pradono, MSc Agr
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya
ilmiah yang berjudul “Korelasi Antara Aktivitas Antioksidan Zeolit Sintetis
Terpilar Titanium dioksida dan Besi(III) oksida Dengan Adsorpsi DPPH”. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Januari 2013 hingga Juli 2013 di Laboratorium Kimia AnOrganik, Departemen Kimia, Institut Pertanian Bogor, Pusat Studi Biofarmaka IPB, Laboratorium Kimia
Sekolah Tinggi Ilmu Farmasi“Yayasan Pharmasi” Semarang dan Balitbanghut
jalan Gunung Batu Bogor.
Penulis mengucapkan terima kasih atas semua bimbingan, dukungan, dan kerjasama yang telah diberikan oleh Sri Sugiarti,Ph.D dan Dr Komar Sutriah, MSi., seluruh staf laboratorium atas bantuan yang telah diberikan selama penulis melakukan penelitian di Laboratorium Kimia AnOrganik, Pusat Studi Biofarmaka
IPB, Sekolah Tinggi Ilmu Farmasi “Yayasan Pharmasi” Semarang dan
Balitbanghut jalan Gunung Batu Bogor, teman-teman (Dilla,Titi,Qadri,Lenita dll ). Di samping itu, penghargaan penulis sampaikan kepada BPPS . Ungkapan terima kasih juga disampaikan kepada suamiku Drs Ciptono, buah cintaku Mila dan Fachri, ibuku dan keluarga UREAAA atas segala doa, semangat, bantuan materi, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat. Terima kasih.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 3
Hipotesis Penelitian 3
2 BAHAN DAN METODE 3
Waktu dan Tempat Penelitian 3
Bahan dan Alat 3
Metode Penelitian 3
3 HASIL DAN PEMBAHASAN 5
Hasil Pencirian zeolit, zeolit Terpilar TiO2 serta zeolit terpilar Fe2O3 5
Karakter zeolit melalui pengamatan menggunakan X-Ray Difraktometer
(XRD) 7
Hasil Pengamatan SEM terhadap morfologi zeolit dan kompositnya 11 Kapasitas adsorpsi zeolit dan kompositnya terhadap biru metilena 14 Korelasi antara kapasitas adsorpsi zeolit dan kompositnya dengan
aktivitas antioksidan melalui pengamatan adsorpsi terhadap DPPH 14
4 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 20
DAFTAR PUSTAKA 20
LAMPIRAN 24
DAFTAR TABEL
1 Aktivitas antioksidan zeolit sintetis dengan DPPH dan kapasitas adsorpsi
zeolit sintetis terhadap biru metilena 15
2 Nilai koefisien korelasi dan koefisien determinasi adsorpsi biru metilena oleh zeolit, komposit zeolit sintetis, TiO2 dan Fe2O3 16
3 Kapasitas adsorpsi dan tetapan isoterm Langmuir adsorben 16
DAFTAR GAMBAR
4 Mikrograf SEM (a) kaolin (b) kaolin referensi (c) metakaolin (d) metakaolin
referensi 11
5 Mikrograf SEM (a) referensi zeolit tipe A (b) zeolit hasil sintesis dan (c)
zeolit hasil sintesis setelah dioksidasi 12
6 Mikrograf SEM (a) ZSTi (b) ZSTiO (c) ZSTiF 13
7 Mikrograf SEM (a) ZSFe (b) ZSFeO (c) ZSFeF 14
8 Penjebakan molekul DPPH oleh zeolit 15
9 Reaksi penangkapan radikal bebas DPPH 17
10 Struktur molekul (a) biru metilena (b) DPPH 17
5 Perhitungan kapasitas minimum (Q) 30
6 Grafik Kapasitas Adsorpsi Zeolit Sintetis danZeolit Sintetis Terpilar TiO2
dan Fe2O3 32
7 Penentuan polaisothermadsorpsi biru metilena (BM) 33
8 Uji statistik 34
PENDAHULUAN
Latar BelakangPenyakit degeneratif akibat berlebihnya radikal bebas di dalam tubuh merupakan slah satu penyebab kematian tertinggi di dunia (WHO 2010). Radikal bebas dalam tubuh dapat mengakibatkan penuaan dini dengan merusak jaringan lemak yang berada di bawah kulit, menghilangkan kekencangan kulit dan kulit menjadi keriput (Winarno 1992). Pada kondisi stres oksidatif, yaitu kondisi tidak seimbangnya antioksidan alami yang terkandung di dalam tubuh, menyebabkan manusia tidak dapat bergantung pada antioksidan alami yang sudah terkandung di dalam tubuhnya untuk mengatasi radikal bebas. Oleh karena itu dibutuhkan sumber lain untuk menanggulangi penyakit degeneratif ini.
Salah satu cara penanggulangan penyakit degeneratif adalah dengan menambahkan antioksidan alami pada produk farmasi dan bahan pangan (Campanella et al. 2004). Antioksidan alami mampu melindungi tubuh dari kerusakan yang disebabkan spesies oksigen reaktif dan menghambat terjadinya peroksidasi lipid, yaitu suatu rantai reaksi yang menghasilkan radikal lipid bebas
(R•) (Halliwel dan Gutteridge 1999). Antioksidan dapat meredam radikal bebas
dengan cara menyumbangkan satu atau lebih elektron kepada radikal bebas (Moon et al. 2009). Antioksidan dapat menangkap berbagai jenis oksigen yang secara biologis bersifat reaktif (O2-, H2O2, ·OH, dan ·HOCl), dengan mengubah
pembentukan molekul radikal bebas atau memperbaiki kerusakan yang ditimbulkannya (Wijaja et al. 2006).
Antioksidan topikal, baik yang berasal dari bahan alami maupun sintesis, telah banyak diteliti untuk melawan stres oksidatif yang disebabkan sinar UV (Endang et al. 2005). Penggunaan antioksidan secara topikal sangat penting untuk mengatasi kekurangan antioksidan pada jaringan kulit karena penggunaan secara
oral tidak cukup untuk meningkatkan konsentrasi α tokoferol pada kulit (Deny et
al. 2006). Vitamin C dapat diberikan secara oral dan topikal. Vitamin C topikal digunakan untuk mencegah kerusakan karena radiasi ultraviolet, terapi melasma, strie alba dan eritem postoperatif laser. Beberapa penelitian terhadap tikus memperlihatkan pemakaian vitamin C topikal dapat menurunkan sel sunburn, eritema dan fotokarsinogenesis.
Zeolit merupakan salah satu material yang potensial untuk dikembangkan sebagai antioksidan. Hal ini disebabkan oleh kelimpahan yang besar, kemudahannya diperoleh, dan harganya yang relatif murah. Zeolit alam sebagai antioksidan memang belum banyak dimanfaatkan, tetapi beberapa penelitian menunjukkan potensi penggunaan zeolit sebagai antioksidan. Zeolit tidak dapat menetralkan radikal bebas tetapi dapat menonaktifkan sifat radikal melalui penjerapan sehingga dapat dengan aman dihilangkan dari tubuh (Warren 2006).
fosfolipid, glikolipid, dan kolesterol yang terbentuk dari reaksi enzimatik atau non‐enzimatik yang melibatkan senyawa oksigen reaktif (ROS). ROS merupakan radikal bebas yang memberikan efek toksik pada makhluk hidup melalui perusakan jaringan (Halliwel dan Whiteman 2004). Turunnya LOOH mengindikasikan berkurangnya aktivitas ROS.
Pranoto (2012) menyatakan bahwa zeolit alam asal Banten, Sukabumi, Tasikmalaya, dan Lampung memiliki aktivitas menyerupai antioksidan karena mampu menyerap senyawa radikal lain, yaitu 1,1-difenil-2-pikrilhidrazil (DPPH), masing-masing sebesar 55,20%, 42,26%, 41,20% dan 31,95% dengan konsentrasi DPPH 125µM dan bobot zeolit 2g. Namun, aktivitas antioksidan ini semakin berkurang dengan meningkatnya suhu. Hal ini diduga pada suhu tinggi terjadi reduksi jumlah logam pengotor seperti oksida logam Fe yang dapat berperan sebagai reduktor dan meningkatkan aktivitas antioksidan zeolit alam (Pranoto 2012). Dengan kata lain, zeolit berfungsi menjerap DPPH sementara oksida besi berfungsi sebagai antioksidan .
Seperti yang telah disebutkan sebelumnya, aktivitas antioksidan zeolit bergantung pada pori-pori dan kandungan oksida logamnya. Zeolit alam diketahui memiliki pori yang tidak seragam, sehingga efek/fungsi penjerapannya sangat bergantung pada pengotor yang terdapat di pori-pori zeolit. Pengaruh keseragaman pori terhadap adsorpsi DPPH perlu dikaji lebih lanjut. Zeolit dengan pori yang seragam dapat diperoleh dengan cara menyintesis zeolit. Bahan baku yang biasanya digunakan untuk menyintesis zeolit adalah kaolin. Namun, kandungan oksida logam pada zeolit sintetik pada umumnya sangat sedikit. Kandungan tersebut dapat ditingkatkan melalui pemilaran zeolit menggunakan oksida logam.
Oksida logam yang banyak digunakan sebagai pemilar adalah TiO2 dan
Fe2O3. TiO2 bersifat semikonduktorfotokatalis, mudah didapatkan dipasaran, tidak
toksik, stabil pada suhu tinggi, dan dapat digunakan berulang kali tanpa kehilangan aktivitas katalitiknya (Fatimah et al. 2006). Oksida logam Fe2O3
memiliki kelebihan, di antaranya stabil pada suhu tinggi, tidak beracun, dan melimpah (Mohapatra 2010), serta memiliki energi celah yang besar yaitu 3,0-3,1eV sehingga dapat digunakan sebagai fotokatalis (Kunarti 2009). Oksida TiO2
dan Fe2O3 memiliki kemampuan mereduksi senyawa lain dengan melepaskan
elektron yang dimilikinya (Guilard 2008).
Penelitian ini telah menunjukkan keberhasilan sintesis zeolit dari bahan baku kaolin yang berasal dari Bangka Belitung dan pemilarannya menggunakan TiO2 dan Fe2O3. Kinerja zeolit hasil sintesis dalam penelitian ini sebagai
antioksidan dipelajari dengan membandingkan perubahan serapan larutan DPPH yang ditambahkan bahan tersebut. Metode DPPH memberikan informasi reaktivitas senyawa yang diuji dengan suatu radikal dan memberikan serapan kuat pada panjang gelombang 517nm dengan warna violet gelap (Kuncahyo & Sunardi 2007).
Tujuan Penelitian
Penelitian ini bertujuan menyintesis zeolit dan memilarnya dengan TiO2 dan
Manfaat Penelitian
Manfaat yang diharapkan sebagai luaran penelitian ini adalah pemanfaatan zeolit sintetik dan zeolit sintetik terpilar yang memiliki aktivitas antioksidan sehingga dapat diaplikasikan dalam bidang kosmetik dan kesehatan.
Hipotesis
Zeolit sintetik yang dipilar dengan TiO2 dan Fe2O3 mempunyai aktivitas
antioksidan dan terdapat perbedaan aktivitas antioksidan antara zeolit sintetik baik yang dipilar TiO2 atau Fe2O3 dan yang tidak.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Januari 2013 hingga Juli 2013 di Laboratorium Kimia Anorganik Departemen Kimia Institut Pertanian Bogor, Laboratorium Kimia Sekolah Tinggi Ilmu Farmasi ”Yayasan Pharmasi”
Semarang, Laboratorium Uji Biofarmaka IPB dan Balai Penelitian dan Pengembangan Kehutanan Jalan Gunung Batu, Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan ialah kaolin Bangka Belitung, TiO2, Fe2O3,
NaOH, vitamin C, 1,1-difenil-2-pikrilhidrazil (DPPH). Alat yang digunakan ialah alat-alat gelas, botol plastik hidrotemal, spektrofotometer UV-VIS 1700 merk Shimadzu, difraktometer sinar-X (XRD) merk Shimadzu (Cu sebagai atom target, panjang gelombang 1.5406Å , voltase 40kV , arus 30mA), dan mikroskop elektron payaran (SEM)-spektroskopi dispersif energi (EDS) merk Bruker.
Metode Penelitian
Penelitian ini dilakukan dengan tiga tahap penelitian, yaitu menyintesis zeolit dari bahan baku kaolin, memilarnya dengan TiO2 dan Fe2O3, dan menguji
kinerjanya sebagai antioksidan menggunakan metode DPPH serta uji kapasitas adsorpsi terhadap biru metilena. Diagram alir penelitian ini dapat dilihat pada Lampiran 1.
Sintesis zeolit (Hediana 2011).
6jam. Serbuk metakaolin yang terbentuk didinginkan. Metakaolin (M) hasil kalsinasi ditimbang sebanyak 10g, kemudian ditambahkan 200mL larutan NaOH 2M. Campuran dipanaskan pada suhu 40 C selama 6 jam. Pemanasan dilanjutkan pada suhu 100 C selama 24 jam. Zeolit sintetik yang diperoleh dicuci dengan akuades bebas ion sampai pH netral dan dikeringkan dengan oven pada suhu 100
C selama 24 jam (ZS). Setengah dari ZS yang diperoleh dipanaskan atau
dioksidasi pada 300 C selama 5 jam (ZSO).
Sintesis zeolit terpilar TiO2 dan Fe2O3 (Wijaya et al. 2006 dengan modifikasi).
Pemilaran zeolit dalam penelitian ini dilakukan dengan, yaitu pertama pemilaran dilakukan setelah sintesis zeolit (secara fisik) dan kedua pemilaran dilakukan bersamaan dengan sintesis zeolit (hidrotermal). Pemilaran secara fisik dilakukan dengan menambahkan 4g zeolit sintetik (ZS) dan TiO2 15% dari bobot
ZS kemudian dipanaskan pada 300 C selama 5 jam (ZSTiF). Pemilaran secara hidrotermal dilakukan dengan mencampurkan 4g metakaolin (M), 80mL NaOH 2M dan TiO2 15% dari bobot M. Campuran kemudian dipanaskan pada suhu 40
C selama 6 jam. Pemanasan dilanjutkan menggunakan oven pada suhu 100 C
selama 24 jam. Campuran kemudian dicuci dengan akuades bebas ion hingga mencapai pH netral, dikeringkan dengan oven pada suhu 100 C selama 24 jam (ZSTi), setengah dari hasil ZSTi yang diperoleh dioksidasi 300 C selama 5 jam (ZSTi O).
Pemilaran zeolit dengan Fe2O3 dilakukan dengan metode yang sama seperti
pada pemilaran dengan TiO2 sehingga menghasilkan zeolit sintesis terpilar Fe2O3
pencampuran secara fisik (ZSFeF) dan zeolit sintetik terpilar Fe2O3 (ZSFe) serta
zeolit sintetik terpilar Fe2O3 yang dioksidasi 300 C selama 5 jam (ZSFeO).
Uji Aktivitas Antioksidan dengan Metode DPPH (Aranda et al. 2009 dengan
modifikasi).
Sebanyak 50mg zeolit sintetik dimasukkan ke dalam tabung reaksi dan ditambahkan 5ml larutan DPPH 125µM. Campuran kemudian dikocok menggunakan vortex selama 5 menit kemudian disentrifugasi dengan kecepatan 4000rpm selama 10 menit. Filtratnya diinkubasi selama 30 menit pada suhu ruangan dan serapannya diukur pada 517nm. Blanko yang digunakan ialah metanol dan vitamin C sebagai kontrol positif. Kapasitas penghambatan radikal bebas dihitung berdasarkan persamaan :
A = Serapan kontrol negatif (DPPH ditambah metanol) B = Serapan sampel (DPPH ditambah metanol, zeolit)
Dilakukan uji yang sama terhadap kaolin, metakaolin, TiO2, Fe2O3, zeolit
yang terpilar dengan TiO2 maupun zeolit terpilar Fe2O3. Selanjutnya hasil
ke dalam persamaan regresi (Y=aX+b) dengan konsentrasi zeolit sintesis (% berat) sebagai absis (sumbu X) dan nilai persentase inhibisi sebagai ordinat (sumbu Y). Nilai IC50 diperoleh pada saat persentase inhibisi sebesar 50%.
Penentuan Kapasitas Adsorpsi ( Hediana 2011)
Sebanyak 50.0mg zeolit sintesis dan yang terpilar ditambahkan larutan biru metilena 100, 200, 300, 400 dan 500mg L-1 sebanyak 15 ml, kemudian dikocok menggunakan vortex selama 2 jam. Setelah itu larutan disentrifugasi dengan kecepatan 500rpm selama 20 menit. Konsentrasi supernatant ( biru metilena / Ct) ditentukan dengan spektrofotometer UV – tampak pada panjang gelombang maksimum ( λ maks). Penentuan λ maks dilakukan dengan mengukur serapan
larutan biru metilena pada rentang panjang gelombang 200 – 700nm. Larutan baku biru metilena dibuat dengan konsentrasi 2 , 3, 4, 5, dan 6 mg L-1. Kapasitas adsorpsi ditentukan dengan persamaan :
Hasil Pencirian Zeolit , Zeolit Terpilar TiO2 serta Zeolit Terpilar Fe2O3
Zeolit yang dibuat dalam penelitian ini berasal dari kaolin. Kaolin merupakan bahan yang banyak digunakan sebagai bahan baku pembuatan zeolit , karena kaolin mengandung SiO2 dan Al2O3 sebagai bahan dasar untuk
menyintesis zeolit (Barrer 1978). Hal ini karena struktur dan senyawa penyusun kaolin mirip dengan penyusun zeolit. Kaolin mempunyai struktur yang berupa lapisan 1 : 1, yaitu untuk setiap lembar terdiri atas satu lapisan tetrahedral oksida –
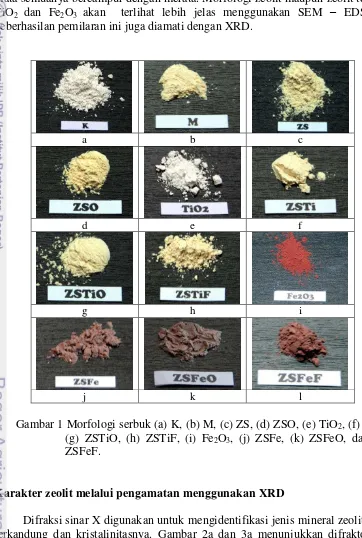
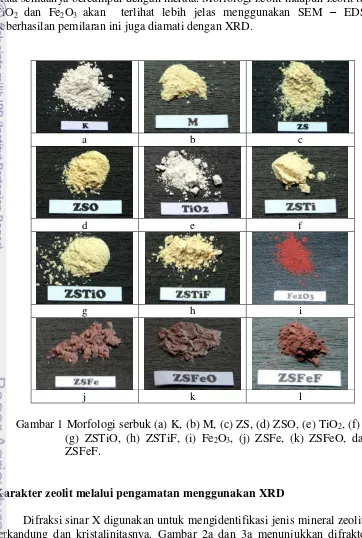
Si (lapisan silikat) dan satu lapisan oktahedral hidroksioksida – Al (lapisan aluminat). Selembar silika tetrahedral dikombinasi dengan hidroksil oktahedral yang dibagi dengan lembar alumina oktahedral (Murray 2000). Sementara zeolit memiliki struktur tetrahedral semua,oleh sebab itu diperlukan pemanasan agar struktur oktahedral aluminat kaolin dapat diubah menjadi struktur tetrahedral aluminat zeolit. Morfologi serbuk kaolin, metakaolin, zeolit sintetik dan zeolit sintetik terpilarisasi diperlihatkan pada Gambar 1.
pada suhu 700 C menjadi sedikit kecoklatan tetapi masih berbentuk serbuk kasar yang kemudian disebut metakaolin (Gambar 1b). Pemanasan 700 C bertujuan meruntuhkan struktur kristal kaolin yang ditandai dengan hilangnya gugus hidroksil yang terikat secara kimia.
Adapun reaksinya diperlihatkan pada Persamaan 1 (Hosseini et al. 2011).
(1)
Kaolin metakaolin
Persamaan 1 menunjukkan perubahan jumlah molekul oksigen dan hidrogen dari kaolin. Selama proses kalsinasi struktur kaolin terdegradasi dan dua molekul H2O akan terdehidroksilasi (Hosseini et al. 2011). Dehidroksilasi adalah
hilangnya molekul air yang terserap pada kisi-kisi kristal dari mineral kaolin membentuk metakaolin. Proses kalsinasi telah merubah molekul Al2O3 yang
berbentuk oktahedral pada kaolin membentuk ion AlO2- yang berbentuk
tetrahedral pada metakaolin.
Metakaolin selanjutnya direaksikan dengan NaOH 2M yang berfungsi sebagai pemberi suasana basa yang memengaruhi waktu nukleasi dengan mengubah fase metakaolin dari fase padat menjadi larutan. NaOH juga berfungsi sebagai donor kation yang berperan dalam mengarahkan dan menyeimbangkan muatan pada kerangka struktur zeolit (Georgiev et al. 2009). Larutan metakaolin dipanaskan pada suhu 40 C selama 6 jam untuk mempercepat proses pembentukan inti kristal zeolit. Pemanasan dilanjutkan pada suhu 100 C selama 24 jam untuk menyempurnakan pembentukan kristal zeolit.
Zeolit sintetik (ZS) yang diperoleh dicuci menggunakan air bebas ion hingga pH netral. Pencucian bertujuan menghilangkan material yang tidak menjadi bagian dari penyusun zeolit yang mungkin ada di permukaan dan larut dalam air bebas ion. ZS selanjutnya dikeringkan dalam oven pada suhu 100 C selama 24 jam dengan tujuan selain menguapkan air yang terperangkap dalam pori-pori kristal zeolit juga agar jumlah pori dan luas permukaan spesifiknya bertambah (Suardana 2008). ZS yang dihasilkan berupa kristal putih kekuningan (Gambar 1c). ZS yang diperoleh dipanaskan lagi pada suhu 300 C selama 5 jam dengan tujuan memperbaiki kristalinitas, meski secara fisik tidak terjadi perubahan warna yang mencolok (Gambar 1d) tetapi dari data difraktogram terjadi kenaikan kristalinitas.
Pemilaran menggunakan TiO2 (Gambar 1e) dilakukan melalui
penambahan TiO2 ke larutan awal metakaolin – NaOH menghasilkan zeolit
sintetik ZSTi (Gambar 1f) yang warnanya putih kekuningan dengan bentuk serbuk lebih halus . Kemudian ZSTi dioksidasi lagi dan diperoleh hasil ZSTiO berbentuk serbuk lebih kasar (Gambar 1g) dibandingkan serbuk ZSTi. Pemilaran TiO2
secara fisik dilakukan melalui penambahan TiO2 pada zeolit yang telah disintesis
menghasilkan campuran/komposit berupa serbuk berwarna kuning pucat (Gambar 1h) yang selanjutnya disebut ZSTiF.
Pemilaran ZS dengan Fe2O3 (Gambar 1i) dilakukan melalui penambahan
Fe2O3 ke larutan awal metakaolin – NaOH menghasilkan serbuk berwarna merah
ZSFeO (Gambar 1k). Pemilaran secara fisik antara ZS dengan Fe2O3
menghasilkan serbuk ZSFeF (Gambar 1l) yang berwarna merah coklat pekat dibandingkan dengan ZSFe.
Serbuk TiO2 berwarna putih dan Fe2O3 berwarna merah bata , apabila
kedua bahan ini dicampurkan dengan zeolit sintetik baik secara fisik maupun saat proses sintesis zeolit maka warnanya akan saling mempengaruhi. Proses sintesis zeolit dengan pilarisasi TiO2 dan Fe2O3 yang dilakukan secara fisik maupun saat
proses sintesis memengaruhi warna zeolit yang dihasilkan, namun secara kasat mata semuanya bercampur dengan merata. Morfologi zeolit maupun zeolit terpilar TiO2 dan Fe2O3 akan terlihat lebih jelas menggunakan SEM – EDS dan
keberhasilan pemilaran ini juga diamati dengan XRD.
a b c
d e f
g h i
j k l
Gambar 1 Morfologi serbuk (a) K, (b) M, (c) ZS, (d) ZSO, (e) TiO2, (f) ZSTi,
(g) ZSTiO, (h) ZSTiF, (i) Fe2O3, (j) ZSFe, (k) ZSFeO, dan (l)
ZSFeF.
Karakter zeolit melalui pengamatan menggunakan XRD
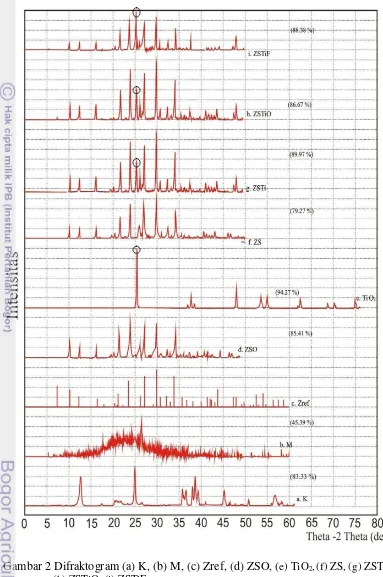
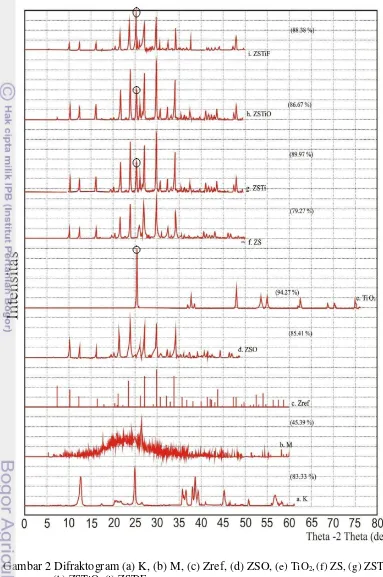
kaolin, sedangkan Gambar 2b dan 3b memperlihatkan difraktogram metakaolin. Perbandingan kedua difraktogram ini memperlihatkan adanya perbedaan puncak antara kaolin dan metakaolin, yang berarti bahwa telah terjadi perubahan struktur pada kaolin, yaitu lepasnya gugus hidroksil. Perubahan ini menghasilkan metakaolin dengan struktur yang lebih amorf dibandingkan kaolin, diindikasikan oleh kristalinitas metakaolin (45.39%), dan kaolin (83.33%).
Gambar 2c dan 3c memperlihatkan difraktogram zeolit sintetik referensi Joint Committee on Powder Difraction Standards (JCPDS ) nomor 39 – 0222, sedangkan difraktogram zeolit sintetik hasil penelitian ditunjukkan pada Gambar 2f dan 3e. ZS hasil penelitian memiliki puncak pada sudut 2θ=10.19°, 12.47°, 16.10°, 21.64°, 23.95°, 26.07°, 27.08°, 29.90°, 32.49°, dan 34.14° dengan kristalinitas sebesar 79.27%. Berdasarkan JCPDS nomor 39–0222 puncak khas zeolit referensi tersebut sebagai zeolit tipe A mempunyai sudut 2θ sebesar 10.17°, 12.46° , 16.11°, 21.36° , 23.99°, 26.11°, 27.11°, 29.94°, 32.54°, dan 34.18°.
Berdasarkan perbandingan pola difraktogram antara ZS hasil penelitian dengan referensi disimpulkan bahwa zeolit hasil penelitian merupakan zeolit sintetik tipe A. Hasil pemanasan tidak menunjukkan perubahan yang signifikan pada nilai 2θ yaitu berturut-turut 10.24°, 12.52°, 16.16°, 21.72°, 24.03°, 26.18°, 27.16°, 29.99°, 32.59°, dan 34.24°. Bagaimanapun, pemanasan menghasilkan zeolit dengan kristalinitas yang lebih baik, ditunjukkan oleh meningkatnya kristalinitas dari 79.27% menjadi 85.41% (Gambar 2d). Kenaikan kristalinitas ini disebabkan oleh terjadinya penyusunan ulang kristal seiring kenaikan suhu.
Gambar 2e memperlihatkan difraktogram TiO2 (anatase) dengan tiga
puncak yang kuat pada sudut difraksi (2θ) yaitu 25.32° (d=3.51440Ȧ), 48.06° (d=1.89158Ȧ), dan 37.80° (d=2.37805Ȧ), sedangkan Gambar 2g sampai 2i memperlihatkan pola difraktogram ZS setelah dipilar menggunakan TiO2. ZS
yang dipilar TiO2 bersamaan saat sintesis zeolit (ZSTi) yang diperlihatkan pada
Gambar 2g menunjukkan puncak 2θ pada 25.29°, puncak ini merupakan puncak dari TiO2 yang berhasil disisipkan. Selain itu terjadi peningkatan kristalinitas dari
79.27% menjadi 89.97%, hasil ini sedikit berbeda ketika ZSTi dioksidasi (Gambar 2h). Setelah dioksidasi, terjadi perbedaan puncak 2θ pada ZSTi dari 25.29° menjadi 29.95° dan penurunan kristalinitas dari 89.97% menjadi 86.67%. Turunnya kristalinitas dan berubahnya 2θ setelah dioksidasi menunjukkan bahwa
proses oksidasi mengakibatkan interaksi fisik antara ZS dengan TiO2 menjadi
lebih lemah. Namun, hasil yang cenderung sama diperlihatkan pada pemilaran TiO2 yang dilakukan secara fisik (ZSTiF) dengan terlihat puncak 2θ yang tidak
jauh berbeda, yaitu pada 25.31° (d=3.51592 A˚) dan kristalinitas sebesar 88.37% (Gambar 2i).
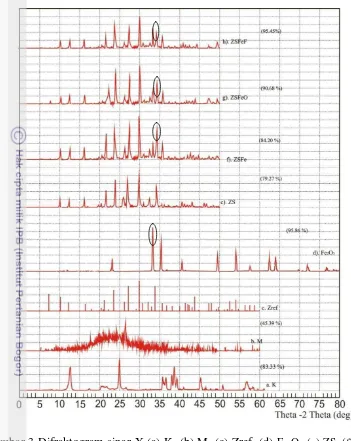
Difraktogram Fe2O3 (hematit) memperlihatkan puncak 2θ pada 33.18°
(d=2.69725Ȧ), 35.66° (d=2.51563Ȧ), dan 54.10° (d=1.69379Ȧ) (Gambar 3d).
Gambar 3f menunjukkan difraktogram zeolit yang dipilar dengan Fe2O3
bersamaan saat sintesis dengan sudut 2θ pada 30.01° dengan kristalinitas 90.68%. Ketika ZSFe dioksidasi, terjadi sedikit perubahan pada sudut sudut 2θ, yaitu dari
30.01° menjadi 29.94° dan naiknya kristalinitas dari 90.68% menjadi 95.45% (Gambar 3g). Gambar 3hmenunjukkan difraktogram zeolit ketika dipilar dengan Fe2O3 secara fisik (ZSFeF) dengan sudut 2θ pada 29.93° dengan kristalinitas
ZS tidak mengandung unsur Fe. Sementara, setelah dipilar terdapat unsur Fe sebesar 2.31%. Artinya, ZS telah berhasil dipilar dengan Fe.
Gambar 2 Difraktogram (a) K, (b) M, (c) Zref, (d) ZSO, (e) TiO2,(f) ZS, (g) ZSTi,
Gambar 3 Difraktogram sinar-X (a) K, (b) M, (c) Zref, (d) Fe2O3,(e) ZS, (f) ZSFe,
(g) ZSFeO, (h) ZSFeF.
Apabila TiO2 dan Fe2O3 memiliki aktivitas antioksidan maka proses
pilarisasi TiO2 dan Fe2O3 ke dalam zeolit sintesis akan meningkatkan aktivitas
antioksidannya, namun hal ini bergantung pada seberapa banyak TiO2 dan Fe2O3
yang terpilar pada zeolit sintesis dan bagaimana cara pilarisasinya. Proses pilarisasi TiO2 dan Fe2O3 ke dalam zeolit melalui pemilaran fisik hanya akan
menghomogenkan campuran dan tidak dapat memaksimalkan penyisipan antara TiO2 dan Fe2O3 dengan zeolit sintetik, namun hal ini dapat dilakukan dengan cara
pemilaran secara hidrotermal, karena TiO2 dan Fe2O3 dapat bergerak secara
Hasil Pengamatan SEM terhadap morfologi zeolit dan kompositnya
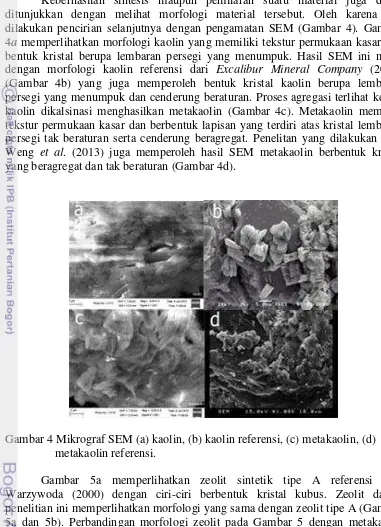
Keberhasilan sintesis maupun pemilaran suatu material juga dapat ditunjukkan dengan melihat morfologi material tersebut. Oleh karena itu, dilakukan pencirian selanjutnya dengan pengamatan SEM (Gambar 4). Gambar 4a memperlihatkan morfologi kaolin yang memiliki tekstur permukaan kasar dan bentuk kristal berupa lembaran persegi yang menumpuk. Hasil SEM ini mirip dengan morfologi kaolin referensi dari Excalibur Mineral Company (2010) (Gambar 4b) yang juga memperoleh bentuk kristal kaolin berupa lembaran persegi yang menumpuk dan cenderung beraturan. Proses agregasi terlihat ketika kaolin dikalsinasi menghasilkan metakaolin (Gambar 4c). Metakaolin memiliki tekstur permukaan kasar dan berbentuk lapisan yang terdiri atas kristal lembaran persegi tak beraturan serta cenderung beragregat. Penelitan yang dilakukan oleh Weng et al. (2013) juga memperoleh hasil SEM metakaolin berbentuk kristal yang beragregat dan tak beraturan (Gambar 4d).
Gambar 4 Mikrograf SEM (a) kaolin, (b) kaolin referensi, (c) metakaolin, (d) metakaolin referensi.
cenderung tidak jauh berbeda. Artinya, zeolit sintetik tahan terhadap pemanasan atau dengan kata lain pemanasan tidak merubah struktur zeolit.
Gambar 5 Mikrograf SEM (a) referensi zeolit tipe A (b) Zeolit hasil sintesis dan (c) Zeolit hasil sintesis setelah dioksidasi.
Gambar 6a, 6b, dan 6cmenunjukkan mikrograf SEM hasil pilarisasi TiO2 ke
dalam ZS. Dari ketiga gambar tersebut terlihat TiO2 paling sedikit menempel di
permukaan ZS ketika dipilar secara hidrotermal (Gambar 6a). Hal ini terjadi karena TiO2 ikut masuk ke dalam kerangka struktur zeolit sehingga hanya sedikit
TiO2 yang terlihat di permukaan zeolit. Meskipun TiO2 terlihat sedikit menempel
di permukaan, namun jumlah titanium berdasarkan data EDS pada ZSTi paling besar dibandingkan zeolit sintesis yang dipilar dengan TiO2 secara fisik.
Sementara zeolit sintetik yang dipilar dengan TiO2 setelah dioksidasi
memperlihatkan lebih banyak TiO2 menempel di permukaan zeolit dibandingkan
sebelum ZSTi dioksidasi (Gambar 6b). Hal ini disebabkan oleh efek pemanasan mengakibatkan TiO2 keluar dari kerangka struktur zeolit dan diduga TiO2 bereaksi
dengan NaOH menjadi titanat seperti yang diperlihatkan pada Persamaan 2 (Qin et al. 2000).
(2) Titanium titanat
Data EDS menunjukkan jumlah titanium dalam ZSTi setelah dioksidasi menurun menjadi 0.40%. Oksidasi dilakukan pada suhu 300 ºC selama 5 jam, suhu ini belum cukup untuk menguapkan TiO2 yang memiliki titik didih 1825 ºC.
Dengan demikian, penurunan jumlah titanium disebabkan oleh adanya titanium yang bertransformasi menjadi titanat. Titanat yang terbentuk ini diduga menempel di permukaan (tidak berada dalam kerangka struktur zeolit), sedangkan TiO2 yang
dipilar secara fisik (Gambar 6c) menunjukkan paling banyak TiO2 terlihat
menempel di permukaan zeolit. Artinya, TiO2 yang dipilar secara fisik
berinteraksi dengan zeolit hanya di permukaan, diduga hanya sedikit sekali yang masuk ke dalam kerangka struktur zeolit. Data EDS menunjukkan titanium yang terdapat pada zeolit sintesis yang dipilar TiO2 secara fisik sebesar 0.41%. Analisis
data EDS menunjukkan bahwa pemilaran TiO2 ke dalam zeolit secara hidrotermal
lebih efektif dibandingkan dengan pemilaran secara fisik.
Gambar 6 Mikrograf SEM (a) ZSTi, (b) ZSTiO, (c) ZSTiF.
Keterangan: bagian yang dilingkari menunjukkan TiO2
Gambar 7a, 7b dan 7cmenunjukkan mikrograf SEM hasil pilarisasi Fe2O3
ke dalam ZS. Mikrograf SEM hasil pemilaran zeolit sintetik dengan Fe2O3
cenderung mirip dengan hasil mikrograf SEM zeolit sintetik yang dipilar dengan TiO2. Zeolit sintetik yang dipilar dengan Fe2O3 secara hidrotermal
memperlihatkan hanya sedikit Fe2O3 yang menempel di permukaan zeolit
(Gambar 7a). Setelah zeolit sintetik yang telah dipilar Fe2O3 dioksidasi, Fe2O3
terlihat lebih banyak menempel (Gambar 7b). Hal ini terjadi sebelum dioksidasi, Fe2O3 ikut masuk ke dalam kerangka struktur zeolit (hanya sedikit yang
menempel di luar), sementara setelah dioksidasi Fe2O3 keluar dari kerangka
struktur zeolit dan diduga bereaksi dengan NaOH membentuk senyawa NaHFe3O4
sesuai Persamaan 3.
(3)
Sama seperti pada pemilaran dengan TiO2, oksidasi dilakukan pada suhu
300 ºC selama 5 jam. Suhu ini belum cukup untuk menguapkan Fe2O3 yang
memiliki titik didih 1538 ºC. Hal ini didukung dari data EDS, yaitu ZSFe sebelum dioksidasi memiliki jumlah Fe sebesar 4.26%, sedangkan setelah dioksidasi jumlahnya menurun menjadi 1.68%. Penurunan jumlah Fe2O3dapat terjadi karena
diduga Fe2O3 bertransformasi menjadi NaHFe3O4. Senyawa ini diduga menempel
di permukaan zeolit sintetik. Sementara zeolit sintetik yang dipilar dengan Fe2O3
secara fisik (Gambar 7c) menunjukkan paling banyak Fe2O3 terlihat menempel di
permukaan zeolit. Data EDS zeolit sintetik yang dipilar Fe2O3 secara fisik
memperlihatkan jumlah Fe sebesar 2.31%. Artinya, meskipun terlihat banyak menempel di permukaan zeolit, namun jumlah Fe yang terkandung dalam zeolit sintetik yang dipilar dengan Fe2O3 lebih sedikit dibandingkan jumlah Fe yang
terkandung pada zeolit sintetik yang dipilar dengan Fe2O3 secara hidrotermal.
Dengan demikian, pemilaran zeolit secara hidrotermal baik dengan TiO2 maupun
dengan Fe2O3 lebih efektif dibandingkan pemilaran zeolit secara fisik.
Pilarisasi dengan TiO2 maupun Fe2O3, baik secara fisik maupun
hidrotermal dan hidrotermal dilanjutkan dengan pemanasan tidak mengubah bentuk kristal dari zeolit sintetik. Bentuk kristal zeolit masih berbentuk kubus dengan perbandingan Si/Al mendekati 1. Dengan demikian, penambahan TiO2
atau Fe2O3 maupun pemanasan saat sintesis zeolit tidak mengganggu proses
pembentukan inti kristal.
c
Gambar 7 Mikrograf SEM (a) ZSFe (b) ZSFeO (c) ZSFeF
Keterangan: bagian yang dilingkari menunjukkan Fe2O3
Kapasitas adsorpsi Zeolit dan kompositnya terhadap biru metilena
Kapasitas adsorpsi pada penelitian ini ditentukan dengan mengukur banyaknya biru metilena yang dapat dijerap zeolit yang hasilnya diperlihatkan pada Tabel 1. Penentuan kapasitas penjerapan menggunakan variasi konsentrasi biru metilena 100, 200, 300, 400, dan 500ppm. Pengukuran dilakukan pada panjang gelombang serapan maksimum 664.5nm menggunakan spektrofotometer. Panjang gelombang maksimum yang diperoleh pada penelitian ini mirip dengan yang diperoleh Mouzdahir et al. (2007), yaitu 663nm.
Kapasitas adsorpsi(Xm) menggambarkan jumlah adsorbat (biru metilena) yang dapat diserap oleh adsorben pada saat kesetimbangan. Sedangkan tetapan isoterm Langmuir (KL) adalah kekuatan ikatan molekul adsorbat pada permukaan
adsorben. Nilai Xm dan KL tertinggi diperlihatkan oleh zeolit sintetik yang
dioksidasi (ZSO), sementara zeolit sintetik terpilar TiO2 secara fisik memiliki nilai
Xm terendah dan zeolit sintetik terpilar Fe2O3 secara fisik memiliki nilai KL
terendah (Tabel 2). Umumnya nilai KL dan Xm berbanding lurus, semakin tinggi
nilai KL, maka nilai Xm juga semakin tinggi. Namun, pada penelitian ini nilai KL
dan Xm tidak memiliki kecenderungan berbanding lurus. Hal ini terlihat dari nilai
koefisien determinasi atau linearitas adsorben pada persamaan Langmuir yang tidak sama sehingga prediksi nilai KL dan Xm berbeda keakuratannya.
Korelasi antara kapasitas adsorpsi zeolit dan kompositnya dengan aktivitas antioksidan melalui pengamatan adsorpsi terhadap DPPH
Pengukuran aktivitas antioksidan biasanya dilakukan dengan beberapa metode di antaranya uji kapasitas antioksidan reduksi kuprat (CUPRAC), uji kekuatan antioksidan mereduksi ferat (FRAP), dan metode DPPH. Metode CUPRAC (Apak et al.2007) menggunakan bis(neokuproin) tembaga(II) (Cu(Nc)22+) sebagai pereaksi kromogenik. Pereaksi (Cu(Nc)22+) yang berwarna
biru akan mengalami reduksi menjadi Cu(Nc)2+ yang berwarna kuning dengan reaksi sebagai berikut:
n Cu(Nc)22+ + Ag(OH)n nCu(Nc)2+ + Ag(=O)n + n H+
Metode FRAP (Benzie dan Strain 1996) menggunakan Fe(TPTZ)23+
kompleks besi ligan 2,4.6-tripiridil-triazin sebagai pereaksi. Kompleks biru Fe(TPTZ)23+ akan berfungsi sebagai zat pengoksidasi dan akan mengalami
reduksi menjadi Fe(TPTZ)23+ yang berwarna kuning dengan reaksi berikut :
Fe(TPTZ)23+ + AgOH Fe(TPTZ)23+ + H+ + Ag=O
Pada penelitian ini uji aktivitas antioksidan zeolit menggunakan metode DPPH (Molyneux 2004). Metode DPPH menggunakan 2,2-difenil-1- pikrilhidrazil sebagai sumber radikal bebas. Anonim (2006) melaporkan mekanisme zeolit sebagai antioksidan dengan cara menjebak molekul DPPH ke dalam pori-pori zeolit seperti yang diperlihatkan pada Gambar 8.
Gambar 8 Penjebakan molekul DPPH oleh zeolit (sumber: Anonim 2006)
Keterangan : warna kuning menunjukkan struktur zeolit, sedangkan warna hijau menunjukkan molekul DPPH
Tabel 2 Nilai koefisien korelasi dan koefisien determinasi adsorpsi biru metilena oleh zeolit sintetik, komposit zeolit sintetik, TiO2 dan Fe2O3
Mineral Isoterm Adsorpsi Langmuir Isoterm Adsorpsi Freundlich
R R2 R R2
Tabel 3 Kapasitas adsorpsi terhadap biru metilena dan tetapan isoterm Langmuir adsorben.
Penangkapan radikal DPPH merupakan salah satu metode uji untuk menentukan aktivitas antioksidan. Metode DPPH dipilih karena sederhana, mudah, cepat dan hanya memerlukan sedikit sampel. Mekanisme penangkapan radikal DPPH oleh antioksidan cukup sederhana dengan memberikan proton kepada radikal, sehingga senyawa-senyawa yang memungkinkan untuk mendonasikan protonnya memiliki aktivitas penangkapan radikal cukup kuat. Donasi proton menyebabkan radikal DPPH (berwarna ungu) menjadi senyawa tidak radikal, maka aktivitas penangkapan radikal dapat dihitung dari peluruhan radikal DPPH. Kadar radikal DPPH tersisa diukur secara spektrofotometri pada panjang gelombang 517nm (Blois 1958). Reaksi penangkapan DPPH oleh antioksidan diperlihatkan pada Gambar 9.
menjebak/menangkap DPPH ke dalam kerangka strukturnya. Setelah terjebak dalam kerangka struktur zeolit, DPPH menjadi tidak aktif sebagai radikal bebas nantinya dapat dengan aman dihilangkan dari tubuh (Anonim 2006 ).
Gambar 9 Reaksi penangkapan radikal bebas DPPH
Aktivitas antioksidan diukur sebagai penurunan serapan larutan DPPH akibat penambahan sampel zeolit yang diukur absorbansinya dan ditentukan IC50
menggunakan spektrofotometer pada panjang gelombang 517.5nm yang hasilnya diperlihatkan pada Tabel 1. Nilai IC50 merupakan konsentrasi suatu senyawa yang
diperlukan untuk menghambat aktivitas radikal DPPH sebesar 50% (IUPAC 1997). Semakin rendah IC50 maka aktivitas antioksidan semakin tinggi.
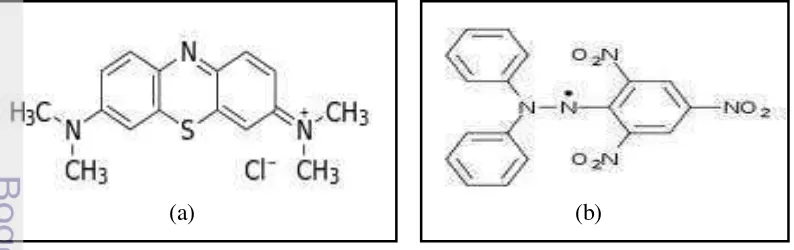
Sedangkan, kapasitas adsorpsi merupakan jumlah maksimum adsorben yang dapat menjerap adsorbat. Semakin tinggi kapasitas adsorpsi diduga aktivitas antioksidan semakin tinggi. Meskipun pada penentuan kapasitas adsorpsi menggunakan biru metilena, dan penetapan kapasitas adsorpsi zeolit dan kompositnya tidak dilakukan terhadap DPPH, tetapi kedua senyawa DPPH dan biru metilena memiliki struktur yang relatif sama besar (Gambar 10), maka kapasitas adsorpsi terhadap biru metilena dapat digunakan untuk menganalisis adsorpsi DPPH.
(a) (b)
Gambar 10 Struktur molekul (a) biru metilena (b) DPPH
Tabel 1 memperlihatkan bahwa terjadi penurunan nilai IC50 ZS, ketika ZS
dioksidasi maupun dipilar dengan TiO2 dan Fe2O3. Penurunan nilai IC50 ini
mengindikasikan terjadi kenaikan aktivitas antioksidan pada ZS dengan perlakuan pemanasan maupun pilarisasi. ZS yang dipilar dengan TiO2 memiliki aktivitas
Fe2O3. Hal ini dapat terjadi karena TiO2 memiliki aktivitas antioksidan yang lebih
tinggi daripada Fe2O3 yang ditunjukkan dari nilai IC50 TiO2 (9919ppm) yang lebih
rendah dibandingkan Fe2O3 (17919ppm). Sehingga kontribusi TiO2 dalam
meningkatkan aktivitas antioksidan zeolit lebih besar dibandingkan Fe2O3.
Aktivitas antioksidan tertinggi diperlihatkan oleh ZSTi yaitu sebesar 19ppm. Jika dibandingkan dengan nilai IC50 vitamin C, yaitu sebesar 5ppm , nilai IC50 ZSTi
masih jauh lebih besar. Artinya, aktivitas antioksidan ZSTi belum seefektif vitamin C. Penelitian yang dilakukan oleh Jati (2013) juga menunjukkan terjadi peningkatan aktivitas antioksidan zeolit alam sebesar 14.8% setelah zeolit alam dipilar dengan TiO2.
Kapasitas adsorpsi zeolit dan nanokomposit terhadap biru metilena berada di kisaran 105mg g-1 dengan nilai yang cenderung tidak berfluktuasi, nilai tertinggi ditunjukkan oleh ZS, dan terendah oleh ZSTiO. Namun bila dibandingkan dengan nilai IC50 zeolit dan nanokomposit terhadap DPPH terlihat
bahwa nilai IC50 sangat dipengaruhi oleh oksida logam yang digunakan sebagai
pemilar dan proses pemilaran. Pencampuran zeolit dengan TiO2 atau Fe2O3 secara
fisik meningkatkan nilai IC50 yang tinggi, dan nilai ini dapat dikorelasikan sebagai
rendahnya kapasitas adsorpsi campuran zeolit terhadap DPPH. Proses pilarisasi secara hidrotermal memberikan hasil yang sangat baik terhadap nilai IC50, yaitu
dihasilkan nilai IC50 terendah dibandingkan seluruh perlakuan. Nilai IC50 ZSTi
adalah 19ppm dan ini hanya 4 kali lipat lebih besar dari nilai IC50 vitamin C.
Artinya ZSTi memiliki kemampuan menyerap DPPH dalam jumlah besar, dan nilai ini dapat dikorelasikan dengan tingginya aktivitas antioksidan ZSTi. Proses pemilaran secara umum meningkatkan nilai IC50, dan bila nilai ini diartikan
sebagai adsorpsi DPPH, maka dapat disimpulkan bahwa proses pemilaran meningkatkan kapasitas adsorpsi zeolit / nanokomposit terhadap DPPH.
Pemanasan zeolit terpilar TiO2 atau Fe2O3 yang disintesis melalui metode
hidrotermal menghasilkan nilai IC50 yang lebih rendah dari ZS. Artinya daya
adsorpsi komposit ini tinggi terhadap DPPH. Hal ini dapat diakibatkan oleh penyusunan ulang pada zeolit yang terpilar bila dipanaskan pada suhu tinggi. Penyusunan ulang ini kemungkinan besar menghasilkan ukuran pori yang lebih kecil, sehingga nilai kapasitas adsorpsi terhadap biru metilena maupun DPPH yang berukuran relatif besar menjadi turun. Tabel 1 menunjukkan korelasi antara turunnya kapasitas adsorpsi ZSTiO dan ZS terhadap biru metilena dan turunnya nilai IC50 kedua komposit tersebut terhadap DPPH.
Rendahnya nilai IC50 untuk ZSTi memberikan indikasi bahwa ZSTi tidak
hanya menjerap DPPH namun juga melakukan reaksi antioksidan. Secara umum terlihat bahwa pemilaran zeolit dengan TiO2 atau Fe2O3 menurunkan kapasitas
adsorpsi terhadap biru metilena, hal ini diduga karena zeolit pemilar mengisi sebagian rongga zeolit yang seharusnya dipakai untuk proses adsorpsi. Namun hal ini tidak terlihat pada adsorpsi DPPH. Pemilaran tidak menurunkan daya adsorpsi zeolit terhadap DPPH, bahkan dapat dikatakan bahwa daya adsorpsinya meningkat sampai hampir 5000 kali lipat (Tabel 1). Tentunya peningkatan daya adsorpsi ini tidak dapat hanya disimpulkan sebagai adsorpsi sederhana. Dapat diduga bahwa ZSTi juga memiliki mekanisme pemadaman radikal, meskipun mekanismenya masih belum dapat diamati secara detail.
bahwa terbentuk senyawa lain dari oksida logam yang lebih reaktif seperti NaHTiO3 atau Na2TiO3 atau terbentuk oksida logam dengan bilangan oksidasi
lebih kecil misalnya TiO atau FeO. TiO2 dapat bereaksi dengan NaOH
membentuk NaHTiO3 dan diduga senyawa ini dapat menyumbangkan hidrogen
pada DPPH sehingga radikal DPPH ternetralkan. Sementara radikal pada NaTiO3
dapat distabilkan oleh resonansi pada struktur ikatan rangkap dan tunggal pada TiO3-.
Suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai nilai IC50 kurang dari 50ppm, sedang jika bernilai 101-150ppm dan lemah jika nilai
IC50 bernilai 151-200ppm. Jika memiliki nilai IC50 lebih besar dari 200ppm
dianggap tidak bersifat antioksidatif (Zuhra et al. 2008). Oleh karena itu, zeolit sintetik terpilar TiO2 memperlihatkan potensi yang baik sebagai antioksidan,
sementara zeolit lainnya dalam penelitian ini tidak.
Nilai korelasi antar variabel (IC50 dan nilai adsorpsi terhadap DPPH)
dihitung menggunakan bantuan perangkat lunak minitab 14 dan diperoleh nilai korelasi Pearson sebesar – 0.531 dengan P value 0.093. Nilai korelasi Pearson berada pada kisaran - 1 sampai +1, dengan nilai – 1 menunjukkan antara variabel berkorelasi negative, 0 yang artinya antar variabel tidak berkorelasi dan + 1 yang artinya antar variabel berkorelasi positif. Nilai korelasi Pearson saja tidak cukup untuk menentukan korelasi, oleh karena itu nilai P value yang diperoleh juga diperhitungkan. Nilai korelasi Pearson yang diperoleh dalam penelitian ini sebesar
– 0.531 menjauhi nilai – 1, sedangkan nilai P value yang diperoleh 0.093 lebih
besar dari α = 0.05. Nilai korelasi antar variabel (IC50 dan nilai kapasitas adsorpsi
biru metilena) diperoleh nilai korelasi Pearson sebesar 0.239 dengan P value 0.569
lebih besar dari α = 0.05 artinya Ho diterima maka tidak terdapat korelasi antara
IC50 dan kapasitas adsorpsi biru metilena. Dengan demikian dapat diartikan tidak
terdapat korelasi antar variabel IC50 dengan nilai adsorpsi terhadap DPPH maupun
terhadap kapasitas adsorpsi biru metilena.
SIMPULAN DAN SARAN
SimpulanHasil karakterisasi dengan XRD menunjukkan bahwa zeolit sintetik yang terbentuk adalah zeolit tipe A. Berdasarkan pengukuran aktivitas antioksidan menggunakan DPPH, disimpulkan bahwa zeolit A tidak memiliki aktivitas antioksidan. Pilarisasi besi oksida dan titanium dioksida ke dalam zeolit sintetik mampu meningkatkan aktivitas antioksidannya dengan peningkatan tertinggi dicapai oleh zeolit sintesis terpilar TiO2. Karakteristik adsorpsi produk-produk
zeolit terhadap biru metilena mengikuti pola isoterm adsorpsi Langmuir. Nilai korelasi Pearson antarvariabel (IC50 dan nilai adsorpsi terhadap DPPH dari semua
produk zeolit) dalam penelitian ini sebesar – 0.531 menjauhi nilai –1, sedangkan nilai P value yang diperoleh 0.093 lebih besar dari α = 0.05. Nilai korelasi antarvariabel (IC50 dan nilai kapasitas adsorpsi biru metilena) diperoleh nilai
korelasi Pearson sebesar 0.239 dengan P value 0.569, sehingga dapat disimpulkan tidak terdapat korelasi antarvariabel IC50 dengan nilai adsorpsi terhadap DPPH
zeolite terpilar TiO2 memiliki aktivitas antioksidan yang bukan diakibatkan oleh
mekanisme adsorpsi.
Saran
Perlu dilakukan penelitian lanjutan untuk mempelajari mekanisme kerja zeolit terpilar TiO2 sebagai antioksidan dengan melakukan TEM dan FTIR pada
zeolit terpilar TiO2 yang telah bereaksi dengan DPPH dan perlu dilakukan
penelitian untuk menguji aktivitas antioksidan zeolit menggunakan uji aktivitas antioksidan yang berbeda.
DAFTAR PUSTAKA
Anonim. Information about toxins and liquid zeolits (clinoptilolite). 2006. [Internet]. [diunduh 2 September 2013]. Tersedia pada: http://www.rebprotocol.net/august2007/Q%20&%20A%20INFORMATIO N%20ABOUT%20TOXINS%20AND%20LIQUID%20ZEOLITS%2021pp .pdf
Apak R. 2007. Comparative evaluation of various total antioxidant capacity applied to phenolic compounds with the CUPRAC assay. Mol. 12:1496-1547
Aranda RS, Lopez LAP, Arroyo JL, Garza BAA, Torres NW. 2009. Antimicrobial and antioxidant activities of plants from Northeast of Mexico. Evidence-Based Complementary and Alternative Medicine. 2011: 1-6. Bareer RM. 1978. Zeolit and Clay Mineral, Sorbents and Molecular Sieves.
London (UK): Academic Pr.
Benzie IFF, Strain JJ. 1996. The ferric reducing ability of plasma (FRAP) as a measurement of antioxidant power: the FRAP assay. Anal Biochem. 239:70-76.
Blois MS. 1958. Antioxidant determinations by the use of a stable free radical. Nat. 181:1199-1200
Campanella L, Bonnani A, Bellantoni D, Favero G, Tomasseti M. 2004. Comparison of fluorimtric, voltametric dan biosensor methods for determination of total antioxidant capacity of drug products containing acetylsalicylic acid. J PharmBiomed Anal. 36:91-99.
Deny F, Lestari S, Hakim Z. 2006. Penggunaan vitamin C dan vitamin E dalam kosmetik. Majalah Kedokteran Andalas. 2(30).
Excalibur Mineral Company. 2010. [Internet]. [diunduh 2013 November 27].Tersedia pada: http://web mineral.com/specimens/picshow.php?id=1283 & target = kaolinite#.us6jr Qwolc.
Fatimah I, Eko S, Karna W, Iqmal T, Kamalia. 2006. Titanium dioksida terdispersi pada zeolit alam (TiO2/zeolit) dan aplikasinya untuk
fotodegradasi congo red. Indones J Chem. 6(1):38-42.
Georgiev D, Bogdanov B, Angelova K, Markovska I, Hristov Y. 2009. Synthetic zeolits-structure, clasification, current trends in zeolit synthesis review. International Science Conference [Internet]. [2009 Juni 4-5; Stara Sagora
(BG)]. [diunduh 2013 Desember 13]. Tersedia pada: damage in vivo and in cell culture: how should you do it and what do the results mean. Britain J Pharmacol. 142(2):231-55.
Hediana N. 2011. Sintesis, pencirian, dan uji fotodegradasi nanokomposit sodalit/TiO2 terhadap zat warna biru metilena [skripsi]. Bogor: Institut
Pertanian Bogor.
Hosseini SA, Niaei A, Salari D. 2011. Production of γ-Al2O3 from Kaolin. Open J Phys Chem. 1:23-27.doi:10.4236/ojpc.2011.12004.
Ipek H et al. 2012. The effect of zeolit on antioxidant status in healthy dairy cow. Acta Vet Brunen. 81:43-47.
[IUPAC] International Union of Pure and Applied Chemistry. 1997. Copendium of Chemical Terminology. Ed ke-2. [Internet]. [diunduh 30 Juni 2013]. Tersedia pada: http://old.iupac.org/goldbook/IO3036.pdf.
Jati I. 2013. Aktivitas antioksidan zeolit alam terpilar TiO2. [Skripsi]. Bogor:
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Kunarti ES, Wahyuni ET, Hermawan FE. 2009. Pengujian aktivitas komposit Fe2O3-SiO2 sebagai fotokatalis pada fotodegradasi 4-klorofenol. Sodality
1(16):54-64.
Kuncahyo I dan Sunardi 2007. Uji aktivitas antioksidan ekstrak belimbing wuluh (Averrhoa bilimbi L.) terhadap 1,1-diphenyl-2-picrylhidrazyl (DPPH). Seminar Nasional Teknologi “Teknologi Untuk Kesejahteraan dan
Peradaban Bangsa”. 2007 Nov 24; Yogyakarta, Indonesia. Yogyakarta
Mohapatra M, S. Anand. 2010. Synthetis and applications of nanostructured iron oxides/hydroxides. Int J Eng Sci Technol. 8:127-146.
Molyneux P. 2004. The use of the stable free radical dyphenylpicrylhydrazil (DPPH) for estimating antioxidant activity. J Sci Technol. 26:211-219. Moon JK, Shibamoto T. 2009. Antioxidant assays for plant and food components.
J Agri Food Chem. 57: 1655-1666.
Mouzdahir Y, Elmchaouri A, Mahboub R, Gil A, Korili SA. 2007. Adsorption of methylene blue from aqueous solution on a Moroccan clay. J Chem Eng. natural clinoptilolite as a possible mechanism of its antimetastatic ability. J Cancer Respirat Clinic Oncol. 128:37-44.
Pranoto Rahmad D. 2012. Potensi zeolit alam sebagai antioksidan [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Qin FX, Wada K, Yang XJ, Wang XM, Yoshimura M, Asami K, Inoue A. 2010. Bioactivity of a Ni-free Ti-based metallic glass. Mater Trans. 51(3):529-534.
Suardana IN. 2008. Optimalisasi daya adsorpsi zeolit terhadap ion kromium (III). JPPSH. 2(1):17-33.
Warren PW. 2006. Information about toxins and liquid zeolits (clinoptilolite). [Internet]. [diunduh 2013 September 2]. Tersedia pada: http://www.rebprotocol.net/august2007/Q%20&%20A%20INFORMATIO N%20ABOUT%20TOXINS%20AND%20LIQUID%20ZEOLITS%2021pp .pdf
Warzywoda J, Maria VT, George AR Jr, Nurcan B, Raymond J, Steven LS, Albert S Jr. 2000. Characterization of zeolits A and X grown in low earth orbit. J Crystalograph Growth. 220:150-160.
Weng TL, Lin WT, Cheng A. 2013. Effect of metakaolin on strength and efflorescence quantity of cement-based composites. Sci W J.
Wijaya K, Sugiharto E, Fatimah I, Sudiono S, Kurniaysih D. 2006. Utilisasi TiO2
zeolit dan sinar UV untuk fotodegradasi zat warna congo red. Teknoindus 11:199–209
Winarno FG. 1992. Kimia Pangan dan Gizi. Jakarta : Gramedia.
Lampiran 1 Diagram alir penelitian
Lampiran 2 Data XRD
Nama 2θ Intensitas kristalinitas % Nama 2θ intensitas kristalinitas %
62.6922 65 54.1013 85
68.7771 31 62.4716 60
70.3140 34 64.0424 54
Lampiran 3 Data EDS
Bahan Unsur Kelimpahan(%) Bahan Unsur Kelimpahan(%)
Lampiran 4 Contoh perhitungan IC50 pada ZSTi
Y = b X + a
50 = 2.7928X + 46.444 logX= 1.273274
X = 18.76 ppm( IC50 )
Lampiran 5 Perhitungan kapasitas minimum ( Q )
Q =
ZS kons awal (mg/L) (C0) Bobot (g) A kons akhir (mg/L) (C1) f(P) (C1*f(P)) (C2) C0-C2 ( Ct)V (L) Q Qrata2 C
100 0.0515 0.112 1.062578343 10 10.62578343 89.37422 0.015 26.031325 26.0397779 100
100 0.0513 0.115 1.091505159 10 10.91505159 89.08495 0.015 26.048231
200 0.0508 2.613 25.17789991 5 125.8894996 74.11050 0.015 21.883022 21.5694054 200
200 0.0507 2.660 25.63108668 5 128.1554334 71.84457 0.015 21.255789
300 0.0504 0.515 4.948413846 50 247.4206923 52.57931 0.015 15.648603 15.6331098 300
300 0.0505 0.515 4.948413846 50 247.4206923 52.57931 0.015 15.617616
400 0.0504 0.063 0.590107029 100 59.01070292 340.9893 0.015 101.48491 101.442018 400
400 0.0503 0.064 0.599749301 100 59.97493009 340.0251 0.015 101.39913
500 0.0502 0.024 0.214058432 200 42.81168643 457.1883 0.015 136.61005 136.474259 500
500 0.0503 0.024 0.214058432 200 42.81168643 457.1883 0.015 136.33846
Lampiran 7 Penentuan pola isotherm adsorpsi biru metilena (BM)
LANGMUIR FREUNDLICH
C x x/m C/(x/m) LOG c LOG x/m
Lampiran 8 Uji statistik
Tes Korelasi Pearson antara IC50 dan Adsorpsi DPPH
Correlations: IC50, adsorpsi DPPH
Pearson correlation of IC50 and adsorpsi DPPH = -0.531
P-Value = 0.093
α=5%
P-value > 0.05, artinya Ho diterima, maka tidak terdapat korelasi antara
Lanjutan Lampiran 8 Uji statistik
Tes Korelasi Pearson antara IC50 dan Kapasitas Adsorpsi
Correlations: IC50, kapasitas adsorpsi
Pearson correlation of IC50 and kapasitas adsorpsi = 0.239
P-Value = 0.569
α=5%
P-value > 0.05, artinya Ho diterima, maka tidak terdapat korelasi antara
IC50 dan kapasitas adsorpsi
TES HOMOGENITAS DUA VARIAN
F-Test Two-Sample for Variances
IC50 adsorpsi DPPH
Mean 25276.45455 0.580181818
Variance 970896569.3 0.012249164
Observations 11 11
Df 10 10
F 79262274396
P(F<=f) one-tail 4.02752E-53 F Critical one-tail 2.978237016
Fhitung >> Ftabel, maka kedua varians sampel tidak homogen
Tes Korelasi Spearman antara IC50 dan Adsorpsi DPPH
t hitung = [ (rs (n-2)1/2)/ (1- rs2)1/2] n=11
rs= -0.318182 Thitung = -1.006
T table pada α (5%)= 2.20
Wilayah penerimaan: -2.20 <thitung< 2.20
RIWAYAT HIDUP
Penulis dilahirkan di Klaten pada tanggal 18 Juni 1964 dari ayah Moeljono dan ibu Soeparni. Penulis merupakan anak pertama dari enam bersaudara.
Penulis menyelesaikan studi S1 program Studi Pendidikan Kimia, Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam, di Institut Keguruan dan Ilmu Pendidikan ( IKIP) Negeri Yogyakarta pada tahun 1990. Tahun itu juga diterima sebagai guru di SMF “Yayasan Pharmasi” Semarang. Pada tahun 1998 penulis diterima sebagai staf pengajar tetap Akademi Farmasi “Yayasan Pharmasi” Semarang. Sejak tahun 2000 diangkat sebagai staf pengajar di Sekolah Tinggi Ilmu Farmasi “Yayasan Pharmasi“ Semarang sampai sekarang.
Manfaat Penelitian
Manfaat yang diharapkan sebagai luaran penelitian ini adalah pemanfaatan zeolit sintetik dan zeolit sintetik terpilar yang memiliki aktivitas antioksidan sehingga dapat diaplikasikan dalam bidang kosmetik dan kesehatan.
Hipotesis
Zeolit sintetik yang dipilar dengan TiO2 dan Fe2O3 mempunyai aktivitas
antioksidan dan terdapat perbedaan aktivitas antioksidan antara zeolit sintetik baik yang dipilar TiO2 atau Fe2O3 dan yang tidak.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Januari 2013 hingga Juli 2013 di Laboratorium Kimia Anorganik Departemen Kimia Institut Pertanian Bogor, Laboratorium Kimia Sekolah Tinggi Ilmu Farmasi ”Yayasan Pharmasi”
Semarang, Laboratorium Uji Biofarmaka IPB dan Balai Penelitian dan Pengembangan Kehutanan Jalan Gunung Batu, Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan ialah kaolin Bangka Belitung, TiO2, Fe2O3,
NaOH, vitamin C, 1,1-difenil-2-pikrilhidrazil (DPPH). Alat yang digunakan ialah alat-alat gelas, botol plastik hidrotemal, spektrofotometer UV-VIS 1700 merk Shimadzu, difraktometer sinar-X (XRD) merk Shimadzu (Cu sebagai atom target, panjang gelombang 1.5406Å , voltase 40kV , arus 30mA), dan mikroskop elektron payaran (SEM)-spektroskopi dispersif energi (EDS) merk Bruker.
Metode Penelitian
Penelitian ini dilakukan dengan tiga tahap penelitian, yaitu menyintesis zeolit dari bahan baku kaolin, memilarnya dengan TiO2 dan Fe2O3, dan menguji
kinerjanya sebagai antioksidan menggunakan metode DPPH serta uji kapasitas adsorpsi terhadap biru metilena. Diagram alir penelitian ini dapat dilihat pada Lampiran 1.
Sintesis zeolit (Hediana 2011).
6jam. Serbuk metakaolin yang terbentuk didinginkan. Metakaolin (M) hasil kalsinasi ditimbang sebanyak 10g, kemudian ditambahkan 200mL larutan NaOH 2M. Campuran dipanaskan pada suhu 40 C selama 6 jam. Pemanasan dilanjutkan pada suhu 100 C selama 24 jam. Zeolit sintetik yang diperoleh dicuci dengan akuades bebas ion sampai pH netral dan dikeringkan dengan oven pada suhu 100
C selama 24 jam (ZS). Setengah dari ZS yang diperoleh dipanaskan atau
dioksidasi pada 300 C selama 5 jam (ZSO).
Sintesis zeolit terpilar TiO2 dan Fe2O3 (Wijaya et al. 2006 dengan modifikasi).
Pemilaran zeolit dalam penelitian ini dilakukan dengan, yaitu pertama pemilaran dilakukan setelah sintesis zeolit (secara fisik) dan kedua pemilaran dilakukan bersamaan dengan sintesis zeolit (hidrotermal). Pemilaran secara fisik dilakukan dengan menambahkan 4g zeolit sintetik (ZS) dan TiO2 15% dari bobot
ZS kemudian dipanaskan pada 300 C selama 5 jam (ZSTiF). Pemilaran secara hidrotermal dilakukan dengan mencampurkan 4g metakaolin (M), 80mL NaOH 2M dan TiO2 15% dari bobot M. Campuran kemudian dipanaskan pada suhu 40
C selama 6 jam. Pemanasan dilanjutkan menggunakan oven pada suhu 100 C
selama 24 jam. Campuran kemudian dicuci dengan akuades bebas ion hingga mencapai pH netral, dikeringkan dengan oven pada suhu 100 C selama 24 jam (ZSTi), setengah dari hasil ZSTi yang diperoleh dioksidasi 300 C selama 5 jam (ZSTi O).
Pemilaran zeolit dengan Fe2O3 dilakukan dengan metode yang sama seperti
pada pemilaran dengan TiO2 sehingga menghasilkan zeolit sintesis terpilar Fe2O3
pencampuran secara fisik (ZSFeF) dan zeolit sintetik terpilar Fe2O3 (ZSFe) serta
zeolit sintetik terpilar Fe2O3 yang dioksidasi 300 C selama 5 jam (ZSFeO).
Uji Aktivitas Antioksidan dengan Metode DPPH (Aranda et al. 2009 dengan
modifikasi).
Sebanyak 50mg zeolit sintetik dimasukkan ke dalam tabung reaksi dan ditambahkan 5ml larutan DPPH 125µM. Campuran kemudian dikocok menggunakan vortex selama 5 menit kemudian disentrifugasi dengan kecepatan 4000rpm selama 10 menit. Filtratnya diinkubasi selama 30 menit pada suhu ruangan dan serapannya diukur pada 517nm. Blanko yang digunakan ialah metanol dan vitamin C sebagai kontrol positif. Kapasitas penghambatan radikal bebas dihitung berdasarkan persamaan :
A = Serapan kontrol negatif (DPPH ditambah metanol) B = Serapan sampel (DPPH ditambah metanol, zeolit)
Dilakukan uji yang sama terhadap kaolin, metakaolin, TiO2, Fe2O3, zeolit
yang terpilar dengan TiO2 maupun zeolit terpilar Fe2O3. Selanjutnya hasil