POTENSI
Spirulina platensis
SEBAGAI ANTIHIPERTENSI
SECARA
IN VITRO
PUTRIANA SARI SIRAIT
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwaskripsi berjudul Potensi Spirulina platensis Sebagai Antihipertensi Secara In Vitro adalah benarkarya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutipdari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
PUTRIANA SARI SIRAIT. Potensi Spirulina platensis Sebagai Antihipertensi Secara In Vitro. Dibimbing oleh IRIANI SETYANINGSIH dan MIN RAHMINIWATI.
Hipertensi menjadi penyebab kematian nomor tiga setelah stroke dan tuberkulosis di Indonesia. Mikroalga Spirulina platensis memiliki kandungan senyawa metabolit sekunder yang berpotensi sebagai sediaan obat alami untuk mengurangi resiko hipertensi.Tujuan penelitian ini adalah untuk mengoptimalkan produksi S. platensis sebagai bahan baku pangan fungsional terutama sebagai suplemen untuk mengurangi resiko hipertensi. Spirulina platensis dikultivasi selama satu minggu dalam media Walne dan RI1+Urea. Spirulina platensis yang dikultivasi dengan media Walne menghasilkan biomassa kering sebesar 7,81 gram, lebih tinggi jika dibandingkan hasil kultivasi dengan media RI1+Urea. Komponen aktif yang terkandung pada kedua kultur S. platensis adalah golongan alkaloid, steroid, dan saponin. Flavonoid hanya ditemukan pada S. platensis hasil kultivasi dalam media pupuk Walne dan didapatkan kandungan total flavonoid sebesar 1,264% (b/b). Kedua kultur S. platensis memiliki aktivitas antioksidan namun tergolong rendah dimana nilai IC50 sebesar 1584,86 ppm pada media Walne dan 1984,34 ppm pada pupuk RI1+Urea. Uji potensi antihipertensi secara in vitro menunjukkan bahwa ekstrak S. platensis 4000 ppm berpotensi sebagai antihipertensi.
Kata kunci: antioksidan, fitokimia, flavonoid, hipertensi, ileum.
ABSTRACT
PUTRIANA SARI SIRAIT. Antihypertensive Potential of Spirulina platensis in Vitro. Supervised by IRIANI SETYANINGSIH and MIN
RAHMINIWATI.
Hypertension is the number three cause of death after stroke and tuberculosis in Indonesia. Microalgae Spirulina platensis contains secondary metabolites that have the potential effect to reduce the risk of hypertension. The purpose of this research was optimalization of S. platensis production as neutraceutical. Spirulina platensis was cultivated on 1 week in Walne and Urea+RI1medium. Spirulina platensis which cultivated with Walne medium produced dried biomass of 7.81 g, which is higher when compared with the cultivation results of RI1+Urea medium. Alkaloids, steroids, and saponins were the chemical constituents of S. platensis in both cultivation medium. Flavonoids are found only in S. platensis cultivation results in Walne medium with total flavonoid content of 1.264% (w/w). Spirulina platensis both cultivation medium has antioxidant activity but relatively low with IC50 values 1584,86 ppm in Walne medium and 1984,34 ppm RI1+Urea fertilizer. Extract of S. platensis 4000 ppm showed antihypertensive potential in vitro.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruhkarya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
POTENSI
Spirulina platensis
SEBAGAI ANTIHIPERTENSI
SECARA
IN VITRO
PUTRIANA SARI SIRAIT
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Potensi Spirulina platensis Sebagai Antihipertensi Secara In Vitro Nama : Putriana Sari Sirait
NIM : C34090023
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Ir Iriani Setyaningsih, MS Pembimbing I
drh Min Rahminiwati, MS, Ph.D Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso, M. Si Ketua Departemen
KATA PENGANTAR
Puji dan syukur dipanjatkan ke hadirat Tuhan Yang Maha Esa, atas karuniaNya yang berlimpah, sehingga penulis dapat menyelesaikan penelitian yang berjudul Potensi Spirulina platensis Sebagai Antihipertensi Secara In Vitro.
Penulis juga mengucapkan terima kasih kepada semua pihak yang telah membantu penulis dalam menyelesaikan penelitan, terutama kepada:
1 Dr Ir Iriani Setyaningsih, MS dan drh Min Rahminiwati, MS, Ph.D selaku dosen pembimbing, atas segala bimbingan dan pengarahan dalam penyusunan skripsi.
2 Dr Desniar, S.Pi, M. Si selaku dosen penguji yang telah memberikan saran dan kritik untuk perbaikan skripsi ini serta selaku wakil ketua program studi yang telah mewakili departemen pada saat ujian dan saran perbaikan.
3 Prof Dr Ir Joko Santoso, M. Si selaku Ketua Departemen Teknologi Hasil Perairan.
4 Ayah Drs M. Sirait, Ibu Ir GF. Pasaribu, dan adik Rani Beatrix Sirait yang telah memberikan kasih sayang dan semangat yang luar biasa.
5 Mazmur, kakak-kakak Biotek2, dan THP46 atas kebersamaan dan semangat yang diberikan dalam penyelesaian skripsi.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan. Semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang memerlukannya.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 2
Perumusan Masalah ... 2
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 2
Bahan Penelitian ... 3
Alat Penelitian ... 3
Prosedur Penelitian ... 3
Kultivasi Spriulina platensis ... 4
Pemanenan dan Pengeringan ... 5
Ekstraksi ... 5
Prosedur Analisis ... 5
Analisis Komponen Aktif ... 5
Analisis Kandungan Flavonoid Secara Kuantitatif ... 6
Uji Antioksidan dengan Metode DPPH... 6
Uji Potensi Antihipertensi dengan Ileum Kelinci Secara In Vitro .. 7
HASIL DAN PEMBAHASAN ... 7
Pertumbuhan dan Biomassa Spirulina platensis... 7
Komponen Aktif Spirulina platensis ... 10
Kadar Total Flavonoid ... 12
Aktivitas Antioksidan Spirulina platensis ... 13
Potensi Antihipertensi Spirulina platensis Secara In Vitro ... 16
KESIMPULAN DAN SARAN ... 20
DAFTAR PUSTAKA ... 21
LAMPIRAN ... 26
DAFTAR TABEL
1 Biomassa basah dan biomassa kering S. platensis... 9
2 Penapisan fitokimia biomassa kering kering S. platensis... 10
3 Kadar flavonoid biomassa kering kering S. platensis... 13
4 Nilai IC50 aktivitas antioksidan S. platensis... 15
DAFTAR GAMBAR
1 Diagram alir tahapan penelitian... 42 Kurva pertumbuhan S. platensis dengan media Walne dan RI1+Urea.. 8
3 Foto hasil uji fitokimia... 10
4 Struktur umum flavonoid dan contoh flavonoid: kuersetin... 13
5 Struktur molekul DPPH... 14
6 Aktivitas antioksidan biomassa kering S. platensis (Walne)... 14
7 Aktivitas antioksidan biomassa kering S. platensis (RI1+Urea)... 15
8 Persentase inhibisi frekuensi ekstrak, aquades dan asetilkolin... 17
9 Persentase inhibisi frekuensi ekstrak, aquades dan asetilkolin... 18
10 Grafik pergerakan usus halus dengan ekstrak S. platensis 4000 ppm… 18 11 Grafik pergerakan usus halus dengan asetilkolin 1000 ppm………... 19
DAFTAR LAMPIRAN
1 Media pertumbuhan Spirulina platensis... 282 Persiapan air untuk media kultivasi... 29
3 Foto hasil kultivasi Spirulina platensis... 30
4 Kurva Ln pertumbuhan Spirulina platensis... 31
5 Kurva standar kuersetin dan data kadar flavonoid ... 32
6 Data kurva antioksidan Spirulina platensis... 33
7 Komposisi larutan Tyrode... 34
PENDAHULUAN
Latar Belakang
Spirulina merupakan salah satu alga hijau biru yang dapat dikultivasi. Mikroalga ini memiliki aktivitas antioksidan sehingga dapat menangkap radikal bebas sebagai salah satu penyebab timbulnya penyakit hipertensi. Penelitian yang dilakukan oleh Wang et al. (2007) menunjukkan bahwa aktivitas antioksidan dari
Spirulina platensis dapat terjadi karena kontribusi komponen flavonoid,
β carotene, vitamin A, dan α tocopherol. Kandungan flavonoid pada ekstrak S. platensis 85,1 g/kg, kandungan β carotene sebesar 77,8 g/kg, kandungan
vitamin A sebesar 113,2 g/kg, dan kandungan α tocopherol sebesar 3,4 g/kg. Penelitian yang dilakukan oleh Lu et al. (2010) menunjukkan bahwa S. platensis memiliki potensi untuk digunakan dalam pencegahan dan pengobatan hipertensi.
Hipertensi menduduki peringkat ketiga dari penyebab kematian utama di Indonesia untuk semua umur (6,8%), setelah stroke (15,4%) dan tuberkulosis (7,5%) (Depkes 2008). Hipertensi merupakan suatu kondisi dimana nilai tekanan darah sistolik ≥ 140 mmHg atau tekanan darah diastolik ≥ 90 mmHg (Garnadi 2012). Beberapa penyebab munculnya hipertensi antara lain penyakit gagal ginjal, kelainan endokrin, asupan garam terlalu tinggi, stres atau salah pemakaian obat (Iskandar 2007).
Saat ini banyak penelitian dilakukan untuk mengetahui potensi obat antihipertensi dari tanaman obat. Secara empiris, beberapa tanaman obat yang pernah digunakan untuk menurunkan tekanan darah adalah buah mengkudu, seledri, bawang putih, jamur, pegagan, tempuyung, rumput laut hitam, belimbing, bawang bombay, sambiloto, dan patikan kebo (Wijayakusuma 2005). Pengobatan menggunakan tanaman obat membutuhkan banyak biomassa dan waktu tumbuh yang lama, serta dapat mengganggu kelestarian alam jika dieksploitasi secara berlebihan, sehingga diperlukan inovasi yang efektif dan efisien sebagai solusi terhadap permasalahan tersebut. Inovasi yang dapat dikembangkan antara lain memanfaatkan mikroorganisme yang dapat dikultivasi, tidak tergantung musim dan dapat menghasilkan biomassa yang banyak. Salah satu jenis mikroalga yang dapat dikembangkan adalah Spirulina.
Pertumbuhan mikroalga dipengaruhi oleh beberapa faktor seperti faktor biologi (konsentrasi biomassa) dan variabel fisika-kimia (pH, suhu, iradiasi dan nutrien) (Olguin et al. 2001). Nutrien merupakan faktor yang sangat penting untuk pertumbuhan dan komposisi biokimia mikroalga. Kondisi nutrien yang optimum akan menghasilkan nilai produktivitas kultivasi mikroalga yang tinggi disertai kualitas biomasa yang baik.
2
potensi antihipertensi dari S. platensis secara in vitro dengan menggunakan usus halus kelinci terisolasi.
Perumusan Masalah
Hipertensi menjadi penyebab kematian nomor tiga setelah stroke dan tuberkulosis di Indonesia. Tanaman obat dapat digunakan untuk menurunkan hipertensi. Salah satu komponen kimiawi yang berperan dalam menurunkan hipertensi adalah flavonoid. Spirulina platensis memiliki kandungan flavonoid yang bekerja sebagai antioksidan, sehingga dapat dimanfaatkan sebagai obat alami untuk mengurangi resiko hipertensi. Spirulina platensis mudah dikultivasi dalam media dan dapat menghasilkan biomassa yang banyak dengan pertumbuhan yang cepat. Pertumbuhan mikroalga dipengaruhi oleh faktor lingkungan, antara lain nutrien. Namun belum diketahui aktivitas antihipertensi S. platensis yang ditumbuhkan dalam media yang berbeda.
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah:
1 Menentukan pola pertumbuhan, komponen aktif, dan mengukur aktivitas antioksidan S. platensis yang ditumbuhkan dalam media yang berbeda. 2 Menentukan potensi antihipertensi dari S. platensis secara in vitro pada
beberapa konsentrasi.
Manfaat Penelitian
Manfaat penelitian ini adalah untuk meningkatkan nilai ekonomis dari S. platensis yang dapat dikultivasi in-door melalui media anorganik maupun
organik, serta memberikan informasi komponen aktif dan aktivitas antioksidan, yang berpotensi sebagai antihipertensi.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah kultivasi mikroalga S. platensis, uji fitokimia, kandungan total flavonoid, dan uji antioksidan serta uji potensi antihipertensi dengan usus halus kelinci terisolasi secara in vitro.
METODE PENELITIAN
3 (1,1-diphenyl-2-picrylhydrazyl) bertempat di Laboratorium Bioteknologi Hasil Perairan 2, Departemen Teknologi Hasil Perairan FPIK-IPB. Uji fitokimia dilakukan di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan FPIK-IPB. Analisis kandungan flavonoid secara kuantitatif dilakukan di Pusat Studi Biofarmaka IPB dan uji potensi antihipertensi dengan usus halus kelinci secara in vitro di Laboratorium Farmakologi, FKH-IPB serta proses freeze drying dilakukan di Pusat Antar Universitas (PAU), IPB. Proses evaporasi dilakukan di Laboratorium Kimia Analitik, FMIPA-IPB.
Bahan Penelitian
Bahan-bahan kultivasi yang digunakan dalam penelitian ini adalah inokulum S. platensis, media pertumbuhan S. platensis (Lampiran 1), dan air untuk media kultivasi (Lampiran 2). Bahan untuk analisis komponen aktif meliputi pereaksi Dragendorff, pereaksi Meyer, pereaksi Wagner, kloroform, asetat anhidrat, Mg powder, amil alkohol, alkohol, air panas, etanol, FeCl3, H2SO4, NaOH 40%, H3BO3, bromcherosol green-methyl red dan n-heksana; uji antioksidan menggunakan biomassa kering DPPH (1,1-diphenyl-2-picrylhydrazyl) radikal dan metanol pro analysis. Bahan untuk uji potensi antihipertensi secara in vitro digunakan usus halus dari kelinci jantan dewasa, larutan Tyrode, asetilkolin 1000 ppm dan ekstrak S. platensis dengan berbagai konsentrasi (ppm).
Alat Penelitian
Alat yang digunakan untuk kultivasi terdiri dari: toples kaca 3 L, toples plastik 15 L, tube light (TL) Philips 40 Watt, lemari es, nylon dengan ukuran lubang 30, timbangan digital (Sartorius TF 502s) dan spektrofotometer UV-VIS (OPTIMA SP-300). Alat yang digunakan untuk pengeringan yaitu cawan dan freeze dryer (Edwards E2M8 34082). Alat untuk uji potensi antihipertensi secara in vitro meliputi pisau, gunting bedah, benang, jarum, pencapit, organbath, aerator, selang aerasi, termometer, ADinstrument, cawan petri, gelas beker, dan alat gelas lainnya.
Prosedur Penelitian
4
Gambar 1 Diagram alir tahapan penelitian.
Kultivasi Spirulina platensis
Kultivasi S. platensis dilakukan menggunakan media Walne dan pupuk RI1+Urea selama 7 hari. Bibit S. platensis dipersiapkan dengan cara ditumbuhkan pada media Walne di dalam toples kaca sebanyak 2 L selama 7 hari. Kultur diperbesar dengan cara menginokulasikan bibit 10% (v/v) pada media
Inokulum S. platensis
Kultivasi (media Walne dan pupuk RI1+Urea)
Pemanenan pada umur 7 hari
Penyaringan dengan nylon (ukuran lubang 30 mikron)
Biomassa sel Pengeringan
Uji fitokimia
Analisis kandungan total
flavonoid
Uji Antioksidan
DPPH Biomassa kering S. platensis
Biomassa kering terpilih terbaik
Kurva Pertumbuhan
Ekstraksi 3 x 24 jam Pelarut metanol (1:10)
Ekstrak
Uji potensi antihipertensi in vitro dilakukan menggunakan usus halus kelinci terisolasi
5 Walne dan pupuk RI1+Urea dalam toples plastik berkapasitas maksimal 15 L. Setiap hari dilakukan sampling kultur untuk mengukur nilai Optical Density (OD) menggunakan spektrofotometer UV-Vis pada panjang gelombang 670 nm, selanjutnya dibuat kurva pertumbuhan.
Pemanenan dan Pengeringan
Kultur S. platensis yang dipanen, selanjutnya diendapkan terlebih dahulu dengan cara mematikan aerasi. Pemanenan dilakukan dengan penyaringan menggunakan nylon dengan ukuran lubang 30 mikron. Biomassa basah kemudian ditimbang lalu dikeringkan menggunakan freeze dryer (Edwards E2M8 34082).
Ekstraksi
Ekstraksi dilakukan pada biomassa kering S. platensis yang dikultivasi dalam Walne (biomassa terpilih). Sampel S. platensis kering sebanyak 3 gram dimaserasi menggunakan pelarut metanol pro analysis 30 mL selama 3 x 24 jam. Hasil maserasi yang berupa larutan kemudian disaring menggunakan kertas saring (Whattman 42) sehingga didapat filtrat dan residu. Filtrat ekstrak metanol yang diperoleh dievaporasi menggunakan rotary vacuum evaporator (Heidolph VV 2000).
Prosedur Analisis Analisis Komponen Aktif (Harborne 1987)
Pengujian komponen aktif atau fitokimia dilakukan pada biomassa kering S. platensis yang meliputi uji alkaloid, uji steroid, uji flavonoid, dan uji saponin.
1) Uji Alkaloid
Sampel sebanyak 0,1 g ditambah empat puluh tetes H2SO4 2 N dikocok dan diendapkan. Sampel tersebut dibagi menjadi tiga bagian lalu diuji dengan tiga pereaksi alkaloid yaitu pereaksi Dragendorff, pereaksi Meyer dan pereaksi Wagner masing-masing tiga tetes. Hasil uji dinyatakan positif bila dengan terbentuk endapan merah jinggapereaksi Dragendorff, endapan putih kuning dengan pereaksi Meyer, dan endapan coklat dengan pereaksi Wagner.
2) Uji Steroid
Sampel sebanyak 0,1 g ditambah dua puluh tetes kloroform, lima tetes asetat anhidrat, dan satu tetes H2SO4 pekat. Hasil uji dinyatakan positif apabila terjadi perubahan warna dari merah menjadi hijau atau biru.
3) Uji Flavonoid
Sampel sebanyak 0,1 g ditambahkan 0,05 Mg powder, delapan tetes amil alkohol serta dua belas tetes alkohol. Terbentuknya lapisan merah atau jingga di antara Mg dan alkohol menunjukkan reaksi positif.
4) Uji Saponin
6
Analisis Kandungan Flavonoid Secara Kuantitatif (Nobre et al. 2005)
Biomassa kering sampel 200 mg dimasukkan ke dalam sistem hidrolisis yang berupa 1,0 mL larutan heksametilenatetramina 0,5% (b/v), 20 mL aseton, dan 2 mL HCl 25% dalam labu bulat, direfluks selama 30 menit. Filtrat hasil hidrolisis disaring menggunakan kapas ke dalam labu takar 100 mL, residu ditambah 20 mL aseton dan dihidrolisis kembali selama 30 menit. Filtrat digabungkan, residu ditambah 20 mL aseton dan dihidrolisis kembali.Filtrat digabungkan kembali dan ditera dengan aseton.
Filtrat sebanyak 20 mL dan 20 mL akuades dimasukkan ke dalam corong pisah, kemudian diekstraksi menggunakan etil asetat (ekstraksi pertama dengan 15 mL etil asetat, ekstraksi kedua dan ketiga masing-masing dengan10 mL). Fraksi etil asetat dikumpulkan dalam labu takar 50 mL dan ditera dengan etil asetat. Larutan tersebut diambil 10 mL lalu dimasukkan ke dalam labu takar 25 mL, direaksikan dengan 1 mL AlCl3 2% (b/v), dan ditera dengan larutan asam S. platensis. Larutan stok sampel pada konsentrasi 200 ppm, 400 ppm, 600 ppm,
800 ppm, dan 1000 ppm dibuat dengan cara melarutkan 0,025 g biomassa kering S. platensis dalam metanol. Larutan stok DPPH (1,1-diphenyl-2-picrylhydrazyl) dibuat tepat sebelum digunakan dengan melarutkan biomassa kering DPPH radikal sebanyak 0,00394 g dalam metanol sebanyak 10 mL. Stok larutan DPPH disimpan di dalam botol ekstrak yang telah dilapisi dengan aluminium foil untuk mencegah bereaksinya DPPH dengan cahaya.
Pengujian dilakukan dengan cara mengambil 2,25 mL larutan stok sampel sesuai dengan deret konsentrasi kemudian ditambah larutan DPPH sebanyak 0,25 mL. Blanko dibuat dengan melarutkan 2,25 mL larutan metanol kemudian ditambah dengan 0,25 mL larutan DPPH. Larutan yang telah divortex kemudian diinkubasi dalam inkubator suhu 37 oC selama 30 menit agar DPPH bereaksi. Setelah larutan diinkubasi, serapan larutan dibaca pada panjang gelombang 517 nm menggunakan spektrofotometer UV-Vis. Sebagai blanko digunakan metanol pro analysis. Aktivitas penangkapan radikal bebas dihitung menggunakan persamaan sebagai berikut:
Keterangan: AB = Absorbansi Blanko AS = Absorbansi Sampel
Nilai IC50 diperoleh dari plot hubungan antara konsentrasi sampel sebagai sumbu-x (absis) dan % aktivitas penangkapan DPPH radikal sebagai sumbu-y (ordinat).
7
Uji Potensi Antihipertensi dengan Usus Halus Kelinci Terisolasi Secara
In Vitro (Kumar et al. 2011)
Uji potensi antihipertensi dilakukan pada ekstrak S. platensis yang dikultivasi pada media Walne. Kelinci dieuthanasi dengan cara dipotong lehernya. Bagian abdomen kelinci dibuka kemudian ususnya dikeluarkan dan diambil bagian ileumnya untuk selanjutnya dimasukkan ke dalam cawan petri besar yang berisi larutan tyrode bersuhu 37oC. Isi usus perlahan-lahan disemprot keluar dengan syringe 20 cc yang berisi larutan tyrode 37oC, sampai bersih. Kemudian usus halus diisolasi dan dipotong menjadi beberapa potongan (2-3 cm). Potongan usus halus tersebut diikat dengan benang pada kedua ujungnya (dilakukan dalam cawan petri yang berisi larutan tyrode 37oC). Salah satu ujung potongan usus halus diikatkan pada ujung tabung aerator, sedangkan ujung lainnya dikaitkan ke bagian kimograf yang berada diatasnya sehingga potongan usus halus berada dalam keadaan direngang.
Uji potensi ini dilakukan tiga kali ulangan untuk setiap perlakuan, dimana terdapat lima perlakuan yaitu konsentrasi ekstrak Spirulina platensis 1000 ppm, 2000 ppm, dan 4000 ppm, serta kontrol negatif yaitu aquades dan kontrol positif yaitu asetilkolin. Pengamatan dilakukan selama 6 menit menggunakan alat pencatat kimograf ADinstrument. Data yang diperoleh dalam uji ini berupa grafik gelombang yang diterjemahkan dalam frekuensi dan amplitudo melalui software ADinstrument. Data yang diambil berupa persentase inhibisi dari frekuensi dan tinggi gelombang (amplitudo) kontraksi sebelum dan sesudah diberikan stimulasi.
HASIL DAN PEMBAHASAN
Pertumbuhan dan Biomassa Spirulina platensis
Pertumbuhan S. platensis ditunjukkan dengan pertambahan nilai OD (optical density) dimana semakin tinggi nilai OD menunjukkan sel yang semakin padat. Chrismadha (2006) menyatakan bahwa pola kepadatan sel S. platensis dipengaruhi oleh faktor tumbuh yang diklasifikasikan sebagai faktor sumberdaya dan faktor pendukung. Faktor sumberdaya terdiri atas sumberdaya yang secara langsung dipergunakan oleh sel-sel alga untuk pertumbuhannya, seperti unsur hara, cahaya, dan CO2. Faktor pendukung terdiri atas faktor lingkungan yang mempengaruhi metabolisme dalam sel mikroalga, antara lain suhu dan pH.
Spirulina platensis pada penelitan ini dikultivasi pada dua media yang berbeda yaitu Walne dan pupuk RI1+Urea (Lampiran 1). Kondisi nutrien yang optimum sangat penting untuk mendapatkan nilai produktivitas kultivasi
mikroalga yang tinggi disertai kualitas biomasa yang baik. Widianingsih et al. (2008) menyatakan bahwa pertumbuhan sel dipengaruhi oleh
ketersedian unsur utama dalam lingkungan kultur yaitu berupa C, H, O, N, P, K, S, Ca, Fe, Mg, dan keberadaan unsur mikro nutrien. Komponen vitamin dalam media yang dapat mempercepat pertumbuhan terutama Vitamin B12.
Spirulina platensis merupakan mikroalga yang tidak memiliki heterosis, sehingga spesies ini tidak mampu memfiksasi nitrogen dari udara. Pemenuhan
8
(Surbakti 2013). Media Walne dan pupuk RI1+Urea mengandung nitrogen dalam komposisi medium. Kurva pertumbuhan S. platensis disajikan pada Gambar 2.
Gambar 2 Kurva pertumbuhan S. platensis dengan media Walne ( ) dan pupuk RI1+Urea ( ).
Kultur S. platensis yang diamati pada media Walne dan pupuk RI1+Urea memiliki fase pertumbuhan yaitu fase logaritmik dan fase stationer, namun tidak mengalami fase adaptasi. Menurut Setyaningsih et al. (2012), fase lag dapat tidak terjadi bila umur bibit dan inokulum sama. Bila inokulum kultur yang digunakan berada dalam fase logaritmik juga, pada umumnya inokulum tidak mengalami masa adaptasi.
Adanya pertumbuhan ditandai dengan meningkatnya jumlah sel dan perubahan warna kultur. Pada awal kultivasi, kultur berwarna hijau muda dan terlihat jernih. Setelah beberapa lama, kultur berwarna hijau tua dan terlihat pekat. Aerasi diberikan terus menerus, dengan tujuan untuk menghindari sedimentasi mikroalga, meratakan pencahayaan dan nutrien serta mencegah stratifikasi suhu dan mempermudah pertukaran gas antara medium kultur dan udara karena sumber karbon dalam bentuk CO2 digunakan untuk fotosintesa (Setyaningsih et al.2012).
Pemanenan S. platensis dilakukan pada saat kultivasi mencapai puncak populasi. Puncak populasi dapat diketahui dari perubahan warna pada media kultivasi dan jumlah populasi berdasarkan pola pertumbuhan (Handayani 2002). Spirulina platensis pada penelitian ini dikultivasi selama 7 hari menggunakan media Walne dan media pupuk RI1+Urea (Lampiran 3). Umur 7 hari menjadi
dasar waktu pemanenan karena Suminto (2009); Hariyati (2008); Utomo et al. (2005) melaporkan bahwa hari ketujuh merupakan fase perlambatan
(ekponensial akhir) dimana kepadatan maksimal Spirulina sp. tercapai.
Hasil penelitian Suminto (2009) menunjukkan bahwa S. platensis yang dikultivasi dengan 3 media yang berbeda yaitu media Walne, TMRL dan Zarrouk, ketiganya mengalami puncak populasi pada hari ke-7. Hariyati (2008) juga melaporkan bahwa hari ketujuh merupakan fase perlambatan (eksponensial akhir),
9 dimana kepadatan maksimal Spirulina sp. yang dikultivasi dengan media Walne dan EDTA tercapai. Hasil penelitian Utomo et al. (2005) menunjukkan bahwa hari ke-7 merupakan puncak dari pertumbuhan populasi S. platensis yang dikultivasi dengan kotoran ayam 300 ppm dan 350 ppm. Berkaitan dengan ini, Surbakti (2013) menyatakan bahwa fase eksponensial akhir merupakan fase untuk menghasilkan komponen bioaktif terbaik.
Pemanenan biomassa atau pemisahan biomassa dari kultur dilakukan menggunakan filtrasi. Filtrasi dapat dilakukan untuk kultur dalam jumlah banyak. Kelemahan sistem filtrasi ini adalah pori dari filter yang digunakan harus
disesuaikan dengan ukuran mikroalga (Setyaningsih et al. 2009). Spirulina platensis memiliki filamen berbentuk spiral dengan diameter 20-100
mikron. Oleh karena itu, S. platensis hasil kultivasi pada penelitian ini difiltrasi menggunakan nylon (dengan ukuran lubang 30 mikron).
Setelah filtrasi, tahap selanjutnya adalah pengeringan. Pengeringan S. platensis pada penelitian ini menggunakan freeze dryer. Pemilihan metode
pengeringan dilakukan untuk menjaga komponen bioaktif bahan. Hal ini sesuai dengan pernyataan Andersen dan Markham (2006) bahwa degradasi enzim dapat terjadi pada saat tanaman yang digunakan segar atau tidak kering, sehingga disarankan untuk menggunakan sampel uji yang kering atau beku. Berat biomassa hasil kultivasi dapat dilihat pada Tabel 1, sedangkan biomassa kering kering S. platensis dapat dilihat pada Lampiran 3.
Tabel 1 Biomassa basah dan biomassa kering S. platensis
Sampel Kultivasi
Spirulina platensis yang dikultivasi dalam media Walne menghasilkan biomassa kering lebih banyak dibandingkan media pupuk RI1+Urea. Perbedaan biomassa yang dihasilkan diduga berkaitan dengan nutrien media yang digunakan. Kultivasi dalam media Walne menggunakan NH4NO3 sebagai sumber nitrogen, sedangkan media pupuk RI menggunakan Urea.
Nutrien merupakan faktor yang sangat penting untuk pertumbuhan dan komposisi biokimia mikroalga. Salah satu komponen nutrien penting dalam media adalah nitrogen. Nitrogen (N) merupakan komponen esensial dari struktur dan fungsional protein pada sel alga. Sumber nitrogen pada kultivasi Spirulina sp. adalah nitrat. Sumber nitrogen ion nitrat yang yang biasa digunakan dapat digantikan oleh ion ammonium yang berasal dari urea (Diharmi 2001). Rahmawati et al. (2012) menyatakan bahwa N-anorganik berupa nitrat (NO3) dan amoniak (NH4) sedangkan N-organik yang tersedia dalambentuk asam amino, asam nukleat danurea juga dimanfaatkan oleh Spirulina sp. Unsur makromolekul ini nantinya akan dimanfaatkan Spirulina sp. untuk kegiatan metabolisme
sehingga akan memperoleh kepadatan populasi dan laju pertumbuhan Spirulina sp. yang optimum
10
baik karena tingginya penyerapan nitrogen oleh tanaman, dan akan lebih baik jika pemberian pupuk nitrogen dalam bentuk campuran nitrat dan amonium seimbang. Hal ini berhubungan dengan konstannya pH yang dapat mempengaruhi penyerapan kedua bentuk sumber nitrogen tersebut. Bentuk yang berbeda dari kedua sumber nitrogen yaitu nitrat sebagai anion dan amonium sebagai kation akan menyebabkan terjadinya mekanisme interaksi yang positif dalam penyerapan nitrogen.
Komponen Aktif Spirulina platensis
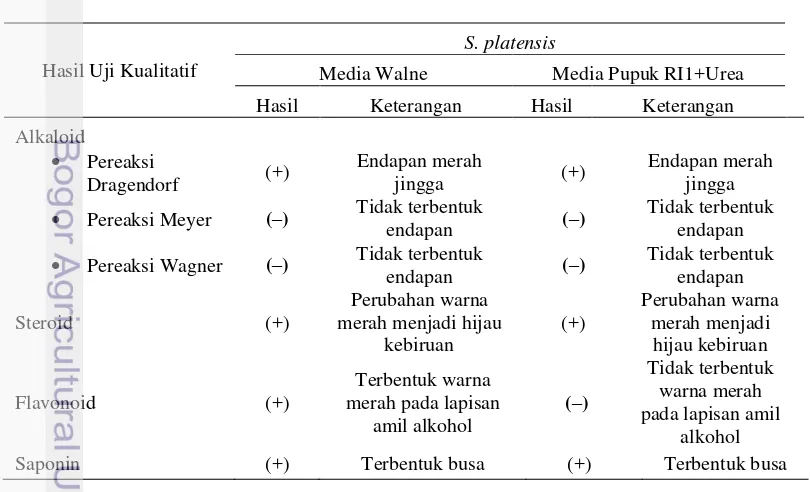
Menurut Simbala (2009), analisis fitokimia merupakan uji pendahuluan untuk mengetahui keberadaan senyawa kimia spesifik seperti alkaloid, flavonoid, steroid, saponin, dan triterpenoid. Uji ini sangat bermanfaat untuk memberikan informasi mengenai senyawa kimia yang terdapat pada tumbuhan. Foto hasil uji fitokimia dapat dilihat pada Gambar 3, sedangkan hasil pengujian fitokimia biomassa kering S. platensis dapat dilihat pada Tabel 2.
Gambar 3 Hasil uji fitokimia (W=Walne dan R=media Pupuk RI1+Urea).
Tabel 2 Hasil uji fitokimia biomassa kering kering S. platensis
Hasil Uji Kualitatif
S. platensis
Media Walne Media Pupuk RI1+Urea
Hasil Keterangan Hasil Keterangan
11
Alkaloid
Kandungan alkaloid secara kualitatif tidak berbeda pada S. platensis yang dikultivasi dalam media Walne dan pupuk RI1+Urea. Pereaksi Dragendorf pada penelitian ini menunjukkan nilai positif untuk kedua sampel ditandai dengan terbentuknya endapan merah jingga, sedangkan untuk pereaksi Meyer dan Wagner menunjukkan hasil negatif. Salah satu pereaksi saja yang menunjukkan positif sudah dapat dikatakan bahwa sampel mengandung alkaloid. Hal ini diduga bahwa sintesis alkaloid berkaitan dengan nitrogen dimana kandungan N yang terdapat pada kedua media mencukupi untuk metabolisme sekunder alkaloid pada taraf yang sama. Suradikusumah (1989) menyatakan bahwa kadar alkaloid ditentukan oleh tersedianya ion nitrat yang cukup.
Wijatmoko (2008) melaporkan uji kualitatif yang sering digunakan untuk mengetahui adanya senyawa alkaloid adalah menggunakan pereaksi pengendapan. Senyawa alkaloid mengandung atom nitrogen yang memiliki pasangan elektron bebas. Elektron bebas ini akan disumbangkan pada atom logam berat membentuk senyawa kompleks dengan gugus yang mengandung atom nitrogen sebagai ligannya. Senyawa kompleks ini tidak larut (mengendap) dan memberikan warna sesuai dengan pereaksi yang digunakan.
Alkaloid memiliki kegunaan dalam bidang medis, antara lain sebagai analgetika dan narkotika, mengubah kerja jantung, penurun tekanan darah, obat asma, sebagai antimalari, stimulan uterus, dan anastesi lokal (Sirait 2007). Nassel (2008) menyatakan banyak senyawa alkaloid yang mempunyai aktivitas farmakologis yang penting seperti d-tubocurarin sebagai relaksasi otot dalam anastesi, reserpin sebagai antihipertensi dan obat psikotropik.
Triterpenoid/Steroid
Triterpenoid dapat dibagi menjadi empat kelompok senyawa, yaitu triterpen sebenarnya, steroid, saponin, dan glikosida jantung (cardiac glycoside). Beberapa triterpen dikenal dengan rasanya, terutama rasa pahit (Sirait 2007). Identifikasi steroid pada penelitian ini dilakukan dengan menggunakan uji Lieberman-Burchard (anhidra asetat-H2SO4 pekat). Hasil penelitian menunjukkan nilai positif untuk kedua sampel ditandai dengan adanya perubahan warna dari merah menjadi hijau atau biru.
Sari (2011) menyatakan bahwa triterpenoid merupakan senyawa aktif yang dapat berfungsi sebagai antioksidan, sehingga dapat menangkap radikal bebas sebagai salah satu penyebab timbulnya penyakit hipertensi. Lu et al. (2010) juga menyatakan bahwa banyak penelitian tentang senyawa triterpenoid terhadap fungsi fisiologis, salah satunya adalah sebagai antihipertensi.
Flavonoid
12
Amanatin dan Nurhidayati (2013), Spirulina sp. perlakuan dengan konsentrasi nitrogen yang tinggi (pupuk Urea lebih dari 100 ppm) mengalami penghambatan pada proses biosintesisnya karena kultur melebihi batas maksimum penggunaan nutrien dari medium oleh sel.
Menurut Nugrahaningtyas et al. (2005), beberapa flavonoid dalam makanan mempunyai efek antihipertensi. Secara umum penelitian lain memperlihatkan bahwa senyawa aktif antihipertensi berasal dari golongan flavonoid, diantaranya flavan-3-ol dan prosianidin (Actis-Goretta et al. 2003). Selain itu, flavonoid berperan sebagai antioksidan dengan cara mendonasikan atom hidrogennya atau melalui kemampuannya mengkelat logam, berada dalam bentuk glukosida (mengandung rantai samping glukosa) atau dalam bentuk bebas yang disebut aglikon (Redha 2010).
Saponin
Saponin adalah glikosida triterpena dan sterol. Glikosida adalah suatu kompleks antara gula pereduksi (glikon) dan bukan gula (aglikon). Glikon bersifat mudah larut dalam air dan glikosida-glikosida mempunyai tegangan permukaan yang kuat.Adanya saponin dalam tumbuhan ditunjukkan dengan pembentukan busa yang mantap saat ekstraksi suatu bahan (Harborne 1987). Hasil penelitian menunjukkan nilai positif terhadap kedua sampel yang diujikan.
Menurut Sudheendra et al. (2009), beberapa saponin bekerja sebagai antimikroba. Jenis saponin dan turunannya yang berasal dari daun-daunan pada tanaman kebun, digunakan untuk mengobati penyakit jantung. Saponin akan memperkuat kontraksi otot jantung, sehingga dapat bekerja lebih efisien pada penderita serangan jantung.
Saponin dapat dimanfaatkan sebagai antihipertensi. Selain itu, saponin juga memiliki aktivitas antimikroba, merangsang sistem imun dan mengatur tekanan darah (Astawan dan Kasih 2008). Saponin digunakan sebagai obat untuk hiperkolesterolemia, hiperglikemia, antioksidan, antikanker, dan antiinflamasi. Pada tanaman, saponin diketahui memiliki aktivitas kardiotonik dan antibakteri (Sermakkani dan Thangapandian 2010).
Kadar Total Flavonoid
Penentuan flavonoid total berdasarkan pembentukan kompleks antara flavonoid dan AlCl3. Alumunium Klorida membentuk kompleks yang stabil dengan gugus keto C4 dan gugus hidroksil dari C3 atau C5 pada flavon dan flavonol. Banyaknya kompleks yang terbentuk diketahui dari hasil pengukuran spektrofotometer UV-Vis (Umar 2008). Semakin banyak kandungan senyawa flavonoid dalam suatu sampel, maka secara visual warna kuning yang terbentuk akan semakin pekat.
13 kedua sampel dapat dilihat pada Tabel 3.
Tabel 3 Kadar total flavonoid biomassa kering kering S. platensis
Sampel % (b/b)
S. platensis (Walne) 1,264
S. platensis (Pupuk RI1+Urea) 0,873
Metode pengujian juga diduga memberikan pengaruh terhadap hasil kadar total flavonoid. Wahyuningrum (2006) menyatakan flavonoid total yang terukur merupakan sumbangan dari golongan flavon dan flavonol yang terdapat pada ekstrak, karena hanya kedua kelompok inilah yang mampu membentuk kompleks stabil dengan AlCl3. Apak et al. (2007) juga menyatakan bahwa metode pengujian menggunakan AlCl3 hanya dapat membentuk kompleks beberapa kelompok dari flavonoid seperti flavon (krisin, apigenin, luteolin) dan flavonol (kuersetin, minisetin, mosin, nitin), tapi tidak dapat membentuk kompleks golongan flavanon dan flavanonol.
Standar flavonoid yang digunakan dalam uji kandungan total flavonoid ini adalah kuersetin. Kuersetin dipilih sebagai standar karena merupakan senyawa flavonoid kuat golongan flavonol. Flavonol diketahui sebagai senyawa penciri adanya flavonoid karena keberadaannya yang banyak tersebar dalam tumbuhan (Julia 2011). Kuersetin merupakan salah satu senyawa flavonoid yang telah diuji antihipertensi secara in vitro (Duarte et al. 2001). Struktur umum flavonoid dan kuersetin dapat dilihat pada Gambar 4.
(a) (b)
Gambar 4 Struktur umum (a) flavonoid dan (b) contoh flavonoid: kuersetin (Wahyuningrum 2006).
Flavonoid banyak ditemukan pada tumbuhan, mengacu pada hasil metabolit sekunder dari tumbuhan yang mempunyai struktur phenylbenzopyrone, biasa dikenal dari aktivitas antioksidannya. Pada manusia flavonoid memiliki kegunaan sebagai antioksidan, antikanker, antialergi, dan antivirus. Flavonoid juga sangat efektif dalam mengikat radikal bebas dari hidroksil dan peroksil sehingga dapat mencegah penyakit kanker dan jantung (Respatie 2007).
Aktivitas Antioksidan Spirulina platensis
14
tubuh (Christiana et al. 2008). Prinsip dasar pengukuran aktivitas antioksidan adalah mengevaluasi adanya aktivitas penghambatan proses oksidasi oleh senyawa antioksidan yang terdapat dalam bahan pangan atau ekstrak bahan alam (Aryudhani 2007). Pengukuran aktivitas antioksidan sangat diperlukan untuk mengetahui kualitas antioksidan dan ketahanan produk selama proses pengolahan dan penyimpanan, serta implikasinya ke jaringan tubuh (Arinanti et al. 2006). Menurut Molyneux (2004), pengujian antioksidan dengan DPPH merupakan salah satu metode yang sederhana dengan menggunakan 1,1-diphenyl-2-picrylhydrazyl sebagai senyawa pendeteksi. Struktur molekul dari DPPH dapat dilihat pada Gambar 5.
Gambar 5 Struktur molekul DPPH (Sumber: Molyneux 2004).
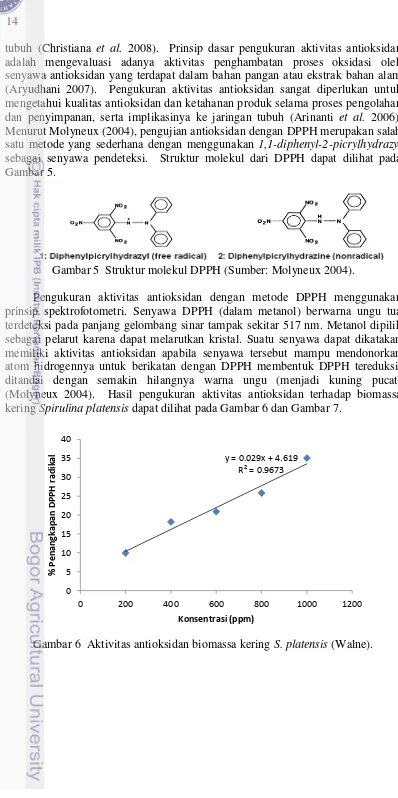
Pengukuran aktivitas antioksidan dengan metode DPPH menggunakan prinsip spektrofotometri. Senyawa DPPH (dalam metanol) berwarna ungu tua terdeteksi pada panjang gelombang sinar tampak sekitar 517 nm. Metanol dipilih sebagai pelarut karena dapat melarutkan kristal. Suatu senyawa dapat dikatakan memiliki aktivitas antioksidan apabila senyawa tersebut mampu mendonorkan atom hidrogennya untuk berikatan dengan DPPH membentuk DPPH tereduksi, ditandai dengan semakin hilangnya warna ungu (menjadi kuning pucat) (Molyneux 2004). Hasil pengukuran aktivitas antioksidan terhadap biomassa kering Spirulina platensis dapat dilihat pada Gambar 6 dan Gambar 7.
Gambar 6 Aktivitas antioksidan biomassa kering S. platensis (Walne).
y = 0.029x + 4.619
0 200 400 600 800 1000 1200
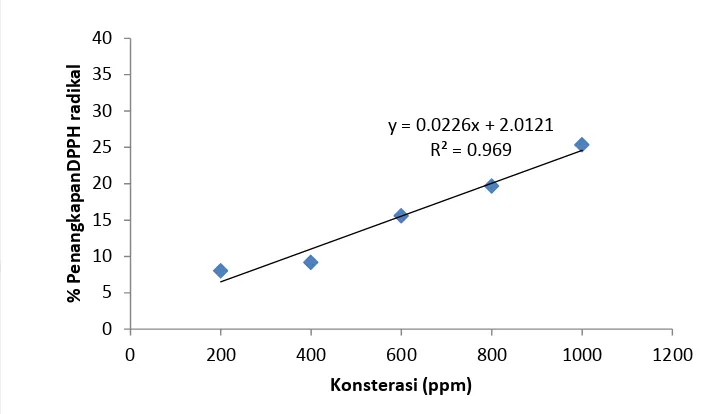
15
Gambar 7 Aktivitas antioksidan biomassa kering S. platensis (Pupuk RI1+Urea). Hasil uji menunjukkan bahwa peningkatan daya hambat S. platensis pada kedua media terhadap radikal bebas, berbanding lurus dengan konsentrasi (ppm), dimana nilai R2 menggambarkan korelasi antara konsentrasi dan persentase inhibisi. Nilai R2 hasil penelitian menunjukkan korelasi cukup kuat antara konsentrasi biomassa kering S. platensis dan persentase penangkapan DPPH radikal dimana konsentrasi 1000 ppm S. platensis yang dikultivasi dengan media Walne mampu menghambat 35,09% DPPH radikal, sedangkan pada pupuk RI1+Urea 25,33%.
Nilai IC50 merupakan besarnya konsentrasi yang dapat menghambat aktivitas radikal bebas sebanyak 50%. Nilai IC50 aktivitas antioksidan S. platensis yang dikultivasi dalam media Walne dan pupuk R1+Urea disajikan pada Tabel 4.
Tabel 4 Nilai IC50 aktivitas antioksidan S. platensis
Sampel Nilai IC50 (ppm) antioksidannya. Aktivitas antioksidan dikatakan sangat kuat bila nilai IC50 kurang
dari 50 ppm dan dikatakan lemah bila nilai IC50 lebih dari 200 ppm (Molyneux 2004). Aktivitas antioksidan yang diekspresikan dengan nilai IC50
(Tabel 4) menunjukkan bahwa S. platensis yang dikultivasi menggunakan Walne memiliki aktivitas antioksidan yang lebih besar dibandingkan S. platensis yang dikultivasi menggunakan pupuk RI1+Urea. Berdasarkan hal tersebut, dapat dikatakan bahwa S. platensis yang dikultivasi pada media Walne dan pupuk RI1+Urea memiliki aktivitas antioksidan namun tergolong rendah. Hal ini diduga
karena tidak dilakukan ekstraksi terlebih dahulu pada saat dianalisis.
0 200 400 600 800 1000 1200
16 Barus (2013) melaporkan bahwa peningkatan komponen-komponen antioksidan
berkorelasi dengan peningkatan jumlah sel kultur. Hal ini sesuai dengan hasil penelitian yang dilakukan dimana S. platensis yang dikultivasi menggunakan media Walne menghasilkan biomassa yang lebih banyak (Tabel 1).
Adanya aktivitas antioksidan didukung dengan hasil analisis komponen aktif, dimana S. platensis yang dikultivasi menggunakan media Walne mengandung flavonoid. Pieta (2000) menyatakan bahwa senyawa flavonoid sangat berperan dalam aktivitas antioksidan karena flavonoid bekerja dengan memerangkap radikal bebas dan ROS seperti radikal anion superoksida dan radikal bebas hidroksil. Menurut Andayani et al. (2008), golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavonol, isoflavon, kateksin, dan kalkon.
Flavonoid merupakan bagian penting dari diet manusia karena banyak manfaatnya bagi kesehatan. Manfaat kebanyakan flavonoid dalam tubuh manusia adalah sebagai antioksidan sehingga sangat baik untuk pencegahan kanker. Manfaat lain flavonoid adalah untuk melindungi struktur sel, memiliki hubungan sinergis dengan vitamin C (meningkatkan efektivitas vitamin C), anti inflamasi, mencegah keropos tulang, dan sebagai antibiotik (Harbone 1987).
Antioksidan memiliki peran penting bagi kesehatan, khususnya untuk menurunkan tekanan darah. Hasil penelitian Liputo et al. (2008) menunjukkan bahwa ada perbedaan yang signifikan antara tekanan darah sistolik dan diastolik baik sebelum dan sesudah pemberian diet tinggi antioksidan. Poliphenol seperti pada flavonoid berkaitan dengan aktivitas antioksidan kuat, hambatan agregasi platelet, dan fungsi endotelial sehingga terjadi penurunan tekanan darah.
Potensi Antihipertensi Spirulina platensis Secara In Vitro
Hipertensi terjadi ketika volume darah meningkat dan atau saluran darah menyempit, sehingga membuat jantung memompa lebih keras untuk menyuplai oksigen dan nutrisi kepada setiap sel didalam tubuh. Hipertensi merupakan suatu kondisi saat nilai tekanan darah sistolik ≥ 140 mmHg atau tekanan darah diastolik
≥ 90 mmHg (Garnadi 2012). Pemilihan obat-obatan hipertensi saat ini telah banyak mengalami perubahan karena perlu mempertimbangkan efek samping
yang ditimbulkan, pemakaian jangka panjang, dan nilai ekonomisnya. Wibowo et al. (2009) menyatakan bahwa dibandingkan dengan obat-obatan
modern, obat herbal memiliki beberapa kelebihan antara lain efek sampingnya relatif rendah, dalam suatu ramuan dengan komponen berbeda memiliki efek saling mendukung, serta lebih sesuai untuk penyakit-penyakit metabolik dan degeneratif.
17 terletak dalam rongga abdomen dan dikelilingi oleh usus besar. Usus halus terdiri dari tiga bagian yaitu usus dua belas jari (duodenum), usus kosong (jejunum), dan usus penyerapan (ileum) (Niman 2013).
Penggunaan usus halus dalam penelitian ini karena proses pencernaan terbesar dan penyerapan lebih kurang 85% dari seluruh absorbsi terjadi disini. Pergerakan usus halus dipicu oleh perenggangan dan secara refleks dikendalikan oleh sistem syaraf otonom. Gerakan usus halus antara lain: 1) segmentasi irama, yaitu pergerakan campuran utama yang berupa gerakan kontraksi dan relaksasi yang bergantian dari cincin-cincin otot dinding usus yang membagi isi menjadi segmen-segmen dan mendorong kimus bergerak maju mundur dari satu segmen yang relaks ke segmen lain (gerakan segmental memisahkan beberapa segmen usus dari yang lain. Hal ini memungkinkan isi lumen yang cair bersentuhan dengan dinding usus dan akhirnya siap di absorbsi), 2) peristaltis, yaitu konstraksi ritmis otot polos longitudinal dan sirkuler yang mendorong dan menggerakkan kimus kearah bawah di sepanjang saluran, 3) gerakan pendulum atau ayunan, menyebabkan isi usus bercampur (Niman 2013).
Uji potensi ini dimulai beberapa saat setelah kelinci dimatikan dan dibuka bagian perutnya dengan memindahkan potongan usus halus ke dalam cawan berisi larutan Tyrode dengan suhu 37oC. Larutan Tyrode adalah larutan isotonik dengan cairan interstisial dan digunakan dalam percobaan fisiologis dan kultur jaringan. Larutan ini menyerupai larutan laktat Ringer, tapi mengandung magnesium, gula (biasanya glukosa) sebagai sumber energi dan menggunakan bikarbonat dan atau HEPES sebagai penyangga (Schwartz 2000). Komposisi larutan Tyrode yang digunakandapat dilihat pada Lampiran 7.
Sesaat setelah dipindahkan maka dapat diamati bahwa usus halus berkontraksi. Untuk keperluan pengujian, potongan usus diikat pada alat pencatat kimograf ADinstrument dan diuji aktivitasnya terhadap ekstrak S. platensis, aquades, serta asetilkolin sebagai kontrol positif. Asetilkolin merupakan suatu neurotransmiter syaraf parasimpatis dan kolinergik yang berperan untuk menurunkan tekanan darah dimana pada jantung memiliki aktivitas kerja menurunkan denyut dan curah jantung, sebaliknya pada saluran cerna, asetilkolin
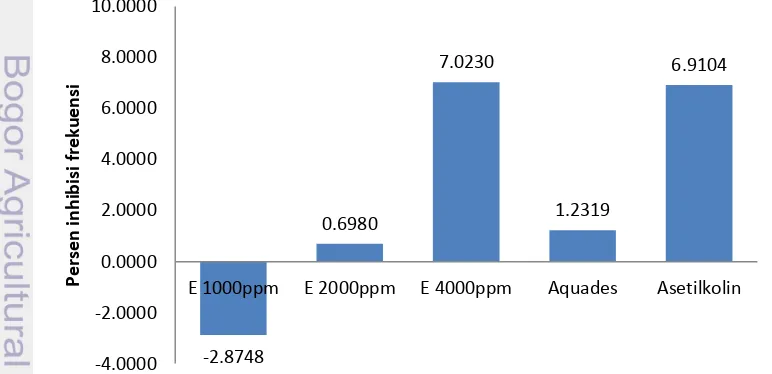
meningkatkan sekresi saliva, memacu sekresi dan gerakan usus (Myeck et al. 2001). Persentasi inhibisi dapat dilihat pada Gambar 8 dan 9.
Gambar 8 Persentase inhibisi frekuensi ekstrak, aquades dan asetilkolin.
-2.8748
E 1000ppm E 2000ppm E 4000ppm Aquades Asetilkolin
18
Gambar 9 Persentase inhibisi amplitudo ekstrak, aquades dan asetilkolin. Frekuensi adalah banyaknya gelombang yang terekam dalam satu satuan waktu. Amplitudo adalah tinggi dari gelombang-gelombang yang terekam, yang merupakan kontraksi maksimum yang berlangsung selama satu siklus getaran (Bueche dan Hecht 2006). Persentase inhibisi frekuensi usus halus kelinci pada ekstrak S. platensis konsentrasi 4000 ppm sebesar 7,0230% dan persentase inhibisi amplitudo sebesar 6,857%. Ekstrak S. platensis 4000 ppm memberikan pengaruh yang serupa dengan asetilkolin dalam persentase inhibisi frekuensi dan amplitudo (Gambar 8 dan Gambar 9).
Secara umum, hasil data frekuensi dan amplitudo yang didapat menunjukkan bahwa ekstrak S. platensis dengan konsentrasi 4000 ppm menunjukkan hasil yang menyerupai dengan asetilkolin dalam meningkatkan aktivitas usus halus. Hal ini dapat dilihat pada Gambar 10 dan Gambar 11.
Gambar 10 Grafik pergerakan usus halus dengan ekstrak S. platensis 4000 ppm.
-1,6407
E 1000ppm E 2000ppm E 4000ppm Aquades Asetilkolin
19
Gambar 11 Grafik pergerakan usus halus dengan asetikolin 1000 ppm. Peningkatan motilitas atau gerakan usus dipengaruhi oleh asetilkolin yang merupakan neurotransmiter dari syaraf parasimpatis sehingga dapat diketahui bahwa syaraf parasimpatis dapat meningkatkan aktivitas gastrointestinal. Sistem saraf otonom mempunyai peran penting dalam mempertahankan tekanan darah. Pada sistem syaraf otonom (tidak sadar), sistem syaraf parasimpatis memiliki efek inhibisi yaitu melambatkan denyut jantung dan menghambat aliran darah ke ekstremitas (Sabiston 1997). Oleh karena itu, dapat disimpulkan bahwa ekstrak S. platensis dengan konsentrasi 4000 ppm berpotensi sebagai antihipertensi.
Sistem syaraf otonom menghantarkan sinyal melalui transmisi impuls listrik secara cepat melalui serabut-serabut syaraf yang berakhir pada organ efektor, dan efek khusus akan timbul sebagai akibat pelepasan substansi neuromediator. Obat-obat yang menghasilkan efek terapeutik utamanya dengan menyerupai kerja sistem syaraf otonom disebut obat-obat otonom. Obat-obat otonom bekerja dengan cara menstimulasi atau menginhibisi kerja sistem syaraf. Obat-obat yang mempengaruhi sistem syaraf otonom terbagi menjadi subgrub sesuai dengan mekanisme kerjanya terhadap tipe neuron yang dipengaruhi. Obat kolinergik adalah satu subgrup obat otonom yang bekerja terhadap reseptor yang diaktifkan oleh asetilkolin. Suatu reseptor obat adalah suatu makromolekul target khusus, berada pada permukaan sel atau intraselular, yang mengikat suatu obat dan menimbulkan kerja famakologikanya. Reseptor muskarinik merupakan salah satu famili reseptor kolinergik (kolinoseptor) yang menunjukkan afinitas terhadap zat yang meniru astetilkolin (obat kolinomimetik). Reseptor ini memiliki beberapa subklas, salah satunya yaitu M2. Reseptor M2 terdapat dalam otot jantung dan otot polos. Aktivasi subtipe M2 pada otot jantung memacu protein G yang menghambat adenililsiklase dan mempertinggi konduktan K+, sehingga denyut dan kontraksi otot jantung akan menurun (Mycek et al. 2001).
20
Antioksidan menetralkan radikal bebas dengan mendonorkan atom hidrogennya. Aktivitas tersebut menghalangi reaksi oksidasi kolesterol jahat (LDL) yang menyebabkan darah mengental, sehingga mencegah pengendapan lemak pada dinding pembuluh darah. Struktur molekul antioksidan bukan hanya memiliki kemampuan melepas atom hidrogen tetapi juga mengubah radikal menjadi reaktivitas rendah, sehingga tidak terjadi reaksi dengan lemak (Athiroh dan Permatasari 2012).
Marxen et al. (2007) menyatakan bahwa mikroalga mempunyai kemampuan menetralkan radikal bebas melalui mekanisme enzimatis dan non enzimatis. Karotenoid dan asam lemak termasuk kelompok non enzimatis yang mampu melindungi organisme dari kerusakan oksidasi, sedangkan tokoferol, flavonoid, alkaloid termasuk kelompok enzimatis. Mekanisme enzimatis dan non enzimatis sama-sama menurunkan radikal, hanya berbeda pada kecepatan dan kecenderungan reaksinya.
Spirulina platensis merupakan mikroalga yang memiliki aktivitas antioksidan. Penelitian yang dilakukan oleh Wang et al. (2007) menunjukkan bahwa aktivitas antioksidan dari S. platensis dapat terjadi karena kontribusi
komponen flavonoid, β carotene, vitamin A, dan α tocopherol. Kandungan flavonoid pada ekstrak S. platensis 85,1 g/kg, kandungan β carotene sebesar
77,8 g/kg, kandungan vitamin A sebesar 113,2 g/kg, dan kandungan α tokoferol sebesar 3,4 g/kg. Salah satu komponen antioksidan yang terkandung dalam S. platensis pada penelitian ini adalah flavonoid. Hal ini sesuai dengan pernyataan Athiroh dan Permatasari (2012) bahwa senyawa flavonoid dapat berperan sebagai antioksidan alami yang melindungi sistem biologis dan menghambat oksidasi sel dengan cara mereduksi, menangkap oksigen aktif dan radikal bebas terutama superoksida.
KESIMPULAN DAN SARAN
Kesimpulan
Spirulina platensis yang dikultivasi baik dalam media Walne maupun Pupuk RI1+Urea memiliki pola pertumbuhan yang terdiri dari fase logaritmik dan stationer. Komponen aktif yang terkandung pada kedua kultur S. platensis adalah golongan alkaloid, steroid, dan saponin. Flavonoid hanya ditemukan pada S. platensis hasil kultivasi dalam media Walne. Spirulina platensis memiliki aktivitas antioksidan namun tergolong rendah. Uji potensi antihipertensi dengan ileum kelinci secara in vitro menunjukkan bahwa ekstrak S. platensis 4000 ppm berpotensi sebagai antihipertensi.
Saran
21 acuan untuk mengetahui potensi antihipertensi ekstrak S. platensis secara adrenergik. Serta, uji in vivo untuk mendapatkan penjelasan yang lebih baik mengenai mekanisme S. platensis dalam menurunkan tekanan darah.
DAFTAR PUSTAKA
Actis-Goretta L, Ottaviani JI, Keen CL, Fraga CG. 2003. Inhibition of angiotensin converting enzyme (ACE) activity by flavan-3-ols and procyanidin. FEBS Lett 555:597-600.
Amanatin DR, Nurhidayati T. 2013. Pengaruh Kombinasi Konsentrasi Media Ekstrak Tauge (MET) dengan Pupuk Urea terhadap Kadar Protein Spirulina sp. Jurnal Sains dan Seni Pomits 2(2):2337-3520.
Andayani R., Yovita L, dan Maimunah. 2008. Penentuanaktivitas antioksidan,
kadar fenolat total danlikopen pada buah Tomat (Solanumlycopersicum l). Jurnal Sains dan Teknologi Farmasi 13(1):31-37.
Andersen OM, Markham KR. 2006. Flavonoids: Chemistry, Biochemistry, and Applications. New Zealand (NZ): CRC Press.
Apak R. 2007. Comparative evaluation of various total antioxidant capacity assay applied to phenolic compounds with the CUPRAC assay. Molecules 12:1496-1547.
Arinanti M, Marsono Y, Noor Z. 2006. Aktivitas antioksidan pada berbagai jenis kacang. Agrosains 19(2):157-169.
Aryudhani N. 2007. Kandungan senyawa fenol rumput laut caulerpa racemosa dan aktivitas antioksidannya. [skripsi]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Astawan M, Kasih AL. 2008. Khasiat Warna-Warni Makanan. Jakarta (ID): PT Gramedia Pustaka Utama.
Athiroh N dan Permatasari N. 2012. Mekanisme kerja benalu teh pada pembuluh darah. Jurnal Kedokteran Brawijaya. 27(1):1-7. penerjemah, Lemeda Simarmata, editor. Jakarta (ID): Penerbit Erlangga. Terjemahan dari: Schaum’s Outlines of Theory and Problems of College Physics Tenth Edition.
Chew OS, Hamdan MR, Ismail Z, Ahmad MN. 2004. Assessment of Herbal Medicine by Chemometrics: Assisted Interpretation of FTIR Spectra. Malaysia (MY): Sains Malaysia.
22
[Depkes] Departemen Kesehatan. 2008. Laporan Hasil Riset Kesehatan Dasar (Riskesdas) Indonesia Tahun 2007. Jakarta (ID): Balitbangkes-Depkes RI. Devlin RM, Witham FH. 1983. Plant Physicology. 4th ed. Boston (UK): Willard
Grant Press.
Diharmi A. 2001. Pengaruh pencahayaan terhadap kandungan pigmen bioaktif mikroalga Spirulina platensis Strain Lokal (INK). [tesis]. Bogor (ID): Program Pasca Sarjana, Institut Pertanian Bogor.
Duarte J, Pérez-Palencia R, Vargas F, Ocete MA, Pérez-Vizcaino F, Zarzuelo A, Tamargo J. 2001. Antihypertensive effects of the flavonoid quercetin in spontaneously hypertensive rats. Brit J Pharmacol 133(1):117-24.
Fu L, Tao-Xu B, Rong-Xu X, You-Gan K, Zhang Y, Qin-Xia E, Bin-Li H. 2011.
Haryati R. 2008. Pertumbuhan dan biomassa Spirulina sp. dalam skala laboratoris. Bioma 10(1):9-22.
Iskandar Y. 2007. Tanaman obat yang berkhasiat sebagai antihipertensi. [karya ilmiah]. Bandung (ID): Fakultas Farmasi, Universitas Padjajaran Bandung.
Julia. 2011. Pengoptimuman ekstraksi flavonoid daun salam (Syzygium polyanthum) dan analisis sidik jari dengan kromatografi lapis
tipis. [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kumar NR, Vijayasankar GR, Prema R, S Jeevanandham S, Murthy GL, Sekar M. 2011. Prelude studies of antidiarrhoeal activity of ethyl acetate extract of aerial part of Indigofera purpurea on isolated rabbit ileum. Asian Journal Pharmacy Clinic Research. 4(2): 85-87.
Liputo NI, Rosalina L, Sulastri D. 2008. Pemberian Diet Minangkabau Tinggi Sumber Antioksidan Dapat Menurunkan Tekanan Darah. [Project Report]. Padang (ID): Universitas Andalas.
Lu B, Liu L, Zhen X, Wu X, Zhang Y. 2010. Antitumor activity of triterpenoid-rich extract from bamboo shavings (Caulis bamfuse in Taeniam). Journal of Biotechnology 9(38):6430-6436.
Lu J, Ren DF, Xue YL, Sawano Y, Miyakawa T, Tanokura M. 2010. Isolation of an antihypertensive peptide from alcalase digest of Spirulina platensis. Journal Agriculture Food Chemistry 58(12):7166-71.
Marxen K, Vaneslow KH, Lipemeler S, Hintze R, Ruser A, Hansen U. 2007. Determination of DPPH radical oxidation caused by methanolic extracts of some microalgal species by linear regression analysis of spectrophotometric measurements. Sensors 7:2080-2095.
Molyneux P. 2004.The use of the stable free radicals diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. Journal of Science and Technology 26 (2):211-219.
23 Mycek M, Harvey RA, Champe PC. 2001. Farmakologi Ed.2. Jakarta (ID):
Widya Medika.
Nassel FM. 2008. Isolasi alkaloid utama dari tumbuhan Lerchea interupta Korth.Percikan 91:57-66.
Niman S. 2013. Anatomi dan Fisiologi Sistem Pencernaan. Jakarta (ID): TIM. Nobre CP, Raffin FN, Moura TF. 2005. Standardization of extracts from
Momordia charantia L. (Cucur bitaceae) by total flavonoid content determination. Acta Farm Bonaerense 24 (4):562-566.
Nugrahaningtyas KD, Matsjeh S, Wahyuni TD. 2005. Isolasi dan identifikasi senyawa flavonoid dalam rimpang temu ireng (Curcuma aeroginosa Roxb.). Biofarmasi 3 (1):32-38.
Olguín EJ, Galicia S, Angulo-Guerrero O, Hernández E. 2001. The effect of low light flux and nitrogen deficiency on the chemical composition of Spirulina sp. grown on pig waste. Bioresource Technol 77(1):19-24.
Pieta PG. 2000. Flavonoids as Anti-oxidants. Journal Natural Product 63:1043-1046.
Pituati G, Indradewa D, Sulistyaningsih E. 2006. Pengaruh nisbah nitrat dan amonium terhadap aktifitas nitrat reduktase, kandungan nitrogen, pertumbuhan dan hasil tanaman Pak Choi (Brassica chinensis L.).Agrosains 19(1):1-11.
Rahmawati N, Yuliani Y, Ratnasari E. 2012. Pengaruh pupuk kompos berbahan campuran limbah cair tahu, daun lamtoro dan isi rumen sapi sebagai media kultur terhadap kepadatan populasi Spirulina sp. Lentera Bio 1(1):17–23. Redha, A. 2010. Flavonoid: Struktur, sifat antioksidatif dan peranannya dalam
sistem biologi. Jurnal Berlian 9(2):196-202.
Respatie DW. 2007. Pengaruh Tinggi Pangkasan dan Pemupukan N Terhadap Pertumbuhan dan Produksi Kandungan Bahan Bioaktif Daun Jambu Biji. [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi Edisi Keenam. Padmawinata K, penerjemah. Bandung (ID): ITB. Terjemahan dari: The organic constituents of higher plants.
Sabiston DC. 1997. Buku Ajar Bedah. Jakarta (ID): EGC.
Sari WE. 2011. Aktivitas antihipertensi aktinomiset endofit asal tanaman pegagan dan belimbing wuluh. [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sermakkani M, Thangapandian V. 2010. Phytochemical screening for active compounds in Pedalium murex L. Journal Recent Research Science Technology 2:110-114.
Setyaningsih I, Desniar, Purnamasari E. 2012. Antimikroba dari Chaetoceros gracilis yang dikultivasi dengan lama penyinaran berbeda.
Jurnal Akuatika 2:180-189.
Schwartz, S. 2000. Intisari Prinsip-Prinsip Ilmu Bedah Edisi ke-6.Jakarta (ID): Penerbit EGC.
Simbala HEI. 2009. Analisis senyawa alkaloid beberapa jenis tumbuhan obat sebagai bahan aktif fitofarmaka. Pacific Journal 1 (4):489-494.
24
Sudheendra AT, Shenoy R, Taranalli AD. 2009. Evaluation of saponin rich fraction of Trigonella foenum Graceum antihypertensive activity. Pharmacologyonline 1:1229-1233.
Suminto 2009. Penggunaan jenis media kultur teknis terhadap produksi dan kandungan nutrisi sel Spirulina platensis.Jurnal Saintek Perikanan 4(2):53-61.
Suradikusumah E. 1989. Bahan Pengajaran Kimia Tumbuhan. Bogor (ID): Departemen Pendidikan dan Kebudayaan, Direktorat Jendral Pendidikan Tinggi Pusat Antar Universitas Ilmu Hayati, Institut Pertanian Bogor. Surbakti TR. 2013. Aktivitas antihiperglikemik dan antioksidan alami Spirulina
platensis pada umur panen berbeda. [skripsi]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Umar F. 2008. Optimasi ekstraksi flavonoid total daun jati belanda. [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Utomo NBP, Winarti, Erlina A. 2005. Pertumbuhan Spirulina platensis yang dikultur dengan pupuk inorganik (Urea, TSP dan ZA) dan kotoran ayam. Jurnal Akuakultur Indonesia 4(1):41-48.
Wang L, Pan B, Sheng J, Xu J, Hu Q. 2007. Antioxidant activity of Spirulina platensis extracts by supercritical carbon dioxide extraction. Food
Chemistry 105:36–41.
Wahyuningrum A. 2006. Penentuan flavonoid total tempuyung (Sonchus arvenis L.) secara ceoat dengan teknik spektroskopi inframerah
dan kemometrik. [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Wibowo MS, Yuliana A, Rimayanti I. 2009. Uji antimikroba infusum bunga rosella (Hibiscus sabdariffa L.) dengan metode difusi agar. Jurnal Kesehatan 1(1):11-10.
Widianingsih, Ridho A, Hartati R, Harmoko. 2008. Kandungan nutrisi Spirulina platensis yang dikultur pada media yang berbeda. Ilmu kelautan 13(3):167-170.
Winarno FG .1997. Kimia Pangan dan Gizi. Jakarta (ID): Gramedia Pustaka. Wijayakusuma HM. 2005. Ramuan Tradisional untuk Pengobatan Darah Tinggi.
Jakarta (ID): Penebar Swadaya.
Wijatmoko A. 2008. Isolasi dan uji genotoksisitas inhibitor topoisomerase I dari daun Ipomoeapes-caprae. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
25
27 Lampiran 1 Media Pertumbuhan Spirulina platensis
Komposisi Walne
Nomor Bahan Jumlah (g L-1)
1 NH4NO3 2,86
2 NaH2PO4 1,81
3 H3BO3 0,222
4 MnCl2 0,018
5 FeCl3 0,079
6 EDTA 1000
7 **Trace element 1 mL untuk 1 L Walne
8 Vitamin B12 1 µL
**Traceelement untuk media Walne
Bahan Jumlah (g L-1)
ZnCl2 2,1
CoCl2 2,0
(NH4)6Mo.7O24 0,9
CuSO4 2,0
NB: Media dibuat dalam bentuk cairan. Pemakaian 1 mL dalam setiap 1 L kultivasi.
Gambar 12 Media Walne (Sumber: Koleksi pribadi). Cara Pembuatan Media Walne:
Makronutrien 1, 2, 3, dan 6 dicampur dengan H2O, nomor 4 dilarutkan dalam 50 mL H2O, nomor 5 dilarutkan dalam H2O. Keseluruhan komposisi tersebut dilarutkan dengan H2O sampai volume 1 L.
28
Komposisi Pupuk RI1 Organik
Mineral: N, P, K, dan Na (1,94 ppm), Ca (0,79 ppm), Mg (0,11 ppm), S (0,08 ppm), Fe (171,18 ppm), Mn (7,06 ppm), Cu (3,28 ppm), serta Zn (23,32 ppm).
Mikroba probiotik: GA 3 Gibbreta
Hormon: Zeabin (255,23%) dan IAA (276,76%).
Asam amino: Asam aspartat (1,146%), Asam glutanat (4,630%), Serin (1,250%), Glisin dan Histidin (1,246%).
Gambar 13 Media pupuk RI1+Urea (Sumber: Koleksi pribadi). Cara Pembuatan Media Pupuk RI1+Urea:
Sebanyak 30 mL cairan pupuk RI1 Organik dilarutkan dalam 100 mL aquades yang sebelumnya telah disterilisasi menggunakan autoklaf. Larutan tersebut digunakan 1 mL untuk 1 L kultivasi.
29 Lampiran 2 Persiapan air untuk media kultivasi
Persiapan air meliputi penyaringan, penurunan salinitas, dan sterilisasi air laut. Penyaringan dilakukan dengan menggunakan filter berdiameter 50 µm. Penurunan salinitas air laut sampai 15 ppt dilakukan dengan menambahkan air tawar dan diukur menggunakan WQM (Water Quality Meter). Rumus perhitungan penambahan air tawar:
V1 x M1 = V2 x M2 Keterangan:
V1 : Volume air laut
M1 : Salinitas air laut yang terukur
V2 : Volume total (air laut yang ditambah air tawar) M2 : Salinitas yang diinginkan
Air laut yang sudah diturunkan salinitasnya, disterilisasi dengan menambahkan NaOCl 60 ppm dan diaerasi selama 24 jam. Setelah itu, NaOCl yang ditambahkan dinetralisasi dengan menggunakan Na2C2O3 20 ppm dan diaerasi selama 24 jam. Perhitungan penambahan NaOCl sebagai berikut:
V1 x M1 = V2 x M2 Keterangan:
V1 : Volume NaOCl yang diinginkan M1 : Konsentrasi awal NaOCl (10%) V2 : Volume total air 15 ppt
M2 : Konsentrasi yang diinginkan (60 ppm) Sedangkan penambahan tiosulfat mengikuti rumus:
Keterangan:
n : Konsentrasi Natrium tiosulfat yang ingin ditambahkan (20 ppm) m : Bobot Natrium tiosulfat yang diperlukan
30
Lampiran 3 Kultur, biomassa kering dan ekstrakSpirulina platensis
(a) (b)
Gambar 14 KulturS. platensis (a) H0 (b) H7 (Sumber: Koleksi pribadi).
Gambar 15 Scale up S. platensis (Sumber: Koleksi pribadi).
(a) (b)
Gambar 16 (a) Biomassa sel S. platensis (b) Ektrak S. platensis (Walne) (Sumber: Koleksi pribadi).
Gambar 17 Biomassa kering kering S. platensis (R=media Pupuk RI1+Urea dan W=Walne)(Sumber: Koleksi pribadi).
32
Lampiran 5 Kurva standar kuersetin dan data kadar flavonoid
Konsentrasi (ppm) Absorban (λ=370,8 nm)
0,5 0,076
1 0,086
5 0,458
10 0,819
15 1,229
Sampel
Bobot sampel
(g)
Abs a B
Kadar flavonoid
(ppm)
Fp Vol (mL)
Kadar flavonoid
(%b/b) S.platensis
(Walne) 0,2244 0,392 0,08 0,029 4,5375 6,25 100 1,263787 S.platensis
33 Lampiran 6 Data kurva antioksidan biomassa keringSpirulina platensis
Biomassa kering S. platensis (Walne)
Konsentrasi (ppm) Rata-rata (%)
200 9,9589
400 18,1716
600 20,9256
800 25,8289
1000 35,0904
Biomassa kering S. platensis (Pupuk RI1+Urea)
Konsentrasi (ppm) Rata-rata (%)
200 8,0224
400 9,1610
600 15,5722
800 19,6560
1000 25,3380
Contoh perhitungan IC50:
Pada kurva S. platensis (Walne) didapatkan y = 0,029x + 4,619 50= 0,029x + 4,619
50 - 4,619= 0,029x 45,381 = 0,029x
= x
x = 1564,8620
34
Lampiran 7 Komposisi larutan Tyrode
Gambar 18Pembuatan larutan Tyrode(Sumber: Koleksi pribadi). Komposisi Erlenmeyer I:
NaCl 16 gram
KCl 0,4 gram
MgCl2 0,2 gram
CaCl2 0,22 gram
Bahan diatas dilarutkan dalam 250 cc H2O. Komposisi Erlenmeyer II:
NaHCO3 2 gram
NaH2PO4 0,1 gram
Bahan diatas dilarutkan dalam 250 cc H2O. Komposisi Erlenmeyer III:
Glukosa 1 gram
Bahan diatas dilarutkan dalam 500 cc H2O.
Selanjutnya, campurkan larutan II kedalam larutan I, kemudian larutan III kedalam larutan I dan II. Lalu, panaskan larutan Tyrode tersebut sampai 37o C. Setelah itu, larutan siap untuk digunakan.