12
energi celah semikonduktor TiO2. Hal ini berkaitan erat dengan perubahan ukuran partikel-partikel TiO2.
Berdasarkan hasil plot kurva (Gambar 7) diketahui bahwa nilai energi celah menurun terhadap peningkatan suhu kalsinasi. Gao et al. (2003) dan Ge et al.
(2006) menyatakan bahwa perubahan energi celah disebabkan oleh perubahan ukuran pertikel karena adanya efek ukuran kuantum (quantum size effect). Hal ini disebabkan oleh perubahan nilai quantum confinement yang menyebabkan peningkatan energi kinetik pada medan kuantum yang diiluminasi, sehingga energi celah meningkat seiring dengan penurunan ukuran partikel. Peristiwa tersebut dikenal sebagai efek ukuran quantum. Beberapa penelitian sebelumnya dilaporkan bahwa nilai energi celah TiO2 anatase yaitu 3,78 (Karabay et al. 2012), 3,6 eV (Gonz´alez dan Santiago 2007), 3,67 eV (Li et al. 2000), variasi suhu kalsinasi 400oC sampai 700oC masing-masing 3,67 eV , 3,40 eV, 3,80 eV, 3,65 eV (Gao et al. 2003), 3,36 eV (Reddy et al. 2002), dan 3,5-3,8 eV (Hasan et al. 2008).
Simpulan
Peningkatan suhu kalsinasi menyebabkan perubahan struktur TiO2, terjadi transformasi fase serta semakin kristal. Ukuran kristal sangat dipengaruhi oleh lebar puncak difraksi yang tertinggi dari setiap fase. Selain itu, peningkatan suhu sangat berpengaruh pada ukuran butir dan keterikatan antar butir TiO2. Semakin tinggi suhu maka ukuran butir semakin meningkat, demikian halnya dengan ukuran makin bertambah besar. Sifat optik TiO2 menunjukkan berada pada daerah UV, dengan koefisien absorpsi yang mengindikasikan terjadinya transisi langsung. Nilai energi gap sangat bergantung pada jenis transisi elektroniknya. Setiap perubahan kenaikan suhu menyebabkan energi gap menjadi semakin berkurang.
3
POTENSI FIKOSIANIN DARI MIKROALGA
Spirulina
platensis
SEBAGAI SENSITISER PADA DSSC
Pendahuluan
Fikosianin dapat dihasilkan dari beberapa jenis mikroalga yang mengandung pigmen biru yaitu kelas mikroalga Cyanophyceae. Fikosianin dan allofikosianin terdapat di dalam group Cyanobacteria yang mempertahankan hidupnya pada lapisan permukaan danau, rawa, kolam dan perairan laut. Lebih lanjut Hall dan Rao (1992) menyatakan bahwa fikosianin merupakan salah satu dari tiga pigmen (klorofil dan karotenoid) yang mampu menangkap radiasi yang tersedia dari matahari paling efisien dan bermanfaat dalam proses fotosintesis. Fikosianin merupakan kompleks pigmen protein yang saling berhubungan dan
13 terlibat dalam pemanenan cahaya, energi transduksi dan dapat bertindak sebagai bahan penyimpan nitrogen dan asam amino karena konsentrasi fikosianin tinggi bila ditumbuhkan dalam kondisi nitrogen yang optimal. Protein kompleks yang terdapat dalam Spirulina platensis lebih dapat dijadikan sumber kehidupan bagi makhluk hidup dan merupakan prekursor bagi klorofil dan hemoglobin karena mengandung magnesium dan besi yang merupakan pigmen biru yang secara struktural mirip dengan karoten, yang telah diketahui mampu meningkatkan aksi sistem kekebalan dan berperan aktif melindungi tubuh dari penyakit tertentu. Pigmen ini mempunyai fungsi sebagai pewarna alami untuk makanan (Yoshida et al. 1996), kosmetik (Cohen 1986), penelitian biomedis (Glazer 1994) dan obat-obatan khususnya sebagai pengganti pewarna sintetik dan mampu mengurangi obesitas (Bhat dan Madyastha 2001).
Fikosianin adalah pigmen yang paling banyak pada Spirulina (alga hijau biru) dan jumlahnya lebih dari 20% berat kering alga (Vonshack 1997). Fikosianin mempunyai absorbansi cahaya maksimum pada panjang gelombang 546 nm. Berat bobot molekul fikosianin (C-fikosianin) adalah sebesar 134 kDa, namun ditemukan bobot molekul yang lebih besar (262 kDa) dari ekstrak fikosianin segar pada banyak spesies. Bobot molekul yang lebih besar ini diduga disebabkan oleh keberadaan fragmen fikobilisom (Ó Carra et al. 1976).
Spirulina sp. merupakan organisme multiseluler yang merupakan alga hijau-biru. Tubuhnya berupa filamen berwarna hijau-biru berbentuk silinder dan tidak bercabang dan mengandung protein dalam jumlah yang cukup tinggi. Kandungan protein Spirulina bervariasi dari 50%, hingga 70% dari berat keringnya. Hasil analisis asam amino dari Spirulina mexican yang dikeringkan dengan spray dryer
ditemukan 18 asam amino (Oliverira et al. 2009). Spirulina sp. memiliki membran tilakoid. Pada membran tilakoid terdapat struktur granula berupa fikobilisom yang terdiri dari fikobiliprotein yang berfungsi untuk menyerap cahaya dan diduga dapat melindungi pigmen fotosintesis lainnya dari oksidasi pada cahaya berintensitas tinggi.
Spirulina dapat hidup di perairan tawar (S. fusiformis) maupun di air laut (S.platensis, S.maxima, dll). Jenis Spirulina tersebut dapat menghasilkan pigmen klorofil dan fikosianin. Pigmen fikosianin berwarna biru tua yang dapat memancarkan warna merah tua. Biliprotein atau biasa dikenal dengan fikobiliprotein adalah kelompok pigmen yang ditemukan pada Rhodophyta (alga merah), Cyanophyta (alga hijau-biru) dan Cryptophyta (alga crytomonad). Pigmen ini berfungsi sebagai penyerap cahaya pada sistem fotosintesis. Fikosianin termasuk golongan biliprotein. Kelompok pigmen ini diantaranya adalah R -phycoerythrin, C-phycoerythrin, B-phycoerythrin, allofikosianin, R-phycocyanin
dan C-phycocyanin. Bentuk lain dari fikosianin adalah allofikosianin, yang merupakan pelengkap biliprotein dalam jumlah sedikit pada mikroalga merah dan hijau-biru, sebagai penyalur energi di lokasi antara lamella klorofil-a dan fikobilisom lainnya. Energi cahaya yang diterima fikobilisomsiap ditransmisikan oleh allofikosianinke pusat reaksi. Allofikosianin dan C-fikosianinterdapat dalam semua jenis mikroalga yang mengandung fikobiliprotein(Li et al. 2007).
14
Gambar 8 Struktur molekul fikosianin (Kathiravan dan Renganathan 2009) Keberadaan gugus kromofor dan kemampuan fikosianin dalam menangkap cahaya matahari yang tinggi serta gugus karboksil fikosianin (-COOH) yang berperan penting untuk berikatan dengan permukaan semikonduktor tertentu (misalnya TiO2). Kedua faktor ini mendorong penelitain lebih lanjut untuk menjadikan fikosianin sebagai salah satu komponen dye sensitiser dalam pembuatan DSSC.
Bahan dan Metode
Bahan
Bahan yang digunakan untuk proses kultivasi dan pemanenan alga Spirulina platensis adalah air laut, NaOCl (klorin), Na2C2O3 (Natrium thiosulfat), media Zarrouk teknis modifikasi (MgSO4, CaCl2, FeCl3, EDTA/ Ethylenediaminetetra
acetic, Urea, ZA, NaHPO4, Vitamin B12), larutan bufer sodium fosfat 10 mM pH7 (Na2HPO4 dan NaH2POH2O), aluminium foil, inokulum kultur Spirulina platensis, etanol, aquades.
Metode
Proses kultivasi diawali dengan persiapan air meliputi penyaringan air laut menggunakan filter (50µm), penurunan salinitas air laut menjadi 15 ppt menggunakan water quality measurement (WQM) sambil ditambahkan air tawar untuk memperoleh salinitas yang diinginkan. Air laut yang telah diturunkan salinitasnya diaerasi 24 jam setelah ditambahkan NaOCl 60 ppm. Kemudian NaOCl dinetralkan kembali dengan menambahkan Na2C2O3 20 ppm sambil tetap diaerasi selama 24 jam.
Kultivasi Spirulina platensis dilakukan di dalam ruangan (di Laboratorium Bioteknologi Hasil Perairan II), menggunakan pupuk yang terdiri dari MgSO4, CaCl2, FeCl3, EDTA, Urea, ZA, NaHPO4,Vitamin B12. Kultivasi dilakukan pada suhu ruang. Selama kultivasi dilakukan pengukuran rapat optis (optical density
(OD)) kultur menggunakan spektrofotometer UV-Vis pada panjang gelombang 670 nm. Pengukuran rapat optis dilakukan setiap hari pada jam yang sama untuk menentukan waktu pemanenan.
15 Pemanenan Spirulina platensis. dilakukan saat kepadatan sel sudah cukup tinggi (rapat optis kultur >0,5). Pemanenan dilakukan dengan cara menyaring biomasa menggunakan kain nylon mesh dengan kerapatan 20 μm. Pengeringan biomasa S. platensis. dilakukan pada suhu ruang (25-300C).
Fikosianin diekstraksi (metode Lorenz) dari biomassa Spirulina sp.
menggunakan larutan buffer fosfat 10 mM pH 7. Prosedur ekstraksi dilakukan dengan cara menambahkan larutan buffer fosfat ke dalam biomassa kering S. platensis. yang akan diekstraksi. Campuran biomassa dan buffer fosfat dengan perbandingan 0.04 gr/1 ml (Lorenz 1998) dikocok menggunakan vorteks agar homogen. Sampel disimpan dalam lemari pendingin pada suhu 10oC selama 24 jam. Selanjutnya disentrifugasi untuk memisahkan fikosianin dari biomasa
Spirulina sp dengan kecepatan minimum 12.000 rpm selama 15 menit pada suhu 10oC. Kemudian memisahkan supernatan (bagian atas) cairan fikosianin berwarna biru dan natan (bagian bawah) berupa padatan. Fikosianin dikeringkan dengan cara freeze drying sampai pada suhu -50oC selama ± 104 jam, bentuk akhir berupa serbuk kering siap digunakan sebagai dye dalam perakitan sel surya.
Fikosianin hasil ekstraksi dengan massa 0,2 gram diencerkan dalam buffer posfat 2 ml sebanyak 3 kali pengenceran. Selanjutnya sampel tersebut diukur menggunakan spektrofotometer pada panjang gelombang 615 nm dan 620 nm, nilai optical density (OD) yang diperoleh pada masing-masing panjang gelombang untuk mengetahui konsentrasi fikosianin (PC) dengan menggunakan persamaan Bennet dan Bogorad (1973), yaitu:
𝑃𝐶 =(𝑂𝐷615) − 0,474 𝑂𝐷620
5,34 (4)
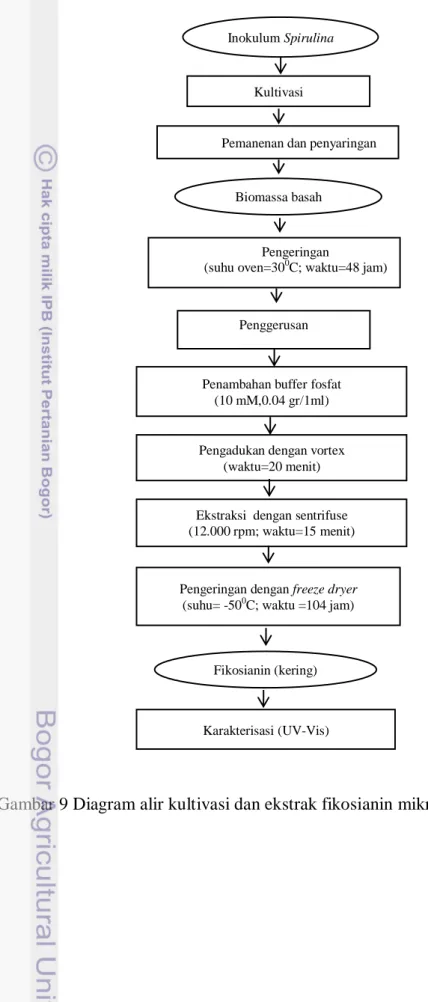
PC adalah konsentrasi fikosianin (mg/ml), OD615 adalah nilai absorbansi pada panjang gelombang 615 nm, dan OD620 adalah nilai absorbansi pada panjang gelombang 620 nm. Selanjutnya mengukur absorbansi dan emisi fikosianin menggunakan spektrofotometer UV-Vis. Diagram alir proses kultivasi dan ekstrak fikosianin disajikan pada Gambar 9.
Pengukuran fluoresensi menggunakan spektrofotometer (Ocean Optics USB 4000), dirangkai terlebih dulu dengan menghubungkan spektrofotometer ke komputer yang telah diinstal program SpectraSuite. Setelah itu tempat kuvet dihubungkan ke spektrofotometer, lalu dihubungkan juga dengan sumber cahaya. Proses pengukuran ini merupakan lanjutan dari pengukuran absorbansi (Gambar 1), akan tetapi sumber cahaya yang digunakan adalah laser. Laser disinari langsung terhadap kuvet yang berisi larutan klorofil tersebut, sehingga diperoleh kurva fluoresensi yang terbentuk pada komputer. Kurva fluoresensi yang terbentuk ditandai dengan adanya pendaran cahaya merah pada larutan fikosianin yang terkena laser tersebut. Data yang diperoleh adalah nilai fluoresensi dari konsentrasi fikosianin yang terukur.
16
Gambar 9 Diagram alir kultivasi dan ekstrak fikosianin mikroalga S. platensis
Inokulum Spirulina
Kultivasi
Pemanenan dan penyaringan
Biomassa basah
Pengeringan
(suhu oven=300C; waktu=48 jam)
Penambahan buffer fosfat (10 mM,0.04 gr/1ml)
Ekstraksi dengan sentrifuse (12.000 rpm; waktu=15 menit)
Penggerusan
Pengadukan dengan vortex (waktu=20 menit)
Pengeringan dengan freeze dryer (suhu= -500C; waktu =104 jam)
Fikosianin (kering)
17 Hasil dan Pembahasan
Rendemen Fikosianin S. platensis
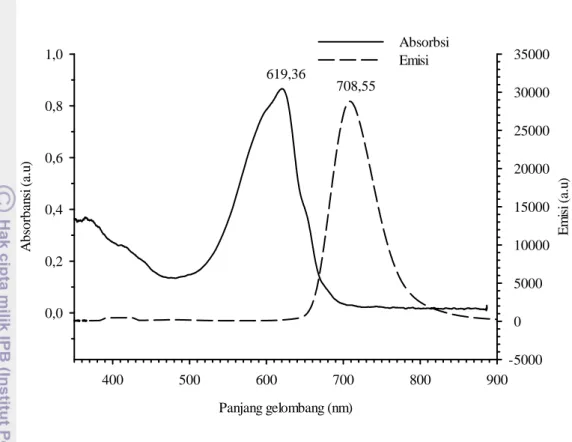
Kultivasi dilakukan dengan media MT (media teknis modifikasi Hastuti) dengan pemberian aerasi serta intensitas cahaya 3000 lux. Salinitas air laut yang digunakan sebesar 15 ppt. Kandungan garam yang terlalu tinggi dapat menyebabkan inokulum tidak mampu untuk bertahan hidup. Pertumbuhan kultur ditandai dengan perubahan nilai optical density (OD) yang meningkat dan mengindikasikan jumlah sel yang semakin padat. Kandungan nutrien dari media MT yang digunakan berupa nitrogen (berasal dari urea) merupakan salah satu faktor yang memicu pertumbuhan sel.
Gambar 10 Sel fikosianin Spirulina platensis
Waktu (Hari) 0 2 4 6 8 10 12 OD 670 nm (a .u ) 0,0 0,2 0,4 0,6 0,8 1,0 1,2
18
Bentuk sel berupa benang yang memanjang, filamen berwarna hijau-biru berbentuk silinder dan tidak bercabang (Gambar 10). Pengamatan kepadatan sel dilakukan setiap 24 jam pada jam yang sama dengan menggunakan spektrofotometer. Kepadatan sel optimum ( fase stasioner) pada hari ke-8 dengan nilai OD > 0,5. Pada keadaan tersebut, kultur dapat dipanen dengan menggunakan
nylon mesh.
Pemisahan pigmen fikosianin dari biomassa tersebut dilakukan melalui proses yang disebut ekstraksi. Achmadi (1992) menyatakan bahwa proses ekstraksi bertujuan untuk memperoleh ekstrak murni atau ekstrak yang hanya terdiri dari satu komponen tunggal. Ekstraksi dapat dilakukan dengan menggunakan aquades dan bufer posfat. Pada penelitian ini digunakan bufer posfat 10 mM dengan pH 7 dengan cara organic phase. Hal ini bertujuan untuk menentukan konsentrasi fikosianin (PC) dan kemurnian fikosianin (Silveira et al. 2007). Inokulum S.platensis yang dikultur dari 80 liter dihasilkan berat kering biomassa 10,46 gram dan bobot fikosianin dalam bentuk bubuk kering 5,50 gram. Berdasarkan jumlah bobot kering yang dihasilkan menunjukkan bahwa metode MT cukup optimum untuk menghasilkan fikosianin. Bahan yang digunakan cenderung lebih murah (bahan teknis) serta kultivasi dapat dilakukan di dalam ruangan.
Sifat Optik Fikosianin
Fikosianin adalah penyimpan cadangan nitrogen dan asam amino serta merupakan pigmen fotosintetik utama pada Spirulina. Fikosianin merupakan protein yang bersifat larut air yang dapat dibebaskan secara sederhana yaitu oleh penghancuran mekanis, seperti perlakuan pembekuan kemudian dicairkan ( freeze-thaw). Fikosianin banyak digunakan sebagai pewarna alami untuk bahan pangan. Keberadaan pigmen fikosianin ini mampu menyerap cahaya yang datang.
Pigmen fikosianin merupakan kelompok pigmen fikobiliprotein yang dipisahkan menjadi dua kelompok utama berdasarkan warnanya. Kelompok pertama adalah fikoeritrin, yaitu pigmen berwarna merah bila terkena cahaya dan memancarkan cahaya pendar berwarna kuning-oranye. Kelompok kedua adalah fikosianin, yaitu pigmen berwarna biru dan memancarkan cahaya pendar merah kuat. Pigmen ini di Spirulina berfungsi sebagai pigmen asesoris yang membantu klorofil sebagai penyerap cahaya pada sistem fotosintesis (Ó Carra & Ó hEocha 1976).
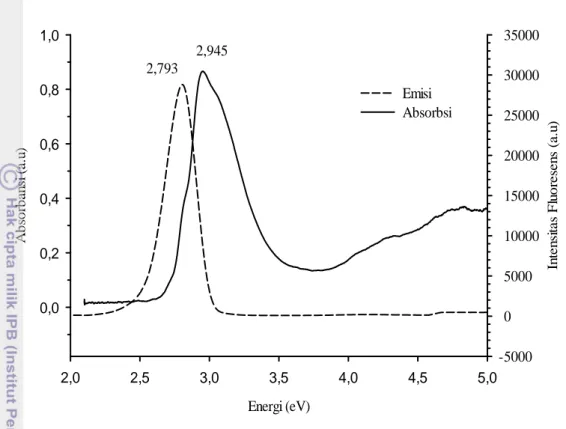
Serapan merupakan kuantitas yang menyatakan kemampuan bahan dalam menyerap cahaya. Senyawa organik mampu menyerap cahaya karena mengandung elektron valensi yang dapat dieksitasi ke tingkat energi yang lebih tinggi. Salah satu senyawa organik tersebut adalah fikosianin. Spektrum serapan yang diperoleh dari hasil ekstrak fikosianin dengan warna biru pekat ditunjukkkan pada Gambar 12.
19 Panjang gelombang (nm) 400 500 600 700 800 900 A b so rb an si ( a.u ) 0,0 0,2 0,4 0,6 0,8 1,0 E m is i ( a.u ) -5000 0 5000 10000 15000 20000 25000 30000 35000 Absorbsi Emisi 619,36 708,55
Gambar 12 Perbandingan spektrum absorpsi dan emisi fikosianin Ketika fikosianin diiluminasi cahaya maka akan menyerap foton sehingga terjadi eksitasi elektron ke level LUMO. Elektron kembali ke keadaan dasar sambil mengemisikan cahaya (fluoresensi). Gambar 12 memperlihatkan serapan dan emisi sampel larutan pigmen fikosianin yang diukur dari panjang gelombang 400 nm hingga 700 nm. Pada gambar tampak jelas bahwa karakteristik puncak serapan berada pada wilayah spektrum cahaya tampak (visible). Spektrum serapan (absorpsi) dan emisi (fluoresens) ekstrak fikosianin ditunjukkan pada Gambar 12.
Soret band fikosianin berada pada panjang gelombang 619,36 nm dan Q band maksimum pada panjang gelombang 708,55 nm. Soret band merupakan keadaan fikosianin yang mampu menyerap foton dan bergeser pada panjang gelombang yang lebih pendek atau energi yang lebih besar. Q band adalah keadaan maksimum ketika fikosianin bergeser pada panjang gelombang yang lebih besar atau energi yang lebih kecil. Hal ini disebabkan adanya perbedaan keadaan elektronik fikosianin ketika diiluminasi cahaya.
Gambar 13 memperlihatkan perbedaan energi relaksasi antara keadaan absorpsi dan emisi fikosianin. Nilai pergeseran Stokes berdasarkan perbedaan transisi absorpsi dan emisi fikosianin adalah 0,152 eV. Keadaan absorpsi dengan energi relaksasi 2,945 eV dan spektrum emisi tertinggi yang bersesuaian dengan energi relaksasi 2,793 eV. Pergeseran Stokes ini terjadi karena struktur relaksasi fikosianin pada keadaan dasar (ground state) berbeda jika dibandingkan dengan struktur relaksasi pada keadaan tereksitasi. Nilai pergeseran panjang gelombang tersebut menunjukkan bahwa fikosianin mampu memanen cahaya tampak yang paling banyak dipancarkan oleh sinar matahari. Berbeda dengan dyesintetis yang mampu menyerap sampai panjang gelombang infra merah, sehingga akumulasi elektron juga lebih besar.
20 Energi (eV) 2,0 2,5 3,0 3,5 4,0 4,5 5,0 In te n si ta s F lu or e se n s ( a .u ) -5000 0 5000 10000 15000 20000 25000 30000 35000 A bs or ba n si ( a .u ) 0,0 0,2 0,4 0,6 0,8 1,0 Emisi Absorbsi 2,793 2,945
Gambar 13 Plot energi (hv) vs absorbansi dan flouresens fikosianin Transisi elektronik merupakan penyebab terjadinya transisi absorpsi tersebut. Lebar spektrum ditentukan transisi elektron dari satu keadaan energi ke keadaan yang lain, serta meliputi beberapa keadaan vibrasi. Peristiwa ini terjadi karena perbedaan energi antara dua keadaan yang berdekatan karena keadaan vibrasi yang lebih kecil jika dibandingkan dengan keadaan elektroniknya. Kedua karakteristik ini menunjukkan bahwa fikosianin mampu menyerap cahaya yang datang serta memancarkan kembali cahaya yang diterima. Hal ini merupakan salah satu karakteristik pigmen yang cocok digunakan sebagai sensitiser dalam sel surya.
Simpulan
Fikosianin yang dikarakterisasi berdasarkan sifat optiknya, diperoleh bahwa daerah absorpsi dan emisi berada pada daerah cahaya tampak. Jenis fikosianin tersebut adalah C-fikosianin sehingga menyerap kuat pada panjang gelombang kuning dan orange serta memancarkan cahaya pendar merah. Hasil karakterisasi menunjukkan bahwa fikosianin merupakan salah satu pigmen yang mampu dijadikan sebagai dye sensitiser dalam pembuatan sel surya DSSC.