RINGKASAN
DONA MARINA. D24080159. 2012. Kualitas Spermatozoa Kelinci Peranakan New Zealand White yang Diberi Pelet Ransum Komplit Mengandung Daun Indigofera zollingeriana dan Leucaena leucocephala. Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Luki Abdullah, M.Sc. Agr. Pembimbing Anggota : Prof. Dr. drh. M. Agus Setiadi
Upaya peningkatan produktivitas ternak dalam rangka swasembada daging di Indonesia telah banyak dilakukan, salah satunya dengan mengembangkan ternak kelinci sebagai salah satu hewan ternak yang memiliki daging dengan kandungan protein yang tinggi dan rendah kolesterol. Peningkatan produktivitas dan perkembangbiakan ternak kelinci menjadi faktor penting. Oleh karena itu berbagai upaya dilakukan untuk memilih pakan yang tepat untuk ternak kelinci.
Penelitian dilaksanakan dari bulan November sampai Januari 2012 di Laboratorium Lapang Bagian Produksi Ternak Ruminansia Kecil Fakultas Peternakan IPB, sedangkan evaluasi kualitas semen dilakukan di Laboratorium Unit Rehabilitasi Reproduksi FKH IPB. Penelitian ini menggunakan 20 ekor kelinci jantan peranakan New Zealand White umur 4 bulan dengan bobot rata-rata 1653,36±265,46 g/ekor. Rancangan percobaan yang digunakan Rancangan Acak Kelompok (RAK), dengan lima perlakuan dan empat kelompok. Perlakuan yang diberikan antara lain R0 (pelet ransum komersil), R1 (pelet ransum komplit mengandung 30% daun lamtoro), R2 (pelet ransum komplit mengandung 20% daun lamtoro dan 10% daun I. zollingeriana), R3 (pelet ransum komplit mengandung 10% daun lamtoro dan 20% I. zollingeriana), R4 (pelet ransum komplit mengandung 30% daun I. zollingeriana). Data yang diperoleh dianalisis dengan menggunakan statistika deskriptif. Peubah yang diamati adalah kualitas makroskopik semen (volume, warna, pH, konsistensi) dan kualitas mikroskopik semen (gerakan massa, konsentrasi spermatozoa, persentase motilitas, viabilitas, abnormalitas dan HOS Test).
Kisaran persentase motilitas, viabilitas dan abnormalitas berturut-turut sebesar 0%-70%, 46,88%-94,33%, 2,87%-19,33%. Hasil yang cenderung tidak berbeda juga ditunjukkan pada parameter kualitas makroskopik semen dan gerakan massa semen. Pemberian pelet ransum komersil pada kelinci memiliki pengaruh rataan persentase viabilitas dan persentase motilitas yang lebih rendah dibandingkan pelet ransum komplit berbasis daun Indigofera zollingeriana dan lamtoro serta memiliki rataan persentase abnormalitas yang lebih tinggi dibandingkan pelet ransum komplit berbasis daun Indigofera zollingeriana dan lamtoro (Leucaena leucocephala).
Dapat disimpulkan bahwa kualitas ransum perlakuan relatif sama dalam menunjang kualitas makroskopik dan mikroskopik semen kelinci. Daun Indigofera zollingeriana dan daun lamtoro tidak memberikan pengaruh negatif terhadap kualitas spermatozoa kelinci.
ABSTRACT
Sperm Quality of New Zealand White Crossbred Rabbit Fed with Complete Ration Containing Indigofera zollingeriana and Leucaena leucocephala Leaves
D. Marina, L. Abdullah and M. A. Setiadi
The experiment was conducted to study the effect of feeding complete ration in pellet form containing Indigofera zollingeriana and lamtoro (Leucaena leucocephala) leaves on sperm quality of New Zealand White crossbred rabbits. The rabbits were grouped according into 5 treatments with 4 replications. The treatments were R0 (commercial fed), R1 (complete ration containing 30% lamtoro leaves), R2 (complete ration containing 20% lamtoro leaves and 10% Indigofera leaves), R3 (complete ration containing 10% lamtoro leaves and 20% Indigofera. leaves), R4 (complete ration containing 30% Indigofera leaves). All of rations were fed to tested rabbits for 60 days, with preliminary trial period for 14 days. Semen was collected and its quality according to treatment were analyzed macroscopically and microscopically. The data were analyzed with statistic of descriptive. The results showed that there were no significant effect among given ration on sperm motility, viability and abnormality percentage of the rabbits. The range of percentage sperm motility, viability and abnormalities were 0%-70%, 46.88%-94.33%, 2.87%-19.33%, respectively. It is concluded that all complete rations containing Indigofera zollingeriana and lamtoro leaves played positive role on spermatogenesis in rabbit.
PENDAHULUAN
Latar Belakang
Kebutuhan masyarakat terhadap daging hingga saat ini masih tinggi, namun
produksi daging yang dihasilkan masih rendah dan tidak terjangkau oleh kalangan
masyarakat golongan menengah ke bawah. Upaya peningkatan produktivitas ternak
dalam rangka swasembada daging di Indonesia telah banyak dilakukan, salah satunya
dengan mengembangkan ternak kelinci sebagai salah satu ternak alternatif yang
menghasilkan daging dengan kandungan protein yang tinggi dan rendah kolesterol.
Peningkatan produktivitas dan perkembangbiakan ternak kelinci merupakan aspek
penting yang harus didukung oleh ketersediaan pakan murah dan berkualitas.
Berbagai upaya dilakukan untuk mendapatkan pakan kelinci yang ekonomis dan
mudah didapat. Salah satu upaya menekan harga pakan dengan memanfaatkan
sumber pakan hijauan lokal yang berkualitas tinggi seperti Indigofera zollingeriana
dan Leucaena lecocephala (Lamtoro).
I. zollingeriana adalah salah satu jenis leguminosa pohon yang relatif baru
dikembangkan di Indonesia. Indigofera jenis leguminosa pohon ini cocok
dikembangkan di Indonesia karena toleran terhadap musim kering, genangan air, dan
tahan terhadap salinitas (Hassen et al., 2007). Selain itu pertumbuhan sangat cepat,
adaptif terhadap tingkat kesuburan rendah, mudah dan murah pemeliharaannya.
Hijauan ini memiliki kandungan protein cukup tinggi yaitu setara dengan alfalfa
berkisar 23%-27% yang optimal bagi ternak. Tepung daun Indigofera zollingeriana
mengandung protein kasar sekitar 23,40%-27,60%, NDF 51,16%-59,97%, kecernaan
in vitro bahan organik berkisar 77,46%-80,47% (Abdullah dan Suharlina, 2010).
Selain itu tepung daun Indigofera zollingeriana memiliki kandungan mineral yang
cukup untuk pertumbuhan optimal ternak, yaitu Ca 1,78%, P 0,34%, Mg 0,51%
(Abdullah, 2010).
Ketersediaan I. zollingeriana yang masih terbatas mengharuskan adanya
penelitian lebih lanjut untuk mendapatkan informasi mengenai kultur tanaman yang
efisien, produk olahan hijauan dan penggunaannya untuk ternak ruminansia. Hijauan
ini sebagai alternatif pengganti sumber nutrisi (protein) pada konsentrat yang
harganya semakin lama semakin meningkat. Sumber hijauan pakan lokal yang
akan protein, karoten, vitamin, dan mineral. Lamtoro memiliki kandungan protein
yang tinggi (21%), kandungan NDF sebesar 4,28% sedangkan kandungan asam
aminonya cukup tinggi (Mtenga dan Laswai, 1994). Penggunaan daun lamtoro dalam
ransum lebih dari 30%, secara langsung dapat merontokkan bulu dan menurunkan
konsumsi bahan kering karena terdapat kandungan antinutrisi yaitu mimosin
(Onwudike, 1995). Oleh Karena itu, pengkombinasian lamtoro dan I. zollingeriana
merupakan hal baru dalam pelet ransum komplit untuk ternak kelinci yang
diharapkan mampu memperbaiki kualitas nutrisi. Pada penelitian sebelumnya
pemberian ransum dengan 40% pelet Indigofera sp. pada ransum ternak kambing PE
Saanen pada peternakan Bangun Karso Farm dapat meningkatkan kecernaaan pakan
dan produksi susu (Apdini, 2011). Pemberian pelet berbasis Indigofera zollingeriana
dan daun lamtoro pada ternak kelinci untuk mengetahui pengaruhnya terhadap
gambaran kualitas mikroskopis dan makroskopis semen kelinci jantan peranakan
New Zealand White belum pernah dilakukan.
Tujuan
Penelitian ini bertujuan untuk membandingkan pengaruh perlakuan
pemberian pelet ransum komplit yang mengandung daun Indigofera zollingeriana
dan Leucaena leucocephala pada taraf yang berbeda terhadap gambaran kualitas
TINJAUAN PUSTAKA
Indigofera zollingeriana
Ransum bentuk pelet merupakan ransum yang terdiri dari bahan-bahan baku
yang diolah melalui proses mekanik, yaitu dipadatkan dan ditekan oleh roller dan
die, sehingga membentuk silinder atau batangan kecil. Dozier (2001) menyatakan
bahwa ransum dalam bentuk pelet dapat meningkatkan ketersediaan nutrisi dalam
pakan, mempermudah penanganan sehingga menurunkan biaya produksi dan
mengurangi penyusutan. Berbagai bahan pakan ternak baik biji-bijian maupun
hijauan dapat dibentuk menjadi pelet sehingga memiliki komposisi bahan yang lebih
padat dan tidak mengubah kandungan bahannya. Salah satu hijauan yang berpotensi
diproses menjadi pelet adalah Indigofera zollingeriana yang akan digunakan sebagai
pakan sumber protein karena memiliki kandungan protein kasar sebanyak 25,66%
(Abdullah, 2010).
Indigofera adalah genus besar dari sekitar 700 jenis tanaman berbunga milik
keluarga Fabaceae (Schrire, 2005). Indigofera adalah genus dengan sekitar 700
spesies yang tersebar secara geografis di Afrika tropis, Asia, Australia dan Amerika
Utara dan Selatan. Banyak spesies di Afrika dan Asia telah dilaporkan berguna untuk
makanan ternak (misalnya hirsuta I., Agrimonia I., I. syn schimperi. I. oblongifolia, I.
spicata dan sin I. subulata. I. trita), pupuk hijau atau sebagai tanaman penutup
(misalnya I. hirsuta dan I. trita). Khas dari Leguminosa ini, Indigofera tinggi protein,
dan kemampuan mereka untuk bertahan terhadap kekeringan, banjir, dan salinitas
membuat agronominya sangat diinginkan (Hassen et al., 2007).
Terdapat di seluruh daerah tropis dan subtropis di dunia, dengan beberapa
jenis mencapai zona di kawasan timur Asia. Indigofera memberikan peluang yang
menjanjikan dalam hal pemenuhan kebutuhan ternak ruminansia terhadap
penyediaan hijauan pakan. Menurut Hassen et al. (2008) produksi BK tanaman
Indigofera sp. adalah sebesar 2.728 kg/ha/tahun. Indigofera sp. memiliki kandungan
protein yang tinggi, toleran terhadap musim kering, genangan air, dan tahan terhadap
salinitas. Menurut Hassen et al. (2008) kandungan protein kasar Indigofera sp.
adalah sebesar 24,3%. Selain itu tepung daun Indigofera memiliki kandungan
0,19%-0,33%, Mg 0,21%-1,07%, Cu 9,0-15,3 ppm, Zn 27,2-50,2 ppm, dan Mn
jenis : Indigofera zollingeriana
Saat akar terdalamnya dapat tumbuh kemampuannya utnuk merespon curah
hujan yang kurang dan ketahanan terhadap herbivore merupakan potensi yang baik
sebagai cover crop (tanaman penutup tanah) untuk daerah semi- kering dan daerah
kering (Hassen et al., 2004; 2006). Produksi bahan kering (BK) total Indigofera
zollingeriana adalah 51 ton/ha/tahun (Abdullah, 2010).
Daun Lamtoro
Lamtoro (Leucaena leucocephala) merupakan legum pohon yang produktif
menghasilkan hijauan, tahan pemotongan, dan pengembalaan berat, dan sebagai
pakan tambahan yang berkualitas tinggi. Lamtoro merupakan tanaman alternatif
yang dapat digunakan untuk menutup kekurangan jumlah ataupun kualitas hijauan
pada musim paceklik. Tanaman lamtoro dapat diberikan kepada ternak berupa
hijauan segar, kering, tepung, silase, dan pelet. Hijauan lamtoro sangat baik sebagai
pakan ternak, dikarenakan daun lamtoro kaya akan protein, karoten, vitamin, dan
mineral (Soeseno dan Soedaharoedjian, 1992). Menurut Mtenga dan Laswai (1994),
lamtoro memiliki kandungan protein yang tinggi (21%), kandungan NDF sebesar
4,28% sedangkan kandungan asam aminonya cukup tinggi dan juga memiliki
antinutrisi seperti mimosin dan tanin
Menurut Onwudike (1995), pelet berbasis daun lamtoro lebih disukai oleh
kelinci dibandingkan daun gamal, namun pemberian daun lamtoro dapat mengurangi
pertumbuhan bobot badan, konsumsi pakan, dan efisiensi pakan. Daun lamtoro
mengandung mimosin yang menyebabkan kerontokan dan reddish (urin berwarna
direkomendasikan tidak lebih dari 50% total ransum. Wood et al. (2003) menyatakan
bahwa terjadi penurunan kadar mimosin daun lamtoro akibat pemanasan pada suhu
60 °C dan 145 °C yaitu sebesar 43%. Selain itu, terjadi inaktivasi mimosin akibat
proses pelleting.
Pengaruh yang merugikan daun lamtoro pada sapi dapat menyebabkan
gondok (Jones et al., 1976), menurunnya fertilitas dan penyusutan berat lahir
(Hamilton et al., 1971; Helmes, 1980). Uji ini dilakukan di Australia dan Papua New
Guinia dengan menggembalakan sapi-sapi percobaan padang lamtoro, sementara itu
kerontokan bulu dan anak-anak yang dilahirkan berkurang terjadi pula pada kelinci
yang diberi pakan daun lamtoro (Ruskin, 1984). Penelitian lain menyatakan,
pemberian tepung daun lamtoro 15% menyebabkan terhambatnya kemampuan
bereproduksi. Terbukti tikus betina menjadi infertil, prenatal dan pada tikus jantan
libido serta fertilitasnya turun setelah diberii pakan mengandung daun lamtoro (Joshi,
1968). Namun demikian, pemberian daun lamtoro dengan level 100-300 g/ekor/hari
secara signifikan mampu meningkatkan konsentrasi spermatozoa domba di daerah
tropis Etiopia (Dana et al., 2000).
Pelet
McEllhiney (1994) menyatakan bahwa pelet merupakan hasil proses
pengolahan bahan baku ransum secara mekanik yang didukung oleh faktor kadar air,
panas dan tekanan. Pelet adalah ransum yang dibuat dengan menggiling bahan baku
yang kemudian dipadatkan menggunakan die dengan bentuk, diameter, panjang dan
derajat kekerasan yang berbeda (Pond et al., 1995).
Ternak kelinci lokal yang diberi ransum komplit berbasis bahan baku lokal
berbentuk pelet, yang tersusun dari bungkil inti sawit dan daun ubi jalar
menghasilkan rataan pertambahan bobot badan (PBB) sebesar 17,9 g dan efisiensi
pakan sebesar 0,17 (Mulia, 2009). Performa kelinci yang diberi pakan berupa pelet
lebih baik dibandingkan dengan kelinci yang diberi pakan berupa butiran atau mash,
hal ini dikarenakan ternak tidak mempunyai kemampuan untuk menyortir pakan
Kelinci
Spesies kelinci sangat banyak, lebih dari 20 spesies dan masing-masing
spesies memiliki ragam warna tersendiri yang dapat mencapai lebih dari 20 warna
berbeda. Kelinci tipe pedaging biasanya besar, memiliki bobot badan berat, dan
tumbuh cepat, seperti Flemish Giant (Vlaamse Reus), Chinchilla Giant, New Zaeland
White, English Spot (Raharjo, 1994).
Klasifikasi kelinci menurut Lebas et al. (1986) adalah sebagai berikut:
Kingdom : Animal
Kelinci merupakan ternak yang cocok dipelihara di Negara berkembang dan
mulai memanfaatkan kelinci sebagai sumber daging. Selain itu, kelinci juga memiliki
potensi: 1) ukuran tubuh yang kecil, sehingga tidak memerlukan banyak ruang, 2)
Orictolagus cuniculus dari genus Orictolagus. El-Raffa (2004) menyatakan bahwa
kelinci memiliki potensi sebagai penghasil daging dan dapat menjadi solusi dalam
memenuhi kebutuhan protein hewani karena memiliki kemampuan efisiensi produksi
dan reproduksi yang patut dipertimbangkan.
Kebutuhan Nutrisi Kelinci
Menurut Cheeke (1987), kebutuhan protein kelinci berkisar antara 12%-18 %,
tertinggi pada fase menyusui (18%) dan terendah pada dewasa (12%), kebutuhan
serat kasar induk menyusui, bunting dan muda (10%-12%), kebutuhan serat kasar
tidak berbeda (2%). Kebutuhan nutrisi untuk ternak kelinci yang sedang tumbuh,
yaitu sebesar 16% protein kasar, 10%-12% serat kasar, 3%-5% lemak kasar, dan
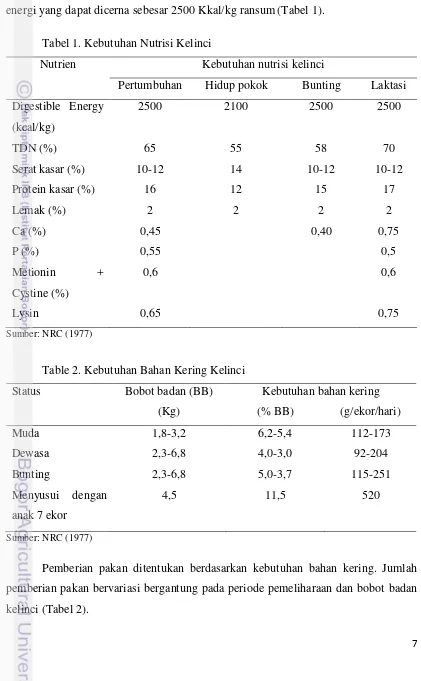
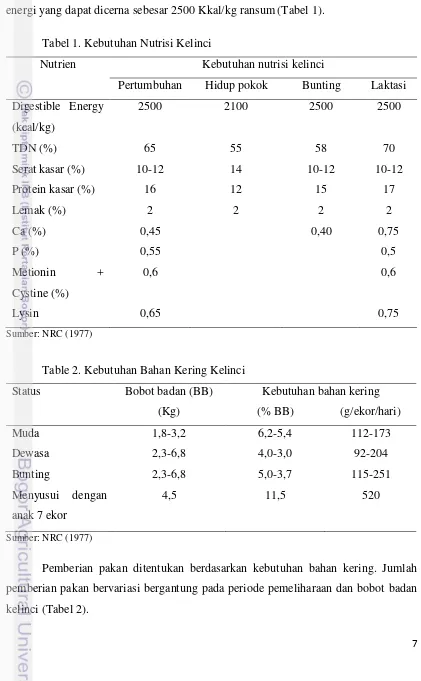
energi yang dapat dicerna sebesar 2500 Kkal/kg ransum(Tabel 1).
Tabel 1. Kebutuhan Nutrisi Kelinci
Nutrien Kebutuhan nutrisi kelinci
Pertumbuhan Hidup pokok Bunting Laktasi
Digestible Energy
Pemberian pakan ditentukan berdasarkan kebutuhan bahan kering. Jumlah
pemberian pakan bervariasi bergantung pada periode pemeliharaan dan bobot badan
Semen
Semen adalah cairan yang disekresikan dari alat kelamin jantan yang secara
alami diejakulasikan ke dalam saluran kelamin betina sewaktu kopulasi (Toelihere,
1981). Semen terdiri dari dua bagian, yaitu spermatozoa dan plasma semen, dimana
spermatozoa bersuspensi di dalam plasma semen yang berbentuk semi gelatinuous.
Plasma semen merupakan suatu cairan atau medium yang berfungsi sebagai medium
pembawa spermatozoa dari saluran reproduksi jantan ke dalam saluran reproduksi
hewan betina (Hafez dan Hafez, 2000).
Spermatozoa dihasilkan melalui proses spermatogenesis di dalam testis
kemudian disimpan dan mengalami pematangan di dalam epididimis. Sedangkan
plasma semen merupakan campuran sekresi yang dihasilkan oleh epididimis dan
kelenjar-kelenjar pelengkap, yaitu vesikularis dan prostat (Hafez dan Hafez, 2000).
Spermatozoa normal terdiri dari kepala dan ekor. Kepala spermatozoa
memanjang, oval dengan ujung kepala yang tumpul. Kepala spermatozoa terisi
dengan materi inti, mengandung kromosom DNA yang membawa informasi genetik
(Hafez dan Hafez, 2000). Bagian ekor spermatozoa terdiri dari bagian leher, bagian
tengah, bagian utama, dan bagian ujung yang berasal dari sentriol spermatid selama
spermiogenesis (Toelihere, 1993).
Menurut Toelihere (1993), nutrisi sangat mempengaruhi kualitas dan
kuantitas semen yang dihasilkan. Selain nutrisi, faktor lingkungan juga sangat
mempengaruhi kualitas semen terutama suhu dan musim. Suhu lingkungan yang
terlampau rendah atau tinggi dapat mempengaruhi reproduksi hewan jantan. Suhu
udara yang tinggi dapat menyebabkan penurunan fertilitas spermatozoa.
Tabel 3. Karakteristik Semen Kelinci di Perkembangbiakan Pertama
Keterangan Jumlah
Umur (bulan) 4-12
Bobot badan Variasi
Volume ejakulat (ml) 0,4 – 0,6
Konsentrasi Spermatozoa 0,5-0,3 x 108 per ml
Menurut Hafez dan Hafez (2000), bahwa kualitas dan kuantitas spermatozoa
yang dihasilkan dipengaruhi oleh makanan, suhu dan musim, frekuensi ejakulasi dan
libido, penyakit dan benih penyakit, pengangkutan, umur, hereditas dan gerak badan.
Volume semen
Volume ejakulasi yang diperoleh bervariasi tergantung pada ras kelinci
tersebut yakni antara 0,2-3,0 ml untuk kelinci ukuran kecil (Morrow, 1986). Kisaran
rataan volume semen yang didapat oleh penelitian terdahulu mengenai pengaruh
karakter plasma semen terhadap reproduksi kelinci betina yaitu sebesar 0,67 ml pada
kelinci New Zealand White (Brun et al., 2002). Volume semen sangat dipengaruhi
oleh aktivitas jaringan pada kelenjar-kelenjar tersebut (Elya et al., 2010).
pH Semen
Nilai pH dipengaruhi oleh komposisi cairan yang tergabung dalam semen.
Kebanyakan semen yang dikumpulkan memiliki pH yang lebih condong kearah asam
dengan variasi pH sekitar 6,5-6,9, tetapi pHnya bervariasi dengan kisaran yang luas,
dari sekitar 6 atau dibawahnya sampai 8 atau sedikit diatasnya. Semen berkualitas
baik biasanya lebih kearah asam (pH rendah) dari pada semen dengan konsentrasi
spermatozoa yang rendah. Semen berkualitas jelek mengandung cairan yang banyak
jumlahnya berasal dari uretralis dan kelenjar-kelenjar pelengkap, sehingga memiliki
pH yang tinggi (Salisbury dan Vandemark, 1985). Nilai pH semen kelinci rata-rata
6,9 (Paufler et al., 1974). Kisaran pH semen yang diperoleh penelitian terdahulu
mengenai pengaruh karakter plasma semen terhadap reproduksi kelinci betina yaitu
sebesar 7,18 pada kelinci New Zealand White (Brun et al., 2002). Menurut Yousef et
al. (2000), pH kelinci New Zealand White yang diberi penambahan vitamin E (1,0
g/l), vitamin C (1,5 g/l) serta kombinasi keduanya (1 g/l vitamin E dan 1,5 g/l )
dalam air minum masing-masing adalah sebesar 8,0; 8,1 dan 8,1.
Nilai pH semen juga ditentukan oleh aktivitas kelenjar assesorius. Nilai pH
semen ditentukan oleh keseimbangan kation dan anion yang terdapat dalam struktur
kimia yang terkandung dalam kelenjar assesorius. Tidak terdapatnya perubahan yang
nyata pada volume serta pH semen berarti bahwa kelenjar assesorius masih bisa
Warna Semen
Warna semen sangat dipengaruhi oleh konsentrasi spermatozoa yang
terkandung di dalam semen. Semakin keruh biasanya jumlah spermatozoa
per-mililiter semen semakin banyak (Partodihardjo, 1982). Semen normal memiliki
warna seperti susu atau krem keputih-putihan dan keruh (Toelihere, 1981).
Ditemukan juga hewan yang menghasilkan semen normal berwarna kuning. Warna
kuning merupakan warna yang normal dan tidak berpengaruh jelek terhadap
spermatozoa dan tidak mempengaruhi fertilitas pejantan. Zat warna riboflavin dalam
semen akan kehilangan zat warna karena sinar alam dan sinar buatan. Zat warna tadi
akan nampak kembali bila diberi zat alkali. Sebagian dari zat warna di dalam cairan
vesicula seminalis adalah flavin, adeneisoalloazine dinucleotide (Salisbury dan
Vandemark, 1985). Semen normal tampak putih kelabu homogen. Semen tampak
jernih jika jumlah sperma terlalu sedikit atau tampak coklat jika ada sel darah merah
(Elya et al., 2010).
Konsistensi Semen
Konsistensi adalah derajat kekentalan (Partodihardjo, 1982). Menurut
Morrow (1986), volume ejakulat kelinci sebanyak 0,5-1,5 ml dengan jumlah
spermatozoa sebesar 10-1000 x 106/ejakulat. Konsentrasi spermatozoa berkisar
0,1-1,0 juta/ml dan persentase motilitas berkisar 40%-80%. Lebih lanjut diesebutkan
bahwa volume ejakulat untuk kelinci ras New Zealand White 0,86 ml dengan
konsentrasi spermatozoa sebesar 0,31 x 106/µl dan persentase motilitas sebesar 55%.
Data ini diperoleh pada pengambilan sampel sebanyak 45 sampel (Paufler et al.,
1974). Konsistensi semen sangat dipengaruhi oleh konsentrasi spermatozoa yang
terkandung di dalam semen, semakin banyak jumlah spermatozoa di dalam semen,
maka konsistensi semen akan semakin kental (Sansone, 2000).
Gerakan Massa Semen
Spermatozoa dalam suatu kelompok memiliki kecenderungan untuk bergerak
bersama-sama ke satu arah dan membentuk gelombang-gelombang yang tebal atau
tipis, bergerak cepat atau lambat tergantung dari konsentrasi spermatozoa hidup di
dalamnya. Gerakan massa spermatozoa dapat dilihat dengan jelas di bawah
(Toelihere, 1981). Pengamatan gerakan massa bertujuan untuk menilai motilitas
spermatozoa. Semakin besar pergerakan gelombang yang terjadi, semakin tinggi
motilitas dan konsentrasi spermatozoa (Salisbury dan VanDemark, 1985).
Konsentrasi Spermatozoa
Kisaran konsentrasi spermatozoa yang diperoleh penelitian terdahulu
mengenai pengaruh karakter plasma semen terhadap reproduksi kelinci betina yaitu
sebesar 403 x 106/ml pada kelinci New Zealand White (Brun et al., 2002). Yousef et
al. (2000) menyatakan, konsentrasi spermatozoa kelinci New Zealand White yang
diberi penambahan vitamin E (1,0 g/l), vitamin C (1,5 g/l) serta kombinasi keduanya
(1 g/l vitamin E dan 1,5 g/l ) dalam air minum masing-masing adalah sebesar 336 x
106/ml, 332 x 106/ml, 332 x 106/ml.
Konsentrasi spermatozoa juga dipengaruhi oleh kadar hormon testosteron.
Kadar testosteron yang tinggi menyebabkan terjadinya mekanisme umpan balik
negatif terhadap hipotalamus dan hipofisis. Testosteron akan menghambat
hipotalamus untuk menghasilkan GnRH sehingga kadar GnRH turun dan
menghambat hipofisis anterior untuk menghasilkan FSH dan LH. Bila FSH turun
maka terjadi gangguan pada sel sertoli yang menyebabkan berkurangnya zat-zat
makanan yang diperlukan untuk proliferasi, diferensiasi serta memelihara sel-sel
spermatogenik (Steven et al., 1974).
Meningkatnya konsentrasi spermatozoa umumnya dianggap bermanfaat
karena memungkinkan inseminasi dari sejumlah besar betina (Foote, 1980). Saat
kawin alam konsentrasi spermatozoa yang lebih tinggi memastikan masuknya
spermatozoa lebih ke dalam serviks dan kemudian ke saluran telur, sehingga
meningkatkan kesempatan terjadinya pembuahan (Garner dan Hafez, 1980).
Menurut Nadir et al. (1993), semakin tinggi konsentrasi, maka semakin besar pula
persaingan antara spermatozoa pada tempat pembuahan, sehingga mampu
meningkatkan kemungkinan sel telur yang dibuahi oleh sebuah spermatozoa yang
normal, memastikan inseminasi yang baik dan tingkat perkembangan embrio normal
Motilitas Spermatozoa
Kisaran motilitas spermatozoa yang diperoleh pada penelitian terdahulu
mengenai pengaruh karakter plasma semen terhadap reproduksi kelinci betina yaitu
sebesar 71% pada kelinci New Zealand White. Pentingnya memilih persentase
motilitas sebelum melakukan inseminasi, karena hal ini berkaitan dengan kesuburan
(Brun et al., 2002).
Viabilitas
Persentase hidup spermatozoa menggambarkan spermatozoa yang hidup pada
saat dicampur dengan zat warna yang menyebabkan perbedaan afinitas zat warna
antara sel-sel spermatozoa yang mati dan hidup (Hafez dan Hafez, 2000). Viabilitas
spermatozoa sangat ditentukan oleh keutuhan membran plasma dan kemampuan
sistem transport membran. Selain itu juga kelangsungan hidup spermatozoa juga
dipengaruhi oleh sekresi epididimis antara lain karnitin, fosfatidilkholin (Kaur et al.,
1991; Brooks et al., 1974).
Abnormalitas Spermatozoa
Abnormalitas terjadi terutama karena bengkok atau ekor melingkar, yang
biasanya terjadi selama perjalanan spermatozoa melalui epididimis (Jainudeen dan
Hafez, 1980). Proporsi yang lebih tinggi pada kelainan ini mungkin disebabkan
gangguan pada fungsi epididimis karena level hormon testosteron yang di bawah
normal (Hainonen, 1989). Produksi hormon ini dinyatakan serius sebagai akibat
dari pakan berkualitas rendah dalam waktu lama (Parker dan Thwaites, 1972).
Setiap spermatozoa abnormal tidak dapat membuahi ovum, tanpa
memandang apakah abnormalitas tersebut terjadi di dalam tubuli seminiferi, dalam
epididimis atau oleh perlakuan yang tidak lege artis terhadap ejakulat. Selama
abnormalitas spermatozoa belum mencapai 20% dari contoh semen, maka semen
tersebut masih dapat dipakai untuk inseminasi (Toelihere, 1981).
HOST Test (Tes keutuhan membran plasma spermatozoa)
Membran plasma spermatozoa mengalami proses pematangan di dalam
epididimis yang antara lain berupa perolehan enzim membran plasma. (Kaur et al.,
1991; Brook et al., 1974). Fungsi normal membran plasma spermatozoa adalah
Pentingnya membran dalam menjaga integritas baik biokimia dan struktur
spermatozoa adalah baik diketahui (Cabrita et al., 1999). Ketika terkena larutan
hypoosmotic, biokimia spermatozoa aktif meningkatkan volume mereka dalam
rangka membangun keseimbangan antara cairan kompartemen dalam spermatozoa
dan ekstraseluler lingkungan. Pembengkakan menyebabkan perubahan baik ukuran
sel dan bentuk yang dapat dievaluasi dengan menggunakan mikroskop fase kontras
(Cabrita et al., 1999). Proses pembengkakan ini memuncak dalam menyebabkan
perluasan membran sel meliputi ekor, sehingga memaksa flagela untuk membentuk
kumparan di dalam membran. Melingkarnya ekor dimulai pada ujung distal ekor
dan melanjutkan jalannya menuju bagian tengah kepala sebagai tekanan osmotik dari
MATERI DAN METODE
Lokasi dan Waktu
Lokasi penelitian bertempat di Laboratorium Lapang Bagian Produksi Ternak
Ruminansia Kecil Fakultas Peternakan IPB dan Laboratorium Unit Rehabilitasi
Reproduksi, Bagian Reproduksi dan Kebidanan, Fakultas Kedokteran Hewan IPB.
Pembuatan pelet ransum komplit berbasis daun Indigofera zollingeriana dan daun
lamtoro dilakukan di Pabrik Pakan Indofeed, Bogor. Penelitian ini dilaksanakan dari
bulan November 2011 sampai Januari 2012.
Materi Ternak
Penelitian ini menggunakan 20 ekor kelinci jantan lokal peranakan New
Zaeland White periode lepas sapih umur 4 bulan, dengan bobot hidup rata-rata
sekitar 1653,36±265,46 g/ekor (Gambar 1).
Gambar 1. Kelinci Penelitian
Kandang dan Peralatan
Kandang yang digunakan adalah kandang individual bertingkat sistem baterai
yang terbuat dari besi. Kandang yang dipakai sebanyak 20 dengan ukuran panjang 75
cm, lebar 60 cm dan tinggi 50 cm. Setiap kandang dilengkapi dengan tempat pakan
dan air minum. Peralatan lain yang dibutuhkan adalah timbangan untuk mengukur
bobot badan kelinci, plastik, alat kebersihan kandang, tabung reaksi, mikro pipet,
bunsen, kompor listrik, dan penyerap oksigen, alat penampung semen, mikroskop,
Gambar 2. Kandang Kelinci penelitian
Bahan Lain
Untuk koleksi dan evaluasi kualitas semen diperlukan jelly, air panas, NaCl
fisiologis, dan larutan eosin negrosin 2%. Bahan-bahan tersebut didapatkan dari Unit
Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan, IPB.
Ransum Penelitian
Ransum standar (R0) yang digunakan merupakan pelet ransum komersil
kelinci yang berasal dari Pabrik Pakan Indofeed dengan komposisi bahan pakan yaitu
jagung kuning, dedak padi, dedak gandum, bungkil kedelai, bungkil kelapa,
molasses, rumput, antimold, antioxidant, vitamin serta mineral. Pelet ransum komplit
yang dibuat dengan sumber hijauan daun tanaman Indigofera zollingeriana dan daun
lamtoro dan bahan lain diantaranya Jagung, dedak, CGM (Corn Gluten Meal),
Bungkil kedele, Bungkil Kelapa, CaCO3, premix, DCP (Dicalcium Phosphate) , NaCl
dan tepung ikan.
Ransum komplit diformulasikan sesuai dengan kebutuhan kelinci periode
pertumbuhan berdasarkan NRC (1977) dengan menggunakan Winfeed 2.8. Ransum
komplit ini disusun sesuai dengan kebutuhan kelinci jantan, dengan pemakaian
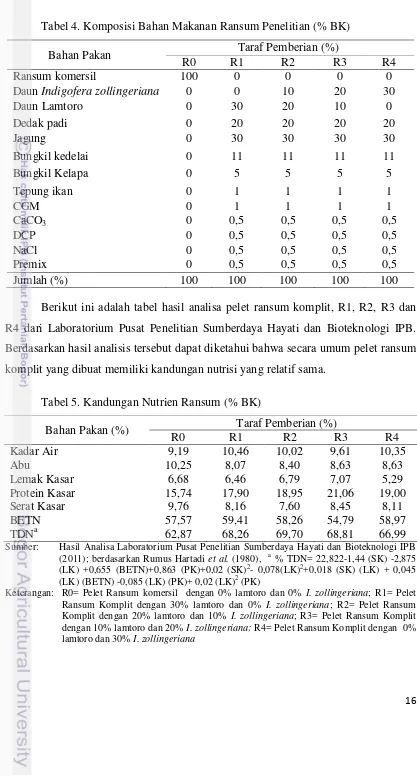
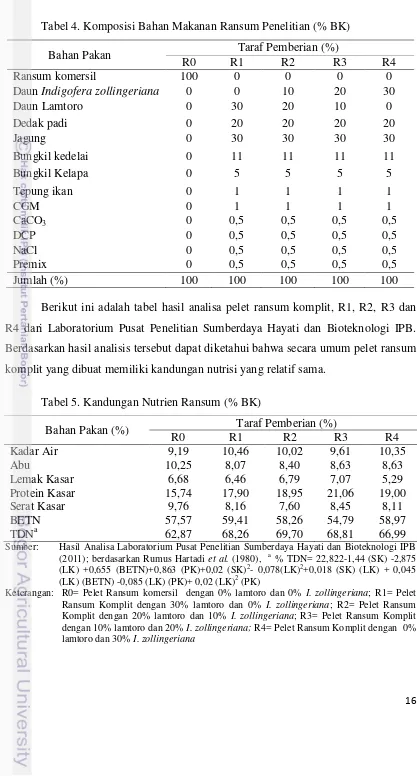
Tabel 4. Komposisi Bahan Makanan Ransum Penelitian (% BK)
R4 dari Laboratorium Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB.
Berdasarkan hasil analisis tersebut dapat diketahui bahwa secara umum pelet ransum
komplit yang dibuat memiliki kandungan nutrisi yang relatif sama.
Tabel 5. Kandungan Nutrien Ransum (% BK)
Bahan Pakan (%) Taraf Pemberian (%)
R0 R1 R2 R3 R4
Prosedur
Persiapan Hijauan
Hijauan yang dipilih sebagai bahan baku ransum komplit adalah daun I.
zollingeriana dan daun lamtoro yang merupakan hijauan yang masih bentuk segar.
Hijauan dikeringkan dengan cara dijemur di bawah sinar matahari selama ± 3 hari
hingga kadar air bahan mencapai ± 12%.
Pembuatan Pelet Ransum Komplit
Bahan hijauan yang telah digiling dan berbentuk tepung dicampur dengan
bahan pakan (Jagung, dedak, CGM, Bungkil kedelai, Bungkil Kelapa, CaCO3, DCP,
NaCl, premix dan tepung ikan) sesuai dengan formula pada Tabel 3. Bahan
campuran tersebut dimasukkan ke dalam mesin pengaduk atau mixer agar semua
bahan tersebut telah tercampur dengan rata. Tahap selanjutnya adalah pelleting yakni
memasukan semua bahan yang telah tercampur ke dalam mesin pelet dengan ukuran
3 mm. Pelet yang akan dihasilkan selanjutnya diangin-anginkan dan dimasukkan ke
dalam karung sesuai dengan perlakuan.
Persiapan Kandang
Kandang sebanyak 20 buah sebelum digunakan dibersihkan terlebih dahulu.
Kemudian kandang dilengkapi tempat pakan dari keramik dan tempat minum dari
botol minum khusus.
Pemeliharaan
20 ekor kelinci jantan lokal peranakan New Zealand White lepas sapih
periode lepas sapih umur 4 bulan, dengan bobot hidup rata-rata sekitar
1653,36±265,46 g/ekor dibagi menjadi 5 perlakuan ransum yaitu:
R0 = Pelet ransum komersil kelinci
R1 = Pelet Ransum komplit dengan 30% lamtoro + 0% I. zollingeriana
R2 = Pelet Ransum komplit dengan 20% lamtoro + 10% I. zollingeriana
R3 = Pelet Ransum komplit dengan 10% lamtoro + 20% I. zollingeriana
R4 = Pelet Ransum komplit dengan 0% lamtoro + 30% I. zollingeriana
Ternak dipelihara dalam kandang individu selama 7 minggu. Dua minggu
hingga kelinci mampu mengkonsumsi pakan yang akan diuji cobakan hingga 100%
(tidak ada sisa) tanpa mengalami penurunan konsumsi dan bobot badan. Kemudian
minggu ke-3 sampai ke-7 dilakukan pengamatan dan pengambilan data.
(R0) (R1)
(R2) (R3)
(R4)
Gambar 3. Pakan Perlakuan R0 = ransum komersil; R1 = 30% lamtoro, 0% I. zollingeriana; R2 = 20% lamtoro, 10% I. zollingeriana; R3 = 10% lamtoro, 20% I. zollingeriana; R4 = 30% I. zollingeriana
Pakan dan air minum diberikan ad libitum. Pemberian pakan dilakukan dua
kali sehari, pada pagi hari pukul 06.00 – 07.00 WIB dan sore hari pada pukul 16.00 – 17.00 WIB.
Koleksi Semen
Koleksi semen dilakukan pada akhir penelitian yaitu pada minggu ke-7
Penampungan dengan menggunakan vagina buatan yang dipancing menggunakan
kelinci betina dewasa. Semen yang sudah tertampung dalam tabung kemudian
diambil sampelnya untuk dideterminasi baik secara makroskopik maupun
mikroskopik.
Rancangan Percobaan dan Analisis Data
Rancangan
Rancangan percobaan pada awal penelitian menggunakan Rancangan Acak
Rancangan Acak Kelompok (RAK) dengan 5 perlakuan dan 4 kelompok. Kelompok
dalam percobaan kali ini adalah bobot badan kelinci jantan New Zealand White yang
dibagi menjadi 4. Empat kelompok adalah jumlah kelinci jantan New Zealand White
untuk masing-masing perlakuan yang merupakan perwakilan dari tiap kelompok.
Model matematika rancangan tersebut adalah sebagai berikut:
Analisis Data
Pada awalnya dianalisis dilakukan dengan sidik ragam sesuai dengan
rancangan percobaan, tetapi karena koefisien variasi data sangat tinggi (mencapai
95,5%) sehingga perbedaan nilai rataan tidak menunjukan perbedaan secara
signifikan secara statistik, sehingga analisis data dilakukan dengan menggunakan
menggunakan statistika deskriptif. Selain tingginya variasi antar perlakuan, terdapat
beberapa ekor individu kelinci yang tidak dapat menghasilkan semen, sehingga
jumlah sampel tidak memenuhi ketentuan untuk sidik ragam.
Peubah yang diamati
Peubah yang diamati pada penelitian ini adalah pH, warna, volume,
konsistensi, gerakan massa, konsentrasi spermatozoa, persentase viabilitas,
persentase motilitas, abnormalitas, serta nilai HOS Test. Yij = µ + τi + ßj+ εij
Keterangan: = rataan umum
i = efek perlakuan ke-i
ßj = efek kelompok ke-j
pH
Pengukuran pH dilakukan dengan menggunakan kertas indikator pH. Nilai
pH dapat diketahui melalui indikasi yang terlihat dari perubahan warna pada kertas
indikator pH tersebut.
Gerakan Massa
Pemeriksaan gerakan massa dilakukan dengan cara satu tetes semen diletakan
pada object glass yang bersih dan hangat (jangan terlalu cembung supaya cahaya
mikroskop dapat menembus semen). Preparat yang sudah jadi kemudian diamati
menggunakan mikroskop dengan pembesaran 10 kali terhadap pergerakan massa
spermatozoa. Spermatozoa mendapat nilai (-) jika tidak ada gerakan, (-/+) jika ada
sangat sedikit gerakan, (+) jika ada sedikit gerakan, (+/++) jika terjadi gerakan yang
agak besar, (++) jika terjadi gelombang gerakan yang besar, (++/+++) jika terjadi
gelombang besar yang hampir menyerupai gumpalan awan yang menggulung dan
(+++) jika terjadi gerakan seperti awan yang menggulung.
Volume
Pengamatan volume dilakukan dengan cara pengamatan langsung pada
tabung penampung semen yang memiliki skala. Semen ditampung seluruhnya dalam
tabung penampung yang bermulut lebar untuk sekali ejakulasi kemudian volume di
dalam tabung diukur dengan gelas ukur yang mempunyai skala volume 0,1 ml
kemudian dibaca hasil yang ditunjukan oleh skala.
Kekentalan (konsistensi)
Kekentalan diukur dengan cara memiringkan tabung sebesar 45o kemudian
ditegakkan kembali ke posisi semula, dilihat dari kecepatan ejakulat kembali pada
posisi semula. Ejakulat memiliki nilai kental (K) jika waktu kembali ke posisi semula
sangat lambat, ejakulat memiliki nilai sedang (S) jika waktu kembali ke posisi
semula lambat dan ejakulat memiliki nilai encer (E) jika waktu kembali ke posisi
Warna
Semen yang ada di dalam tabung reaksi diamati dengan menggunakan latar
belakang putih dan dilakukan di tempat yang mempunyai penerangan cukup. Warna
ejakulat terdiri dari tiga warna, yaitu: putih (P), krem (C), dan krem keputihan (C-P).
Konsentrasi spermatozoa
Konsentrasi spermatozoa merupakan jumlah spermatozoa yang terkandung
dalam setiap milliliter semen. Sebanyak 10 µl semen kelinci dicampurkan dengan
990 µl pengencer. Keduanya dicampurkan pada tabung eppendorf dengan
menggunakan mikropippet kemudian campuran dihomogenkan dengan memutar
tabung seperti angka 8. Campuran semen kemudian diambil sebanyak 8-10 µl dan
dimasukan ke counting chamber. Preparat kemudian diamati menggunakan
mikroskop dengan pembesaran 400 kali. Pada counting chamber (Neubauer
Chamber) dipilih 5 kotak besar kemudian di dalam masing-masing kotak besar
terdapat 16 kotak kecil.
Kemudian dihitung dengan menggunakan rumus :
Di mana
N = Jumlah spermatozoa yang ada di chamber (5 kotak besar yang terdapat 16 kotak
kecil)
FP = Faktor pengencer ( 100, 200, atau 500 )
„5‟ = Faktor koreksi di mana hanya 5 dari 25 kotak yang dihitung
10.000 = Faktor koreksi yang dibutuhkan karena di dalam cover slip .0001 ml per chamber.
Persentase motilitas
Persentase motilitas adalah perbandingan spermatozoa yang bergerak ke
depan (progresif) dibandingkan dengan jumlah spermatozoa yang diamati. Semen
diambil dengan pipet plastik kemudian diteteskan pada object glass sebanyak satu
tetes dan ditambahkan NaCl fisiologis sebanyak satu tetes. Campuran tersebut
ditutup dengan cover glass. Jumlah spermatozoa motil progresif diamati
menggunakan mikroskop listrik dengan pembesaran objektif 40 kali pada sepuluh
zig-zag. Penilaian yang diberikan dari angka 0% (tidak ada yang bergerak) sampai
dengan 100% (seluruh spermatozoa bergerak ke depan).
Viabilitas dan abnormalitas
Object glass yang bersih dan bebas lemak disiapkan sebanyak 3 buah.Pada
glass objek yang pertama diteteskan negrosin 2% sebanyak 1 tetes dan dicampurkan
semen sebanyak 8 tetes. Negrosin dan semen kemudian dihomogenkan. Kemudian
object glass kedua digunakan untuk mengambil sedikit campuran di ujungnya dan
diulas pada glass objek ketiga. Object glass ketiga kemudian dikeringkan di bunsen
selama 10-15 detik. Preparat ulas yang sudah dibuat diamati di mikroskop.
Spermatozoa yang masih hidup akan berwarna putih dan yang mati akan berwarna
merah. Pada pengamatan viabilitas dapat dilakukan pengamatan normalitas dan
abnormalitas.
HOS test (Tes keutuhan membran plasma spermatozoa)
Menurut Jeyendran dan Zaneveld (1986), pembuatan larutan HOS test
dilakukan dengan mencampurkan 2,7 g fruktosa yang dilarutkan ke dalam 100 ml
aquadest dengan 1,47 g natrium sitrat yang dilarutkan ke dalam 100 ml aquadest.
Kemudian larutan hipoosmotik dimasukan kedalam tabung effendorf sebanyak 0,35
ml dan semen kelinci sebanyak 0,05 ml. Campuran kemudian diinkubasikan dalam
incubator dengan temperature 37 oC selama 30 menit. Setelah diinkubasikan
campuran tersebut diteteskan pada glass objek dan ditutup dengan cover glass.
Kemudian diamati dengan mikroskop pembesaran 450 kali. Spermatozoa yang
memiliki membran utuh pada bagian ekor akan terlihat melengkung sedangkan
HASIL DAN PEMBAHASAN
Keadaan Umum
Selama penelitian rataan suhu dan kelembaban harian kandang berturut-turut
28,3o C dan 91,3% yang masih dalam kisaran normal untuk hidup kelinci. Adapun
suhu dan kelembaban pada saat penampungan dan evaluasi adalah 25,5o C dan 84%.
Kondisi tersebut diasumsikan tidak mempengaruhi kondisi spermatozoa karena
masih dalam kondisi normal suhu kamar.
Pada penelitian ini terdapat beberapa ekor kelinci yang mengalami penyakit
scabies. Pemberian obat antibiotik secara injeksi subkutan dilakukan pada tiga ekor
kelinci perlakuan R2 dan R3. Terdapat juga dua ekor kelinci yang mengalami luka di
bawah telapak kakinya yang selanjutnya diberi obat penyembuh luka guna mencegah
terjadinya infeksi lebih lanjut. Selama penelitian pada masa adaptasi terjadi kematian
dua ekor kelinci. Faktor perbedaan cuaca dan pakan menjadi penyebab utama, hal ini
karena kelinci penelitian didatangkan dari Kota Bandung yang suhu umum
rata-ratanya lebih rendah dibandingkan Kota Bogor.
Bobot badan awal rata-rata kelinci yang digunakan dalam penelitian ini
adalah 1653,36±265,46 g/ekor. Penimbangan bobot badan dilakukan setiap seminggu
sekali dengan empat pengelompokan bobot badan. Rataan bobot badan pada saat
penampungan semen adalah 2010,10±300,18 g/ekor (Tabel 6).
Tabel 6. Rataan Bobot Badan Kelinci pada Saat Penampungan Semen
Perlakuan Rataan BB Minggu Ke-7 (gram/ekor)
R0 1898,25±398,27 zollingeriana; R2= Pelet 20% lamtoro dan 10% I. zollingeriana; R3= Pelet 10% lamtoro dan 20% I. zollingeriana; R4= Pelet 0% lamtoro dan 30% I. zollingeriana
Pemberian ransum R3 dan R4 cenderung meningkatkan PBB dan bobot
badan jika dibandingkan dengan pemberian ransum R0, R1 dan R2. Menurut
dibandingkan daun gamal, namun pemberian daun lamtoro dapat mengurangi
pertumbuhan bobot badan, konsumsi pakan, dan efisiensi pakan. Daun lamtoro
mengandung mimosin yang menyebabkan kerontokan dan reddish (urin berwarna
coklat) pada kelinci. Oleh karena itu penggunaan daun lamtoro dalam ransum
direkomendasikan tidak lebih dari 50% total ransum. Menurut Toelihere (1993),
nutrisi sangat mempengaruhi kualitas dan kuantitas semen yang dihasilkan.
Penampungan semen dilakukan pada akhir penelitian dengan menggunakan
vagina buatan. Namun terdapat 8 ekor kelinci yang menyebar pada 5 perlakuan tidak
dapat dilakukan penampungan semennya. Hal ini dapat disebabkan karena
kelinci-kelinci tersebut belum terbiasa dengan penampungan semen menggunakan vagina
buatan serta secara keseluruhan kelinci belum benar-benar mengalami dewasa
kelamin meskipun kelinci telah berumur 6 bulan. Dua diantara 8 ekor tersebut yaitu
pada perlakuan R1 perolehan data didapat dari semen yang diambil dari bagian
epididimis. Hal ini menunjukan bahwa produksi spermatozoa telah berlangsung
meskipun belum mampu berejakulasi saat ditampung.
Kualitas Makroskopik Semen
Kualitas makroskopik semen yang diamati pada penelitian ini antara lain
volume, pH, konsistensi dan warna semen.
Volume Semen
Pada penelitian ini terdapat 8 ekor kelinci yang menyebar pada 5 perlakuan
tidak dapat dilakukan penampungan semennya. Dua diantara 8 ekor tersebut yaitu
pada perlakuan R1 perolehan data didapat dari semen yang diambil dari bagian
epididimis. Nilai rataan volume semen dapat dilihat pada Tabel 7.
Tabel 7 menunjukkan nilai rataan volume pada kelinci yang diberi perlakuan
R0 memiliki nilai rataan volume semen relatif lebih tinggi dibandingkan dengan
perlakuan R1, R2, R3 dan R4. Hal ini kemungkinan berhubungan dengan nutrisi
yang dikandung masing-masing pelet perlakuan. Menurut Toelihere (1993), nutrisi
sangat mempengaruhi kualitas dan kuantitas semen yang dihasilkan. Hafez dan
Hafez (2000) menyatakan, volume ejakulat kelinci berkisar antara 0,4-0,6 ml.
Volume ejakulat kelinci sebanyak 0,5-1,5 ml dengan jumlah spermatozoa per
Tabel 7. Nilai Rataan Volume Semen
Perlakuan Nilai Rataan volume (ml)
R0 1,52±1,28
R1 0,55
R2 0,58±0,11
R3 0,18±0,10
R4 0,27±0,21
Keterangan : R0= Pelet 0% lamtoro dan 0% I. zollingeriana; R1= Pelet 30% lamtoro dan 0% I. zollingeriana; R2= Pelet 20% lamtoro dan 10% I. zollingeriana; R3= Pelet 10% lamtoro dan 20% I. zollingeriana; R4= Pelet 0% lamtoro dan 30% I. zollingeriana
Kisaran volume pada perlakuan R0 adalah 0,07-2,5 ml, pada perlakuan R1
hanya terdapat satu sampel volume yaitu sebesar 0,55 ml sehingga tidak terdapat
nilai standar deviasi, pada perlakuan R2 kisaran volumenya adalah 0,5-0,65 ml,
sedangkan kisaran volume pada perlakuan R3 dan R4 berturut-turut adalah 0,1-0,3
ml dan 0,1-0,5 ml. Kisaran volume semen yang diperoleh cenderung lebih rendah
jika dbandingkan dengan rataan volume semen yang didapat oleh penelitian
terdahulu mengenai pengaruh karakter plasma semen terhadap reproduksi kelinci
betina yaitu sebesar 0,67 ml pada kelinci New Zealand White (Brun et al., 2002).
Selain faktor nutrisi, volume ejakulat juga dipengaruhi oleh kelenjar assesorius yang
dipengaruhi oleh umur dewasa kelamin kelinci-kelinci tersebut. Plasma semen
dihasilkan sebagian besar oleh kelenjar vasikularis dan sisanya oleh cairan dari testis
dan prostate. Plasma semen sebagai komponen semen disamping spermatozoa,
dibuat pada jaringan kelamin sekunder termasuk diantaranya adalah epididimis vas
deferent, ampula, kelenjar vesikularis, prostat dan cowper. Oleh karena itu, volume
semen sangat dipengaruhi oleh aktivitas jaringan pada kelenjar-kelenjar tersebut
(Elya et al., 2010).
Tidak adanya respon yang signifikan dalam mempengaruhi volume semen,
menunjukkan bahwa pemberian pelet ransum komplit berbasis daun I. zollingeriana
dan daun lamotoro sampai 30% berpengaruh baik pada kelenjar seks aksesori kelinci
pH Semen
Nilai pH dipengaruhi oleh komposisi cairan yang terdapat dalam semen yang
sebagian besar berasal dari kelenjar pelengkap. Semakin banyak cairan dari kelenjar
pelengkap, maka semakin tinggi pH semen. Nilai pH semen kelinci rata-rata 6,9 zollingeriana; R2= Pelet 20% lamtoro dan 10% I. zollingeriana; R3= Pelet 10% lamtoro dan 20% I. zollingeriana; R4= Pelet 0% lamtoro dan 30% I. zollingeriana
Nilai rataan pH pada kelinci dengan perlakuan R0 adalah 6,7, pada perlakuan
R1 didapat kisaran nilai pH antara 6,4-7,5. Pada perlakuan R2 nilai pH berkisar
antara 6,7-7, sedangkan kisaran nilai pH pada perlakuan R3 dan R4 berturut-turut
adalah 6,4-7,5 dan 6,7-7,7. Kisaran pH semen yang diperoleh cenderung sama jika
dbandingkan dengan rataan pH semen yang didapat oleh penelitian terdahulu
mengenai pengaruh karakter plasma semen terhadap reproduksi kelinci betina yaitu
sebesar 7,18 pada kelinci New Zealand White (Brun et al., 2002). Menurut Yousef et
al. (2000), pH kelinci New Zealand White yang diberi penambahan vitamin E (1,0
g/l), vitamin C (1,5 g/l) serta kombinasi keduanya (1 g/l vitamin E dan 1,5 g/l )
dalam air minum masing-masing adalah sebesar 8,0; 8,1 dan 8,1.
Nilai pH semen juga ditentukan oleh aktivitas kelenjar assesorius. pH semen
ditentukan oleh keseimbangan kation dan anion yang terdapat dalam struktur kimia
yang terkandung dalam kelenjar assesorius. Tidak terdapatnya perubahan yang nyata
pada volume serta pH semen berarti bahwa kelenjar assesorius masih bisa bekerja
Kekentalan Semen
Konsistensi semen sangat dipengaruhi oleh konsentrasi spermatozoa yang terkandung di dalam semen, semakin banyak jumlah spermatozoa di dalam semen,
maka konsistensi semen akan semakin kental (Sansone, 2000). Hasil pengamatan
konsistensi dapat dilihat pada Tabel 9. zollingeriana; R2= Pelet 20% lamtoro dan 10% I. zollingeriana; R3= Pelet 10% lamtoro dan 20% I. zollingeriana; R4= Pelet 0% lamtoro dan 30% I. zollingeriana
`
Dari Tabel 9 dapat dilihat bahwa kelinci yang diberi pelet ransum R0
memiliki konsistensi yang encer (E). Sedangkan pada kelinci yang diberi pelet
ransum R1 didapatkan dua kelompok kelinci dengan konsistensi kental (K) dan
konsistensi encer (E). Hal ini dapat disebabkan bahwa rataan konsentrasi
spermatozoa pada pelet ransum R1 lebih tinggi yaitu sebesar 826,25 x 106/ml
dibandingkan dengan rataan konsentrasi spermatozoa pada ransum R0 yaitu sebesar
345 x 106/ml. Konsistensi yang kental pada ransum R1 juga disebabkan pengambilan
sampel yang diperoleh langsung dari epididimis sehingga akan menghasilkan
substansi berupa lendir yang bersifat licin dan kental.
Warna Semen
Warna semen sangat dipengaruhi oleh konsentrasi spermatozoa yang
terkandung di dalam semen. Semakin keruh biasanya jumlah spermatozoa
per-mililiter semen semakin banyak (Partodihardjo, 1982). Semen normal memiliki
warna seperti susu atau krem keputih-putihan dan keruh (Toelihere, 1981). Hasil
Tabel 10. Hasil Pengamatan Warna Semen zollingeriana; R2= Pelet 20% lamtoro dan 10% I. zollingeriana; R3= Pelet 10% lamtoro dan 20% I. zollingeriana; R4= Pelet 0% lamtoro dan 30% I. zollingeriana
Dari Tabel 10 dapat dilihat bahwa secara umum kelinci menghasilkan
ejakulat dengan warna terbanyak putih (P) kemudian diikuti dengan warna krem
serta krem keputihan. Warna tersebut merupakan warna semen kelinci normal. Hal
ini menunjukan bahwa kelinci yang diberi ransum R0, R1, R2, R3, dan R4 tidak
memberikan pengaruh nyata terhadap warna semen kelinci. Semen normal tampak
putih kelabu homogen. Semen tampak jernih jika jumlah sperma terlalu sedikit atau
tampak coklat jika ada sel darah merah (Elya et al., 2010).
Kualitas Mikroskopik Semen
Kualitas mikroskopik semen yang diamati pada penelitian ini antara lain
gerakan massa, konsentrasi spermatozoa, persentase motilitas, persentase viabilitas,
persentase abnormalitas dan persentase nilai HOS Test. Nilai rataan persentase
motilitas, viabilitas dan Abnormalitas disajikan pada Lampiran 1.
Gerakan Massa Semen
Spermatozoa dalam suatu kelompok memiliki kecenderungan untuk bergerak
bersama-sama ke satu arah dan membentuk gelombang-gelombang yang tebal atau
tipis, bergerak cepat atau lambat tergantung dari konsentrasi spermatozoa hidup di
dalamnya. Semakin besar pergerakan gelombang yang terjadi, semakin tinggi
motilitas spermatozoa. Hasil pemeriksaan gerakan massa dapat dilihat pada Tabel 11.
Tabel 11 dapat menunjukkan bahwa semen kelinci yang diberi ransum R1,
R3 dan R4 saja yang memiliki gerakan massa dengan gelombang gerakan yang besar
baik jika dibandingkan dengan semen dengan gerakan massa sedikit (+). Hal ini
menunjukkan bahwa spermatozoa memiliki motilitas dan konsentrasi yang baik.
Tabel 11. Hasil Pengamatan Gerakan Massa
Keterangan: 1. R0 = ransum komersil; R1 = 30% lamtoro + 0% lamtoro; R2 = 20% lamtoro+10% I. zollingeriana; R3 = 10% lamtoro+20% I. zollingeriana; R4 = 30% I. zollingeriana
+0% lamtoro
2. - = tidak ada gerakan; + = terjadi sedikit gerakan; ++ = terjadi gelombang gerakan yang besar; T.A.S = Tidak Ada Sampel
Perbedaan gerakan massa pada kelinci perlakuan terjadi akibat perlakuan
yang diberikan. Pada perlakuan R1, terdapat gerakan massa dengan gelombang
gerakan yang besar, akan tetapi data ini diperoleh pada kelinci perlakuan R1 yang
pengambilan semennya langsung dari saluran epididimis. Ada kecenderungan
pemberian pakan dengan taraf I. zollingeriana yang tinggi dapat memberikan
pengaruh baik pada gerakan massa semen kelinci. Hal ini diduga karena ransum yang
mengandung daun lamtoro dengan taraf 20% dan 30% masih mengandung zat anti
nutrisi mimosin pada pakan pelet tersebut.
Pengaruh yang merugikan daun lamtoro pada sapi dapat menyebabkan
gondok (Jones et al., 1976), menurunnya fertilitas dan penyusutan berat lahir
(Hamilton et al., 1971; Helmes, 1980). Uji ini dilakukan di Australia dan Papua New
Guinia dengan menggembalakan sapi-sapi percobaan padang lamtoro, sementara itu
kerontokan bulu dan anak-anak yang dilahirkan berkurang terjadi pula pada kelinci
yang diberi pakan daun lamtoro (Ruskin, 1984). Penelitian lain menyatakan,
pemberian tepung daun lamtoro 15% menyebabkan terhambatnya kemampuan
bereproduksi. Terbukti tikus betina menjadi infertil, prenatal dan pada tikus jantan
libido serta fertilitasnya turun setelah diberi pakan mengandung daun lamtoro (Joshi,
Konsentrasi Spermatozoa
Konsentrasi spermatozoa berkisar 0,1-1,0 ml juta dan persentase motilitas
berkisar 40%-80%. Volume ejakulat untuk kelinci ras New Zealand White 0,86 ml
dengan konsentrasi spermatozoa sebesar 0,31 x 106 / µl dan persentase motilitas
sebesar 55%. Data ini diperoleh pada pengambilan sampel sebanyak 45 sampel
(Paufler et al., 1974).
Kisaran nilai konsentarasi spermatozoa pada kelinci yang diberi perlakuan R0
adalah 277,5 x 106-412,4 x 106, pada perlakuan R1 didapat kisaran nilai konsentrasi
spermatozoa antara 180 x 106/ml – 1472,5 x 106/ml. Pada perlakuan R2 nilai kisaran konsentrasi spermatozoa berkisar antara 182 x 106/ml – 860 x 106/ml, sedangkan kisaran nilai konsentrasi spermatozoa pada perlakuan R3 dan R4 berturut-turut
adalah 112,5 x 106/ml– 592,5 x 106/ml dan 372,5 x 106 /ml– 2375 x 106/ml. Kisaran konsentrasi spermatozoa yang diperoleh cenderung lebih rendah jika dbandingkan
dengan rataan konsentrasi spermatozoa yang didapat oleh penelitian terdahulu
mengenai pengaruh karakter plasma semen terhadap reproduksi kelinci betina yaitu
sebesar 403 x 106/ml pada kelinci New Zealand White (Brun et al., 2002). Hal ini
kemungkinan terdapat perbedaan umur kelinci pada penelitian terdahulu dengan
penelitan ini.
Gambar 4. Diagram Rataan Konsentrasi Spermatozoa (106/ml).
Keterangan: R0 = ransum komersil; R1 = 30% lamtoro, 0% I. zollingeriana; R2 = 20% lamtoro, 10% I. zollingeriana; R3 = 10% lamtoro, 20% I. zollingeriana; R4 = 30% I. zollingeriana
Gambar 4 menunjukkan lebih jelas bahwa rataan konsentrasi spermatozoa
pada R0 relatif lebih rendah dibandingkan dengan konsentrasi spermatozoa pada
perlakuan ransum lainnya walaupun diketahui pemberian perlakuan R0 memiliki
penelitian lainnya. Hal ini cenderung disebabkan karena protein ransum R0 lebih
rendah yaitu sebesar 15,74% sedangkan kisaran protein ransum untuk R1 sampai R4
berkisar antara 17,94%-21,06%. Protein merupakan zat yang berperan dalam
pertumbuhan dan pembentukan tubuh, termasuk di dalamnya pembentukan sel
kelamin (spermatogenesis). Namun, rataan konsentrasi spermatozoa tersebut masih
sesuai dengan kisaran konsentrasi spermatozoa kelinci. Menurut Morrow (1986),
volume ejakulat kelinci sebanyak 0,5-1,5 ml dengan jumlah spermatozoa per ejakulat
sebesar 10-1000 x 106. Yousef et al. (2000) menyatakan, konsentrasi spermatozoa
kelinci New Zealand White yang diberi penambahan vitamin E (1,0 g/l), vitamin C
(1,5 g/l) serta kombinasi keduanya (1 g/l vitamin E dan 1,5 g/l ) dalam air minum
masing-masing adalah sebesar 336 x 106/ml, 332 x 106/ml, 332 x 106/ml.
Selain faktor nutrisi, konsentrasi spermatozoa juga dipengaruhi oleh kadar
hormon testosteron. Kadar testosteron yang tinggi menyebabkan terjadinya
mekanisme umpan balik negatif terhadap hipotalamus dan hipofisis. Testosteron
akan menghambat hipotalamus untuk menghasilkan GnRH sehingga kadar GnRH
turun dan menghambat hipofisis anterior untuk menghasilkan FSH dan LH. Bila FSH
turun maka terjadi gangguan pada sel sertoli yang menyebabkan berkurangnya
zat-zat makanan yang diperlukan untuk proliferasi, diferensiasi serta memelihara sel-sel
spermatogenik (Steven et al., 1974). Apabila kadar LH turun maka testosteron yang
dihasilkan juga berkurang. Kadar FSH dan testosteron yang rendah akan
menyebabkan proses spermatogenesis terganggu, akibatnya jumlah spermatozoa
yang dihasilkan menurun.
Rataan konsentrasi tertinggi terdapat pada perlakuan yang diberi ransum R4
(Gambar 4). Hal ini juga dibuktikan dengan terdapatnya konsistensi sedang pada
kelompok perlakuan R4 dengan pengambilan sampel yang menggunakan vagina
buatan. Rataan konsentrasi tertinggi berikutnya ada pada perlakuan R1, dimana
pemberian pelet ransum komplit yang mengandung 30% daun lamtoro mampu
memberikan efek positif terhadap peningkatan konsentrasi spermatozoa per
ejakulatnya. Pemberian daun lamtoro dengan level 100-300 g/ekor/hari secara
signifikan mampu meningkatkan konsentrasi spermatozoa domba di daerah tropis
Meningkatnya konsentrasi spermatozoa umumnya dianggap bermanfaat
karena memungkinkan inseminasi dari sejumlah besar betina (Foote, 1980). Saat
kawin alam konsentrasi spermatozoa yang lebih tinggi memastikan masuknya
spermatozoa lebih ke dalam serviks dan kemudian ke saluran telur, sehingga
meningkatkan kesempatan terjadinya pembuahan (Garner dan Hafez, 1980).
Menurut Nadir et al. (1993), semakin tinggi konsentrasi, maka semakin besar pula
persaingan antara spermatozoa pada tempat pembuahan, sehingga mampu
meningkatkan kemungkinan sel telur yang dibuahi oleh sebuah spermatozoa yang
normal, memastikan inseminasi yang baik dan tingkat perkembangan embrio normal
berikutnya.
Motilitas Spermatozoa
Ciri utama spermatozoa adalah motilitas atau daya geraknya yang dijadikan
patokan atau cara yang paling sederhana dalam penilaian semen untuk inseminasi
buatan. Hal ini karena motilitas atau pergerakan spermatozoa memegang peranan
penting sewaktu pertemuannya dengan ovum. Motilitas juga digunakan sebagai
ukuran kesanggupan apermatozoa untuk membuahi (Toelihere, 1993).
Gambar 5. Diagram Rataan Motilitas Spermatozoa (%)
Keterangan: R0 = ransum komersil; R1 = 30% lamtoro, 0% I. zollingeriana; R2 = 20% lamtoro, 10%
I. zollingeriana; R3 = 10% lamtoro, 20% I. zollingeriana; R4 = 30% I. zollingeriana
Gambar 5 menunjukkan bahwa rataan motilitas sperma pada perlakuan yang
diberi ransum R0 relatif lebih rendah dibandingkan dengan rataan motalitas sperma
pada perlakuan lainnya. Secara umum motilitas spermatozoa yang diperoleh sangat
rendah jika dibandigkan dengan karakteristik seminal kelinci oleh Paufler et al.
lebih rendah jika dbandingkan dengan rataan motilitas yang didapat pada penelitian
terdahulu mengenai pengaruh karakter plasma semen terhadap reproduksi kelinci
betina yaitu sebesar 71% pada kelinci New Zealand White. Pentingnya memilih
persentase motilitas sebelum melakukan inseminasi, karena hal ini berkaitan dengan
kesuburan (Brun et al., 2002).Rendahnya persentase motilitas yang diperoleh dapat
disebabkan kelinci yang belum dewasa kelamin sehingga spermatozoa yang
terbentuk tidak dapat bergerak secara progresif.
Viabilitas
Persentase hidup spermatozoa menggambarkan spermatozoa yang hidup pada
saat dicampur dengan zat warna yang menyebabkan perbedaan afinitas zat warna
antara sel-sel spermatozoa yang mati dan hidup (Hafez dan Hafez, 2000).
Spermatozoa yang mati akan menyerap warna sedangkan spermatozoa yang hidup
tidak atau sedikit sekali menyerap warna.
Gambar 6. Diagram Rataan Viabilitas Spermatozoa (%)
Keterangan: R0 = ransum komersil; R1 = 30% lamtoro, 0% I. zollingeriana; R2 = 20% lamtoro, 10%
I. zollingeriana; R3 = 10% lamtoro, 20% I. zollingeriana; R4 = 30% I. zollingeriana
Gambar 6 menunjukkan bahwa rataan viabilitas spermatozoa dari kelinci
yang diberi pelet ransum mengandung daun I. zollingeriana dan lamtoro mencapai di
atas 70%, kecuali viabilitas spermatozoa dari kelinci yang diberi ransum komersial.
Yang menunjukan nilai. Rataan spermatozoa tertinggi didapat pada kelinci yang
diberi perlakuan R2 dan R4, sedangkan kelinci yang mendapat perlakuan R1 dan R3
tidak mengalami penurunan yang signifikan. Pemberian semua pakan perlakuan
memberikan pengaruh yang tidak berbeda terhadap nilai persentase viabilitas. Hal
tersebut menunjukkan bahwa nilai persentase viabilitas kelinci yang diberi perlakuan
ditentukan oleh keutuhan membran plasma dan kemampuan sistem transport
membran. Selain itu juga kelangsungan hidup spermatozoa juga dipengaruhi oleh
sekresi epididimis antara lain karnitin, fosfatidilkholin (Kaur et al., 1991; Brooks et
al., 1974).
Abnormalitas
Persentase abnormalitas menggambarkan spermatozoa yang hidup namun
tidak memiliki bentuk yang sempurna seperti tidak adanya ekor, ekor kriting dan
ekor tidak lurus.
Gambar 7. Diagram Rataan Abnormalitas Spermatozoa (%)
Keterangan: R0 = ransum komersil; R1 = 30% lamtoro, 0% I. zollingeriana; R2 = 20% lamtoro, 10%
I. zollingeriana; R3 = 10% lamtoro, 20% I. zollingeriana; R4 = 30% I. zollingeriana
Nilai abnormalitas spermatozoa dapat dilihat pada Gambar 7, yang
menunjukan adanya kecenderungan penurunan nilai persentasenya jika kelinci diberi
pelet yang mengandung daun Indigofera zollingeriana dan/atau lamtoro. Nilai
abnormalitas spermatozoa secara relatif mengalami penurunan jika kandungan
Indigofera pada pelet ditingkatkan, dibandingkan dengan peningkatan daun lamtoro.
Penurunan nilai abnormalitas spermatozoa akibat pemberian Indigofera merupakan
informasi baru yang positif, sehingga daun tanaman ini diduga dapat menjadi salah
satu komponen pakan yang berperan penting untuk program pembibitan kelinci.
Tingginya persentase abnormalitas pada spermatozoa disebabkan spermatogenesis
yang belum sempurna dan akibat perlakuan di laboratorium. Selama abnormalitas
spermatozoa belum mencapai 20% dari contoh semen, maka semen tersebut masih
dapat dipakai untuk inseminasi (Toelihere, 1981).
Abnormalitas terjadi terutama karena bengkok atau ekor melingkar, yang
Hafez, 1980). Proporsi yang lebih tinggi pada kelainan ini mungkin disebabkan
gangguan pada fungsi epididimis karena level hormon testosteron yang di bawah
normal (Hainonen, 1989). Produksi hormon ini dinyatakan serius sebagai akibat
dari pakan berkualitas rendah dalam waktu lama (Parker dan Thwaites, 1972).
HOS Test
Spermatozoa yang memiliki membran utuh pada bagian ekor akan terlihat
melengkung sedangkan spermatozoa yang tidak mempunyai membran pada bagian
ekor akan terlihat lurus.
Gambar 8. Diagram Rataan Nilai HOS Test (%)
Keterangan: R0 = ransum komersil; R1 = 30% lamtoro, 0% I. zollingeriana; R2 = 20% lamtoro, 10%
I. zollingeriana; R3 = 10% lamtoro, 20% I. zollingeriana; R4 = 30% I. zollingeriana
Membran plasma spermatozoa mengalami proses pematangan di dalam
epididimis yang antara lain berupa perolehan enzim membran plasma. (Kaur et al.,
1991; Brook et al., 1974). Fungsi normal membran plasma spermatozoa adalah
melindungi spermatozoa dan mempertahankan daya hidupnya.
Gambar 8 menunjukkan bahwa rataan nilai HOS Test tertinggi secara relatif
terdapat pada semen kelinci yang diberi perlakuan R3 dan R4. Hal ini dapat
dimaknai bahwa semen yang diberi perlakuan R3 dan R4 memiliki persentase
membran plasma utuh relatif lebih tinggi dibandingkan dengan semen yang diberi
perlakuan lain. Secara relatif perlakuan R2 memiliki nilai rataan membrane plasma
utuh paling rendah. Hal ini dapat disebabkan proses pematangan di dalam epididimis
yang tidak sempurna pada kelinci yang diberi perlakuan R2. Rataan konsumsi pelet
pada kelinci perlakuan R2 juga lebih rendah yaitu sebesar 73,86 g/ekor/hari jika
dibandingkan dengan perlakuan R0, R1, R3 dan R4 masing-masing sebesar 84,14
konsumsi pakan juga akan mempengaruhi kualitas dan kuantitas spermatozoa.
Menurut Hafez dan Hafez (2000), bahwa kualitas dan kuantitas spermatozoa yang
dihasilkan dipengaruhi oleh makanan, suhu dan musim, frekuensi ejakulasi dan
libido, penyakit dan benih penyakit, pengangkutan, umur, hereditas dan gerak badan.
Pentingnya membran dalam menjaga integritas baik biokimia dan struktur
spermatozoa adalah baik diketahui (Cabrita et al., 1999). Ketika terkena solusi
hypoosmotic, biokimia-aktif spermatozoa meningkatkan volume mereka dalam
rangka membangun keseimbangan antara cairan kompartemen dalam spermatozoa
dan ekstraseluler lingkungan. Pembengkakan menyebabkan perubahan baik ukuran
sel dan bentuk yang dapat dievaluasi dengan menggunakan mikroskop fase kontras
(Cabrita et al., 1999). Proses pembengkakan ini memuncak dalam mempromosikan
perluasan membran sel meliputi ekor, sehingga memaksa flagela untuk membentuk
kumparan di dalam membran. Melingkarnya ekor dimulai pada ujung distal ekor
dan melanjutkan jalannya menuju bagian tengah kepala sebagai tekanan osmotik dari
KESIMPULAN DAN SARAN
Kesimpulan
Pelet ransum komplit mengandung daun Indigofera zollingeriana dan
lamtoro (Leucaena leucocephala) tanpa kombinasi cenderung menghasilkan kualitas
spermatozoa lebih baik dibandingkan dengan pelet ransum komersil. Sedangkan,
kombinasi daun Indigofera zollingeriana dan lamtoro dalam pelet ransum komplit
menghasilkan rataan persentase kualitas spermatozoa yang bervariasi.
Saran
Pelet ransum komplit berbasis daun Indigofera zollingeriana dan lamtoro
dengan taraf yang berbeda berpeluang untuk digunakan sebagai pellet ransum untuk
program pembibitan kelinci, karena relatif menghasilkan kualitas sperma lebih baik.
Variasi data yang tinggi perlu dieliminasi dengan melalui pengambilan sperma dalam
KUALITAS SPERMATOZOA KELINCI PERANAKAN
NEW
ZEALAND WHITE
YANG DIBERI PELET RANSUM KOMPLIT
MENGANDUNG DAUN
Indigofera zollingeriana
DAN
Leucaena leucocephala
SKRIPSI DONA MARINA
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN