KEPEKAAN LARVA
Crocidolomia pavonana
ASAL CIANJUR,
JAWA BARAT,
TERHADAP TIGA JENIS INSEKTISIDA
ANITA WIDYAWATI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
ANITA WIDYAWATI. Kepekaan Larva Crocidolomia pavonana Asal Cianjur, Jawa Barat, terhadap Tiga Jenis Insektisida. Dibimbing oleh ENDANG SRI RATNA dan DJOKO PRIJONO.
Crocidolomia pavonana merupakan hama penting pada kubis yang dapat menyebabkan kerusakan tanaman dan menurunkan produksi. Dalam usaha meminimumkan kehilangan hasil, petani sering menggunakan insektisida untuk mengendalikan hama C. pavonana. Penggunaan insektisida secara terus menerus dapat menurunkan kepekaan hama sasaran terhadap insektisida yang sering digunakan. Penelitian ini bertujuan menentukan perbedaan kepekaan larva C. pavonana asal Cianjur, Jawa Barat, terhadap insektisida abamektin, klorantraniliprol, dan profenofos. Berdasarkan LC95 pada 72 JSP, ketiga jenis
insektisida tersebut memiliki toksisitas yang tinggi baik terhadap larva C. pavonana strain laboratorium maupun strain lapangan. LC95 pada 72 JSP
abamektin, klorantraniliprol, dan profenofos terhadap larva C. pavonana strain laboratorium berturut-turut 0.004, 0.014, dan 40.1 mg/L dan terhadap strain lapangan berturut-turut 0.006, 0.017, dan 49.5 mg/L. Berdasarkan nisbah resistensi pada taraf LC50 (72 JSP), larva C. pavonana terindikasi resisten
KEPEKAAN LARVA
Crocidolomia pavonana
ASAL CIANJUR,
JAWA BARAT,
TERHADAP TIGA JENIS INSEKTISIDA
ANITA WIDYAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada
Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Kepekaan Larva Crocidolomia pavonana Asal Cianjur, Jawa Barat, terhadap Tiga Jenis Insektisida
Nama Mahasiswa: Anita Widyawati
NIM : A34080018
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Endang Sri Ratna, Ph.D. Ir. Djoko Prijono, MAgrSc.
NIP 19580120 198203 2 001 NIP 19590827 198303 1 005
Mengetahui, Ketua Departemen
Dr. Ir. Abdjad Asih Nawangsih, M.Si. NIP 19650621 198910 2 001
RIWAYAT HIDUP
Penulis lahir di Cirebon pada tanggal 17 Juli 1990 sebagai anak pertama dari dua bersaudara pasangan Bapak Wahyu Ismail dan Ibu Erniyanah.
Penulis menyelesaikan pendidikan sekolah menengah atas Islam di SMAI Al-Azhar 5 Cirebon (2005-2008). Pada tahun 2008 penulis diterima sebagai mahasiswa Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) pada kurikulum berbasis mayor-minor.
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT yang atas rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi yang berjudul “Kepekaan Larva Crocidolomia pavonana Asal Cianjur, Jawa Barat, terhadap Tiga Jenis Insektisida”. Penelitian dan penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman dari Januari sampai Juli 2012.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada:
1. Endang Sri Ratna, Ph.D. selaku dosen pembimbing I yang senantiasa memberikan saran, masukan, dan arahan kepada penulis.
2. Ir. Djoko Prijono, MAgrSc. selaku dosen pembimbing II yang telah memberi masukan dan saran.
3. Dr. Ir. Swastiko Priyambodo, M.Si. selaku dosen pembimbing akademik yang selalu memberikan saran, arahan, dan motivasi.
4. Kedua orang tua tercinta yang selalu memberikan doa dan motivasi kepada penulis.
5. Rekan kerja di Laboratorium Fisiologi dan Toksikologi Serangga, Eka Chandra Lina M.Si, Herma Amalia M.Si, Yan Yanuar Syahroni, Rizky Irawan, SP., Miranti Christi Arifin, Yuke Nur Aprilianti, Yunian Asih Andriyarini, SP., Elsa Dwi Juliana, SP., dan Dian Fitria, SP.
6. Teman-teman seperjuangan Departemen Proteksi Tanaman, khususnya angkatan 45.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun. Semoga skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
TINJAUAN PUSTAKA ... 3
Bioekologi Ulat Krop Kubis Crocidolomia pavonana ... 3
Resistensi Hama terhadap Insektisida ... 4
Struktur dan Cara Kerja Insektisida ... 5
Abamektin ... 6
Klorantraniliprol ... 7
Profenofos ... 8
BAHAN DAN METODE ... 10
Tempat dan Waktu ... 10
Penyiapan Insektisida Uji ... 10
Penyiapan Tanaman Pakan Crocidolomia pavonana ... 10
Perbanyakan Serangga Uji ... 10
Uji Toksisitas ... 11
Uji Pendahuluan ... 12
Uji Lanjutan ... 12
HASIL DAN PEMBAHASAN ... 14
Toksisitas Insektisida Uji terhadap Larva Crocidolomia pavonana 14
Tingkat Resistensi ... 19
SIMPULAN DAN SARAN ... 22
DAFTAR PUSTAKA ... 23
DAFTAR TABEL
Halaman 1 Toksisitas tiga jenis insektisida terhadap larva C. pavonana strain
standar laboratorium (Departemen Proteksi Tanaman) ... 17
2 Toksisitas tiga jenis insektisida terhadap larva C. pavonana strain lapangan Cianjur ... 18
3 Nisbah resistensi C. pavonana terhadap insektisida abamektin, klorantraniliprol, dan profenofos (72 JSP) ... 20
DAFTAR GAMBAR
Halaman 1 Struktur kimia abamektin ... 62 Struktur kimia klorantraniliprol ... 7
3 Struktur kimia profenofos ... 8
DAFTAR LAMPIRAN
Halaman 1 Mortalitas larva Crocidolomia pavonana strain laboratorium pada
perlakuan abamektin ... 27 2 Mortalitas larva C. pavonana strain lapangan pada perlakuan
abamektin ... 27 3 Mortalitas larva C. pavonana strain laboratorium pada perlakuan
klorantraniliprol ... 27 4 Mortalitas larva C. pavonana strain lapangan pada perlakuan
klorantraniliprol ... 28 5 Mortalitas larva C. pavonana strain laboratorium pada perlakuan
profenofos ... 28 6 Mortalitas larva C. pavonana strain lapangan pada perlakuan
profenofos ... 28 7 Hasil wawancara dengan petani di daerah pengambilan serangga
PENDAHULUAN
Latar Belakang
Ulat krop kubis Crocidolomia pavonana (F.) (Lepidoptera: Crambidae) merupakan hama penting pada tanaman famili Brassicaceae (Sastrosiswojo dan Setiawati 1993). Ulat tersebut menyerang tanaman kubis sejak fase awal prapembentukan krop, yaitu 1-49 hari setelah tanam (HST) sampai fase pembentukan krop 50-85 HST (Soeroto et al. 1994). Ulat C. pavonana lebih sering memakan daun muda dan titik tumbuh yang sukulen, namun pada tingkat serangan yang tinggi dapat menghabiskan seluruh bagian daun. Kerusakan oleh ulat ini dapat menyebabkan kehilangan hasil hingga 100% pada musim kemarau (Sastrosiswojo dan Setiawati 1992).
Dalam usaha meminimumkan kerusakan tanaman akibat serangan hama, petani sering menggunakan insektisida sintetik untuk mengendalikan populasi serangga hama di lapangan. Menurut Djojosumarto (2008), penggunaan insektisida sintetik di Indonesia masih menempati urutan teratas. Petani enggan mengambil risiko kehilangan hasil sehingga mereka memilih alternatif pengendalian yang lebih efektif dan hasilnya cepat terlihat. Namun demikian, penggunaan insektisida sintetik dapat menimbulkan penurunan kepekaan hama sasaran terhadap insektisida yang sering digunakan. Aplikasi insektisida hanya efektif pada populasi hama rentan. Bila kepekaan hama sasaran terhadap insektisida sudah berkurang, insektisida tersebut tidak dapat lagi digunakan untuk mengendalikan hama sasaran dan hama tersebut dikategorikan sudah resisten (Zalom 2001; Djojosumarto 2008).
et al. 1990), terhadap abamektin di Brazil dengan NR 61.7 (Santos et al. 2011),
dan terhadap klorantraniliprol di Cina dengan NR 1.8-8.9 (Wang dan Wu 2012). Di dalam strategi pengelolaan resistensi, insektisida yang sering digunakan petani seperti insektisida berbahan aktif profenofos sering dialihkan atau dirotasikan dengan insektisida lain, seperti abamektin dan klorantraniliprol (Denholm et al. 1998). Ketiga bahan aktif tersebut memiliki cara kerja yang berbeda; abamektin sebagai racun pengganggu fungsi reseptor asam γ-amino butirat (GABA), klorantraniliprol sebagai modulator reseptor rianodin, dan profenofos merupakan racun penghambat aktivitas enzim asetilkolinesterase (AChE) (Perry et al. 1998; Djojosumarto 2008).
Menurut Zalom (2001), penggunaan insektisida yang baru diintroduksikan dapat mengurangi tekanan seleksi pada populasi hama yang telah resisten terhadap insektisida yang telah lama diaplikasikan tetapi dapat memicu terjadinya resistensi terhadap insektisida baru tersebut. Resistensi terhadap insektisida abamektin dan klorantraniliprol pada berbagai serangga telah didokumentasikan, seperti resistensi terhadap abamektin pada Spodoptera exigua di Pakistan (Ishtiaq et al. 2012) dan resistensi terhadap klorantraniliprol pada P. xylostella di dataran
tinggi Sulawesi Selatan (Prabaningrum et al. 2012).
Berdasarkan latar belakang di atas dan informasi tentang jenis insektisida yang sering digunakan oleh petani kubis di daerah Cianjur, perlu dilakukan pemantauan perubahan kepekaan populasi hama baik terhadap insektisida yang telah lama digunakan maupun terhadap insektisida yang lebih baru.
Tujuan Penelitian
Penelitian ini bertujuan menentukan perbedaan kepekaan larva C. pavonana asal Cianjur, Jawa Barat, terhadap insektisida abamektin, klorantraniliprol, dan profenofos.
Manfaat Penelitian
TINJAUAN PUSTAKA
Bioekologi Ulat Krop Kubis Crocidolomia pavonana
Crocidolomia pavonana (F.) (Lepidoptera: Crambidae) merupakan salah satu hama penting pada tanaman famili Brassicaceae. Larva C. pavonana menyerang tanaman pada fase vegetatif dan generatif yang dapat terjadi sepanjang tahun (Sastrosiswojo dan Setiawati 1993). Daerah persebaran hama ini meliputi Afrika Selatan, Asia Selatan, Asia Tenggara, Australia, dan Kepulauan Pasifik (Kalshoven 1981).
Telur C. pavonana biasanya diletakkan pada permukaan bawah daun kubis. Sebelum menetas, warna telur berubah menjadi oranye, lalu menjadi cokelat kekuningan, hingga akhirnya berwarna cokelat gelap. Kelompok telur yang diletakkan terdiri atas 9 sampai 120 butir telur dengan rata-rata 48 butir (Othman 1982). Masa inkubasi telur rata-rata 4 hari pada suhu antara 26.0 dan 33.2 oC (Sastrosiswojo dan Setiawati 1992) dan persentase penetasan telur rata-rata dapat mencapai 92.4% (Othman 1982).
Larva C. pavonana instar awal berwarna kuning kehijauan dengan kepala cokelat tua yang berukuran panjang berkisar dari 2.1 sampai 2.7 mm dan lama stadium rata-rata sekitar 2 hari. Larva instar II C. pavonana berwarna hijau muda, dengan panjang berkisar dari 5.5 sampai 6.1 mm dan lama stadium rata-rata 2 hari. Larva instar III C. pavonana berwarna hijau, dengan panjang berkisar dari 1.1 sampai 1.3 cm dan lama stadium rata-rata 1.5 hari. Larva instar IV C. pavonana berwarna hijau lebih tua dengan tiga titik hitam dan tiga garis
23 sampai 28 hari sedangkan imago jantan berkisar dari 24 sampai 29 hari (Prijono dan Hassan 1992).
Pengendalian hama C. pavonana dengan menggunakan insektisida kimia merupakan tindakan yang sering dilakukan oleh petani. Penggunaan insektisida secara rutin dapat menimbulkan berbagai dampak negatif. Karena itu, pengendalian terhadap hama C. pavonana perlu lebih memerhatikan prinsip-prinsip pengendalian hama terpadu (PHT).
Resistensi Hama terhadap Insektisida
Resistensi didefinisikan sebagai kemampuan bertahan yang dapat diwariskan dari suatu strain hama untuk mengatasi dosis suatu insektisida yang dapat membunuh sebagian besar individu dalam suatu populasi pada spesies yang sama. Resistensi dapat pula diartikan sebagai suatu fenomena evolusi yang merefleksikan seleksi gen resisten serangga akibat aplikasi insektisida. Gen tersebut menyandi berbagai mekanisme, terutama peningkatan detoksifikasi insektisida atau penurunan kepekaan bagian sasaran di dalam tubuh serangga. Tindakan penyemprotan insektisida yang intensif dilakukan dapat menyebabkan resistensi berkembang dengan cepat (Denholm dan Horowitz 2001; Scott 2001).
Resistensi dilaporkan pertama kali pada tahun 1908 yaitu pada kutu perisai Quadrispidiotus perniciosus yang telah resisten terhadap belerang (Pedigo 1989).
Contoh kasus resistensi lain yang telah dilaporkan seperti pada P. xylostella, Bemisia tabaci, Myzus persicae, Helicoverpa armigera, dan Musca domestica.
Resistensi pada C. pavonana belum banyak dilaporkan baik di dalam negeri maupun luar negeri (Denholm dan Horowitz 2001).
Struktur dan Cara Kerja Insektisida
Cara masuk insektisida ke dalam tubuh serangga sasaran dibedakan menjadi tiga kelompok yaitu sebagai racun lambung (racun perut, stomach poison), racun kontak, dan racun pernapasan. Insektisida yang bekerja sebagai racun perut membunuh serangga sasaran jika termakan dan masuk ke dalam organ pencernaan serangga. Selanjutnya, insektisida tersebut diserap dinding saluran pencernaan makanan kemudian dibawa oleh hemolimfe ke bagian tempat kerja insektisida tersebut. Oleh karena itu, serangga harus memakan bagian tanaman yang sudah disemprot dengan insektisida dalam jumlah yang cukup untuk membunuhnya. Insektisida yang bekerja sebagai racun kontak masuk ke dalam tubuh serangga sasaran melalui kulit (lapisan kutikula). Serangga akan mati bila bersinggungan dengan insektisida tersebut. Pada umumnya racun kontak juga berperan sebagai racun perut. Insektisida yang bersifat racun pernapasan merupakan insektisida yang bekerja melalui saluran trakea, sehingga dapat menyebabkan kematian pada hama bila menghirup insektisida dalam jumlah yang cukup (Djojosumarto 2008).
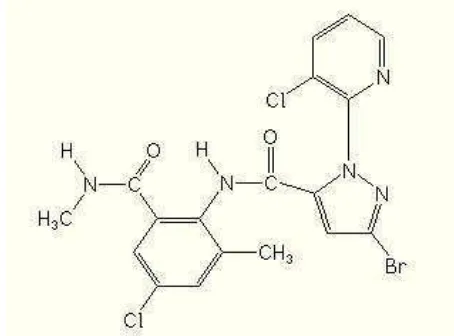
Abamektin
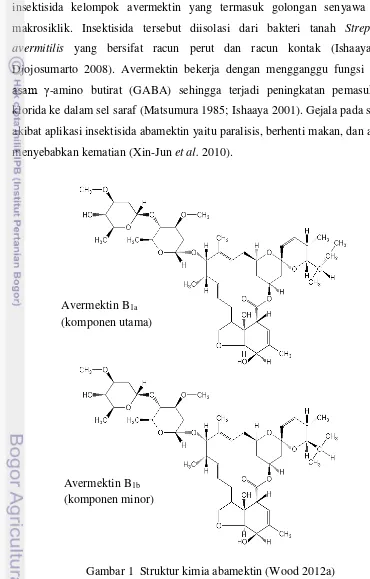
Abamektin merupakan campuran antara avermektin B1a dan avermektin B1b
(Wood 2012a) yang strukturnya ditunjukkan pada Gambar 1. Abamektin adalah insektisida kelompok avermektin yang termasuk golongan senyawa laktona makrosiklik. Insektisida tersebut diisolasi dari bakteri tanah Streptomyces avermitilis yang bersifat racun perut dan racun kontak (Ishaaya 2001;
Djojosumarto 2008). Avermektin bekerja dengan mengganggu fungsi reseptor asam γ-amino butirat (GABA) sehingga terjadi peningkatan pemasukan ion klorida ke dalam sel saraf (Matsumura 1985; Ishaaya 2001). Gejala pada serangga akibat aplikasi insektisida abamektin yaitu paralisis, berhenti makan, dan akhirnya menyebabkan kematian (Xin-Jun et al. 2010).
Gambar 1 Struktur kimia abamektin (Wood 2012a) Avermektin B1a
(komponen utama)
Avermektin B1b
Salah satu formulasi insektisida berbahan aktif abamektin yang terdaftar di Indonesia adalah Agrimec 18 EC. Insektisida tersebut terdaftar untuk mengendalikan Aphis pomi pada apel; Thrips parvispinus pada cabai; Phyllocnistis citrella pada jeruk; S. litura, Phaedonia inclusa, Lamprosema
indicata, Etiella zinckenella, dan Riptortus linearis pada kedelai; Maruca testulalis pada kacang panjang; Coptotermes curvignathus pada kelapa sawit; Liriomyza huidobrensis dan Thrips palmi pada kentang; L. chrysanthemi pada krisan; P. xylostella pada kubis; dan L. huidobrensis pada tomat (PPI 2012).
Klorantraniliprol
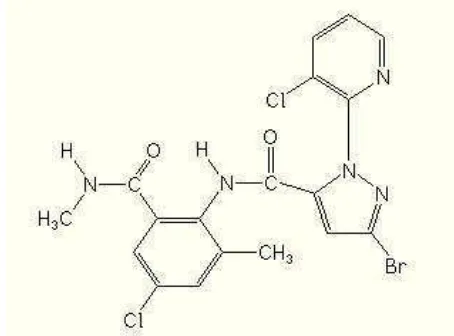
Klorantraniliprol mempunyai nama kimia 3-bromo-N-[4-kloro-2-metil-6-[(metilamino)karbonilfenil]-1-(3-kloro-2-piridinil-1H-pirazol-5-karboksamida (PCPA-R 2012) yang strukturnya ditunjukkan pada Gambar 2. Insektisida tersebut termasuk golongan senyawa antranilik diamida yang bersifat racun perut dan racun kontak (Djojosumarto 2008; Wang dan Wu 2012). Klorantraniliprol bekerja mengganggu saraf otot dengan mengaktifkan reseptor rianodin serangga yang menyebabkan ion kalsium intraselular berkurang sehingga serangga mengalami kelumpuhan otot kemudian mengalami kematian (Perry et al. 1998). Gejala pada serangga akibat aplikasi insektisida klorantraniliprol yaitu paralisis, berhenti makan, dan mati dalam beberapa hari (Cordova et al. 2006).
Salah satu formulasi insektisida berbahan aktif klorantraniliprol yang terdaftar di Indonesia adalah Prevathon 50 SC. Insektisida tersebut terdaftar untuk mengendalikan hama S. exigua pada bawang merah; S. litura pada cabai; M. testulalis dan L. huidobrensis pada kacang panjang; Conopomorpha cramerella pada kakao; S. litura pada kedelai; Metisa plana, C. curvignathus, dan Setora nitens pada kelapa sawit; Phthorimaea opercutella dan L. huidobrensis pada kentang; P. xylostella dan C. pavonana pada kubis; Scirpophaga incertulas dan Cnaphalocrosis medinalis pada padi; S. excerptalis pada tebu; S. litura, Heliothis assulta, dan Helicoverpa armigera pada tembakau; dan H. armigera pada tomat (PPI 2012).
Profenofos
Profenofos mempunyai nama kimia O-(4-bromo-2-klorofenil) O-etil S-propil fosforotioat (Wood 2012b) yang strukturnya ditunjukkan pada Gambar 3. Profenofos termasuk golongan organofosfat yang bersifat racun perut dan racun kontak (Djojosumarto 2008). Profenofos bersifat non-sistemik dan mempunyai spektrum yang luas. Mekanisme kerja profenofos yaitu menghambat kerja enzim asetilkolinesterase sehingga neurotransmitter asetilkolin yang berikatan dengan reseptornya di daerah pascasinapsis saraf pusat tidak terurai dan menimbulkan impuls saraf secara terus menerus. Gejala yang ditimbulkan berturut-turut eksitasi (kegelisahan), konvulsi (kekejangan), paralisis (kelumpuhan), dan akhirnya kematian (Matsumura 1985; Siegfried dan Scharf 2001; Djojosumarto 2008).
Gambar 3 Struktur kimia profenofos (Wood 2012b)
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB), dari Januari sampai Juli 2012.
Penyiapan Insektisida Uji
Insektisida yang digunakan yaitu abamektin (Agrimec 18 EC, b. a. 18.4 g/L), klorantraniliprol (Prevathon 50 SC, b. a. 50 g/L), dan profenofos
(Curacron 500 EC, b. a. 500 g/L).
Penyiapan Tanaman Pakan Crocidolomia pavonana
Tanaman brokoli (Brassica oleracea L. var. italica Plenck) digunakan untuk penyediaan pakan serangga uji dan sebagai medium perlakuan (Abizar dan Prijono 2010). Benih brokoli „Green Magic‟ disemai dalam nampan semai dengan media tanam berupa campuran tanah dan kompos Super Metan. Bersamaan dengan penyemaian dilakukan pemupukan dengan pupuk majemuk ”Dekastar” (NPK 18-9-10). Setelah bibit berumur 4 minggu atau sekurang-kurangnya memiliki 4 helai daun, bibit dipindahkan ke media tanam dalam polybag kapasitas 5 L yang diisi campuran tanah dan pupuk kandang dengan perbandingan 3:1 (v/v). Pada setiap polybag ditanam 1 bibit tanaman. Setelah berumur 4 minggu, tanaman dipupuk NPK dengan dosis ± 1 gram per polybag. Pupuk ditabur melingkar mengelilingi tanaman, lalu ditutup tanah dan disiram. Pemeliharaan tanaman brokoli yang dilakukan meliputi penyiraman, penyiangan gulma, dan pengendalian hama secara mekanis. Setelah tanaman brokoli berumur 2 bulan, daunnya digunakan sebagai pakan larva C. pavonana. Selama pemeliharaan tanaman brokoli tidak disemprot dengan pestisida.
Perbanyakan Serangga Uji
kurungan plastik-kasa berbingkai kayu (50 cm x 50 cm x 50 cm) dan diberi pakan larutan madu 10% yang diserapkan pada segumpal kapas yang digantungkan di dalam kurungan. Daun brokoli ditempatkan dalam tabung film berisi air dan diletakkan di dalam kurungan sebagai tempat peletakan telur. Kelompok telur pada daun brokoli dikumpulkan setiap hari. Setelah telur menetas, larva dipindahkan ke dalam wadah plastik (28 cm x 25 cm x 5 cm) berjendela kasa yang dialasi kertas stensil sebagai kertas hisap, dan diletakkan daun brokoli bebas pestisida sebagai pakan larva C. pavonana. Larva instar II digunakan untuk pengujian. Bila tidak digunakan untuk pengujian, sebagian larva dipelihara dan diperbanyak lebih lanjut dalam wadah plastik (35 cm x 25 cm x 6 cm) berisi daun brokoli. Pada saat larva akan memasuki fase pupa, larva dipindahkan ke dalam wadah plastik lain yang berisi serbuk gergaji sebagai medium untuk berpupa. Serbuk gergaji tersebut sebelumnya diayak, kemudian dioven pada suhu 105 °C selama ± 24 jam. Pupa beserta kokonnya dipindahkan ke dalam kurungan plastik-kasa seperti di atas sampai muncul imago untuk pemeliharaan selanjutnya.
Populasi larva C. pavonana yang diuji kerentanannya terhadap insektisida berasal dari pertanaman kubis petani di Kecamatan Pacet, Kabupaten Cianjur. Larva diambil dan dikoleksi dalam wadah plastik berjendela kasa, kemudian dipelihara dan diperbanyak di Laboratorium Fisiologi dan Toksikologi, Departemen Proteksi Tanaman, IPB. Larva diberi pakan daun kubis yang diperoleh dari lapangan dengan asumsi bahwa larva masih tetap terpapar insektisida yang diaplikasikan oleh petani. Pakan disimpan dalam lemari es (± 4 ºC) di laboratorium. Larva dipelihara hingga imago dengan cara yang sama seperti perbanyakan serangga strain laboratorium. Larva instar II dari imago generasi I digunakan untuk pengujian.
Uji Toksisitas
Uji Pendahuluan
Uji pendahuluan diperoleh berdasarkan acuan dari konsentrasi anjuran yang tertera pada label formulasi masing-masing insektisida. Insektisida berbahan aktif abamektin (Agrimec 18 EC) diuji pada konsentrasi 0.0575, 0.115, 0.23, 0.46, dan 0.92 mg/L. Klorantraniliprol (Prevathon 50 SC) diuji pada konsentrasi 0.315, 0.625, 1.25, 2.5, dan 5 mg/L. Profenofos (Curacron 500 EC) diuji pada konsentrasi 4, 7.5, 10, 13.5, dan 17.5 mg/L. Larutan pengencer yang digunakan adalah akuades yang mengandung 0.2 ml/L perekat Agristick (berbahan aktif alkilaril poliglikol eter 400 g/L). Setiap perlakuan dengan setiap taraf konsentrasi pengenceran insektisida dan kontrol diulang tiga kali.
Potongan daun brokoli (4 cm x 4 cm) segar dan bebas pestisida dicelup satu per satu dalam suspensi insektisida dengan konsentrasi tertentu sampai basah merata lalu dikeringanginkan. Daun kontrol dicelup dalam akuades yang mengandung Agristick 0.2 ml/L. Setelah lapisan cairan insektisida pada daun mengering, setiap potong daun perlakuan dan daun kontrol diletakkan secara terpisah pada bagian tutup cawan petri (diameter 10 cm) yang dialasi tisu yang ukurannya melebihi diameter cawan dan sebelumnya telah diletakkan 15 larva instar II C. pavonana. Selanjutnya, bagian dasar cawan segera ditutupkan di atas bagian tutup cawan yang telah berisi larva uji dan daun perlakuan atau daun kontrol. Dengan demikian, bagian tutup dan dasar cawan tersekat tisu sehingga larva uji tidak dapat keluar dari dalam cawan (Abizar dan Prijono 2010). Larva uji dibiarkan makan selama 24 jam. Setelah 24 jam ditambahkan daun perlakuan atau daun kontrol secukupnya. Dua puluh empat jam berikutnya, daun perlakuan diganti dengan daun tanpa perlakuan. Jumlah larva yang mati diamati dan dicatat setiap hari sampai hari ke-3 (72 jam sejak perlakuan [JSP]).
Uji Lanjutan
100, dan 150 mg/L. Cara perlakuan dan pengamatan pada uji lanjutan sama seperti uji pendahuluan, tetapi pada uji lanjutan setiap perlakuan diulang 6 kali. Data mortalitas kumulatif pada 24, 48, dan 72 JSP diolah dengan analisis probit menggunakan program POLO-PC (LeOra Software 1987) untuk menentukan nilai LC50 dan LC95. Hubungan antara waktu dan tingkat kematian larva pada lima taraf
konsentrasi uji dipetakan menggunakan Microsoft Office Excel 2007.
Sebagai tolok ukur resistensi digunakan nisbah resistensi (NR) pada taraf LC50 yang dihitung dengan rumus sebagai berikut:
LC50 serangga strain lapangan
NR =
LC50 serangga strain laboratorium
HASIL DAN PEMBAHASAN
Toksisitas Insektisida Uji terhadap Larva Crocidolomia pavonana
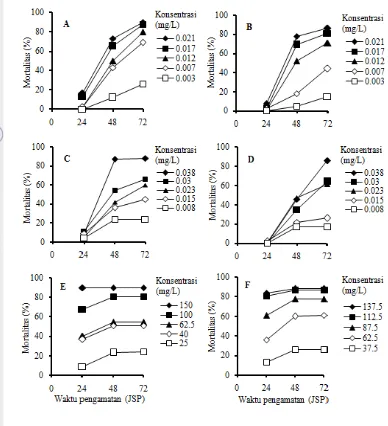
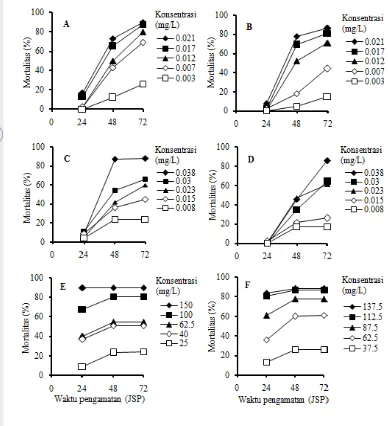
Mortalitas larva C. pavonana akibat perlakuan insektisida abamektin, klorantraniliprol, dan profenofos pada uji pemantapan secara umum telah terjadi pada pengamatan 24 jam setelah perlakuan (JSP), kemudian tingkat mortalitas meningkat secara tajam pada 48 JSP dan kematian larva C. pavonana masih meningkat pada 72 JSP kecuali pada perlakuan profenofos (Gambar 4). Persentase kematian awal yang cukup tinggi terjadi pada perlakuan dengan insektisida profenofos baik pada larva C. pavonana strain laboratorium maupun strain lapangan bila dibandingkan dengan perlakuan abamektin dan klorantraniliprol. Persentase kematian larva C. pavonana pada perlakuan profenofos pada 24 JSP meningkat seiring dengan penambahan konsentrasi perlakuan baik pada strain laboratorium maupun strain lapangan (Gambar 4E dan 4F). Tingginya kematian larva C. pavonana pada pengamatan awal menunjukkan bahwa insektisida profenofos bekerja sangat cepat dalam membunuh serangga, karena insektisida tersebut dapat mencapai sasaran celah sinapsis saraf dengan cepat setelah masuk ke dalam tubuh serangga uji melalui kontak atau termakan bersama daun perlakuan (Perry et al. 1998). Hasil perlakuan profenofos tersebut berbeda dibandingkan dengan perlakuan abamektin dan klorantraniliprol pada semua taraf konsentrasi, yaitu kedua insektisida yang disebut terakhir mengakibatkan kematian cukup rendah dan relatif tidak jauh berbeda, yaitu berkisar 0-20% (Gambar 4A dan 4B; 4C dan 4D).
Gambar 4 Perkembangan tingkat mortalitas larva C. pavonana. (A) abamektin, strain laboratorium; (B) abamektin, strain lapangan; (C) klorantra-niliprol, strain laboratorium; (D) klorantraklorantra-niliprol, strain lapangan; (E) profenofos, strain laboratorium; (F) profenofos, strain lapangan. Pada semua perlakuan, tidak ada kematian larva kontrol hingga 72 JSP.
dan gangguan impuls saraf yang mengakibatkan serangga lumpuh dan berhenti makan kemudian mengalami kematian. Insektisida abamektin bekerja dengan merangsang reseptor asam γ-amino butirat (GABA) yang dapat meningkatkan pemasukan ion klorida ke dalam sel saraf (Perry et al. 1998).
larva C. pavonana strain laboratorium kurang dari 10%, sedangkan pada larva C. pavonana strain lapangan tidak terjadi kematian (Gambar 4C dan 4D). Peningkatan mortalitas serangga uji akibat perlakuan klorantraniliprol terjadi pada 48 JSP. Pada konsentrasi klorantraniliprol 0.038 mg/L, mortalitas serangga uji strain laboratorium telah melebihi 80%, sedangkan mortalitas serangga strain lapangan hanya sekitar 40%. Pada akhir pengamatan (72 JSP), mortalitas larva C. pavonana strain laboratorium berkisar dari sekitar 20% sampai 90% (Gambar 4C)
dan mortalitas larva C. pavonana strain lapangan berkisar dari sekitar 15% sampai 90% (Gambar 4D). Klorantraniliprol mengganggu saraf otot dengan mengaktifkan reseptor rianodin serangga. Pengaktifan ini merangsang pelepasan ion kalsium yang mengganggu pengaturan kontraksi otot, yang selanjutnya mengakibatkan kelumpuhan dan kematian serangga (PCPA-R 2012).
Pada 24 JSP, perlakuan profenofos mengakibatkan kematian larva C. pavonana strain laboratorium dan larva C. pavonana strain lapangan dengan
konsentrasi tertinggi (masing-masing 150 dan 137.5 mg/L) lebih dari 100% dan 80% (Gambar 4E dan 4F). Pada 72 JSP secara umum tidak terjadi peningkatan mortalitas serangga uji pada perlakuan profenofos. Cara kerja insektisida tersebut yaitu menghambat kerja enzim asetilkolinesterase sehingga terjadi akumulasi asetilkolin dan merusak fungsi saraf. Gejala keracunan yang ditunjukkan oleh serangga akibat insektisida golongan organofosfat adalah hiperaktif kemudian menggelepar lalu lumpuh dan mati (Perry et al. 1998).
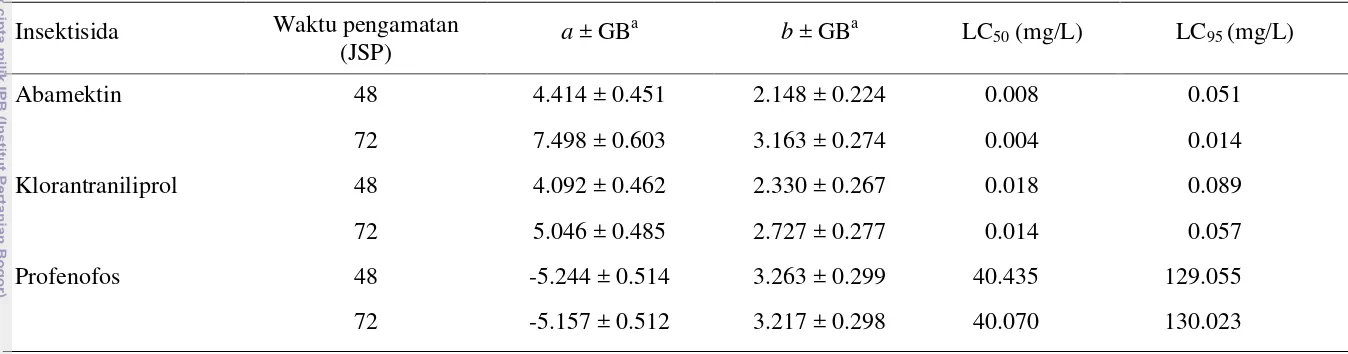
Pada 24 JSP, mortalitas serangga uji pada perlakuan dengan insektisida abamektin, klorantraniliprol, dan profenofos pada konsentrasi tertinggi kurang dari 50%. Karena itu, analisis probit dilakukan terhadap data mortalitas pada 48 dan 72 JSP. Nilai LC50 dan LC95 insektisida abamektin, klorantraniliprol, dan
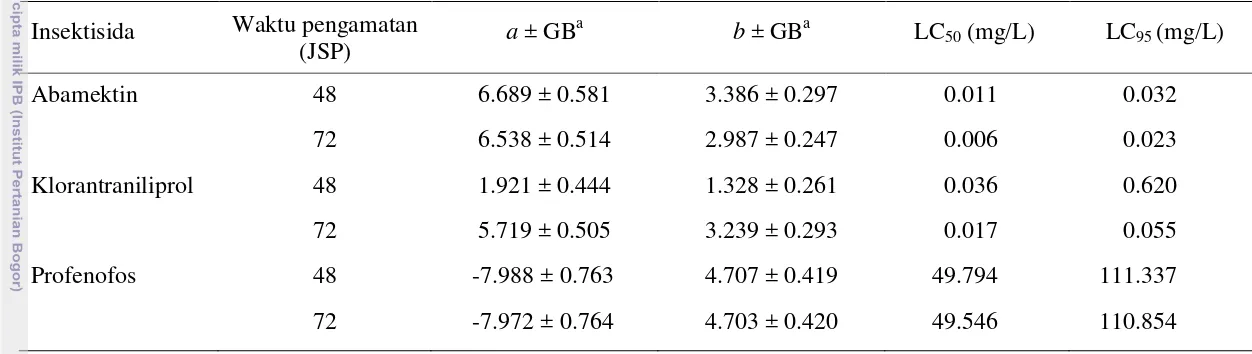
profenofos terhadap larva C. pavonana strain laboratorium pada 72 JSP berturut-turut 0.004 dan 0.014 mg/L, 0.014 dan 0.057 mg/L, serta 40.070 dan 130.023 mg/L (Tabel 1) serta terhadap larva C. pavonana strain lapangan berturut-turut 0.006 dan 0.023 mg/L, 0.017 dan 0.055 mg/L, serta 49.546 dan 110.854 mg/L (Tabel 2). Nilai-nilai LC50 dan LC95 tersebut masih jauh di bawah konsentrasi
Tabel 1 Toksisitas tiga jenis insektisida terhadap larva C. pavonana strain standar laboratorium (Departemen Proteksi Tanaman)
Insektisida Waktu pengamatan
(JSP) a ± GB
a
b ± GBa LC50 (mg/L) LC95 (mg/L)
Abamektin 48 4.414 ± 0.451 2.148 ± 0.224 0.008 0.051
72 7.498 ± 0.603 3.163 ± 0.274 0.004 0.014 Klorantraniliprol 48 4.092 ± 0.462 2.330 ± 0.267 0.018 0.089 72 5.046 ± 0.485 2.727 ± 0.277 0.014 0.057
Profenofos 48 -5.244 ± 0.514 3.263 ± 0.299 40.435 129.055
72 -5.157 ± 0.512 3.217 ± 0.298 40.070 130.023
a
a = intersep, b = kemiringan garis regresi, GB = galat baku.
Tabel 2 Toksisitas tiga jenis insektisida terhadap larva C. pavonana strain lapangan Cianjur Insektisida Waktu pengamatan
(JSP) a ± GB
a
b ± GBa LC50 (mg/L) LC95 (mg/L)
Abamektin 48 6.689 ± 0.581 3.386 ± 0.297 0.011 0.032
72 6.538 ± 0.514 2.987 ± 0.247 0.006 0.023 Klorantraniliprol 48 1.921 ± 0.444 1.328 ± 0.261 0.036 0.620 72 5.719 ± 0.505 3.239 ± 0.293 0.017 0.055
Profenofos 48 -7.988 ± 0.763 4.707 ± 0.419 49.794 111.337
72 -7.972 ± 0.764 4.703 ± 0.420 49.546 110.854
a
a = intersep, b = kemiringan garis regresi, GB = galat baku.
(Agrimec 18 EC), 40-50 mg/L untuk klorantraniliprol (Prevathon 50 SC), dan 750 mg/L untuk profenofos (Curacron 500 EC). Dengan demikian ketiga jenis insektisida tersebut masih efektif terhadap larva C. pavonana.
Berdasarkan hasil analisis probit terhadap data mortalitas C. pavonana strain laboratorium dan strain lapangan pada 48 dan 72 JSP, LC50 dan LC95
insektisida abamektin dan klorantraniliprol cenderung makin kecil (Tabel 1 dan 2). Namun, LC95 profenofos cenderung meningkat. Hal tersebut karena pada
konsentrasi yang lebih tinggi, peningkatan mortalitasnya lebih rendah dibandingkan dengan konsentrasi yang lebih rendah sehingga kemiringan garis regresi probit lebih kecil. Toksisitas insektisida abamektin lebih kuat daripada insektisida klorantraniliprol dan profenofos yang ditunjukkan dengan nilai LC50
dan LC95 yang lebih kecil (Tabel 1 dan 2).
Tingkat Resistensi
Populasi lapangan (Cianjur) C. pavonana terindikasi telah resisten terhadap ketiga jenis insektisida yang diuji dengan nilai NR lebih dari satu (Tabel 3). Namun nisbah resistensi larva C. pavonana tersebut masih di bawah ketentuan yang dikemukakan oleh Winterringham (1969 dalam Soemawinata et al. 1994) (NR ≥ 4).
Berdasarkan nisbah resistensi LC50 pada 72 JSP, larva C. pavonana
Tabel 3 Nisbah resistensi larva C. pavonana terhadap insektisida abamektin, klorantraniliprol, dan profenofos (72 JSP)
Insektisida
LC50 (mg/L)
NRa Statusb Populasi laboratorium (standar) Populasi lapangan (Cianjur)
Abamektin 0.004 0.006 1.50 Terindikasi resisten Klorantraniliprol 0.014 0.017 1.21 Terindikasi resisten Profenofos 40.070 49.546 1.24 Terindikasi resisten a
NR = LC50 strain lapangan/ LC50 strain laboratorium. b
Menurut Dono et al. (2010), indikasi resisten bila nilai NR > 1.
yaitu 2 minggu sekali. Selain itu, tampaknya frekuensi gen resisten dalam populasi C. pavonana relatif rendah sehingga hama tersebut tidak cepat resisten terhadap insektisida yang digunakan.
Nisbah resistensi larva C. pavonana terhadap profenofos lebih rendah dibandingkan dengan abamektin, kemungkinan karena saat ini tidak banyak petani yang menggunakan insektisida tersebut. Tindakan penyemprotan juga tidak dilakukan secara intensif. Kebanyakan petani di Cianjur lebih mengandalkan klorantraniliprol untuk mengendalikan hama C. pavonana sebab sebelumnya tingkat resistensi populasi C. pavonana di daerah tersebut terhadap profenofos sudah cukup tinggi sehingga hama C. pavonana tidak dapat lagi dikendalikan dengan insektisida tersebut dengan konsentrasi yang rendah.
Nisbah resistensi larva C. pavonana terhadap abamektin, klorantraniliprol,
dan profenofos jauh lebih rendah daripada nisbah resistensi larva P. xylostella. Larva P. xylostella dilaporkan telah resisten terhadap beberapa jenis insektisida.
perilaku petani dalam menggunakan insektisida untuk mengendalikan hama kubis, seperti frekuensi penyemprotan dan pola penggunaan insektisida. Berkurangnya frekuensi penggunaan insektisida menurunkan tekanan seleksi, sehingga akan meningkatkan proporsi individu serangga rentan, sementara pergiliran pestisida dapat memperlambat perkembangan resistensi hama sasaran terhadap insektisida (Georghiou dan Mellon 1983).
SIMPULAN DAN SARAN
Insektisida abamektin memiliki toksisitas yang paling tinggi dan profenofos memiliki toksisitas paling rendah terhadap larva C. pavonana. Populasi larva C. pavonana asal pertanaman kubis di Cianjur telah terindikasi resisten terhadap
insektisida abamektin, klorantraniliprol, dan profenofos. Nisbah resistensi larva C. pavonana tertinggi terjadi pada perlakuan abamektin, sedangkan nisbah resistensi
larva C. pavonana terhadap klorantraniliprol dan profenofos hampir sama.
DAFTAR PUSTAKA
Abizar M, Prijono D. 2010. Aktivitas insektisida ekstrak daun dan biji Tephrosia vogelii J.D. Hooker (Leguminosae) dan ekstrak buah Piper cubeba L. (Piperaceae) terhadap larva Crocidolomia pavonana (F.) (Lepidoptera: Crambidae). JHPT Trop. 10(1):1-12.
Basana IR, Prijono D. 1994. Insecticidal activity of aqueous seed extracts of four species of Annona (Annonaceae) against cabbage head caterpillar Crocidolomia binotalis Zeller (Lepidoptera: Pyralidae). Bul HPT. 7(2):50-90.
Cordova D, Benner EA, Sacher MD, Rauh JJ, Sopa GP, et al. 2006. Anthranilic diamides: A new class of insecticides with novel mode of action, ryanodine receptor activation [abstract]. Pestic Biochem Physiol. 84(3):196-124. Dadang, Prijono D. 2008. Insektisida Nabati: Prinsip, Pemanfaatan, dan
Pengembangan. Bogor (ID): Departemen Proteksi Tanaman, Institut Pertanian Bogor.
Denholm I, Horowitz RA. 2001. Impact of insecticide resistance mechanisms on management strategies. Di dalam: Ishaaya I, editor. Biochemical Sites of Insecticide Action and Resistance. New York (US): Springer-Verlag. hlm 323-335.
Denholm I, Horowitz RA, Cahill M, Ishaaya I. 1998. Management of resistance to novel insecticides. Di dalam: Ishaaya I, Degheele D, editor. Insecticides with Novel Modes of Action. New York (US): Springer-Verlag. hlm 339-341.
Djojosumarto P. 2008. Pestisida dan Aplikasinya. Jakarta (ID): Agromedia Pustaka.
Dono D, Ismayana S, Idar, Prijono D, Muslikha I. 2010. Status dan mekanisme resistensi biokimia Crocidolomia pavonana (F.) (Lepidoptera: Crambidae) terhadap insektisida organofosfat serta kepekannya terhadap insektisida botani ekstrak biji Barringtonia asiatica. J Entomol Indones. 7(1):9-27.
Georghiou GP, Mellon RB. 1983. Pesticide resistance in time and space. Di dalam: Georghiou GP, Saito T, editor. Pest Resistance to Pesticides. New
York (US): Plenum Press.
Ishaaya I. 2001. Biochemical processes related to insecticide action; an overview. Di dalam: Ishaaya I, editor. Biochemical Sites of Insecticide Action and Resistance. New York (US): Springer-Verlag. hlm 1-10.
Ishtiaq M, Saleem MA, Razaq M. 2012. Monitoring of resistance in Spodoptera exigua (Lepidoptera: Noctuidae) from four districts of the Southern Punjab, Pakistan to four conventional and six new chemistry insecticides. Crop Prot. 33(12):13-20.
Kim GH, Seo YS, Lee JH, Cho KY. 1990. [Development of fenvalerate resistance in the diamondback moth Plutella xylostella Linn. (Lepidoptera: Yponomeutidae)] [dalam bahasa Korea]. Kor J Appl Entomol. 29(3):194-200.
LeOra Software. 1987. POLO-PC User’s Guide. Petaluma (US): LeOra Software. Matsumura F. 1985. Toxicology of Insecticides. Ed ke-2. New York (US): Plenum
Press.
Othman N. 1982. Biology of Crocidolomia binotalis Zell. (Lepidoptera: Pyralidae) and its parasites from Cipanas area (West Java) (a report of training course research). Bogor (ID): Seameo-Biotrop.
[PCPA-R] Pest Control Products Act and Regulations. 2012. Evaluation report: chlorantraniliprole [Internet]. Sante (US). Health Canada‟s Pest Management Regulatory Agency; [diunduh 2012 okt 10]. Tersedia pada: http://www.solutionsstores.com/Chlorantraniliprole_Information_s/736.html Pedigo LP. 1989. Entomology and Pest Management. New York (US): Macmillan
Publishing Company.
Perry AS, Yamamoto I, Ishaaya I, Perry RY. 1998. Insecticides in Agriculture and Environment: Retrospects and Prospects. New York (US): Springer-Verlag.
[PPI] Pusat Perizinan dan Investasi. 2012. Pestisida Pertanian dan Kehutanan Tahun 2012. Jakarta: PPI, Sekretariat Jenderal Kementrian Pertanian Republik Indonesia.
Prabaningrum L, Uhan TS, Nurwahidah U, Hendra A, Karmin. 2012. Pemantauan resistensi Plutella xylostella terhadap insektisida yang umum digunakan oleh petani kubis di dataran tinggi Sulawesi Selatan sebagai dasar pemilihan insektisida yang tepat [Internet]. Jakarta (ID): Badan Penelitian dan Pengembangan Pertanian; [diunduh 2012 Sep 1]. Tersedia pada: http://pkpp.ristek.go.id/_assets/upload/docs/665_doc_1.pdf.
Prijono D, Hassan E. 1992. Life cycle and demography of Crocidolomia binotalis Zell. (Lepidoptera: Pyralidae) on broccoli in the laboratory. Indon J Trop Agric. 4(1):18-24.
Qian L, Cao G, Song J, Yin Q, Han Z. 2008. Biochemical mechanisms conferring cross-resistance between tebufenozide and abamectin in Plutella xylostella. Pestic Biochem Physiol. 91(12):175-179.
Santos V, Siquera DH, Silva DJ, Farias DM. 2011. Insecticide resistance in populations of the diamondback moth, Plutella xylostella (L.) (Lepidoptera: Plutellidae), from the State of Pernambuco, Brazil. J Neotrop Entomol. 40(2):264-270.
Santoso AB. 1997. Deteksi resistensi profenofos terhadap Crocidolomia binotalis Zell. (Lepidoptera: Pyralidae) dan pengaruh konsentrasi subletal profenofos terhadap berat pupa, keberhasilan pupa menjadi imago, reproduksi dan lama hidup imago [skripsi]. Bogor (ID): Institut Pertanian Bogor.
editor. Diamondback Moth and Other Crucifer Pests. Proceedings of the Second International Workshop; 1990 Dec 10-14; Tainan. Taiwan (TW): AVRDC. hlm 81-87.
Sastrosiswojo B, Setiawati W. 1993. Hama-hama tanaman kubis dan cara pengendaliannya. Di dalam: Permadi AH, Sastrosiswojo S, editor. Kubis. Bandung (ID): Badan Penelitian dan Pengembangan Pertanian dan Balai Penelitian Hortikultura. hlm 39-50.
Scott JG. 2001. Cytochrome P450 monooxygenases and insecticide resistance: lessons from CYP6D1. Di dalam: Ishaaya I, editor. Biochemical Sites of Insecticide Action and Resistance. New York (US): Springer-Verlag. hlm 255-263.
Siegfried BD, Scharf ME. 2001. Mechanisms of organophosphate resistance in insects. Di dalam: Ishaaya I, editor. Biochemical Sites of Insecticide Action and Resistance. New York (US): Springer-Verlag. hlm 269-287.
Soemawinata RAT, Prijono D, Santosa TH. 1994. Status resistensi wereng coklat Nilaparvata lugens Stal. (Homoptera: Delphacidae) terhadap empat jenis insektisida. Bul HPT. 7(1):11-22.
Soeroto, Hikmat A, Cahyaniati. 1994. Pengelolaan Organisme Pengganggu Tumbuhan secara Terpadu pada Tanaman Kubis. Jakarta (ID): Direktorat Jenderal Pertanian Tanaman Pangan, Direktorat Bina Perlindungan Tanaman.
Sudarjat. 1993. Tingkat resistensi Plutella xylostella L. (Lepidoptera: Plutellidae) di Arjasari terhadap beberapa macam insektisida [skripsi]. Bandung (ID): Universitas Padjajaran.
Suharti T. 2000. Status resistensi Crocidolomia binotalis Zell. (Lepidoptera: Pyralidae) terhadap insektisida profenofos (Curacron 500 EC) dari tiga daerah di Jawa Barat (Garut, Pengalengan, Lembang) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Wang X, Wu Y. 2012. High levels of resistance to chlorantraniliprole evolved in field populations of Plutella xylostella. J Econ Entomol. 105(3):23-1019. Wood A. 2012a. Compendium of pesticide common names: abamectin.
http://www.alanwood.net/pesticides/abamectin.html [7 Jan 2013].
Wood A. 2012b. Compendium of pesticide common names: profenofos. http://www.alanwood.net/pesticides/profenofos.html [7 Jan 2013].
Zalom FG. 2001. Pesticide use practices in integrated pest management. Di dalam: Krieger R, Doull J, Ecobichon D, Gammon D, Hodgson et al.,
editor. Handbook of Pesticide Toxicology. Vol 1. San Diego (US): Academic Press. hlm 275-283.
Lampiran 1 Mortalitas larva Crocidolomia pavonana strain laboratorium pada perlakuan abamektin
Konsentrasi (mg/L) Mortalitas kumulatif (%) pada JSP
a
24 48 72
0.003 0 13.3 28.9
0.007 2.2 47.8 76.7
0.012 2.2 55.6 88.9
0.017 14.4 72.2 97.8
0.021 18.9 81.1 100.0
a
JSP = jam setelah perlakuan.
Jumlah serangga uji pada awal perlakuan adalah 15 ekor larva instar II untuk semua perlakuan. Larva diberi makan daun perlakuan selama 2 x 24 jam.
Lampiran 2 Mortalitas larva C. pavonana strain lapangan pada perlakuan abamektin
Konsentrasi (mg/L) Mortalitas kumulatif (%) pada JSP
a
24 48 72
0.003 0 5.6 16.7
0.007 2.2 20.0 48.9
0.012 1.1 57.8 78.9
0.017 2.2 76.7 90.0
0.021 8.9 86.7 95.6
Catatan kaki seperti pada Lampiran 1.
Lampiran 3 Mortalitas larva C. pavonana strain laboratorium pada perlakuan klorantraniliprol
Konsentrasi (mg/L) Mortalitas kumulatif (%) pada JSP
a
24 48 72
0.008 4.4 26.7 26.7
0.015 10.0 40.0 50.0
0.023 5.6 46.7 66.7
0.030 12.2 60.0 73.3
0.038 10.0 96.7 97.8
Lampiran 4 Mortalitas larva C. pavonana strain lapangan pada perlakuan klorantraniliprol
Konsentrasi (mg/L) Mortalitas kumulatif (%) pada JSP
a
24 48 72
0.008 0 18.9 18.9
0.015 2.2 24.4 28.9
0.023 1.1 52.2 67.8
0.030 0 38.9 71.1
0.038 0 51.1 95.6
Catatan kaki seperti pada Lampiran 1.
Lampiran 5 Mortalitas larva C. pavonana strain laboratorium pada perlakuan profenofos
Konsentrasi (mg/L) Mortalitas kumulatif (%) pada JSP
a
24 48 72
25 10.0 25.6 26.7 40 41.1 56.7 56.7 62.5 44.4 61.1 61.1 100 75.6 90.0 90.0 150 100.0 100.0 100.0 Catatan kaki seperti pada Lampiran 1.
Lampiran 6 Mortalitas larva C. pavonana strain lapangan pada perlakuan profenofos
Konsentrasi (mg/L) Mortalitas kumulatif (%) pada JSP
a
24 48 72
37.5 14.4 28.9 28.9
62.5 40.0 66.7 67.8
87.5 67.8 86.7 86.7
112.5 90.0 96.7 96.7
137.5 93.3 97.8 97.8
Lampiran 7 Hasil wawancara demham petani di daerah pengambilan serangga lapangan Tanggal pengambilan Lokasi pengambilan Nama pemilik Jenis insektisida
(bahan aktif) Frekuensi aplikasi 9 Februari 2012 Desa Rarahan, Cibodas Ukar Dursban 200 EC 2 minggu sekali
Prevathon 50 SC Desa Rarahan, Cibodas H. Yamin Curacron 500 EC
Agrimec 18 EC
Dalam 1 musim 7-8 kali penyemprotan
7 Juni 2012 Desa Cimacan, Cibodas Iwan Prevathon 50 SC 2 minggu sekali
Agrimec 18 EC
Desa Cimacan, Cibodas Atih Prevathon 50 SC 2 minggu sekali Bestox 50 EC
Agrimec 18 EC
ABSTRAK
ANITA WIDYAWATI. Kepekaan Larva Crocidolomia pavonana Asal Cianjur, Jawa Barat, terhadap Tiga Jenis Insektisida. Dibimbing oleh ENDANG SRI RATNA dan DJOKO PRIJONO.
Crocidolomia pavonana merupakan hama penting pada kubis yang dapat menyebabkan kerusakan tanaman dan menurunkan produksi. Dalam usaha meminimumkan kehilangan hasil, petani sering menggunakan insektisida untuk mengendalikan hama C. pavonana. Penggunaan insektisida secara terus menerus dapat menurunkan kepekaan hama sasaran terhadap insektisida yang sering digunakan. Penelitian ini bertujuan menentukan perbedaan kepekaan larva C. pavonana asal Cianjur, Jawa Barat, terhadap insektisida abamektin, klorantraniliprol, dan profenofos. Berdasarkan LC95 pada 72 JSP, ketiga jenis
insektisida tersebut memiliki toksisitas yang tinggi baik terhadap larva C. pavonana strain laboratorium maupun strain lapangan. LC95 pada 72 JSP
abamektin, klorantraniliprol, dan profenofos terhadap larva C. pavonana strain laboratorium berturut-turut 0.004, 0.014, dan 40.1 mg/L dan terhadap strain lapangan berturut-turut 0.006, 0.017, dan 49.5 mg/L. Berdasarkan nisbah resistensi pada taraf LC50 (72 JSP), larva C. pavonana terindikasi resisten
PENDAHULUAN
Latar Belakang
Ulat krop kubis Crocidolomia pavonana (F.) (Lepidoptera: Crambidae) merupakan hama penting pada tanaman famili Brassicaceae (Sastrosiswojo dan Setiawati 1993). Ulat tersebut menyerang tanaman kubis sejak fase awal prapembentukan krop, yaitu 1-49 hari setelah tanam (HST) sampai fase pembentukan krop 50-85 HST (Soeroto et al. 1994). Ulat C. pavonana lebih sering memakan daun muda dan titik tumbuh yang sukulen, namun pada tingkat serangan yang tinggi dapat menghabiskan seluruh bagian daun. Kerusakan oleh ulat ini dapat menyebabkan kehilangan hasil hingga 100% pada musim kemarau (Sastrosiswojo dan Setiawati 1992).
Dalam usaha meminimumkan kerusakan tanaman akibat serangan hama, petani sering menggunakan insektisida sintetik untuk mengendalikan populasi serangga hama di lapangan. Menurut Djojosumarto (2008), penggunaan insektisida sintetik di Indonesia masih menempati urutan teratas. Petani enggan mengambil risiko kehilangan hasil sehingga mereka memilih alternatif pengendalian yang lebih efektif dan hasilnya cepat terlihat. Namun demikian, penggunaan insektisida sintetik dapat menimbulkan penurunan kepekaan hama sasaran terhadap insektisida yang sering digunakan. Aplikasi insektisida hanya efektif pada populasi hama rentan. Bila kepekaan hama sasaran terhadap insektisida sudah berkurang, insektisida tersebut tidak dapat lagi digunakan untuk mengendalikan hama sasaran dan hama tersebut dikategorikan sudah resisten (Zalom 2001; Djojosumarto 2008).
et al. 1990), terhadap abamektin di Brazil dengan NR 61.7 (Santos et al. 2011),
dan terhadap klorantraniliprol di Cina dengan NR 1.8-8.9 (Wang dan Wu 2012). Di dalam strategi pengelolaan resistensi, insektisida yang sering digunakan petani seperti insektisida berbahan aktif profenofos sering dialihkan atau dirotasikan dengan insektisida lain, seperti abamektin dan klorantraniliprol (Denholm et al. 1998). Ketiga bahan aktif tersebut memiliki cara kerja yang berbeda; abamektin sebagai racun pengganggu fungsi reseptor asam γ-amino butirat (GABA), klorantraniliprol sebagai modulator reseptor rianodin, dan profenofos merupakan racun penghambat aktivitas enzim asetilkolinesterase (AChE) (Perry et al. 1998; Djojosumarto 2008).
Menurut Zalom (2001), penggunaan insektisida yang baru diintroduksikan dapat mengurangi tekanan seleksi pada populasi hama yang telah resisten terhadap insektisida yang telah lama diaplikasikan tetapi dapat memicu terjadinya resistensi terhadap insektisida baru tersebut. Resistensi terhadap insektisida abamektin dan klorantraniliprol pada berbagai serangga telah didokumentasikan, seperti resistensi terhadap abamektin pada Spodoptera exigua di Pakistan (Ishtiaq et al. 2012) dan resistensi terhadap klorantraniliprol pada P. xylostella di dataran
tinggi Sulawesi Selatan (Prabaningrum et al. 2012).
Berdasarkan latar belakang di atas dan informasi tentang jenis insektisida yang sering digunakan oleh petani kubis di daerah Cianjur, perlu dilakukan pemantauan perubahan kepekaan populasi hama baik terhadap insektisida yang telah lama digunakan maupun terhadap insektisida yang lebih baru.
Tujuan Penelitian
Penelitian ini bertujuan menentukan perbedaan kepekaan larva C. pavonana asal Cianjur, Jawa Barat, terhadap insektisida abamektin, klorantraniliprol, dan profenofos.
Manfaat Penelitian
TINJAUAN PUSTAKA
Bioekologi Ulat Krop Kubis Crocidolomia pavonana
Crocidolomia pavonana (F.) (Lepidoptera: Crambidae) merupakan salah satu hama penting pada tanaman famili Brassicaceae. Larva C. pavonana menyerang tanaman pada fase vegetatif dan generatif yang dapat terjadi sepanjang tahun (Sastrosiswojo dan Setiawati 1993). Daerah persebaran hama ini meliputi Afrika Selatan, Asia Selatan, Asia Tenggara, Australia, dan Kepulauan Pasifik (Kalshoven 1981).
Telur C. pavonana biasanya diletakkan pada permukaan bawah daun kubis. Sebelum menetas, warna telur berubah menjadi oranye, lalu menjadi cokelat kekuningan, hingga akhirnya berwarna cokelat gelap. Kelompok telur yang diletakkan terdiri atas 9 sampai 120 butir telur dengan rata-rata 48 butir (Othman 1982). Masa inkubasi telur rata-rata 4 hari pada suhu antara 26.0 dan 33.2 oC (Sastrosiswojo dan Setiawati 1992) dan persentase penetasan telur rata-rata dapat mencapai 92.4% (Othman 1982).
Larva C. pavonana instar awal berwarna kuning kehijauan dengan kepala cokelat tua yang berukuran panjang berkisar dari 2.1 sampai 2.7 mm dan lama stadium rata-rata sekitar 2 hari. Larva instar II C. pavonana berwarna hijau muda, dengan panjang berkisar dari 5.5 sampai 6.1 mm dan lama stadium rata-rata 2 hari. Larva instar III C. pavonana berwarna hijau, dengan panjang berkisar dari 1.1 sampai 1.3 cm dan lama stadium rata-rata 1.5 hari. Larva instar IV C. pavonana berwarna hijau lebih tua dengan tiga titik hitam dan tiga garis
23 sampai 28 hari sedangkan imago jantan berkisar dari 24 sampai 29 hari (Prijono dan Hassan 1992).
Pengendalian hama C. pavonana dengan menggunakan insektisida kimia merupakan tindakan yang sering dilakukan oleh petani. Penggunaan insektisida secara rutin dapat menimbulkan berbagai dampak negatif. Karena itu, pengendalian terhadap hama C. pavonana perlu lebih memerhatikan prinsip-prinsip pengendalian hama terpadu (PHT).
Resistensi Hama terhadap Insektisida
Resistensi didefinisikan sebagai kemampuan bertahan yang dapat diwariskan dari suatu strain hama untuk mengatasi dosis suatu insektisida yang dapat membunuh sebagian besar individu dalam suatu populasi pada spesies yang sama. Resistensi dapat pula diartikan sebagai suatu fenomena evolusi yang merefleksikan seleksi gen resisten serangga akibat aplikasi insektisida. Gen tersebut menyandi berbagai mekanisme, terutama peningkatan detoksifikasi insektisida atau penurunan kepekaan bagian sasaran di dalam tubuh serangga. Tindakan penyemprotan insektisida yang intensif dilakukan dapat menyebabkan resistensi berkembang dengan cepat (Denholm dan Horowitz 2001; Scott 2001).
Resistensi dilaporkan pertama kali pada tahun 1908 yaitu pada kutu perisai Quadrispidiotus perniciosus yang telah resisten terhadap belerang (Pedigo 1989).
Contoh kasus resistensi lain yang telah dilaporkan seperti pada P. xylostella, Bemisia tabaci, Myzus persicae, Helicoverpa armigera, dan Musca domestica.
Resistensi pada C. pavonana belum banyak dilaporkan baik di dalam negeri maupun luar negeri (Denholm dan Horowitz 2001).
Struktur dan Cara Kerja Insektisida
Cara masuk insektisida ke dalam tubuh serangga sasaran dibedakan menjadi tiga kelompok yaitu sebagai racun lambung (racun perut, stomach poison), racun kontak, dan racun pernapasan. Insektisida yang bekerja sebagai racun perut membunuh serangga sasaran jika termakan dan masuk ke dalam organ pencernaan serangga. Selanjutnya, insektisida tersebut diserap dinding saluran pencernaan makanan kemudian dibawa oleh hemolimfe ke bagian tempat kerja insektisida tersebut. Oleh karena itu, serangga harus memakan bagian tanaman yang sudah disemprot dengan insektisida dalam jumlah yang cukup untuk membunuhnya. Insektisida yang bekerja sebagai racun kontak masuk ke dalam tubuh serangga sasaran melalui kulit (lapisan kutikula). Serangga akan mati bila bersinggungan dengan insektisida tersebut. Pada umumnya racun kontak juga berperan sebagai racun perut. Insektisida yang bersifat racun pernapasan merupakan insektisida yang bekerja melalui saluran trakea, sehingga dapat menyebabkan kematian pada hama bila menghirup insektisida dalam jumlah yang cukup (Djojosumarto 2008).
Abamektin
Abamektin merupakan campuran antara avermektin B1a dan avermektin B1b
(Wood 2012a) yang strukturnya ditunjukkan pada Gambar 1. Abamektin adalah insektisida kelompok avermektin yang termasuk golongan senyawa laktona makrosiklik. Insektisida tersebut diisolasi dari bakteri tanah Streptomyces avermitilis yang bersifat racun perut dan racun kontak (Ishaaya 2001;
[image:45.595.101.471.147.726.2]Djojosumarto 2008). Avermektin bekerja dengan mengganggu fungsi reseptor asam γ-amino butirat (GABA) sehingga terjadi peningkatan pemasukan ion klorida ke dalam sel saraf (Matsumura 1985; Ishaaya 2001). Gejala pada serangga akibat aplikasi insektisida abamektin yaitu paralisis, berhenti makan, dan akhirnya menyebabkan kematian (Xin-Jun et al. 2010).
Gambar 1 Struktur kimia abamektin (Wood 2012a) Avermektin B1a
(komponen utama)
Avermektin B1b
Salah satu formulasi insektisida berbahan aktif abamektin yang terdaftar di Indonesia adalah Agrimec 18 EC. Insektisida tersebut terdaftar untuk mengendalikan Aphis pomi pada apel; Thrips parvispinus pada cabai; Phyllocnistis citrella pada jeruk; S. litura, Phaedonia inclusa, Lamprosema
indicata, Etiella zinckenella, dan Riptortus linearis pada kedelai; Maruca testulalis pada kacang panjang; Coptotermes curvignathus pada kelapa sawit; Liriomyza huidobrensis dan Thrips palmi pada kentang; L. chrysanthemi pada krisan; P. xylostella pada kubis; dan L. huidobrensis pada tomat (PPI 2012).
Klorantraniliprol
Klorantraniliprol mempunyai nama kimia 3-bromo-N-[4-kloro-2-metil-6-[(metilamino)karbonilfenil]-1-(3-kloro-2-piridinil-1H-pirazol-5-karboksamida (PCPA-R 2012) yang strukturnya ditunjukkan pada Gambar 2. Insektisida tersebut termasuk golongan senyawa antranilik diamida yang bersifat racun perut dan racun kontak (Djojosumarto 2008; Wang dan Wu 2012). Klorantraniliprol bekerja mengganggu saraf otot dengan mengaktifkan reseptor rianodin serangga yang menyebabkan ion kalsium intraselular berkurang sehingga serangga mengalami kelumpuhan otot kemudian mengalami kematian (Perry et al. 1998). Gejala pada serangga akibat aplikasi insektisida klorantraniliprol yaitu paralisis, berhenti makan, dan mati dalam beberapa hari (Cordova et al. 2006).
[image:46.595.197.424.513.681.2]
Salah satu formulasi insektisida berbahan aktif klorantraniliprol yang terdaftar di Indonesia adalah Prevathon 50 SC. Insektisida tersebut terdaftar untuk mengendalikan hama S. exigua pada bawang merah; S. litura pada cabai; M. testulalis dan L. huidobrensis pada kacang panjang; Conopomorpha cramerella pada kakao; S. litura pada kedelai; Metisa plana, C. curvignathus, dan Setora nitens pada kelapa sawit; Phthorimaea opercutella dan L. huidobrensis pada kentang; P. xylostella dan C. pavonana pada kubis; Scirpophaga incertulas dan Cnaphalocrosis medinalis pada padi; S. excerptalis pada tebu; S. litura, Heliothis assulta, dan Helicoverpa armigera pada tembakau; dan H. armigera pada tomat (PPI 2012).
Profenofos
Profenofos mempunyai nama kimia O-(4-bromo-2-klorofenil) O-etil S-propil fosforotioat (Wood 2012b) yang strukturnya ditunjukkan pada Gambar 3. Profenofos termasuk golongan organofosfat yang bersifat racun perut dan racun kontak (Djojosumarto 2008). Profenofos bersifat non-sistemik dan mempunyai spektrum yang luas. Mekanisme kerja profenofos yaitu menghambat kerja enzim asetilkolinesterase sehingga neurotransmitter asetilkolin yang berikatan dengan reseptornya di daerah pascasinapsis saraf pusat tidak terurai dan menimbulkan impuls saraf secara terus menerus. Gejala yang ditimbulkan berturut-turut eksitasi (kegelisahan), konvulsi (kekejangan), paralisis (kelumpuhan), dan akhirnya kematian (Matsumura 1985; Siegfried dan Scharf 2001; Djojosumarto 2008).
Gambar 3 Struktur kimia profenofos (Wood 2012b)
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB), dari Januari sampai Juli 2012.
Penyiapan Insektisida Uji
Insektisida yang digunakan yaitu abamektin (Agrimec 18 EC, b. a. 18.4 g/L), klorantraniliprol (Prevathon 50 SC, b. a. 50 g/L), dan profenofos
(Curacron 500 EC, b. a. 500 g/L).
Penyiapan Tanaman Pakan Crocidolomia pavonana
Tanaman brokoli (Brassica oleracea L. var. italica Plenck) digunakan untuk penyediaan pakan serangga uji dan sebagai medium perlakuan (Abizar dan Prijono 2010). Benih brokoli „Green Magic‟ disemai dalam nampan semai dengan media tanam berupa campuran tanah dan kompos Super Metan. Bersamaan dengan penyemaian dilakukan pemupukan dengan pupuk majemuk ”Dekastar” (NPK 18-9-10). Setelah bibit berumur 4 minggu atau sekurang-kurangnya memiliki 4 helai daun, bibit dipindahkan ke media tanam dalam polybag kapasitas 5 L yang diisi campuran tanah dan pupuk kandang dengan perbandingan 3:1 (v/v). Pada setiap polybag ditanam 1 bibit tanaman. Setelah berumur 4 minggu, tanaman dipupuk NPK dengan dosis ± 1 gram per polybag. Pupuk ditabur melingkar mengelilingi tanaman, lalu ditutup tanah dan disiram. Pemeliharaan tanaman brokoli yang dilakukan meliputi penyiraman, penyiangan gulma, dan pengendalian hama secara mekanis. Setelah tanaman brokoli berumur 2 bulan, daunnya digunakan sebagai pakan larva C. pavonana. Selama pemeliharaan tanaman brokoli tidak disemprot dengan pestisida.
Perbanyakan Serangga Uji
kurungan plastik-kasa berbingkai kayu (50 cm x 50 cm x 50 cm) dan diberi pakan larutan madu 10% yang diserapkan pada segumpal kapas yang digantungkan di dalam kurungan. Daun brokoli ditempatkan dalam tabung film berisi air dan diletakkan di dalam kurungan sebagai tempat peletakan telur. Kelompok telur pada daun brokoli dikumpulkan setiap hari. Setelah telur menetas, larva dipindahkan ke dalam wadah plastik (28 cm x 25 cm x 5 cm) berjendela kasa yang dialasi kertas stensil sebagai kertas hisap, dan diletakkan daun brokoli bebas pestisida sebagai pakan larva C. pavonana. Larva instar II digunakan untuk pengujian. Bila tidak digunakan untuk pengujian, sebagian larva dipelihara dan diperbanyak lebih lanjut dalam wadah plastik (35 cm x 25 cm x 6 cm) berisi daun brokoli. Pada saat larva akan memasuki fase pupa, larva dipindahkan ke dalam wadah plastik lain yang berisi serbuk gergaji sebagai medium untuk berpupa. Serbuk gergaji tersebut sebelumnya diayak, kemudian dioven pada suhu 105 °C selama ± 24 jam. Pupa beserta kokonnya dipindahkan ke dalam kurungan plastik-kasa seperti di atas sampai muncul imago untuk pemeliharaan selanjutnya.
Populasi larva C. pavonana yang diuji kerentanannya terhadap insektisida berasal dari pertanaman kubis petani di Kecamatan Pacet, Kabupaten Cianjur. Larva diambil dan dikoleksi dalam wadah plastik berjendela kasa, kemudian dipelihara dan diperbanyak di Laboratorium Fisiologi dan Toksikologi, Departemen Proteksi Tanaman, IPB. Larva diberi pakan daun kubis yang diperoleh dari lapangan dengan asumsi bahwa larva masih tetap terpapar insektisida yang diaplikasikan oleh petani. Pakan disimpan dalam lemari es (± 4 ºC) di laboratorium. Larva dipelihara hingga imago dengan cara yang sama seperti perbanyakan serangga strain laboratorium. Larva instar II dari imago generasi I digunakan untuk pengujian.
Uji Toksisitas
Uji Pendahuluan
Uji pendahuluan diperoleh berdasarkan acuan dari konsentrasi anjuran yang tertera pada label formulasi masing-masing insektisida. Insektisida berbahan aktif abamektin (Agrimec 18 EC) diuji pada konsentrasi 0.0575, 0.115, 0.23, 0.46, dan 0.92 mg/L. Klorantraniliprol (Prevathon 50 SC) diuji pada konsentrasi 0.315, 0.625, 1.25, 2.5, dan 5 mg/L. Profenofos (Curacron 500 EC) diuji pada konsentrasi 4, 7.5, 10, 13.5, dan 17.5 mg/L. Larutan pengencer yang digunakan adalah akuades yang mengandung 0.2 ml/L perekat Agristick (berbahan aktif alkilaril poliglikol eter 400 g/L). Setiap perlakuan dengan setiap taraf konsentrasi pengenceran insektisida dan kontrol diulang tiga kali.
Potongan daun brokoli (4 cm x 4 cm) segar dan bebas pestisida dicelup satu per satu dalam suspensi insektisida dengan konsentrasi tertentu sampai basah merata lalu dikeringanginkan. Daun kontrol dicelup dalam akuades yang mengandung Agristick 0.2 ml/L. Setelah lapisan cairan insektisida pada daun mengering, setiap potong daun perlakuan dan daun kontrol diletakkan secara terpisah pada bagian tutup cawan petri (diameter 10 cm) yang dialasi tisu yang ukurannya melebihi diameter cawan dan sebelumnya telah diletakkan 15 larva instar II C. pavonana. Selanjutnya, bagian dasar cawan segera ditutupkan di atas bagian tutup cawan yang telah berisi larva uji dan daun perlakuan atau daun kontrol. Dengan demikian, bagian tutup dan dasar cawan tersekat tisu sehingga larva uji tidak dapat keluar dari dalam cawan (Abizar dan Prijono 2010). Larva uji dibiarkan makan selama 24 jam. Setelah 24 jam ditambahkan daun perlakuan atau daun kontrol secukupnya. Dua puluh empat jam berikutnya, daun perlakuan diganti dengan daun tanpa perlakuan. Jumlah larva yang mati diamati dan dicatat setiap hari sampai hari ke-3 (72 jam sejak perlakuan [JSP]).
Uji Lanjutan
100, dan 150 mg/L. Cara perlakuan dan pengamatan pada uji lanjutan sama seperti uji pendahuluan, tetapi pada uji lanjutan setiap perlakuan diulang 6 kali. Data mortalitas kumulatif pada 24, 48, dan 72 JSP diolah dengan analisis probit menggunakan program POLO-PC (LeOra Software 1987) untuk menentukan nilai LC50 dan LC95. Hubungan antara waktu dan tingkat kematian larva pada lima taraf
konsentrasi uji dipetakan menggunakan Microsoft Office Excel 2007.
Sebagai tolok ukur resistensi digunakan nisbah resistensi (NR) pada taraf LC50 yang dihitung dengan rumus sebagai berikut:
LC50 serangga strain lapangan
NR =
LC50 serangga strain laboratorium
HASIL DAN PEMBAHASAN
Toksisitas Insektisida Uji terhadap Larva Crocidolomia pavonana
Mortalitas larva C. pavonana akibat perlakuan insektisida abamektin, klorantraniliprol, dan profenofos pada uji pemantapan secara umum telah terjadi pada pengamatan 24 jam setelah perlakuan (JSP), kemudian tingkat mortalitas meningkat secara tajam pada 48 JSP dan kematian larva C. pavonana masih meningkat pada 72 JSP kecuali pada perlakuan profenofos (Gambar 4). Persentase kematian awal yang cukup tinggi terjadi pada perlakuan dengan insektisida profenofos baik pada larva C. pavonana strain laboratorium maupun strain lapangan bila dibandingkan dengan perlakuan abamektin dan klorantraniliprol. Persentase kematian larva C. pavonana pada perlakuan profenofos pada 24 JSP meningkat seiring dengan penambahan konsentrasi perlakuan baik pada strain laboratorium maupun strain lapangan (Gambar 4E dan 4F). Tingginya kematian larva C. pavonana pada pengamatan awal menunjukkan bahwa insektisida profenofos bekerja sangat cepat dalam membunuh serangga, karena insektisida tersebut dapat mencapai sasaran celah sinapsis saraf dengan cepat setelah masuk ke dalam tubuh serangga uji melalui kontak atau termakan bersama daun perlakuan (Perry et al. 1998). Hasil perlakuan profenofos tersebut berbeda dibandingkan dengan perlakuan abamektin dan klorantraniliprol pada semua taraf konsentrasi, yaitu kedua insektisida yang disebut terakhir mengakibatkan kematian cukup rendah dan relatif tidak jauh berbeda, yaitu berkisar 0-20% (Gambar 4A dan 4B; 4C dan 4D).
Gambar 4 Perkembangan tingkat mortalitas larva C. pavonana. (A) abamektin, strain laboratorium; (B) abamektin, strain lapangan; (C) klorantra-niliprol, strain laboratorium; (D) klorantraklorantra-niliprol, strain lapangan; (E) profenofos, strain laboratorium; (F) profenofos, strain lapangan. Pada semua perlakuan, tidak ada kematian larva kontrol hingga 72 JSP.
dan gangguan impuls saraf yang mengakibatkan serangga lumpuh dan berhenti makan kemudian mengalami kematian. Insektisida abamektin bekerja dengan merangsang reseptor asam γ-amino butirat (GABA) yang dapat meningkatkan pemasukan ion klorida ke dalam sel saraf (Perry et al. 1998).
[image:54.595.122.510.78.504.2]larva C. pavonana strain laboratorium kurang dari 10%, sedangkan pada larva C. pavonana strain lapangan tidak terjadi kematian (Gambar 4C dan 4D). Peningkatan mortalitas serangga uji akibat perlakuan klorantraniliprol terjadi pada 48 JSP. Pada konsentrasi klorantraniliprol 0.038 mg/L, mortalitas serangga uji strain laboratorium telah melebihi 80%, sedangkan mortalitas serangga strain lapangan hanya sekitar 40%. Pada akhir pengamatan (72 JSP), mortalitas larva C. pavonana strain laboratorium berkisa