INDUKSI EMBRIO GLOBULAR PADA
TANAMAN AREN (
Arenga pinnata
(Wurmb) Merr.)
MICHA GRACIANNA DEVI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Induksi Embrio Globular pada Tanaman Aren (Arenga pinnata (Wurmb) Merr.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Micha Gracianna Devi
ABSTRAK
MICHA GRACIANNA DEVI. Induksi Embrio Globular pada Tanaman Aren
(Arenga pinnata (Wurmb) Merr.). Dibimbing oleh AGUS PURWITO dan ALI
HUSNI.
Penelitian ini bertujuan mendapatkan media terbaik untuk menghasilka n embrio somatik dari eksplan embrio zigotik tanaman aren yang dilaksanakan di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Oktober 2012 sampai dengan bulan April 2013. Penelitian terdiri atas tiga tahap yaitu induksi kalus, induksi embrio globular dan pendewasaan embrio globular. Sterilisasi menggunakan NaOCl 1.575 % dan alkohol 96 % paling banyak menghasilkan persen eksplan steril pada perlakuan A1 (MS + 3 mg l-1 2,4-D + 2 mg l-1 NAA) yaitu 89 % (16/18).
eksplan yang ditanam pada tahap induksi embrio globular. Pada tahap pendewasaan embrio globular, perlakuan C11 (clump embrio globular B9 ke media 0.1 mg l-1
GA3) mampu menghasilkan clump embrio dewasa paling banyak yaitu 70.8 %
(22/24).
Kata kunci: aren, embriogenesis, embrio globular, zat pengatur tumbuh
ABSTRACT
MICHA GRACIANNA DEVI. Globular Embryo Induction of Sugar Palm (Arenga
pinnata (Wurmb.) Merr). Supervised by AGUS PURWITO and ALI HUSNI.
The objective of this study was to get the best media to produce somatic embryos from zygotic embryos of sugar palm. This research was conducted at Tissue Culture Laboratory 3 Department of Agronomy and Horticulture, Faculty of Agriculture, Bogor Agricultural University from October 2012 to April 2013. This research consisted of three phases which were callus induction, globular embryo induction, and globular embryo maturation. Sterilization using NaOCl 1.575 % and alcohol 96 % was able to provide the most sterile explants for treatment A1 (MS +
induction phase. During embryo globular maturation phase, media C11 (globular embryo clumps B9 to media MS + 0.1 mg l-1 GA3) was able to induce 70.8 % mature
globular embryo clumps.
Ringkasan
MICHA GRACIANNA DEVI. Induksi Embrio Globular pada Tanaman Aren
(Arenga pinnata (Wurmb) Merr.). Dibimbing oleh AGUS PURWITO dan ALI
HUSNI.
Aren adalah tanaman dari famili Arecaceae yang bernilai ekonomis dan mempunyai prospek cerah untuk dikembangkan dari bahan pangan hingga bioethanol sebagai bahan bakar pengganti minyak bumi. Sulitnya perbanyakan aren terutama melalui biji karena masa siklus reproduksi aren cukup panjang, waktu pembentukan dan dormansi biji lama, kemampuan daya berkecambah rendah, serta pertumbuhan bibit yang tidak seragam. Pemuliaan secara nonkonvensio na l menggunakan bioteknologi dapat menjadi solusi alternatif yang tepat dalam mengatasi kendala penyediaan bibit unggul untuk peningkatan produktivitas aren. Kultur jaringan menggunakan metode embriogenesis somatik merupakan salah satu teknik yang dapat digunakan untuk menumbuhkan embrio-embrio somatik dalam jumlah yang banyak dan cukup seragam dari embrio zigotik yang ditanam. Salah satu faktor keberhasilan teknik tersebut yang difokuskan pada percobaan ini adalah peranan zat pengatur tumbuh golongan auksin, sitokinin dan giberelin.
Penelitian ini bertujuan mendapatkan media terbaik untuk menghasilka n embrio somatik dari eksplan embrio zigotik tanaman aren. Hasil tersebut diharapkan dapat digunakan untuk pemuliaan nonkonvensional.
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Oktober 2012 sampai dengan bulan April 2013. Penelitian terdiri atas tiga tahapan yaitu tahap induksi kalus, tahap induksi embrio globular dan tahap pendewasaan embrio globular. Tahap pertama terdiri atas enam perlakuan dengan beberapa kombinasi hormon 2,4-D, NAA, dan biotin yang bertujuan untuk induksi kalus dari eksplan embrio zigotik muda. Pada tahap kedua, eksplan yang didapatkan dari perlakuan tahap pertama disubkultur ke dalam 14 perlakuan yang berbeda dengan kombinasi hormon kinetin dan TIBA. Sedangkan tahap ketiga eksplan yang didapat dari tahap kedua disubkultur ke media dengan dan tanpa GA3. Variabel pengamatan
yang diamati adalah persentase dan jumlah eksplan yang steril, persentase dan jumlah eksplan berkalus, rata-rata persentase penutupan kalus pada permukaan eksplan, persentase dan jumlah eksplan yang membentuk kalus embriogenik , persentase dan jumlah eksplan dengan ukuran pangkal apokol lebih kecil dari haustorium, persentase dan jumlah eksplan yang membentuk embrio globular , persentase dan jumlah akar semu yang muncul, persentase dan jumlah clump embrio globular yang hidup, dan persentase dan jumlah clump embrio globular yang dewasa.
Sterilisasi menggunakan NaOCl 1.575 % dan alkohol 96 % mampu menghasilkan eksplan steril dari 50-85 %. Pembentukan kalus embriogenik paling banyak terdapat pada A5 (MS + 3 mg l-1 2,4-D + 0.2 mg l-1 NAA + 100 mg l-1
biotin) yaitu 73.4 % (11/15) pada tahap induksi kalus. Perlakuan B3 (kalus A1 ke media MS + 4 mg l-1 Kinetin), B6 (kalus A1 ke media MS + 1 mg l-1 Kinetin + 0.1
mg l-1 TIBA), B12 (kalus A2 ke media MS + 0.1 mg l-1 Kinetin+ 1 mg l-1 TIBA),
dan B14 (kalus A2 ke media MS + 1 mg l-1 Kinetin + 1 mg l-1 TIBA) mampu
membentuk embrio globular pada seluruh eksplan yang ditanam pada tahap induksi embrio globular. Pada tahap pendewasaan embrio globular, perlakuan C11 (clump
embrio globular B9 ke media 0.1 mg l-1 GA
3) mampu menghasilkan clump embrio
dewasa paling banyak yaitu 70.8 % (22/24).
Summary
MICHA GRACIANNA DEVI. Globular Embryo Induction of Sugar Palm (Arenga
pinnata (Wurmb.) Merr). Supervised by AGUS PURWITO and ALI HUSNI.
Sugar palm is a monocot plant belong to the Arecaceae family economica ll y valuable and have bright prospects to be developed for food products to bio-ethanol substituting fossil fuels. This plant is usually propagated generatively yet there are a few issues being faced such as a long reproductive cycle, long seed production and dormancy, low germination capacity, and uniform seedling growth. Non-conventional plant breeding through biotechnology is the best possible alternative solution to provide good quality seedlings in order to increase sugar palm productivity. Tissue culture through somatic embryogenesis method is a technique that can be used to induce abundant and relatively uniform somatic embryos from be used for future sugar palm non-conventional breeding.
This research was conducted at Tissue Culture Laboratory Department of Agronomy and Horticulture, Faculty of Agriculture, Bogor Agricultural Univers it y from October 2012 to April 2013. It covers the embryogenic callus induction phase, globular embryo induction phase and globular embryos maturation phase. The first phase consisted six treatments with 2,4-D, NAA, and biotin combination aiming to induce callus formation from young zygotic embryos. In the second phase, callus obtained from the first phase were subcultured to 14 different treatments with various kinetin and TIBA combination. As for the third phase, explants which were obtained from the second phase were subcultured into media with or without GA3
combination. The variables which were observed were percentage and total sterile explants, percentage and total explants which induced callus formation, average percentage of callus coverage, percentage and total explants with base apocol smaller than haustorium, percentage and total pseudo roots, percentage and total explants which induced globular embryos, percentage and total alive and mature globular embryo clumps.
Sterilization using NaOCl 1.575 % and alcohol 96 % was able to provide 50-85 % sterile explants. During callus induction phase, embryogenic callus were
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
INDUKSI EMBRIO GLOBULAR PADA
TANAMAN AREN (
Arenga pinnata
(Wurmb) Merr.)
MICHA GRACIANNA DEVI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Induksi Embrio Globular pada Tanaman Aren (Arenga pinnata
(Wurmb) Merr.)
Nama : Micha Gracianna Devi
NIM : A24090048
Disetujui oleh
Dr Ir Agus Purwito, MScAgr Pembimbing I
Dr Drs Ali Husni, MSi Pembimbing II
Diketahui oleh
Dr Ir Agus Purwito, MScAgr Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2012 ini ialah embriogenesis, dengan judul Induksi Embrio Globular pada Tanaman Aren
(Arenga pinnata (Wurmb) Merr.).
Terima kasih penulis ucapkan kepada Dr Ir Agus Purwito MScAgr dan Dr Drs Ali Husni MSi selaku pembimbing yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Indra Wirianto, Yogo Adhi Nugroho, dan Arif Rahman yang telah banyak membantu pelaksanaan dan kelangsungan penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 2
METODE 6
Lokasi dan Waktu Penelitian 6
Bahan Penelitian 6
Peralatan Penelitian 6
Prosedur Percobaan 6
Analisis Data 8
HASIL DAN PEMBAHASAN 10
Pembahasan Umum 10
Persentase dan Jumlah Eksplan yang Kontaminasi 11
Persentase dan Jumlah Eksplan yang Berkalus 12
Persentase dan Jumlah Eksplan yang Membentuk Kalus Embriogenik dan Rata-rata Persentase Penutupan Kalus pada
Eksplan 13
Perbandingan Ukuran Pangkal Apokol dan Haustorium 15 Persentase dan Jumlah Eksplan yang Membentuk Embrio Globular 16
Rata-rata Jumlah Akar Semu yang Muncul 18
Persentase dan Jumlah Clump Embrio Globular Hidup dan yang
dewasa 19
SIMPULAN DAN SARAN 21
Simpulan 21
Saran 22
DAFTAR PUSTAKA 22
LAMPIRAN 25
RIWAYAT HIDUP 27
DAFTAR TABEL
1. Komposisi media perlakuan 9
2. Pengaruh perlakuan terhadap persentase dan jumlah kalus
embriogenik dan rata-rata persentase penutupan kalus 14 3. Pengaruh perlakuan terhadap persentase eksplan dengan
ukuran pangkal apokol lebih kecil dari haustorium 16 4. Pengaruh perlakuan terhadap persentase dan jumlah clump
DAFTAR GAMBAR
1. Arenga pinnata (Wurmb) Merrill 3
2. Tahap persiapan penelitian, sterilisasi eksplan, dan kultur embrio 8
3. Alur kultur embrio aren 11
4. Rata-rata persentase eksplan yang steril pada 8 MSP 12
5. Eksplan aren yang terkontaminasi 12
6. Persentase keberhasilan eksplan berkalus 4-8 MSP 13 7. Persentase penutupan kalus pada permukaan embrio aren 14
8. Penampakan kalus 15
9. Perbandingan ukuran pangkal apokol dan haustorium 15 10.Persentase eksplan yang membentuk embrio globular pada 2 MSP 18
11.Rata-rata akar semu yang muncul saat 2 MSP 19
12.Akar semu aren 19
13.Hasil embrio globular pada penelitian 20
DAFTAR LAMPIRAN
1 Komposisi media MS 25
2 Komposisi vitamin Morel and Wetmore 25
PENDAHULUAN
Latar Belakang
Aren (Arenga pinnata (Wurmb) Merr.) adalah tanaman dari famili Arecaceae yang bernilai ekonomis dan mempunyai prospek cerah untuk dikembangkan (Putih
et al. 2003). Seluruh bagian tanaman tersebut bisa dimanfaatkan menjadi berbagai
produk seperti gula, tepung aren, kolang-kaling, maupun ijuk (Soeseno 2000). Kegunaan aren tidak hanya sebatas produk olahan melainkan dari segi konservasi lingkungan mampu menahan erosi, memperbaiki kondisi mikro tanah, maupun meningkatkan porositas tanah dan menjerap air hujan. Manfaat yang hingga sekarang masih dieksplorasi adalah kemampuan tanaman aren untuk menghasilka n produk berupa bioetanol sebagai bahan bakar pengganti minyak bumi. Potensi aren cukup besar dapat mencapai 1.43 juta kL bioetanol setiap tahun (Effendi 2010).
Tanaman aren pada umumnya tumbuh dan berkembang secara liar di hutan-hutan namun saat ini sudah mulai dibudidayakan secara intensif seperti di kabupaten Lebak dan Pandeglang sebanyak 1,348 ha (Mamat dan Tarigans 1993; Kardiyono dan Mutakin 2011). Walaupun budidaya tanaman tersebut mulai digerakan kembali, sulitnya perbanyakan aren terutama melalui biji karena waktu dormansinya yang lama menyebabkan keterbatasan bibit di pasaran. Alasan lain mengapa tanaman aren populasinya semakin berkurang adalah dengan perambahan hutan dan penebangan pohon yang tidak diimbangi dengan regenerasi tanaman aren muda seperti yang telah dialami oleh masyarakat di Desa Rubit, Kecamatan Kewapante, Nusa Tenggara Timur (Rofik dan Murniati 2008).
Pengusahaan tanaman aren dalam skala komersial masih belum banyak dilakukan. Aren dibudidayakan hanya sebatas tanaman pekarangan dengan produktivitas yang masih rendah. Peningkatan produktivitas dapat dilakukan dengan penyediaan bahan tanam unggul yang berasal dari pohon induk aren berproduksi tinggi hasil seleksi dalam program pemuliaan tanaman. Namun hal ini terkendala di antaranya adalah secara alami masa siklus reproduksi aren cukup panjang, waktu pembentukan dan dormansi biji lama, kemampuan daya berkecambah rendah, serta pertumbuhan bibit yang tidak seragam (Soeseno 2000). Walaupun dalam satu pohon dapat ditemukan 4-5 tandan dengan kurang lebih 5,200 bunga betina, tidak semua dapat dijadikan benih. Kenyataan di lapang juga membuktikan bahwa membutuhkan waktu 5-6 bulan agar benih aren berkecambah (Maliangkay et al. 1997).
Pemuliaan secara nonkonvensional menggunakan bioteknologi dapat menjadi solusi alternatif yang tepat dalam mengatasi kendala penyediaan bibit unggul untuk peningkatan produktivitas aren. Kultur jaringan menggunaka n metode embriogenesis somatik merupakan salah satu teknik yang dapat digunakan untuk menumbuhkan embrio-embrio somatik dalam jumlah yang banyak dan cukup seragam dari embrio zigotik yang ditanam. Berpegang pada teori totepotensi, sel untuk beregenerasi menjadi tanaman utuh membuka peluang pemuliaa n menghasilkan tanaman dengan karakteristik yang diinginkan.
2
adalah peranan zat pengatur tumbuh. Auksin berperan sebagai awal mengind uks i pembelahan sel serta penentu arah diferensiasi sel tanaman. Bila konsentrasi auksin tinggi akan menyebabkan pertumbuhan akar, konsentrasi sitokinin tinggi yang akan menyebabkan terbentuknya tunas, dan giberelin untuk pendewasaan embrio (Slater
et al. 2008).
Upaya perbanyakan tanaman menggunakan teknik kultur jaringan diawali dengan terbentuknya kalus pada eksplan. Kalus merupakan jaringan permukaan pada luka tumbuhan. Kalus dalam lingkungan in vitro dapat diinisasi dari semua bagian tanaman. Kalus yang embriogenik diduga mampu membentuk embrio globular dan tumbuh menjadi tanaman utuh.
Perumusan Masalah
Penanaman aren pada media kultur jaringan menggunakan kombinasi 2,4-D dengan NAA pada beberapa konsentrasi serta vitamin biotin dan jumlah explan yang ditanam dalam botol dapat mempengaruhi terbentuknya kalus embriogenik. Kalus embriogenik yang didapatkan dari percobaan pertama yang kemudian ditanam pada beberapa komposisi media Kinetin dan TIBA akan mampu menginduksi embrio globular. Media dengan tambahan GA3 mampu menstimulas i
pendewasaan embrio globular.
Tujuan Penelitian
Tujuan percobaan adalah mendapatkan media terbaik untuk menghasilka n embrio somatik dari eksplan embrio zigotik tanaman aren. Komposisi media tersebut diharapkan dapat digunakan untuk pemuliaan nonkonvensional.
Manfaat Penelitian
Penelitian mengenai kultur jaringan aren belum banyak dilakukan sehingga dengan dilakukannya penelitian tersebut diharapkan akan mampu mendukung penelitian dari segi pemuliaan nonkonvensiona l.
Hipotesis
3 TINJAUAN PUSTAKA
Aren
Aren (Arenga pinnata) termasuk famili Arecaceae merupakan tanaman berbiji tertutup dimana biji bunganya terbungkus daging buah. Tanaman tersebut mirip dengan pohon kelapa namun batangnya terlihat kotor akibat terbalut ijuk. Garis tengah batang tanaman aren bisa mencapai 65 cm dengan tinggi 15 m dan seringkali ditumbuhi berbagai jenis paku epifit (Soeseno 2000). Perakaran pohon aren merupakan tipe serabut dimana akar menyebar cukup dalam sehingga mampu berperan dalam mencegah terjadinya erosi.
Daun tanaman aren pada awalnya tumbuh dalam bentuk tidak menyir ip karena kegunaannya untuk memperluas permukaan tempat absorbsi cahaya matahari. Setelah mencapai dewasa, daun tanaman ini akan berubah bersirip ganjil dengan ukuran daun dan pelepah yang lebih besar dan kuat (Soeseno 2000).
Buah aren terbentuk dari bunga betina yang telah mengalami penyerbukan oleh bunga jantan. Bagian dari buah tersebut terdiri atas kulit luar, daging buah, kulit biji, endosperm dan embrio. Kulit luar biasanya berwarna hijau pada waktu muda dan menjadi kuning setelah masak. Daging buah biasa berwarna putih kekuning-kuningan dan terdapat senyawa asam oksalat yang cukup banyak sehingga mampu menyebabkan rasa gatal yang dahsyat. Kulit biji bisa juga disebut sebagai arilus yang melindungi endosperm merupakan lapisan tipis berwarna kuning. Endosperm merupakan tempat cadangan makanan embrio dimana setelah masak fisiologis penampakannya akan mengeras dan sulit sekali untuk dipecahkan (Untu et al.1998). Asikin et al. (2000) menyatakan bahwa biji aren memiliki letak embrio yang unik karena letaknya pada sisi kanan atau kiri bagian tengah biji sehingga perkecambahannya dimulai dari bagian lateral. Ukuran embrio tanaman tersebut berbentuk kerucut tumpul dengan ukuran 1-2 mm. Beberapa karakteristik umum tanaman aren dapat dilihat pada Tabel 1.
Kingdom: Plantae – Tumbuhan
Subkingdom: Tracheobionta – Tumbuhan Bervaskuler
Superdivision: Spermatophyta – Tumbuhan Berbiji
Division: Magnoliophyta – Tumbuhan Berbunga
Class: Liliopsida – Monokotiledon
Subclass: Arecidae
Order: Arecales
Family: Arecaceae
Genus: Arenga Labill. – arenga palm
Species: Arenga pinnata (Wurmb) Merr.
Gambar 1. Arenga pinnata (Wurmb) Merrill; 1) pohon berbunga, 2) bunga betina, 3) bunga jantan, 4) buah (Smitz 1917; USDA NRCS 2012)
4
Tanaman tersebut yang selama ini dianggap sebagai usaha tani tambahan nyatanya telah memberikan kontribusi terhadap petani sebesar 55.9 % bagi petani sehingga berdasarkan proporsi tersebut, terlihat bahwa aren merupakan komoditas potensial untuk dikembangkan sebagai sumber pendapatan petani.
Kultur Jaringan Aren
Kultur jaringan merupakan merupakan integrasi dari ilmu bioteknologi yang memungkinkan terjadinya regenerasi tanaman dalam bentuk klon ataupun transgenik (Constabel dan Shyluk 1994). Berpegang pada teori totepotensi, kemampuan satu buah sel untuk berregenerasi menjadi tanaman utuh lainnya membuka peluang perbanyakan dalam jumlah masal, cepat, berkualitas lebih baik, tidak tergantung pada musim, bebas penyakit sistemik, tidak membutuhkan ruangan pembibitan yang luas, dan kemungkinan untuk dilakukan konservasi plasma nutfah (Putih et al. 2003).
Percobaan kultur jaringan telah dilakukan sebelumnya oleh Untu et al. (1998) saat mencoba melakukan uji keberhasilan pelakasanaan kultur embrio aren diawali dengan melakukan percobaan ekstraksi embrio yang matang fisiologis dan embrio yang berumur 10 bulan. Hasil dari percobaannya tersebut tidak berhasil karena pada embrio yang matang fisiologis, kulit biji beserta endosperm keras, dan pada embrio yang berumur 10 bulan, ekstraksi berlangsung dengan baik namun terjadi kontaminasi akibat metode sterilisasi yang belum tepat.
Hasil percobaan lain yang telah didapatkan adalah oleh Asikin et al. (2000) yang menunjukan bahwa respon pertumbuhan embrio terlihat lebih cepat dibandingkan dengan embrio yang terbungkus oleh endosperm karena embrio lebih mudah menyerap air dan hara serta ada nya kontak langsung antara embrio dengan zat pengatur tumbuh yang tertanam pada media. Pada hari ke-7 embrio terlihat membesar dan pada hari ke-10 terjadi inisasi apokol yang terus memanjang. Perlakuan pada kondisi gelap juga telah terbukti mampu menstimulasi pertumbuha n embrio yang lebih cepat karena adanya pengaruh etiolasi namun hal demikian tidak berpengaruh terhadap kecepatan awal tumbuh.
Embriogenesis Somatik
Chawla (2002) menjelaskan bahwa embriogensis somatik merupakan proses dimana sel somatik berkembang membentuk tanaman baru melalui tahap perkembangan embrio yang spesifik tanpa melalui fusi gamet. Embrio somatik memiliki ciri-ciri dari strukturnya yang bipolar (memiliki 2 calon meristem: akar dan tunas), melalui pembelahan mitosis yang cepat. Embriogenesis terbagi menjadi dua tipe yaitu embriogensis langsung dan tidak langsung. Embriogenesis langsung mampu menginisiasi pertumbuhan embrio langsung dari jaringan tanaman yang digunakan tanpa melalui tahan poliferasi kalus. Embriogenesis tidak langsung harus melalui tahapan poliferasi sel sebelum membentuk embrio.
5 adalah untuk memfasilitasi maturasi embrio yang menggunakan konsentrasi auksin yang lebih rendah atau tidak ada sama sekali, dan yang ketiga adalah untuk perkembangan embrio menjadi tanaman.
Zat Pengatur Tumbuh
Auksin merupakan hormon pertumbuhan yang berperan dalam pembelahan sel maupun pertumbuhan sel (Slater et al. 2008). Zat pengatur tumbuh (ZPT) ini terbagi atas dua kategori yaitu auksin sintetis dan auksin alami. Auksin alami sebagai contohnya adalah asam indolasetat (IAA). Auksin sintesis merupakan zat yang memiliki kemampuan seperti IAA namun dibuat secara tidak alami. Contoh dari auksin tersebut asam a-naftalenasetat (NAA), asam 2,4-diklorophenoksiase tat (2,4-D), dan asam 4-amino-3,5,6-triklorophikolinik (pikloram) (Sandra 2012).
Menurut Chawla (2002), hormon sitokinin merupakan hasil derivatif dari adenin dan memiliki peranan penting dalam induksi tunas. Jenis sitokinin yang seringkali digunakan dalam kultur jaringan adalah kinetin, benzil adenin (BA), atau 6-benzil amino purin (BAP), zeatin, dan isopenteniladenin (2 iP). Zat-zat tersebut biasa digunakan untuk menstimulasi pertumbuhan dan perkembangan tanaman khususnya pembelahan sel jika dikombinasikan dengan auksin.
Giberelin merupakan zat pengatur tumbuh yang berfungsi sinergis dengan hormone auksin. Giberelin berpengaruh terhadap perkembangan dan perkecambahan embrio. Selain itu dalam proses pembentukan biji, giberelin berperan dalam merangsang pembentukan serbuk sari, memperbesar ukuran buah, merangsang pembentukan bunga, dan mengakhiri masa dormansi biji. Pada konsentrasi rendah hormon ini tidak merangsang pembentukan akar, tetapi pada konsentrasi tinggi akan merangsang pembentukan akar (Suwasono 1989).
Menurut Hong (1990), antiauksin merupakan zat yang mengha mbat aktivitas hormon auksin. Beberapa antiauksin yang digunakan dalam kultur jaringan adalah asam 2,4,6-triklorobenzoik (2,4,6-TB), asam 2-(2,4-diklorofenoks i) isobutirik (2,4-DP-I), dan asam 2,3,5-triiodobenzoik (TIBA). TIBA merupakan antiauksin yang unik karena dapat berperan sebagai antiauksin maupun sebagai penghambat transportasi auksin.
METODE
Lokasi dan Waktu Penelitian
Percobaan dilaksanakan di Laboratorium Kultur Jaringan 3 Departemen Agronomi dan Hortikultura Faperta IPB. Periode waktu dilaksanakannya percobaan adalah dari Oktober 2012 sampai Maret 2013.
Bahan Penelitian
6
larutan MS (Murashige and Skoog), gula, karbon aktif, VMW (Morel and Wetmore
vitamine), kasein hidrolisat, glutamin, asparagin, Phytagel, 2,4-D (
2,4-dichlorophenoxyasetate), NAA (asam α-naftalenasetat), kinetin, TIBA (
2,3,5-triiodobenzoic acid) dan GA3 (Giberelic acid 3). Bahan pendukung lainnya yang
dibutuhkan adalah alkohol 96 %, NaOCl 1.575 %, dan detergen.
Peralatan Penelitian
Alat yang digunakan dalam percobaan adalah laminar air flow cabinet
(LAFC), otoklaf, mikroskop stereo, mikroskop cahaya, botol kultur, peralatan diseksi (pinset besar, pinset kecil, dan pisau scalpel), timbangan analitik, magnetic
stirrer, kertas pH, oven, lemari pendingin, dan rak kultur. Seluruh media yang
belum ditanami ditempatkan pada ruang penyimpanan kultur dengan suhu 25-27 oC
dalam kondisi gelap untuk perlakuan tahap pertama dan kondisi terang untuk perlakuan tahap selanjutnya. Alat analisis statistik yang digunakan adalah SAS v9 Portable.
Prosedur Percobaan
Alur Percobaan
A. Persiapan Bahan Tanam
Percobaan diawali dengan persiapan bahan tanam dimana buah aren dikirim dari Desa Gunung Goong ke Bogor. Ciri-ciri fisik dari buah yang terseleksi adalah ukuran embrio yang cukup besar dan endosperm yang masih berwujud seperti agar-agar. Buah yang sampai di Bogor selanjutnya diperam beberapa hari hingga kulitnya sedikit melunak agar mempermudah isolasi embrio zigotik dari buah (Gambar 2B).
B. Sterilisasi Bahan Tanam
Bahan tanam direndam dalam larutan detergen selama kurang lebih 15 menit dan dibilas bersih sehingga bersih dari kotoran fisik. Satu per satu buah dikupas kulit luarnya sehingga tinggal embrio, endosperm dan kulit ari (kolang-kaling). Setelah seluruh buah dikupas menggunakan pisau tajam, air akuades dibuang dan diganti dengan NaOCl 1.575 % selama 5 - 10 menit. Selama perendaman dengan larutan tersebut, terlihat adanya reaksi kolang-kaling dan larutan sehingga lapisan kulit ari berubah warnya menjadi kecoklatan. Perendaman berikutnya adalah dengan menggunakan alkohol 96 % selama 10 - 15 menit (Gambar 2C).
C. Pembuatan Media Tanam
Pembuatan media perlakuan dilaksanakan minimal seminggu sebelum penanaman. Cara pembuatan media diawali dengan sterilisasi botol dalam
autoclave dan pembuatan media tanam. Setelah media selesai dibuat, kemudian
7 Seluruh media yang dibuat disterilkan kembali di dalam otoklaf selama 15 menit pada suhu 121 oC, tekanan 1.5 kg cm-3 dan dipindahkan ke ruang penyimpanan agar
tetap steril (Gambar 2A).
D. Penanaman Bahan Tanam
Penanaman eksplan dilakukan di dalam lemari laminar air flow dengan mempersiapkan kolang-kaling yang sudah steril dan media tanam yang sebelumnya telah disemprot alkohol. Satu per satu kolang-kaling diambil menggunakan pinset dan dibakar menggunakan bunsen selama beberapa detik hingga kulit luar menjadi sedikit renyah lalu dimasukkan ke dalam cawan petri. Kolang-kaling selanjutnya dibelah dan diambil embrionya (sekitar 0.1-0.5 cm) yang kemudian ditanam di media yang telah dipersiapkan (Gambar 2 D dan 2E).
E. Pemeliharaan
Pemeliharaan botol-botol kultur, botol-botol yang belum ditanami maupun botol-botol steril dilakukan dengan cara meletakkan pada rak-rak kultur. Botol-botol tersebut disemprot dengan alkohol 96 % seminggu sekali agar lingkunga n tetap steril (Gambar 1F).
F. Subkultur
Kegiatan subkultur pertama dilakukan saat 8 MSP pada tahap induksi kalus. Tujuan dari subkultur pertama adalah untuk memberi perlakuan dengan media yang berbeda untuk menginduksi embrio globular. Subkultur kedua dilakukan saat 2 MSP pada tahap induksi embrio globular. Tujuan dari subkultur kedua adalah untuk memberi perlakuan dengan media yang berbeda untuk pendewasaan embrio globular.
G. Pengamatan
Variabel pengamatan pada percobaan yang akan diamati terdiri atas: 1. Persentase dan jumlah eksplan yang steril
2. Persentase dan jumlah eksplan berkalus
3. Rata-rata persentase penutupan kalus pada permukaan eksplan 4. Persentase dan jumlah eksplan yang membentuk kalus embriogenik 5. Persentase dan jumlah eksplan dengan ukuran pangkal apokol lebih
kecil dari haustorium
6. Persentase dan jumlah eksplan yang membentuk embrio globular 7. Persentase dan jumlah akar semu yang muncul
8
Gambar 2 Tahap persiapan penelitian, sterilisasi eksplan, dan kultur embrio A) Media perlakuan yang siap digunakan untuk percobaan. B) Persiapan bahan tanam berupa embrio masih diselaputi endosperm. C) Sterilisas i embrio yang masih diselaputi endosperm menggunakan larutan NaOCl 1.575 % dan alkohol 96 %. D) Isolasi embrio zigotik dari endosperm yang sudah steril. E) Kumpulan embrio sebelum ditanam dalam media perlakuan. F) Penempatan botol perlakuan dalam ruang kultur tahap induksi kalus.
Analisis Data
Penelitian terdiri tiga tahap yaitu 1) tahap induksi kalus, 2) tahap induksi embrio globular, dan 3) tahap pendewasaan embrio globular. Tahap pertama disusun menggunakan rancangan acak lengkap (RAL) satu faktor yang terdiri atas enam taraf komposisi media yaitu media perlakuan A1 hingga A6. Setiap perlakuan diulang sebanyak 6 ulangan. Masing-masing ulangan terdiri 1 botol kultur yang ditanami tiga eksplan, sehingga terdapat total 108 satuan amatan.
Tahap kedua disusun menggunakan rancangan acak lengkap (RAL) satu faktor yang terdiri atas 14 taraf yaitu media perlakuan B1 hingga B14. Setiap perlakuan diulang sebanyak tiga kali. Masing-masing ulangan terdiri 1 botol kultur yang ditanami satu eksplan, sehingga terdapat total 42 satuan amatan.
Tahap ketiga disusun menggunakan rancangan acak lengkap (RAL) satu faktor yang terdiri atas 12 taraf yaitu media perlakuan C1 hingga C12. Masing-masing tiga ulangan terdiri 1 botol kultur yang ditanami sekitar 8 clump embrio globular, sehingga terdapat total 288 satuan amatan. Seluruh komposisi media perlakuan dapat dilihat pada Tabel 2.
Rancangan berpatokan pada rumus linier sebagai berikut: Yik = μ + αi + εik
dimana: i = 1, 2, 3…; j= 1, 2, 3…; k = 1, 2, 3…; Yijk = Pengamatan pada perlakuan ke-i, serta ulangan ke-k; µ= Rataan umum; αi= Pengaruh ke-i; εik = Pengaruh acak pada perlakuan ke-i, dan ulangan ke-k.
Data kuantitatif yang dihasilkan dianalisis dengan uji F dengan taraf 5 %. Jika terdapat perlakuan yang berpengaruh nyata, akan dilakukan uji lanjut menggunakan Duncan Multiple Range Test pada taraf 5 %.
A B C
9 Tabel 1.Komposisi media perlakuan
Media
10
dipecahkan (Untu et al.,1998) sehingga pada penelitian digunakan embrio yang diisolasi dari buah dengan endosperm yang belum mengeras.
Penelitian ini diawali dengan tahap persiapan bahan tanam berupa buah aren yang diambil dari tandan betina paling pertama diperam hingga kulit sedikit melunak. Pemeraman dilakuan selama kurang lebih seminggu sebelum embrio zigotik aren diisolasi dan ditanam dalam media perlakuan. Tahap isolasi embrio zigotik dilakukan secara bertahap dan perlu dilakukan secara hati-hati agar tidak rusak.
Pada tahap induksi kalus, selama 1-8 MSP terdapat masalah kontaminas i oleh cendawan dan bakteri sehingga banyak eksplan yang mati. Diduga sumber kontaminan disebabkan saat isolasi embrio zigotik, penanaman, dan penyimpa na n kultur lingkungan kurang steril walaupun sudah dicegah dengan penyemprotan alkohol 96 %.
Media yang digunakan pada tahap induksi kalus membutuhkan peran auksin dan lingkungan tanpa cahaya. Adanya cahaya sebenarnya mengha mbat perkecambahan dan mendorong terjadinya fotosintesis sehingga tanaman akan sulit diarahkan untuk pertumbuhan kalus (Asikin dan Puspitaningtyas 2000). Pada sebagian besar perlakuan, kalus tumbuh mulai 4-8 MSP. Kalus yang tumbuh merupakan kalus kompak yang menempel erat pada permukaan eksplan. Pada beberapa kasus terbentuk serabut putih yang berkembang dan menutupi kalus menyebabkan tidak tumbuhnya kalus embriogenik.
Pada tahap induksi embrio globular, kalus yang dipindahkan pada media perlakuan karena ditempatkan pada ruang bercahaya sebagian besar berubah warna menjadi hijau, membesar ukurannya dan membentuk embrio somatik pada fase globular. Clump embrio globular bila terlalu cepat dipindahkan ke media pendewasaan akan mati sedangkan bila terlambat akan tertutup oleh kalus dan gagal berkembang menjadi embrio dewasa. Pada beberapa eksplan terbentuk struktur akar semu (pneumathode) dimana membuat pembentukan embrio globular menjadi sulit untuk direalisasikan.
Pada tahap pendewasaan embrio globular, beberapa perlakuan terdapat eksplan yang mati karena pelukaan akibat pemisahan clump. Ciri-ciri clump embrio globular yang mati berwarna hitam dan terdapat cairan berwarna kecoklatan berupa fenolik sekeliling eksplan. Embrio globular yang dewasa cenderung berwarna putih kekuningan dan memiliki permukaan yang mengkilat berbeda dari permukaan haustorium yang baru ditanam. Pada akhir pengamatan 2 MSP embrio somatik yang berkecambah masih belum didapatkan.
11
Gambar 3 Alur kultur embrio aren A) Buah aren umur ±18 bulan asal Desa Gunung Goong, Jawa Barat. B) Embrio aren yang telah diisolasi dari endosperm. C) Kalus pada permukaan embrio pada tahap induksi kalus. D) Kalus pada eksplan pada tahap induksi embrio globular. E) Clump embrio globular pada tahap pendewasaan embrio globular. F) Clump embrio globular muda. G) Clump embrio globular dewasa.
Tahap 1: Induksi Kalus
Persentase dan Jumlah Eksplan yang Steril
Eksplan steril merupakan syarat utama dalam keberhasilan kultur jaringan. Respon eksplan yang dikulturkan terhadap media kultur yang diuji dapat diamati pada Gambar 4 yang menunjukkan bahwa persentase kultur steril paling besar terdapat pada perlakuan A1dengan persen eksplan steril 89 % (16/18). Eksplan yang steril pada media A2, A3, A4, A5, dan A6 berturut-turut 50 % (9/18), 16.7 % (15/18), 22.2 % (14/18), 16.7 % (15/18), dan 16.7 % (15/18). Adanya perbedaan persentase kultur yang steril antar media perlakuan diduga disebabkan oleh proses selama pengkulturan.
Sumber kontaminasi pada percobaan berupa cendawan dan bakteri. Kultur yang terkontaminasi cendawan ditandai dengan adanya hifa dan spora sedangkan pada bakteri terdapat lendir berwara putih susu seperti yang terlihat pada Gambar 5 (Yudhanto 2012). Beberapa alasan penyebab kontaminasi yaitu kemungk ina n disebabkan oleh proses sterilisasi yang kurang bersih, kurang hati-hati saat pindah bahan tanam ke media baru, kondisi ruang kultur yang kurang steril, alat kultur dan botol yang kurang bersih serta eksplan yang telah mengandung bakteri yang sistemik (Raynalta 2013). Menurut Thaib (2008) perendaman dengan larutan alkohol 70% selama beberapa detik yang dilanjutkan dengan perendaman dalam larutan HgCl2 0.05 % selama 25 menit adalah cara sterilisasi ujung batang dan ujung
akar aren yang paling tepat dan efektif. Pada penelitian ini, sterilisasi menggunaka n larutan HgCl2 tidak dilakukan karena larutan tersebut bersifat toksik. Sterilisas i menggunakan alkohol 96 % dan NaOCl 1.575 % berhasil mendapatkan eksplan embrio yang steril dengan persentase yang tinggi.
A B C D
12
Gambar 4 Rata-rata persentase eksplan yang steril pada media perlakuan tahap induksi kalus selama 8 MSP
aA1(MS + 3 mg l-1 2,4-D + 2 mg l-1 NAA); A2: (MS + 5 mg l-1 2,4-D + 2 mg l-1 NAA); A3 (MS + 2 mg l-1 2,4-D + 0.2 mg l-1 NAA + 100 mg l-1 biotin); A4 (MS + 2 mg l-1 2,4-D + 0.2 mg l-1 NAA + 400 mg l-1 biotin); A5 (MS + 3 mg l-1 2,4-D + 0.2 mg l-1 NAA + 100 mg l-1 biotin); A6 (MS + 3 mg l-1 2,4-D + 0.2 mg l-1 NAA + 400 mg l-1 biotin); nilai yang berada dalam kurung menunjukan jumla h eksplan yang steril dari total percobaan.
Gambar 5Ekplan aren yang terkontaminasi A) Cendawan. B) Bakteri. Persentase dan Jumlah Eksplan yang Berkalus
Terbentuknya kalus pada eksplan yang dikultur dalam media yang mengandung auksin merupakan salah satu respon yang ditunjukkan dalam kultur jaringan. Hasil percobaan pada Gambar 6 menunjukkan persentase eksplan paling banyak yang mulai berkalus pada 4 MSP terdapat pada media A1 dan A6 yaitu 77.8 % (14/18). Di kultur perlakuan A2, A3, A4 dan A5 yang secara berturut-tur ut 38.8 % (7/18), 53.4 % (8/18), 73.4 % (11/15), dan 50.2 % (9/15). Kalus mulai muncul secara tidak homogen namun terlihat adanya peningkatan jumlah eksplan berkalus pada sebagian besar perlakuan (4-8 MSP). Pada 8 MSP, eksplan berkalus paling banyak adalah A4 yaitu 100 % (12/12) sedangkan yang paling sedikit berasal dari media A3 yaitu 80.2 (12/15). Adanya penambahan vitamin biotin dalam media yang telah mengandung 2 mg l-1 2,4-D dan 0.2 mg l-1 NAA dapat menghasilka n
respon eksplan membentuk kalus. Hal tesebut diduga disebabkan oleh biotin yang berperan sebagai koenzim sehingga dapat meingkatkan sintesis protein.
Respon pertumbuhan kalus dari eksplan embrio zigotik yang digunakan mulai terlihat pada 4 MSP. Menurut Asikin dan Puspitaningtyas (2000), respon pertumbuhan embrio terlihat lebih cepat dibandingkan dengan embrio yang terbungkus oleh endosperm karena embrio lebih mudah menyerap air dan hara serta adanya kontak langsung antara embrio dengan zat pengatur tumbuh yang tertanam pada media.
13
Gambar 6 Persentase keberhasilan eksplan berkalus 4-8 MSP
aA1(MS + 3 mg l-1 2,4-D + 2 mg l-1 NAA); A2: (MS + 5 mg l-1 2,4-D + 2 mg l-1 NAA); A3 (MS + 2 mg l-1 2,4-D + 0.2 mg l-1 NAA + 100 mg l-1 biotin); A4 (MS + 2 mg l-1 2,4-D + 0.2 mg l-1 NAA + 400 mg l-1 biotin); A5 (MS + 3 mg l-1 2,4-D + 0.2 mg l-1 NAA + 100 mg l-1 biotin); A6 (MS + 3 mg l-1 2,4-D + 0.2 mg l-1 NAA + 400 mg l-1 biotin); nilai yang berada dalam kurung menunjukkan jumla h eksplan yang berkalus dari total percobaan.
Persentase dan Jumlah Eksplan Membentuk Kalus Embriogenik dan Rata-rata Persentase Penutupan Kalus pada Eksplan
Embriogensis somatik merupakan proses dimana sel somatik berkembang membentuk tanaman baru melalui tahap perkembangan embrio yang spesifik tanpa melalui fusi gamet (Chawla 2002). Tahap awal untuk menghasilkan embrio somatik adalah pembentukan kalus khususnya kalus yang berpotensi menjadi kalus embriogenik. Acuan yang digunakan untuk menentukan persentase penutupan kalus pada eksplan dapat dilihat pada Gambar 7. Pada Tabel 2, perlakuan yang mampu menginduksi paling banyak kalus pada permukaan eksplan adalah A1 yaitu 72.2 % yang tidak berbeda nyata dengan perlakuan A2, A3, A4, dan A6. Zat pengatur tumbuh 2,4-D yang ditambahkan pada media merupakan jenis hormon auksin sintesis yang berperan dalam pembelahan sel maupun pertumbuhan sel (Slater et al. 2008). Penambahan 2,4-D dalam media kultur sangat dibutuhka n untuk menginduksi struktur nodular embrogenik pada tahap induksi embriogenes is somatik seperti pada Bactris gasipaes (Maciel et al. 2010).
Perlakuan dengan persentase kalus paling sedikit adalah A5 yaitu 51.3 %. Namun bila dibandingkan dengan perlakuan A1, penambahan 100 mg l-1 biotin
cenderung kurang mendukung pembentukan kalus yang lebih banyak padahal dengan adanya tambahan biotin atau vitamin H yang merupakan kunci karboksilasi sintesis lemak diduga mampu menstimulasi pembentukan kalus yang lebih cepat seperti pada percobaan yang telah dilakukan oleh El-shiaty et al. (2004) dimana 93.7 % total pembentukan kalus didapatkan dari media MS + 5 mg l-1 biotin pada
tanaman kurma.
Penambahan biotin sebanyak 400 mg l-1 ternyata mampu meningkatka n
persentase penutupan kalus seperti yang terlihat pada perlakuan A4 dan A6 bila dibandingkan dengan penambahan 100 mg l-1 biotin pada perlakuan A3 dan A5.
14
pada konsentrasi 0.01-1.0 mg l-1 khusus pada aren dapat ditambahkan hingga lebih
dari 1 mg l-1.
Gambar 7Persentase penutupan kalus pada permukaan embrio aren A) 0 % B) 1% C) 10 % D) 50 % E) 100 %.
Kalus yang bersifat embriogenik merupakan kondisi kalus yang dapat beregenerasi membentuk tanaman baik melalui jalur embriogenesis somatik maupun organogenesis. Secara umum, semua media kultur yang dicoba dapat menghasilkan kalus embriogenik. Hasil percobaan pada Tabel 2 menunj uka n persentase kalus embriogenik yang muncul paling banyak terdapat pada A5 yaitu 73.4 % (11/15) walaupun tidak berbeda nyata dengan perlakuan lainnya. Sedangkan kalus embriogenik paling sedikit terdapat pada A6 yaitu 49.9 % (9/18).
Tabel 2 Pengaruh perlakuan terhadap persentase dan jumlah kalus embriogenik dan rata-rata persentase penutupan kalus
Perlakuan*) Persentase
kalus embriogenik
(%)
Rata-rata persentase penutupan kalus
(%)
A1 (3 mg l-1 2,4-D + 2 mg l-1 NAA) (13/18 ) 72.2a 72.2 a
A2 (5 mg l-1 2,4-D + 2 mg l-1 NAA) (12/18) 66.7a 57.2 ab
A3 (2 mg l-1 2,4-D + 0.2 mg l-1 NAA + 100 mg l-1 biotin) (9/15) 60.0a 54.0 ab
A4 (2 mg l-1 2,4-D + 0.2 mg l-1 NAA + 400 mg l-1 biotin) (7/12) 58.3a 65.8 ab
A5 (3 mg l-1 2,4-D + 0.2 mg l-1 NAA + 100 mg l-1 biotin) (11/15) 73.4a 51.3 b
A6 (3 mg l-1 2,4-D + 0.2 mg l-1 NAA + 400 mg l-1 biotin) (9/18) 49.9a 62.8 ab aAngka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda
nyata berdasarkan uji DMRTpada taraf α = 5%; nilai yang berada dalam kurung menunjukan jumlah
kalus embriogenik dari total percobaan; *) menggunakan media dasar MS.
Sel-sel yang embriogenik seperti pada Gambar 8A ditandai dengan permukaan yang halus, terdiri atas sel-sel yang membelah sejajar dan tegak lurus permukaan kalus (Rohani et al. 2000). Warna sel embriogenik cenderung mengkilat dan tidak transparan. Kalus yang bersifat tidak embriogenik dapat dilihat pada Gambar 8B dan 8C. Gambar 8B menunjukan adanya struktur serabut putih pada permukaan kalus. Bila dibiarkan terus berkembang, kalus yang embriogenik akan tertutupi dan gagal berkembang. Pembentukan serabut putih mungkin berhubunga n
B
A C
15 dengan keseimbangan auksin yang terlalu tinggi dibandingkan dengan sitokinin. Jumlah eksplan yang tumbuh serabut putih mengurangi jumlah kalus embriogenik yang terbentuk dan yang akan dipindahkan ke media perlakuan selanjutnya untuk induksi embrio globular.
Gambar 8 Penampakan kalus A) Embriogenik (perlakuan A2). B) Tidak embriogenik dengan serabut putih (perlakuan A6). C) Tidak embriogenik tanpa serabut putih (perlakuan A3).
Perbandingan Ukuran Pangkal Apokol dan Haustorium
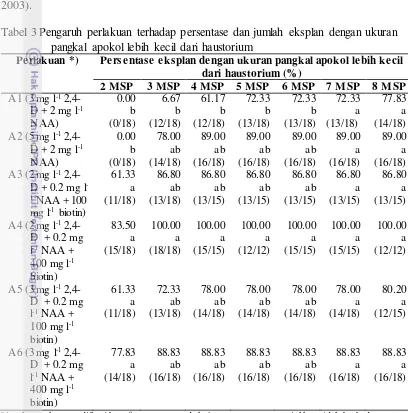
Aren merupakan tanaman monokotil dimana tipe perkecambahan biji adalah hipogeal. Embrio yang tertanam dalam biji aren berbentuk kerucut dimana saat terjadi perkecambahan bagian apokol memanjang membentuk akar terlebih dahulu dan bagian haustorium membengkak (Sulisetijono 2003). Penanaman eksplan pada media perlakuan diharapkan apokol tidak memanjang sehingga tidak diharapkan eksplan membentuk pangkal apokol yang lebih besar atau sama dengan haustorium (Gambar 9B) melainkan pangkal apokol lebih kecil dari haustorium (Gambar 9A). Hasil pengamatan pada Tabel 3 menunjukan media yang terbaik untuk menghasilkan ukuran pangkal apokol lebih kecil dari haustorium adalah A4 yaitu 100 % pada 8 MSP. Berdasarkan uji statistika perlakuan tersebut tidak berbeda nyata dengan perlakuan lainnya namun pada 2 MSP terlihat komposisi A4 mampu memberikan reaksi yang lebih cepat dibandingkan perlakuan A1 dan A2 yaitu 0 %.
Gambar 9Perbandingan ukuran pangkal apokol dan haustorium A) Pangkal apokol lebih besar dari haustorium. B) Pangkal apokol lebih kecil dan sama dengan haustorium.
Pada pekecambahan biji aren, terdapat pertumbuhan morfologi yang spesifik yaitu adanya pertumbuhan apokol yang memanjang membentuk akar primer setelah hari ke-10 dimana nantinya terdapat tunas yang muncul dari pertengahannya (Asikin dan Puspitaningtyas 2000). Pada percobaan, apokol diharapkan tidak memanjang dan membentuk akar primer melainkan adanya pembengkakan pada bagian haustorium sehingga ukuran pangkal apokol akan lebih kecil dibandingkan dengan haustorium. Haustorim adalah organ pada embrio aren
A B
C B
16
yang merupakan tempat cadangan makanan (Sulisetijono 2003). Pada konsentrasi auksin yang sesuai, pembengkakan yang terjadi akan menstimulasi pembentukan kalus khususnya pada bagian haustorium. Walaupun haustorium adalah organ yang berfungsi untuk tempat cadangan makanan namun terbukti dapat diinduks i pembentukan kalus yang mampu menutupi permukaan hingga 100% (Sulisetijo no 2003).
Tabel 3 Pengaruh perlakuan terhadap persentase dan jumlah eksplan dengan ukuran pangkal apokol lebih kecil dari haustorium
Perlakuan *) Persentase eksplan dengan ukuran pangkal apokol lebih kecil
dari haustorium (%)
aAngka-angka yang diikuti huruf yang sama pada kolom yang sama menujukkan tidak berbed a nyata
berdasarkan uji DMRTpada taraf α = 5%; nilai yang berada dalam kurung menunjukan eksplan dengan ukuran pangkal apokol lebih kecil dari haustorium dari total percobaan; *) menggunakan media dasar MS.
Tahap 2: Induksi Embrio Globular
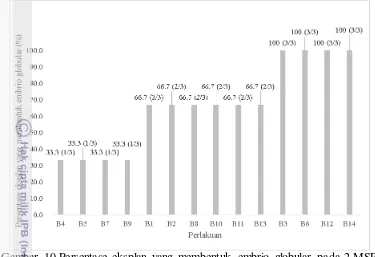
Persentase dan Jumlah Eksplan yang Membentuk Embrio Globular
17 mampu membentuk embrio globular. Sedangkan pada B4, B5, B7, dan B9 hanya 33.3 % (1/3) dari total eksplan yang ditanam mampu membentuk embio globular. Keberhasilan dalam membentuk embrio globular pada percobaan masih tergolong rendah mengingat bahan yang digunakan berasal dari embrio zigotik yang relatif beragam sehingga stimulasi antar eksplan juga berbeda (Slater et al. 2008). Pembentukan fase globular embrio somatik aren pada penelitian ini juga masih lebih lambat (9-10 minggu dari awal tanam) bila dibandingkan dengan yang tanaman kelapa sawit mulai terbentuk setelah 4-6 minggu dari awal tanam (Husni
et al 2012).
Pada tahap induksi embrio globular, zat pengatur tumbuh yang digunakan adalah dari golongan sitokinin dan antiauksin karena diharapkan mampu membentuk embrio globular. Menurut Chawla (2002), hormon sitokinin merupakan hasil turunan dari adenin dan memiliki peranan penting dalam induksi tunas serta menstimulasi pertumbuhan dan perkembangan tanaman khususnya pembelahan sel jika dikombinasikan dengan auksin.
Pada perlakuan dengan kalus dari media dengan tambahan 3 mg l-1 2,4-D
dan 2 mg l-1 NAA yang kemudian dipindahkan ke media yang diberi 4 mg l-1
Kinetin ternyata membentuk embrio globular yang paling banyak dibandingka n dengan penggunaan 0.4 dan 1 mg l-1 Kinetin. Penggunaan auksin dalam jumlah
yang lebih rendah pada tahap sebelumnya dan sitokinin tinggi memberikan hasil yang paling baik walaupun belum bisa dipastikan kestabilan genetik akibat keragaman somaklonal yang mungkin terjadi. Sedangkan perlakuan dengan kalus dari media dengan tambahan 5 mg l-1 2,4-D dan 2 mg l-1 NAA yang kemudian
dipindahkan ke media yang diberi 1 mg l-1 Kinetin ternyata menghasilkan embrio
globular yang paling sedikit. Diduga keseimbangan hormon sitokinin terlalu rendah dibandingkan hormon auksin yang telah diberikan pada media sebelumnya maupun auksin endogen pada perlakuan tersebut.
Penggunaan Kinetin dan TIBA pada beberapa konsentrasi memberikan hasil yang berbeda bila ditambahkan pada kalus yang diperoleh dari perlakuan 2 mg l-1
NAA dengan 2,4-D sebanyak 3 atau 5 mg l-1. Pada kalus yang diperoleh dari 2 mg
l-1 NAA dan 3 mg l-1 2,4-D, penambahan 1 mg l-1 Kinetin dan 0.1 mg l-1 TIBA
memberikan hasil yang paling baik. Sedangkan pada kalus yang diperoleh dari 2 mg l-1 NAA dan 5 mg l-1 2,4-D, penambahan 0.1 mg l-1 Kinetin dan 1 mg l-1 TIBA
maupun penambahan 1 mg l-1 Kinetin dan 1 mg l-1 TIBA mampu menghasilka n
paling banyak kalus dengan embrio globular. Aren diduga memiliki auksin endogen yang cukup tinggi sehingga tidak ditambahkan auksin eksogen pada tahap induksi embrio globular melainkan TIBA. TIBA merupakan antiauksin yang memilik i peran dalam menekan tingkat auksin endogen (Dovzhenko 2001).
18
Gambar 10 Persentase eksplan yang membentuk embrio globular pada 2 MSP a Semua perlakuan menggunakan media dasar MS; Setiap perlakuan terdiri atas 3 eksplan yang diamati; B1 (kalus A1 ke media 0.4 mg l-1 Kinetin); B2 (kalus A1 ke media 1 mg l-1 1 Kinetin); B3 (kalus A1 ke media 4 mg l-1 Kinetin); B4 (kalus A1 ke media 0.1 mg.l-1 Kinetin + 0.1 mg l-1 TIBA); B5 (kalus A1 ke media 0.1 mg l-1 Kinetin + 1 mg l-1 TIBA); B6 (kalus A1 ke media 1 mg l-1 1 Kinetin + 0.1 mg l-1 1 TIBA); B7 (kalus A1 ke media 1 mg l-1 Kinetin + 1 mg l-1 TIBA); B8 (kalus A2 ke media 0.4 mg l-1 Kinetin); B9 (kalus A2 ke media 1 mg l-1 Kinetin); B10 (kalus A2 ke media 4 mg l-1 Kinetin); B11 (kalus A2 ke media 0.1 mg l-1 1 Kinetin + 0.1 mg l-1 TIBA); B12 (kalus A2 ke media 0.1 mg l-1 Kinetin+ 1 mg l-1 TIBA); B13 (kalus A2 ke media 1 mg l-1 Kinetin + 0.1 mg l-1 TIBA); B14 (kalus A2 ke media 1 mg l-1 Kinetin + 1 mg l-1 TIBA); nilai yang berada dalam kurung menunjukan jumlah eksplan yang membentuk embrio globular dari total percobaan.
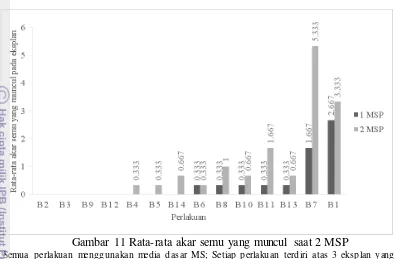
Rata-rata Jumlah Akar Semu yang Muncul
Keseimbangan antar zat pengatur tumbuh auksin dan sitokinin dapat diarahkan ke pembentukan embrio somatik maupun organogenesis. Kalus embriogenik yang diberi perlakuan diharapkan berkembang membentuk embrio somatik yang kemudian berkecambah ataupun bertunas. Namun, terkadang keseimbangan hormon cenderung lebih menuju ke arah pembentukan akar. Pada Gambar 11 menunjukan perlakuan B7 mampu membentuk paling banyak akar semu yaitu 6 buah. Hasil uji menunjukan perlakuan tersebut tidak berbeda nyata dengan B1 yaitu rata-rata 4 akar semu. Perlakuan B2, B3, B9, dan B12 tidak mampu membentuk akar semu sehingga menjadi media yang paling baik untuk mengarahkan kalus embriogenik ke arah embrio globular yang berpotensi untuk berkecambah dan menumbuhkan tunas terlebih dahulu.
19 penambahan auksin eksogen sehingga membuktikan bahwa auksin endogen pada eksplan masih tinggi walaupun telah diberi sitokinin dan antiauksin.
Gambar 11 Rata-rata akar semu yang muncul saat 2 MSP
a Semua perlakuan menggunakan media dasar MS; Setiap perlakuan terdiri atas 3 eksplan yang diamati; B1 (kalus A1 ke media 0.4 mg l-1 Kinetin); B2 (kalus A1 ke media 1 mg l-1 1 Kinetin); B3 (kalus A1 ke media 4 mg l-1 Kinetin); B4 (kalus A1 ke media 0.1 mg.l-1 Kinetin + 0.1 mg l-1 TIBA); B5 (kalus A1 ke media 0.1 mg l-1 1 Kinetin + 1 mg l-1 TIBA); B6 (kalus A1 ke media 1 mg l-1 1 Kinetin + 0.1 mg l-1 1 TIBA); B7 (kalus A1 ke media 1 mg l-1 Kinetin + 1 mg l-1 TIBA); B8 (kalus A2 ke media 0.4 mg l-1 Kinetin); B9 (kalus A2 ke media 1 mg l-1 Kinetin); B10 (kalus A2 ke media 4 mg l-1 Kinetin); B11 (kalus A2 ke media 0.1 mg l-1 1 Kinetin + 0.1 mg l-1 TIBA); B12 (kalus A2 ke media 0.1 mg l-1 Kinetin+ 1 mg l-1 TIBA); B13 (kalus A2 ke media 1 mg l-1 Kinetin + 0.1 mg l-1 TIBA); B14 (kalus A2 ke media 1 mg l-1 Kinetin + 1 mg l-1 TIBA).
Gambar 12 Akar semu aren A) Penampakan akar semu aren pada perlakuan B11. B) Potongan melintang akar semu aren.
Tahap 3: Pendewasaan Embrio Globular
Persentase dan Jumlah Clump Embrio Globular Hidup dan yang Dewasa
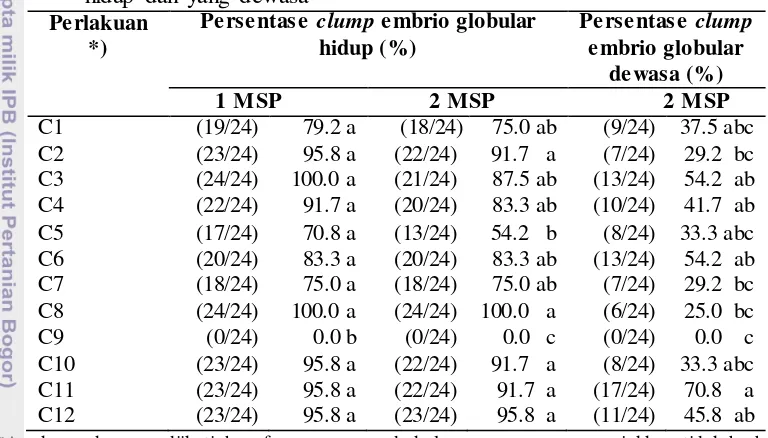
Fase globular merupakan tahap awal dari perkembangan embrio somatik membentuk tanaman utuh dari proses embriogenesis somatik. Kumpulan embrio globular yang didapatkan dari percobaan sebelumnya dipisahkan menggunaka n pisau scalpel dan ditanam pada media perlakuan baru. Tabel 4 menunjukka n komposisi media yang terbaik dalam mempertahankan clump embrio globular hidup hingga 2 MSP adalah C8 yaitu 100 % namun tidak berbeda nyata dengan
20
perlakuan C1, C2, C3, C4, C6, C7, C10, C11, dan C12. Perlakuan C9 menyebabkan seluruh eksplan mati. Embrio globular yang mati berubah menjadi warna coklat dan mengeluarkan cairan coklat sekelilingnya seperti pada Gambar 13H dan 13I. Hal serupa dapat ditemukan pada pemisahan clump protocorm like bodies (PLB)
Phalaenopsis amabilis dimana gejala pencoklatan yang diduga terjadi akibat
akumulasi fenol yang teroksidasi akibat perlukaan saat pemisahan (Raynalta 2013). Embrio globular sebelum ditanam pada media perlakuan baru dapat dilihat pada Gambar 13A dan 13B.
Gambar 13 Hasil embrio globular pada penelitian A) Clump embrio globular muda pada haustorium (perlakuan C11). B) Clump embrio globular muda (perlakuan C6). C) Clump embrio globular dewasa (perlakuan C11). D) Individu embrio globular (perlakuan C11). E) Potongan melinta ng
clump embrio globular aren (perlakuan C6). F) Potongan embrio
globular melintang. G) Bakal tunas pada permukaan ekplan. H) Kalus yang mati. I) clump embrio globular yang telah berkembang dan mengeluarkan fenol. EG: embrio globular. A dan C menggunaka n perbesaran 100x . B dan D menggunakan perbesaran 200x. E dan F menggunakan perbesaran 400x.
Embrio somatik pada fase globular untuk berkembang menjadi tahap skutelar membutuhkan asupan nutrisi, hormon dan waktu untuk pendewasaan. Hasil uji statistik menunjukan bahwa persentase clump embrio globular dewasa paling banyak terdapat pada perlakuan C11 yaitu 70.8% (22/24) namun tidak berbeda nyata dengan C1, C3, C4, C5, C6, C10, dan C12. Ciri-ciri clump embrio globular yang dewasa adalah warnanya menjadi putih susu kekuningan dan mengkilat seperti yang terlihat pada Gambar 12C dan 12D. Gambar 12E dan 12F menunjukan penampakan mikroskopis ekplan ketika dilakukan penyayatan melintang. Perlakuan C9 tidak menghasilkan clump embrio globular dewasa karena semua eksplan mati.
A
B
C
D E F G
21 Penambahan 0.1 mg l-1 GA
3 maupun tanpa pemberian GA3 pada perlakuan
kurang memberikan dampak yang terlalu nyata karena pengaruh zat pengatur tumbuh dari media perlakuan sebelumnya masih terus berperan terhadap perkembangan embrio globular. Alasan lain mengapa pemberian GA3 pada
konsentrasi tersebut tidak memberikan pengaruh yang nyata adalah waktu pengamatan hanya hingga 2 MSP. Setelah 2 MSP, kondisi sebagian besar kultur mengalami kontaminasi khususnya cendawan akibat proses pemindahan eksplan yang kurang steril sehingga sulit untuk dilakukan pengamatan lanjutan. Namun pada eksplan yang berhasil hidup didapatkan struktur yang diduga bakal tunas seperti yang terlihat pada Gambar 12G.
Tabel 4 Pengaruh perlakuan terhadap persentase dan jumlah clump embrio globular hidup dan yang dewasa
Perlakuan *)
Persentase clump embrio globular
hidup (%)
aAngka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda
nyata berdasarkan uji DMRTpada taraf α = 5%; *) Menggunakan media dasar MS; nilai yang berada
dalam kurung menunjukan jumlah clump embrio globular dari total percobaan; C1 (clump embrio globular B1 ke media 0.1 mg l-1 GA3); C2 (clump embrio globular B2 ke media 0 mg l-1 GA3); C3 menghasilkan eksplan steril dari 50-85 %. Pembentukan kalus embriogenik paling banyak terdapat pada A5 (MS + 3 mg l-1 2,4-D + 0.2 mg l-1 NAA + 100 mg l-1
22
mg l-1 TIBA), B12 (kalus A2 ke media MS + 0.1 mg l-1 Kinetin+ 1 mg l-1 TIBA),
dan B14 (kalus A2 ke media MS + 1 mg l-1 Kinetin + 1 mg l-1 TIBA) mampu
membentuk embrio globular pada seluruh eksplan yang ditanam pada tahap induksi embrio globular. Pada tahap pendewasaan embrio globular, perlakuan C11 (clump
embrio globular B9 ke media 0.1 mg l-1 GA
3) mampu menghasilkan clump embrio
dewasa paling banyak yaitu 70.8 % (22/24).
Saran
Pada penelitian ini, sumber eksplan yang digunakan berupa embrio zigot ik yang berasal dari pohon aren dalam dan sangat bervariasi sifat genetiknya sehingga disarankan pada penelitian selanjutnya menggunakan eksplan dari tunas muda aren genjah. Media perlakuan pada tahap induksi embrio globular berupa media padat sehingga tidak seluruh permukaan eksplan terkena media. Disarankan penggunaa n media cair khususnya menggunakan temporary immersion system untuk menghasilkan embrio globular dengan hasil yang optimal.
DAFTAR PUSTAKA
Akuba RH. 2004. Profil Aren. Pengembangan Tanaman Aren. Balai Penelit ia n Tanaman Kelapa dan Palma Lain. Prosiding Seminar Nasional Aren. Seminar
Nasional Aren; 2004 Juni 9; Tondano, Indonesia. Tondano (ID). hlm 1-9.
Asikin D, Puspitaningtyas DM. 2000. Studi perkecambahan biji aren (Arenga
pinnata (Wurmb.) Merr.) secara in vitro dan in vivo. Di dalam: Subroto MA.
Prosiding Seminar Hasil Penelitian dan Pengembangan Bioteknologi III.
Seminar Hasil Penelitian dan Pengembangan Bioteknologi III; 2000 Maret
7-9; Cibinong, Indonesia. Cibinong (ID). hlm 411-419.
Bhojwani SS, Razdan MK. 1983. Plant tissue culture: theory and practice. Amsterdam (NE): Elsevier.
Chawla HS. 2002. Introduction to Plant Biotechnology 2nd Edition. Enfie ld (USA): Science Publishers.
Constabel F, Shyluk JP. 1994. Initiation, nutrition, and maintenance of plant cell and tissue culture, 3-15 pg. Di dalam: Vasil IK, Thorpe TA. Plant Cell and Tissue Culture. Netherlands (NL): Kluwer Academic Publishers.
Dovzhenko A. 2001. Towards plastid transformation in rapeseed (Brassica napus
L.) and sugarbeet (Beta vulgaris L.) [disertasi]. Munich (DE): Universitä t München.
Effendi DS. 2010. Prospek pengembangan tanaman aren (Arenga pinnata MERR)
mendukung kebutuhan bioetanol di Indonesia. Perspektif. 9(1):36-46.
EL-Shiaty OH, El-Sharabasy SF, El-Kareim AHA. 2004. Effect of some amino acids and biotin on callus and proliferation of date palm (Phoenix dactylifera
L.) Sewy cultiver.
x.php?option=com_content&view=article&id=438:teknologi-pembibitan-23 dan-pengolahan-aren- menjadi-triger-sistem-agribisnis-aren-di-provinsi-banten&catid=47:success-story&Itemid=66.
Hong XZ. 1990. Barley (Hordeum vulgare L.): Anther culture and the production of haploids, 125-175 pg. Di dalam: Bajaj YPS. 1990. Haploids in Crop Improvement I. Germany (DE): Springer-Verlag.
Husni A, Kosmiatin M, Purwito A. 2012. Embriogenesis somatik langsung pada tanaman kelapa sawit. Di dalam: Suryani A, Syamsu K, Saputra D, Suparman KS, Sulaeman I, Sukmawati Y. Prosiding Akselerasi lnovasi lndustri Kelapa Sawit untuk Meningkatlam Daya Saing Global. Seminar Nasional dan
Kongres MAKSI; 2012 Januari 26; Bogor, Indonesia. Bogor (ID). hlm
412-418
Maciel AD, Fermino PCPF, Silva RAD, Pereira JES. 2010. Morpho-anatomica l characterization of embryogenic calluses from immature zygotic embryo of peach palm during somatic embryogenesis. Acta Scientiarum: Agronomy. 32(2):263-267 doi:10.4025/actasciagron.v32i2.3248
Maliangkay RB. Allorerung D. Polnaja CM. Ilat A. Mahmud Z. 1997. Kriteria buah aren untuk dijadikan benih. Laporan Tahunan Balitka 1996/1997. Manado (ID): Balitka. hlm 298-307.
Mamat HS, Tarigans D. 1993. Potensi produksi aren di Jawa Barat dan kontribusinya terhadap pendapatan. Media Komunikasi Litbangtri. 11:84– 87. Microprogation of Elaeis guineensis Jacq. “Dura’: Comparison of three basal
media for efficient regeneration. Indian J. Exp. Biol. 46:79-82.
Nehra NS, Kartha KK. 1990. Meristem and shoot tip culture. Di dalam: Vasil IK, Thorpe TA, editor. Plant Cell and Tissue Culture. Dordrecht (NL): Kluwer Academic Publishers. hlm 37-70.
Putih R, Satria B, Thaib R. 2003. Upaya perbanyakan vegetatif enau (Arenga
pinnata (Wurmb) Merr.) melalui regenerasi tunas secara in vitro. Stigma.
11(3):208-212.
Raynalta E. 2013. Pengaruh komposisi media dalam perrtumbuhan PLB, plantlet, dan aklimatisasi Phalaenopsis amabilis [skripsi]. Bogor (ID): Insitit ut Pertanian Bogor
Rofik A, Murniati E. 2008. Pengaruh perlakuan deoperkulasi benih dan media perkecambahan untuk meningkatkan viabilitas benih aren (Arenga pinnata
24
Rohani O, Sharifa SA, Rafii MY, Ong M, Tarmizi AH, Zamzuri I. 2000. Tissue culture of Oil palm. Di dalam: Basiron T, Jalani BS, Chan KW (editor).
Advances in Oil Palm Research I. Kuala Lumpur (MY): Malaysian Palm Oil
Board. Hlm 19-38. Rofik A, Murniati E. 2008. Pengaruh perlakuan deoperkulasi benih dan media perkecambahan untuk meningkatkan viabilita s benih aren (Arenga pinnata (Wurmb.) Merr.). Bul. Agron. 36(1):33–40. Sandra HE. 2012. Auksin Zat Pengatur Tumbuh [Internet]. [diunduh 2012 Maret
28]. Tersedia pada: http://eshaflora.com/index. php?option=com_co n tent&task=view&id=99&Itemid=1.
Slater A, Scott N, Fowler M. 2008. Plant Biotechnology: The Genetic
Manipulation of Plants 2nd Edition. London (UK): Oxford University Press.
Soeseno S. 2000. Bertanam Aren. Jakarta (ID): Penebar Swadaya.
Sulisetijono. 2003. Developmental of Haustorium of Cotyledon at Palm (Arecaceae) Seed. Chimera [Internet]. [diunduh 2013 Juni 1]; 8(1). Tersedia pada: http://journal.um.ac.id/index.php/chimera/article/view/1709.
Suwasono H. 1989. Hormon Tumbuhan. Jakarta (ID): Rajawali
Thaib R. 2008. Mendapatkan cara sterilisasi eksplan enau (Arenga pinnata Merr.)
yang tepat dan efektif. Padang [ID]: Universitas Andalas.
Untu Z, Taulu DB, Kumaunang J, Akuba RH. 1998. Pertumbuhan dan perkembangan embrio tanaman aren. Laporan Tahunan Balitka 1996/1997. Manado (ID): Balitka. hlm 308–317.
United States Department of Agriculture Natural Resources Conservation Service. 2012. Arenga pinnata (Wurmb) Merr [Internet]. [diunduh 2012 Maret 15]. Tersedia pada: http://plants.usda.gov/java/profile?symbol=ARPI6.
25 Lampiran 1 Komposisi media MS (Murashige dan Skoog 1962)
Komposisi Konsentrasi
NH4NO3 1,650 mg l-1
KNO3 1,900 mg l-1
CaCl2. 2H2O 440 mg l-1
MgSO4. 7H2O 370 mg l-1
KH2PO4 170 mg l-1
Na2-EDTA. 2H2O 37.2 mg l-1
FeCl3. 6H2O 27.8 mg l-1
H3BO3 6.2 mg l-1
MnSO4. 4H2O 22.3 mg l-1
ZnSO4. 7H2O 8.6 mg l-1
KI 0.83 mg l-1
Na2MoO4. 2H2O 0.25 mg l-1
CuSO4. 5H2O 0.025 mg l-1
CoCl2. 6H2O 0.025 mg l-1
Myo-inositol 100 mg l-1
Lampiran 2 Komposisi vitamin Morel dan Wetmore (Morel 1950)
Komposisi Konsentrasi
Calcium Panthotenate 0.001g l-1
Nicotinic Acid 0.001g l-1
Pyridoxine 0.001g l-1
Thiamine 0.001g l-1
Lampiran 3 Komposisi media induksi kalus embriogenik dengan media dasar MS
Media A1 A2 A3 A4 A5 A6
2,4-D 3 mg l-1 5 mg l-1 2 mg l-1 2 mg l-1 3 mg l-1 3 mg l-1
NAA 2 mg l-1 2 mg l-1 0.2 mg l-1 0.2 mg l-1 0.2 mg l-1 0.2 mg l-1
Arginin 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1
Biotin - - 100 mg l-1 400 mg l-1 100 mg l-1 400 mg l-1
Kasein
hidrolisat 100 mg l
-1 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1
Glutamin 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1
Asparagin 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1 100 mg l-1
Vitamin
Morel and
Wetmore
4 ml l-1 4 ml l-1 1 ml l-1 1 ml l-1 1 ml l-1 1 ml l-1
Arang aktif 1 g l-1 1 g l-1 1 g l-1 1 g l-1 1 g l-1 1 g l-1
Phytagel 3 g l-1 3 g l-1 3 g l-1 3 g l-1 3 g l-1 3 g l-1
Sukrosa 50 g l-1 50 g l-1 50 g l-1 50 g l-1 50 g l-1 50 g l-1