SECARA
IN VITRO
PRIMADIYANTI ARSELA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Regenerasi Terubuk (Saccharum edule) Secara In Vitro” adalah karya saya sendiri dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Desember 2011
PRIMADIYANTI ARSELA. In Vitro Regeneration of Terubuk (Saccharum edule). Under supervision of BAMBANG S PURWOKO as chairman; AGUS PURWITO and ANAS D SUSILA as members of the advisory committee.
Terubuk is one of the potential vegetable known as cauliflower sugarcane. It is characterized by unusual, swollen and aborted inflorescences, which is sweet and edible. The inflorescences are used as a source of food in Fiji, New Guinea, Indonesia and Malaysia by the indigenous people. The inflorescences are abnormal in the sense that they remain enclosed within the leaf-sheaths, forming a compact mass about the size of a banana fruit. Terubuk is produced and consumed locally and traded in local market only. In Indonesian’s traditional market, it is sold in bunches of 10. Terubuk is closely related to Saccharum officinarum, S. spontaneum, and S. robustum. It is exclusively propagated by cuttings or by division of clumps. To provide more inflorescences, it needs higher plants production. Its production needs cutting materials or propagules. Conventional propagation requires a lot of planting material. Tissue culture is an alternative propagation technique to solve the inavailability of plant material. The objective of this research was to obtain the best method to propagate terubuk using in vitro micropropagation through direct and indirect organogenesis. Flower stalks were used as explants. The explant’s sterilization was done by spraying the inflorescences with alcohol 96 %, then the flower was burnt. The indirect organogenesis using calli induction showed that the best medium was MS + 3.0 mg l-1 2,4-D + 1.0 mg l-1 kinetin. This media did not produce shoots from calli proliferation stage. It was only able to produce roots. The other method was by direct organogenesis. It was shown that the best medium was MS + 0.25 mg l-1 thidiazuron + 0.1 mg l-1 NAA + 0.25 mg l-1 GA3 to produce shoots in 2 weeks without putting the explants in calli induction medium. Shoots obtained through the media varied in size. Only shoot with 1-3 cm in size were rooted. Root formation required full strength of MS salt. The percentage of success in rooting ranged from 50-80%. Acclimatization has been done, however, after 2 weeks the planlet did not survive.
RINGKASAN
PRIMADIYANTI ARSELA. Regenerasi Terubuk (Saccharum edule) Secara In Vitro. Dibawah bimbingan BAMBANG S PURWOKO sebagai ketua Komisi Pembimbing, AGUS PURWITOdan ANAS D SUSILA sebagai anggota Komisi Pembimbing.
planlet mengalami kematian setelah 2 minggu ditanam di media tanah.
©Hak Cipta Milik IPB, tahun 2011 Hak Cipta Dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, pernulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan sebagian besar pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SECARA
IN VITRO
PRIMADIYANTI ARSELA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Regenerasi Terubuk (Saccharum edule) Secara In Vitro Nama : Primadiyanti Arsela
NIM : A253080051
Disetujui, Komisi Pembimbing
Prof. Dr. Ir. Bambang S. Purwoko, M.Sc. Ketua
Dr. Ir. Agus Purwito, M.Sc.Agr Dr. Ir. Anas D. Susila, M.Si Anggota Anggota
Diketahui,
Ketua Mayor
Pemuliaan dan Bioteknologi Tanaman Dekan Sekolah Pascasarjana IPB
Dr. Ir.Trikoesoemaningtyas, M.Sc Dr. Ir. Dahrul Syah, M.Sc.Agr
Puji dan syukur hanya kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian yang berjudul Regenerasi Terubuk (Saccharum edule) Secara In Vitro yang dilaksanakan sejak bulan Oktober 2009 sampai dengan bulan Juni 2011.
Penulis mengucapkan terima kasih kepada Prof. Dr. Ir. Bambang S. Purwoko, M.Sc. , Dr. Ir. Agus Purwito, M.Sc.Agr , dan Dr. Ir. Anas D Susila, M.Si atas bimbingan, saran, serta ilmu yang dapat menunjang terlaksananya
penelitian ini. Penulis juga menyampaikan ucapan terima kasih kepada Dr. Ir. Trikoesoemaningtyas, M.Sc. selaku Ketua Program Studi Pemuliaan dan
Bioteknologi Tanaman, IPB, seluruh staf pengajar, dan seluruh teknisi yang telah memberikan bantuan selama penelitian ini.
Ucapan terima kasih juga disampaikan kepada bapak Ari Yunanto dan ibu Eko Saryuliningsih, adik-adik penulis Sarie dan Titie serta ananda Denny yang selalu mendoakan dan memberikan semangat agar penulis tetap maju berkarya. Terima kasih juga kepada teman-teman seperjuangan, PBT angkatan 2008 dan 2009 yang telah menemani dan memberikan kritik saran dalam penulisan tesis ini. Semoga tesis ini dapat memberikan manfaat bagi pembaca dan pengembangan ilmu pengetahuan. Terima kasih.
Bogor, Desember 2011
RIWAYAT HIDUP
DAFTAR TABEL ... x Klasifikasi Tanaman Terubuk ... 5
Teknik Kultur Jaringan ... 7 Eksplorasi Eksplan Terubuk ... 22
DAFTAR TABEL
Halaman
1. Kombinasi zat pengatur tumbuh pada kultur jaringan tebu ... 13 2. Eksplorasi bahan tanaman in vitro terubuk ... 23 3. Rataan waktu muncul kalus, persentase terbentuknya kalus dan
bobot kalus (set pertama) ... 24 4. Rataan waktu muncul kalus, persentase terbentuknya kalus dan
Halaman
1. Bagan alir pelaksanaan penelitian ... 4
2. Morfologi tanaman terubuk ... 6
3. Bunga terubuk ... 7
4. Stek tanaman terubuk dalam polibag ... 15
5. Potongan bunga terubuk ... 16
6. Tunas terubuk ... 17
7. Penampakan kalus pada media MS+ 3 mg l-1 2,4-D+ 1 mg l-1 kinetin . 25 8. Perlakuan induksi tunas dari kalus terubuk ... 26
9. Eksplan dalam perlakuan induksi tunas ... 27
10. Tunas yang terbentuk pada perlakuan MS+ 0,25 mg l-1 TDZ ... 28
11. Tunas yang terbentuk pada perlakuan BAP dan kinetin ... 30
12. Ukuran tunas terubuk ... 30
13. Planlet terubuk dalam botol kultur ... 32
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Terubuk (Saccharum edule Hasskarl) adalah salah satu jenis sayuran lokal yang telah lama dikenal masyarakat sebagai sayuran indigenous. Sayuran indigenous merupakan sayuran asli daerah atau wilayah tertentu yang sudah dibudidayakan atau dimanfaatkan oleh penduduk setempat dari dulu, sehingga sudah dianggap sebagai tanaman turun-temurun. Sayuran indigenous merupakan bagian dari keanekaragaman hayati yang dimiliki Indonesia, dan Indonesia termasuk dalam 3 negara mega keanekaragaman hayati setelah Brazil dan Madagaskar (Baihaki 2003). Beberapa sayuran indigenous lainnya antara lain gambas/oyong, labu siam, leunca, katuk, kemangi, kenikir koro, paria dan selada air (AVRDC 1999). Pemanfaatan sayuran indigenous merupakan salah satu alternatif yang dapat digunakan sebagai sumber nutrisi (gizi).
Terubuk adalah tanaman asli Asia Tenggara dan sekitar Pasifik yang tersebar di daerah dataran rendah sampai daerah dataran tinggi. Terubuk termasuk tanaman perenial. Umumnya terubuk dapat dipanen setelah berumur 5-10 bulan, dengan daur hidup sekitar 2-3 tahun (Van den Bergh 1994). Tinggi terubuk mencapai 1,5-4 m, dengan sistem pembungaan yang abnormal, bunga tetap terbungkus dalam pelepah daun atau kelobot, berukuran sebesar buah pisang
(Martin 1984).
Sampai saat ini, terubuk masih dibudidayakan secara konvensional (perbanyakan vegetatif menggunakan setek batang) di areal tanam yang tidak luas, sedangkan permintaan beberapa sayuran indigenous cukup tinggi. Alasan sayuran indigenous dibudidayakan masih secara konvensional antara lain kurang tersedianya benih/bibit, kurang informasi teknologi budidaya, kurang informasi tentang kesesuaian sayuran indigenous dengan sistem produksi yang ada (Soetiarso 2010).
2
tradisional daerah Bogor dan sekitarnya), serta memungkinkan untuk dibudidayakan secara intensif, maka diperlukan usaha peningkatan produksi dan kualitas terubuk.
Terubuk diperbanyak secara vegetatif dengan menggunakan setek batang, karena terubuk tidak menghasilkan biji, bunga terubuk tidak normal dan tidak dapat berkembang sempurna sampai membentuk biji (James 2004). Perbanyakan dengan setek memerlukan bahan tanaman dalam jumlah banyak. Hal ini menyebabkan penyediaan bahan setek terubuk dalam waktu singkat akan menemui kendala. Metode in vitro adalah suatu metode perbanyakan yang dapat memecahkan permasalahan bibit (Farid 2003). Metode ini dapat menghasilkan bibit dalam jumlah banyak tanpa memerlukan bahan tanaman yang banyak dan dapat menyediakan bahan tanaman yang bebas patogen (Zulkarnain 2009).
Kultur jaringan terubuk belum pernah dilakukan. Oleh sebab itu, perbanyakan secara in vitro terubuk menggunakan acuan dari hasil penelitian kultur jaringan keluarga dekat terubuk yaitu tebu (S. officinarum). Keberhasilan regenerasi tanaman tebu secara in vitro telah banyak dilaporkan antara lain produksi dan regenerasi kalus, induksi tunas dan proliferasinya, serta induksi perakaran. Pada induksi kalus yang digunakan adalah media MS (Murashige dan Skoog ) dengan auksin (2,4-D) 3 mg l-1 dan sitokinin (kinetin) 0,1 mg l-1, untuk induksi tunas menggunakan kombinasi auksin (NAA) 2 mg l-1 dan sitokinin (BAP atau kinetin) antara 0,1-2 mg l-1, sedangkan untuk induksi akar menggunakan auksin saja (IBA atau NAA) antara 1-3 mg l-1 (Karim 2002; Farid 2003; Chengalrayan et al. 2005; Khan & Abdullah 2008; Gandonou et al. 2005; Ali et al. 2008; Roy & Kabir 2007; Behera & Santilata 2009).
Tujuan Penelitian
Tujuan penelitian ini adalah:
1. Memperoleh bagian tanaman yang dapat digunakan sebagai bahan tanam in vitro
3. Mempelajari pengaruh sitokinin terbaik terhadap kemampuan eksplan membentuk tunas
4. Mempelajari kemampuan elongasi dan perakaran tunas 5. Mempelajari respon aklimatisasi planlet terubuk.
Hipotesis
Hipotesis penelitian ini adalah:
1. Terdapat bagian tanaman terbaik yang digunakan sebagai eksplan in vitro 2. Terdapat pengaruh auksin dan sitokinin terhadap induksi kalus
3. Terdapat pengaruh sitokinin dalam induksi tunas
4. Terdapat metode terbaik dalam elongasi dan perakaran tunas 5. Terdapat respon aklimatisasi planlet terubuk.
Kerangka Pemikiran
Salah satu upaya untuk mendapatkan bibit dalam jumlah besar tanpa memerlukan bahan tanaman yang banyak yaitu melalui perbanyakan secara in vitro. Perbanyakan tanaman secara in vitro dapat dilakukan melalui organogenesis secara langsung dan tidak langsung. Organogenesis secara langsung terjadi bila eksplan langsung dapat membentuk tanaman utuh tanpa melalui pembentukan kalus terlebih dahulu, sedangkan organogenesis secara tidak langsung terjadi bila eksplan membentuk kalus kemudian kalus membentuk tunas dan akar yang dapat disebut sebagai tanaman utuh atau planlet.
4
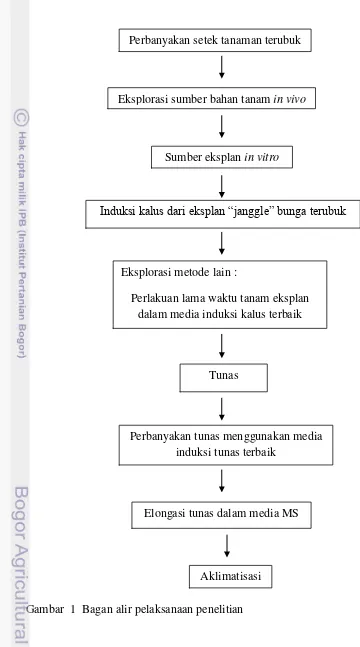
Gambar 1 Bagan alir pelaksanaan penelitian
Perbanyakan setek tanaman terubuk
Sumber eksplan in vitro
Induksi kalus dari eksplan “janggle” bunga terubuk
Tunas Eksplorasi metode lain :
Perlakuan lama waktu tanam eksplan dalam media induksi kalus terbaik Eksplorasi sumber bahan tanam in vivo
Perbanyakan tunas menggunakan media induksi tunas terbaik
Aklimatisasi
TINJAUAN PUSTAKA
Klasifikasi Tanaman Terubuk
Terubuk (Saccharum edule Hasskarl) termasuk dalam famili Gramineae (Poaceae). Dillon et al. (2007), Daniels & Roach (1987), James (2004) membagi genus Saccharum ke dalam enam spesies yaitu, S. spontaneum, S. robustum Brandes Jeswit ex Grassl, S. officinarum L., S. barberi Jeswit, S. sinense Roxb., dan S. edule Hasskarl. Irvine (1999) juga menyebutkan bahwa setiap spesies dikarakterisasi berdasarkan karakter bunga, kandungan gula, dan jumlah kromosom.
Irvine (1999) dan Nakayama (2005) menyatakan bahwa S. spontaneum, dan S. robustum Brandes Jeswit ex Grassl. merupakan spesies liar sedangkan S. officinarum, S. barberi Jeswit., S. sinense Roxb., dan S. edule Hasskarl. merupakan spesies budidaya. Diantara spesies budidaya, S. barberi Jeswit dan S. sinense Roxb. diyakini merupakan hibrid alami S. spontaneum dan S. officinarum yang merupakan spesies budidaya turunan dari S. robustum (Irvine 1999; Ming et al. 2002; Grivet et al. 2004).
Spesies budidaya S. edule memiliki pembungaan yang tidak normal yang tidak terjadi pada varietas komersial tebu lainnya walaupun terjadi banyak persilangan setiap tahunnya di negara-negara berbeda. Pembungaan yang mirip cauliflower pada S. edule disebabkan oleh adanya beberapa mutasi gen. Identifikasi gen yang bertanggung jawab terhadap fenotipe cauliflower pada S. edule memungkinkan untuk usaha memanipulasi gen pembungaan pada tebu varietas komersil dan fenotipe juga dapat terbawa. Ada 1 produk ekonomis baru dari tebu yang dapat meningkatkan keuntungan petani tebu. Seperti pada kasus “baby corn” yang telah menjadi salah satu jenis sayuran favorit, “cane flower” juga dapat menjadi sayuran favorit di daerah non-tradisional (Guimaeraes & Sobral 1997; D’Hont et al. 2002). James (2004) menyatakan bahwa dengan pembungaan yang tidak biasa, membengkak dan bunga aborsi, terubuk dimanfaatkan sebagai sumber makanan di Melanesia.
6
pengolahannya karena salah mengenali terubuk dengan menganggap tanaman ini sebagai kaso (S. spontaneum) yang secara morfologi memang sangat mirip. Secara tidak langsung pemanfaatan terubuk hanya sebatas sebagai pakan ternak saja. Bentuk tanaman terubuk sama dengan tebu, yaitu memiliki batang yang beruas-ruas dan berwarna hijau kemerahan, namun rasa batangnya tidak terlalu manis (Gambar 2).
Gambar 2 Morfologi tanaman terubuk : A. di lapangan; B. dalam polibag
Di daerah Jawa Barat, terubuk dikenal dengan nama tiwu endog atau terubus, sedangkan di Jawa Tengah dan Jawa Timur dikenal dengan nama tebu endog atau tebu terubuk. Bunga terubuk dipasarkan dengan cara dijual per ikat yang berisi 10-15 bunga (Gambar 3A). Sebutan endog atau telur pada nama tanaman ini disebabkan tekstur bunga yang dikonsumsi menyerupai telur ikan (Daulay 1984) (Gambar 3B). Nama asing terubuk adalah Fiji asparagus, duruka atau pit-pit (http://ecocrop.fao.org).
Seperti pada sayuran lainnya, terubuk kaya akan nutrisi dan zat-zat baik bagi tubuh. Terubuk banyak mengandung mineral utama terutama kalsium dan fosfor, disamping vitamin C. Dalam 100 g bunga terubuk segar terkandung
4,3 g, kalsium 25 mg, zat besi 2 mg, vitamin C 35 mg, dan air 92,4 % dengan total energi sebesar 120 kJ (French 2006).
kk
Gambar 3 Bunga terubuk: A. dalam 1 ikat berisi 10-15 bunga; B. dibuka kelobot
Budidaya terubuk masih terbatas dengan bahan tanaman setek batang. Hal ini disebabkan karena terubuk tidak dapat menghasilkan biji, bunga terubuk tidak dapat berkembang sempurna sampai membentuk biji. Perbanyakan dengan menggunakan setek batang memerlukan bahan tanam dalam jumlah banyak, waktu yang lama dan areal penanaman yang luas. Hasil yang didapat dari perbanyakan konvensional adalah antara 7-22 tunas per setek 2 buku tanaman terubuk berumur antara 7-22 minggu dengan jarak tanam 70 cm x 70 cm, jumlah bunga per rumpun yang berisi 14 tanaman antara 14-108 bunga terubuk (Kurniatusolihat 2009, Jannah 2011).
Teknik Kultur Jaringan
Kultur jaringan merupakan salah satu metode perbanyakan tanaman yang dilakukan untuk menjawab berbagai masalah yang terjadi dalam perbanyakan tanaman secara konvensional. Kultur in vitro adalah suatu teknik mengisolasi bagian tanaman seperti protoplas, sel, jaringan dan organ, yang kemudian
8
menumbuhkannya dalam media buatan dengan kondisi aseptik dan terkendali. Dasar teknik kultur jaringan adalah teori totipotensi sel yang menyatakan bahwa setiap sel merupakan suatu satuan otonom dan mempunyai kemampuan untuk beregenerasi menjadi tanaman lengkap kembali (Gunawan 1988). Metode kultur jaringan dapat menghasilkan bibit dalam jumlah besar tanpa memerlukan jumlah induk yang banyak, waktu yang relatif singkat dan bibit yang dihasilkan bebas patogen (Zulkarnain 2009). Kultur in vitro merupakan teknik menumbuh kembangkan bagian tanaman baik berupa sel, jaringan atau organ dalam kondisi aseptik. Meskipun pada prinsipnya semua sel dapat ditumbuhkan, sebaiknya dipilih bagian tanaman yang masih muda dan mudah tumbuh, seperti anakan atau mata tunas, buku, daun muda, tangkai daun, akar, antera, ovul, polen (George & Sherrington 1984; Hendaryono & Wijayani 1994; Yusnita 2004; Yuwono 2008).
Teknik ini pada awalnya digunakan dalam usaha perbanyakan tanaman secara cepat, namun saat ini telah berkembang menjadi sarana pendukung program perbaikan sifat tanaman (Farid 2003). Faktor penting dalam keberhasilan perbanyakan tanaman secara in vitro, yaitu bahan tanam awal, media dan lingkungan kultivasi yang sesuai. Eksplan (bahan tanam awal) adalah bagian tanaman (dapat berupa sel, jaringan atau organ). Bagian tanaman yang digunakan sebagai eksplan sebaiknya merupakan bagian yang mempunyai sel aktif membelah, berasal dari tanaman induk yang sehat dan berkualitas tinggi. Media yang digunakan harus mencukupi kebutuhan tanaman, seperti unsur hara makro dan mikro, zat besi, vitamin, mineral, karbon, asam organik dan zat pengatur tumbuh (ZPT).
jaringan yang membelah diri secara terus-menerus (Gunawan 1988). Kemampuan kalus untuk beregenerasi sangat ditentukan oleh media yang digunakan dan komposisi zat pengatur tumbuh dalam media.
Zat Pengatur Tumbuh
Kelompok zat-zat yang dalam jumlah kecil mempengaruhi pertumbuhan dan perkembangan organisme (tanaman), disebut sebagai zat pengatur tumbuh (ZPT). ZPT adalah zat-zat yang keaktifannya jauh berlipat ganda apabila dibandingkan dengan konsentrasinya. Keaktifan tersebut menyangkut proses fisiologi tanaman seperti pertumbuhan, diferensiasi, dan perkembangan tanaman serta proses-proses lain seperti pembukaan stomata, serapan hara, dan translokasi (Davies 2004).
Zat pengatur tumbuh sangat diperlukan sebagai komponen medium bagi pertumbuhan dan diferensiasi sel eksplan. Tanpa penambahan zat pengatur tumbuh dalam medium, pertumbuhan sangat terhambat, bahkan mungkin tidak tumbuh sama sekali. Setiap eksplan yang berasal dari organ dan spesies yang berbeda akan membutuhkan zat pengatur tumbuh yang berbeda pula. Selain itu dijelaskan pula oleh Gunawan (1988) bahwa zat pengatur tumbuh mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan atau organ secara in vitro. Arah perkembangan kultur ditentukan oleh interaksi dan perimbangan antara zat pengatur tumbuh yang diproduksi oleh sel tanaman secara endogen. Walaupun pada eksplan terdapat zat pengatur tumbuh endogen tetapi sering kali pada medium ditambahkan zat pengatur tumbuh eksogen untuk pertumbuhan dan perkembangan eksplan yang ditanam secara in vitro.
10
inisiasi akar adventif serta tanggap tropistik. Sitokinin berperan dalam meningkatkan pembelahan sel, proliferasi pucuk dan morfogenesis pucuk (Davies 2004). Gunawan (1988) menyatakan bahwa dua golongan zat pengatur tumbuh yang sangat penting dalam kultur jaringan tanaman adalah auksin dan sitokinin. George & Sherrington (1984), menyatakan bahwa inisiasi tunas dan akar diatur oleh interaksi auksin dan sitokinin yang diberikan dalam media.
Auksin dikenal sebagai hormon yang mampu berperan menginduksi terjadinya kalus, mendorong proses morfogenesis kalus membentuk tunas atau akar, mendorong proses embriogenesis, dan dapat mempengaruhi kestabilan genetik sel tanaman (Arteca 1996: Santoso & Nursandi 2001). Jenis auksin yang sering digunakan adalah 2,4-diclorophenoxy acetic acid (2,4-D), α-naphthalene acetic acid (NAA) dan indole butyric acid (IBA). IAA (indole acetic acid) merupakan satu satu jenis auksin alami yang terdapat dalam tumbuhan (Zulkarnain 2009). Menurut Hendaryono & Wijayani (1994) IAA dapat mengalami degradasi yang disebabkan adanya cahaya atau enzim oksidatif. Oleh karena sifatnya yang labil IAA jarang digunakan dan hanya merupakan hormon alami yang ada pada jaringan tanaman yang digunakan sebagai eksplan. NAA tidak mudah terurai oleh enzim yang dikeluarkan sel atau pemanasan pada proses sterilisasi. Pemakaian zat pengatur tumbuh 2,4–D biasanya digunakan dalam jumlah kecil dan dalam waktu yang singkat, antara 2-4 minggu karena merupakan auksin kuat, artinya auksin ini tidak dapat diuraikan di dalam tubuh tanaman (Hendaryono & Wijayani 1994). 2,4-D pada suatu konsentrasi tertentu sanggup membuat mutasi-mutasi karena mempunyai sifat fitotoksisitas yang tinggi sehingga dapat bersifat herbisida (Wattimena 1988; Suryowinoto 1996). Kisaran konsentrasi auksin yang biasa digunakan adalah 0,01-3,0 mg l-1 (Amien et al. 2007: Conde et al. 2008; Yuan et al. 2008).
bahwa secara alami sitokinin ditemukan dalam bentuk 4-hydroxi-3-methyl-trans-2-butenylaminopurine (zeatin) dan 2-isopentyl adenine (2-IP), sitokinin sintesis
yang sering ditambahkan dalam kultur jaringan adalah kinetin (6-furfurylaminopurine), thidiazuron dan 6-benzylaminopurine (BAP).
Penggunaan auksin dalam kultur jaringan pada umumnya dilakukan melalui kombinasi dengan sitokinin. Nisbah sitokinin dan auksin akan menentukan apakah suatu eksplan akan membentuk tunas adventif, akar, atau tunas adventif dan akar (Yusnita 2004; George & Sherrington 1984). Perimbangan konsentrasi yang lebih efisien dari auksin dan sitokinin tidak dapat ditentukan dengan pasti, karena sumber ZPT yang sama pada tanaman yang berbeda dapat memberikan efek yang berbeda. Konsentrasi yang tepat dari ZPT perlu diperhatikan, karena akan mempengaruhi kecepatan inisiasi, sehingga dibutuhkan studi untuk mengetahui konsentrasi yang paling efisien dari ZPT ini bagi pertumbuhan dan perkembangan tanaman.
Gunawan (1988) melaporkan bahwa pada perbanyakan tebu secara in vitro, zat pengatur tumbuh yang ditambahkan pada media diferensiasi untuk organogenesis kalus adalah auksin 1 mg l-1 dan sitokinin 1 mg l-1. Peningkatan konsentrasi sitokinin akan mendorong pembentukan tunas yang kemudian akan tumbuh menjadi planlet dalam kondisi yang sesuai. Pada konsentrasi auksin dan sitokinin yang sama cenderung terjadi pertumbuhan yang tidak terdiferensiasi. Namun pada genotipe tanaman yang berbeda akan memperlihatkan arah morfogenesis yang berbeda sehingga tidak ada suatu perbandingan antara auksin dan sitokinin yang bersifat universal yang dapat digunakan sebagai dasar dalam menginduksi tunas dan akar.
Tabel 1 Kombinasi zat pengatur tumbuh pada kultur jaringan tebu
Sumber Penelitian Induksi kalus Induksi tunas Induksi akar
Karim et al. 2002 MS+ 2,4-D 3 mg l-1 + CW 10% MS + BAP 1 mg l-1 + IBA 0,5 mg l-1 ½ MS + 3 mg l-1
Karim et al. 2002 MS+ 2,4-D 3 mg l-1 + CW 10% MS + BAP 1 mg l-1 + IBA 0,5 mg l-1 MS + NAA 5 mg l-1
Khalil 2002 MS+ 2,4-D 3 mg l-1 + CH 5 mg l-1 +
CW 10%
Baksha et al. 2002 MS + BAP 2 mg l-1 + Kn 0,5 mg l-1 ½ MS + NAA 5 mg l-1
Farid 2003 MS + BAP 0,5 mg l-1 + IBA 1,5 mg l-1 MS + BAP 1 mg l-1 + IBA 1 mg l-1
Cheema et al. 2004 MS + BAP 0,4 mg l-1 + Kn 0,4 mg l-1 ½ MS
Ananda 2004 MS + 2,4-D 3 mg l-1 + Kn 0,1 mg l-1 Ms + NAA 2 mg l-1 + Kn 1,3 mg l-1
Ali et al. 2008 MS + 2,4-D 3mg l-1 MS + BAP 1 mg l-1 MS+ NAA 2 mg l-1
Nurhasanah 2007 MS + 2,4-D 3 mg l-1 + Kn 0,1 mg l-1 MS + BAP 1 mg l-1 + NAA 1 mg l-1
Roy et al. 2007 MS + BAP 1,5 mg l-1 + NAA 0,5 mg l-1 MS+ NAA 2,5 mg l-1
Khan & Abdullah 2008 MS + BAP 0,5 mg l-1 + GA3 0,1 mg l
-1
MS+ IBA 1 mg l-1
Susiyanti 2008 MS + 2,4-D 3 mg l-1 + Kn 0,1 mg l-1 MS + BAP 0,5 mg l-1 + Kn 0,1 mg l-1 MS+ IBA 2 mg l-1
Behera & Santilata 2009
MS+ 2,4-D 2,5 mg l-1 MS + BAP 2 mg l-1 + NAA 0,5 mg l-1 ½ MS+NAA 3 mg l
-1
Keterangan: CW= coconut water (air kelapa); Kn= Kinetin
Prahardini & Sudaryono (1992) menyebutkan bahwa penambahan 3,0 mg l-1 NAA dan 2,0 mg l-1 BA efektif untuk induksi kalus pepaya dan jumlah tunas per kalus meningkat dengan peningkatan NAA dari 1,0-3,0 mg l-1. Hasil penelitian Wulandari et al (2006) pada tanaman jeruk manis menunjukkan bahwa kombinasi NAA 0,1-1,0 mg l-1 dan BA 0,1-1,0 mg l-1 dapat menginduksi kalus dan akar, tetapi tidak untuk tunas. Penelitian Maryani & Zamroni (2005) pada krisan menunjukkan bahwa perimbangan BAP dan IAA sebanyak 1,0 mg l-1 dapat meningkatkan multiplikasi tunas secara in vitro.
14
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Oktober 2009 sampai dengan bulan Juni 2011 di Laboratorium Kultur Jaringan Kelompok Peneliti Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian Bogor (BB-Biogen Bogor) dan Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan tanam (eksplan) yang digunakan dalam penelitian ini adalah “janggle” bunga terubuk, buku batang setek tanaman terubuk, daun muda yang masih menggulung, dan akar. Tanaman terubuk diambil dari Kampung Banyuwangi, Cigudeg, Bogor, yang telah diperbanyak dengan menggunakan setek di dalam polybag selama 4 bulan, sedangkan bunga terubuk didapat dari beberapa pasar tradisional di sekitar Bogor.
Media yang digunakan untuk perlakuan dalam penelitian ini adalah media dasar Murashige dan Skoog (MS). Bahan-bahan kimia yang digunakan adalah aquades, komponen dari media dasar MS, 30 g l-1 sukrosa, dan bahan pemadat berupa 2 g l-1 phytagel. Zat pengatur tumbuh (ZPT) yang digunakan ke dalam media sebagai perlakuan berupa 2,4-D, Kinetin, Thidiazuron, NAA, BAP dan GA3. Bahan untuk sterilisasi eksplan adalah Agrept, Dithane-45, Alkohol, Bayclin dan Betadin.
Peralatan yang digunakan adalah Laminar Air Flow Cabinet (LAFC), autoklaf, mikropipet, alat-alat diseksi (pinset, gunting, dan skalpel), pH meter, botol kultur, peralatan gelas, bunsen dan sprayer.
Metode Penelitian
Penelitian ini terdiri atas lima tahapan, yaitu:
1. Eksplorasi eksplan terubuk dan sterilisasi ekplan 2. Induksi kalus
4. Elongasi dan induksi akar 5. Aklimatisasi
Persiapan Bahan Tanam
Dilakukan persiapan bahan tanam sebagai sumber eksplan yaitu penanaman setek tanaman terubuk di dalam polibag (Gambar 4) yang dilaksanakan pada bulan Oktober 2009. Sekitar 3 ruas batang digunakan sebagai sumber eksplan in vivo. Tunas yang tumbuh dari ruas batang kemudian disterilisasi dan ditumbuhkan secara in vitro pada media prekondisi untuk mendapatkan sumber eksplan in vitro.
Gambar 4 Setek tanaman terubuk dalam polibag
Sterilisasi Eksplan
16
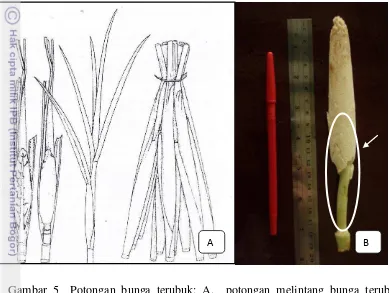
Tahapan sterilisasi pada bunga terubuk di dalam laminar adalah dengan menyemprotkan alkohol 96% ke seluruh bagian bunga. Bunga kemudian dibakar di atas bunsen beberapa kali. Penanaman dilakukan dengan membuka atau mengupas kelobot bunga sampai habis (Gambar 5A). Bagian “janggle” bunga terubuk (Gambar 5B) dipotong menjadi beberapa bagian berukuran ± 1 cm.
Gambar 5 Potongan bunga terubuk: A. potongan melintang bunga terubuk; B. bagian “janggle” bunga
Tahapan sterilisasi pada tunas di dalam laminar adalah dengan merendam eksplan dalam Bayclin 30% selama 15 menit, membilas ke dalam aquades steril sebanyak 3 kali, dilanjutkan dengan merendam eksplan ke dalam Bayclin 10% selama 30 menit, kemudian membilas ke dalam aquades steril sebanyak 3 kali, dan terakhir dengan merendam ke dalam larutan Betadine selama 30 menit (Gambar 6A). Penanaman dilakukan dengan membuka atau mengupas beberapa lapis tunas (Gambar 6B). Tunas terubuk dipotong menjadi beberapa bagian berukuran ± 1 cm.
Gambar 6 Tunas terubuk: A. tahap sterilisasi; B. dalam botol kultur
Tahapan sterilisasi pada daun yang masih menggulung dalam tunas di dalam laminar adalah dengan merendam eksplan dalam Bayclin 30% selama 10 menit, membilas ke dalam aquades steril sebanyak 3 kali, dilanjutkan dengan merendam eksplan ke dalam Bayclin 20% selama 5 menit, kemudian membilas ke dalam aquades steril sebanyak 3 kali. Daun terubuk dipotong menjadi beberapa bagian berukuran ± 1 cm.
Tahapan sterilisasi pada akar terubuk di dalam laminar adalah dengan merendam eksplan dalam alkohol 96% selama 3 menit, membilas ke dalam aquades steril sebanyak 3 kali, dilanjutkan dengan merendam eksplan ke dalam alkohol 70% selama 3 menit, kemudian membilas ke dalam aquades steril sebanyak 3 kali, dan terakhir dengan merendam ke dalam larutan Betadin selama 5 menit.
Masing-masing media terdiri atas 4 botol, 1 botol berisi 2 eksplan. Kultur diinkubasi pada suhu 22±3 0C dalam ruang gelap untuk induksi kalus dan dalam kondisi terang untuk induksi tunas dan akar.
18
Pembuatan Media Tanam In Vitro
Media tanam in vitro yang digunakan dalam penelitian ini terdiri atas dua jenis berdasarkan tujuan pengunaannya, yaitu media prekondisi dan media perlakuan. Media prekondisi digunakan untuk mengetahui tingkat kesterilan bahan tanam sebelum dijadikan eksplan in vitro. Hyponex digunakan sebagai media prekondisi karena mengandung beberapa unsur hara yang dapat mendukung pertumbuhan eksplan pada awal pertumbuhan. Media perlakuan yang digunakan adalah media dasar MS yang ditambah dengan beberapa macam ZPT sesuai dengan tahapan penelitian.
Media Hyponex 0.2% dibuat dengan menimbang Hyponex sebanyak 2 g yang ditambah dengan vitamin dan myo-inositol dengan konsentrasi yang sama seperti dalam media MS, kemudian dilarutkan dalam 1 l aquades. Media MS dibuat dengan mengambil setiap komponen media MS (Lampiran 1) dari larutan stok yang telah dibuat sebelumnya. Semua media yang digunakan ditambahkan dengan 30 g l-1 sukrosa, dan 2 g l-1 phytagel, dengan pH 5.8. Media yang telah dibuat kemudian dimasukkan ke dalam botol kultur steril yang kemudian disterilisasi menggunakan autoklaf pada suhu 121 oC dan tekanan 17,5-20 psi selama 10 menit.
Induksi Kalus
Prosedur Pelaksanaan
7. MS + 5 mg l-1 2,4-D + 0,1 mg l-1 kinetin
Eksplan yang digunakan adalah “janggle” terubuk yang telah dipotong menjadi beberapa bagian (ukuran eksplan ± 1 cm). Setiap perlakuan diulang sebanyak 4 kali, dalam setiap satuan percobaan terdiri atas 1 botol kultur yang berisi 2 eksplan, sehingga terdapat 28 satuan percobaan. Eksplan dengan konsentrasi ZPT yang terbaik untuk induksi kalus, disubkultur terus setiap 4 minggu pada medium yang sama selama 12 minggu. Kultur dipelihara dalam ruang kultur gelap dengan suhu 25⁰C.
Rancangan
Model linear aditif yang digunakan dalam percobaan ini adalah sebagai berikut (Mattjik & Sumertajaya 2006) :
Yij = µ + αi + εi
Dimana: i = 1, 2, ...,7 dan j = 1, 2, 3
Yijk : Pengamatan pada konsentrasi ZPT ke-i µ : Rataan umum
αi : Pengaruh konsentrasi ZPT ke-i
εij : Pengaruh galat percobaan perlakuan ZPT ke-i.
Pengamatan
Pengamatan dilakukan terhadap peubah waktu muncul kalus (minggu setelah tanam atau MST) yang dilakukan setiap minggu, persentase jumlah eksplan yang membentuk kalus (%) dan bobot basah kalus (g) yang diamati pada akhir pengamatan.
Analisis Data
20
Induksi Tunas
Prosedur Pelaksanaan
Percobaan ini menggunakan media induksi kalus terbaik pada percobaan pertama (3 mg l-1 2,4-D + 0,1 mg l-1 kinetin). Dilanjutkan subkultur ke media induksi tunas (yang telah ditambahkan 0,1 mg l-1 NAA dan 0,25 mg l-1 GA3), sebagai berikut:
1. MS + 1 mg l-1 BAP 2. MS + 3 mg l-1 BAP 3. MS + 5 mg l-1 BAP 4. MS + 0,5 mg l-1 kinetin 5. MS + 1 mg l-1 kinetin 6. MS + 1,5 mg l-1 kinetin 7. MS + 0,25 mg l-1 Thidiazuron 8. MS + 0,5 mg l-1 Thidiazuron 9. MS + 1 mg l-1 Thidiazuron
Eksplan yang digunakan adalah “janggle” terubuk yang telah dipotong menjadi beberapa bagian (ukuran eksplan ± 1 cm). Setiap perlakuan diulang sebanyak 4 kali sehingga terdapat 36 satuan percobaan. Kultur dipelihara dalam ruang kultur dengan fotoperiodisitas 24 jam terang, suhu 25⁰C dan intensitas cahaya 1500 lux. Tunas yang berasal dari media induksi tunas aksilar terbaik ditumbuhkan pada media yang sama untuk multiplikasinya selama 8 minggu.
Pengamatan
Elongasi Tunas dan Induksi Akar
Tunas yang berukuran besar (1-3 cm) disubkultur ke media MS (kontrol) untuk pemanjangan tunas dan pembentukan akar. Kultur dipelihara dalam ruang kultur dengan fotoperiodisitas 24 jam terang, suhu 25⁰C dan intensitas cahaya 1500 lux. Tunas ditumbuhkan pada media yang sama selama 12 minggu.
Aklimatisasi
22
HASIL DAN PEMBAHASAN
Eksplorasi Eksplan Terubuk
Bahan tanam awal (eksplan) merupakan salah satu faktor penting dalam keberhasilan perbanyakan tanaman secara in vitro. Eksplan yang baik untuk digunakan adalah bagian tanaman yang memiliki sel yang aktif membelah, sebagai contoh bagian tanaman yang masih muda. Daun muda, ujung akar, ujung batang, keping biji atau tunas dapat digunakan sebagai bahan tanam in vitro.
Upaya perbanyakan tebu secara in vitro telah banyak dilakukan melalui eksplorasi bahan tanam (eksplan) dan media tanam yang sesuai. Hal yang sama juga dilakukan pada in vitro terubuk. Eksplorasi sumber eskplan in vitro terubuk mengacu pada kultur in vitro tebu. Eksplan yang digunakan antara lain “janggle” bunga terubuk, tunas dari setek tanaman terubuk, daun muda yang masih menggulung dalam tunas, daun tua dan akar.
Penggunaan eksplan tunas dari setek tanaman terubuk dan daun muda yang masih menggulung dalam tunas mempunyai tingkat kontaminasi yang tinggi. Kontaminasi bakteri terjadi setelah beberapa minggu eksplan ditanam dalam media prekondisi. Telah dilakukan tindakan pencegahan kontaminasi, dengan modifikasi proses sterilisasi yang lebih kompleks. Akan tetapi, kontaminasi tetap terjadi. Eksplorasi sumber eksplan in vitro tanaman terubuk diperluas. Penggunaan daun tua, akar, dan bunga terubuk digunakan sebagai sumber eksplan. Kontaminasi terjadi pada eksplan daun tua dan akar.
Tabel 2 Eksplorasi bahan tanam kultur in vitro terubuk
Bagian tanaman % keberhasilan
sterilisasi
Keterangan: % dihitung dari jumlah total bahan tanam yang digunakan dibandingkan dengan jumlah total bahan tanam yang berhasil disterilkan, mampu untuk membentuk kalus dan tunas
Tabel 2 menunjukkan bahwa bagian bunga tanaman terubuk ternyata mampu menghasilkan kalus dan tunas dengan tingkat kontaminasi terkecil (10 %). Bagian bunga terubuk yang dijadikan eskplan adalah “janggle” bunga yang berukuran 3-5 cm dari pangkal bunga. Eksplan bunga terubuk memiliki tingkat keberhasilan sterilisasi (90 %) dan tingkat kontaminasi terendah disebabkan karena bunga terubuk memiliki lapisan-lapisan atau kelobot yang melindungi “janggle” dari kontaminan luar.
Proses sterilisasi yang beragam telah dilakukan guna mendapatkan bahan tanam yang steril. Penggunaan sterilan alkohol 96 % dengan menyemprotkan ke bunga terubuk dan membakarnya merupakan cara yang tepat untuk mendapatkan bahan tanam yang steril.
Induksi Kalus
24 yang sama menunjukkan tidak berbeda nyata pada DMRT dengan α=5%.
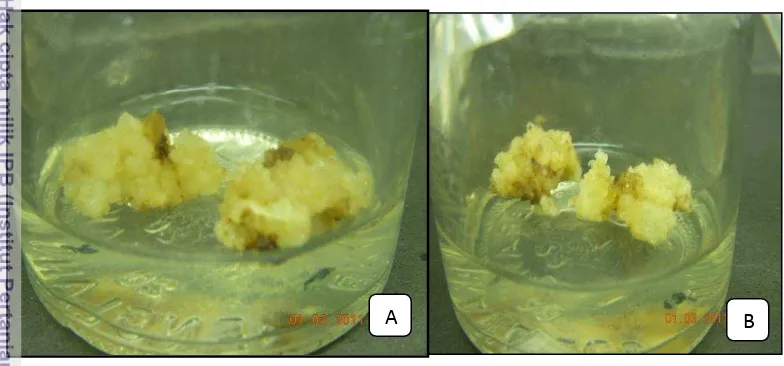
Tabel 4 menunjukkan konsistensi hasil yang sama dengan Tabel 3. Pada perlakuan media MS dengan penambahan ZPT 3 mg l-1 2,4-D + 0,1 mg l-1 kinetin mampu menginduksi persentase terbentuknya kalus tertinggi (92,86%). Media yang sama juga memberikan waktu terbentuknya kalus tercepat (2 MST) dan bobot kalus tertinggi (1,50 g). Kalus yang terbentuk berwarna putih kekuningan dan bertekstur remah (Gambar 7B).
Gambar 7 Penampakan kalus dalam media MS + 3 mg l-1 2,4-D + 0,1 mg l-1 : A. set pertama; B. set kedua
Beberapa penelitian melaporkan bahwa ZPT yang efektif digunakan untuk menginduksi kalus tanaman tebu adalah auksin (2,4-D) (Ananda 2004; Nurhasanah 2007; Behera & Sahoo 2009). Induksi kalus pada tanaman tebu dengan menggunakan media MS ditambah ZPT 3 mg l-1 2,4-D + 0,1 mg l-1 kinetin mampu menghasilkan bobot kalus dan persentase terbentuknya kalus tertinggi. Hasil penelitian Susiyanti (2008) menunjukkan bahwa media MS yang ditambah ZPT 3 mg l-1 2,4-D + 0,1 mg l-1 kinetin mampu menghasilkan diameter kalus yang terbentuk dan persentase eksplan membentuk kalus tertinggi yaitu 100 % pada 6 MST. Hal yang sama terjadi pada tanaman terubuk yang menggunakan media MS dengan penambahan ZPT 3 mg l-1 2,4-D + 0,1 mg l-1 kinetin mampu menghasilkan bobot kalus tertinggi.
Kalus yang dihasilkan pada tahap induksi kalus ini kemudian diberi perlakuan induksi tunas dengan menggunakan media MS dengan penambahan ZPT 1; 3; 5; 10 mg l-1 kinetin. Setelah beberapa waktu, hanya terdapat 1 botol
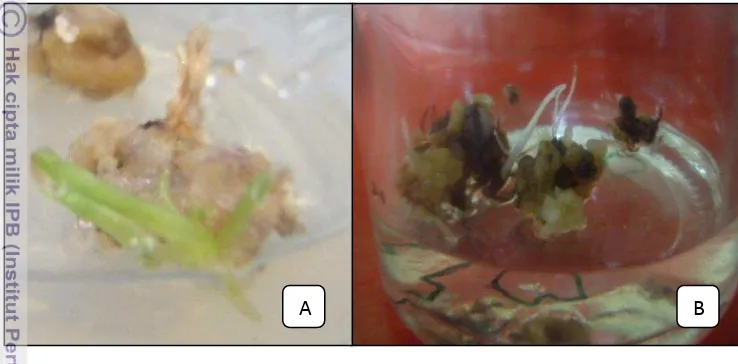
26
perlakuan kalus yang mampu membentuk tunas (Gambar 8A), akan tetapi setelah disubkultur, tunas tersebut mati. Kalus lainnya tidak dapat membentuk tunas, karena pada saat disubkultur ke media induksi tunas, kalus membentuk akar (Gambar 8B). Hal ini terjadi pada kedua tahapan di atas, sehingga diperlukan adanya modifikasi perlakuan induksi tunas terubuk.
Gambar 7 Perlakuan induksi tunas dari kalus terubuk; A. kalus membentuk tunas; B. kalus membentuk akar
Induksi Tunas
Perlakuan dilanjutkan dengan menginduksi tunas menggunakan media induksi tunas. Induksi tunas melalui kalus (organogenesis secara tidak langsung) ternyata tidak mampu menghasilkan tunas yang diharapkan, kalus langsung membentuk akar. Setelah dilakukan beberapa kali pengulangan, hanya akar yang terbentuk pada induksi tunas melalui kalus terubuk. Modifikasi perlakuan induksi tunas terubuk antara lain perlakuan lama waktu tanam dalam media kalus terbaik dan subkultur ke dalam media induksi tunas. Eksplan yang digunakan adalah “janggle” bunga terubuk yang baru, bukan kalus yang terbentuk dari percobaan 1.
Eksplan ditanam pada media MS + 3 mg l-1 2,4-D + 0,1 mg l-1 kinetin selama 0 minggu (kontrol), 1, 2, 3, dan 4 minggu. Pada perlakuan kontrol, eksplan langsung ditanam ke media induksi tunas (organogenesis secara langsung) atau tanpa melalui media induksi kalus, sedangkan pada perlakuan lama waktu dalam media kalus 1, 2, 3, dan 4 minggu, eksplan membentuk kalus.
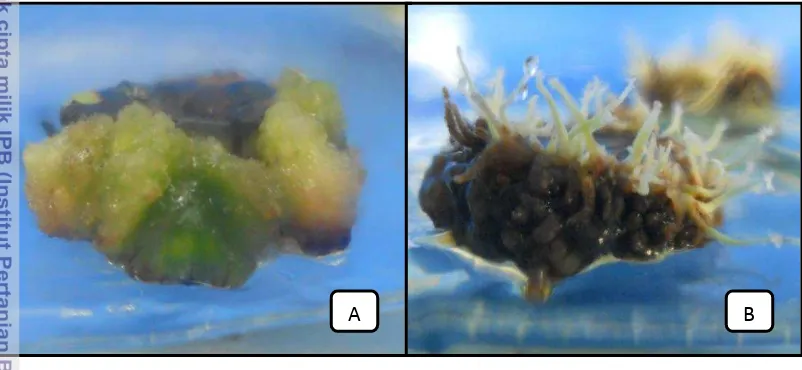
Perlakuan kedua yaitu perlakuan media induksi tunas, mampu menghasilkan tunas dari eksplan yang langsung ditanam dalam media induksi tunas. Eksplan yang telah membentuk kalus hasil perlakuan lama waktu tanam dalam media kalus 1, 2, 3, dan 4 minggu kemudian disubkultur ke media induksi tunas. Eksplan berkalus (Gambar 9A) dalam media induksi tunas (± 2 MST) ternyata tidak mampu membentuk tunas, yang terbentuk adalah akar pada keempat perlakuan (Gambar 9B).
Gambar 9 Eksplan dalam perlakuan induksi tunas: A. eksplan berkalus pada perlakuan 3 MST dalam media kalus; B. kalus membentuk akar dalam media induksi tunas setelah 2 minggu kultur
Eksplan terubuk yang ditanam dalam media kalus terlebih dahulu (1, 2, 3, dan 4 minggu) membentuk kalus, setelah disubkultur ke media induksi tunas ternyata tidak mampu membentuk tunas dan yang terbentuk adalah akar (Tabel 5). Hal ini berbeda dengan perlakuan in vitro tebu yang mampu menghasilkan tunas dari kalus. Percobaan ini menunjukkan bahwa kemungkinan di dalam eksplan bunga terubuk, sudah banyak mengandung hormon auksin endogen, walaupun kalus diinduksi tunas, kalus tetap membentuk akar (Amien et al. 2007).
28
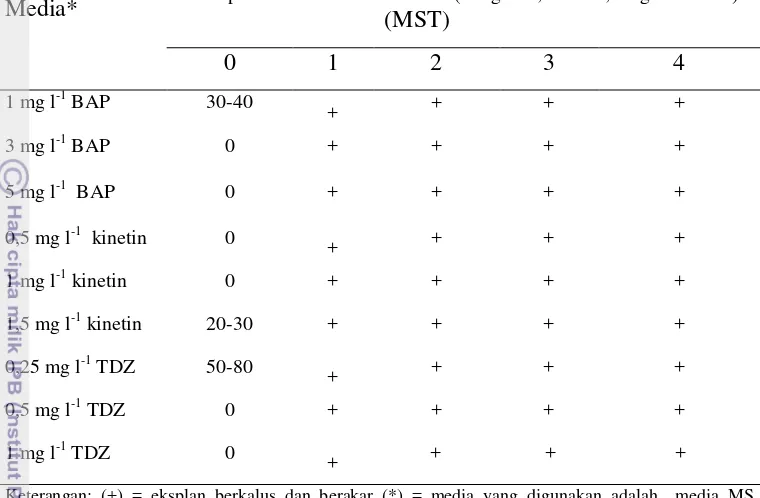
Tabel 5 Jumlah tunas yang terbentuk pada media induksi tunas Media* Lama perlakuan dalam media kal (3 mg l
-1
2,4-D + 0,1 mg l-1 kinetin)
(MST)
0 1 2 3 4
1 mg l-1 BAP 30-40
+ + + +
3 mg l-1 BAP 0 + + + +
5 mg l-1 BAP 0 + + + +
0,5 mg l-1 kinetin 0 + + + +
1 mg l-1 kinetin 0 + + + +
1,5 mg l-1 kinetin 20-30 + + + +
0,25 mg l-1 TDZ 50-80 + + + +
0,5 mg l-1 TDZ 0 + + + +
1 mg l-1 TDZ 0
+ + + +
Keterangan: (+) = eksplan berkalus dan berakar (*) = media yang digunakan adalah media MS telah
ditambahkan 0,1 mg l-1 NAA dan 0,25 mg l-1 GA
3
Eksplan “janggle” terubuk yang langsung ditanam ke dalam media induksi tunas (perlakuan kontrol 0 minggu dalam media kalus) ternyata mampu membentuk tunas dalam waktu yang bersamaan (2 MST). Jumlah tunas terbanyak didapat pada perlakuan media MS + 0,25 mg l-1 TDZ (50-80 tunas) (Gambar 10).
Hal ini disebabkan karena TDZ mempunyai aktivitas sitokinin yang kuat, dimana dalam konsentrasi rendah mampu menginduksi tunas dan merangsang pembelahan sel (Shan et al. 2000; Sugito et al. 2006). Hal yang sama juga dijelaskan oleh Karam & Al-Majathoub 2000, 75 % eksplan bagian bunga mampu untuk membentuk tunas dengan penambahan 0,22 mg l-1 TDZ. Interaksi TDZ dengan ZPT auksin NAA serta dengan penambahan GA3 mampu menghasilkan induksi tunas tertinggi, dimana fungsi GA3 antara lain untuk pertumbuhan batang dan pemanjangan sel.
Hasil penelitian tentang kultur jaringan tebu telah banyak dilaporkan. Penelitian Ananda (2004), Nurhasanah (2007), Khan & Abdullah (2008) menunjukkan bahwa media MS dengan penambahan ZPT yang berupa auksin (0,1-2 mg l-1 NAA), sitokinin (0,5-2 mg l-1 BAP dan 0,1-1 mg l-1 kinetin), dan GA3 (0,2-0,5 mg l-1) mampu menghasilkan jumlah tunas serta jumlah daun tertinggi sekitar 10-15 tunas dengan jumlah 7-11 daun pada umur 3-4 MST. Hasil penelitian lain menunjukkan bahwa 75% spesies tanaman membentuk tunas jika menggunakan kinetin atau BAP dengan konsentrasi antara 0,1-4,5 mg l-1 (Hendaryono & Wijayani 1994). Penggunaan eksplan tunas kotiledon tanaman kacang mampu menghasilkan 12 tunas per eksplan dengan penambahan 0,5 mg l-1 thidiazuron dalam media selama 14 hari kultur (Das et al. 1998).
Menurut Sari (2005) BAP dengan kisaran konsentrasi antara 0,5-2,0 mg l-1 berperan dalam penggandaan jumlah tunas daripada pertambahan
jumlah daun. Perlakuan yang sama juga dilakukan pada terubuk, menunjukkan bahwa penambahan 1 mg l-1 BAP dalam media mampu menginduksi tunas sebanyak 30-40 tunas (Gambar 11A).
Jumlah tunas yang didapat dari hasil penelitian Hiregoudar et al. 2003 adalah 20-32 tunas selama 5 bulan kultur dari eksplan buku (1 cm) dan potongan daun (5 x 5 mm) dengan penambahan 0,23 mg l-1. Penggunaan eksplan tunas dari rhizom Alpinia galanga dengan penambahan 3 mg l-1 kinetin pada media MS mampu untuk menginduksi tunas dengan tingkat keberhasilan 80 % (Borthakur et al. 1999). Hal yang sama juga dilakukan pada in vitro terubuk, penambahan 1,5
30
Gambar 11 Tunas yang terbentuk pada perlakuan: A. MS + 0,1 mg l-1 BAP ; B. MS + 1,5 mg l-1 kinetin
Elongasi dan Induksi Akar
Tunas terubuk (Gambar 12A) yang terbentuk dikelompokkan menjadi dua ukuran yaitu ukuran besar (1-3 cm) (Gambar 12B) dan ukuran kecil (0,5-1 cm) (Gambar 12C). Tunas yang berukuran kecil paling banyak terbentuk, namun tidak dapat bertahan hidup. Tunas tersebut akan berwarna kecoklatan dan mati pada umur 1 bulan atau setelah subkultur kedua.
Gambar 12 Ukuran tunas terubuk: A. tunas utuh; B. tunas berukuran 1-3 cm; C. tunas berukuran 0,5-1 cm
A B
A B
Tunas yang berukuran besar saja yang mampu bertahan hidup sampai menjadi planlet (tunas yang telah berakar) (Tabel 6). Tunas yang berukuran besar kemudian disubkultur ke media MS (kontrol) sebagai media pemanjangan tunas dan induksi perakaran sehingga akan terbentuk planlet, seperti disebutkan pada penelitian Sari (2005) agar tunas dapat tumbuh besar dan mampu membentuk planlet, perlu disubkultur ke media tanpa ZPT.
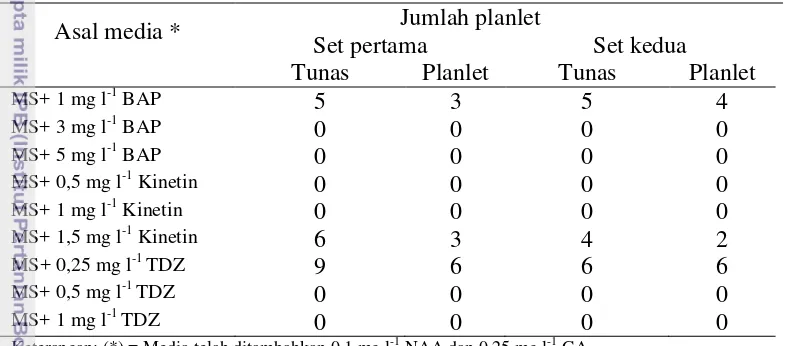
Tabel 6 Rataan jumlah planlet yang terbentuk pada media MS (kontrol) Asal media * Jumlah planlet
Tabel 7 Rekapitulasi jumlah planlet yang terbentuk pada media MS (kontrol) Media asal tunas* ∑ tunas
32
tunas MS + 0,25 mg l-1 TDZ, dengan persentase menghasilkan planlet tertinggi yaitu 80 %.
Gambar 13 Planlet terubuk dalam botol kultur
Aklimatisasi
Planlet yang terbentuk setelah 4 minggu dalam media MS kontrol, akar baru mulai terbentuk. Planlet dipindahkan dari media agar ke media aklimatisasi untuk mengetahui respon planlet setelah dipindahkan ke media tanah.
Gambar 14 Planlet terubuk: A. sebelum diaklimatisasi; B. setelah diaklimatisasi; C. planlet mati setelah berumur 2 minggu
C
Menurut Khan et.al (2008) planlet tebu yang dapat diaklimatisasi berukuran 8-10 cm. Planlet terubuk yang telah mencapai ukuran 8-10 cm (Gambar 14A) dapat dipindahkan ke media aklimatiasi (Gambar 14B). Respon planlet setelah setelah berumur 2 minggu dalam media tanah menunjukkan gejala kematian. Daun mulai menguning, pucat dan akhirnya mati (Gambar 14C). Hal ini dapat disebabkan karena kondisi planlet yang belum optimal untuk diaklimatisasi. Faktor asal media planlet tidak mempengaruhi tingkat keberhasilan hidup planlet dalam media aklimatisasi.
34
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, diperoleh beberapa kesimpulan sebagai berikut:
1. Bagian tanaman terubuk yang dapat digunakan sebagai bahan tanam adalah “janggle” bunga yang merupakan pangkal atau poros bunga dalam kelobot
2. Induksi kalus in vitro terubuk yang terbaik adalah menggunakan MS + 3 mg l-1 2,4-D + 0,1 mg l-1 kinetin. Kalus yang dihasilkan belum optimal untuk diregenerasikan membentuk tunas.
3. Induksi tunas in vitro terubuk yang terbaik adalah menggunakan metode organogenesis secara langsung, dengan perlakuan media MS + 0.25 mg l-1 TDZ + 0,1 mg l-1 NAA + 0,25 mg l-1 GA3.
4. Ukuran tunas yang viabel menjadi planlet adalah 1-3 cm. Tingkat keberhasilan membentuk planlet (tunas berakar) pada media MS tanpa ZPT adalah 50-80%.
5. Tingkat respon aklimatisasi planlet terubuk masih rendah dan belum dilakukan secara optimal, disebabkan karena jumlah planlet yang tidak mencukupi.
Saran
DAFTAR PUSTAKA
Ali A, Naz S, Siddiqui FA, Iqbal J. 2008. Rapid clonal multiplication of sugarcane (Saccharum officinarum) through callogenesis and organogenesis. Pak. J. Bot 40(1):123-138.
Amien S, Ariyati M, Arief M, Kurniawan D. 2007. Induksi kalus dari daun Nilam kultivar Lhokseumawe, Sidikalang dan Tapaktuan dengan 2,4-D. Zuriat 18(2):179-192.
Ananda WU. 2004. Studi transformasi pada tebu dengan perantara Agrobacterium tumefaceiens GV 2260 (pMA) serta regenerasi kalus transgenik [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Anonim. 2007. Saccharum edule. http://ecocrop.fao.org.
Arteca RN. 1996. Plant Growth Substance Principles and Applications. New York: Chapman & Hall.
[AVRDC] Asian Vegetable Research dan Development Center. 1999. Memorandum of Understanding on the Technical Assistance for the Collection, Conservation, dan Utilization of Indigenous Vegetables. Taiwan: AVRDC.
Baihaki A. 2003. Aspek sosial ekonomi dalam pemanfaatan dan pelestarian keanekaragaman hayati Jawa Barat. J.Ekologi & Biodiversitas Tropika 2(2):54-60.
Baksha R, Alam R, Karim MZ, Mannan SA, Podder BP, Rahman M. 2002. In vitro shoot tip culture of sugarcane (Saccharum officinarum) variety Isd 28. Biotechnology 1(2):67-72.
Behera KK, Santilata S. 2009. Rapid in vitro micro propagation of sugarcane (Saccharum officinarum L. cv-Nayana) through callus culture. Nature and Science 7(4):1545-0740.
Borthakur M, Hazarika J, Singh RS. 1999. A protocol for micropropagation of Alpinia galanga. Plant Cell Tissue Organ Culture 55:231-233.
Cheema KL, Hussain M. 2004. Micropropagation of sugarcane through apical bud and axillary bud. International J. of Agriculture and Biology 6(2):257-259. Chengalrayan K, Abouzid A and Gallo-Meagher M. 2005. In vitro regeneration of plant from sugarcane seed-derived callus. In Vitro Cell. Dev. Biol. Plant 41:477–482.
36
Daniels J and Roach BT. 1987. Taxonomy and Evolution In: Sugarcane Improvement Through Breeding (eds. DJ Heinz). Amsterdam: Elsevier. Das DK, Prakash NS, Bhalla-Sarin N. 1998. An efficient regeneration system of
black gram (Vigna mungo L.) through organogenesis. Plant Science 134: 199-206.
Daulay D 1984. Mempelajari Peningkatan Daya Simpan dan Pemanfaatan Tebu Terubuk. Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Bogor.
Davies PJ. 2004. Plant Hormones, Biosynthesis, Signal Transduction, Action!. London: Kluwer Academic Publishers.
Dillon SL, Frances MS, Robert JH, Cordeiro G, Quierdo L, Lee LS. 2007. Review domestication to crop improvement: genetic resources for Sorghum and Saccharum (Andropogoneae). Annals of Botany 100:975-989.
D’Hont A, Paulet F, Glaszmann JC. 2002. Oliclonal interspesific origin of “North Indian” and “Chinese” sugarcanes. Chromosome Res. :253-262.
Falco MC, Beatriz M, Januzzi M, Agusto TN, Beatriz da Gloria. 1996. Histological characterization of in vitro regeneration of Saccharum sp. R.Bras. Fisiol. Veg. 8(2):93-97.
Farid MB. 2003. Perbanyakan tebu (Saccharum officinarum L.) secara in vitro pada berbagai konsentrasi IBA dan BAP. J. Sains & Teknologi 3(3):103-109.
French BR. 2006. Growing Food in the Southern Highlands Province of Papua New Guinea. AFTSEMU (Agricultural Field Trials, Surveys, Evaluation and Monitoring Unit): Australia.
Gandonou CT, Errabii T, Abrinii J, Idaomari M, Chibi F and Senhaji NS. 2005. Effect of genotype on callus induction and plant regeneration from leaf explants of sugarcane (Saccharum sp.). African J. Biotech 4(11):1250-1255.
Grivet L, Daniels C, Glaszman JC and D’Hont A. 2004. A review of recent molecular genetics evidence for sugarcane evolution and domestication. Ethnobotany Research and Applications 2:9-17.
George EF, Sherrington PD. 1984. Plant Propagation by Tissue Culture. Great Britain: Eastern Press.
Gunawan LW. l988. Teknik Kultur Jaringan. Bogor: Laboratorium Kultur Jaringan Tanaman Pusat Antar Universitas (PAU) Bioteknologi Institut Pertanian Bogor. Direktorat Jendral Pendidikan Tinggi Departemen Pendidikan dan Kebudayaan.
Hendaryono DPS, Wijayani A. 1994. Teknik Kultur Jaringan. Yogyakarta: Yayasan Kanisius.
Hiregoudar LV. Murthy HN, Hema BP. 2003. Multiple shoot induction and plant regeneration of Feronia limonia (L.) Swingle. Scientia Horticulturae 98: 357-364.
Irvine JE. 1999. Saccharum species as horticultural classes. Theor Appl Genetics 98:186-194.
James G. 2004. Sugarcane (Second Edition). United Kingdom: Blackwell Science.
Jannah UF. 2011. Penetapan dosis pupuk N, P, dan K terubuk (Saccharum edule Hasskarl) [Makalah Seminar]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Karam NS, Al-Majathoub M. 2000. In vitro shoot regeneration from mature tissue of wild Cyclamen persicum Mill. Scientia Horticulturae 86:323-333. Karim MZ, R Alam, R Baksha, SK Paul, MA Hossian, ABM Mafizur R. 2002. In
vitro clonal propagation of sugarcane (Saccharum officinarum) variety lsd 31. Pak. J. Biol Sci. 5(6):659-661.
Karim MZ, MN Amin, MA Hossain, S Islam, Faruk H, R Alam. 2002. Micropropagation of two sugarcane (Saccharum officinarum) varieties from callus culture. OnLine J of Biol Sci. 2(10):682-685.
Khalil SM. 2002. Regeneration via embryosomatic and microprojectile-mediated co-transformation of sugarcane. Arab J. Biotech. 5(1):19-32.
Khan IA, Abdullah K. 2008. Plant regeneration via organogenesis or somatic embryogenesis in sugarcane: histological studies. Pak. J. Bot. 38(3):631-636.
Kurniatusolihat N. 2009. Pengaruh bahan setek dan pemupukan terhadap produksi terubuk (Saccharum edule Hasskarl) [Skripsi]. Bogor: Program Studi Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Martin F. 1984. Saccharum edule Hasskarl. (http://ecocrop.fao.org)
38
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor: IPB Press.
Ming R et al. 2002. Construction of a Saccharum consensus genetic map from two interspecific crosses. Crop Sci. 42: 570-583.
Nakayama S. 2005. Species-specific accumulation of interspersed sequence in genus saccharum. Genes Genet. Syst. 79:361-365.
Nurhasanah AN. 2007. Penyisipan gen fitase pada tebu (Saccharum officinarum) varietas PS 861 dan PA 198 dengan perantara Agrobacterium tumefaceiens GV 2260 (pMA) [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Prahardini PER, Sudaryono T. 1992. Pengaruh kombinasi Asam Naftalen Asetat dan Benzyladenin terhadap kultur Pepaya kultivar Dampit secara in vintro. J.Hort. 2(4):6-11.
Premachandran MN. 2006. Cauliflower gene in sugarcane. Current Sci. 91(6):750-751.
Putrasamedja S. 2005. Eksplorasi dan koleksi sayuran indigenous di Kabupaten Karawang, Purwakarta dan Subang. Buletin Plasma Nutfah 11(1):16-20. Roy PK and Kabir MH. 2007. In vitro propagation of sugarcane (Saccharum
officinarum L.) var. Isd 132 through shoot tips and folded leaves culture. Biotechnology 6(4):588-592.
Santoso U, Nursandi F. 2001. Kultur Jaringan Tanaman. Penerbitan Fakultas Pertanian, Universitas Brawijaya. Malang.
Shan X, Li D, Qu R. 2000. Thidiazuron promotes in vitro regeneration of wheat and barley. In vitro Cell Dev. Biol. Plant 36:207–210.
Sari L. 2005. Optimalisasi media untuk jumlah daun dan multiplikasi tunas lidah buaya (Aloe vera) dengan pemberian BAP dan adenin. Biodiversitas 6(3): 178-180.
Soetiarso TA. 2010. Alternatif sumber pangan bernilai gizi tinggi. Iptek Hortikultura 6:5-10.
Sugito H, Santosa Y, Sandra E. 2006. Penggunaan Thidiazuron, 2,4-D dan Giberellin dalam pembentukan embrio somatik pule pandak. Media Konservasi 11 (2):66–71.
Susiyanti. 2008. Penyisipan gen fitase pada genome beberapa kultivar tebu, regenerasi, ekspresi dan aklimatisasi. [Disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Van den Bergh MH. 1994. Saccharum edule Hasskarl In: JS Siemonsma and K Piluek (Eds). Plant Resources of South-East Asia. PROSEA: Vegetables. Prosea. Bogor:243-244.
Wattimena GA. 1988. Zat Pengatur Tumbuh Tanaman. PAU Institut Pertanian Bogor (IPB).Bogor.
Wulandari S, Wan Syafii dan Yossilia. 2004. Respon eksplan daun tanaman Jeruk Manis (Citrus sinensis L.) secara in vitro akibat pemberian NAA dan BA. J.Biogenesis 1(1):21-24.
Yuan X, Wang Z, Liu J, She J. 2008. Development of a plant regeneration system from seed-derived calluses of Centipedegrass [Eremochloa ophiuroides (Munro.) Hack]. Scientia Horticulturae 120:96-100.
Yusnita. 2004. Kultur Jaringan: Cara Memperbanyak Tanaman Secara Efisien. Jakarta: Agromedia Pustaka.
Yuwono T. 2008. Bioteknologi Pertanian. Yogyakarta: Gadjah Mada University Press.
40
Lampiran 1 Komponen media Murashige and Skoog
Halaman
DAFTAR LAMPIRAN
Halaman
ABSTRACT
PRIMADIYANTI ARSELA. In Vitro Regeneration of Terubuk (Saccharum edule). Under supervision of BAMBANG S PURWOKO as chairman; AGUS PURWITO and ANAS D SUSILA as members of the advisory committee.
Terubuk is one of the potential vegetable known as cauliflower sugarcane. It is characterized by unusual, swollen and aborted inflorescences, which is sweet and edible. The inflorescences are used as a source of food in Fiji, New Guinea, Indonesia and Malaysia by the indigenous people. The inflorescences are abnormal in the sense that they remain enclosed within the leaf-sheaths, forming a compact mass about the size of a banana fruit. Terubuk is produced and consumed locally and traded in local market only. In Indonesian’s traditional market, it is sold in bunches of 10. Terubuk is closely related to Saccharum officinarum, S. spontaneum, and S. robustum. It is exclusively propagated by cuttings or by division of clumps. To provide more inflorescences, it needs higher plants production. Its production needs cutting materials or propagules. Conventional propagation requires a lot of planting material. Tissue culture is an alternative propagation technique to solve the inavailability of plant material. The objective of this research was to obtain the best method to propagate terubuk using in vitro micropropagation through direct and indirect organogenesis. Flower stalks were used as explants. The explant’s sterilization was done by spraying the inflorescences with alcohol 96 %, then the flower was burnt. The indirect organogenesis using calli induction showed that the best medium was MS + 3.0 mg l-1 2,4-D + 1.0 mg l-1 kinetin. This media did not produce shoots from calli proliferation stage. It was only able to produce roots. The other method was by direct organogenesis. It was shown that the best medium was MS + 0.25 mg l-1 thidiazuron + 0.1 mg l-1 NAA + 0.25 mg l-1 GA3 to produce shoots in 2 weeks without putting the explants in calli induction medium. Shoots obtained through the media varied in size. Only shoot with 1-3 cm in size were rooted. Root formation required full strength of MS salt. The percentage of success in rooting ranged from 50-80%. Acclimatization has been done, however, after 2 weeks the planlet did not survive.
PENDAHULUAN
Latar Belakang
Terubuk (Saccharum edule Hasskarl) adalah salah satu jenis sayuran lokal yang telah lama dikenal masyarakat sebagai sayuran indigenous. Sayuran indigenous merupakan sayuran asli daerah atau wilayah tertentu yang sudah dibudidayakan atau dimanfaatkan oleh penduduk setempat dari dulu, sehingga sudah dianggap sebagai tanaman turun-temurun. Sayuran indigenous merupakan bagian dari keanekaragaman hayati yang dimiliki Indonesia, dan Indonesia termasuk dalam 3 negara mega keanekaragaman hayati setelah Brazil dan Madagaskar (Baihaki 2003). Beberapa sayuran indigenous lainnya antara lain gambas/oyong, labu siam, leunca, katuk, kemangi, kenikir koro, paria dan selada air (AVRDC 1999). Pemanfaatan sayuran indigenous merupakan salah satu alternatif yang dapat digunakan sebagai sumber nutrisi (gizi).
Terubuk adalah tanaman asli Asia Tenggara dan sekitar Pasifik yang tersebar di daerah dataran rendah sampai daerah dataran tinggi. Terubuk termasuk tanaman perenial. Umumnya terubuk dapat dipanen setelah berumur 5-10 bulan, dengan daur hidup sekitar 2-3 tahun (Van den Bergh 1994). Tinggi terubuk mencapai 1,5-4 m, dengan sistem pembungaan yang abnormal, bunga tetap terbungkus dalam pelepah daun atau kelobot, berukuran sebesar buah pisang
(Martin 1984).
Sampai saat ini, terubuk masih dibudidayakan secara konvensional (perbanyakan vegetatif menggunakan setek batang) di areal tanam yang tidak luas, sedangkan permintaan beberapa sayuran indigenous cukup tinggi. Alasan sayuran indigenous dibudidayakan masih secara konvensional antara lain kurang tersedianya benih/bibit, kurang informasi teknologi budidaya, kurang informasi tentang kesesuaian sayuran indigenous dengan sistem produksi yang ada (Soetiarso 2010).
2
tradisional daerah Bogor dan sekitarnya), serta memungkinkan untuk dibudidayakan secara intensif, maka diperlukan usaha peningkatan produksi dan kualitas terubuk.
Terubuk diperbanyak secara vegetatif dengan menggunakan setek batang, karena terubuk tidak menghasilkan biji, bunga terubuk tidak normal dan tidak dapat berkembang sempurna sampai membentuk biji (James 2004). Perbanyakan dengan setek memerlukan bahan tanaman dalam jumlah banyak. Hal ini menyebabkan penyediaan bahan setek terubuk dalam waktu singkat akan menemui kendala. Metode in vitro adalah suatu metode perbanyakan yang dapat memecahkan permasalahan bibit (Farid 2003). Metode ini dapat menghasilkan bibit dalam jumlah banyak tanpa memerlukan bahan tanaman yang banyak dan dapat menyediakan bahan tanaman yang bebas patogen (Zulkarnain 2009).
Kultur jaringan terubuk belum pernah dilakukan. Oleh sebab itu, perbanyakan secara in vitro terubuk menggunakan acuan dari hasil penelitian kultur jaringan keluarga dekat terubuk yaitu tebu (S. officinarum). Keberhasilan regenerasi tanaman tebu secara in vitro telah banyak dilaporkan antara lain produksi dan regenerasi kalus, induksi tunas dan proliferasinya, serta induksi perakaran. Pada induksi kalus yang digunakan adalah media MS (Murashige dan Skoog ) dengan auksin (2,4-D) 3 mg l-1 dan sitokinin (kinetin) 0,1 mg l-1, untuk induksi tunas menggunakan kombinasi auksin (NAA) 2 mg l-1 dan sitokinin (BAP atau kinetin) antara 0,1-2 mg l-1, sedangkan untuk induksi akar menggunakan auksin saja (IBA atau NAA) antara 1-3 mg l-1 (Karim 2002; Farid 2003; Chengalrayan et al. 2005; Khan & Abdullah 2008; Gandonou et al. 2005; Ali et al. 2008; Roy & Kabir 2007; Behera & Santilata 2009).
Tujuan Penelitian
Tujuan penelitian ini adalah:
1. Memperoleh bagian tanaman yang dapat digunakan sebagai bahan tanam in vitro
3. Mempelajari pengaruh sitokinin terbaik terhadap kemampuan eksplan membentuk tunas
4. Mempelajari kemampuan elongasi dan perakaran tunas 5. Mempelajari respon aklimatisasi planlet terubuk.
Hipotesis
Hipotesis penelitian ini adalah:
1. Terdapat bagian tanaman terbaik yang digunakan sebagai eksplan in vitro 2. Terdapat pengaruh auksin dan sitokinin terhadap induksi kalus
3. Terdapat pengaruh sitokinin dalam induksi tunas
4. Terdapat metode terbaik dalam elongasi dan perakaran tunas 5. Terdapat respon aklimatisasi planlet terubuk.
Kerangka Pemikiran
Salah satu upaya untuk mendapatkan bibit dalam jumlah besar tanpa memerlukan bahan tanaman yang banyak yaitu melalui perbanyakan secara in vitro. Perbanyakan tanaman secara in vitro dapat dilakukan melalui organogenesis secara langsung dan tidak langsung. Organogenesis secara langsung terjadi bila eksplan langsung dapat membentuk tanaman utuh tanpa melalui pembentukan kalus terlebih dahulu, sedangkan organogenesis secara tidak langsung terjadi bila eksplan membentuk kalus kemudian kalus membentuk tunas dan akar yang dapat disebut sebagai tanaman utuh atau planlet.
4
Gambar 1 Bagan alir pelaksanaan penelitian
Perbanyakan setek tanaman terubuk
Sumber eksplan in vitro
Induksi kalus dari eksplan “janggle” bunga terubuk
Tunas Eksplorasi metode lain :
Perlakuan lama waktu tanam eksplan dalam media induksi kalus terbaik Eksplorasi sumber bahan tanam in vivo
Perbanyakan tunas menggunakan media induksi tunas terbaik
Aklimatisasi
TINJAUAN PUSTAKA
Klasifikasi Tanaman Terubuk
Terubuk (Saccharum edule Hasskarl) termasuk dalam famili Gramineae (Poaceae). Dillon et al. (2007), Daniels & Roach (1987), James (2004) membagi genus Saccharum ke dalam enam spesies yaitu, S. spontaneum, S. robustum Brandes Jeswit ex Grassl, S. officinarum L., S. barberi Jeswit, S. sinense Roxb., dan S. edule Hasskarl. Irvine (1999) juga menyebutkan bahwa setiap spesies dikarakterisasi berdasarkan karakter bunga, kandungan gula, dan jumlah kromosom.
Irvine (1999) dan Nakayama (2005) menyatakan bahwa S. spontaneum, dan S. robustum Brandes Jeswit ex Grassl. merupakan spesies liar sedangkan S. officinarum, S. barberi Jeswit., S. sinense Roxb., dan S. edule Hasskarl. merupakan spesies budidaya. Diantara spesies budidaya, S. barberi Jeswit dan S. sinense Roxb. diyakini merupakan hibrid alami S. spontaneum dan S. officinarum yang merupakan spesies budidaya turunan dari S. robustum (Irvine 1999; Ming et al. 2002; Grivet et al. 2004).
Spesies budidaya S. edule memiliki pembungaan yang tidak normal yang tidak terjadi pada varietas komersial tebu lainnya walaupun terjadi banyak persilangan setiap tahunnya di negara-negara berbeda. Pembungaan yang mirip cauliflower pada S. edule disebabkan oleh adanya beberapa mutasi gen. Identifikasi gen yang bertanggung jawab terhadap fenotipe cauliflower pada S. edule memungkinkan untuk usaha memanipulasi gen pembungaan pada tebu varietas komersil dan fenotipe juga dapat terbawa. Ada 1 produk ekonomis baru dari tebu yang dapat meningkatkan keuntungan petani tebu. Seperti pada kasus “baby corn” yang telah menjadi salah satu jenis sayuran favorit, “cane flower” juga dapat menjadi sayuran favorit di daerah non-tradisional (Guimaeraes & Sobral 1997; D’Hont et al. 2002). James (2004) menyatakan bahwa dengan pembungaan yang tidak biasa, membengkak dan bunga aborsi, terubuk dimanfaatkan sebagai sumber makanan di Melanesia.