PENGARUH PEMBERIAN EKSTRAK ETANOL
TEMULAWAK (Curcuma xanthorrhiza Roxb.) PADA
AKTIVITAS DAN KAPASITAS FAGOSITOSIS MAKROFAG
PERITONEAL AYAM PETELUR (Gallus sp.)
AHMAD NUR AFIFUDIN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi Pengaruh Pemberian Ekstrak
Etanol Temulawak (Curcuma xanthorrhiza Roxb.) pada Aktifitas dan Kapasitas
Makrofag Peritonial Ayam Petelur (Gallus sp.) adalah karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
daftar pustaka di bagian akhir skripsi.
Bogor, Agustus 2009
Ahmad Nur Afifudin
ABSTRACT
AHMAD NUR AFIFUDIN. The Effect of Temulawak (Curcuma xanthorrhiza Roxb.) Ethanol Extract on Phagocytosis Activity and Capacity of Peritoneal Macrophages in Laying Hens (Gallus sp.). Under the direction of BAMBANG PONTJO PRIOSOERYANTO and OKTI NADIA POETRI.
The activity of temulawak (Curcuma xanthorrhiza. Roxb) ethanol (70% and 96%) extract on phagocytic activity and capacity of laying hens peritoneal macrophages in order to elaborate the immunomodulatory effect was conducted. Twenty four head of laying hens were divided into eight treatments groups, there were negative control, positive control (Phyllanthus niruri extract), three groups were treated with temulawak ethanol (70%) extract with the doses of 17.5; 35 and 52.5 mg/kg BW, and the other three groups were treated with temulawak ethanol (96%) extract with the doses of 17.5; 35 and 52.5 mg/kg BW for 4 weeks. The birds were then challenge with a non (-A) Staphylococcus aureus intraperitoneally to observed the phagocytic activity and capacity of each treated groups. Result showed that there was increasing in phagocytic activity and capacity all temulawak treated groups. The highest activity was detected on the temulawak ethanol (96%) extract with the dose of 52.5 mg/kg BW. Based on all finding mentioned above we suggest that temulawak ethanol extract has an immunostimulator activity and could be use for increasing the health status of laying hens.
ABSTRAK
AHMAD NUR AFIFUDIN. Pengaruh Pemberian Ekstrak Etanol Temulawak
(Curcuma xanthorrhiza Roxb.) pada Aktivitas dan Kapasitas Fagositosis
Makrofag Peritoneal Ayam Petelur (Gallus sp.). Dibimbing oleh BAMBANG
PONTJO PRIOSOERYANTO dan OKTI NADIA POETRI.
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian 2 jenis ekstrak etanol (70% dan 96%) temulawak pada berbagai dosis terhadap sistem kekebalan nonspesifik ayam melalui aktivitas dan kapasitas fagositosis makrofag peritoneal. Dua puluh empat ayam petelur dibagi menjadi 8 kelompok perlakuan,
yaitu kontrol negatif, kontrol positif (Phyllanthus niruri ekstrak), 3 kelompok
diberi ekstrak etanol (70%) temulawak dengan dosis 17,5; 35 dan 52,5 mg/kg BB dan 3 kelompok lagi diberi ekstrak etanol (96%) temulawak dengan dosis 17,5, 35 dan 52,5 mg/kg BB selama 4 minggu. Ayam kemudian ditantang dengan Staphylococcus aureus nonprotein A secara intraperitoneal untuk mengetahui masing-masing aktivitas dan kapasitas fagositosis dari masing-masing perlakuan. Hasil pengamatan menunjukkan terjadi peningkatan aktivitas dan kapasitas fagositosis pada semua kelompok perlakuan ekstrak etanol temulawak. Kenaikan aktivitas dan kapasitas fagositosis tertinggi terjadi pada ekstrak temulawak dalam pelarut etanol 96% pada dosis 52,5 mg/kg BB. Berdasarkan semua hasil penelitian, dapat disimpulkan bahwa ekstrak temulawak memiliki aktivitas imunostimulator dan dapat digunakan sebagai bahan untuk meningkatkan status kesehatan ayam atau unggas pada umumnya.
© Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penyusunan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENGARUH PEMBERIAN EKSTRAK ETANOL
TEMULAWAK (Curcuma xanthorrhiza Roxb.) PADA
AKTIVITAS DAN KAPASITAS FAGOSITOSIS MAKROFAG
PERITONEAL AYAM PETELUR (Gallus sp.)
AHMAD NUR AFIFUDIN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengaruh Pemberian Ekstrak Etanol Temulawak (Curcuma xanthorrhiza Roxb.) pada Aktivitas dan Kapasitas Fagositosis Makrofag Peritoneal Ayam Petelur (Gallus sp.)
Nama : Ahmad Nur Afifudin
NIM : B04052849
Disetujui
Pembimbing I Pembimbing II
drh. Bambang P.Priosoeryanto, M.S, Ph.D drh. Okti Nadia Poetri, M.Si
NIP : 19600228 198601 1 001 NIP : 19801027 200501 2 003
Diketahui Wakil Dekan
Fakultas Kedokteran Hewan Institut Pertanian Bogor
Dr. Nastiti Kusumorini NIP: 19621205 198703 2 001
PRAKATA
Alhamdulillahirobilalamin. Segala puji bagi Allah SWT yang telah memberikan rahmat, taufik dan hidayah-Nya serta kemudahan dan
pertolongan-Nya sehingga penulis dapat menyelesaikan skripsi berjudul “ Pengaruh Pemberian Ekstrak Etanol Temulawak (Curcuma xanthorrhiza Roxb.) pada Aktivitas dan
Kapasitas Fagositosis Makrofag Peritoneal Ayam Petelur (Gallus sp.)“. Skripsi ini
merupakan salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Dalam pelaksanaan penelitian dan penyusunan banyak sekali hambatan dan rintangan yang dihadapi penulis, namun karena pertolongan dan kemudahan Allah SWT akhirnya skripsi ini dapat diselesaikan. Bantuan dan dukungan dari berbagai pihak juga sangat membantu selesainya skripsi ini. Dalam kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya atas dukungan dan bantuan dari berbagai pihak.
1. drh. Bambang Pontjo Priosoeryanto, M.S, Ph.D sebagai dosen pembimbing
I yang telah meluangkan waktu untuk memberikan perhatian, bimbingan, arahan, telaah dan koreksi yang sangat berguna bagi penulis selama penelitian dan penyusunan skripsi.
2. drh. Okti Nadia Poetri, M.Si sebagai dosen pembimbing II yang telah
meluangkan waktu untuk memberikan perhatian, bimbingan, arahan, telaah dan koreksi yang sangat berguna bagi penulis selama penelitian dan penyusunan skripsi.
3. drh. Bambang Pontjo Priosoeryanto, M.S, Ph.D selaku dosen pembimbing
akademik yang telah memberikan saran, arahan dan bimbingan dalam kegiatan akademik penulis.
4. Dr. drh. Hera Maheshwari, M.Sc selaku dosen penilai yang telah
memberikan saran dan arahannya.
5. Seluruh staf pengajar dan pegawai Laboratorium Patologi FKH-IPB yang
telah memberikan bantuannya.
6. Keluargaku tercinta orang tuaku dan kakakku, atas segala kasih sayang,
7. Sahabatku Dimas TN, atas segala bantuan, semangat dan perhatiannya.
8. Rita Oktariani, atas perhatian dan kasih sayang kepada penulis.
9. Teman terbaikku, Mas Andri dan Zeni FR kepada penulis.
10.Teman-teman baikku Nova A, Tiara Putri, Mariani, Thufiel Y dan masih
banyak lagi yang tidak bisa disebutkan satu per satu, atas segala kesabaran, kebersamaan, bantuan dan kemauan untuk berbagi dengan penulis.
11.Teman-teman di Forum Kajian Islam Ilmiah Mahasiswa Majelis Ta’lim Al
Furqon.
12.Teman-teman di Pondok Sahabat, (Rizal F, Alfa MW, Yusep M,
Hernawan, Doli R, Janji, Eldi) atas bantuan, kebersamaan dan perhatiannya.
13. Mba Renny Safety Anggie S.KH, atas bantuannya dalam penulisan makalah dan skripsi.
14.Mas Muhammad Daud, S.Hut, atas kuliah statistik dan bantuannya untuk
pengolahan data penelitian.
15.Temanku Nurandi Setiabudi di statistika 42 atas bantuannya mengolah data
penelitian.
16.Semua teman FKH angkatan 42 dan teman satu tim penelitian (Maryam,
Ester, Keszia, Herlince, Dimas Nugroho, Reni, Listia, Dine, Ajeng) yang telah mendukung.
17.Mas Wawan Tri Mulya dkk, atas perhatian dan bantuannya kepada penulis
selama ini.
18.Semua pihak, semoga Allah membalas dengan ridho dan SurgaNya.
Penulis menyadari masih banyak kekurangan dalam penulisan skripsi ini, namun penulis juga berharap semoga skripsi ini dapat bermanfaat bagi penulis pribadi dan pihak lain yang membutuhkan.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Pekalongan pada tanggal 3 Agustus 1987, anak ketiga dari tiga bersaudara dari pasangan bapak Suwarno Susilo dan ibu Kautun.
Penulis menyelesaikan pendidikan taman kanak-kanak di TK Budi Harapan II Jakarta Selatan pada tahun 1993, pendidikan dasar di SDN 17 Pagi Jakarta Selatan pada tahun 1999, sekolah lanjutan tingkat pertama di SLTP Negeri 153 Jakarta Selatan yang diselesaikan hingga tahun 2002 dan sekolah menengah atas di SMA Negeri 90 Jakarta Selatan yang diselesaikan tahun 2005. Penulis diterima menjadi mahasiswa Institut Pertanian Bogor (IPB) pada tahun 2005 melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjadi mahasiswa penulis pernah menjadi pengurus Kerohanian Islam B19 dan B20 pada tahun 2005 hingga 2006. Semasa kuliah penulis juga terdaftar sebagai pengurus himpunan profesi (Himpro) Satwa Liar (SATLI) pada tahun 2006 hingga 2007 dan anggota himpunan profesi (Himpro) Hewan Kesayangan dan Satwa Akuatik pada tahun 2006 hingga 2007, anggota Neunzig Community (NECO) pada tahun 2005 hingga 2006, ketua divisi internal DPM KM FKH pada tahun 2006 hingga 2007 serta pengurus BEM FKH pada tahun 2007 hingga 2008. Tahun 2008 hingga sekarang penulis aktif sebagai anggota di
x
DAFTAR ISI
Halaman
DAFTAR ISI ... x
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Temulawak ... 4
Klasifikasi ... 4
Deskripsi ... 4
Komposisi ... 6
Manfaat ... 6
Meniran (Phyllanthus niruri) ... 7
Klasifikasi dan Morfologi ... 7
Sifat dan Khasiat ... 8
Komposisi ... 8
Ayam Petelur ... 9
Klasifikasi ... 9
Produktivitas ... 10
Staphylococcus aureus... 11
Klasifikasi ... 12
Patogenitas ... 12
Mekanisme Tanggap Kebal Inang ... 15
Definisi ... 15
Sel Leukosit Sebagai Sistem Kekebalan ... 15
Sistem Kekebalan Pada Unggas ... 17
Imunomodulator ... 19
BAHAN DAN METODE ... 20
Waktu dan Tempat Penelitian ... 20
Bahan dan Alat ... 20
Bahan ... 20
Alat ... 20
Hewan Penelitian ... 20
Isolat Bakteri ... 21
Metode Penelitian ... 21
Persiapan kandang ... 21
xi Preparasi Suspensi Bakteri Staphylococcus aureus (SA)
non A ... 22
Pemberian Vaksin AI ... 22
Pemberian Perlakuan Terhadap Hewan Percobaan ... 22
Pemeriksaan Aktivitas dan Kapasitas Fagositosis ... 23
Variabel Pengamatam ... 23
Aktivitas Fagositosis ... 23
Kapasitas Fagositosis ... 23
Rancangan Percobaan ... 24
HASIL DAN PEMBAHASAN ... 25
Aktivitas Fagositosis ... 25
Kapasitas Fagositosis ... 31
Mekanisme Temulawak pada Fagositosis ... 34
SIMPULAN DAN SARAN ... 39
DAFTAR PUSTAKA ... 40
xii
DAFTAR GAMBAR
Halaman
1. Tanaman Temulawak (Curcuma xanthorrhiza Roxb.) ... 5
2. Bakteri Staphylococcus aureus ... 14 3. Struktur antigenik pada Staphylococcus sp ... 14
4. Aktivitas fagositasis makrofag peritonial ayam petelur rata-rata
pada ayam petelur yang diberikan dosis ekstrak etanol temulawak secara bertahap selama 4 minggu ... 25
5. Kurva respon hubungan dosis ekstrak temulawak dalam pelarut
etanol 70% terhadap aktivitas fagositosis makrofag. ... 30
6. Kurva respon hubungan dosis ekstrak temulawak dalam pelarut
etanol 96% terhadap aktivitas fagositosis makrofag. ... 30
7. Kapasitas fagositasis makrofag peritonial ayam petelur rata-rata
pada ayam petelur yang diberikan dosis ekstrak etanol temulawak secara bertahap selama 4 minggu ... 31
8. Kurva respon hubungan dosis ekstrak temulawak dalam pelarut
etanol 70% terhadap kapasitas fagositosis makrofag. ... 35
9. Kurva respon hubungan dosis ekstrak temulawak dalam pelarut
etanol 96% terhadap kapasitas fagositosis makrofag. ... 35 10.Proses fagositosis. ... 38
11.Preparat cairan intraperitoneal ayam petelur setelah pemberian
xiii
DAFTAR LAMPIRAN
Halaman
1. Hasil analisis ragam aktivitas fagositosis makrofag peritonial
ayam petelur setelah pemberian ekstrak etanol temulawak ... 45
2. Hasil uji Duncan perbedaan terhadap aktivitas fagositosis makrofag peritonial ayam petelur pada masing-masing perlakuan dosis ... 46
3. Hasil analisis ragam jumlah ekstrak, konsentrasi pelarut etanol serta interaksinya terhadap aktivitas fagositosis makrofag peritonial ayam petelur setelah pemberian ekstrak etanol temulawak ... 47
4. Hasil uji Duncan perbedaan terhadap aktivitas fagositosis makrofag peritonial ayam petelur pada masing-masing konsentrasi pelarut etanol ... 48
5. Hasil uji Duncan perbedaan terhadap aktivitas fagositosis makrofag peritonial ayam petelur pada masing-masing jumlah ekstrak temulawak. ... 49
6. Hasil analisis ragam kapasitas fagositosis makrofag peritonial ayam petelur setelah pemberian ekstrak etanol temulawak. ... 50
7. Hasil uji Duncan perbedaan terhadap kapasitas fagositosis makrofag fagositik ayam petelur pada masing-masing perlakuan dosis. ... 51
8. Hasil analisis ragam jumlah ekstrak, konsentrasi pelarut etanol serta interaksinya terhadap kapasitas fagositosis makrofag peritonial ayam petelur setelah pemberian ekstrak etanol temulawak ... 52
9. Hasil uji Duncan perbedaan terhadap kapasitas fagositosis peritonial makrofag ayam petelur pada masing-masing konsentrasi pelarut etanol.. ... 53
10.Hasil uji Duncan perbedaan terhadap kapasitas fagositosis peritonial makrofag ayam petelur pada masing-masing jumlah ekstrak temulawak.. ... 54
11.Data mentah aktivitas fagositosis. ... 55
12.Data mentah kapasitas fagositosis ... 56
13.Gambar skema proses pembuatan ekstrak etanol temulawak... 57
14.Perhitungan persamaan uji ortogonal polinomial pada aktivitas fagositosis ekstrak etanol (70%) temulawak ... 58
15.Perhitungan persamaan uji ortogonal polinomial pada aktivitas fagositosis ekstrak etanol (96%) temulawak ... 59
16.Perhitungan persamaan uji ortogonal polinomial pada kapasitas fagositosis ekstrak etanol (70%) temulawak ... 60
17. Perhitungan persamaan uji orthogonal polinomial pada kapasitas fagositosis ekstrak etanol (96%) temulawak ... 61
PENDAHULUAN
Latar Belakang
Daging dan telur merupakan salah satu bahan makanan konsumsi sebagai sumber protein hewani dan bahan utama yang berfungsi dalam proses pertumbuhan dan perkembangan tubuh. Tingkat konsumsi daging dan telur untuk penduduk Indonesia relatif tinggi, maka diperlukan usaha pemenuhan daging dan telur dengan meningkatkan budidaya perternakan.
Peternakan unggas adalah suatu usaha membudidayakan ternak unggas yang bertujuan untuk menghasilkan keuntungan. Untuk tujuan tersebut, maka diperlukan pemeliharaan peternakan yang baik dan penggunaan biaya pemeliharaan yang efisien. Usaha untuk meningkatkan produk peternakan unggas dapat dilakukan dengan pemilihan bibit unggul, penerapan manajemen kandang dan pakan yang baik, serta pencegahan dan pengobatan penyakit.
Menurut Efrizanti (2005) pakan dalam sebuah industri peternakan unggas merupakan komponen biaya produksi terbesar, mencapai 60-70%. Tingginya biaya pakan, disebabkan oleh pengunaan pakan komersial yang tinggi harganya. Antibiotik, hormon dan feed additive merupakan bahan perangsang pertumbuhan
untuk meningkatkan efisiensi penggunaan pakan. Feed additive yang biasa
digunakan yaitu bersifat komersil, namun sebagai alternatif dapat digunakan tanaman tradisional temulawak.
Penyakit unggas merupakan salah satu masalah dalam usaha peternakan unggas. Usaha peternakan unggas akan berkembang baik jika ternak unggas bebas dari penyakit. Salah satu penyakit yang sering menyerang ternak unggas
diantaranya avian influenza atau flu burung yang dapat mengakibatkan tingginya
tingkat kematian pada unggas dan menimbulkan kerugian yang besar. Salah satu tindakan pencegahan dari penyakit flu burung dengan cara meningkatkan kesehatan unggas pada sistem kekebalannya yang spesifik (antibodi) dengan vaksinasi dan nonspesifik (fagositosis makrofag).
2 contohnya yaitu adanya residu antibiotik dalam produk hasil unggas. Penggunaan obat yang bersifat alamiah merupakan salah satu alternatifnya, yaitu penggunaan tanaman temulawak. Potensi obat-obatan alamiah ini mampu memberikan peranannya dalam upaya pemeliharaan, peningkatan dan pemulihan kesehatan serta pengobatan penyakit.
Temulawak (Curcuma xanthorrhiza Roxb.) merupakan tanaman obat asli
Indonesia. Temulawak termasuk famili Zingiberacea dan dikenal sebagai obat fitofarmaka dengan khasiatnya yaitu untuk mengobati penyakit saluran pencernaan, kelainan hati, kandung empedu, pankreas, usus halus, tekanan darah tinggi, kontraksi usus, TBC, sariawan dan dapat dipergunakan sebagai tonikum. (Raharjo dan Otih 2005). Menurut Dalimartha (1999), temulawak juga memiliki khasiat sebagai antiinflamasi, antioksidan, dan antitumor.
Khasiat obat alami dapat meningkatkan kekebalan tubuh dan kesehatan manusia. Obat-obat tersebut memiliki kemampuan sebagai imunomodulator yang dapat membuat sistem imun berperan lebih aktif dalam menjalankan fungsinya, yakni yang akan berperan aktif dalam menguatkan sistem imun tubuh (imunostimulator). Beberapa hasil penelitian menunjukkan bahwa temulawak (curcuma xanthorrhiza) merupakan tanaman multifungsi yang mengandung bahan-bahan aktif seperti kurkuminoid, minyak atsiri, flavonoid dan pati (polisakarida) (Ketaren 1988).
Manfaat-manfaat temulawak tersebut telah berhasil dibuktikan khasiatnya pada manusia, tetapi sejauh ini belum ada yang menelusuri khasiat temulawak terhadap tingkat kesehatan ayam melalui sistem kekebalan tubuh yang spesifik (antibodi) dan nonspesifik (fagositosis makrofag). Makrofag merupakan salah satu sel yang berperan penting dalam respon imun dengan fagositosis dan sebagai
antigen presenting cells (APC). Makrofag peritoneal dari sistem fagositik mononuklear memiliki aktivitas fagositosis yang tahan lama, sehingga akan terbentuk tanggap kebal (Tizard 2009).
3
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui efektivitas ekstrak temulawak dalam meningkatkan respon kekebalan nonspesifik melalui aktivitas dan kapasitas fagositosis.
Manfaat Penelitian
4
TINJAUAN PUSTAKA
Temulawak
Temulawak merupakan tanaman obat berupa tumbuhan rumpun berbatang semu. Di daerah Jawa Barat temulawak disebut sebagai koneng gede sedangkan di Madura disebut sebagai temu lobak. Kawasan Indo-Malaysia merupakan tempat dari mana temulawak ini menyebar ke seluruh dunia. Saat ini tanaman ini selain di Asia Tenggara dapat ditemui pula di Cina, IndoCina, Bardabos, India, Jepang, Korea, di Amerika Serikat dan Beberapa negara Eropa (Prihatman 2008).
Klasifikasi
Menurut Prihatman (2008), Temulawak (Curcuma xanthorrhiza Roxb.)
merupakan tanaman asli Indonesia dan merupakan salah satu tumbuhan obat yang cukup dikenal oleh masyarakat. Temulawak merupakan salah satu jenis temu-temuan yang termasuk keluarga zingiberaceae, klasifikasi temulawak secara lengkap adalah Divisi: Spermatophyta, Subdivisi: Angiospermae, Kelas: Monocotyledonem, Bangsa: Zingiberales, Suku: Zingiberaceae, Genus: Curcuma dan Spesies: Curcuma xanthorrhiza Roxb.
Deskripsi
Tanaman berbatang semu dengan tinggi antara 1-2 m, berwarna hijau atau coklat gelap. Tiap batang mempunyai daun 2-9 helai dengan bentuk bundar
dengan warna daun hijau atau coklat keunguan dan memiliki panjang daun 31–84
cm dan lebar 10-18 cm serta panjang tangkai daun termasuk helaian 43-80 cm (Gambar 1a). Perbungaan lateral, tangkai ramping dan sisik berbentuk garis
dengan panjang tangkai 9-23 cm dan lebar 4–6 cm. Kelopak bunga berwarna putih
berbulu dengan panjang 8–13 mm dan mahkota bunga berbentuk tabung dengan
5
antara 3–4 buah. Warna rimpang cabang umumnya lebih muda dari pada rimpang
induk (Gambar 1c) .
Warna kulit rimpang sewaktu masih muda maupun tua adalah kuning atau coklat kemerahan. Warna daging rimpang adalah kuning tua dengan cita rasanya amat pahit atau coklat kemerahan berbau tajam, serta keharumannya sedang. Rimpang terbentuk dalam tanah pada kedalaman 16 cm. Tiap rumpun tanaman temu lawak umumnya memiliki enam buah rimpang tua dan lima buah rimpang muda (Gambar 1d) (Prihatman 2008).
Gambar 1 Temulawak (Curcuma xanthorrhiza Roxb.). a) Morfologi tanaman temulawak. b) Bunga tanaman temulawak. c) Akar rimpang temulawak. d) Daging rimpang temulawak.
6
Komposisi
Kandungan zat aktif yang terdapat di temulawak adalah kurkumin, kurkuminoid, P-toluilmetilkarbinol, seskuiterpen d-kamper, mineral, minyak atsiri serta minyak lemak, karbohidrat, protein, mineral seperti Kalium (K), Natrium
(Na), Magnesium (Mg), Besi (Fe), Mangan (Mn) dan Kadmium (Cd) (Boesro et
al. 2006).
Bagian yang paling berkhasiat dari temulawak adalah rimpangnya. Ekstrak rimpang temulawak mengandung lebih dari 100 macam zat seperti amilase, fenolase, lemak, pati dan berbagai mineral senyawa fenol serta minyak atsiri. Seperti umumnya fetoterapi, zat-zat tersebut berkerja secara totalitas meningkatkan daya tahan tubuh (Ketaren 1988). Rimpang temulawak segar mengandung air sekitar 75%, minyak atsiri (volatile oil), lemak (fixed oil), zat warna (pigmen), protein, resin, selulosa, pentosan, pati, mineral, zat-zat penyebab rasa pahit dan sebagainya. Kandungan dari komponen-komponen dalam temulawak sangatlah tergantung pada umur tumbuhan pada saat dipanen (Ketaren 1988).
Rimpang temulawak mengandung karbohidrat sekitar 29-34% dan minyak 6-10% bobot kering. Komposisi temulawak sangat tergantung pada musim, dengan komponen utama pati temulawak yang kadarnya berkisar antara 30-40% dan komponen minyak atsirinya berkisar antara 7-30% dihitung berdasarkan
bobot kering (Prihatman 2008). Curcuma xanthorriza Roxb. mempunyai
kandungan minyak atsiri yang paling tinggi diantara jenis Curcuma sp (Ketaren
1988). Kandungan minyak atsiri pada temulawak sekitar 8% dan warna kuning merupakan warna dari kurkumin. Komposisi rimpang temulawak dapat dilihat pada Tabel 1.
Manfaat
7 Hasil penelitian tentang kandungan zat aktif pada temulawak diketahui bahwa khasiat temulawak terutama disebabkan oleh beberapa kelompok kandungan kimia utama, yakni golongan kurkuminoid, minyak atsiri, flavonoid dan pati (polisakarida). Kurkumoinoid terdiri dari dua jenis senyawa yaitu kurkumin dan desmetosikurkumin yang berkhasiat menetralkan racun, menghilangkan rasa nyeri sendi, meningkatkan ekskresi empedu, menurunkan kadar lemak darah, anti bakteri, serta dapat mencegah terjadinya perlemakkan dalam sel-sel hati dan sebagai anti oksidan penangkal senyawa-senyawa radikal bebas yang berbahaya. Minyak atsiri temulawak yang terdiri dari 32 komponen secara umum bersifat meningkatkan produksi getah empedu dan mampu menekan
pembengkakan jaringan (Liang et al. 1985). Manfaat lain dari rimpang tanaman
ini adalah sebagai obat jerawat, meningkatkan nafsu makan, anti kolesterol, anti inflamasi, anemia, anti oksidan, pencegah kanker dan anti mikroba (Raharjo dan Otih 2005; Dalimartha 1999).
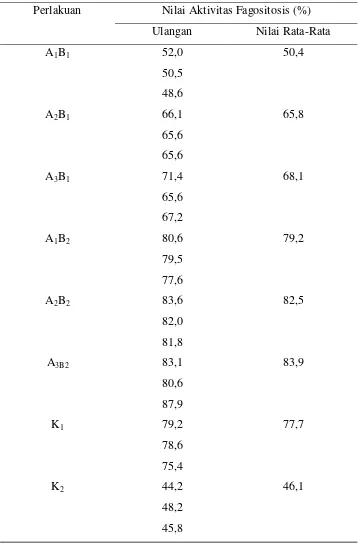
Tabel 1 Komposisi Rimpang Temulawak Kering
Komposisi Kadar (%)
Pati 58,24
Lemak (fixed oil) 12,10
Minyak Atsiri 4,90
Abu 4,90
Mineral 4,29
Serat Kasar 4,20
Protein 2,90
Kurkumin 1,55
(Sumber: Luthana 2008)
Meniran (Phyllanthus niruri) Klasifikasi dan Morfologi
Klasifikasi Meniran adalah sebagai berikut: Kingdom: Plantae, Divisi:
Magnoliophyta, Kelas: Magnoliopsida, Ordo: Euphorbiales, Famili:
Euphorbiaceae, Genus: Phyllanthus dan Spesies: Phyllanthus niruri Linn (Van
8 hijau kemerahan. Batang tumbuhan ini berbentuk bulat, basah dengan tinggi kurang dari 50 cm. Daunnya bersirip genap dan setiap satu tangkai daun terdiri atas daun majemuk yang mempunyai ukuran kecil dan berbentuk lonjong. Sedangkan bunganya muncul di ketiak daun dan menghadap ke arah bawah (Utami 2008). Helaian daun bulat telur sampai bulat memanjang, ujung tumpul, pangkal membulat, permukaan bawah berbintik, tepi rata, panjang sekitar 1,5 cm, lebar sekitar 7 mm dan berwarna hijau. Dalam satu tanaman ada bunga betina dan bunga jantan. Bunga jantan keluar di bawah ketiak daun, sedangkan bunga betina keluar di atas ketiak daun. Buahnya berbentuk kotak, bulat pipih, licin, bergaris tengah 2-2,5 mm serta memiliki biji yang kecil, keras, berbentuk seperti ginjal, dan berwarna coklat (Dalimartha 1999).
Sifat dan Khasiat
Menurut Dalimartha (2008), herba ini rasanya agak pahit, manis, sifatnya sejuk dan astringen. Berkhasiat membersihkan hati, anti radang, pereda demam (antipiretik), peluruh kencing (diuretik), peluruh dahak, peluruh haid, menerangkan penglihatan dan penambah nafsu makan.
Komposisi
Tanaman meniran mengandung berbagai macam zat aktif yang bermanfaat
untuk pengobatan seperti golongan lignan. Antara lain filantin, hipofilantin,
niranin, nirtetralin dan fitetralin. Beberapa senyawa lignan baru, juga telah
diisolasi dari Phyllantus niruri yaitu 4-hidroksilintetralin,
seco-isoarisiresinoltrimetileter, hidroksinirantin, dibenzilbutirolakton, nirfilin dan neolignan (filnirurin). Akar dan daun meniran juga banyak mengandung senyawa
flavonoid, antara lain quercetin, qeurcetrin, isoquercetrin, astragalin dan rutin
(Dexamedica 2009).
Menurut Utami (2008), kandungan kimia filantin, hipofilantin, kalium, damar dan tanin. Filantin dan hipofilantin berkhasiat melindungi sel hati dari zat
toksik (hepatoprotektor). Phyllanthus niruri L. mempunyai efek terhadap respon
9 ekstrak tumbuhan ini dapat meningkatkan proliferasi sel limfosit T dan terhadap imunitas humoral, ekstrak ini memiliki efek dalam meningkatkan produksi imunoglobulin M (IgM) serta imunoglobulin G (IgG).
Ayam Petelur
Ayam petelur adalah ayam-ayam betina dewasa yang dipelihara khusus untuk diambil telurnya. Asal mula ayam unggas adalah berasal dari ayam hutan dan itik liar yang ditangkap dan dipelihara serta dapat bertelur cukup banyak. Tahun demi tahun ayam hutan diseleksi secara ketat oleh para pakar. Arah seleksi ditujukan pada produksi yang banyak. Ayam yang terseleksi ditujukan untuk produksi daging dikenal dengan ayam broiler, sedangkan untuk produksi telur dikenal dengan ayam petelur. Selain itu, seleksi juga diarahkan pada warna kulit telur hingga kemudian dikenal ayam petelur putih dan ayam petelur cokelat. Persilangan dan seleksi itu dilakukan cukup lama hingga menghasilkan ayam petelur seperti yang ada sekarang ini. Dalam setiap kali persilangan, sifat jelek dibuang dan sifat baik dipertahankan. Inilah yang kemudian dikenal dengan ayam petelur unggul.
Menurut Rasyaf (2003) ayam petelur mempunyai kerabang berwarna putih berasal dari strain Hisex putih, Lohman putih, Steggles Longhorn dan Shaver 288. Ayam petelur yang mempunyai kerabang telur yang berwarna coklat, berasal dari strain ayam ras tipe telur berwarna coklat yang telah dibudidayakan antara lain:
Hisex Brown, Hiline Brown, Ross Brown, Enya Red, Lohman Brown, Isa Brown,
Rosella dan Austra White. Appleby et al. (2004) menyatakan bahwa nenek moyang dari unggas domestik adalah Gallus gallus (the red jungle fowl atau ayam hutan merah). Sedangkan asal usul dan domestikasi dari spesies utama pada unggas dimulai dengan Galliformes.
Klasifikasi
Klasifikasi ayam domestikasi termasuk dalam Kingdom: Animalia, Filum:
Chordata, Kelas: Aves, Ordo: Galliformes, Famili: Phasianidae, Genus: Gallus
dan Spesies: Gallus gallus (Brotowidjoyo 1989). Menurut Chan dan Zamroni
10 menjadi tiga tipe yaitu: (1) ayam pedaging; (2) ayam petelur; (3) ayam dwiguna. Ciri-ciri ayam tipe petelur menurut Chan dan Zamroni (1992); Sundaryani dan Santosa (1994) adalah ayam petelur mempunyai ukuran badan lebih kecil dibanding ayam pedaging dan langsing sehingga disebut tipe ringan. Ayam petelur aktif bergerak untuk mencari makan dan lebih cepat mengalami dewasa kelamin sehingga cepat bertelur serta memiliki kaki yang bersih tanpa bulu. Makanan yang dimakan tidak banyak dan efisien sekali dalam memetabolisme makanan menjadi hasil produksi (telur). Bertelur dalam jumlah telur banyak dengan telur berwarna putih serta telur jarang dierami.
Menurut Rasyaf (2003) ayam ras petelur dapat dibagi dua berdasarkan warna bulu dan warna kerabangnya (kulit telur). Pertama, ayam petelur putih memiliki bulu dan telur berwarna putih, tubuhnya ramping, mata bersinar tajam, jengger tunggal berwarna merah darah. Ayam ini mampu bertelur banyak sekali dan dikenal sebagai ayam ras tipe petelur unggul. Kedua, ayam ras petelur berbulu coklat dan warna kerabangnya juga coklat. Ayam ini agak gemuk, telur lebih besar tetapi dari segi jumlah lebih sedikit. Ayam petelur semacam ini dikenal juga sebagai ayam petelur tipe dwiguna, awalnya digunakan sebagai penghasil telur dan setelah diafkir dapat dijual sebagai ayam pedaging.
Produktivitas
Ayam ras petelur mulai bertelur pada umur 22 minggu dengan lama produksi sekitar 15 bulan. Produksi telur mencapai puncak pada kisaran umur 32-36 minggu dan akan mengalami penurunan dengan perlahan sampai menjelang afkir pada saat ayam berumur 82 minggu dengan rataan produksi 55%. Daya produksi ayam petelur rata-rata 20 butir telur perbulan perekor selama periode satu tahun pertama masa produksi (Karo Karo 2007)
11 mengakibatkan produksi telur menurun. Jenis ayam yang tahan terhadap perubahan tersebut adalah jenis ayam dwiguna.
Staphylococcus aureus
Staphylococcus aureus merupakan spesies dari genus Staphylococcus yang
bersifat pathogen. Nama Staphylococcus berasal dari kata staphylo yang dalam
bahasa Yunani berarti anggur, ini dikarenakan sifatnya yang membelah diri tidak hanya pada satu lapis permukaan dan tersusun bergerombol sehingga terlihat
menyerupai rangkaian anggur. Staphyloccocus aureus merupakan bakteri gram
positif, dibawah mikroskop mereka nampak seperti putaran (cocci) dan terlihat seperti seikat buah anggur (Gambar 2). Umumnya bakteri ini tidak berbahaya dan merupakan mikroflora normal di selaput lendir dan kulit manusia dan organisme yang lain (Jawetz et al. 1996).
Menurut Pratama (2005) Staphylococcus aureus tumbuh optimum pada
temperatur 35-40oC tetapi dapat tumbuh pada kisaran suhu 6,5-46oC, sedangkan
pH optimum untuk pertumbuhannya adalah 7,0-7,5 dengan kisaran pH yang
memungkinkan pertumbuhan antara 4,2-9,3. Staphylococcus aureus adalah
bakteri aerob dan anaerob, fakultatif yang mampu menfermentasikan manitol dan menghasilkan enzim koagulase, hyalurodinase, fosfatase, protease dan lipase.
Staphylococcus aureus memiliki pigmen berwarna kuning keemasan,
kuman ini diduga memiliki banyak strain patogenik dan beberapa strain
nonpatogen. Strain Staphylococcus berkemungkinan besar bersifat patogen
apabila memiliki pigmen, bersifat hemolitik, memiliki enzim koagulase (koagulase positif), memfermentasi manitol dan laktosa dalam suasana alkalis dan mempunyai kemampuan untuk tumbuh dalam media yang mengandung Kristal
violet. Dilihat dari struktur antigeniknya Staphylococcus aureus memiliki
polisakarida dan protein yang bersifat antigenik. Protein A salah satu komponen
pada permukaan sel Staphylococcus aureus mempunyai kemampuan untuk
12
Klasifikasi
Secara morfologi Staphylococcus berbentuk bundar (kokus) atau agak
lonjong dengan diameter 0,5-1,5µm. Mikroba ini digolongkan bakteri gram positif, bersifat aerobik dan anaerobik fakultatif, tidak motil dan tidak membentuk spora (Jawetz et al. 1996). Klasifikasi Staphylococcus aureus menurut Capuccino (2001) adalah termasuk Kingdom: Bakteria, Divisi: Firmicutes, Kelas: Bacilli, Ordo: Bacillales, Famili: Staphylococcaceae, Genus: Staphylococcus dan Spesies:
Staphylococcus aureus.
Patogenitas
Staphylococcus dapat menyebabkan penyakit dengan dua cara yaitu
pertama, Staphylococcus menyebabkan penyakit dengan cara menginvasi,
memperbanyak diri dan menyebar pada jaringan tubuh. Kedua, Staphylococcus
dapat menimbulkan penyakit melalui substansi ekstraseluler yang dihasilkannya, diantarannya adalah eksotosin, leukosidin, enterotoksin dan enzim koagulase. Menurut Pratama (2005) toksin yang dibentuk oleh Staphylococcus aureus adalah haemolysin alfa, beta, gamma delta dan apsilon. Toksin lain ialah leukosidin, enterotoksin dan eksfoliatin. Enterotosin dan eksoenzim dapat menyebabkan keracunan makanan terutama yang mempengaruhi saluran pencernaan. Leukosidin menyerang leukosit sehingga daya tahan tubuh akan menurun. Selain itu ada juga substansi lain yang dihasilkan seperti hialuronidase, staphilokinase,
penisilinase, proteinase dan lipase. Staphylococcus aureus mengandung
lysostaphin yang dapat menyebabkan lisisnya sel darah merah (Jawetz et al.
1996).
Patogenitas pada Staphylococcus merupakan efek kombinasi dari substansi ektraseluler dan toksin yang dihasilkan dengan kemampuan invasi dari
Staphylococcus. Pada kulit infeksi dari Staphylococcus aureus dapat
13 Prevalensi mikroba ini amatlah tinggi pada kasus mastitis sapi (Hidayattullah 1999). Keracunan makanan juga dapat terjadi akibat tercemarnya makanan oleh
toksin yang dihasilkan galur-galur toksigenik Staphylococcus aureus
(Hidayattullah 1999).
Wibawan et al. (2003) menyatakan bahwa protein permukaan bertanggung
jawab atas sifat adhesif Staphylococcus antigen permukaan pada Staphylococcus
aureus seperti polisakarida, dinding sel, produk seluler dan protein permukaan merupakan faktor virulensi yang berperan dalam ptogenesis infeksi kuman pada inang. Bakteri ini memiliki sejumlah determinan virulensi yaitu dinding sel, kapsul polisakarida, protein permukaan, sejumlah enzim ekstraseluler dan eksotoksin seperti toksin A, B , D, G, leukosidin dan enterotoksin serta enzin
ekstraseluler seperti koagulase dan protease (Cifrian et al. 1996). Staphylococcus
aureus dapat menyebabkan penyakit yang beragan pada manusia dan hewan lain
melalui invasi atau produksi toksin. Toksin Staphylococcus aureus biasanya
menyebabkan keracunan pada makanan.
Salah satu spesies Staphyloccocus yang patogen adalah Staphylococcus
aureus bakteri ini dapat menginfeksi luka dan menyebabkan lesi supuratif, mastitis, artritis dan botriomikosis pada kambing. Pada kuda, bakteri ini menimbulkan pyoderma infeksi traktus urinarius dan diskospondilitis. Pada anjing bakteri ini menyebabkan bumblefoot, lesi kulit serta arthritis pada ayam (Carlton dan Charles 1993). Bakteri ini dapat bertahan di permukaan yang kering, sehingga dapat kesempatan untuk transmisi.
Pada manusia sehat bakteri ini secara normal terdapat dalam hidung dan
kulit dengan proporsi yang berbeda. Staphylococcus aureus merupakan bakteri
14 Gambar 2 Bakteri Staphylococcus aureus.
(Sumber: Matt 2008)
15
Mekanisme Tanggap Kebal Inang Definisi
Sistem tanggap kebal merupakan kemampuan tubuh untuk mengenali dan menghancurkan bahan yang dianggap asing. Sistem ini mempunyai kemampuan untuk membedakan antara unsur dasar tubuh normal dan benda asing, hal ini sangat penting jika tubuh ingin mempertahankan diri bebas dari serangan mikroorganisme dan parasit (Tizard 2009).
Sekelompok jaringan termasuk leukosit dan system retikulositendotelia secara terus-menerus melawan setiap agen infeksi yang mencoba menyerang tubuh. Dalam menjalankan tugasnya untuk mencegah infeksi, jaringan mempunyai 2 respon yaitu : menghancurkan agen penyerang dengan fagositosis dan membentuk antibodi dan limfosit spesifik yang disensitifkan, salah satu atau keduanya akan menghancurkan penyerang (Guyton dan Hall 1997).
Respon imun yang pertama dapat digolongkan sebagai respon nonspesifik, sedangkan yang kedua respon spesifik. Jadi secara umum respon imun dapat digolongkan menjadi respon nonspesifik yaitu respon yang diperantarai sel-sel fagositik dan respon imun yang spesifik yaitu sistem kekebalan yang bersifat
spesifik mengenali dan menghancurkan antigen yang spesifik (Campbell et al.
1994).
Sel Leukosit Sebagai Sistem Kekebalan
Sel leukosit atau sel darah putih merupakan unit mobil dari sistem pertahanan tubuh. Terdapat 6 jenis sel darah putih yang normal berada dalam peredaran darah, yaitu netrofil, eosinofil, basofil, monosit, limfosit dan sel plasma (Guyton dan Hall 1997). Netrofil, eosinofil dan basofil disebut sebagai sel granulosit karena mempunyai granula di sitoplasmanya, sedangkan monosit dan limfosit disebut sebagai sel agranulosit karena tidak memiliki granula di sitoplasmanya (Tizard 2009; Guyton dan Hall 1997).
16 tetapi tidak mampu bertahan lama. Sistem yang kedua, sistem fagositik mononukleus, terdiri dari sel yang bekerja lebih lambat tetapi mampu melakukan fagositosis berulang-ulang kali. Tidak seperti sistem myeloid, sel fagositik mononukleus mampu mengolah antigen untuk kemudian dipergunakan dalam sistem tanggal kebal spesifik (Tizard 2009).
Sel utama yang berperan dalam sistem myeloid adalah sel granulosit netrofil (Tizard 2009). Netrofil merupakan garis pertahanan penting dalam sistem fagositik. Secara morfologi netrofil memiliki apparatus golgi dan beberapa mitokondria tetapi tidak memiliki ribosom atau retikulum endoplasmik kasar. Netrofil memiliki cadangan energi yang terbatas dan tidak dapat diisi kembali sehingga kemampuan fagositosisnya terbatas (Tizard 2009). Netrofil umumnya hanya melakukan satu kali fagositosis dengan kapasitas antara 5-20 partikel bakteri sebelum netrofil itu sendiri menjadi tidak aktif dan mati (Guyton dan Hall 1997). Pada manusia dan karnivora, netrofil merupakan bagian terbesar dari populasi sel darah putih (Tizard 2009; Guyton dan Hall 1997).
Sel yang mempunyai peranan kedua dalam sistem myeloid ialah eosinofil. Granula pada sitoplasma eosinofil berwarna kuat dengan pewarnaan eosin. Eosinofil tidak seefisien netrofil dalam fagositosis, tetapi eosinofil memiliki fungsi istimewa, yang pertama mempunyai kemampuan untuk menghancurkan larva cacing yang menyusup. Kedua , enzim dari eosinofil mampu menetralkan factor radang yang dilepas oleh sel mast dan basofil. Sel ketiga pada sistem myeloid adalah basofil. Basofil memiliki inti yang bulat atau oval dengan banyak granula kecil berwarna gelap yang terwarnai kuat dengan zat warna yang bersifat basofilik seperti hematoksilin. Fungsi dari basofil serupa dengan yang dimiliki sel mast, yaitu untuk membangkitkan perbarahan akut pada tempat deposisi antigen (Tizard 2009).
17 dari limfosit T makrofag yang aktif akan bermigrasi sebagai respon terhadap ransangan kemotaktik. Selanjutnya menelan dan membunuh bakteri melalui proses yang umumnya serupa dengan neutrofil (Ganong 2003).
Selain sistem sel fagositik, mekanisme lain dari sistem kekebalan oleh sel darah putih diperantarai oleh sel limfosit. Limfosit merupakan unsur kunci dari sistem kekebalan tubuh. Pada mamalia, sistem ini memiliki kemampuan yang menonjol dalam menghasilkan antibodi terhadap berjuta zat asing berlainan yang menyusup dalam tubuh (limfosit B). Disamping itu, sistem kekebalan ini memiliki kemampuan untuk mengingat sehingga pada pemaparan yang kedua kalinya oleh senyawa asing yang sama akan menghasilkan respon yang lebih cepat dan hebat, aktifitas ini dilakukan oleh sel limfosit T pembantu (Ganong 2003).
Sistem Kekebalan Pada Unggas
Sistem imun pada unggas tidak jauh berbeda dengan sistem imun pada mamalia. Imunitas spesifik berkaitan dengan kemampuan dalam mengenal serta merespon antigen tertentu melalui dua mekanisme interaksi yaitu respon humoral
dan seluler (Arstila et al. 1994). Ayam yang diimunisasi dengan antigen spesifik
akan memproduksi antibodi spesifik terhadap antigen tersebut dalam jumlah banyak dan akan ditransfer ke kuning telur. Vertebrata tingkat rendah (reptil, amphibi dan burung) menghasilkan imunoglobulin Y (IgY) yang ditransfer dari serum darah ayam ke kuning telurnya agar keturunannya mendapatkan imunitas. Proses transfer IgY pada keturunannya melalui dua tahap; pertama, IgY ditransfer dari serum ke kuning telur yang analog dengan transfer antibodi melalui plasenta pada mamalia, kedua transmisi IgY dari kantung embrio yang sedang berkembang. Konsentrasi IgY pada telur yang telah matang sebesar 10-20 mg/ml (Carlender 2002).
18 antibodi. Timus adalah pusat pematangan tali pusat yang berdiferensial menjadi limfosit T. Aktifitas limfosit T pada unggas sama dengan aktifitas limfosit T pada mamalia (Larsson et al. 1998).
Sel fagositik memiliki sistem yang saling komplemen yaitu sistem myeloid dan sistem fagositik mononuklear. Pada sistem myeloid sel-sel yang berperan adalah sel-sel yang dapat bekerja dengan cepat tetapi tidak mampu bertahan lama, yaitu neutrofil (disebut heterofil dalam darah unggas), eosinofil dan basofil. Sedangkan sistem pertahanan fagositik mononuklear dilakukan oleh sel monosit. Sel monosit bekerja lebih lambat tetapi mampu bertahan dengan melakukan fagositosis berulang-ulang (Tizard 2009).
Heterofil unggas memiliki fungsi yang sama seperti neutrofil mamalia dan merupakan leukosit dominan dalam respon peradangan hematologis ataupun di jaringan. Heterofil juga merupakan sel fagosit jaringan yang penting untuk melawan mikroba patogen (Stedman 2001). Heterofil merupakan sel utama yang berperan dalam sistem myeloid dan disebut juga sel granulosit polimorfonuklear. Heterofil merupakan sistem pertahanan pertama dari invasi benda asing dalam tubuh. Heterofil berfungsi terutama untuk fagositosis (Tizard 2009). Heterofil dalam tahap kemotaksis akan menuju bahan asing melalui pengaruh rangsangan kimiawi eksternal. Rangsangan kimiawi tersebut dapat berupa produk bakteri, faktor-faktor yang dilepaskan oleh sel rusak atau produk reaksi kebal (Tizard 2009). Sebuah sel heterofil mampu memfagosit 5-20 bakteri sebelum sel heterofil itu sendiri menjadi inaktif dan mati (Guyton dan Hall 1997).
19 Faktor-faktor yang mempengaruhi terbentuknya antibodi diantaranya adalah umur hewan percobaan yang digunakan, ukuran molekul antigen, kerumitan struktur kimiawi antigen, konstitusi genetik, metoda pemasukan antigen dan dosis yang diberikan (Subowo 1993).
Imunomodulator
Imunomodulator berasal dari kata imuno yang berarti kekebalan dan modulator yang berarti pembawa. Imunomodulator adalah suatu agen atau zat yang dapat membawa, merangsang atau menyiapkan sistem pertahanan tubuh (Fitriani 2000). Zat tersebut dapat memiliki kemampuan memperbaiki dan merangsang sistem imun bila terganggu atau dapat menekannya bila berlebihan. Menurut Imanishi (1993) menyatakan bahwa efek imunomodulator yang dimiliki oleh suatu obat mengandung dua pengertian yaitu pertama imunomodulator positif (imunostimulan), bila obat tersebut dapat meningkatkan respon kekebalan. Kedua imunomodulator negatif (imunodepresan), bila obat tersebut dapat menurunkan respon kekebalan.
20
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai dari bulan September 2007 sampai dengan Agustus 2008, bertempat di Laboratorium Patologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat Bahan
Bahan yang digunakan dalam penelitian adalah ekstrak etanol temulawak, ekstrak meniran komersial, larutan Giemsa, kloroform, NaCl fisiologis, THB
(Todd Hewitt Broth), metanol, larutan BaSO4 10% (620 nm), kapur putih, minyak
emersi, kapas, label dan pakan ayam yang mengandung coccidiostat, bakteri Staphylococcus aureus nonprotein A dan hewan penelitian berupa ayam petelur strain Isa Brown umur 16 minggu yang telah divaksinasi AI.
Alat
Peralatan yang digunakan dalam penelitian meliputi kandang ayam, timbangan, gunting, pinset, syring 1 ml, peralatan untuk nekropsi serta pembuatan preparat ulas berupa gelas objek, gelas penutup dan pipet serta mikroskop cahaya untuk pengamatan.
Hewan Penelitian
Penelitian ini menggunakan ayam petelur yang berumur 16 minggu dengan bobot badan yang seragam. Sebelum perlakuan dimulai, diadakan masa adaptasi selama 7 hari untuk mengembalikan kondisi ayam dari stres karena pemindahan dan transportasi. Selama masa ini diberikan vitamin dan elektrolit (Nopstress
VitaminTM) lewat air minum sesuai dengan rekomendasi pabrik pembuat.
21 sebanyak 3 ekor. (2) kelompok ayam yang divaksin AI dan diberi ekstrak meniran komersial, sebagai kontrol positif, dengan distribusi ayam sebanyak 3 ekor. (3) kelompok ayam yang divaksin AI dan diberi ekstrak temulawak (dengan 3 tingkat dosis yang berbeda), dengan distribusi ayam sebanyak 18 ekor. Selama percobaan, pemberian pakan dan minum sesuai dengan perlakuan di peternakan ayam komersil.
Isolat Bakteri
Pada penelitian ini untuk membantu mendeteksi aktivitas dan kapasitas fagositosis dari sel fagosit (makrofag), dilakukan uji tantang dengan menggunakan bakteri Staphylococcus aureus nonprotein A yang disuntikan secara intraperitoneal.
Metode Penelitian Persiapan kandang
Kandang ayam percobaan dibuat menurut sistem baterai. Seluruh dinding dan lantai ruangan percobaan dikapur dengan kapur tembok berwarna putih, didesinfeksi dengan desinfektan kelompok fenol sintetik dua hari sebelum ayam percobaan dimasukkan.
Pembuatan Ekstrak Etanol Temulawak
Pembuatan ekstrak temulawak menggunakan metode maserasi. Jenis pelarut ekstrak temulawak yang digunakan terdiri dari 2 jenis etanol dengan konsentrasi berbeda yaitu etanol 70% dan 96%. Etanol dipakai karena relatif aman untuk makanan. Sebelumnya dibuat terlebih dahulu simplisia rimpang temulawak. Selanjutnya simplisia temulawak direndam dengan pelarut etanol dan aquabidest menggunakan perbandingan 1:10. Selama perendaman, campuran ini diaduk setiap 3 jam selama 24 jam. Kemudian campuran ini diperas untuk memisahkan larutan dan ampasnya. Setelah itu pelarut untuk ekstraksi dipisahkan kembali
dengan penguapan menggunakan pompa vakum evaporator pada suhu 50 oC
22 17,5; 35 dan 52,5 mg/kg BB. Dosis didapat dari hasil uji aktivitas biologik fraksi bioaktif pada penelitian sebelumnya.
Preparasi Suspensi Bakteri Staphylococcus aureus nonprotein A
Inokulasi bakteri dilakukan dua hari sebelum hewan percobaan ditantang dan persiapan suspensi dilakukan satu hari menjelang proses tantang. Bakteri
Staphylococcus aureus yang sebelumnya sudah disiapkan, diinokulasikan dari kulturnya ke dalam 1000 ml THB, kemudian diinkubasi dalam inkubator pada
suhu 37 oC selama 24 jam. Setelah 24 jam, biakan tersebut disentrifus selama 10
menit dengan kecepatan 1500 rpm sampai terbentuk pelet. Pelet yang terbentuk diambil dan disuspensikan kembali dengan NaCl fisiologis steril sampai sepersepuluh volume awal. Suspensi bakteri kemudian disentrifus kembali sampai terbentuk pelet, dibilas dan disuspensikan dengan NaCl fisiologis steril sampai mencapai volume 100 ml. Suspensi bakteri disetarakan dengan larutan
BaSO4 10% pada panjang gelombang 620 nm menggunakan spektrofotometer,
sehingga diharapkan suspensi bakteri setara dengan konsentrasi 109 partikel
bakteri per ml suspensi. Suspensi tersebut disimpan pada suhu 4 oC sampai pada
hari penginfeksian hewan percobaan.
Pemberian Vaksin AI
Vaksin AI komersial yang secara legal telah mendapat persetujuan pemerintah digunakan dalam penelitian ini. Dosis yang digunakan sesuai dengan petunjuk pabrik pembuat. Sebelum mendapat suntikan vaksin, semua ayam dipastikan harus dalam keadaan sehat.
Pemberian Perlakuan Terhadap Hewan Percobaan
23 ketiga diberikan pencekokan ekstrak temulawak secara oral dengan dosis 52,5 mg/kg BB dengan pelarut etanol 70%. Perlakuan keempat diberikan pencekokan ekstrak temulawak secara oral dengan dosis 17,5 mg/kg BB dengan pelarut etanol 96%. Perlakuan kelima diberikan pencekokan ekstrak temulawak secara oral dengan dosis 35 mg/kg BB dengan pelarut etanol 96%. Perlakuan keenam diberikan pencekokan ekstrak temulawak secara oral dengan dosis 52,5 mg/kg BB dengan pelarut etanol 96%. Perlakuan ketujuh diberikan pencekokan meniran komersial secara oral dengan dosis 0.2 cc/kg BB sebagai kontrol positif. Perlakuan kedelapan diberikan pencekokan NaCl fisiologis secara oral dengan dosis 0.5 cc/kg BB sebagai kontrol negatif.
Pemeriksaan Aktivitas dan Kapasitas Fagositosis
Pengamatan aktivitas dan kapasitas fagositosis secara in vitro, dilakukan
langkah sebagai berikut dilakukan pada 24 jam setelah perlakuan ekstrak temulawak terakhir, semua ayam percobaan ditantang dengan bakteri Staphylococcus aureus non A sebanyak 1 ml suspensi bakteri (109 partikel bakteri/ml) melalui intraperitoneal. Setelah 1 jam, ayam-ayam percobaan disembelih, dipanen cairan peritoneal, dibuat preparat ulas, dikeringkan, difiksasi dengan metanol selama 3 menit, diwarnai dengan Giemsa, lalu dihitung aktivitas dan kapasitas fagositosis makrofag peritoneal.
Variabel Pengamatam Aktivitas Fagositosis
Aktivitas fagositosis adalah jumlah makrofag yang aktif melakukan proses fagositosis dalam 50 makrofag yang diamati, dan dinyatakan dalam persen. Penghitungan dilakukan sebanyak 2 kali (duplo).
Kapasitas Fagositosis
24
Rancangan Percobaan
Penelitian ini bertujuan untuk mengamati interaksi dan pengaruh dari ekstrak temulawak terhadap aktivitas dan kapasitas fagositosis sel makrofag peritoneal dari hewan ayam petelur. Rancangan yang digunakan adalah rancangan acak lengkap (RAL) yang terdiri dari 8 perlakuan dosis dimana masing-masing
perlakuan diulang sebanyak 2 kali yaitu : (1) A1B1 = dosis 17,5 mg/kg BB pelarut
etanol 70%, (2) A2B1 = dosis 35 mg/kg BB pelarut etanol 70%, (3) A3B1 = dosis
52,5 mg/kg BB pelarut etanol 70%, (4) A1B2 = dosis 17,5 mg/kg BB pelarut
etanol 96%, (5) A2B2 = dosis 35 mg/kg BB pelarut etanol 96%, (6) A3B2 = dosis
52,5 mg/kg BB pelarut etanol 96%, (7), K1 = kontrol positif dan (8) K2 = kontrol
negatif.
Model Rancangan Acak Lengkap (RAL) faktor tunggal menurut Gaspersz (1991) adalah sebagai berikut:
dengan
Yij =Nilai pengamatan pada satuan percobaan ke-j yang memperoleh
kombinasi perlakuan ke-i µ = Nilai tengah umum
τi = Pengaruh perlakuan ke-i
εij = Pengaruh galat percobaan ke-j yang memperoleh kombinasi perlakuan
ke-i
25
HASIL DAN PEMBAHASAN
Aktivitas Fagositosis
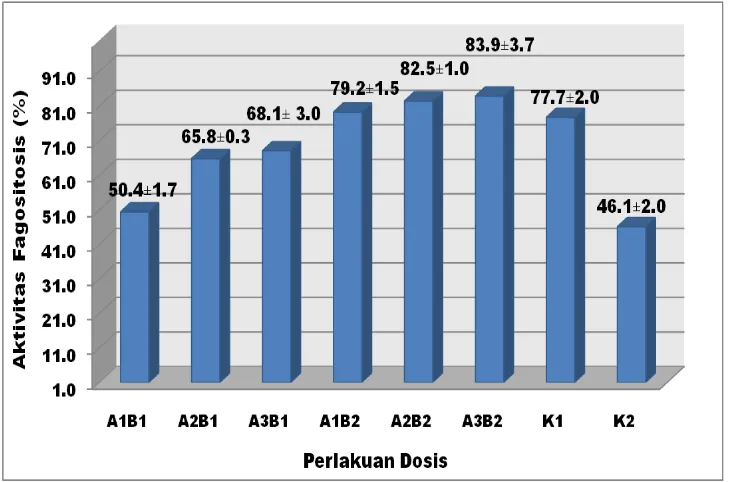
Hasil pengamatan aktivitas fagositosis (%) dari makrofag peritoneal ayam petelur bervariasi dengan nilai antara 44,2-87,9%. Rata-rata aktivitas fagositosis pada masing-masing dosis ditunjukkan pada Gambar 4.
Gambar 4 Aktivitas fagositasis makrofag peritonial ayam petelur rata-rata pada ayam petelur yang diberikan dosis ekstrak etanol temulawak secara bertahap selama 4 minggu.
Keterangan: A1 = dosis 17,5 mg/kg BB, A2 = dosis 35 mg/kg BB, A3 = dosis 52,5
mg/kg BB, B1 = pelarut etanol 96%, B2 = pelarut etanol 96%, K1 =
kontrol positif dan K2 = kontrol negatif.
[image:39.595.131.496.233.474.2]26 Hasil analisis ragam (Lampiran 1) menunjukkan bahwa dosis ekstrak etanol temulawak berpengaruh nyata (p<0,01) terhadap aktivitas fagositosis sel makrofag peritonial ayam petelur. Hasil uji Duncan (Lampiran 2) menunjukkan
bahwa tidak ada perbedaan nyata (p>0,01) antara perlakuan K2 dengan perlakuan
A1B1, namun terdapat perbedaan nyata (p<0,01) perlakuan A1B2, perlakuan A2B2,
perlakuan A2B1, perlakuan A3B1, perlakuan K1 dan perlakuan A3B2. Hal ini
menunjukkan bahwa perlakuan perlakuan K2 akan memberikan aktivitas
fagositosis makrofag yang relatif sama dengan perlakuan A1B1, namun relatif
berbeda dengan perlakuan A1B2, perlakuan A2B2, perlakuan A2B1, perlakuan
A3B1, perlakuan K1 dan perlakuan A3B2.
Analisis ragam menggunakan rancangan faktorial dengan rancangan dasar rancangan acak lengkap dilakukan untuk melihat pengaruh jumlah ekstrak, konsentrasi pelarut etanol serta interaksinya terhadap aktivitas fagositosis sel makrofag peritonial ayam petelur (Lampiran 3). Hasil analisis ragam menunjukkan bahwa ada pengaruh jumlah ekstrak, konsentrasi pelarut dan interaksinya terhadap aktivitas fagositosis sel makrofag peritonial ayam petelur. Hal ini juga menunjukkan bahwa ada perbedaan nyata (p<0,01) aktivitas fagositosis sel makrofag peritoneal akibat adanya perbedaan konsentrasi pelarut etanol yang digunakan sebagaimana yang ditunjukkan pada Lampiran 4 yang mengindikasikan bahwa penggunaan ekstrak temulawak dengan menggunakan pelarut etanol 96% akan menghasilkan aktivitas fagositosis yang lebih tinggi dibandingkan pelarut etanol 70%. Hal ini disebabkan oleh semakin tingginya zat bioaktif terutama kurkuminoid (kurkumin), flavonoid, minyak atsiri, golongan
terpena dan terpenoid seperti α-pinena dan β-pinena yang terlarut dengan semakin tingginya konsentrasi pelarut etanol. Hal ini juga sesuai dengan Paryanto dan Bambang (2006) bahwa semakin tinggi konsentrasi etanol dalam pelarut maka kadar kurkuminoid (kurkumin) dalam ekstrak semakin tinggi.
27 akan memberikan aktivitas fagositosis sel makrofag peritonial ayam petelur yang relatif sama dengan dosis ekstrak etanol temulawak 35 mg/kg BB namun relatif berbeda dengan dosis ekstrak etanol temulawak 17,5 mg/kg BB.
Berdasarkan hasil uji juga menunjukkan bahwa dosis ekstrak etanol temulawak 52,5 mg/kg BB dan 35,0 mg/kg BB akan memberikan kekebalan yang tinggi dibandingkan dengan 17,5 mg/kg BB, karena menunjukkan aktivitas fagositosis sel makrofag peritonial yang relatif tinggi dibanding dengan dosis ekstrak yang lain. Semakin tinggi dosis ekstrak temulawak akan memungkinkan jumlah zat bioaktif terlarut yang menyebabkan semakin tinggi pula aktivitas fagositosis sel makrofag peritonial. Semakin tinggi dosis ekstrak etanol temulawak akan meningkatkan jumlah zat bioaktif yang bersifat imunomodulator (imunostimulator) yang larut dalam dosis. Beberapa zat ekstraktif yang memiliki sifat bioaktif adalah dari golongan flavonoid, saponin, alkaloid dan golongan
tepena dan terpenoid (Robinson 1991). Hasil penelitian Kusmardi et al. (2006)
dan Kusmardi et al. (2007) menunjukkan bahwa kandungan flavonoid pada
ekstrak etanol daun Johar (Cassia siamea Lamk) dan ekstrak ketepeng cina (Cassia alata L) dapat meningkatkan aktivitas fagositosis sel makrofag pada mencit.
Temulawak merupakan jenis tanaman yang telah dimanfaatkan sebagai tanaman obat. Menurut Sugiharto (2004) bahwa komponen utama rimpang temulawak adalah kurkumin, minyak atsiri, flavonoid, pati, gula, protein, lemak, serta beberapa kation (Fe, Ca, Na dan K). Santosa dan Gunawan (2003)
melaporkan bahwa rimpang remulawak mengandung minyak atsiri, mirsen, α
-felandren, kurkumin, atlanton, β-kurkumin, borneol, d-kmafer,
desmetoksikurkumin, isofuranogermakren, I-sikloisoprenmirsen, monodesmetoksi kurkumin, p-toluil metal karbinol, amilum, turmeron, xanthorizol, zingiberen dan zingiberol. Senyawa minyak atsiri yang terkandung dalam rimpang temulawak ini
adalah α-pinena, kamfena, β-pinena, β-mirsena, limonene, β-linalool, DL-kamfor,
isoborneol, β-elemena, α-zingibirena, isokariofilena, β-fernesena, α-kurkumina,
sativena, germakrena dan α-farnesena. Senyawa hasil ekstrak temulawak yang
28
Menurut Majeed et al. (1995), kurkumin
[1,7-bis(4-hidroksi-3-metoksifenil)-1,6-heptadiena-3,5-dion] telah terbukti memberikan efek terhadap aktivitas biologis dengan spektrum yang sangat luas. Aktivitas kurkumin ini
disebabkan oleh adanya gugus hidroksi aromatik terminal, gugus β-diketon dan ikatan rangkap, sehingga memungkinkan kurkumin ini digunakan sebagai antikanker dan antimutagenik. Substitusi kurkumin pada C-4 dengan substituen pendorong elektron (gugus alkil) dan substituen penarik elektron (gugus fenil dan fenil tersubstitusi), mempengaruhi stabilitas tautomer kurkumin. Substituen
pendorong elektron meningkatkatkan stabilitas tautomer β-diketo, sedangkan
substituen penarik elektro meningkatkan stabilitas keto enol kurkumin (Istyastono
et al. (2003). Hal ini diduga akan memberikan efek imunomodulator
(imunostimulator) pada sel makrofag yang ditunjukkan dengan peningkatan aktivitas fagositosis sel makrofag. Hal ini didukung oleh penelitian Supardjan dan
Da’i (2005) melaporkan bahwa gugus pendorong elektron pada C-4 kurkumin
menaikkan aktivitas turunan kurkumin melalui stabilitas struktur β-diketo dan sebaran muatan parsial positif struktur turunan kurkumin.
Kurkumin juga dilaporkan bersifat antibakteri (Sidik et al. 1995; Sugiharto
2004). Selain itu, Sidik et al. (1995) juga melaporkan bahwa gugus metoksi dan
gugus hidroksi fenolat yang terdapat dalam struktur kurkuminoid merupakan gugus aktif dan mempunyai aktivitas antibakteri. Sifat antibakteri dari kurkumin
juga menyebabkan bakteri Staphylococcus aureus lebih mudah terfagosit oleh sel
fagosit peritonial makrofag.
Senyawa flavonoid yang terekstrak dalam pelarut etanol juga memiliki sifat imunomodulator (imunostimulator) sehingga dapat meningkatkan aktivitas fagositosis pada sel peritonial makrofag ayam petelur terhadap serangan bakteri Staphylococcus aureus. Peningkatan aktivitas sel makrofag peritoneal juga disebabkan oleh adanya komponen minyak atsiri dan dari golongan terpena dan
terpenoid seperti α-pinena dan β-pinena yang bersifat antibakteri.
Menurut Johnson et al. (1994) bahwa Staphylococcus aureus merupakan
bakteri yang memiliki dinding yang terdiri dari 50% lapisan peptidoglikan dan memiliki susunan dinding yang kompak. Dinding inilah yang membuat bakteri
29 patogen. Walaupun demikian, pemberian ekstrak etanol temulawak pada ayam
petelur dan diuji tantang dengan bakteri Staphylococcus aureus terbukti dapat
meningkatkan aktivitas fagositosis sel makrofag darah ayam petelur melawan bakteri patogen tersebut dengan cara menangkap, menelan dan menghancurkan bakteri tersebut. Semakin tinggi ekstrak etanol temulawak yang diberikan yang berarti semakin tinggi pula zat bioaktif terutama kurkumin yang terkandung dalam
dosis, maka semakin tinggi pula bakteri Staphylococcus aureus yang difagosit
oleh sel makrofag sebagai akibat peningkatan aktivitas fagositosis pada sel peritonial makrofag ayam petelur.
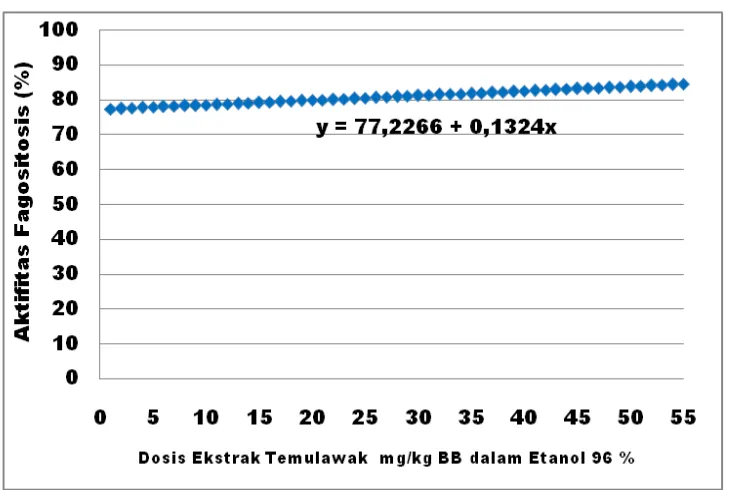
Hasil analisis ortogonal polinomial menunjukkan bahwa peningkatan dosis ekstrak dengan pelarut etanol 70% terhadap aktivitas fagositosis merupakan fungsi kuadratik (Gambar 5), sedangkan pada dosis ekstrak dengan pelarut etanol 96% merupakan fungsi linier (Gambar 6). Persamaan kuadrat hubungan antara dosis ekstrak pelarut 70% dengan aktivitas fagositosis adalah
, sedangkan persamaan linier hubungan antara dosis ekstrak
pelarut 96% dengan aktivitas fagositosis adalah . Hal ini
30 Gambar 5 Kurva respon hubungan dosis ekstrak temulawak dalam pelarut etanol
70% terhadap aktivitas fagositosis makrofag.
[image:44.595.131.497.348.593.2]31
Kapasitas Fagositosis
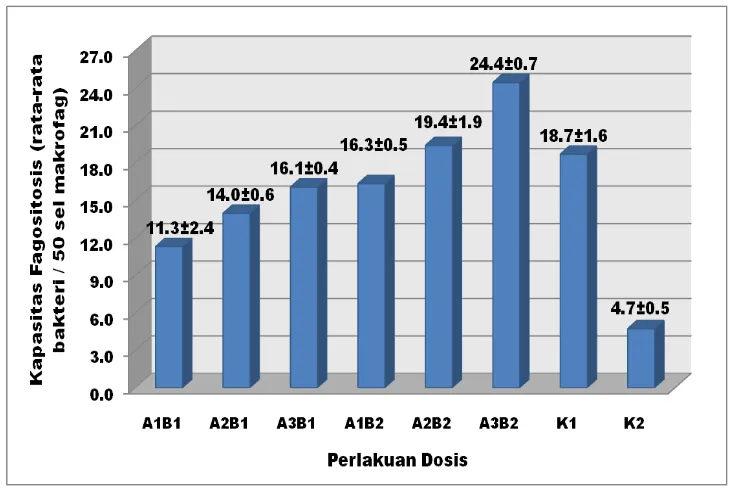
[image:45.595.129.497.186.430.2]Hasil pengamatan kapasitas fagositosis (rata-rata bakteri/50 sel fagosit aktif) dari makrofag peritoneal ayam petelur bervariasi antara 4,3-25,1. Rata-rata kapasitas fagositosis pada masing-masing dosis ditunjukkan pada Gambar 7.
Gambar 7 Kapasitas fagositasis makrofag peritonial ayam petelur rata-rata pada ayam petelur yang diberikan dosis ekstrak etanol temulawak secara bertahap selama 4 minggu.
Keterangan : A1 = dosis 17,5 mg/kg BB, A2 = dosis 35 mg/kg BB, A3 = dosis 52,5
mg/kg BB, B1 = pelarut etanol 70%, B2 = pelarut etanol 96%, K1 =
kontrol positif dan K2 = kontrol negatif.
Berdasarkan Gambar 7 menunjukkan bahwa kapasitas fagositosis makrofag cenderung meningkat dengan meningkatnya dosis ekstrak dan konsentrasi pelarut. Kapasitas fagositosis terendah didapat pada kontrol negatif nilai 4,7 rata-rata bakteri/50 sel fagosit, sedangkan kapasitas fagositosis tertinggi 24,4 rata-rata bakteri/50 sel fagosit didapat pada dosis ekstrak 52,5 mg/kg BB dengan pelarut etanol 96%.
Hasil analisis ragam (Lampiran 6) menunjukkan bahwa jenis dosis ekstrak etanol temulawak berpengaruh nyata (p<0,01) terhadap kapasitas fagositosis sel makrofag peritonial ayam petelur. Hasil uji Duncan (Lampiran 7) menunjukkan
32 A1B1, perlakuan A1B2, perlakuan A2B2, perlakuan A2B1, perlakuan A3B1,
perlakuan K1 dan perlakuan A3B2. Hal ini menunjukkan bahwa perlakuan
perlakuan K2 akan memberikan kapasitas fagositosis makrofag yang relatif
berbeda dengan perlakuan A1B1, perlakuan A1B2, perlakuan A2B2, perlakuan
A2B1, perlakuan A3B1, perlakuan K1 dan perlakuan A3B2.
Analisis ragam menggunakan rancangan faktorial dengan rancangan dasar rancangan acak lengkap dilakukan untuk melihat pengaruh jumlah ekstrak, konsentrasi pelarut etanol serta interaksinya terhadap kapasitas fagositosis sel makrofag peritonial ayam petelur (Lampiran 8). Hasil analisis ragam menunjukkan bahwa ada pengaruh jumlah ekstrak, konsentrasi pelarut dan interaksinya terhadap kapasitas fagositosis sel makrofag peritonial ayam petelur. Hal ini juga menunjukkan bahwa ada perbedaan nyata (p<0,01) kapasitas fagositosis sel fagosit peritonial akibat adanya perbedaan pelarut etanol yang digunakan sebagaimana yang ditunjukkan pada Lampiran 9 yang mengindikasikan bahwa penggunaan ekstrak temulawak dengan menggunakan pelarut 96% akan menghasilkan kapasitas fagositosis yang lebih tinggi dibandingkan pelarut etanol 70%. Hal disebabkan oleh semakin tingginya zat bioaktif terutama kurkuminoid (kurkumin), flavonoid, polisakarida dan minyak
atsiri golongan terpena dan terpenoid seperti α-pinena dan β-pinena yang terlarut dengan semakin tingginya konsentrasi pelarut etanol. Hal ini juga sesuai dengan Paryanto dan Bambang (2006) bahwa semakin tinggi konsentrasi etanol dalam pelarut maka kadar kurkuminoid (kurkumin) dalam ekstrak semakin tinggi.
33 yang relatif tinggi dibanding dengan jumlah ekstrak yang lain. Semakin tinggi dosis ekstrak temulawak akan memungkinkan jumlah zat bioaktif terlarut yang semakin tinggi pula sehingga menyebabkan kapasitas fagositosis sel fagosit peritonial semakin tinggi pula. Semakin tinggi dosis ekstrak etanol temulawak akan meningkatkan jumlah zat bioaktif yang bersifat imunomodulator (imunostimulan) yang larut dalam dosis. Kusmardi et al. (2006) dan Kusmardi et al. (2007) melaporkan bahwa kandungan flavonoid pada ekstrak etanol daun Johar (Cassia siamea Lamk.) dan ekstrak ketepeng cina (Cassia alata Lamk.) memiliki sifat imunomodulator yang dapat meningkatkan kapasitas fagositosis sel makrofag pada mencit.
Menurut Peschel et al. (2006) kurkuminoid (kurkumin) adalah pigmen
kuning dari temulawak yang dapat digunakan sebagai antioksidan, antikarsinogenik dan antihiperkolesterolimea. Berdasarkan hasil penelitian
Suparjdan dan Da’i (2005) menunjukkan bahwa kurkuminoid (curcumin)
memiliki aktivitas biologis berspektrum luas yaitu antikanker, antimutagenik, antiproliferasi, antioksidan dan memacu apoptosis. Pada keadaan normal sel akan menghasilkan radikal bebas sebagai konsekuensi logis pada reaksi biokomia dalam keadaan aerobik. Radikal bebas secara fisiologis akan berperan dalam proses fagositosis, sintesa DNA dan protein. Apabila radikal bebas berada dalam jumlah berlebihan sementara antioksidan seluler tetap atau sedikit maka kelebihannya tidak dapat menetralkan dan dapat berakibat kerusakan sel (Waras 2008).
Kurkumin sebagai antioksidan akan menangkal radikal bebas yang dihasilkan oleh sel dalam keadaan berlebih, sehingga kapasitas fagositosis dapat berjalan secara normal bahkan akan meningkat. Selain sifat imunomodulator, sifat antibakteri dari kurkumin juga menyebabkan sel makrofag peritonial
memfagosit bakteri Staphylococcus aureus yang ditunjukkan meningkatnya
kapasitas sel makrofag. Peningkatan kapasitas fagositosis pada sel peritonial makrofag ayam petelur juga disebabkan oleh keberadaan senyawa flavonoid yang terekstrak dalam pelarut etanol juga memiliki sifat imunomodulator (imunostimulator), sehingga dapat meningkatkan sifat fagositik sel makrofag
34 sel makrofag juga disebabkan oleh adanya komponen minyak atsiri yang bersifat antibakteri sehingga banyak bakteri yang terfagosit.
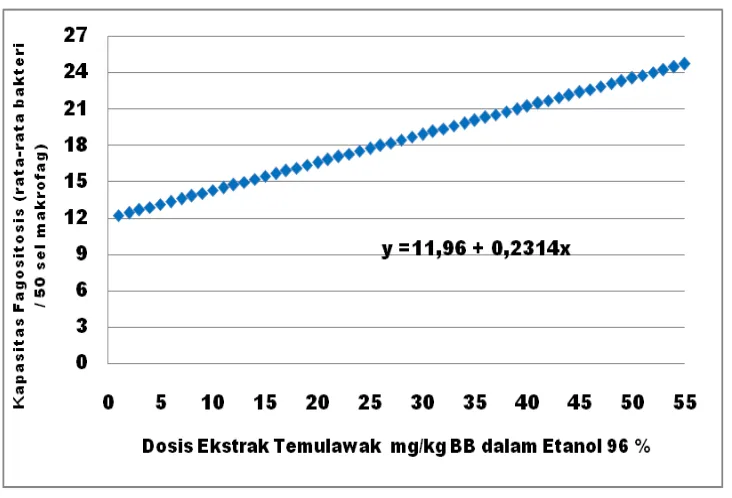
Hasil analisis ortogonal polinomial menunjukkan bahwa pengaruh peningkatan dosis ekstrak terhadap kapasitas fagositosis pada pelarut etanol 70% dan 96% merupakan fungsi linier. Persamaan linier hubungan antara dosis ekstrak pelarut 70% dengan kapasitas fagositosis adalah
(Gambar 8). Hal ini mengindikasikan bahwa kapasitas fagositosis dengan pelarut etanol 70% akan meningkat sebanyak 0,1362% dari peningkatan dosis ekstrak sebanyak 1 mg/kg BB. Persamaan linier hubungan antara dosis ekstrak pelarut
96% dengan nilai kapasitas fagositosis adalah (Gambar
9). Hal ini menunjukkan bahwa kapasitas fagositosis pada pelarut etanol 96% akan meningkat sebanyak 0,2314% dari peningkatan dosis ekstrak sebanyak 1 mg/kg BB.
Mekanisme Temulawak pada Fagositosis
Mekanisme dasar tanggal kebal yang khusus mengatasi infeksi bakteri yaitu berupa netralisasi toksin atau enzim oleh antibodi, pemusnahan bakteri oleh antibodi, komplemen dan lisozim, opsonisasi bakteri oleh antibodi dan komplemen yang mengakibatkan fagositosis dan penghancuran bakteri serta penghancuran intraseluler bakteri oleh makrofag yang teraktivasi. Sel fagositik memiliki sistem yang saling komplemen yaitu sistem myeloid dan sistem fagositik mononuklear. Pada sistem myeloid sel-sel yang berperan adalah sel-sel yang dapat bekerja dengan cepat tetapi tidak mampu bertahan lama, yaitu neutrofil (disebut heterofil dalam darah unggas), eosinofil dan basofil. Sedangkan sistem pertahanan fagositik mononuklear dilakukan oleh sel monosit. Sel monosit bekerja lebih lambat tetapi mampu bertahan dengan melakukan fagositosis berulang-ulang (Tizard 2009).
35 Gambar 8 Kurva respon hubungan dosis ekstrak temulawak dalam pelarut etanol
70% terhadap kapasitas fagositosis makrofag.
[image:49.595.131.497.377.626.2]Gambar

Dokumen terkait