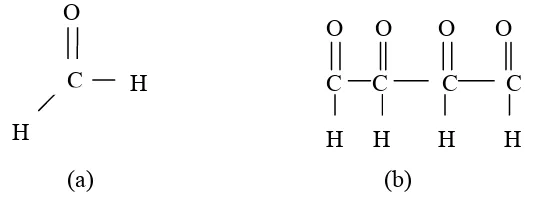DE
Diajuka
PENENT
ESINFEK
SU
an untuk m
Gelar Sa
ROM
PROG
UNI
TUAN KO
KTAN YA
UPERMA
melengka
arjana Fa
Universi
MAULI AN
NI
GRAM ST
FAKU
IVERSITA
OEFISIEN
ANG BER
ARKET K
SKRIPS
api salah s
rmasi pad
itas Suma
OLEH
NNA TER
IM 09150
TUDI SAR
ULTAS FA
AS SUMA
MEDAN
2014
N FENOL
REDAR D
KOTA ME
SI
satu syara
da Fakult
atera Utar
:
RESIA M
01130
RJANA F
ARMASI
ATERA U
N
L PRODU
DI BEBER
EDAN
PENGESAHAN SKRIPSI
PENENTUAN KOEFISIEN FENOL PRODUK
DESINFEKTAN YANG DIPASARKAN DI BEBERAPA
SUPERMARKET KOTA MEDAN
OLEH:ROMAULI ANNA TERESIA MARBUN
NIM 091501130
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal : 08 Februari 2014
Pembimbing I, Panitia Penguji,
Dra. Erly Sitompul, M.Si., Apt. Dr. Ginda Haro, M.Sc., Apt. NIP 195006121980032001 NIP 195108161980031002 Pembimbing II,
Dra. Erly Sitompul, M.Si., Apt. NIP 195304031983032001 Popi Patilaya, S.Si., M.Sc., Apt.
NIP 197812052010121004
Dra. Azizah Nasution, M.Sc., Ph.D., Apt. NIP 195503121983032001
Dra. Masfria, M.S., Apt. NIP 195707231986012001 Medan, April 2014
Fakultas Farmasi
Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena limpahan rahmat kasih dan karuniaNya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Adapun tujuan penelitian ini adalah untuk menetapkan koefisien fenol produk desinfektan dan membandingkan koefisien fenol produk desinfektan yang beredar di Kota Medan, yang merupakan salah satu syarat memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Penulis juga ingin mempersembahkan rasa terima kasih yang tak terhingga kepada Ayahanda Santun Wantoni Marbun dan Ibunda Dewi Sinaga tercinta atas doa dan pengorbanannya dengan tulus dan ikhlas, untuk adik saya Frisca Anna Lidwina Marbun, Gratius Partogi Halomoan Marbun, Santa Lusiana Marbun, dan Gregorian Alfonsus Pardomuan Marbun, serta teman-teman saya yang selalu setia memberi doa, dorongan dan semangat.
Penulis menyadari bahwa skripsi ini masih banyak kekurangannya, oleh karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang farmasi.
Medan, April 2014 Penulis,
Romauli A. T. Marbun
PENENTUAN KOEFISIEN FENOL PRODUK DESINFEKTAN YANG DIPASARKAN DI BEBERAPA SUPERMARKET KOTA MEDAN
ABSTRAK
Produk desinfektan yang dipasarkan di Kota Medan beranekaragam jenisnya dari produsen yang berbeda. Bahan yang terdapat dalam desinfektan tersebut merupakan senyawa fenol dan ammonium kuartener. Kekuatan desinfektan dalam membunuh mikroorganisme perlu dievaluasi untuk menjamin mutu produk. Penelitian ini bertujuan untuk menentukan efektivitas produk desinfektan berdasarkan koefisien fenol.
Uji koefisien fenol produk desinfektan dilakukan secara mikrobiologi terhadap bakteri Salmonella typhi. Larutan desinfektan dibuat dengan pengenceran 1:5, 1:10, 1:20, 1:30, 1:40, dan 1:50 dalam air suling steril. Larutan fenol 5% (b/v) digunakan sebagi pembanding. Pertumbuhan bakteri diamati pada waktu kontak 5, 10, dan 15 menit.
Hasil penelitian menunjukkan bahwa koefisien fenol produk A, B, C, D, E, F, dan G masing-masing adalah 2,38; 2,00; 3,00; 3,38; 2,38; 2,63; dan 3,00. Analisis statistik menggunakan uji Kruskal-Wallis menunjukkan bahwa mutu produk desinfektan tersebut berbeda secara signifikan (p < 0,05). Penelitian ini menunjukkan bahwa produk A, B, C, D, E, F, dan G yang dipasarkan di beberapa supermarket Kota Medan memenuhi persyaratan aktivitas desinfektan. Produk D yang mengandung asam klorida memiliki aktivitas yang paling kuat dibandingkan produk desinfektan lain.
DETERMINATION OF PHENOL COEFFICIENT OF DISINFECTANT PRODUCTS MARKETED IN SOME SUPERMARKETS OF MEDAN
ABSTRACT
Disinfectant products marketed in Medan vary in types from different manufacturers. Disinfectant ingredients are phenol and quartenary ammonium. Potency of disinfectant for killing microorganisms needs to be evaluated to assure the quality of the products. This study was carried out to determine the effectivity of disinfectant products based on phenol coefficient.
Phenol coefficient testing of disinfectant products was microbiologically performed against Salmonella typhi. The disinfectant solutions were prepared by diluting the sample in sterile distilled water in ratio of 1:5, 1:10, 1:20, 1:30, 1:40, and 1:50. Phenol solution (5%, w/v) was used as disinfectant standard. The growth of bacteria was observed at the exposure time of 5, 10, and 15 minutes.
The results indicated that the phenol coefficient of product A, B, C, D, E, F, and G were 2.38, 2.00, 3.00, 3.38, 2.38, 2.63, and 3.00, respectively. Statistical analysis using Kruskal-Wallis test showed that the quality of desinfectant products was significantly different (p < 0.05). This study revealed that product A, B, C, D, E, F and G marketed in supermarkets of Medan fulfilled the requirement of disinfectant activity. Product D that contain chloride acid had the strongest activity compared the other disinfectant products.
Keyword : disinfectant, phenol coefficient, chloroxylenol, sodium hypochloride, benzalkonium chloride, chloride acid, and pine oil.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Desinfektan ... 5
2.2 Mekanisme Kerja Desinfektan ... 6
2.2.1 Inaktivasi enzim ... 6
2.2.2 Denaturasi protein ... 7
2.2.4 Interkalasi dalam asam deoksiribo nukleat ... 10
2.2.5 Pembentukan khelat ... 11
2.3 Penggologan Desinfektan ... 11
2.3.1 Turunan aldehida ... 11
2.3.2 Turunan alkohol ... 13
2.3.3 Senyawa pengoksidasi ... 14
2.3.4 Turunan fenol ... 15
2.3.5 Turunan ammonium kuartener ... 17
2.3.6 Turunan halogen dan halogenofor ... 18
2.4 Koefisien Fenol ... 18
2.4.1 Uji pembawa (carrier tests) ... 19
2.4.2 Uji suspensi (suspension tests) ... 19
2.4.3 Uji kapasitas (capacity tests) ... 20
2.4.4 Uji praktek (practical tests) ... 21
BAB III METODE PENELITIAN ... 22
3.1 Alat dan Bahan ... 22
3.1.1 Alat-alat ... ... 22
3.1.2 Bahan ... 22
3.2 Mikroorganisme Uji ... 22
3.3 Pengambilan Sampel ... 23
3.4 Prosedur ... .... 23
3.4.1 Penyiapan media ... 23
3.4.3 Pembuatan larutan fenol 5% ... 23
3.4.4 Pembuatan larutan desinfektan uji ... 24
3.4.5 Penetapan koefisien fenol ... 24
3.4.6 Analisis statistik ... 26
BAB IV HASIL DAN PEMBAHASAN ... 27
BAB V KESIMPULAN DAN SARAN ... 33
5.1 Kesimpulan ... 33
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Tabel Halaman 4.1 Tabel uji larutan fenol 5% (b/v) ... 27 4.2 Tabel koefisien fenol berbagai produk desinfektan yang
beredar di kota medan ... 28
DAFTAR GAMBAR
Gambar Halaman
2.1 Reaksi alkilasi pada gugus nukleofil ... ... 7
2.2 Mekanisme denaturasi senyawa merkuri ... 8
2.3 Mekanisme denaturasi senyawa peroksida ... 9
2.4 Formaldehid dan paraformaldehid ... 12
2.5 Glutaraldehid ... 13
2.6 Mekanisme kerja dan sasaran utama desinfektan ... 16
DAFTAR LAMPIRAN
Lampiran Halaman
1. Bagan penyiapan media ... ... 38
2. Bagan pembuatan larutan fenol 5% ... ... 39
3. Bagan penyiapan larutan desinfektan uji ... 39
4. Bagan penetapan koefisien fenol dari fenol baku 5% ... 40
5. Bagan penetapan koefisien fenol desinfektan ... 41
6. Hasil uji koefisien fenol produk desinfektan . ... 42
7. Perhitungan koefisien fenol ... 46
8. Koefisien fenol produk desinfektan ... 50
9. Hasil pemeriksaan produk desinfektan ... 51
10. Analisis statistik menggunakan uji kolmogrov-smirnov ... 52
11. Analisis statistik menggunakan uji kruskal-wallis... ... 53
BAB I PENDAHULUAN
1.1 Latar belakang
Penelitian terhadap jasad renik penyebab penyakit telah menjadi bahan pemikiran selama berabad-abad. Dalam seni Mesir kuno, mumifikasi dilakukan menggunakan balsam yang berisi pengawet alami. Di Perancis dan Inggris, penggunaan desinfektan dikembangkan untuk mengendalikan penyebaran infeksi di rumah sakit. Pada tahun 1987, Kronig dan Paul dengan bantuan Ikeda memperkenalkan karya terkenal mereka mengenai dinamika desinfeksi
yang menyatakan bahwa desinfektan digunakan pada benda mati (Russel and Chopra, 1987; Butcher and Ulaeto, 2010).
Antimikroba sudah banyak dicoba untuk menghilangkan jasad renik yang dapat mencemari benda hidup ataupun benda mati. Bahan antimikroba yang ditemukan memiliki efektivitas yang berbeda-beda dan digunakan untuk tujuan yang berbeda pula. Salah satu jenis antimikroba yang sering digunakan adalah desinfektan (Dwijoseputro, 1982; Jiang, et al., 2010).
atau pembersih, dan tersedia dalam jumlah yang memadai dengan harga yang terjangkau (Eka, 2006; Tafti, et al., 2012).
Pemanfaatan desinfektan secara efektif perlu diketahui kekuatan daya bunuhnya terhadap mikroba dengan menggunakan fenol sebagai pembanding. Fenol adalah salah satu desinfektan yang efektif dalam membunuh kuman. Koefisien fenol adalah perbandingan ukuran keampuhan suatu bahan antimikrobial dibandingkan dengan fenol sebagai standar. Fenol dijadikan pembanding karena fenol sering digunakan untuk mematikan mikroorganisme (Purohit, et al., 2004; Brewer, 2010).
Koefisien fenol yang kurang dari 1 menunjukkan bahwa bahan antimikroba tersebut kurang efektif dibandingkan fenol. Sebaliknya, apabila koefisien fenol lebih dari 1 artinya bahan antimikroba tersebut lebih ampuh daripada fenol. Koefisien fenol ditentukan dengan cara membagi pengenceran tertinggi dari fenol yang mematikan jasad renik dalam sepuluh menit tetapi tidak membunuh dalam lima menit terhadap pengenceran tertinggi bahan antimikroba yang membunuh jasad renik dalam sepuluh menit tetapi tidak dalam lima menit (Purohit, et al., 2004).
Zat-zat antimikroba yang dipergunakan untuk desinfektan harus diuji keefektifannya. Salah satu cara menentukan efektivitas desinfektan adalah dengan melakukan uji koefisien fenol. Uji ini dilakukan untuk membandingkan aktivitas suatu produk desinfektan dengan daya bunuh fenol baku dalam kondisi uji yang sama. Produk desinfektan banyak beredar di pasaran dengan berbagai merek dagang dari produsen yang berbeda pula. Oleh karena itu, efektivitasnya perlu dievaluasi untuk menjamin mutu produk desinfektan (Eka, 2006; Brewer, 2010).
Teknologi produksi dan komposisi produk desinfektan dari masing-masing produsen yang berbeda kemungkinan berpengaruh terhadap aktivitas desinfektan yang dihasilkan. Hal tersebut mendorong dilakukan penelitian lebih lanjut terhadap produk desinfektan yang beredar di beberapa supermarket Kota Medan berdasarkan angka koefisien fenol.
1.2 Perumusan Masalah
Berdasarkan latar belakang yang diuraikan di atas maka perumusan masalahnya adalah:
1. Apakah produk desinfektan yang beredar di beberapa supermarket Kota Medan memenuhi persyaratan aktivitas?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas maka hipotesisnya yaitu:
1. Produk desinfektan yang beredar di beberapa supermarket Kota Medan memenuhi persyaratan aktivitas
2. Produk desinfektan yang beredar di beberapa supermarket Kota Medan memiliki mutu yang tidak sama
1.4 Tujuan Penelitian
Tujuan penelitian adalah:
1. Untuk menetapkan koefisien fenol produk desinfektan yang beredar di Kota Medan
2. Untuk membandingkan koefisien fenol produk desinfektan yang mengandung golongan senyawa kimia yang berbeda yang beredar di Kota Medan
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1. Desinfektan
Desinfektan merupakan bahan kimia yang digunakan untuk mencegah terjadinya infeksi dengan membunuh jasad renik (bakterisid), terutama pada benda mati. Proses desinfeksi dapat menghilangkan 60% - 90% jasad renik. Desinfektan digunakan secara luas untuk sanitasi baik di rumah tangga, laboratorium, dan rumah sakit (Shaffer, 1965; Larson, 2013).
Kriteria suatu desinfektan yang ideal adalah bekerja dengan cepat untuk menginaktivasi mikroorganisme pada suhu kamar, berspektrum luas, aktivitasnya tidak dipengaruhi oleh bahan organik, pH, temperatur, dan kelembaban, tidak toksik pada hewan dan manusia, tidak bersifat korosif, bersifat biodegradable, memiliki kemampuan menghilangkan bau yang kurang sedap, tidak meninggalkan noda, stabil, mudah digunakan, dan ekonomis (Siswandono, 1995; Butcher and Ulaeto, 2010).
sehingga merusak membran sel, mendenaturasi protein, dan menghambat enzim. Pada kadar optimal, senyawa ammonium kuartener menyebabkan sel mengalami lisis sedangkan pada kadar yang lebih tinggi, terjadi denaturasi protein enzim bakteri (Siswandono, 1995; Stevens, 2011).
2.2.3 Mengubah permeabilitas membran sel bakteri
Membran sel berguna sebagai penghalang selektif terhadap zat terlarut dan menahan zat yang tidak larut. Beberapa zat diangkut secara aktif melalui membran, sehingga konsentrasinya dalam sel tinggi. Zat-zat yang terkonsentrasi pada permukaan sel akan mengubah sifat-sifat fisiknya sehingga membunuh dan menghambat sel (Ghanem, et al., 2012).
Perubahan permeabilitas membran sel bakteri merupakan mekanisme kerja fenol, dan senyawa amonium kuartener. Terjadinya perubahan permeabilitas membran sel menyebabkan kebocoran kostituen sel yang esensial sehingga bakteri mengalami kematian (Siswandono, 1995; Butcher and Ulaeto, 2010).
2.2.4 Interkalasi dalam asam deoksiribo nukleat (ADN)
Senyawa Turunan trifenilmetan seperti gentian violet dan akridin seperti akriflavin bekerja sebagai antibakteri dengan mengikat secara kuat asam nukleat. Ikatan ini akan menghambat sintesis ADN sehingga sintesis protein tidak terjadi. Turunan trifenilmetan dan turunan akridin merupakan kation aktif yang dapat membentuk ikatan hidrogen menghasilkan kompleks dengan gugus bermuatan negatif dari konstituen sel. Hal ini menyebabkan penghambatan proses biologi yang penting untuk kehidupan bakteri sehingga bakteri mengalami kematian (Stevens, 2011).
2.2.5 Pembentukan khelat
Beberapa turunan fenol, seperti heksaklorofen dan oksikuinolin dapat membentuk khelat dengan ion Fe dan Cu masuk ke dalam sel bakteri, kemudian bentuk khelat tersebut masuk ke dalam sel bakteri. Kadar yang tinggi dari ion-ion logam di dalam sel menyebabkan gangguan fungsi enzim-enzim sehingga jasad renik mengalami kematian (Siswandono, 1995; Somani, et al., 2011).
2.3Penggolongan Desinfektan
Menurut Siswandono (1995), desinfektan dapat dibagi menjadi enam kelompok, yaitu:
2.3.1 Turunan aldehida
aldehid umumnya digunakan dalam campuran air dengan konsentrasi 0,5% - 5% dan bekerja dengan mendenaturasi protein sel bakteri (Siswandono, 1995; Somani, et al., 2011).
Larutan formaldehid (formalin), mengandung formaldehid (HCOH) 37% yang mempunyai aktivitas antibakteri dengan kerja yang lambat. Larutan formaldehid digunakan untuk pengawetan mayat, desinfektan ruangan, alat-alat, dan baju dengan kadar 1:5000. Larutan formaldehid dalam air atau alkohol digunakan untuk mendesinfeksi tangan dengan konsentrasi maksimum 0,5 mg/L (Somani, et al., 2011). Struktur kimia formaldehid dapat dilihat pada Gambar 2.4(a).
Paraformaldehid diperoleh dengan menguapkan larutan formaldehid. Senyawa ini serupa dengan formalin. Paraformaldehid mempunyai bau kurang menyenangkan. Paraformaldehid bekerja pada konsentrasi maksimum 0,1 mg/L (Ghanem, et al., 2012). Struktur kimia paraformaldehid dapat dilihat pada Gambar 2.4(b).
Gambar 2.4 Struktur Kimia Formaldehid (a) dan Paraformaldehid (b)
Glutaraldehid digunakan untuk mensterilkan bahan cair dan peralatan bedah yang tidak dapat disterilkan dengan pemanasan. Senyawa ini mempunyai keuntungan karena tidak berbau dan efek iritasi terhadap kulit dan
O
H
H
O O O O C C C C H H H H
(a) (b)
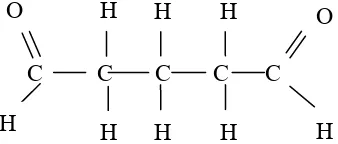
mata lebih rendah dibanding formalin. Larutan glutaraldehid 2% efektif sebagai antibakteri dan spora pada pH 7,5 – 8,5 (Fazlara and Ekhtelat, 2012). Glutaraldehid mempunyai lebih efektif daripada Formaldehid dan tidak berpotensi karsinogenik sehingga lebih banyak dipilih dalam bidang virologi (Siswandono, 1995; Brewer, 2010).
Mekanisme reaksinya dijelaskan pada Gambar 2.5
C C C C C
Gambar 2.5 Glutaraldehid
Pada prinsipnya, turunan aldehida ini dapat digunakan dengan spektrum luas. Misalnya, formaldehid membunuh jasad renik dalam ruangan, peralatan, dan lantai. Sedangkan glutaraldehid digunakan untuk membunuh virus. Keunggulan turunan aldehid adalah sifatnya stabil, persisten, dapat dibiodegradasi, dan cocok dengan beberapa material peralatan. Namun senyawa tersebut dapat mengakibatkan resistensi jasad renik, berpotensi sebagai karsinogen dan mengakibatkan iritasi pada sistem mukosa (Kahrs, 1995; Larson, 2013).
2.3.2 Turunan alkohol
Turunan alkohol merupakan bahan yang banyak digunakan selain turunan aldehid, misalnya etanol (C2H5OH), isopropanol (C3H7OH). Alkohol bekerja dengan mendenaturasi protein dari sel bakteri dan umumnya dibuat
O
H
H H H H
H
H H
dalam campuran air pada konsentrasi 70% - 90%. Etanol bersifat bakterisid yang cepat, digunakan sebagai antiseptik kulit dan sebagai pengawet. Aktivitas bakterisidnya optimal pada kadar 70%. Isopropanol mempunyai aktivitas bakterisid lebih kuat dibandingkan etanol karena lebih efektif dalam menurunkan tegangan permukaan sel bakteri dan denaturasi bakteri (Elisabeth, dkk., 2012).
2.3.3 Senyawa pengoksidasi
Senyawa pengoksidasi yang umum digunakan sebagai desinfektan adalah hidrogen peroksida, benzoil peroksida, karbanid peroksida, kalium permanganat, dan natrium perborat (Siswandono, 1995; Aboh, et al., 2013). Hidrogen peroksida adalah senyawa pengoksidasi yang sering digunakan sebagai antimikroba. Senyawa ini diurai oleh enzim katalase menghasilkan oksigen yang aktif sebagai antiseptik. Hidrogen peroksida digunakan untuk mencuci luka dan penghilang bau badan dengan kadar 1-3% (Siswandono, 1995; Ghanem, et al., 2012).
Benzoil peroksida dalam air melepaskan hidrogen peroksida dan asam benzoat. Benzoil peroksida pada konsentrasi 5-10% digunakan sebagai antiseptik dan keratolitik untuk pengobatan jerawat (Stampi, et al., 2002; Aboh, et al., 2013).
antiseptik pada telinga dan pada luka (Siswandono, 1995; Elisabeth, dkk., 2012).
Kalium permanganat dan natrium perborat digunakan sebagai desinfektan dan antiseptik karena bersifat oksidatif. Pada umumnya, kedua senyawa tersebut digunakan untuk pemakaian lokal dalam bentuk larutan dalam air (Siswandono, 1995; Larson, 2013).
2.3.4 Turunan fenol
Fenol sendiri mempunyai efek antiseptik dan desinfektan. Golongan fenol diketahui memiliki aktivitas antimikroba yang bersifat bakterisid namun tidak bersifat sporisid. Senyawa turunan fenol yang dikenal sebagai senyawa fenolik mengandung molekul fenol yang secara kimiawi dapat diubah. Perubahan struktur kimia tersebut bertujuan untuk mengurangi efek iritasi kulit dan meningkatkan aktivitas antibakteri (Brewer, 2010).
Senyawa fenolik seringkali digunakan dalam campuran sabun dan deterjen. Aktivitas antimikroba senyawa fenolik disebabkan kemampuannya merusak lipid pada membran plasma mikroorganisme sehingga menyebabkan isi sel keluar. Peningkatan sifat lipofil turunan fenol akan meningkatkan aktivitas desinfektannya. Salah satu senyawa fenolik yang paling sering digunakan adalah kresol (Siswandono, 1995; Kahrs, 1995).
sulfohidril dari protein, dan merusak DNA sehingga efektif membunuh bakteri (Siswandono, 1995; Fazlara and Ekhtelat, 2012).
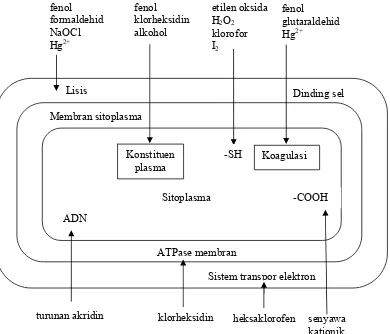
Mekanisme kerja dan sasaran utama dari senyawa fenol dijelaskan pada Gambar 2.6 menurut Russel and Chopra (1987).
Gambar 2.6 Mekanisme kerja dan sasaran utama desinfektan
Pemasukan gugus halogen, seperti klorin dan bromin ke inti fenol akan meningkatkan aktivitas antiseptik. Aktivitas ini lebih meningkat bila jumlah halogen yang dimasukkan bertambah. Polihalogenisasi fenol akan membentuk senyawa yang mempunyai kelarutan dalam air sangat kecil. Ikatannya dengan
Dinding sel Membran sitoplasma Sitoplasma ATPase membran Konstituen plasma Koagulasi Sitoplasma Lisis fenol formaldehid NaOCl Hg2+ fenol klorheksidin alkohol fenol glutaraldehid Hg2+ -SH etilen oksida H2O2
klorofor I2
Sistem transpor elektron
klorheksidin heksaklorofen ADN
turunan akridin
-COOH
reseptor inti fenol lemah, sehingga aktivitasnya rendah. Pemasukan gugus nitro dapat meningkatkan aktivitas antimikroba. Sedangkan pemasukan gugus asam karboksilat dan asam sulfonat menurunkan aktivitas antimikroba karena menurunkan kelarutan dalam lemak sehingga penembusan ke membran sel bakteri menurun (Pratiwi, 2008; Ghanem, et al., 2012).
Fenol, fenol terhalogenisasi, dan alkilfenol meskipun efek antibakterinya besar tetapi tidak dapat digunakan secara sistemik karena toksisitasnya tinggi. Senyawa-senyawa tersebut hanya digunakan untuk antiseptik kulit, mulut, dan desinfektan. Contoh: timol, kresol, klorokresol, klorosilenol, dan betanaftol (Pratiwi, 2008).
2.3.5 Turunan ammonium kuartener
Turunan amonium kuartener seperti benzalkonium klorida, benzetonium klorida, setrimid, dequalinium klorida, dan domifen bromida. Turunan ini mempunyai efek bakterisid dan bakteriostatik terhadap bakteri Gram positif dan Gram negatif, jamur, dan protozoa. Tetapi, turunan ini tidak aktif terhadap bakteri pembentuk spora, seperti Mycobacterim tuberculosis dan virus (Loughlin, et al., 2002; Ghanem, et al., 2012).
2.3.6 Turunan halogen dan halogenofor
Turunan halogen yang umum digunakan adalah berbasis iodium seperti larutan iodium, iodofor, dan povidon iodium. Kompleks klorin dengan senyawa organik disebut klorofor, sedangkan kompleks iodin dengan senyawa organik disebut iodofor. Halogen dan halogenofor digunakan sebagai antiseptik dan desinfektan. Klorin dan klorofor terutama digunakan untuk mendesinfeksi air, seperti air minum dan air kolam renang. Contohnya, klorin dioksida, natrium hipoklorit, kalsium hipoklorit, dan triklosan. Sedang iodin dan iodofor digunakan untuk antiseptik kulit sebelum pembedahan dan antiseptik luka. Turunan ini umumnya digunakan dalam larutan air dengan konsentrasi 1 - 5% dan mampu mengoksidasi dalam rentang waktu 10 - 30 menit. Contohnya, povidon iodium (Brewer, 2010).
2.4 Koefisien Fenol
Pengujian desinfektan yang baik harus mampu memprediksikan kekuatannya ketika digunakan. Desinfektan digunakan untuk pemeliharaan permukaan, peralatan-peralatan, air, kain linen, obat-obatan, bidang pertanian, dan industri makanan. Uji yang lebih spesifik telah dikembangkan untuk memberikan gambaran keefektifan suatu desinfektan. Metode pengujian desinfektan meliputi uji pembawa, uji suspensi, uji kapasitas, dan uji praktik (Cremieux dan Fleurette, 1991; Reybrouck, 1992a).
2.4.1 Uji pembawa (carrier tests)
Uji pembawa merupakan metode yang telah lama digunakan. Pembawa yang digunakan pada uji ini adalah sutera yang dikontaminasi dengan inokulum mikroorganisme uji. Setelah dikeringkan, pembawa dimasukkan ke dalam larutan desinfektan dengan waktu kontak tertentu, kemudian diinokulasi dalam media pertumbuhan. Tidak adanya pertumbuhan mikroorganisme menunjukkan kekuatan desinfektan uji (Borneff, et al., 1981; Jiang, et al., 2010).
Kelemahan uji pembawa adalah jumlah bakteri yang terdapat pada pembawa sulit diperkirakan. Selain itu, bakteri yang bertahan hidup pada pembawa selama pengeringan tidak konstan (Borneff, et al., 1981; Fazlara and Ekhtelat, 2012).
2.4.2 Uji suspensi (suspension tests)
mikroorganisme dan dimasukkan ke dalam larutan desinfektan. Suspensi kemudian diinokulasi pada media pertumbuhan. Kekuatan desinfektan ditunjukkan dengan ada tidaknya pertumbuhan mikroorganisme (Reybrouck, 1992; Jiang, et al., 2010).
Koefisien fenol dihitung dengan membandingkan tingkat pengenceran desinfektan dengan fenol yang mampu membunuh mikroorganisme dalam kondisi yang sama (Rideal and Walker, 1903; Jiang, et al., 2010).
Uji suspensi secara kuantitatif dilakukan dengan membandingkan jumlah mikroorganisme hidup sebelum dan sesudah kontak dengan desinfektan uji. Kekuatan desinfektan dihitung berdasarkan nilai efek mikrobiosid, yaitu perbandingan logaritma jumlah koloni mikroorganisme sesudah dan sebelum kontak. Jika nilai efek mikrobiosid 1, menunjukkan desinfektan mampu membunuh 90% koloni mikroorganisme. Jika nilai efek mikrobiosid 2, menunjukkan 99% mikroorganisme terbunuh. Syarat umum yang ditentukan adalah jika efek mikrobiosid > 5, maka 99,99% mikroorganisme terbunuh (CEN, 1996; Tafti, et al., 2012).
2.4.3 Uji kapasitas (capacity tests)
2.4.4 Uji praktek (practical tests)
Uji praktek dilakukan dengan mengukur hubungan waktu dan konsentrasi desinfektan terhadap mikroorganisme yang terdapat pada peralatan rumah tangga. Metode ini bertujuan untuk memastikan apakah efektivitas desinfektan memiliki korelasi dengan hasil percobaan laboratorium. Uji ini umumnya digunakan untuk desinfektan permukaan (Reybrouck, 1992b; Jiang et al., 2010).
BAB III
METODE PENELITIAN
3.1 Alat dan Bahan 3.1.1 Alat-alat
Alat yang digunakan dalam penelitian ini adalah tabung reaksi berbibir dengan ukuran (20 x 150) mm dan (25 x 250) mm, sengkelit platina berdiameter mata 4 mm, spektrofotometer (Halo VIS-10), pipet mikro (Eppendorf), laminar air flow cabinet (Astec HLF 1200 L), oven (Fisher), timbangan analitik (Mettler Toledo), stopwatch, inkubator (Memmert), otoklaf (Express equipment), erlenmeyer , beaker glass, spatula, dan pengaduk.
3.1.2 Bahan
Fenol yang digunakan dalam penelitian ini adalah berkualitas pro analis yang diproduksi dari E. Merck (Jerman). Produk desinfektan uji diperoleh dari supermarket yang tersebar di Kota Medan. Bahan untuk pembuatan media bakteri yaitu Nutrient Broth (NB) dan Nutrient Agar (NA) diperoleh dari Oxoid (Amerika Serikat).
3.2 Mikroorganisme Uji
3.3 Pengambilan Sampel
Sampel yang digunakan dalam penelitian ini adalah produk desinfektan dari berbagai merek dagang yang beredar di beberapa supermarket Kota Medan. Produk desinfektan yang diuji meliputi produk yang mengandung klorosilenol (A), natrium hipoklorit (B), benzalkonium klorida (C), asam klorida (D dan E) dan minyak pinus (F dan G). Supermarket yang dipilih adalah supermarket yang menyediakan ketujuh produk desinfektan tersebut meliputi Alfamart, Carefour, Irian, dan Ramayana.
3.4 Prosedur
3.4.1 Penyiapan media
Penyiapan media dilakukan berdasarkan prosedur yang tertera pada label produk Oxoid. Media dibuat dengan mensuspensikan 13 gram serbuk NB dalam 1 liter air suling dan dipanaskan hingga larut sempurna. Kemudian disterilkan dalam otoklaf pada 121oC selama 15 menit.
3.4.2 Penyiapan bakteri uji
Salmonella tyhpi diremajakan 3 kali dalam 3 hari berturut turut dalam
NA. Inokulum dipindahkan secara aseptik ke media NB, densitasnya diatur sedemikian rupa hingga diperoleh transmittan 25% (Singleton, 2000).
3.4.3 Pembuatan larutan fenol 5% (b/v)
larutan A, ditambah air suling hingga 500 ml. Dicampur homogen sebagai larutan B, dipipet 15 ml larutan B dalam erlenmeyer bertutup dan ditambah 30 ml baku KBr-KBrO3. Ke dalam larutan B ditambah 5 ml HCl 0,1 N dan segera ditutup, kemudian dikocok teratur selama 30 menit dan didiamkan selama 15 menit. Tutup erlenmeyer dibuka sedikit, ditambahkan dengan cepat 5 ml larutan KI 20% dan segera ditutup rapat. Dikocok seksama, tutup erlenmeyer dibuka sedikit, bagian leher dibilas sedikit dengan air suling, dijadikan sebagai larutan C yang dititrasi dengan larutan Na2S2O3 0,1 N. Larutan baku harus disimpan rapat dalam tempat yang sejuk dan terhindar dari cahaya. Setelah diperoleh kadar fenol yang sebenarnya maka dibuat larutan fenol baku 5%. Larutan fenol 5% tersebut diencerkan dengan air suling steril dengan perbandingan 1:5, 1:10, 1:20, 1:30, 1:40, dan 1:50. Hasil perhitungan kadar fenol dapat dilihat pada lampiran 7.
3.4.4 Pembuatan larutan desinfektan uji
Desinfektan uji diencerkan sesuai dengan yang tertera pada etiket kemasan dengan air suling steril. Larutan tersebut diencerkan secara bertingkat dalam air suling steril untuk memperoleh pengenceran 1:5, 1:10, 1:20, 1:30, 1:40, dan 1:50 dengan volume masing-masing 5 ml.
3.4.5 Penetapan koefisien fenol
1:5, 1:10, 1:20, 1:30, 1:40, dan 1:50. Deret kedua, ketiga, dan keempat untuk tabung berisi media NB masing-masing untuk pengamatan waktu kontak 5, 10, dan 15 menit. Ke dalam tiap tabung pengenceran sampel dimasukkan 0,1 ml suspensi bakteri uji yang telah dikocok homogen. Waktu memasukkan bakteri uji pada tabung pengenceran pertama dicatat sebagai 0 menit. Interval waktu inokulasi antar tabung adalah 30 detik, sehingga untuk 7 tabung dapat diselesaikan selama 3 menit, setiap kali inokulasi diusahakan ujung pipet mendekati permukaan cairan dan tidak menyentuh dinding tabung. Lima menit setelah bakteri uji diinokulasikan pada tabung pertama, segera dikocok, dan dipindahkan secara aseptik 1 ml suspensi ke dalam media NB deret ke-2 satu persatu dengan selang waktu 30 detik sampai tabung ke-7. Sepuluh menit setelah inokulasi, tabung pengenceran pertama dikocok, dipindahkan 1 ml suspensi ke dalam media NB deret ke-3 sama seperti di atas. Lima belas menit setelah bakteri uji diinokulasi pada tabung pengenceran pertama, setelah dikocok dan dipindahkan 1 ml suspensi ke dalam media NB deret ke-4. Semua tabung yang telah diinokulasi dikocok homogen kemudian diinkubasi pada suhu 35-37oC selama 48 jam dan diamati pertumbuhan bakteri pada setiap tabung. Pengujian dilakukan secara duplo.
3.4.6 Analisis statistik
BAB IV
HASIL DAN PEMBAHASAN
4.1 Uji Terhadap Larutan Fenol 5% (b/v)
Uji koefisien terhadap larutan fenol 5% (b/v) menunjukkan bahwa larutan fenol tersebut pada pengenceran 10 kali dapat membunuh bakteri Salmonella thypi dengan waktu kontak 10 menit dan tidak membunuh bakteri
[image:36.595.120.494.498.630.2]pada waktu kontak 5 menit (Tabel 4.1). Menurut hasil penelitian Wright, et al., (1960), tingkat pengenceran fenol yang efektif membunuh Salmonella thypi adalah 1:90 dan efektif membunuh Staphylococcus aureus pada pengenceran 1:60. Menurut hasil penelitian Aboh, et al., (2013), tingkat pengenceran fenol yang efektif membunuh bakteri Staphylococcus aureus adalah 1:100. Sedangkan larutan fenol 5% efektif terhadap bakteri Staphylococcus aureus pada pengenceran 1:80 (Elisabeth, dkk., 2012).
Tabel 4.1 Uji larutan fenol 5% (b/v) Tingkat
pengenceran
Lama kontak
5 menit 10 menit 15 menit
Blanko - - -
1 : 5 - - -
1 : 10 + - -
1 : 20 + + -
1 : 30 + + +
1 : 40 + + +
1 : 50 + + +
Aktivitas antibakteri senyawa fenol disebabkan oleh kemampuannya mengkoagulasi komponen intrasel bakteri. Fenol berinteraksi dengan sel bakteri melalui proses adsorpsi yang melibatkan ikatan hidrogen. Pada kadar rendah terbentuk kompleks protein-fenol dengan ikatan yang lemah dan segera mengalami peruraian, diikuti penetrasi fenol ke dalam sel dan menyebabkan presipitasi serta denaturasi protein. Pada kadar tinggi fenol menyebabkan koagulasi protein dan sel membran mengalami lisis (Siswandono, 1995).
4.2 Uji Koefisien Fenol Produk Desinfektan
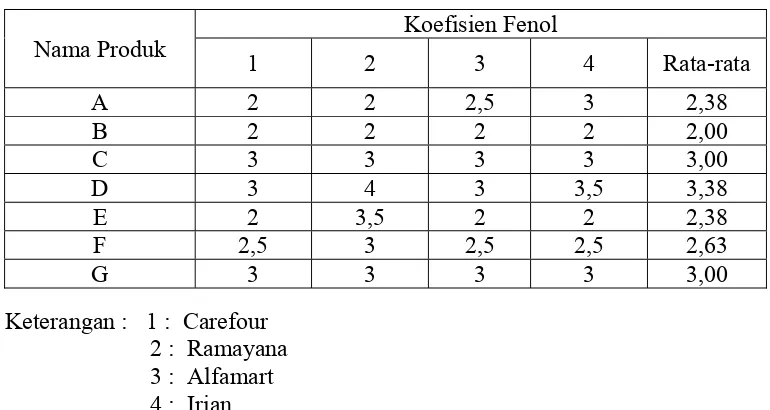
[image:37.595.111.496.453.658.2]Uji terhadap produk desinfektan yang beredar di beberapa supermarket Kota Medan menunjukkan koefisien fenol yang berbeda seperti terlihat pada Tabel 4.2.
Tabel 4.2 Koefisien fenol berbagai produk desinfektan yang beredar di beberapa supermarket kota medan
Keterangan : 1 : Carefour 2 : Ramayana 3 : Alfamart 4 : Irian Nama Produk
Koefisien Fenol
1 2 3 4 Rata-rata
A 2 2 2,5 3 2,38
B 2 2 2 2 2,00
C 3 3 3 3 3,00
D 3 4 3 3,5 3,38
E 2 3,5 2 2 2,38
F 2,5 3 2,5 2,5 2,63
Dari ketujuh produk desinfektan yang diuji, produk D dengan bahan aktif asam klorida memiliki efektivitas yang paling kuat dengan koefisien fenol 3,38 dan produk B dengan bahan aktif natrium hipoklorit memiliki efektivitas yang paling rendah dengan koefisien fenol 2,00.
Analisi statistik menggunakan uji Kolmogrov-Smirnov dan Kruskal-Wallis menunjukkan bahwa efektivitas produk desinfektan uji yang beredar di beberapa supermarket Kota Medan berbeda secara signifikan (p < 0,05). Perbedaan efektivitas tersebut disebabkan oleh komposisi bahan kimia yang terkandung dalam produk desinfektan.
Produk A mengandung klorosilenol 4,8% efektif membunuh Salmonella typhi dengan koefisien fenol 2,38. Menurut Aboh et al. (2013),
produk desinfektan yang mengandung klorosilenol 4,8% dan diklorosilenol 2% efektif membunuh bakteri Staphylococcus aureus dengan koefisien fenol masing-masing 6,4. Klorosilenol 4,8% dan diklorosilenol 2% juga efektif membunuh bakteri Escherichia coli dan Klebsiella aerogenosa dalam waktu kontak 5 menit. Namun kedua senyawa tersebut tidak efektif terhadap bakteri Pseudomonas aeruginosa. Senyawa desinfektan turunan fenol lainnya, yaitu
diklorometasilenol 2,5% mampu membunuh bakteri Staphylococcus aureus dengan koefisien fenol 5,0. Selain efektif terhadap bakteri, desinfektan yang mengandung klorosilenol 4,8% juga memiliki kemampuan untuk menginaktivasi orthopovirus. Virus ini dapat merusak peralatan rumah tangga (Butcher and Ulaeto, 2010). Klorosilenol merupakan golongan fenol yang
10 – 30 menit. Denaturasi protein dari konstituen protoplasma menyebabkan protein tidak berfungsi lagi. Namun, klorosilenol dalam produk desinfektan tidak efektif terhadap beberapa jenis bakteri Gram positif (Shaffer, 1965).
Produk B yang mengandung natrium hipoklorit 3% mampu membunuh bakteri Salmonella typhi dengan koefisien fenol 2,00. Menurut Somani, et al., (2011), larutan natrium hipoklorit 3% mampu membunuh 71,8% bakteri yang terkandung dalam air dengan waktu kontak optimum 30 menit. Pada konsentrasi 10%, natrium hipoklorit mampu membunuh 89,7% bakteri. Selain bakteri, senyawa ini juga efektif terhadap jamur dan virus. Natrium hipoklorit merupakan golongan klorofor yang bekerja dengan mengoksidasi membran sel mikroorganisme. Akibatnya, struktur sel mikroorganisme menjadi rusak sehingga sel lisis dan mati. Hipoklorit memiliki sifat antibakteri spektrum luas, yang efektif terhadap bakteri Gram positif dan Gram negatif (Kahrs, 1995).
Produk C dengan bahan aktif benzalkonium klorida 1% dapat membunuh bakteri Salmonella typhi dengan koefisien fenol 3,00. Benzalkonium klorida 1% juga efektif terhadap Staphylococcus aureus, Listeria monocytogenesis, dan Escherichia coli. Tetapi Bacillus cereus
membran. Pelepasan senyawa nitrogen dan fosfor menunjukkan bahwa zat aktif ini lebih efektif terhadap bakteri Gram positif daripada Gram negatif (Russel and Chopra, 1987).
Produk D yang mengandung asam klorida 9,5 % efektif membunuh bakteri Salmonella typhi dengan koefisien fenol 3,38. Namun produk E yang juga mengandung asam klorida aktivitas desinfektasinya lebih lemah dibandingkan dengan produk D. Hal ini kemungkinan karena konsentrasi asam klorida dalam produk E lebih rendah dibandingkan produk D (Kahrs, 1995). Menurut Stampi, asam klorida juga juga efektif membunuh bakteri Escherichia coli hingga mencapai lebih dari 99% (Stampi et al., 2002). Asam klorida bersifat bakterisid yang bekerja dengan mengoksidasi membran sel bakteri sehingga mengalami kerusakan dan lisis. Senyawa ini memiliki laju reaksi yang relatif lambat, tetapi aktivitasnya dapat ditingkatkan dengan penambahan air (Pelczar and Chan, 1998).
Produk F dengan bahan aktif pine oil 2,5% mampu membunuh bakteri Salmonella typhi dengan koefisien fenol 2,63. Senyawa ini juga efektif
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Produk desinfektan yang beredar di beberapa supermarket Kota Medan memenuhi persyaratan efektivitas dengan koefisien fenol lebih besar dari 1. Koefisien fenol produk A, B, C, D, E, F, dan G masing-masing adalah 2,38; 2,00; 3,00; 3,38; 2,38; 2,63; dan 3,00.
Produk D dengan bahan aktif asam klorida 9,5% memiliki aktivitas desinfektasi paling kuat dibandingkan produk desinfektan lain.
5.2 Saran
DAFTAR PUSTAKA
Aboh, M., Oladosu, P., dan Ibrahim, K. (2013). Antimicrobial Activities of Some Brands of Households Disinfectants Marketed in Abuja Municipal Area Council, Federal Capital Territory, Nigeria. American Journal of Research Communication. 1(8): 172-183.
Aparecida, M., Tibana, M., and Nunes, P.M. (2000). Disinfectant and antibiotic Activities: A Comparative Analysis in Brazilian Hospital Bacterial Isolates. Brazilian Journal of Microbilogy. 31(1): 193-199.
Borneff, J., Eggers, and Grun, L. (1981). Richtlinien fur die Prufung und Bewertung Chemischer Desinfektionsverfahren. Erster Teilabschnitt.
Stuttgart: Gustav Fischer Verlag. Hal. 67- 68.
Brewer, C. (2010). Variations in Phenol Coefficient Determinations of Certain Disinfectants. American Journal of Public Health. 33(1): 261.
Butcher, W and Ulaeto, D. (2010). Contact Inactivation of Orthopoxviruses by Household Disinfectants. Philadelphia: Department of Biomedical
Sciences, Dstl Porton Down. Hal. 279-283.
Comite Europeen de Normalisation. (1996). Chemical Disinfectants and Antiseptics-Basic Bactericidal Activity-Test Method and Requirements. New York: Europeisches Komitee fur Normung. Hal. 1040.
Cremieux, A., and Fleurette, J. (1991). Methods of Testing Disinfectants. In Disinfection, Sterilization, and Preservation. Edisi empat. Philadelphia: Lea dan Febiger. Hal. 1009-1027.
Depkes. (1995). Materia Medika Indonesia. Jilid IV. Jakarta: Depkes RI. Hal. 663.
Dwidjoseputro. (1982). Dasar-Dasar Mikrobiologi. Jakarta: Penerbit Djambatan. Hal. 102, 118-134.
Eka. (2006). Desinfektan dan Antimikroba. Jakarta: Penerbit Universitas Indonesia. Hal. 26, 49-65.
Fazlara, A and Ekhtelat, M. (2012). The Disinfectant Effects of Benzalkonium Chloride on Some Important Foodborne Pathogens. American-Eurasian Journal of Agricultural & Environment Scientifique. 12(1): 23-29.
Ghanem, K.M., Fassi, F.A., and Hazmi, N.M. (2012). Optimization of Chloroxylenol Degradation by Aspergillus niger Using Plackett-Burman Design and Response Surface Methodology. African Journal of Biotechnology. 11(84): 144-156.
Jawetzet, E.J., Melnick, and Ornston, L.N. (1987). Mikrobiologi Kedokteran. Edisi 20. Diterjemahkan Oleh Edi Nugroho. Jakarta: EGC. Hal. 47-51. Jiang, L., Wang, J., and Qingchui, C. (2010). Determination of Phenolic
Disinfectants in Consumer Products by Capillary Electrophoresis With Amperometric Detection. Journal of Chromatographic Science. 48(1): 584-585.
Kahrs, R.F. (1995). Disinfectants, Antiseptics, Sanitizers, and Sterilizing Agents. Revue Scientifique et Technique de L’ Office International Des Epizooties. 14(1): 105-122.
Kelsy, J.C., and Sykes, G. (1969). A New Test For The Assesment of Disinfectants With Particular Reference to Their Use in Hospitals. Pharmaceutical Journal. 13(2): 607-609.
Lamichhane, K.R., Riordan, J.T., and Delgado, A. (2008). Genetic Changes that Correlate with the Pine-oil Disinfectant Reduced Susceptibility Mechanism of Staphylococcus aureus. Mexico: New Mexico State University. Hal. 1973-1974.
Larson, E. (2013). Monitoring Hand Hygiene. American Journal of Infection Control. 41(2): 43-45.
Loughlin, M.F., Jones, M.V., and Lambert, P.A. (2002). Pseudomonas aeruginosa Cells Adapted to Benzalkonium Chloride Show Resistance to Other Membran-active Agents But Not to Clinically Relevant Antibiotics. Merseyside: Microbiology Research Group, School of Life and Health Sciences, Aston University. Hal. 631-639.
Pelczar, J.R., and Chan, E.C.S. (1998). Dasar-Dasar Mikrobiologi. Diterjemahkan oleh Hadioetomo, Imas, Tjitrosomoso, dan Lestari. Jakarta: Penerbit UI Press. Hal. 132, 138-140, 144.
Pratiwi, S. (2008). Mikrobiologi Farmasi. Jakarta: Penerbit Erlangga.
Purohit, S.S., Saliys, A.K, and Karkam, H.N. (2004). Pharmaceutical Microbiology. Jodhpur, India: Agrobios India. Hal. 332.
Reybrouck, G. (1992). The Assesment of the Bactericidal Activity of Surface Disinfectants. Edisi pertama. Oxford: Zentralblatt fur Hygiene und
Umweltmedizin. Hal. 190, 479-491.
Reybrouck, G. (1992a). Evaluation of the Antibacterial and Antifungal Activity of Disinfectants. In Principles and Practice of Desinfection,
Preservation, and Sterilization. Edisi ke dua. Oxford: Blackwell Scientific Publications. Hal. 114-133.
Reybrouck, G. (1992b). The Assesment of the Bactericidal Activity of Surface Disinfectants. Edisi kelima. Oxford: Zentralblatt fur Hygiene und
Umweltmedizin. Hal. 192, 438-446.
Rideal, S., and Walker, J.T. (1903). The Standardisation of Disinfectants. Journal of The Royal Sanitary Institute. 13(1): 424-441.
Russel, A.D., and Chopra, I. (1987). Understanding Antibacterial Action and Resistance. Cardiff: Welsh School of Pharmacy University of Wales College of Cardiff. Hal. 101-111.
Shaffer, J.G. (1965). The Role of Laboratory in Infection Control in the Hospital. Arbor: University of Michigan, School of Pulbic health. Hal. 354, 357.
Singleton, E. (2000). Disinfectan: Phenol Coefficient Methods. New York: AOAC International. Hal. 240.
Siswandono. (1995). Kimia Medisinal. Surabaya: Airlangga University Press. Hal. 249-250.
Somani, S.B., Ingole, W.N., and Kulkarni, S.N. (2011). Disinfection of Water by Using Sodiun Chloride (NaCl) and Sodium Hypochlorite (NaOCl). Shegaon: Shri Sant Gajanan Maharaj College of Engineering. Hal. 40-43.
Stampi, S., De Luca, G., Onorato, M., Ambrogiano, E., and Zanetti, F. (2002). Peracetic Acid as an Alternative Wastewater Disinfectant to Chlorine Dioxide. Bologna: Department of Medicine and Public Health, Division of Hygiene, University of Bologna. Hal. 725-731.
Tafti, F., Jajari, A.A., and Kamran, M.H. (2012). Comparison Of The Effectiveness Of Sodium Hypochlorite and Dentamize Tablet For Denture Disinfection. World Journal of medical Sciences. 3(1): 10-14. Wesley, A. (1986). Medical Microbiology. Edisi dua. Texas: Department of
Microbiology of University of Texas Medical Branch. Hal. 354-358. Wright, S.E., and Mundy, A. (1960). Defined Medium For Phenol Coefficient
Lampiran 1. Bagan penyiapan media
13 gram Nutrient Broth
Nutrient Broth Steril
Lampiran 2. Bagan pembuatan larutan fenol 5%
Lampiran 3. Bagan penyiapan larutan desinfektan uji
5,05 gram kristal fenol baku (FB) 99%
FB 5% FB (1:10) FB (1:5) Blanko Pengenceran larutan
Larutan dibuat 7 seri pengenceran
dimasukkan ke dalam erlenmeyer 100 ml
ditambahkan air suling steril sampai 100 ml, diaduk hingga homogen
diencerkan dengan air suling
FB (1:20) FB (1:30) FB (1:40) FB (1:50)
dimasukkan ke dalam 7 tabung reaksi
diencerkan dengan air suling
Blanko DU
*
1 2 3 K Lampiran Blanko NB NB NB Keterangan: Sn 4. Bagan p
1 : 5
NB
NB
NB diamb
m
: - standar y
*: pengenc
1: penamb 2: penamb 3: penamb
elang 30 det
penetapan k B B B
1 : 10
NB
NB
NB il 0,1 ml den micropipet
yang diguna ceran fenol ahan 1 ml p ahan 1 ml p ahan 1 ml p
tik koefisien fen suspen Salmonella B B B
1 : 20
N N N ngan akan adalah 5% pengenceran pengenceran pengenceran
nol dari fen si a typhi 0 NB NB NB
1 : 3
N
N
N
fenol 5% n fenol setel n fenol setel n fenol stetl
nol baku 5%
0
NB
NB
NB
1 : 4