ABSTRACT
EFECT OF THE USE OF MAKASAR FRUIT OIL (Brucea javanica) AGAINST QUALITY OF RAT SPERMATOZOA
By Reni Indriyani
Condition of the environment and human behavior are less well able to give effect to the difficulty of obtaining baby. To overcome this problem, community use traditional medicine to improve sexuality or fertility. One of them using makasar fruit oil (Brucea javanica). This study aimed to determine the effect of makasar fruit oil towards improving the quality of rat spermatozoa and determine the dosage of makasar fruit oil optimal to improve the quality of rat spermatozoa. This research was conducted in two stages. In the first step of extraction and isolation of makasar fruit oil and the second step of administration of makasar fruit oil against the quality of rat spermatozoa. The results showed that the makasar fruit oil effect on improving the quality of rat spermatozoa. Giving makasar fruit oil dose of 600 mg/kg bw improve the high quality of rat spermatozoa with motility (85.75%), concentration (1.46x109), viability (91.50%), abnormal (23.75%), testosterone (2.36 ng/mL), the relative weight of testis (1.1%), diameter of seminiferous tubules (250.72 m) and epithelium thickness of seminiferous tubules (60.12 m), as well as produce the numbers of copulation in female rats 100% with the number of fetuses (9.25).
ABSTRAK
PENGARUH PENGGUNAAN MINYAK BUAH MAKASAR (Brucea javanica) TERHADAP KUALITAS SPERMATOZOA TIKUS
Oleh Reni Indriyani
Keadaan lingkungan dan berbagai kebiasaan manusia yang kurang baik dapat memberikan efek terhadap sulitnya memperoleh keturunan. Untuk mengatasi hal ini sebagian masyarakat menggunakan ramuan tradisional untuk meningkatkan seksualitas atau kesuburan. Salah satu diantaranya dengan menggunakan minyak buah makasar (Brucea javanica). Penelitian ini bertujuan untuk mengetahui pengaruh pemberian minyak buah makasar terhadap peningkatan kualitas spermatozoa tikus dan mengetahui dosis pemberian minyak buah makasar yang optimal untuk meningkatkan kualitas spermatozoa tikus. Penelitian ini dilakukan dalam dua tahap. Pada tahap pertama dilakukan proses ekstraksi dan isolasi minyak buah makasar dan tahap kedua dilakukan pengujian pemberian minyak buah makasar terhadap kualitas spermatozoa tikus. Hasil penelitian menunjukkan bahwa pemberian minyak buah makasar berpengaruh terhadap peningkatan kualitas spermatozoa tikus. Pemberian minyak buah makasar dosis 600 mg/kg bb meningkatkan kualitas spermatozoa tertinggi dengan motilitas spermatozoa (85,75%), konsentrasi spermatozoa (1,46 x 109), viabilitas spermatozoa (91,50%), abnormalitas spermatozoa (23,75%), kadar hormon testosteron (2,36 ng/mL), berat relatif testis (1,1%), diameter tubulus seminiferus (250,72 m), dan tebal epitel tubulus seminiferus (60,12 m), serta menghasilkan angka kopulasi pada tikus betina 100% dengan jumlah fetus (9,25 ekor).
PENGARUH PENGGUNAAN MINYAK BUAH MAKASAR
(
Brucea javanica
) TERHADAP KUALITAS
SPERMATOZOA TIKUS
(Tesis)
Oleh
PROGRAM PASCASARJANA
TEKNOLOGI INDUSTRI PERTANIAN
UNIVERSITAS LAMPUNG
BANDAR LAMPUNG
2016
ABSTRACT
EFECT OF THE USE OF MAKASAR FRUIT OIL (Brucea javanica) AGAINST QUALITY OF RAT SPERMATOZOA
By Reni Indriyani
Condition of the environment and human behavior are less well able to give effect to the difficulty of obtaining baby. To overcome this problem, community use traditional medicine to improve sexuality or fertility. One of them using makasar fruit oil (Brucea javanica). This study aimed to determine the effect of makasar fruit oil towards improving the quality of rat spermatozoa and determine the dosage of makasar fruit oil optimal to improve the quality of rat spermatozoa. This research was conducted in two stages. In the first step of extraction and isolation of makasar fruit oil and the second step of administration of makasar fruit oil against the quality of rat spermatozoa. The results showed that the makasar fruit oil effect on improving the quality of rat spermatozoa. Giving makasar fruit oil dose of 600 mg/kg bw improve the high quality of rat spermatozoa with motility (85.75%), concentration (1.46x109), viability (91.50%), abnormal (23.75%), testosterone (2.36 ng/mL), the relative weight of testis (1.1%), diameter of seminiferous tubules (250.72 m) and epithelium thickness of seminiferous tubules (60.12 m), as well as produce the numbers of copulation in female rats 100% with the number of fetuses (9.25).
ABSTRAK
PENGARUH PENGGUNAAN MINYAK BUAH MAKASAR (Brucea javanica) TERHADAP KUALITAS SPERMATOZOA TIKUS
Oleh Reni Indriyani
Keadaan lingkungan dan berbagai kebiasaan manusia yang kurang baik dapat memberikan efek terhadap sulitnya memperoleh keturunan. Untuk mengatasi hal ini sebagian masyarakat menggunakan ramuan tradisional untuk meningkatkan seksualitas atau kesuburan. Salah satu diantaranya dengan menggunakan minyak buah makasar (Brucea javanica). Penelitian ini bertujuan untuk mengetahui pengaruh pemberian minyak buah makasar terhadap peningkatan kualitas spermatozoa tikus dan mengetahui dosis pemberian minyak buah makasar yang optimal untuk meningkatkan kualitas spermatozoa tikus. Penelitian ini dilakukan dalam dua tahap. Pada tahap pertama dilakukan proses ekstraksi dan isolasi minyak buah makasar dan tahap kedua dilakukan pengujian pemberian minyak buah makasar terhadap kualitas spermatozoa tikus. Hasil penelitian menunjukkan bahwa pemberian minyak buah makasar berpengaruh terhadap peningkatan kualitas spermatozoa tikus. Pemberian minyak buah makasar dosis 600 mg/kg bb meningkatkan kualitas spermatozoa tertinggi dengan motilitas spermatozoa (85,75%), konsentrasi spermatozoa (1,46 x 109), viabilitas spermatozoa (91,50%), abnormalitas spermatozoa (23,75%), kadar hormon testosteron (2,36 ng/mL), berat relatif testis (1,1%), diameter tubulus seminiferus (250,72 m), dan tebal epitel tubulus seminiferus (60,12 m), serta menghasilkan angka kopulasi pada tikus betina 100% dengan jumlah fetus (9,25 ekor).
PENGARUH PENGGUNAAN MINYAK BUAH
MAKASAR (
Brucea javanica
) TERHADAP KUALITAS
SPERMATOZOA TIKUS
Oleh
RENI INDRIYANI
Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar
MAGISTER SAINS
Pada
Program Pascasarjana Magister Teknologi Industri Pertanian
Fakultas Pertanian Universitas Lampung
PROGRAM PASCASARJANA
TEKNOLOGI INDUSTRI PERTANIAN
UNIVERSITAS LAMPUNG
BANDAR LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 05 November 1975. Penulis adalah
anak ke tujuh dari tujuh bersaudara buah hati dari pasangan Bapak Aqwam Soeripto
dan Ibu Sri Moeliyati.
Penulis menyelesaikan pendidikan Taman Kanak-Kanak di TK Nirmala
Puspa Kramatjati Jakarta pada tahun 1982, Sekolah Dasar di SD Negeri 07
Kramatjati Jakarta tahun 1988, Sekolah Menengah Pertama di SMP Negeri 150
Jakarta tahun 1991. Sekolah Menengah Atas di SMA Negeri 51 Jakarta tahun 1994.
Selanjutnya menyelesaikan pendidikan S1 Kesehatan Masyarakat Universitas
Malahayati pada Tahun 2013. Pada tahun 2014, penulis diterima sebagai
mahasiswa Pascasarjana Teknologi Industri Pertanian.
Penulis bekerja sebagai pegawai negeri sipil tahun 1997-1998, sebagai
tenaga pelaksana gizi di Puskesmas Talang Jawa Kabupaten Lampung Selatan,
tahun 1998-2002 penulis bekerja di Puskesmas Penengahan Kabupaten Lampung
Selatan. Pada tahun 2003-2013 penulis bekerja di Dinas Kesehatan Kabupaten
Lampung Selatan. Tahun 2013 sampai dengan sekarang penulis bekerja di Jurusan
SANWACANA
Puji syukur penulis panjatkan kehadirat Allah SWT atas nikmat, petunjuk
serta ridho-Nya sehingga penulis dapat menyelesaikan penulisan tesis ini yang
berjudul “Pengaruh Penggunaan Minyak Buah Makasar (Brucea javanica)
terhadap Kualitas Spermatozoa Tikus”. Dalam kesempatan ini penulis
mengucapkan terima kasih kepada:
1. Bapak Dr. Ir. Subeki, M.Si., M.Sc. selaku Pembimbing Pertama atas
bimbingan, nasihat, serta motivasi selama menyusun tesis.
2. Ibu Dr. Ir. Sussi Astuti, M.Si. selaku Pembimbing Kedua atas bimbingan,
arahan, nasihat, serta motivasi selama menyusun tesis.
3. Bapak Dr. Ir. Samsu Udayana Nurdin, M.Si. selaku Pembahas dan
Pembimbing Akademik atas bimbingan, saran, motivasi, serta evaluasinya
selama menyusun tesis.
4. Bapak Prof. Dr. Ir. Irwan Sukri Banuwa, M.Si., selaku Dekan Fakultas
Pertanian Universitas Lampung.
5. Prof. Dr. Sudjarwo, M.S. selaku Direktur Program Pascasarjana.
6. Ibu Prof. Ir. Neti Yuliana, M.Si., Ph.D. selaku Ketua Program Studi Magister
Teknologi Industri Pertanian periode (2010-2016) atas bimbingan, dukungan
serta motivasinya dalam penyelesaian tesis.
7. Ibu Dr. Sri Hidayati, S.TP., M.P. selaku Ketua Program Studi Magister
Teknologi Industri Pertanian atas bimbingan, dukungan, serta motivasinya
8. Bapak Dr. Hendri Bousman, S.Si., M.Biomed. selaku dosen Jurusan MIPA
Universitas Lampung yang telah banyak membantu dalam memberikan saran
dalam penyelesaian tesis.
9. Bapak dan ibu dosen, staf administrasi, dan Pranata Laboratorium Pendidikan
Program Studi Magister Teknologi Industri Pertanian, Fakultas Pertanian,
Universitas Lampung.
10. Bapak dan ibu dosen, staf administrasi dan Instruktur Laboratorium Jurusan
Gizi, Poltekkes Tanjungkarang.
11. Bapak dan ibu penulis yang selalu mendoakan dalam menjalankan kehidupan.
12. Suami dan anak-anakku tercinta yang telah memberikan dukungan, motivasi,
dan doanya yang tidak terhenti untuk menyelesaikan tesis.
13. Keluarga besar Magister Teknologi Industri Pertanian Fakultas Pertanian
Universitas Lampung, rekan-rekan seangkatan, bapak-bapak, ibu-ibu,
kakak-kakak, dan adik-adik seangkatan atas bantuan dan kebersamaannya selama
ini.
Penulis berharap semoga Allah SWT, membalas segala kebaikan yang
telah diberikan dan semoga tesis ini dapat bermanfaat. Aamiin.
Bandar Lampung, Desember 2016
DAFTAR ISI
Halaman
HALAMAN JUDUL………. iii
HALAMAN PERSETUJUAN………. iv
HALAMAN PENGESAHAN………. v
SANWACANA………. viii
DAFTAR ISI………. x
DAFTAR TABEL……….. xiii
DAFTAR GAMBAR……….. xvi
I. PENDAHULUAN………. 1
1.1. Latar Belakang dan Masalah ……… 1
1.2. Tujuan Penelitian ……….. 3
1.3. Kerangka Pemikiran ………. 3
1.4. Hipotesis ………... 6
II. TINJAUAN PUSTAKA……… 7
2.1 Buah Makasar ……….. 7
2.2. Fisiologi Reproduksi Tikus Jantan ……….. 9
2.2.1. Viabilitas Spermatozoa………. 12
2.2.2. Morfologi Spermatozoa ……….. 12
2.3. Produksi Spermatozoa……… 14
2.3.1. Spermatogenesisi pada Tikus ……….. 14
2.3.2. PeranHormon pada Spermatogenesis……… 16
III. METODE PENELITIAN……….. 18
3.1. Tempat dan Waktu Penelitian……… 18
3.2. Bahan dan Alat Penelitian……… 18
3.3. Rancangan Percobaan ………. 19
3.4. Pelaksanaaan Penelitian……… 19
3.4.1. Ekstrasi Minyak Buah Makasar……… 19
3.4.2. UjiIn VivoPemberian Minyak Buah Makasar terhadap Kualitas Spermatozoa Tikus Jantan………. 21
3.5. Pengamatan……… 23
3.5.1. Motilitas Spermatozoa……….. 23
3.5.2. Konsentrasi Spermatozoa ………. 24
3.5.3. Viabilitas Spermatozoa ……… 25
3.5.4. Abnormalitas Spermatozoa………... 25
3.5.5. Kadar Hormon Testosteron ………. 26
3.5.6. Berat RelatifTestis………. 26
3.5.7. Diameter dan Tebal Epitel Tubulus Semeniferus ………….. 26
3.5.8. Angka Konsepsi dan Jumlah Fetus pada Tikus Betina ……… 27
IV. HASIL DAN PEMBAHASAN……….. 28
4.2. Motilitas Spermatozoa……… 29
4.3. Konsentrasi Spermatozoa ……… 31
4.4. Viabilitas Spermatozoa ………. 34
4.5. Abnormalitas Spermatozoa ……….. 36
4.6. Kadar Hormon testosteron……… 39
4.7. Berat Relatif Testis ……….. 41
4.8. Diameter dan Tebal Epitel Tubulus Semeniferus ………. 43
4.9. Angka Kopulasi, Konsepsi dan Jumlah Fetus……… 47
4.10. Penentuan Perlakuan Terbaik .……….. 49
V. KESIMPULAN DAN SARAN………. 52
DAFTAR PUSTAKA……… 53
DAFTAR TABEL
Tabel Halaman
1. Komposisi ransum standar untuk tikus percobaan …………...……. 21
2. Karakteristik minyak buah makasar ……….……... 28
3. Angka kopulasi, konsepsi, dan jumlah fetus pada tikus betina setelah
dikawinkan tikus jantan ………..…………. 48
4. Kualitas spermatozoa tikus pada berbagai pemberian dosis minyak
buah makasar ………...……….... 50
5 Motilitas spermatozoa tikus pada berbagai perlakuan dosis
pemberian minyak buah makasar setelah 48 hari …………... 61
6 Uji kehomogenan (kesamaan) ragam (Bartlett’stest) motilitas
spermatozoa tikus pada berbagai perlakuan dosis pemberian minyak buah makasarsetelah 48 hari ………..…………. 61
7 Analisis ragam motilitas spermatozoa tikus pada berbagai perlakuan dosis pemberian minyak buah makasarsetelah 48 hari……..………. 62
8 Uji BNT motilitas spermatozoa tikus pada berbagai perlakuan dosis pemberian minyak buah makasarsetelah 48 hari ………..…….. 62
9. Konsentrasi spermatozoa tikus pada berbagai perlakuan dosis
pemberian minyak buah makasarsetelah 48 hari …………..……….. 63
10. Uji kehomogenan (kesamaan) ragam (Bartlett's test) konsentrasi spermatozoa tikus pada berbagai perlakuan dosis pemberian minyak buah makasarsetelah 48 hari ………..………. 63
11. Analisis ragam konsentrasi spermatozoa tikus pada berbagai
perlakuan dosis pemberian minyak buah makasar setelah 48 hari ... 64
12. Uji BNT konsentrasi spermatozoa tikus pada berbagai perlakuan
dosis pemberian minyak buah makasar setelah 48 hari ... 64
13. Viabilitas spermatozoa tikus pada berbagai perlakuan dosis
14. Uji kehomogenan (kesamaan) ragam (Bartlett's test) viabilitas spermatozoa tikus pada berbagai perlakuan dosis pemberian minyak buah makasarsetelah 48 hari ………..………. 65
15. Analisis ragam viabilitas spermatozoa tikus pada berbagai
perlakuan dosis pemberian minyak buah makasar setelah 48 hari ... 66
16. Uji BNT viabilitas spermatozoa tikus pada berbagai perlakuan
dosis pemberian minyak buah makasar setelah 48 hari ... 66
17. Abnormalitas tikus pada berbagai perlakuan dosis pemberian
minyak buah makasarsetelah 48 hari ………..…… 67
18. Uji kehomogenan (kesamaan) ragam (Bartlett's test) abnormalitas spermatozoa tikus pada berbagai perlakuan dosis pemberian
minyak buah makasar 48 hari ………..……… 67
19. Analisis ragam abnormalitas spermatozoa tikus jantan pada berbagai perlakuan dosis pemberian minyak buah makasar setelah 48 hari... 68
20. Uji BNT abnormalitas spermatozoa tikus pada berbagai perlakuan
dosis pemberian minyak buah makasarsetelah 48 hari ………..…… 68
21 Kadar hormon testosteron tikus jantan pada berbagai perlakuan
dosis pemberian minyak buah makasar setelah 48 hari………..……. 69
22 Uji kehomogenan (kesamaan) ragam (Bartlett's test) kadar hormon testosteron tikus yang diberikan berbagai perlakuan dosis pemberian
minyak buah makasar 48 hari………...… 69
23 Analisis ragam kadar hormon testosteron tikus jantan pada berbagai perlakuan dosis pemberian minyak buah makasar setelah 48
hari………...…... 70
24 Uji BNT kadar hormon testosteron tikus jantan pada berbagai perlakuan dosis pemberian minyak buah makasar setelah 48
hari………... .
70
25 Berat testis tikus pada berbagai perlakuan dosis pemberian minyak
buah makasar setelah 48 hari………..….. 71
26 Uji kehomogenan (kesamaan) ragam (Bartlett's test) berat testis tikus yang diberikan berbagai perlakuan dosis pemberian minyak
buah makasar 48 hari……… 71
27 Analisis ragam berat testis tikus pada berbagai perlakuan dosis
28 Uji BNT berat testis tikus pada berbagai perlakuan dosis
pemberian minyak buah makasar setelah 48 hari………...…… 72
29. Diameter tubulus semeniferus tikus jantan pada berbagai perlakuan
dosis pemberian minyak buah makasar setelah 48 hari ………...…… 73
30. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) diameter
tubulus semeniferus tikus jantan pada berbagai perlakuan dosis
pemberian minyak buah makssar setelah 48 hari ……….. 73
31. Analisis ragam diameter tubulus semeniferus tikus jantan pada berbagai perlakuan dosis pemberian minyak buah makasar setelah
48 hari ……….. 74
32. Uji BNT berat diameter tubulus semeniferus tikus pada berbagai
perlakuan dosis pemberian minyak buah makasar setelah 48 hari ..… 74
33. Tebal epitel tubulus semeniferus tikus pada berbagai perlakuan dosis pemberian minyak buahmakasar setelah 48 hari ……… 75
34 Uji kehomogenan (kesamaan) ragam (Bartlett’s test) tebal epitel
tubulus semeniferus tikus pada berbagai perlakuan dosis pemberian minyak buah makssar setelah 48 hari ……….. 75
35 Analisis ragam tebal epitel tubulus semeniferus tikus pada berbagai perlakuan dosis pemberian minyak buah makasar setelah 48 hari … 76
36 Uji BNT tebal epitel tubulus semeniferus tikus pada berbagai
perlakuan dosis pemberian minyak buah makasar setelah 48 hari ..… 76
37 Jumlah fetus pada tikus betina setelah dikawinan dengan tikus yang diberikan berbagai perlakuan dosis pemberian minyak buah makasar
48 hari……… 77
38 Uji kehomogenan (kesamaan) ragam (Bartlett’s test) jumlah fetus
pada tikus betina setelah dikawinkan dengan tikus yang diberikan berbagai perlakuan dosis pemberian minyak buah makssar setelah 48
hari ………...…… 77
39 Analisis ragam jumlah fetus pada tikus betina setelah dikawinkan dengan tikus yang diberikan berbagai perlakuan dosis pemberian
minyak buah makasar setelah 48 hari ………..… 78
40 Uji BNT jumlah fetus pada tikus betina setelah dikawinkan dengan tikus yang diberikan berbagai perlakuan dosis pemberian minyak
DAFTAR GAMBAR
Gambar Halaman
1. Tanaman buah makasar ... 8
2. Morfologi spermatozoa tikus. ... 13
3. Tahapan siklus sel spermatogenesis pada tikus ... 15
4. Ekstraksi dan isolasi minyak buah makasar (Brucea javanica)... 20
5. Diagram alir pemberian minyak buah makasar pada tikus jantan ... 22
6. Motilitas spermatozoa tikus setelah pemberian berbagai dosis minyak buah makasar selama 48 hari ... 29
7. Konsentrasi spermatozoa tikus setelah pemberian berbagai dosis minyak buah makasar selama 48 hari ... 32
8. Viabilitas spermatozoa tikus setelah pemberian berbagai dosis minyak buah makasar selama 48 hari ... 34
9. Abnormalitas spermatozoa tikus setelah pemberian berbagai dosis minyak buah makasar selama 48 hari ... 37
10. Kadar hormon testosteron tikus jantan setelah pemberian berbagai dosis minyak buah makasar selama 48 hari ... 40
11. Berat relatif testis (%) tikus setelah pemberian berbagai dosis minyak buah makasar selama 48 hari ... 42
12 Diameter dan tebal epitel tubulus seminiferus tikus jantan setelah pemberian berbagai dosis minyak buah makasar selama 48 hari ... 44
13 Diameter dan tebal epitel tubulus seminiferus testis tikus yang diberikan berbagai dosis minyak buah makasar selama 48 hari dengan pebesaran 400x... 46
14 Proses ekstraksi dan isolasi minyak buah makasar... 80
1
I. PENDAHULUAN
1.1. Latar Belakang dan Masalah
Indonesia merupakan negara yang mempunyai keanekaragaman tanaman
sebesar 30.000 sepesies dan lebih dari 940 spesies merupakan tanaman obat
(Akib, 2006). Tanaman obat menjadi bahan utama dalam pembuatan obat herbal
dan semuanya mengklaim bermanfaat untuk menyembuhkan penyakit. Namun
demikian, sebagian besar hanya berdasarkan pengalaman turun temurun tanpa
disertai bukti ilmiah sehingga efektifitas, dosis, efek samping, dan toksisitasnya
belum jelas. Oleh karena itu, perlu dilakukan kajian ilmiah agar pemakaian obat
herbal berpedoman pada penggunaan obat yang baik dan benar dalam
menyembuhkan penyakit.
Berbagai spesies tanaman obat di Indonesia secara tradisional telah
digunakan sebagai obat kesuburan. Tingkat kesuburan pada individu jantan dapat
diukur dari kemampuan spermatozoa dalam melakukan proses fertilisasi. Proses
fertilisasi sangat dipengaruhi oleh kemampuan organ dan hormon reproduksi.
Testosteron merupakan hormon reproduksi yang berfungsi untuk pertumbuhan
dan perkembangan organ kelamin jantan. Selain berfungsi dalam kehidupan
seksual, hormon testosteron juga memiliki efek biologis terhadap metabolisme,
integritas tulang, otot, sistem kardiovaskular, dan otak. Kekurangan hormon
testosteron dapat menyebabkan penurunan sensitivitas insulin, kelemahan otot,
2
mudah lelah, peningkatan lemak tubuh, serta penurunan kemampuan seksual
(Jones, 2008).
Buah makasar (Brucea javanica) merupakan salah satu jenis tanaman obat
yang banyak tumbuh di Sumatera, Kalimantan, dan Jawa. Secara tradisional,
tanaman ini digunakan sebagai jamu untuk menyembuhkan penyakit malaria,
kanker, demam berdarah, dan disentri (Siregar, 1999). Buah tanaman ini banyak
mengandung senyawa quasinoid (Subeki et al., 2007, Elkhateeb et al., 2008;
Bawm et al., 2008). Beberapa penelitian menunjukkan bahwa pemberian ekstrak
pasak bumi (Eurycoma longifolia) yang mengandung senyawa quasinoid sehari
sekali selama 14 hari dapat meningkatkan jumlah sel spermatozoa dan
meningkatkan aktivitas seksual tikus jantan (Ang and Cheang, 2001; Ang and
Lee, 2002; Ang et al., 2003).
Hasil penelitian pendahuluan menunjukkan bahwa minyak buah makasar
mengandung vitamin E (α-tokoferol) sebesar 0,30 mg/g dan β-sitosterol 1,82
mg/g. Flohe dan Traber (1999) menyebutkan bahwa vitamin E sangat esensial
untuk reproduksi. Vitamin E dapat mencegah kerusakan spermatozoa pada hewan
jantan dan menjaga perkembangan zigot pada hewan betina. Pada proses
spermatogenesis, vitamin E berfungsi sebagai antioksidan yang mampu
menangkal radikal bebas hasil metabolisme aerob (Ogbuewuet al., 2010).
Menurut Hadiah (2002), pemberian akar pasak bumi dapat meningkatkan
kadar hormon testosteron. Hal ini disebabkan oleh efek senyawa-sitosterol yang
terkandung dalam akar pasak bumi. Senyawa -sitosterol memberikan pengaruh
terhadap enzim mikrosomal dalam sel Leydig sehingga meningkatkan hormon
-3
sitosterol kemungkinan besar juga dapat meningkatkan hormon testosteron dalam
tubuh.
Penelitian ini diharapkan dapat memberikan informasi mengenai pengaruh
pemberian minyak buah makasar terhadap kualitas spermatozoa individu jantan,
sehingga dapat digunakan sebagai obat penyubur dalam sistem reproduksi
individu jantan.
1.2. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui pengaruh pemberian minyak buah makasar terhadap peningkatan
kualitas spermatozoa tikus jantan.
2. Mengetahui dosis pemberian minyak buah makasar yang optimal dalam
meningkatkan kualitas spermatozoa tikus jantan.
1.3. Kerangka Pemikiran
Keadaan lingkungan yang semakin tidak ideal dan berbagai kebiasaan
manusia yang kurang baik dapat memberikan efek kurang baik terhadap
kehidupan manusia. Salah satu masalah yang terjadi saat ini adalah sulitnya
memperoleh keturunan. Untuk mengatasi hal ini, sebagian besar masyarakat
menggunakan ramuan tradisional untuk meningkatkan seksualitas atau kesuburan.
Pada umumnya, penggunaan obat tradisional berdasarkan pengalaman secara
turun temurun dan belum disertai kajian ilmiah yang jelas (Depkes RI, 1989).
Berbagai tanaman obat telah digunakan secara tradisional oleh masyarakat
untuk meningkatkan kesuburan. Hasil penelitian menunjukkan bahwa pemberian
4
selama 14 hari terbukti dapat meningkatkan kadar hormon testosteron tikus wistar
jantan tua sebesar 19,53% (Novianti, 2015).
Buah makasar merupakan salah satu tanaman obat yang banyak tumbuh di
Sumatera, Kalimantan, dan Jawa. Secara tradisional tanaman ini digunakan
sebagai jamu untuk menyembuhkan penyakit malaria, kanker, demam berdarah,
dan disentri (Siregar, 1999). Tanaman ini banyak mengandung senyawa quasinoid
(Subeki et al., 2007, Elkhateeb et al., 2008; Bawm et al., 2008). Beberapa
penelitian menunjukkan bahwa senyawa quasinoid yang diperoleh dari ekstrak
pasak bumi berpengaruh terhadap fertilitas tikus jantan serta meningkatkan jumlah
sel sperma dan aktivitas seksual (Ang and Cheang, 2001; Ang and Lee, 2002; Ang
et al., 2003).
Buah makasar banyak mengandung minyak. Menurut Wisnaningsih
(2012), minyak buah makasar mengandung asam linoleat (40.15%), 2-ethyl
hexanol (15.05%), asam palmitat (12.02%), di-9-octadecenoyl-gliserol (11.04%),
ethyl oleat (5.6%), myristyl oleat (1.09%), ethyl palmitat (0.48%), dan o-phytalic
acid anhydride (0.24%). Minyak buah makasar juga mengandung vitamin E (
-tokoferol) sebesar 0,304 mg/g dan -sitosterol 1,82 mg/g (Hasil penelitian
pendahuluan). Vitamin E merupakan senyawa untuk kesuburan dan berfungsi
sebagai zat antioksidan yang dapat melindungi membran sel dari kerusakan
oksidasi (Tillmanet al., 1991).
Aktivitas vitamin E sebagai antioksidan berjalan secara sinergis dengan
senyawa antioksidan lainnya di dalam tubuh. Vitamin E dapat melindungi sel dari
serangan radikal bebas. Dengan mengkonsumsi minyak buah makasar, maka
5
mampu melindungi sel penyusun tubulus seminiferus di dalam testis dari
kerusakan akibat serangan radikal bebas (Tillmanet al., 1991).
Mekanisme kerja vitamin E dalam menangkal radikal bebas pada
membran sel yaitu vitamin E akan memberikan atom hidrogen secara cepat ke
radikal bebas yang terbentuk pada membran sel. Hal ini menyebabkan
terbentuknya radikal vitamin E yang bersifat stabil. Radikal vitamin E selanjutnya
akan diubah oleh selenium melalui induksi glutation peroksidasemenjadi vitamin
E yang netral kembali di dalam sel (Qauliyah, 2006).
Fungsi reproduksi jantan diawali dengan proses spermatogenesis, yaitu
tahap perubahan struktur sel spermatogonia yang membelah menjadi spermatozoa
secara berurutan. Berbagai tahap ini diatur oleh hormon testosteron, follicle
stimulating hormon(FSH), danluteinising hormon (LH) yang dihasilkan oleh sel
Leydig dan Sertoli di dalam tubulus seminiferus pada testis (Combs, 1992).
Proses spermatogenesis diawali dengan pembelahan sel spermatogonia.
Kekurangan vitamin E dapat menyebabkan terjadinya degenerasi sel
spermatogonia. Jika sejak awal jumlah sel spermatogonia berkurang maka akan
mempengaruhi perkembangan sel-sel spermatogenik berikutnya (Wahyuni, 2002).
Quratulainy (2006) menyatakan bahwa kekurangan vitamin E dapat menyebabkan
degenerasi jaringan testis, yaitu berkurangnya jumlah sel-sel spermatogenik di
dalam tubulus seminiferus. Hal ini akan berpengaruh terhadap diameter dan tebal
epitel tubulus seminiferus, serta bobot testis.
Vitamin E yang terkandung dalam minyak buah makasar dapat berperan
dalam proses reproduksi dengan mencegah terjadinya degenerasi testis. Oleh
6
spermatogenik dalam tubulus seminiferus dan kualitas spermatozoa. Kekurangan
vitamin E dapat menyebabkan otot lemah, pertumbuhan terhambat, degenerasi
embrio, daya tetas telur rendah, degenerasi dan pelepasan sel epitel germinatif
testis, terjadi kemandulan, penurunan produksi hormon dari testis, penurunan
permeabilitas sel, memacu kematian, dan kerusakan syaraf (Sulistyowati, 2006).
Kandungan –sitosterol pada minyak buah makasar diharapkan dapat
meningkatkan kadar hormon testosteron. Hal ini karena senyawa-sitosterol yang
terdapat pada minyak buah makasar bersifat androgenik dan berpengaruh
langsung terhadap enzim mikrosomal dalam sel Leydig sehingga dapat menaikkan
kadar hormon testosteron (Hadiah, 2002).
1.4. Hipotesis
1. Pemberian minyak buah makasar dapat meningkatkan kualitas spermatozoa
tikus jantan.
2. Terdapat dosis minyak buah makasar yang optimal dalam meningkatkan
7
II. TINJAUAN PUSTAKA
2.1. Buah Makasar
Buah makasar (Brucea javanica) merupakan tanaman yang tergolong
famili Simaroubaceae. Tanaman ini banyak ditanam sebagai tanaman pagar dan
tumbuh liar di hutan atau pekarangan. Buah makasar tumbuh pada ketinggian
1-500 m di atas permukaan laut, tanaman perdu, tegak, menahun, tinggi 1-2,5 m,
dan berambut halus warna kuning. Daunnya bersifat majemuk menyirip ganjil,
jumlah anak daun 5-13, bertangkai, dan letak saling berhadapan. Bunga majemuk
berkumpul dalam rangkaian malai padat yang keluar dari ketiak daun dengan
warna ungu kehijauan. Buahnya berupa buah batu dengan bentuk bulat telur,
panjang sekitar 8 mm, dan jika sudah masak berwarna hitam. Bijinya bulat dan
berwarna putih. Di Indonesia, buahnya disebut buah makasar (Ardhi, 2010).
Buah makasar memiliki berbagai nama antara lain ya danzi, false sumac,
dan java brucea fruit. Tanaman ini memiliki nama lokal seperti malur (Batak),
berul (Lampung), walot (Sunda), kwalot (Jawa), tambara marica (Makasar), dan
nagas (Ambon). Buah makasar mengandung senyawa alkaloid brucamarine dan
yatamine, senyawa glikosida brucealin, yatanosid A dan B, serta kosamine,
senyawa phenol brucenol danbruceolic acid, brusatol, dan brusein A, B, C, D,F,
G, H. Daging buahnya mengandung asam oleat, asam linoleat, asam stearat, dan
asam palmitoleat (wright et al., 1988). Tanaman dan buah makasar dapat dilihat
8
a b
Gambar 1. (a) Tanaman buah makasar dan (b) buah makasar
Buah makasar banyak mengandung minyak. Ekstraksi minyak buah
makasar dapat dilakukan dengan tepung buah makasar direndam dalam larutan
etanol selama 4 minggu. Selanjutnya dilakukan penyaringan menggunakan kain
saring dan filtrat yang diperoleh diuapkan dengan evaporator. Filtrat pekat yang
diperoleh kemudian diekstrak dengan etil asetat (EtOAc) hingga diperoleh fraksi
air dan EtOAc. Fraksi EtOAc diuapkan hingga kering dan selanjutnya dimasukkan
ke dalam silika gel kolom khromatografi dan dielusi dengan CHCl3. Fraksi CHCl3
diuapkan hingga kering dan kemudian dimasukkan ke dalam silika gel kolom
kromatografi dan dielusi dengan klorofom sehingga diperoleh tiga fraksi. Minyak
buah makasar diperoleh dari fraksi kedua setelah dievaporasi (Subeki et al.,
2006).
Minyak buah makasar yang diperoleh dari proses ekstraksi berwarna agak
kehijauan. Hal ini karena zat warna alami klorofil yang terdapat dalam bahan ikut
terekstrak pada proses ekstraksi. Minyak buah makasar mempunyai aroma khas
dan mengandung senyawa asam linoleat (40.15%), 2-ethyl hexanol (15.05%),
9
(5.60%), myristyl oleat (1.09%), ethyl palmitat (0.48%), dan o-phytalic acid
anhydride (0.24%) (Wisnaningsih, 2012). Hasil penelitian pendahuluan
menunjukkan bahwa minyak buah makasar mengandung vitamin E (-tokoferol)
30,4 mg/100 g dan-sitosterol 182 mg/100 g (data tidak dipublikasikan).
Pemberian minyak buah makasar secara oral dengan dosis 7.5 mg/kg berat
badan sehari sekali selama 7 hari pada ayam broiler memberikan jumlah
hemoglobin (12.34 g/dL), sel darah putih (9.70 m/mm3), hematokrit (30.98%),
dan meningkatkan sistem imun tubuh dengan nilai GMT ND sebesar 54,68 pada
hari ke-12 pasca vaksinasi (Wisnaningsih, 2012).
Hasil penelitian Suharyati dan Hartono (2013), menunjukkan bahwa
pemberian vitamin E dan mineral Zn berpengaruh terhadap motilitas, persentase
spermatozoa abnormal, spermatozoa hidup, dan meningkatkan kualitas
spermatozoa kambing boer. Oleh karena itu, minyak buah makasar yang banyak
mengandung asam lemak tidak jenuh, vitamin E, dan -sitosterol besar
kemungkinan dapat digunakan untuk meningkatkan kualitas spermatozoa individu
jantan.
2.2. Fisiologi Reproduksi Tikus Jantan
Sistem reproduksi tikus jantan terdiri dari testis dan kantong skrotum,
epididimis dan vas deferens, sistem ekskretori pada masa embrio untuk transport
sperma, kelenjar aksesoris, uretra, dan penis. Epididimis terletak pada bagian
dorsolateral testis yang merupakan struktur memanjang dari bagian atas sampai
bagian bawah testis. Organ ini terdiri dari bagian kaput, korpus, dan kauda
10
Spermatozoa bergerak dari tubulus seminiferus lewat duktus eferen
menuju kepala epididimis. Epididimis merupakan pipa berkelok-kelok yang
menghubungkan vas eferensia pada testis dengan duktus eferen. Kepala
epididimis melekat pada bagian ujung testis dimana pembuluh darah dan saraf
masuk. Badan epididimis sejajar dengan aksis longitudinal dari testis dan ekor
epididimis selanjutnya menjadi duktus deferen yang rangkap dan kembali ke
daerah kepala. Epididimis berperan sebagai tempat untuk pematangan
spermatozoa sampai pada saat spermatozoa dikeluarkan dengan cara ejakulasi.
Spermatozoa belum matang ketika meninggalkan testikel dan harus mengalami
periode pematangan di dalam epididimis sebelum mampu membuahi ovum
(Frandson, 1995).
Jika spermatozoa terlalu banyak ditimbun karena tidak ejakulasi
yang lama atau karena sumbatan pada saluran keluar, maka sel epididimis dapat
bertindak phagocytosis terhadap spermatozoa. Spermatozoa itu kemudian
terdegenerasi dalam dinding epididimis. Pada vasektomi, epididimis juga berperan
untuk memphagocytosis spermatozoa yang tertimbun terus-menerus. Terbukti
spermatozoa yang diambil dari daerah kaput dan korpus tidak fertil, sedang yang
diambil dari daerah kauda fertil sama dengan spermatozoa yang terdapat dalam
ejakulat (Yatim, 1994).
Spermatozoa tikus adalah sel kelamin atau gamet yang diproduksi di
dalam tubulus seminiferus melalui proses spermatogenesis, dan bersama-sama
dengan plasma semen akan dikeluarkan melalui sel kelamin jantan. Menurut Rugh
(1968), spermatozoa tikus yang normal terbagi atas bagian kepala yang bentuknya
11
panjang. Panjang bagian kepala kurang lebih 0,0080 mm dan panjang
spermatozoa seluruhnya sekitar 0,1226 mm.
Kemampuan bereproduksi hewan jantan dapat ditentukan oleh kualitas dan
kuantitas semen yang dihasilkan. Produksi semen yang tinggi dinyatakan dengan
volume semen dan dosis spermatozoa yang tinggi pula. Sedangkan kualitas semen
yang baik dapat dilihat dari persentase spermatozoa yang normal dan motilitasnya
(Hardjopranoto, 1995).
Sel germinal primordial tikus jantan muncul sekitar 8 hari kehamilan,
dengan jumlah 100, yang merupakan awal dari jutaan spermatozoa yang akan
diproduksi dan masih berada di daerah ekstrak gonad. Karena sel germinal kaya
akan alkalin fosfatase untuk mensuplai energi pergerakannya melalui jaringan
embrio, maka sel germinal dapat dikenali dengan teknik pewarnaan. Pada hari
ke-9 dan hari ke-10 kehamilan sebagian mengalami degenerasi dan sebagian lagi
mengalami proliferasi dan bahkan bergerak pada hari ke-11 dan ke-12 ke daerah
genitalia. Pada saat itu jumlahnya mencapai sekitar 5000 dan identifikasi testis
dapat dilakukan. Proses diferensiasi dan proliferasi berlangsung di daerah medula
testis (Rugh, 1968).
Setiap spermatozoa membawa enzim yang cukup untuk membersihkan
jalan melalui cell cumulus menuju matriks jel ovum. Bahan asam hialuronik
semen cenderung bergabung ke sel granulosa sel cumulus, agar kepala sperma
dapat disuplai dengan enzim. Proses spermatogenesis ini baru dimulai secara aktif
pada hari ke-9 setelah lahir (Rugh, 1968). Volume cairan spermatozoa dapat
12
2.2.1 Viabilitas Spermatozoa
Spermatozoa mudah sekali terganggu oleh lingkungan yang berubah.
Perubahan pH dapat merusak sperma. kekurangan vitamin E menyebabkan sel
sperma tidak bertenaga melakukan pembuahan. Bagi gamet yang membuahi
dalam air, ketahanan spermatozoa sangat sedikit sekali ketika mencari ovum.
Daya hidup atau viabilitas merupakan indikator fertilisasi. Bila semen tersimpan
lama maka sedikit yang motil (Nalbandov, 1990).
Banyak faktor yang mempengaruhi pembuahan misalnya viabilitas sperma
yang rendah sehingga sperma tersebut tidak mampu mengadakan pembuahan.
Faktor hambatan ini dapat berasal dari struktur histologi saluran reproduksi jantan,
struktur sperma yang diperoleh selama di dalam alat genital, enzim-enzim yang
terdapat di dalam saluran reproduksi jantan serta dalam spermatozoa itu sendiri.
Sperma yang belum dewasa maupun bentuk-bentuk yang tidak sempurna tidak
akan mampu membuahi (Ilyas, 1997).
Viabilitas diukur dengan melihat persentase motil setelah jangka waktu
tertentu. Makin lama semen tersimpan makin sedikit yang motil. Penurunan
motilitas normal adalah 2-3 jam sudah ejakulasi 50-60% spermatozoa motil
maju/mL dan 7 jam sudah ejakulasi 50% spermatozoa motil maju/mL. Jika
setelah 3 jam yang motil kurang dari 50% menandakan adanya gangguan atau
kelainan dalam genitalia. Jika ejakulasi sering menyebabkan volume semen dan
dosis menurun, tetapi tidak menurun ketahanan (Yatim, 1994).
2.2.2 Morfologi Spermatozoa
Menurut Rugh (1968), spermatozoa tikus yang normal terbagi atas bagian
13
bagian ekor yang sangat panjang. Panjang bagian kepala kurang lebih 0,0080 mm
sedangkan panjang spermatozoa seluruhnya sekitar 0,1226 mm.
Bentuk spermatozoa abnormal (Gambar 2) dapat diklasifikasikan
berdasarkan bentuk kepala dan ekornya. Menurut Washington et al, (1983),
bentuk sperma abnormal pada tikus terdiri dari bentuk kepala seperti pisang,
bentuk kepala tidak beraturan (amorphous), bentuk kepala terlalu membengkok
dan lipatan-lipatan ekor yang abnormal.
Gambar 2. Morfologi spermatozoa tikus. (a) spermatozoa normal, (b) pengait salah membengkok, (c) sperma melipat, (d) kepala terjepit, (e) pengait pendek, (f) kesalahan ekor sebagai alat tambahan, (g) tidak ada pengait, (h) sperma berekor ganda dengan kepala tidak berbentuk, (i) kepala tidak berbentuk. Perbesaran 800 x. (Wyrobek dan Bruce, 1975).
2.2.3 Motilitas Spermatozoa
Jumlah yang bergerak maju adalah jumlah spermatozoa semua dikurangi
jumlah mati. Dianggap normal jika motil maju >40%. Menurut Yatim (1994)
bahwa spermatozoa yang normal persentase motilnya adalah 63% dengan range
10-95%. Ada orang yang spermatozoanya lemah sekali gerak majunya
14
(necrozoospermia) berarti orang ini infertil. Tapi ada laporan spermatozoa yang
tak bergerak belum menunjukkan mati. Mungkin ada suatu zat cytotoxic atau
antibodi yang membuatnya tak bergerak.
Menurut Tadjudin (1988), kategori untuk mengklasifikasi motilitas sperma
yaitu: (a) jika sperma bergerak cepat dengan lurus ke muka (gerak maju sangat
baik/buruk), (b) jika geraknya lambat/sulit maju lurus/bergerak tidak lurus (gerak
lemah atau sedang), (c) jika tidak bergerak maju, dan (d) jika sperma tidak
bergerak.
2.3. Produksi Sperma
Produksi sperma tiap hari per testis pada tikus adalah 35,4 x 106/mL, tidak
berbeda signifikan dengan manusia yaitu sebesar 45,5 x 106/mL, tubulus
seminiferustikus lebih tebal dari manusia yaitu 347 µm vs 262 µm, tetapi
pembatas tubulus pada tikus lebih tipis dibanding manusia (1,4 µm vs 15,9 µm).
Epitel seminiferus tikus mengandung 40% lebih sel spermatogenik dari
volumenya, dua kali lebih banyak dari epitel seminiferus manusia (Ilyas, 2007).
Spermatozoa pada tikus lebih panjang dibandingkan dengan spesies
mamalia lainnya, termasuk manusia dan hewan lainnya dan biasanya panjangnya
sekitar 150 – 200 mm. Kepala sperma pada tikus berbentuk kail hal ini sama
seperti pada hewan pengerat lainnya (Krinke, 2000).
2.3.1 Spermatogenesis Pada Tikus
Sel primodial germinal yang telah berhenti bermigrasi diliputi oleh sel
15
kelamin tikus jantan. Sel kelamin jantan tetap tidak aktif sampai sebelum masa
pubertas, yaitu sekitar 50 hari setelah kelahiran. Pada tahap ini mereka mulai
membelah dan menjadi sprematogonium dan terus membelah sampai hewan
kehilangan kemampuan untuk memproduksi spermatozoa. Tahapan siklus sel
spermatogenesis pada tikus dapat dilihat pada Gambar 3.
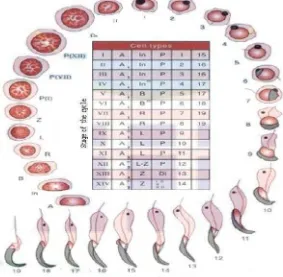
Gambar 3. Tahapan siklus sel spermatogenesis pada tikus, dimulai dari kiri bawah searah jarum jam. A, tipe spermatogonium A; In, spermatogonium tipe intermediet; B, tipe spermatogonium B; R, spermatosit primer resting; L, spermatosit leptotene; Z, spermatosit zygotene; P(I), P(VII), P(XII), awal, pertengahan dan akhir spermatosit pachytene. Angka romawi menunjukkan tahap siklus dimana mereka ditemukan; Di, diplotene; II, spermatosit sekunder, 1-19, tahap spermiogenesis. Tabel ditengah memberikan komposisi sellular dari tahapan siklus pada epitel seminiferus (I-XIV) (Krinke, 2000)
Pada Gambar 3 terlihat pada stage II sprematid yang telah berekor yaitu
spermatid yang telah mengalami maturasi. Sedangkan spermatozoa hanya
ditemukan pada stage VII dan pada stage XII tidak ditemukannya lagi spermatid
16
di dalam tubulus seminiferus. Tubulus memiliki susunan ruas dan setiap potongan
melintang tubula menunjukkan tahapan yang seragam melibatkan empat atau
lima generasi di sel germinal dengan sesuai. Tubulus seminiferus di tikus
dikarakerisasi oleh struktur ruas, sedangkan pada manusia menunjukkan pola
mosaik di beberapa tahap. Pada tikus, dibutuhkan 12 hari untuk menyelesaikan
satu siklus yang terdiri dari 14 tahap. Spermatogonium tikus membutuhkan empat
siklus sampai akhirnya membentuk spermatozoa, sehingga diperlukan 48 hari
untuk menyelesaikan seluruh tahap spermatogenesis (Krinke, 2000).
2.3.2 Peran Hormon pada Spermatogenesis
Proses spermatogenesis dipengaruhi oleh hormon yang dihasilkan oleh
organ hipotalamus, hiofisis, dan testis. Testis memproduksi sejumlah hormon
jantan yang disebut androgen. Salah satu hormon androgen adalah testosteron
yang berfungsi untuk merangsang pendewesaan spermatozoa yang terbentuk
dalam tubulus seminifurus, merangsang pertumbuhan kelenjar-kelenjar asesori,
dan merangsang pertumbuhan sifat jantan (Partodiharjo, 1980).
Spermatogenesis dan pematangan sperma sewaktu bergerak di sepanjang
epididimis dan vas deferens memerlukan androgen. Androgen juga mengontrol
pertumbuhan dan fungsi vesikula seminalis serta kelenjar prostat.
Spermatogenensis hampir seluruhnya terjadi dibawah pengaruh hormon yang
berasal dari hipofisa, terutama follicle stimulating hormon(FSH). Spermiogenesis
adalah lanjutan spermatogenesis yang berlangsung dibawah peranan luteinizing
hormone (LH) dan testosteron. Tanpa testosteron spermatozoa tidak dapat
17
Spermatogenesis dimulai pada saat pubertas karena adanya peningkatan
sekresi gonadotropin (FSH dan LH) dari hipofisis anterior. FSH merupakan
hormon penting untuk induksi spermatogenesis dan merangsang secara langsung
pada tubulus seminifurus. Spermatogenesis pada tikus dikendalikan oleh FSH
dalam kombinasi dengan LH dan testosteron. Di sisi lain, efek spermatogenesis
dari LH akan merangsang interstitial cell stimulating hormon (ICSH) pada pria
karena tindakan andogenik pada sel Leydig diinterstitium. Sekresi LH juga
merangsang sintesisi testosteron di sel Leydig pada testis (Krinke, 2000).
Aksi FSH pada spermatogenesis dimediasi oleh sel Sertoli. Hal ini karena
hormon peptida tidak dapat secara langsung mencapai spermatosit dan spermatid
karena melintasi sawar daerah testis yang terbentuk selama 16-19 hari setelah
kelahiran. Sebaliknya, testosteron dapat dengan mudah melewati sawar daerah
testis dengan cara difusi. Tingkat testosteron di dalam cairan interstisial (lebih dari
50 µg/mL) pada tikus dewasa jauh lebih tinggi dibanding pada testis (sekitar 30
µg/mL) atau cairan vena perifera (kurang dari 10 µg/mL). Hal ini menunjukkan
aksi parakrin atau autokrin dari testosteron pada spermatogenesis di testis (Krinke,
2000).
Salah satu peran sel Sertoli adalah produksi androgen yang mengikat
protein yang dirangsang oleh FSH dan testosteron. Hal ini menunjukkan bahwa
terdapat beberapa faktor yang tidak diketahui yang dikeluarkan dari sel Sertoli
III. METODE PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Analisis Hasil Pertanian
Fakultas Pertanian dan Laboratorium Reproduksi Jurusan Biologi MIPA
Universitas Lampung. Penelitian dilakukan pada bulan April-Desember 2015.
3.2. Bahan dan Alat
Bahan yang digunakan adalah buah makasar yang diperoleh dari Desa
Kurungan Nyawa Kabupaten Pesawaran. Bahan kimia untuk ekstraksi adalah
hexan, EtOAc, SiO2, dan CHCl3. Tikus jantan dan betina strain Sprague Dawley
(SD) umur 4 bulan dengan berat sekitar 250 g diperoleh dari PT. Indoanilab
Bogor. Bahan penyusun ransum adalah kasein, mineral mix, vitamin mix, minyak
jagung, selulosa, air, dan tepung maizena. Bahan analisis spermatozoa adalah
NaCl, eosin, nigrosin, giemsa, metanol, dan alkohol. Bahan uji histopatologi
adalah formalin, buffer netral, aquades, haematoxylin-eosin, ammonium, merkuri
oksida, asam asetat, hidroklorik acid, alkohol, dan paraffin.
Peralatan yang digunakan adalah mikroskop, gelas preparat, gelas penutup,
tabung reaksi, mikropipet, tabung mikro kapiler, tabung eppendorf,
haemocytometer, hand counter, lemari pendingin, thermometer, jarum ose,
bunsen, tissue processor,cassete embedding, pisau mikrotom, inkubator, kandang
19
3.3. Rancangan Percobaan
Penelitian disusun dalam Rancangan Acak Lengkap (RAL) dengan 7
perlakuan dan 4 ulangan. Perlakuan dosis minyak buah makasar terdiri dari 0,
100, 200, 300, 400, 500, dan 600 mg/kg berat badan. Data yang diperoleh diuji
kesamaan ragamnya dengan uji Bartlett dan kemenambahan data diuji dengan
Tukey. Analisis sidik ragam digunakan untuk mendapatkan penduga ragam galat
dan mengetahui ada tidaknya pengaruh antar perlakuan. Apabila terdapat
pengaruh yang nyata antar perlakuan dilanjutkan dengan uji Beda Nyata Terkecil
(BNT) pada taraf nyata 5%.
3.4. Pelaksanaan Penelitian
3.4.1. Ekstraksi Minyak Buah Makasar
Ekstraksi minyak buah makasar dilakukan sesuai dengan metode Subekiet
al(2006). Sebanyak 10 kg buah makasar segar dikeringkan dengan sinar matahari
hingga kadar air 12%. Selanjutnya buah makasar kering digilling dan diayak
dengan ukuran 80 mesh. Sebanyak 5 kg tepung buah makasar yang diperoleh
kemudian direndam dalam 15 L EtOH 95% selama 28 hari dan setiap hari selama
10 menit dilakukan pengadukan. Selanjutnya filtrat disaring dengan kain saring
dan diuapkan dengan evaporator menjadi 1 L. Filtrat pekat tersebut kemudian
diekstrak dengan etil asetat (EtOAc) hingga diperoleh fraksi air dan EtOAc.
Fraksi EtOAc diuapkan hingga kering dan selanjutnya dimasukkan ke dalam
silika gel kolom khromatografi dan dielusi dengan CHCl3 (3 L). Fraksi CHCl3
diuapkan hingga kering dan selanjutnya dimasukkan ke dalam silika gel kolom
20
makasar diperoleh dari fraksi ke-2 setelah dievaporasi. Prosedur ekstraksi minyak
buah makasar dapat dilihat pada Gambar 4.
Gambar 4. Ekstraksi dan isolasi minyak buah makasar (Brucea javanica)
Buah makasar
SiO2kolom kromatografi (CHCl3
Fraksi CHCl3
Evaporasi
Konsentrat
SiO2kolom kromatografi (CHCl3
Fraksi 1 Fraksi 1 Fraksi 1
Evaporasi
21
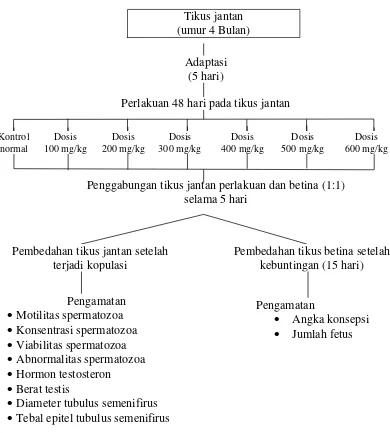
3.4.2. UjiInvivoPemberian Minyak Buah Makasar terhadap Kualitas Spermatozoa Tikus Jantan
Percobaan dilakukan dengan menggunakan 28 ekor tikus jantan dan 28
ekor tikus betina strain Sprague Dawley umur 4 bulan yang diberi 7 perlakuan
yang berbeda. Perlakuan dosis minyak buah makasar terdiri dari 0, 100, 200, 300,
400, 500, dan 600 mg/kg berat badan. Masing-masing dosis dilarutkan dalam 100
L aquabides yang mengandung carboxy methyl cellulose (CMC) 0,1% untuk
diberikan pada masing-masing tikus jantan. Sebelum digunakan, semua tikus
diadaptasikan dalam lingkungan laboratorium selama 5 hari. Selama percobaan
tikus diberikan ransum standar dan minum secara ad libitum. Ransum yang
diberikan pada tikus jantan dan tikus betina merupakan ransum basal kasein
dengan kadar protein sebesar 10% (AOAC, 1990). Komposisi ransum standar
dapat dilihat pada Tabel 1 (Hegdeet al., 2005). Selanjutnya tikus dikelompokkan
berdasarkan perlakuan dan diberikan minyak buah makasar secara oral dengan
jarum sonde dua hari sekali selama 48 hari sesuai dengan perlakuan. Setelah 48
hari perlakuan, maka tikus jantan digabung dengan tikus betina (1:1). Prosedur
pelaksanaan penelitian pemberian minyak buah makasar pada tikus jantan dapat
dilihat pada Gambar 5.
Tabel 1. Komposisi ransum standar untuk tikus percobaan
Bahan Komposisi
(g/100 g)
Pati maizena 65
Kasein 20
Minyak jagung 9
Mineral mix 4
Vitamin mix 2
TOTAL 100
22
Gambar 5. Diagram alir pemberian minyak buah makasar pada tikus jantan
Contoh perhitungan pemberian dosis minyak buah makasar 600 mg/kg
berat badan dilakukan dengan cara menimbang berat badan tikus terlebih dahulu.
Jika seekor tikus mempunyai berat badan 250 g, berarti 600 mg/1000 g x 250 g =
150 mg. Dengan demikian, seekor tikus akan menerima 150 mg minyak buah
makasar yang dilarutkan dalam 100L aquabides yang mengandung CMC 0,1%. Tikus jantan
(umur 4 Bulan)
Adaptasi (5 hari)
Perlakuan 48 hari pada tikus jantan
Kontrol normal
23
Setelah 48 hari perlakuan, selanjutnya tikus jantan digabung dengan tikus
betina (1:1). Setiap pagi pada tikus betina dilakukan usap vagina dengan
menggunakan teknik pewarnaan giemsa untuk mengetahui kondisi estrus dan
mendeteksi ada tidaknya spermatozoa. Setelah terdeteksi adanya spermatozoa
pada vagina tikus betina dan dihitung sebagai awal waktu kebuntingan,
selanjutnya tikus jantan dikorbankan dengan cara dipatahkan tulang leher. Bagian
testis dikoleksi dan dilakukan pengamatan terhadap berat testis dan kualitas
spermatozoanya. Sampel spermatozoa diambil pada dari cauda epididimis yaitu 1
cm dibawah caput epididimis. Ditempat tersebut diklem kemudian dipotong dan
dikeluarkan spermanya dengan cara dipencet, kemudian ditetesi NaCl 0,9%
sebanyak 2 tetes dan diaduk hingga homogen. Pada umur kebuntingan hari ke-15,
tikus betina kemudian dikorbankan untuk mengamati angka konsepsi dan jumlah
fetus.
3.5. Pengamatan
Analisis dilakukan terhadap berat motilitas, konsentrasi, viabilitas,
abnormalitas, hormon testosteron, berat relatif testis, diameter dan tebal epitel
tubulus seminiferus, serta angka konsepsi dan jumlah fetus tikus betina.
3.5.1. Motilitas Spermatozoa
Perhitungan motilitas spermatozoa dilakukan dengan metode Partodiharjo
(1992). Sperma tikus diambil dari bagian cauda epididimis dengan disayat dan
dipencet perlahan. Satu tetes sperma ditempatkan pada gelas obyek, ditambah satu
tetes larutan NaCl fisiologis 0,9%, dicampur merata dan ditutup dengan gelas
24
pandang menggunakan mikroskop cahaya pembesaran 400x dengan menghitung
spermatozoa yang bergerak progresif dari keseluruhan area pandang kemudian
dikali 100%.
3.5.2. Konsentrasi Spermatozoa
Perhitungan pada dosis spermatozoa dilakukan dengan slide
hemositometer dengan menggunakan metode Partodiharjo (1992). Caranya, pipet
eritrosit diisi dengan sperma yang belum diencerkan sampai tanda 0,5.
Selanjutnya, larutan eosin 0,2% dihisap sampai tanda 101 pada pipet eritrosit.
Campuran dikocok dengan hati-hati menurut pola angka 8 selama 3 menit.
Beberapa tetes dibuang dan dikocok lagi, beberapa tetes dibuang lagi, dan
kemudian satu tetes ditempatkan di bawah gelas penutup (slide) hemositometer
pada ketebalan 0,1 mm, kemudian dosis spermatozoa dihitung pada kamar hitung
Neubauer.
Sel-sel spermatozoa dalam kamar dihitung menurut arah diagonal
(5 kamar) karena setiap kamar mempunyai 16 ruang kecil, maka dalam kamar
terdapat 80 ruang kecil. Seluruh gelas hemositometer memiliki 400 ruangan kecil.
Volume setiap ruangan kecil adalah 0,1 mm3. Pengenceran 200 kali (101/0,5).
Apabila dalam 5 kamar atau 80 ruang kecil kemudian terdapat Y spermatozoa,
maka dosis spermatozoa yang diperiksa adalah:
Dosis spermatozoa = Y x (400/80) x 10 x 200
= Y x 0,01 juta spermatozoa/mm3
25
3.5.3. Viabilitas Spermatozoa
Sebanyak 10 µL larutan spermatozoa diambil dengan menggunakan
mikropipet dan diteteskan pada kaca objek, kemudian diteteskan larutan eosin-Y
sebanyak 10 µL, ditutup dengan kaca penutup dan diamati dengan mikroskop
pembesaran 400x. Prinsip pewarnaan dilakukan karena membran plasma sel
mati yang rusak dapat dimasuki oleh zat warna. Persentase jumlah
spermatozoa hidup dapat diketahui dengan menghitung jumlah spermatozoa hidup
dari 100 spermatozoa untuk tiap ulangan. Spermatozoa hidup tidak harus
bergerak, tetapi memiliki kepala berwarna hijau sedangkan yang mati berwarna
merah. Jika jumlah spermatozoa yang immotile lebih dari 60%, harus
dilakukan uji viabilitas untuk melihat berapa banyak spermatozoa yang hidup.
Banyaknya spermatozoa hidup tetapi tidak motil menunjukkan adanya kelainan
struktur pada flagel (Partodiharjo, 1992).
3.5.4. Abnormalitas Spermatozoa
Sebanyak 10 µ L spermatozoa diambil dengan menggunakan
mikropipet dan diteteskan pada kaca objek. Selanjutnya, sampel tersebut
diwarnai dengan larutan eosin-Y dan dibuat sediaan oles dengan
menggeserkan kaca objek lain di atasnya. Kaca objek yang digeser membentuk
sudut 45° dan digeserkan hanya sekali geser. Sediaan oles spermatozoa
selanjutnya dikeringanginkan. Sediaan oles yang telah dikeringkan kemudian
difiksasi dengan metanol 96% selama 5 menit, selanjutnya sediaan diwarnai
dengan larutan giemsa selama 30 menit dan dibilas dengan air mengalir.
26
abnormalitas spermatozoa dilakukan berdasarkan jumlah spermatozoa normal dan
abnormal (Partodiharjo, 1992).
Jumlah spermatozoa abnormal
% Abnormalitas spermatozoa = x 100% Jumlah spermatozoa abnormal + normal
3.5.5. Kadar Hormon Testosteron
Pemeriksaan kadar hormon testosteron menggunakan metode
Imunofliorescence Immunoassay. Tikus jantan dimatikan dengan cara
mematahkan tulang leher pada tikus, kemudian darah diambil melalui jantung
sebanyak 1 ml dengan menggunakan spuite. Darah kemudian diperiksa di
Laboratorium Klinik Pramitra Biolab Indonesia Bandar Lampung untuk
mengukur kadar testosterone dalam serum. Darah yang diambil dimasukkan ke
eppendorf kemudian di sentrifuse. Serum disimpan pada suhu -21°C hingga siap
dilakukan analisis.
3.5.6. Berat Relatif Testis
Pengukuran bobot relatif testis tikus dilakukan terhadap bobot badan tikus
dengan rumus sebagai berikut:
Berat testis (g)
% Berat relatif testis = x 100% Berat badan (g)
3.5.7. Diameter dan Tebal Epitel Tubulus Semenifirus
Pemeriksaan diameter dan tebal epitel tubulus semenifirus dilakukan
dengan menggunakan metode uji histopatologi. Organ testis dimasukkan kedalam
27
bagian buffer neutral formalin 10%. Kemudian dilakukan pemotongan jaringan
(trimming) yaitu pemotongan tipis pada jaringan dengan ketebalan 5 mikron.
Jaringan didehidrasi pada tissue processor selama 23 jam dan dimasukkan ke
dalam cassete embedding, Selanjutnya pemotongan blok jaringan (cutting)
menggunakan mikrotom dengan ketebalan 4-5 mikron. Pisau mikrotom kasar
difiksir pada mikrotom, kemudian mengambil blok jaringan untuk dipotong pada
bagian permukaan. Permukaan yang akan dipotong didinginkan dengan balok es
dan difiksir pada mikrotom. Blok jaringan dipotong dengan pisau mikrotom kasar,
sehingga didapatkan permukaan rata. Blok jaringan dipotong kembali dengan
menggunakan pisau mikrotom halus dan dipilih potongan yang terbaik. Potongan
jaringan diambil dengan menggunakan jarum ose dan kuas. Kemudian jaringan
diapungkan ke dalam bak air yang telah berisi larutan pengapung. Kemudian
jaringan disalut dengan gelas preparat yang telah berisi nomor patologi. Preparat
dimasukkan ke dalam inkubator dan dibiarkan semalam. Preparat siap diwarnai
dengan menggunakan haematoxylin dan eosin, kemudian diperiksa dengan
mikroskop pembesaran 400 x.
3.5.8. Angka Konsepsi dan Jumlah Fetus pada Tikus Betina
Angka konsepsi dan jumlah fetus pada tikus betina diamati dengan
menggunakan metode Astuti (2009). Terjadinya kopulasi diamati dengan
terdeteksinya spermatozoa pada vagina tikus betina dan dihitung sebagai hari
pertama kebuntingan. Tikus betina dimatikan pada umur kebuntingan 15 hari
dengan cara mematahkan tulang leher. Persentase tikus betina bunting dinyatakan
sebagai angka kebuntingan (angka konsepsi), serta dilakukan penghitungan
V. KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Pemberian minyak buah makasar berpengaruh terhadap peningkatan motilitas
spermatozoa, konsentrasi spermatozoa, viabilitas spermatozoa, abnormalitas
spermatozoa, hormon testosteron, diameter dan tebal epitel tubulus seminiferus,
serta jumlah fetus pada tikus betina.
2. Pemberian minyak buah makasar dosis 600 mg/kg bb meningkatkan kualitas
spermatozoa tikus jantan tertinggi dengan motilitas spermaozoa 85,75%,
konsentrasi spermatozoa 1,46x109, viabilitas spermatozoa 91,50%, abnormalitas
spermatozoa 23,75%, hormon testosteron 2,36 ng/mL, berat relatif testis 1,19%,
diameter tubulus semeniferus 250,72 µm, tebal epitel tubulus seminiferus 60,12
µm, serta menghasilkan angka konsepsi pada tikus betina sebesar 100% dengan
jumlah fetus 9,25 ekor.
5.2. Saran
Perlu dilakukan penelitian lebih lanjut pengaruh pemberian minnyak buah
DAFTAR PUSTAKA
Agarwal, A. 2005. Oxidadative Stress, DNA Damage and Apoptosis in Male Infertility: a Clinical Approach.BJU International. 25 (3):237-243.
Akib, H.R.T. 2006. Kebijakan Pengembangan Obat Asli Indonesia Menyongsong Era Pasar Bebas Asia 2006. Prosiding Seminar Tumbuhan Indonesia XXX. Bogor. 15-18 Oktober 2006.
Ang, H.H. and H.S. Cheang. 2001. Effects of Eurycoma longifolia Jack on Elevator Ani Muscle in Both Uncastrated and Testosterone Stimulated Castrated Intact Male Rats.Arc Phar Res.24:437-440.
Ang, H.H. and K.L. Lee. 2002. Effects ofEurycoma longifoliaJack on Libido in Middle Aged Male Rats. J Basic Clin Physol Pharmacol.13(3):249-254.
Ang, H.H., T.H. Ngai, and T.H. Tan. 2003. Effects of Eurycoma longifolia Jack on Sexual Qualities in Middle Aged Male Rats. Phytomed. 10(6-8):590-593.
AOAC. 1990. Official Methods of Analysis of the AOAC. AOAC Inc. Arlington. Virginia.
Ardhi. 2010. Tanaman Obat: Khasiat Buah Makassar Sebagai Anti Kanker. www.iptek.net.id. Diakses tanggal 21 September 2010. Indonesia.
Astuti, S. 2009. Kualitas Spermatozoa Tikus Jantan yang Diberi Tepung Kedelai Kaya Isoflavon.Majalah Kedokteran Bandung. 41(4):180-186.
Aziz, R.A. 2005. Engineering Spects of Herbal and Phytochemical Processing a Malaysian Perpective. Jurutera. Malaysia.
Bawm, B.S., H. Matsuura, A. Elkhateeb, K. Nabeta, Subeki, Y. Oku, and K. Katakura. 2008. Invitro Antitrypanosamal Activities of Quassinoid Compounds from the Fruit of Medicinal Plant Brucea javanic. Vet Parasitol.158(4):288-294.
Bernhoft, A. 2010. Bioactive Compoundd in Plants –Benefit and Risks For Man and Animals. Proceedings from a Symposium Held at The Norwegian Academy of Science and Letters. Oslo.
Brinkman, A.O. 2009. Androgen Fisologi Receptor and Metabolic
54
Combs, J.G.F. 1992. The Vitamins. Fundamental Aspects in Nutrition and Health.Academic Press Inc. San Diego.
Depkes R.I. 1989. Materia Medika Indonesia. Jilid V. Direktorat Jenderal Pengawasan Obat dan Makanan. Jakarta.
Deptan. 1999. Manual Standar Metode Diagnosa Laboratorium Kesehatan Hewan. Direktorat Bina Kesehatan Hewan. Jakarta.
Djelani, M.A. 2010. Konsentrasi Spermatozoa Mencit (Mus musculus) Swiss Webster L. setelah Pemberian Serbuk Rimpang Kunyit (Curcuma doestica) dengan Dosis Kronik. Buku Praktikum Laboratorium Biologi Struktur dan Fungsi Hewan Jurusan Biologi. Universitas Diponegoro. Semarang.
Elkhateeb, A., M. Yamasaki, K. Katakura, K. Nabeta, and H. Matsuura. 2008. Anti-babesial Quassinoids from the Fruits ofBrucea javanica. Nat Prod Commun.3(1):1-4.
Elpiana. 2011. Pengaruh Monosodium Glutamat terhadap Kadar Hormon Testosteron dan Berat Testis pada Tikus Putih Jantan (Rattus norvegicus). M. Biomed. (Tesis). Universitas Andalas. Padang.
Erlinasari, D. 2000. Pengaruh Penyuntikan Depot Medroksi Progesteron Asetat (DMPA) Terhadap Histologi Testis Mencit (Mus musculud Linn). (Skripsi). FMIPA Unila. Bandar Lampung.
Ernawati dan A. Nurliani. 2012. Efek Antioksidan Ekstrak Etanol Bulbus Bawang Dayak (Eleutherine americanaMerr.) terhadap Struktur Mikroanatomi Tubulus Seminiferus Testis Tikus yang Dipapar Asap Rokok. (Skripsi). FMIPA Universitas Lambung Mangkurat. Kalimantan Selatan.
Favig, E.M. and O. Foad. 2009. Serum and Plasma levels of Total and Free Testosterone Binding Globulins in Rats Growing in the Belaow Sea Level Environtment of the Jordan Valley.Endocr. 5(2):1-6.
Flohe, R.B. and M.G. Traber. 1999. Vitamin E: Function and Metabolism. The Faseb Journal. 13:1145-1155.
Finlayson, A. and S. Sanders. 2007.Crash Course: Endocrine and Reproductive Systems. 3rd Edition. Elsevier Limited. Philadelphia.
55
Gaman, P.M. and K.B. Sherrington. 1994.Pengantar Ilmu Pangan, Nutrisi, dan Mikrobiologi. Penerjemah Gardjito, Naruki, Murdiati, dan Sardjono. Gadjah Mada University Press. Yogyakarta.
Gulkesen, K.H., T. Erdogru, C.F. Sargin, and G. Karpuzoglu. 2002. Expression of Extracellular Matrix Proteins and Vimentin in Testes of Azoospermic Man: An Immunohistochemical and Morphometric Study.Asian J Androl.
6:55-60.
Guru, P.Y., D.C. Warhurst, A. Harris, and J.D. Phillipson. 1983. Antimalarial Activity of BruceantinIn Vitro. Ann Trop Med Parasitol.77: 433-735.
Guyton, A.C., and J.E. Hall. 2000.Reproduktive and Hormonal Functions of the Male (and Function of the Pineal Gland). In Textbook of Medical Physiology.W.B.Saunders. Philadelphia.
Hadiah, T.J. 2002. Pasak Bumi (Jamu) IndonesiaWebsite:http://www.Pasak bumi.com./konstituen-efek.html. Diakses tanggal 14 Mei 2015.
Hedge, P.S., S. Namakkal, Rajasekaran, and T.S. Chandra. 2005. Effect of the Antioxidant Properties of Millet Species on Oxidative Stress and Glycemic Status in Alloxan Induced Rats. Nutrition Research. 25:1109-1120.
Hidayaturrahmah. 2007. Waktu Motilitas dan Viabilitas Spermatozoa Ikan Mas (Cyprinus carpioL) pada Beberapa Konsentrasi Larutan Fruktosa. Jurnal Biologi Universitas Lambung Mangkurat. 4(1):9-18.
Hafy, Z. dan N. Moeloek. 2001. Tinjauan Ultrastruktur dan Molekuler Sel Spermatozoa pada Kelainan Primary Ciliany Dyskeria (PCD) sebagai Salah Satu Penyebab Infertilitas Laki-laki serta Peranan Teknik IVF sebagai Alteranatif Utama Penanggulangannya. Majalah Kedokteran Indonesia.51(11):401-406.
Hardjopranoto, S. 1995.Ilmu Kemajiran pada Ternak. AUP. Surabaya.
Ilyas, S. 2007. Azoozpermia dan Pemulihannya Melalui Regulasi Apoptosis Sel Spermatogenik Tikus (Rattus sp.) pada Penyuntikan Kombinasi TU dan MPA. (Disertasi). Program Doktor Ilmu Biomedik Fakultas Kedokteran Universitas Indonesia. Jakarta.
Iswara, A. 2009. Pengaruh Pemberian Antioksidan Vitamin C terhadap Kualitas Spermatozoa Tikus Putih Terpapar Allethrin. (Skripsi). Universitas Negeri Semarang. Semarang.
56
Kempinas, W.G. and T.L. Lamano-Carvalho. 1988. A Method for Estimating the Concentration of Spermatozoa in the Rat Cauda Epididymidis.Laboratory Animals.22:154-6.
Krinke, G.J. 2000. The Handbook of Experimental Animal The Laboratory Rat.
Academy Press. New York.
Komala, S.S. 2004. Efek Pemberian Ekstrak Daun Kumis Kucing (Orthosiphon spicatus) terhadap Uji Kualitas Spermatozoa Mencit (Mus musculus
Linn.). (Skripsi). FMIPA Unila. Bandar Lampung.
Lamirande, E. and C. Gagnon. 1992. Reactive Oxygen Species (ROS) and Human Spermatozoa: Depletion of Adenosine Triphosphate.J Androl.13: 379-386.
Larasaty, W.S. 2013. Uji Anti Ekstrak Etil Asetat Biji Jarak Pagar (Jatropha curcas L.) pada Tikus Putih Jantan (Rattus norvegicus) Galur Sprague Dawley Secara In Vivo. (Skripsi). Universitas Islam Negeri Syarif Hidayatullah. Jakarta.
Masrizal dan Efrizal. 1997. Pengaruh Ratio Pengenceran Mani Terhadap Fertilisasi Sperma dan Daya Tetas Telur Ikan Mas (Cyprinus carpio L).
Fisheries Journal Garing. 6:47-55.
Mayes, P.A. 2003. Metabolisme Asam Lemak Tak Jenuh dan Eikosanoid. In Murray, R.K., D.K. Granner, P.A. Mayes, and V.W. Rodwell (Eds). Biokimia Harper. Alih bahasa Andri Hartono, A., P. Anna, Bani, Tiara, M.N. Sikumbang. EGC. Jakarta.
Metha R.H., H. Sridhar, B.R. Vijay Kumar, and T.C. Anand Kumar. 2008. High Incidence of Oligozoosperia and Teratozoospermia in Human Semen Infected with the Aerobik BacteriumStreptococcus faecalis.RBM online.
5:17-21.
Mooradian, A.D., J.E. Morley, and S.G. Korenman. 1987. Biological action of androgens. Endocr Rev.8(1):1-28.
Morgentaler, A. and C. Schulman. 2009. Testosteron and Prostate Safety. Front Horm Res. 37:197-203.
Manik, N.G.A., Ermayanti, dan N.M.R. Suarni. 2010. Kualitas Spermatozoa Mencit (Mus musculus L.) Setelah Perlakuan Infus Kayu Amargo Wood (Quassia amara Linn.) dan Pemulihannya. Jurnal Biologi Universitas Udayana. 15(1): 45-49.
Nalbandov, A.V. 1990. Fisiologi Reproduksi pada Mamalia dan Unggas.