EVALUASI DAYA PENETRASI ETIL
P-METOKSISINAMAT HASIL ISOLASI DARI
RIMPANG KENCUR (KAEMPFERIA GALANGA
L.)
PADA SEDIAAN SALEP, KRIM, DAN GEL
SKRIPSI
CHARINNA AGUS PRABAWATI
1111102000057
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
EVALUASI DAYA PENETRASI ETIL
P-METOKSISINAMAT HASIL ISOLASI DARI
RIMPANG KENCUR (KAEMPFERIA GALANGA
L.)
PADA SEDIAAN SALEP, KRIM, DAN GEL
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
CHARINNA AGUS PRABAWATI
1111102000057
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Skripsi ini adalah benar hasil karya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan benar.
Nama : Charinna Agus Prabawati
NIM : 1111102000057
Tanda Tangan :
Nama : Charinna Agus Prabawati
NIM : 1111112000057
Program Studi : Farmasi
Judul Skripsi : Evaluasi Daya Penetrasi Etil p-Metoksisinamat Hasil Isolasi dari Rimpang Kencur (Kaempferia Galanga L.) pada Sediaan Salep, Krim, dan Gel
Disetujui oleh
Pembimbing I
Yuni Anggraeni, M. Farm., Apt. NIP. 198310282009012008
Pembimbing II
Ismiarni Komala, M.Sc., Ph.D., Apt. NIP. 197806302006042001
Mengetahui,
Kepala Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
UIN Syarif Hidayatullah jakarta
Skripsi ini diajukan oleh:
Nama : Charinna Agus Prabawati
NIM : 1111102000057
Program Studi : Farmasi
Judul Skripsi : Evaluasi Daya Penetrasi Etil p-Metoksisinamat Hasil Isolasi dari Rimpang Kencur (Kaempferia Galanga L.) pada Sediaan Salep, Krim, dan Gel
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan (FKIK), Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
DEWAN PENGUJI
Pembimbing 1 : Yuni Anggraeni, M.Farm., Apt. ( )
Pembimbing 2 : Ismiarni Komala, M.Sc., Ph.D., Apt. ( )
Penguji 1 : Lina Elfita, M.Si., Apt. ( )
Penguji 2 : Ofa Suzanti Betha, M.Si., Apt. ( )
Ditetapkan di : Ciputat
Nama : Charinna Agus Prabawati Program Studi : Farmasi
Judul Skripsi : Evaluasi Daya Penetrasi Etil p-Metoksisinamat Hasil Isolasi dari Rimpang Kencur (Kaempferia galanga L.) pada Sediaan Salep, Krim, dan Gel
Etil p-metoksisinamat (EPMS) merupakan senyawa isolat terbesar dari ekstrak minyak atsiri kencur (Kaempferia galanga L.) yang memiliki aktivitas antiinflamasi. Pada penelitian ini EPMS diformulasikan ke dalam tiga bentuk sediaan setengah padat untuk tujuan terapi lokal antiinflamasi. Efek optimal dari sediaan yang telah dibuat dapat dinilai dari daya penetrasi obat melalui kulit teratas melalui uji penetrasi secara in vitro. Tujuan penelitian ini adalah untuk melihat profil pelepasan EPMS dari pembawanya, mempelajari pengaruh perbedaan formulasi sediaan tehadap kecepatan penetrasi EPMS melalui membran difusi, dan menentukan sediaan dengan daya penetrasi EPMS tertinggi. EPMS diisolasi dari ekstrak n-heksan kencur melalui tahap pemisahan kristal dan pencucian kristal. Kemurnian isolat kristal EPMS di uji dengan metode KLT, titik leleh dan Kromatografi Gas Spetrofotomeri Massa (GC-MS). Kristal EPMS hasil isolasi kemudian diformulasikan ke dalam sediaan salep, krim dan gel dengan kadar 1% pada masing-masing sediaan. Kadar EPMS dalam sediaan ditetapkan dengan metode Spektrofotometri UV-Vis. Pengujian penetrasi in vitro dilakukan dengan alat sel difusi franz menggunakan membran difusi berupa kulit tikus galur Sprague Dawley. Hasil dari penelitian ini menunjukkan bahwa kristal isolat dari kencur adalah murni EPMS 100%. Kadar EPMS dalam sediaan salep, krim, dan gel berturut-turut yaitu 0,86%, 1,03% dan 1,00%. Persentase jumlah kumulatif EPMS yang terpenetrasi per luas area pada jam ke-6 dari sediaan salep, krim dan gel berturut-turut yaitu 49,71 ± 3,85%, 77,29 ± 3,01%, dan 89,98 ± 4,82%. Kecepatan penetrasi EPMS pada jam ke-6 dari sediaan salep, krim, dan gel berturut-turut yaitu 45,22 ± 3,50 µgcm-2jam-1, 84,39 ± 3,29 µgcm-2jam-1dan 98,24 ± 5,26 µgcm-2jam-1. Berdasarkan hasil tersebut dapat disimpulkan bahwa sediaan gel memiliki daya penetrasi tertinggi diikuti sediaan krim dan salep.
Name : Charinna Agus Prabawati Study Program : Pharmacy
Title : Penetration Ability Evaluation of Ethyl p-Methoxycinnamate that Isolated from Kencur Rhizome (Kaempferia galanga L.) in The Ointment, Cream and Gel Dosage Forms
Ethyl p-methoxycinnamate (EPMC) is the main isolate compound from essensial oil of kencur (Kaempferia galangaL.) extract that has anti-inflammatory activity. In this study, EPMC was formulated in the three kinds of semi solid dosage forms with the purpose of local therapy. The optimum effect of semi solid dosage forms that had been made can assessed from penetration ability of the drugs through top skin layer by in vitro penetration test. This research aims to see the releasing profile of EPMC from its carriers, studied influence of different formulation toward flux penetration of EPMC through diffusion membrane, and deciding the kind of dosage form that has the highest penetration ability of EPMC. EPMC was isolated from n-hexane extract of kencur rhizome through separation of crystals and crystal purification stages. The purity of isolate EPMC crystals was examined by TLC, melting point and Gas Chromatography Mass Spectrometry (GC-MS) method. The isolate EPMC crystals was prepared in ointment, cream and gel dosage forms with 1% concentration of EPMC respectively. EPMC concentration in all of the dosage forms was determined by spectrophotometry UV-Vis method. Penetration ability test was examined by in vitro franz diffusion cell test uses rats Sprague Dawley strain skin as membrane diffusion. The results of this research shown that the isolate crystals of kencur is pure 100% EPMC. The percentage concentration of EPMC in ointment, cream and gel were 0,86%, 1,03% and 1,00% respectively. The percentage total cumulative penetration of EPMC from ointment, cream and gel preparation at 6th hour were 49,71 ± 3,85%, 77,29 ± 3,01%, and 89,98 ± 4,82% respectively. Flux penetration of EPMC from ointment, cream and gel preparation at 6th hour were 45,22 ± 3,50 µgcm-2jam-1, 84,39 ± 3,29 µgcm-2jam-1 and 98,24 ± 5,26 µgcm-2jam-1 respectively. Based on the result, it can be concluded that penetration ability of gel dosage form is higher than ointment and cream.
Puji dan Syukur penulis panjatkan kehadirat Allah SWT karena atas rahmat
dan karunia-Nya penulis dapat menyelesaikan skripsi yang berjudul “Evaluasi
Daya Penetrasi Etil p-Metoksisinamat Hasil Isolasi dari Rimpang Kencur (Kaempferia galanga L.) pada Sediaan Salep, Krim, dan Gel”. Shalawat dan
salam senantiasa terlimpah kepada junjungan, Nabi Muhammad SAW, teladan
bagi umat manusia dalam menjalani kehidupan.
Skripsi ini ditulis untuk memenuhi tugas akhir guna mendapatkan gelar
Sarjana Farmasi pada Program Studi Farmasi, Fakultas Kedokteran dan Ilmu
Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Pada penulisan
skripsi ini, penulis tidak terlepas dari bimbingan, arahan, bantuan serta dukungan
dari berbagai pihak. Oleh karena itu, dengan segenap kerendahan dan
kesungguhan hati penulis ingin mengucapkan terima kasih yang sebesar-besarnya
kepada:
1. Bapak Dr. Arif Sumantri S.K.M., M.Kes. selaku Dekan Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Bapak Yardi, Ph.D., Apt., selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
3. Ibu Yuni Anggraeni, M.Farm., Apt. Sebagai Pembimbing I dan Ibu Ismiarni
Komala, Ph.D., Apt sebagai Pembimbing II yang telah memberikan bimbingan,
ilmu, nasihat serta dedikasinya selama masa penelitian hingga penulisan
skripsi.
4. Bapak Surya, Bapak Mono, dan Bapak Endang dari PT. Iratco yang telah
membantu dalam memperoleh bahan penelitian.
5. Seluruh dosen Program Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta atas ilmu dan
pengetahuan yang telah diberikan.
6. Kedua orang tua tercinta, Ayahanda Agus Sutaji dan Ibunda Lusia Suratini
pernah terputus serta dukungan moral untuk penulis.
8. Seluruh anggota keluarga, Tante Herma, Om Eko, Nenek dan Kakek, Bayu,
Luthfi, Shofi yang senantiasa memberi kasih sayang, nasihat, hiburan serta
dukungan baik moral maupun materi untuk penulis.
9. Segenap laboran FKIK yang telah banyak membantu penulis melakukan
penelitian di laboratorium.
10. Happy, Beryl, Arum dan Kak Mentari yang selalu ada dan tak henti
memberikan semangat serta saran kepada penulis selama masa penelitian.
11. Teman-teman seperjuangan “Geng Unyils” (Diyah dan Robbani) atas
kebersamaan, bantuan, dan saran yang telah diberikan kepada penulis.
12. Rekan-rekan Mahasiswai S1 Farmasi UIN Syarif Hidayatullah Jakarta
angkatan 2011, yang telah menjadi bagian penting hidup penulis selama
menjalankan perkuliahan.
13. Semua pihak yang tidak dapat disebutkan namanya satu persatu yang telah
membantu dengan ikhlas baik secara langsung maupun tidak langsung dalam
proses penelitian dan penulisan skripsi.
Semoga semua kebaikan dan bantuan yang telah diberikan mendapatkan
balasan dari Allah SWT.Penulis menyadari bahwa dalam pembuatan laporan ini
masih terdapat banyak kekurangan dan kesalahan. Oleh karena itu, penulis
mengharapkan kritik dan saran yang membangun.
Akhir kata, penulis berharap semoga ilmu dan pengetahuan yang penulis
tuangkan dalam skripsi ini dapat memberikan manfaat bagi rekan sejawat dan
semua pihak yang membutuhkan, serta menjadi keberkahan tersendiri bagi penulis.
Jakarta, Oktober 2015
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Charinna Agus Prabawati
NIM : 1111102000057
Program Studi : Strata-1 Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan (FKIK)
Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah
saya, dengan judul :
EVALUASI DAYA PENETRASI ETILP-METOKSISINAMAT HASIL
ISOLASI RIMPANG KENCUR (KAEMPFERIA GALANGAL.) DARI SEDIAAN SALEP, KRIM DAN GEL
untuk dipublikasikan atau ditampilkan di internet atau media lain, yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian persetujuan publikasi skripsi/karya ilmiah ini saya buat dengan
sebenarnya.
Dibuat di: Ciputat
Pada tanggal: 16 Oktober 2015
Yang menyatakan,
Halaman
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENYATAAN ORISINILITAS... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ...v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI...x
DAFTAR ISI ... xi
DAFTAR GAMBAR ...xv
DAFTAR TABEL ... xvi
DAFTAR LAMPIRAN ... xvii
BAB 1 PENDAHULUAN ...1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 3
1.3 Tujuan Penelitian ... 3
1.4 Manfaat Penelitian ... 3
BAB 2 TINJAUAN PUSTAKA ...4
2.1 Kencur ... 4
2.1.1 Taksonomi Tumbuhan ... 4
2.1.2 Habitat Tumbuh ... 5
2.1.3 Morfologi Tanaman ... 5
2.1.4 Kandungan Kimia dan Kegunaan ... 6
2.2 Senyawa Etilp-Metoksisinamat dan Aktivitasnya ... 7
2.3 Kulit ... 8
2.3.1 Anatomi Kulit ... 8
2.3.2 Fisiologi dan Fungsi Kulit ... 11
2.7 Sediaan Gel ... 21
2.8 Formulasi Sediaan Setengah Padat ... 24
2.8.1 Lanolin Hidrat ... 24
2.8.2 Setil Alkohol ... 25
2.8.3 Vaselin Album ... 25
2.8.4 Asam Stearat ... 26
2.8.5 Isopropil Miristat ... 26
2.8.6 Minyak Zaitun ... 26
2.8.7 Vitamin E ... 27
2.8.8 Karbopol 940 ... 27
2.8.9 Natrium Metabisulfit ... 28
2.8.10 Metil Paraben dan Propil Paraben ... 29
2.8.11 Trietanolamin ... 30
2.8.12 Propilen Glikol ... 30
2.8.13 Alkohol 96 % ... 31
2.9 Ekstrak dan Ekstraksi ... 32
2.9.1 Maserasi ... 33
2.8.7 Vaccum Rotary Evaporator ... 33
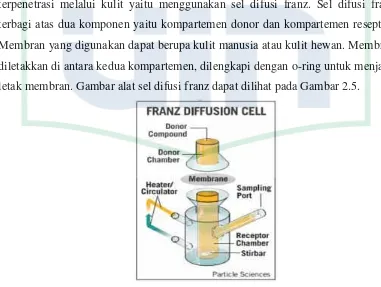
2.10 Uji Penetrasi Sediaan SecaraIn VitroMenggunakan Sel Difusi Franz ... 34
2.11 Spektrofotometri UV-Vis ... 35
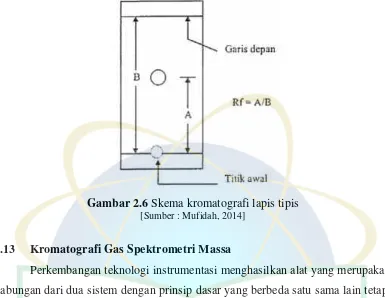
2.12 Kromatografi Lapis Tipis ... 36
2.13 Kromatografi Gas Spektrofotometri Massa (GC-MS) ... 38
BAB 3 METODE PENELITIAN ...40
3.1 Waktu dan Tempat Penelitian ... 40
3.2 Alat dan Bahan ... 40
3.2.1 Alat ... 40
3.2.2 Bahan ... 40
3.3.1.3 Ekstraksi ... 42
3.3.1.4 Isolasi Kristal Etilp-Metoksisinamat dari ekstrak Kencur ... 42
3.4 Identifikasi dan Uji Kemurnian Kristal Etilp-Metoksisinamat ... 42
3.4.1 Pemeriksaan Organoleptis ... 42
3.4.2 Pengujian Kromatografi Lapis Tipis (KLT) ... 43
3.4.3 Pengujian Titik Leleh ... 43
3.4.4 Pengujian Kromatografi Gas Spektrometri Massa ... 43
3.5 Pembuatan Sediaan ... 43
3.5.1 Sediaan Salep ... 44
3.5.2 Sediaan Krim ... 44
3.5.3 Sediaan Gel ... 45
3.6 Penetapan Kadar Etilp-Metoksisinamat dalam Sediaan ... 46
3.6.1 Pembuatan Kurva Kalibrasi Etilp-Metoksisinamat dalam Metanol ... 46
3.6.2 Pengukuran Kadar Etilp-Metoksisinamat dalam Sediaan 47 3.7 Uji Penetrasi Sediaan SecaraIn Vitro ... 47
3.7.1 Penyiapan Membran Difusi ... 47
3.7.2 Pembuatan Larutan EDP ... 48
3.7.3 Pembuatan Kurva Kalibrasi Etilp-Metoksisinamat dalam Larutan EDP ... 48
3.7.4 Uji Penetrasi Sediaan ... 49
3.7.5 Perhitungan Jumlah Kumulatif dan Kecepatan Penetrasi Zat Aktif ... 49
BAB 4 HASIL DAN PEMBAHASAN ...51
4.1 Isolasi kristal Etilp-Metoksisinamat ... 51
4.1.1 Pembuatan Ekstrak Kencur ... 51
4.1.2 Isolasi kristal Etilp-Metoksisinamat dari Ekstrak Kencur 52 4.2 Identifikasi dan Uji Kemurnian Kristal Etilp-Metoksisinamat ... 52
4.2.1 Pemeriksaan Organoleptis ... 53
4.3 Pembuatan Sediaan ... 56
4.3.1 Pembuatan Sediaan Salep ... 56
4.3.2 Pembuatan Sediaan Krim ... 57
4.3.3 Pembuatan Sediaan Gel ... 58
4.4 Penetapan Kadar Etilp-Metoksisinamat dalam Sediaan ... 58
4.4.1 Pembuatan Kurva Kalibrasi Etilp-Metoksisinamat dalam Metanol ... 59
4.4.2 Pengukuran Kadar Etilp-Metoksisinamat dalam Sediaan 59 4.5 Uji Penetrasi Sediaan SecaraIn Vitro ... 60
4.5.1 Pembuatan Kurva Kalibrasi Etilp-Metoksisinamat dalam Larutan EDP ... 60
4.5.2 Penyiapan Membran Sel Difusi dari Kulit Tikus ... 60
4.5.3 Pengujian Penetrasi Etilp-Metoksisinamat ... 61
4.5.4 Jumlah Kumulatif Zat Aktif Terpenetrasi Per Luas Area . 63 4.5.5 Fluks Penetrasi ... 66
BAB 5 KESIMPULAN DAN SARAN ...68
5.1 Kesimpulan ... 68
5.2 Saran ... 68
Halaman
Gambar 2.1 Rimpang Kencur (Kaempferia galangaL.) ... 4
Gambar 2.2 Struktur Etilp-Metoksisinamat ... 7
Gambar 2.3 Anatomi Kulit ... 9
Gambar 2.4 Rute Penetrasi Obat Melalui Kulit ... 15
Gambar 2.5 Kompartemen Sel Difusi Franz ... 34
Gambar 2.6 Skema Kromatografi Lapis Tipis ... 38
Gambar 4.1 Serbuk Simplisia Rimpang Kencur (Kaempferia galangaL.) ... 51
Gambar 4.2 Kristal Etilp-Metoksisinamat Hasil Isolasi ... 53
Gambar 4.3 Spot Senyawa Etilp-Metoksisinamat pada Plat Silica Gel F254nm Visualisasi Sinar UV λ 254 nm... 54
Gambar 4.4 Kromatogram Standar Etilp-Metoksisinamat ... 55
Gambar 4.5 Kromatogram Isolat Kristal Etilp-Metoksisinamat ... 56
Gambar 4.6 Sediaan Salep, Krim, dan Gel dengan Kandungan EPMS 1% ... 58
Gambar 4.7 Grafik Jumlah Kumulatif Etilp-Metoksisinamat yang Berdifusi Per Luas Area ... 63
Halaman Tabel 3.1 Formula Sediaan Salep ... 44
Tabel 3.2 Formula Sediaan Krim Struktur Etilp-Metoksisinamat ... 44 Tabel 3.3 Formula Sediaan Gel ... 45
Tabel 4.1 Jumlah Kumulatif Difusi Etilp-Metoksisinamat Per Luas Area dari Sediaan Salep, Krim dan Gel ... 63
Halaman
Lampiran 1. Kerangka Penelitian ... 76
Lampiran 2. Bagan Alur Ekstraksi Rimpang Kencur ... 77
Lampiran 3. Bagan Alur Rekristalisasi dan Karakterisasi Kristal EPMS ... 78
Lampiran 4. Gambar Alat Penelitian ... 79
Lampiran 5. Gambar Uji Difusi ... 79
Lampiran 6. Perhitungan Rendemen Kristal... 80
Lampiran 7. Nilai Luas Puncak dan Persentase |Kadar Etil p-Metoksisinamat 80 Lampiran 8. Data Hasil Uji Titik Leleh ... 81
Lampiran 9. Scanning Panjang Gelombang Maksimum Etilp-Metoksisinamat dalam Metanol ... 81
Lampiran 10. Data Absorbansi Kurva Standar EPMS dalam Metanol ... 81
Lampiran 11. Kurva Standar Etilp-Metoksisinamat dalam Metanol ... 82
Lampiran 12. Data Hasil Penetapan Kadar EPMS dalam Sediaan ... 82
Lampiran 13. Scanning Panjang Gelombang Maksimum Etilp-metoksisinamat dalam Larutan EDP ... 83
Lampiran 14. Data Absorbansi Kurva Standar EPMS dalam Larutan EDP ... 83
Lampiran 15. Kurva Standar Etilp-Metoksisinamat dalam Larutan EDP ... 84
Lampiran 16. Data Hasil Uji Difusi Salep ... 84
Lampiran 17. Data Hasil Uji Difusi Krim ... 85
Lampiran 18. Data Hasil Uji Difusi Gel ... 85
Lampiran 19. Data Fluks Penetrasi Salep ... 86
Lampiran 20. Data Fluks Penetrasi Krim ... 87
Lampiran 21. Data Fluks Penetrasi Gel ... 87
Lampiran 22. Uji Statistik Anova Persentase EPMS Terpenetrasi Perluas Area 88 Lampiran 23. Uji Statistik Anova Fluks Penetrasi ... 92
Lampiran 24. Contoh Perhitungan Kadar EPMS dalam Sediaan Gel ... 96
Lampiran 25. Contoh Perhitungan Penetrasi Kumulatif Zat Aktif Per Luas Area Sampel 1 Sediaan Salep Pada Menit ke 10 ... 98
1.1 Latar Belakang
Kencur (Kaempferia galanga L.) merupakan salah satu dari lima jenis
tumbuhan yang dikembangkan sebagai tanaman obat asli Indonesia. Kencur
merupakan tanaman obat yang bernilai ekonomis cukup tinggi sehingga banyak
dibudidayakan. Banyaknya manfaat kencur memungkinkan pengembangan
pembudidayaannya dilakukan secara intensif yang disesuaikan dengan produk
akhir yang diinginkan (Rostianaet al., 2005).
Penelitian Hasanah dkk (2011) melaporkan bahwa ekstrak rimpang kencur
ternyata memiliki aktivitas antiinflamasi. Dalam studi in vitro yang dilakukan oleh Umar et al., (2012) menyatakan bahwa efek antiinflamasi kencur terutama berasal dari komponen aktifnya yaitu etil p-metoksisinamat (EPMS). EPMS secara non-selektif menghambat aktivitas enzim COX-1 dan COX-2, dimana
enzim ini berguna dalam pembentukan prostaglandin yang merupakan mediator
inflamasi (Gosalet al., 2012).
Menurut penelitian terbaru yang dilakukan Umar et al., (2014). EPMS yang diisolasi dari kencur memiliki efek analgesik dan antiinflamasi yang
signifikan melalui mekanisme utama penghambatan sintesis de novo cytokines pro-inflamatory, meliputi TNF-α dan IL-1. Efek ini juga melibatkan penghambatan fungsi vital sel endogen seperti proliferasi, migrasi dan sintesis dari
vaskular endotel growth factor. Dengan demikian, EPMS dapat menjadi precursor potensial untuk pengembangan agen terapi dengan potensi untuk mengobati penyakit yang melibatkan peradangan.
Berdasarkan hasil uji efektivitas antiinflamasi in vitro dengan metode uji inhibisi denaturasi Bovine Serum Albumin (BSA) yang dilakukan oleh Mufidah (2014) melaporkan bahwa EPMS memiliki aktivitas antiinflamasi dengan nilai
IC50 34,9 ppm. Hal ini turut memvalidasi potensi EPMS sebagai precursor agen
terapi antiinflamasi sebagaimana dijelaskan pada penelitian Williamet al., (2008) bahwa suatu senyawa dianggap memiliki aktivitas antiinflamasi jika memberikan
Banyaknya penelitian yang memperkuat bukti bahwa EPMS memiliki
aktivitas antiinflamasi mendasari dilakukannya formulasi sediaan antiinflamasi
dengan zat aktif EPMS hasil isolasi dari ekstrak kencur. Bentuk sediaan setengah
padat dipilih karena dinilai memiliki efek samping yang lebih sedikit dan
kemampuan melekat yang cukup baik dan tahan lama serta pengaplikasiannya
yang mudah dibandingkan dengan sediaan topikal lainnya seperti, linimen, lotio
dan bedak (Asmara dkk, 2012). Selain itu, pemilihan bentuk sediaan ini juga
mengacu pada bentuk sediaan anti inflamasi topikal yang beredar di pasaran.
Menurut ISO Indonesia Vol. 49 (2014-2015), sediaan topikal antiinflamasi
terbanyak di pasaran yaitu bentuk sediaan krim dengan persentase sebesar 79%,
sediaan gel 11%, sediaan salep hanya 2% dan 18% sisanya terdiri dari bentuk
sediaan lainnya. Pemilihan bentuk salep, krim dan gel memiliki tujuan untuk
terapi lokal inflamasi. Tujuan terapi lokal hanya membutuhkan penetrasi obat
melalui kulit pada organ atau jaringan tertentu tubuh yang mengalami gangguan,
dengan harapan hanya sedikit atau tidak ada obat yang terakumulasi di sistemik
(Ranade et. al, 2004). Selain itu ketiga bentuk sediaan tersebut merupakan suatu alternatif untuk menghindari variabilitas ketersediaan hayati obat pada
penggunaan peroral (Ramadon, 2012).
Salah satu cara untuk melihat efek yang optimal dari sediaan setengah
padat adalah dengan melihat penetrasi obat melalui lapisan kulit teratas sehingga
efek farmakologinya dapat dirasakan (Iswandana, 2011). Faktor-faktor yang
mempengaruhi penetrasi obat melalui kulit antara lain profil pelepasan obat dari
pembawanya, afinitas zat aktif terhadap pembawa, kelarutan zat aktif dalam
pembawa dan pH pembawa. Pada penelitian Iswandana (2011) yang mengacu
pada artikel yang ditulis oleh Witt, K & Buck, D (2003) menyatakan bahwa
penelitian daya penetrasi secara in vitro merupakan cara termudah dan hemat dalam mengkarakterisasi absorpsi dan penetrasi obat melalui kulit. Hal tersebut
diperlukan untuk pengembangan formula sediaan setengah padat agar diperoleh
formula yang terbaik.
Berdasarkan latar belakang tersebut maka akan dilakukan evaluasi daya
franz dengan tujuan untuk membandingkan daya penetrasi dari ketiga bentuk
sediaan. Selanjutnya akan dihitung nilai persentase kumulatif dan kecepatan
penetrasi EPMS dari sediaan, kemudian ditentukan sediaan yang paling baik
sebagai pembawa EPMS berdasarkan parameter persentase kumulatif zat aktif
terpenetrasi per luas area dan kecepatan penetrasi zat aktif melalui membran
difusi.
1.2 Rumusan Masalah
a. Bagaimanakah profil pelepasan etil p-metoksisinamat yang terkandung dalam sediaan salep, krim, dan gel?
b. Bagaimanakah pengaruh perbedaan formulasi sediaan salep, krim, dan
gel terhadap kecepatan penetrasi etil p-metoksisinamat melalui membran difusi?
c. Sediaan setengah padat manakah yang memiliki daya penetrasi
senyawa etilp-metoksisinamat tertinggi?
1.3 Tujuan Penelitian
a. Melihat profil pelepasan senyawa aktif etil p-metoksisinamat pada sediaan salep, krim dan gel.
b. Mempelajari pengaruh perbedaan formulasi sediaan salep, krim dan
gel terhadap kecepatan penetrasi etil p-metoksisinamat melalui membran difusi.
c. Menentukan sediaan setengah padat yang memiliki daya penetrasi
senyawa aktif etilp-metoksisinamat tertinggi.
1.4 Manfaat Penelitian
Diharapkan hasil penelitian ini dapat memberikan manfaat sebagai berikut:
a. Meningkatkan nilai manfaat isolat rimpang kencur etil p-metoksisinamat sebagai precursor agen terapi untuk mengobati penyakit yang melibatkan peradangan.
2.1 Kencur
2.1.1 Taksonomi Tumbuhan (USDA)
Kedudukan kencur (Kaempferia galanga L.) dalam sistematika
(Taksonomi) tumbuhan diklasifikasikan sebagai berikut :
Gambar 2.1Rimpang kencur (Kaempferia galangaL.) [Sumber : koleksi pribadi]
Kingdom : Plantae (Tumbuhan)
Subkingdom : Traecheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Liliopsida (Berkeping satu/monokotil)
Sub Kelas : Commenlinidae
Ordo : Zingiberales
Famili : Zingiberaceae (Suku jahe-jahean)
Genus : Kaempferia
2.1.2 Habitat Tumbuh
Kencur merupakan terna kecil yang tumbuh subur di daerah dataran
rendah atau pegunungan yang tanahnya gembur dan tidak terlalu banyak air.
Kencur tumbuh dan berkembang pada musim tertentu, yaitu pada musim
penghujan. Kencur dapat ditanam di dalam pot atau di kebun yang cukup sinar
matahari, tidak terlalu basah dan di tempat terbuka (Depkes RI, 1987)
Kencur tumbuh dengan baik pada tanah yang gembur, sedikit berpasir dan
subur. Namun kencur cukup toleran terhadap tanah yang tidak terlalu subur.
Bahkan pada musim kemarau panjang, kencur masih dapat bertahan hidup, namun
tampak seolah mati suri. Di musim kemarau, semua daunnya mengering, tetapi
rimpang kencur masih dapat bertahan. Saat hujan atau disirami air, maka tunas
akan tumbuh kembali (Muhlisah, 1999).
2.1.3 Morfologi Tanaman
Kencur (Kaempferia galanga L.) termasuk dalam tanaman jenis
empon-empon yang mempunyai daging buah paling lunak, tidak berserat, berwarna putih,
dan kulit luarnya berwarna coklat. Rimpang kencur mempunyai aroma yang
spesifik (Anonim, 1987). Kencur merupakan terna yang hampir menutupi tanah,
tidak berbatang, rimpang bercabang-cabang, berdesak-desakan, akar-akar
berbentuk gelendong, kadang-kadang berumbi, panjang 1-1,5 cm. Daun berbentuk
jorong lebar sampai hampir bundar, pangkal hampir berbentuk jantung, ujung
lancip, bagian atas tidak berambut, bagian bawah berambut halus, pinggir
bergelombang berwarna merah kecoklatan, bagian tengah berwarna hijau, pinggir
helai daun 7-15 cm, lebar 2-8 cm, tangkai pendek, berukuran 3-10 mm, pelepah
terbenam dalam tanah, panjang 1,5-3,5 cm, warna putih (Depkes, 1977). Jumlah
helaian daun kencur tidak lebih dari 2-3 lembar dengan susunan berhadapan
(Anonim, 1987). Perbungaan, panjang 4 cm, bunganya tersusun setengah duduk
dengan mahkota bunga berjumlah antara 4 sampai 12 buah, bibir bunga berwarna
lembayung dengan warna putih lebih dominan dan mengandung 4-12 bunga.
Kelopak berbentuk tabung, panjang lebih kurang 3 cm, bergerigi 2-3 buah. Tajuk
berwarna putih dengan tabung panjang 2,5-5 cm, ujung berbelah-belah berbentuk
Sampai saat ini karakteristik utama yang dapat dijadikan sebagai pembeda
kencur adalah daun dan rimpang. Berdasarkan ukuran daun dan rimpangnya,
dikenal 2 tipe kencur, yaitu kencur berdaun lebar dengan ukuran rimpang besar
dan kencur berdaun sempit dengan ukuran rimpang lebih kecil. Biasanya kencur
berdaun lebar dengan bentuk bulat atau membulat, mempunyai rimpang dengan
ukuran besar pula, tetapi kandungan minyak atsirinya lebih rendah daripada
kencur yang berdaun kecil berbentuk jorong dengan ukuran rimpang lebih kecil.
Salah satu varietas unggul kencur dengan ukuran rimpang besar adalah varietas
unggul asal Bogor (Galesia-1) yang mempunyai ciri sangat spesifik dan berbeda
dengan klon dari daerah lain yaitu warna kulit rimpang cokelat terang dan daging
rimpang berwarna kuning, berdaun membulat, ujung daun meruncing dengan
warna daun hijau gelap (Rostianaet al., 2005).
2.1.4 Kandungan Kimia dan Kegunaan
Rimpang tumbuhan kencur mengandung saponin, flavonoid, polifenol, dan
minyak atsiri (Depkes, 2001). Kencur mengandung pati (4,14 %), mineral (13,73
%), minyak atsiri (0,02 %) berupa sineol, asam metil kanil dan penta dekan, asam
sinamat, etil ester, borneol, kamphen, paraeumarin, asam anisat, alkaloid, dan gom
(Anonim, 1987).
Menurut Umaret al., (2012) kandungan kimia dalam ekstrak minyak atsiri kencur diantaranya ialah asam propionate (4,71%), pentadekan 2,08%), asam
tridekanoat &(1,81%), 1,21-docosadiene (1,47%), beta-sitosterol (9,88%), dan
komponen terbesar adalah etil para metoksisinamat (80,05%). Selain itu pada
penelitian Tewtrakul et al.,(2005) juga disebutkan bahwa terdapat kandungan a-pinen, kamphen, karvon, benxen, eukaliptol, borneol dan metil sinamat.
Sebagai tanaman obat, kencur memberikan manfaat cukup banyak
terutama rimpangnya. Rimpang kencur berkhasiat untuk obat batuk, gatal-gatal
pada tenggorokan, perut kembung, rasa mual, masuk angin, pegal-pegal,
pengompresan bengkak, tetanus, penambah nafsu makan dan juga sebagai
minuman segar. Kencur dapat pula mengobati penyakit radang lambung, radang
Berbagai penelitian terbaru mengungkap banyak manfaat kencur lainnya,
diantaranya penelitian Tewtrakulet al., (2005) menyatakan ekstrak minyak kencur memiliki aktivitas anti mikroba dan antifungi. Ekstrak metanol kencur memiliki
toksisitas terhadap larva dan pupa Anopheles stephensi dan juga berpotensi sebagai repellent (Dhandapani et al., 2011). Ekstrak air dari kencur ternyata memiliki aktivitas sebagai antinosiseptif dan antiinflamasi (Sulaiman et al., 2008). Ekstrak alkohol dari kencur diteliti memiliki aktivitas sebagai antiinflamasi dan
analgesik (Vittalraoet al., 2011), juga memiliki aktivitas sebagai penyembuh luka (Tara Vet al., 2006)
2.2 Senyawa Etilp-Metoksisinamat dan Aktivitasnya
Etil p-metoksisinamat adalah suatu ester yang mengandung cincin benzen dan gugus metoksi yang bersifat non polar dan mengandung gugus karbonil yang
mengikat etil yang bersifat semi polar. Hal ini menyebabkan senyawa ini mampu
larut dalam beberapa pelarut dengan kepolaran bervariasi seperti etanol, etil
asetat, metanol, air dan n-heksan. (Taufikurohmah, Rusmini, Nurhayati, 2008)
Gambar 2.2Struktur etilp-metoksisinamat [Sumber : www.chemicalbook.com]
Etil p-metoksisinamat atau C12H14O3 termasuk turunan asam sinamat,
dimana asam sinamat adalah turunan senyawa fenil propanoad. Etil p-metoksisinamat sebelumnya dimanfaatkan sebagai bahan tabir surya (Windono
Jany, Widji, 1997), namun dewasa ini telah diteliti lebih lanjut bahwa etil p-metoksisinamat merupakan senyawa isolat kencur yang memiliki aktivitas sebagai
antiinflamasi non-selektif menghambat COX-1 dan COX-2 secarain vitro (Umar et al., 2012).
Senyawa etil p-metoksisinamat berbentuk kristal berwarna putih, berbau aromatik khas lemah dengan berat molekul 206.4 g/mol dan memiliki titik lebur
Etil p-metoksisinamat (EPMS) menghambat induksi edema karagenan pada tikus dengan MIC 100mg/kg dan juga berdasarkan hasil uji in vitro, etil p-metoksisinamat secara non-selektif menghambat aktivitas COX-1 dan COX-2,
dengan masing-masing nilai IC50 1,12 µM dan 0,83 µM. Hasil ini memvalidasi
aktivitas anti-inflamasi kencur yang dihasilkan oleh penghambatan COX-1 dan
COX-2 (Umaret al, 2012)
2.3 Kulit
Kulit merupakan selimut yang menutupi permukaan tubuh dan memiliki
fungsi utama sebagai pelindung dari berbagai macam gangguan dan rangsangan
dari luar (Tranggono, 2007). Kulit adalah bagian terluas dari tubuh, terhitung
lebih dari 10% dari massa tubuh dan bagian yang paling utama berinteraksi
dengan lingkungan (Walters, 2002). Kulit tersusun dari jaringan yang tumbuh,
berdiferensiasi, dan beregenerasi (Gregoriadis, Florence dan Patel, 1993).
Kulit adalah organ tubuh paling besar yang melapisi seluruh tubuh. Luas
kulit pada manusia rata-rata sekitar 2 m2dengan berat sekitar 10 kg jika ditimbang
dengan lemaknya atau 4 kg jika tanpa lemak, atau beratnya sekitar 16% dari berat
badan seseorang (Kusantati, Prihatin, dan Wiana, 2008). Kulit merupakan organ
yang pertama kali terkena polusi oleh zat-zat yang terdapat di lingkungan hidup,
termasuk jasad renik (mikroba) yang tumbuh dan hidup di lingkungan.Kulit juga
sangat kompleks, elastis dan sensitif, serta bervariasi pada keadaan ilkim, umur,
jenis kelamin, ras, dan lokasi tubuh (Kusantati, Prihatin, dan Wiana, 2008).
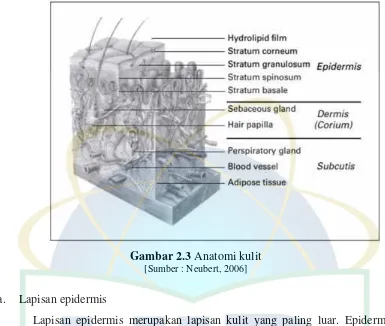
2.3.1 Anatomi Kulit
Kulit terbagi menjadi tiga lapisan utama, yaitu: epidermis, dermis, dan
subkutan (subkutis) (Seeley, Stepens dan Tate, 2003). Tidak ada garis tegas yang
memisahkan antara dermis dan subkutis. Subkutis ditandai dengan adanya
jaringan ikat longgar dan sel-sel yang membentuk jaringan lemak. Lapisan
epidermis dan dermis dibatasi oleh taut dermoepidermal (Kusantati, Prihatin, dan
Gambar 2.3Anatomi kulit [Sumber : Neubert, 2006]
a. Lapisan epidermis
Lapisan epidermis merupakan lapisan kulit yang paling luar. Epidermis
merupakan jaringan epitel berlapis pipih, dengan sel epitel yang mempunyai
lapisan tertentu. Epidermis tersusun dari beberapa lapisan sel dengan tebal sekitar
0,1-0,3 mm (Mitsui, 1997). Di dalam epidermis paling banyak mengandung sel
keratinosit yang mengandung protein keratin (Tranggono dan Latifah, 2007).
Lapisan ini terdiri atas:
1) Stratum korneum (lapisan tanduk), merupakan lapisan sel kulit mati yang
mengandung air paling rendah sekitar 10-30%. Lapisan ini tersusun atas
lipid (asam lemak bebas atau esternya, fosfolipid, skualen, dan
kolesterol), urea, asam amino, asam organik, dan air serta dilapisi oleh
lapisan tipis lembab dan bersifat asam disebut “mantel asam kulit”
(Tranggono dan Latifah, 2007).
2) Stratum lusidum (lapisan jernih)
3) Stratum granulosum (lapisan berbutir-butir), merupakan lapisan yang
4) Stratum spinosum (lapisan malphigi), merupakan lapisan sel yang lebih
dalam dan lapisan paling tebal dalam epidermis yang mengandung serat
protein.
5) Stratum germinativum (lapisan basal), merupakan pembatas membran
dasar yang kontak dengan dermis (Mitsui, 1997).
Normalnya dibutuhkan 3-4 minggu untuk replikasi epidermis dengan
proses divisi dan diferensiasi.
b. Lapisan dermis
Lapisan dermis merupakan lapisan di bawah epidermis yang jauh lebih
tebal dari pada epidermis (sekitar empat kali tebal dermis, tergantung area tubuh).
Secara metabolisme, dermis kurang aktif dibandingkan dengan epidermis serta
terdiri dari polisakarida dan protein (kolagen dan elastin). Di dalam dermis
terdapat benyak pembuluh darah, serabut saraf, kelenjar keringat, kelenjar
minyak, dan folikel rambut (Tranggono dan Latifah, 2007).
Dermis tersusun atas matriks ekstraseluler yang disintesis dan disekresikan
oleh fibroblast.Bahan dasar matriks ekstraseluler ini terdiri dari glikosaminoglikan
atau mukopolisakarida asam (asam hialuronat dan dermatan sulfat), dan protein
berserat.Glikosaminoglikan ada sebagai proteoglikan yang menggabungkan
protein, dan berisi sejumlah besar air sehingga dapat membentuk gel. Protein
berserat tertanam dalam gel ini yang tersusun dari serat kolagen dan elastin
(Mitsui, 1997).
Kolagen merupakan protein utama dari matriks ekstraseluler dan
memelihara bentuk jaringan. Kolagen tersusun atas beberapa asam amino,
terutama glisin, prolin, dan hidroksiprolin. Kolagen lebih tebal daripada elastin.
Serat-serat elastin dihubungkan satu sama lain oleh ikatan cross-link untuk mempertahankan elastisitas jaringan. Selain itu, matriks ekstraseluler berfungsi
sebagai mediator interaksi induksi reseptor antar sel sehingga mempengaruhi
proliferasi dan diferensiasi sel. Kolagen tipe I dan II merupakan urat saraf.
Kekuatan tegangan kulit diakibatkan oleh dominasi kolagen ini (Zhang & Falla,
2009). Oleh karena itu, dermis memegang peranan penting dalam elastisitas dan
Pada dermis terdapat sel mast, makrofag, melanosit, leukosit dan sel
endotelial dari pembuluh darah. Fungsi dermis adalah menutrisi epidermis dan
menghubungkan ke jaringan subkutan. Lapisan ini terdiri atas lapisan elastis dan
fibrosa dengan elemen-elemen selular dan folikel rambut (Wirakusumah, 1994).
Secara garis besar dibagi menjadi 2 bagian yaitu:
1) Pars papilare, yaitu bagian yang menonjol ke dalam epidermis, berisi ujung serabut saraf dan pembuluh darah.
2) Pars retikulare, yaitu bagian bawahnya yang menonjol ke arah subkutan, bagian ini terdiri atas serabut-serabut penunjang misalnya serabut
kolagen elastis dan retikulin.
c. Lapisan subkutan
Lapisan subkutan adalah kelanjutan dermis atas jaringan ikat longgar,
berisi sel-sel lemak di dalamnya. Sel lemak merupakan sel bulat, besar, dengan
inti terdesak ke pinggir karena sitoplasma lemak yang bertambah. Sel-sel ini
membentuk kelompok yang dipisahkan satu dengan yang lainnya oleh trabekulua
dan fibrosa. Lapisan sel lemak disebut panikulus adiposus, berfungsi sebagai
cadangan makanan. Di lapisan ini terdapat ujung-ujung saraf tepi, pembuluh
darah, dan saluran getah bening. Tebal jaringan lemak tidak sama, bergantung
pada lokasi, di abdomen 3 cm, sedangkan di daerah kelopak mata dan penis sangat
tipis. Lapisan lemak ini juga berfungsi sebagai bantalan (Kusantati, Prihatin, dan
Wiana, 2008).
Fungsi dari lapisan hipodermis yaitu membantu melindungi tubuh dari
benturan-benturan fisik dan mengatur panas tubuh. Jumlah lemak pada lapisan ini
akan meningkat apabila makan berlebihan. Jika tubuh memerlukan energi ekstra
maka lapisan ini akan memberikan energi dengan cara memecah simpanan
lemaknya (Wirakusumah, 1994). Pada lapisan ini juga terdapat pangkal dasar
folikel rambut dan kelenjar keringat.
2.3.2 Fisiologi dan Fungsi Kulit
Kulit merupakan batas antara tubuh dan lingkungan eksternal, sehingga
memisahkan kita dari lingkungan eksternal tetapi juga memungkinkan untuk
Kulit sebagai organ tubuh yang paling utama mempunyai beberapa fungsi
diantaranya sebagai berikut:
a. Fungsi proteksi (Dwikarya, 2003), terjadi karena beberapa hal:
1) Keasaman (pH) kulit akibat keringat dan lemak kulit (sebum) menahan
dan menekan bakteri dan jamur yang berada di sekitar kulit.
2) Jaringan kolagen dan jaringan lemak menahan atau melindungi organ
tubuh dari benturan.
3) Serabut elastis dari lapisan dermis dan jaringan lemak subkutan berfungsi
untuk mencegah trauma mekanik langsung ke dalam tubuh. Lapisan
tanduk dan mantel lemak kulit berfungsi sebagai penghalang penetrasi air
dan kehilangan cairan tubuh serta melawan racun dari luar. Permukaan
kulit yang tidak rata berperan dalam difraksi sinar untuk melindungi
tubuh dari sinar yang berbahaya.
b. Fungsi termoregulas
Kulit menyesuaikan temperatur tubuh dengan mengubah aliran darah ke
kulit melalui mekanisme dilatasi dan konstriksi pembuluh kapiler kulit dan
penguapan keringat, yang keduanya dipengaruhi oleh saraf otonom. Lapisan
tanduk dan jaringan subkutan mencegah perubahan temperatur tubuh dengan
menghalangi hantaran temperatur eksternal ke dalam tubuh.
Kulit melakukan peran ini dengan cara mengeluarkan keringat dan
mengerutkan otot dinding pembuluh darah kulit ketika terjadi peningkatan suhu.
Dengan dikeluarkannya keringat, maka terbuang pula panas tubuh. Mekanisme
termoregulasi ini diatur oleh sistem saraf simpatis yang mengeluarkan zat
perantara asetil kolin (Langley dan Lenny, 1958).
c. Fungsi persepsi sensoris
Kulit bertanggung jawab sebagai indra terhadap rangsangan. Ada
bermacam-macam reseptor pada kulit, yaitu reseptor yang sensitif terhadap
tekanan, rabaan, temperatur, dan nyeri. Rangsangan dari luar akan diterima oleh
reseptor-reseptor tersebut dan diteruskan ke sistem saraf pusat, selanjutnya
d. Fungsi absorpsi
Kulit yang sehat tidak mudah menyerap air, larutan maupun benda padat.
Tetapi cairan yang mudah menguap lebih mungkin diserap kulit, begitu pula zat
yang larut dalam minyak. Kemampuan absorpsi kulit dipengaruhi oleh tebal
tipisnya kulit, hidrasi, kelembaban udara, metabolisme dan jenis pembawa zat
yang menempel di kulit. Penyerapan dapat melalui celah antarsel, saluran kelenjar
atau saluran keluar rambut (Langley dan Lenny, 1958).
Beberapa senyawa dapat diabsorpsi ke dalam tubuh melalui dua jalur
absorpsi, yaitu melalui jalur epidermis dan melalui kelenjar sebasea folikel
rambut. Steroid dan bahan yang larut dalam lemak (vitamin A, D, E dan K) dapat
diserap melalui kulit, namun bahkan yang larut dalam air tidak mudah diserap
akibat dari fungsi penghalang lapisan tanduk.
e. Fungsi pembentukan pigmen (melanogenesis)
Sel pembentuk pigmen kulit (melanosit) terletak di lapisan basal
epidermis. Sel ini berasal dari rigi saraf, jumlahnya 1:10 dari sel basal. Jumlah
melanosit serta jumlah dan besarnya melanin yang terbentuk menentukan warna
kulit. Pajanan sinar matahari mempengaruhi produksi melanin. Bila pajanan
bertambah produksi melanin akan meningkat (Langley dan Lenny, 1958).
f. Fungsi keratinisasi
Keratinisasi dimulai dari sel basal yang kuboid, bermitosis ke atas berubah
bentuk lebih poligonal yaitu sel spinosum, terangkat ke atas menjadi lebih gepeng,
dan bergranula menjadi sel granulosum. Kemudian sel tersebut terangkat ke atas
lebih gepeng, dan granula serta intinya hilang menjadi sel spinosum dan akhirnya
sampai di permukaan kulit menjadi sel yang mati, protoplasmanya mengering
menjadi keras, gepeng, tanpa inti yang disebut sel tanduk. Proses ini berlangsung
terus-menerus dan berguna untuk fungsi rehabilitasi kulit agar dapat
melaksanakan fungsinya secara baik (Langley dan Lenny, 1958).
g. Fungsi poduksi vitamin D
Kulit juga dapat membuat vitamin D dari bahan baku
7-dihidroksikolesterol dengan bantuan sinar matahari. Namun produksi ini masih
lebih rendah dari kebutuhan tubuh akan vitamin D dari luar makanan (Langley
h. Fungsi lain
Kulit dapat menggambarkan kondisi emosional, seperti memerah,
ketakutan (pucat dan rambut berdiri), dan sebagai organ penerima emosi.
2.4 Penetrasi Obat Melalui Kulit
Penetrasi melintasi stratum korneum dapat terjadi karena adanya proses
difusi melalui dua mekanisme, yaitu :
a. Absorpsi transepidermal
Jalur absorpsi transepidermal merupakan jalur difusi melalui stratum
korneum yang terjadi melalui dua jalur, yaitu jalur transelular yang berarti jalur
melalui protein di dalam sel dan melewati daerah yang kaya akan lipid, dan jalur
paraselular yang berarti jalur melalui ruang antar sel. Penetrasi transepidermal
berlangsung melalui dua tahap. Pertama, pelepasan obat dari pembawa ke sratum
korneum, tergantung koefisien partisi obat dalam pembawa dan stratum korneum.
Kedua, difusi melalui epidermis dan dermis dibantu oleh aliran pembuluh darah
dalam lapisan dermis. (Anggraeni, 2008)
b. Absorpsi transappendageal
Jalur absorpsi transappendageal merupakan jalur masuknya obat melalui
folikel rambut dan kelenjar keringat disebabkan karena adanya pori-pori di
antaranya, sehingga memungkinkan obat berpenetrasi. Penetrasi obat melalui jalur
transepidermal lebih baik daripada jalur transappendageal, karena luas permukaan
pada jalur transappendageal lebih kecil (Anggraeni, 2008).
Faktor-faktor yang mempengaruhi absorpsi perkutan adalah sifat-sifat
fisikokimia dari obat, sifat pembawa yang digunakan, dan kondisi fisiologi kulit.
Dari sifat-sifat tersebut, dapat diuraikan faktor-faktor yang dapat mempengaruhi
absorpsi perkutan antara lain:
1) Harga koefisien partisi obat yang tergantung dari kelarutannya dalam minyak
dan air.
2) Kondisi pH akan mempengaruhi tingkat disosiasi serta kelarutan obat yang
lipofil.
4) Profil pelepasan obat dari pembawanya, bergantung pada afinitas zat aktif
terhadap pembawa, kelarutan zat aktif dalam pembawa, dan pH pembawa.
5) Komposisi sistem tempat pemberian obat, yang ditentukan dari permeabilitas
stratum korneum yang disebabkan hidrasi dan perubahan struktur lipid.
6) Peningkatan suhu kulit dapat menyebabkan perubahan difusi yang disebabkan
oleh peningkatan kelarutan obat.
7) Pembawa yang dapat meningkatkan kelembaban kulit akan mendorong
terjadi absorpsi obat melalui kulit.
8) Waktu kontak obat dengan kulit.
9) Ketebalan kulit. Absorpsi perkutan lebih besar jika obat digunakan pada kulit
dengan lapisan tanduk yang tipis daripada yang tebal.
10) Bahan-bahan peningkat penetrasi (enhancer) dapat meningkatkan
permeabilitas kulit dengan cara mengubah sifat fisika kimia stratum korneum
sehingga mengurangi daya tahan difusi. Contohnya DMSO, DMF, DMA,
urea, dan lain-lain.
11) Adanya sirkulasi darah in situ pada kulit akan meningkatkan absorpsi obat (Anggraeni, 2008).
Gambar 2.4 Rute penetrasi obat melalui kulit. (1) Rute transepidermal; (2)&(3) Rute transappendageal.
2.5 Sediaan Salep
Salep merupakan sediaan yang diaplikasikan secara eksternal, tetapi
berbeda dengan krim karena basis salep umumnya berminyak. Basisnya adalah
anhidrat yang dapat bercampur dengan sekresi kulit. Salep biasanya mengandung
suatu obat atau campuran obat terlarut atau terdispersi dalam basisnya. (Marriot,
John Fet al., 2010)
Menurut British Pharmacopoeia: “ Salep diformulasikan untuk sediaan
yang tidak dapat larut, larut atau dapat diemulsikan dengan sekresi kulit. Salep
hidrofobik dan salep pengemulsi-air dapat diaplikasikan pada kulit atau selaput
lendir untuk memperoleh efek emolien, pelindung, tujuan terapeutik atau
profilaksis sesuai tingkat oklusi yang diinginkan. Salep hidrofilik dapat bercampur
dengan sekresi kulit namun sifatnya kurang emolien (Marriot, John Fet al., 2010). Terdapat 4 peraturan dalam pembuatan salep menurut F. Van Duin, yaitu:
a. Peraturan salep pertama
“Zat-zat yang dapat larut dalam campuran lemak dilarutkan ke dalamnya, jika
perlu dengan pemanasan.”
b. Peraturan salep kedua
“Jika tidak ada peraturan lain, bahan-bahan yang larut dalam air dilarutkan
terlebih dahulu dalam air asalkan jumlah air yang digunakan dapat diserap
seluruhnya oleh dasar salep dan jumlah air yang dipakai, dikurangi dari dasar
salepnya.
c. Peraturan salep ketiga
“Bahan-bahan yang sukar larut atau hanya sebagian larut dalam minyak dan
air harus diserbukkan terlebih dahulu, kemudian diayak dengan pengayak No.
60.”
d. Peraturan salep keempat
“Campuran salep yang dibuat dengan cara dicairkan harus digerus sampai
dingin.” (Bahan-bahan yang ikut dilebur, penimbangannya harus dilebihkan
Metode pembuatan salep, diantaranya :
a. Metode fusi
1) Pembuatannya harus dilebihkan karena akan terjadi ketertinggalan
produk saat dipindahkan dalam wadah yang sesuai.
2) Tentukan titik leleh dari basis lemak kemudian dilelehkan atau dicairkan
secara bersamaan. Proses pencairan diawali dengan basis yang memilki
titik leleh tinggi, masing-masing basis harus mencair pada suhu serendah
mungkin atau saat dimana campuran sudah mulai dingin.
3) Tambahkan bahan-bahan pada wadah diatas waterbath untuk menghindari pemanasan berlebih. Gunakan termometer untuk
pemeriksaan suhu secara teratur.
4) Bahan-bahan yang ditambahkan ke dalam basis harus sesuai dengan suhu
titik leleh masing-masing bahan. Aduk terus menerus sampai sediaan
homogen. Pengadukan harus dilakukan secara perlahan untuk
menghindari adanya udara berlebih yang dapat mempercepat
pendinginan dan membuat sediaan menjadi kental (Marriot, John Fet al., 2010).
b. Penambahan zat aktif dalam bentuk padatan ke dalam dasar salep
1) Zat aktif yang larut dalam dasar salep
Zat aktif ditambahkan ke dalam dasar salep lemak pada temperatur yang
sangat rendah dan pencampuran dilakukan sampai campuran tersebut
dingin (Marriot, John Fet al., 2010).
2) Zat aktif yang tidak larut dalam dasar salep
a) Serbuk kasar
Dasar salep yang sudah meleleh atau mengental dimasukkan ke
dalam lumpang. Kemudian masukkan serbuk kasar dan gerus dengan
cara levigasi sampai homogen. Kecepatan pengadukan harus
dilakukan sampai sediaan menjadi dingin (Marriot, John F et al., 2010).
b) Serbuk halus
Serbuk halus dicampurkan dengan cara triturasi. Masukkan dasar
salep ke dalam lumpang dan ratakan untuk mencegah dasar salep
masuk ke pori-pori lumpang. Kemudian tambahkan serbuk halus dan
tambahkan dasar salep dengan cara “doubling-up” atau secara
geometri. Penambahan secara geometri maksudnya adalah
penambahan dasar salep yang jumlahnya sesuai dengan bobot yang
terdapat dalam lumpang dilakukan secara perlahan-lahan dan
bertahap. Kemudian campuran dicampurkan denga cara triturasi
sampai homogeny (Marriot, John Fet al., 2010).
c. Penambahan zat aktif dalam bentuk cairan ke dalam dasar salep
1) Cairan yang tidak menguap atau cairan yang larut
Cairan yang dapat larut dapat dicampur dengan dasar salep minyak. Jika
menggunakan dasar salep yang pre-prepared pencampuran dapat dikatakan sebagai cairan yang mudah menguap atau bercampur (Marriot,
John Fet al., 2010).
2) Cairan yang mudah menguap atau cairan yang tidak larut
Cairan yang mudah menguap harus ditriturasi dengan bahan dasar salep
dalam lumpang. Dasar salep dimasukkan ke dalam lumpang, kemudian
tambahkan dasar salep lain secara geometri. Kemudian aduk hingga
homogeny (Marriot, John Fet al., 2010).
2.6 Sediaan Krim
Krim adalah sediaan setengah padat yang berupa emulsi yang mengandung
satu atau lebih bahan obat yang terlarut atau terdispersi dalam bahan dasar yang
sesuai dan mengandung air tidak kurang dari 60 %. (Syamsuni,H. 2002).
terdispersi dalam dasar yang sesuai. Istilah ini secara tradisional telah digunakan
untuk sediaan setengah padat yang mempunyai konsentrasi relatif cair yang
diformulasi sebagai emulsi air dalam minyak atau minyak dalam air. Sekarang ini
batasan tersebut lebih diarahkan untuk produk yang terdiri dari emulsi minyak
dalam air atau dispersi mikrokristal asam-asam lemak atau alkohol berantai
panjang dalam air, yang dapat dicuci dengan air atau lebih ditujukan untuk
penggunaan kosmetika dan estetika.
Fungsi krim adalah sebagai bahan pembawa substansi obat untuk
pengobatan kulit, sebagai bahan pelumas untuk kulit, dan sebagai pelindung untuk
kulit yaitu mencegah kontak permukaan kulit dengan larutan berair dan
rangsangan kulit (Anief, 2000).
Menurut British Pharmacopoeia, “ Krim diformulasikan untuk sediaan
yang dapat bercampur dengan sekresi kulit. Sediaan krim dapat diaplikasikan pada
kulit atau membran mukosa untuk pelindung, efek terapeutik, atau profilaksis
yang tidak membutuhkan efek oklusif”(Marriot, John Fet al., 2010).
Prinsip umum dalam preparasi sediaan krim, seperti sediaan emulsi dan
yang lainnya, kebersihan merupakan hal yang penting. Spatula dan peralatan
lainnya harus dibersihkan dengan IMS (Industrial Methylaed Spirits). IMS lebih
baik daripada air suling karena cepat menguap dan tidak meninggalkan residu.
Pembuatan krim harus dilebihkan karena pada proses pemindahan sediaan krim ke
wadah akhir, ada kemungkinan tertinggalnya sediaan di tempat yang sebelumnya.
Menentukan bahan yang larut dalam fase air atau yang larut dalam fase minyak.
Larutkan bahan yang larut air dalam fase air. Lelehkan basis lemak dalam cawan
evaporasi di atas waterbath dalam suhu serendah mungkin. Proses ini diawali dengan melelehkan basis yang memiliki titik leleh tinggi. Setelah itu didinginkan
pada suhu 60°C (pemanasan yang berlebihan dapat mendenaturasi agen
pengemulsi dan menghilangkan stabilitas produk). Zat-zat yang dapat larut
dengan fase minyak harus diaduk sampai mencair. Suhu fase cair harus
disesuaikan 60°C. Fase terdispersi kemudian ditambahkan ke dalam fase
pendispersi pada suhu yang sama. Oleh karena itu, untuk produk minyak dalam
air, maka minyak yang ditambahkan ke dalam air. Sedangkan untuk produk air
terus dilakukan tanpa adanya udara. Jangan mempercepat proses pendinginan
karena akan menghasilkan produk yang buruk. (Marriot, John Fet al., 2010) Syarat-syarat krim yang baik adalah :
a. Stabil selama dalam pemakaian pada suhu kamar dan kelembaban yang ada
dalam kamar
b. Lunak yaitu semua zat dalam keadaan halus
c. Seluruh produk homogen
d. Mudah dipakai
Pertimbangan yang terpenting bagi sediaan emulsi seperti krim di bidang
farmasi dan kosmetika adalah stabilitas dari produk jadi. Menurut Anief (2000)
ketidakstabilan emulsi dapat digolongkan menjadi :
a. Flokulasi ataucreaming
b. Koalesen atau pecahnya emulsi (breaking, cracing)
c. Macam-macam perubahan fisika dan kimia
d. Inverse
Creamingadalah terpisahnya emulsi menjadi dua lapiasan, dimana lapisan yang satu mengandung butir-butir tetesan (fase terdispersi) lebih banyak dari pada
lapisan yang lain.Creamingmerupakan proses bolak-balik, sedangkan pemecahan merupakan proses searah. Krim yang menggumpal bisa didispersikan kembali
dengan mudah, dan dapat terbentuk kembali suatu campuran yang homogen dari
suatu emulsi yang membentuk krim dengan pengocokan, karena bola-bola minyak
masih dikelilingi oleh suatu lapisan pelindung dari zat pengemulsi. Jika terjadi
pemecahan, pencampuran biasa tidak bisa mensuspensikan kembali bola-bola
tersebut dalam suatu emulsi yang stabil (Martin, 1993).
Inversi adalah peristiwa berubahnya tipe emulsi dari tipe M/A menjadi
A/M atau sebaliknya. Inverse dapat dipengaruhi oleh suhu, atau inverse
merupakan fungsi suhu (Lachmanet. al, 1994).
Bahan-bahan umum yang biasa ditambahkan pada sediaan krim yaitu :
2.7 Sediaan Gel
Gel merupakan sediaan semi padat yang transparan yang digunakan secara
topikal. Fase cair dari gel akan ditahan dalam tige dimensi matriks polimer. Bahan
obat dapat tersuspensi dalam matriks atau larut dalam fase cairnya. Gel cenderung
memiliki struktur yang lebih besar dari salep atau emulsi tergantung pada polimer
matriks pembentuknya (Marriot, John Fet al., 2010).
Gel sering digunakan dalam penghantaran obat yang mengandung polimer
yang dapat menjerap sejumlah air yang dikenal dengan hidrogel. Penyerapan
cairan berlangsung melalui pengembangan. Hal ini diikuti dengan peningkatan
volume dan membesarnya tekanan (tekanan pembengkakan sampai 100 Mpa, 103
at), dan peristiwa tersebut berkaitan erat dengan dihasilkannya panas positif.
Koloid linier yang digunakan untuk membentuk gel dapat mengembang tanpa
batas, artinya kondisi gel dapat diubah menjadi larutan dengan penambahan
pelarut yang lebih banyak. Dengan demikian jumlah air yang digunakan untuk
pengembangan sangat menentukan sifatrheologysediaan yang terbentuk.
Komposisi sediaan gel umumnya terdiri dari komponen bahan yang dapat
mengembang dengan adanya air, humektan, dan pengawet, terkadang diperlukan
bahan yang dapat meningkatkan penetrasi bahan berkhasiat.
a. Gel tautan–silang (cross link) secara kimia
Pada sistem ini, pemisahan fase makroskopik dicegah dengan adanya
tautan silang dan semakin tinggi densitas massa jenis dari senyawa penaut silang
maka semakin kuat. Kekuatan gel dapat diukur denganTexture analyzer.
Surfaktanionik dapat terikat dengan polimer nonionik, sehingga cara yang
efektif untuk memasukkan muatan ke dalam gel polimer nonionik adalah dengan
menambahkan surfaktan ionik. Muatan tersebut bergantung bergantung pada
ikatan kooperatif dari surfaktan pada rantai backbone polimer, maka pengembangan dari gel bergantung pada parameter yang mengendalikan ikatan
pada surfaktan. Saat panjang rantai alkil pada surfaktan meningkat, afinitas ikatan
pada polimer pun akan meningkat, sehingga secara efektif meningkatkan densitas
polimer. Derajat pengembangan secara langsung mempengaruhi pelepasan
b. Gel yang terbentuk oleh polimer polisakarida
Gel polisakarida bersifat temperature-reversible, terbentuk pada konsentrasi polimer yang relatif rendah umumnya dari turunan selulosa, struktur
gel dapat dibentuk pada konsentrasi antara 2-6%. Gel polisakarida dapat dibentuk
dengan memodifikasi ikatan silang secara kimia, yang dipengaruhi oleh pH.
c. Pembentuk gel alami
Pembentuk gel alami yang umum digunakan adalah xantan gum, gellan
gum, pektin dan gelatin. Xanthan gum dan gellan gum adalah polisakarida dengan
berat molekul besar yang diperoleh dari fermentasi menggunakan mikroba.
Larutan xanthan gum memiliki viskositas yang tinggi pada tekanan geser (shear
rate) yang rendah yang dapat menjaga partikel padat tetap tersuspensi dan mencegah emulsi mengalami koalesen. Gellan gum adalah pembentuk gel, efektif
pada penggunaan dengan jumlah yang sedikit, membentuk gel yang padat pada
konsentrasi rendah.
Selain bahan pembentuk gel, bahan tambahan lainnya yang sering
digunakan dalam pembuatan gel yaitu humektan, chelating agent, enhancer dan zat pengawet.
Metode pembuatan gel secara umum, diantaranya :
a. Panaskan semua komponen gel (terkecuali dengan air), kurang lebih sekitar
90oC.
b. Panaskan air, kurang lebih sekitar 90oC.
c. Tambahkan air ke minyak, aduk terus. Hindari pengadukan kuat karena hal
ini akan menimbulkan gelembung (Marriot, John Fet al., 2010).
Fungsi gel menurut Lachman et al., 1989 yaitu gel dapat digunakan untuk
pemberian oral, sediaan obat long-acting yang diinjeksikan secara intramuskular, bahan pengikat pada granulasi tablet, bahan pelindung koloid pada suspensi,
bahan pengental pada sediaan cair per oral, dan basis supositoria. Selain itu gel
juga dapat digunakan untuk obat yang diberikan secara setengah padat (non steril)
atau dimasukkan ke dalam lubang tubuh atau mata (steril) dan telah digunakan
Sifat dan karakteristik gel menurut Lachman et al 1989 adalah sebagai
berikut :
a. Swelling
Gel dapat mengembang karena komponen pembentuk gel dapat
mengabsorbsi larutan sehingga terjadi pertambahan volume. Pelarut akan
berpenetrasi di antara matriks gel dan terjadi interaksi antara pelarut dengan gel.
Pengembangan gel kurang sempurna bila terjadi ikatan silang antar polimer di
dalam matriks gel yang dapat menyebabkan kelarutan komponen gel berkurang
(Lachmanet al.,1989). b. Sinerasis
Suatu proses yang terjadi akibat adanya kontraksi di dalam massa gel.
Cairan yang terjerat akan keluar dan berada di atas permukaan gel. Pada waktu
pembentukan gel terjadi tekanan yang elastis, sehingga terbentuk massa gel yang
padat. Mekanisme terjadinya kontraksi berhubungan dengan fase relaksasi akibat
adanya tekanan elastis pada saat terbentuknya gel. Adanya perubahan pada
kepadatan gel akan mengakibatkan jarak antar matriks berubah, sehingga
memungkinkan cairan bergerak menuju permukaan. Sineresis dapat terjadi pada
hidrogel maupun organel (Lachmanet al.,1989). c. Efek suhu
Efek suhu mempengaruhi struktur gel. Gel dapat terbentuk melalui
penurunan temperatur tapi dapat juga pembentukan gel terjadi setelah pemanasan
hingga suhu tertentu. Polimer seperti MC, HPMC, terlarut hanya pada air yang
dingin membentuk larutan yang kental. Pada peningkatan suhu larutan tersebut
membentuk gel. Fenomena pembentukan gel atau pemisahan fase yang
disebabkan oleh pemanasan disebutthermogelation(Lachmanet al.,1989). d. Efek elektrolit
Konsentrasi elektrolit yang sangat tinggi akan berpengaruh pada gel
hidrofilik di mana ion berkompetisi secara efektif dengan koloid terhadap pelarut
yang ada dan koloid digaramkan (melarut). Gel yang tidak terlalu hidrofilik
dengan konsentrasi elektrolit kecil akan meningkatkan rigiditas gel dan
mengurangi waktu untuk menyusun diri sesudah pemberian tekanan geser. Gel
yang disebabkan karena terjadinya pengendapan parsial dari alginat sebagai
kalsium alginat yang tidak larut (Lachmanet al.,1989). e. Elastisitas dan rigiditas
Sifat ini merupakan karakteristik dari gel gelatin agar dan nitroselulosa,
selama transformasi dari bentuk larutan menjadi gel terjadi peningkatan elastisitas
dengan peningkatan konsentrasi pembentukan gel. Bentuk struktur gel resisten
terhadap perubahan atau deformasi dan mempunyai aliran viskositelastik. Struktur
gel dapat bermacam-macam tergantung dari komponen pembentuk gel (Lachman
et al.,1989). f. Rheologi
Larutan pembentuk gel (gelling agent) dan dispersi padatan yang terflokulasi
memberikan sifat aliran pseudoplastis yang khas, dan menunjukkan jalan aliran
non-newton yang dikarakterisasi oleh penurunan viskositas dan peningkatan laju
aliran (Lachmanet al.,1989).
2.8 Formulasi Sediaan Setengah Padat 2.8.1 Lanolin Hidrat
Lanolin hidrat atau disebut juga adeps lanae cum aqua (PhEur)
dideskripsikan sebagai campuran dari adeps lanae dan 25-30% b/b air suling.
Lanolin hidrat berfungsi sebagai agen pengemulsi dan basis salep. Lanolin hidrat
berwarna kuning pucat, dengan bau khas lemah. Lanolin hidrat biasanya
digunakan pada pembuatan sediaan salep dan krim tipe air dalam minyak (a/m).
Ketika meleleh oleh pemanasan dengan penangas air, lanolin akan terpisah
menjadi lapisan minyak jernih dan lapisan air jernih. Lanolin hidrat melebur pada
suhu 38-44°C, praktis tidak larut dalam kloroform, eter dan air. Hanya komponen
lemak dari lanolin hidrat yang larut dalam pelarut organik. Lanolin hidrat harus
disimpan dalam wadah tertutup baik, tertutup rapat dan terlindung dari cahaya,
kelembaban dan di tempat kering. Penyimpanan normal bertahan sampai 2 tahun.
Lanolin hidrat dapat mengandung pro-oksidan yang mungkin mempengaruhi
2.8.2 Setil Alkohol
Nama lain dari setil alkohol adalah alcohol cetylicus dan crodacol. Penggunaan setil alkohol pada sediaan farmasi sangat luas, diantaranya coating agent; emulsifying agent (2-5%); stiffening agent (2-10%). Setil alkohol merupakan serpihan putih licin, granul, atau kubus, putih, bau khas lemah, rasa
lemah. Setil alkohol memiliki titik lebur 45-52°C, larut dalam etanol 95% dan eter,
kelarutan meningkat dengan kenaikan suhu, praktis tidak larut dalam air. Mudah
larut ketika dilebur bersama dengan lemak, paraffin padat atau cair, dan isopropil
miristat. Setil alkohol tetap stabil meskipun terdapat asam, basa, cahaya dan udara
tidak menjadi tengik. Sebaiknya disimpan dalam wadah tertutup baik di tempat
yang kering dan sejuk. Inkompatibel dengan agen pengoksidasi kuat (Rowe,
Sheskey, Owen, 2006).
2.8.3 Vaselin Album
Vaselin album berwarna kuning pucat, transparan, massa lembut, sedikit
berbau dan sedikit berasa. Fungsi vaselin album adalah sebagai emolien, dan basis
salep. Kelarutan praktis tidak larut dalam aseton, etanol 95% panas atau dingin,
gliserin, dan air, larut dalam benzen, karbon disulfida, kloroform, eter, heksan dan
minyak lemak dan menguap. Pada paparan sinar, kemurnian dari vaselin album
menurun akibat berubah warna dan teroksidasi serta menghasilkan bau yang tidak
diinginkan. Oksidasi dapat dicegah dengan penambahan antioksidan yang cocok
seperti BHT, BHA dan tokoferol. Vaselin album dapat disterilisasi dengan
pemanasan kering. Meskipun vaselin album dapat disterilisasi dengan iradiasi
gamma, tetapi proses tersebut dapat mempengaruhi sifat fisik dari vaselin album
seperti mengembang, berubah warna, bau dan sifat rheologi. Vaselin album harus
disimpan dalam wadah tertutup baik, terlindung dari cahaya di tempat sejuk dan
kering. Vaselin album merupakan bahan inert dengan sedikit inkompatibilitas
2.8.4 Asam Stearat
Asam stearat adalah campuran asam organik padat yang diperoleh dari
lemak sebagian besar terdiri dari asam oktadekanoat, C18H36O2 dan asam
heksadekanoat, C16H32O2(Ditjen POM, 1979).
Pemerian asam stearat yaitu zat padat; putih atau kuning pucat; beberapa
terlihat mengkilap, padatan kristal atau serbuk putih atau putih kekuningan. Bau
khas kuat dan rasanya mirip lemak. Asam stearat memiliki titik lebur ≥ 54°C.
Kelarutannya mudah larut dalam benzen, karbon tetraklorida, kloroform, dan eter.
Larut dalam etanol 95%, heksan dan propilen glikol, praktis tidak larut dalam air.
Penggunaannya adalah sebagai basis krim dan saleb juga sebagai lubrikan tablet
(Rowe, Sheskey, Owen, 2006).
Asam stearat merupakan bahan yang stabil, penambahan antioksidan dapat
dilakukan untuk menjaga kestabilannya. Asam stearat harus disimpan dalam
wadah tertutup baik di tempat sejuk dan kering. Asam stearat inkompatibel
dengan banyak logam hidroksida dan agen pengoksida (Rowe, Sheskey, Owen,
2006).
2.8.5 Isopropil Miristat
Isopropil miristat merupakan cairan tidak berwarna dan praktis tidak
berbau. Larut dalam aseton, kloroform, etanol 95%, etil asetat, praktis tidak larut
dalam gliserin, glikol dan air. Isopropil miristat tidak kompatibel dengan parafin
padat karena akan menghasilkan campuran butiran, tetapi isopropil miristat
kompatibel dengan oksidator kuat. Isopropil miristat tahan terhadap oksidasi dan
hidrolisis, dan tidak menjadi tengik. Bahan ini harus disimpan dalam wadah yang
tertutup di tempat yang sejuk dan kering serta terlindung dari cahaya (Rowe,
Sheskey, Owen, 2006).
2.8.6 Minyak Zaitun



![Gambar 2.4Rute penetrasi obat melalui kulit. (1) Rute transepidermal; (2)&(3)Rute transappendageal.[Sumber : www.skin-care-forum.basf.com]](https://thumb-ap.123doks.com/thumbv2/123dok/1172100.769710/33.595.112.516.68.678/gambar-penetrasi-melalui-kulit-rute-transepidermal-transappendageal-sumber.webp)