SKRINING FITOKIMIA DAN UJI PENDAHULUAN ANTIKANKER EKSTRAK ETANOL DAUN CEREMAI (Phyllanthus acidus (L.) Skeels)
PADA MENCIT JANTAN MENGGUNAKAN METODE MIKRONUKLEUS
SKRIPSI
OLEH: RIZAYANI NIM 071501064
SKRINING FITOKIMIA DAN UJI PENDAHULUAN ANTIKANKER EKSTRAK ETANOL DAUN CEREMAI (Phyllanthus acidus (L.) Skeels)
PADA MENCIT JANTAN MENGGUNAKAN METODE MIKRONUKLEUS
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: RIZAYANI NIM 071501064
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
SKRINING FITOKIMIA DAN UJI PENDAHULUAN ANTIKANKER EKSTRAK ETANOL DAUN CEREMAI (Phyllanthus acidus (L.) Skeels)
PADA MENCIT JANTAN MENGGUNAKAN METODE MIKRONUKLEUS
OLEH: RIZAYANI NIM 071501064
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal: Juli 2011
Pembimbing I, Panitia Penguji
Prof. Dr. Sumadio Hadisahputra, Apt. Prof. Dr. Urip Harahap, Apt. NIP 195311281983031002 NIP 195301011983031004
Prof. Dr. Sumadio Hadisahputra, Apt.
Pembimbing II, NIP 195311281983031002
Dra. Masfria., M.S., Apt. Drs. Saiful Bahri, M.S., Apt. NIP 195707231986012001 NIP 195208241983031001
Drs. Ramadin Mukhtar, M.S., Apt. NIP 194909101980031002
SKRINING FITOKIMIA DAN UJI PENDAHULUAN ANTIKANKER DARI EKSTRAK ETANOL DAUN CEREMAI (Phyllanthus acidus (L.) Skeels) PADA
MENCIT JANTAN MENGGUNAKAN METODE MIKRONUKLEUS ABSTRAK
Kanker adalah pembentukan jaringan baru yang tidak normal dan bersifat ganas serta tidak terkendali. Penyakit ini disebabkan oleh terganggunya siklus sel akibat mutasi dari gen-gen pengatur pertumbuhan, yang terjadi karena diinduksi oleh suatu mutagen, seperti bahan kimia, radiasi, radikal bebas maupun infeksi dari beberapa jenis virus. Radikal bebas menyebabkan terjadinya mutasi sehingga terjadinya kerusakan DNA. Senyawa yang dapat menetralkan radikal bebas sehingga tidak terjadi mutasi dikenal sebagai antioksidan misalnya senyawa flavonoid dan polifenol. Daun ceremai mengandung senyawa flavonoid dan polifenol yang telah diteliti mempunyai aktifitas antioksidan yang diduga mempunyai efek sebagai antikanker.
Simplisia dikarakterisasi berdasarkan Materia Medika Indonesia dan diekstraksi dengan etanol 96% secara perkolasi. Skrining fitokimia dilakukan terhadap simplisia dan ekstrak etanol daun ceremai dan skrining antikanker dilakukan terhadap mencit jantan menggunakan metode mikronukleus yang diberikan secara oral 1 kali sehari selama 7 hari dengan dosis 200 mg/kg BB, 400 mg/kg BB dan 800 mg/kg BB. Siklofosfamid dosis 30 mg/kg BB digunakan sebagai penginduksi terjadinya sel mikronukleus dan suspensi CMC 1% sebagai pelarut ekstrak.
Dari hasil analisis statistik menunjukkan bahwa pemberian ekstrak etanol daun ceremai mampu menurunkan jumlah sel mikronukleus yang terbentuk secara signifikan terhadap kelompok kontrol positif (p < 0,05). Dengan demikian disimpulkan bahwa ekstrak etanol daun ceremai mempunyai aktivitas sebagai antikanker. Hasil uji efek antikanker menunjukkan bahwa ekstrak etanol daun ceremai dosis 800 mg/kg BB menurunkan jumlah sel mikronukleus yang sama secara statistik dengan kontrol normal. Ekstrak etanol daun ceremai dosis 800 mg/kg BB menurunkan jumlah sel mikronukleus lebih banyak dibandingkan dengan ekstrak etanol daun ceremai dosis 200 mg/kg BB dan 400 mg/kg BB.
PRELIMINARY PHYTOCHEMICAL SCREENING AND ANTICANCER TEST OF ETHANOLIC EXTRACT OF CEREMAI LEAVES (Phyllanthus
acidus (L.) Skeels) ON MALE MICE USING MICRONUCLEUS TEST METHOD
ABSTRACT
Cancer is the abnormal formation of new tissue which is malignant and uncontrolled. It is caused by disruption of the cell cycle due to mutations of genes regulating growth, which occurs due to induction by a mutagen, such as chemicals, radiation, free radicals and infection of several viruses. Free radicals cause mutations which leads to DNA damage. Compounds that can neutralize free radicals so mutations will not take place are known as antioxidants, for example flavonoids and poliyphenols. Ceremai leaves contain flavonoids and polyphenols that have been observed to have antioxidant activity alleged to have anticancer effects.
The simplex was characterized based on the Materia Medika Indonesia and extracted with 96% ethanol by percolation. Phytocemical screening was carried out on simplex and ethanol extract of Ceremai leaves and anticancer screening was carried out on male mice using micronucleus method, given orally 1 time a day for 7 days with a dose of 200 mg/kg bw, 400 mg/kg bw dan 800 mg/kg bw. Cyclophosphamide with dose of 30 mg/kg bb is used as an inductor of the occurrence of micronucleus cells and CMC 1% suspension as extract solvent
From the statistic analysis, it is showed that the administration of ethanol extract of ceremai leaves was able to reduce the number of micronucleus cells formed significantly to the positive control group (p < 0.05). Thus, it is concluded that ethanolic extract of the ceremai leaves has anticancer activity. The result of the anticancer effect test showed that the ethanolic extract of ceremai leaves dose 800 mg/kg bw reduced the number of micronucleus cells statistically similar to normal controls. The ethanolic extract of ceremai leaves dose 800 mg/kg bw reduced the number of micronucleus cells more than the extract of leaves ceremai dose of 200 mg/kg bw and 400 mg/kg bw.
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT atas segala nikmat yang tak
terhingga sehingga penulis bisa menyelesaikan penelitian dan penulisan skripsi
sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas
Farmasi. Shalawat dan salam kepada Rasulullah SAW.
Terima kasih yang sebesar-besarnya penulis sampaikan kepada almarhum
ayahanda Imran dan ibunda Rukiah, atas segala dukungan yang begitu luar biasa
yang telah diberikan kepada ananda, serta kepada kakakku Nana irhamni,
adik-adikku, Rizki Ardian dan Rizka Fazila, dan abang sepupuku Farid.
Penulis juga mengucapkan terima kasih yang sebesar–besarnya kepada :
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., dan Dra. Masfria, M.S., Apt.,
selaku pembimbing, yang telah membimbing dan mengarahkan penulis dari
awal penelitian hingga penyelesaian skripsi ini.
2. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi
USU dan Ibu Marianne, M.Si., Apt., selaku Kepala Lab.Farmakologi yang
telah memberikan fasilitas dan sarana dalam melakukan penelitian.
3. Ibu Dr. Marline Naenggolan, M.Si., Apt., selaku dosen wali yang telah
membimbing penulis selama masa pendidikan.
4. Bapak/Ibu staf pengajar di Fakultas Farmasi USU yang telah mendidik dan
membina penulis selama masa pendidikan.
5. Bapak Prof. Dr. Urip Harahap, Apt., Bapak Drs. Saiful Bahri, M.S., Apt., dan
Bapak Drs. Rasmadin Mukhtar, M.S., Apt., selaku dosen penguji yang telah
6. Kepada staf dan asisten Lab Farmakologi Bg Abdi, Bg Bagus, Bg Dadang, Ibu
Aminah, Ibu Poppy, Kak Wanda, Kak Nisa, Bg Harry, Kak Intan, Kak Tata,
Bg Rian, Bg Mumu, Fanny, Meliza, serta anggota lantai 3 Bg Rico, Bg Azhar,
Bg Ari, Bg Gokman, terkhusus kepada Bg Aulia dan Bg Hendra atas segala
bantuan dan motivasi selama ini.
7. Sahabat-sahabat penulis yang telah memberikan dukungan dan menjadi
penyemangat bagi penulis, Puji, Ayu, Danny, Ila, Fanny, Ade, teman-teman
mahasiswa stambuk 2007 serta kakak dan adik Kelas Fakultas Farmasi
Universitas Sumatera Utara.
Serta kepeda semua pihak yang tidak dapat penulis sebutkan satu persatu
yang telah banyak membantu dalam penyelesaian skripsi ini. Semoga Allah SWT
memberikan balasan yang berlipat ganda atas segala kebaikan dan bantuan yang
telah diberikan kepada penulis.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan,
sehingga penulis mengharapkan kitik dan saran yang bersifat membangun. Akhir
kata semoga tulisan ini dapat menjadi sumbangan yang berarti bagi ilmu
pengetahuan khususnya bidang Farmasi.
Medan, Juli 2011
Penulis,
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
ABSTRAK ………... ... iii
ABSTRACT ………... iv
KATA PENGANTAR ………. v
DAFTAR ISI ………... vi
DAFTAR TABEL ………... x
DAFTAR GAMBAR ………... xi
DAFTAR LAMPIRAN ………... xii
BAB I PENDAHULUAN ………... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ……… 4
BAB II TINJAUAN PUSTAKA ………... 5
2.1 Uraian Tumbuhan ……… 5
2.1.1 Sistematika Tumbuhan ……… 5
2.1.2 Nama Daerah ……….. 5
2.1.4 Kandungan Kimia Tumbuhan ……… 6
2.1.5 Khasiat Tumbuhan ……… 6
2.2 Ekstraksi ……….. 7
2.3 Metode-Metode Ekstraksi ……… 7
2.4 Kanker ………. 9
2.4.1 Proses Kanker ……… 9
2.4.2 Bahan-Bahan Penyebab kanker (Karsinogen) ………… 10
2.4.3 Tahap Terjadinya kanker ……… 11
2.4.4 Pencegahan Kanker ……… 11
2.4.5 Pengobatan Kanker ……… 12
2.5 Siklofosfamid ……… 14
2.5.1 Mekanisme Kerja ……… 14
2.6 Metode Uji Pendahuluan Antikanker ……… 15
2.6.1 Metode Ames ……….. 15
2.6.2 Metode Mikronukleus ………. 15
2.6.3 Metode Habig ……….. 16
BAB III METODOLOGI PENELITIAN …... 17
3.1 Alat dan Bahan ... 17
3.1.1 Alat-alat ... 17
3.1.2 Bahan-bahan ... 17
3.2 Hewan Percobaan ... 18
3.3 Pembuatan Larutan Pereaksi ……....……….. 18
3.3.3 Larutan Pereaksi Bouchardat …...……… 19
3.3.4 Larutan Pereaksi Molish ……… 19
3.3.5 Larutan Pereaksi Liebermann-Burchard ……… 19
3.3.6 Larutan Pereaksi Besi (III) Klorida 1% ………. 19
3.3.7 Larutan Pereaksi Timbal (II) Asetat ……….. 19
3.3.8 Larutan Pereaksi Natrium Hidroksida 2 N ……… 19
3.3.9 Larutan Pereaksi Asam Klorida 2 N ………. 19
3.4 Identifikasi Tumbuhan ………... 20
3.5 Pengumpulan dan Pengolahan Sampel ... 20
3.5.1 Pengumpulan Sampel ……… 20
3.5.2 Pengolahan Sampel ………... 20
3.6 Pemeriksaan Karakterisasi Simplisia ... 21
3.6.1 Pemeriksaan Makroskopik ………. 21
3.6.2 Pemeriksaan Mikroskopik ... 21
3.6.3 Penetapan Kadar Air ... 21
3.6.4 Penetapan Kadar Abu Total ... 22
3.6.5 Penetapan Kadar Abu Tidak Larut Asam ... 22
3.6.6 Penetapan Kadar Sari Larut Dalam Air ... 22
3.6.7 Penetapan Kadar Sari Larut Dalam Etanol ... 23
3.7 Pemeriksaan Skrining Fitokimia Simplisia ... 23
3.7.1 Pemeriksaan Alkaloid ... 23
3.7.2 Pemeriksaan Flavonoid ... 24
3.7.3 Pemeriksaan Tanin ... 25
3.7.5 Pemeriksaan Saponin ... 25
3.7.6 Pemeriksaan Steroid/Triterpenoid ... . 26
3.8 Pembuatan Ekstrak Etanol Daun Ceremai ... 26
3.9 Pemeriksaan Skrining Fitokimia Ekstrak Etanol Daun Ceremai ... 27
3.10 Uji Efek Antikanker Peroral ... 27
3.10.1 Penyiapan Hewan Percobaan ... 27
3.10.2 Penyiapan Suspensi CMC 1% ... 27
3.10.3 Penyiapan Suspensi Ekstrak Etanol Daun Ceremai (EEDC) ... 28
3.10.4 Penyiapan Larutan siklofosfamid (LS) 0,05% (b/v) .... 28
3.10.5 Pembuatan Serum Darah Sapi (SDS) ... 28
3.10.6 Pengujian Antikanker ... 28
3.10.7 Pembuatan Preparat Hapusan Sumsum Tulang Femur.. 29
3.11 Analisis Data ... 30
BAB IV HASIL DAN PEMBAHASAN ... 31
4.1 Simplisia dan Ekstrak ... 31
4.2`Pengujian Efek Antikanker …... 32
BAB V KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan ... 36
5.2 Saran ... 36
DAFTAR PUSTAKA... 37
DAFTAR TABEL
Halaman
Tabel 3.1 Hasil Pemeriksaan Karakterisasi Simplisia Daun Ceremai ... 44
Tabel 3.2 Hasil Pemeriksaan Skrining Fitokimia Serbuk Simplisia dan
DAFTAR GAMBAR
Halaman
Gambar 1.1 Diagram Kerangka Pikir Penelitian ……… 4
Gambar 3.1 Tumbuhan Ceremai …...………... 42
Gambar 3.2 Simplisia Daun Ceremai ………. 42
Gambar 3.3 Mikroskopik serbuk Simplisia Daun Ceremai Perbesaran 10 × 10 ……….….……….. 43
Gambar 3.4 Velocity 18R Refrigerated Centrifuge ………..……. 51
Gambar 3.5 Oral sonde ……….. 51
Gambar 3.6 Peralatan Bedah ..……….……….. 52
Gambar 3.7 Mikroskop ……….………. 52
Gambar 3.8 Mencit Jantan ……… 53
Gambar 3.9 Kontrol Normal ………. 54
Gambar 3.10 Kontrol positif .……….. 54
Gambar 3.11 Perlakuan (Suspensi EEDC dosis 200 mg/kg BB) ...……. 54
Gambar 3.12 Perlakuan (Suspensi EEDC dosis 400 mg/kg BB) ……… 55
Gambar 3.13 Perlakuan (Suspensi EEDC dosis 800 mg/kg BB) …... 55
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Hasil Identifikasi Tanaman ... 41
Lampiran 2 Karakteristik Tumbuhan Ceremai ………... 42
Lampiran 3 Hasil Pemeriksaan Karakterisasi dan Skrining Fitokimia Serbuk Simplisia dan Ekstrak Etanol Daun Ceremai …… 44
Lampiran 4 Perhitungan Hasil Pemeriksaan Karakterisasi Simplisia ... 45
Lampiran 5 Bagan Alur Penelitian ……… 50
Lampiran 6 Alat-alat ………. ... 51
Lampiran 7 Hewan Percobaan ………... 53
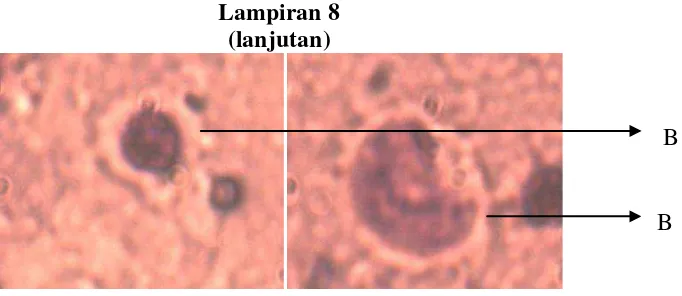
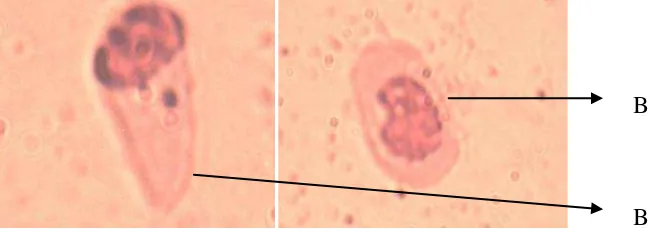
Lampiran 8 Sel Normal dan Sel Bermikronukleus ……….... 54
Lampiran 9 Contoh Perhitungan Dosis………... 57
lampiran10 Jumlah Sel Mikronukleus pada Sumsum Tulang Femur Mencit ……… 57
SKRINING FITOKIMIA DAN UJI PENDAHULUAN ANTIKANKER DARI EKSTRAK ETANOL DAUN CEREMAI (Phyllanthus acidus (L.) Skeels) PADA
MENCIT JANTAN MENGGUNAKAN METODE MIKRONUKLEUS ABSTRAK
Kanker adalah pembentukan jaringan baru yang tidak normal dan bersifat ganas serta tidak terkendali. Penyakit ini disebabkan oleh terganggunya siklus sel akibat mutasi dari gen-gen pengatur pertumbuhan, yang terjadi karena diinduksi oleh suatu mutagen, seperti bahan kimia, radiasi, radikal bebas maupun infeksi dari beberapa jenis virus. Radikal bebas menyebabkan terjadinya mutasi sehingga terjadinya kerusakan DNA. Senyawa yang dapat menetralkan radikal bebas sehingga tidak terjadi mutasi dikenal sebagai antioksidan misalnya senyawa flavonoid dan polifenol. Daun ceremai mengandung senyawa flavonoid dan polifenol yang telah diteliti mempunyai aktifitas antioksidan yang diduga mempunyai efek sebagai antikanker.
Simplisia dikarakterisasi berdasarkan Materia Medika Indonesia dan diekstraksi dengan etanol 96% secara perkolasi. Skrining fitokimia dilakukan terhadap simplisia dan ekstrak etanol daun ceremai dan skrining antikanker dilakukan terhadap mencit jantan menggunakan metode mikronukleus yang diberikan secara oral 1 kali sehari selama 7 hari dengan dosis 200 mg/kg BB, 400 mg/kg BB dan 800 mg/kg BB. Siklofosfamid dosis 30 mg/kg BB digunakan sebagai penginduksi terjadinya sel mikronukleus dan suspensi CMC 1% sebagai pelarut ekstrak.
Dari hasil analisis statistik menunjukkan bahwa pemberian ekstrak etanol daun ceremai mampu menurunkan jumlah sel mikronukleus yang terbentuk secara signifikan terhadap kelompok kontrol positif (p < 0,05). Dengan demikian disimpulkan bahwa ekstrak etanol daun ceremai mempunyai aktivitas sebagai antikanker. Hasil uji efek antikanker menunjukkan bahwa ekstrak etanol daun ceremai dosis 800 mg/kg BB menurunkan jumlah sel mikronukleus yang sama secara statistik dengan kontrol normal. Ekstrak etanol daun ceremai dosis 800 mg/kg BB menurunkan jumlah sel mikronukleus lebih banyak dibandingkan dengan ekstrak etanol daun ceremai dosis 200 mg/kg BB dan 400 mg/kg BB.
PRELIMINARY PHYTOCHEMICAL SCREENING AND ANTICANCER TEST OF ETHANOLIC EXTRACT OF CEREMAI LEAVES (Phyllanthus
acidus (L.) Skeels) ON MALE MICE USING MICRONUCLEUS TEST METHOD
ABSTRACT
Cancer is the abnormal formation of new tissue which is malignant and uncontrolled. It is caused by disruption of the cell cycle due to mutations of genes regulating growth, which occurs due to induction by a mutagen, such as chemicals, radiation, free radicals and infection of several viruses. Free radicals cause mutations which leads to DNA damage. Compounds that can neutralize free radicals so mutations will not take place are known as antioxidants, for example flavonoids and poliyphenols. Ceremai leaves contain flavonoids and polyphenols that have been observed to have antioxidant activity alleged to have anticancer effects.
The simplex was characterized based on the Materia Medika Indonesia and extracted with 96% ethanol by percolation. Phytocemical screening was carried out on simplex and ethanol extract of Ceremai leaves and anticancer screening was carried out on male mice using micronucleus method, given orally 1 time a day for 7 days with a dose of 200 mg/kg bw, 400 mg/kg bw dan 800 mg/kg bw. Cyclophosphamide with dose of 30 mg/kg bb is used as an inductor of the occurrence of micronucleus cells and CMC 1% suspension as extract solvent
From the statistic analysis, it is showed that the administration of ethanol extract of ceremai leaves was able to reduce the number of micronucleus cells formed significantly to the positive control group (p < 0.05). Thus, it is concluded that ethanolic extract of the ceremai leaves has anticancer activity. The result of the anticancer effect test showed that the ethanolic extract of ceremai leaves dose 800 mg/kg bw reduced the number of micronucleus cells statistically similar to normal controls. The ethanolic extract of ceremai leaves dose 800 mg/kg bw reduced the number of micronucleus cells more than the extract of leaves ceremai dose of 200 mg/kg bw and 400 mg/kg bw.
BAB 1 PENDAHULUAN 1.1 Latar Belakang
Kanker adalah pembentukan jaringan baru yang abnormal dan bersifat
ganas (Tan dan Rahardja, 2007). Kasus kanker di Indonesia dan beberapa Negara
di dunia tiap tahun terus meningkat, WHO memperkirakan pada tahun 2010,
kanker akan menjadi penyakit penyebab kematian nomor satu di dunia
mengalahkan serangan jantung. Menurut prediksi WHO, pada tahun 2030 akan
ada 75 juta orang yang terkena kanker di dunia (Republika Newsroom, 2009).
Menurut Prof. Tjandra Yoga, dalam data Riskesdas (2007), di Indonesia rasio
tumor atau kanker adalah 4,3 per 1000 penduduk.
Riset mengungkapkan bahwa kanker disebabkan oleh terganggunya siklus
sel akibat mutasi dari gen-gen yang mengatur pertumbuhan (Tan dan Rahardja,
2007). Terjadinya mutasi dari beberapa gen tersebut karena diinduksi oleh suatu
mutagen, seperti bahan kimia, radiasi, radikal bebas maupun infeksi dari beberapa
jenis virus (kelompok oncovirus) (Sudiana, 2008). Salah satu indikator terjadinya
mutasi adalah adanya mikronukleus. Mikronukleus merupakan hasil mutasi dari
kromosom utuh yang patah dan kemudian tampak sebagai nukleus berukuran
kecil di dalam suatu sel (Schmid, 1975). Mutasi yang terjadi akibat adanya radikal
bebas berawal dari teroksidasinya asam lemak tak jenuh pada lapisan lipid
membrane sel, reaksi ini mengawali terjadinya oksidasi lipid berantai yang
menyebabkan kerusakan membran sel, oksidasi lebih jauh akan terjadi pada
Beberapa laporan menyebutkan bahwa suatu antioksidan, yaitu senyawa
yang dapat menetralkan radikal bebas mempunyai aktivitas antimutagenik
(Ghaskadbi, 1992; Shiraki, 1994; Rompelberg, 1995). Sejumlah senyawa fenol
terutama flavonoid dan phenolic acid merupakan senyawa antioksidan yang
biasanya terdapat dalam buah dan sayur (Madhujith dan Shahidi, 2005).
Kekayaan akan flora di Indonesia sangat mendukung untuk pengembangan
pemakaian tanaman obat untuk kanker, tanaman obat dengan berbagai macam
kandungan berpeluang untuk lebih berperan dalam pengobatan kanker (Saputra,
2000).
Salah satu tumbuhan yang berkhasiat sebagai antikanker adalah Ceremai
(Phyllanthus acidus (L.) Skeels). Ceremai merupakan salah satu tumbuhan yang
mengandung senyawa flavonoid, polifenol, tannin dan saponin. Daun ceremai
berkhasiat mengobati kanker, selain itu juga berkhasiat sebagai peluruh dahak,
pencahar (purgatif), mual dan sariawan (Dalimartha dan Agriwidya, 1999).
Diduga efek antikanker yang dimiliki daun ceremai berasal dari kandungan
senyawa flavonoid dan polifenol yang berperan sebagai antioksidan. Agnes
Krismawati (2007), telah melakukan penelitian terhadap kandungan antioksidan
ekstrak etanol daun ceremai yang mencapai nilai 70%.
Berdasarkan uraian, untuk membuktikan efek antikanker dari daun ceremai
(Phyllanthus acidus (L.) Skeels), perlu dilakukan uji efek ekstrak etanol daun
ceremai sebagai antikanker yang dibandingkan dengan kelompok kontrol positif,
dengan siklofosfamid sebagai penginduksi terjadinya mikronukleus, dengan
menggunakan metode mikronukleus secara in vivo. Metode ini digunakan karena
dipertanggungjawabkan, waktu yang dibutuhkan singkat (Krishna dan Hayashi,
2000).
1.2Perumusan Masalah
Adapun perumusan masalah dalam penelitian ini yaitu:
1. Senyawa apakah yang terkandung dalam simplisia dan ekstrak etanol daun
ceremai?
2. Apakah ekstrak etanol daun ceremai (Phyllanthus acidus) mempunyai efek
antikanker?
1.3Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis:
1. Senyawa yang terkandung dalam simplisia dan ekstrak etanol daun ceremai
adalah flavonoid, tanin, glikosida dan saponin.
2. Ekstrak etanol daun ceremai (EEDC) mempunyai efek antikanker.
1.4Tujuan
Adapun tujuan penelitian ini adalah:
1. Untuk mengetahui senyawa apa yang terkandung dalam simplisia dan ekstrak
etanol daun ceremai.
1.5 Manfaat
Adapun manfaat dari penelitian ini adalah sebagai berikut:
1. Pengembangan daun ceremai menjadi suatu sediaan herbal terstandar yang
berefek sebagai antikanker.
2. Menambah inventaris tanaman obat yang berkhasiat sebagai antikanker.
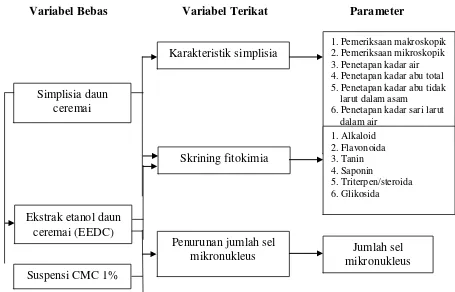
1.6 Kerangka Pikir Penelitian
Adapun kerangka pikir penelitian ini adalah sebagai berikut:
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Diagram Kerangka Pikir Penelitian Simplisia daun
ceremai
Ekstrak etanol daun ceremai (EEDC)
Suspensi CMC 1%
Karakteristik simplisia
Penurunan jumlah sel
mikronukleus mikronukleus Jumlah sel
1. Pemeriksaan makroskopik 2. Pemeriksaan mikroskopik 3. Penetapan kadar air 4. Penetapan kadar abu total 5. Penetapan kadar abu tidak
larut dalam asam
6. Penetapan kadar sari larut dalam air
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Pohon ini berasal dari India, dapat tumbuh pada tanah ringan sampai tanah
berat dan tahan akan kekurangan sampai kelebihan air. Ceremai banyak ditanam
orang di halaman, di ladang dan di tempat lain sampai ketinggian 1.000 m dpl
(Dalimartha dan Agriwidya, 1999).
2.1.1 Sistematika Tumbuhan
Menurut Johnny Ria Hutapea (1994) sistematika tumbuhan ceremai adalah
sebagai berikut:
Divisi : Spematophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Euphorbiales
Suku : Euphorbiaceae
Marga : Phyllanthus
Jenis : Phyllanthus acidus (L.) Skeels
2.1.2 Nama Daerah
Di beberapa daerah Indonesia, namanya berbeda-beda. Di Aceh disebut
ceremoi, cerme (Gayo), ceramai (Melayu), camin-camin (Minangkabau), careme,
cerme (Sunda), cerme (Jawa). Di Bali disebut carmen, cermen, careme (Madura),
2.1.3 Morfologi Tumbuhan
Ciri pohon kecil, tinggi sampai 10 m kadang lebih, percabangan banyak,
dan kulit kayu tebal. Daun tunggal, bertangkai pendek, tersusun dalam tangkai
membentuk rangkaian seperti daun majemuk. Helai daun bundar telur sampai
jorong, ujung runcing, pangkal tumpul sampai bundar, tepi rata, pertulangan
menyirip, permukaan licin tidak berambut, panjang 2 cm hingga 7 cm, lebar 1,5
cm hingga 4 cm. Warna hijau muda (Dalimartha dan Agriwidya, 1999).
Bila tangkai gugur akan meninggalkan bekas yang nyata pada cabang.
Perbungaan berupa tandan yang panjang 1,5 cm hingga 12 cm, keluar di
sepanjang cabang, kelopak bentuk bintang, mahkota merah muda. Terdapat bunga
betina dan jantan dalam satu tandan. Buahnya buah batu, bentuknya bulat pipih,
berlekuk 6 cm hingga 8 cm, panjang 1,25 cm hingga 1,5 cm, lebar 1,75 cm hingga
2,5 cm, warnanya kuning muda, berbiji 4 hingga 6, rasanya asam. Biji bulat pipih
berwarna coklat muda (Dalimartha dan Agriwidya, 1999).
2.1.4 Kandungan Kimia Tumbuhan
Kandungan kimia daun ceremai adalah saponin, flavonoida, tanin, dan
polifenol (Hutapea, J.R., 1994).
2.1.5 Khasiat Tumbuhan
Daun Ceremai berkhasiat untuk mengobati kanker (Dalimartha dan
Agriwidya,1999; Saputra, K., et al, 2000; Hariana, H.A., 2007) selain itu juga
berkhasiat mengobati batuk berdahak, menguruskan badan, mual, dan sariawan.
Sedangkan kulit berkhasiat mengatasi penyakit asma dan sakit kulit. Biji
berkhasiat untuk mengobati sembelit serta mual akibat perut kotor (Dalimartha
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair (Ditjen
POM, 2000).
Hasil dari ekstraksi disebut dengan ekstrak yaitu sediaan kental yang
diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia
hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua
pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian
sehingga memenuhi baku yang telah ditetapkan (Ditjen POM, 1995).
Untuk ekstraksi Farmakope Indonesia menetapkan bahwa sebagai cairan
penyari adalah air, etanol, dan etanol-air atau eter. Penyarian pada perusahaan
obat tradisional masih terbatas pada penggunaan penyari air, etanol, atau
etanol-air (Ditjen POM, 1986).
2.3 Metode-Metode Ekstraksi
Ekstraksi dengan menggunakan pelarut terdiri dari 2 cara, yaitu:
a. Cara dingin
Ekstraksi menggunakan pelarut dengan cara dingin terdiri dari:
• Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
• Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan. Proses terdiri
dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi
sebenarnya (penetesan/penampungan ekstrak), terus-menerus sampai
diperoleh ekstrak (perkolat).
b. Cara panas
Ekstraksi menggunakan pelarut dengan cara panas terdiri dari:
• Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama
waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya
pendingin balik.
• Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
• Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar (40-50oC).
• Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur
• Dekok
Dekok adalah infus pada waktu yang lebih lama (30 menit) dan temperatur
sampai titik didih air (Ditjen POM, 2000).
2.4 Kanker 2.4.1 Proses kanker
Kanker adalah istilah umum untuk pertumbuhan sel tidak normal, yaitu
suatu kondisi dimana sel telah kehilangan pengendalian dan mekanisme normal,
sehingga mengalami pertumbuhan yang tidak normal, cepat dan tidak terkendali.
Kanker dapat menyusup ke jaringan tubuh normal dan menekan jaringan tubuh
normal sehingga mempengaruhi fungsi tubuh. Kanker bukan merupakan penyakit
menular (Diananda, 2009).
Istilah tumor tidak sama dengan kanker. Tumor adalah istilah umum untuk
setiap benjolan abnormal. Sedangkan kanker adalah tumor yang bersifat ganas.
Dengan kata lain kanker sama dengan tumor ganas (Diananda, 2009).
Dalam keadaan normal sel-sel tubuh makhluk hidup secara alami
melakukan pembelahan. Pembelahan ini dikendalikan oleh enzim dan
hormon-hormon tubuh atas perintah otak. Dalam kondisi tertentu misalnya karena mutasi
(perubahan gen), sel secara tiba-tiba bisa berubah. Perubahannya bisa membuat
sel tersebut diluar kontrol pusat koordinasi dan menyebabkan terbentuknya sel
kanker (Harianto, 2009).
Sel-sel kanker mempunyai kemampuan membelah dengan kecepatan yang
bersebelahan (invasi) atau dengan migrasi sel ke tempat yang jauh (metastasis).
Pertumbuhan yang tidak terkendali dari sel-sel kanker bisa menyebabkan
kerusakan DNA serta mutasi lanjut di gen vital yang mengontrol pembelahan sel.
Kemampuan (mutasi) inilah yang akhirnya mengakibatkan sel-sel normal menjadi
sel-sel kanker (Harianto, 2009). Terjadiya mutasi biasanya disebabkan oleh
adanya faktor pemicu yang disebut mutagen (Sudiana, 2008).
2.4.2 Bahan-Bahan Penyebab Kanker (Karsinogen)
Bahan-bahan yang dapat menjadi pemicu dan penyebab terjadinya kanker
adalah:
a. Karsinogen Biologis.
Karsinogen ini berasal dari makhluk hidup, biasanya berupa virus dan bakteri.
Contoh spesies karsinogen biologis adalah virus papilloma (Human Papilloma
Virus), Virus Sitomegalo (Citomegalo Virus), Helicobacter pylori.
b. Karsinogen Kimia.
Karsinogen ini berasal dari zat-zat kimia sentetis. Contoh karsinogen kimia
diantaranya adalah pestisida, agen alkilasi (mustard), asam nitril, hidroksil amino
(NH2OH), aflatoksin, nitrosamin, arsenikum, asbestosis, arsen dan bahan-bahan
industri pabrik.
c. Karsinogen Fisika.
Karsinogen ini biasanya berasal dari paparan sinar tertentu atau radiasi yang
mengakibatkan mutasi. Contoh karsinogen fisika adalah radiasi sinar ultraviolet,
2.4.3 Tahap Terjadinya Kanker
Secara singkat, pembentukan dan pertumbuhan sel kanker dapat dijelaskan
melalui tahapan-tahapan berikut:
a. Fase inisiasi, yaitu ketika sel normal mulai mengalami mutasi oleh karsinogen.
b. Fase induksi, yaitu ketika sel normal yang sedang bermutasi mulai berubah
menjadi sel kanker. Fase inisiasi dan induksi tidak bisa diketahui dan sangat
susah untuk dideteksi. Fase-fase ini berlangsung hingga puluhan tahun.
c. Fase in situ, yaitu ketika pertumbuhan kanker terbatas pada jaringan tempat
asalnya tumbuh. Fase ini lamanya sangat bervariasi. Mungkin saja penderita
penyakit kanker berada dalam fase ini selamanya, tetapi umumnya berlangsung
sampai 5 tahun.
d. Fase invasif, yaitu sel kanker telah menembus membran basal dan masuk ke
jaringan atau organ sekitar yang berdekatan. Fase ini lebih cepat dari fase lain
dan berlangsung kurang dari 5 tahun.
e. Fase metastasis, yaitu penyebaran kanker ke kelenjar getah bening atau organ
lain yang letaknya jauh (misal kanker usus besar menyebar ke hati). Penyebaran
ini dapat melalui aliran darah, aliran getah bening, atau langsung dari tumor
(Diandana, 2009; Haryanto, 2009).
2.4.4 Pencegahan Kanker
a. Pencegahan Primer
Pencegahan primer adalah usaha mencegah timbulnya kanker dengan
menghilangkan atau melindungi tubuh dari kontak dengan karsinogen dan
b. Pencegahan Sekunder
Pencegahan sekunder berupa usaha untuk mencegah timbulnya kerusakan
lebih lanjut akibat kanker dengan mendeteksi dini kanker pada individu yang
tanpa gejala. Bila ditemukan kecurigaan pada deteksi dini, segera dilakukan
pemeriksaan lanjutan untuk penentuan diagnosis kanker dan pengobatan segera.
Pada stadium dini, kerusakan yang timbul akibat kanker masih kecil sehingga
dengan pengobatan segera akan membebaskan penderita dari kanker dan dapat
hidup normal (Dalimartha, 2004).
c. Pencegahan Tersier
Pencegahan tersier adalah usaha untuk mencegah timbulnya komplikasi
akibat kanker dan pengobatannya (Dalimartha, 2004).
2.4.5 Pengobatan Kanker
Jenis pengobatan kanker dapat dipilih tergantung dari jenis, lokasi dan stadium
kanker, kondisi fisik pasien, pilihan pasien dan ketersediaan sarana. Berikut
adalah berbagai pilihan pengobatan untuk kanker:
a.Operasi atau Pembedahan
Pembedahan merupakan prosedur pengobatan kanker paling tua, dan paling
besar kemungkinannya untuk sembuh, khususnya untuk jenis kanker tertentu
yang belum menyebar ke jaringan lain.
b.Kemoterapi
Kemoterapi telah digunakan untuk pengobatan kanker sejak tahun
1950-an. Diberika sebelum operasi untuk memperkecil ukuran kanker yang akan
dioperasi, atau sesudah operasi untuk membersihkan sisa-sisa sel kanker.
pemberiannya ada yang setiap hari, seminggu sekali, atau bahkan sebulan
sekali.
c.Radiasi
Terapi yang efeknya bersifat lokal ini diberikan secara eksternal atau secara
internal. Secara eksternal menggunakan alat tertentu untuk menembakkan ,
sedang internal dalam bentuk implantradioaktif yang disisipkan di area kanker,
atau berupa obat telan atau suntik.
d.Immunoterapi
Immunoterapi disebut juga terapi biologis merupakan jenis pengobatan kanker
yang relative baru. Ada tiga macam immunoterapi,yaitu aktif (vaksin kanker),
pasif danm terapi adjuvant.
e.Terapi gen
Terapi gen dilakukan dengan beberapa cara: (1) mengganti gen yang rusak atau
hilang, (2) menghentikan kerja gen yang bertanggung jawab terhadap
pembentukan sel kanker, (3) menambahkan gen yang membuat sel kanker lebih
mudah dideteksi dan dihancurkan oleh sistem kekebalan tubuh, kemoterapi,
maupun radioterapi, dan (4) menghentikan kerja gen yang memicu pembuatan
pembuluh darah baru di jaringan kanker sehingga sel-sel kankernya mati. Pada
saat ini terapi gen belum digunakan secara umum (Diandana, 2009).
2.5 Siklofosfamid 2.5.1 Mekanisme Kerja
didalam nukleus merupakan interaksi utama yang menyebabkan kematian sel.
Siklofosfamid juga bereaksi secara kimia dengan gugusan sulfahidril, amino,
hidroksil, karboksil dan fosfat dari semua nukleofil sel. Tempat alkilasi utama di
dalam DNA adalah posisi N7 guanin. Siklofosfamid tidak secara langsung
memberi efek vesicant dan harus diaktifkan menjadi bentuk sitotoksik oleh enzim
mikrosomal.
Sistem sitokrom P450 mixed function oxidase mikrosoma hati mengubah
siklofosfamid menjadi 4-hidroksisiklofosfamid yang seimbang dengan
aldofosfamid. Metabolit-metabolit aktif ini dibawa aliran darah ke jaringan tumor
dan jaringan sehat, dimana pemecahan nonenzimatik dari aldofosfamid menjadi
bentuk sitotoksik fosforamid mustar dan akrolein. Hati terlindung oleh adanya
pembentukan 4-ketosiklofosfamid dan karboksifosfamid, metabolit inaktif yang
dibentuk secara enzimatik. Peracunan utama dari alkilator ini adalah pada sumsum
tulang dan supresi miolopoisis yang bergantung pada dosis. Dalam kemoterapi
siklofosfamid digunakan sebanyak 3,5-5 mg/kg/hari peroral selama 10 hari
(Salmon dan Sartorelli, 1998).
2.6 Metode Uji Pendahuluan Antikanker 2.6.1 Metode Ames
Untuk menentukan sifat karsinogenik dari suatu zat kimia secara tidak
langsung dapat dilakukan uji mutagenisitas. Ames telah membuktikan bahwa
80-90% senyawa yang bersifat karsinogenik juga bersifat sebagai mutagenic. Uji
Ames menggunakan bakteri Salmonella thyphimirium yang mengandung gen
et al., 1975). Selain itu juga digunakan Escherichia coli WP2 yang mengandung
gen mutasi uvrA (Brusick, 1980).
2.6.2 Metode Mikronukleus
Sel mikronukleus merupakan hasil mutasi dari kromosom utuh yang patah
dan kemudian tampak sebagai nukleus berukuran kecil di dalam suatu sel
(Schmid, 1975). Pada hewan pengerat baik sumsum tulang dan limpa merupakan
organ hematopoietik, dimana dalam stem sel terbentuk dari eritropoiesis dengan
tahapan proliferasi dan maturasi. Selama proliferasi, sel yang terus menerus
membelah jika diberikan suatu agen, akan menyebabkan kerusakan kromosom,
seperti hancur atau terjadi pertukaran, dan dapat juga bertindak pada
makromolekul yang berhubungan dengan fungsi kerusakan kromatid, seperti
tubulin yang menyebabkan kegagalan spindel, proses ini tergantung pada
mekanisme aksi agen yang diberikan. Kelainan ini bisa menyebabkan gangguan
pada sel selama pembelahan dan sel tidak bisa berintegrasi menjadi daughter
nuclei, yang akhirnya akan membentuk mikronukleus, yang dapat dilihat di dalam
sitoplasma (Krishna dan Hayashi, 2000).
2.6.3 Metode Habig
Uji ini melibatkan glutation-S-transferase yang merupakan sekelompok
enzim yang memiliki peran utama sebagai katalis enzimatik pada detoksifikasi
senyawa elektrofilik melalui konjugasi dengan glutation (GSH) (Mannervik dan
Danielson, 1988). Glutation S-transferase adalah keluarga enzim multifungsi
kompleks yang berperan pada detoksifikasi senyawa elektrofilik xenobiotik yang
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental dengan tahapan penelitian
yaitu identifikasi sampel, pengumpulan dan pengolahan sampel, pembuatan simplisia,
pemeriksaan karakterisasi simplisia, pemeriksaan skrining fitokimia serbuk simplisia,
pembuatan ekstrak, pemeriksaan skrining fitokimia ekstrak, pengujian efek antikanker
secara oral terhadap mencit jantan dengan metode mikronukleus. Data dianalisis secara
ANAVA (analisis variansi) dan dilanjutkan dengan uji Post Hoc Tuckey meggunakan
program SPSS (Statistical Product and Service Solution) versi 17.
3.1 Alat dan Bahan 3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi alat-alat gelas
laboratorium, aluminium foil, blender (National), lemari pengering, oven listrik,
neraca kasar (OHAUS), neraca listrik, seperangkat alat destilasi penetapan kadar
air, perkolator, desikator, stopwatch, mortir dan stamfer, objek glass, rotary
evaporator (Heidolph VV-300), Freeze dryer (Edwards), neraca hewan (Presica),
spuit 1 ml (Terumo), oral sonde, alat bedah (wells spencer), mikroskop (Boeco),
centrifuge (Velocity 18R), polytube, mikrotube. Gambar alat–alat yang digunakan
dapat dilihat pada Lampiran 6, halaman 51.
3.1.2 Bahan-bahan
Daun ceremai, etanol 96% (destilasi), toluena (p.a), air suling, kalium
iodida, merkuri (II) klorida, bismut nitrat, asam nitrat, iodium, α-naftol, asam
natrium hidroksida, asam klorida pekat, metanol (teknis), eter minyak tanah
(teknis), etil asetat (teknis), serbuk seng, serbuk magnesium, isopropanol,
karboksi metil selulosa (CMC) (teknis), larutan giemsa, minyak emersi,
siklofosfamid, serum darah sapi, NaCl 0,9%.
3.2 Hewan Percobaan
Hewan yang digunakan pada penelitian ini adalah mencit jantan berumur
2-3 bulan dengan berat badan 20-30 g. Sebelum percobaan dimulai, terlebih
dahulu mencit dipelihara selama 2 minggu dalam kandang yang baik untuk
menyesuaikan lingkungannya. Gambar hewan percobaan dapat dilihat pada
Lampiran 7, halaman 53.
3.3 Pembuatan Larutan Pereaksi 3.3.1 Larutan Pereaksi Mayer
Sebanyak 5 g kalium iodida dalam 10 ml air suling kemudian ditambahkan
larutan 1,36 g merkuri (II) klorida dalam 60 ml air suling. Larutan dikocok dan
ditambahkan air suling hingga 100 ml (Ditjen POM, 1995).
3.3.2 Larutan Pereaksi Dragendorff
Sebanyak 8 g bismut nitrat dilarutkan dalam asam nitrat pekat 20 ml
kemudian dicampur dengan larutan kalium iodida sebanyak 27,2 g dalam 50 ml
air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih
diambil dan diencerkan dengan air secukupnya hingga 100 ml (Ditjen POM,
Sebanyak 4 g kalium iodida dilarutkan dalam 20 ml air suling kemudian
ditambah 2 g iodium sambil diaduk sampai larut, lalu ditambah air suling hingga
100 ml (Ditjen POM, 1995).
3.3.4 Larutan Pereaksi Molish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N secukupnya
hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.3.5 Larutan Pereaksi Liebermann-Burchard
Sebanyak 2 bagian asam asetat anhidrat dicampurkan dengan 1 bagian
asam sulfat pekat (Harborne, 1987).
3.3.6 Larutan Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml
kemudian disaring (Ditjen POM, 1995).
3.3.7 Larutan Pereaksi Timbal (II) Asetat
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling hingga 100 ml (Ditjen POM, 1995).
3.3.8 Larutan Pereaksi Natrium Hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dalam air suling hingga
diperoleh larutan 100 ml (Depkes RI, 1979).
3.3.9 Larutan Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai
100 ml(Depkes RI, 1979).
Identifikasi sampel dilakukan di Herbarium Medanense (MEDA),
Universitas Sumatera Utara. Hasil identifikasi tumbuhan dapat dilihat pada
Lampiran 1, halaman 41.
3.5 Pengumpulan dan Pengolahan Sampel 3.5.1 Pengumpulan Sampel
Pengumpulan sampel dilakukan secara purposif, yaitu tanpa
membandingkan dengan daerah lain. Bahan yang digunakan dalam penelitian ini
adalah daun ceremai yang diambil dari Kampung Durian, Medan, Sumatera Utara.
Daun yang diambil sebagai sampel adalah daun tumbuhan yang muda. Gambar
tumbuhan ceremai dapat dilihat pada Lampiran 2, halaman 42.
3.5.2 Pengolahan Sampel
Sampel yang digunakan pada penelitian ini adalah daun ceremai yang
masih segar. Daun dipisahkan dari pengotor lain lalu dicuci hingga bersih
kemudian ditiriskan dan ditimbang. Diperoleh berat basah sebesar 1.700 g.
Selanjutnya daun tersebut dikeringkan selama 10 hari dalam lemari pengering
dengan temperatur ±40o
C sampai daun kering (ditandai bila diremas rapuh).
Simplisia yang telah kering diblender menjadi serbuk lalu dimasukkan ke dalam
wadah plastik bertutup dan di simpan pada suhu kamar. Kemudian serbuk
Pemeriksaan karakterisasi simplisia meliputi pemeriksaan makroskopik
dan mikroskopik, penetapan kadar air, penetapan kadar abu total, penetapan kadar
abu tidak larut dalam asam, penetapan kadar sari larut dalam air, penetapan kadar
sari larut dalam etanol.
3.6.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati warna,
bentuk, ukuran dan tekstur dari simplisia. Gambar simplisia daun ceremai dapat
dilihat pada Lampiran 2, halaman 42.
3.6.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik terhadap simplisia dilakukan dengan cara
menaburkan serbuk simplisia di atas kaca objek yang telah diteteskan dengan
larutan kloralhidrat dan ditutup dengan kaca penutup kemudian diamati di bawah
mikroskop. Hasil pengamatan mikroskopik terhadap simplisia dapat dilihat pada
Lampiran 2, halaman 43.
3.6.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi
toluena). Cara Kerja: toluena sebanyak 200 ml dan air suling sebanyak 2 ml
dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Toluena
didinginkan selama 30 menit dan volume air dalam tabung penerima dibaca
(WHO, 1998). Kemudian ke dalam labu tersebut dimasukkan 5 g serbuk simplisia
yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah
toluena mendidih, kecepatan tetesan diatur 2 tetes tiap detik sampai sebagian
besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap
toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima
dibiarkan mendingin pada suhu kamar. Setelah air dan toluena memisah
sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air
yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang
diperiksa. Kadar air dihitung dalam persen (Ditjen POM, 1995).
3.6.4 Penetapan Kadar Abu Total
Sebanyak lebih kurang 2 g sampai 3 g zat yang telah digerus dan
ditimbang seksama dimasukkan dalam krus porselen yang telah dipijar dan ditara,
kemudian diratakan. Krus dipijarkan perlahan-lahan hingga arang habis,
kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu
total dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM,
1995).
3.6.5 Penetapan Kadar Abu Tidak Larut Asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan dalam
25 ml asam klorida 2 N selama 5 menit. Bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring, dipijarkan hingga bobot tetap
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995).
3.6.6 Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 g serbuk dimaserasi selama 24 jam dalam 100 ml air
kloroform (2,5 ml kloroform dalam air suling sampai 1000 ml) dalam labu
bersumbat sambil sesekali dikocok selama 6 jam pertama kemudian dibiarkan
dalam oven pada suhu 105oC sampai diperoleh bobot konstan. Kadar sari yang
larut di dalam air dihitung terhadap bahan yang telah dikeringkan di udara
(Ditjen POM, 1995).
3.6.7 Penetapan Kadar Sari Larut dalam Etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali
selama 6 jam pertama dan kemudian dibiarkan selama 18 jam dan disaring.
Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan dangkal
berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105oC
sampai diperoleh bobot konstan. Kadar sari yang larut dalam etanol dihitung
terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995).
Hasil pemeriksaan karakterisasi simplisia daun ceremai dapat dilihat pada
Tabel 3.1., Lampiran 3, halaman 44.
3.7 Pemeriksaan Skrining Fitokimia Serbuk Simplisia 3.7.1 Pemeriksaan Alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan lalu disaring.
Filtrat dipakai untuk percobaan berikut:
a. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Mayer akan
terbentuk endapan berwarna putih atau kuning
b. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Bouchardat
c. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Dragendorff
akan terbentuk endapan berwarna merah atau jingga
Alkaloida dinyatakan positif jika terjadi endapan atau paling sedikit dua
atau tiga dari percobaan di atas (Ditjen POM, 1995).
3.7.2 Pemeriksaan Flavonoida
Larutan Percobaan:
Sebanyak 0,5 g sampel disari dengan 10 ml metanol lalu direfluks selama
10 menit, disaring panas-panas melalui kertas saring berlipat, filtrat diencerkan
dengan 10 ml air suling. Setelah dingin ditambah 5 ml eter minyak tanah, dikocok
hati-hati, didiamkan. Lapisan metanol diambil, diuapkan pada temperatur 40oC.
Sisa dilarutkan dalam 5 ml etil asetat, disaring.
Cara Percobaan:
a. Satu ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam
1-2 ml etanol 96%, ditambahkan 0,5 g serbuk seng dan 2 ml asam klorida
2 N, didiamkan selama satu menit. Ditambahkan 10 ml asama klorida pekat,
jika dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan adanya
flavonoida (glikosida-3-flavonol)
b. Satu ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam
1 ml etanol 96%, ditambahkan 0,1 g magnesium dan 10 ml asam klorida
pekat, terjadi warna merah jingga sampai merah ungu menunjukkan adanya
flavonoida (Ditjen POM, 1995).
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu
filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml
larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi
warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.7.4 Pemeriksaan Glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 bagian volume etanol 96% dan 3 bagian volume air suling,
selanjutnya ditambahkan 10 ml HCl 2 N, direfluks selama 10 menit, didinginkan
dan disaring. Pada 30 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II)
asetat 0,4 M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari
sebanyak 3 kali, tiap kali dengan 20 ml campuran 3 bagian volume kloroform dan
2 bagian volume isopropanol. Diambil lapisan air kemudian ditambahkan 2 ml air
dan 5 tetes pereaksi Molisch, ditambahkan hati-hati 2 ml asam sulfat pekat
terbentuk cincin warna ungu pada batas kedua cairan menunjukkan adanya ikatan
gula (Ditjen POM, 1995).
3.7.5 Pemeriksaan Saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan
ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat
selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi
1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang
menunjukkan adanya saponin (Ditjen POM, 1995).
Sebanyak 1 g sampel dimaserasi dengan 20 ml eter selama 2 jam, lalu
disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa dalam cawan penguap
ditambahkan 2 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat. Timbul
warna ungu atau merah kemudian berubah menjadi hijau biru menunjukkan
adanya steroida triterpenoida (Harborne, 1987). Hasil pemeriksaan skrining
fitokimia simplisia daun ceremai dapat dilihat pada Tabel 3.2, Lampiran 3,
halaman 44.
3.8 Pembuatan Ekstrak Etanol Daun Ceremai
Sebanyak 300 g serbuk simplisia dimasukkan ke dalam bejana tertutup dan
dibasahi dengan etanol 96%, kemudian dimaserasi selama 3 jam. Massa
dipindahkan sedikit demi sedikit ke dalam perkolator sambil tiap kali ditekan
hati-hati, kemudian cairan penyari dituangkan secukupnya sampai cairan mulai
menetes dan di atas simplisia masih terdapat selapis cairan penyari, perkolator
ditutup dan dibiarkan 24 jam. Cairan dibiarkan menetes dengan kecepatan 1 ml
tiap menit, cairan penyari ditambahkan berulang-ulang secukupnya dengan
memasang botol cairan penyari di atas perkolator dan diatur kecepatan penetesan
cairan penyari sama dengan kecepatan menetes perkolat, sehingga selalu terdapat
selapis cairan penyari di atas simplisia. Perkolasi dihentikan jika perkolat yang
keluar telah jernih. Perkolat yang diperoleh dipekatkan dengan alat rotary
evaporator. Kemudian dikeringkan dengan freeze dryer selama lebih kurang 24
jam dan diperoleh ekstrak kental sebanyak 61,096 g (Depkes RI, 1974). Flow
3.9 Pemeriksaan Skrining Fitokimia Ekstrak Etanol Daun Ceremai
Ekstrak kental terlebih dahulu dilarutkan dalam etanol 96%. Kemudian
dilakukan pemeriksaan golongan senyawa kimia ekstrak. Prosedur pemeriksaan
golongan senyawa kimia ekstrak etanol daun ceremai dilakukan sama seperti
prosedur untuk pemeriksaan skrining fitokimia serbuk simplisia. Hasil
pemeriksaan dapat dilihat pada Tabel 3.2, Lampiran 3, halaman 44.
3.10 Uji Efek antikanker
Pengujian efek antikanker peroral meliputi penyiapan hewan percobaan,
suspensi CMC 1% (kontrol), bahan uji, penginduksi mikronukleus, serum darah
sapi dan uji efek antikanker.
3.10.1 Penyiapan Hewan Percobaan
Hewan yang digunakan adalah mencit dengan berat 20-30 g dibagi 5
kelompok, setiap kelompok terdiri dari 7 ekor mencit.
Sebelum digunakan sebagai hewan percobaan, semua mencit dipelihara
terlebih dahulu selama kurang lebih satu minggu untuk penyesuaian lingkungan,
mengontrol kesehatan dan berat badan serta menyeragamkan makanannya
(Kusmardi, 2007).
3.10.2 Penyiapan Suspensi CMC 1%
Pembuatan suspensi CMC 1% (b/v) dilakukan dengan cara sebagai
berikut: sebanyak 250 mg CMC ditaburkan ke dalam lumpang yang berisi air
suling panas sebanyak 8 ml. Didiamkan selama 15 menit hingga diperoleh masa
kemudian dituang ke dalam labu tentukur 25 ml, ditambah air suling sampai batas
tanda.
3.10.3. Penyiapan Suspensi Ekstrak Etanol Daun Ceremai (EEDC)
Pembuatan suspensi EEDC dilakukan dengan cara sebagai berikut:
sebanyak 250 mg CMC ditaburkan ke dalam lumpang yang berisi air suling panas
sebanyak 8 ml. Didiamkan selama 15 menit hingga diperoleh masa yang
transparan, digerus hingga berbentuk gel. Ditambahkan sebanyak 1 g ekstrak
etanol daun ceremai ke dalam lumpang, kemudian digerus sampai homogen.
Dituang ke dalam labu tentukur 25 ml, ditambah air suling sampai batas tanda.
3.10.4 Penyiapan Larutan siklofosfamid (LS) 0,5% (b/v)
Pembuatan LSdilakukan dengan cara sebagai berikut: ditimbang sebanyak 25 mg kemudian dimasukkan ke dalam labu tentukur 5 ml, ditambahkan larutan
fisiologis [NaCl 0,9% (b/v)] sampai batas tanda.
3.10.5 Pembuatan Serum Darah Sapi (SDS)
Serum diperoleh dari darah sapi segar. Darah didiamkan selama 30 menit, kemudian disentrifuge dengan kecepatan 2000 rpm selama 15 menit hingga
terpisah antara endapan dan cairan yang berwarna bening kekuning-kuningan
yang merupakan serumnya, kemudian cairan tersebut dipisahkan dari endapan.
3.10.6 Pengujian Antikanker
Hewan percobaan dikelompokkan menjadi 5 kelompok, masing-masing
terdiri dari 7 ekor hewan percobaan. Kelompok tersebut adalah:
- Kelompok I : Kontrol normal, diberikan larutan CMC 1% selama 7 hari secara
- Kelompok II : Kontrol positif, diberikan larutan CMC 1% selama 7 hari secara oral dan setelah hari ke 7, diinduksikan LS dengan dosis 30 mg/kg
BB.
- Kelompok III : Perlakuan, diberikan larutan Suspensi EEDC dengan dosis 200
mg/kg BB secara oral selama 7 hari dan setelah hari ke 7,
diinduksikan LS 30 mg/kg BB.
- Kelompok IV : Perlakuan, diberikan larutan Suspensi EEDC dengan dosis
400mg/kg BB secara oral selama 7 hari dan setelah hari ke 7,
diinduksikan LS 30 mg/kg BB.
- Kelompok V : Perlakuan, diberikan larutan Suspensi EEDC dengan dosis 800
mg/kg BB secara oral selama 7 hari dan setelah hari ke 7,
diinduksikan LS 30 mg/kg BB. (Cara perhitungan dosis dapat
dilihat pada Lampiran 9, halaman 56).
Setelah 30 jam pemberian siklofosfamid, hewan dibunuh dengan cara
dislokasi leher dan diambil sumsum tulang femurnya dengan cara disempritkan
dengan spuit yang berisi SDS sebanyak 0,3 ml dan ditampung di dalam mikrotube
(Khrisna dan Hayashi, 2000).
3.10.7 Pembuatan Preparat Hapusan Sumsum Tulang Femur
Campuran sumsum tulang dan SDS dalam mikrotube disentrifuge
dengan kecepatan 1200 rpm selama 5 menit, kemudian supernatannya dibuang.
Endapannya disuspensikan kembali dengan dua tetes SDS. Kemudian satu tetes
suspensi sel diambil dan diletakkan keatas slide, dengan menggunakan penghapus
slide, sel di hapuskan menjadi preparat hapusan. Kemudian slide dikeringkan,
difiksasi dengan metanol selama 5 menit. Kemudian di berikan pewarna giemsa
hapusan dikeringkan dan diamati di mikroskop dengan perbesaran 10 × 100
dengan bantuan minyak immersi. Jumlah sel mikronukleus dalam 100 sel
dihitung. Perhitungan dilakukan sebanyak 2 kali pada setiap hapusan. Ukuran sel
mikronukleus lebih kecil dari ukuran nukleus normal (Khrisna dan Hayashi,
2000).
Gambar sel mikronukleus sumsum tulang mencit dapat dilihat pada
Lampiran 8, halaman 54. Data penelitian dapat dilihat pada Lampiran 10, halaman
57.
3.11 Analisis Data
Data hasil penellitian dianalisis dengan menggunakan program SPSS 17. Data
hasil penelitian ditentukan homogenitas dan normalitasnya untuk menentukan analisis
statistik yang digunakan. Data dianalisis dengan menggunakan uji ANAVA satu arah
untuk menentukan perbedaan rata-rata di antara perlakuan. Jika terdapat perbedaan,
dilanjutkan dengan menggunakan uji Post Hoc Tuckey untuk mengetahui variabel mana
yang memiliki perbedaan. Berdasarkan nilai signifikansi, p<0,05 dianggap signifikan. Data
BAB IV
HASIL DAN PEMBAHASAN 4.1 Simplisia dan Ekstrak
Tumbuhan yang digunakan telah diidentifikasi di Herbarium Medanense
(MEDA), Universitas Sumatera Utara. Hasil identifikasi tumbuhan dapat dilihat
pada lampiran 1.
Hasil pemeriksaan makroskopik simplisia (Lampiran 2, halaman 42) daun
ceremai menunjukkan daun berwarna hijau muda, berbentuk bulat telur sampai
jorong, tepi daun rata, ukuran ±4×8 cm, dengan tekstur permukaan daun licin dan
berkerut-kerut, berbau khas dan tidak berasa. Hasil pemeriksaan mikroskopik
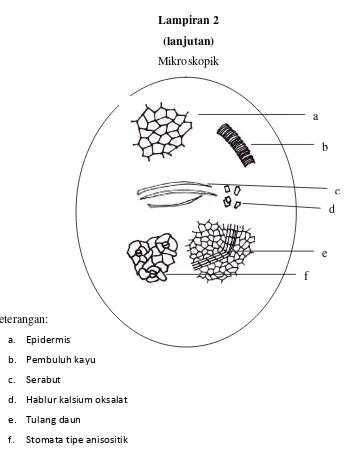
serbuk simplisia daun ceremai (Lampiran 2, halaman 42) terlihat fragmen berupa
epidermis, stomata tipe anisositik, tulang daun, pembuluh kayu, hablur kalsium
oksalat, serabut.
Hasil pemeriksaan karakterisasi simplisia daun ceremai diperoleh kadar
air 5,99% yang telah memenuhi persyaratan secara umum (<10%), kadar abu total
5,19%, kadar abu tidak larut dalam asam 0,56%, kadar sari larut dalam air 22,20%
dan kadar sari larut dalam etanol 22,21%. Hasil penetapan kadar sari yang larut
dalam air, kadar sari yang larut dalam etanol, kadar abu total, dan kadar abu tidak
larut asam memenuhi persyaratan pada Materia Medika Indonesia (MMI).
Standarisasi simplisia diperlukan karena kandungan bahan aktif yang terkandung
dalam jenis tanaman yang sama dapat bervariasi, dengan standarisasi diharapkan
bahan aktif yang terkandung di dalam bahan baku tersebut cukup konsisten,
sehingga takaran yang digunakan untuk pengujian memiliki kandungan aktif yang
Hasil pemeriksaan skrining fitokimia baik terhadap simplisia maupun
ekstrak menunjukkan bahwa keduanya mengandung senyawa kimia golongan
flavonoid, tannin, saponin dan glikosida. Adanya senyawa flavonoida dan
senyawa-senyawa polifenol yang terkandung dalam daun ceremai menunjukkan
bahwa daun ceremai memiliki aktivitas antioksidan yang dapat digunakan sebagai
antikanker.
4.2 Pengujian Efek Antikanker
Pada penelitian ini, pengujian efek antikanker ekstrak daun ceremai
dilakukan dengan metode mikronukleus yang digunakan untuk melihat pengaruh
ekstrak terhadap penghambatan pembentukan sel mikronukleus. Sel
mikronukleus merupakan hasil mutasi dari kromosom utuh yang patah dan
kemudian tampak sebagai nukleus berukuran kecil di dalam suatu sel (Schmid,
1975). Adanya peningkatan jumlah sel mikronukleus menunjukkan bahwa telah
terjadi kerusakan kromosom yang disebabkan oleh agen penginduksi
(siklofosfamid) (Krishna dan Hayashi, 2000).
Perhitungan jumlah sel mikronukleus dilakukan sebanyak 2 kali pada tiap
apusan sumsum tulang femur mencit untuk mengurangi kesalahan pada
perhitungan. Adapun hasil perhitungan jumlah sel mikronukleus dalam penelitian
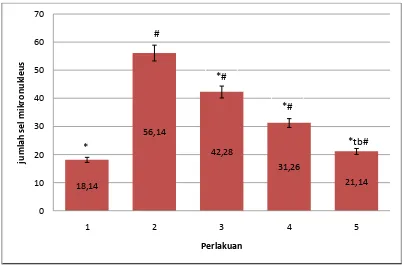
Gambar 4.1: Jumlah sel mikronukleus dalam tiap 100 sel mencit pada berbagai perlakuan (Rerata ± SEM)
1 = pemberian CMC 1% (kontrol normal)
2 = pemberian CMC 1% , kemudian diinduksi dengan siklofosfamid 30mg/kg BB (kontrol positif)
3 = pemberian suspensi EEDC dosis 200 mg/kg BB, kemudian diinduksi dengan siklofosfamid 30 mg/kg BB
4 = pemberian suspensi EEDC dosis 400 mg/kg BB, kemudian diinduksi dengan siklofosfamid 30 mg/kg BB
5 = pemberian suspensi EEDC dosis 800 mg/kg BB, kemudian diinduksi dengan siklofosfamid 30 mg/kg BB
* = berbeda signifikan dengan kelompok 2 # = berbeda signifikan dengan kelompok 1
tb# = tidak berbeda signifikan dengan kelompok 1
Pada grafik 3.1 terlihat bahwa pemberian CMC 1% (kelompok 1) dan
suspensi EEDC dosis 200, 400, 800 mg/kg BB kemudian diinduksi dengan
siklofosfamid (kelompok 3, 4 dan 5) menunjukkan jumlah sel mikronukleus yang
terbentuk berbeda dengan pemberian CMC 1% yang kemudian diinduksi dengan
siklofosfamid (kelompok 2). Dimana jumlah rata-rata sel mikronukleus pada
pemberian CMC dan suspensi EEDC dosis 200, 400, 800 mg/kg BB berturut-turut
adalah 18,14 sel, 42,28 sel, 31.26 sel, 21,14 sel. Jumlah ini lebih sedikit jika
18,14 56,14 42,28 31,26 21,14 0 10 20 30 40 50 60 70
1 2 3 4 5
dibandingkan dengan jumlah sel mikronukleus yang terbentuk pada kelompok
yang diberikan CMC 1% kemudian diinduksikan dengan siklofosfamid (kontrol
positif), yang jumlah rata-ratanya mencapai 56,14.
Untuk melihat ada tidaknya perbedaan dari setiap perlakuan pada tiap
kelompok hewan coba, dilakukan analisis variansi (ANAVA) menggunakan
program SPSS versi 17 terhadap jumlah sel mikronukleus yang terbentuk dimana
hasil analisis variansi dapat kita lihat pada lampiran 11 halaman 58. Hasil analisis
variansi diperoleh harga F hitung > F tabel (F tabel = 2,71 ). Hal ini menunjukkan
adanya perbedaan yang signifikan antar kelompok perlakuan terhadap jumlah sel
mikronukleus yang terbentuk dengan nilai signifikansi p<0,05.
Untuk mengetahui kelompok perlakuan mana yang memiliki efek yang
sama atau berbeda antara satu perlakuan dengan perlakuan yang lain dilakukan uji
Post Hoc Tuckey untuk semua perlakuan, hasil uji tersebut dapat dilihat pada
Lampiran 11, halaman 59.
Hasil uji Post Hoc Tuckey menunjukkan bahwa jumlah sel mikronukleus
yang terbentuk pada kelompok perlakuan Suspensi EEDC dosis 800 mg/kg BB
menyamai kelompok perlakuan CMC 1% (kontrol normal). Ini menunjukkan
bahwa Suspensi EEDC dosis 800 mg/kg BB dapat menghambat terjadinya
pembentukan sel mikronukleus yang diinduksi oleh siklofosfamid paling kuat
karena dapat menyamai jumlah mikronukleus pada kelompok perlakuan yang
hanya diberi suspensi CMC 1% tanpa di induksi dengan siklofosfamid. Efek
penghambatan terbentuknya sel mikronukleus ini terkait dengan adanya senyawa
semua bagian tanaman dan struktur kimianya secara umum adalah kerangka
C6C3C6 (Larbier dan Leclerco 1992) . Sejumlah senyawa fenol terutama flavonoid
merupakan senyawa antioksidan (Madhujith dan Shahidi, 2005). Potensi
flavonoid sebagai antioksidan dan kemampuannya mengurangi aktivitas radikal
hidroksi, anion superoksida, dan radikal peroksida lemak menjadikan flavonoid
berperan penting (Larbier dan Leclerco, 1992).
Siklofosfamid menginduksi pembentukan sel mikronukleus melalui
metabolit aktifnya yang bersifat pengalkilasi, yaitu mustard fosforamida, akrolein,
dan 4-hidroksisiklofosfamid. Senyawa pengalkilasi tersebut dapat berikatan
dengan berbagai gugus fungsi komponen sel, termasuk terhadap basa-basa DNA.
Reaksi tersebut antara lain mengakibatkan patahan rantai DNA yang diduga
menyebabkan terjadinya patahan kromosom dan dapat terlihat sebagai
mikronukleus (Czyzewska dan Mazur, 1995). Metabolisme siklofosfamid juga
dilaporkan menyebabkan peningkatan radikal anion superoksida dan hidroksil
(Ramu, et al. 1996) yang mungkin ikut berperan dalam menginduksi
pembentukan mikronukleus. Sifat alkilasinya itu terutama timbul pada jaringan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Adapun kesimpulan dari penelitian ini adalah:
1. Simplisia dan ekstrak etanol daun ceremai mengandung senyawa
flavonoid, tanin, saponin, dan glikosida.
2. Ekstrak etanol daun ceremai mempunyai efek sebagai antikanker, dengan
menghambat terjadinya pembentukan sel mikronukleus yang diinduksi
oleh siklofosfamid.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk meneliti lebih lanjut
mengenai isolasi dan identifikasi zat aktif dalam daun ceremai yang mempunyai
DAFTAR PUSTAKA
Ames, B.N., J.Mc Can and Yamasaki, E. (1975). Methods for Detection Carsinogens and Mutagens with the Salmonella/ Mamalian Microsome Mutagenicity Test. Mutation Res. 31.
Anonim. (2009). Obat Kanker Warisan Kedokteran Islam. Diakses tanggal 28 April 2010.
Brusick, D.J. (1980). An Evaluation of the Escherichia coli WP2 and WP2 uvrA Reverse Mutation Assay. Mutation Res. 76: 169-190.
Cook, N.C. dan Samman S. (1996). Flavonoid and Chemistry, Metabolism, Cardioprotective Effect, and Dietary Sources. Journal of Nutritional Biochemistry. 7: 66-67.
Czyzewska, A., dan Mazur, L. (1995). Supressing effect or WR-2721 on micronuclei induced by cyclophosphamide in mice. Teratogenesis, carcinog. Mutagen.15: 109-114.
Dalimartha, S. (2004). Deteksi Dini Kanker dan Simplisia Antikanker.Cetakan Pertama. Jakarta: Penebar Swadaya. Halaman 5, 8.
Dalimartha dan Agriwidya. (1999). Ceremai (Pyllanthus acidus (L.) Skeel). Diakses pada tanggal 28 April 2011. http://Ceremai (Phyllanthus acidus (L.) Skeels) « CCRC FARMASI UGM.htm.
Depkes RI. (1974). Ekstra Farmakope Indonesia. Jakarta: Departemen Kesehatan RI. Halaman 831.
Depkes RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Halaman 7, 744, 748.
Diandana, R. (2009). Mengenal Seluk Beluk Kanker. Cetakan ketiga. Jogjakarta: Katahati. Halaman 15, 22, 29-30.
Ditjen POM. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 300-306, 321, 325, 333-337.
Ditjen POM. (1986). Sediaan Galenik. Jakarta: Departemen Kesehatan RI. Halaman 1, 7.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Jakarta: Departemen Kesehatan RI. Halaman 10-11.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants. J. Pharm. Sci. 55(3): 264.
Ghaskadbi, S., Rajmachikar, S,, Agate, C., Kapadi, A.H., dan Vaidya, V.G., (1992). Modulation of cyclophosphamide mutagebicity by vitamin C in vivo rodent micronucleus assay. Teratogenesis, carcinog. Mutagen. 12: 11-13.
Griscelli, A.B., Bosq, J., Koscielny, S., Lefrere, F., Turhan, A., Brousse, N., Hermine, O., dan Ribrag, V. (2004). High Level of Glutathione-s-Transferase π Expression in Mantle Cell Lymphomas. Clin. Cancer Res. 10: 3029-3034.
Harborne, J.B. (1987). Metode Fitokimia. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Edisi II. Bandung: Penerbit ITB. Halaman 152.
Hariana, H.A. (2007). Tumbuhan Obat dan Khasiatnya. Seri I. Cetakan Kelima. Jakarta: Penebar Swadaya. Halaman 84.
Harianto, N. (2009). Mengenal, Mencegah, Mengatasi Silent Killer Kanker. Semarang: Pustaka Widyamara. Halaman 1-2, 12-13, 18.
Hutapea, J.R. (1994). Inventaris Tanaman Obat Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI Badan Penelitian dan Pengembangan Kesehatan. Halaman 203-204.
Krishna, G., dan Makoto, H. (2000). In vivo rodent micronucleus assay: protocol, conduct and data interpretation. Mutation Res. 455: 155-166.
Krismawati, A. (2007). Pengaruh Ekstrak Tanaman Ceremai, Delima Putih, Jati Belanda, Kecombrang, dan Kemuning Secara In Vitro terhadap Proliferasi Sel Limfosit manusia. Skripsi. Bogor: Fakultas Teknologi Pertanian, IPB.
Kusmardi, S.K., dan Enif, E.T. (2007). Efek Imunomodulator Ekstrak Daun Ketepeng Cina (Cassia alata. L) Terhadap Aktivitas dan Kapasitas Fagositosis Makrofag. Makara Kesehatan. 11(2): 50-51.
Larbier dan Leclerco. (1992). Antioksidan. Diakses tanggal 28 April 2011.
Ramu, K., Perry, C.S., Ahmed, T., Pakenham, G., dan Kehrer J.P. (1996). Studies on the basis for the toxicity of acrolein mercapturates. Toxicol. Appl. Pharmacol. 140: 487-498.
Riskesdas. (2007). Rasio Tumor dan Kanker di Indonesia. Badan Litbang Kesehatan. Departemen Kesehatan RI. Diakses tanggal 27 April 2011.
Rompelberg, C.J.M., Stenhuis, W.H., de Vogel, N., van Osenbruggen, W.A., Schouten, A., dan Verhagen, H. (1995). Antimutagenicity of eugenolin the rodent bone marrow micronucleus test. Mutation Res. 346: 69-75.
Salmon, S.E., dan Alan, C.S. (1989). Kemoterapi kanker. Dalam: Farmakologi dasar dan klinik. Editor Katzung, B.G. Edisi 3. Cetakan I. Jakarta: Penerbit Buku Kedokteran ECG. Halaman 800.
Salmon, S.E., dan Alan, C.S. (1998). Kemoterapi kanker. Dalam: Farmakologi dasar dan klinik. Editor Katzung, B.G. Edisi IV. Cetakan I. Jakarta: Penerbit Buku Kedokteran ECG. Halaman 861, 865.
Saputra, K. (2000). Terapi Biologi Untuk Kanker. Surabaya: Airlangga University Press. H