EKSTRAKSI PROPOLIS DAN SINTESIS
NANOPROPOLIS LEBAH MADU Trigona spp
NURUL SYIFA QURBATUSSOFA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Ekstraksi Propolis dan Sintesis Nanopropolis Lebah Madu Trigona spp adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
iv
ABSTRAK
NURUL SYIFA QURBATUSSOFA. Ekstraksi Propolis dan Sintesis Nanopropolis Lebah Madu Trigona spp. Dibimbing oleh I MADE ARTIKA dan EMAN KUSTAMAN.
Propolis merupakan bahan perekat dari resin yang dikumpulkan lebah pekerja dari kuncup, kulit kayu, dan bagian tumbuhan lainnya. Propolis kaya akan manfaat, diantaranya sebagai antibakteri, antivirus, dan antikanker. Penelitian ini bertujuan mencari metode ekstraksi dan sintesis nanopropolis yang akan menghasilkan efektivitas tinggi serta mengetahui aktivitas antibakteri dan mengetahui nilai optimasi nanopropolis sebagai antibakteri terhadap bakteri E. coli. Propolis diekstrak menggunakan metode maserasi dengan modifikasi MAE
(microwave-assisted extraction). Selanjutnya pembuatan nanopropolis
menggunakan metode Aimi yang dimodifikasi dengan teknik homogenisasi kecepatan tinggi, harapannya nanopropolis dapat lebih efektif dibandingkan propolis sebagai antibakteri. Rendemen ekstrak propolis yang diperoleh sebesar 10.93%. Nilai PSA (particle size analyzer) dari nanopropolis memiliki sebaran 176.30 nm, 205.10 nm, dan 295.80 nm. Hasil pengujian antibakteri nanopropolis dengan metode difusi cakram terhadap E. coli, menunjukkan nanopropolis tidak bersifat antibakteri terhadap E. coli, karena tidak menghasilkan zona bening diarea kertas cakram. Hasil dari ampisilin menunjukkan hal yang sama, yaitu tidak bersifat antibakteri terhadap E. coli.
Kata kunci : antibakteri, nanopropolis, propolis.
ABSTRACT
NURUL SYIFA QURBATUSSOFA. The Extraction of Propolis and Synthesis of Nanopropolis Honey Bee Trigona spp. Under the direction of I MADE ARTIKA and EMAN KUSTAMAN.
Propolis is a resin adhesive material collected from worker bees from the buds, bark, and other plant parts. Propolis have many benefits are as antibacterial, aniviral, and anticancer. The purpose of this study is to search method of extraction and nanopropolis synthesis that will produce the high effectiveness, knowing antibacterial activity and knowing value of optimization nanopropolis as antibacterial against E. coli . Propolis extracted uses the method maceration with modification MAE (microwave-assisted extraction). Futhermore synthesis of nanopropolis use Aimi methode modified by high speed homogenization, hopefully nanopropolis more effective than propolis as antibacterial. The yield of propolis extract is 10.93%. The values of PSA from nanopropolis are 176.30 nm, 205.10 nm, and 295.80 nm. Result activity antibacterial nanopropolis with disc diffusion methode againts E. coli indicated nanopropolis does not have antibacterial, because nanopropolis does not produce cleare zones in disc paper area. The result from ampicilin is does not have antibacterial againts E. coli.
EKSTRAKSI PROPOLIS DAN SINTESIS
NANOPROPOLIS LEBAH MADU Trigona spp
NURUL SYIFA QURBATUSSOFA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul : Ekstraksi Propolis dan Sintesis Nanopropolis Lebah Madu Trigona spp
Nama : Nurul Syifa Qurbatussofa NIM : G84070033
Disetujui oleh
Dr.Ir. I Made Artika, M.App.Sc. Pembimbing I
Ir. Eman Kustaman Pembimbing II
Diketahui oleh
Dr.Ir. I Made Artika, M.App.Sc. Ketua Departemen Biokimia
viii
PRAKATA
Puji serta syukur penulis panjatkan kehadirat Allah SWT atas rahmat-Nya penulisan skripsi ini dapat terselesaikan. Banyak kendala yang penulis hadapi pada proses pembuatan skripsi ini berkaitan dengan data dan pembahasan. Namun, atas rahmat Allah SWT dan dorongan semangat dari keluarga, suami, dan teman-teman tercinta, skripsi dengan judul ekstraksi propolis dan sintesis nanopropolis lebah madu Trigona spp dapat diselesaikan dengan baik.
Terima kasih penulis sampaikan kepada Dr.Ir. I Made Artika, M.App.Sc selaku pembimbing utama dan. Ir. Eman Kustaman selaku pembimbing kedua yang telah membimbing dan mendukung penulis secara moril serta memberikan bimbingan dan arahan hingga terselesaikannya skripsi ini. Terima kasih kepada Ir.H.A.E. Zainal Hasan, M.Si atas saran, dukungan secara materil dan moril. Ucapan terimakasih pula penulis haturkan kepada orang tua, suami, dan adik-adik, yang selalu memberi motivasi dan dukungan, teman-teman satu kontrakan, Mike, Putri, Neina, Laras, Mevi, Umi, Huda yang selalu menghadirkan semangat, kepada Pak Tono dan Mega atas bantuannya selama penelitian, kepada dosen-dosen dan laboran atas ilmunya yang diberikan selama penulis menimba ilmu di IPB, khususnya di Biokimia. serta rekan-rekan Biokimia 44 yang selalu memberikan dukungannya.
Penulisan skripsi ini tak luput dari kesalahan. Oleh karena itu, penulis mengharapkan kritik dan saran untuk kesempurnaan skripsi ini.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN
vii
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 2
Metode 2
Ekstraksi Etanol Propolis 2
Pembuatan Nanopropolis 3
Pembuatan Media 3
Regenerasi Bakteri Uji 3
Uji Pendahuluan Aktivitas Antibakteri 4
Penentuan Konsentrasi Hambat Tumbuh Minimum 4
Analisis Statistik 4
HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 7
Ekstrak Propolis 7
Nanopropolis 8
Uji Antibakteri 10
SIMPULAN 12
SARAN 11
DAFTAR PUSTAKA 12
x
DAFTAR TABEL
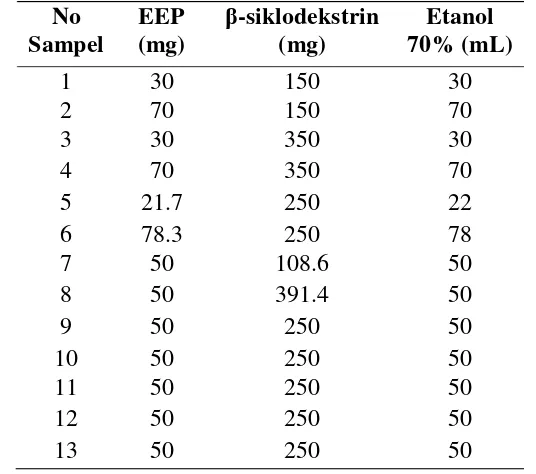
1 Formulasi preparasi pembuatan nanopropolis 3
2 Hasil rendemen EEP didalam β-siklodekstrin 6
DAFTAR GAMBAR
1 Propolis kasar lebah madu Trigona spp 5
2 Ekstrak etanol propolis 5
3 Hasil uji antibakteri 6
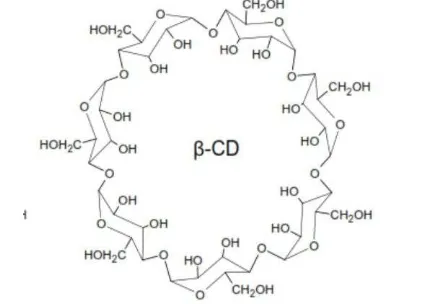
4 Struktur molekul dan bentuk toroid β-siklodekstrin 8
DAFTAR LAMPIRAN
1 Alur penelitian 14
2 Alur pembuatan ekstrak etanol propolis 15
3 Alur pembuatan nanopropolis 16
PENDAHULUAN
Indonesia merupakan negara beriklim tropis yang memiliki keanekaragaman hayati. Salah satu kekayaan hayati yang dapat dimanfaatkan adalah lebah madu. Madu merupakan salah satu produk alam yang dihasilkan oleh lebah yang telah lama dikenal dan dimanfaatkan di Indonesia karena khasiatnya dalam menyembuhkan berbagai macam penyakit. Selain menghasilkan madu, ternyata lebah juga menghasilkan produk lain seperti royal jelly, pollen, venom, dan propolis. Setiap produk lebah tersebut mempunyai fungsi dan manfaat yang berbeda bagi kesehatan manusia.
Propolis atau lem lebah merupakan suatu bahan resin yang dikumpulkan oleh lebah madu dari berbagai macam jenis tumbuhan. Jenis lebah yang dikenal mampu menghasilkan propolis dalam jumlah banyak, yaitu jenis Trigona spp. Lebah madu Trigona spp merupakan lebah asli Asia dari genus trigona yang memiliki karakteristik spesifik yaitu madu yang dihasilkan mempunyai rasa asam namun tahan terhadap fermentasi dan bersifat jarang sekali berpindah tempat, serta harga produk madunya lebih tinggi dibandingkan dengan madu produk lebah genus Apis. Jenis lebah madu Trigona spp menghasilkan propolis yang lebih banyak dibandingkan dengan lebah madu genus Apis (Sihombing 1997).
Propolis banyak digunakan dalam bidang kesehatan. Penelitian terhadap propolis telah banyak dilakukan baik secara in vivo maupun in vitro. Penelitian mengenai propolis yang diekstrak menggunakan metode maserasi, menyebutkan bahwa propolis memiliki potensi sebagai antibakteri. Ekstrak propolis lebah madu Trigona lebih efektif menghambat pertumbuhan bakteri Staphylococcus aureus, Bacillus subtilis, Escherichia coli, dan Pseudomonas aeruginosa dibandingkan dengan propolis komersial yang berasal dari lebah madu Apis mellifera (Angraini 2006). Menurut Lasmayanti (2007) propolis Trigona spp dapat digunakan sebagai antikaries alternatif dalam pasta gigi karena mampu menghambat pertumbuhan serta jumlah bakteri Streptococcus mutans, suatu bakteri penyebab karies gigi. Prasetyo (2011) menyatakan bahwa nanopropolis efektif menghambat pertumbuhan bakteri baik Gram positif maupun Gram negatif.
Metode ekstraksi yang digunakan dalam penelitian ini adalah metode maserasi dengan modifikasi MAE (microwave-assisted extraction). MAE merupakan metode ekstraksi menggunakan energi gelombang mikro yang dapat menghancurkan sel sehingga zat yang akan diekstrak keluar dari dalam sel dan memperbesar kontak antara pelarut dan sampel (Jang et al 2009). Diharapkan dengan modifikasi MAE, zat aktif dari propolis akan banyak terekstrak.
Pengembangan dan pemanfaatan teknologi nano saat ini telah banyak dilakukan. Salah satunya teknologi nano dapat diaplikasikan dalam bidang kesehatan untuk pembuatan obat. Keuntungan dari teknologi nano ini adalah meningkatkan efek terapi obat. Oleh karena itu, dalam penelitian ini akan diterapkan teknologi nano terhadap propolis, sehingga diharapkan dapat meningkatkan fungsi dari propolis tersebut. Propolis yang berukuran nano diduga dapat melewati membran luar bakteri sehingga senyawa-senyawa aktif antibakterinya dapat merusak dinding sel bakteri.
2
antibakteri khususnya pada bakteri Escherichia coli, maka digunakan berbagai
formulasi nanopropolis menggunakan β-siklodekstrin.
Penelitian ini bertujuan untuk mencari metode ekstraksi dan sintesis nanopropolis, serta menguji aktivitas antibakteri dan mengetahui nilai optimasi nanopropolis sebagai antibakteri. Manfaat dari hasil penelitian ini dapat memberikan informasi ilmiah mengenai metode ekstraksi propolis dan sintesis nanopropolis yang lebih baik dan memberikan informasi mengenai aktivitas antibakteri nanopropolis lebah madu Trigona spp serta nilai optimasi nanopropolis sebagai antibakteri terhadap bakteri E. coli.
METODE
Bahan
Bahan-bahan yang digunakan adalah propolis kasar Trigona spp asal Pandeglang, bakteri Gram negatif (E. coli), media padat NA (Nutrient Agar), media cair NB (Nutrient Broth), media PYG (Pepton Yeast extract Glucose), akuades, etanol 70%, β-siklodekstrin, bufer fosfat 50 mM pH 10 dan bufer fosfat 300 mM pH 5, dan ampisilin 10 mg/ml.
Alat
Alat-alat yang digunakan adalah microwave, rotavator EYELA OSB-2100, penangas air, cawan porselen, cawan petri, homogenizer 22000 rpm merek Tokebi, laminar air flow cabinet, wrap, shaker orbital EYELA, lemari es, neraca analitik, vortex, tabung Eppendorf, jarum ose, kaca sebar, autoklaf, mikropipet, dan alat-alat gelas lainnya.
Metode
Ekstrak Etanol Propolis
3
Pembuatan Nanopropolis
Pembuatan partikel nanopropolis menggunakan metode Aimi et al. (2009) yang dimodifikasi. Nanopropolis dirancang sebanyak tiga belas sampel dengan rancangan perbandingan komposisi antara ekstrak etanol propolis (EEP), β -siklodekstrin, serta pelarut etanol 70%. Fomulasinya dapat dilihat pada Tabel 1. Masing-masing sampel tersebut dihomogenisasi dengan tiga variasi waktu yang diperoleh berdasarkan waktu optimum penelitian sebelumnya (Dwitaharyani 2011). Tahap I selama 20 menit, tahap II dan tahap III selama 30 menit. Tahap I semua bahan dihomogenisasi dengan kecepatan 22000 rpm selama 20 menit. Selanjutnya etanol diuapkan menggunakan rotavapor dengan suhu 40οC, hingga larutan menjadi sedikit pasta. Ekstrak yang telah menjadi pasta diambil dan ditimbang. Kemudian ekstrak dilarutkan dalam larutan bufer fosfat 50 mM pH 10 (75 mL bufer fosfat pH 10 untuk 250 mg ekstrak), dan dihomogenisasi dengan waktu tahap II dengan kecepatan 22000 rpm. Hasil homogenisasi tersebut diambil sebanyak 10 mL dan dilarutkan dalam 100 mL larutan bufer fosfat 300 mM pH 5, dan dihomogenisasi dengan waktu tahap III dengan kecepatan 22000 rpm (Lampiran 3).
Pembuatan Media
Formula pembuatan media agar NA yaitu 28 gram serbuk NA untuk 1 liter akuades, sedangkan formula pembuatan media cair NB yaitu 13 gram serbuk NB untuk 1 liter akuades. Setelah media serbuk NA dan NB dilarutkan dengan akuades, kemudian disterilisasi menggunakan autoklaf dengan suhu 121oC selama 15 menit.
Pembuatan media PYG menggunkan metode Hadioetomo (1990). Komposisi media PYG terdiri atas pepton, yeast ekstrak, glukosa, dan agar, dengan perbandingan secara berurutan sebesar 1:1:2:2. Semua bahan dilarutkan
Tabel 1 Formulasi preparasi pembuatan nanopropolis
4
dengan akuades, kemudian dipanaskan hingga terbentuk larutan sempurna. Sterilkan dengan autoklaf pada suhu 121oC selama 15 menit. Tuangkan ke dalam cawan petri. Setelah agar PYG membeku, dimasukkan ke dalam inkubator 37oC selama 24 jam.
Regenerasi Bakteri Uji
Bakteri yang akan digunakan terlebih dahulu diregenerasi sebelum dipakai untuk uji aktivitas antibakteri yaitu dengan memilih koloni-koloni yang terpisah dari masing-masing bakteri uji sebanyak 1 ose. Kemudian digoreskan biakan dari stok bakteri tersebut ke permukaan agar miring NA yang masih baru. Selanjutnya diinkubasi pada suhu 37oC selama 24 jam. Biakan tersebut merupakan aktivitas awal dari stok bakteri yang telah disimpan pada suhu 4-5 oC. Diambil sebanyak 1 ose dari biakan tersebut dan diinokulasikan ke dalam tabung reaksi yang berisi 10 mL NaCl, sehingga mempunyai kekeruhan sesuai dengan suspensi McFarland no. 3 yaitu 9x109 sel per bakteri. Kemudian dari larutan suspensi tersebut dipipet sebanyak 0.5 mL ke dalam 4.5 mL NaCl sehingga diperoleh konsentrasi 10-6 bakteri per mL.
Uji Pendahuluan Aktivitas Antibakteri
Metode yang digunakan dalam penelitian ini adalah metode difusi cakram (Hadioetomo 1990). Inokulum bakteri hasil dari pengenceran diambil 1 mL untuk disebarkan di dalam cawan petri, lalu dituangkan 20 ml media PYG bersuhu ± 45oC, lalu cawan petri digoyangkan agar bakteri tersebar merata. Selanjutnya didiamkan pada suhu kamar sampai media agar memadat. Setelah padat, diletakkan kertas cakram yang mengandung ekstrak uji 50 ppm, kontrol positif ampisilin 10 mg/mL serta kontrol negatif berupa akuades, kemudian diinkubasi selama 24 jam lalu diamati dan diukur lebar daerah hambat (LDH) masing-masing cakram terhadap pertumbuhan bakteri. Lebar daerah hambat diukur dari diameter zona bening yang terbentuk. Semakin lebar daerah hambat menunjukkan semakin besar aktivitas antibakterinya.
Penentuan Konsentrasi Hambat Tumbuh Minimum
Penentuan KHTM dilakukan setelah diketahui bahwa ekstrak propolis memiliki aktivitas antibakteri. Tahap pertama yaitu pengenceran nanopropolis dengan akuades sehingga diperoleh 10 konsentrasi (0.009% sampai 5% v/v). Setiap konsentrasi sebanyak 50 µl dimasukkan ke dalam lubang media PYG padat yang mengandung bakteri uji, lalu diinkubasi pada suhu 37oC selama 24 jam. Aktivitas antibakteri diperoleh dengan mengukur diameter zona bening di sekitar lubang sampel menggunakan jangka sorong.
Analisis Statistik
5
Yij= µ + τi+ εij
Yij = pengamatan pada perlakuan ke-I dan ulangan ke-j
µ = pengaruh rataan umum
τ = pengaruh perlakuan ke-i
ε = pengaruh acak pada perlakuan ke-i ulangan ke-j.
Data yang diperoleh dianalisis dengan ANOVA (Analysis of varience) pada tingkat kepercayaan 95% dan taraf α 0.05. Uji selanjutnya yang digunakan adalah uji Duncan. Seluruh data dianalisis dengan menggunakan program SPSS 17.0.
HASIL DAN PEMBAHASAN
Hasil
Propolis kasar berbentuk serbuk yang berasal dari lebah madu Trigona spp (Gambar 1) diekstraksi dengan cara maserasi selama 18 jam, kemudian dimodifikasi menggunakan metode MAE (microwave-assisted extraction) selama 30 menit dengan suhu 50oC. Setelah itu pelarut etanol 70% diuapkan dan diperoleh ekstrak etanol propolis berwarna coklat tua (Gambar 2).
Gambar 1 Propolis kasar lebah madu Trigona spp.
6
Rendemen ekstrak etanol propolis yang diperoleh sebesar 10.93%. Ekstrak etanol propolis kemudian ditambahkan β-siklodekstrin dan dihitung rendemennya (Tabel 2). Nanopropolis yang dihasilkan berupa cairan. Selanjutnya ukuran partikel nanopropolis ditentukan menggunakan PSA (particle size analyzer). Sebaran ukuran nanopropolis yang diperoleh adalah 176.30 nm, 205.10 nm, dan 295.80 nm dengan nilai PI (polydispersity index) sebesar 0.5. Kemudian sampel nanopropolis diuji antibakteri terhadap bakteri E. coli dengan konsentrasi masing-masing sebesar 50 ppm. Hasil yang diperoleh dari pengujian antibakteri sampel nanopropolis terhadap bakteri E. coli menunjukkan bahwa ketiga belas sampel nanopropolis tersebut tidak berperan sebagai antibakteri. Kontrol positif yang digunakan adalah antibiotik ampisilin 10 mg/ml, sedangkan kontrol negatif menggunakan akuades. Hasil dari kontrol positif menunjukkan hal yang sama, yaitu tidak menunjukkan perannya sebagai antibakeri. Nanopropolis dan ampisilin tidak membentuk zona bening (Gambar 3).
Tabel 2 Hasil rendemen EEP
Gambar 3 Hasil uji antibakteri. Kontrol positif, ampisilin 10 mg/mL (a), nanopropolis
(b dan d) dan kontrol negatif, akuades (c). a
b c
7
Pembahasan Ekstrak Propolis
Propolis yang digunakan berasal dari sarang lebah madu Trigona spp asal Pandeglang. Propolis berfungsi untuk menambal sarang lebah yang bocor dan untuk memperkuat sarang. Propolis juga berfungsi untuk membungkus bangkai binatang yang masuk ke sarang lebah agar tidak menyebarkan penyakit, serta digunakan untuk mensterilkan sarang, menghentikan pertumbuhan dan penyebaran bakteri, virus, dan jamur (Winingsih 2004). Selain itu, propolis dapat berfungsi sebagai antibiotik alami karena kemampuan antimikrobnya. Kelebihan propolis sebagai antibiotik alami dibandingkan dengan bahan sintetik adalah lebih aman serta efek samping yang kecil. Satu-satunya efek samping yang terjadi dan itu pun jarang yaitu timbulnya reaksi alergi yang digunakan secara lokal sedangkan bila diberikan secara peroral tidak menimbulkan resistensi. Selain itu propolis sebagai antibiotik memiliki selektivitas tinggi. Propolis hanya membunuh penyebab penyakit sedangkan mikroba yang berguna seperti flora usus tidak terganggu (Winingsih 2004).
Propolis diekstrak menggunakan metode Jang et al. (2009), yaitu cara maserasi yang dimodifikasi menggunakan MAE (microwave-assisted extraction). Ketika berlangsung proses maserasi, propolis dibuat dalam keadaan gelap dengan dibungkus plastik hitam. Tujuan keadaan gelap dalam proses eksraksi adalah agar propolis tidak langsung terkena cahaya matahari yang akan membuat bahan aktif seperti flavonoid yang terkandung dalam propolis rusak. Setelah itu, propolis dipanaskan menggunakan metode bantuan gelombang mikro atau yang disebut MAE. Proses pemanasan dalam microwave berlangsung selama 30 menit. Waktu pemanasan menggunakan microwave merupakan hasil optimasi dalam penelitian Jannah (2011). MAE merupakan metode ekstraksi baru yang menggunakan energi gelombang mikro yang dapat menghancurkan sel sehingga zat yang akan diekstrak keluar dari dalam sel dan bercampur dengan pelarut serta memperbesar kontak antara pelarut dan sampel (Jang et al. 2009) sehingga diharapkan senyawa-senyawa yang diinginkan dapat terekstrak lebih baik dibandingkan metode maserasi sederhana. Margeretha et al. (2012) menyebutkan bahwa metode MAE merupakan metode yang efektif dalam ekstraksi flavonoid dan total fenolik pada propolis lebah madu Trigona spp dibandingkan dengan metode maserasi dan refluks. Routray & Orsat (2011) menyatakan hal yang sama bahwa MAE merupakan metode potensial untuk menghasilkan senyawa flavonoid dibandingkan metode ekstraksi lain. Metode MAE dikarakterisasi oleh kecepatan dan pemanasan yang sama pada ekstrak dan pelarut. Menurut Jang et al. (2009) waktu ekstraksi yang baik digunakan sekitar 15-30 menit. Penelitian Margeretha (2012) menggunakan waktu ekstraksi yang sama, yaitu 30 menit.
8
sebagai pelarut adalah etanol memiliki titik didih yang rendah dan mudah menguap, sehingga memperkecil jumlahnya didalam ekstrak.
Setelah propolis diekstraksi dengan pelarut etanol 70%. Tahap selanjutnya dilakukan penguapan untuk menghilangkan pelarutnya. Penguapan dilakukan pada suhu 40oC. Penggunaan suhu 40oC untuk melindungi senyawa aktif pada propolis, seperti flavonoid sebagai bahan antimikrob agar tidak rusak karena flavonoid tidak tahan panas.
Berdasarkan hasil ekstraksi, rendemen ekstrak propolis yang diperoleh tergolong tinggi, yaitu sebesar 10.93% dengan perbandingan 1 gram propolis dalam 20 mL etanol 70%, sedangkan pada penelitian Prasetyo (2011) rendemen yang dihasilkan sebesar 13.33%, dengan menggunakan propolis sebanyak 150 gram. Metode ekstraksi yang digunakan dalam penelitian Prasetyo (2011) yaitu metode maserasi sederhana. Metode maserasi sederhana memerlukan waktu yang lebih lama, yaitu pengadukan selama 1 minggu, penggunaan jumlah ekstrak kasar yang lebih banyak, serta memerlukan volume pelarut yang lebih banyak, sedangkan metode maserasi dengan modifikasi MAE memerlukan waktu pengadukan yang lebih singkat, yaitu 18 jam, serta bahan dan volume pelarut yang sedikit. Penelitian Margeretha et al. (2012) menggunakan MAE untuk propolis lebah madu Trigona spp memperoleh parameter optimum untuk nilai maksimum flavonoid yaitu konsentrasi etanol sebesar 64.66%, waktu ekstraksi selama 24.42 menit, dan diprediksi isi dari flavonoid sebesar 0.36%, sedangkan parameter optimum untuk nilai maksimum total fenolik yaitu konsentrasi etanol 60.85%, waktu ekstraksi selama 30.57 menit, dan diprediksi isi dari total fenolik sebesar 5.81%. Dilihat dari hasil rendemen, perbedaan nilai rendemen yang diperoleh dapat dipengaruhi oleh warna propolis. Warna propolis dipengaruhi oleh senyawa flavonoid yang terkandung dalam ekstrak. Propolis dengan warna lebih gelap akan menghasilkan rendemen yang lebih besar dibandingkan dengan propolis dengan warna lebih muda (Salomao et al. 2004). Warna propolis yang diperoleh dalam penelitian ini berwarna cokelat tua, sedangkan pada penelitian Prasetyo (2011) warna propolis yang diperoleh adalah cokelat. Bankova dan Popova (2007), menyatakan bahwa perbedaan nilai rendemen dipengaruhi oleh vegetasi tempat lebah Trigona spp dalam mendapatkan bahan baku propolis, musim, dan lokasi geografi tempat pengambilan propolis.
Setelah itu, EEP (ekstrak etanol propolis) dilarutkan bersama β -siklodekstrin sebagai tahap awal pembuatan nanopropolis. Tahap tersebut menghasilkan bentuk berupa serbuk karena proses evaporasi. Serbuk dihitung rendemennya. Diperoleh nilai rendemen tertinggi pada sampel nanopropolis nomor 10, yaitu sebesar 96.7%. Hal ini menunjukkan sampel nomor 10 memiliki nilai efektifitas yang tinggi dibandingkan dengan sampel yang lainnya. Selanjutnya akan dibuktikan pada uji aplikasi.
Nanopropolis
Teknologi nano merupakan teknik memanipulasi materi menjadi berskala nanometer dari sekumpulan atomnya melalui pemurnian bentuk serbuknya (Aitken et al. 2004). Nanopropolis yang dihasilkan dalam penelitian ini berupa cairan. Nanopropolis dirancang sebanyak tiga belas formulasi untuk mencari
9
nanopropolis menggunakan metode Aimi et al. (2009) yang dimodifikasi dengan menggunakan teknik homogenisasi pada kecepatan 22000 rpm. Waktu homogenisasi didasarkan pada waktu optimum yang diperoleh penelitian Dwitaharyani (2012) yaitu tahap I dan II selama 20 menit, sedangkan tahap III selama 30 menit. Teknik homogenisasi pada kecepatan tinggi bertujuan unuk mengecilkan ukuran partikel serta terjadinya tumbukan dan benturan antar partikel
yang menyebabkan terjadinya interaksi antara propolis dan β-siklodekstrin pada proses penyalutan. Proses penyalutan propolis menggunakan teknik mikroenkapsulasi. Komponen mikroenkapsulasi terdiri atas bahan inti dan bahan penyalut. Propolis merupakan bahan inti yakni bahan spesifik yang akan disalut. Bahan penyalut merupakan bahan yang digunakan untuk menyelaputi inti dengan tujuan tertentu. Bahan penyalut harus mampu memberikan suatu lapisan tipis yang kohesif dengan bahan inti, tidak bereaksi dengan inti (bersifat inert) dan mempunyai sifat yang sesuai dengan tujuan penyalutan (Laga 2008).
Bahan penyalut yang digunakan adalah β-siklodekstrin. β-siklodekstrin merupakan salah satu jenis pati termodifikasi oleh aktivitas enzim CGTase (siklodekstrin glikosil transferase) (Laga 2008). Struktur β-siklodekstrin berbentuk seperti donat (toroid) dengan permukaan luar bersifat hidrofilik dan bagian rongga dalam bersifat hidrofobik (Isadiartuti & Suwaldi 2005). Struktur kimia β-siklodekstrin dapat dilihat pada Gambar 5. Penyalutan propolis oleh β -siklodekstrin akan membentuk kompleks inklusi. Pembentukan kompleks dipengaruhi oleh sifat hidrofobik propolis yang berinteraksi dengan bagian rongga dalam siklodekstrin. Kompleks inklusi yang terbentuk dapat meningkatkan kelarutan dan stabilitas, selain itu, kompleks ini dapat melindungi senyawa aktif yang terdapat dalam propolis dari pengaruh oksidasi (Yunianto 2000). Penelitian Coneac et al. (2008), menunjukkan bahwa propolis dan β-siklodekstrin dalam ukuran nanopartikel akan membentuk interaksi yang lebih baik. Oleh karena itu,
β-siklodekstrin dipilih sebagai bahan penyalut, karena propolis dan β -siklodekstrin dapat membentuk kompleks yang dapat meningkatkan kelarutan, memiliki stabilitas yang tinggi, dan tidak toksik terhadap tubuh.
Metode Aimi et al. (2009) menggunakan bufer fosfat pH basa dan asam. Penggunaan bufer fosfat tersebut bertujuan untuk membuat nanopropolis lebih stabil dalam kondisi asam dan dapat mengontrol ukuran partikel. Bufer fosfat yang digunakan adalah bufer fosfat 50 mM pH 10 dan bufer fosfat 300 mM pH 5.
Gambar 5 Struktur Molekul dan Bentuk
10
Penggunaan bufer fosfat dengan perbedaan pH tersebut diharapkan dapat mengkondisikan semakin banyak ekstrak yang membentuk kompleks dengan siklodekstrin dan lebih stabil.
Selanjutnya ukuran nanopropolis ditentukan menggunakan PSA (particle size analyzer). Hasil PSA yang diperoleh memiliki sebaran 176.30 nm, 205.10 nm, dan 295.80 nm. Nanopropolis pada penelitian Dwitaharyani (2012) menunjukkan ukuran partikel dengan sebaran 171 nm, 369 nm, dan 773 nm, sedangkan nanopropolis pada penelitian Prasetyo (2011) menunjukkan ukuran partikel dengan sebaran 175 nm, 197 nm, dan 307 nm. Berdasarkan ketiga penelitian mengenai sintesis nanopropolis yang berasal dari lebah madu Trigona spp, ukuran nanopropolis ketiganya tidak berbeda jauh, walaupun terdapat perbedaan didalam pembuatannya. Sintesis nanopropolis Dwitaharyani (2012) menggunakan bahan
penyalut dan metode yang sama, yaitu β-siklodekstrin dan metode Aimi et al (2009) yang dimodifikasi, sedangkan sintesis nanopropolis Prasetyo (2011) menggunakan bahan penyalut dan metode yang berbeda. Sintesis nanopropolis Prasetyo (2011) menggunakan bahan penyalut maltodekstrin dan menggunakan penggabungan metode modifikasi Bhaskar et al. (2009) dengan Sutriyo et al. (2004) yang hanya dilakukan dua tahap homogenisasi pada kecepatan 22000 rpm. Maltodekstrin (C6H10O5).nH2O merupakan polimer dari D-glukosa yang berikatan
dengan ikatan α-1,4 glikosidik. Ikatan yang terdapat dalam maltodekstrin ini sangat lemah dan mudah terputus. Maltodekstrin bersifat meningkatkan viskositas membentuk matriks hidrogel dan memiliki daya rekat (Anwar 2004).
Nanopropolis yang dibuat oleh Coneac et al. (2008) dengan bahan penyalut
β-siklodekstrin menunjukkan bentuk partikel yang tidak seragam dan tepian yang tidak rata. Hasil analisis SEM (scanning elektrone microscope) nanopropolis pada penelitian Prasetyo (2011) juga menunjukkan bahwa partikel nanopropolis memiliki bentuk yang tidak seragam dengan tepian yang tidak rata. Ukuran nanopropolis yang dihasilkan pada penelitian ini serta penelitian Dwitaharyani (2012) dan Prasetyo (2011) sesuai dengan pernyataan Mohanraj dan Chen (2006), yaitu bahan organik dalam bentuk nanopartikel memiliki ukuran 10-1000 nm yang dilindungi oleh matriks pembawanya.
Nilai indeks polidispersitas yang diperoleh dari hasil uji PSA yaitu 0.5. Indeks polidispersitas merupakan parameter untuk menentukan distribusi ukuran partikel dari sintesis nanopartikel. Nilai tersebut menunjukkan bahwa partikel nanopropolis yang dibuat berada dalam rentang nanopartikel. Semakin mendekati nol, maka distribusi parikel semakin baik.
Uji Antibakteri
11
Uji antibakteri dilakukan dengan metode difusi cakram karena metode ini umum dan mudah dilakukan. Uji ini dilakukan secara dua kali ulangan atau duplo. Ada tidaknya zona hambat yang terbentuk disekitar kertas cakram menunjukkan aktivitas antibakteri dari nanopropolis. Pelczar dan Chan (1988) menyatakan bahwa suatu senyawa memiliki kemampuan sebagai bahan antibakteri dipengaruhi konsentrasi antibakteri, jumlah bakteri, dan jenis bakteri yang digunakan. Semakin besar konsentrasi antibakteri yang digunakan, maka daya hambatnya juga akan semakin besar.
Kontrol positif yang digunakan adalah antibiotik ampisilin. Ampisilin merupakan antibiotik β-laktam dan termasuk ke dalam golongan penisilin. Ampisilin mampu menghambat bakteri Gram positif dan Gram negatif. Namun, dalam penelitian ini hal tersebut tidak berlaku, karena ampisilin tidak membentuk zona bening terhadap E. coli. Artinya ampisilin tidak dapat menghambat bakteri E.coli. Hal ini dapat disebabkan karena konsentrasi ampisilin yang terlalu rendah, sehingga fungsi antibakterinya tidak terlihat jelas. Umumnya konsentrasi ampisilin yang digunakan sebesar 100 mg/mL dan konsentrasi paling rendah sebesar 50 mg/mL.
Mekanisme kerja dari antibiotik ampisilin adalah dengan menghambat pembentukan ikatan silang pada biosintesis peptidoglikan yang melibatkan penicillin-binding protein (PBP). Pada E. coli, PBP1-3 merupakan enzim bifungsi yang mengkatalisis reaksi transglikosilase dan transpeptidase serta PBP3-6 mengkatalisis reaksi karboksipeptidasi.
Pengujian sampel nanopropolis terhadap bakteri E. coli menunjukkan tidak terbentuknya zona bening atau zona hambat. Hal ini menunjukkan pada nanopropolis tersebut tidak terdapat zat aktif sebagai bahan antibakteri. Diduga senyawa flavonoid pada propolis rusak akibat proses homogenisasi. Penelitian sebelumnya menunjukkan adanya aktivitas antibakteri terhadap E.coli. Hasil penelitian Prasetyo (2011) menyatakan zona bening yang terbentuk dari nanopropolis terhadap E.coli sebesar 15.55 mm, sedangkan pada ekstrak propolis hanya membentuk zona bening sebesar 6.85 mm. Zona bening dari ekstrak propolis yang dihasilkan Angraini (2006) sebesar 12.617 mm. Berdasarkan data dari penelitian tersebut menunjukkan bahwa nanopropolis memiliki daya hambat yang lebih baik dibandingkan dengan ekstrak propolis.
Mekanisme antibakteri pada propolis belum diketahui sepenuhnya. Diperkirakan peran propolis sebagai antibakteri adalah menghambat kerja enzim polimerase DNA bakteri untuk melekat pada DNA sehingga replikasi DNA bakteri tidak terjadi.
Angraini (2006) menyatakan berdasarkan hasil uji fitokimia yang dilakukan, senyawa yang bersifat antibakteri adalah flavonoid, tanin, saponin, dan senyawa fenolik. Menurut Cushine & Lamb (2005), gugus hidroksil pada flavonoid menyebabkan berubahnya komponen organik dan transport nutrisi yang dapat mengakibatkan efek toksik bagi bakteri.
12
uji pendahuluan antibakteri, hal tersebut tidak terjadi, karena tidak terbentuk zona bening. Sehingga uji selanjutnya, yaitu uji KHTM (konsentrasi hambat tumbuh minimum) tidak dapat dilakukan.
SIMPULAN
Metode maserasi dengan modifikasi MAE menghasilkan rendemen yang tinggi yaitu sebesar 10.93%. Hasil uji PSA menunjukkan sebaran ukuran partikel sebesar 176.30 nm, 205.10 nm, dan 295.80 nm. Sintesis nanopropolis belum sesuai dengan yang diharapkan. Hal ini terlihat dari tidak terbentuknya zona bening. Begitu pula pada kontrol positif, yaitu ampisilin 10 mg/mL. Oleh karena itu, uji KHTM tidak dapat dilakukan.
SARAN
Perlu dilakukan penelitian lebih lanjut mengenai metode ekstrak propolis dengan menggunakan waktu pemanasan dan konsentrasi etanol yang berbeda, sedangkan untuk sintesis nanopropolis perlu digunakan alat homogenisasi yang berbeda agar diperoleh efektifitas yang lebih baik. Uji antibakteri perlu dilakukan ulangan lebih banyak dan menggunakan ampisilin dengan konsentrasi yang lebih tinggi. Selain itu, perlu dilakukan uji FTIR untuk melihat keberadaan propolis dalam penyalut.
DAFTAR PUSTAKA
Aimi et al, penemu; United State Patent Aplication Publication. 12 Nov 2009 .Casein nanoparticle. US 2009/0280148 A1.
Aitken RJ, Creely KS, Tran CL. 2004. Nanoparticle: An occupational hygiene review. Norwegia: St Clements House.
Angraini AD. 2006. Potensi propolis lebah madu Trigona spp sebagai bahan antibakteri [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bankova V, Popova M. 2007. Propolis of stingless bee: a promising source of biologically active compounds. Pharmacognosy Reviews 1: 88-92.
Coneac et al. 2008. Propolis extract/β-cyclodextrin nanoparticles: synthesis, physico-chemical, and multivariate analyses. Journal of Agroalimentary Processes and Technologies 14:58-70.
Dwitaharyani M. 2012. Nanopropolis sebagai penghambat poliferasi sel kanker payudara MCF-7 [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
13
Fitriannur. 2009. Aktivitas antibakteri propolis lebah Trigona spp asal Pandeglang terhadap Enterobacter sakazakii [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hadioetomo. 1990. Mikrobiologi Dasar dalam Praktik. Jakarta: Gramedia.
Jannah N. 2011. Potensi ekstrak propolis Trigona spp asal Sambas dan Malang terhadap aktivitas sel kanker MCF-7 [skripsi]. Bogor: Universitas Pakuan. Jang M-J et al. 2009. Optimization analysis of the experimental parameters on the
extraction process of propolis. Intenational Multi Conference of Engineers and Computer Scientists 2: 1-5.
Jawetz E et al. 1995. Mikrobiologi Kedokteran ed. 20. San Francisco: University of California.
Laga A. 2008. Pengaruh konsentrasi substrat hidrolisat tapioka dan akseptor minimal pada pembentukan siklodekstrin. J. Teknologi dan Industri Pangan XIX (2) : 149-157.
Lasmayanti M. 2007. Potensi antibakteri propolis lebah madu Trigona spp terhadap bakteri kariogenik (Strepococcus mutans) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Margeretha I et al. 2012. Optimization and comparative study of different extraction methods of biologically active components of Indonesian propolis Trigona spp. Journal of Natural Products 5: 233-242.
Mohanraj VJ, Chen Y. 2006. Nanoparticles-A review. Tropical Journal of Pharmaceutical Research 5: 561-573.
Pelczar MJ, Chan ECS. 1988. Dasar-Dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Prasetyo R. 2011. Potensi nanopropolis lebah madu Trigona spp asal Pandeglang sebagai antibakteri [skripsi]. Bogor: Institut Pertanian Bogor.
Routray W & Orsat V. 2011. Microwave-Assisted Extraction of Flavonoids: A Review. Food Bioprocess Technol 1-2.
Salomao K et al. 2004. Chemical composition and microbicidal activity of extracts from Brazilian and Bulgarian propolis. Letters in Applied Microbiology 38:87–92.
Sihombing DTH. 1997. Ilmu Ternak Lebah Madu. Yogyakarta: Gajah Mada Univ Pr.
Sutriyo, Djajadisastra J, Novitasari A. 2004. Mikrokapsulasi propanol hidroklorida dengan penyalut etil selulosa menggunakan teknologi penguapan pelarut. Majalah Ilmu Kefarmasian 1: 93-101.
Winingsih. 2004. Kediaman lebah sebagai antibiotik dan antikanker. [terhubung berkala]. http://www.pikiranrakyat.com/cetak/0904/16/cakrawala.html [11 Oktober 2011]
Woo KS. 2004. Use of bee venom and propolis for apitherapi in Korea. Di Dalam Proceeding of 7th Asian Apicultural Associato Conference and 10th BEE)ET Symposium and Technofora; Los Banos, Februari 2004. Los Banos: Univ Phillipines. hlm: 311-315.
Yunianto, Prasetyawan. 2000. Pengaruh pH dan suh terhadap produksi β
14
Lampiran 1 Alur penelitian
Pembuatan ekstrak propolis
Uji efektivitas antibakteri terhadap masing-masing ekstrak
Analisis data Ekstrak bentuk
pasta Ekstrak etanol
propolis (EEP)
Pembuatan nanopropolis
Ekstrak cair Kompleks propolis
dan ß-siklodekstrin
15
Lampiran 2 Alur pembuatan ekstrak etanol propolis
Dilarutkan dalam alkohol 70% sebanyak 20 mL
Dimasukkan kedalam microwave selama 30 menit Dikocok dengan kecepatan 200 rpm selama 18 jam dan
ditutup dengan plastik hitam
Disaring
Diuapkan diatas penangas air dengan suhu 40oC
Ekstrak yang telah diuapkan kemudian ditimbang
Dihitung berat ekstrak dan rendemen Raw propolis
16
Lampiran 3 Alur pembuatan nanopropolis
Dievaporasi
Dilarutkan dengan buffer fosfat 50 mM pH10 Homogenisasi selama 20 menit (tahap 1)
Diambil 10 ml
Homogenisasi selama 20 menit (tahap 2)
Homogenisasi selama 30 menit (tahap 3) Dilarutkan dalam 100 ml buffer fosfat 300 mM pH 5
Ekstrak + etanol + ß-siklodekstrin
Serbuk
17
Lampiran 4 Alur pengujian antibakteri
Pengujian sensitifitas bakteri secara invitro
Pembuatan ekstrak uji
Pembuatan media PYG
Penyiapan larutan stok
bakteri uji
Penyiapan kertas cakram
Uji pendahuluan
Uji KHTM
18
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 18 Juni 1989 dari ayahanda Oded Muhamad Danial dan ibunda Lala Nurlaeni (almh). Tahun 2006, ibunda Siti Muntamah hadir dalam kehidupan penulis. Penulis merupakan putri pertama dari tujuh bersaudara. Desember 2011 penulis menikah dengan seorang mahasiswa teknik elektro. Kini penulis telah dikaruniai bayi mungil nan tampan bernama Ahmad Fakhri Nurrobbani.
Tahun 2007 penulis lulus dari SMA PGII 1 Bandung dan pada tanggal 2 Juli 2007 penulis menginjakkan kakinya di Institut Pertanian Bogor. Penulis berhasil masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.