PEMANFAATAN FRAKSI AKTIF EKSTRAK
TANAMAN JARAK PAGAR (
Jatropha curcas
Linn.)
SEBAGAI ZAT ANTIMIKROBA DAN ANTIOKSIDAN
DALAM SEDIAAN KOSMETIK
SRI WINDARWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul : PEMANFAATAN FRAKSI AKTIF EKSTRAK TANAMAN JARAK PAGAR (Jatropha curcas Linn.) SEBAGAI ZAT ANTIMIKROBA DAN ANTIOKSIDAN DALAM SEDIAAN KOSMETIK adalah benar merupakan karya sendiri dibawah arahan Komisi Pembimbing dan belum pernah dipublikasikan. Semua sumber data dan informasi telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Juli 2011
ABSTRACT
SRI WINDARWATI. F351074011. Utilization of Active Fraction of Jatropha curcas Herb Extracts as Antimicrobial and Antioxidant Agents in Cosmetic. Supervised by DWI SETYANINGSIH and FRANSISKA R. ZAKARIA.
Crude extract of Jatropha curcas herbs exhibit antimicrobial and antioxidant activity that may be used in cosmetic product. Extract fractionation was done by solvent partition with hexane and ethyl acetate successively to produce low and medium polarity fractions. The objective of this research was to obtain active fraction from leaves, seedcakes, and stem barks of Jatropha curcas as antimicrobial and antioxidant agents in cosmetics product. Furthermore, this research examined the toxicity of the selected fractions and its cosmetics product i.e. hand and body cream. Crude extract and/or its fractions were analyzed for antioxidant activity by DPPH scavenging test, antimicrobial activity, total phenol, phorbol ester, skin irritation testing by Draize test, and chemical composition by GC-MS. Results of this study showed that methanol fraction of leaf extract was the most potential antioxidants with DPPH scavenging activity of 89.42%, while ethyl acetate fraction from the same extract was potentially used as an antimicrobial agent with zone of inhibition of 12,5 mm. Total phenol content for methanol and ethyl acetate fractions was 32,76 and 88,53 mg tannic acid/g sample, respectively. Primary irritation testing using New Zealand white rabbits revealed that application of methanol fraction (0,064%-1%) did not induce erythema or edema formation, meanwhile the cream containing this fraction induced mild irritation. Application of ethyl acetate fraction of 1.25% did not caused skin irritation, meanwhile the cream containing this fraction induced mild irritation. Crude extract and ethyl acetate fractions of leaf extract were classified as slight irritant; meanwhile methanol fraction was considered as non irritant. Allergenic reaction using human IgE showed that crude extract of leaves, seedcakes and stem barks may react with human IgE that may induce allergy reaction.
Key words: antimicrobial, antioxidant, skin irritation, Jatropha curcas, extract
RINGKASAN
SRI WINDARWATI. F351074011. Pemanfaatan Fraksi Aktif Ekstrak Tanaman Jarak Pagar (Jatropha curcas Linn.) sebagai Zat Antimikroba dan Antioksidan dalam Sediaan Kosmetik. Dibimbing oleh DWI SETYANINGSIH dan FRANSISKA R. ZAKARIA.
Kajian mengenai aktivitas biokimia yaitu sifat antimikroba dan antioksidan ekstrak kasar tanaman jarak pagar telah dilakukan oleh beberapa peneliti. Untuk mendapatkan ekstrak murni dengan aktivitas biokimia yang lebih tinggi serta untuk mendukung pemanfaatannya dalam produk turunan, maka fraksi aktif dari ekstrak tanaman jarak pagar yang potensial sebagai agen antimikroba dan antioksidan perlu dievaluasi. Uji coba pemanfaatan fraksi aktif ekstrak jarak pagar dalam formula produk akhir perlu dilakukan untuk mengetahui efektivitasnya dalam bentuk sediaan kosmetik/produk akhir sekaligus uji toksisitas dan alergenitas untuk mengetahui tingkat keamanan penggunaan produk.
Tujuan penelitian adalah untuk mengembangkan produk berbasis senyawa aktif ekstrak tanaman jarak pagar, lebih khusus adalah produk zat antimikroba dan zat antioksidan dalam sediaan kosmetik. Tujuan khusus penelitian adalah mendapatkan fraksi aktif ekstrak tanaman jarak pagar yang potensial sebagai zat antimikroba dan antioksidan, mengidentifikasi senyawa kimia yang terdapat pada fraksi aktif ekstrak tanaman jarak pagar yang diperoleh, mendapatkan produk sediaan kosmetik yang memanfaatkan fraksi aktif ekstrak tanaman jarak pagar, mendapatkan informasi toksisitas kulit dari fraksi aktif ekstrak jarak pagar dan produk sediaan kosmetik yang dihasilkan dan mendapatkan informasi sifat alergenitas dari ekstrak jarak pagar.
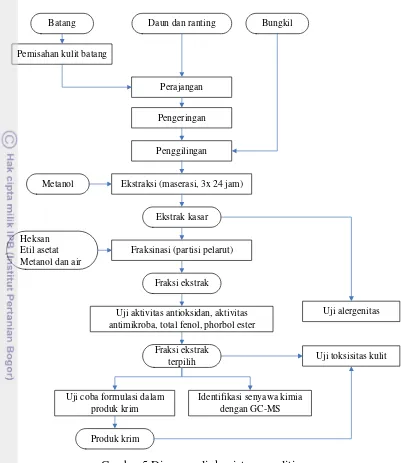
Penelitian diawali dengan persiapan dan karakterisasi bahan baku (daun, bungkil, kulit batang), dilanjutkan dengan proses ekstraksi dan fraksinasi untuk menentukan fraksi terpilih sebagai zat antimikroba dan zat antioksidan. Ekstrak kasar dan fraksi-fraksi ekstrak dianalisa aktivitas antioksidan (peredaman DPPH), aktivitas antimikroba (difusi sumur), kandungan total fenol (Folin Ciocalteu) dan kandungan senyawa toksik ester forbol. Fraksi terpilih diidentifikasi komposisi kimianya dengan Gas Chromatography Mass Spectrometry (GC-MS) dan digunakan dalam uji coba formulasi fraksi ekstrak jarak pagar dalam produk krim. Pengaruh penambahan ekstrak jarak pagar terpilih dievaluasi berdasarkan analisa pH, stabilitas emulsi, aktivitas antioksidan dan cemaran mikroba. Sebagai uji tingkat keamanan penggunaan ekstrak, dilakukan uji toksisitas kulit yaitu uji iritasi kulit primer dengan metode Draize test dan uji sifat alergenitas ekstrak dengan metode Enzyme Linked Immunosorbent Assay (ELISA).
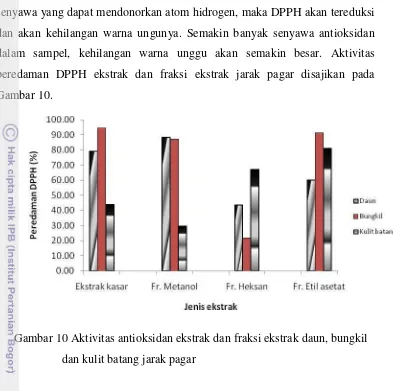
Fraksi polar dari ekstrak metanol daun jarak pagar berpotensi sebagai zat antioksidan dengan aktivitas peredaman DPPH 89,42%, kandungan total fenol 32,76±0,58 mg asam tanat/g dan tidak teridentifikasi senyawa toksik ester forbol. Sedangkan fraksi etil asetat dari ekstrak yang sama berpotensi sebagai zat antimikroba dengan diameter penghambatan terhadap S.aureus 12,50 mm, dengan kandungan total fenol 88,53±10,89 mg asam tanat/g ekstrak
asetat terpilih teridentifikasi senyawa terpen, senyawa fenol, asam lemak, alkaloid dan senyawa glikosida. Senyawa-senyawa tersebut berasal dari tanaman dan reaksi pada proses penyiapan ekstrak, dan kemungkinan bertanggung jawab terhadap aktivitas antimikroba dan antioksidan yang dimiliki.
Formulasi produk krim dengan penambahan fraksi etil asetat 1,25% sebagai substitusi metil paraben dan propil paraben merupakan formula terbaik yang memiliki aktivitas antioksidan tertinggi dan nilai cemaran mikroba terendah. Sedangkan formulasi produk krim dengan penambahan fraksi metanol daun jarak 0,064% sebagai substitusi BHT memiliki aktivitas antioksidan yang lebih rendah dari formula komersial.
Penggunaan fraksi metanol daun jarak pagar sebagai zat antioksidan dalam formula produk krim masih mungkin untuk ditingkatkan konsentrasinya karena fraksi ekstrak ini dalam bentuk larutan 0,064%-1% dan pengenceran 1:1 (50%) tidak menyebabkan reaksi iritasi kulit, dan diklasifikasikan sebagai bahan “non irritant”. Larutan fraksi etil asetat daun jarak dengan konsentrasi 1,25% tidak menyebabkan reaksi iritasi kulit (PII=0), sedangkan konsentrasi 2,5% dapat menyebabkan iritasi lemah (PII=0,25) dan dengan pengenceran 1:1 menyebabkan iritasi ringan (PII=2,25). Ekstrak kasar daun jarak pagar juga menyebabkan iritasi kulit ringan (PII 1,25). Hasil uji sifat alergenitas ekstrak jarak pagar menggunakan IgE manusia menunjukkan bahwa ketiga ekstrak kasar (daun, bungkil, kulit batang) bereaksi positif dengan IgE serum subyek dan berpotensi menyebabkan reaksi alergi.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya.Pengutipan hanya untuk
kepentingan pendidikan, penelitian, penulisan karya ilmiah,
penyusunan laporan, penulisan kritik atau tinjauan suatu masalah;
dan pengutipan tersebut tidak merugikan kepentingan yang wajar
IPB
PEMANFAATAN FRAKSI AKTIF EKSTRAK TANAMAN
JARAK PAGAR (
Jatropha curcas
Linn.) SEBAGAI ZAT
ANTIMIKROBA DAN ANTIOKSIDAN
DALAM SEDIAAN KOSMETIK
SRI WINDARWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
i
LEMBAR PENGESAHAN
Judul Tesis : Pemanfaatan Fraksi Aktif Ekstrak Tanaman Jarak Pagar (Jatropha curcas Linn.) sebagai Zat Antimikroba dan Antioksidan dalam Sediaan Kosmetik
Nama : Sri Windarwati
N RP : F351074011
Disetujui
Komisi Pembimbing
Dr. Ir. Dwi Setyaningsih, M.Si. Prof. Dr. Fransisca R. Zakaria, M.Sc.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Teknologi Industri Pertanian
Dr. Ir. Machfud, MS Dr. Ir. Dahrul Syah, MSc. Agr
iii
PRAKATA
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karuniaNya sehingga tugas akhir penelitian yang berjudul: “Pemanfaatan Fraksi Aktif Ekstrak Tanaman Jarak Pagar (Jatropha curcas Linn.) sebagai Zat Antimikroba dan Antioksidan dalam Sediaan Kosmetik” dapat diselesaikan.
Tidak bisa dipungkiri bahwa pelaksanaan penelitian dan penyusunan thesis tidak mungkin selesai tanpa peran serta berbagai pihak yang telah membantu. Oleh karena itu pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Dr. Ir. Dwi Setyaningsih, M.Si. selaku Ketua Komisi Pembimbing dan Prof. Dr. Fransisca R. Zakaria, M.Sc selaku Anggota Komisi Pembimbing atas bimbingan dan arahannya; Dr. Ir. Liesbetini Hartoto, MS selaku dosen penguji atas arahan dan masukannya, teman-teman seperjuangan di SBRC LPPM IPB atas dukungan dan bantuannya dalam menyelesaikan penelitian, staf dan laboran di Departemen Teknologi Industri Pertanian, FATETA IPB serta rekan-rekan di Departemen Teknologi Industri Pertanian angkatan 2007 dan 2008. Secara khusus penulis mengucapkan terima kasih kepada Ecoscience Investments dan SBRC LPPM IPB atas kesempatan beasiswa yang diberikan. Ucapan terima kasih sebesar-besarnya penulis sampaikan kepada Bapak, Ibu, Kakak dan Adik-Adik dan seluruh keluarga atas segala dukungan dan doanya.
Penulis menyadari bahwa karya tulis ilmiah ini masih jauh dari sempurna, oleh karena itu saran dan kritik yang bersifat membangun sangat diharapkan agar dapat memberikan informasi dalam pengembangan karya tulis ini lebih lanjut.
Bogor, Juli 2011
v
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 25 Mei 1983 di Desa Ngawen Muntilan Magelang Jawa Tengah. Penulis merupakan anak kedua dari empat bersaudara dari pasangan Bapak Iskahar dan Ibu Siti Murni.
Pendidikan dasar diselesaikan oleh penulis pada tahun 1995 di SD Muhammadiyah Ngawen, Magelang dan pendidikan menengah pertama diselesaikan pada tahun 1998 di MTs Assalaam, Sukoharjo. Setelah itu penulis menyelesaikan pendidikan lanjutan menengah atas pada tahun 2001 di SMU Assalaam, Sukoharjo.
vii
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
I. PENDAHULUAN…. ... 1
1.1 Latar belakang ... 1
1.2 Tujuan ... 3
II. TINJAUAN PUSTAKA…. ... 5
2.1 Tanaman Jarak Pagar ... 5
2.2 Komposisi Kimia tanaman Jarak Pagar ... 7
2.3 Senyawa Metabolit Sekunder pada Tanaman ... 12
2.4 Ekstraksi dan Fraksinasi Senyawa Aktif ... 14
2.5 Zat Antimikroba ... 16
2.6 Zat Antioksidan ... 18
2.7 Sifat Toksisitas ... 20
2.8 Sifat Alergenitas ... 22
2.9 Produk Krim dan Pengawet pada Produk Kosmetik ... 26
III. METODOLOGI PENELITIAN …. ... 29
3.1 Kerangka Pemikiran ... 29
3.2 Waktu dan Tempat Penelitian... 29
3.3 Bahan dan Alat ... 30
3.4 Metode Penelitian ... 30
3.4.1 Persiapan dan Karakterisasi Bahan Baku ... 31
3.4.2 Proses Ekstraksi dan Fraksinasi ... 32
3.4.3 Analisis Ekstrak dan Fraksi Ekstrak ... 33
3.4.4 Pemanfaatan fraksi aktif dalam formulasi produk kosmetik ... 33
Halaman
3.4.6 Uji alergenitas ekstrak jarak pagar ... 35
3.5 Teknik Analisis Data ... 37
3.6 Hipotesis Penelitian... 38
IV. HASIL DAN PEMBAHASAN…. ... 39
4.1 Karakteristik Bahan Baku ... 39
4.2 Proses Ekstraksi Senyawa Aktif dan Fraksinasi ... 41
4.3 Analisa Ekstrak dan Fraksi Ekstrak ... 45
4.3.1Aktivitas Antimikroba... 45
4.3.2Uji Aktivitas antioksidan ... 49
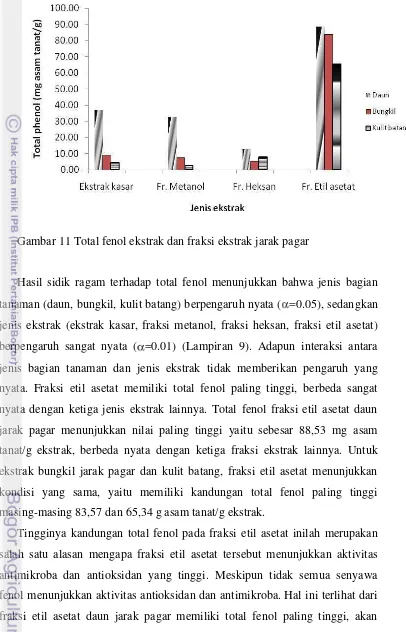
4.3.3Uji Total Fenol ... 53
4.3.4Kandungan Ester Forbol ... 55
4.4 Pemilihan Fraksi Ekstrak Jarak Potensial sebagai zat antioksidan dan zat antimikroba ... 57
4.4.1Zat Antioksidan ... 57
4.4.2Zat Antimikroba ... 61
4.5 Uji Coba Formulasi Ekstrak Terpilih dalam Produk Krim ... 64
4.6 Uji Toksisitas Kulit ... 78
4.7 Uji Sifat Alergi ... 81
V. SIMPULAN DAN SARAN…... 85
5.1 Simpulan ... 85
5.2 Saran ... 86
DAFTAR PUSTAKA …. ... 87
ix
DAFTAR TABEL
Halaman
1. Komposisi kimia kernel dan cangkang biji jarak pagar ... 7
2. Kandungan phorbol ester pada beberapa bagian tanaman jarak pagar ... 10
3. Tingkat kepolaran beberapa jenis pelarut ... 15
4. Klasifikasi potensi iritasi kulit ... 21
5. Evaluasi reaksi kulit metode Draize ... 35
6. Hasil analisa proksimat bahan baku penelitian ... 40
7. Rendemen proses ekstraksi ... 42
8. Persentase fraksi-fraksi pelarut dari ekstrak ... 43
9. Rendemen ekstrak dan fraksi ekstrak jarak pagar ... 44
10.Kandungan ester forbol ekstrak dan fraksi ekstrak ... 56
11.Pemilihan ekstrak sebagai zat antioksidan ... 58
12.Identifikasi senyawa kimia fraksi metanol ekstrak daun jarak pagar ... 59
13.Pemilihan ekstrak sebagai zat antimikroba ... 62
14.Identifikasi senyawa kimia fraksi etil asetat ekstrak daun jarak pagar ... 62
15.Bahan pembuatan krim beserta fungsinya ... 65
16.Formula penambahan fraksi aktif terpilih dalam produk krim ... 66
17.Nilai cemaran mikroba pada formula produk krim ... 71
18.Pengaruh suhu penambahan ekstrak terhadap karakteristik krim ... 74
19.Formula produk krim dengan penambahan ekstrak jarak pagar ... 75
xi
DAFTAR GAMBAR
Halaman 1. Tanaman dan bagian tanaman jarak pagar ... 6 2. Struktur tetradecanoyl phorbol-13-acetate (TPA) ... 9 3. Respon peradangan dari senyawa ester forbol ... 11 4. Mekanisme alergi ... 26 5. Diagram alir kegiatan penelitian ... 31 6. Diagram alir pembuatan produk hand and body cream ... 34 7. Daun, bungkil biji dan batang tanaman jarak pagar ... 39 8. Fraksi metanol daun, bungkil dan kulit batang jarak pagar ... 45 9. Diameter zona penghambatan ekstrak dan fraksi ekstrak jarak pagar
terhadap Bakteri S. aureus ... 46 10.Aktivitas antioksidan ekstrak dan fraksi ekstrak daun, bungkil dan kulit
batang jarak pagar ... 50 11.Total fenol ekstrak dan fraksi ekstrak jarak pagar ... 54 12.Struktur senyawa yang teridentifikasi pada fraksi metanol daun jarak... 59 13.Perbandingan aktivitas antioksidan ekstrak terpilih dengan BHT ... 61 14.Struktur senyawa yang teridentifikasi pada fraksi etil asetat daun jarak ... 64 15.Produk krim hasil formulasi dengan fraksi ektrak jarak pagar ... 67 16.Histogram pengaruh formulasi produk krim terhadap nilai pH ... 68 17.Histogram pengaruh formulasi produk krim terhadap total mikroba... 70 18.Histogram pengaruh formulasi ekstrak terhadap aktivitas antioksidan krim 73 19.Produk krim dengan perbedaan suhu penambahan ekstrak ... 74 20.Histogram pengaruh formulasi ekstrak jarak terhadap aktivitas antioksidan
xiii
DAFTAR LAMPIRAN
I. PENDAHULUAN
1.3 Latar Belakang
Pengembangan jarak pagar sebagai salah satu tanaman penghasil Bahan Bakar Nabati (BBN) di Indonesia sudah mulai bermunculan dengan berbagai skala usaha. Sebagai bahan baku BBN, jarak pagar memiliki beberapa keunggulan dibanding tanaman penghasil BBN lainnya. Tanaman ini merupakan tanaman tropis yang dapat beradaptasi dengan baik pada lahan kering, memiliki kandungan minyak yang tinggi, dan memiliki ciri yang sesuai untuk bahan bakar. Selain itu jarak pagar tidak termasuk tanaman untuk pangan, sehingga pemanfaatannya sebagai bahan baku energi diharapkan tidak mengganggu stabilitas harga pangan. Keunggulan lain adalah hampir semua bagian tanaman dapat dimanfaatkan misalnya bungkil jarak sebagai biobriket, dan biopelet, sedangkan kulit buah dan daun jarak dimanfaatkan sebagai kompos.
Selain pemanfaatan sebagai bioenergi, jarak pagar juga memiliki potensi yang besar untuk pengembangan produk di bidang obat-obatan, pertanian maupun industri kimia. Daun jarak pagar di sejumlah daerah di Indonesia secara tradisional telah digunakan untuk penyembuh batuk, zat antiseptik setelah melahirkan, pereda panas, pereda kembung, obat cacing, obat gusi bengkak, anti ketombe dan lain-lain. Daun jarak juga dilaporkan sebagai obat malaria di Mali (Henning 1997) dan sebagai haemostatik di Afrika (Watt dan Breyer-Brandwijk 1962, diacu dalam Gubitz et al. 1999). Minyak jarak digunakan sebagai obat pencahar, mengobati penyakit kulit dan mengurangi rasa sakit akibat reumatik (Duke 1985, diacu dalam Gubitz et al. 1999). Di Afrika, biji jarak digunakan langsung sebagai obat pencahar dan anthelmintic (obat pembasmi cacing pathogen) (Watt dan Breyer-Brandwijk 1962, diacu dalam Gubitz et al. 1999). Penggunaan ekstrak jarak pagar secara tradisional untuk antiseptik dan obat gigitan ular dilakukan masyarakat di Brazil, untuk pengobatan infeksi saluran kencing di Timor, gatal-gatal kulit dan jamur mulut (candidiasis) di Tanzania dan sakit tenggorokan di Trinidad dan Tobago.
pengujian aktivitas antimikroba dari ekstrak etanol, metanol dan ekstrak air kulit batang jarak pagar. Kemampuan ekstrak kasar dalam menghambat pertumbuhan bakteri dan kapang merupakan indikasi adanya potensi yang besar sebagai produk antimikroba. Pase (2009) melakukan pengujian aktivitas antimikroba dari sabun transparan dan sabun opaque berbahan baku minyak jarak pagar. Adanya aktivitas antimikroba pada sabun jarak membuka peluang untuk pengembangan sabun kesehatan alami. Produk lain seperti antioksidan juga dapat dikembangkan dari jarak pagar. Diwani et al. (2009) mendapatkan bahwa ekstrak metanol dari akar tanaman jarak pagar menunjukkan aktivitas antioksidan yang tinggi yang dapat meningkatkan stabilitas oksidasi dari minyak dan biodiesel jarak pagar, jelantah dan minyak zaitun.
Dalam pengembangan produk-produk turunan senyawa aktif, beberapa negara telah mengembangkan beberapa produk seperti antibiotik, biopestisida, anti virus dan anti fungi serta isolat protein dari jarak pagar. Berkaitan dengan pengembangan jarak pagar di Indonesia sebagai bahan baku BBN, maka potensi senyawa aktif pada jarak pagar perlu mendapatkan perhatian karena berpotensi untuk menghasilkan produk-produk yang bermanfaat bagi manusia.
Kajian mengenai aktivitas antimikroba dan antioksidan ekstrak kasar tanaman jarak pagar yang meliputi bagian batang dan daun, kulit buah serta biji jarak dengan 3 jenis pelarut yaitu metanol, heksan dan etil asetat telah dilakukan. Hasil uji antioksidan menunjukkan bahwa aktivitas antioksidan terbesar terdapat pada sampel ekstrak metanol biji jarak. Hasil uji antimikroba dengan metode difusi sumur terhadap bakteri uji E.coli dan S. aureus menunjukkan bahwa sampel yang memiliki aktivitas antimikroba dengan diameter penghambatan 6 mm antara lain ekstrak biji jarak dengan pelarut metanol dan heksan, ekstrak batang + daun jarak dengan pelarut metanol dan heksan serta ekstrak kulit buah jarak dengan pelarut metanol. Ekstrak biji jarak pagar dengan pelarut metanol memiliki diameter hambat terbesar yaitu 11,9 mm terhadap bakteri E. coli dan 14,83 mm terhadap bakteri S. aureus (Nurmillah 2009).
3
dari ekstrak tanaman jarak pagar, yang potensial sebagai agen antimikroba dan antioksidan. Untuk mengetahui efektivitasnya dalam bentuk sediaan kosmetik maka perlu dilakukan uji coba pemanfaatan fraksi aktif ekstrak jarak pagar dalam formula hand & body cream.
1.4 Tujuan
Tujuan penelitian ini adalah mengembangkan produk bioaktif berbasis senyawa aktif ekstrak tanaman jarak pagar. Secara khusus, tujuan penelitian adalah:
a. Mendapatkan fraksi aktif ekstrak tanaman jarak pagar sebagai zat antimikroba dan antioksidan.
b. Identifikasi senyawa kimia yang terdapat pada fraksi aktif ekstrak tanaman jarak pagar yang diperoleh.
c. Mendapatkan produk sediaan kosmetik yang memanfaatkan fraksi aktif ekstrak tanaman jarak pagar.
II. TINJAUAN PUSTAKA
3.1Tanaman Jarak Pagar (Jatropha curcas. L)
Jarak pagar termasuk famili Euphorbiaceae. Tanaman ini merupakan tanaman semak atau pohon yang tahan terhadap kekeringan dan dapat tumbuh pada area dengan curah hujan rendah sampai tinggi (200-1500 mm per tahun). Tanaman ini berasal dari Amerika Tengah dan saat ini banyak dibudidayakan di Amerika Selatan dan Tengah, Asia Tenggara, India dan Afrika (Gubitz et al. 1999). Jarak pagar berpotensi untuk memperbaiki lingkungan dan meningkatkan kualitas hidup penduduk pedesaan di negara tropis karena pemanfaatannya yang sangat beragam. Tanaman ini dapat digunakan untuk mencegah atau mengontrol erosi, reklamasi lahan, meningkatkan kesuburan tanah dan sebagai tanaman pagar.
Tanaman jarak pagar berupa perdu dengan tinggi 1-7 m, bercabang tidak teratur. Batangnya berkayu, silindris, dan bila terluka mengeluarkan getah. Bagian-bagian tanaman jarak pagar adalah sebagai berikut (Hambali et al. 2006):
2.1.1. Daun
Daun tanaman jarak pagar adalah daun tunggal berlekuk dan bersudut 3 atau 5. Daun tersebar di sepanjang batang. Permukaan atas dan bawah lebih pucat dibanding permukaan atas. Daunnya lebar dan berbentuk jantung atau bulat telur melebar dengan panjang 5-15 cm. Helai daunnya bertoreh, berlekuk, dan ujungnya meruncing. Tulang daun menjari dengan jumlah 5-7 tulang daun utama. Daunnya dihubungkan dengan tangkai daun. Panjang tangkai daun antara 4-15 cm.
2.1.2. Bunga
melengkung keluar berwarna kuning. Bunganya mempunyai 5 mahkota berwarna keunguan. Setiap tandan terdapat lebih dari 15 bunga. Jarak pagar termasuk tanaman monoecious dan bunganya uniseksual. Kadang kala muncul bunga hermaprodit yang berbentuk cawan berwarna hijau kekuningan.
2.1.3. Buah
Buah tanaman jarak pagar berupa buah kotak berbentuk bulat telur dengan diameter 2-4 cm. Panjang buah 2 cm dengan ketebalan sekitar 1 cm. Buah berwarna hijau ketika muda dan berubah menjadi hijau kekuningan dan coklat atau kehitaman ketika masak. Buah jarak terbagi menjadi 3 ruang, masing-masing ruang berisi satu biji sehingga dalam setiap buah terdapat 3 biji. Biji berbentuk bulat lonjong dan berwarna cokelat kehitaman. Biji inilah yang banyak mengandung minyak dengan rendemen sekitar 35-45% dan beracun.
Gambar 1 Tanaman dan bagian tanaman jarak pagar
Tanaman Jarak Pagar Bunga
7
Biji jarak pagar dapat dipisahkan bagian kernel dan cangkang. Bagian kernel mencapai 60-62.7% bagian biji. Komposisi kimia kernel dan cangkang biji jarak pagar varietas Cape Verde disajikan pada Tabel 1 berikut.
Tabel 1 Komposisi kimia kernel dan cangkang biji jarak pagar
Keterangan Kernel biji jarak Cangkang biji jarak
Kandungan bahan kering (bk, %) 96.6 90.3
Protein kasar (bk, %) 22.2 4.3
Lemak (bk, %) 57.8 0.7
Abu (bk, %) 3.6 6.0
Neutral detergent fiber (bk, %) 3.8* 83.9
Acid detergent fiber (bk, %) 3.0* 74.6
Acid detergent lignin (bk, %) 0.2* 45.1
* Dihitung dari nilai yang diperoleh dari sampel bebas lemak Sumber : Makkar et al. (1998)
2.10 Komposisi Kimia Tanaman Jarak Pagar (Jatropha curcas. L)
Daun, ranting, batang, akar serta biji jarak mengandung berbagai macam senyawa kimia, beberapa diantaranya merupakan senyawa-senyawa aktif. Senyawa kimia yang terisolasi dari bagian daun dan ranting jarak pagar meliputi cyclic triterpene stigmasterol, stigmast-5-en-3β,7β-diol, stigmast-5-en-3β,7α-diol, cholest-5-en-3β,7β-diol, cholest-5-en-3β,7α-diol, campesterol, β-sitosterol, 7-keto- β-sitosterol. Selain itu, bagian daun dan ranting mengandung senyawa flavanoid apigenin, vitexin dan isovitexin (Neuwinger 1994).
Senyawa kimia yang diisolasi dari bagian batang tanaman jarak pagar antara lain friedelin, epi-friedelinol, tetracyclic triterpene ester jatrocurcin dan scopoletin methyl ester. Senyawa β-amyrin, β-sitosterol dan juga taraxerol didapatkan terkandung pada bagian kulit batang tanaman jarak, sedangkan bagian akar mengandung β-sitosterol, β-D-glucoside, mermesin, propacin, curculathyranes A dan B dan juga curcusones A-D. Lebih lanjut, diterpenoid jatrophol dan jatrpholone A dan B, coumarin tomentin, coumerin-lignan jatrophin dan juga taraxerol juga ditemukan pada akar (Naengchomnong et al. 1994).
daging buah mengandung protein 27-32% dan minyak 58-60%. Makkar et al. (1998) melaporkan adanya total fenol serta tannin pada kernel dan cangkang biji beberapa varietas jarak pagar (Cape verde, Nicaragua, Ife-Nigeria). Pada bungkil jarak pagar (meal) ditemukan adanya aktivitas tripsin inhibitor, lektin, saponin, juga phytat, sedangkan ester forbol ditemukan pada bagian kernel jarak. Senyawa curcin dan ester forbol yang merupakan senyawa racun dan antinutrisi paling banyak ditemukan pada bagian biji.
Komponen toksik utama pada bungkil jarak adalah hemaglutinin bernama curcin. Curcin menghambat sintesis protein in vitro. Senyawa toksik lain adalah lektin (51-102 mg bungkil/ml uji produksi hemaglutinasi), fitat (8.9-10.1%), saponin (2.0-3.4% ekuivalen diosgenin) dan inhibitor tripsin (21.1-26.5 mg tripsin dihambat/gram bungkil kering). Penelitian terhadap berbagai varietas jarak di Meksiko menunjukkan kandungan tripsin inhibitor 33.1-36.4 mg tripsin/gram bungkil kering, fitat 8.5-9.3% ekuivalen asam fitat, saponin 2.1-2.9% dan lektin 0.35-1.46 mg/ml sampel dibutuhkan untuk aglutinasi (Martinez-Herrera et al. 2006).
Menurut Aregheore et al. (2003) komponen toksik dan iritan pada biji jarak adalah β-D-glycoside dari sitosterol, curcin (lektin), flavonoid vitexin, isovitexin dan 12-deoxyl-16-hydroxyphorbol (ester forbol). Lektin dan inhibitor tripsin dapat dikurangi dengan pemanasan 121oC, 25 menit (Aderibigbe et al. 1997), fitat sedikit berkurang dengan iradiasi 10 kGy, sementara ester forbol bersifat stabil dan tahan terhadap suhu penyangraian sampai 160oC, 30 menit, akan tetapi perlakuan kimia dapat mengurangi kandungannya (Makkar dan Becker 1997).
9
Ester forbol bersifat mengaktifkan protein kinase C (PKC) yaitu enzim kunci pada penghantaran sinyal dan proses pertumbuhan kebanyakan sel dan jaringan. Interaksi yang berlanjut antara ester forbol dengan PKC menyebabkan respon mitogenik dan pembentukan tumor. Ester forbol juga menyebabkan meningkatnya proliferasi sel, aktivasi platelet darah, mitogenesis limfosit, inflamasi, produksi prostaglandin dan degranulasi neutrofil (Aitken 1986, diacu dalam Evans 1986).
Gambar 2 Struktur tetradecanoyl phorbol-13-acetate (TPA) (Evans 1986)
Ester forbol telah diidentifikasi sebagai senyawa racun utama pada jarak pagar. Kandungan ester forbol pada biji dan kernel jarak pagar sangat dipengaruhi oleh varietas. Makkar et al. (1998) malaporkan kandungan ester forbol untuk empat varietas jarak pagar yang berbeda. Varietas toksik Cape Verde yang diperoleh dari Nicaragua mengandung ester forbol paling tinggi yaitu 2.7 mg/g kernel, sedangkan varietas non toksik Mexico paling rendah yaitu 0.11 mg/g kernel. Makkar et al. (1998) juga menemukan bahwa biji dari buah muda (belum matang) mengandung senyawa ester forbol yang lebih tinggi.
Senyawa ester forbol secara alami ditemukan pada tanaman famili Euphorbiaceae dan Thymelaeaceae. Beberapa tanaman yang dilaporkan mengandung senyawa toksik ester forbol adalah Sapium indicum, S. japonicum,
Euphorbia frankiana, E. cocrulescence, E. ticulli, Croton spareiflorus, C. tigilium, C.ciliatoglandulifer, Jatropha curcas, Excoecaria agallocha, dan Homalanthus nutans (Beutler et al. 1989). Haas et al. (2002) telah melaporkan 6 jenis ester forbol dalam minyak jarak pagar, dimana semua senyawa memiliki bagian diterpen yang sama yaitu 12-deoxy-16-hydroxyphorbol.
Makkar dan Becker (2009) melaporkan distribusi senyawa ester forbol pada tanaman jarak pagar (Tabel 2). Kernel biji jarak pagar mengandung senyawa ester forbol tertinggi yaitu 2-6 mg/g sampel kering, sedangkan konsentrasi terendah ditemukan pada kayu tanaman jarak pagar (0,09 mg/g sampel kering). Adapun pada getah tanaman jarak tidak terdeteksi senyawa tersebut.
Tabel 2 Kandungan ester forbol pada beberapa bagian tanaman jarak pagar Bagian tanaman Ester forbol (mg/g sampel kering)*
Kernel 2,00 – 6,00
Kulit (bagian luar, coklat) 0,39 Kulit (bagian dalam, hijau) 3,08
Kayu 0,09
* equivalent dengan phorbol 12 myristate 13 acetate Sumber : Makkar dan Becker (2009)
11
Selain cara fisik dan kimia, penggunaan larva Hyles euphorbiae dapat memetabolisme 70-90% ester forbol (Hundsdoerfer et al. 2005). Selain itu enzim liver carboxylesterase dari tikus juga dapat mendetoksifikasi senyawa forbol (Mentlein 1986).
Selain memiliki efek negatif pada manusia dan hewan, senyawa ester forbol juga memiliki sifat-sifat yang bermanfaat. Beberapa senyawa forbol alami mampu menghambat tumor, menghambat replikasi virus (HIV) dan memiliki aktivitas antileukemic yang potensial sebagai obat kanker darah. Dilaporkan bahwa TPA merupakan satu-satunya penghambat potensial HIV-1 yang diinduksi CPEs (cytopathic effects ) dengan nilai IC100 0.48 ng/ml. TPA juga dapat menghasilkan perubahan struktur pada parasit Leishmania amazonensis pada konsentrasi 20 ng/ml (Chan-Bacab dan Pe˜na-Rodr´ıguez 2001).
Senyawa ester forbol bertanggung jawab terhadap reaksi iritasi kulit, inflamasi (peradangan) dan pembentukan tumor. Mekanisme peradangan yang disebabkan oleh senyawa ester forbol disajikan pada Gambar 3.
Gambar 3 Respon peradangan yang diakibatkan oleh senyawa ester forbol (Goel et al. 2007)
diikuti dengan pelepasan plasma yang bisa mengakibatkan tumor, kemerahan dan rasa panas. Aktivasi integrin pada leukosit menyebabkan migrasi sel transendotelial, sedangkan pelepasan interleukin (IL-2) menyebabkan ekspansi klonal. Adapun pelepasan protease, sitokin dan aktivasi NADPH oksidase menyebabkan kerusakan jaringan yang akhirnya menyebabkan rasa sakit (Goel et al. 2007).
Sebagai promotor tumor, senyawa ester forbol sendiri tidak menyebabkan tumor, akan tetapi memicu pertumbuhan tumor bagi sel/jaringan yang telah terpapar dengan senyawa karsinogen pada dosis tertentu ataupun yang telah mengalami mutasi. Dengan kata lain senyawa ester forbol merupakan ko-karsinogen. Sifat ko-karsinogen ini menjadi jelas dengan adanya penelitian Berenblum (1941), diacu dalam Goel et al. (2007), yang mendapatkan bahwa minyak croton (Croton tiglium) dapat meningkatkan pembentukan tumor ketika diaplikasikan pada kulit tikus bersamaan ataupun terpisah dengan aplikasi dosis subefektif karsinogen hydrocarbon 3,4-bezpyrene. Lebih lanjut, Berebblum and Shubik (1947), diacu dalam Goel et al. (2007) mendapatkan bahwa peningkatan produksi tumor hanya terlihat ketika minyak croton diaplikasikan setelah aplikasi karsinogen, bukan sebelumnya.
2.11 Senyawa Metabolit Sekunder pada Tanaman
Senyawa metabolit sekunder adalah senyawa-senyawa kimia pada tanaman yang distribusinya sangat beragam dari tanaman satu dengan yang lain. Beberapa senyawa metabolit sekunder tersebut memiliki penting pada tanaman antara lain sebagai zat pertumbuhan tanaman, komponen pigmen dan bau pada bunga, zat antiherbivora, zat antifungi, serta membantu proses simbiosis dengan tanaman tertentu (Harborne 1999).
13
(C10) hingga delapan unit (C40). Terpenoid terdiri atas beberapa macam senyawa mulai dari komponen minyak atsiri yaitu monoterpen dan seskuiterpen yang mudah menguap (C10 dan C15), diterpen yang lebih sukar menguap (C20) sampai ke senyawa yang tidak menguap yaitu triterpenoid dan sterol (C30) serta pigmen karotenoid (C40) (Harborne 1999).
Sifat umum senyawa terpenoid adalah larut dalam lemak, dan pada tanaman sebagian besar terdapat pada bagian sitoplasma sel, sebagian kecil terdapat dalam sel kelenjar khusus permukaan daun, daun dan daun bunga. Ekstraksi terpenoid dari jaringan tanaman dilakukan menggunakan eter minyak bumi, eter atau kloroform serta dapat dipisahkan secara kromatografi menggunakan pelarut-pelarut tersebut. Senyawa terpenoid umumnya tidak berwarna kecuali senyawa karotenoid (Harborne 1987).
Salah satu golongan terpenoid yang berpotensi sebagai antimikroba adalah triterpenoid. Triterpenoid termasuk senyawa yang merupakan komponen aktif dalam tumbuhan obat yang telah digunakan untuk penyakit gangguan kulit, berfungsi sebagai antifungi, insektisida, antibakteri atau virus (Robinson 1995). Triterpenoid dapat dipilah menjadi sekurang-kurangnya empat golongan senyawa yaitu triterpena sebenarnya, steroid, saponin, dan glikosida jantung (Harborne 1987).
Senyawa triterpenoid yang terdapat pada tumbuhan tingkat tinggi adalah fitosterol yang terdiri dari sitosterol ( - sitosterol), stigmasterol, dan kampesterol. Steroid merupakan golongan dari senyawa triterpenoid (Harborne 1987). Steroid alami berasal dari berbagai transformasi kimia dua triterpen yaitu lanosterol dan sikloartenol. Pada umumnya, steroid tumbuhan berasal dari sikloartenol. Senyawa steroid dapat digunakan sebagai dasar untuk pembuatan obat.
Alkaloid adalah senyawa metabolit tanaman mengandung nitrogen yang paling umum. Alkaloid merupakan senyawa organik basa yang mengandung atom nitrogen pada strukturnya sebagai bagian dari sistem siklik. Keberadaan senyawa alkaloid pada tanaman tingkat tinggi sebagai senyawa metabolit sekunder cukup terbatas. Hal ini berkaitan dengan senyawa nitrogen sebagai penyusun senyawa alkaloid yang umumnya terbatas pada tanaman (Harborne 1999).
Senyawa fenol meliputi beragam senyawa yang memiliki ciri yang sama yaitu cincin aromatik yang mengandung satu atau lebih grup hidroksil. Senyawa fenol cenderung mudah larut dalam air karena umumnya senyawa fenol sering kali berikatan dengan gula sebagai glikosida. Flavanoid merupakan golongan terbesar dari senyawa polifenol. Selain itu fenol monosiklik sederhana, fenilpropanoid, dan kuinon fenolik juga terdapat dalam jumlah yang besar. Lignin, melanin dan tannin yang merupakan polimer penting dalam tumbuhan adalah senyawa fenolik. Kadang-kadang senyawa fenolik dijumpai pada protein, alkaloid dan diantara terpenoid (Harborne 1987).
Harborne (1999) mengklasifikasikan senyawa-senyawa fenol menjadi beberapa kelas meliputi 1) senyawa fenol sederhana, benzoquinones, 2) Asam hidroksibenzoat, 3) Acetophenon, asam fenil asetat, 4) Asam hidroksisinamat, fenilpropanoid yang terdiri dari kaumarin, isokaumarin, kromone dan kromene, 5) Naptoquinon, 6) Xanthon, 7) Stilben, antraquinon, 8) flavanoid dan isoflavanoid, 9) lignan dan neolignan, 10) Biflavanoid, 11) lignin dan 12) Tanin terkondensasi (flavolan atau proantosianidin). Flavanoid merupakan golongan terbesar dari senyawa polifenol.
2.12 Ekstraksi dan Fraksinasi Senyawa Aktif
15
merupakan proses melewatkan pelarut organik pada sampel sehingga senyawa organik akan terbawa oleh pelarut. Teknik perkolasi hanya efektif untuk senyawa yang sangat mudah larut dalam pelarut yang digunakan. Sokletisasi merupakan proses ekstraksi menggunakan soxhlet yang disertai dengan pemanasan. Teknik ini akan menghemat pelarut karena terjadi sirkulasi pelarut yang selalu membasahi sampel dan cocok untuk senyawa yang tidak terpengaruh oleh panas (Briger 1969).
Pemilihan pelarut dalam proses ekstraksi akan memberikan efektifitas yang tinggi dengan memperhatikan kelarutan senyawa dalam bahan. Pelarut metanol merupakan pelarut yang paling banyak digunakan dalam proses isolasi senyawa organik bahan alam karena dapat melarutkan semua golongan senyawa metabolit sekunder (Briger 1969). Daftar pelarut yang umum digunakan diurut berdasarkan tingkat kepolaran disajikan pada Tabel 3.
Tabel 3 Tingkat kepolaran beberapa jenis pelarut
Pelarut Indek kepolaran
Butanon (metil etil keton) 4,7
Aseton 5,1
Metanol 5,1
Air 10,2
Sumber : Houghton and Raman (1998)
superkritis, kromatografi gas, distilasi vakum, presipitasi dan kristalisasi (Van Beek, 1999). Proses pemisahan partisi pelarut merupakan teknik pemisahan tahap awal yang paling umum dilakukan karena beberapa pertimbangan antara lain tidak membutuhkan peralatan khusus, kapasitas yang lebih besar, proses penggandaan skala mudah, pelarut dapat disesuaikan dengan senyawa yang akan dipisahkan, relatif lebih cepat dan konsumsi pelarut lebih sedikit.
2.13 Zat Antimikroba
Zat antimikroba adalah senyawa biologis atau kimia yang dapat menghambat pertumbuhan dan aktivitas mikroba. Fardiaz (1987) menyatakan bahwa zat antimikroba dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal, fungistatik, atau menghambat germinasi spora bakteri.
Zat antibakteri (antibacterial agent) banyak digunakan dalam produk-produk kosmetik dan rumah tangga karena senyawa ini memberikan efek bakterisida dan bakteriostatik selama penggunaan. Fungsi lain dari zat antibakteri adalah untuk melindungi produk selama penyimpanan dengan menyediakan efek pengawetan melawan bakteri. Dengan mempertimbangkan jenis mikroba lain selain bakteri seperti kapang dan khamir, maka digunakan istilah antimikroba (Siquet dan Devleeschouwer 2001).
17
product) banyak menggunakan triclosan, minyak atsiri dan senyawa-senyawa lain (Siquet and Devleeschouwer 2001).
Beberapa persyaratan zat antimikroba dalam fungsi pengawetan produk kosmetik menurut Siquet and Devleeschouwer (2001) adalah sebagai berikut:
Compatible dengan komponen lain dalam formula produk
Dapat mempertahankan khasiat dalam jangka waktu lama
Bersifat non toksik bagi konsumen.
Memiliki koefisien partisi air-minyak yang bagus
Tidak terinaktivasi oleh faktor-faktor luar ( pH, kondisi proses)
Perlu diperhatikan juga kelarutan dan volatilitasnya
Menurut Pelczar et al. (1993), aktivitas antimikroba dimiliki senyawa-senyawa kimia tertentu seperti fenol dan senyawa-senyawa fenolik, alkohol, halogen, logam berat, detergen, dan senyawa amonium kuartener. Masing-masing senyawa memiliki mekanisme khusus dalam menghambat atau membunuh mikroba.
Senyawa fenol dan senyawa fenolik merusak sel mikroba dengan mengubah permeabilitas membran sitoplasma, menyebabkan kebocoran bahan-bahan intraseluler serta dapat mendenaturasi dan menginaktifkan protein seperti enzim. Alkohol akan mendenaturasi protein, merusak struktur lemak dan membran sel mikroba; halogen yang terdiri dari iodium, klor, dan bromin dapat mengoksidasi dan merusak organel penting dari sel mikroba, sedangkan logam akan menginaktifkan protein seluler. Deterjen akan merusak membran sitoplasma dan menyebabkan kebocoran bahan intraseluler, sedangkan senyawa amonium kuarterner akan mendenaturasi protein, mengganggu proses metabolisme dan merusak membran sitoplasma.
memutuskan ikatan peptidoglikan dalam usahanya menerobos dinding sel. Setelah menerobos dinding sel, senyawa fenol akan menyebabkan kebocoran nutrien sel dengan cara merusak ikatan hidrofobik komponen membran sel (seperti protein dan fospolipida) serta larutnya komponen-komponen yang berikatan secara hidrofobik yang berakibat meningkatnya permeabilitas membran. Terjadinya kerusakan pada membran sel mengakibatkan terhambatnya aktivitas dan biosintesa enzim – enzim spesifik yang diperlukan dalam reaksi metabolisme.
2.14 Zat Antioksidan
Senyawa antioksidan merupakan senyawa yang dapat memperlambat oksidasi di dalam bahan khususnya senyawa lipid. Antioksidan harus mampu menunda atau mencegah terjadinya reaksi autooksidasi radikal bebas dalam oksidasi lipid (Kochhar dan Rossell 1990).
Autooksidasi merupakan reaksi rantai radikal bebas yang mekanismenya diawali oleh proses inisiasi yang menyebabkan lepasnya gugus H, sehingga membentuk radikal lemak. Tahap selanjutnya adalah propagasi yaitu radikal lemak bereaksi dengan oksigen untuk membentuk radikal peroksida yang selanjutnya dapat bereaksi kembali dengan lemak tak jenuh sehingga terbentuk hidroperoksida dan radikal lemak yang dapat bereaksi kembali dengan oksigen untuk membentuk radikal peroksida dan begitu seterusnya (Wong 1989). Reaksi oksidasi lemak dapat dipercepat oleh cahaya, panas, peroksida lemak atau hidroperoksida, logam-logam berat seperti Cu, Fe, Co dan Mn, logam porfirin seperti hematin, hemoglobin, mioglobin, klorofil dan enzim-enzim lipoksigenase (Winarno 2002).
19
oksigen, pemecahan hidroperoksida menjadi non radikal, penyerapan radiasi ultraviolet atau pendeaktifan oksigen singlet (Gordon 1990).
Antioksidan primer pada umumnya merupakan senyawa fenolik seperti tokoferol dan alkil gallat. Aktivitas antioksidan senyawa fenolik ditentukan oleh substituennya (Maslarova 2001). Adapun Gordon (1990) dan Jadhav (1996) menyatakan bahwa aktivitas antioksidan senyawa fenolik tergantung pada konsentrasi. Pada konsentrasi tinggi, antioksidan fenolik dapat bersifat sebagai prooksidan yang disebabkan oleh keterlibatan senyawa fenolik tersebut dalam menginisiasi reaksi oksidasi.
Contoh antioksidan sekunder antara lain asam askorbat, askorbil palmitat, asam eritrobat serta natrium eritrobat. Senyawa-senyawa tersebut berperan sebagai oxygen scavenger, yang dapat bereaksi dengan molekul oksigen dan menghilangkannya dari sistem (Gordon 1990). Contoh lain antioksidan sekunder adalah asam sitrat, asam amino, asam etilendiaminatetra asetat (EDTA) yang mampu mengkelat logam. Ketiga senyawa yang terakhir sering disebut sebagai antioksidan sinergis karena mampu meningkatkan peran antioksidan fenolik namun memiliki aktivitas yang kecil ketika digunakan sendiri.
Antioksidan dikelompokkan menjadi dua berdasarkan sumbernya, yaitu antioksidan sintetik yang diperoleh dari hasil sintesis reaksi kimia dan antioksidan alami yang diperoleh dari hasil ekstraksi bahan alami. Butil hidroksi anisol (BHA), butil hidroksi toluen (BHT), tert butil hidroksi quinon (TBHQ), propil galat dan tokoferol merupakan antioksidan sintetik yang penggunaannya sudah sangat luas dan tersebar di seluruh dunia (Buck 1991).
Antioksidan alami banyak terdapat dalam tanaman pada seluruh bagian dari tanaman seperti akar, daun, bunga, biji, batang dsb. Menurut Pratt dan Hudson (1990), senyawa-senyawa yang umum terkandung dalam antioksidan alami adalah fenol, polifenol, dan yang paling umum adalah flavonoid (flavanol, isoflavon, flavon, katekin, dan flavonon), turunan asam sinamat, tokoferol dan asam organik polifungsi. Tokoferol merupakan antioksidan alami yang telah diproduksi secara sintesis untuk tujuan komersial.
merupakan antioksidan yang paling banyak diaplikasikan pada produk-produk topikal (Weber et al. 2001). Formulasi antioksidan tersebut dalam produk kosmetik dinyatakan dapat memberikan perlindungan, melembabkan dan dapat melawan penuaan kulit (Burke 2006).
Termasuk dalam kelompok antioksidan alami adalah senyawa produk reaksi Maillard. Nakamura et al. (1992) menyatakan bahwa adanya konjugasi ovalbumin dengan dekstran atau galaktomanan melalui reaksi Maillard antara gugus amino bebas dalam protein dan gugus karbonil pereduksi dalam polisakarida dapat meningkatkan aktivitas penangkapan radikal bebas oleh ovalbumin. Aktivitas antioksidan dalam sistem asam linoleat juga ditunjukkan oleh produk reaksi Maillard hasil pemanasan campuran lisin dan madu (Antony et al. 2000), sedangkan Yoshimura et al. (1997) melaporkan aktivitas penghambatan radikal bebas dari produk reaksi Maillard hasil pemanasan glukosa-glisin.
BHT dan BHA merupakan antioksidan sintetik yang umum digunakan dalam produk kosmetik (pelembab, produk riasan, pewangi) sebagai antioksidan dan pengawet. Lebih lanjut dinyatakan bahwa BHA bersifat toksik bagi sistem imun, sedangkan BHT kemungkinan bersifat toksik bagi kulit, paru-paru, hati serta sistem imun. Meskipun demikian CIR (Cosmetic Ingredient Review) untuk produk personal care menyatakan bahan tersebut aman untuk formulasi kosmetik (Steinberg 2010).
2.15 Sifat Toksisitas
Toksisitas suatu bahan adalah kapasitas suatu bahan untuk menciderai suatu organisme hidup. Informasi toksisitas suatu bahan dapat diperoleh dengan mempelajari efek-efek dari pemaparan bahan kimia terhadap binatang percobaan, pemaparan bahan kimia terhadap organisme tingkat rendah seperti bakteri dan kultur sel dari mamalia di laboratorium, dan pemaparan bahan kimia terhadap manusia.
21
atau subkronik, dan kronik. Pengujian toksisitas khusus meliputi uji potensiasi, karsinogenik, mutagenik, teratogenik dan reproduksi serta toksisitas kulit dan mata serta perilaku (Loomis 1978).
Uji toksisitas akut yang berhubungan dengan kulit (acute dermal toxicity testing) dirancang untuk menyediakan informasi mengenai efek-efek lokal, terutama iritasi dan korosi pada kulit (Barile 2007). Metode umum yang digunakan adalah Draize Skin Test. Draize skin test pertama kali dipublikasikan oleh Draize et al. (1944) yang merupakan kajian kuantitatif iritasi kulit sebagai panduan untuk keamanan produk. Draize et al. (1944) mendefinisikan iritant lokal utama sebagai senyawa yang menghasilkan reaksi radang kulit. Proses peradangan yang tergolong sebagai iritasi kulit dicirikan dengan adanya edema (akumulasi cairan di bawah kulit dan ruang interstisial) dan erythema (kemerahan kulit akibat peningkatan aliran darah lokal).
Kajian iritasi kulit dirancang untuk meniru pemaparan pada manusia dan biasa dilakukan pada kelinci. Uji ini dilakukan untuk mendapatkan nilai indek iritasi kulit/PDII (Primary Dermal Irritation Index) dari suatu bahan. Klasifikasi potensi iritasi kulit disajikan pada Tabel 4 berikut.
Tabel 4 Klasifikasi potensi iritasi kulit
Klasifikasi PDII Skor
Non iritasi 0,0
Iritasi diabaikan/lemah >0,0- 0,5
Iritasi ringan >0,5- 2,5
Iritasi moderat/sedang >2,5- 5,0 Iritasi parah/berat >5,0- 8,0 Sumber : Auletta (2004) di dalam Barile (2007)
senyawa-senyawa mediator peradangan. Potensi iritasi kulit dipengaruhi oleh sifat fisik iritant seperti pKa yang merupakan konstanta disosiasi asam (Mailbach dan Watkins 2009). pKa digunakan untuk memprediksi potensi iritasi kulit akut untuk senyawa asam dan basa. Asam dengan pKa kurang dari 4 dan basa dengan pKa lebih dari 8 sangat bersifat iritasi/irritative (Hogan 2009).
Hogan (2009) mendefinisikan ICD sebagai reaksi peradangan kulit yang ditunjukkan dengan erythema, edema dan pembentukan kerak. ICD merupakan respon non spesifik kulit terhadap kerusakan kimia secara langsung yang melepaskan mediator-mediator peradangan yang kebanyakan berasal dari sel-sel epidermis. Senyawa yang bersifat korosif akan menyebabkan kematian sel epidermis secara langsung. Perubahan-perubahan patofisiologi yang teridentifikasi dari ICD meliputi : terganggunya lapisan pelindung kulit, perubahan sel epidermis dan pelepasan sitokin.
Banyak senyawa-senyawa kimia dengan konsentrasi dan waktu pemaparan yang cukup dapat menyebabkan iritasi kulit. Iritant kulit yang bersifat ringan/low grade antara lain sabun, detergen dan air. Sedangkan pelarut dapat menyebabkan iritasi kulit lain, yaitu dengan menghilangkan minyak dan lemak esensial pada kulit yang meningkatkan kehilangan air dan menyebabkan kulit menjadi lebih rentan terhadap irritant (Hogan 2009).
Komponen dalam kosmetik yang berpotensi mengiritasi kulit antara lain zat pengawet (zat antimikroba), antioksidan, pewangi, pewarna dan pelindung UV. Meskipun demikian, komponen-komponen tersebut sering berada dalam formula kosmetik dalam jumlah kecil dan tidak mempengaruhi keseluruhan potensi iritasi dari produk akhir. Komponen tersebut lebih sering diperhatikan karena reaksi alergi (Barel 2001).
2.16 Sifat Alergenitas
23
Alergi dapat dikelompokkan berdasarkan organ yang diserang (alergi kulit, hidung, mata), berdasarkan sumber alergen (alergi makanan, protein hewan, getah) maupun berdasarkan gejala/respon alergi yang ditimbulkan (Ring 2005). Berdasarkan respon alergi, dikenal rhinitis, asma, anaphylaxis, alergi makanan dan alergi kulit. Rhinitis dicirikan dengan bersin-bersin, pembengkakan lokal saluran pernafasan, keluar cairan dan iritasi hidung yang disebabkan oleh terhirupnya alergen. Asma dicirikan oleh sesak nafas karena penyempitan saluran pernafasan yang disebabkan oleh aktivasi mastosit pada saluran pernafasan bagian bawah oleh alergen yang terhirup. Alergi kulit dicirikan dengan urtikaria akut dan eksim yang ditandai dengan kemerahan dan pembengkakan kulit akibat alergen memasuki kulit baik melalui gigitan serangga, kontak langsung maupun melalui darah (obat atau makanan yang tertelan). Alergi kulit dapat disebabkan oleh terpaparnya kulit pada obat atau senyawa-senyawa kimia tertentu (Barile 2007).
Goossens (2001) menyatakan bahwa penggunaan produk kosmetik pada kulit dapat menyebabkan beberapa reaksi seperti iritasi, fototoksik, alergi kontak dan fotokontak juga urtikaria kontak. Alergi kontak terhadap produk kosmetik dipengaruhi oleh beberapa faktor antara lain frekuensi penggunaan, komposisi/formula produk, konsentrasi kandungan bahan/komposisi, penggunaan ingredient kosmetik tertentu pada obat-obatan, senyawa-senyawa penguat penetrasi produk, lokasi penggunaan produk, kondisi kulit, waktu kontak dan frekuensi peggunaan dan efek kumulatif.
Barel (2001) mengklasifikasikan efek yang tidak diinginkan dari kosmetik akibat ingredient tertentu menjadi 7 kategori, yaitu 1) iritasi dan urtikaria kontak, 2) alergi kontak, 3) reaksi fotosensitif, 4) acnegenesis dan comedogenesis, 5) perubahan warna kulit dan appendages, 6) efek samping sistemik dan 7) efek samping lokal lainnya. Alergi kontak berhubungan dengan reaksi inflamasi yang dimediasi oleh sistem imun.
dibawa ke kelenjar getah bening regional dan mensensitasi limfosit. Sejumlah bahan kimia dapat menginduksi reaksi ini (Baratawidjaja 2006).
Dermatitis kontak alergi sering disebut juga dengan sensitisasi kulit. Reaksi sensitisasi kulit muncul dari respon imun terhadap protein kulit yang telah dimodifikasi oleh suatu kovalen dari bahan kimia reaktif dengan berat molekul rendah. Proses ini terjadi dalam 2 tahap yaitu induksi dan elisitasi. Pada tahap induksi, sistem imun akan bereaksi dengan senyawa kimia yang berpenetrasi dalam kulit yaitu dengan memperbanyak sel T yang mampu mengenali dan merespon terhadap senyawa kimia tersebut. Sedangkan pada tahap elisitasi, paparan terhadap bahan kimia akan menimbulkan peradangan kulit yang dikaitkan dengan dermatitis kontak alergi (Basketter 2008).
Menurut Barile (2007), respon reaksi sensitisasi kulit memerlukan minimal 24-72 jam, dan reaksi dikarakterisasi sebagai jenis hipersensitivitas tertunda tipe IV. Respon berkisar dari iritasi ringan yang menimbulkan eritema dan indurasi, hingga munculnya eksim, kulit terbakar hingga kulit pecah.
Pengujian alergi melibatkan uji invivo dan invitro (Arshad et al. 2005). Yang termasuk uji invivo adalah tes kulit, yang umum dilakukan karena cukup cepat, dapat diandalkan dan relatif murah. Terdapat tiga tipe tes kulit yang umum dilakukan, yaitu:
1. Skin Prick Test (SPT)
SPT dilakukan dengan meletakkan 1 tetes cairan yang mengandung allergen di atas kulit, dan rangkaian garukan atau tusukan jarum dilakukan sehingga cairan dapat memasuki kulit. Perubahan positif pada kulit seperti terbentuk warna merah, melebarnya area garukan/gatal menunjukkan bahwa seseorang bersifat alergi terhadap allergen.
2. Intradermal Test (IT)
Intradermal test dilakukan ketika dihasilkan reaksi negative dari SPT, akan tetapi senyawa/larutan tersebut tetap dianggap allergen bagi manusia. IT bersifat lebih sensitif dibanding SPT, tetapi sering menunjukkan reaksi positif terhadap orang yang tidak menunjukkan gejala-gejala alergi. Pada Intradermal test ini, larutan disuntikkan ke dalam kulit.
25
3. Skin Patch Test
Pada pengujian ini, larutan allergen diletakkan dalam bantalan/alas yang kemudian ditepukkan pada kulit selama 24-72 jam. Pengujian ini digunakan untuk mendeteksi alergi kulit yang disebut dengan contact dermatitis. Patch Testing sangat bermanfaat untuk menganalisis contact allergic dermatitis yang disebabkan oleh logam nickel, pengawet kosmetik maupun berbagai macam tanaman.
Yang termasuk uji invitro antara lain pengukuran total IgE serum, IgE spesifik alergen, pengukuran total eosinofil darah, level triptase sel mastosit, pelepasan histamin dll. Pengukuran IgE spesifik umum dilakukan untuk mengkonfirmasi status alergi dan mengidentifikasi alergen tertentu.
IgE merupakan salah satu jenis dari lima kelompok antibodi yang diproduksi manusia (IgG, IgA, IgM, IgD dan IgE). Menurut Baratawidjaja (2006) IgE memiliki sifat utama dalam pengerahan agen antimikroba dan berperan pada gejala alergi atopi. IgE mudah diikat sel mastosit, basofil dan eusinofil karena pada permukaanya memiliki reseptor untuk fraksi Fc dari IgE. Dalam keadaan normal IgE terdapat dalam konsentrasi yang sangat rendah pada serum yaitu 17-450 nm/ml dan hanya sebagian kecil dari sel plasma dalam tubuh yang membentuknya (Roitt 1990).
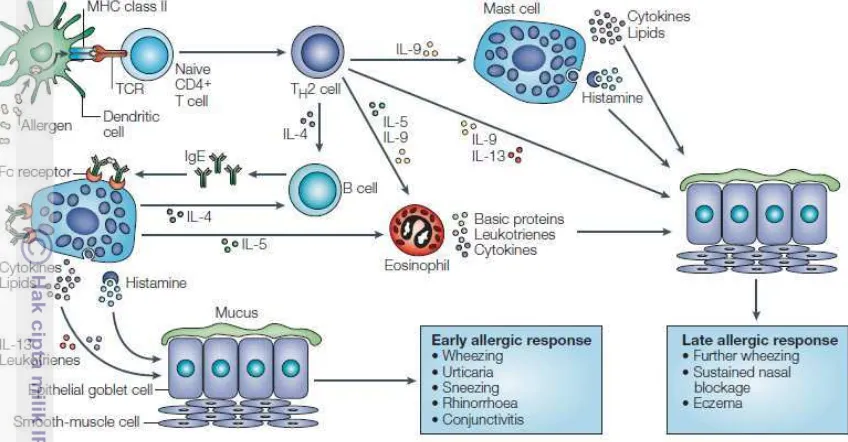
Gambar 4 Mekanisme alergi (Hawrylowicz dan O’Garra 2005)
Enzyme-linked immunosorbent assay (ELISA, EIA) merupakan salah satu uji in vitro alergi yang umum digunakan saat ini karena cukup sederhana dan tidak menggunakan radioaktif. Prinsip dasar ELISA adalah reaksi antara antigen dengan antibodi (Ag-Ab) yang kemudian keberadaan komplek tersebut dideteksi dengan antibodi yang telah dikonjugasikan dengan enzim tertentu seperti peroksidase horseradish (HRP), fosfatase alkaline (AP), urease, β-galaktosidase dan oksidase glucose. Tahapan umum metode ELISA meliputi penempelan Ag atau Ab pada fase padat, penambahan konjugat Ab-enzim dan diakhiri dengan penambahan substrat (Suryadi et al. 2009)
2.17 Produk Krim dan Pengawet pada Produk Kosmetik
Menurut Depkes RI (1995), produk krim adalah sediaan setengah padat mengandung satu atau lebih zat terlarut atau terdispersi dalam bahan dasar yang sesuai. Menurut Schmitt (1996), umumnya produk krim berbentuk o/w dengan fasa minyak dan humektan yang lebih banyak dari produk lotion. Krim terdiri dari 15-40% fasa minyak dan 5-15% fasa humektan, dengan karakteristik penampakannya hampir sama dengan produk lotion.
27
pada siang hari dan berfungsi untuk memberikan kelembutan dan kesan dingin di kulit, cream dasar bedak yang dapat membantu agar bedak tidak mudah luntur, cream tangan dan badan untuk mencegah kekeringan pada kulit serta cream pembersih untuk membersihkan atau menghapus kotoran dari wajah yang disebabkan oleh debu ataupun sisa tata rias. Menurut Mitsui (1997), cream berfungsi melindungi kulit dari perubahan cuaca, radiasi ultraviolet dan membuat kulit tampak indah dan sehat. Untuk melindungi kulit dari radiasi ultraviolet dikenal sunscreen cream (krim tabir surya).
Sebagaimana produk lotion, produk krim juga disusun oleh komponen-komponen emulsifier (pengemulsi), humektan, emolien, bahan aktif, dan air. Komponen bahan pengawet dan pewangi juga penting untuk ditambahkan, namun harus stabil pada suhu, pencahayaan dan kelembaban. Penambahan bahan pengawet pada skin lotion adalah sebesar 0.1-0.2% (Schmitt 1996). Pengawet yang digunakan sebagai tambahan pada produk menyebabkan mikroba tidak dapat tumbuh karena memiliki sifat antimikroba. Pengawet juga harus ditambahkan pada suhu yang tepat pada saat pembuatan, yaitu antara 35-45oC agar tidak merusak bahan aktif dalam pengawet tersebut. Pengawet yang baik memiliki persyaratan yaitu efektif mencegah tumbuhnya berbagai macam mikroorganisme yang menyebabkan penguraian bahan, dapat larut dalam berbagai konsentrasi yang digunakan dan tidak menimbulkan bahaya (racun) secara internal dan eksternal pada kulit.
III. BAHAN DAN METODE
3.7Kerangka Pemikiran
Ekstrak kasar tanaman jarak pagar memiliki sifat antimikroba dan antioksidan. Kendala pemanfaatan ekstrak kasar seperti kandungan padatan yang tinggi, aktivitas yang rendah serta sifat toksik perlu diwaspadai. Oleh karena itu perlu dilakukan proses fraksinasi/pemisahan dengan tujuan mendapatkan fraksi ekstrak yang lebih murni dengan aktivitas yang lebih tinggi. Salah satu metode pemisahan yang dapat digunakan adalah partisi pelarut.
Uji coba pemanfaatan fraksi aktif ekstrak terpilih sebagai zat antimikroba atau zat antioksidan dalam formula produk kosmetik (hand and body cream) dilakukan untuk mengevaluasi karakteristik produk kosmetik yang dihasilkan dan mengevaluasi efektivitas fraksi aktif sebagai zat antimikroba dan zat antioksidan dalam produk krim. Evaluasi dilakukan dengan melihat karakterisitik produk krim yang disimpan pada suhu 37oC selama waktu tertentu.
Tujuan penambahan zat antioksidan dalam produk hand and body cream ada dua yaitu sebagai pengawet yang melindungi produk dari oksidasi, dan sebagai bahan aktif yang memberikan fungsi khusus (seperti perlindungan kulit, pelembab, anti-aging). Adapun penambahan zat antimikroba lebih ditujukan untuk pengawetan produk dengan melawan pertumbuhan mikroba pada produk karena adanya peraturan BPOM (HK.03.1.23.12.10.12459) bahwa produk kosmetika tidak dipergunakan untuk pengobatan atau mencegah penyakit.
Evaluasi keamanaan dari penggunaan ekstrak jarak pagar dalam produk kosmetik dilakukan dengan melakukan uji toksisitas dan sifat alergenitas. Beberapa uji untuk mengevaluasi tingkat keamanan suatu bahan antara lain uji toksisitas akut oral, uji toksisitas akut kulit, uji iritasi kulit primer, uji iritasi kulit kumulatif, uji fototoksik, uji iritasi mata, uji sensitisasi, dan uji fotosensitisasi.
3.8Waktu dan Tempat Penelitian
Kimia Teknologi Industri Pertanian, IPB. Beberapa laboratorium penunjang antara lain Laboratorium Biokimia Pangan, Departemen Ilmu dan Teknologi Pangan IPB, Laboratorium Instrumentasi SBRC LPPM IPB dan Laboratorium Pemuliaan dan Genetika Ternak, Fakultas Peternakan IPB.
3.9Bahan dan Alat
Bahan utama dalam penelitian adalah sampel tanaman jarak pagar yang diperoleh dari Kebun Jarak Pagar PT. Indocement Tunggal Prakarsa, Citeureup Bogor yang berupa batang dan daun serta bungkil jarak pagar. Bahan lain untuk proses ekstraksi dan fraksinasi meliputi: metanol, kertas saring, n-heksan dan etil asetat. Bahan untuk uji aktivitas dan analisa meliputi: DPPH, metanol p.a., bakteri Escherichia coli dan Staphylococcus aureus, media agar NA dan NB, pelarut Folin Ciocalteu, natrium karbonat, asam tanat, aseton, asetonitril dan standar phorbol ester. Bahan untuk uji toksisitas kulit dan sifat alergenitas menggunakan PBS, antibodi sekunder (IgG kelinci anti IgE manusia, Anti IgG kelinci terkonjugasi HRP), substrat DAB (Diaminobenzidine), Sodium Dodecyl Sulfate, dan kelinci jantan sebagai hewan coba. Bahan untuk formulasi produk kosmetik (krim) meliputi: asam stearat, setil alkohol, olive oil, Nipagin (MP), Nipasol (PP), Dimetikon, Allantoin, BHT, propilen glikol, sorbitol dan aquades.
Peralatan yang digunakan dalam penelitian ini adalah pisau dan wadah untuk pengambilan sampel, perangkat alat ekstraksi, penguap putar (rotary evaporator), freeze dryer, HPLC (Shimadzu, ELSD detector), spektrofotometer (Genesys, Vis), inkubator, GC-MS (Agilent 19091S-433), lempeng ELISA (Costar® 3590), ELISA reader (BIORAD Microplate Reader Benchmark), serta kandang kelinci percobaan.
3.10 Metode Penelitian
31
Gambar 5 Diagram alir kegiatan penelitian
3.10.1 Persiapan dan Karakterisasi Bahan Baku
pengepresan biji jarak langsung digiling karena sudah dalam keadaan kering. Sampel serbuk kering dikemas dalam kantong plastik dan disimpan dalam freezer sebelum proses ekstraksi. Karakterisasi yang dilakukan terhadap sampel serbuk kering sebelum digunakan dalam penelitian meliputi analisa kadar air, kadar abu dan kadar lemak. Prosedur analisa proksimat sampel jarak pagar disajikan pada Lampiran 1.
3.10.2 Proses Ekstraksi dan Fraksinasi
Proses ekstraksi dilakukan menggunakan cara maserasi dengan pelarut metanol. Prosedur ekstraksi yang dilakukan adalah sebagai berikut : sebanyak 200 g serbuk sampel kering diekstraksi menggunakan metanol (3 x 800 ml) dengan cara direndam selama 24 jam pada suhu kamar (cara maserasi). Ekstrak yang diperoleh dipisahkan dari pelarut dengan penguap putar (rotary evaporator) hingga diperoleh ekstrak kental. Ekstrak yang dihasilkan dikeringkan dengan pengering beku (freeze dryer) hingga diperoleh ekstrak kasar kering.
Proses fraksinasi kasar yang dilakukan mengacu pada metode Can-Ake et al. (2004) yaitu proses partisi menggunakan pelarut metanol-air (2:3), heksan dan etil asetat. Sebanyak 5 g ekstrak kasar dilarutkan dalam 50 ml pelarut campuran metanol air. Larutan selanjutnya dipartisi dengan menambahkan 150 ml pelarut n-heksan, diaduk/dikocok dalam labu pemisah, didiamkan selama 30-60 menit dan dipisahkan lapisan yang terbentuk (lapisan metanol air bagian bawah, lapisan heksan lapisan atas). Proses penambahan heksan pada lapisan metanol air diulang tiga kali, dan lapisan heksan yang diperoleh digabungkan menadi satu sebagai fraksi heksan.
33
setelah proses partisi pelarut etil asetat dipisahkan sebagai fraksi metanol air. Masing-masing fraksi yang diperoleh dipisahkan pelarutnya menggunakan rotary evaporator pada suhu 50oC hingga diperoleh ekstrak kental dan dikeringkan dengan pengeringan beku selama 24 jam hingga diperoleh fraksi ekstrak. Perhitungan rendemen proses ekstraksi dan persentase fraksi pelarut adalah sebagai berikut:
3.10.3 Analisis Ekstrak dan Fraksi Ekstrak
Ekstrak kasar dan fraksi ekstrak yang dihasilkan selanjutnya dianalisa aktivitas antioksidan dengan metode peredaman DPPH, aktivitas antimikroba dengan metode difusi sumur, total fenol dengan metode Folin Ciocalteu serta dilakukan kandungan senyawa toksik ester forbol menggunakan HPLC. Fraksi yang memiliki aktivitas antimikroba dan aktivitas antioksidan tinggi dipilih sebagai fraksi aktif terpilih dan diidentifikasi komposisi senyawa kimianya dengan GC-MS serta digunakan dalam formulasi produk yaitu produk krim. Prosedur uji ekstrak dan fraksi ekstrak jarak pagar disajikan pada Lampiran 2.
3.10.4 Pemanfaatan Fraksi Aktif dalam Formulasi Produk Kosmetik
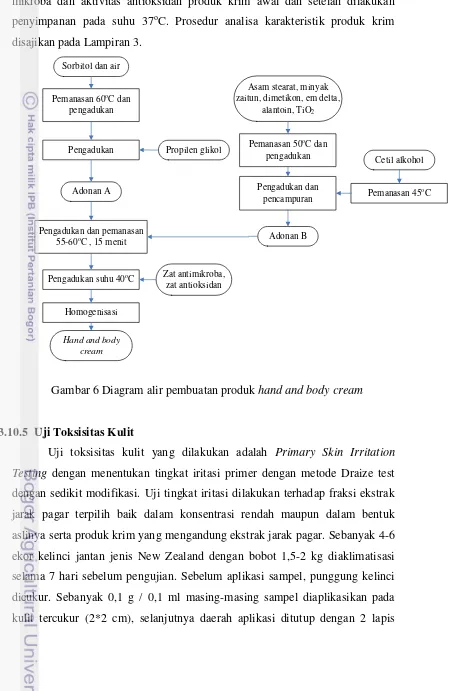
Fraksi aktif terpilih diformulasikan dalam sediaan kosmetik yaitu produk krim. Formula dan proses pembuatan produk krim mengacu pada formula PT. ANI dengan dua kelompok utama bahan yaitu fase air dan fase lemak. Pembuatan krim dilakukan dengan mencampurkan/menghomogenkan masing-masing bahan fase air dan fase lemak secara terpisah pada suhu 60oC dan 50oC, kemudian dilakukan pencampuran dan homogenisasi fase air dan fase minyak hingga diperoleh sediaan krim. Diagram alir pembuatan produk disajikan pada Gambar 6.
dalam produk kosmetik dilakukan analisa penampakan, nilai pH, cemaran mikroba dan aktivitas antioksidan produk krim awal dan setelah dilakukan penyimpanan pada suhu 37oC. Prosedur analisa karakteristik produk krim disajikan pada Lampiran 3.
Propilen glikol Pemanasan 50pengadukan oC dan
Pengadukan dan
Gambar 6 Diagram alir pembuatan produk hand and body cream
3.10.5 Uji Toksisitas Kulit
35
perban dan dilekatkan menggunakan perekat. Sekitar 24, 48 dan 72 jam setelah aplikasi, kulit kelinci diamati tanda-tanda iritasi dan dilakukan pemberian skor dari eritema dan edema yang terbentuk berdasarkan Metode Draize (Tabel 5) (Draize et al. 1944). Sebagai kontrol positif digunakan surfaktan SDS (Sodium Dodecyl Sulfate) dengan konsentrasi 20%.
Tabel 5 Evaluasi reaksi kulit Metode Draize
No Reaksi Kulit Skor
1 Eritema dan Pembentukan Kerak
Tanpa eritema 0
Eritema sangat sedikit (hampir tidak nampak) 1
Eritema berbatas jelas 2
Eritema moderat sampai berat 3
Eritema berat (merat bit) sampai sedikit membentuk kerak (luka dalam)
4
Total Skor Eritema yang mungkin 4
2 Pembentuka edema
Tanpa edema 0
Edema sangat sedikit (hampir tidak nampak) 1 Edema sedikit (tepi daerah berbatas jelas) 2 Edema moderat (tepi naik kira-kira 1 mm) 3 Edema berat (naik lebih dari 1 mmdan meluas keluar
daerah pajanan)
4
Total skor edema yang mungkin 4
Respon reaksi kulit = Jumlah maksimal skor eritema dan pembentukan kerak + jumlah maksimal skor edema/Jumlah kelinci
3.10.6 Uji Alergenitas Ekstrak Jarak Pagar