INTRODUKSI DAN EKSPRESI GEN HORMON
PERTUMBUHAN PADA IKAN MAS TRANSGENIK
NURLY FARIDAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Introduksi dan Ekspresi Gen Hormon Pertumbuhan pada Ikan Mas Transgenik adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulisan lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2012
ABSTRACT
NURLY FARIDAH. Introduction and Expression of Growth Hormone Gene on Transgenic Common Carp. Under direction of ALIMUDDIN, and KOMAR SUMANTADINATA.
Common carp Cyprinus carpio is one of the economically valuable aquaculture fish species in Indonesia. This research was aimed to produce transgenic common carp that grow rapidly by over-expressing the tilapia growth hormone (tiGH) gene. Trangenic common carp were produced by sperm-mediated gene transfer using electroporation method. In this study, two electroporation programs that developed by other researcher were applied to obtain a suitable electroporation method for common carp. The electroporated sperm were then used to fertilize eggs to produce F0 transgenic fish. Transgenic F0 carrying tiGH in their sperm were crossed with non-transgenic fish to produce transgenic first (F1) generation. Identification of transgenic fish was performed by PCR method using specific primer for tiGH gene. Expression of tiGH was analyzed using RT-PCR method and growth measurement at F1 fish generation. The results showed that electroporation of sperm using 50 Volt/cm, and DNA concentration of 25 ng/µl was produced higher percentarge of fish carrying tiGH in their gamet compared to that of another electroporation program (40 Volt/cm, DNA concentration of 50 ng/µl). Five sexually matured males F0 transgenic fish were selected and mated with non-transgenic to produce F1 generation. Percentage of F1 progenies carrying tiGH was 47,2-66,7%. Variated measure of F1 genereations was 10,1->12,0 cm size (22,5%-42,9%), 8,1->10,0 cm size (14,3%-42,9%), 6,1->8,0 cm size (11,9%-29,2%), 4,1->6,0 cm size (0,0%-39,3%). Increasing of growth of F1 was about 1,4-1,87 times for non transgenic fish. Survival of transgenic and non-transgenic F1 was generally similar. RT-PCR analysis showed that the F1 transgenic fish have tiGH gene expression in caudal fin, while no expression in non-transgenic fish were found. Thus, the increased body weight of F1 transgenic common carp was associated with expression of tiGH gene, and this fish can be used as broodstock for the production of fast-grow stable transgenic common carp.
RINGKASAN
NURLY FARIDAH. Introduksi dan Ekspresi Gen Hormon Pertumbuhan pada Ikan Mas Transgenik. Dibimbing oleh ALIMUDDIN, dan KOMAR SUMANTADINATA.
Aplikasi teknologi transfer gen telah menunjukkan potensi yang tinggi dalam meningkatkan produksi budidaya ikan. Hal tersebut ditunjukkan oleh peningkatan pertumbuhan bobot ikan transgenik yang signifikan dibandingkan dengan non-transgenik. Ikan transgenik yang mengeskpresikan gen hormon pertumbuhan dapat memiliki laju pertumbuhan 2-35 kali lebih tinggi daripada ikan non-transgenik. Over-ekspresi gen hormon pertumbuhan diharapkan juga meningkatkan pertumbuhan ikan mas secara signifikan. Ikan mas merupakan salah satu spesies yang menjadi target program peningkatan produksi budidaya oleh Kementerian Kelautan dan Perikanan 2009-2014.
Keberhasilan transfer gen yang tinggi dengan menggunakan metode elektroporasi telah ditunjukkan pada berbagai spesies ikan seperti ikan zebra, ikan loach, dan ikan ayu. Persentase keberhasilan transfer gen yang tinggi juga diharapkan dapat dicapai pada ikan mas. Pada penelitian ini 2 program elektroporasi, masing-masing sudah diuji pada ikan kerapu tikus dan ikan mas dibandingkan untuk memperoleh prosedur yang menghasilkan ikan mas transgenik yang lebih banyak.
Indukasi ovulasi dilakukan menggunakan ovaprim dengan dosis 0,5 mL/kg bobot tubuh induk mas betina. Ikan mas yang digunakan adalah strain majalaya, sebanyak satu ekor betina, dan satu ekor jantan. Pemijahan dilakukan dengan metode semi buatan. Elektroporasi dilakukan menggunakan Gene Pulser II (Biorad, USA) dengan tipe kejutan square wave. Program pertama berdasarkan Subiyakto (2010) dilakukan pada ikan kerapu tikus menggunakan kuat tegangan listrik 50 Volt/cm, lama kejutan 0,5 ms, jumlah kejutan 5 kali, jeda waktu antar kejutan 0,1 s serta konsentrasi DNA 25 ng/μL. Program kedua berdasarkan Faqih (2011) dilakukan pada ikan mas dengan kuat tegangan listrik 40 Volt/cm, lama kejutan 0,5 ms, jumlah kejutan 4 kali, jeda waktu antar kejutan 0,1 s serta konsentrasi DNA 300 ng/μL. DNA yang ditransfer adalah dalam bentuk plasmid pmBA-tiGH (Kobayashi et al. 2007). Gen hormon pertumbuhan ikan nila (tiGH)
pada konstruksi ini dikendalikan oleh promoter β-aktin ikan medaka (mBA). Derajat motilitas, dan viabilitas sperma pasca elektroporasi dihitung setelah mengamati pergerakan spermatozoa di bawah mikroskop pada pembesaran 400x, dan 1000x dari 3 bidang pandang. Penilaian viabilitas sperma didasarkan pada perbedaan kriteria sperma yang hidup, dan mati.
motilitas dan viabilitas sperma, derajat pembuahan, penetasan telur, dan kelangsungan hidup larva umur 5 hari. Untuk memastikan bahwa sperma yang diberi elektroporasi adalah mengandung gen tiGH, maka dilakukan analisis PCR. Pita DNA produk PCR (sekitar 250 bp) terlihat dari hasil analisis DNA sperma hasil elektroporasi, sedangkan pada kontrol tidak ada. Hal ini menunjukkan bahwa kedua program elektroporasi yang diuji telah menyebabkan gen tiGH masuk ke sperma ikan mas.
Sperma hasil elektroporasi program 1 dan 2 digunakan untuk membuahi telur ikan mas. Setelah ikan berumur 2 bulan, dilakukan identifikasi ikan transgenik F0 yang membawa gen tiGH pada sirip ekor. Persentase ikan perlakuan elektroporasi 1 (51,1%) yang membawa gen tiGH di sirip ekor adalah lebih tinggi daripada pada perlakuan elektroporasi 2 (31,7%). Demikian juga halnya dalam identifikasi ikan F0 yang membawa gen tiGH di sperma, persentase ikan perlakuan elektroporosi 1 (49,1%) lebih banyak membawa gen tiGH dibandingkan dengan elektroporasi 2 (32,1%). Selain itu, jumlah DNA yang digunakan dalam elektroporasi 1 (25 ng/µL) lebih sedikit dibandingkan dengan elektroporasi 2 (300 ng/µL). Dengan demikian, program elektroporasi 1 lebih tepat digunakan untuk sperma ikan mas.
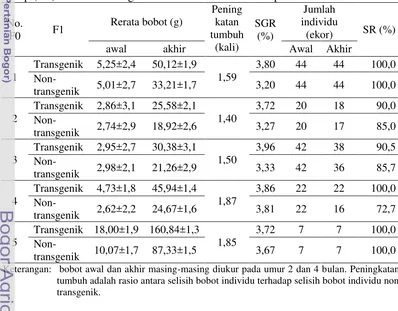
Produksi individu F1 dilakukan dengan memijahkan 5 ekor individu jantan F0 berbeda yang membawa tiGHdi sperma masing-masing dengan 1 ekor ikan mas betina normal (non-transgenik). Ikan transgenik F1 berhasil diproduksi dengan persentase berkisar antara 47,2-66,7%, sebanyak 22,5%-42,9% diantaranya memiliki kisaran panjang tubuh 10,1->12,0 cm, 14,3%-42,9%: memiliki kisaran panjang tubuh 8,1->10,0 cm, 11,9%-29,2%; memiliki kisaran panjang tubuh 6,1->8,0 cm, dan 0,0%-39,3%; memiliki kisaran panjang tubuh 4,1->6,0 cm. Hal tersebut menunjukkan bahwa gen tiGH dapat diwariskan, dan peningkatan ukuran tubuh tersebut diduga sebagai akibat dari ekspresi gen tiGH. Rerata bobot tubuh ikan transgenik F1 dan non-transgenik pada umur 2 bulan relatif sama, tetapi bobot tubuh ikan transgenik meningkat lebih tinggi pada umur 4 bulan. Peningkatan pertumbuhan tubuh ikan transgenik F1 berkisar 1,40-1,87 kali dibandingkan kontrol non transgenik. Selanjutnya, kelangsungan hidup ikan transgenik dan non-transgenik secara umum adalah sama.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber:
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
INTRODUKSI DAN EKSPRESI GEN HORMON
PERTUMBUHAN PADA IKAN MAS TRANSGENIK
NURLY FARIDAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Introduksi dan Ekspresi Gen Hormon Pertumbuhan pada Ikan Mas Transgenik
Nama : Nurly Faridah, S.Pi NIM : C151080311
Disetujui Komisi Pembimbing
Dr. Alimuddin, S.Pi, M.Sc Ketua
Prof.Dr.Ir Komar Sumantadinata, M.Sc Anggota
Mengetahui
Ketua Program Studi Ilmu Akuakultur
Prof. Dr. Ir. Enang Harris, M.S
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tesis “Introduksi dan Ekspresi Gen Hormon Pertumbuhan pada Ikan Mas Transgenik” dilaksanakan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Laboratorium Genetika Ikan Balai Besar Pengembangan Budidaya Air Tawar Sukabumi. Penelitian dilaksanakan pada bulan Desember 2010 – November 2011. Sebagian dari hasil penelitian ini telah dipresentasikan dalam Forum Inovasi Teknologi Akuakultur, tanggal 19-21 Juli 2011 di Bali, dengan abstrak seperti terlampir pada Lampiran 1.
Terima kasih penulis ucapkan kepada komisi pembimbing: Dr. Alimuddin, S.Pi, M.Sc dan Prof.Dr.Ir. Komar Sumantadinata, M.Sc., atas segala bimbingannya hingga terselesaikannya karya ilmiah ini, serta Dr.Ir. Dinar Tri Soelistyowati, DEA sebagai dosen penguji pada sidang akhir. Terima kasih disampaikan pula kepada Prof. Dr. Goro Yoshizaki atas kontribusi kebaikan hatinya memberikan konstruksi gen yang digunakandalam penelitian ini.
Ucapan terima kasih, penulis sampaikan juga kepada Ir. Maskur, M.Si selaku Kepala BBPBAT Sukabumi, rekan-rekan kerja di BBPBAT Sukabumi, rekan-rekan Akuakultur program Magister angkatan 2008, dan rekan-rekan di Laboratorium Reproduksi dan Genetika Organisme Akuatik. Terima kasih penulis ucapkan pula kepada Dwi Hany Yanti, Arief Eko Prasetiyo, dan Anna Octavera atas bantuan dan dukungannya selama penelitian dan penyelesaian tesis.
Ungkapan terima kasih juga penulis sampaikan kepada suami tercinta Dian Hardiantho,S.Pi.M.Si., anak-anakku tersayang Annisa Nur Rahmayanti dan Dinda Aulia Rahmayanti atas dukungan, doa, kasih sayang dan kesabarannya selama penulis menempuh studi hingga terselesaikannya tesis ini. Terima kasih penulis ucapkan Erfan Rizaly,SH., ayahanda Tahiruddin dan ibunda Kustiningsih (alm) atas teladan ketegaran hati, dukungan semangat dan doanya. Penulis juga mengucapkan terima kasih kepada para sahabat yang tak dapat penulis tuliskan satu persatu di sini, atas segala bantuan, dukungan semangat dan doanya hingga terselesaikannya tesis ini.
Semoga karya ilmiah ini dapat bermanfaat bagi perkembangan penelitian dan ilmu pengetahuan sebagai upaya untuk meningkatkan produksi ikan budidaya di Indonesia.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bondowoso pada tanggal 24 Mei 1972 dari ayah H. Tahiruddin dan Ibu Kustiningsih. Penulis merupakan putra pertama dari dua bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
I. PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Rumusan masalah ... 3
1.3 Tujuan ... 3
1.4 Manfaat penelitian ... 3
1.5 Hipotesis ... 4
II. TINJAUAN PUSTAKA ... 5
2.1 Ikan mas Cyprinus carpio ... 5
2.2 Motilitas dan viabilitas sperma ikan ... 5
2.3 Hormon pertumbuhan (growth hormone/GH) dan sistem regulasinya ... 8
2.4 Transgenesis melalui metode elektroporasi ... 11
2.5 Ekspresi gen ... 14
III. BAHAN DAN METODE ... 16
3.1 Perangsangan ovulasi dan spermiasi ... 16
3.2 Elektroporasi sperma dan analisis efektivitas transfer gen GH eksogen pada ikan mas founder (F0) ... 16
3.3 Produksi dan analisis ekspresi transgen ikan mas transgenik F1 .... 20
3.4 Parameter dan analisis data ... 23
IV. HASIL DAN PEMBAHASAN ... 26
4.1 Elektroporasi sperma dan analisis efektivitas transfer gen GH eksogen pada ikan mas founder (F0) ... 26
4.2 Produksi dan analisis ekspresi transgen pada ikan mas transgenik F1 ... 31
V. SIMPULAN DAN SARAN ... 37
5.1 Simpulan ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Halaman
1. Motilitas dan viabilitas sperma, derajat pembuahan (FR) dan derajat penetasan telur (HR), serta tingkat kelangsungan hidup(SR) larva hasil perlakuan elektroporasi sperma dengan DNA pmβa-tiGH ... 26
2. Rerata jumlah dan persentase ikan membawa gen tiGH pada sirip dan sperma yang dideteksi menggunakan metode PCR... 30
3. Jumlah, dan persentase ikan mas transgenik keturunan pertama (F1) yang membawa gen tiGH dari induk jantan F0 berbeda ... 31
4. Bobot tubuh, laju pertumbuhan spesifik (SGR), dan tingkat kelangsungan hidup (SR) ikan mas transgenik F1 selama 60 hari masa pemeliharaan... 33
DAFTAR GAMBAR
Halaman
1. Mekanisme kerja hormon peptida (Walsh, 2002) ... 9
2. Unit peralatan dan pelaksanaan elektroporasi pada sperma. Gene Pulser Xcell Unit (A) beserta komponennya : ShockPod (B.1) dan Cuvet (B.2) ... 17 3. Unit peralatan mikroskop Olympus CX 31 (A) dan monitor (B) untuk
pengamatan sperma dan embrio ikan mas hasil elektroporasi ... 18
4. Unit peralatan mesin PCR Rotor Gene 6000 (A) dan komputernya (B) 20
5. Deteksi DNA pmβa-tiGH pada sperma yang telah dielektroporasi menggunakan program 1 (kolom nomor 1-2), dan program 2 (kolom nomor 3-4), kontrol sperma yang dielektroporasi tanpa penambahan DNA tiGH (KЁ) dan kontrol plasmid DNA (KЀ). Angka di sebelah kiri gambar adalah ukuran fragmen DNA marker (M). Tanda kepala panah di sebelah kanan gambar adalah posisi target amplifikasi PCR (250 bp) ... 28
6. Deteksi DNA pmβa-tiGH pada embrio setelah 4 jam fertilisasi dengan sperma yang telah dielektroporasi dengan program 1 (kolom nomor 1-5), dan program 2 (kolom nomor 6-10), kontrol plasmid DNA (KЀ) dan kontrol embrio hasil elektroporasi sperma tanpa penambahan DNA pmβa-tiGH (KЁ). Tanda panah di sebelah kanan gambar adalah posisi target amplifikasi PCR (250 bp) ... 29
7. Deteksi DNA pmβa-tiGH pada sperma ikan mas F0 (kolom nomor 1-8), kontrol positif berupa plasmid tiGH (K+), dan kontrol negatif berupa ikan mas non-transgenik (K-). M= marker DNA VC 100 bp Plus DNA Ladder (Vivantis, USA) ... 30
8. Ukuran ikan mas transgenik F1 pada umur 4 bulan dalam satu populasi dari induk founder (F0) yang sama ... 32
DAFTAR LAMPIRAN
Halaman
1. Abstrak materi presentasi dalam Forum Inovasi Teknologi Akuakultur 2011 ... 48
2. Prosedur pelaksanaan elektroporasi ... 49
3. Sperma ikan mas setelah perlakuan elektroporasi dengan DNA pmβa -tiGH, diamati di bawah mikroskop pada pembesaran 40x10 (A) dan 100x10 (B). Sperma mati ditunjukkan dengan panah , sedangkan sperma hidup ditunjukkan dengan panah ... 51
4. Perkembangan embrio ikan mas hasil fertilisasi telur dengan sperma yang dielektroporasi ... 52
5. Data hasil elektroporasi pada program 1 dan program 2, efektifitasnya terhadap motilitas dan viabilitas sperma, derajat pembuahan (FR) serta derajat penetasan (HR) telur ikan mas ... 53
6. Kelangsungan hidup (SR) larva 5 hari dan benih 2 bulan ikan mas hasil fertilisasi telur dengan sperma yang dielektroporasi menggunakan program 1 dan program 2. ... 54
7. Hasil analisis DNA pada gonad calon induk ikan mas founder F0 ... 55
8. Data hasil analisis DNA tiGH pada sirip individu F1 berumur 2 bulan dan persentase ikan mas transgenik keturunan pertama (F1) ... 56
9. Hasil identifikasi tiGH dan laju transmisi pada keturunan pertama (F1) dari tiap induk founder (F0) ... 57
10. Data pertumbuhan individu keturunan pertama (F1) dari tiap induk founder (F0) selama 60 hari pemeliharaan ... 58 11. Tingkat kelangsungan individu keturunan pertama (F1) dari tiap induk
founder (F0) selama 60 hari pemeliharaan ... 59
I. PENDAHULUAN
1.1. Latar Belakang
Ikan, sebagai salah satu sumber protein yang penting bagi mayoritas masyarakat di dunia, sebagian besar masih dihasilkan secara alami. Berdasarkan data FAO (1999), konsumsi ikan dunia meningkat sebesar 31% pada tahun 1990-1997. Bahkan produksi ikan hasil budidaya saat ini telah mencapai 30% dari total produksi ikan dunia, dan diperkirakan akan mencapai 50% pada tahun 2030 (FAO, 2000). Akan tetapi upaya peningkatan perluasan kegiatan budidaya akan dihadapkan pada benturan kepentingan dan permasalahan lingkungan. Sehingga perbaikan kualitas hasil produksi ikan menjadi satu pemecahan bagi peningkatan nilai produksi ikan budidaya.
Perbaikan pertumbuhan ikan budidaya dapat diupayakan dengan menerapkan metode rekayasa genetik, seperti pemijahan selektif (selective breeding) dan transgenesis/introduksi gen. Perkembangan bioteknologi yang pesat pada saat ini memungkinkan untuk mendapatkan produk hasil perikanan yang memiliki karakteristik seperti yang diinginkan. Teknologi transgenesis atau rekombinan DNA merupakan rekayasa genetik yang memungkinkan diperolehnya ikan dengan kualitas lebih baik melalui introduksi gen. Gen yang diintroduksi atau biasa disebut dengan transgen merupakan pengkode protein tertentu yang mengontrol karakter yang diinginkan dan bermanfaat dalam menghasilkan ikan budidaya yang memiliki karakter unggul sesuai dengan gen yang disisipkan.
di antaranya adalah untuk meningkatkan laju pertumbuhan ikan dan krustase (Devlin et al., 1995), mengurangi laju konsumsi oksigen pada ikan (Cook et al., 2000), memproduksi protein farmaseutika/nutraseutika yang berguna bagi akuakultur dan kesehatan manusia ( Fletcher & Davies, 1991;Kinoshita & Ozato, 1995; Collas et al., 2000), dan peningkatan daya tahan terhadap bakteri patogen dengan mengintroduksikan peptida cecropin-B pada channel catfish transgenik (Dunham et al., 2004).
Transgenesis dapat dilakukan menggunakan metode transfeksi, mikroinjeksi, dan elektroporasi (Hackett, 1993; Chen et al., 1995; Sarmasik et al., 2001), tetapi metode elektroporasi tidak memerlukan keterampilan tinggi dan dapat menghasilkan ikan transgenik lebih banyak dalam waktu relatif singkat dibandingkan dengan mikroinjeksi. Pertumbuhan ikan salmon Atlantik (Du et al., 1992) dan ikan nila (Kobayashi et al., 2007) hasil transgenesis meningkat lebih dari 2 kali lebih tinggi dibandingkan ikan non transgenik, 10 kali lipat pada ikan salmon Pasifik (Devlin et al., 1995), dan 32 kali lipat pada ikan mud loach (Nam et al., 2001). Ikan transgenik dengan pertumbuhan tinggi dan relatif sama antar individu dicapai pada generasi kedua. Gen yang digunakan adalah penyandi hormon pertumbuhan (growth hormone/GH) dari ikan.
Ikan mas merupakan salah satu ikan budidaya yang menjadi prioritas Kementerian Kelautan dan Perikanan dalam program peningkatan produksi tahun 2010-2014 (KKP, 2010). Budidaya ikan mas tumbuh cepat hasil transgenesis diharapkan dapat mendukung program peningkatan produksi ikan budidaya nasional tersebut.
1.2. Rumusan Masalah
Budidaya ikan mas yang memiliki pertumbuhan cepat merupakan salah satu pendekatan yang dapat dilakukan untuk mendukung program peningkatan produksi ikan mas nasional. Salah satu metode rekayasa genetik yang bisa diaplikasikan untuk memproduksi ikan mas dengan pertumbuhan relatif cepat adalah transfer gen penyandi hormon pertumbuhan (GH/Growth Hormone). Elektroporasi merupakan salah satu metode introduksi gen yang tidak membutuhkan kecermatan tinggi dan dapat menghasilkan ikan transgenik dalam jumlah banyak dalam waktu relatif singkat. Tahapan dalam produksi ikan transgenik tumbuh cepat yang dapat digunakan oleh pembudidaya adalah introduksi dan analisis ekspresi gen GH, produksi ikan transgenik generasi kedua, dan produksi ikan transgenik homosigot yang berguna dalam produksi ikan mas secara massal oleh pembudidaya. Oleh karena itu sebagai tahap awal, pada penelitian ini akan dilakukan introduksi gen GH pada ikan mas menggunakan metode elektroporasi, dan analisis ekspresinya.
1.3. Tujuan
Penelitian ini bertujuan untuk menghasilkan ikan mas Cyprinus carpio transgenik tumbuh cepat dengan cara mengintroduksikan gen hormon pertumbuhan menggunakan metode elektroporasi. Selanjutnya menganalisis tingkat ekspresi gen GH pada individu transgenik founder F0 dan keturunan pertamanya (F1).
1.4. Manfaat Penelitian
Pemijahan antara ikan transgenik homosigot dengan ikan non transgenik akan menghasilkan ikan transgenik secara massal.
1.5 Hipotesis
II.
TINJAUAN PUSTAKA
2.1. Ikan Mas Cyprinus carpio
Ikan mas merupakan ikan yang mempunyai nilai ekonomis penting, dagingnya banyak disukai orang, mudah dipelihara, dapat memanfaatkan makanan buatan, relatif tahan terhadap penyakit, pertumbuhannya relatif cepat dan mempunyai toleransi yang besar terhadap kisaran suhu dan oksigen telarut, dan mudah dipijahkan (Hardjamulia & Suseno, 1975). Ikan mas mula-mula didatangkan dari China dan Rusia, kemudian didatangkan juga dari Eropa pada tahun 1972 dan 1930, Taiwan pada tahun 1970, serta dari Jepang pada tahun 1980 (Bardach, 1972). Data statistik mengindikasikan bahwa produksi ikan mas hampir mendekati batas puncaknya. Bagaimanapun juga, ikan mas merupakan salah satu komoditas penting (FAO, 2010), sehingga perlu ada inovasi untuk mempercepat laju pertumbuhannya guna mendukung kegiatan pembudidayaan ikan mas secara luas.
2.2. Motilitas dan Viabilitas Sperma Ikan
Sperma didefinisikan sebagai larutan spermatozoa yang berada dalam larutan seminal dan dihasilkan oleh hidrasi testis, yang merupakan salah satu bagian dari alat reproduksi ikan (Harvey & Hoar, 1979). Menurut Tave (1986), spermatogenesis (2n) yang aktif akan membelah secara mitosis dan mengalami replikasi kromosom menjadi formasi empat yang disebut spermatosit primer, spermatosit ini mengalami pembelahan meiosis menjadi spermatosit sekunder, selanjutnya akan terjadi pembelahan mitosis menjadi spermatid (n) dan setelah proses metamorfosa akan menjadi spermatozoa. Spermatozoa yang normal terdiri dari kepala dan ekor. Bagian ekor terbagi atas leher (tengah), bagian utama dan bagian ujung. Bagian kepala spermatozoa berbentuk membulat (sperichal) dan bagian leher mengalami reduksi. Ekor sperma berguna sebagai organ renang (Stoss & Donaldson, 1982).
mana keseimbangan ion menjadi faktor utama yang menjadi pemicu aktifnya sperma. Interaksi antara ion lingkungan atau media dengan membran sel akan mengubah keadaan di dalam membran sel dan memberikan sinyal di dalam sel sehingga memicu sperma untuk motil. Ciereszko et al. (2001) menyatakan bahwa sperma akan diam pada kondisi asam dan baru akan motil jika masuk dalam lingkungan dengan pH antara 6,0-9,0.
Proses pengaktifan sperma dan hubungannya dengan ion ditunjukkan dengan adanya pengaruh dari kejutan konsentrasi, yaitu perbedaan konsentrasi cairan di dalam spermatozoa dengan lingkungan di luar spermatozoa sehingga menimbulkan pergerakan spermatozoa (osmotic shock), yaitu dengan merubah transmembran potensial dan melalui regulasi (proses pengaturan isoosmosis antara dua media yang berbeda konsentrasi) sehingga terjadi perubahan di dalam dan juga saluran ion untuk Na+, K+ dan Ca+. Keseimbangan ion ini dipercaya menjadi penghubung antara faktor yang lain dengan kondisi di dalam sel, komposisi dalam seminal plasma (Ohta et al., 2001), dan arus ion yang melalui membran yang pada akhirnya diatur oleh saluran.
Beberapa jenis dari pembukaan saluran dapat diuraikan sebagai berikut: 1) membuka saluran pori-pori yang disebabkan adanya perbedaan konsentrasi antara di dalam dan di luar sel, 2) mengaktifkan gerbang saluran secara mekanik dan dibuka saat membran memperluas karena ada pengaruh dari lingkungan (air), 3) saluran yang bergantung pada voltase, akan diaktifkan ketika terjadi perubahan pada potensial membran, 4) saluran ligands bekerja melalui protein tertentu yang berhubungan dengan reseptornya dan yang terakhir 5) saluran interchanger di mana energi dihasilkan oleh jalur lintasan yang menyertakan suatu ion melalui gradien, saluran ini digunakan sebagai lintasan ion lain dalam arah sebaliknya.
Kategori yang dipakai Jamieson (1990) untuk mengklasifikasi motilitas sperma tersebut adalah sebagai berikut:
a. Jika sperma bergerak cepat dan lurus ke depan, maka motilitas spermatozoa ini masuk ke dalam kategori fast proggresive.
b. Jika sperma geraknya lambat atau sulit maju lurus atau bergerak tidak lurus, maka motilitas spermatozoa ini masuk ke dalam kategori slow proggresive. c. Jika sperma tidak bergerak maju, maka motilitas spermatozoa ini masuk ke
dalam kategori non proggresive.
d. Jika sperma tidak bergerak, maka motilitas spermatozoa ini masuk ke dalam kategori immotile.
Kemampuan spermatozoa hidup secara normal setelah keluar dari testis hanya berkisar antara 1-2 menit (Effendie, 1997). Kemampuan hidup (viabilitas) spermatozoa sangat dipengaruhi oleh suhu dan secara umum akan hidup lebih lama dalam suhu rendah (Toelihere, 1981).
Perubahan infrastruktur pada membran plasma, hilangnya beberapa matrik mitokondria dan penurunan densitas elektron dari matrik mitokondria menyebabkan hilangnya viabilitas spermatozoa. Ekor sperma merupakan alat gerak yang membutuhkan energi tinggi dari mitokondria. Sumber energi ini berasal dari pemecahan monosakarida terutama fruktosa dalam plasma semen yang berasal dari kelenjar asesoris (Toliehere, 1981). Penggunaan larutan fisiologis yang mengandung NaCl dan urea dapat mempertahankan daya hidup spermatozoa antara 20-25 menit. Tabares et al. (2007) menambahkan bahwa waktu motilitas terlama dicapai dengan menggunakan pengencer yang mengandung Na+ dan Mg+.
dan viabilitas sperma akan berbanding terbalik, yaitu semakin meningkatnya waktu motilitas sperma maka akan semakin menurun waktu viabilitasnya.
2.3. Hormon Pertumbuhan (Growth Hormone/GH) dan Sistem Regulasinya
Hormon adalah bahan kimia pembawa sinyal yang dibentuk dalam sel-sel khusus pada kelenjar endokrin. Hormon disekresikan ke dalam darah, kemudian disalurkan ke organ-organ yang menjalankan fungsi-fungsi regulasi tertentu secara fisiologik dan biokimia. Sel kelenjar yang khusus mensintesis hormon dari prekusornya dapat menyimpan dan menyekresikannya ke dalam aliran darah sesuai kebutuhan. Hormon dan metaboliknya dikeluarkan melalui sistem ekskresi, kebanyakan melalui ginjal. Sel-sel pada organ target memiliki reseptor yang dapat mengikat hormon, sehingga informasi yang diperoleh dapat diteruskan ke sel-sel dan akhirnya menghasilkan suatu respons (Koolman & Rohm, 2001).
Pesan hormon disampaikan pada sel-sel sasaran menurut dua prinsip yang berbeda. Hormon lipofilik masuk ke dalam sel dan bekerja pada inti sel, sedangkan hormon hidrofilik bekerja pada membran sel. Hormon steroid dan tiroksin termasuk dalam hormon lipofilik. Hormon ini menembus membran sel dan berikatan pada satu reseptor spesifik di dalam sel sasaran. Sementara kelompok hormon hidrofilik merupakan hormon yang tersusun dari asam amino, polipeptida dan proteohormon. Hormon-hormon hidrofilik berikatan pada bagian luar sel sasaran pada reseptor yang difiksasi dalam membran sel (Koolman & Rohm, 2001).
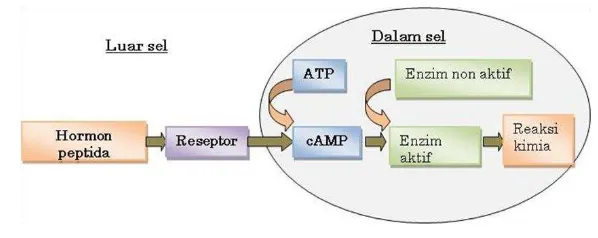
Gambar 1. Mekanisme kerja hormon peptida (Walsh, 2002).
GH merupakan hormon polipeptida yang dilepaskan dari adenohipofisa yang menginduksi hati agar mensintesis somatomedin yang berperan langsung dalam pertumbuhan, baik pertumbuhan tulang, otot maupun sel-sel lain. Hormon ini menunda katabolisme asam-asam amino dan memacu inkorporasinya ke dalam protein-protein tubuh. Kerja hormon ini dipermudah oleh pankreas, korteks adrenal dan tiroid yang berkerja bersama-sama dalam memacu metabolisme lemak dan karbohidrat (Calduch-Giner et al., 2000; Walsh 2002). GH bekerja dengan merangsang sintesis protein dan pemecahan lemak (untuk energi). Hormon ini merupakan peptida yang besar, terdiri dari 191 asam amino dan relatif spesies-spesifik. Sekresi hormon pertumbuhan dikendalikan oleh kelenjar hipotalamus. Sekresi GH dirangsang oleh growth hormone releasing hormone (GHRH), ghrelin, protein pakan, kandungan gula darah yang rendah, peningkatan sekresi androgen, dan arginin. Sedangkan yang menghambat antara lain somatostatin, konsentrasi hormon pertumbuhan dan insulin-like growth factor 1 (IGF-1) yang bersirkulasi, kandungan gula darah yang tinggi, glukokortikoid, dan estradiol ataupun estrogen lainnya. Walsh (2002) menyatakan bahwa sekresi GH dari kelenjar pituitari diatur oleh regulator hipotalamik, yaitu growth hormone realeasing factor (GHRF). Pelepasan GH dapat dirangsang oleh kondisi hipoglikemia dan asam amino seperti arginina (Price & Wilson, 1995). Pelepasan hormon ini dihambat oleh faktor hipotalamik kedua yaitu hormon penghambat pelepasan GH (somatostatin).
stimulasi GH oleh kolesistokinin (CCK), neuropeptida Y (NPY) dan hormon pelepas tirotropin (tyrotropin releasing hormone/TRH). Somatostatin, norepineprin dan serotonin menghambat sekresi GH secara langsung. Sedangkan norepineprin dan serotonin dapat mendorong sekresi GH secara tidak langsung melalui aksi stimulasi pada GnRh yang kemudian menstimulasi sekresi GH.
Hormon pertumbuhan mempunyai peranan yang penting pada proses transfer asam amino ekstraselular melintasi membran sel, khususnya ke dalam sel-sel otot dan menahan asam amino tersebut tetap di dalam sel. Selain itu hormon ini dapat memacu retensi berbagai mineral dan elemen essensial lain untuk pertumbuhan normal (Walsh, 2002).
GH merupakan bagian dari hormon yang disirkulasikan dan menstimulasi pertumbuhan tubuh. Selain itu berperan juga dalam adaptasi di air laut pada kelompok ikan-ikan salmonid (McLean & Donaldson, 1993), menstimulasi steroidogenesis gonad (Rand-Weaver & Kawauchi 1993) dan fungsi imun (Calduch-Giner et al., 2000). Menurut Matty (1985) GH mampu meningkatkan nafsu makan, konversi pakan, sintesis protein, menurunkan ekskresi (loading) nitrogen, merangsang metabolisme dan oksidasi lemak, serta memacu sintesis dan pelepasan insulin. Selain itu, GH juga mempengaruhi reproduksi (Le Gac et al., 1993; Van Der Kraak et al., 1990 dalam Li et al., 2005) dan osmoregulasi (Sakamoto et al., 1993; Tatsuya & Hirano, 1993 dalam Li et al., 2005).
Beberapa pengaruh hormon pertumbuhan dalam tubuh antara lain meningkatkan retensi kalsium, meningkatkan massa otot, merangsang lipolisis, meningkatkan sintesis protein, merangsang pertumbuhan dari seluruh organ internal kecuali otak, berperan dalam pemenuhan homeostasi, mengurangi pengambilan glukosa oleh hati, merangsang glukoneogenesis dalam hati, berkontribusi dalam pemeliharaan dan fungsi dari islet pankreatik, dan merangsang sistem imun. Selain pertumbuhan yang lambat, kekurangan hormon pertumbuhan juga dapat menghambat pematangan seksual.
fotoperiod dan temperatur dapat mempengaruhi kandungan GH pada pituitari ikan yellow perch (Robert et al., 2004). Pada ikan Eurasians perch (Perca fluviatilis) kandungan GH pituitari mencapai level maksimum di bulan Mei/Juni saat fotoperiod terpanjang (Swift & Pickford, 1965). Sementara Jourdan et al. (2000) menambahkan bahwa fotoperiod (18L : 6 D atau 24L : 0D) mampu meningkatkan pertumbuhan juvenil ikan Eurasians perch.
2.4. Transgenesis Melalui Metode Elektroporasi
Teknologi transgenesis atau teknologi transfer gen ini merupakan suatu proses mengintroduksi DNA eksogen atau DNA asing ke embrio dengan tujuan untuk memanipulasi struktur genetiknya (Glick & Pasternak, 2003). Penelitian awal pada transgenesis ikan pada saat ini berkembang pada banyak jenis ikan. Pada dua dekade terakhir, paling sedikit 35 jenis ikan diteliti untuk menjadi subyek transgenik terutama melalui perbaikan pertumbuhan melalui transgenesis gen GH.
Dalam usaha budidaya perikanan teknologi transgenik ini berguna untuk meningkatkan laju pertumbuhan ikan dan krustase (Devlin et al., 1995), meningkatkan daya tahan terhadap penyakit (Dunham, 2004), mengurangi laju konsumsi oksigen pada ikan (Cook et al., 2000), serta untuk memproduksi protein farmaseutika/nutraseutika yang berguna bagi akuakultur dan kesehatan manusia (Kinoshita & Ozato, 1995; Fletcher & Davies, 1991; Collas et al., 2000). Sebagai contoh aplikasi teknologi transgenesis yang telah berhasil diantaranya adalah peningkatan daya tahan terhadap bakteri patogen dengan mengintroduksikan peptida cecropin-B pada channel catfish transgenik (Dunham, 2004); peningkatan laju pertumbuhan pada ikan salmon Pasifik (Devlin et al., 1995), ikan mud loach (Nam et al., 2001), dan ikan nila (Kobayashi et al., 2007).
dalam genom resipien, (8) analisis tingkat ekspresi transgen, dan (9) analisis pewarisan transgen pada generasi selanjutnya (Beardmore & Porter, 2003).
Beberapa metode transfer gen untuk memproduksi ikan transgenik di antaranya adalah melalui mikroinjeksi DNA ke dalam nukleus telur yang telah dibuahi (Ozato et al., 1986), elektroporasi pada telur dan sperma (Inoue et al., 1990; Lu et al., 2002), lipofeksi gonad (Lu et al., 2002), retrovival vector (Lin et al., 1994) dan particle gun bombardment (Yazawa et al., 2005). Di antara metode-metode transfer gen tersebut, mikroinjeksi merupakan teknik yang paling banyak dipakai untuk memproduksi ikan transgenik. Namun demikian, teknik mikroinjeksi membutuhkan keterampilan yang tinggi dan tingkat keberhasilannya ditentukan oleh karakteristik telur; antara lain besar kecilnya ukuran telur, korion yang keras, mudah pecah, buram dan sebagainya (Lanes et al., 2009). Bagaimanapun juga, memproduksi hewan transgenik melalui mikroinjeksi tergolong relatif mahal dengan tingkat keberhasilan 1-4% (Anzar & Buhr, 2006). Elektroporasi memfasilitasi terbentuknya pori-pori temporal yang bersifat permeabel guna membantu transgen/DNA rekombinan masuk ke dalam sel melalui permukaan membran sel (Chen, 1995; Sarmasik, 2003). Sedangkan, transfeksi adalah metode transfer gen dengan reagen tertentu yang membungkus DNA sehingga dengan reagen tersebut memungkinkan DNA dapat masuk ke sel inang melalui dinding sel. Reagen yang digunakan dalam proses tranfeksi adalah dari bahan lipid.
menggunakan elektroporasi dipengaruhi oleh kombinasi tingkat kuat medan listrik, jumlah kejutan listrik serta konsentrasi DNA yang akan diinsersikan.
Proses elektroporasi dapat dilakukan pada sperma (Kang et al., 1990). Hal ini dikarenakan sperma dapat berperan sebagai pembawa DNA eksogen, serta memiliki kemampuan alami untuk mentransfer DNA eksogen ke dalam oosit dan memproduksi benih transgenik (Anzar & Buhr, 2006). Pembuktian pertama kali telah dilakukan oleh Brackett et al. (1971) bahwa sperma kelinci mampu mengikat DNA eksogen yang terdapat dalam larutan, dan DNA eksogen yang terikat ini mampu terlokalisasi di bagian kepala sperma. Selanjutnya Arezzo (1989) dan Lavitrano et al. (1989) membuktikan bahwa sel spermatozoa bulu babi dan tikus dapat digunakan sebagai vektor untuk transfer gen. Sperm-mediated gene transfer (SMGT) juga mampu memproduksi babi transgenik yang mengandung human decay accelerating factor (hDAF) dengan tingkat transkripsi 64% pada jaringan yang diuji. Metode ini lebih sederhana dibandingkan mikroinjeksi pada zigot dan membuka peluang untuk melakukan transgenesis pada skala massal (Anzar & Buhr, 2006).
Menurut Sin et al. (2000), sperm-mediated gene transfer (SMGT) merupakan suatu metode yang ideal untuk transfer gen secara massal pada organisme yang fertilisasinya bersifat eksternal, seperti pada ikan salmon. SMGT dapat berguna untuk transgenesis pada spesies yang memiliki fekunditas tinggi, ukuran telur yang sangat kecil serta dapat mudah diakses pada spermatozoanya (Lanes et al., 2009).
hewan akuatik dapat diawetkan (cryopreservation), sehingga sperma dapat selalu tersedia untuk digunakan (Tsai, 2000).
Menurut Symonds et al. (1994) bahwa jumlah DNA yang akan ditransfer ke dalam sperma tergantung pada tegangan listrik (kV/cm atau V/cm), jumlah kejutan yang dikenakan dan konsentrasi DNA. Sedangkan efisiensi transfer DNA ke embrio atau sperma yang dielektroporasi sangat dipengaruhi oleh tegangan dan lama kejutan.
Sin (2000) menyebutkan bahwa sperma dalam kondisi motil akan lebih mampu mengikat DNA asing yang akan ditransfer hingga mencapai 30% dari keseluruhan sperma. Dinyatakan lebih lanjut bahwa beberapa molekul DNA terletak atau mengikat pada bagian luar spermatozoa ikan salmon (Symonds et al., 1994), abalon Haliotis iris (Sin et al., 1995) dan ikan zebra (Patil & Khoo, 1996). Motilitas dari sperma ikan yang merupakan ukuran dari kelangsungan hidup sperma akan menurun dengan semakin meningkatnya tegangan dan lama kejutan. Namun demikian, kelangsungan hidup dari embrio yang dibuahi dengan sperma yang dielektroporasi dibandingkan dengan sperma tanpa perlakuan tidak nampak perbedaan karena diperkirakan 30 juta sel sperma digunakan untuk membuahi 500 butir telur (Sin, 2000).
Menurut Lavitrano et al. (2006), setidaknya ada dua parameter penting yang harus optimal dalam teknik SMGT agar lebih efisien, yaitu kualitas semen dan proses masuknya sperma. Proses masuknya sperma ini sangat tergantung pada viabilitas dan motilitas sperma. Sedangkan kualitas sperma dipengaruhi oleh beberapa faktor, antara lain: musim, frekuensi pengambilan sperma, dan usia donor. Keberhasilan fertilitas sperma sangat dipengaruhi oleh motilitas sperma tersebut. Ada korelasi positif kemampuan DNA asing masuk dan berintegrasi dengan inti sperma dengan kualitas semen utamanya dan tingkat motilitas sperma. Untuk itu diperlukan progresivitas motilitas sperma paling tidak 80% dan tidak boleh lebih kecil dari 65%.
2.5. Ekspresi Gen
pertumbuhan tikus tanah (sekuen heterolog) yang disambungkan dengan promoter metallothionein (MT) tikus ke dalam genom tikus (Palmitter et al., 1982).
Tingkat ekspresi transgen pada organisme transgenik yang stabil dipengaruhi oleh banyak faktor antara lain, promoter yang mengendalikan transgen, jumlah copy transgen dalam genom inang, serta hasil interaksi antara transgen dengan sekuen yang mengapit transgen (Rahman et al., 2000). Rahman et al. (2000) juga menyebutkan bahwa introduksi gen LacZ dengan promoter β -actin ikan mas pada ikan nila menunjukkan pola mozaik dari ekspresi LacZ pada jaringan somatik berbeda antar garis keturunan, tetapi konsisten dalam satu garis keturunan. Hasil penelitian Devlin et al. (1994) menunjukkan bahwa transfer gen
dengan menggunakan konstruksi gen ”all-salmonid” yang mengandung gen GH-I dari salmon sockeye (Oncorhynchus nerka) yang disambungkan dengan promoter salmon sockeye metallothionein-B (MT-B) pada salmon coho (O. kisutch), yaitu spesies yang kekerabatan dekat, menunjukkan peningkatan pertumbuhan yang drastis.
Hackett (1993) menyebutkan bahwa ikan mas, salmon, Northern pike, loach, trout dan lele dapat ditransformasikan dengan berbagai hormon pertumbuhan di bawah kontrol promoter yang berbeda untuk memproduksi ikan dengan peningkatan pertumbuhan lebih dari 100% dibandingkan kontrol. Bobot rataan ikan patin siam transgenik F0 yang diintroduksi GH ikan patin melalui metode elektroporasi pada sperma sebagai vektor, dengan konsentrasi DNA 50 µg/ml dan 90 µg/ml mengalami peningkatan sebesar 2,6% dan 19,0% dibandingkan non-transgenik, tetapi pada konsentrasi 10 µg/ml lebih rendah, yaitu -8,5% (Dewi, 2010).
III. BAHAN DAN METODE
3.1. Perangsangan ovulasi dan spermiasi
Perangsangan ovulasi dilakukan dengan menggunakan Ovaprim dengan dosis 0,2 ml/kg bobot tubuh induk ikan mas jantan dan 0,5ml/kg bobot tubuh induk mas betina. Perangsangan ovulasi dilakukan guna memastikan ikan ovulasi pada waktu yang diinginkan. Ikan mas yang digunakan adalah strain majalaya, sebanyak satu ekor betina dan satu ekor jantan. Ketika ikan mas memijah, induk jantan dan betina diangkat kemudian dilakukan pengurutan (stripping) sperma dan telurnya.
3.2. Elektroporasi sperma dan analisis efektivitas transfer gen GH eksogen pada ikan F0
Proses transfer gen dilakukan dengan menggunakan metode elektroporasi pada sperma. Elektroporasi dilakukan dengan menggunakan alat Gene Pulser II (Gambar 3; Biorad, USA). Proses elektroporasi dilakukan dengan tipe kejutan square wave dan dua program guna mengetahui efektivitasnya pada ikan mas. Program pertama mengacu pada program elektroporasi yang berhasil dilakukan pada ikan kerapu tikus, yaitu: kuat tegangan listrik 50 Volt/cm, lama kejutan 0,5 ms, jumlah kejutan 5 kali, jeda waktu antar kejutan 0,1 s serta konsentrasi DNA pmβa-tiGH 25ng/μL (Subyakto, 2010). Sementara itu, program kedua mengacu pada program elektroporasi yang dilakukan pada ikan mas, yaitu: kuat tegangan listrik 40 Volt/cm, lama kejutan 0,5 ms, jumlah kejutan 4 kali, jeda waktu antar kejutan 0,1 s serta konsentrasi DNA pmβa-tiGH 300 ng/μL (Faqih, 2011).
Peralatan dan prosedur pelaksanaan elektroporasi secara lengkap dapat dilihat pada Gambar 2 dan Lampiran 2.
(A) (B)
Gambar 2. Unit peralatan untuk pelaksanaan elektroporasi pada sperma. Gene Pulser Xcell Unit (A) beserta komponennya: ShockPod (B.1) dan Cuvet (B.2).
Pembuahan telur dilakukan dengan cara mencampur sperma dan telur ikan mas dalam media air, agar sperma menjadi motil. Campuran tersebut selanjutnya diinkubasi dalam akuarium berukuran 60 cm x 50 cm x 40 cm yang telah berisi air, dan masing-masing dilengkapi dengan aerasi. Pemanas air (water heater) digunakan pada tiap akuarium untuk mempertahankan suhu pada 27-28˚C. Pengamatan dilakukan terhadap motilitas dan viabilitas sperma setelah perlakuan elektroporasi, keberadaan DNA pmβa-tiGH pada sperma, perkembangan embrio hasil pembuahan, dan jumlah penetasan larva setelah 24 jam masa inkubasi.
Derajat motilitas dan viabilitas sperma hasil elektroporasi diukur dengan melihat pergerakan spermatozoa di bawah mikroskop dengan pembesaran 40x10, dan 100x10 dari tiga bidang pandang (Gambar 3). Satu tetes sperma diteteskan dengan menggunakan mikropipet di atas gelas obyek, kemudian ditutup dengan cover glass. Pada tepi cover glass diteteskan akuades, lalu dilihat pergerakan spermatozoa setelah terkena akuades. Penilaian motilitas didasarkan pada jumlah sperma yang bergerak maju (progresif) terhadap jumlah keseluruhan sperma. Derajat kelangsungan hidup sperma hasil elektroporasi diamati melalui pewarnaan Erithrosin B 2%. Satu tetes sperma diteteskan dengan menggunakan mikropipet di atas gelas obyek dan ditambahkan Erithrosin B 2%, kemudian dicampur secara merata. Penilaian viabilitas sperma didasarkan pada perbedaan kriteria sperma yang hidup dan yang mati. Sperma yang hidup ditandai dengan kepala sperma yang berwarna transparan dan bergerak aktif, sedangkan sperma yang mati 1
ditandai dengan kepala sperma yang berwarna buram, tidak bergerak dan mengembang.
Gambar 3. Unit peralatan mikroskop Olympus CX31 (A) pada pengamatan sperma dan embrio ikan mas hasil elektroporasi dan divisualisasikan pada monitor (B).
Analisis keberadaan DNA pmβa-tiGH pada sperma dimulai dengan mengisolasi DNA genom. Sampel sperma pasca elektroporasi dibilas menggunakan phosphate buffer saline (PBS) untuk membersihkan sisa plasmid pada media elektroporasi. Selanjutnya sperma disentrifugasi dengan kecepatan 5000 rpm selama 1 menit. Supernatan yang terbentuk dibuang. Proses pembilasan ini dilakukan sebanyak dua kali. Pelet sperma yang terbentuk kemudian diresuspensi dengan menambahkan ke dalam tabung mikro 200 μl cell lysis solution (Puregene, Minneapolis, USA), 2 μl proteinase K (20 mg/ml) dan diinkubasi pada suhu 55˚C selama semalam (over night). RNase sebanyak 2 μL (4 mg/mL) ditambahkan ke dalam larutan dan diaduk secara hati-hati dengan membolak-balik tabung mikro. Larutan kemudian diinkubasi pada suhu 37˚C selama 60 menit, dan disimpan pada suhu -20˚C selama 5 menit. Sebanyak 100 μL protein precipitation solution (Puregene, Minneapolis, USA) ditambahkan ke dalam larutan, selanjutnya dihomogenasi menggunakan vorteks dan disimpan kembali pada suhu -20˚C selama 15 menit. Kemudian, disentrifugasi pada kecepatan 12000 rpm selama 10 menit. Selanjutnya supernatan dipindahkan ke dalam tabung mikro berisi 300 μL isopropanol 100%, lalu tabung mikro dibolak-balik sebanyak 50x dengan hati-hati dan disentrifugasi pada kecepatan 12000 rpm selama 10 menit. Supernatan yang terbentuk dibuang dan ditambahkan 300 μL etanol 70% dingin. Kemudian disentrifugasi kembali pada kecepatan 12000 rpm
A
selama 10 menit. Selanjutnya supernatan dibuang dan pelet DNA yang terbentuk dikering-udarakan. Steril destillated water (SDW) ditambahkan sebanyak 30 μL ke dalam tabung mikro digunakan untuk melarutkan DNA. Larutan DNA selanjutnya dapat disimpan dalam freezer suhu -20˚C hingga digunakan dalam proses selanjutnya.
Keberadaan DNA pmβa-tiGH pada sperma diamati dengan metode polymerase chain reaction (PCR) semi-kuantitatif menggunakan primer tiGH forward (5-AGACAGC CAGCGTTTGTTCT-3) dan tiGH reverse (5-CCAGGACTCAACCAGTCCAT-3). Analisis PCR dilakukan dengan volume reaksi sebanyak 10 μL yang terdiri atas 1 μL 10 x dream taq buffer, 0,2 μM dNTP mix, 0,25U dream Taq DNA polymerase (Fermentas International Inc, Burlington, Kanada), 1 μL DNA sebagai cetakan, dan 1 mM untuk setiap primer. Proses denaturasi awal dilakukan pada suhu 95°C selama 5 menit, diikuti dengan 35 siklus denaturasi pada suhu 95°C selama 30 detik, annealing pada suhu 62°C selama 30 detik, ekstensi pada suhu 72°C selama 1 menit dan ekstensi akhir 72°C selama 5 menit. Sebanyak 1 μL produk amplifikasi PCR digunakan dalam elektroforesis dengan menggunakan 1% gel agarosa. Visualisasi pita DNA menggunakan Gel Red (Biotum, Inc,USA) dengan bantuan cahaya ultraviolet. Produk amplifikasi berada pada kurang lebih 250 base pairs (bp) (Kobayashi et al,. 2007).
μM dNTP mix, 0,25 U dream Taq DNA polymerase (Fermentas International Inc, Burlington, Kanada), 1 μL DNA template, dan 1 mM masing-masing primer forward dan reverse.
Proses PCR dilakukan menggunakan alat Rotor Gene 6000 (Gambar 5; Corbeth Research Inc, Sydney, Australia), dengan program amplifikasi: 95°C selama 5 menit, diikuti dengan 35 siklus yang terdiri dari 95°C selama 30 detik, 62°C selama 30 detik, 72°C selama 1 menit dan 72°C selama 5 menit. Pengecekan hasil amplifikasi dilakukan dengan elektroforesis menggunakan gel agarosa 1%.
Selanjutnya benih calon F0 ikan mas dipelihara selama 8 bulan atau hingga matang gonad. Pemeliharaan dilakukan di kolam beton dengan menggunakan hapa berukuran 2x2x1 cm. Pemberian pakan dilakukan setiap hari sebanyak 30% kemudian menurun hingga 5% bobot biomas/hari, dengan frekuensi pemberian sebanyak tiga kali setiap hari. Persentase pemberian pakan selama pemeliharaan berkurang searah dengan pertambahan bobot ikan.
Analisis untuk menentukan ikan founder (F0) yang membawa transgen di gamet dilakukan dengan menggunakan metode PCR yang sama pada sampel sperma individu jantan. Sementara analisis untuk induk betina tetap dilakukan pada sampel sirip. Hal ini dikarenakan sel telur pada induk betina baru diperoleh setelah umur ikan 1,5-2 tahun.
Gambar 4. Unit peralatan mesin PCR Rotor Gene 6000 (A) beserta komputernya (B).
3.3. Produksi dan analisis ekspresi transgen ikan mas transgenik F1 Produksi ikan mas transgenik F1 dilakukan dengan memijahkan 5 ekor individu ikan mas jantan transgenik F0 berbeda yang membawa transgen di sperma dengan 1 ekor ikan mas betina normal (non-transgenik). Pemijahan ikan dilakukan dengan metode semi buatan. Perangsangan ovulasi dilakukan dengan menggunakan Ovaprim dengan dosis 0,2 mL/kg bobot tubuh induk ikan mas
jantan dan 0,5 mL/kg bobot tubuh induk mas betina. Ketika ikan mas memijah, induk jantan dan betina diangkat kemudian dilakukan pengurutan (stripping) sperma dan telurnya.
Pembuahan telur dilakukan dengan cara mencampur sperma dan telur ikan mas dalam media air. Embrio diinkubasi dalam akuarium berukuran 60 cm x 50 cm x 40 cm yang telah berisi air, dan masing-masing dilengkapi dengan aerasi. Pemanas air (water heater) digunakan pada tiap akuarium untuk mempertahankan suhu pada 27-28˚C. Larva yang dihasilkan selanjutnya dipelihara dalam akuarium yang sama dengan kepadatan 1.000 ekor tiap akuarium. Pakan larva yang diberikan berupa naupli Artemia sp. yang diberikan sebanyak 10% bobot biomasa (bobot basah) per hari. Pemberian pakan dilakukan empat kali dalam sehari selama dua minggu pemeliharaan. Selama pemeliharaan, penggantian air dilakukan setiap hari sebanyak 30% dari total volume air.
Pemeliharaan benih selanjutnya dilakukan dalam wadah hapa berukuran 2 m x 2 m x 2 m dengan mata jaring yang sesuai mengikuti ukuran benih (Gambar 6). Seluruh hapa diletakkan dalam satu kolam yang sama agar tercapai kondisi lingkungan yang homogen. Penggantian hapa dilakukan setiap 2 bulan. Pengukuran bobot awal biomas dilakukan sebelum benih dimasukkan ke dalam hapa. Pakan yang diberikan berupa pelet halus dengan kadar protein 28% sebanyak 30% bobot biomas per hari. Pemberian pakan dilakukan sebanyak 3 kali dalam sehari.
Analisis keberhasilan transfer gen GH eksogenus pada benih ikan mas transgenik F1 dilakukan dengan menggunakan metode PCR. Sampel sirip pada ikan mas hasil elektroporasi saat mencapai ukuran 3-5 cm. Primer yang digunakan adalah tiGH forward (5-AGACAGCCAGCGTTTGTTCT-3) dan tiGH reverse (5-CCAGGACTCAACCAGTCCAT-3) dengan gen target sepanjang kurang lebih 250 bp (Kobayashi et al., 2007). Pereaksi PCR dalam 10 μL terdiri
dari 1 μL 10x dream Taq bufer, 0,2 μM dNTP mix, 0,25U dream Taq DNA polymerase (Fermentas International Inc, Burlington, Kanada), 1 μL DNA sebagai cetakan, dan 1 mM untuk setiap primer.
detik, 72°C selama 1 menit dan 72°C selama 5 menit. Pengecekan hasil amplifikasi dilakukan dengan elektroforesis menggunakan gel agarosa 1%.
Analisis ekspresi transgen diamati melalui ekspresi fenotipe dan genotipe individu F1 transgenik yang dihasilkan. Pengamatan ekspresi secara fenotipe dilakukan dengan mengukur bobot benih individu F1 berumur 2 bulan dan 4 bulan. Pengukuran bobot dilakukan pada masing-masing individu F1 hasil dari tiap induk. Selanjutnya dibuat grafik distribusi bobot individu F1 yang positif menyandi hormon pertumbuhan (transgenik) dan yang tidak menyandi hormon pertumbuhan (non-transgenik) dari hasil pemijahan tiap induk jantan F0. Penghitungan juga dilakukan terhadap kelangsungan hidup (survival rate/SR) individu F1.
Pengamatan ekspresi genotipe dilakukan dengan analisis terhadap sirip individu F1transgenik, yang dihasilkan dari 5 jantan F0 founder. Sebagian sirip individu F1 positif tersebut dipotong untuk selanjutnya dilakukan ekstraksi total RNA. Proses ekstraksi RNA dilakukan dengan menggunakan RNeasy Mini kit (Qiagen, Australia). Selanjutnya dilakukan proses reverse transcription PCR (RT-PCR) menggunakan One Step RT-PCR kit (Qiagen, Australia) dengan program: 50°C selama 30 menit, diikuti tahap aktivasi awal PCR pada suhu 95°C selama 15 menit, dilanjutkan dengan proses amplifikasi sebanyak 35 siklus yang terdiri dari: 95°C selama 20 detik, 62°C selama 15 detik, 72°C selama 15 detik. Kemudian diakhiri dengan tahap ekstensi akhir pada suhu 72°C selama 10 menit. Proses RT-PCR tersebut menggunakan primer tiGH forward (5-AGACAGCCAGC-GTTTGTTCT-3) dan tiGH reverse (5-CCAGGACTCAACCAGTCCAT-3) dengan gen target sepanjang kurang lebih 250 bp (Kobayashi et al., 2007).
dilakukan dengan elektroforesis menggunakan gel agarosa 1%. Intensitas cahaya dari ketebalan setiap pita DNA dikuantifikasi menggunakan program Quantity One (Biorad Inc., California, USA). Asumsi untuk metode ini adalah jumlah copy gen berbanding lurus dengan intensitas cahaya dari pita DNA yang diukur.
3.4. Parameter dan analisis data
Motilitas Sperma
Motilitas sperma dilihat di bawah mikroskop dan diperkirakan persentase gerakan yang aktif dengan jumlah sperma total (Effendie, 1997).
Keterangan : MR = Persentase sperma yang motil SM = Jumlah sperma yang motil TS = Jumlah sperma total
Kelangsungan hidup sperma
Kelangsungan hidup sperma diamati di bawah mikroskop dan diperkirakan persentase sperma yang hidup dengan jumlah sperma total (Effendie, 1997).
Keterangan : SR = Persentase sperma yang hidup SL = Jumlah sperma yang hidup TS = Jumlah sperma total
Derajat pembuahan
Derajat pembuahan (fertility rate/FR) telur adalah nilai yang menunjukkan persentase embrio yang terbuahi sperma, hidup dan mengalami perkembangan hingga fase bintik mata. Perhitungan derajat kelangsungan hidup embrio ini dilakukan sebelum telur menetas (Effendie, 1997).
100% X
TS SM MR =
100% X
Keterangan : FR = Persentase telur berhasil terbuahi FE = Jumlah telur berhasil terbuahi TE = Jumlah total telur diamati
Derajat penetasan
Derajat penetasan (hacthing rate/HR) telur adalah nilai yang menunjukkan persentase telur yang berhasil menetas yang diperhitungkan terhadap jumlah total telur yang diamati (Effendie, 1997).
Keterangan : HR = Persentase telur berhasil menetas HE = Jumlah telur berhasil menetas TE = Jumlah total telur diamati
Kelangsungan hidup ikan
Kelangsungan hidup (survival rate/SR) ikan adalah nilai yang menunjukkan persentase ikan pengamatan yang hidup pada akhir waktu pengamatan tertentu yang diperhitungkan terhadap jumlah total ikan pada awal pengamatan (Effendie, 1997).
Keterangan : SR = Persentase ikan hidup
SF = Jumlah ikan hidup pada akhir penelitian TF = Jumlah total ikan diamati pada awal penelitian
Persentase ikan transgenik founder
Persentase individu ikan yang terdeteksi membawa gen eksogen pada jaringan gonad ikan F0 (founder), diperhitungkan terhadap jumlah total individu yang dianalisis (Kobayashi et al., 2007)
Laju transmisi transgen
Persentase individu ikan transgenik F1 yang terdeteksi membawa gen eksogen yang diperhitungkan terhadap jumlah total individu yang dianalisis (Kobayashi et al,. 2007).
Laju pertumbuhan spesifik
Keterangan : α = Laju pertumbuhan spesifik
Wt = Bobot rataan individu pada akhir pengamatan W0 = Bobot rataan individu pada awal pengamatan t = Lama waktu pengamatan
Data dianalisis menggunakan statistika non parametrik dengan membandingkan nilai rataan pada setiap parameter (Least Significant Different Test) (Kato et al., 2007). Data diolah dengan bantuan program Microsoft Excel 2007.
100% X
Persentase ikan founder = ∑ sampel positif
∑ sampel dianalisis
100% X
Laju transmisi = ∑ sampel positif
∑ sampel dianalisis
100% - 1
α
=Wt
t
W0
IV. HASIL DAN PEMBAHASAN
4.1. Elektroporasi sperma dan analisis efektivitas transfer gen GH eksogen pada ikan mas founder (F0)
Pengaruh elektroporasi pada motilitas dan viabilitas sperma, derajat pembuahan dan derajat penetasan telur, serta tingkat kelangsungan hidup 5 hari pertama dapat dilihat pada Tabel 1. Tingkat viabilitas sperma yang mengalami perlakuan elektroporasi dan penambahan DNA pmβa-tiGH relatif tinggi pada program 1 (97,00±1,73%) dan program 2 (97,67±1,53%). Namun tidak terdapat perbedaan nyata antara nilai viabilitas sperma pada program 1 dan program 2 ataupun pada kontrol (97,00±1,41%).
Tabel 1. Motilitas dan viabilitas sperma, derajat pembuahan (FR) dan derajat penetasan telur (HR), serta tingkat kelangsungan hidup 5 hari (SR) larva hasil perlakuan elektroporasi sperma dengan DNA pmβa-tiGH.
Program
Program 1 91,67±2,89ª 97,00±1,73ª 90,30±1,25ª 86,07±1,87ª 68,87±3,42ª
Program 2 93,33±2,89ª 97.67±1,53ª 88,77±2,60ª 84,57±1,03ª 67,37±1,92ª
Kontrol 90,00±0,01ª 97,00±1,41ª 93,55±0,21ª 87,50±1,27ª 67,05±1,77ª
* Kontrol adalah sperma yang dielektroporasi tanpa DNA.
Motilitas sperma yang mengalami perlakuan elektroporasi dan penambahan DNA pmβa-tiGH relatif tinggi pada program 1 (91,67±2,89%) maupun program 2 (93,33±2,89%). Namun tidak terdapat perbedaan nyata antara nilai motilitas sperma pada program 1 dan program 2 ataupun pada kontrol (90,00±0,00%). Dengan demikian metode elektroporasi dengan kedua program yang dilakukan tidak mempengaruhi viabilitas dan motilitas sperma ikan mas.
gelombang yang pendek sehingga menimbulkan sedikit panas. Selanjutnya transfer DNA dapat terjadi tanpa membunuh sel atau embrio.
Motilitas sperma pasca elektroporasi bergantung pada voltase, panjang kejutan, jumlah kejutan dan kekuatan ionik buffer (Symonds et al., 1994). Pada ikan mas, motilitas dan viabilitas sperma pasca elektroporasi relatif tinggi baik pada program 1, program 2, dan kontrol.
Selanjutnya, sperma yang dielektroporasi tetap memiliki kemampuan untuk membuahi sel telur. Derajat pembuahan telur oleh sperma yang telah dielektroporasi relatif tinggi baik pada program 1 (90,30±1,25%) maupun program 2 (88,77±2,60%). Namun tidak terdapat perbedaan nyata antara derajat pembuahan telur ikan mas pada program 1 dan program 2 ataupun pada kontrol (93,55±0,21%). Dengan demikian metode elektroporasi dengan kedua program yang dilakukan tidak mempengaruhi derajat pembuahan telur ikan mas.
Kondisi sperma ikan akan mempengaruhi keberhasilan pembuahan sel telur. Sperma yang baik akan membuahi sel telur dengan baik. Terjadinya perubahan pergerakan (motilitas) dan viabilitas sperma akan mempengaruhi kerja sperma. Menurut Hafez (1987), semen yang memenuhi syarat untuk proses pembuahan mengandung sperma yang hidup dan bergerak aktif ke depan (progresif). Persentase sperma yang motil tidak harus lebih dari 70%, di mana dalam penggunaan sehari-hari tidak kurang dari 50%, meskipun beberapa peneliti menganjurkan 60% atau lebih
Derajat penetasan telur ikan mas yang difertilisasi dengan sperma hasil elektroporasi menunjukkan nilai yang tidak berbeda nyata antara program 1 (86,07±1,87%) dan program 2 (84,57±1,03%) ataupun pada kontrol (87,50±1,27%). Hal ini menunjukkan bahwa metode elektroporasi yang dilakukan dengan kedua program tersebut tidak mempengaruhi penetasan telur ikan mas. Hal yang senada dilaporkan oleh Tsai et al. (2000) bahwa daya tetas telur antara yang dibuahi dengan sperma terelektroporasi dan sperma kontrol relatif sama. Tsai et al. (2000) juga menyebutkan bahwa selisih di antaranya hanya 4% lebih besar pada sperma kontrol.
kelangsungan hidup larva ikan mas pada umur 5 hari pada program 1 (68,87±3,42%) dan program 2 (67,37±1,92%) ataupun pada kontrol (67,05±1,77%). Dengan demikian metode elektroporasi yang dilakukan dengan kedua program tersebut tidak mempengaruhi kelangsungan hidup larva yang dihasilkan.
Aplikasi sperm mediated gene transfer (SMGT) menunjukkan tingkat keberhasilan yang bervariasi pada beberapa spesies hewan. Secara umum nampaknya sebagian besar hasil yang signifikan dengan tingkat keberhasilan yang tinggi diperoleh dari invertebrata laut, amfibi dan ikan. Hal ini dimungkinkan karena beberapa alasan bahwa sel sperma dari hewan-hewan dengan karakter fertilisasi eksternal diduga memiliki karakter intrinsik yang membuat sel sperma menjadi substrat yang lebih baik sebagai perantara transfer DNA dibandingkan spermatozoa mamalia (Spadafora, 1998). Elektroporasi merupakan proses memodifikasi permeabilitas membran sel melalui kuat medan listrik. Aplikasi kejutan listrik pada suspensi sel menginduksi polarisasi komponen membran sel dan mengembangkan potensi tegangan di seluruh membran. Pada saat perbedaan potensial antara bagian dalam dan luar membran sel melewati titik kritis, komponen membran direorganisasi ke dalam pori pada area yang terlokalisasi, dan sel menjadi permeable terhadap masuknya makromolekul (Knight, 1981; Knight & Scrutton, 1986). Besarnya perubahan ukuran pori dipengaruhi oleh kuat medan listrik, lamanya kejutan dan kekuatan ionik media. Perubahan permeabilitas ini bersifat sementara, dengan syarat kejutan listrik tidak melebihi batas kritis bagi sel (Tsong, 1983).
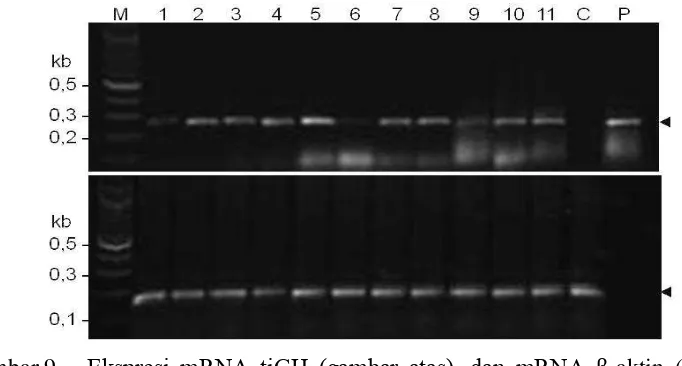
Analisis keberadaan DNA pmβa-tiGH pada sperma yang dielektroporasi menggunakan PCR semi-kuantitatif menunjukkan bahwa sperma hasil elektroporasi membawa DNA pmβa-tiGH baik pada program 1 ataupun program 2. Sementara pita DNA pmβa-tiGH yang sama tidak terlihat pada perlakuan kontrol (Gambar 5). Hal ini menunjukkan bahwa gen pmβa-tiGH berhasil ditransfer ke sperma ikan mas melalui metode elektroporasi dengan program 1 ataupun program 2.
Selanjutnya, hasil analisis keberadaan DNA pmβa-tiGH pada embrio ikan mas setelah 4 jam fertilisasi menggunakan PCR semi-kuantitatif, juga menunjukkan bahwa DNA pmβa-tiGH ditemukan pada embrio hasil fertilisasi telur oleh sperma yang dielektroporasi dengan penambahan tiGH, baik pada program 1 ataupun program 2. Sementara pita DNA pmβa-tiGH yang sama tidak terlihat pada perlakuan kontrol (Gambar 6). Hal ini menunjukkan bahwa gen pmβa-tiGH yang ditransfer melalui metode elektroporasi dengan program 1 dan program 2 mampu terintegrasi ke dalam kepala sperma yang dielektroporasi.
Gambar 6. Deteksi DNA pmβa-tiGH pada embrio setelah 4 jam fertilisasi menggunakan sperma yang telah dielektroporasi dengan program 1 (kolom nomor 1-5), dan program 2 (kolom nomor 6-10), kontrol plasmid DNA (KЀ) dan kontrol embrio hasil elektroporasi sperma tanpa penambahan DNA pmβa-tiGH (KЁ). Tanda panah di sebelah kanan gambar adalah posisi target amplifikasi PCR (250 bp).
dari telur yang dibuahi oleh sperma hasil elektroporasi adalah normal seperti halnya non-transgenik.
Analisis keberhasilan transfer gen GH eksogen pada benih ikan mas transgenik F0 diamati melalui persentase individu transgen yang membawa DNA pmβa-tiGH setelah benih berukuran 3-5 cm atau umur 2 bulan. Selanjutnya benih founder F0 ikan mas dipelihara selama 8 bulan atau hingga matang gonad. Analisis untuk menentukan induk founder (F0) dilakukan dengan menggunakan metode PCR yang sama pada sampel sperma individu jantan. Hasil analisis DNA pada sirip benih F0 dan sperma individu jantan ditampilkan pada Tabel 2 dan Gambar 7.
Tabel 2. Rerata jumlah dan persentase ikan membawa gen tiGH pada sirip dan sperma yang dideteksi menggunakan metode PCR.
Program elektroporasi
Ikan membawa tiGH di sirip Ikan membawa tiGH di sperma
N * Nilai merupakan rerata dari 3 ulangan. n = jumlah individu dianalisis; tiGHЀ = individu positif
tiGHЀ; % = rerata persentase ikanyang membawa gen tiGH.
Gambar 7. Deteksi DNA pmβa-tiGH pada sperma ikan mas founder F0 (kolom nomor 1-8), kontrol positif berupa plasmid tiGH (K+), dan kontrol negatif berupa ikan mas non-transgenik (K-). M= marker DNA VC 100 bp Plus DNA Ladder (Vivantis, USA).
nilai yang berbeda nyata lebih tinggi pada program 1 (49,1±7,5%) dibandingkan program 2 (32,1±5,7 %). Hal tersebut menunjukkan bahwa produksi ikan mas founder (F0) secara nyata lebih baik dihasilkan melalui metode elektroporasi dengan program 1 dibandingkan program 2.
4.2 Produksi dan analisis ekspresi transgen pada ikan mas transgenik F1 Produksi ikan mas transgenik F1 dilakukan dengan memijahkan 5 ekor individu ikan mas jantan transgenik F0 berbeda yang membawa transgen di sperma dengan 1 ekor ikan mas betina normal (non-transgenik). Seperti ditampilkan pada Tabel 3, ikan transgenik F1 berhasil diproduksi dari kelima induk founder (F0) dengan persentase berkisar 47,19-66,67% dari total populasi ikan yang dihasilkan masing-masing founder.
Tabel 3. Jumlah, dan persentase ikan mas transgenik keturunan pertama (F1) yang membawa gen tiGH dari induk jantan F0 berbeda.
No
F1 menurut kelompok ukuran tubuh ekor (%) Keterangan: angka di dalam kurung merupakan nilai persentase. Ukuran ikan diamati pada umur
4 bulan.
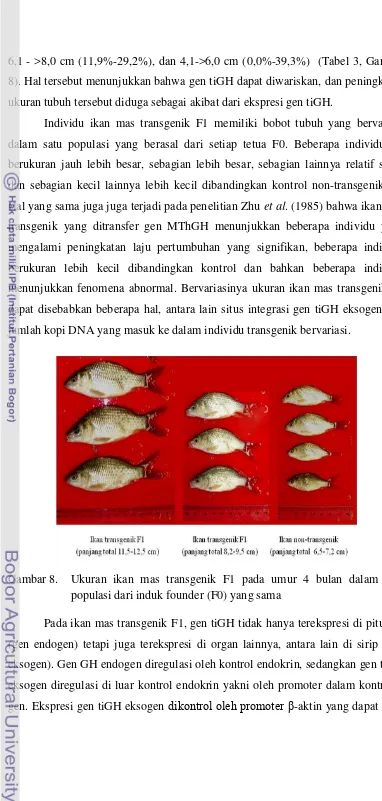
6,1 - >8,0 cm (11,9%-29,2%), dan 4,1->6,0 cm (0,0%-39,3%) (Tabel 3, Gambar 8). Hal tersebut menunjukkan bahwa gen tiGH dapat diwariskan, dan peningkatan ukuran tubuh tersebut diduga sebagai akibat dari ekspresi gen tiGH.
Individu ikan mas transgenik F1 memiliki bobot tubuh yang bervariasi dalam satu populasi yang berasal dari setiap tetua F0. Beberapa individu F1 berukuran jauh lebih besar, sebagian lebih besar, sebagian lainnya relatif sama dan sebagian kecil lainnya lebih kecil dibandingkan kontrol non-transgeniknya. Hal yang sama juga juga terjadi pada penelitian Zhu et al. (1985) bahwa ikan mas transgenik yang ditransfer gen MThGH menunjukkan beberapa individu yang mengalami peningkatan laju pertumbuhan yang signifikan, beberapa individu berukuran lebih kecil dibandingkan kontrol dan bahkan beberapa individu menunjukkan fenomena abnormal. Bervariasinya ukuran ikan mas transgenik F1 dapat disebabkan beberapa hal, antara lain situs integrasi gen tiGH eksogen dan jumlah kopi DNA yang masuk ke dalam individu transgenik bervariasi.
Gambar 8. Ukuran ikan mas transgenik F1 pada umur 4 bulan dalam satu populasi dari induk founder (F0) yang sama