Lampiran 1 .Perhitungan Larutan Standar Cu2+
1. Larutan Induk Cu2+ 1000 ppm
Gram Cu2+ = ����
�� Cu (NO 3).3H2Ox gram Cu(NO3)2.3H2O 0,4999 gram = 63,5
241,5x gram Cu(NO3)2.3H2O Gram Cu(NO3)2.3H2O = 1,9018 gram
Larutan Induk 1000 ppm ppm= ���� ��2+
1000 �� x 1000 ppm = 0,4999
500 �� x 1000 ppm = 999,8 ppm ≈ 1000 ppm
2. Larutan Seri Standar Cu2+ 100 ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 100 ppm
V1 = 25 mL
3. Larutan Seri Standar Cu2+ 200 ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 200 ppm
V1 = 50 mL
4. Larutan Seri Standar Cu2+ 300 ppm V1 x N1= V2 x N2
V1 x 10000 ppm = 250 mL x 300 ppm
5. Larutan Seri Standar Cu2+ 400 ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 400 ppm
V1 = 100 mL
6. Larutan Seri Standar Cu2+ 500ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 500 ppm
Lampiran 2. Perhitungan Daya Serap (%) Zat Hasil Reaksi
% Daya Serap =����� ���� −����� ��ℎ��
����� ���� x 100 %
1. % Daya Serap Selulosa Suksinat
a. Selulosa Suksinat-Larutan Standar 100 ppm % Daya Serap = 100 – 69,6195
100 x 100 % = 0,303805 x 100 % = 30,3805 %
b. Selulosa Suksinat-Larutan Standar 200 ppm % Daya Serap = 200 – 181,0619
200 x 100 % = 0,091905 x 100 % = 9,1905 %
c. Selulosa Suksinat-Larutan Standar 300 ppm % Daya Serap = 300 – 258,2907
300 x 100 % = 0,139031 x 100 % = 13,9031 %
d. Selulosa Suksinat-Larutan Standar 400 ppm % Daya Serap = 400 – 360,7893
e. Selulosa Suksinat-Larutan Standar 500 ppm % Daya Serap = 500 – 459,7956
500 x 100 % = 0,080408 x 100 % = 8,0408 %
2. % Daya Serap Selulosa
a. Selulosa Larutan Standar 100 ppm % Daya Serap = 100 – 81,1011
100 x 100 % = 0,188989 x 100 % = 18,8989 %
b. Selulosa Larutan Standar 200 ppm % Daya Serap = 200 – 178,0126
200 x 100 % = 0,109937 x 100 % = 10,9937 %
c. Selulosa Larutan Standar 300 ppm % Daya Serap = 300 – 261,8399
300 x 100 % = 0,127200 x 100 % = 12,7200 %
d. Selulosa Larutan Standar 400 ppm % Daya Serap = 400 – 368,0740
e. Selulosa Larutan Standar 500 ppm % Daya Serap = 500 – 471,3945
500 x 100 % = 0,057211 x 100 % = 5,7211 %
Lampiran 3. Perhitungan Kadar Alfa Selulosa Hasil Isolasi Kadar alfa selulosa teori = 53,2 %
Massa alfa selulosa teori = 53
100 x 75 gram = 39,9 gram Massa alfa selulosa praktek = 8,64 gram % Ralat =������ ����� − ������������
���������� � x 100 % = �39,9 ���� −8,64 ����
39,9 ���� � x 100% = 78%
Lampiran 4. α-Selulosa dan Selulosa Suksinat dari Sabut Buah Pinang
Selulosa
Lampiran 6. SEM α-Selulosa Pembanding
DAFTAR PUSTAKA
Alila S., and Boufi S., (2009). Removal of Organic Pollutants from Water by Modified Cellulose Fibers. Ind. Crop. Prod. 30: 93-104.
Bahar H., Vu-Manh H., and Bechtold T., (2009). Interaction of Cellulose with Alkali Metal Ions and Complexed Heavy Metals. Lenzinger Berichte 87: 142-150. Bethnova, L. (2012). Perekat Likuida dari Limbah Sabut Pinang (Areca catechu L.).
Fakultas Pertanian USU. USU Repository : Medan.
Bezerra R., Teixeira P., dan Eiras C., (2015). Chemical Functionalization of Cellulosic Materials Main Reactions and Applications in the Contaminants Removal of Aqueous Medium. Chapter 4. Brazil: Federal University of Piaui. Bhimte A., dan Tayade P., (2007). Evaluation of Microcrystalline Cellulose Prepared
From Sisal Fibers as a Tablet Excipient: A Technical Note. Japan : AAPS PharmSciTech. 8 (1) :1.
Bogan R., Kuo C., and Brewer R., (1979). Encyclopedia of Chemical Technology. New York : Wiley Interscience. Pages : 703-756.
Chikkol S., Bennehalli B., and Kenchappa M.. (2010). Flexure of Areca Composites. GM Institute of Technology. Bioresource 5(3) : 1846-1858.10
Coffey D., Bell D., and Handerson A., (1995). Cellulose and Cellulose Derivate. New York: John Wiley & Son.
Cronquist, A. (1981). A Intregated Sistem of Classification of Flowering Plants. New York: Columbia University Press.
Dence, C.W., and Reeve, D.W., (1996). Pulp Bleaching Principle and Practice. Atlanta : Tappi Press. Pages : 349-415.
Donghee P., Yeoung S., Hwa Y., and Jong M., (2004). Chromium Biosorption by Thermally Treated Biomass of The Brown Seaweed Ecklonia sp. Ind. Eng. Chem. Resc, (42): 8226-8232.
Dronnet V., Axelois M., Renard C., and Thibault. (1998). Imprvement of the Binding Capacity of Metal Cations by Sugar-beet Pulp. Part 1. Carbohydrat Polymer. 35 : 29-37.
Fengel, D and Wegener, G. (1995). Kimia : Kayu. Terjemahan Hardjono Sastrohamidjojo. Yogyakarta : Gajah Mada University Press.
Fessenden, R.J., dan Fessenden J.S., (1986). Kimia Organik. Jilid 2. Edisi ketiga. Penerbit Erlangga. Jakarta.
Freire C., Silvestre A., Neto C., and Belgacem M., (2006). Controlled Heterrogenous Modification of Cellulose Fibers with Fatty Acid. Polymer Science 100(2). 1093-1102.
Gagliardi D., and Shippee, F., (1963). Crosslinking of Cellulose with Polycarboxylic Acids. Am. Dyest. Rep. 52:300–303.
Granström, M. (2009). Cellulose Derivatives: Synthesis, Properties and Applications. Finland : University of Helsinki.
Haworth, W. N., (1932). Berichte der Deutschen Chemischen Gesellschaft. (A). 65, 43.
Huang and Zhang. (2010). Preparation of Cellulose Sulphate and Evaluation of Its Properties. Chemical Department China.
Jabli M., Aloui F., and Hassine B., (2013). {Cooper (II)/Cellulose] Microspheres Complex for Dye Immobilization. Journal of Engineered Fibers and Fabrics. Volume 8 : 19-20.
Jaiswal P., Kumar P., and Singh V.. (2011). Areca catechu L. : A Valuable Medicine Against Different Health Problems. New Delhi : Research Journal of Medicinal Plant. 5. (2). 145-152.
Kaban J., Bangun H., Meriaty, dan Brahmana, H., (2005). Pembuatan Serta Karakterisasi Membran Haemodialisa Melalui Reaksi Antara Alginat dengan Kalsium Klorida dan Magnesium Klorida. Jurnal Komunikasi Penelitian. Volume 17 (5) : 89-90.
Karnitz, Gurgel, Melo, and Botaro. (2007). Adsorption of Heavy Metal Ion from Aqueous Solution Single Setal Solution by Chemically Modified Sugarcane Bagasse. Bioresource Technology.
Kim S.H, Song H, Nisola G.M, Ahn J, Galera M.M, Chung W.J, Lee C.H. (2006). Adsorption of Lead Ions using Surface Modified Chitin. Journal of Ind.Eng.Chem. Vol 12 (3):469-475
Klemm D., Philipp B., and Heinze T., (1998). Comprehensive Cellulose Chemistry Volume 2. Fundamentals and Analytical Methods. Weinheim: Wiley Verlag. Kottelnikova N., Vainio U., Pirkkalainen K., and Serina R., (2007). Novel
Approaches to Metallization of Cellulose by Reduction of Cellulose-Incorporated Copper and Nickel Ions. Macromolecul Symposia, 254: 74-79. Köhler S., and Heinze T.,. (2007). Cellulose. 14, 489.
Leandro, Freitas and Gil. (2008). Adsorption of Cu(II), Cd(II), and Pb(II) from aqueous single metal solutions by cellulose and mercerized cellulose chemically modified with succinic anhydride. Elsevier.
Lukita, N. (2015). Pemanfaatan Selulosa Mikrokristal Sebagai Bahan Tambahan dalam Pembuatan Tablet. Medan : USU Repository.
Marshall W., Wartelle L., and Boler D., (1999). Enhanced Metal Absorption by Soybean Hulls Modified with Citric Acid. Bioresource Technology 69 :263-268.
Mohamad, E., (2012). Fitoremediasi Logam Berat Kadmium (Cd) Pada Tanah dengan Menggunakan Bayam Duri (Amaranthus spinosus L.). Universitas Negeri Gorontalo. Halaman 17.
Nagel and Heinze. (2010). Esterification of Cellulose with Acyl01H-benzotriazole. O’neil M., Smith A., Heckelmen P., (2001). The Merck Index 13th edition. New
Jearsey : Merck and Co. Whitehouse Station. Oscik, J. (1982). Adsorption. Chichester : Jhon Wiley.
Oyeniyi Y., and Itiola O., (2011). The Physicochemical Characteristic of Microcrystalline Cellulose, Derived From Sawdust, Agricultural Waste Products. Ligerian : International Journal of Pharmacy and Pharmaceutical Sciences. 4(2): 197.
Palar,H. ( 2008). Pencemaran dan Toksikologi Logam Berat. Penerbit Rieneka Cipta. Jakarta.
Panjaitan, R.R., (2008). Pengembangan Pemanfaatan Sabut Pinang untuk Pembuatan Asam Oksalat.Jakarta :Berita Litbang Industri Media Publikasi and Komunikasi Peneliti Industri. 39 (1).
Rajan A., Kurup J., and Abraham T., (2005). Biosoftening of Areca Nut Fiber For Value Added Products. Biochemical Engineering Journal. 25: 237-242.
Richardson, S. and Gorton, L. (2003).Characterisation of the Substituent Distribution in Starch and Cellulose Derivatives, Analytica Chimica Acta (2).New York: McGraw-Hill. Pages 27-65.
Samios F, Dart and Dawkins. (1997). Preparation, characterization and biodegradation studies on cellulose acetate with varying degrees of substitution.
Sitorus, Z. (2010). Pemanfaatan Limbah Padat Pulp di PT. TPL sebagai Bahan Baku pada Pembuatan Keramik Konstruksi. Meand : Universitas Sumatera Utara. Staudinger, H. (1960). Die hochmolekularen organichen Verbindungen – Kautschuk
und Cellulose. Second Edition.Berlin :Springer Verlag
Tarmansyah, K.U., (2007). Pemanfaatan Serat Rami untuk Pembuatan Selulosa.Jakarta :Tim Puslitbang Indhan Balitbang Dephan.
Thanh, N. D., and Nhung H.L.,(2009).Some Derivatives of Cellulose with Diethanolamine and Ethylendiamine.Faculty of Chemistry Hanoi University of Science. Hanoi.
Vaswani, S., (2010). Bio-Based Succinic Acid.California : Sri Consulting. Review No. 14.
Volesky B., and Naja G., (2005). Biosorption Application Strategies In: Proceedings of the 16th Internat. Biotechnol, Symp. (S.T.L.Harrison; DE. Rawlings and J. Petersen) (eds.) IBS Compress Co.,Capetown South Africa: 531-542.
Wang. (2008). Bioresource Technology.doi:10.1016/j.biortech.2008.09.002.
Welch C., and Kottes-Andrews. (1989). Ester Crosslinks: A Route to High Performance Nonformaldehyde Finishing of Cotton. USA : Textile Chemist and Colorist 21 (2) : 13-17.
Yan, Y. (2001) .Production of Sugar Fatty Acid Ester by Enzimatic Esterification in a Stirred-Tank Membrane Reactor: Optimization of Parameters by Response Surface Metodology,
Zahroh B., Lazuardy T., Rohmania S., dan Indah H.,. (2013). Adsorpsi Logam Berat Pb dalam Larutan Menggunakan Senyawa Xanthate Jerami Padi. Semarang : Universitas Wahid Hasyim. Prosiding SNST ke-4 Tahun 2013
BAB 3
METODE PENELITIAN
3.1. Alat– Alat
Adapun alat –alat yang digunakan dalam penelitian ini adalah: -Spektrofotometer FT-IR Agilent Technologies -Spektrofotometer Serapan Atom GF Perkin Elmer -Scanning Electron Microscope JSM-35 C Shumandju
-Labu takar 250 mL Pyrex
-Labu takar 1000 mL Pyrex
-Gelas Beaker 5 L Pyrex
-Gelas ukur 100 mL Pyrex
-Indikator pH universal Sartorius -Hotplate stirrer Fishons -Magnetic bar
-Neraca analitis Metler PM 480
-Termometer 110oC Fisher -Oven
-Blender -Pipet tetes -Cawan penguap
-Cawan porselen Pyrex
3.2. Bahan – Bahan
Adapun bahan yang digunakan dalam penelitian ini adalah: -Sabut buah pinang
-Asam suksinat p.a E’Merck
-KBr p.a E’Merck
-NaNO2 p.a E’Merck
-HNO3 p.a E’Merck
-Asam asetat glasial p.a E’Merck
-NaOH pellet p.a E’Merck
-HCl p.a E’Merck
-NaOCl p.a E’Merck
-H2O2 p.a E’Merck
-Aquadest
-Kertas saring no. 42 Whatman
3.3. Prosedur Penelitian 3.3.1. Preparasi Sampel
Sabut buah pinang dikeringkan, digunting kecil-kecil dan diblender sampai menjadi serbuk.
3.3.2. Pembuatan Pereaksi
3.3.2.1. Pembuatan Larutan NaOH 17,5%
3.3.2.2. Pembuatan Larutan H2O2 10 %
Sebanyak 333 ml H2O2 30% dimasukkan kedalam labu takar 1000 ml, ditambahkan
aquadest hingga garis tanda, dihomogenkan.
3.3.2.3. Pembuatan Larutan NaOCl 1,7%
Sebanyak 136 ml NaOCl(p) 12% dimasukkan ke dalam labu takar 1000 ml,
ditambahkan aquadest hingga garis tanda, dihomogenkan.
3.3.2.4. Pembuatan Larutan Buffer Asetat
Sebanyak 27 gram NaOH pellet dilarutkan dengan 500 ml aquadest dalam gelas Beaker, diaduk hingga larut, lalu dimasukkan kedalam labu takar 1000 ml yang telah berisi 75 ml asam asetat glasial, ditambahkan dengan aquadest hingga garis tanda, dihomogenkan.
3.3.2.5. Pembuatan NaOH 2 %
Ditimbang NaOH pellet sebanyak 20 gram dan dilarutkan dengan aquadest dalam labu takar 1000 ml.
3.3.2.6. Pembuatan HNO3 3,5 %
Sebanyak 54,6 ml HNO3 65 % diencerkan dengan aquadest dalam labu takar 1000 ml
3.3.2.7. Larutan Seri Standar Cu2+
3.3.2.7.1.Larutan Seri Standar Cu2+ 100 mg/L
Sebanyak 25 mL Cu(NO3)2 dimasukkan ke dalam labu takar 250 mL, ditambahkan
aquadest hingga garis batas dan dihomogenkan.
3.3.2.7.2.Larutan Seri Standar Cu2+ 200 mg/L
Sebanyak 50 mL Cu(NO3)2 dimasukkan ke dalam labu takar 250 mL, ditambahkan
aquadest hingga garis batas dan dihomogenkan.
3.3.2.7.3.Larutan Seri Standar Cu2+ 300 mg/L
Sebanyak 75 mL Cu(NO3)2 dimasukkan ke dalam labu takar 250 mL, ditambahkan
aquadest hingga garis batas dan dihomogenkan.
3.3.2.7.4.Larutan Seri Standar Cu2+ 400 mg/L
Sebanyak 100 mL Cu(NO3)2 dimasukkan ke dalam labu takar 250 mL, ditambahkan
aquadest hingga garis batas dan dihomogenkan.
3.3.2.7.5.Larutan Seri Standar Cu2+ 500 mg/L
Sebanyak 125 mL Cu(NO3)2 dimasukkan ke dalam labu takar 250 mL, ditambahkan
3.3.3. Isolasi Alfa Selulosa dari Sabut Buah Pinang
Isolasi alfa selulosa dari sabut buah pinang (Areca catechu L.) dengan metode kimia. Serbuk dimasukkan ke dalam gelas Beaker, ditambahkan 1 Liter HNO3 3,5% dan 10
mg NaNO2 serta dipanaskan di atas hot plate pada suhu 90oC selama 2 jam sambil
diaduk, disaring residu dan dicuci hingga filtrat netral. Residu yang sudah netral dilarutkan dalam 1 Liter NaOH 2% dan dipanaskan di atas hot plate pada suhu 80oC selama 4 jam sambil diaduk menggunakan magnetic stirrer, disaring residu dan dicuci hingga filtrat netral. Residu yang sudah netral diputihkan menggunakan 1 Liter campuran larutan buffer asetat dan NaOCl 1,7% dengan perbandingan 1:1 dan dipanaskan di atas hot plate pada suhu 80oC selama 6 jam sambil diaduk menggunakan magnetic stirrer.
Dilakukan penghilangan beta dan gamma selulosa dengan melarutkan residu yang sudah netral ke dalam 500 mL larutan NaOH 17,5% dan dipanaskan di atas hot plate pada suhu 80oC selama 30 menit sambil diaduk menggunakan
magnetic stirrer, disaring residu dan dicuci hingga filtrat netral. Residu yang udah
netral diputihkan menggunakan 500 mL H2O2 10% dan dipanaskan pada suhu 60oC
selama 15 menit sambil diaduk menggunakan magnetic stirrer, disaring residu dan dicuci hingga filtrat netral. Diperoleh alfa selulosa basah dan dikeringkan di dalam oven pada suhu 60oC selama 4 jam. Dihasilkan alfa selulosa kering dan disimpan dalam desikator yang kemudian dianalisis menggunakan FT-IR, dan diuji morfologi permukaannya menggunakan SEM.
3.3.4. Pembuatan Selulosa Suksinat
campuran. Kemudian suhu dinaikkan menjadi 120oC selama 12 jam agar reaksi terjadi secara sempurna. Diangkat dari oven dan dibiarkan hingga dingin. Kemudian dicuci dengan 200 mL aquadest hangat untuk selanjutnya dikeringkan kembali di dalam oven pada suhu 50oC selama 4 jam dan disimpan di dalam desikator. Kemudian dianalisis dengan menggunakan spektroskopi FT-IR, dihitung derajat substitusinya dan dianalisa menggunakan SEM.
3.3.5. Karakterisasi Hasil Reaksi
3.3.5.1. Analisis Gugus Fungsi dengan FT-IR
Untuk masing-masing cuplikan selulosa dan selulosa suksinat berwujud padat digerus dengan KBr anhidrat hingga homogen dan menjadi serbuk halus dan dicetak hingga bentuk pellet serta diukur spektrumnya dengan alat Spektrofotometer FT-IR model Agilent Technologies.
3.3.5.2. Analisis Morfologi dengan SEM
Analisis dilakukan untuk memperlajari morfologi dari selulosa dan selulosa suksinat. Hasil analisis SEM akan memunculkan rongga hasil pencampuran sehingga memberikan gambaran seberapa baik hasil yang diperoleh.
3.3.5.3. Penentuan Derajat Substitusi
DS (%) =
��
�1720�3348
� −
0,10
�
x 100
Dimana DS adalah derajat subtitusi dan nilai 0,10 mewakili gugus hidroksil yang spesifik dalam selulosa asli.
3.3.5.4. Analisis Serapan Ion Logam Cu2+dengan SSA
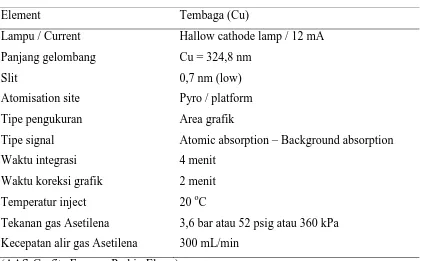
Pada penelitian ini, sebelum dilakukan analisis sampel dilakukan pemeriksaan terhadap alat spektrofotometer serapan atom (SSA) dengan kondisi operasi peralatan (Tabel 3.1.).
Tabel 3.1 Cek Alat SSA
Element Tembaga (Cu)
Lampu / Current Hallow cathode lamp / 12 mA Panjang gelombang Cu = 324,8 nm
Slit 0,7 nm (low)
Atomisation site Pyro / platform
Tipe pengukuran Area grafik
Tipe signal Atomic absorption – Background absorption
Waktu integrasi 4 menit
Waktu koreksi grafik 2 menit Temperatur inject 20 oC
Tekanan gas Asetilena 3,6 bar atau 52 psig atau 360 kPa Kecepatan alir gas Asetilena 300 mL/min
(AAS-Grafite Furnace Perkin Elmer)
3.3.6. Perlakuan dan Analisis Penyerapan Ion Cu2+ 3.3.6.1. Penentuan Waktu Kontak Optimum
Sebanyak 50 mL larutan standar Cu2+ 400 ppm dimasukkan ke dalam gelas Erlenmeyer kemudian ditambahkan selulosa suksinat sebanyak 0,1 g. Diaduk dengan pengaduk magnet selama 30 menit lalu campuran disaring menggunakan kertas saring Whatmann no. 42. Diatur pH filtrat hingga pH= 3 dengan menggunakan HNO3(p). Diukur absorbansinya dengan menggunakan spektrofotometer serapan atom
pada � spesifik 324,8 nm. Dilakukan perlakuan yang sama dengan variasi waktu kontak 60 menit, 90 menit, 120 menit, dan 150 menit.
3.3.6.2. Selulosa dalam Larutan Standar
Sebanyak 50 mL larutan standar Cu2+ 100 ppm dimasukkan ke dalam gelas Erlenmeyer, kemudian ditambahkan selulosa sebanyak 0,1 g. Diaduk dengan pengaduk magnet selama waktu kontak optimum lalu campuran disaring menggunakan kertas saring Whatmann no. 42. Diatur pH filtrat hingga pH=3 dengan menggunakan HNO3(p). Diukur absorbansinya dengan menggunakan
spektrofotometer serapan atom pada � spesifik 324,8 nm. Dilakukan perlakuan yang sama dengan variasi larutan standar Cu2+ 200 ppm, 300 ppm, 400 ppm dan 500 ppm.
3.3.6.2. Selulosa Suksinat dalam Larutan Standar
3.4. Bagan Penelitian
3.4.1. Preparasi Sampel
Sabut buah pinang
Serbuk sabut buah pinang digunting kecil-kecil
dikeringkan
3.4.2. Isolasi Alfa Selulosa dari Sabut Buah Pinang
75 gram serbuk sabut buah pinang
Residu Filtrat
Residu Filtrat
Residu Filtrat
Residu Filtrat
ditambahkan dengan 500 mL larutan H2O2 10%
dipanaskan pada suhu 60oC selama 15 menit sambil diaduk di atas hot plate disaring dan dicuci endapan hingga filtrat netral
Alfa selulosa basah Filtrat
dikeringkan pada suhu 60oC di dalam oven selama 4 jam disimpan dalam desikator
Alfa selulosa kering
dikarakterisasi menggunakan FT-IR Hasil
dimasukkan kedalam gelas Beaker 5 liter
ditambahkan 1 l campuran HNO3 3,5 %dan 10 milligram NaNO2 dipanaskan diatas hotplate sambil diaduk pada suhu 90oC selama 2 jam disaring dan dicuci residu hingga filtrat netral
ditambahkan 1 liter larutan NaOH 2 %
dipanaskan pada suhu 80oC selama 4 jam sambil diaduk diatas hotplate
disaring dan dicuci residu hingga filtrat netral
diputihkan dengan 1 liter larutan yang terbuat dari larutan buffer asetat dan NaOCl 1,7 % dengan perbandingan 1 : 1
dipanaskan pada suhu 80oC selama 6 jam sambil diaduk di atas hotplate disaring dan dicuci residu hingga filtrat netral
ditambahkan 500 ml larutan NaOH 17,5 %
3.4.3. Pembuatan Selulosa Suksinat
0,5 gram selulosa
dicampurkan dengan larutan asam suksinat sebanyak 1,5 gram dalam 8 mL aquadest
diaduk selama 30 menit menggunakan stirrer
dituang ke dalam cawan porselen
dikeringkan di dalam oven pada suhu 50oC selama 12 jam lalu suhu dinaikkan menjadi 120oC selama 12 jam
didinginkan
dicuci dengan aquadest hangat
dikeringkan di dalam oven pada suhu 50oC disimpan di dalam desikator
Selulosa Suksinat
3.4.4. Perlakuan dan Analisis Penyerapan Logam Cu2+ dengan Zat Hasil Sintesis
3.4.4.1. Penentuan Waktu Kontak Optimum
50 mL Larutan Standar Cu2+ 400 ppm
Filtrat
diatur pH hingga 3 dengan menambahkan HNO3 (p)
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada spesifik 324,8 nm.
Residu
dimasukkan ke dalam gelas Erlenmeyer ditambahkan 0,1 gram selulosa suksinat
diaduk dengan pengaduk magnet selama 30 menit
disaring dengan menggunakan kertas saring Whatman no. 42
λ
Hasil
3.4.4.2. Penyerapan Logam Cu2+ dengan Selulosa Suksinat dalam Larutan Standar
50 mL Larutan Standar Cu2+ 100 ppm
Filtrat
diatur pH hingga 3 dengan menambahkan HNO3 (p)
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada spesifik 324,8 nm.
Residu
dimasukkan ke dalam gelas Erlenmeyer
ditambahkan 0,1 gram selulosa suksinat
diaduk dengan pengaduk magnet selama 60 menit
disaring dengan menggunakan kertas saring Whatman no. 42
Hasil
λ
3.4.4.3. Penyerapan Logam Cu2+ dengan Selulosa dalam Larutan Standar
50 mL Larutan Standar Cu2+ 100 ppm
Filtrat
diatur pH hingga 3 dengan menambahkan HNO3 (p)
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada spesifik 324,8 nm.
Residu
dimasukkan ke dalam gelas Erlenmeyer
ditambahkan 0,1 gram selulosa
diaduk dengan pengaduk magnet selama 60 menit
disaring dengan menggunakan kertas saring Whatman no. 42
Hasil
λ
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Hasil Analisis Gugus Fungsi Menggunakan Spektrofotometer FT-IR
4.1.1.1. Hasil Analisis Spektrofotometer FT-IR Selulosa
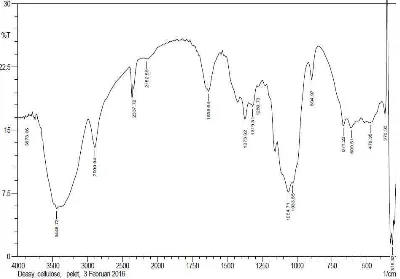
Selulosa yang digunakan dalam penelitian ini adalah α-selulosa 22% hasil isolasi dari 75 gram sabut buah pinang. Dari data spektroskopi FT-IR selulosa memberikan spektrum dengan puncak-puncak vibrasi pada daerah bilangan gelombang 3448 cm-1, 2900 cm-1, 2152 cm-1, 1373 cm-1, 1064 cm-1, 894 cm-1, 671 cm-1 (Gambar 4.1).
4.1.1.2. Hasil Analisis Spektrofotometer FT-IR Selulosa Suksinat
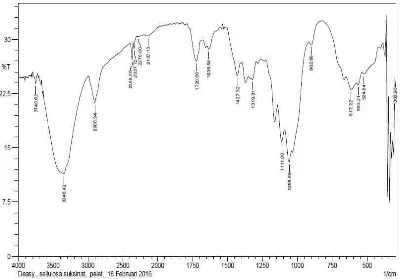
Selulosa suksinat sebanyak 0,4986 gram diperoleh dari reaksi esterifikasi 0,5 gram selulosa dengan 1,5 gram asam suksinat. Hasil yang diperoleh berupa selulosa suksinat berupa serat halus berwarna putih yang selanjutnya dianalisis menggunakan spektroskopi FT-IR, di mana memberikan spektrum puncak-puncak serapan pada bilangan gelombang 3348 cm-1, 2900, cm-1, 2137 cm-1, 1720 cm-1, 1635 cm-1, 1427 cm-1, 1319 cm-1, 1056 cm-1, 902 cm-1, 617 cm-1 (Gambar 4.2).
4.1.2. Hasil Analisis Morfologi Menggunakan SEM (ScanningElectron Microscopic)
4.1.2.1. Hasil Analisis Morfologi SEM dari Selulosa
Adapun hasil SEM dari selulosa dapat dilihat pada Gambar 4.3 berikut.
(a) (b)
(c)
4.1.2.2. Hasil Analisis Morfologi SEM dari Selulosa Suksinat
Adapun hasil SEM dari selulosa suksinat dapat dilihat pada Gambar 4.4 berikut.
(a) (b)
(c)
4.1.3. Hasil Analisis Adsorpsi Ion Logam Cu2+ Menggunakan SSA (Spektrofotometer Serapan Atom)
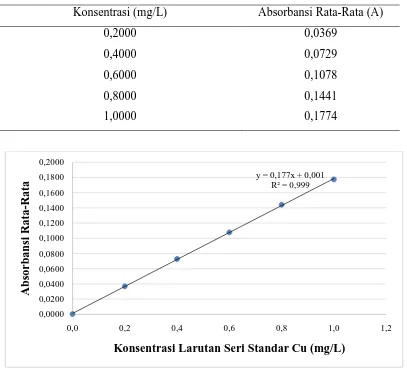
Dari hasil analisis menggunakan alat Spektrofotometer Serapan Atom diperoleh nilai adsorbansi seperti pada tabel 4.1.
Tabel 4.1. Data Adsorbansi Larutan Seri Standar Ion Tembaga (Cu2+)
Konsentrasi (mg/L) Absorbansi Rata-Rata (A)
0,2000 0,0369
0,4000 0,0729
0,6000 0,1078
0,8000 0,1441
1,0000 0,1774
Gambar 4.5. Kurva Kalibrasi Larutan Seri Standar Cu2+
y = 0,177x + 0,001
Dari kurva yang dihasilkan pada Gambar 4.5, diperoleh harga koefisien korelasi (R2) kurva kalibrasi di atas yakni sebesar 0,999 yang menunjukkan bahwa alat yang digunakan mempunyai respon yang sangat baik. Setelah didapat kurva kalibrasi, selanjutnya dilakukan analisis terhadap sampel (0,1 gram) hasil analisis adsorpsi dengan SSA.
4.1.3.1. Hasil Penentuan Waktu Kontak Optimum Adsorpsi Ion Logam Tembaga (Cu2+)
Dari hasil analisis menggunakan alat SSA diperoleh waktu kontak adsorpsi selulosa suksinat terhadap logam tembaga (Cu2+) seperti Tabel 4.2.
Tabel 4.2. Waktu Kontak Adsorpsi Ion Tembaga (Cu2+)
Waktu Kontak (menit) Konsentrasi Awal (ppm) Konsentrasi Akhir (ppm)
30 400 382,7541
60 400 350,1203
90 400 389,5026
120 400 363,8671
150 400 391,0790
4.1.3.2. Hasil Analisis Adsorpsi Selulosa Terhadap Ion Logam Tembaga (Cu2+)
Dari data SSA yang diperoleh hasil analisis selulosa terhadap ion tembaga (Cu2+) diuraikan pada Tabel 4.3berikut.
Tabel 4.3. Hasil Pengukuran Adsorpsi Selulosa dengan SSA No. Konsentrasi Awal
(ppm)
Absorbansi (A) Konsentrasi Akhir (ppm)
Berdasarkan data Tabel 4.3 menunjukkan bahwa penurunan kadar ion logam tembaga (Cu2+) optimum adalah 18,8989 %, sedangkan penurunan kadar ion logam tembaga (Cu2+) minimum adalah 5,7211 %.
4.1.3.3. Hasil Analisis Adsorpsi Selulosa Suksinat Terhadap Ion Cu2+
Dari data SSA yang diperoleh hasil analisis selulosa suksinat terhadap ion tembaga (Cu2+) diuraikan pada Tabel 4.4 berikut.
Tabel 4.4 Hasil Pengukuran Adsorpsi Selulosa Suksinat dengan SSA No. Konsentrasi Awal
Berdasarkan data Tabel 4.4 menunjukkan bahwa penurunan kadar ion logam tembaga (Cu2+) optimum adalah 30,3805 %, sedangkan penurunan kadar ion logam tembaga (Cu2+) minimum adalah 8,0408 %.
4.2. Pembahasan
4.2.1. Analisis Menggunakan Spektrofotometer FT-IR
Spektroskopi FT-IR merupakan suatu teknik analisis yang dilakukan untuk mengetahui gugus fungsi dari suatu molekul dalam suatu sampel.Analisis gugus fungsi dengan FT-IR telah dilakukan dengan menggunakan alat Agilent Technologies. Sampel yang dianalisis yaitu selulosa hasil isolasi dari sabut buah pinang, dan selulosa suksinat hasil sintesis.
4.2.1.1. Analisis Selulosa dengan Spektrofotometer FT-IR
Selulosa yang dianalisis diperoleh dari hasil isolasi sabut buah pinang sebanyak 75 gram melalui beberapa tahap sesuai metode penelitian sebelumnya. Tahap pertama adalah prehidrolisis menggunakan HNO3 3,5% untuk menghilangkan hemiselulosa
dan zat ekstraktif lainnya. Tahap kedua adalah delignifikasi menggunakan NaOH 2% karena dapat merusak struktur lignin dan menyebabkan penggembungan struktur selulosa. Selanjutnya pemutihan menggunakan campuran buffer asetat dan NaOCl yang akan melarutkan sisa lignin karena terdegradasi menjadi lignin rantai pendek yang mudah larut pada saat dicuci. Kemudian dilakukan penghilangan β-selulosa dan γ-selulosa dengan melarutkan residu dalam NaOH 17,5 karena hanya α-selulosa yang tidak larut dalam larutan ini. Sehingga diperoleh α-selulosa dilakukan pemucatan terlebih dahulu menggunakan H2O2 10%.Pemucatan ini dilakukan
karena α-selulosa yang diperoleh berwarna putih kekuningan.Sehingga adanya H2O2akan menghilangkan pigmen yang melekat pada selulosa.
bilangan gelombang 3348 cm-1 serta didukung oleh puncak serapan pada bilangan gelombang 1064 cm-1yang menunjukkan vibrasi dari gugus C-O simetris dan puncak serapan pada bilangan gelombang 1373 cm-1 menunjukkan vibrasi C-O anti-simetris. Puncak vibrasi pada bilangan gelombang 2900 cm-1 merupakan vibrasi stretching C-H yang didukung oleh vibrasi C-C-H bending pada bilangan gelombang 671 cm-1. Munculnya puncak vibrasi pada bilangan gelombang 2152 cm-1 menunjukkan vibrasi C-C stretching dan didukung dengan bilangan gelombang 894 cm-1 yang merupakan C-C bending.
4.2.1.2. Analisis Selulosa Suksinatdengan Spektrofotometer FT-IR
Pembuatan selulosa suksinat berdasarkan metode yang telah dimodifikasi dari Marshall (Marshallet al.,1999).Selulosa suksinat merupakan hasil reaksi antara selulosa dengan asam suksinat yang dicampurkan dalam aquadest.Kemudian diaduk dan dituangkan kedalam cawan porselen untuk dikeringkan di dalam oven selama 50oC selama 12 jam untuk menghomogenkan campuran,lalu suhu dinaikkan menjadi 120oC selama 12 jam agar terjadi reaksi termokimia. Kemudian diangkat dari oven dan dibiarkan hingga dingin serta dicuci dengan 200 mL aquadest hangat.Terakhir, dikeringkan di dalam oven pada suhu 50oC dan disimpan di dalam desikator.
Puncak serapan pada bilangan gelombang 3348 cm-1 menunjukkan vibrasi OH dari selulosa.Puncak vibrasi pada bilangan gelombang 2900 cm-1 merupakan vibrasi stretching C-H yang didukung oleh vibrasi C-H bending pada bilangan gelombang 617 cm-1, serta munculnya puncak vibrasi pada bilangan gelombang 2137 cm-1 menunjukkan vibrasi C-C stretching dan didukung dengan bilangan gelombang 902 cm-1 yang merupakan C-C bending. Puncak serapan pada bilangan gelombang 1427 cm-1 menunjukkan vibrasi gugus metilena (-CH2-) dari penambahan asam
suksinat.
O
4.2.2. Analisis Morfologi dengan SEM (Scanning Electron Microscopic)
Analisis SEM dilakukan untuk melihat morfologi dari senyawa hasil modifikasi selulosa yang diperoleh. Informasi dari analisis ini akan menunjukkan gambaran bahwa terjadi perubahan yang menandakan selulosa telah berinteraksi dengan asam suksinat yang membuat morfologi pemukaannya terlihat semakin besar. Dalam penelitian ini uji SEM dilakukan pada selulosa dan selulosa suksinat dengan perbesaran gambar mencakup 100x, 250x, dan 500x.
4.2.2.1. Analisis MorfologiSEM dari Selulosa
Adapun hasil SEM dari Selulosa dari Gambar 4.3, menunjukkan morfologi permukaan sebelum dimodifikasi. Permukaan pada perbesaran 100x, 250x, dan 500x tampak serat lebih halus dan memiliki pemukaan serat yang kecil.
4.2.2.2. Analisis Morfologi SEM dari Selulosa Suksinat
Adapun hasil SEM dari selulosa suksinatdari Gambar 4.4, menunjukkan telah terjadi perubahan morfologi permukaan. Permukaan pada perbesaran 100x, 250x, dan 500x tampak serat lebih kasar, dan memiliki pemukaan seat yang lebih besar dari pada selulosa. Ini menunjukkan perubahan morfologi yang mendukung telah terjadi interaksi antara gugus hidroksil (OH) dari selulosa dan gugus karboksil dari asam suksinat.
4.2.3. Penentuan Derajat Substitusi (DS)
cm-1 dan 3348 cm-1 masing-masing adalah 26,948 dan 11,347 yang dapat dilihat pada Gambar 4.2. Perhitungan nilai derajat subtitusinya dapat dihitung berdasarkan persamaan berikut ini :
DS (%) =
��
�1720�3348
� −
0,10
�
x 100
(Samios,et.al., 1997) Absorbansi pada bilangan gelombang 1720 cm-1 (A1720)
%T = 26,948
Absorbansi pada bilangan gelombang 3348 cm-1 (A11,347)
%T = 11,347
Derajat Subtitusi (%) = ��A1720
A11,347� − 0,10� x 100
=��0,5696
0,9453� − 0,10� x 100
= 50,25%
Derajat subtitusi sebesar 50,25% menunjukkan bahwa hanya 50,25% asam suksinat yang tersubtitusi ke gugus OH dari selulosa sedangkan selebihnya sekitar 49,75% masih berupa selulosa yang tidak bereaksi.
4.2.4. Analisis Adsorpsi Ion Logam Cu2+ Menggunakan SSA (Spektrofotometer Serapan Atom)
Gambar 4.7. Kurva daya serap selulosa
Sementara itu,dari data hasil analisis adsorpsi selulosa suksinat terhadap ion tembaga (Cu2+) diperoleh kurva daya serap selulosa suksinat seperti pada Gambar 4.8 berikut.
Gambar 4.8. Kurva daya serap selulosa suksinat
0
Konsentrasi Ion Cu2+
0
Berdasarkan kedua kurva yang ditunjukkan sebelumnya menyatakanbahwa adanya modifikasi terhadap selulosa jelas mempengaruhi kemampuan serapannya terhadap ion logam Cu2+. Ester selulosa suksinat memiliki selulosa sebagai komponen penyusun utamanya. Dimana selulosa merupakan jaringan berserat dalam tumbuhan. Dan tersusun atas rantai-rantai panjang yang terikat satu sama lain sehingga membentuk struktur seperti fibrilsehingga mampu menyerap ion logam secara fisika. Adanya modifikasi pada selulosa menjadikannya lebih reaktif karena memiliki gugus fungsi yang lebih banyak dari selulosa itu sendiri.
Kemampuan selulosa sebagai adsorben disebabkan karena adanya interaksi gugus aktif gugus hidroksil (O-H) terhadap ion logam Cu2+. Gugus ini akan mengikat ion logam Cu2+ melalui ikatan kovalen . Bertambahnya gugus karbonil dan hidroksil dari penambahan asam suksinat menyebabkan selulosa suksinat mempunyai reaktifitas kimia yang lebih tinggi dari selulosa.Dari kurva pada Gambar 4.8 dapat dilihat bahwa terjadi penurunan serapan terhadap ion logam Cu2+ pada konsentrasi 200 ppm hingga 500 ppm sedangkan pada konsentrasi 100 ppm mengalami peningkatan. Ini disebabkan jumlah adsorben yang digunakan sudah optimum pada konsentrasi 100 ppm dan interaksi antara adsorben dan adsorbat yang kuat sehingga menyebabkan ion logam tertahan pada permukaan adsorben. Sementara pada konsentrasi 200 ppm hingga 500 ppm sudah melewati batas optimum sehingga menurunkan interaksi antara adsorben dan adsorbat yang menyebabkan ion logam terlepas dari permukaan adsorben.
Selain itu pada konsentrasi 300 ppm mengalami peningkatan kembali dikarenakan konsentrasi ion logam yang besar melebihi konsentrasi optimum.Dimana konsentrasi 100 ppm dan 200 ppm merupakan batas optimum terjadinya interaksi antara adsorben dengan adsorbat sehingga ketika melewati batas optimumnya terjadi peningkatan dan penurunan yang tidak stabil.
O
Gambar 4.9 Pembentukan ikatan kovalen koordinasiion tembaga dengan selulosa(Bezerra, et.al., 2015)
Dari gambar 4.9 dapat diketahui bahwa ikatan yang terjadi antara selulosa dengan logam tembaga adalah ikatan kovalen koordinasi, dimana lone pairelektron pada atom O dari selulosa dipindahkan ke orbital d yang kosong pada ion Cu2+ membentuk ikatan kovalen koordinasi yang baru. Gugus hidroksil dari selulosa sebagai ligan (basa lewis), sementara logam transisi tembaga sebagai aseptor (asam lewis).
Adapun reaksi pengikatan ion timbal dengan selulosa suksinat dapat dilihat pada Gambar 4.10.
O
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Esterifikasi sebanyak 0,5 gram selulosa dengan asam suksinat menghasilkan 0,4986 gram selulosa suksinat berbentuk serat dan berwarna putih pucat, yang dalam penelitian ini memberikan karakteristik :
a. Pada analisis gugus fungsi menggunakan FT-IR memunculkan pita serapan yang kuat pada daerah bilangan gelombang 3348 cm-1 menunjukkan adanya vibrasi stretching O-H, dan didukung oleh vibrasi gugus karbonil (C=O) pada daerah bilangan gelombang 1720 cm-1. b. Pada analisis morfologi permukaan menggunakan SEM menunjukkan
bahwa permukaan selulosa suksinat serat lebih kasar dan memiliki morfologi permukaan yang lebih besar menandakan selulosa dan asam suksinat telah bereaksi.
2. Hasil analisis adsorpsi terhadap ion logam Cu2+ menggunakan SSA menunjukkan bahwa serapan optimum dengan waktu kontak 60 menit terdapat pada konsentrasi 100 ppm, di mana selulosa suksinat memiliki serapan sebesar 30,3805 % dan selulosa sebesar 18,8989 %.
5.2. Saran
1. Disarankan untuk penelitian selanjutnya meneliti kekuatan serapan selulosa termodifikasi yang dihasilkan dengan variasi ion logam yang berbeda. 2. Disarankan untuk penelitian selanjutnya meneliti ester selulosa dari sabut
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Pinang
Tumbuhan pinang (Areca catechu L.) adalah salah satu jenis palma atau palem yang tumbuh dan tersebar luas di wilayah India, Malaysia, Taiwan, Indonesia, dan negara Asia lainnya, baik secara individu maupun populasi serta memiliki banyak kegunaan antara lain untuk dikonsumsi, bahan industri kosmetik, kesehatan, dan bahan pewarna pada industri tekstil (Jaiswal, et.al., 2011). Diantara semua bahan serat alam, pinang merupakan suatu bahan yang menjanjikan karena tidak mahal, secara bebas tersedia, dan berpotensi sebagai tanaman tahunan yang sangat tinggi (Rajan, et.al., 2005).
Berbeda dengan jenis palem lainnya yang memiliki famili Arecaceae seperti palem merah, salak, sagu, palem raja dan sebagainy meski ada pula yang lebih besarsepertipada gambar 2.1.Pelepah tabung dengan ujung sobek dan bergerigi.Tongkol yang panjang dan mudah ront jinggadengan dinding buah yang berserabut seperti pada gambar 2.2.
Adapun klasifikasi ilmiah dari pinang menurut Cronquist (1981), sebagai berikut :
Kingdom :Plantae
Division : Magnoliophyta
Classis : Liliopsida
Ordo : Arecales
Family : Arecaceae
Genus : Areca
Species : Areca catechu L.
Pinang mudah tumbuh di daerah tropis dan biasa ditanam di pekarangan, taman, atau dibudidayakan karena memiliki banyak kegunaan mulai dari batang, biji, sabut, daun, hingga pelepahnya. Bijinya dikenal sebagai salah satu campuran orang makan sebagai pembungkus kue-kue dan makanan. Batangnya kerap diperjual belikan sedangkan batang pinang tua yang dibelah dan dibuang tengahnya digunakan untuk membuat talang atau saluran air.
Gambar 2.3.Foto Sabut Buah Pinang
Penelitian terdahulu menemukan bahwa sabut buah pinang dapat digunakan sebagai komposit serat alam yang dipakai dalam pabrik pembuat badan mobil (Chikkol, et.al., 2010). Pada tahun 2015, Lukita memanfaatkan ekstrak etanol sabut buah pinang menjadi selulosa mikrokistal sebagai bahan tambahan dalam tablet antidiare.
2.2. Selulosa
Selulosa adalah salah satu biopolimer yaitu polimer karbohidrat yang tersusun atasD-glukopiranosa berikatan β(1→4) dengan jumlah berlimpah di alam serta bersifat dapat diperbaharui, mudah terurai, tidak beracun. Senyawa ini berbentuk seperti serabut, liat, tidak larut dalam air dan ditemukan didalam dinding sel pelindung tumbuhan, terutama pada tangkai, batang, dahan dan semua bagian berkayu dari jaringan tumbuhan.Strukturnya terdiri dari tiga gugus hidroksi per anhidroglukosa menjadikan selulosa memiliki derajat fungsionalitas yang tinggi.Sebagai materi yang diperbaharui, selulosa dan turunannya dapat dipelajari dengan baik (Coffey,et.al., 1995).
Polimer ini memiliki struktur molekul yang memperlihatkan unit selobiosa sebagai penyusun ulang serta unitglukopiranosa yang berotasi 180o yang berkaitan satu sama lain (Haworth, 1932). Setiap penyusun glukopiranosa memiliki tiga gugus hidroksil (OH) pada posisi C-2, C-3 dan C-6. Monomer glukopiranosanya dihubungkan sau sama lain dengan ekuatoial-ekuatorial. Strukturnya seperti pada gambar 2.4.
Gambar 2.4. Struktur selulosa (Fesenden, 1986)
Untuk esterifikasi, gugus hidroksil primer (HO-6) memiliki reaktifitas yang lebih tinggi sedangkan untuk eterifikasi, gugus hidroksil sekunder (HO-2) biasanya paling mudah bereterifikasi. Aksesibilitas berarti kemudahan relatif gugus-gugus hidroksil untuk dicapai oleh pereaksi-pereaksi gugus (HO-6) reaktifitasnya lebih tinggi terhadap substituen-substituen yang besar dari pada gugus-gugus hidroksil yang lain karena paling sedikit halangan steriknya (Fengel, et.al., 1995).
Berbeda dengan hemiselulosa, selulosa dapat bersifat kristalin maupun amorf, sukar larut dalam alkali, dan menghasilkan D-glukosa jika dihidrolisis.Sementara hemiselulosa yang terdiri dari berbagai unit gula bersifat amorf, bukan merupakan serat panjang, mudah larut dalam alkali tapi sukar larut dalam asam dan menghasilkan D-xilosis jika dihidrolisis (Sitorus, 2010).
hemiselulosa dalam bahan baku pada waktu pemasakan (cooking) menggunakan air lunak (soft water) atau larutan asam encer (Tarmansyah, 2007).
Tahap delignifikasi dilakukan dengan larutan NaOH, karena larutan ini dapat menyerang dan merusak struktur lignin, bagian kristalin dan amorf, memisahkan lignin serta menyebabkan penggembungan struktur selulosa (Enari, 1983). Proses pemutihan bertujuan untuk melarutkan sisa senyawa lignin yang dapat menyebabkan perubahan warna, dengan cara mendegradasi rantai lignin yang panjang oleh bahan-bahan kimia pemutih menjadi rantai-rantai lignin yang pendek, maka lignin dapat larut pada saat pencucian dalam air atau alkali (Fengel, et.al., 1995). NaOCl secara tradisional digunakan untuk memutihkan warna dari suatu zat.
Selanjutnya adalah proses penghilangan β-selulosa dan γ-selulosa dengan menggunakan larutan NaOH 17,5%. Hal ini sesuai dengan pembagian selulosa berdasarkan derajat polimerisasi (DP) dan kelarutan dalam senyawa natrium hidroksida (NaOH) 17,5% (Tarmansyah, 2007) yaitu :
a. α-selulosa adalah selulosa berantai panjang, tidak larut dalam larutan NaOH 17,5% atau larutan basa kuat dengan DP 600-1500
b. β-selulosa adalah selulosa berantai pendek, larut dalam larutan NaOH 17,5% ataubasa kuat dengan DP 15 – 90, dapat mengendap bila dinetralkan.
c. γ-selulosasama dengan beta selulosa, tetapi DP nya kurang dari 15.
Proses selanjutnya adalah pemutihanmenggunakanhidrogen peroksida karena merupakan pemutihyang ramah lingkungan. Di samping itu, hidrogen peroksida juga mempunyai beberapa kelebihan antara lain bahan yang diputihkan mempunyai ketahanan yang tinggi serta penurunan kekuatan serat sangat kecil. Pada kondisi asam, hidrogen peroksida sangat stabil.Peruraian hidrogen peroksida juga dipercepat oleh naiknya suhu.Zat reaktif dalam sistem pemutihan dengan hidrogen peroksida dalam suasana basa adalah perhidroksil anion (HOO-) (Dence, et.al., 1996).
pelarut organik.Hal ini berdasarkan ikatan hidrogen yang kuat antara molekul selulosa berantai lurus.Sehingga kelarutan dari selulosa dapat diperbaiki dengan turunan yang dimodifikasi.
Serat selulosa secara umum memiliki banyak gugus fungsi yang mampu mengikat logam.Karena itu banyak yang sudah mencoba untuk menggunakan selulosa sebagai pembersih logam melalui beberpa turunannya.Beberapa di antaranya berdasarkan penambahan gugus dengan kemampuan mengkompleks seperti gugus karboksilat dan amin.Seperti halnya kitosan dan juga alginate maka selulosa ini juga memiliki kemampuan untuk membentuk kompleks dengan unsur logam yang memiliki d-orbital back donation, serta sekaliguas adanya ether linkage C1 –C4 yang ekuatorial-ekuatorial (Kaban dkk,2005).Konsep pembentukan kompleks ini dapat digunakan juga untuk menjelaskan terjadinya penyerapan terhadap logam berat seperti khrom, kobalt, nikel, seng, kadmium dan tembaga.
Selulosa dapat berinteraksi dengan logam berat melalui mekanisme penukar ion yaitu dengan gugus –OH sementara itu juga memungkinkan untuk mekanisme pembentukan kompleks karena atom oksigen pada gugus –OH memiliki elektron bebas (Mohamad, 2012).
2.3. Asam Suksinat
Asam suksinat (asam butadenoat, 1,2-asam etana dikarboksilat) merupakan suatu asam dikarboksilat dengan rumus kimia (CH2)2(COOH)2yang sangat berpotensial
sebagai suatu metabolisme perantara.Secara fisik larut dalam air, etanol, eter dan gliserin.
Senyawa ini dominan dihasilkan dari hidrokarbon empat karbon melalui anhidrida maleat, memanfaatkan fraksi nafta n-butana yang diawali dengan hidrogenasi diikuti oleh hidrasi di sekitar berat total 15.000 ton per tahun dan merupakan salah satu fermentasi produk akhir metabolisme anaerobik.Struktur asam suksinat adalah seperti gambar 2.5 berikut.
O
OH O
HO
Gambar 2.5.Struktur Kimia Asam Suksinat atau Asam Butadenoat (O’neil,et.al., 2001)
Karena memiliki nilai kimia cukup tinggi, senyawa ini termasuk kunci dalam memproduksi lebih dari 30 produk komersial penting seperti asam adipat.Aplikasi dalam industri seperti makanan, obat-obatan, polimer, cat, kosmetik, dan tinta.Hal ini juga digunakan sebagai surfaktan, deterjen extender, anti busa, dan
ion-chelator.
2.4. Ester Selulosa
Selulosa dapat secara kimia dimodifikasi menghasilkan turunan yang secara luas dipergunakan pada berbagai sektor industri termasuk aplikasi konvensional. Seperti salah satu contohnya, pada tahun 2003, 3,2 juta ton bahan ini digunakan sebagai material mentah untuk produksi serat dan film regenerasi termasuk turunannya (Klemm, 2005). Pembentukan ester selulosa melalui proses esterifikasi terhadap gugus hidroksi alkohol, yang umum menggunakan asam klorida atau asam anhidrat lainnya sebagai agen yang meningkatkan derajat esterifikasi secara signifikan. Beberapa contoh senyawa turunan dari ester selulosa adalah seperti gambar 2.7..
O
Gambar 2.7. Struktur (a) selulosa-asetat, (b) selulosa-butirat, (c) selulosa benzoat, (d) selulosa ftalat, dan (e) selulosa antranilat (Granstrom, 2009).
intermediateanhidrat, yang dianggap lebih efektif dalam esterifikasi daripada asam
karboksilat bebas.
Pada tahun 1996, Yang dan Wang mengklaim bahwa hanya asam karboksilat yang membentuk siklik intermediet anhidrida ester selulosa. Pendapat lain menyatakan bahwa kelompok karboksil dapat diesterifikasi selulosa tanpa intermediet anhidrat (Gagliardi, et.al., 1963). Hal ini berakhir setelah teori asam dikarboksilat terakhir, karena asam dikarboksilat hanya memiliki kemampuan untuk membentuk satu anhidrat siklik.
2.4.1. Ester Selulosa Melalui Asilasi
Asilasi selulosa dapat dibuat dalam keadaan homogen maupun heterogen. Pada kondisi heterogen, gugus hidroksil dari unit anhidroglukosa memiliki pencapaian yang rendah dan reaksinya dapat terjadi pada permukaan selulosa (Freire,et.al., 2006). Dalam medium homogen, tiga gugus hidroksil dari unit anhidroglukosa semuanya tercapai oleh bahan asetilasi, dimana dapat memperoleh suatu derajat substitusi yang lebih tinggi dan suatu distribusi seragam dari gugus fungsi yang dimiliki rantai polimer (Nagel ,et.al., 2010).
2.4.1.1. Ester Selulosa menggunakan Asam Karboksilat Alifatis Rantai Panjang
Hanya sedikit publikasi dari asilasi selulosa dengan asam karboksilat alifatis rantai panjang (misalnya asam lemak) dalam media rekasi larutan ionik yang sudah pernah dipublikasikan. Hal ini kemungkinan dikarenakan kelarutan yang rendah dari turunan asam alifatis berantai panjang dalam beberapa larutan ionik pada kelarutan heterogen. Reaksi dengan asam lemak sebagai reagen asilasi dalam larutan ini harus disesuaikan dengan sistem LiCl.
2.4.1.2 Ester Selulosa menggunakan Asam Karboksilat lainnya
Beberapa asilasi yang sudah sukses terjadi dengan hasil derajat subtitusi yang tinggi diantaranya menggunakan klorida asam, klorida pentanoil, klorida heksanoil dan klorida benzoil. Dalam hal ini, katalis piridin sangatlah membantu mengefisiensikan proses asilasi. Selain reagen di atas, ftalat anhidrat dan suksinat anhidrat juga dapat digunakan dalam asilasi.
Selulosa ftalat merupakan suatu material berpotensi yang dapat di degradasi untuk penyerapan logam berat dari pembuangan alternatif air dikarenakan kemampuannya sebagai pengkhelat logam. Strukturnya seperti pada gambar 2.7(c) . Ftalat aseto selulosa sudah digunakan dalam industri farmasi sebagai pembungkus tablet dan kapsul.
Sementara itu asam suksinat akan membentuk anhidrat sebagai
intermediateketika terjadi pemanasan dan kemudian bereaksi dengan selulosa.
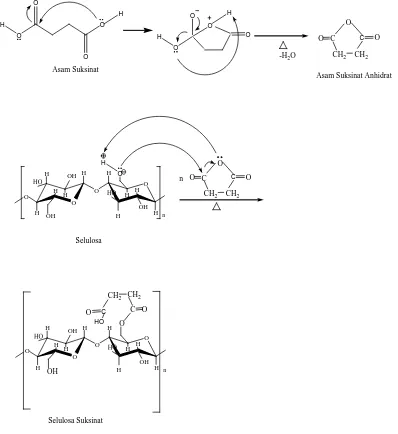
Reaksi asilasi menggunakan anhidrat dari asam maleat, ptalat dan suksinat dapat dilihat seperti pada gambar 2.8.Asilasi dapat berlangsung dengan adanya pemanasan dimana diperlukan pelarut yang sesuai.
O
Gambar 2.8. Reaksi asilasi selulosa menggunakan : a) Anhidrat Asam Maleat, b) Anhidrat Asam Suksinat dan c) Anhidrat Asam Ptalat (Bezerra,et.al., 2015).
yang menarik ditinjau dari kemampuannya untuk membentuk membran pertahanan pada gambar 2.9.Reaksinya menggunakan dua jalur 1-butil-3-metilimidazolium klorida. Pada jalur pertama selulosa bereaksi dengan klorida 2-furoil dalam piridin, dimana pada jalur kedua asam karboksilat 2-furan diaktivasi dengan N,N’-karbonildiimidiazole (Köhler , et.al., 2007).
O
Gambar 2.9.a) Struktur furoat selulosa, b) Ikat silang furoat selulosa untuk membentuk membran (Granstrom, 2009).
menggunakan asam asetat anhidrat atau asetat klorida sebagai reagen (Bogan,et.al., 1979). Selulosa asetat merupakan salah satu turunan selulosa yang sangat penting karena aplikasinya yang menjanjikan pada industri tekstil, film plastik, pembungkusan dan penyaring rokok.Meskipun penelitian asetilasi selulosa dipublikasikan pada tahun 1950.
Selulosa dapat diasetilasi secara langsung melalui esterifikasi gugus hidroksil atau transesterifikasi, menggunakan substituen primer sebagai gugus pergi.Asam asetat tidak cukup baik untuk mengesterkan selulosa, namun dapat didukung dengan penambahan asam yang lebih reaktif seperti asam asetat anhidrat.Asetilasi selulosa berlangsung dalam reaksi setimbang, namun adanya air berlebih dapat menimbulkan terjadinya deasetilasi dan juga dipengaruhi hadirnya asam dari katalis. Pada proses asetilasi, selulosa yang telah diaktivasi umumnya direaksikan dengan asetat anhidrat berlebih (Klemm,et.al., 1998).
Secara umum, asetat selulosa yang direaksikan dengan asetatanhidridaberlebih menggunakan asam sulfat atau asam perklorat sebagai katalis. Karena sifat reaksi yang heterogen sehingga mustahil untuk menghasilkan asetat selulosa sebagian secara langsung.Cairan ionik sudah ditemukan bukan hanya sebagai pelarut tetapi juga sebagai katalis basa dalam reaksi asetilasi. Kebalikannya, asetilasi selulosa dalam cairan ionik dapat dikendalikan untuk menghasilkan turunan dari nilai DS yang bervariasi.
N
Gambar 2.10. Mekanisme reaksi asetilasi suatu alkohol menggunakan katalis piridin (Granstrom, 2009)
2.4.2. Ester Selulosa Melalui Sulfonasi
Pelajaran sebelumnya pada sulfonasi selulosa sudah dilakukan dalam sistem heterogen dimulai dengan suatu aktivasi suspensi selulosa, atau dalam sistem homogen dimulai dengan suatu substitusi parsial turunan selulosa dalam larutan.Permasalahan pada sistem heterogen sudah digambarkan dan pada kebalikannya, nilai derajat subtitusi dalam reaksi homogen yang terbatas dengan adanya gugus hidroksil sebagai permulaan reaksi dengan turunan yang tersubtitusi.
Sulfonasi dari selulosa dalam 1-butil-3-metilimidazolium klorida yang terjadi menggunakan kompleks dimetilformamida sulfutrioksida (DMF-SO3) sebagai
suatu agen sulfonasi dihasilkan dari asam klorosulfonik (ClSO3H).Kompleks yang
direaksikan dengan selulosa dalam larutan 1-butil-3-metilimidazolium klorida pada 30oC selama 1 sampai 2 jam. Suatu selulosa yang sudah dikeringkan direaksikan dengan larutan dimetilformamidadari asam sulfamik pada suhu 80oC dengan reaksi sebagai berikut (Huang, et.al., 2010).
Selulosa-OH + NH2SO3H → Selulosa-O-SO3+NH3-
2.4.3. Ester Selulosa Melalui Karbanilasi
HN
Gambar 2.11. Struktur selulosa karbanilat (Granstrom, 2009)
2.5. Logam Tembaga (Cu)
Tembaga adalah suatu lambang Cu dan
dari bahasa latin yaitu cuprum. Massa jenisnya 8.94
g· cm−3.Tembaga merupaka
1084.62 °C dan titik didihnya 2562 °C.Selain itu sekali.Tembaga murni sifatnya halus dan lunak, dengan permukaan berwarna jingga kemerahan.Tembaga dicampurkan denga
Ion tembaga (II) dapat berlarut ke dalam air, di mana fungsi mereka dalam konsentrasi tinggi adalah sebagai kayu. Dalam konsentrasi tinggi maka tembaga akan bersifat racun, tapi dalam jumlah sedikit tembaga merupakan tanaman tingkat rendah.
Logam inisering ditemukan dalam limbah industri dan tidak dapat terdegradasi secara alamiah, selain itu tersebarnya logam ini di atas ambangbatas yang diizinkan akan menimbulkankeracunan pada manusia dan dapatmenyebabkan kematian. Oleh karena itu,diperlukan usaha-usaha yang serius untukmenanggulangi masalah pencemaran agarkonsentrasi Cu dalam air limbah dalam batasaman.Usaha-usaha pengendalian danpengolahan limbah logam belakangan inisemakin berkembang, yang mengarah padaupaya-upaya pencarian metode-metode baruyang murah, efektif, dan efisien.
Dewasa ini dikembangkan metode penyerapan tembaga menggunakan interaksi dengan adsorben seperti selulosa.Penyerapan ini selalu bergantung pada jenis ion logam yang hadir, dimana ikatannya dapat terjadi melalui penukar ion misalnya ion kalsium atau melalui penukaran ligan misalnya logam berat. Jenis kation logam yang masuk dan dipilih akan menentukan mekanisme reaksi yang terjadi dan kemampuan mengikat dari selulosa melalui reaksi penukaran ligan sehingga memungkinkan kadar ion logam yang masuk akan meningkat sampai level tertinggi misalnya tembaga dalam 5000 mg/kg serat selulosa (Kottelnikova, et.al., 2007).
Untuk logam berat dengan d-orbital back donation seperti kalsium, magnesium, nikel, tembaga, timbal dan sebagainya maka memiliki kemampuan mekanisme interaksi elektrostatis (penukaran ion) dengan turunan selulosa seperti misalnya adanya gugus karboksil. Dengan kata lain, selulosa maupun turunannya bertindak sebagai ligan dalam larutan dan logam tembaga sebagai atom pusat (Bahar,
dimana pasangan elektron bebas dari O pada OH akan berikatan dengan logam Cu2+ dalam ikatan kovalen koordinasi sehingga orbital d menjadi terisi penuh.
2.6. Adsorpsi
Akumulasi partikel pada permukaan zat padat disebut adsorpsi atau penjerapan.Zat yang mengadsorpsi disebut adsorben dan material yang dijerap disebut adsorbat atau substrat. Proses adsorpsi terdiri atas dua jenis, yaitu adsorpsi kimia (kemisorpsi) dan fisika (fisisorpsi). Pada adsorpsi kimia, suatu molekul menempel ke permukaan melalui pembentukan ikatan kimia.Sementara itu dalam adsorpsi fisika, adsorbat menempel pada permukaan melalui interaksi antarmolekul yang lemah (ikatan van der Waals).
Faktor-faktor yang memengaruhi proses adsorpsi antara lain sifat fisik dan kimia adsorben seperti luas permukaan, ukuran partikel, dan komposisi kimia. Adsorpsi merupakan metode yang paling umum dipakai karena memiliki beberapa kelebihan diantaranya adalah prosesnya relatif sederhana, efektifitas dan efesiensinya relatif tinggi serta tidak memberikan efek samping berupa zat beracun dan juga ekonomis (Volesky, et.al.,2005). Proses adsorpsi yang paling berperan adalah adsorben.
adsorben melalui pengikatan gugus-gugus pembentuk kompleks dengan logam seperti ester, amina, polietilamin (Kim.dkk., 2006).
Salah satu contoh adsorben organik adalah selulosa dan turunannya.Modifikasi turunan selulosa cukup dalam penyerapan dari berbagai penyebab kontaminasi air. Sebagai contoh modifikasi dengan maleat anhidrat efektif mengadsorpsi logam divalensi seperti Co2+ dan Ni2+ dimana mekanisme adsorpsinya adalah pembentukan kompleks di antara pusat dasar dari gugus karboksil dan kation divalensi seperti pada gambar 2.12. Pada reaksinya menunjukkan suatu
counter-ionmenetralisasi muatan kation bebas sehingga kation dapat berekasi dengan gugus
karboksil atau dua pusat dasar yang berbeda.
O
Gambar 2.12 Pembentukan kompleks selulosa maleat dengan logam divalensi (Bezerra et al., 2015)
Kehadiran gugus karboksilat dalam bahan alam berarti secara signifikan menaikkan penyerapan.Untuk memfasilitasi pembentukan kompleks ini maka pH harus diminimumkan. Dengan kata lain, pengaruh pH mendeprotonasi gugus karboksil, suatu keadaan dimana akan mampu membentuk ikatan kovalen dan secara langsung kapasitas serapan pada logam akan meningkat.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Selulosa merupakan polisakarida yang berbentuk padatan, tidak berasa, tidak berbau dan terdiri dari 2000-4000 unit glukosa yang dihubungkan oleh ikatan β-1,4 glikosidik dan ditemukan pada tahun 1838 oleh Payen yang diperoleh dari hasil isolasi tanaman dan ditemukan rumus kimianya (C6H10O5)n (Oyeniyi, et.al., 2011).
Senyawa ini diisolasi dari dinding sel tanaman, bahan berkayu, rambut biji, kulit pohon, dan tanaman laut namun memerlukan proses yang panjang untuk menghilangkan hemiselulosa dan lignin yang tercampur dalam bahan baku tersebut (Bhimte, et.al., 2007). Selain dapat diperbaharui, dapat didegradasi, selulosa juga dapat dimodifikasi, sehingga memiliki potensi yang lebih besar untuk digunakan sebagai material industri (Richardson, et.al., 2003).
Pinang merupakan salah satu sumber daya alam yang berlignoselulosa. Bagian tumbuhan ini yang mengandung alfa selulosa paling banyak adalah sabut buahnya dengan kadar sekitar 53,2%. Mengingat bahwa saat ini pemanfaatan sabut pinang secara langsung sangat sedikit, sehingga perlu ada inovasi untuk memanfaatkan sabut pinang (Bethnova, 2012). Oleh karena kadar selulosanya yang tinggi sehingga Lukita pada tahun 2015 memanfaatkan selulosa mikrokristal dari sabut buah pinang sebagai bahan tambahan dalam pembuatan tablet.
dua gugus asam seperti asam maleat dan asam suksinat dapat digunakan (Welch,
et.al., 1989).
Asam suksinat merupakan salah satu asam karboksilat yang dapat membentuk anhidrida siklik yang tidak menghasilkan produk sampingan ketika digunakan untuk pembuatan ester selulosa. Faktanya adalah bahwa jumlah gugus asam saat dikeringkan akan mengaktivasi bahan sehingga meningkatkan muatannya. Penelitian terakhir menunjukkan bahwa modifikasi selulosa (seperti kapas, biji kacang, biji kapas, jerami beras, jerami kacang) sudah ditinjau untuk penghilangan logam berat dari larutan (Dronnet, et.al., 1998).
Kehadiran logam berat dalam lingkungan menjadi masalah yang cukup serius, mengingat jumlah penggunaannya yang semakin meningkat, bersifat toksik, serta dapat masuk ke badan air yang dapat mempengaruhi kualitas air berat yang terdapat dalam air mudah terserap dalam fitoplankton yang merupakan titik awal dari rantai makanan dan selanjutnya akan sampai ke organisme lainnya termasuk manusia (Purnomo, 2007).
Toksikan yang sangat berbahaya umumnya berasal dari buangan industri, terutama sekali kimia (produk dari industri pestisida) dan industri yang melibatkan logam berat (contohnya Cu, Cd, Pb, Fe, dan Zn) dalam proses produksinya (Palar, 2008). Leandro et al (2008) menggunakan modifikasi suksinat anhidrat pada ampas tebu untuk mengadsorpsi logam Cu, Cd dan Pb serta menunjukkan hasil bahwa adsorpsi maksimum pada logam Pb. Sementara itu, Zahroh dkk di tahun 2013 menggunakan modifikasi xantat dengan selulosa dari jerami padi untuk menjerap logam berat Pb dan menunjukkan bahwa modifikasi dapat meningkatkan kapasitas adsorpsi hingga 2 kali lipat. Selain itu Yunita dkk (2013) menemukan waktu optimum serapan logam Cu pada esterifikasi asam sitrat dengan biomassa Azolla
microphylla adalah 60 menit. Proses adsorpsi menawarkan fleksibilitas dan
Berdasarkan uraian di atas peneliti tertarik untuk melakukan modifikasi selulosa melalui reaksi esterifikasi menggunakan selulosa hasil isolasi dari sabut buah pinang dengan asam suksinat serta diuji kemampuannya sebagai adsorben ion Cu2+.
1.2 Permasalahan
1. Bagaimana mensintesis senyawa selulosa suksinat dari selulosa sabut buah pinang melalui reaksi esterifikasi ?
2. Bagaimana perbandingan kekuatan serapan antara selulosa dengan selulosa suksinat terhadap ion logam Cu2+ ?
1.3 Pembatasan Masalah
1. Selulosa yang digunakan adalah selulosa hasil isolasi dari sabut buah pinang dari Desa Sugihen, Kecamatan Juhar, Kabupaten Karo dengan kandungan
α-selulosa sekitar 53,2%.
2. Senyawa selulosa suksinat diperoleh dari hasil asilasi selulosa dengan asam suksinat.
3. Ion logam Cu (II) yang digunakan adalah larutan standar Cu(NO3)2.3H2O.
1.4 Tujuan Penelitian
1. Untuk mensintesis selulosa suksinat dari sabut buah pinang melalui reaksi esterifikasi.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk dapat memberikan tambahan informasi mengenai sabut buah pinang yang dapat diaplikasikan sebagai adsorben ion Cu2+.
1.6 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Organik FMIPA-USU Medan. Analisis Fourier Transform Infra Red (FTIR) dilakukan di Laboratorium Kimia Organik UGM Yogyakarta dan Scanning Electron Microscopic (SEM) dilakukan di Pusat Laboratorium Forensik Mabes Polri Jakarta. Analisis penyerapan ion logam menggunakan SSA (Spektrofotometer Serapan Atom) dilaksanakan di Laboratorium Badan Riset dan Standarisasi (Baristand) Medan.
1.7 Metodologi Penelitian
Penelitian ini bersifat eksperimen laboratorium dimana pada tahap pertama dilakukan preparasi sampel sabut buah pinang dan diisolasi selulosa meliputi proses prehidrolisis atau pretreatment, delignifikasi, bleaching dan pengeringan. Selulosa basah yang diperoleh dikeringkan, dianalisis menggunakan FT-IR dan dianalisis morfologi permukaannya menggunakan SEM.
perbandingan kekuatan serapannya dengan selulosa terhadap ion Cu2+ menggunakan SSA.
SINTESIS SELULOSA SUKSINAT MELALUI REAKSI ESTERIFIKASI ASAM SUKSINAT DENGAN SELULOSA HASIL ISOLASI DARI
SABUT BUAH PINANG (Areca catechu L.) SEBAGAI ADSORBEN ION TEMBAGA (Cu2+)
ABSTRAK
Selulosa diisolasi dari sabut buah pinang lalu diesterifikasi menggunakan asam suksinat membentuk selulosa suksinat sebanyak 0,4998. Hasil analisis menggunakan spektrofotometer FT-IR menunjukkan adanya vibrasi C=O karboksilat pada daerah bilangan gelombang 1720 cm-1 dan didukung oleh vibrasi gugus O-H pada daerah bilangan gelombang 3348 cm-1. Hasil analisis morfologi menggunakan SEM juga menunjukkan adanya pori dan homogen. Pengujian daya adsorpsi terhadap ion Cu2+ (pada konsentrasi 100, 200, 300, 400, dan 500 ppm) menggunakan spektrofotometer serapan atom (SSA) menunjukkan penyerapan optimum terdapat pada konsentrasi 100 ppm, di mana selulosa suksinat menyerap sebesar 30,3805 % dan selulosa sebesar 18,8989 %.
SYNTHESIS SUCCINIC CELLULOSE THROUGH ESTERIFICATION REACTION SUCCINIC ACID WITH CELLULOSE ISOLATED
FROM ARECA NUT FIBER (Areca catechu L.) AS AN ADSORBENT ON COPPER IONS (Cu2+)
ABSTRACT
Cellulose isolated from areca nut fiber was then esterificated with succinic acid gave 0.8 gram of succinic cellulose. FT-IR spectroscopy analysis indicated C=O carboxylated vibration in the region 1720 cm-1 and in the 3348 cm-1 region attributed to vibration of O-H group. Morphological analysis using SEM showed homogeneous and porous at their structure. Their adsorption capability for Cu2+ ions (at concentrations of 100, 200, 300, 400, dan 500 ppm) have been investigated and the maximum sorption indicated at concentration 100 ppm, where succinic cellulose sorption about 30.3805 %. and cellulose about 18.8989 %.
SINTESIS SELULOSA SUKSINAT MELALUI REAKSI ESTERIFIKASI ASAM SUKSINAT DENGAN SELULOSA HASIL ISOLASI DARI
SABUT BUAH PINANG (Areca catechu L.) SEBAGAI ADSORBEN ION TEMBAGA (Cu2+)
SKRIPSI
DEASY C.M BR SEMBIRING
120802028
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
SINTESIS SELULOSA SUKSINAT MELALUI REAKSI ESTERIFIKASI ASAM SUKSINAT DENGAN SELULOSA HASIL ISOLASI DARI
SABUT BUAH PINANG (Areca catechu L.) SEBAGAI ADSORBEN ION TEMBAGA (Cu2+)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DEASY C.M BR SEMBIRING 120802028
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERNYATAAN
SINTESIS SELULOSA SUKSINAT MELALUI REAKSI ESTERIFIKASI ASAM SUKSINAT DENGAN SELULOSA HASIL ISOLASI DARI
SABUT BUAH PINANG (Areca catechu L.) SEBAGAI ADSORBEN ION TEMBAGA (Cu2+)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2016
PERSETUJUAN
Judul : Sintesis Selulosa Suksinat Melalui Reaksi Esterifikasi Asam Suksinat dengan Selulosa Hasil Isolasi dari Sabut Buah Pinang (Areca catechu L.) Sebagai Adsorben Ion Tembaga (Cu2+)
Kategori : Skripsi
Nama : Deasy C.M Br Sembiring
Nomor Induk Mahasiswa : 120802028
Program : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam (MIPA) Universitas Sumatera Utara
Disetujui di Medan, Juni 2016
Komisi Pembimbing :
Pembimbing II Pembimbing I
Dr. Mimpin Ginting, M.S Dra. Herlince Sihotang, M.Si NIP. 195510131986011001 NIP : 195503251986012002
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PENGHARGAAN
Segala puji dan syukur penulis ucapkan kepada Tuhan Yesus Kristus sumber segala hal dalam hidup sebab atas berkat dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini dengan baik. Dalam pelaksanaan hingga penyelesaian skripsi ini, penulis menyadari banyak mendapat bantuan, dukungan maupun motivasi dari berbagai pihak. Untuk itu pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan terima kasih kepada :
1. Bapak Dr. Kerista Sebayang, M.S sebagai Dekan FMIPA USU.
2. Ibu Dr. Rumondang Bulan, M.S dan Bapak Drs. Albert Pasaribu, M.Sc sebagai Ketua dan Sekretaris Departemen Kimia FMIPA USU.
3. Ibu Dra. Herlince Sihotang, M.Si sebagai pembimbing I dan Bapak Dr. Mimpin Ginting, M.S sebagai pembimbing II yang dengan sabar telah memberikan bimbingan dan saran sehingga skripsi ini dapat terselesaikan.
4. Bapak Prof. Dr. Jamaran Kaban, M.Sc selaku Ketua bidang Kimia Organik FMIPA USU.
5. Kepala Laboratorium Kimia Organik FMIPA USU Bapak Dr. Mimpin Ginting, M.S beserta Dosen dan Staff Laboratorium Kimia Organik FMIPA USU.
6. Seluruh Dosen Departemen Kimia FMIPA USU yang telah memberikan waktunya untuk memberi bimbingan selama penulis mengikuti perkuliahan di Departemen Kimia FMIPA USU, terkhusus kepada Ibu Dr. Rumondang Bulan, M.S sebagai dosen wali penulis.
7. Teman-teman Asisten Laboratorium Kimia Organik FMIPA USU (Sevty Angel, Hardy, Eben, May, Lois, Yeski, Kak Yulia, Kak Friska, Kak Indah, Bang Lianta, Bang Hotlan, Bang Bernard dan Bang Daniel).
8. Teman-teman Stambuk 2012 ( Harpina, Sevty, Juwita, Defrista, Laura, Annisa, Die) dan adik-adik stambuk 2013, 2014, dan 2015 yang tidak dapat disebutkan namanya satu per satu.
9. Pihak yang tidak disebutkan namun dengan tulus membantu penulis dalam menyelesaikan penulisan skripsi ini.
Secara khusus, penulis mengucapkan terima kasih yang sebesar-besarnya kepada kedua orang tua tercinta, Bapak terkasih Jonson Sembiring dan Mamak terkasih Sri Ulina Br Ginting yang dengan kasihnya telah mengorbankan banyak hal lewat doa dan dukungan dalam mendidik saya. Terima kasih kepada adik-adik tersayang (Andy P.P, Irma Natasya dan Grace A.P ) atas doa dan semangatnya. Tidak lupa saya ucapkan terimakasih teristimewa untuk Novly Andre Hutabarat yang selalu ada memberi dukungan untuk menyelesaikan skripsi ini. Semoga kasih karunia Tuhan Yesus memberkati kita.