I. PENDAHULUAN
1.1. Latar Belakang
Jagung sebagai sumber kalori merupakan tanaman pangan utama kedua sesudah beras. Tidak kurang dari 18 juta penduduk Indonesia makanan pokoknya adalah jagung dengan rata-rata konsumsi per kapita berkisar antara 15
-
20 kg per tahun (Sudaryanto et al., 1988). Di beberapa wilayah seperti Madura, Sulawesi Tenggara dan Nusa Tenggara Timur tingkat konsumsi jagung rata-rata mencapai 95 kglkapitaltahun.Disamping sebagai tanaman pangan, jagung juga merupakan tanaman pakan te~nak dan bahan baku industri yang jumlah permintaannya setiap tahun selalu me- ningkat, sehingga jumlah imporpun turut meningkat. Pada tahun 1987 angka Impor jagung mencapai 69 000 ton, Perkiraan proyeksi kebutuhan jagung untuk pahgan, pakan dan industri sampai akhir Pelita V (1994) sekitar 6.356 juta ton, sementafa proyeksi perkiraan produksi pada tahun yang sarna hanya 6.044 juta ton,
bsngan
demikian masih perlu impor sebesar 312 000 ton. Namun dalam realisaslnyaatrgka
impor jagung tahun 1993 dari
BULOG
malah mencapai 439 000 tonyang
didatan&kan
terutama dari RRC'). Pada akhir PJP I1 atau PELITA X (tahun 2018),perklraan
jumlah kebutuhan jagung akan meningkat lebih 2 kali lipat menjadi 14.69 juts ton (Ditjentan Pangan dbkm Puslitbangtan dan Yuslitbanghort
,
1992).Dalam rangka mencapai swasembada jagung di masa mendatang, maka upaya-upaya peningkatan produktivitas dan pengembangan lahan-lahan matginal perlu terus digaldckan. Di Indonesia sebagian besar lahan marjinal tersebut berupa tanah masam. Diperkirakan total luas arealnya mencapai sekitar 101.5
19
juts hektar, 48.3 juta hektar diantaranya atau sekitar 30 persen dari luas lahan Indoneala termasuk jenis Podzolik Merah Kuning. Dari jumlah tersebut hampir semuanyaberada di luar Jawa. Daerah penyebarannya meliputi Sumatera seluas
20.6
juta hektar (43.5 % luas pulau), Kali~nantan 16.1 juta hektar (29.9 % luas pulau), Irian Jaya 9.6 juta hektar (23.0% eluas pulau) dan Sulawesi 2.0 juta hektar (10.3% luas pulau) (Sudjadi, 1984).Masalah-masalah yang umum ditemui pada tanah Podzolik Merah Kuning adalah tingkat erosi menonjol dan pencucian hara yang tinggi, sehingga gejala kahat unsur Ca, Mg, P,
K
dan N serta keracunan A1 kerapkali ditemukan.Kelebihan A1 dalam tanah pada umumnya berakibat buruk terhadap pertum- buhan tanaman. Gejala pertama yang mudah dilihat adalah pada sistem perakaran- nya yang tidak berkembang (pendek dan tebal). Hal tersebut disebabkan oleh terja- dinya hambatan perpanjangan sel dan rusaknya plasmalemma (selaput sitoplasma) sel akar (Wagatsuma, 1988). Akibatnya transportasi air dan suplai hara menjadi ter- ganggu, sehingga pada akhirnya pertumbuhan dan produksi tanaman akan menurun.
Keracunan A1 pada tanaman dapat diatasi dengan meniadakan kendala-kenda- la tanah masam itu sendiri melalui manipulasi sifat-sifat fisika kimia tanah dengan pengapuran dan pemupukan berat serta penggunaan varietas tenggang (toleran) ma- Sam. Kedua pendekatan tersebut telah ditempuh oleh Pemerintah Indonesia sejalan dengan pengembangan program transmigrasi, terutama dalam satu dekade terakhir. Namun demikian hasil yang diperoleh nampaknya belum memuaskan.
Usaha-usaha pemuliaan tanaman ke arah ketenggangan terhadap keracunan A1 secara konvensional melalui seleksi lapang terhadap koleksi plasma nutfah jagung yang tersedia di Indonesia (lokal dan intrduksi), selanjutnya diusahakan penyilang- annya dengan varietas jagung komersial sudah cukup lama dilakukan, baik oleh
per-
Beberapa faktor yang dirasakan sebagai kendala adalah pola pewarisan dari sifat ketenggangan tanaman jagung terhadap keracunan A1 tersebut tidak sederhana, sehingga pengaruh interaksi dengan faktor lingkungan sangat besar. Disamping itu seringkali sifat ketenggangan tersebut terkait (linkage) dengan tingkat kemampuan produksi dan kualitas hasil yang kurang memuaskan (Gorsline et al., 1964 dan 1968; Lutz et al., 1971).
Faktor lainnya adalah jagung merupakan tanaman menyerbuk silang (cross pollinated crop) dimana konstitui genetik pada setiap lokusnya pada umumnya he- terozigot. Dengan demikian relatif sulit untuk dapat melakukan rancangan persilang- an yang mampu mengkombinasikan gen tenggang A1 tersebut ke dalam varietas ko-
I
mersial secara cepat dan mantap. Selama ini metode pemuliaan yang umum diguna- kan pada tanaman jagung adalah metode seleksi daur ulang (recurrent selection). Melalui metode tersebut untuk mencapai peningkatan frekuensi gen yang cukup tinggi diperlukan beberapa siklus seleksi, yaitu antara 5
-
8 siklus bergantung pada nilai heritabilitas dari karakter yang dimuliakan, walaupun pemuliaan untuk ketahan-an
terhadap penyakit tertentu sudah dapat diperoleh pada siklus kedua atau ketiga. Semakin rendah nilai heretabilitasnya dan semakin komplek pola pewarisannya maka akan semakin lama diperlukan waktu untuk melakukan seleksi guna mendapatkan kemajuan genetik yang berarti. Hal tersebut disebabkan oleh pengaruh faktor ling- kungan yang sangat besar. Oleh karena itu perlu dicari suatu terobosan strategi pemuliaan tanaman baru yang memungkinkan untuk dapat melakukan tindakan selek- si lebih dini secara efektif dan efisien.1982). Beberapa kelebihan dari teknik in-vitro tersebut adalah sifat
totipotensi
sel atau jaringan untuk dapat ditumbuhkan menjadi tanaman utuh dalam media kultur buatan di dalam wadah yang relatif kecil (botol). Dengan demikian tidak diperlukan areal atau lahan yang luas, namun cukup dalam ruangan yang sempit tapi memadai untuk berlangsungnya kehidupan suatu kultur. Disamping itu keragaman ger~etik tanaman dapat juga ditingkatkan melalui kultur in-vitro tersebut serta tekanan seleksi relatif lebih seragam daripada di lapang. Namun demikian suatu kelemahan dari teknik ini adalah daya ketenggangan terhadap suatu unsur (zat racun) yang ditunjuk-kan
pada tingkat sel dan jaringan (dalam botol kultur) belum tentu sama dengan daya ketenggangan yang ditunjukkan pada tingkat tanaman (lapangan). Oleh karena itu, hasil seleksi yang diperoleh pada tingkat laboratorium perlu dilanjutkan dengan pengujian di lapangan.Upaya mengkombinasikan pendekatan konvensional dengan pendekatan in- vitro secara baik dalam memperbaiki karakter suatu tanaman dapat meningkatkan efisiensi seleksi dari seluruh tahapan proses pemuliaan tanaman tersebut. Kedua cara tersebut bersifat saling melengkapi, karena masing-masing cara rnempunyai kelebihan dan kelemahan sendiri-sendiri. Ddam ha1 ini upaya seleksi melalui
pen-
dekatan in-vitro hams didahului dengan studi regenerasi yang mantap.Hasil studi terhadap kemampuan regenerasi dari embrio muda
(imwaturl?
embryo)
pada tanaman jagung menjadi tanaman utuh dm perbanyakannya menunjuk- kan bahwa peranan genotipa, komposisi media dan interaksi antar keduanya serta umur eksplan sangat nyata. Setiap genotipa tidak selalu mempunyai tanggap yang sama terhadap komposisi media yang sama, apalagi pada media yang berbeda (Sutjahjo, 1991). Demikian juga hasil studi terhadap kulturanther
jagung menun- jukkan persentase keberhasilan yang relatif sangat rendah dan peranan genotipaSeleksi secara in-vitro sangat mungkin dilakukan disebabkan oleh adanya fenomena keragaman somaklon (somaclonal variation), yai tu keragaman geneti k tanaman yang dihasilkan melalui kultur sel atau kultur jaringan (Larkin dan Scowcroft, 1981). Sejauh mana keampuhan dari fenomena ini jika diarahkan pada perbaikan sifat tanaman pada kondisi lingkungan tertentu, nampaknya masih perlu djuji lebih teliti.
1.2. Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan keragaman somaklon tanaman jagung yang tenggang terhadap keracunan A1 melalui penerapan tekanan seleksi pada tingkat in-vitro. Hasil yang diperoleh diharapkan dapat dikembangkan ke arah pembentukan varietas jagung yang tenggang terhadap keracunan A1 melalui metode seleksi massa di lapang atau pembentukan varietas hibrida melalui kultur haploid (anther culture maupun ovule culture).
Hasil yang diharapkan pada program penelitian ini adalah :
(1) Pembentukan kalus dan pertumbuhan kalus pada berbagai komposisi media yang dicobakan.
(2)
Mogbgenesis
(proses perubahan menuju terbentuknya-
organ tunas dan akar atau pianlet) pada kalus yang t e h t r r k .(3) Pertumbuhan dan perkembangan kaks parts d i a seleksi yang meagaadung berbagai konsentrasi A1 serta
~~
pada kaius yang tenggang Al.(4) Aklimatisasi clan evaluasi penampilan tanaman mmaklon di lapang.
A IEpkisPenelitiart
Beberap hipotesis yang diajttkau chtfam p e n d i t h ini addah sebagai berikut:
(2) Melalui penerapan tekanan seleksi pada tingkat in-vitro dengan A1 akan di pero-
leh tanaman jagung somaklon yang mampu menenggang terhadap keracunan Al.
(3) Diantara tanaman somaklon tenggang A1 yang diperoleh akan dapat diseleksi
tanaman jagung yang mempunyai karakter agronomik tetap baik dengan penam-
11. TINJAUAN PUSTAKA
2.1. Kemasaman 'bnah dan Keracunan Aluminium
'Emah masam berkembang pada horizon-horizon yang kadar ketersediaan basanya pada larutan tanah akibat pelapukan mineral primer atau sumber lain lebih sedikit dibandingkan dengan tingkat pencuciannya (Van Wambeke, 1979; Clark, 1982). Ditegaskan oleh Soepardi (1978) bahwa kemasaman tanah merupakan hasil akhir dari curah hujan yang tinggi yang diikuti dengan intensitas hancuran yang tinggi juga. Dalam ha1 ini, selama proses hancuran berlangsung basa-basa dari mineral primer dibebaskan dan tercuci keluar dari profil tanah oleh air hujan yang mengikutiny a.
Kussow (1971) menyatakan bahwa sumber kemasaman tanah bergantung pada pHnya. Pada tanah yang mempunyai pH kurang dari 5.5, aluminium dalam berbagai bentuk merupakan sumber utarna dari kemasaman. Pada tanah yang amat masam (pH kurang dari 4.5) sejumlah ion ~ l menempati tempat pertukaran, ~ + sedangkan pada pH antara 4.5 sampai 5.5 aluminium berada dalam bentuk hidroksi monomerik atau menjadi bentuk kompleks dengan bahan organik.
Gejda keracunan aluminium tampak pada keadaan perakaran dan bagian atas tanaman (tajuk) yang merana. Reid (1976) menyatakan bahwa pada tanaman serea- lia, gejala keracunan aluminium adalah : akar lambat memanjang, menebal dan tidak bercabang secara normal, ujung akar rusak dan berwarna coklat serta akar adventif tumbuh selama tajuk masih hidup. Sunarto (1984) yang menguji daya ketenggangan galur kedelai terhadap keracunan aluminium, mendapatkan bahwa kemasaman tanah yang tinggi berpengaruh terhadap bobot kering tajuk dan panjang akar, namun tidak berpengaruh terhadap bobot kering akar. Adapun Samad (1980) yang bekerja pada tanaman padi gogo, mendapatkan bahwa jumlah anakan dan bobot kering tajuk terganggu oleh kemasaman tanah yang tinggi, sedangkan bobot akar dan nisbah tajuk-akar tidak terganggu.
2.2. Keragaman dan Seleksi Tanaman ke arah Ketenggangan terhadap Keracunan Aluminium
Devine (1982) menyatakan bahwa salah satu prasyarat untuk melakukan perbaikan genetik adalah tersedianya keragaman genetik untuk ciri yang dikehen- daki. Keragaman itu dapat berasal dari varietas budidaya, spesies liar atau dari spesies lain yang berdekatan.
Adanya keragaman genetik untuk karakter ketenggangan terhadap keracunan aluminium dan pH rendah pada berbagai tanaman telah ditemukan sejak lama. WrigM clan Ferrari (1976) menemukan adanya perkdaan tanggap tanaman terha- dap kefarutan ion aluminium tinggi dan kondisi pH tanah rendah pada tanaman serea- lia seperti : barley, gandum, rye, triticale, padi, jagung, sorghum, millet dan oats serta tanaman legurn seperti : kedelai dan alfalfa.
Upaya untuk menyaring atau menyeleksi jenis-jenis tanaman tenggang Al dan pH rendah tersebut dari alam sudah dilakukan oleh banyak peneliti. Demikian pula upaya untuk mengetahui pola pewarisannya secara genetik sudah dipelajari. Foy et
dan mendapatkan tanggap yang beragam antar varietas. Diduga ketenggangan tanaman gandum tersebut terhadap keracunan A1 dikendalikan oleh satu atau dua gen utama (major gene) dan beberapa gen peubah (modifier gene) yang pola pewarisan- nya tidak sederhana (Kerridge dan Kronstad, 1968)
.
Van Essen dan Dantuma (1962) mendapatkan sebanyak 61 varietas tanaman barley yang tenggang terhadap kondisi pH tanah rendah dari 670 varietas yang diseleksi.Pada tanaman jagung Lutz et al. (1971) menguji sejumlah galur inbred (inbred line) dan hibrida silang tunggal pada tanah sangat masam (pH =. 3.9). Hasil yang diperoleh menunjukkan bahwa tinggi tanaman dan produktivitasnya sangat beragam diantara galur-galur yang diuji. Berdasarkan hasil studi Gorsline et al. (1964 dan 1968) ditegaskan bahwa perbedaan tanggap tanaman tersebut bersifat genetik dan dikendalikan oleh paling sedikit dua gen utama dan satu atau lebih gen pendamping (minor gene). Dengan demikian, potensi genetik di alam untuk menyeleksi tanaman-tanaman yang tenggang terhadap keracunan A1 relatif tersedia cukup besar, walaupun seringkali terkait dengan tingkat kemampuan produksi dan kualitas hasil yang kurang memuaskan, sehingga diperlukan suatu strategi pemuliaan yang mampu mematahkan kaitan gen tersebut serta mendorong rekombinasi baru yang menguntungkan (Hallauer, 1981).
2.3. Mekanisme Serapan Al oleh Tanaman dan Ketenggangan Tanaman terhadap Keracunan Aluminium
Aluminium hanya dapat disetap oleh akar dalam bcntuk ian, Dal81il h@l
in1
terbentuknya ion A1 sangat bergantung pada keadaan pH tanah (McLcnn, 1978). Ion A1 hanya dapat terbentuk pada pH rendah dimana terdapat kelebiha~
ion
H+,
sedangkan pada kondisi basa aluminium akan mengendap sebagai Al(OH) +
+.
Kesetimbangan yang terjadi dapat dilukiskan sebagai berikut :Al+**
+
H20 Al(OH)+++
H+Wagatsuma et al. (1987) menyatakan bahwa urutan dart
keterngg&ngan
terhadap A1 diantara spesies-spesies tanaman pada umumnya sejalan dengan
perbe-
daan ketenggangan dari plasmalemma sel akar terhadap A1
, semakin kuat plama-
lemma sel akan semakin tenggang tanaman tersebut terhadap Al, Sebaliknya, semakin lemah plasmalemmanya lnaka tanaman akan semakin peka terhadap ke- racunan Al. Dalam ha1 ini, plasmalemma dari set akar berfungsi sebagai penghalang (barrier) terhadap penembusan pasif dari A1lce
dalam sitoplasma scthingga fungai serta struktur sitoplasma secara metabolik dapat terpelihara.Tempat ikatan utama dari A1 di dalam akar adalah senyawa pektat,
asarn
malat dan
asam
transakonitat pada dindingwl
(Suhsyda
darlIlnrrg,
1986), terutamapada sel-sel epidern~je, aklotwlcrn~is dan endodertnis. Pada akar utuh kebanyakan Al
yang diserap dilokalisir di apoplasma dan plasmalemma, Bila plasmal&rnma
ruw,
maka A1 yang diserap akan terus masuk ke zsitoplnsma dari sel-sel akar dafldilkat
oleh berbagai organel sel di dalaln sitoplasma, sehingga ujung akarakan
tt~sbk
Mekanisme fisiologi dan biokimia yarig tepat pada tingkat seluler
tantang
keracunan A1 atau ketenggangannya masih sukar dipahami, walaupun data tentang pengaruh racun dari logam tersebut cukup banyak tersedia
(Foy
etal.,
1978dan
Haug, 1984). Dalam ha1 ini, mekanisme tersebut dapat berbedaantar
species dan varietas serta dikendalikan oleh gen yang berbeda,Beberapa teorl mekanisme ketenggangan tanaman terhadap keracunan A1 dan pH rendah secara fisiologi yang berkembang sa~t~pai wit ini sedikitnya ada
2
maam
yaitu:(1) Tanaman mempunyai kemampuan untuk mengubah pH di daerah perakaran dengan cara melringkatkan pH larutan hara sehingga kelarutan
dan
uksisitas
A1berkurang
(Foy
el al., 19671MugwDra
elal.,
1976;Matrumoto
otal,,
19761Foy
dan Flemrning, 1978). Diduga kelrlampuan mengubahpH
@rrebutb(3rh~.
bungan dengan mekanisme penyerapan aniondan
kation olehakat
tanaman,
(2) Pembentukan komplek A1 dengan senyawa organik (asam sitrat)
dm
agsWfmctl
sehingga pengaruh racun dari A1 dapat dinetralkan
(Madner,
1986).Berdasarkan akurnulasi A1 di dalam tajuk, tanaman yang tenggang terhadap A1 dapat dibagi sedikitnya ke dalarn 3 kelompok (Blum, 1988) yaitu:
(1) Kadar A1 dalam tajuk tidak nyata berbeda dengan tanaman yang peka, tetapi akar
tanaman
yang tenggang A1 sering mengandungkadar
A1 lebih rendahdad*
pada
mmnan
Yangpeka.
(2) Ketenggangan terhadap A1 ditunjukkan dengan kadar A1
dalam
tajuk yang lebih rendah.2.4. Seleksi In-vitro pada 'bnaman
Seleksi in-vitro untuk mendapatkan sel-sel tanaman yang
tenggang
tethadap
garam clan beberapa logam berat telah banyak dilakukan sejak beberapa tahun terak. hir pada tanaman pertanian penting, Adapun seleksi untuk mendapatkangel-sel
tanaman yang tenggang terhadap aluminium baru dilakukan pada tomat dan kentang (Stavarek dan Rains, 1984), wortel (Ojima dan Ohira, 1982) serta sorghum (Smith et al., 1983).
Kultur kalus dari dua kultivar tomat pada media yang meng8rlduog
alunrinl-
um
juga diuji oleh Meredith (1978). Kesimpulan yang diperoleh m~negukan biahwskultur sel dapat digunakan untuk menyeleksi varietas yang berbeda ketenggmgan- nya terhadap aluminium. Namun demikian, dari kultur kalus yang tengang
terse-
but belum berhasil diregenerasikan menjadi tanaman utuh. DemiMan pula dengan Ojima dan Ohira (1982), kalus wortel yang tenggang terhadap keracunan alumi- nium sudah diperoleh namun upaya untuk menumbuhkannya menjadi tanamanlengkap masih belum berhasil, Baru empat tahun kemudian (1986) etelah
kottrpo-
sisi media regenerasi untuk menumbuhkan kalus wortel tenggangkeracunidh
A1 tersebut ditemukan, tanaman wortel tenggang A1 hasil regenerad diperoleh. Nrdmun demikian evaluasi daya ketenggangannya terhadap kerolcunan A1 di iapang belum dilakukan.Melalui teknik kultut in-vltro ini terdapat dua ha1 yang berbetla kepentlng- annya bagi pemuliaan tanaman, yaitu mcmpertahankan kestabilan genotipa
dan
me-
rangsang terbentuknya
kemgrrman genetik ,Kestabilan
genotipa dapat clicapai dengwmendorong sesingkat mungkin fase pertumbu han talc berdiferensiasi (fase ltalus dm sel bebas), sedangkan keragaman genetik dapat dicapai pada fase tak berdiferensiasi yang relatif panjang. Sejumlah mutan diduga dapat terbentuk pada fase kalus dan sel bebas, dan dari sini dapat diseleksi turunan yang sangat berguna bagi pemuliaan
2.5. Induksi Kalus dan Regenerasi pada
'hnaxnan
JagungKultur jaringan jagung yang dilakukan dengan menggunakan kultur endo- sperma pada awalnya ditujukan untuk penelitian-penelitian biokimia. Media yanlp digunakan dikembangkan oleh Straus (1960). Dalam hal ini, induksi
pembentukarl
kalus sudah berhasil diperoleh dengan menggunakan eksplan potongan tunas, embrio mu& dan bunga muda (Green et al., 1974). Akan tetapi usahauntuk
meregene- rasikan kalus tersebut membentuk planlet masih mengalami kegagalan. Baru pada tahun berikutnya, Green dan Phillips (1975) berhasil meregenerasikan tanaman dari kultur kalus dengan menggunakan embrio muda yang ditumbuhkan dalam media yang diberi hormon 2,4-D. Selanjutnya, Vasllet
al. (1984) juga berhasil mendapatkan kalus embriogenik melalui kultur suspensi sel dengan subkultur (pemindahan kalus ke dalam media baru) yang dilakukan berulang-ulang. Dari hail peneli tian tersebut disimpulkan bahwa frekuensi pembentukan kalus embrioge- nik dipengaruhi juga oletr tipe eksplan dan tingkat perkembangan tanaman yang digunakan sebagai sumber eksplan. Stadia embrio dan macam genatipa jagung yang digunakan j uga berpengaru h terhadap kemampuan regenerasi tanaman tersebu t. Beberapa genotipa tidak mempunyai daya regenerasi untuk metnbentuk planlet. Sebaliknya, beberapa lainnya mempunyai kemampuan beregenerasi. Oleh Duncanet al. (1985) ditegaskan bahwa pada kultur jaringan jagung terdapat potensi genetik yang berbeda untuk tumbuh dan beregenerasi menjadi tanaman. Kemampuan rege- nerasi untuk membentuk tanaman relatif sukar dicapai dan terbatas pada beberapa genotipa saja (Rapela, 1985).
beberapa genotipa jagung menunjukkan bahwa saat pengambilan embrio yang terbaik pada saat 10 hari sesudah polinasi (Sutjahjo, 1991).
Tomes (1985) menjelaskan bahwa terdapat 2 macam kalus yang dapat terben- tuk dalam kultur in-vitro suatu tanaman, yaitu: (a) kalus embriogenik dan (b) kalus non-embriogenik, Kalus embriogenik (kalus G) adalah kalus yang rnempunyai
po-
tensi untuk beregenerasi menjadi tanaman, baik melaluiorganogenesis
(langsung rnembentuk organ) maupun embriogenesis (melalui pembentukan embrio somatik). Adapun kalus non-embriogenik adalah kalus yang sedikit atau tidak mempunyai kemampuan untuk beregenerasi membentu k tanaman, Oleh Green et al, (1983),kalus E dibedakan lagi menjadi 2 macam yaitu: (a) kalus E tipe I dengan ciri-ciri; kompak, tidak tembus cahaya, pertumbuhannya relatif lambat dan strukturnya komplek, (b) kalus E tipe II dengan ciri-ciri; friabel (remah), kurang kompak per- tumbuhannya c e p t dengan bentuk embriosomatik lebih jelas pada
permukaan
kalus (berupa nodul), kalus berwarna putih sampai kuning. Oleh Vasil (1982) embrioge- nesis somatik disebut juga sebagai struktur bipolar, yaitu suatu struktur bulat yang terbentuk pada permukaan kalus E sebagai hasil dari aktivitas perturnbuhan sel-sel rneristematik pada skutelurn sampai koleoriza. Pada sejumlah tanaman struktur demikian di yalcini sebagai lintasan utama (principal pathway)un
tu k terjadin ya re- generasi tanaman.2.6. Keragaman Sornaklon
gamet disebut gametoklonal. Adapun tanaman yang diperoleh dari peristiwa somaklonal disebut somaklon dan dari gametoklonal disebut gametoklon
(Evans
dnn
Sharp, 1986). Istilah kaliklon (Skirvln dan Janick, 1976) berlaku bagi tmaman yang berasal dari kalus, sedangkan protoklon bagi tanaman yang berasal dari proto- plas (Shepard et al,, 1980). Namun demikian pada saat ini pengertian keragaman somaklon dari Larkin dan Scowcroft (1981) yang dipakai termasuk di dalamnya : gametoklon,
kaliklon dan protoklon.Adanya keragaman somaklon pertama kali dilaporkan pada tanaman tebu oleh Heinz dan Mee (1969; 1971) yang meliputi keragaman dari kandungan sukrosa dan resistensi terhadap beberapa penyakit seperti: virus Fiji, downy mildew, eyespot
dan Colmicolous smut. Sejak saat itu penelitian terus dilakukan pada tanaman perta- nian penting lainnya seperti padi (Oono, 1978; Sun et al., 1983)
,
Lolium spp. (Ahloowalia, 1975; 1983), gandum (Larkin et al., 1984) dan jagung (Gangenbachet al., 1977; Gangenbach et al., 1981).
Dokumentasi oleh Evans et al. (1986) mencatat sebanyak 22 jenis tanaman pertanian penting telah diteliti tanggapnya secara in-vitro dan terbukti dapat menghab silkan keragaman somaklon yang mewaris (inherited) pada berbagai karakter seperti tinggi tanaman, jumlah daun, letak daun, ketahanan terhadap FZtsarr'um
sp., besar
dan warna bunga, kegenjahanserta
komponen produksi dan lain-lain.Tujuan seleksi pada tanaman somaklon yrng beragam terutama untuk memperbaiki sifat lemah dari suatu kultivat yang telah beradaptasi, sepertl untuk meningkatkan ketahanan terhadap penyakit, kekeringan, termasuk ketenggangan ter- hadap keracunan aluminium.
2.6.1.
pembawa sifat menurun (inherited trait) baik pada tingkat DNA atau gen yang disebut juga mutasi kecil atau mutasi titik, maupun pada tingkat khromosom yang disebut juga mutasi besar. Oleh karena itu, mekanisme kejadiannya hampir sama dengan efek mutagenesis konvensional (radiasi), yakni bersifat acak dan keragaman yang dihasilkannya dapat bermanfaat atau kurang bermanfaat, bahkan mungkin fnerugikan. Namun demikian keragaman somaklon relatif lebih mudah dideteksi dan lebih cepat diperoleh daripada mutagenesis konvensional (Ahloowalia, 1986; Novak et al., 1986 dan 1988). Evans dan Sharp (1983) mendapatkan 1 mutan dari setiap 20-25 tanaman tomat hasil regenerasi in-vitro. Dalam ha1 ini, keragaman genetik yang terjadi dapat berasal dari eksplan atau dari perubahan getletik yang
te rjadi selama dalam kultur media (Wattimena, 1988a). Dengan demikian perubah-
an
genetik tersebut bukan disebabkan oleh peristiwa segregasi maupun rekombinasi gen seperti biasa te jadi akibat proses persilangan (crossing).Keragaman genetik pada eksplan disebabkan oleh adanya sel-sel bermutan da- ri jaringan tertentu. Adapun keragaman genetik yang terjadi di dalan~ kultur media dapat disebabkan olch adan ya peristi wa eruiornitosis, eruioreduplikmi,
perm-
bahan struktur khromosom (duplikasi, inversi dan translokasi), pindah silang sornatik maupun poliploidi (Scowcroft dan Larkin, 1981; Evans dan Sharp, 1986; Ahloowalia, 1986; Suzukl, 1981).2.6.2. M e m m h i Ke-
(1)
GenotiDa
Genotipa merupakan faktor penting di dalam menimbulkan keragaman soma- klon, karena genotipa dapat mempengaruhi besarnya frekuensi regenerasi dan fre- kuensi somaklon yang terjadi. Gunn dan Shepard (1981) mendapatkan jumlah ta- naman regenerasi yang berbeda dari 2 kultivar kentang yang dikulturkan pada kon- disi yang sama.
Dari banyak literatur diketahui bahwa tanaman dari genotipa yang berbeda mempunyai frekuensi somaklon yang berbeda pula. Shepard et
al.
(1980) mencatat te rjadinya frekuensi keragaman genotipa yang tinggi dari kultivar kentangRusset
Burbank. Akan tetapi Wenzel et al. (1979) hanya mendapatkan keragaman yang
sa-
ngat kecil di antara 200 tanaman regenerasi hasil kultur protoplas yang berasal dati 5 Mon kentang diploid.Sun et
al.
(1983) membandingkan besarnya frekuensi poliploid tanaman re- generasi in-vitro dari 18 varietas padi. Adanya multiploid ditemukan pada varietas indica, sedangkan pada varietas japonica tidak ditemukan. Demikian pula frekuensi mutan yang mengalami defisiensi khlorofil beragam sangat nyata di antara 2 varietas padi tersebut.(2)
S
S
W
Sumber eksplan merupakan faktor yang sangat penting dalam
medtnbulkan
keragaman sornaklon. Pada tanaman geranium, keragaman hanya berhasil diperoleh dari eksplan potongan petiol, sedangkan dari eksplan potongan batang tidak berhasil, Demikian pula pada tanaman tebu, frekuensi dan spektrum somaklon yang terjadi berasal dari sumber eksplan yang berbeda.
diperoleh melalui kultur langsung dari eksplan daun maupun petiol. Dalam
hd
ini menurut Roest dan Bokelman (1980), eksplan yang berasal dari daun atau bagian daun memberikan keragaman genetik lebih besar daripada eksplan dad bagian tanaman lainnya.(3) Lamanva dalam Kultur Sel
Adanya keragaman dalam jumlah khromosom akibat kultur sel sudah dilapor- kan oleh para peneliti. Beberapa faktor yang mempengaruhi terjadinya keragaman tersebut adalah:
(a) Adanya khromosom cacat (mosaik) pada tanaman yang digunakan untuk inisiasi kultur.
(b) Terjadinya fragmen tasi in ti yang berasosiasi dengan pembelahan
pertama
dari sel pada saat inisiasi kdus (Cionini et al., 1978).(c) Endoreduplikasi atau endomitosis yang terjadi selama inisiasi kultur (Dl Amato, 1978).
(d) Terjadinya ketidaknormalan proses mitosis yang dihasilkan oleh sel-sel aneuploid.
Reberapa peneliti menyatakan bahwa keragaman somaklon semakin mening- kat dengan makin lamanya masa inkubasi eksplan dalam kultur. Barbier dan Dulieu (1983) yang menggunakan penanda genetik dari sumber eksplan yang digu- nakan telah menunjukkan bahwa kebanyakan perubahan-perubahan genetik terjadi pada periode mitosis prtama dalam kultur dan beberapa perubahan genetik mening- kat sejalan dengar1 larnanya dalam kultur, Demikian pula dengan menggunakan protoplas dari tanaman donor heterozigot I d n dan Scowcroft (1983) menu~~jukkan bahwa dengan memperpanjang periode kultur dua kali lipat frekuensi perubahan genetik meningkat dari 1.4 % menjadi 6 %. Fukui (1983) memonitor terjadinya mutasi ganda (multiple mutation) pada tanaman regenerasi asal kultur kalus dari padi. Ia dapat menguraikan tentang urutan tejadinya mutasi, yang terjadi tidak bersamaan selama dalam kultur dari galur kalus tunggal. Evans et 01. (1982) menambahkan bahwa hibrida somatik merupakan sumber keragaman yang besar daripada hibrida seksual. Beberapa keragaman unik telah dideteksi antara Won-klon hibrida somatik (Evans et al., 1983).
(4) Kondisi Kultu~
Telah diketahui sejak lama bahwa komposisi zat pengatur tumbuh dari media kultur dapat mempengaruhi frekuensi perubahan kariotipa dalam kultur sel
(Baylks,
1975). Zat pengatur tumbuh 2,443 paling sering diyakini sebagai yang bertanggung jawab terhadap te rjadinya keragarnan khromosom (Singh et
al.,
1975). Konsentrasi yang tinggi dari 2,4-D erat kaitannya dengan keragaman dari tanaman-tanaman regenerasi Hordewn (Deambrogiodan
Dale, 1980). Demikian pula, penggunaan 2,4-D dan NAA dalam media kultur kentang juga meningkatkan frekuensitanaman
abnormal (Shepard, 1981). Dalam ha1 ini, terdapat hubungan yang erat antara keberadaan zat pengatur tumbuh dengan lamanya periode kultur.
secara kimia (EMS, DEMS, dan NMU) (Ancora dan Sonuino, 1987). Ceulemans
et al. (1986) menyatakan bahwa penggabungan teknik mutagen dengan teknik soma- klon mungkin memberikan harapan lebih besar untuk memperoleh keragaman ta- naman yang besar. Pada tanaman kentang pemberian mutagen pada eksplan relatif lebih baik daripada kalus, karena pemberian mutagen pada eksplan akan memberikan mutan utuh (solid mutan), sedangkan pemberian mutagen pada kalus menghasilkan mutan parsial (chimeric mutant) (Roest, 1977). Dalam ha1 ini, mutan yang mem- punyai nilai dalam perbaikan tanaman adalah mutan utuh.
2.7. Bentuk-bentuk Keragaman Somaklon pada Beberapa Bnaman
Bentuk-bentuk perubahan sifat secara genetik yang diperoleh meialui feno- mena somaklon yang telah diteliti sampai sejauh ini dapat dibagi ke dalam beberapa kelompok sebagai berikut (Ahloowalia, 1986) :
(a) Albino, defisiensi klorofil dan bentuk-bentuk cacat: Bentuk-bentuk keragaman somaklon seperti ini ban yak ditemukan pada Avena sativa L., padi, Loliwn spp., Festuca ruba
,
gandum,
barley dan jagung.(b) Perubahan karakter kuantitatif seperti produksi biji, tinggi tanaman, ketahanan terhadap penyakit, fertilitas polen dan kandungan protein telah dilaporkan pada beberapa tanaman yang meliputi :
-
perubahan vigor pada Lolium spp.-
tanaman kerdil pada tebu-
pembentukan malai (tasseling) yang lebih awal pada jagung-
peningkatan kandungan protein pada padi-
perubahan jumlah tongkol, warna biji pada jagung-
perubahan kandungan gula pada tebu(c) Ketahanan terhadap penyakit dan herbisida pada alfalfa
,
tembakau, tomat, ja- gung, padi, kentang dan tebu.(d) Keragaman lainnya meliputi ketahanan terhadap cekaman lingkungan dan zat antibiotik.
2.8. Teknik Mendapatkan Keragaman Somaklon
Terdapat tiga cara memperoleh keragaman somaklon yaitu meliputi : (1) kul- tur kalus, (2) kultur suspensi (sel tunggal), (3) kultur protoplasma.
2.8.1. Kultur Kalus
Dalam kultur kalus, eksplan tidak langsung diregenerasikan menjadi tunas adventif atau embrio somatik, akan tetapi diinduksi dulu membentuk kalus untuk be- berapa lama. Selanjutnya kalus diinduksi untuk membentuk embrio somatik, scsu- dah itu dirangsang untuk membentuk tunas dan akar menjadi planlet. Dalam hal ini bahan tanaman yang membentuk kalus akan menghasilkan sejumlah keragaman ge- netik. Secara skematis tahapan kultur kalus (regenerasi tidak langsung) tersebut adalah :
Eksplan
----
b kalus---- b e. somatik----
b tunas adventif---
b tanamau.2.8.2. Kultur Suspensi (Sel Tun@
Kultur sel tunggal pada dasarnya merupakan modifikasi dari kultur kalus.
Dalam ha1 ini kalus embriogenik yang dihasilkan diagregasi menjadi sel tunggal
untuk selanjutnya dikulturkan kembali di dalam kultur cair untuk diinduksi kembali
menjadi kalus dan planlet.
Prosedur seleksi melalui kultur suspensi dimulai dari penanaman dan pemilih-
an eksplan, induksi kalus, isolasi sel, penebaran sel, induksi kalus kembali, induksi tunas adventif, induksi akar dan pemindahan lapang.
Genotipa dan umur tanaman sebagai sumber eksplan sangat menentukan
proses-proses selanjutnya. Demikian juga faktor media sangat menentukan keberha-
silan kultur. Kultur sel ini telah dicobakan pada tanaman tebu, kentang, tembakau,
padi, jagung
,
barley, kol, pelargonium dan chrysanthemum (Scowcroft dan Larkin,2.8.3. Kultur Proto~las
Protoplas adalah sel yang telah dihilangkan dindingnya secara enzimatik atau
disebut juga sebagai sel telanjang.
Di dalam kultur protoplas yang penting bahwa harus dapat diisolasi protoplas yang utuh dan protoplas tersebut harus dapat membentuk dinding sel, selanjutnya
membelah membentuk kalus kemudian meregenerasi menjadi plantlet. Kalus yang
berasal dari protoplas disebut protoplas kalus (Wattimena et al., 1988).
Kultur protoplas merupakan salah satu cara untuk memperbaiki sifat-sifat
lemah dari kultivar yang ada, seperti: ketahanan terhadap penyakit, ketenggangan
terhadap stres dan sifat-sifat morfologis tertentu. Cara ini telah dilakukan pada
Tanaman hasil regenerasi dari protaplas seringkali mengalami perubahan morfologi, jumlah khromosom maupun fertilitasnya. Pada tembakau perubahan terjadi pada warna dan bentuk daun, sedangkan pada kentang perubahan te jadi pada bentuk umbi, kematangan umbi, warna daun, bulu-bulu pada daun, respon terhadap lamanya penyinaran, ketahanan terhadap Phyptophtora infestan dm Alternuria sofani (Reish, 1983).
2.9. Keragaman Somaklon pada Jagung
Penelitian tentang adanya keragaman somaklon pada tanaman jagung sudah banyak dilakukan oleh peneliti di luar negeri. Sejak Green dan Phillips (1975) berhasil meregenerasikan tanaman jagung asal kultur in-vitro dengan menggunakan eksplan embrio muda (immature embryo), maka penelitian tentang kultur in-vitro ja- gung pada berbagai genotipa dilakukan semakin intensif di berbagai negara. Namun demikian selama lebih dari satu dekade kebanyakan arah penelitian baru dititik beratkan pada studi regenerasi tanaman melalui induksi embriogenesis somatik (Green, 1982; Armstrong dan Green, 1985; Lu et af., 1982: Vasil et al., 1984; Novak et al., 1983). Hasil yang diperoleh pada umumnya menyimpulkan bahwa regenerasi pada jagung dapat diinduksi hanya terbatas pada genotipa-genotipa terten- tu saja (Fahey et al., 1986), dan tanaman yang diperoleh pada umumnya mengalami penyimpangan fenotipa yang frekuensinya cukup besar (Novak et al., 1983).
masing frekuensinya 8% pada galur W64A dan 15.5 % pada galur S65. Dari popula- si tanaman mutan tersebut 45 96 diantaranya adalah tetraploid. Disamping itu dite- mukan juga sel-sel tanaman dengan jumlah khromosom antara 31-39 (aneuploid). Hal tersebut diduga akibat terjadinya proses eliminasi khromosom oleh kultur in- vitro. Diungkapkan juga diantara tanaman somaklon hasil regenerasi tersebut ada yang mewaris secara sederhana pada generasi kedua
(%).
Adapun jenis ragam somakion yang diperoleh dari satu macam eksplan (em- brio) dapat beragam antara 2-9 macam. Namun demikian, kebanyakan tanaman somaklon yang diperoleh mempunyai penampalcan morfologi yang kurang mengun- tungkan seperti: pertumbuhan yang abnormal, endosperma tidak sempurna, albino serta tanamannya kerdil. Hasil yang hampir sama ditemukan juga oleh Novak et al. (1986) yang mengkombinasikan kultur in-vitro jagung dengan perlakuan radiasi sinar gamma pada eksplannya.
Adapun bentuk tanaman somaklon jagung yang mengalaini perubahan menguntungkan dan diwariskan ditemukan pada karakter saat pembentukan malai (tasseling) menjadi lebih awal (Brook Housen et al., 1984).
Beberapa faktor kendala yang patut dipertimbangkan dalam memanfaatkan fenomena keragaman somaklonal adalah :
(1) Munculnya bentuk-bentuk perubahan sifat yang tidak diinginkan
(2) Adanya efek sinergistik dari suatu karakter yang terkait (linkage) dengan karak- ter lain .
(3) Seringkali ekspresi gen suatu karakter tidak stabil akibat adanya aktivasi dari transposable-gene, yaitu perpindahan elemen genetik dalam utusan DNA dari satu lokus ke lokus lain dalam satu genom.
111. METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Percobaan
Penelitian dilakukan di Laboratorium Biomolekuler dan Seluler 'Emaman ser- ta di Rumah Plastik milik PAU (Pusat Antar Universitas) IPB di Dramaga, Bogor. Penelitian dimulai sejak awal bulan Desember 1991 sampai dengan bulan Agustus
1993 (+ 21 bulan). 3.2. Bahan Percobaan
Bahan yang digunakan berupa 4 macam genotipa jagung yang diperoleh dari Balai Penelitian Tanaman Pangan (BPTP) Bogor, terdiri atas 2 macam galur murni generasi kedelapan (S,) yaitu : GI = (Ar C,-94-3-3-3-1-2- 1-3-@ b) dan G, = (Ar C,- 178- 1-3- 1- 1 -4-2-2-@I), 1 macam hibrida silang tunggal (GI X G,) dan 1 macam varietas bersari bebas (open pollinated) Arjuna. Kedua galur murni GI dan G,
-
tersebut merupakan hasil ~eleksi massa satu siklus yang dilanjutkan dengan seleksi melalui serbuk sendiri (selfing) secara berulang dari varietas Arjuna. Keduanya berbeda dalam ha1 nomor seleksi tanaman (diberi kode 1, 2, 3 dan seterusnya di belakang huruf Arc,) sejak S,.
Berdasarkan studi sebelumnya varietas A rjuna dini- lai mempunyai tanggap yang relatif baik terhadap kultur in-vitro datipada genotipa lainnya. Oleh karena itu dengan menggunakan genotipa turunan Arjuna tersebut diharapkan dapat diperoleh tanggap yang baik juga dari masing-masing genotipa tersebut sehingga penelitian dapat be rjalan lancar.3.3. Sumber Eksplan dan Penanaman
Eksplan berupa embrio muda (immature embryo) dengan ukuran antara 1.0- 1.5 mm diambil dari biji jagung yang ditanam di rumah plastik kira-kira 10 hari se- telah dilakukan penyerbukan sendiri.
70 % (vlv) sdama 5 menit, cholorox 20 % dan 10 % (vlv), masing-masing selama 15 menit dan 10 menit. Selanjutnya biji dibilas dengan air suling sebanyak tiga kali
.
Embrio yang sudah diambil, langsung diinkubasikan di dalam botol kultur
yang berisi kira-kira 20 ml media setengah padat dan mengandung zat pengatur
tumbuh 2,4-D (2mgll). Dalam setiap botol kultur ditanam sebanyak 4 buah eks-
plan. Selanjutnya semua botol kultur ditutup dengan aluminium foil dan diinku-
basikan dalam ruang pertumbuhan (growth room). Satu minggu kemudian, semua
kalus yang terbentuk diperiksa dan skutelum yang tumbuh di ujung kalus dipotong dan dibuang. Selanjutnya, kalus dikulturkan kembali di dalam media yang sama
selama 2-8 minggu, bergantung pada perlakuan 2,4-D yang diberikan.
Kalus yang menunjukkan pertumbuhan baik (embriogenik) dipindahkan ke
dalam media regenerasi untuk diinduksi membentuk planlet selama 4-6 minggu.
Planlet yang terbentuk segera dikeluarkan dari botol dan diaklimatisasi selama 10
hari pada media kompus dalam wadah gelas plastik bekas minuman aqua dan disiram
dengan larutan urea dengan konsentrasi 2 g per liter. Selanjutnya, tanaman ditum- buhkan di lapang di bawah rumah plastik dengan menggunakan plastik polibag hitam
berisi 15 kg tanah podzolik merah kuning. Pupuk yang diberikan berupa urea
(4 ku/ha); KC1 (2 kulha) dan TSP (1 ku/ha). Semua tanaman yang berhasil mem- bentuk bunga normal diserbuk sendiri dan pada saat panen setiap tongkol buah dipi-
sahkan dalam kantong tersendiri. Secara ringkas, langkah-langkah tersebut ditun-
jukkan dalam Gambar 2.
3.4. Media Kultur
Dalam penelitian ini digunakan media setengah padat dari Murashige dan
Skoog (1962) yang komposisi lengkapnya dapat dilihat pada Tabel Lampiran 1.
Media setengah padat dibuat dengan melarutkan agar Bacto dengan konsentrasi 0.8 % (8 gll). Media dipanaskan di atas tungku listrik untuk melarut- kan agar dan sukrosa. Selanjutnya, larutan media ditakar dan dimasukkan ke da-
lam
botol yang sudah disterilkan sebelumnya sebanyak 20 ml setiap botol. Sete-lah
itu botol ditutup dengan aluminium foil dan disterilkan dalam autoklaf selama 45 menit dengan suhu 12 1"C
pada tekanan 17- 18 psi.3.5. Seterilisasi Alat dan Botol
Sebelum alat untuk penanaman digunakan, terlebih dahulu semuanya di- sterilkan dalam autoklav selama 1-1.5 jam pada tekanan 20 psi. Alat-alat yang digunakan untuk penanaman terdiri atas botol kultur, cawan petri
,
akuades, pisau pinset, dan lain-lain.I
3.6. Lingkungan Tumbuh Kultur
Pelaksanaan penanaman eksplan dilakukan di dalam kotak penanaman steril (laminar airflow cabinet) dan semua eksplan yang sudah selesai diinkubasikan di dalam botol kultur selanjutnya ditempatkan dalam ruang kultur yang suhunya diatur &tar (28 sf 2)
"C
dan diberikan cahaya lampu TL 20 watt selama 16 jam per hari.3.7. Pelaksanaan Percobaan
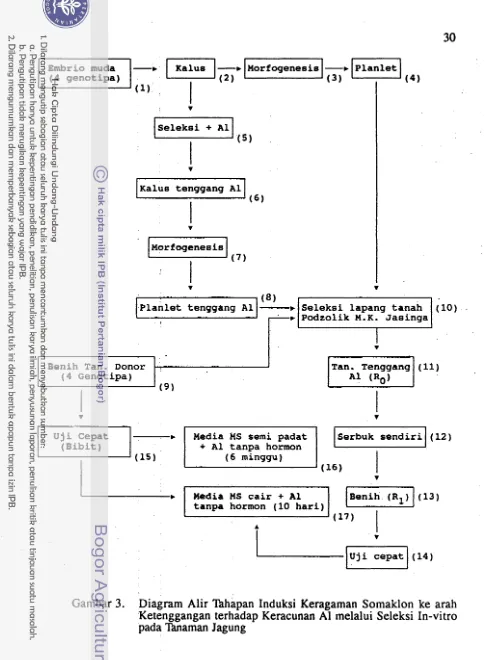
Penelitian ini dilaksanakan dalam beberapa tahap terdiri atas 4 kelompok percobaan seperti dilukiskan pada Gambar 3.
~
( 4 g e n o t i p a )~
FIX.
~
z
.
I
v
Kalus tenggang A1
I
( 6 )T
I
P l a n l e t tenggang A1
Benih Tan. Donor . ,
( 4 Genotipa)
I
(9U j i Cepat b
( B i b i t )
I
+ A1 tanpa hormon
( 6 minggu)
tanpa hormon ( 1 0 h a r i )
Tan. Tenggang ( 1 1 )
A l ( R o )
I
[image:200.555.47.533.28.688.2]