EKSPLORASI
HARMFUL ALGAL BLOOMS
(HABs) DAN
HUBUNGANNYA DENGAN KARAKTERISTIK LINGKUNGAN
DI PERAIRAN PESISIR SUMATERA SELATAN
RIRIS ARYAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertas berjudul Eksplorasi Harmful Algal Blooms (HABs) dan Hubungannya dengan Karakteristik Lingkungan di Perairan Pesisir Sumatera Selatan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016 Riris Aryawati
RINGKASAN
RIRIS ARYAWATI. Eksplorasi Harmful Algal Blooms (HABs) dan Hubungannya dengan Karakteristik Lingkungan di Perairan Pesisir Sumatera Selatan. Dibimbing oleh DIETRIECH G BENGEN, TRI PRARTONO dan HILDA ZULKIFLI.
Perairan pesisir Sumatera Selatan merupakan wilayah perairan yang banyak bermuara sungai besar yang berperan penting dalam roda kehidupan masyarakat Sumatera Selatan. Hal ini akan mempengaruhi organisme dan biota yang ada di dalam perairan. Salah satunya adalah fitoplankton yang berperan sebagai produsen primer dalam tingkatan rantai makanan pada perairan tersebut. Apabila suatu perairan mendapat masukan nutrien yang terlalu tinggi sehingga menjadikan kondisi perairan terlalu subur (eutrofikasi), hal ini dapat menimbulkan ledakan fitoplankton yang pada akhirnya akan mengganggu ekosistem perairan. Ledakan fitoplankton ini dikenal dengan istilah Harmful Algal Bloom (HABs).
Penelitian ini bertujuan untuk mengkaji karakteristik perairan pesisir Sumatera Selatan, mengetahui jenis, kelimpahan dan sebaran fitoplankton, mendeterminasi sebaran fitoplankton potensial HABs dan mendeterminasi hubungan antara fitoplankton penyebab HABs dengan karakteristik lingkungan menurut dimensi ruang dan waktu di pesisir Sumatera Selatan.
Hasil penelitian menunjukkan bahwa karakteristik perairan pesisir Sumatera selatan memiliki variasi yang luas karena letak stasiun yang terletak di muara sungai dan di laut, juga karena faktor musim yang berbeda. Hasil analisis PCA memperlihatkan bahwa pada saat pasang, salinitas, fosfat dan pH menjadi penciri pada stasiun 7. Kekeruhan, nitrat dan silikat menjadi penciri pada stasiun 9. Pada saat surut hasil analisis komponen utama menunjukkan suhu menjadi penciri di stasiun 1, 3 dan 9. PH menjadi penciri di stasiun 7. Fosfat dan kekeruhan menjadi penciri pada stasiun 9 dan stasiun 10.
Hasil penelitian ini menemukan 52 genera fitoplankton, yang terdiri dari kelas Bacillariophyceae (29 genera), Dinophyceae (8 genera) Cyanophyceae (7 genera) and Chlorophyceae (8 genus). Jumlah genera tertinggi dijumpai pada bulan November (24 genera) saat surut, dan terendah pada bulan Mei saat pasang (16 genera). Kelimpahan tertinggi dijumpai pada bulan Agustus dan September, dan terendah pada bulan Mei. Diindikasikan terdapat 19 genus fitoplankton yang dimungkinkan dapat membahayakan lingkungan perairan apabila berada dalam jumlah yang sangat tinggi (blooming). Delapan bersifat toksik, yang dapat memproduksi racun yang menyebabkan gangguan kesehatan pada manusia yang mengkonsumsinya (Nitszchia, Alexandrium, Dinophysis, Protoperidinium,
Prorocentrum, Anabaena, Microcystis dan Oscillatoria) dan sebelas tidak bersifat
toksik tetapi merupakan alga yang dapat menyebabkan berbagai efek merusak pada ekosistem perairan, termasuk mengakibatkan kekurangan oksigen pada perairan dan menyumbat insang ikan karena bentuk selnya yang tajam dan berantai banyak (Bacteriastrum, Chaetoceros, Coscinodiscus, Dytilum, Odontella,
Rhizosolenia, Skeletonema, Thalassiosira, Thalassiothrix, Ceratium dan
Noctiluca). Hasil penelitian mengindikasikan bahwa telah terjadi blooming
Chaetoceros pada bulan Agustus stasiun 4, dan Noctiluca pada bulan November stasiun 1.
Hasil analisis koresponden (CA), memperlihatkan hubungan antara kelimpahan genera fitoplankton potensial HABs dengan faktor lingkungan. Kelimpahan Skeletonema saat pasang dipengaruhi oleh silikat yang tinggi, nitrat, fosfat dan pH yang rendah. Kelimpahan Chaetoceros dipengaruhi oleh kekeruhan dan silikat yang rendah, suhu, pH, DO, fosfat dan nitrat yang tinggi. Noctiluca
dipengaruhi oleh salinitas yang tinggi. Saat surut kelimpahan Skeletonema
dipengaruhi oleh konsentrasi nitrat, fosfat dan silikat yang tinggi, serta suhu, salinitas, pH dan DO yang rendah. Kelimpahan Chaetoceros sangat dipengaruhi oleh suhu, salinitas, pH dan DO yang tinggi serta nitrat, fosfat, silikat yang rendah.
Analisis diskriminan menunjukkan bahwa terdapat parameter pembeda pada kondisi pasang dan surut. Parameter tersebut adalah adalah suhu, kekeruhan, arus, salinitas, pH, fosfat, silikat, Skeletonema dan Chaetoceros.
SUMMARY
RIRIS ARYAWATI. Exploration of Harmful Algal Blooms ( HABs ) and Its Relationship with Characteristics of Coastal Water Environment in South Sumatra. Supervised by DIETRIECH G BENGEN, TRI PRARTONO dan HILDA ZULKIFLI.
The South Sumatra coastal water is the mouth place of some large rivers that have important roles in daily activities and life of South Sumatra people. These activities will affect biota in water column including phytoplankton, the important biota in top level of aquatic food chain. While a water get high nutrient input that cause eutrofication, it might harmful to aquatic ecosystem due to the blooming of phytoplankton. The phenomenon of algae blooming is known as
Harmful Algal Bloom (HABs).
This study aimed to investigate the characteristics of South Sumatera coastal water, species identification, abundance and distribution of phytoplankton, to determine the distribution of potential HABs phytoplankton and its relation with aquatic environment caharacteristics based on spasiotemporal aspects of South Sumatera coastal.
The results indicated that the characteristics of the South Sumatra coastal water have wide variations because of the location of the stations are distributed widely from the mouth of the river to the sea, and also due to the different seasons. The PCA analysis showed that at high tide condition, salinity, phospate and pH characterized station 7. At low tide, temperature was the main characteristic of stations 1, 3 and 9, then pH characterized station 7. Stations 9 and 10 were caharacterized by phospate and turbidity.
This study found 52 genera of phytoplankton, consisted of Bacillariophyceae (29 genera), Dinophyceae (8 genera), Cyanophyceae (7 genera) and Chlorophyceae (8 genera). The highest number of genera at low tide was found at November (24 genera) and at May during high tide condition (16 genera). The highest abundance of phytoplankton occured at August and September, and lowest at May.
There were 19 potential HABs consisted of 8 toxic genera (Nitzschia,
Alexandrium, Dinophysis, Protoperidinium, Prorocentrum, Anabaena,
Microcystis and Oscillatoria) and 11 potential harmful genera (Bacteriastrum,
Chaetoceros, Coscinodiscus, Dytilum, Odontella, Rhizosolenia, Skeletonema,
Thalassiosira, Thalassiothrix, Ceratium and Noctiluca). The highest number of
HAB genera at high tide occured at July and lowest at April, and the highest abundance was found at August and lowest at March. At low tide, the highest and lowest number of HAB genera occured at October and January respectively, then the highest abundance found at August and lowest at March.
The spasiotemporal analysis by PCA indicated that Microcystis, Nitzschia,
Odontela, Bacteriastrum and Dytilum characterized stations 3, 5, 6, 8, 9, and 10 at
July. During August and September showed the highest abundance of
Thalassiosira, Coscinodiscus, Rhizosolenia, Protoperidinium, Chaetoceros,
Thalassiothrix and Skeletonema. At high tide, Anabaena, Thalassiosira,
abundance at stations 6 and 7 at July, August and September. At stations 2, 5 and 7 during July, and station 2 during August and September were characterized by
Nitzschia, Odontela, Coscinodiscus, Odontela and Dytilum. Station 9 at August
was characterized by Dinophysis and Bacteriastrum. During November, stasiun 1 was characterized by the highest abundance of Noctiluca.
Furthermore, the CA analysis showed that the abundance of Skeletonema
was influenced significantly by high concentration of nitrate, phosphate and silicate, but low temperature, salinity , DO and pH at high tide. The abundance of Chaetoceros and Noctiluca were affected substantially by low nitrate, phosphate and silicate, but high temperature, salinity , pH and DO. At low tide, Skeletonema is affected by high concentration of nitrate, phosphate and silicate, but low temperature, salinity, pH and DO. Abundance of Chaetoceros strongly influenced by high temperature, salinity, pH and DO but low nitrate, phosphate, and silicate.
Discriminant analysis shows that there are distinguishing parameters on the condition of high tide and low tide. These parameters are is temperature, salinity, turbidity, currents, phosphat, silicate, pH, Skeletonema and Chaetoceros.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Kelautan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
RIRIS ARYAWATI
EKSPLORASI
HARMFUL ALGAL BLOOMS
(HABs) DAN
Ujian Tertutup:
Penguji Luar Komisi: 1. Prof Dr Ir Dedi Soedharma, DEA 2. Prof Dr Ir Muhammad Zainuri, DEA
Sidang Promosi Terbuka:
PRAKATA
Alhamdulillah, segala puji dan syukur dipersembahkan kepada Allah SWT dan sholawat serta salam untuk Nabi Muhammad SAW, keluarga dan sahabatnya. Rasa syukur penulis sampaikan atas segala karunia-Nya sehingga disertasi ini berhasil diselesaikan. Tema dalam penelitian adalah ekologi fitoplankton potensial HABs, dengan judul Eksplorasi Harmful Algal Blooms (HABs) dan Hubungannya dengan Karakteristik Lingkungan di Perairan Pesisir Sumatera Selatan.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih yang tulus dan penghargaan yang setinggi-tingginya kepada Bapak Prof. Dr. Ir. Dietriech Geoffrey Bengen, DEA, Bapak Dr. Ir. Tri Prartono, M.Sc, dan Ibu Prof. Dr. Hilda Zulkifli, DEA, yang dengan penuh kesabaran dan ketulusan hati telah membimbing penulis dalam menyelesaikan disertasi ini. Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Dedi Soedharma, DEA dan Bapak Prof Dr Ir Muhammad Zainuri, DEA selaku anggota luar komisi yang telah berkenan menyumbangkan buah pikiran untuk memperkaya tulisan ini. Terima kasih kepada seluruh jajaran IPB, Rektor, Dekan Pascasarjana, Dekan FPIK, Ketua Program Studi IKL dan seluruh dosen IPB yang telah memberi kesempatan kepada penulis untuk menimba ilmu di instansi ini.
Terima kasih kepada Rektor Universitas Sriwijaya, Dekan FMIPA, Ketua Program Studi Ilmu Kelautan dan seluruh rekan-rekan dosen beserta staf UNSRI, khususnya Heron Surbakti, M.Si, Tengku Zia Ulqodry, M.Si, Ph.D dan Isnaini, M.Si atas bantuan dan dukunganya selama ini serta mahasiswa Kelautan UNSRI yang telah membantu di lapangan. Penghargaan dan terima kasih juga penulis sampaikan kepada rekan-rekan seperjuangan di IPB (Pak Tumpak, Wike, Iwan, Meutia, Khalid), semoga ilmu yang kita dapatkan bermanfaat bagi masyarakat luas dan menjadi ladang ibadah untuk kita semua ke depan.
Ungkapan terima kasih dan penghargaan secara khusus, penulis sampaikan kepada suamiku tercinta Suhartono, ST, MSi dan anak-anakku Sayyid Muhammad Umar Al-Haris, M. Ivan Samudera dan Rishanda Auliya Puteri serta Ayahandaku Bapak H. Jalaludin dan Bapak Soekar (Alm), Ibunda Sutini (Almh), Ibunda Pariyem (Almh) dan Ibunda Sunarsih serta ayah dan ibu mertuaku Bapak H.BS Soegeng (Alm), Ibu Hj. Tuminah (Almh) dan Ibu Hj. Zuraidah, juga untuk adik-adikku tercinta (Om Dian, Om Yoyok, Umi, Abi, Bunda, Bunda Icha, Bulik Uci dan Om Rus) serta seluruh keluarga, atas segala pengorbanan, doa dan kasih sayangnya.
Akhirnya penulis berharap semoga karya ilmiah ini bermanfaat dan Allah SWT meridhoiNya. Amin.
Bogor, Agustus 2016
! "
# $
% $
& ' $
( ) & *
! +% + *
+% + , + ++ *
+ - + . ' ' /
" & & ) & 0 ) ) ) 1- 1
& ) ) ) )
,
, +,
, ' "
) % "2
$ ) & 0 ) ) ) 1- 1
1 & 1 1 ) ) ) )
) ) "3
, "3
, +, "/
, ' $4
) % *
* & & & 1 & 1 ) )
) ) ) ) *"
, *"
, +, *$
, ' **
) % 5
5 ) 5"
2 ) ) 24
) % 24
) 2
) & 2
( -! # +% + % . ' ' , % ,+ 2
& ! , # +% + , % ,+ 3
" ' % 8+ + ! , # +% + , ' ' /
$ , ' % $4
* ( , % # +% + %+ % , %
% % 9 4" : -"; $*
5 ( , % # +% + %+ % , %
% 9 4" : -"; $5
2 ( , % # +% + %+ % , % '
% % 9 4" : -"; $2
3 ( , % # +% + %+ % , % '
% 9 4" : -"; $3
/ 9 % ; *3
4 9 % ; *3
9 % ; *3
9 % ; */
" 9 %+ ; 54
$ 9 %+ ; 54
* 9 %+ ; 54
5 9 %+ ; 54
+ , ) )
) ' % - 94<; % % 9 ;
, % 9 ; ' % $
" ) ' %+ 94<; % % 9 === ;
, % 9- - -; % *
$ ) ' % - 9% ; % %
9 ; , % 9 ; ' % 5
* ) ' %+ 9% ; % % 9 === ;
, % 9- - -; % 2
5 ) ' % - 9 ; , % %
9 ; , % 9 ; ' % 3
2 ) ' %+ 9 ; % 9 === ;
, % 9- - -; % /
3 ) ' - % , % 9 ; , % 9 ;
8 % ' % 4
/ ) ' %+ % % % 9 === ;
, % 9- - -; %
4 ) ' % - + 9 1; 9 : - ; , %
9 ; , % 9 ; ' %
) ' %+ + 9 1; 9 : - ; % %
9 === ; , % 9- - -; % "
) ' % - 8 % 9 :, - ; , %
" ) ' %+ 8 % 9 :, ; , % %
9 === ; , % 9- - -; % *
$ ) ' % - + 9 : - ; , %
9 ; , % 9 ; ' % 2
* ) ' %+ + , % %
9 === ; , % 9- - -; % 3
5 ) ' % - + #+ # 9 : - ; , %
9 ; , % 9 ; ' % /
2 ) ' %+ + #+ # 9 : - ; , % %
9 === ; , % 9- - -; % "4
3 ) ' % - + 9 : - ; , %
9 ; , % 9 ; ' % "
/ ) ' + 9 : - ; , % %
9 === ; , % 9- - -; % "
4 & , ' + 9 1 , <1 ; 9 : - ; , %
) ' > % "$
& , ' + 9 1 , <1 ; 9 : - ; , %
) . ' > % "$
& , ' + 9 : - ; 1 9 ; , <1 9 ;
, % % ) ) > % "*
" + %+ ' % # - %
, % % % "5
$ + %+ ' % # - %
, % % "2
* & % # +% + % , % %
% 9 ; , 9' > ; $
5 & % # +% + % , % % 9 === ;
, % 9- - -; 8 %+ $"
2 + %+ , % %
*4
3 + %+ , % %
) *
/ # < , % # % % *5
"4 # < , % # % *2
% % 2/
% % 34
" % % 3
$ % % % 3
* % + 9 1; % 3"
5 % 8 % % 3$
2 % % 3*
3 % #+ # % 35
/ % % 32
4 & % + # +% + 9 : -"; > %
& % + # +% + 9 : -"; > %
' % 4 " /4
" & % + # +% + 9 : -"; > %
' % 4 " % /
$ & % + # +% + 9 : -"; > %
' 4 " /
* & % + # +% + 9 : -"; > %
' 4 " % /"
5 & % + # +% + 9 : -"; > %
' ( 4 " /$
2 & % + # +% + 9 : -"; > %
' ( 4 " % /*
3 & % + # +% + 9 : -"; > %
' ( 4 " /5
/ & % + # +% + 9 : -"; > %
' ( 4 " % /2
4 & % + # +% + 9 : -"; > %
' 4 " /3
& % + # +% + 9 : -"; > %
' 4 " % //
& % + # +% + 9 : -"; > %
' ) % ' 4 " 44
" & % + # +% + 9 : -"; > %
' ) % ' 4 " % 4
$ & % + # +% + 9 : -"; > %
' 1 +' 4 " 4
* & % + # +% + 9 : -"; > %
' 1 +' 4 " % 4"
5 & % + # +% + 9 : -"; > %
' +? ' 4 " 4$
2 & % + # +% + 9 : -"; > %
' +? ' 4 " % 4*
3 & % + # +% + 9 : -"; > %
' ' 4 " 45
/ & % + # +% + 9 : -"; > %
' ' 4 " % 42
"4 & % + # +% + 9 : -"; > %
' ( 4 $ 43
" & % + # +% + 9 : -"; > %
' ( 4 $ % 4/
" & % + # +% + 9 : -"; > %
' ' 4 $ 4
"" & % + # +% + 9 : -"; > %
1 PENDAHULUAN
Latar Belakang
Fitoplankton merupakan organisme yang mempunyai peranan penting dalam kehidupan suatu perairan. Peran fitoplankton di perairan salah satunya sebagai produsen utama dalam rantai makanan. Fitoplankton di laut mempunyai peranan penting sebagai pembentuk dasar dari rantai makanan (food-chain) dan bertanggung jawab dalam produksi primer (primary production).
Dalam keadaan normal fitoplankton sangat dibutuhkan oleh organisme pada tingkatan trofik di atasnya, tetapi apabila berada dalam jumlah yang sangat besar akan membahayakan. Hal inilah yang disebut sebagai Harmful Algal Blooms (HABs). Graneli and Turner (2006) mendefinisikan Harmful Algae sebagai alga yang dapat menyebabkan berbagai efek merusak pada ekosistem perairan, termasuk mengakibatkan kekurangan oksigen pada perairan, menyumbat insang ikan, atau keracunan akibat mengkonsumsi fitoplankton yang mengandung racun. Dampak langsung dari beberapa Harmful Algae adalah kekurangan oksigen di perairan dalam, yang pada gilirannya, menyebabkan kematian massal hewan bentik dan membunuh ikan.
Blooming fitoplankton dapat menyebabkan kematian ikan akibat
kekurangan oksigen, pembusukan atau produksi biotoksin seperti PSP (Paralytic
Shellfish Poisoning), Ciguatera, tetradotoksin, DSP (diarrhetic shellfish
poisoning), NSP (neurotoxic shellfish poisoning), dan ASP (amnesic shellfish
poisoning) (Wiadnyana 1997; Graneli and Turner 2006). Jika manusia
mengkonsumsi ikan yang mengandung biotoksin, dapat mengalami keracunan bahkan kematian. Di samping itu adanya produk perikanan yang mengandung toksin dapat pula menyebabkan kerugian materi yang sangat besar bagi petambak dan nelayan (Mulyasari et al. 2003).
Racun-racun tersebut sangat berbahaya karena diantaranya menyerang sistem saraf manusia, pernapasan, dan pencernaan. Semua penyakit di atas berkaitan dengan konsumsi biota air khususnya kerang oleh manusia. Dan faktanya, semua jenis fitoplankton penghasil senyawa beracun di atas umumnya dapat dijumpai di perairan pesisir Indonesia (Praseno dan Sungestiningsih 2000). Lebih lanjut dinyatakan ada 37 spesies fitoplankton yang berpotensi HABs di perairan Indonesia. Sebagai contoh, menurut Setiapermana (1992), produksi biotoksin seperti PSP banyak dihasilkan oleh fitoplankton jenis Pyrodinium
bahamense var compressum, di mana jenis ini merupakan jenis fitoplankton dari
Di Pesisir Sumatera Selatan, berdasarkan hasil penelitian Aryawati et al. (2005) ditemukan beberapa jenis fitoplankton penyebab HABs, yaitu Ceratium sp,
Pseudonitzschia sp, dan Skeletonema sp. Pada tahun 2006 di perairan Sungai
Musi terjadi peristiwa keracunan ikan secara massal yang oleh masyarakat setempat dinamakan “ikan mabok”. Penyebab keracunan ikan tidak diketahui secara pasti. Berdasarkan penelitian Isnaini et al. (2011) pada perairan Muara Banyuasin yang dilakukan pada tahun 2005 dijumpai salah satu jenis fitoplankton penyebab HABs yakni jenis Gonyoulax sp dan kelimpahan tertinggi diatom yang ditemukan dari seluruh stasiun pengamatan pada kedua musim yaitu genera
Skeletonema. Hasil penelitian Surbakti et al. (2011) ditemukan juga dua jenis
diatom berpotensi HABs (Pseudonitszchia dan Skeletonema) dan empat jenis dinoflagellata toksik yaitu Ceratium, Dinophysis, Gymnodinium dan Pyrodinium.
Perumusan Masalah
Pesisir Sumatera Selatan merupakan wilayah bermuaranya empat sungai besar di Sumatera Selatan, yaitu Sungai Musi, Sungai Mesuji, Sungai Lalan dan Sungai Banyuasin. Perairan ini dimanfaatkan manusia untuk berbagai macam kegiatan, salah satunya adalah kegiatan menangkap/ mencari ikan oleh nelayan. Masyarakat umumnya dan nelayan khususnya memanfaatkan perairan ini untuk memenuhi kebutuhan hidup. Potensi sumber daya laut di daerah ini cukup besar antara lain ikan, udang dan kerang. Berdasarkan data dari BPS Sumatera Selatan (2011) produksi perikanan laut dari tahun 2006 sampai tahun 2010 terjadi peningkatan dari 35.484,4 ton menjadi 40.936 ton.
Peningkatan penduduk yang terjadi di Sumatera Selatan akan menimbulkan dampak yang tidak kecil pada wilayah pesisir. Data dari BPS Sumatera Selatan (2011) menyatakan bahwa selama kurun waktu 2002-2010 terjadi peningkatan jumlah penduduk di Sumatera Selatan dari 6.430.188 menjadi 7.450.394 orang. Pertambahan penduduk yang cepat ini menyebabkan peningkatan kegiatan di segala sektor, antara lain industri, transportasi, penangkapan maupun budidaya. Dampak dari meningkatnya aktivitas manusia ini akan berakibat pada tingginya limbah yang dihasilkan. Apabila limbah yang dihasilkan tinggi akan memicu pertumbuhan fitoplankton dengan cepat. Apabila hal ini didukung oleh faktor lingkungan lain seperti suhu yang tepat, tersedianya oksigen, dan intensitas cahaya yang sesuai maka ledakan fitoplankton bisa saja terjadi. Ledakan fitoplankton ini dikenal dengan istilah Harmful Algal Blooms (HABs). Hasil studi di perairan Hongkong menunjukkan adanya korelasi positif antara bertambahnya jumlah manusia dengan frekuensi kejadian ledakan blooming alga (Lam and Ho 1989 dalam Hallegraeff 1995).
Pemicu utama terjadinya HABs adalah ketika suatu perairan mendapat masukan nutrien yang terlalu tinggi sehingga menjadikan kondisi perairan terlalu subur (eutrofikasi). Hal ini lebih lanjut menimbulkan ledakan fitoplankton termasuk juga fitoplankton toksik. Perairan pesisir Sumatera Selatan sebagai muara dari empat sungai besar merupakan urat nadi kegiatan industri, pertanian, aktifitas rumah tangga, dan budidaya perikanan di Sumatera Selatan yang kesemuanya berpotensi menghasilkan limbah organik pemicu eutrofikasi perairan menjadikannya juga sangat rentan akan timbulnya bencana Harmful Algal
Berdasarkan penelitian yang telah dilakukan sebelumnya terlihat kecenderungan adanya peningkatan jumlah spesies HABs yang ditemukan dan juga kelimpahannya, hal ini didukung dengan adanya peningkatan konsentrasi nutrien pada setiap penelitian. Adanya jenis-jenis fitoplankton yang ditemukan di pesisir Sumatera Selatan yang dapat menimbulkan HABs dan adanya kecenderungan peningkatan jumlah spesies dan kelimpahan akan mengakibatkan kekhawatiran akan bencana ini.
Bila HABs terjadi di wilayah ini maka dapat menimbulkan kematian massal ikan karena terjadi penyumbatan insang atau kekurangan oksigen. Akan lebih berbahaya lagi apabila HABs yang terjadi ditimbulkan oleh jenis fitoplankton toksik yang dapat terakumulasi pada kerang maupun organisme laut lainnya sehingga dapat menimbulkan keracunan pada manusia yang mengkonsumsinya. Oleh karena itu perlu dilakukan penelitian tentang fitoplankton yang mempunyai peranan penting sebagai pembentuk dasar dari rantai makanan (food-chain) khususnya keberadaan fitoplankton berbahaya yang dapat mengganggu keastabilan ekosistem perairan dan juga kesehatan manusia.
Hal ini perlu dilakukan mitigasi sejak dini karena ada kecenderungan peningkatan spesies fitoplankton penyebab HABs, baik yang bersifat toksik maupun non toksik. Keadaan ini didukung oleh semakin tingginya kandungan hara di perairan oleh buangan limbah karena adanya aktivitas manusia yang terus bertambahseiring dengan bertambahnya populasi manusia, dan aktivitas tersebut akan terus meningkat di masa mendatang sesuai dengan laju pembangunan saat ini. Kondisi perairan pesisir Sumatera Selatan yang rentan terhadap blooming fitoplankton memerlukan adanya suatu penelitian untuk mendapatkan informasi tentang jenis, kelimpahan serta pola sebaran fitoplankton berbahaya (dari dimensi waktu dan ruang). Hal ini dilakukan sebagai deteksi awal keberadaan fitoplankton penyebab HABs yang ada di pesisir Sumatera Selatan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengeksplorasi fitoplankton yang berpotensi menyebabkan Harmful Algal Bloom (HABs) dan hubungannya dengan karakteristik lingkungan di Perairan Pesisir Sumatera Selatan. Secara khusus tujuan dari penelitian ini adalah:
1. Mengkaji karakteristik perairan pesisir Sumatera Selatan menurut dimensi ruang dan waktu
2. Mengetahui jenis, kelimpahan dan sebaran fitoplankton di pesisir Sumatera Selatan dalam ruang dan waktu.
3. Mendeterminasi sebaran spasio-temporal fitoplankton potensial HABs di perairan pesisir Sumatera Selatan secara spasio-temporal
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat digunakan sebagai informasi awal bagi pengelolaan wilayah pesisir, khususnya potensi blooming fitoplankton di perairan pesisir Sumatera Selatan sehingga dapat dilakukan tindakan-tindakan yang diperlukan agar tidak terjadi dampak merugikan bagi manusia.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi:
a. Pengukuran kandungan nutrien (nitrat, fosfat dan silikat)
b. Pengukuran kandungan bahan organik dari sungai yang masuk ke wilayah pesisir
c. Pengamatan dan pengukuran komunitas fitoplankton (identifikasi dan kelimpahan jenis).
d. Pengukuran parameter fisik-kimia oseanografi lainnya.
Kebaruan Penelitian
Fitoplankton potensial HABs (Chaetoceros, Skeletonema, dan Noctiluca) ditemukan pada musim berbeda yang sangat berkaitan dengan kualitas perairan.
Chaetoceros dan Skeletonema sangat melimpah pada saat surut di bulan Juli,
2 TINJAUAN PUSTAKA
Tinjauan Umum Fitoplankton
Fitoplankton berkaitan erat dengan komponen plankton autotrofik yang hanyut di kolom air. Kata fitoplankton berasal dari bahasa Yunani dari kata phyton yang berarti "tumbuhan" dan plankton yang berarti "pengembara" atau "hanyut". Kebanyakan fitoplankton terlalu kecil dilihat dengan mata telanjang. Tetapi jika fitoplankton tersedia dalam jumlah yang sangat besar, kehadiran mereka dapat menimbulkan perubahan warna yang berbeda-beda pada perairan
(discoloration of the water).
Walaupun banyak kelompok alga yang dikategorikan sebagai fitoplankton, secara umum di perairan hanya didominasi oleh 3 kelompok utama fitoplankton saja, yakni: Diatom, Cyanobacteria dan Dinoflagellata. Menurut Nybakken (1992) diatom (Bacillariophyceae) dan dinoflagellata (Dinophyceae) merupakan kelompok utama fitoplankton di laut. Diatom adalah golongan tumbuh-tumbuhan bersel tunggal yang mempunyai kulit yang mengandung silika (siliceous).
Fitoplankton ditemukan di seluruh samudera, danau dan laut yang terdapat di bumi. Meskipun demikian, secara lokal kelimpahan fitoplankton bervariasi secara horisontal, serta secara vertikal bervariasi menurut waktu setiap tahunnya. Kelimpahan dan distribusi fitoplankton sangat tergantung pada faktor-faktor seperti nutrien, parameter fisik kolom air, dan kelimpahan dari plankton yang lain. Secara umum, penyebab utama variasi sebaran fitoplankton adalah ketersediaan cahaya. Keberadaan fitoplankton di lautan sangat dipengaruhi oleh input energi matahari (kecuali yang melakukan kemosintesis). Dengan kata lain variasi kelimpahan cahaya secara geografis dan musim merupakan pembatas bagi produksi primer di lautan. Penyebab adanya variasi kelimpahan fitoplankton adalah ketersediaan nutrien (zat hara). Meskipun lautan-lautan di daerah tropik dan subtropik melimpah akan cahaya matahari, tetapi kawasan ini bisa dikatakan miskin akan ketersediaan nutrien-nutrien seperti nitrat, fosfat dan silikat. Fenomena miskin nutrien (poor nutrient) ini dapat diatasi bila terjadi proses pengadukan (turbulent), up-welling, dan proses sirkulasi massa air laut lainnya
Di permukaan perairan plankton cenderung terdapat jumlah yang melimpah di sepanjang kolom airnya. Di lapisan dalam di mana tidak terjadi produktifitas primer, maka zooplankton dan bakterioplankton mengganti (instead) makanannya dengan material organik yang tenggelam dari lapisan permukaan. Fenomena perubahan terus menerus (flux) material organik yang tenggelam
(organic material sinking) ini di daerah subtropis dapat disusul oleh suatu
fenomena yang dikenal dengan nama spring blooms (ledakan musim semi).
Fitoplankton dan Fenomena AlgalBloom
Blooming alga (algal bloom) adalah suatu proses peningkatan populasi
fitoplankton mencapai suatu kepadatan tertentu yang dapat membahayakan organisme di laut ataupun mengakibatkan terjadinya akumulasi toksin dalam tubuh organisme. Mulyasari et al. (2003) menjelaskan bahwa blooming terjadi jika jumlah kelimpahan fitoplankton pada saat itu melebihi jumlah rata-rata fitoplankton per bulannya. Widiarti (2000) menemukan blooming Skeletonema pada bulan Agustus dengan kelimpahan lebih dari 180.106 sel.m-3 kemudian diikuti Pyrodinium (Oktober) dengan kelimpahan lebih dari 80.106 sel.m-3. Pada bulan-bulan lainnya kelimpahan kedua jenis ini kurang dari 20. 106 sel.m-3
(Skeletonema) dan kurang dari 5. 106 sel.m-1 (Pyrodinium). Pada perairan Teluk
Ambon telah terjadi beberapa kali blooming alga pada bulan-bulan tertentu. Sidabutar (2006) menyatakan bahwa telah terjadi blooming Trichodesmium
erythraeum pada bulan Juli 1996 dengan kelimpahan 3.107sel.m-3 dan blooming
Alexandrium pada bulan Oktober 1997 dengan kelimpahan 2.109 sel.m-3.
Penelitian yang dilakukan Pednekar (2012) di estuaria Mandovi dan Zuari, Indiamenyatakan telah terjadi ledakan populasi Skeletonema dengan jumlah sel 1,3.104 sel.m-3.
Beberapa peneliti mendefinisikan HABs sebagai suatu fenomena blooming fitoplankton di suatu perairan yang dapat menyebabkan kematian biota lain dan juga perubahan struktur komunitas ekosistem perairan, keracunan dan kematian pada manusia. Toksin yang dihasilkan HABs dapat mengkontaminasi manusia melalui perantara kerang dan ikan.
Hallegraeff (1995) mengelompokkan HABs menjadi tiga tipe:
1. Tipe yang umumnya membuat perubahan warna pada air, membahayakan biota laut akibat terjadinya penurunan oksigen terlarut. Contoh: dinoflagellata Gonyaulax polygramma, Noctiluca scintillans, Scrippsiella trochoidea, cyanobacterium Trichodesmium erytrhraeum.
2. Tipe yang dapat menghasilkan racun dan membahayakan manusia. Contoh: dinoflagellata Alexandrium acatenella, A. Tamarense, Gymnodinium
catenatum, Pyrodinium bahamense, Dinophysis acuta, D. acuminata, D.
rotundata, Prorocentrum lima, diatom Pseudo-nitzschia multiseries, P.
Australis, cyanobacteria Anabaena circinalis, Nodularia spumigena.
3. Tipe yang tidak membahayakan manusia tetapi membahayakan biota laut, karena merusak dan menyumbat sistem pernafasan (insang). Contoh: diatom
Chaetoceros convolutus, dinoflagellata Gymnodinium mikimotoi
Graneli and Turner (2006) menyatakan bahwa dari 5000 spesies fitoplankton yang ada, diketahui sejumlah 300 dapat mengakibatkan HABs dan 80 jenis yang dapat memproduksi racun. Pada saat blooming ini, beberapa spesies dinoflagellata merupakan penghasil neurotoxins, suatu senyawa yang dalam jumlah tertentu dapat membunuh ikan-ikan, terakumulasi di dalam organisme filter feeders seperti shellfish, yang nanti pada gilirannya akan sampai kepada manusia yang mengkonsumsinya.
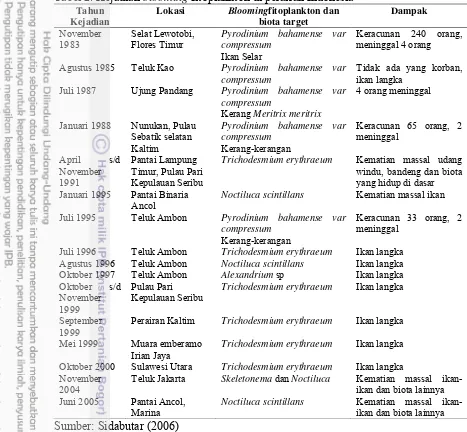
Cyanophyta. Beberapa contoh kejadian blooming fitoplankton secara lebih lengkap disajikan pada Tabel 2.
Tabel 1. Jenis-jenis fitoplankton penyebab HABs di perairan Indonesia
No Spesies No Spesies
Sumber: Praseno dan Sugestiningsih (2000)
Pada Tabel 2 terlihat bahwa di perairan Indonesia kejadian blooming sering terjadi antara bulan Juli sampai dengan Januari. Selama kurun waktu 12 tahun (1983-2005) di perairan Indonesia telah terdeteksi fitoplankton yang sering mengalami blooming adalah dari kelompok Dinoflagellata (Pyrodinium
bahamense var compressum, Noctiluca scintillans dan Alexandrium sp), satu jenis
dari kelompok Cyanophyta (Trichodesmium erythraeum) dan satu jenis dari kelompok diatom (Skeletonema). Dampak yang ditimbulkan oleh blooming alga ini dapat berakibat kerugian pada lingkungan, kerugian finansial bahkan kematian pada manusia.
Pertumbuhan alga yang berlebihan dapat mengganggu proses makan-memakan pada jaring makanan. Alga yang mati dan tenggelam ke dasar perairan akan merangsang pertumbuhan dekomposer, terutama bakteri. Proses pembusukan oleh dekomposer dapat mengakibatkan penurunan kadar oksigen pada lapisan air yang lebih dalam, dimana kondisi ini akan mengakibatkan terbunuhnya ikan-ikan atau adanya penggantian (replacement) oleh organisme-organisme yang lebih toleran terhadap kadar nutrien yang terlalu tinggi dan kadar oksigen yang rendah.
Tabel 2. Kejadian blooming fitoplankton di perairan Indonesia
Tahun Kejadian
Lokasi Bloomingfitoplankton dan biota target
Pyrodinium bahamense var compressum
Ikan Selar
Pyrodinium bahamense var compressum
Pyrodinium bahamense var compressum
Kerang Meritrix meritrix Pyrodinium bahamense var compressum
Kerang-kerangan
Trichodesmium erythraeum
Noctiluca scintillans
Pyrodinium bahamense var compressum
Skeletonema dan Noctiluca
Noctiluca scintillans
Kematian massal udang windu, bandeng dan biota yang hidup di dasar Kematian massal ikan
Kematian massal ikan-ikan dan biota lainnya Kematian massal ikan-ikan dan biota lainnya
Sumber: Sidabutar (2006)
Di pesisir Sydney, Australia, pada periode tahun 1978-1979 pernah terjadi
blooming fitoplankton, yang diawali dengan ledakan diatom berukuran kecil yang
membentuk rangkaian (Skeletonema, Thalassiosira, Leptocylindrus, Asterionella) diikuti dengan diatom berukuran besar (Eucampia, Detonula, Lauderia) dan terakhir ledakan dinoflagellata (Protoperidinium, Ceratium) (Rissik et al. 2009).
Di perairan Teluk Hurun, Lampung,pernah dilakukan penelitian serupa, diperoleh hasil bahwa blooming dimulai oleh Skeletonema (Agustus) kemudian diikuti Pyrodinium (Oktober) dan diakhiri oleh Chaetoceros (November) (Widiarti 2000). Hasil penelitian Widiarti (2000) menunjukkan bahwa
Skeletonema berkorelasi positif dengan fosfat di perairan, sedangkan Pyrodinium
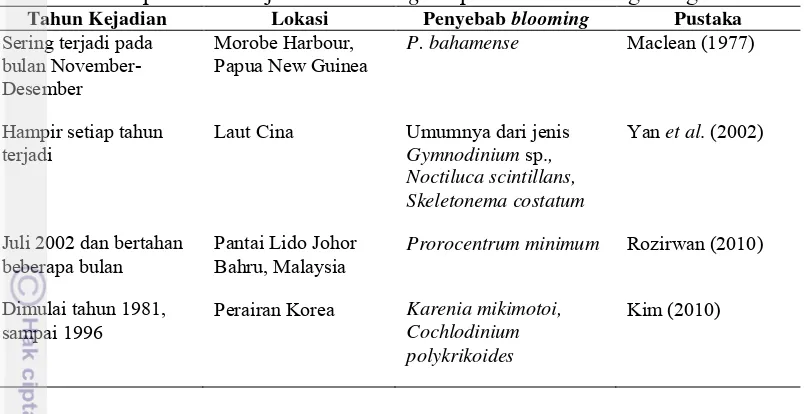
Tabel 3. Beberapa contoh kejadian blooming fitoplankton di berbagai negara.
Tahun Kejadian Lokasi Penyebab blooming Pustaka
Sering terjadi pada bulan November-Desember
Morobe Harbour,
Papua New Guinea P. bahamense Maclean (1977)
Hampir setiap tahun
terjadi Laut Cina Umumnya dari jenisGymnodinium sp.,
Noctiluca scintillans, Skeletonema costatum
Yan et al. (2002)
Juli 2002 dan bertahan
beberapa bulan Pantai Lido Johor Bahru, Malaysia Prorocentrum minimum Rozirwan (2010) Dimulai tahun 1981,
sampai 1996 Perairan Korea Karenia mikimotoi, Cochlodinium polykrikoides
Kim (2010)
Faktor-Faktor Penyebab HABs
Banyak penyebab blooming alga antara lain akibat aktivitas manusia, masukan nutrien yang berlebih, akibat kegiatan pertanian dan budidaya perairan,
over fishing, air ballast dan kemungkinan juga oleh adanya pengaruh perubahan
iklim global (Anderson et al. 2002). Sellner, et al. (2003) menyatakan bahwa
blooming dari suatu organisme didasarkan pada dua faktor utama yaitu proses
alami, seperti sirkulasi air dan aliran sungai, dan faktor non alami yaitu adanya aktivitas manusia yang menyebabkan pemasukan antropogenik ke wilayah perairan yang dapat menyebabkan eutrofikasi. Lebih lanjut beberapa ahli menyatakan bahwa keberadaan spesies HABs berkaitan dengan kondisi cuaca yang mempengaruhi parameter perairan seperti salinitas, suhu, arus, konsentrasi nutrien, pola musim, dan juga geomorfologi suatu wilayah (Tan et al. 2006 dan Tilstone et al. 1994 dalam Pednekar et al. 2012).
Maclean (1977) dan Pednekar et al. (2012) menyatakan bahwa hujan mempunyai peranan penting dalam distribusi spatiotemporal spesies alga berbahaya. Lebih lanjut Pednekar et al. (2012) menyatakan bahwa kelimpahan spesies HAB berkaitan dengan peningkatan nutrien yang masuk ke perairan pesisir yang berasal dari muara sungai dan tingginya nutrien di wilayah ini merupakan hasil dari kegiatan antropogenik. Panggabean (1994) menyatakan bahwa umumnya red tide terjadi di perairan yang mengalami penyuburan
(eutrophic) sangat tinggi. Penyuburan dapat berasal dari limbah daratan atau
karena perubahan musim. Di negara subtropis penyuburan terjadi pada musim panas. Kenaikan suhu air laut, mengakibatkan naiknya nutrien dari dasar perairan dan selanjutnya terjadi pengadukan. Di negara tropis perubahan suhu tidak terlalu nyata. Penyuburan mungkin terjadi pada musim hujan. Kim (2010) memberikan gambaran bahwa blooming fitoplankton di perairan laut Korea dapat terjadi apabila suhu air berkisar antara 24-26°C dan salinitas antara 32-33 psu.
3 KARAKTERISTIK DAN VARIABILITAS
SPASIO-TEMPORAL LINGKUNGAN PERAIRAN
PESISIR SUMATERA SELATAN
Pendahuluan
Perairan pesisir merupakan kawasan yang sangat penting untuk berbagai aktifitas pembangunan, seperti perikanan, pariwisata, industri dan sebagainya. Menurut Simanjuntak (1998), suatu perairan laut dapat dikatakan kaya akan sumberdaya perairan jika perairan tersebut memiliki kesuburan yang tinggi yang dapat dilihat dari produktifitas perairannya yang terkait erat dengan keberadaan fitoplankton. Semakin banyak fitoplankton pada suatu perairan maka semakin besar pula daya dukungnya bagi kehidupan komunitas penghuninya, sebaliknya fitoplankton yang sedikit menunjukkan daya dukung yang rendah pula. Keberadaan fitoplankton sangat dipengaruhi oleh faktor fisika dan kimia suatu perairan, terutama suhu, cahaya dan nutrien.
Menurut Anderson et al (2002), Domingues (2005), Lionard et al (2005), Harrison dan William (2008), Hasini et al (2012) nutrien adalah salah satu faktor yang harus tersedia agar proses fotosintesis dapat berlangsung. Nitrat dan fosfat terlarut dianggap penting bagi organisme perairan, karena di dalam perairan sedikit sekali tetapi dibutuhkan oleh organisme perairan, sehingga menjadi faktor pembatas. Di sisi lain, kadar nutrien yang sangat tinggi dan melebihi kebutuhan normal organisme nabati akan menyebabkan keadaan lewat subur (eutrofikasi) yang akan merangsang timbulnya blooming sehingga menyebabkan kematian organisme-organisme perairan akibat keadaan air yang anaerob.
Kejadian seperti itu dapat terjadi di perairan tempat bermuaranya sungai-sungai yang mengangkut limbah industri maupun yang berasal dari aktifitas manusia lainnya sehingga dampaknya akan mempengaruhi ekosistem perairan tersebut. Demikian halnya dengan perairan pesisir Sumatera Selatan yang merupakan tempat bermuara dari beberapa sungai yang ada di Sumatera Selatan. Beberapa peneliti terdahulu, Aryawati et al. (2005) menjumpai kandungan nutrien yang terukur sebesar 0.015 – 0.145 mg.L-1 (nitrat) dan 0,003 – 0,054 mg.L-1 (fosfat) dan saat itu ditemukan Ceratium sp dengan total kelimpahan 476 sel.m-3,
Pseudonitzschia sp 1,3.103 sel.m-3 dan yang tertinggi adalah jenis Skeletonema sp
dengan kelimpahan 1,3.106 sel.m-3. Pada saat itu suhu berkisar 29-320 C dan faktor lingkungan yang lain masih mendukung untuk pertumbuhan fitoplankton.
Hasil penelitian Surbakti et al. (2011) ditemukan juga beberapa jenis fitoplankton yang berpotensi mengakibatkan HABs, ada dua jenis diatom berpotensi HABs (Pseudonitszchia dan Skeletonema) dan empat jenis dinoflagellata toksik yaitu Ceratium, Dinophysis, Gymnodinium dan Pyrodinium. Konsentrasi nitrat yang terukur pada penelitian ini berkisar antara 2.8 – 21.30 mg.L-1, fosfat berkisar antara 0.01 – 2.25 mg.L-1, dan konsentrasi ammonia 0 – 0.05 mg.L-1.
Bahan dan Metode
Lokasi dan Waktu Penelitian
Penelitian ini dilakukan pada Bulan Maret 2013 sampai Februari 2014 di Perairan pesisir Sumatera Selatan (Gambar 1) pada saat pasang dan surut pada sepuluh titik pengamatan untuk mendapatkan pola sebarannya dari segi dimensi ruang.
Gambar 1. Peta Lokasi Penelitian di Pesisir Sumatera Selatan
Desain Penelitian
Penelitian dilakukan selama satu tahun di perairan pesisir Sumatera Selatan. Penelitian ini meliputi pengumpulan data kondisi kualitas lingkungan perairan termasuk pengukuran beban masukan bahan organik dari sungai ke laut (hal ini penting dilakukan karena nutrien yang diperlukan oleh fitoplankton berasal dari proses degradasi bahan organik).
Pengumpulan data parameter perairan (suhu, salinitas, kekeruhan, arus, pH, DO, nutrien) dilakukan setiap bulan selama satu tahun. Pengukuran beban masukan bahan organik dari sungai ke laut dilakukan empat kali dalam satu tahun yang mewakili musim.
Penentuan Lokasi Pengambilan Contoh
Pengambilan Contoh Air Laut dan Pengukuran Parameter Perairan
Sampel air diambil dengan water sampler lalu dimasukkan dalam botol sampel untuk selanjutnya disimpan dalam kotak pendingin untuk dianalisa kandungan unsur haranya (nitrat, fosfat dan silikat) serta kandungan BOD dan COD. Pada saat pengambilan sampel juga dilakukan pengukuran parameter oseanografi secara in situ seperti suhu, salinitas, pH, turbiditas, oksigen terlarut yang dilakukan dengan menggunakan CTD, pengukuran arah dan kecepatan arus dengan current meter.
Pengukuran Bahan Organik
Pengambilan sampel dan pengukuran bahan organik (BOD dan COD) dilakukan pada dua sungai di Sumatera Selatan yaitu Sungai Musi dan Sungai Banyuasin saat surut pada empat musim yang berbeda. Pengukuran BOD menggunakan metode langsung dengan DO meter yang merujuk kepada SNI 6989.72:2009 (2009). Pengukuran COD menggunakan metode spektrofotometri yang merujuk pada SNI 06-6989.2-2004 (2004).
Analisis Kimia Air
Pengukuran konsentrasi nitrat, fosfat dan silikat dilakukan dengan metode spektrofotometri menurut Standar Nasional Indonesia (SNI 2004).
Analisis Data
Data yang telah diperoleh selanjutnya ditampilkan dalam grafik diolah dengan menggunakan Excel. Analisis PCA Biplot digunakan untuk menentukan pengelompokan dan parameter penciri berdasarkan zona pengamatan. PCA juga bermanfaat untuk mengasosiasikan suatu peran deskriptif dalam batasan kuantitatif dan kualitatif (Bengen 2000). Dalam analisis ini, zona pengamatan menjadi objek, dan parameter-parameter lingkungan sebagai parameter. Hal ini dilakukan untuk mengamati kesamaan dan korelasi linier antara objek dan parameter yang diamati. Analisis ini dapat pula digunakan untuk mengamati variasi dari masing-masing parameter. Untuk memudahkan perhitungan dalam analisis, digunakan alat bantu perangkat lunak XLstat 2014.
Hasil dan Pembahasan
Suhu
masukan air sungai yang biasanya memiliki suhu yang lebih tinggi dari air laut umumnya.
Gambar 2. Sebaran spasial rata-rata suhu (0C) permukaan perairan saat surut (A) dan pasang (B) selama 12 bulan pengamatan
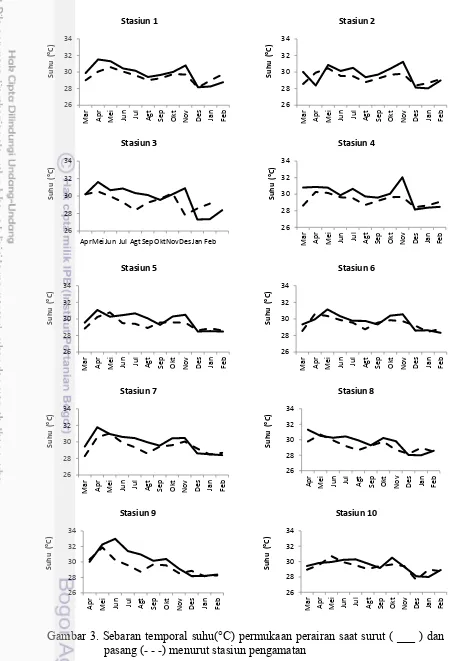
Selain itu proses pemanasan di perairan lebih optimal terjadi pada saat surut karena massa air yang lebih sedikit dibanding saat pasang. Pada Gambar 2 terlihat juga bahwa kisaran suhu pada stasiun 3 dan 9 memiliki rentang yang lebar, hal ini karena dangkalnya perairan di stasiun ini. Dangkalnya perairan memiliki fluktuasi yang lebar terhadap nilai suhu, karena pengukuran dilakukan setiap bulan sehingga kondisi suhu perairan sangat tergantung pada faktor musim. Bila ditinjau dari pengamatan setiap bulannya, secara umum suhu tinggi pada musim kemarau dan penghujan dan menurun pada musim peralihan (Gambar 3).
Kondisi suhu di perairan ini baik untuk pertumbuhan fitoplankton. Menurut Raymont (1963), suhu optimum untuk pertumbuhan fitoplankton pada perairan tropis berkisar antara 25 – 32 °C. Hasil ini mirip dengan penelitian yang dilakukan oleh beberapa peneliti lainnya di perairan Indonesia (Sidabutar 1997; Widiarti 2000; Haumahu 2004; Hadikusumah 2008; Hasani et al. 2012; Isnaini 2012; Mulyani et al. 2012).
28 29 30 31 32
1 2 3 4 5 6 7 8 9 10
S
u
h
u
(
°
C)
Stasiun Pengamatan A
28 29 30 31 32
1 2 3 4 5 6 7 8 9 10
S
u
h
u
(
°
C)
Gambar 3. Sebaran temporal suhu(°C) permukaan perairan saat surut ( ___ ) dan pasang (- - -) menurut stasiun pengamatan
26
AprMeiJun Jul Agt SepOktNovDes Jan Feb
Salinitas
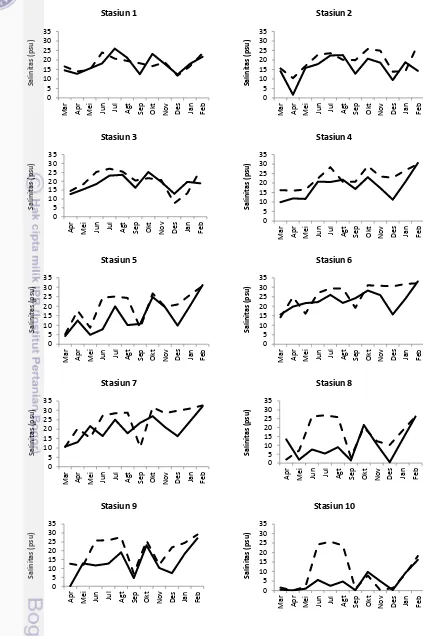
Salinitas berpengaruh terhadap penyebaran plankton, baik secara vertikal maupun horisontal (Romimohtarto dan Juwana 2004). Sebaran salinitas di laut dipengaruhi oleh berbagai faktor seperti pola sirkulasi air, penguapan, curah hujan dan aliran sungai. Perairan dengan tingkat curah hujan tinggi dan dipengaruhi oleh aliran sungai memiliki salinitas yang rendah sedangkan perairan yang memiliki penguapan yang tinggi, salinitas perairannya tinggi. Selain itu pola sirkulasi juga berperan dalam penyebaran salinitas di suatu perairan.
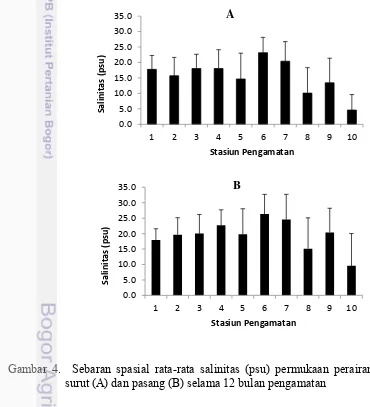
Salinitas pada lapisan permukaan saat penelitian berkisar antara 0,085 – 32.629 psu (surut) dan 0,095-33,051 psu (pasang) (Lampiran 2). Secara umum kondisi salinitas di pesisir Sumatera Selatan memiliki nilai sedikit lebih tinggi pada saat pasang dibandingkan saat surut (Gambar 4 dan 5). Pada saat pasang perairan banyak dipengaruhi oleh massa air dari laut yang bersalinitas tinggi sehingga kondisi perairan memiliki salinitas yang lebih tinggi di saat pasang dibandingkan saat surut yang banyak mendapat pengaruh dari massa air sungai. Kondisi salinitas di perairan ini hampir sama dengan kondisi perairan Indonesia lainnya yang memiliki sungai-sungai besar yang bermuara di laut (Azis 2007; Isnaini 2012; Sembiring et al. 2012; Supiyati et al. 2012).
Gambar 4. Sebaran spasial rata-rata salinitas (psu) permukaan perairan saat surut (A) dan pasang (B) selama 12 bulan pengamatan
0
Gambar 5. Sebaran temporal salinitas (psu) permukaan perairan saat surut ( ___ ) dan pasang (- - -) menurut stasiun pengamatan
Kekeruhan
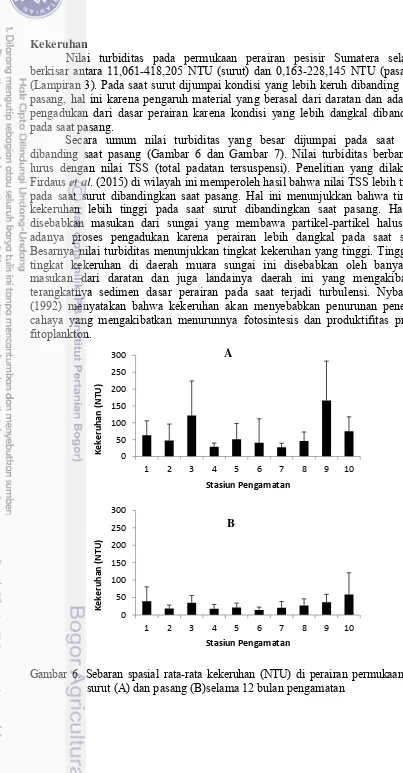
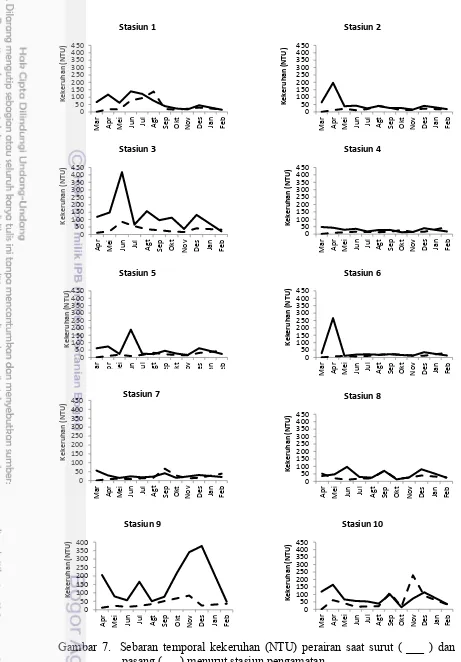
Nilai turbiditas pada permukaan perairan pesisir Sumatera selatan berkisar antara 11,061-418,205 NTU (surut) dan 0,163-228,145 NTU (pasang) (Lampiran 3). Pada saat surut dijumpai kondisi yang lebih keruh dibanding saat pasang, hal ini karena pengaruh material yang berasal dari daratan dan adanya pengadukan dari dasar perairan karena kondisi yang lebih dangkal dibanding pada saat pasang.
Secara umum nilai turbiditas yang besar dijumpai pada saat surut dibanding saat pasang (Gambar 6 dan Gambar 7). Nilai turbiditas berbanding lurus dengan nilai TSS (total padatan tersuspensi). Penelitian yang dilakukan Firdaus et al. (2015) di wilayah ini memperoleh hasil bahwa nilai TSS lebih tinggi pada saat surut dibandingkan saat pasang. Hal ini menunjukkan bahwa tingkat kekeruhan lebih tinggi pada saat surut dibandingkan saat pasang. Hal ini disebabkan masukan dari sungai yang membawa partikel-partikel halus dan adanya proses pengadukan karena perairan lebih dangkal pada saat surut. Besarnya nilai turbiditas menunjukkan tingkat kekeruhan yang tinggi. Tingginya tingkat kekeruhan di daerah muara sungai ini disebabkan oleh banyaknya masukan dari daratan dan juga landainya daerah ini yang mengakibatkan terangkatnya sedimen dasar perairan pada saat terjadi turbulensi. Nybakken (1992) menyatakan bahwa kekeruhan akan menyebabkan penurunan penetrasi cahaya yang mengakibatkan menurunnya fotosintesis dan produktifitas primer fitoplankton.
Gambar 6. Sebaran spasial rata-rata kekeruhan (NTU) di perairan permukaan saat surut (A) dan pasang (B)selama 12 bulan pengamatan
Gambar 7. Sebaran temporal kekeruhan (NTU) perairan saat surut ( ___ ) dan pasang (- - -) menurut stasiun pengamatan
Derajat keasaman (pH)
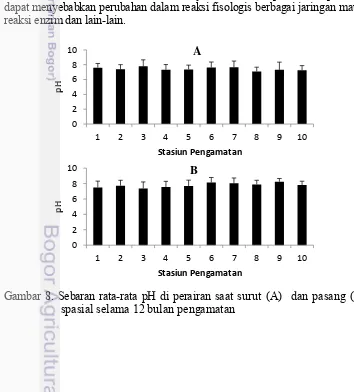
Derajat keasaman (pH) merupakan gambaran jumlah atau aktivitas ion hidrogen dalam perairan. Nilai pH suatu perairan dapat mencerminkan keseimbangan antar asam dan basa dalam perairan tersebut. Nilai pH berkisar antara 10-14, pH 7 adalah batasan tengah antara asam dan basa (netral). Semakin tinggi pH suatu perairan maka makin besar sifat basanya, demikian juga sebaliknya, semakin rendah nilai pH maka semakin asam suatu perairan.
Pada penelitian ini nilai pH berkisar antara 5,85-8,98 (surut) dan 6,12-8,98 (pasang) (Lampiran 4). Secara umum pH dijumpai sedikit lebih tinggi pada saat pasang (Gambar 8 dan Gambar 9), karena pengaruh masuknya air laut yang bersifat basa. Umumnya pH di perairan laut dan pesisir berkisar antara 7,70-8,4. Nilai pH pada penelitian ini memiliki kemiripan dengan nilai pH di beberapa wilayah perairan Indonesia (Soedibjo 2006; Prianto et al. 2013).
pH dipengaruhi oleh kapasitas penyangga (buffer) yaitu adanya garam-garam karbonat dan bikarbonat yang dikandungnya (Nybakken 1992). Nilai pH perairan merupakan parameter yang dikaitkan dengan konsentrasi karbon dioksida (CO2) dalam ekosistem. Semakin tinggi konsentrasi karbon dioksida, pH perairan semakin rendah. Konsentrasi karbon dioksida ditentukan pula oleh keseimbangan antara proses fotosintesis dan respirasi. Fotosintesis merupakan proses yang menyerap CO2, sehigga dapat meningkatkan pH perairan. Respirasi menghasilkan CO2 ke dalam ekosistem, sehingga pH perairan menurun. Karbon dioksida dalam ekosistem perairan dihasilkan melalui proses respirasi oleh semua organisme dan proses perombakan bahan organik dan anorganik oleh bakteri.
Romimohtarto dan Juwana (2004) menyatakan bahwa perubahan pH sedikit saja dapat menyebabkan perubahan dalam reaksi fisologis berbagai jaringan maupun pada reaksi enzim dan lain-lain.
Gambar 8. Sebaran rata-rata pH di perairan saat surut (A) dan pasang (A) secara spasial selama 12 bulan pengamatan
0 2 4 6 8 10
1 2 3 4 5 6 7 8 9 10
p
H
Stasiun Pengamatan A
0 2 4 6 8 10
1 2 3 4 5 6 7 8 9 10
p
H
Gambar 9. Sebaran temporal pH permukaan perairan saat surut ( ___ ) dan pasang (- - -) menurut stasiun pengamatan
Oksigen terlarut (DO)
Oksigen terlarut (DO) adalah jumlah oksigen terlarut dalam air yang berasal dari fotosintesa dan absorbsi atmosfer/udara. Oksigen terlarut di suatu perairan sangat berperan dalam proses penyerapan makanan oleh makhluk hidup dalam air. Sumber utama oksigen dalam air laut adalah dari udara melalui proses difusi dan proses fotosintesis fitoplankton dan tumbuhan air lainnya pada siang hari. Nybakken (1992) menyatakan bahwa kelarutan oksigen dalam air dipengaruhi oleh temperatur dan kecerahan, semakin rendah temperatur perairan semakin tinggi kelarutannya, dengan kata lain kandungan oksigen dalam kolom air akan semakin rendah.
Kadar DO yang terukur pada penelitian ini berkisar antara 2,630-8,740 mg.L-1 (surut) dan 3,490-8,217 mg.L-1 (pasang) (Lampiran 5). Nilai ini menurut Wardana (1995) masih cukup mendukung kehidupan organisme perairan secara normal karena memiliki nilai lebih dari 2 mg.L-1. Hasil ini juga memiliki kemiripan dengan beberapa penelitian yang dilakukan di perairan Indonesia (Sembiring et al. 2012). Oksigen di perairan bersumber baik melalui difusi dari
udara maupun dari hasil proses fotosintesis oleh organisme nabati, seperti fitoplankton dan tumbuhan air lainnya di zona eufotik. Oksigen dikonsumsi oleh tumbuhan dan hewan secara terus-menerus selama aktivitas respirasi. Salah satu faktor yang dapat mempengaruhi kadar oksigen terlarut dalam air laut adalah masuknya limbah yang dalam proses penguraiannya banyak membutuhkan oksigen. Limbah jenis ini umumnya berasal dari kegiatan-kegiatan penduduk.
Gambar 10. Sebaran spasial rata-rata oksigen terlarut (DO) (mg.L-1) di perairan saat surut (A) dan pasang (B)selama 12 bulan pengamatan
Arus
Arus sangat mempengaruhi sebaran dari fitoplankton. Ukuran fitoplankton yang sangat kecil mengakibatkan pergerakannya sangat tergantung pada pergerakan air (Romimohtarto dan Juwana 2004). Arah dan kecepatan arus pada perairan ini sangat bervariasi, mulai dari mulut sungai sampai dengan daerah perairan lepas. Kecepatan arus permukaan baik pada saat pasang maupun surut, memiliki nilai antara 0,029-0,945 m.det-1 (surut) dan antara 0,009-1-141 m.det-1 (pasang) (Lampiran 6).Kecepatan arus yang tinggi dijumpai pada daerah sekitar muara sungai (Gambar 12). Pada daerah muara sungai, besarnya arus yang mengalir ini kemungkinan karena derasnya aliran sungai yang masuk ke perairan muara sungai. Arah arus permukaan pada daerah muara umumnya mengikuti arah alur sungai.
Gambar 12. Sebaran spasial rata-rata kecepatan arus (m.det-1) di perairan saat surut (A) dan pasang (B)selama 12 bulan pengamatan
Gambar 13. Sebaran temporal kecepatan arus (m.det-1) di permukaan perairan saat surut ( ___ ) dan pasang (- - -) menurut stasiun pengamatan
Sebaran Spasio-Temporal Bahan Organik dan Anorganik
a. Kandungan nutrien
Nitrat
Nitrat (NO3) adalah bentuk utama nitrogen di perairan alami dan merupakan nutrien utama bagi pertumbuhan tanaman dan alga. Nitrat nitrogen sangat mudah larut dalam air dan bersifat stabil. Senyawa ini dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan. Nitrifikasi yang merupakan proses yang penting dalam siklus nitrogen dan berlangsung aerob (Effendi, 2003).
Konsentrasi nitrat yang diperoleh selama penelitian, memiliki nilai antara 0,110-3,190 mg.L-1 (surut) dan 0,640-3,980 mg.L-1 (pasang) (Lampiran 7). Berdasarkan keputusan MENLH No.51 Tahun 2004, baku mutu konsentrasi nitrat air laut yang layak untuk kehidupan biota laut adalah 0,008 mg.L-1. Hal ini dapat diartikan bahwa konsentrasi nitrat dalam penelitian ini jauh lebih tinggi atau berada di atas baku mutu. Data ini mengindikasikan bahwa perairan ini mengalami tekanan berupa pengkayaan nitrogen atau nitrat. Konsentrasi nitrat terlihat tinggi pada bulan Agustus dan September untuk stasiun 1, 2, 3, 6 dan 7 dan bulan November-Desember untuk stasiun 2, 4, 5, 6, 7, 8 dan 10 (Gambar 15).Tingginya nitrat di perairan ini kemungkinan besar dipengaruhi oleh masukan massa air dari beberapa sungai yang bermuara yang banyak membawa zat hara nitrat. Hal ini mirip dengan penelitian yang dilakukan Risamasu dan Prayitno (2011) di perairan Kepulauan Matasiri, Kalimantan Selatan yang menyimpulkan bahwa konsentrasi nitrat di perairan ini sangat tinggi dan melebihi ambang batas yang diperbolehkan (baku mutu). Tingginya konsentrasi nitrat ini mengindikasikan terjadinya pengkayaan nitrogen dan sebagian besar dipengaruhi oleh masukan massa air Sungai Barito yang membawa senyawa nitrogen dari daratan ke perairan laut.
Konsentrasi nitrat yang tinggi ditemukan juga pada beberapa wilayah perairan di Indonesia. Penelitian Pirzan dan Pong-Masak (2008) di perairan Pulau Bauluang, Takalar Sulawesi selatan menjumpai konsentrasi nitrat sebesar 1,37±0,008 mg.L-1. Rokhim et al. (2009) mendapatkan kandungan nitrat di perairan Kwanyar, Bangkalan sebesar 1,49-1,64 mg.L-1. Isnaini et al. (2014a) juga mendapatkan kandungan nitrat yang tinggi di perairan sekitar Pulau Maspari, Ogan Ilir Sumatera Selatan sebesar 1-2,1 mg.L-1. Handoko et al. (2013) melakukan penelitian di Kepulauan Karimunjawa, Jawa Tengah dan menunjukkan bahwa nitrat mempunyai nilai sebaran antara 0.108-1.595 mg.L-1.
Fosfat
Gambar 14. Sebaran spasial rata-rata konsentrasi nitrat (mg.L-1) di perairan saat surut (A) dan pasang (B)selama 12 bulan pengamatan
Konsentrasi fosfat yang diperoleh pada penelitian ini berkisar antara 0,030-1,660 mg.L-1 (surut) dan 0,020-1,110 mg.L-1 (pasang) (Lampiran 8). Dalam keputusan MENLH No.51 Tahun 2004, disebutkan bahwa baku mutu konsentrasi maksimum fosfat yang layak untuk kehidupan biota laut adalah 0,015 mg.L-1. Dengan demikian secara umum kondisi fosfat di perairan pesisir Sumatera Selatan tergolong tinggi.
Apabila dibandingkan dengan wilayah perairan Indonesia lainnya, konsentrasi fosfat di wilayah ini lebih tinggi dibandingkan perairan Takalar, Sulawesi Selatan 0,319-0,336 mg.L-1 (Pirzan dan Pong-masak 2008) dan perairan Kwanyar, Bangkalan sebesar 0,05-0,96 mg.L-1 (Rokhim et al.2009). Tetapi apabila dibandingkan dengan perairan Kepulauan Karimunjawa Jawa Tengah, kandungan fosfat di perairan pesisir Sumatera Selatan ini lebih kecil, Handoko et al. (2013) mendapatkan nilai konsentrasi fosfat di Karimunjawa sebesar 1.769-4.030 mg.L-1.
0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5
1 2 3 4 5 6 7 8 9 10
N
itr
at
(m
g
.L
-1)
Stasiun Pengamatan B
0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5
1 2 3 4 5 6 7 8 9 10
N
itr
at
(m
g
.L
-1)
Gambar 15. Sebaran temporal konsentrasi nitrat di permukaan perairan saat surut ( ___ ) dan pasang (- - -) menurut stasiun pengamatan
Gambar 16. Sebaran spasial rata-rata konsentrasi fosfat (mg.L-1) di perairan saat surut (A) dan pasang (B)selama 12 bulan pengamatan
Silikat
Silikat merupakan bahan dasar penting untuk pembentukan kerangka diatom, dan juga penting bagi radiolaria (Romimohtarto dan Juwana 2004). Silikat berasal dari pelapukan batu-batuan dan kerak bumi. Menurut Millero dan Sohn (1991), pada dasarnya sumber silikat di laut sebagian besar merupakan hasil pelapukan yang terbawa oleh aliran sungai dan angin melalui arus laut. Kandungan silikat di perairan pesisir Sumatera Selatan pada saat penelitian dilakukan berkisar antara 0,001-0,660 mg.L-1 (surut) dan 0,001-0,430 mg.L-1 (pasang) (Lampiran 9). Hasil ini mirip dengan penelitian yang dilakukan Tambaru (2008) di perairan pesisir Maros Sulawesi Selatan, tetapi lebih kecil bila dibandingkan dengan penelitian Simanjuntak (2007) di Teluk Jakarta.
Gambar 17. Sebaran temporal konsentrasi fosfat (mg.L-1) di permukaan perairan
Apr Mei Jun Jul Agt Sep Okt NovDes Jan Feb
F
Apr Mei Jun Jul Agt Sep Okt NovDes Jan Feb
F
Apr Mei Jun Jul Agt Sep Okt NovDes Jan Feb
Gambar 18. Sebaran spasial rata-rata konsentrasi silikat (mg.L-1) di perairan saat surut (A) dan pasang (B)selama 12 bulan pengamatan
b. Kandungan bahan organik
Effendi (2003) menyatakan bahwa terdapat tiga cara pengukuran yang umumnya digunakan untuk memperkirakan kandungan bahan organik di perairan, yaitu dengan memperkirakan Biological Oxygen Demand (BOD), Chemical
Oxygen Demand (COD) dan Total Organik Carbon (TOC).Berdasarkan
kemampuan oksidasi, maka penentuan nilai BOD dan COD yang dianggap paling baik dalam menggambarkan keberadaan bahan organik (Effendi 2003).
BOD adalah kebutuhan oksigen (mgO2.L-1) oleh mikroorganisme di perairan untuk mendegradasi unsur-unsur sederhana dan senyawa kompleks yang berasal dari limbah domestik yang dibuang atau secara alamiah terdapat didalam perairan. Pada umumnya besarnya konsentrasi BOD dari limbah domestik yang tidak diolah mulai dari 110 mg.L-1 sampai dengan 400 mg.L-1 (Suhartono 2004). Secara tidak langsung, BOD merupakan gambaran bahan organik atau dengan kata lain BOD menunjukkan jumlah oksigen yang dikonsumsi oleh proses respirasi mikroba aerob yang terdapat dalam botol BOD yang diinkubasi (Effendi 2003; Salmin 2005).
0 0.1 0.2 0.3 0.4 0.5 0.6
1 2 3 4 5 6 7 8 9 10
S
il
ikat
(m
g
.L
-1)
Stasiun Pengamatan B
0 0.1 0.2 0.3 0.4 0.5 0.6
1 2 3 4 5 6 7 8 9 10
S
il
ikat
(m
g
.L
-1)
Gambar 19. Sebaran konsentrasi silikat (mg.L-1) di permukaan perairan saat surut ( ___ ) dan pasang (- - -) menurut stasiun pengamatan
0.0
Apr Mei Jun Jul Agt Sep Okt Nov Des Jan Feb
S
Apr Mei Jun Jul Agt Sep Okt Nov Des Jan Feb
S
Apr Mei Jun Jul Agt Sep Okt Nov Des Jan Feb
COD menggambarkan jumlah total oksigen yang dibutuhkan untuk mengoksidasi bahan organik secara kimiawi, baik yang dapat didegradasi secara biologis maupun yang sukar didegradasi secara biologis menjadi CO2 dan H2O. Parameter COD digunakan secara luas untuk menentukan tingkat pencemaran oleh senyawa organik dari suatu air limbah domestik maupun air limbah industri. Definisi COD adalah banyaknya oksigen yang dibutuhkan untuk mengoksidasi senyawa organik, sehingga parameter COD dapat disebut sebagai parameter untuk mengetahui konsentrasi senyawa organik yang dapat dioksidasi oleh oksidator kuat dalam suasana asam (Effendi 2003).COD erat kaitannya dengan BOD karena banyak zat organik yang tidak mengalami penguraian biologi secara cepat berdasarkan pengujian BOD. Tetapi senyawa-senyawa organik itu tetap menurunkan kualitas air. Karena itu perlu diketahui konsentrasi organik dalam limbah melalui uji COD setelah masuk dalam perairan (Silalahi 2010).
Umumnya nilai COD lebih besar dibandingkan dengan nilai BOD. Nilai COD merupakan ukuran bagi pencemaran air oleh bahan-bahan organik yang secara alamiah dapat dioksidasikan melalui proses mikrobiologis dan mengakibatkan berkurangnya oksigen terlarut dalam air. Pada umumnya besarnya konsentrasi COD dari limbah domestik yang tidak diolah mulai dari 250 mg.L-1 sampai dengan 1000 mg.L-1 (Suhartono 2004).
BOD dan COD dapat mengindikasikan kandungan bahan organik di perairan. Artinya semakin tinggi nilai BOD dan COD, maka semakin tinggi kadar kandungan bahan organik yang terdapat dalam perairan.BOD hanya menggambarkan sebagian bahan organik mudah urai, tetapi dapat menggambarkan dinamika ekosistem perairan.COD dapat menggambarkan hampir keseluruhan kandungan bahan organik, baik yang mudah urai secara biologi maupun yang tidak mudah urai secara biologi, tetapi nilainya cenderung statis di perairan (Effendi 2003). Penentuan beban masukan bahan organik hasil oksidasi BOD dan COD dari beberapa aliran sungai dapat mempengaruhi nilai konsentrasi BOD dan COD yang terdapat di perairan muara karena perairan muara merupakan daerah akumulasi bahan yang masuk dari daratan.
Pada penelitian ini dilakukan pengukuran bahan organik dari sungai-sungai besar yang masuk ke perairan pesisir Sumatera Selatan, yaitu Sungai Musi dan Sungai Banyuasin.
Bahan organik Sungai Musi
Kandungan bahan organik pada Sungai Musi memiliki kisaran nilai antara 7,800-29,000 mg.L-1 (COD) dan 0,148-3,273 mg.L-1(BOD) (Gambar 20).Kondisi ini memperlihatkan bahwa Sungai Musi masih dikategorikan sebagai wilayah perairan yang masih dalam kondisi baik. Salmin (2007) menyatakan bahwa suatu perairan yang tingkat pencemarannya rendah dan dapat dikategorikan sebagai perairan yang baik, apabila kadar oksigen biokimianya (BOD) berkisar 0 - 10
mg.L-1. Hal ini sesuai pendapat Suhartono (2004). Kandungan bahan organik di wilayah ini berasal dari kegiatan pemukiman di sepanjang sungai, karena masyarakat masih mengandalkan sungai Musi untuk kegiatan domestik (Zulkifli
et al, 2008). Hasil penelitian ini mirip dengan penelitian yang dilakukan Debby et
Gambar 20. Kandungan bahan organik (BOD dan COD) (mg.L-1) di perairan Sungai
Musi bagian hilir menurut waktu pengamatan
Bahan organik Sungai Banyuasin
Kandungan bahan organik di Sungai Banyuasin memiliki kisaran nilai antara 8,00- 62,00 mg.L-1 (COD) dan 0,530-3,80 mg.L-1 (BOD) (Gambar 21). Sama halnya dengan kandungan bahan organik di Sungai Musi, bahan organik di Sungai Banyuasin memiliki rentang nilai yang dapat dikategorikan sebagai perairan yang baik, kadar oksigen biokimianya (BOD) berkisar 0 - 10 mg.L-1. Bahan organik di wilayah ini berasal dari serasah mangrove yang berada di perairan Banyuasin. Bahan organik dalam perairan laut terdiri dari kelompok hewan dan tumbuhan (makro dan mikro) yang hidup maupun yang telah mati, serasah atau detritus hasil degradasi bahan organik dan produk limbah organik hasil aktivitas manusia.
Gambar 21. Kandungan bahan organik (BOD dan COD) (mg.L-1) di perairan Sungai
Banyuasin bagian hilir menurut waktu pengamatan
Bahan organik pesisir Sumatera Selatan
Kandungan bahan organik di pesisir Sumatera Selatan, mengikuti pola yang ada di Sungai Musi dan Sungai Banyuasin. Konsentrasi BOD antara 0,530-3,80 mg.L-1dan konsentrasi COD antara 8,00- 62,00 mg.L-1. Pengamatan pada bulan April dan Juli memiliki konsentrasi bahan organik yang lebih tinggi dibandingkan pada bulan Oktober dan Januari. Secara umum kandungan bahan organik, khususnya BOD lebih tinggi pada saat pasang dibanding surut, karena pada saat surut masukan bahan organik dari daratan menjadi lebih besar.