REMAZOL YELLOW OLEH BIOMASSA Rhyzopus oryzae AKTIF DAN TERIMMOBILISASI
Oleh :
Prima Vinka Rahmayanti M 0301008
SKRIPSI
Ditulis dan diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
ii Pembimbing I
Triana Kusumaningsih, M.Si NIP 132 240 166
Pembimbing II
Khoirina Dwi N, M.Si NIP 132 258 052
Dipertahankan didepan TIM Penguji Skripsi pada : Hari : Jumat
Tanggal : 3 November 2006
Anggota TIM Penguji : 1. Fitria Rahmawati, M.Si
NIP 132 258 066 2. Venty Suryanti, M.Phil
NIP 132 162 026
1. ……….
2. ……….
Disahkan oleh
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Dekan,
Drs. Marsusi, MS NIP. 130 906 776
Ketua Jurusan Kimia,
iii
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul OPTIMASI pH DAN WAKTU KONTAK BIOSORPSI ZAT WARNA REMAZOL YELLOW
OLEH BIOMASSA Rhyzopus oryzae AKTIF DAN TERIMMOBILISASI adalah
benar-benar hasil penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan disuatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, November 2006
iv
BIOSORPSI ZAT WARNA REMAZOL YELLOW OLEH BIOMASSA Rhyzopus oryzae AKTIF DAN TERIMMOBILISASI. Skripsi. Jurusan Kimia. Fakultas
PMIPA. Universitas Sebelas Maret.
Telah dilakukan penelitian dengan judul Optimasi pH dan Waktu Kontak Biosorpsi Zat Warna RemazolYellow oleh Biomassa Rhyzopus oryzae Aktif dan
Terimmobilisasi. Tujuan penelitian ini adalah mengetahui pengaruh aktivasi NaOH dan immobilisasi pada natrium silikat biomassa Rhyzopus oryzae dalam proses penyerapan zat warna Remazol Yellow dengan beberapa variasi pH dan
lamanya waktu kontak, serta untuk menentukan jenis adsorpsi yang terjadi selama proses penyerapan.
Biomassa Rhyzopus oryzae ditumbuhkan pada media cair Yeast Ekstrak
Pepton Dekstrosa (YEPD). Biomassa diaktivasi dengan cara diberi NaOH 1 M, dipanaskan pada 121oC selama 15 menit lalu dikeringkan pada suhu 70oC selama 12 jam. Proses immobilisasi biomassa dilakukan dengan cara dicampur pada gel natrium silikat, kemudian dipanaskan pada suhu 60oC selama 12 jam. Zat warna
Remazol Yellow diserap dari larutannya dengan variasi pH 7 – 13 dan variasi
waktu kontak 10 – 100 menit. Konsentrasi zat warna Remazol Yellow yang
diserap dianalisis dengan spektrofotometer Ultraviolet-Visibel (UV-VIS) sebagai selisih dari konsentrasi awal dan konsentrasi terukur. Jenis isoterm adsorpsi diuji dengan isoterm adsorpsi Langmuir dan Freundlich.
Hasil penelitian menunjukkan bahwa daya serap biomassa aktif sebesar 2,623 mg/g pada kondisi pH 10-11 dan waktu kontak optimum 30 menit, sedangkan daya serap biomassa terimmobilisasi sebesar 3,775 mg/g pada kondisi pH optimum 11 dan waktu kontak optimum 20 menit. Isoterm adsorpsi yang sesuai untuk biomassa aktif maupun biomassa terimmobilisasi adalah isoterm Langmuir.
v
Prima Vinka Rahmayanti, 2006. OPTIMATION OF pH AND CONTACT TIME BIOSORPTION OF REMAZOL YELLOW DYE BY Rhyzopus oryzae BIOMASS
ACTIVE AND BIOMASS IMMOBILE. Thesis. Department of Chemistry. Mathematic and Science Faculty. Sebelas Maret University.
Optimation of pH and contact time biosorption of Remazol Yellow dye by Rhyzopus oryzae biomass active and biomass immobile has been carried out. The
aim of this research was to compare the ability of Rhyzopus oryzae biomass active
and biomass immobile at initial pH and contact time variation, and also to determine isotherm adsorption type that occurred during adsorption process.
Rhyzopus oryzae was grown in Yeast Ekstract Peptone Dextrose (YEPD)
liquid media. Rhyzopus oryzae biomass was activated by NaOH 1 M and heated
at 120oC during 15 minutes, then dried at 70oC during 12 hours. Rhyzopus oryzae
biomass was immobilized into natrium silicate matrix and dried at 60oC for 12 hours. The adsorption of Remazol Yellow dyes was conducted by varying pH
7-13 and contact time of 10, 20, 30, 40, 60, 80, and 100 minutes. Remazol Yellow
dye sorption was analyzed by Ultraviolet – Visible spectroscopy as difference between initial concentration and final concentration. Isoterms adsorption were analyzed by Langmuir and Freundlich isotherm.
The study yield that biomass immobile has higher biosorption capacity compare to biomass active. Optimum condition of biosorption Remazol Yellow
dye by biomass active found at pH 10 - 11 and contact time 30 minutes, while biosorption Remazol Yellow dye by biomass immobile found at pH 12 and contact
time 20 minutes. The capacity of biosorption in optimum condition for biomass active was 2.623 mg/g and biomass immobile was 3.775 mg/g. Isoterm analysis of Remazol Yellow dye by biomass active and biomass immobile was Langmuir
isotherm.
vi
Karena sesungguhnya sesudah kesulitan ada kemudahan. Maka apabila kamu telah selesai (dari satu urusan), kerjakanlah dengan sungguh-sungguh urusan yang lain (Q.S. Al-Insyirah : 6-7).
vii
K arya kecilku ini kupersembahkan kepada :
Bapak dan I bu tercinta, at as bimbingan, cinta, kasih sayang, dan perhatian untuk Ananda yang tak pernah mengenal lelah. Terima kasih atas semuanya, maaf jika Ananda sering berbuat salah, tapi Ananda akan berusaha mewujudkan semua harapan Bapak dan I bu.
Semua orang yang selalu menyayangiku dengan tulus.
viii
Segala puji syukur kehadirat Allah SWT, karena Ridhlo-Nya skripsi ini, yang berjudul “Optimasi pH dan Waktu Kontak Biosorpsi Zat Warna Remazol
Yellow oleh Biomassa Rhyzopus oryzae Aktif dan Terimmobilisasi” hingga selesai
dengan baik.
Skripsi ini disusun sebagai hasil penelitian yang telah penulis lakukan untuk memenuhi sebagian syarat guna memperoleh gelar Sarjana Sains pada Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret Surakarta.
Penulis telah banyak menerima bantuan, dorongan dan pertunjuk serta fasilitas dalam pengerjaan skrispsi ini. Oleh karena itu, penulis mengucapkan banyak terima kasih kepada semua pihak, terutama kepada :
1. Bapak Drs.Marsusi, M.S selaku Dekan FMIPA UNS.
2. Bapak Drs. Sentot Budi Rahardjo, Ph.D selaku Ketua Jurusan Kimia. 3. Ibu Triana Kusumaningsih, M.Si selaku dosen pembimbing I yang telah
berkenan meluangkan waktu dan memberikan bimbingan yang berguna demi terselesaikannya skripsi ini.
4. Ibu Khoirina Dwi N, M.Si selaku dosen pembimbing II yang dengan penuh kesabaran telah membantu dalam penyelesaian skripsi ini.
5. Bapak dan Ibu Dosen di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret atas semua ilmu yang berguna dalam penyusunan skripsi ini.
6. Bapak Agung Budiharjo, M.Si selaku Ketua Sub Laboratorium Biologi Laboratorium Pusat MIPA UNS beserta teknisi.
7. Ibu Desi Suci Handayani, M.Si selaku Ketua Laboratorium Kimia FMIPA UNS beserta teknisi
8. Kepala Laboratorium Kimia Organik UGM Yogyakarta beserta teknisi 9. Kepala Laboratorium Kimia Analitik Penelitian dan Pengembangan
ix
10. Teman-teman kimia ’01 ( Rere teman seperjuanganku, Inge, Ituk, Elis, Yeye, Ina, Opik, dll, makasih atas semuanya), kakak-kakak kimia ’98, 99, 00 dan adek-adek kimia ’02, 03, 04, 05 dan 06. Teman-teman kos Tiko, Heni, Ana makasih dah sering membantuku, Afro, Putri, Pipit, Alef, Diana, Silvi, Lilin, Helga, Iput, Rulis, Dewi makasih atas persahabatannya. Seseorang jauh disana yang selalu siap membantuku dan memberiku spirit, makasih bantuan dan keceriannya.
11.Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini
Penulis sadar bahwa skripsi ini masih jauh dari sempurna. Harapan penulis semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan dan kita semua. Amin
Surakarta, November 2006
x
HALAMAN JUDUL... i
HALAMAN PERRSETUJUAN ... ii
HALAMAN PERNYATAAN ... iii
HALAMAN ABSTRAK... iv
HALAMAN ABSTRACT ... v
HALAMAN MOTTO ... vi
HALAMAN PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
DAFTAR ISI... x
DAFTAR TABEL... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN... xvi
BAB I. PENDAHULUAN... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 4
1. Identifikasi Masalah ... 4
2. Batasan Masalah... 5
3. Rumusan Masalah ... 5
C. Tujuan Penelitian ... 5
D. Manfaat Penelitian ... 6
BAB II. LANDASAN TEORI ... 7
A. Tinjauan pustaka ... 7
1. Zat Warna Remazol Yellow... 7
2. Biomassa Rhyzopus oryzae... 8
a. Struktur Kitin... 9
b. Modifikasi Biomassa... 10
1. Aktivasi ... 10
xi
c. Karakterisasi Biomassa ... 12
1. Spektroskopi Infra Merah ... 12
2. Analisis Permukaan... 14
3. Adsorpsi... 15
a. Spektroskopi UV-VIS ... 16
b. Isoterm Adsorpsi ... 17
1. Isoterm Langmuir... 17
2. Isoterm Freundlich ... 17
B. Kerangka Pemikiran... 18
C. Hipotesis... 19
BAB III. METODOLOGI PENELITIAN ... 20
A. Metode Penelitian... 20
B. Tempat dan Waktu Penelitian ... 20
C. Alat dan Bahan yang Digunakan... 20
1. Alat yang Digunakan... 20
2. Bahan yang Digunakan ... 21
D. Prosedur Penelitian... 21
1. Preparasi Adsorben ... 21
a. Sterilisasi Alat ... 21
b. Pembuatan Media Pertumbuhan ... 22
1. Larutan Yeast Ekstrak Pepton... 22
2. Larutan Dekstrosa 40 %... 22
c. Penanaman Kultur Biomassa... 22
1. Penanaman Biomassa untuk Kultur Awal (Starter) ... 22
2. Penanaman Biomassa... 23
d. Aktivasi Biomassa... 23
e. Immobilisasi Biomassa... 23
2. Proses Adsorpsi... 24
xii
Natrium Silikat... 24
2. Penentuan pH optimum... 24
3. Penentuan Waktu Kontak Optimum ... 25
4. Penentuan Isoterm Adsorpsi ... 25
b. Aplikasi Limbah... 25
1. Adsorpsi Limbah Zat Warna... 25
2. Desorpsi ... 26
E. Teknik Pengumpulan Data... 26
F. Teknik Analisis Data... 26
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN... 28
A. Preparasi Adsorben ... 28
1. Penanaman Rhyzopus oryzae... 28
2. Aktivasi dan Immobilisasi Biomassa Rhyzopus oryzae... 29
3. Analisis Gugus Fungsi ... 30
4. Analisis Permukaan... 33
B. Proses Adsorpsi... 35
1. Adsorpsi Zat Warna Remazol Yellow... 35
a. Adsorpsi Zat Warna Remazol Yellow oleh Biomassa Tanpa Perlakuan Awal, Aktif dan Terimmobilisasi Natrium Silikat 35 b. Penentuan pH Optimum... 36
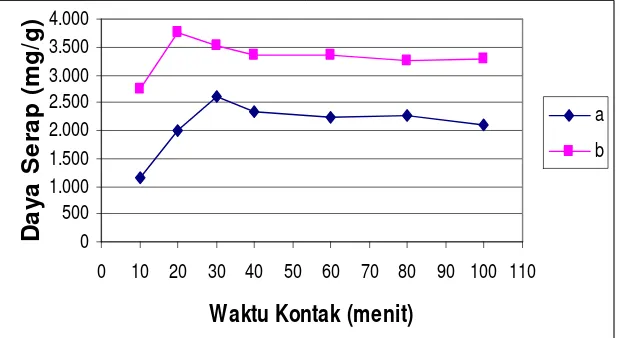
c. Penentuan Waktu Kontak Optimum ... 38
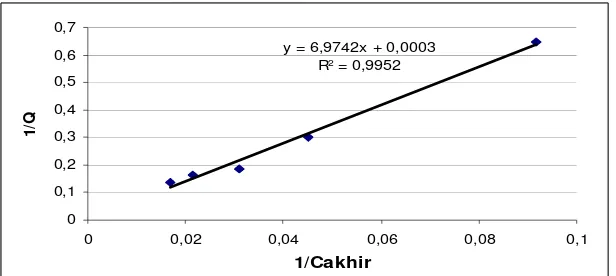
d. Penentuan Isoterm Adsorpsi Biomassa Aktif ... 40
1. Isoterm Langmuir... 40
2. Isoterm Freundlich ... 41
e. Penentuan Isoterm Adsorpsi Biomassa Terimmobilisasi Natrium Silikat... 41
1. Isoterm Langmuir... 41
2. Isoterm Freundlich ... 42
xiii
1. Adsorpsi ... 43
2. Desorpsi ... 44
BAB V. KESIMPULAN DAN SARAN... 45
A. Kesimpulan ... 46
B. Saran... 46
DAFTAR PUSTAKA ... 47
xiv
1. Biomassa dan Matrik yang Mengimmobilisasi Biomassa ... 11 2. Data Hasil Analisis Gugus Fungsi Biomassa Tanpa Perlakuan Awal,
Biomassa Aktif dan Biomassa Terimmobilisasi Natrium Silikat ... 31 3. Data Analisis Permukaan Biomassa Aktif, Natrium Silikat dan
Biomassa Terimmobilisasi Natrium Silikat ... 34 4. Adsorpsi Biomassa Aktif dan Biomassa Terimmobilisasi Natrium
Silikat terhadap Limbah Zat Warna ... 44 5. Hasil Desorpsi Biomassa Aktif dan Biomassa Terimmobilisasi
xv
Halaman
1. Struktur Zat Warna Remazol Yellow... 7
2. Struktur Turunan Vinil Sulfon ... 7
3. Rhyzopus sp... 8
4. Struktur Kitin ... 9
5. Spektra FTIR Biomassa Rhyzopus oryzae Tanpa Perlakuan Awal (a), Biomassa Rhyzopus oryzae Aktif (b) dan Biomassa Rhyzopus oryzae Terimmobilisasi Natrium Silikat (c) ... 30
6. Daya Serap Biomassa Biomassa Rhyzopus oryzae Tanpa Perlakuan Awal (a), Biomassa Rhyzopus oryzae Aktif (b) dan Biomassa Rhyzopus oryzae Terimmobilisasi Natrium Silikat (c) ... 35
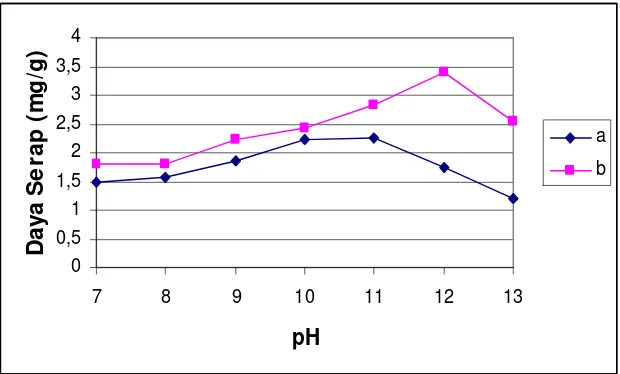
7. Pengaruh pH terhadap Daya Serap Biomassa Aktif (a) dan Biomassa Terimmobilisasi Natrium Silikat (b) ... 37
8. Pengaruh Waktu Kontak terhadap Daya Serap Biomassa Aktif (a) dan Biomassa Terimmobilisasi Natrium Silikat (b) ... 39
9. Isoterm Adsorpsi Langmuir Biomassa Rhyzopus oryzae Aktif ... 40
10 .Isoterm Adsorpsi Freundlich Biomassa Rhyzopus oryzae Aktif... 41
xvi
1. Spektra FTIR Biomassa Tanpa Perlakuan Awal... 50
2. Spektra FTIR Biomassa Tanpa Aktif... 51
3. Spektra FTIR Biomassa Tanpa Terimmobilisasi Natrium Silikat ... 52
4. Analisis Permukaan Biomassa Aktif dengan SAA ... 53
5. Analisis Permukaan Natrium Silikat dengan SAA ... 55
6. Analisis Permukaan Biomassa Terimmobilisasi Natrium Silikat dengan SAA... 57
7. Data Daya Serap Biomassa Tanpa Perlakuan Awal, Aktif, dan Terimmobilisasi Natrium Silikat ... 59
8. Data Optimasi pH Biomassa Aktif... 60
9. Data Optimasi pH Biomassa Terimmobilisasi Natrium Silikat ... 61
10. Data Optimasi Waktu Kontak Biomassa Aktif ... 62
11. Data Optimasi Waktu Kontak Biomassa Terimmobilisasi Natrium Silikat ... 63
12. Data Isoterm Adsorpsi Biomassa Aktif ... 64
13. Isoterm Adsorpsi Langmuir Biomassa Aktif ... 65
14. Isoterm Adsorpsi Freundlich Biomassa Aktif... 66
15. Data Isoterm Adsorpsi Biomassa Terimmobilisasi Natrium Silikat... 67
16. Isoterm Adsorpsi Langmuir Biomassa Terimmobilisasi Natrium Silikat ... 68
17. Isoterm Adsorpsi Freundlich Biomassa Terimmobilisasi Natrium Silikat ... 69
18. Aplikasi Adsorpsi Limbah Zat Warna ... 70
19. Desorpsi Limbah Zat Warna ... 71
20. Perhitungan Daya Serap dan persentase Adsorpsi Biomassa terhadap Zat Warna Remazol Yellow... 72
xvii
18. Uji Statistik Duncan dan Anova Optimasi pH Jamur Terimmobilisasi Natrium Silikat... 75 19. Uji statistik Duncan dan Anova Optimasi Waktu Kontak Jamur Aktif.... 77 20. Uji Statistik Duncan dan Anova Optimasi Waktu Kontak Jamur
1
PENDAHULUAN
A. Latar Belakang Masalah
Industri tekstil di Indonesia khususnya di Karesidenan Surakarta Jawa Tengah telah maju dengan sangat pesat. Perkembangan industri tekstil mempunyai dampak positif yaitu dapat meningkatkan kesejahteraan manusia. Selain berdampak positif, perkembangan industri tekstil ini juga bisa menimbulkan dampak negatif yaitu pencemaran lingkungan apabila air limbah industri tekstil yang berasal dari proses pencelupan zat warna dibuang ke sungai atau selokan tanpa diolah terlebih dahulu. Limbah zat warna industri tekstil ini bisa mengakibatkan penurunan kualitas air yang pada akhirnya bisa meracuni biota yang ada. Bila zat warna ini masuk ke tubuh manusia bisa bersifat karsinogenik yang bisa merangsang tumbuhnya kanker serta depresi (Franck, 1995).
Salah satu jenis zat warna reaktif yang sering digunakan dalam pewarnaan tekstil terutama pewarnaan batik adalah zat warna Remazol Yellow. Zat warna
Remazol Yellow sering digunakan dalam proses pencelupan batik karena
warnanya terang dan tidak mudah luntur (Gitopadmojo, 1978). Penelitian adsorpsi zat warna Remazol Yellow dengan enceng gondok teraktivasi NaOH telah
dilakukan oleh Rahmawati, Pranoto dan Aryunani, (2003) dimana limbah zat warna tekstil yang dapat diserap sebesar 4,44 mg/g. Supriyanto (2005) juga telah melakukan penelitian adsorpsi zat warna Remazol Yellow dengan alang-alang
teraktivasi NaOH dimana limbah zat warna Remazol Yellow yang bisa diserap
sebesar 5,165 mg/g.
Pengolahan zat warna selain menggunakan alang-alang atau enceng gondok dimungkinkan juga bisa menggunakan mikroorganisme jamur. Pengolahan polutan pada lingkungan dengan menggunakan mikroorganisme (material biologi) disebut biosorpsi. Komponen utama penyusun dinding sel mikroorganisme jamur yang sering digunakan untuk biosorpsi adalah kitin yang merupakan polimer N
dengan struktur selulosa dimana dimana C-2 kitin berupa gugus asetamida sedang pada selulosa berupa gugus hidroksil sehingga kitin dapat dipertimbangkan sebagai turunan selulosa (Pudjaatmaka, 1986). Selulosa banyak dimanfaatkan untuk menyerap zat warna, maka kitin juga bisa dimanfaatkan untuk mengadsorpsi zat warna. Sehingga mikroorganisme jamur bisa digunakan sebagai adsorben alternatif zat warna Remazol Yellow.
Salah satu jenis jamur yang komponen utama penyusun dinding selnya kitin adalah jamur Rhizopus oryzae. Jamur Rhizopus oryzae termasuk dalam kelas
Phycomycetes (Palezar, Chan, dan Palezar, 1986). Percobaan biosorpsi logam Fe(III), Cr(IV), Pb (II), Cu(II), dan Ni(II) dengan menggunakan biomassa
Rhizopus oryzae telah dilakukan oleh Sag dan Kutsal (2000).
Hasil penelitian Goksungup, Uren, dan Guvenc, (2002) menunjukkan bahwa perlakuan awal pada biomassa bisa meningkatkan proses biosorpsi dibandingkan biomassa tanpa perlakuan awal. Salah satu perlakuan awal biomassa adalah dengan perlakuan kimia yaitu dengan cara aktivasi baik menggunakan asam maupun basa. Yan dan Viraraghavan (2000) menunjukkan bahwa biomassa yang telah diaktivasi dengan menggunakan basa NaOH daya serapnya lebih besar bila dibandingkan dengan biomassa yang diaktivasi menggunakan asam. Aktivasi dapat membersihkan kitin pada dinding sel jamur dari pengotor yang berupa protein, lipid, dan ion-ion pengganggu pada dinding sel biomassa sehingga sisi aktif spesifik dinding sel jamur yang berfungsi sebagai adsorben dapat ditingkatkan.
Perlakuan awal pada biomassa selain aktivasi NaOH bisa juga dilakukan modifikasi biomassa dengan cara immobilisasi. Immobilisasi pada biomassa dapat meningkatkan kekuatan partikel, densitas, porositas dan ketahanan kimia biomassa (Goksungup, dkk, 2002). Selain itu immobilisasi biomassa juga bisa memperluas permukaan biomassa sehingga dapat meningkatkan kemampuan adsorpsi biomassa (Fomina, dan Gadd, 2002).
Penelitian immobilisasi Medicago sativa dengan menggunakan matrik
3
mengimobilisasi biomassa karena natrium silikat memiliki pori yang cukup besar sehingga mempunyai permukaan yang cukup luas setiap satuan berat yang bisa menyebabkan jumlah biomassa yang dapat diikat juga lebih banyak dibandingkan bahan yang tidak berpori. Santoso, (2005) juga telah melakukan percobaan immobilisasi Aspergillus oryzae dengan menggunakan matrik natrium silikat
untuk mengadsorpsi logam nikel (II), dimana adsorpsi logam nikel (II) oleh biomassa terimmobilisasi natrium silikat lebih besar daripada biomassa aktif tanpa immobilisasi.
Proses adsorpsi zat warna oleh biomassa selain dipengaruhi oleh perlakuan awal biomassa juga dipengaruhi oleh pH awal larutan zat warna dan waktu kontak. Percobaan adsorpsi zat warna Remazol Yellow biasanya dilakukan pada
pH basa karena pada pH basa dengan penambahan NaOH bisa terbentuk senyawa vinil sulfon yang bisa meningkatkan penyerapan (Jufri, 1976, Gitopadmojo, 1978). Hasil penelitian Rahmawati, dkk, 2003, menunjukkan bahwa proses adsorpsi zat warna Remazol Yellow oleh enceng gondok aktif mencapai optimum
pada pH 11, sedangkan pada penelitian Supriyanto, (2005) menunjukkan bahwa adsorpsi zat warna Remazol Yellow oleh alang-alang aktif mencapai optimum
pada pH 10.
Santoso, 2005 menunjukkan bahwa biosorpsi logam Ni (II) oleh biomassa
Aspergillus oryzae aktif dari 5 menit sampai 30 menit terus mengalami
peningkatan dari 6,862 mg/g menjadi 8,247 mg/g. Hasil penelitian Hadi, (2005) menunjukkan bahwa biosorpsi logam Ni(II) oleh biomassa Saccharomyces
cereviceae dari 0 sampai 30 menit juga terus mengalami peningkatan.
Proses adsorpsi dapat terjadi karena adanya ikatan antara adsorben dengan adsorbat secara kimia atau fisika. Apabila ikatan yang terjadi adalah ikatan kimia (adsorpsi kimia) maka ikatan antara adsorben dan adsorbat kuat tetapi adsorben yang sudah digunakan tidak bisa diperbaiki lagi sedangkan bila ikatannnya fisika (adsorpsi fisika) maka ikatan yang terjadi tidak terlalu kuat dan adsorben yang sudah digunakan dapat digunakan lagi karena desorpsinya mudah terjadi.
adalah isoterm Langmuir dan Freundlich. Apabila ikatan yang terjadi antara adsorben dengan zat yang diserap cenderung ikatan kimia (adsorpsi kimia) maka jenis isotermnya adalah isoterm Langmuir sedangkan bila ikatan yang terjadi adalah ikatan fisika (adsorpsi fisika) maka jenis isotermnya adalah isoterm Freundlich (Robert, 1997).
B. Perumusan Masalah 1. Identifikasi Masalah
Dinding sel jamur mengandung gugus fungsional yang berfungsi sebagai sisi aktif untuk adsorpsi. Komponen utama penyusun dinding sel jamur adalah kitin, dimana kitin merupakan turunan dari selulosa. Kitin ini berfungsi sebagai sisi aktif jamur yang mampu mengadsorpsi zat warna.
Proses adsorpsi dapat ditingkatkan dengan perlakuan awal yaitu dengan cara aktivasi. Aktivasi dapat dilakukan dengan penambahan asam maupun basa, tetapi aktivasi dengan menggunakan basa lebih efektif dan efisien. Aktivasi biomass dapat membersihkan kitin pada dinding sel biomassa Rhyzopus oryae dari
senyawa pengotor yang berupa protein, lipid, dan ion-ion pengganggu sehingga penyerapan biomassa dapat meningkat.
Perlakuan awal pada biomassa selain dengan cara aktivasi bisa juga dilakukan modifikasi biomassa dengan cara immobilisasi. Biomassa yang diimobilisasi pada pendukung berpori akan memiliki luas permukaan dan volume pori yang lebih besar serta mempunyai kekuatan partikel, porositas, ketahanan kimia dan luas permukaan yang tinggi. Oleh karena itu immobilisasi biomassa pada bahan yang berpori besar dapat meningkatkan proses penyerapan biomassa.
5
luas maka waktu kontak yang diperlukan pada proses adsorpsi lebih singkat dibanding adsorben yang mempunyai luas permukaan lebih kecil.
Sifat adsorpsi dapat dipahami dengan berbagai model isoterm. Isoterm adsorpsi Langmuir dan Freundlich merupakan isoterm adsorpsi sederhana yang sering digunakan untuk menentukan sifat adsorpsi suatu adsorben.
2. Batasan Masalah
a. Biomassa Rhizopus oryzae diaktivasi dengan menggunakan NaOH
b. Biomassa Rhizopus oryzae diaktivasi dan dilanjutkan immobilisasi pada
matrik natrium silikat
c. Proses bisorpsi dipelajari dengan variasi pH awal larutan 7, 8, 9, 10, 11, 12, dan 13 sedangkan varisasi waktu kontak selama 10, 20, 30, 40, 60, 80, dan 100 menit.
d. Jenis adsorpsi yang terjadi diolah dengan isoterm Langmuir dan Freundlich.
3. Rumusan Masalah
a. Bagaimana pengaruh aktivasi NaOH dalam proses penyerapan zat warna
Remazol Yellow oleh biomassa Rhizopus oryzae?
b. Bagaimana pengaruh penggunaan matrik natrium silikat dalam proses
penyerapan zat warna Remazol Yellow oleh biomassa Rhizopus oryzae yang
diaktivasi?
c. Bagaimana pengaruh pH awal dan waktu kontak dalam proses penyerapan ?
d. Bagaimana jenis adsorpsi yang terjadi ?
C. Tujuan Penelitian
1. Mengetahui pengaruh aktivasi NaOH dalam proses penyerapan zat warna oleh biomassa Rhyzopus oryzae
2. Mengetahui pengaruh penggunaan matrik natrium silikat dalam proses penyerapan zat warna Remazol Yellow oleh biomassa Rhyzopus oryzae
4. Menentukan jenis adsorpsi yang terjadi selama proses penyerapan.
D. Manfaat Penelitian
Memperoleh alternatif adsorben zat warna Remazol Yellow dalam
7
LANDASAN TEORI
A. Tinjauan Pustaka 1. Zat Warna Remazol Yellow
Jenis zat warna berdasarkan sifat pencelupan dan aplikasinya dapat digolongkan menjadi 12 yaitu : zat warna bejana (tong), zat warna basa, zat warna asam, zat warna direk, zat warna mordan (beitsa), zat warna azoat (naftol), zat warna belerang (sulfur), zat warna bejana mengandung belerang (hidron), zat warna bejana larut, zat warna dispersi, pigmen, dan zat warna reaktif. Salah satu jenis zat warna reaktif adalah Remazol Yellow. Zat warna Remazol Yellow sering
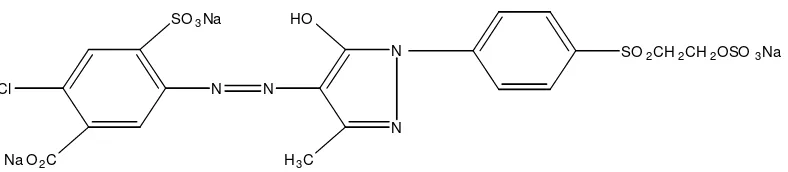
digunakan dalam industri batik (Gitopadmojo, 1978). Zat warna Remazol Yellow mempunyai struktur seperti disajikan pada Gambar 1.
N
Cl N
SO2CH2CH2OSO3Na
N N HO
H3C
Na O2C
SO3Na
Gambar 1. Struktur Zat Warna Remazol Yellow (Krik-Othmer, 1992)
Zat warna Remazol Yellow dapat bereaksi dengan alkali membentuk
senyawa turunan vinilsulfon. Persamaan reaksi Remazol Yellow dengan alkali
NaOH disajikan pada persamaan (1) (Jufri, 1976., Gitopadmojo, 1978) :
Z-SO2-CH2-CH2-OSO3-Na + NaOH → Z-SO2-CH=CH2 + Na2SO4 + H2O…….(1)
Z adalah bagian zat warna.
Gugus vinilsulfon [–SO2-CH=CH2] merupakan bagian zat warna yang dapat menyebabkan terjadinya kepolaran yang kuat. Struktur turunan vinilsulfon disajikan pada Gambar 2.
δ-
δ+
Z-SO2-CH=CH2
Ikatan rangkap dari senyawa radikal vinil sulfon pada zat warna Remazol
Yellow tersebut bereaksi dengan gugus hidroksil dari air, alkohol, dan selulosa
disajikan pada persamaan (2) (Gitopadmojo, 1978) :
Z-SO2-CH=CH2 + R-O-H → Z.W.-SO2-CH2-CH2-OR…………..………(2)
Ikatan yang terjadi antara senyawa radikal vinil sulfon pada zat warna
Remazol Yellow dengan gugus hidroksil membentuk ikatan kovalen.
Zat warna Remazol Yellow bila dibuang langsung ke lingkungan sangat
berbahaya karena dapat menyebabkan penurunan kualitas air sehingga perlu dilakukan upaya untuk mengurangi limbah zat warna dilingkungan. Untuk mengurangi limbah zat warna tersebut dilakukan proses adsorpsi. Zat warna dapat diadsorpsi dengan bahan yang mengandung selulosa, karbon aktif, hidrokalsit, zeolit, dan dimungkinkan juga bisa menggunakan biomassa.
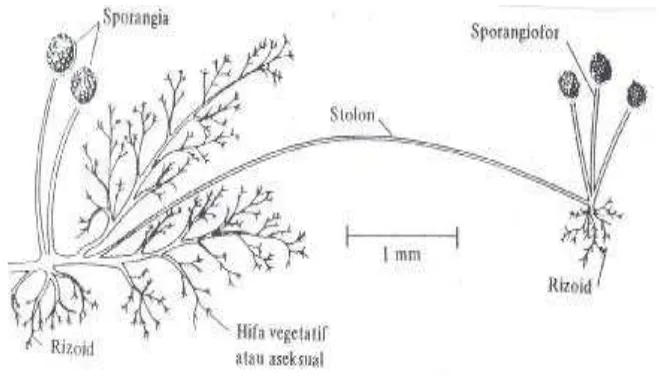
2. Biomassa Rhizopus oryzae
Rhizopus oryzae yang disajikan pada Gambar 3 disebut juga sebagai Rhizopus arrhizus. Jamurtersebut banyak dimanfaatkan pada fermentasi makanan
dan alkohol di Indonesia, China dan Jepang. Jamur Rhizopus oryzae dapat
diisolasi dari tanah, tumbuhan yang busuk, bahan makanan, serta pada kotoran hewan dan burung (Ellis, 2005)
9
Taksonomi Rhizopus oryzae (Ellis, 2005):
Kingdom : Fungi Phyllum : Zygomycota Class : Phycomycetes Order : Mucorales Family : Mucoraceae Genus : Rhizopus Species : Oryzae
Secara umum dinding sel jamur mengandung polisakarida dengan protein, lipid, dan ion-ion pengganggu yang membentuk dinding sel jamur (Goksungup, dkk, 2002). Komponen utama yang ada dalam jamur adalah kitin (Madigan, Martindo dan Parker, 1997).
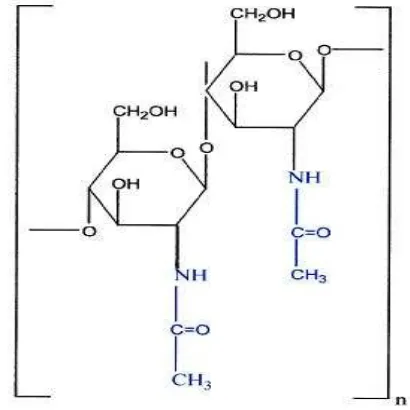
a. Struktur Kitin
Kitin merupakan senyawa karbohidrat golongan polisakarida linier yang mengandung N-asetil-D-glukosamina terikat β. Kitin dapat dipertimbangkan
sebagai turunan selulosa karena gugus hidroksil pada atom C-2 selulosa digantikan oleh gugus amida (Pudjaatmaka, 1986). Struktur kitin disajikan pada Gambar 4.
Kitin dimungkinan dapat digunakan sebagai adsorben zat warna Remazol
Yellow. Gugus aktif pada kitin dapat berikatan dengan gugus vinilsulfon pada zat
warna Remazol Yellow.
Peningkatkan adsorpsi zat warna Remazol Yellow oleh biomassa dapat
dilakukan dengan cara modifikasi pada biomassa. Hasil penelitian Goksungup, dkk (2002) menunjukkan bahwa perlakuan awal pada biomassa dapat meningkatkan daya serap biomassa.
b. Modifikasi Biomassa 1. Aktivasi
Perlakuan awal dengan cara aktivasi menggunakan NaOH pada biomassa bertujuan untuk membersihkan kitin pada dinding sel biomassa Rhyzopus oryzae
dari komponen lain yang berupa protein, lipid, dan ion-ion pengganggu. Aktivasi dengan NaOH dapat menghancurkan enzim autolitik yang menyebabkan pembusukan dan menghilangkan senyawa-senyawa pengotor yang berupa lipid, protein dan ion-ion pengganggu yang menutupi dinding sel jamur.
11
2. Immobilisasi
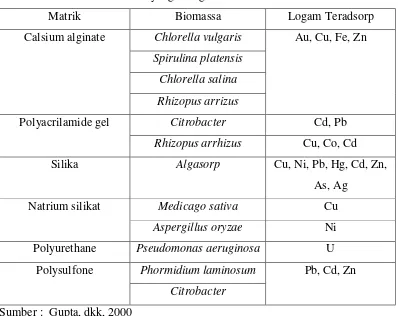
Proses immobilisasi pada biomassa dapat meningkatkan daya serap biomassa tersebut. Bahan yang sering digunakan dalam proses immobilisasi adalah bahan yang mempunyai pori cukup besar sehingga dapat memperluas permukaan adsorben (Fomina dan Gadd, 2002). Beberapa bahan yang sudah pernah digunakan untuk immobilisasi biomassa disajikan pada Tabel 1.
Tabel 1. Biomassa dan Matrik yang Mengimmobilisasi Biomassa
Matrik Biomassa Logam Teradsorp
Chlorella vulgaris
Spirulina platensis
Chlorella salina
Calsium alginate
Rhizopus arrizus
Au, Cu, Fe, Zn
Citrobacter Cd, Pb
Polyacrilamide gel
Rhizopus arrhizus Cu, Co, Cd
Silika Algasorp Cu, Ni, Pb, Hg, Cd, Zn,
As, Ag
Medicago sativa Cu
Natrium silikat
Aspergillus oryzae Ni
Polyurethane Pseudomonas aeruginosa U
Phormidium laminosum
Polysulfone
Citrobacter
Pb, Cd, Zn
Sumber : Gupta, dkk, 2000
Gordea-Torresdey, dkk (1996) telah melakukan penelitian immobilisasi biomassa Medicago sativa pada matrik natrium silikat. Santoso, (2005) juga telah
melakukan penelitian immobilisasi biomassa Aspergillus oryzae dengan
silikat mempunyai pori yang besar dan harga natrium silikat murah sehingga proses penyerapannya lebih ekonomis, efektif dan efisien.
Gugus-gugus yang ada pada biomassa teraktivasi NaOH dan biomassa terimobilisasi natrium silikat dapat dikarakterisasi dengan menggunakan spektroskopi infra merah. Karakter biomassa juga bisa diketahui dari analisis permukaan biomassa tersebut.
c. Karakterisasi Biomassa 1. Spektroskopi Infra Merah
Spektroskopi Infra Merah adalah alat untuk menentukan struktur suatu senyawa berdasarkan interaksi molekul dengan energi sinar infra merah. Atom-atom dalam suatu molekul tidak diam, tetapi terus bervibrasi (bergetar) dimana ikatan kimia yang menghubungkan dua atom dapat dimisalkan sebagai dua bola yang dihubungkan oleh suatu pegas.
Bila radiasi infra merah dilewatkan pada cuplikan, maka molekul-molekul cuplikan tersebut akan menyerap energi sehingga terjadi transisi dari vibrasi dasar (ground state) ke tingkat vibrasi tereksitasi (exited state). Pengabsorpsian energi
pada berbagai frekuensi dapat dideteksi oleh spektrofotometer infra merah yang memplotkan jumlah radiasi yang diteruskan melalui cuplikan sebagai fungsi frekuensi atau panjang gelombang radiasi. Hasil plot tersebut yang memberikan informasi penting tentang gugus fungsional suatu molekul (Hendayana, Kadarohman, dan Supriatna, 1994)
Spektrum infra merah kebanyakan menyatakan panjang gelombang atau frekuensi versus persen transmitansi (%T). Apabila senyawa menyerap radiasi dengan panjang gelombang tertentu, maka intensitas radiasi yang diteruskan oleh sampel akan berkurang, sehingga mengakibatkan penurunan %T dan dalam spektrum nampak sebagai sumur (dip) yang disebut puncak adsorpsi (peak) atau
pita absorpsi (band). Tidak adanya serapan oleh senyawa pada panjang
gelombang tertentu terekam sebagai 100% T dan disebut sebagai garis dasar (base
13
Skala dasar spektra infra merah adalah bilangan gelombang yang berkurang dari 4000 cm-1 ke 670 cm-1 atau lebih rendah. Daerah yang sering digunakan untuk mengidentifikasi gugus-gugus fungsional berada pada daerah 4000 cm-1 - 1400 cm-1 yang terlatak di bagian kiri spektrum infra merah.
Daerah infra merah pada bilangan gelombang 4000-1400 cm-1 dibagi menjadi 4 bagian, yaitu :
a. Daerah 4000 – 2500 cm-1 sesuai untuk vibrasi ikatan stretching N-H, C-H, dan O-H, keduanya menyerap pada daerah 3300-3600 cm-1. Ikatan C-H stretching terjadi dekat 3000 cm-1. Karena hampir semua senyawa orgnik mempunyai ikatan C-H, maka hampir semua spektra memberikan serapan kuat pada daerah ini.
b. Daerah 2500 – 2000 cm-1 merupakan daerah serapan yang diberikan oleh ikatan rangkap tiga stretching. Nitril dan alkuna menunjukkan puncaknya di daerah ini.
c. Daerah 2000 – 1500 cm-1 adalah daerah absorpsi ikatan rangkap dua yang meliputi C=O, C-N dan C=C. Secara umum gugus karbonil menyerap pada bilangan gelombang 1670 –1780 cm-1 dan alkena stretching secara normal terjadi dalam rentang yang lebar dari 1640 – 1680 cm-1. Posisi pasti dari serapan C=O sering ditentukan sebagai serapan gugus karbonil dalam molekul. Serapan ester biasa terjadi pada daerah 1735 cm-1, aldehid pada 1725 cm-1 dan ikatan keton terbuka terjadi pada 1715 cm-1.
d. Daerah dibawah 1500 cm-1 biasa disebut daerah sidik jari. Sejumlah besar serapan yang disebabkan oleh berbagai vibrasi ikatan tunggal seperti O, C-C, dan C-N yang terjadi di daerah ini, membentuk pola yang unik yang bertindak sebagai identitas sidik jari oleh tiap molekul organik (McMurry, 1994).
Menurut Hamdan, (1992) spektrum FTIR didasarkan pada metode vibrasi gugus –O-Si-O- dibedakan menjadi 3, yaitu :
2. Analisis Permukaan
Luas permukaan suatu padatan dapat diukur dengan metode Brunauer-Emmet-Teller (BET). Luas permukaan zat padat dapat dihitung dengan mengukur jumlah molekul N2 yang diadsorpsi.
Berdasarkan metode BET adsorbat yang digunakan adalah gas nitrogen dan adsorpsi isotermisnya berlangsung pada suhu 77 K dengan tekanan relatif dibatasi 0,005 – 0,35. Persamaan yang digunakan untuk menganalisis dengan menggunakan metode BET disajikan pada persamaan (3) (Satterfield, 1991).
1 ) ( 1 − −P Po
Wm = WmC
1 + C W C m 1
− (P/Po) ………(3)
Dengan :
W = berat gas total yang diserap pada tekanan P
Wm = berat gas nitrogen yang membentuk lapisan monolayer pada permukaan zat padat
C = konstanta BET Po = tekanan jenuh
P = tekanan yang digunakan
Persamaan (3) akan memberikan garis lurus apabila dibuat grafik 1/[W(Po/P)-1] versus P/Po. Berat gas nitrogen yang membentuk lapisan satu lapis (Wm) dengan persamaan (6) dapat ditentukan dari slope (B) dan intercept (A) yang disajikan oleh persamaan (4) dan (5) .
Slope (B) = C W C m 1 − ……….(4)
Intersept (A) = C Wm
1
……….(5)
Berat nitrogen yang membentuk satu lapisan dapat diperoleh dari persamaan (4) dan (5) :
Wm =
) (
1
A
B+ ……….(6)
15
SBET =
2
MrN NA
Wm m
……….(7)
Dimana : SBET = luas permukaan (m2/g) N = bilangan Avogadro
Am = luas penampang melintang untuk gas nitrogen (16,2 Å2) Luas permukaan spesifik dari adsorben berongga tergantung pada ukuran partikel penyusunya. Permukaan sebagian besar zat padat dapat dipastikan mengandung pori-pori. Keberadaan pori-pori yang berisi udara ini sangat mempengaruhi sifat dan kegunaan zat padat tersebut. Berdasarkan asumsi bahwa mengasumsikan pori-pori berbentuk silindris, pori-pori dapat diklasifikasikan menjadi (Oscik, 1982) :
1) Mikropori = jari-jari < 10 Å 2) Mesopori = jari-jari 10 – 100 Å 3) Makropori = jari-jari > 100 Å
3. Adsorpsi
Adsorpsi merupakan akumulasi sejumlah senyawa, ion, maupun atom yang terjadi dalam batas antara dua fasa. Adsorpsi terjadi jika gaya tarik menarik antara zat terlarut dengan permukaan penyerap dapat mengatasi gaya tarik menarik antara pelarut dengan permukaan penyerap (Oscik, 1982). Zat yang diserap disebut adsorben sedang atom atau ion yang diserap disebut adsorbat (Gadd, 1990).
Analisis penentuan konsentrasi zat warna dalam proses adsorpsi zat warna biasanya menggunakan spektroskopi UV-VIS. Pada penelitian adsorpsi zat warna
Remazol Yellow yang telah dilakukan oleh Rahmawati, dkk (2003) dan Supriyanto
a. Spektroskopi UV-VIS
Suatu molekul yang menyerap sinar tampak atau ultra violet bisa menyebabkan terjadinya eksitasi molekul tersebut dari tingkat energi dasar (ground state) ke tingkat energi yang lebih tinggi (exited stated). Proses tersebut
melalui dua tahap, yaitu :
Tahap I : M + hν M*
Tahap II : M* M + Energi
Umur molekul yang tereksitasi (M*) sangat pendek (10-8 – 10-9 detik) kemudian molekul kembali ke tingkat dasar lagi (M). Proses diatas disebut reaksi fotokimia.
Absorpsi sinar ultra violet atau sinar tampak oleh suatu molekul biasanya menghasilkan eksitasi elektron bonding yang bisa mengakibatkan panjang gelombang absorpsi maksimum dapat dikorelasikan dengan jenis ikatan yang ada di dalam molekul yang sedang diselidiki. Sehingga spektroskopi serapan molekul dapat mengidentifikasi gugus-gugus fungsional yang ada dalam suatu molekul. Tetapi yang lebih penting adalah penggunaan spektroskopi UV-VIS untuk penentuan kuantitatif senyawa yang mengandung gugus-gugus pengabsorpsi.
Semua senyawa organik dapat mengabsorpsi cahaya karena semua senyawa organik mengandung elektron valensi yang dapat dieksitasi ke tingkat energi yang lebih tinggi. Energi eksitasi untuk elektron pembentuk ikatan tunggal cukup tinggi sehingga absorpsi terbatas pada daerah ultra violet vakum (λ<185 nm) sehingga percobaan dengan sinar ultra violet vakum sulit dilakukan. Oleh karena itu penyelidikan spektroskopi senyawa-senyawa organik dilakukan pada daerah ultar violet dengan λ>185 nm. Absorbsi sinar ultra violet dan sinar tampak yang panjang gelombangnya lebih besar hanya berlaku pada beberapa gugus fungsional (chromophore) yang mengandung elektron valensi dengan energi eksitasi rendah.
Elektron-elektron yang bertanggung jawab pada pengabsorpsian cahaya oleh suatu molekul organik adalah elektron- elektron yang terlibat langsung di dalam pembentukan ikatan diantara atom-atom dan elektron-elektron bebas atau tak berpasangan seperti pada atom-atom oksigen, halogen, belerang dan nitrogen.
17
Sebagian besar materi melakukan absorpsi pada daerah sinar ultra violet (λ
200-400 nm) dan yang lainnya pada daerah sinar tampak (λ 400 – 750 nm)
(Hendayana, dkk, 1994).
b. Isoterm Adsorpsi
Isoterm adsorpsi adalah adsorpsi yang menggambarkan hubungan antara zat yang teradsorpsi oleh adsorben dengan tekanan atau konsentrasi pada keadaan kesetimbangan dan temperatur tetap (Barrow, 1988; Alberty dan Daniel, 1983). Ada beberapa jenis isoterm, antara lain :
1. Isoterm Langmuir
Isoterm adsorpsi Langmuir didasarkan pada asumsi bahwa setiap tempat adsorpsi ekivalen dan kemampuan partikel untuk ditempat itu tidak tergantung pada ditempatinya atau tidak tempat yang berdekatan (Kartohadiprojo, 1992). Isoterm Langmuir mengasumsikan proses adsorbsi terjadi saat terbentuk lapisan tunggal (monolayer adsorption). Persamaan isoterm Langmuir disajikan pada
persamaan 8 (Goksungup, dkk, 2002) :
kC Q Q
Q max max
1 1
1
+
= ………(8)
Dimana :
Q = massa yang teradsorpsi untuk tiap gram adsorben (mg/g) Qmax = kapasitas adsorpsi monolayer maksimal (mg/g)
k = konstanta Langmuir (L/mg)
C = konsentrasi pada keadaan setimbang (keadaan akhir) (mg/L)
2. Isoterm Freundlich
Isoterm adsorpsi Freundlich menggambarkan adsorpsi fisika yang terjadi pada beberapa lapis dan ikatannya tidak kuat. Model adsorpsi Freundlich menggambarkan bahwa adsorben mempunyai permukaan yang heterogen sehingga mengalami beberapa lapisan.
Persamaan isoterm Freundlich (Goksungup, dkk, 2002) :
Q = b Cn 1
Dimana :
Q = massa zat yang teradsorpsi tiap gram zat adsorben (mg/g) C = konsentrasi larutan pada kesetimbangan (mg/L)
b, n = konstanta Freundlich
Dari persamaan isoterm Freundlich bila dijadikan dalam bentuk logaritma maka menjadi :
Log Q = log b +
n
1
log C………...(10)
B. Kerangka Pemikiran
Zat warna Remazol Yellow merupakan salah satu jenis zat warna reaktif.
Senyawa vinil sulfon pada zat warna Remazol Yellow dimungkinkan dapat
berikatan dengan gugus aktif pada dinding sel biomassa Rhyzopus oryzae.
Perlakuan awal pada biomassa Rhyzopus oryzae dengan cara aktivasi
mengunakan basa NaOH dapat menghancurkan lipid, protein, dan ion-ion pengganggu yang menutupi sisi aktif biomassa yang berupa kitin sehingga sisi aktif biomassa dapat meningkat. Peningkatan sisi reaktif biomassa aktif dapat meningkatkan daya serap biomassa aktif dibandingkan biomassa tanpa perlakuan awal.
Modifikasi biomassa dengan cara immobilisasi pada pendukung yang berpori besar dapat meningkatkan luas permukaan biomassa, kekuatan partikel, porositas, dan ketahanan kimia biomassa. Peningkatan sifat-sifat tersebut dapat menyebabkan daya serap biomassa terimmobilisasi lebih besar dibandingkan biomassa tanpa immobilisasi.
Adsorpsi zat warna Remazol Yellow oleh biomassa selain dipengaruhi oleh
sifat fisik biomassa juga dipengaruhi oleh kondisi proses adsorpsi, antara lain pH awal larutan dan waktu kontak. Proses adsorpsi zat warna Remazol Yellow
19
netral kemungkinan kurang efektif karena pada keadaan asam dan netral belum terbentuk senyawa vinil sulfon.
Adsorpsi zat warna Remazol Yellow oleh biomassa Rhyzopus oryzae selain
dipengaruhi oleh pH awal larutan juga dipengaruhi oleh waktu kontak antara biomassa dan zat warna. Lamanya waktu kontak proses adsorpsi ini kemungkinan dipengaruhi oleh luas adsorben. Apabila luas permukaan adsorbennya besar maka lamanya waktu kontak yang diperlukan lebih singkat dibanding adsorben yang luas permukaannya kecil. Dari berbagai variasi pH awal larutan dan lamanya waktu kontak tersebut akan diperoleh kondisi optimum penyerapan zat warna
Remazol Yellow oleh biomassa.
Jenis isoterm adsorpsi zat warna Remazol Yellow dengan biomassa
ditentukan pada kondisi pH dan waktu kontak optimum. Kemungkinan isoterm adsorpsi antara zat warna Remazol Yellow dengan biomassa Rhyzopus oryzae
adalah isoterm Langmuir karena dimungkinkan terjadi ikatan kimia antara gugus vinil sulfon pada zat warna dengan gugus aktif pada dinding sel biomassa.
C. Hipotesis
1. Aktivasi NaOH dapat meningkatkan proses penyerapan zat warna Remazol
Yellow oleh biomassa Rhyzopus oryzae
2. Modifikasi dengan cara immobilisasi pada matrik natrium silikat mempunyai daya serap yang lebih besar dibandingkan biomassa teraktivasi NaOH tanpa terimobilisasi pada matrik natrium
3. Proses biosorpsi zat warna oleh biomassa Rhizopus oryzae dipengaruhi oleh
pH awal dan waktu kontak, dimana kondisi optimum biosorpsi zat warna
Remazol Yellow terjadi pada pH basa dan waktu kontak biosorpsi biomassa
terimmobilisasinatrium silikat lebih singkat dibandingkan biomassa aktif 4. Jenis isoterm yang sesuai pada proses biosorpsi zat warna oleh biomassa
20
A. Metode Penelitian
Penelitian ini dalam menentukan efektivitas biomassa Rhyzopus oryzae
dalam menyerap zat warna Remazol Yellow menggunakan metode eksperimental
laboratoris dengan melakukan:
1. Penentuan pH optimum dan waktu kontak optimum biosorpsi zat warna
Remazol Yellow oleh biomassa
2. Penentuan harga koefisien regresi linier dari persamaan Langmuir dan Freundlich untuk mengetahui jenis isoterm adsorpsi yang sesuai diantara keduanya dengan uji regresi
B. Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Pusat Biologi Universitas Sebelas Maret Surakarta, pada bulan September 2005 – Juni 2006. Karakterisasi gugus fungsi jamur dengan FTIR dilakukan di Laboratorium Kimia Organik Universitas Gajah Mada Yogyakarta. Analisis SAA dilakukan di Laboratorium Kimia Analitik Penelitian dan Pengembangan Teknologi BATAN Yogyakarta.
C. Alat dan Bahan 1. Alat yang Digunakan a. Seperangkat peralatan gelas
b. Spektrofotometer UV-VIS Double Beam Shidamidzu 160 PC c. Digital pH meter Lutron
d. Neraca Analitis Mattler Toledo AG 204 (Max 210, d = 0,1 mg) e. Sentrifugasi Hettich EBA 30
f. FTIR Shimadzu model 8201 PC
g. Surface Area Analyzer (SAA) NOVA 1000 h. Incubator Hotcold-M Selecta
21
j. Shaker KS 250 basic IKA Labortecknik k. Magnetik stirrer
l. Oven Memmert m.Kawat ose n. Bunsen
o. Pengayak 20 mesh dan 40 mesh p. Penggerus dan lumpang porselen
2. Bahan yang Digunakan
a. Jamur Rhizopus oryzae dari PAU UGM (FNCC tidak tercatat)
b. H2SO4 95 – 97 % p.a Merck c. HCl 37 % p.a Merck
d. NaOH p.a Merck
e. Zat warna Remazol Yellow
f. BaCl2.2H2O p.a Merck g. Natrium silikat p.a Merck
h. Dextrose anhydrous BAR JT Baker i. Pepton water Oxoid
j. Yeast Ekstrak Oxoid k. Aquades
l. Kertas saring Whatman 42 m.Alumunium foil
n. Kapas steril
D. Prosedur Penelitian 1. Preparasi Adsorben
a. Sterilisasi Alat
Semua peralatan gelas yang akan digunakan harus dicuci sampai bersih. Peralatan untuk pertumbuhan jamur Rhizopus oryzae disterilkan dengan autoklaf
b. Pembuatan Media Pertumbuhan 1. Larutan Yeast Ekstrak Pepton
Sebanyak 10 gram yeast ekstrak dan 20 gram pepton dilarutkan dalam aquades menjadi 1000 mL. Larutan yang terbentuk dibagi menjadi 4 masing-masing 225 mL dimasukkan ke dalam 4 erlenmeyer @ 500 mL. Sisanya dibagi menjadi 2 bagian dan dimasukkan ke dalam 2 erlenmeyer @ 250 mL. Masing-masing tabung erlenmeyer ditutup kapas dan dilapisi aluminium foil di bagian luar, selanjutnya diikat karet dan disterilisasi dalam autoklaf pada suhu 121o C selama 15 menit.
2. Larutan dekstrosa 40%
Sebanyak 40 gram dekstrosa dilarutkan dalam akuades sampai volume 100 mL. Larutan yang terbentuk dimasukkan ke dalam tabung erlenmeyer 250 mL, lalu disimpan dalam lemari pendingin. Masing-masing tabung erlenmeyer ditutup kapas dan dilapisi aluminium foil di bagian luar, selanjutnya diikat karet dan disterilisasi dalam autoklaf pada suhu 121o C selama 15 menit.
c. Penanaman Kultur Biomassa
Penanaman (inokulasi) kultur dilakukan dalam ruang inokulasi yang dijaga supaya tetap steril. Ruang inokulasi yang digunakan disterilisasi dengan disemprot etanol 96%. Kawat ose disterilisasi dengan mencelupkannya ke dalam etanol 96% kemudian dibakar dengan nyala lampu spirtus.
1. Penanaman biomassa untuk kultur awal (starter) a. Media Yeast Ekstrak Pepton Dekstrosa (YEPD)
Sebanyak 3 mL larutan dekstrosa 40% ditambahkan ke dalam masing-masing 50 mL larutan YEPD yang terdapat dalam tabung erlenmeyer 250 mL
b. Masing-masing media YEPD ditanami Rhizopus oryzae
c. Media YEPD yang ditanami Rhizopus oryzae dishaker dengan kecepatan
175 rpm selama 48 jam pada suhu ruang (± 27 oC)
23
2. Penanaman biomassa
a. Media Yeast Ekstrak Pepton Dekstrosa (YEPD)
Sebanyak 10 mL larutan dekstrosa 40% ditambahkan ke dalam 225 media YEP dalam 4 tabung erlenmeyer 500 mL
b. Sebanyak 10 mL starter dimasukkan ke dalam 225 mL media YEPD pada tabung erlenmeyer yang berbeda.
c. Media YEPD yang ditanami starter diinkubasi dengan shaker dengan kecepatan 175 rpm selama 48 jam pada suhu kamar (± 27 oC).
d. Aktivasi biomassa
1. Sel biomassa yang masih dalam media dipanaskan dengan autoklaf pada 121o C selama 15 menit.
2. Biomassa dari media disaring dengan kertas saring Whatman no. 42 kemudian dicuci sebanyak 3 kali.
3. Sebanyak 5 gram biomassa dicampur dengan 100 mL 1 mol/L NaOH dipanaskan dengan autoklaf pada suhu 121o C selama 15 menit.
4. Biomassa dikumpulkan dengan disaring pada kertas saring
5. Biomassa dicuci beberapa kali dengan aquades untuk menghilangkan NaOH yang berlebihan.
6. Pengeringan biomassa dengan oven pada suhu 70o C selama 12 jam.
7. Karakterisasi gugus fungsional dengan FTIR dan analisis permukaan biomassa dengan SAA
e. Immobilisasi biomassa
1. Sebanyak 5 gram biomassa aktif basah dicuci beberapa kali dan disentrifugasi selama 5 menit dengan kecepatan 3000 rpm.
2. 75 mL asam sulfat 5% dicampur dengan larutan natrium silikat. Setelah campuran asam sulfat 5% dan natrium silikat mencapai pH 2, maka sebanyak 5 gram biomassa aktif basah yang telah dicuci ditambahkan pada larutan silikat dan diaduk selama 15 menit.
4. Gel polimer dicuci berkali-kali dengan aquades sampai bila ditambah 2 tetes barium klorida (BaCl2) tidak diperoleh endapan yang menandakan bahwa sulfat pada biomassa telah hilang.
5. Gel polimer dengan biomassa terimobilisasi dikeringkan selama 12 jam pada suhu 60o C dan digiling dengan mortar sehingga dapat melewati saringan dengan ukuran 20 - 40 mesh.
6. Karakterisasi gugus fungsional dengan FTIR dan analisis permukaan biomassa dengan SAA
2. Proses Adsorpsi
a. Adsorpsi Zat Warna Remazol Yellow
1. Perbandingan Kemampuan Daya Serap Biomassa Tanpa Perlakuan Awal, Aktif dan Terimmobilisasi Natrium Silikat
Sebanyak 25 mL larutan zat warna Remazol Yellow pada pH 7
masing-masing ditambah 50 mg biomassa Rhyzopus oryzae tanpa perlakuan, 50 mg
biomassa aktif dan 50 mg biomassa terimmobilisasi natrium silikat. Masing-masing digojog dengan shaker dengan kecepatan 120 rpm selama 60 menit. Biomassa dipisahkan dari medianya dengan sentrifugasi pada kecepatan 4000 rpm selama 5 menit. Filtrat yang diperoleh ditentukan konsentrasinya dengan spektroskopi UV-VIS untuk mengetahui konsentrasi yang tidak diserap oleh biomassa. Konsentrasi zat warna yang diserap oleh biomassa adalah selisih antara konsentrasi awal larutan dengan konsentrasi yang tidak diserap oleh biomassa.
2. Penentuan pH Optimum
Masing-masing 50 mg biomassa aktif dan biomassa terimmobilisasi natrium silikat dimasukkan ke dalam 25 mL larutan zat warna Remazol Yellow
25
yang tidak diserap oleh biomassa. Konsentrasi zat warna yang diserap oleh biomassa adalah selisih antara konsentrasi awal larutan dengan konsentrasi yang tidak diserap oleh biomassa.
3. Penentuan Waktu Kontak Optimum
Masing-masing 50 mg biomassa aktif dan biomassa terimmobilisasi natrium silikat dimasukkan ke dalam 25 mL larutan zat warna Remazol Yellow
pada pH optimum masing-masing biomassa. Tabung ditutup dengan alumunium foil, digojog dengan shaker pada kecepatan 120 rpm dengan variasi waktu kontak 10, 20, 30, 40, 60, 80, dan 100 menit. Biomassa dipisahkan dari medianya dengan sentrifugasi pada kecepatan 4000 rpm selama 5 menit. Filtrat yang diperoleh ditentukan konsentrasinya dengan spektroskopi UV-VIS untuk mengetahui konsentrasi yang tidak diserap oleh biomassa. Konsentrasi zat warna yang diserap oleh biomassa adalah selisih antara konsentrasi awal larutan dengan konsentrasi yang tidak diserap oleh biomassa
4. Penentuan Isoterm Adsorpsi
Masing-masing 50 mg biomassa aktif dan biomassa terimmobilisasi natrium silikat dimasukkan ke dalam 25 mL larutan zat warna Remazol Yellow
dengan beberapa variasi konsentrasi pada pH optimum. Tabung ditutup dengan alumunium foil, digojok dengan shaker pada kecepatan 120 rpm selama waktu kontak optimum. Biomassa dipisahkan dari medianya dengan sentrifugasi pada kecepatan 4000 rpm selama 5 menit. Filtrat yang diperoleh ditentukan konsentrasinya dengan spektroskopi UV-VIS untuk mengetahui konsentrasi yang tidak diserap oleh biomassa. Konsentrasi zat warna yang diserap oleh biomassa adalah selisih antara konsentrasi awal larutan dengan konsentrasi yang tidak diserap oleh biomassa.
b. Aplikasi Limbah 1. Adsorpsi Limbah Zat Warna
warna diukur setelah zat warna diatur pHnya sampai pH optimum dengan penambahan NaOH dan HCl. Masing-masing 50 mg biomassa aktif dan biomassa terimmobilisasi natrium silikat dimasukkan ke dalam 25 mL limbah yang telah diatur pHnya sampai pH optimum kemudian digojog dengan shaker pada kecepatan 120 rpm selama waktu kontak optimum. Biomassa dipisahkan dari medianya dengan sentrifugasi pada kecepatan 4000 rpm selama 5 menit. Filtrat yang diperoleh ditentukan konsentrasinya dengan spektroskopi UV-VIS untuk mengetahui konsentrasi yang tidak diserap oleh biomassa. Konsentrasi limbah zat warna yang diserap oleh biomassa adalah selisih antara konsentrasi awal larutan dengan konsentrasi yang tidak diserap oleh biomassa.
2. Desorpsi
Endapan adsorben yang diperoleh setelah proses adsorpsi ditambah 25 mL aquades, kemudian diaduk dengan shaker pada kecepatan 120 rpm selama waktu kontak optimum. Setelah itu biomassa dipisahkan dari medianya dengan sentrifugasi pada kecepatan 4000 rpm selama 5 menit. Filtrat yang diperoleh ditentukan konsentrasinya dengan spektroskopi UV-VIS untuk mengetahui konsentrasi limbah zat warna yang terdesorpsi.
E. Teknik Pengumpulan Data
1. Gugus-gugus fungsi yang ada dalam biomassa diketahui dari hasil analisis spektroskopi IR di laboratorium Kimia Organik UGM Yogyakarta.
2. Analisa permukaan biomassa diukur dengan SAA di BATAN Yogyakarta. 3. Zat warna ditentukan konsentrasinya dengan alat spektroskopi UV-VIS.
F. Teknik Analisis Data
1. Gugus fungsi yang ada dalam biomassa diketahui dengan cara membandingkan puncak-puncak spektra spektroskopi IR dengan referensi 2. Luas permukaan biomassa dianalisis dengan metode BET, sedangkan rata-rata
27
3. Konsentrasi zat warna Remazol Yellow ditentukan berdasarkan data adsorbansi
dengan spektroskopi UV-VIS. Data hasil pengukuran absorbansi diplotkan dengan kurva standar sehingga konsentrasi zat warna dapat diketahui.
4. Besarnya konsentrasi zat warna Remazol Yellow digunakan untuk menghitung
nilai daya serap (mg/g) dan persentase adsorpsi.
Daya serap per gram biomassa = xV m
Cterserap
Persentase adsorpsi = x100%
Cawal Cterserap
Dengan :
m = berat adsorben (g) V = volume larutan (L)
Cterserap = konsentrasi yang terserap (mg/L) Cawal = konsentrasi awal larutan (mg/L)
5. Kondisi optimum adsorpsi zat warna ditentukan dengan cara membandingkan kemampuan adsorpsi pada beberapa variasi pH (7, 8, 9, 10, 11, 12, 13) dan beberapa variasi waktu kontak (10, 20, 30, 40, 60, 80, 100 menit). Kondisi optimum yang diperoleh digunakan untuk menguji jenis isoterm adsorpsi 6. Jenis adsorpsi diketahui dari uji persamaan isoterm Langmuir dan Freundlich.
28
A. Preparasi Adsorben 1. Penanaman Rhyzopus oryzae
Rhyzopus oryzae yang diperoleh dari PAU UGM berwarna putih yang
dikemas pada ampul kecil. Pengembangbiakan Rhyzopus oryzae pada media cair
YEPD dilakukan pada suhu kamar melalui 2 tahap, yaitu dalam media YEPD starter sebagai media persemaian jamur dengan volume kecil dan media YEPD yang lebih besar sebagai media penanaman yang volumenya lebih besar. Setiap sekali pertumbuhan jamur Rhyzopus oryzae digunakan media YEPD sebanyak
1 liter. Pengembangbiakan biomassa Rhyzopus oryzae pada YEPD dilakukan
selama 96 jam, dimana 48 jam pertama untuk pembentukan starter atau media persemaian dan pada 48 jam kedua untuk penanaman biomassa pada volume yang lebih besar. Pada penelitian ini dilakukan sebanyak 6 kali pertumbuhan biomassa
Rhyzopus oryzae dalam media YEPD dan diperoleh biomassa Rhyzopus oryzae
sebanyak 26,435 gram. Setelah dilakukan proses aktivasi dan immobilisasi pada natrium silikat diperoleh biomassa aktif sebanyak 3,958 gram dan biomassa terimmobilisasi natrium silikat sebanyak 4,321 gram.
YEPD mengandung nutrisi yang dibutuhkan biomassa Rhyzopus oryzae
yaitu berupa yeast ekstrak, pepton dan dekstrosa. Yeast ekstrak merupakan sumber asam amino dan vitamin. Pepton merupakan bentuk protein yang terhidrolisis sebagai sumber nitrogen, sedangkan dekstrosa merupakan sumber karbon dan energi. Pada saat proses pengembangbiakan pada media cair YEPD dilakukan shaking yang bertujuan agar nutrien yang ada pada YEPD lebih merata sehingga pertumbuhan spora jamur lebih optimum. Rhyzopus oryzae pada media
cair YEPD berbentuk pellet atau gumpalan-gumpalan berwarna putih dimana bila dipegang dengan tangan akan terasa kenyal.
29
pada temperatur ruang selama kurun waktu yang cukup lama, tidak mengalami keracunan zat warna dan tidak membutuhkan nutrisi. Biomassa yang masih dalam media YEPD dimatikan dengan cara diautoklaf pada suhu 121o C selama 15 menit.
2. Aktivasi dan Immobilisasi Biomassa Rhyzopus oryzae
Perlakuan awal pada biomassa dapat meningkatkan daya serap biomassa. Salah satu cara perlakuan awal biomassa adalah dengan cara aktivasi menggunakan basa NaOH. Aktivasi dengan basa NaOH bertujuan untuk membersihkan kitin pada dinding sel jamur dari senyawa pengotor yang berupa lipid, protein, dan ion-ion pengganggu sehingga sisi aktif pada dinding sel jamur yang berfungsi menyerap zat warna dapat ditingkatkan. Peningkatan sisi aktif pada dinding sel jamur ini dapat meningkatkan daya serap jamur tersebut terhadap zat warna. Biomassa Rhyzopus oryzae yang telah diaktivasi dengan NaOH setelah
dioven selama 12 jam menjadi kering dan berupa padatan yang berwarna coklat muda.
Perlakuan awal biomassa selain aktivasi NaOH bisa juga dilakukan modifikasi biomassa dengan cara immobilisasi. Proses immobilisasi dilakukan pada bahan yang mempunyai luas permukaan dan volume pori cukup luas. Penelitian ini digunakan natrium silikat karena harganya relatif murah dan telah dibuktikan oleh Santoso, S.S.D, (2005) bahwa immobilisasi biomassa menggunakan natrium silikat dapat meningkatkan daya serap biomassa
Aspergillus oryzae terhadap logam Nikel (II).
Immobilisasi biomassa pada penelitian ini dilakukan setelah biomassa diaktivasi terlebih dahulu dengan menggunakan NaOH agar penyerapannya lebih maksimal Kurang lebih 10 mL larutan natrium silikat dicampur dengan 75 mL asam sulfat 5 % hingga mencapai pH 2 diberi 5 gram biomassa Rhyzopus oryzae,
kemudian diaduk selama 15 menit agar biomassa Rhyzopus oryzae dapat
terimmobilisasi dalam natrium silikat. Biomassa Rhyzopus oryzae yang telah
putih dari natrium silikat yang digunakan untuk mengimmobilisasi biomassa
Rhyzopus oryzae.
Gugus-gugus yang ada pada biomassa Rhyzopus oryzae dapat
dikarakterisasi dengan menggunakan spektroskopi infra merah. Analisis permukaan biomassa Rhyzopus oryzae tersebut dilakukan dengan SAA.
3. Analisis Gugus Fungsi
Analisis gugus fungsi dinding sel biomassa Rhyzopus oryzae tanpa
perlakuan awal, biomassa Rhyzopus oryzae aktif dan biomassa Rhyzopus oryzae
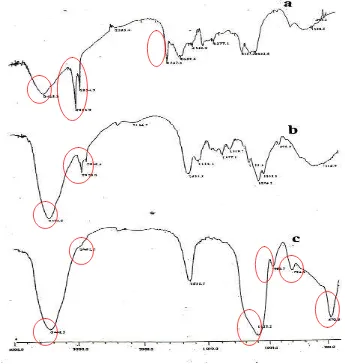
[image:48.595.140.485.343.707.2]terimmobilisasi natrium silikat menggunakan spektroskopi FTIR pada bilangan gelombang 4000 – 400 cm-1.
Gambar 5. Spektra FTIR Biomassa Rhyzopus oryzae Tanpa Perlakuan Awal (a),
Biomassa Rhyzopus oryzae Aktif (b) dan Biomassa Rhyzopus oryzae
31
Spektra FTIR gugusfungsi dinding sel biomassa Rhyzopus oryzae aktif
disajikan pada Gambar 5. Data spektra FTIR selengkapnya ada pada Lampiran 1, 2, dan 3. Hasil analisis gugus fungsi Biomassa Rhyzopus oryzae tanpa perlakuan
awal, biomassa aktif dan biomassa terimmobilisasi natrium silikat disajikan pada Tabel 2.
Tabel 2. Data Hasil Analisis Gugus Fungsi Biomassa Tanpa Perlakuan Awal, Biomassa Aktif dan Biomassa Terimmobilisasi Natrium Silikat
Bilangan Gelombang (cm-1) Gugus
Fungsi
Biomassa Tanpa Perlakuan Awal
Biomassa Aktif Biomassa Terimmobilisasi
Natrium Silikat
Ulur O-H 3425,3 3444,6 3448,5
Ulur C-H 2923,9
2854,5
2920,0 2850,6
2962,5
Ulur C=O asam alifatik
1747,4 - -
Ulur C=O amida 1639,4 1635,5 1635,5
Tekuk N-H amida 1639,4 1635,5 1635,5
Ulur C-O eter 1033,8 1033,3 1103,2
Ulur asimetri Si-O-Si
- - 1103,2
Si-OH - - 960,5
Ulur simetri Si-O-Si
- - 794,6
Tekuk Si-O-Si - - 470,6
gelombang 2923,9 cm-1 dan 2854,5 cm-1 pada spektra biomassa tanpa perlakuan perlakuan awal, 2920,0 cm-1 dan 2850,6 cm-1 untuk biomassa aktif serta serapan pada 2962,3 cm-1 untuk biomassa terimmobilisasi natrium silikat menunjukkan adanya vibrasi C-H. Serapan pada bilangan gelombang 1747,4 cm-1 untuk spektra biomassa tanpa perlakuan awal menunjukkan adanya vibrasi ulur C=O karbonil asam. Serapan pada bilangan gelombang 1639,4 cm-1 untuk spektra biomassa tanpa perlakuan awal, 1635,5 cm-1 untuk biomassa aktif dan biomassa terimmobilisasi natrium silikat menunjukkan adanya tumpang tindih vibrasi ulur C=O amida dan vibrasi tekuk N-H amida. Serapan pada bilangan gelombang 1033,8 cm-1 untuk biomassa tanpa perlakuan awal dan 1033,3 cm-1 untuk biomassa terimmobilisasi natrium silikat menunjukkan serapan ulur C-O eter. Serapan pada bilangan gelombang 1103,2 cm-1 pada spektra biomassa terimmobilisasi natrium silikat menunjukkan adanya tumpang tindih antara vibrasi ulur C-O eter dan vibrasi ulur asimetri Si-O-Si. Serapan pada bilangan gelombang 960,5 cm-1 untuk spektra biomassa terimmobilisasi natrium silikat menunjukkan adanya gugus Si-OH pada biomassa Rhyzopus oryzae terimmobilisasi natrium
silikat. Vibrasi ulur simetri Si-O-Si pada biomassa terimmobilisasi natrium silikat ditunjukkan pada bilangan gelombang 794,6 cm-1. Vibrasi tekuk Si-O-Si pada biomassa Rhyzopus oryzae terimmobilisasi natrium silikat ditunjukkan pada
bilangan gelombang 470,6 cm-1. Adanya gugus O-H, C-H, C=O amida, N-H amida, dan C-O eter pada spektra FTIR biomassa tanpa perlakuan awal, biomassa aktif dan biomassa terimmobilisasi natrium silikat menunjukkan bahwa pada dinding sel biomassa Rhyzopus oryzae mengandung kitin.
33
awal, sedangkan pada spektra biomassa aktif dan terimmobilisasi natrium silikat tidak muncul serapan C=O karbonil asam dari asam amino (protein) yang menandakan bahwa proses aktivasi dengan menggunakan NaOH dapat menghilangkan pengotor pada dinding sel biomassa yang berupa protein.
Spektra FTIR biomassa Rhyzopus oryzae terimmobilisasi natrium silikat
muncul serapan pada bilangan gelombang 1103,2 cm-1, 794,6 cm-1, dan 470,6 cm-1 yang menunjukkan adanya gugus Si-O-Si pada natrium silikat serta adanya serapan pada bilangan gelombang 960,5 cm-1 yang menunjukkan adanya gugus Si-OH pada biomassa immobilisasi. Adanya gugus Si-O-Si dan Si-OH menunjukkan adanya natrium silikat sebagai matrik yang mengimmobilisasi biomassa Rhyzopus oryzae.
4. Analisis Permukaan
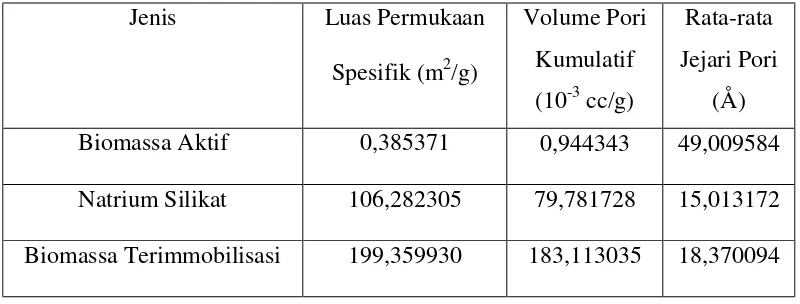
Karakterisasi suatu adsorben selain dilakukan dengan cara menganalisis gugus fungsi pada adsorben tersebut, perlu juga dilakukan analisis permukaan adsorben. Analisis permukaan adsorben ini meliputi analisis luas permukaan spesifik, volume pori komulatif, dan rata-rata jejari pori
Luas permukaan biomassa dapat mempengaruhi kemampuan daya serap biomassa tersebut sebagai adsorben, semakin besar luas permukaannya maka kemungkinan daya serapnya juga meningkat. Ukuran luas permukaan suatu padatan sangat dipengaruhi oleh pori-pori dari padatan tersebut. Distribusi pori ini juga sangat penting dalam penentuan kemampuan adsorben. Padatan yang mempunyai volume pori kumulatif kecil maka padatan tersebut baik bila digunakan untuk menyerap zat dalam jumlah yang kecil pula, sedangkan bila volume kumulatifnya besar maka padatan tersebut dapat menyerap zat dalam jumlah yang besar. Distribusi pori suatu padatan selain dipengaruhi oleh volume pori komulatif juga dipengaruhi oleh jari-jari pori.
makropori baik digunakan sebagai sorben molekul yang berukuran besar. Rata-rata jejari pori pada suatu padatan menunjukkan ukuran pori yang paling banyak frekuensinya dalam material berpori tersebut. Data analisis permukaan biomassa aktif, natrium silikat, dan biomassa terimmobilisasi natrium silikat dengan menggunakan alat SAA disajikan pada Tabel 3. Data selengkapnya ada pada Lampiran 4, 5, dan 6.
Tabel 3. Data Analisis Permukaan Biomassa Aktif, Natrium Silikat dan Biomassa Terimmobilisasi Natrium Silikat
Jenis Luas Permukaan
Spesifik (m2/g)
Volume Pori Kumulatif (10-3 cc/g)
Rata-rata Jejari Pori
(Å) Biomassa Aktif 0,385371 0,944343 49,009584
Natrium Silikat 106,282305 79,781728 15,013172
Biomassa Terimmobilisasi 199,359930 183,113035 18,370094
Tabel 3 menunjukkan bahwa luas permukaan dan volume pori kumulatif natrium silikat cukup besar, sehingga natrium silikat cukup baik bila digunakan sebagai bahan untuk mengimmobilisasi biomassa Rhyzopus oryzae. Immobilisasi
biomassa biasanya dilakukan pada bahan yang mempunyai luas permukaan dan volume pori besar sehingga diharapkan dapat meningkatkan daya serap biomassa tersebut..
35
besar, sehingga diharapkan daya serap biomassa terimmobilisasi natrium silikat juga bisa meningkat.
Proses adsorpsi biomassa selain dipengaruhi oleh karakter biomassa sebagai adsorben, dimungkinkan juga dipengaruhi oleh kondisi pH larutan zat warna dan lamanya waktu kontak terjadinya proses adsorpsi. Oleh karena itu pada penelitian ini dilakukan optimasi pH larutan zat warna Remazol Yellow dan optimasi waktu
kontak proses adsorpsi.
B. Proses Adsorpsi
1. Adsorpsi Zat Warna Remazol Yellow
a. Adsorpsi Zat Warna Remazol Yellow oleh Biomassa Tanpa Perlakuan Awal,
Aktif dan Terimmobilisasi Natrium Silikat
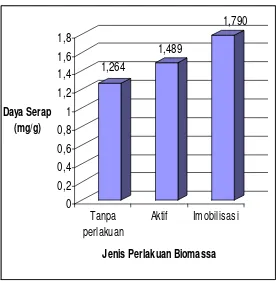
Perbedaan daya serap biomassa tanpa perlakuan, biomassa aktif dan biomassa terimmobilisasi natrium silikat terhadap zat warna Remazol Yellow
disajikan pada Gambar 6. Data selengkapnya ada pada Lampiran 7.
1,264
1,489
1,790
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8
Daya Serap (mg/g)
Tanpa perlakuan
Aktif Imobilisasi
[image:53.595.173.450.422.703.2]Jenis Perlakuan Biomassa
Gambar 6. Daya Serap Biomassa Rhyzopus oryzae Tanpa Perlakuan Awal,
Biomassa Rhyzopus oryzae Aktif dan Biomassa Rhyzopus oryzae Terimmobilisasi
Gambar 6 menunjukkan bahwa perlakuan awal biomassa dengan cara aktivasi menggunakan NaOH dan modifikasi biomassa dengan cara immobilisasi dapat meningkatkan daya serap biomassa jika dibandingkan dengan daya serap biomassa tanpa perlakuan awal. Daya serap biomassa aktif bi