TUGAS AKHIR
PENGARUH KANDUNGAN UDARA DALAM GAS SF
6TERHADAP KEKUATAN DIELEKTRIK
Diajukan untuk memenuhi salah satu syarat dalam menyelesakan Pendidikan
Sarjana (S-1) pada Departemen Teknik Elektro Fakultas Teknik Universitas
Sumatera Utara
Oleh :
070402066
LEONARDO HUTAURUK
DEPARTEMEN TEKNIK ELEKTRO
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
MEDAN
ABSTRAK
Secara teknis gas SF6 yang diisikan ke dalam peralatan listrik (misalnya CB)
dapat bercampur dengan udara. Ketidakmurnian gas SF6 sudah tentu akan
mempengaruhi KD gas itu sendiri sehingga berpengaruh pada kerja koefisien
kerja peralatan yang menggunakan gas SF6 tersebut. Bercampurnya udara dalam
gas SF6 dapat terjadi akibat ketidaktelitian teknisi pada saat pengisian gas SF6 ke
dalam peralatan listrik. Tugas akhir ini bertujuan untuk meneliti pengaruh
kandungan udara di dalam gas SF6 terhadap kekuatan dielektriknya.
Dari hasil pengujian diperoleh bahwa, semakin vakum tabung tempat di
isikan gas SF6, maka nilai tegangan tembus dan kekuatan dielektriknya akan
semakin tinggi. Kekuatan dielektrik yang terjadi pada kevakuman 0,3 bar dimana
persen kandungan udara sebesar 8,64 % adalah sebesar 139,848 kV/cm dan
kekuatan dielektrik pada tekanan dalam tabung 1 bar atau persen kandungan udara
28,8 % adalah sebesar 83,104 kV/cm . Kevakuman yang memiliki kekuatan
dielektrik sesuai dengan standar yang ditulis oleh Ruben D. Garzon dengan judul
buku High Voltage Circuit Breaker Design and Applications dimana kekuatan
dielektrik untuk gas SF6 pada tekanan 5 bar sebesar 100 kV/cm adalah 0,7 bar
KATA PENGANTAR
Puji dan syukur tiada terkira penulis panjatkan kepada Tuhan Yesus
Kristus atas segala berkat dan karunianya yang telah diberikan kepada penulis,
sehingga penulis dapat menyelesaikan Tugas Akhir yang berjudul :
PENGARUH KANDUNGAN UDARA DALAM GAS SF6 TERHADAP
KEKUATAN DIELEKTRIK
Penulisan Tugas Akhir ini merupakan salah satu syarat untuk
menyelesaikan studi dan memperoleh gelar Sarjana Teknik di Departemen Teknik
Elektro, Fakultas Teknik, Universitas Sumatera Utara.
Tugas Akhir ini penulis persembahkan untuk kedua orangtua yang telah
membesarkan penulis dengan kasih sayang yang tak ternilai harganya, yaitu
Laosma Hutauruk, S.Pd dan Monri simbolon, S.Pd, ketiga saudari penulis, yaitu
kak Sandra, S.Pd, kak Juli, S.Kep dan dek vera serta yang paling spesial Monora
Panca Bakara yang selalu memberikan semangat kepada penulis dalam proses
penyelesaian Tugas Akhir ini.
Selama masa kuliah sampai penyelesaian Tugas akhir ini, penulis juga
banyak mendapat dukungan, bimbingan, maupun bantuan dari berbagai pihak.
Untuk itu penulis ingin menyampaikan rasa terimakasih yang sebesar-besarnya
kepada :
1. Bapak Ir. Hendra Zulkarnain, selaku Dosen Pembimbing Tugas Akhir
yang telah banyak meluangkan waktu dan pikirannya untuk memberikan
bantuan, bimbingan, dan pengarahan kepada penulis selama penyusunan
tugas akhir ini.
3. Bapak Ir.Surya Tarmizi, M.si selaku Ketua Departemen Teknik Elektro
FT.USU serta Bapak Rahmat Fauzi, ST, MT selaku Sekretaris Departemen
Teknik Elektro FT USU yang banyak memberi motivasi selama penulis
menjalani kuliah.
4. Seluruh staf pengajar Departemen Teknik Elektro, Fakultas Teknik,
Universitas Sumatera Utara.
5. Seluruh staf pegawai Departemen Teknik Elektro, Fakultas Teknik,
Universitas Sumatera Utara, terkhusus buat Abang Marthin Luther
Tarigan, yang banyak membantu penulis semenjak penulis memulai kuliah
pertama kali.
6. Abang dan kakak sepupu penulis, terkhusus bang Ir.Binharun Pardede,
Bang Priyanto, ST dan kak Elyana Surbakti, ST untuk segala
dukungannya, baik moril ataupun materi, selama penulis kuliah.
7. Para asisten Laboratorium Teknik Tegangan Tinggi, khusunya Rumonda
Sitepu, ST dan Yoakim Simamora, yang dengan kerelaan hati meluangkan
waktunya untuk membantu pengambilan data tugas akhir.
8. Teman-teman stambuk 2007 yang sangat sensasional dan luar biasa,
terkhusus untuk, Ivan, ST, Jon Iman saragih, ST, Francisco, Ramcheys
Siahaan, Harapan Singarimbun, Asyer Nababan, Jannes Pinem, Setia
Sianipar, ST, Ramli Situmeang, ST, Advent Girsang, Lamhot, sandro, ST,
Sofian, ST, Haogoaro, ST, Kendri Malau, ST, niko, nobel dan yang tidak
bisa disebutkan satu per satu. Terimakasih untuk semua yang telah kalian
9. Adik-adik junior baik stambuk 2008,2009, dan 2010, terkhusus kepada
saudari maria silalahi dan meta sinaga. Terimakasih untuk segala
dukungan kalian kepada penulis.
10.Teman-teman di luar Teknik Elekro, yaitu nando, donal, agus ningsih,
agus, robi, Sartika, yang selalu memberikan semangat kepada penulis.
11.Serta untuk semua yang tidak bisa disebutkan oleh penulis, saya ucapkan
terimaksih sebesar-besarnya.
Penulis Sadar bahwa Tugas akhir ini masih kurang sempurna, oleh
karena itu penulis mengharapakn kritik dan saran yang membangun demi
memperbaiki tugas akhir ini. Akhir kata, semoga tugas akhir ini bermanfaat
bagi penulis dan pembaca.
Medan, Januari 2011 Penulis,
DAFTAR ISI
ABSTRAK ... i
KATA PENGANTAR ... ii
DAFTAR ISI ... v
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... x
BAB I PENDAHULUAN I.1 Latar Belakang ... 1
I.2 Tujuan dan Manfaat Penelitian ... 1
I.3 Batasan Masalah ... 2
I.4 Metode penulisan ... 3
I.5 Sistematika Penulisan... 3
BAB II SIFAT-SIFAT LISTRIK DIELEKTRIK II.1 Umum ... 5
II.2 Kekuatan Dielektrik ... 7
II.3 Rugi-rugi Dielektrik ... 10
II.4 Tahanan Isolasi... 12
II.5 Kekuatan Kerak Isolasi ... 21
II.6 Teori Kegagalan Isolasi ... 22
II.6.A Ionisasi ... 22
II.6.1 Radiasi Sinar Kosmis ... 23
II.6.3 Ionisasi Thermis ... 25
II.6.B Deionisasi ... 26
II.6.B.1 Deionisasi Medan Elektrik ... 26
II.6.B.2 Deionisasi Akibat Rekombinasi ... 27
II.6.B.3 Deionisasi Akibat Pendinginan ... 28
II.6.B.4 Deionisasi Akibat Tangkapan Elektron .... 28
II.6.C Emisi ... 29
II.6.C.1 Emisi Fotoelektrik ... 30
II.6.C.2 Emisi Benturan Ion Positif ... 31
II.6.C.3 Emisi Medan tinggi ... 32
II.6.C.4 Emisi Thermis ... 32
II.6.D Mekanisme Tembus Listrik Gas ... 33
BAB III Karakteristik SF6 dan Udara III.A Gas SF6 ... 37
III.A.1 Ikatan Molekul Gas SF6 ... 37
III.A.2 Sifat Fisik Gas SF6 ... 38
III.A.3 Sifat Kimia Gas SF6 ... 41
III.A.4 Proses Tangkapan Elektron Bebas pada Gas SF6 ... 43
III.B Udara ... 46
III.B.1 Helium ... 46
III.B.2 Nitrogen ... 47
III.B.3 Oksigen ... 48
III.C Pendeskripsian komposisi Campuran Suatu Gas ... 49
III.D Hubungan p, V, dan T Campuran Gas Ideal ... 51
BAB IV PENGUJIAN PENGARUH KANDUNGAN UDARA DALAM GAS SF6 TERHADAP KEKUATAN DIELEKTRIK IV.1 Umum ... 54
IV.2 Prosedur Pengujian ... 60
IV.3 Hasil Percobaan... 61
IV.4 Analisa Data ... 62
BAB V KESIMPULAN DAN SARAN V.1 Kesimpulan ... 71
V.2 Saran ... 71
DAFTAR GAMBAR
Gambar II.2 Medan Elektrik dalam Dielektrik ... 8
Gambar II.3.A Dampak Elektrik terhadap Molekul Dielektrik ... 11
Gambar II.3.B Hubungan rugi-rugi dielektrik dengan Frekuensi ... 12
Gambar II.4.A Arus pada Suatu Dielektrik ... 12
Gambar II.4.C Tahanan vs Waktu ... 15
Gambar II.4.C Tahanan Isolasi vs Waktu Pengeringan ... 15
Gambar II.4.D Kapasitor Plat Sejajar ... 18
Gambar II.4.E Hubungan Tegangan dan Arus terhadap bahan Isolasi .. 18
Gambar II.4.F Hubungan Tegangan dan Arus terhadap Isolasi Padat .... 19
Gambar II.6A Proses Ionisasi ... 22
Gambar II.6.A.1 Ionisasi karena Radiasi Sinar Kosmis ... 23
Gambar II.6.A.2 Ionisasi Benturan ... 24
Gambar II.6.A.1 Ionisasi Thermis ... 25
Gambar II.6.B Proses Deionisasi ... 27
Gambar II.6.B.1 Deionisasi Medan Elektrik ... 28
Gambar II.6.B.2 Deionisasi Rekombinasi ... 28
Gambar II.6.B.4 Deionisasi Tangkapan Elektron ... 29
Gambar II.6.C Proses Terjadinya Emisi ... 30
Gambar II.6.C.1 Emisi Fotoelektrik ... 31
Gambar II.6.C.2 Emisi Benturan Ion Positif ... 31
Gambar II.6.C.3 Emisi Medan Tinggi ... 32
Gambar II.6.C.4 Emisi Thermis ... 33
Gambar II.6.D.2 Banjiran Elektron menyebabkan Tembus Listrik ... 35
Gambar III.A.1 Ikatan Molekul Gas SF6 ... 38
Gambar III.A.2 Hubungan Tekanan dan Kekuatan Dielektrik dari Gas SF6 39 Gambar III.A.3 Perbandingan perpindahan panas SF6 dengan Udara ... 42
Gambar III.A.4a Medan Listrik yang Timbul diantara Dua Elektroda ... 43
Gambar III.A.4b Penyerap Elektron bebas pada Molekul Netral ... 44
Gambar III.D Campuran Beberapa Gas ... 52
Gambar IV.1.a Tabung Sampel Gas SF6 ... 54
Gambar IV.1.b Elektron Bola-bola ... 55
Gambar IV.1.c Wadah Pengukuran sampel Gas SF6 ... 56
Gambar IV.1.d Trafo Uji ... 56
Gambar IV.1.e Auto transformator ... 47
Gambar IV.1.f Voltmeter AC ... 57
Gambar IV.1.g Pompa Vakum ... 58
Gambar IV.1.h Tahanan Peredam ... 59
Gambar IV.1.i Rangkain Percobaan ... 60
DAFTAR TABEL
Tabel III.A.2 Nilai faktor efisiensi η ... 41
Tabel III.A.4 Zat-zat yang menyebabkan berkurangnya fungsi Gas SF6 ... 35
Tabel IV.3 Hasil Percobaan dari sampel gas SF6 ... 62
Tabel IV.4.a Nilai Tegangan Tembus rata-rata SF6 ... 62
Tabel IV.4,b Interpolasi mencari efisiensi ... 63
Tabel IV.4.c Nilai kekuatan dielektrik Gas SF6 yang Bercampur Udara ... 65
Tabel IV.4.d Nilai rata-rata kekuatan dielektrik Gas SF6 Bercampur Udara . 65 Tabel IV.4.e Persentase Kandungan Udara Tiap Kevakuman Tabung ... 67
ABSTRAK
Secara teknis gas SF6 yang diisikan ke dalam peralatan listrik (misalnya CB)
dapat bercampur dengan udara. Ketidakmurnian gas SF6 sudah tentu akan
mempengaruhi KD gas itu sendiri sehingga berpengaruh pada kerja koefisien
kerja peralatan yang menggunakan gas SF6 tersebut. Bercampurnya udara dalam
gas SF6 dapat terjadi akibat ketidaktelitian teknisi pada saat pengisian gas SF6 ke
dalam peralatan listrik. Tugas akhir ini bertujuan untuk meneliti pengaruh
kandungan udara di dalam gas SF6 terhadap kekuatan dielektriknya.
Dari hasil pengujian diperoleh bahwa, semakin vakum tabung tempat di
isikan gas SF6, maka nilai tegangan tembus dan kekuatan dielektriknya akan
semakin tinggi. Kekuatan dielektrik yang terjadi pada kevakuman 0,3 bar dimana
persen kandungan udara sebesar 8,64 % adalah sebesar 139,848 kV/cm dan
kekuatan dielektrik pada tekanan dalam tabung 1 bar atau persen kandungan udara
28,8 % adalah sebesar 83,104 kV/cm . Kevakuman yang memiliki kekuatan
dielektrik sesuai dengan standar yang ditulis oleh Ruben D. Garzon dengan judul
buku High Voltage Circuit Breaker Design and Applications dimana kekuatan
dielektrik untuk gas SF6 pada tekanan 5 bar sebesar 100 kV/cm adalah 0,7 bar
BAB I PENDAHULUAN
1.1 Latar Belakang
Pada GIS, sebagian besar peralatan listrik ditempatkan dalam suatu
tabung yang berisi gas SF6 (Sulphur Hexafluorida), sehingga tidak
membutuhkan area yang luas dan tata ruang yang kompleks. Penggunaan gas
SF6 pada GIS selain sebagai isolasi terhadap peralatan, juga terhadap lingkungan
sebagai pemadam busur api. Kelebihan lain yang di miliki oleh gas SF6 adalah
memiliki kekuatan dielektrik yang tinggi, konduktivitas termal yang tinggi. Hal
ini membantu untuk mendinginkan konduktor-konduktor berarus listrik yang
berada di dalam gas. Pada saat pemutus daya memutuskan arus listrik, maka
akan timbul busur api. Makin besar arus, makin besar pula busur api yang akan
timbul dan panas yang akan ditimbulkan akibat busur api tersebut. Oleh karena
itu, dibutuhkan suatu media yang dapat mengisolasi sekaligus memadamkan
busur api tersebut. Akan tetapi Gas SF6 akan berkurang fungsionalnya jika tidak
terjaga kemurniannya. Biasanya gas ini diisikan kedalam tabung hampa
sehingga tidak diijinkan senyawa apapun kedalamnya karena akan
mempengaruhi kemurniannya. Dalam tugas akhir ini, Ketidakmurniannya
dipengaruhi oleh udara yang dikatakan sebagai polutan.
I.2.Tujuan dan Manfaat Penulisan
Adapun tujuan utama penulisan Tugas Akhir ini adalah :
1. Untuk mengetahui pengaruh udara terhadap kekuatan dielektrik gas SF6
2. Untuk mengetahui perbandingan Kekuatan Dielektrik yang terjadi jika
Gas SF6 murni dengan Gas SF6 yang terkontaminasi. Dalam hal ini udara
yang dikatakan sebagai polutan.
3. Untuk mengetahui seberapa besar kandungan udara yang masih diijinkan
dalam tabung pengisian tanpa harus melakukan kevakuman paling
minimum. Karena untuk melakukan kevakuman sampai nol, harus
mempunyai alat yang khusus.
Manfaat penulisan Tugas Akhir ini adalah untuk mengetahui secara nyata
pengaruh kandungan udara dalam Gas SF6 terhadap kekuatan dielektrik dan juga
digunakan sebagai acuan untuk pengembangan praktikum di Laboratorium
Teknik Tegangan Tinggi Fakultas Teknik Departemen Teknik Elektro.
I.3.Batasan Masalah
Agar tujuan penulisan tugas akhir ini sesuai dengan yang diharapkan serta
terfokus pada judul dan bidang yang telah disebutkan di atas, maka penulis
membatasi permasalahan yang akan dibahas sebagai berikut :
1. Tidak membahas secara keseluruh tentang kandungan udara
2. Tidak membahas reaksi kimia antara SF6 dan kandungan udara jika
terjadi dan sesudah terjadi tembus listrik
3. Tidak membahas sampai terjadinya busur api
4. Tidak membahas pengaruh Korosi
5. Standar tegangan tembus gas SF6 pada tekanan 5 bar sesuai dengan
standar buku yang ditulis oleh Ruben D.Garzon yang berjudul High
I.4.Metode Penulisan
Untuk dapat menyelesaikan tugas akhir ini maka penulis menerapkan
beberapa metode diantaranya :
a. Studi literatur yaitu dengan membaca teori-teori yang berkaitan
dengan topik tugas akhir ini dari buku-buku referensi baik yang
dimiliki oleh penulis atau di perpustakaan dan juga dari artikel-artikel,
jurnal, internet dan lain-lain.
b. Studi lapangan yaitu dengan melaksanakan percobaan di
Laboratorium Teknik Tegangan tinggi FT USU.
c. Studi bimbingan yaitu dengan melakukan diskusi tentang topik tugas
akhir ini dengan dosen pembimbing yang telah ditunjuk oleh pihak
Departemen Teknik Elektro USU, dengan dosen-dosen bidang Teknik
Tegangan Tinggi, asisten Laboratorium Teknik Tegangan Tinggi dan
teman-teman sesama mahasiswa.
I.5.Sistematika Penulisan
Tugas Akhir ini disusun berdasarkan sistematika penulisan sebagai berikut:
BAB I : PENDAHULUAN
Bab ini berisikan tentang latar belakang masalah, tujuan penulisan,
batasan masalah, manfaat penulisan, metode dan sistematika
penulisan.
BAB II : SIFAT- SIFAT LISTRIK DIELEKTRIK
Bab ini menjelaskan tentang teori sifat-sifat listrik dielektrik yang
berisi tentang kekuatan dielektrik, rugi-rugi dielektrik, tahanan isolasi,
BAB III : KARAKTERISTIK GAS
Bab ini berisikan tentang, Karakteristik SF6 yang berisi tentang ikatan
molekul gas SF6, sifat fisik gas SF6, sifat kimia gas SF6, proses
tangkapan elektron bebas pada SF6, Udara, Pendeskripsian Campuran
suatu Gas.
BAB IV : PERCOBAAN PENGARUH KANDUNGAN UDARA DALAM
GAS SF6 TERHADAP KEKUATAN DIELEKTRIK DI
LABORATORIUM TEKNIK TEGANGAN TINGGI FT USU
Bab ini akan mengumpulkan data dimana data diambil dengan
melakukan percobaan “pengaruh kandungan udara dalam gas SF6
terhadap kekuatan dielektrik”di Laboratorium Teknik Tegangan
Tinggi Fakultas Teknik USU
BAB V : KESIMPULAN DAN SARAN
Bab ini akan memberikan kesimpulan dari awal sampai selesai
BAB II
SIFAT-SIFAT LISTRIK DIELEKTRIK
II.1 UMUM
Dalam menentukan dimensi suatu sistem isolasi dibutuhkan
pengetahuan yang pasti mengenai jenis, besaran, dan durasi tekanan dielektrik
yang akan dialami bahan isolasi tersebut, dan disamping itu perlu
mempertimbangkan kondisi sekitar di mana isolasi akan ditempatkan. Selain itu
perlu juga diperhatikan sifat-sifat dari berbagai bahan isolasi sehingga dapat
dipilih bahan-bahan yang tepat untuk untuk suatu sistem isolasi. Sifat-sifat bahan
isolasi ditentukan pada keadaan kondisi standar. Adapun fungsi utama dari
bahan isolasi adalah :
a) Untuk mengisolasi antara suatu penghantar dengan penghantar lainnya.
Misalnya antara konduktor fasa dengan dengan konduktor fasa, atau
konduktor fasa dengan tanah
b) Menahan gaya mekanis akibat adanya arus pada konduktor yang diisolasi
c) Mampu menahan tekanan yang diakibatkan panas dan reaksi kimia.
Tekanan yang diakibatkan medan elektrik, gaya mekanik, thermal maupun
kimia dapat terjadi serentak, sehingga perlu diketahui efek bersama dari semua
parameter tersebut. Dengan kata lain, suatu bahan isolasi dinyatakan ekonomis
jika bahan tersebut dalam jangka waktu yang lama dapat menahan semua
tekanan tersebut. Adapun sifat dielektrik yang dibutuhkan untuk suatu bahan
a) Mempunyai kekuatan dielektrik (KD) yang tinggi, agar dimensi sistem
isolasi menjadi kecil dan penggunaan bahan semakin sedikit, sehingga
harganya semakin murah
b) Rugi-rugi dielektriknya rendah, agar suhu badan isolasi tidak melebihi batas
yang ditentukan
c) Memiliki kekuatan kerak (tracking strenght) tinggi, agar tidak terjadi erosi
karena tekanan elektrik permukaan
d) Memiliki konstanta dielektrik yang tepat dan cocok, sehingga membuat
arus pemuatan (charging current) tidak melebihi yang diijinkan.
Bahan isolasi sekaligus juga merupakan bahan konstruksi peralatan.
Oleh karena itu ia juga memikul beban mekanis, sehingga bahan isolasi harus
memenuhi persyaratan mekanis yang dibutuhkan. Sifat mekanis yang
dibutuhkan tergantung dengan pemakainnya. Peralatan-peralatan listrik akan
mengalami kenaikan suhu selama beroperasi baik pada kerja normal maupun
dalam kondisi gangguan, sehingga bahan isolasi harus memiliki sifat thermal
sebagai berikut:
a) Kemampuan menahan panas tinggi (daya tahan panas)
b) Kerentanan terhadap perubahan bentuk pada keadaan panas
c) Konduktivitas panas yang tinggi
d) Koefisien muai panas rendah
e) Tidak mudah terbakar
f) Tahan terhadap tembus listrik dan busur api.
Bahan isolasi harus dapat menyesuaikan diri terhadap lingkungan di
mana bahan itu digunakan. Bahan isolasi yang digunakan tidak hanya dengan
bagaimana pengaruhnya jika ada polutan yang mengakibatkan bahan isolasi
tersebut menjadi tidak murni. Karena jika bahan tersebut tidak murni akan
mempengaruhi keandalaanya. Dan dalam tugas akhir ini udara dianggap
sebagai polutan dari bahan isolasi tersebut. Tujuan dari pengujian tegangan
tinggi adalah untuk meneliti sifat-sifat listrik dielektrik baik yang telah
digunakan sebagai bahan isolasi peralatan listrik maupun masih dalam
penelitian. Ada sifat-sifat listrik dielektrik yang perlu diketahui, yaitu:
a) Kekuatan dielektrik
b) Rugi-rugi dielektrik
c) Tahanan Isolasi
d) Kekuatan kerak isolasi (tracking strength).
Bahan isolasi sekaligus juga merupakan bahan konstruksi peralatan.
Oleh karena itu ia juga memikul beban mekanis, sehingga bahan isolasi harus
memenuhi persyaratan mekanis yang dibutuhkan. Berikut ini akan dijelaskan
secara sederhana tentang apa yang dimaksud dengan keempat sifat-sifat diatas
sehingga kita dapat memilih bahan apa yang harus dipilih untuh sistem
pengisolasian ketika terjadinya tembus listrik pada peralatan listrik tersebut,
pendingin, dan pemadaman busur api.
II.2.KEKUATAN DIELEKTRIK
Suatu dielektrik tidak mempunyai elektron-elektron bebas, melainkan
elektron-elektron yang terikat pada inti atom unsur yang membentuk dielektrik
tersebut. Pada Gambar II.2 ditunjukkan suatu bahan dielektrik yang
ditempatkan diantara dua elektroda piring sejajar. Bila tegangan diberi tegangan
memberi gaya kepada elektron-elektron agar terlepas dari ikatannya dan menjadi
elektron bebas. Dengan kata lain, medan elektrik merupakan suatu beban yang
menekan dielektrik agar berubah sifat menjadi konduktor. Lihat gambar sebagai
berikut ini:
V
+
-E
Elektroda
Elektroda Dielektrik
Gambar II.2 Medan Elektrik dalam Dielektrik
Beban yang dipikul dielektrik ini disebut juga terpaan medan elektrik,
satuannya dinyatakan dalam Volt/cm. Setiap dielektrik mempunyai batas
kekuatan untuk memikul terpaan dielektrik. Jika terpaan dielektrik yang
dipikulnya melebihi batas tersebut dan terpaan berlangsung cukup lama, maka
dielektrik akan menghantar arus atau gagal melaksanakan fungsinya sebagai
isolator. Dalam hal ini dielektrik disebut tembus listrik atau “breakdown”.
Terpaan dielektrik tertinggi yang dapat dipikul suatu dielektrik tanpa
menimbulkan dielektrik tersebut tembus listrik disebut kekuatan dielektrik. Jika
suatu dielektrik mempunyai kekuatan dielektrik Ek, maka terpaan dielektrik yang
Jika terpaan elektrik yang dipikul dielektrik melebihi Ek, maka di
dalam dielektrik akan terjadi proses ionisasi berantai yang akhirnya dapat
membuat dielektrik mengalami tembus listrik. Poses ini membutuhkan waktu
dan lamanya tidak tentu tetapi bersifat statistik. Waktu yang dibutuhkan sejak
mulai terjadi ionisasi sampai terjadi tembus listrik disebut waktu tunda tembus
(time lag). Jadi, tidak selamanya terpaan elektrik dapat menimbulkan tembus
listrik, tetapi ada dua syarat yang harus dipenuhi agar dikatakan tembus listrik,
yaitu:
1. Terpaan elektrik yang dipikul dielektrik harus lebih besar atau
samadengan kekuatan dielektriknya
2. Lama terpaan elektrik berlangsung lebih besar atau sama dengan
waktu tunda tembus.
Untuk tegangan sinusoidal frekuensi daya dan untuk tegangan searah,
syarat kedua tidak berlaku, karena waktu puncak tegangan berlangsung dalam
orde milisekon sedangkan waktu tunda tembus ordenya dalam mikrosekon.
Tetapi untuk tegangan impuls yang durasinya dalam mikrodetik kedua syarat
tersebut harus dipenuhi. Untuk tegangan impuls, sekalipun tegangan yang
diberikan telah menimbulkan terpaan elektrik yang lebih besar daripada
kekuatan dielektrik, masih ada kemungkinan dielektrik tidak tembus listrik.
Kemungkinan ini terjadi jika terpaan elektrik itu berlangsung lebih lama
daripada waktu tunda tembusnya. Lamanya waktu tunda tembus tidak tentu, oleh
karena itu ditentukan oleh statistik, sehingga terpaan elektrik yang menimbulkan
tembus listrik dinyatakan dalam suatu harga statistik, yaitu harga yang
Tegangan yang menyebabkan dielektrik tersebut tembus listrik
disebut dengan tegangan tembus atau breakdown voltage. Tegangan tembus
adalah besarnya tegangan yang menimbulkan terpaan elektrik pada dielektrik
sama dengan atau lebih besar daripada kekuatan dielektriknya.
II.3.RUGI-RUGI DIELEKTRIK
Suatu bahan dilektrik terdiri dari susunan molekul-molekul, dimana
elektron-elektron terikat kuat dengan inti atomnya. Susunan molekul suatu
dielektrik yang bebas dari medan elektrik luar tidak beraturan seperti
ditunjukkan pada Gambar II.3.Aa. Bila dielektrik dikenai medan elektrik, maka
elektron-elektron akan mengalami gaya yang arahnya berlawanan dengan arah
medan elektrik, sedang inti atom yang bermuatan positif akan mengalami gaya
searah dengan arah medan elektrik. Gaya ini akan memindahkan elektron dari
posisi semula, sehingga molekul-molekul berubah menjadi dipol-dipol yang
letaknya sejajar dengan medan elektrik seperti ditunjukkan pada Gambar
II.3.Ab. Suatu dielektrik yang molekul-molekulnya berubah menjadi dipol,
disebut terpolarisasi. Jika medan elektrik berubah arah, maka gaya pada
muatan-muatan dipol akan berubah arah membuat dipol berputar 1800. Dapat kita lihat
pada Gambar II.3.Ac. Ketika molekul-molekul yang yang terpolarisasi ini
berubah posisi, maka terjadilah gesekan antar molekul. Jika medan elektrik
ulang berubah arah, maka gesekan antar molekul juga akan
berulang-ulang, Gesekan yang berulang-ulang ini akan menimbulkan panas pada
dielektrik, dan panas inilah yang disebut dengan rugi-rugi dielektrik. Untuk lebih
±
c
±
c
c
c
c
c
c
c
c
±
±
± ±
±
±
± ± ±
±
±
+
+
+
+
+
+
+
+
-Atom Netral Molekul terpolarisasi Molekul terpolarisasi
Gambar II.3.A Dampak medan Elektrik terhadap Molekul Dielektrik
Rugi-rugi dielektrik terjadi jika ada perubahan arah medan elektrik yang
berulang-ulang. Oleh karena itu, rugi-rugi dielektrik hanya terjadi pada medan
elektrik bolak-balik, yaitu medan yang ditimbulkan makin tinggi, maka
frekuensi gesekan antar molekul akan meningkat, akibatnya rugi-rugi dielektrik
semakin besar. Tetapi, jika frekuensi sangat tinggi, maka perubahan posisi dipol
sangat sedikit, karena molekul harus segera kembali ke semula. Dalam hal ini,
dipol tidak sempat berubah posisi 1800 sehingga peluang terjadinya gesekan
antar molekul berkurang. Akibatnya, rugi-rugi dielektrik akan berkurang pada
frekuensi yang sangat tinggi. Besarnya rugi-rugi dielektrik sebanding dengan
besarnya frekuensi, dan tan δ. Hubungan faktor disipasi dengan frekuensi yang
diambil dari buku yang ditulis oleh R.BARTNIKAS yang berjudul Electrical
102 103 104
105 106 107 108
0 0,002 0,004 0,006 0,008 0,01
Frekuensi (Hz) tan δ (Faktor disipasi)
101 60
Gambar.II.3.B Hubungan Rugi-rugi dielektrik dengan Frekuensi
II.4.Tahanan Isolasi
Jika suatu dielektrik diberi tegangan searah seperti ditunjukkan pada
gambar sebagai berikut:
IV IS
V
A
Ia
Pada gambar II.4.A, dapat kita lihat arus yang mengalir pada dielektrik
terdiri atas dua komponen, yaitu:
a) Arus yang mengalir pada permukaan dielektrik (Arus permukaan, Is).
b) Arus yang mengalir yang melalui volume dielektrik (Arus volume, Iv).
Sehingga arus sumber dapat dituliskan:
Ia = Is + Iv (II.4.a)
Hambatan yang dialami arus permukaan disebut tahanan permukaan
(Rs), sedang hambatan yang dialami arus volume disebut tahanan Volume (Rv).
Dalam prakteknya, faktor-faktor yang mempengaruhi pengukuran tahanan
isolasi antara lain arus absorpsi, suhu dan tegangan yang diterapkan. Berhubung
dengan adanya arus absorpsi, maka dalam pengukuran tahanan perlu
diperhatikan lamanya tegangan yang diterapkan dan sebelum pengukuran
dimulai, bahan yang hendak diuji sudah dibebaskan dari muatan yang melekat
padanya (waktu pelepasan biasanya 5-10 menit). Selanjutnya untuk melihat
kondisi sesuatu bahan isolasi dipakai suatu indeks polarisasi yaitu sebagai
dituliskan pada persamaan berikut ini :
(II.4.b)
Dimana R menyatakan tahanan isolasi, dan I menyatakan jumlah arus
yang mengalir, semuanya diukur sesudah 1 atau 10 menit. Bila αp = 1. Maka
dalam bahan isolasi terdapat kebocoran, dan dapat dikatakan bahan isolasi
tersebut tidak baik. Untuk isolasi murni dan kering di Jepang berlaku
syarat-syarat sebagai berikut :
αp > 1,5, untuk isolasi kelas A
Sebagai contoh untuk membuktikan karakteristik isolasi terhadap
waktu dapat kita lihat dari dua buah generator yang ditunjukkan pada Gambar
II.4.C yang diambil sesuai dengan buku yang ditulis oleh Artono Arismunandar
yang berjudul Teknik Tegangan Tinggi. Lengkung A adalah karakteistik dari
sebuah generator 20.000 kVA yang bersih dan dikeringkan, sedang lengkung B
adalah karakteistik dari generator 18.750 kVA yang sudah tidak terpakai dan
lembab. Dapat dilihat pada Gambar II.4.C yaitu Grafik Tahanan Isolasi vs
waktu bahwa untuk generator yang isolasinya baik, tahanannya naik terus,
dengan seiring waktu (lengkung A). Biasanya diperlukan waktu sehari penuh
untuk mencapai harga akhinya. Sebaliknya, untuk generator untuk isolasi yang
buruk (basah), waktu yang diperlukan untuk mencapai harga akhirnya pendek
sekali (kira-kira 4 menit untuk lengkung B). Kecuali itu harganya pun rendah.
Akibatnya ialah bahwa indeks polarisasi untuk generator A lebih besar dari
indeks untuk generator B. Sebagai contoh lain, Gambar II.4.D menunjukkan
variasi tahanan isolasi kelas B dari sebuah Angker A.C. selama proses
pengeringan. Dalam gambar ini nilai tahanan 1 menit dan 10 menit digambar
bersama. Biasanya, pada permulaan pengeringan tahanan isolasi turun dengan
naiknya suhu, tetapi sesudah itu naik lagi bila bahannya menjadi bertambah
kering. Proses pengeringan dapat dihentikan bila tahanannya mencapai
kekenyangan, tahanannya cukup tinggi dan αp nya cukup besar. Untuk lebih
0,1 0,2 0,5 1,0 10 10 20 30 40 50 100 200 1000 1500 Tahanan Isolasi (MΩ)
Waktu (Menit) Lengkung A
Lengkung B
4,0
Gambar II.4.C Tahanan vs waktu
10 20 30 40 50 60 70 80
10 20 30 40 50 60 70 80
Pengukuran pada 1 menit
750C
300C
490C
90 100 750C
740C
750C
750C
740C
750C
750C
Pengukuran pada 10 menit Tahanan Isolasi MΩ
Waktu Pengeringan (Jam)
Pengukuran tahanan isolasi biasanya dilakukan sesudah pengujian suhu.
Untuk mesin, tahanan isolasi biasanya sangat terpengaruh oleh macam dan
kapasitas mesin, dan kondisi pengujian, tetapi dapat diperkirakan dari
rumus-rumus di bawah ini :
(II.4.d)
Atau bila kecepatan perputaran diperhitungkan :
(II.4.e)
Dimana : R : tahanan isolasi dalam Megaohm
V : tegangan nominal dalam volt
P : daya nominal dalam kW atau kVA
N : Perputaran nominal permenit (RPM)
Untuk generator berkapasitas besar dapat dipakai :
(II.4.f)
Dimana : K : 0,005 (Isolasi Kelas A)
Bila P > 1000 kVA K : 0,5 ( Isolasi Kelas B)
K : 0,008 (Isolasi Kelas A)
Bila P < 1000 kVA K : 0,015 ( Isolasi Kelas B)
Pengaruh dari suhu terhadap isolasi diberikan oleh rumus empiris sebagai
berikut :
Dimana : R1 : tahanan isolasi pada t1 0C dalam Megaohm
R2 : tahanan isolasi pada t2 0C dalam Megaohm
kT : konstanta suhu
: 30 untuk generator dengan isolasi kelas A
: 60 untuk generator dengan isolasi kelas B
: 40 untuk lilitan angker mesin D.C
Persamaan (II.4.g) dapat dituliskan sebagai berikut :
R1 = fR2 (II.4.h)
Di mana f adalah faktor koreksi suhu yaitu sebagai berikut :
f = 10A (T2 – T1) (II.4.i)
(II.4.j)
Adapun faktor lain yang mempengaruhi besarnya tahanan isolasi yaitu
polaritas tegangan. Di dalam bahan isolasi gas dan cairan murni akan didapat
hubungan arus dan tegangan. Pada Gambar II.4.E dijelaskan bahwa sebuah
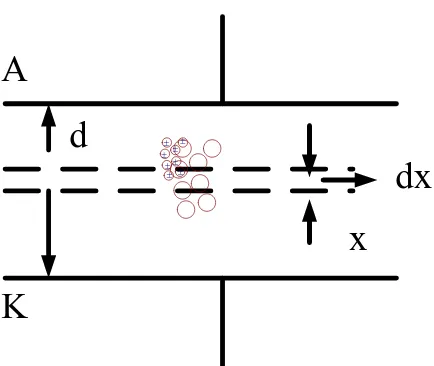
kapasitor plat sejajar yang memiliki media isolasi gas yang mempunyai jarak d
disuplai tegangan searah sehingga timbul medan elektrik di antara dua plat
sejajar tersebut dan sebelumnya keadaan molekul ion positif dan elektron masih
stabil dan dikatakan terdapat banyak atom-atom netral. Untuk lebih jelasnya
dx
x
d
A
K
c c c c c c c c ± ± ± ± ± ± ± ±Gambar II.4.E Kapasitor plat sejajar
Keadaan ini akan berubah karena adanya medan elektrik yang tinggi.
Dengan metode Townsend dijelaskan bahwa jika medan elektrik tinggi maka
arus dan tegangan akan tinggi juga. Akan tetapi arus akan tetap konstan
walaupun tegangan dinaikkan pada titik tertentu dan tidak akan naik lagi dan
arus ini dinamakan arus saturasi I0 dan dapat kita lihat pada Gambar II.4.F.
Ketika pada tegangan yang lebih tinggi, arus akan bertambah secara
eksponensial. Pertambahn arus secara eksponensial berkaitan dengan ionisasi
benturan elektron pada gas. Sebagaimana tegangan bertambah dan otomatis
medan elektrik pun bertambah, sehingga elektron akan bergerak lebih cepat.
Dan ketika energi kinetik lebih besar dari energi ikat elektron maka elektron
akan keluar dari ikatannya. Untuk menjelaskan pertambahan arus secara
eksponensial, dapat dilihat pada Gambar II.4.E dan Townsend akan
memperkenalkan sebuah koefisien α yang dikenal dengan koefisien ionisasi
townsend yang pertama yang artinya adalah jumlah elektron yang dihasilkan
di daerah medan elektrik tersebut. Dan no adalah jumlah elektron yang
meninggalkan katoda dan jumlah elektron yang meninggalkan katoda dan
dari anoda menuju daerah dx maka akan meghasilkan tambahan elektron
sebesar dn dan akan menyebabkan benturan. Dan hasil benturan tersebut
dapat dirumuskan sebagai berikut :
dn = α n dx (II.4.k)
(II.4.l)
ln n = αx + A (II.4.m)
Dan pada x = 0, n = n0 sehingga ln n = A. Maka diperoleh :
ln n = αx + ln n0 (II.4.n)
(II.4.o)
Pada x = d, maka n = n0 eαd, Oleh karena itu, dapat diperoleh arusnya adalah :
I = I0 eαd (II.4.p)
Dimana eαd adalah banjiran elektron dan jumlah elektron adalah elektron yang berasal dari katoda ke anoda. Dari persamaan yang dikutip dari buku yang
ditulis oleh C.L.Wadwha dengan judul New Age High Voltage Engineering,
diperoleh grafik II.4.F yaitu hubungan antara arus dan tegangan yang
mempengaruhi bahan isolasi tersebut yaitu sebagai berikut :
I0
V1 V2
I (AMPERE)
V (Volt) Isolasi Gas
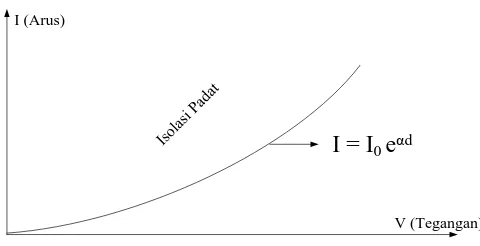
Bahan isolasi padat dipengaruhi oleh tegangan dan arus dimana
seiring bertambahnya tegangan yang diberikan maka arusnya juga bertambah
dan hal ini sesuai dengan teori ionisasi. Kemudian arus tersebut bertambah
secara eksponensial dan tidak mengalami titik saturasi. Besarnya arus yang
bertambah secara eksponensial dapat dilihat pada persamaan (II.4.p). Dari
persamaan tersebut maka diperoleh grafik yang diambil dari buku yang ditulis
oleh Artono ArisMunandar yang berjudul Teknik Tegangan Tinggi yaitu sebagai
berikut :
I (Arus)
V (Tegangan)
Isolasi Padat I = I
[image:32.595.208.448.310.433.2]0 eαd
Gambar II.4.G Hubungan Tegangan dan Arus terhadap bahan Isolasi Padat
Untuk keperluan evaluasi, dimana sampelnya dapat dilihat pada
Gambar II.4.F. Didefenisikan suatu faktor yang disebut faktor titik lemah, yaitu
perbandingan tahanan pada tegangan V1 dengan tahanan pada tegangan V2,
dimana V2 > V1, jika faktor titik lemah semakin besar, merupakan pertanda
bahwa isolasi semakin buruk. Dapat kita lihat persamaan sebagai berikut :
(II.4.q)
Dimana : αtl = Faktor titik lemah
Rv1 = tahanan pada V1
Selain itu tahanan dielektrik tergantung pada temperatur, kelembapan,
dan bentuk elektroda uji. Oleh karena itu, semua kondisi ini harus dicantumkan
pada hasil pengukuran.
II.5 Kekuatan Kerak isolasi
Bila suatu sistem isolasi diberikan tekanan dielektrik, maka arus akan
mengalir pada permukaannya. Besar arus permukaan ini ditentukan tahanan
permukaan sistem isolasi. Arus ini sering juga disebut dengan arus bocor arus
yang menyelusuri sirip isolator. Mudah dipahami, bahwa besar arus tersebut
dipengaruhi oleh kondisi sekitarnya, yaitu suhu, tekanan, kelembapan dan
polusi. Secara teknis, sistem isolasi harus mampu memikul arus bocor tersebut
tanpa menimbulkan pemburukan pada permukaan sistem isolasi atau setidaknya
pemburukan karena arus bocor tersebut dapat dibatasi.
Arus bocor menimbulkan panas, dan hasil sampingannya adalah
timbulnya penguraian pada bahan kimia yang membentuk permukaan sistem
isolasi. Efek yang sangat nyata dari penguaraian ini adalah timbulnya kerak
(jejak arus). Kerak dapat membentuk suatu lajur konduktif yang selanjutnya
akan menimbulkan tekanan elektrik yang berlebihan pada sistem isolasi. Panas
yang ditimbulkan arus bocor dapat juga menimbulkan erosi tanpa didahului oleh
adanya kerak konduktif.
Terjadinya kerak tidak terbatas hanya pada permukaan isolasi
pasangan luar, tetapi dapat juga terjadi pada isolasi peralatan pasangan dalam
yang terpasang pada tempat kotor dan lembab, juga pada isolasi yang terpasang
dibahagian dalam peralatan itu sendiri. Semua kejadian itu dipengaruhi sifat
Mekanisme terjadinya kerak sama dengan mekanisme lewat denyar isolasi
terpolusi. Bergabungnya beberapa kerak dapat memicu lewat denyar sempurna.
II.6 Teori Kegagalan Isolasi
Suatu peralatan listrik jika mengalami kegagalan pengisolasian maka
akan mengakibatkan Terjadinya Busur Api yang sudah menandakan terjadinya
tembus listrik. Terjadinya atau padamnya busur api berhubungan dengan
peristiwa ionisasi, deionisasi dan emisi. Berikut ini akan dijelaskan secara
singkat tentang peristiwa ketiga tersebut.
II.6.A Ionisasi
Terjadinya atau padamnya busur api berhubungan dengan peristiwa
ionisasi. Lihat gambar sebagai berikut :
+
+
ea
Elektron bebas
ei
Elektron terikat
Proton Neutron
+
+
ea ei
Proton Neutron
Gambar a.suatu
e
a membenture
i Gambar b.e
i keluar lintasan Gambar II.6.A Proses IonisasiPada Gambar II.6.A ditunjukkan model dari suatu atom helium. Inti
atom ini terdiri dari dua proton bermuatan positif dan dua neutron yang tidak
bermuatan. Dua elektron bermuatan negatif berputar mengelilingi inti atom
Oleh suatu proses, misalnya karena benturan suatu partikel dari luar, maka
elektron dapat keluar dari lintasannya dan terlepas menjadi elektron bebas,
sehingga partikel yang tersisa dalam atom tinggal berupa dua proton, dua
neutron dan satu elektron. Karena muatan positif lebih banyak dari muatan
negatif, maka total muatan atom sekarang menjadi positif. Terlepasnya
elektron dari ikatan atom netral sehingga terjadi elektron bebas dan ion positif
disebut ionisasi. Ionisasi dalam gas dapat terjadi karena tiga hal, yaitu: karena
adanya radiasi sinar kosmis, adanya massa yang membentur gas (Ionisasi
benturan) dan karena kenaikan temperatur gas ( Ionisasi thermis).
II.6.A.1 Radiasi Sinar Kosmis
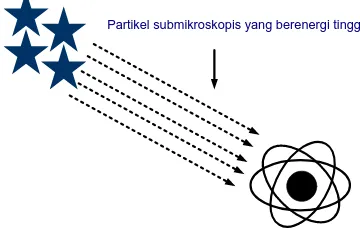
Ruang di atas bumi secara terus-menerus dibombardir dengan
partikel-partikel-partikel submikroskopis yang berenergi tinggi. Sebagian
berasal dari matahari yang sering disebut dengan sinar kosmis. Sebagian
berasal dari pemisahan bahan radioaktif yang setiap menit terjadi di dalam
bumi, di langit dan didalam organisme makhluk hidup. Partikel berenergi
tinggi ini membentur elektron molekul netral. Peristiwa ini membuat gas
[image:35.595.221.401.620.738.2]selalu mengandung elektron-elektron bebas. Untuk lebih jelasnya lihat
gambar sebagai berikut:
Dari gambar II.6.A.1 terlihat bahwa energi yang berasal dari
radiasi sinar kosmis yang menimbulkan partikel submikroskopis yang
berenergi tinggi yang disebut juga energi radiasi akan membentur atom
netral yang ada di bumi. Walaupun ada energi ikat elektron pada atom
tersebut atau disebut juga dengan energi ikat elektron akan tetapi jika energi
radiasi lebih besar dari energi ikat elektron maka akan terjadi ionisasi yang
disebut dengan ionisasi radiasi sinar kosmis. Dimana proses kimianya
adalah sebagai berikut:
A + Energi A+ +
e
Dimana : A = Atom netral
A+ = ion Positif
e = elektron bebas
II.6.A.2 Ionisasi benturan
suatu gas berada diantara dua dua elektroda plat sejajar. Kedua
elektroda diberi tegangan searah, akibatnya timbul medan listrik diantara
kedua elektroda yang arahnya dari anoda kekatoda. Lihat gambar sebagai
berikut:
ea
E
(+)Anoda Katoda (-)
Elektro bebas Molekul netral
Didalam gas dimisalkan ada satu elektron bebas hasil radiasi
sinar kosmis (ea). Karena adanya medan listrik, elektron tersebut akan
mengalami gaya yang arahnya menuju anoda. Dalam perjalanan menuju
anoda, elektron itu membentur molekul-molekul netral gas. Jika energi
kinetis elektron pembentur lebih besar dari energi ikat elektron gas, maka
elektron gas akan keluar dari lintasannya menjadi elektron bebas baru dan
menyisakan ion positif. Ion positif akan mengalami gaya dan bergerak
menuju katoda sedang elektron bebas baru akan bergerak menuju anoda.
Elektron baru ini akan mengadakan ionisasi benturan lagi, sehingga elektron
bebas dan ion positif didalam gas semakin banyak jumlahnya.
II.6.A.3 Ionisasi Thermis
Jika temperatur gas dalam suatu bejana tertutup dinaikkan,
maka molekul-molekul gas akan bersirkulasi dengan kecepatan tinggi
sehingga terjadi benturan antar molekul dengan molekul. Jika temperatur
semakin tinggi, maka kecepatan molekul semakin tinggi, sehingga benturan
antar molekul semakin keras dan dapat membuat terlepasnya elektron dari
molekul netral. Lihat gambar sebagai berikut:
[image:37.595.257.343.582.729.2]II.6.B Deionisasi
Jika suatu elektron bebas bergabung dengan suatu ion positif akan
dihasilkan suatu molekul netral. Peristiwa penggabungan ini disebut dengan
deionisasi. Deionisasi akan mengurangi partikel bermuatan dalam suatu gas. Jika
pada suatu gas terjadi aktivitas deionisasi yang lebih besar dari aktivitas ionisasi,
maka muatan-muatan bebas didalam gas itu akan berkurang. Lihat gambar
sebagai berikut:
+
+
Elektron bebas Elektron terikat
Proton Neutron
+
+
Proton Neutron
e
ae
aGambar a.elektron kembali terikat Gambar b.
e
a diluar lintasan Gambar II.6.B Proses DeionisasiAda empat proses deionisasi yang berhubungan dengan pemadaman
busur api pada suatu pemutus daya, yaitu:
1. Deionisasi medan elektrik
2. Deionisasi rekombinasi
3. Deionisasi akibat pendinginan
4. Deionisasi tangkapan elektron.
II.6.B.1 Deionisasi medan elektrik
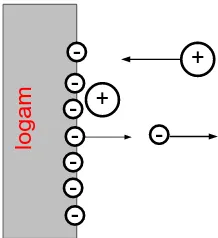
Telah dijelaskan sebelumnya bahwa medan elektrik timbul diantara
muatan-muatan gas yang terdapat diantara elektroda. Elektron bebas bergerak
menuju anoda sedangkan ion positif bergerak menuju katoda. Jika elektron
bebas tiba di anoda, maka elektron akan masuk kedalam metal. Ion positif
akhirnya akan mendekati spermukaan katoda dan menarik elektron keluar
permukaan dari permukaan katoda, dan bergabung membentuk molekul gas
netral. Jika diantara kedua elektroda tidak terjadi proses ionisasi, maka medan
elektrik akan melenyapkan semua elektron bebas dari gas dan mengubah semua
ion positif menjadi molekul netral. Lihat gambar sebagai berikut :
-( - )
Ion ( + )
E
K
( - )
Molekul netral
E
K
Gambar II.6.B.1 Deionisasi Medan Elektrik II.6.B.2 Deionisasi akibat Rekombinasi
Rekombinasi adalah pengurangan muatan karena penggabungan
elektron bebas dengan ion positif. Rekombinasi jarang terjadi dalam suatu gas.
Peristiwa ini lebih mudah terjadi pada bidang batas antara gas dengan zat padat
+
+
+
+
+
+
+
Partikel bermuatan = 14
+
+
+
+
+
+
+
Partikel bermuatan = 8
Gambar II.6.B.2 Deionisasi rekombinasi II.6.B.3 Deionisasi Akibat pendinginan
Telah dijelaskan sebelumnya bahwa didalam gas bertemperatur tinggi
akan terjadi gerakan molekul-molekul gas yang dapat menimbulkan ionisasi
thermis. Sebaliknya, pendinginan gas atau udara akan memperlambat gerakan
molekul. Hal ini akan menghalangi terjadinya ionisasi thermis dalam gas
tersebut, sehingga pembentukan elektron bebas dan ion positif dapat dicegah.
Pendinginan gas atau udara tidak secara langsung mengurangi partikel
bermuatan, tetapi hanya menghalangi terjadinya ionisasi thermis dalam gas.
II.6.B.4 Deionisasi tangkapan elektron
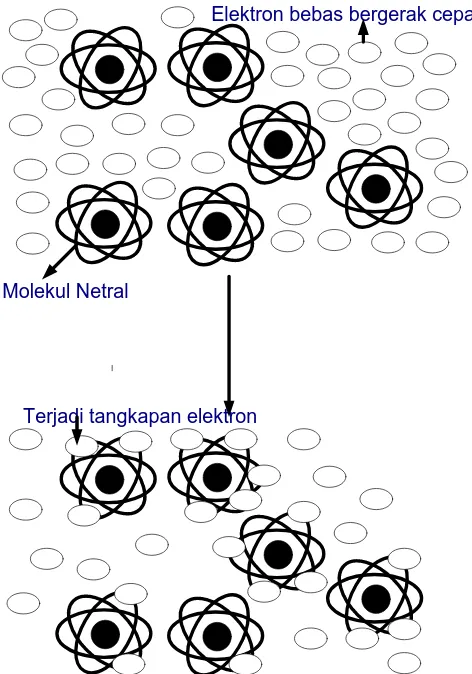
Beberapa gas tertentu, seperti gas SF6, mempunyai atom netral yang
giat menangkap elektron bebas yang bergerak di dekatnya. Penggabungan
elektron bebas dengan atom netral menghasilkan ion negatif. Seandainya gas ini
berada diantara dua elektroda plat sejajar bertegangan, maka elektron bebas yang
bergerak ke anoda akan ditangkap atom netralnya dan membentuk ion negatif.
Ion negatif ini akan mengalami gaya dan bergerak menuju anoda. Tetapi karena
massanya yang relatif besar, maka ia bergerak lebih lambat dari pergerakan
elektron bebas, sehingga tidak mampu menimbulkan ionisasi. Dengan demikian,
terjadinya elektron baru hasil ionisasi. Untuk lebih jelasnya lihat gambar sebagai
berikut :
Molekul Netral
Elektron bebas bergerak cepat
[image:41.595.198.434.157.494.2]Terjadi tangkapan elektron
Gambar II.6.B.4 Deionisasi tangkapan elektron II.6.C Emisi
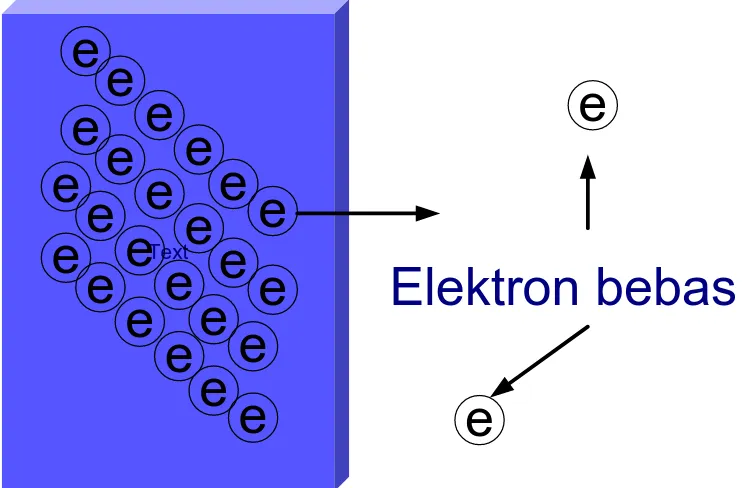
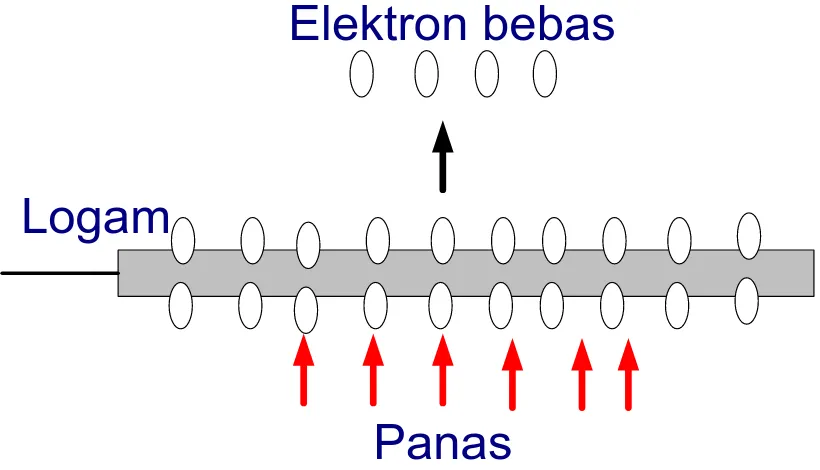
Emisi adalah peristiwa pelepasan elektron dari permukaan suatu
logam menjadi elektron bebas didalam gas. Ada dua proses emisi yang
berhubungan dengan pembentuk busur api pada pemutus daya, yaitu emisi
Text
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
e
Elektron bebas
Gambar II.6.C proses terjadinya emisi
Ada empat proses yang menyebabkan terjadinya emisi, yaitu:
1. Emisi fotoelektrik
2. Emisi benturan ion positif
3. Emisi medan tinggi
4. Emisi Thermis
II.6.C.1 Emisi Fotoelektrik
Cahaya yang menghasilkan energi foton akan membentur logam yang
memiliki banyak elektron karena logam termasuk bahan yang konduktif.
Ketika energi foton lebih besar dari energi ikat elektron maka elektron akan
terlepas dari permukaan logam. Untuk lebih jelasnya lihat gambar sebagai
--
--
-Dinding logam
[image:43.595.208.432.100.285.2] [image:43.595.261.370.548.667.2]h.v (energi foton)
Gambar II.6.C.1 Emisi foto elektrik
II.6.C.2 Emisi benturan ion positif
Massa ion positif lebih besar daripada masa elektron bebas dan ion
positif membentur ion negatif pada logam. Karena energi kinetis ion positif
lebih besar dari energi ikat elektron logam maka elektron akan terlepas dari
permukaan logam. Untuk lebih jelasnya dapat kita lihat pada gambar
sebagai berikut :
-- +
logam
+
II.6.C.3 Emisi Medan Tinggi
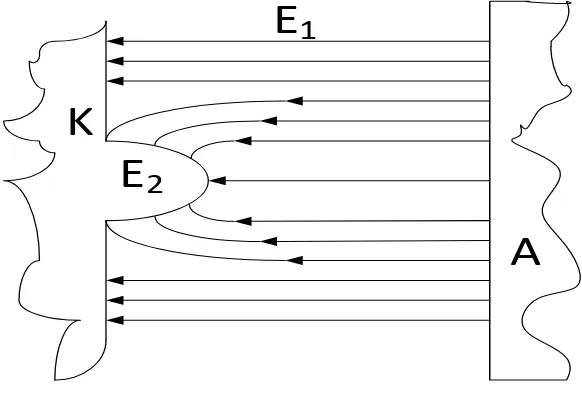
Permukaan suatu logam tidak semuanya mulus, tetapi selalu
ada titik-titik yang runcing. Jika logam tersebut dikenai medan elektrik
seperti yang ditunjukkan pada gambar berikut ini:
E
1
E
2
K
[image:44.595.167.458.201.399.2]A
Gambar II.6.C.3 Emisi Medan Tinggi
Maka elektron yang terdapat permukaan logam katoda (K) akan
mengalami gaya yang arahnya menuju anoda (A). Elektron pada ujung
runcing akan mengalami gaya yang lebih besar karena intensitas medan
elektrik di titik tersebut relatif lebih besar dibandingkan dengan intensitas
medan elektrik di bahagian yang datar. Jika intensitas medan elektrik cukup
besar, maka dari titik runcing tersebut akan dilepaskan elektron bebas.
Pelepasan elektron ini yang disebut emisi bintik katoda.
II.6.C.4 Emisi Thermis
Suatu logam yang mempunyai titik lebur tinggi, seperti karbon, jika
menjadi elektron bebas di dalam gas. Proses inilah disebut emisi thermis.
Untuk lebih jelasnya dapat kita lihat pada gambar sebagai berikut :
Panas
Elektron bebas
[image:45.595.115.525.158.393.2] [image:45.595.239.401.650.739.2]Logam
Gambar II.6.C.4 Emisi Thermis
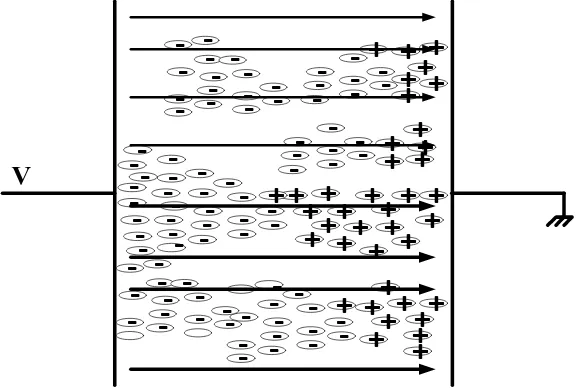
II.6.D Mekanisme tembus listrik pada Gas
Mekanisme tembus listrik yang digunakan adalah metode tembus
listrik townsend. Metoda ini digunakan untuk di daerah yang mempunyai
tekanan rendah dan jarak sela antara kedua plat sejajar yang sempit. Oleh
karena itu, akan diuraikan mekanisme tembus listrik townsend yaitu sebagai
berikut :
-ea
Elektroda
Elektroda
Plat sejajar Plat sejajar
Dari Gambar II.6.D.1 dapat dijelaskan bahwa didalam Udara
terdapat elektron bebas yang disebabkan karena peristiwa ionisasi foton
radiasi sinar ultraviolet dan juga terdapat molekul-molekul netral. Apabila
kedua elektroda dihubungkan dengan sumber tegangan, maka timbul medan
listrik (E) yang arahnya dari anoda ke katoda. Akibat adanya medan listrik,
maka ea (elektron bebas) akan mengalami gaya (F) yang arahnya berlawanan
dengan arah medan listrik (E). Karena adanya gaya (F) maka ea bergerak dari
katoda ke anoda. Dalam perjalanan menuju anoda, elektron bebas membentur
atom netral. Jika Energi kinetis elektron awal lebih besar dari energi ikat
elektron molekul netral maka akan terjadi ionisasi. Ionisasi benturan
menghasilkan satu elektron bebas baru (eb ) dan satu ion positif. Jadi, ea dan eb
terus bergerak menuju anoda. Dalam perjalanannya menuju anoda ea dan eb
membentur lagi atom netral sehingga terjadi lagi ionisasi sehingga jumlah
elektron bebas dan ion positif semakin banyak. Ion positif bergerak menuju
katoda dan terjadilah benturan ion positif dengan dinding katoda sehingga
timbullah emisi benturan ion positif. Dari permukaan katoda muncul
elektron-elektron baru hasil emisi ion positif membentur lagi atom netral
sehingga terjadi lagi ionisasi sehingga jumlah elektron elektron bebas dan ion
positif semakin banyak. Selama medan listrik masih ada maka proses ionisasi
benturan dan emisi ion positif akan terus berlangsung sehingga terjadilah
banjiran elektron dan ion positif. Ion positif yang membentur katoda semakin
banyak sehingga elektron hasil emisi ion positif semakin banyak yang
menyebabkan banjiran muatan. Muatan yang berpindah dari katoda ke anoda
semakin besar yang dimana perpindahan muatan sebanding dengan arus dan
menyebabkan banjir muatan dan arus pun semakin besar yang kemudian
terjadilah tembus listrik. Dan dapat kita lihat pada gambar sebagai berikut :
[image:47.595.175.464.142.336.2]--
--
--
--
--
-
--
--
--
-
---
--
-
--
--
-
--
-
--
-
--
-
--
-
-+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+ + +
+
+
+
+
+
-
---
--
--
-V
BAB III
KARAKTERISTIK SF6 DAN UDARA
Sistem pengisolasian dengan menggunakan minyak dan udara
pada CB (Circuit Breaker) sudah digunakan selama 100 tahun. Akan tetapi,
ada alternatif lain yang digunakan untuk pengisolasian pada CB yaitu dengan
mengunakan SF6.Gas ini sudah diketahui pada tahun 1956 danditeliti pada
tahun 1900 oleh Henry Moisson yaitu orang pertama yang mengatakan
bahwa fungsi SF6 adalah sebagai pemadam busur api yang kemudian
dikembangkan oleh T.E.Browne, A.P.Strom dan H.J.Lingal pada tahun 1953.
Pada tugas akhir ini akan membahas pengaruh Kandungan Udara dalam Gas
SF6 terhadap kekuatan dielektrik dimana udara dinyatakan sebagai polutan.
Hal ini terjadi karena pada saat pengisian gas SF6 kedalam tabung hampa
tidak diijinkan unsur apapun didalamnya karena akan mempengaruhi
keandalan dari gas tersebut.
III.A GAS SF6 (SULPHUR HEXAFLUORIDA)
Ada berbagai macam gas sintetis dari senyawa halogen. Salah satu
jenis gas sintetis tersebut adalah gas SF6. Untuk saat ini, gas SF6 merupakan
gas sintetis dari senyawa halogen yang perannya hampir tidak tergantikan
sebagai bahan isolasi di dalam dunia teknik tenaga listrik. Salah satu contoh
penggunaan gas SF6 sebagai bahan isolasi di dalam dunia teknik tenaga
listrik adalah pada pemutus tenaga atau circuit breaker. Senyawa gas SF6
diperoleh dari pencampuran atau direaksikan dari belerang cair dan gas
kemurnian 99,9%. Gas-Gas SF6 murni adalah gas berat yang tidak berwarna,
tidak berbau, tidak berasa dan tidak beracun. Secara kimia stabil dan tidak
mudah terbakar.
III.A.1 Ikatan Molekul Gas SF6
Ikatan molukul gas SF6 mempunyai bentuk simetris yang sempurna
dengan sebuah atom sulphur (S) terletak di pusatnya dan atom fluor (F)
berada mengelilingi atom sulphur membentuk sudut-sudut yang beraturan.
Atom sulphur bervalensi enam, hal ini menunjukan bahwa atom sulphur
mampu mengikat enam atom fluor untuk melengkapi lapisan luar
elektronnya.
Struktur dari gas SF6 yang seluruh ikatan kimianya terisi penuh
menunjukan sifat molekul yang diam (inert) dan mempunyai kesetabilan
yang tinggi serta memiliki energi pembentukan yang besar. Gas SF6 tersusun
atas 22% berat belerang dan 78% berat fluor. Gas SF6 mempunyai rapat gas
sebesar 6,139 gram/liter pada suhu 20°C, dan merupakan gas terberat, yaitu
lima kali lebih berat dari udara. Bentuk molekul dari gas SF6 adalah bentuk
oktahedron. Pengertian dari bentuk oktahedron adalah suatu bentuk molekul
yang terbentuk dari dua buah limas segi empat, dengan bidang alas dari
masing-masing limas segi empat tersebut saling berhimpit, sehingga
membentuk delapan bidang segitiga. Molekul oktahedron ini terdiri dari satu
atom pusat dan enam atom yang mengelilingi atom pusatnya. Untuk gas SF6,
atom pusatnya adalah atom sulfur dan enam atom yang mengelilingi atom
pusat adalah atom fluor. Atom pusat dari molekul gas SF6 ini terletak pada
atom lainnya terletak pada sudut-sudut limas tersebut. Untuk lebih jelasnya,
hal ini dapat dilihat pada gambar berikut ini :
F
F
S F
F
[image:50.595.218.419.141.334.2]F F
Gambar III.A1 Ikatan molekul Gas SF6
III.A.2 Sifat Fisik Gas SF6
Pada temperatur 200C dan tekanan 1 atm, gas SF6 ini mempunyai
berat jenis 6,16 kg/m2, sedangkan udara hanya 1,66 kg/m2 berarti hal ini
mencapai 4 kali berat jenis udara. Oleh karena itu, gas SF6 termasuk dalam
kategori gas berat. Selain itu gas SF6 mempunyai berat molekul ± 5 kali lebih
berat dari udara. Berat molekul gas SF6 140,07 kg/kmol dan berat molekul
udara 28,8 kg/kmol. Pada temperatur yang rendah yaitu -50,70C dan tekanan
2,3 bar maka gas SF6 akan mencair. Kecepatan suara dalam gas SF6 adalah
138,5 m/det pada temperatur 300C dan tekanan 1 atm, sedangkan untuk udara
dalam kondisi yang sama mempunyai kecepatan rambat suara 350 m/dt. Jadi,
kecepatan perambatan suara dalam gas Sulphur Hexafluorida (SF6) adalah
sepertiga kali dari udara. Hal ini sangat baik pengaruhnya terhadap
penempatan pemutus daya gas SF6 ini tidak akan banyak membawa pengaruh
buruk bahkan akan menjadi tetangga yang baik. Panas jenis dari gas Sulphur
Hexafluorida (SF6) adalah sekitar 3,7 kali besar dari udara dan mempunyai
kerapatan 5 kali lebih besar dari udara dan ini merupakan hal penting untuk
pembatasan temperatur kerja peralatan listrik. Sebagai media isolasi, gas SF6
mempunyai kekuatan dielektrik yang baik, yaitu antara 2 sampai 3 kali lebih
besar daripada kekuatan dielektrik udara. Sedangkan pada tekanan 3 atm
keadaan absolut, kekuatan dielektrik dari gas SF6 hampir sama dengan
kekuatan dielektrik minyak. Selain itu, kekuatan dielektrik gas SF6
dipengaruhi oleh tekanan dimana semakin besar tekanan suatu gas maka
semakin besar pula tegangan kekuatan dielektriknya. Gambar III.A.2
berikut ini menunjukkan hubungan antara tegangan tembus gas SF6 terhadap
tekanannya untuk berbagai jarak sela pada elektroda bola-bola. Adapun
grafik ini diambil dari buku yaang ditulis oleh Ruben D.Garzon yang berjudul
High Voltage Circuit Breaker Design and Applications yaitu sebagai berikut :
2 4 6 8 10 12
50 100 150 200 250 0 X
X = 10 m
m
X = 5 m
m
X = 2 m
m
X = 1 m m
KD (Kekuatan Dielektrik)
kV/cm
P (Bar)
[image:51.595.171.469.524.735.2]Adapun cara untuk mendapatkan nilai kekuatan dielektrik gas SF6 dari
nilai tegangan tembusnya, maka dipergunakan persamaan berikut :
E
max=
(III.A.2a)
Dalam hal ini :
Emax = Kuat Medan Listrik Tertinggi Di Antara Elektroda Bola-Bola
Vt = Tegangan Tembus Media Isolasi Di Antara Elektroda Bola-Bola
d = Jarak Sela Elektroda Bola-Bola
η = Faktor Efisiensi
Faktor efisiensi merupakan fungsi dari karakteristik-karakteristik
geometri elektroda bola-bola. Karakteristik-karakteristik geometri elektroda
bola-bola tersebut adalah :
P
=
(III.A.2b)q
=
(III.A.2c)Untuk elektroda bola-bola yang identik, maka nilai q sama dengan
satu. Sehingga faktor efisiensi adalah :
= f(p,q) (III.A.2d)
Gas SF6 tepat akan tembus listrik pada saat kuat medan listrik
maksimum yang menerpanya sama dengan kekuatan dielektriknya. Sehingga
dapat dinyatakan dalam persamaan :
KD gas SF6 = Emax (III.A.2e)
Berikut ini disajikan tabel nilai faktor efisiensi η untuk berbagai nilai
Tabel III.A.2 Tabel Nilai Faktor Efisiensi η
P q =1
1 1
1,5 0,924
2 0,861
3 0,760
4 0,684
5 0,623
6 0,574
8 0,497
10 0,442
15 0,349
20 0,291
50 0,1574
100 0,094
300 0,038
500 0,025
800 0,0168
1000 0,0138
III.A.3 Sifat Kimia Gas SF6
Ikatan molekul gas SF6 yang membentuk ikatan kovalen dimana
molekul dari gas SF6 ini mempunyai beberapa keuntungan yaitu :
- Tidak larut dalam air
- Tidak dapat diserap oleh asam
- Tidak mudah terbakar
Pada temperatur yang sangat tinggi sekitar ± 5000 C, gas SF6
dapat terurai menjadi SF4 dan SF2 serta sedikit campuran dari S, F dan S2.
Bahan-bahan ini jika bercampur dengan uap air akan menyebabkan korosi
pada bahan gelas dan logam dimana bahan ini banyak digunakan sebagai
penyekat pada gardu induk. Selain itu, kemampuan dari perpindahan panas
oleh SF6 sangat layak. Kemampuan perpindahan SF6 lebih baik daripada
perpindahan suhu pada gas helium adalah 10 kali lebih besar dari SF6.,
Kemudian helium memiliki sifat perpindahan panas yang terjadi lebih tinggi
dari SF6. SF6 bukan hanya sebagai bahan isolasi yang baik tapi ia juga
memiliki gaya ikat elektron yang tinggi atau dengan kata lain memiliki sifat
keelektronegatifan yang tinggi. Selain memiliki tembus listrik yang tinggi,
tetapi juga memiliki kekuatan dielektrik yang tinggi sehingga sangat baik
dalam pemadaman busur api. Lihat gambar sebagai berikut :
10 100 1000
0,1 1 10 100
Perpindahan Panas (Watt)
SF6
Udara
[image:54.595.192.443.236.489.2]Temperatur (OC)
Gambar III.A.3 Perbandingan perpindahan panas SF6 dan Udara
Karena Suhu pemisah senyawa SF6 rendah dan energi pemisah
senyawa SF6 tinggi sehingga sangat baik digunakan untuk pemadaman
busur api. Fungsi utama SF6 untuk memadamkan busur api selain itu juga
memiliki kemampuan khusus dapat memulihkan kekuatan dielektrik
mengikuti perioda busur terjadinya busur api sangat cepat, dan pada waktu
yang singkat dan konstant dapat membuat perubahan arus mendekati nol
dimana salah satu sifat penting untung melakukan pemutusan arus ketika
III.A.4 Proses Tangkapan Elektron Bebas Pada Gas SF6
Gas SF6 memiliki energi elektronegativitas yang tinggi.
Elektronegativitas adalah suatu sifat kimia dari sebuah atom atau molekul
untuk menarik atau menyerap elektron bebas yang berada di sekitarnya. Jika
di antara dua elektroda sejajar yang dipisahkan oleh bahan isolasi gas SF6
diberi sumber tegangan, maka akan timbul medan listrik di antara elektroda
sejajar yang melalui bahan isolasi gas SF6 tersebut. Pada gas SF6, terdapat
molekul netral dan tentunya elektron bebas. Elektron bebas yang terdapat di
dalam gas SF6 tersebut akan dikenai medan listrik, sehingga elektron bebas
akan mengalami gaya dan menuju ke terminal positif. Gambar di bawah
menunjukkan medan listrik yang timbul di antara dua buah elektroda plat
[image:55.595.164.518.419.604.2]sejajar yang dipisahkan oleh bahan isolasi gas SF6.
Gambar III.A.4a. Medan Listrik Yang Timbul Di Antara Dua Elektroda
Dalam perjalanannya, elektron bebas akan mendekati molekul netral
gas SF6. Setelah elektron bebas sangat dekat dengan molekul netral gas SF6
atau hampir membentur molekul netral gas SF6, maka molekul netral gas SF6
negatif. Gambar berikut menunjukkan molekul netral gas SF6 yang menyerap
elektron bebas.
GambarIII.A.4b Penyerapan Elektron Bebas Pada Molekul Netral
Ion negatif yang terbentuk memiliki massa yang relatif besar jika
dibandingkan dengan elektron bebas. Sehingga ion negatif ini tidak mampu
untuk menimbulkan ionisasi benturan. Semakin kecil peluang terjadinya
ionisasi benturan, maka elektron bebas yang terbentuk akan semakin sedikit
juga. Maka media isolasi, dalam hal ini adalah gas SF6, semakin sulit untuk
terjadi tembus listrik. Oleh karena gas SF6 mempunyai energi
elektronegativitas yang tinggi, maka gas SF6 memiliki kekuatan dielektrik
yang baik. Meskipun gas SF6 memiliki kekuatan dielektrik yang baik dan
beberapa keunggulan, perlu diperhatikan bahwa gas SF6 juga mempunyai
beberapa kekurangan, yaitu gas SF6 tidak dapat digunakan untuk tekanan
diatas 13,8 bar. Apabila tekanan akan dipakai melebihi 13,8 bar, maka gas
SF6 harus dipanaskan terlebih dahulu. Fungsi dari pemanasan ini adalah
[image:56.595.132.515.151.345.2]Ada pun kemunduran fungsi dapat terjadi karena zat pencemar SF6.
Menurut data dari PT. PLN (PERSERO) P3B Jawa – Bali, zat tersebut
merupakan produk-produk dekomposisi, seperti tertera pada tabel sebagai
[image:57.595.137.561.224.705.2]berikut :
Tabel III.A.4 Zat-zat yang menyebabkan berkurangnya fungsi Gas SF6
Gas Senyawa Sumber
Udara (80%N2, 20%O2) N2, O2 Bocor / Intrusi dari luar
Moisture H2O Bocor / Intrusi dari luar
Carbon tetraflouride CF4 Kompenen berunsur karbon
Hydrofluoric acid HF Terbentuk di SF6 jika ada busur api
Sulfur dioxide S02 Terbentuk jika SOF2 bereaksi dengan
air
Sulfur monoflouride S2F2 tidak terdeteksi karena sangat reaktif /
tidak stabil
Sulfur diflouride SF2 Mudah bereaksi
Sulfur tetraflouride SF4 Sangat mudah bereaksi
Disulfur decaflouride S2F10 keberadaannya dalam SF6 sangat
diragukan
Silicon tetraflouride SiF4 Busur api, jika ada silicon
Carbon disulfur CS2 Busur api, jika ada silicon
Carbon dioxide CO2 Dari senyawa yang mengandung
III.B Udara
Udara terdiri atas campuran
Udar
ua
dan partikel dalam udara akan berubah-ubah dengan ketinggian dari
permukaan
ketinggian. Semakin dekat dengan lapisan
sehingga melewati batas
Adapun gas-gas yangterkandung dalam udara adalah seperti berikut :
1)
2)
3)
4)
III.B.1 Helium
Helium (He) adalah
berasa, tak beracun, hampi
pada seri
Dikatakan gas mulia karena konfigurasi elektronnya terisi penuh dan gas ini
memiliki energi ionisasi yang sangat besar dan afinitas elektron yang sangat
rendah, Titik didih dan titik leburnya merupakan yang terendah dari
unsur-unsur lain dan ia hanya ada dalam bentuk gas kecuali dalam kondisi ekstrim.
Kondisi ekstrim juga diperlukan untuk menciptakan sedikit
massa jenis 101,325 kPa pada suhu 0 0C, (0,1786 g/L), titik lebur 0,95
272,05
peleburan 0,0138 kJ/mol, kalor penguapan 0,0829 kJ/mol, dan kapasitor kalor
(25 °C) 20,786 J/(mol·K) semua kondisi 1 atm.
III.B.2 Nitrogen
Nitrogen atau zat lemas adalah
memiliki lambang N da
tanpa warna, tanpa bau, tanpa rasa dan merupakan gas diatomik bukan
logam yang stabil, sangat sulit bereaksi dengan unsur atau senyawa lainnya.
Dinamakan zat lemas karena zat ini bersifat malas, tidak aktif bereaksi
dengan unsur lainnya. Nirogen merupakan senyawa penting seperti
77 0K (-196oC) pada tekanan 1 atmosfir dan membeku pada suhu 63 0K
(-210oC). Adapun sifat-sifat kimia dari Nitrgen yaitu:
1. Mempunyai massa atom 14,0067 sma
2. Mempunyai nomor atom 7
3. Titik didih -196 0C
4. Titik beku -210 0C
5. Mempunyai volume atom 17,30 cm3 /mol
6. Mempunyai struktur heksagonal
7. Mempunyai massa jenis 1,2151 gram/cm3
8. Mempunyai kapasitas panas 1,042 J/g0K