UJI ANTAGONIS Trichoderma harzianum TERHADAP
Rhizoctonia sp. PENYEBAB PENYAKIT HAWAR DAUN PADA
JABON (Anthocephalus cadamba (Roxb.) Miq.) SECARA IN VITRO
RESANANDA EFRILIA
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Uji Antagonis Trichoderma harzianum terhadap Rhizoctonia sp. Penyebab Penyakit Hawar Daun pada Jabon (Anthocephalus cadamba (Roxb.) Miq.) secara in Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
RESANANDA EFRILIA. Uji Antagonis Trichoderma harzianum terhadap Rhizoctonia sp. Penyebab Penyakit Hawar Daun pada Jabon (Anthocephalus cadamba (Roxb.) Miq.) secara in Vitro. Dibimbing oleh ACHMAD.
Jabon (A. cadamba) merupakan salah satu jenis pohon cepat tumbuh yang diminati oleh industri kayu lapis dan industri pulp dan kertas karena riapnya yang besar dengan daur yang pendek. Salah satu penyakit yang menyerang tanaman Jabon adalah hawar daun (leaf blight) yang disebabkan oleh Rhizoctonia sp. Penelitian ini menggunakan jamur antagonis T. harzianum dengan tujuan untuk mengetahui potensi penghambatan pada aktifitas Rhizoctonia sp. pada media PDA (Potatos Dextrose Agar) dan PFA (Potatos Fructose Agar) sebagai media padat serta PDB (Potatos Dextrose Broth) dan PFB (Potatos Fructose Broth) sebagai media cair yang digunakan untuk uji antagonis. Analisis data yang digunakan yaitu RAL (Rancangan Acak Lengkap) in time untuk isolat yang ditumbuhkan pada media padat dan RAL faktorial untuk isolat yang ditumbuhkan pada media cair. Hasil uji Duncan menunjukkan bahwa media-media yang digunakan tidak berpengaruh nyata terhadap penghambatan aktifitas Rhizoctonia sp. oleh T. harzianum dimana tingkat penghambatan pada metode langsung di media PDA (79.38%) lebih tinggi daripada di media PFA (69.10%).
Kata kunci: Jabon, Rhizoctonia sp., Trichoderma harzianum, media, RAL
ABSTRACT
RESANANDA EFRILIA. Antagonist Test Trichoderma harzianum against Rhizoctonia sp. Causes leaf blight disease on Jabon (Anthocephalus cadamba (Roxb.) Miq.) by in vitro. Supervised by ACHMAD.
Jabon (A. cadamba) is a fast-growing species demanded by the plywood industry and the pulp and paper industry because of great growth increment with short cutting cycle. One of the diseases that attack Jabon is leaf blight caused by Rhizoctonia sp. This study uses antagonistic fungus Trichoderma harzianum in order to find out the potential inhibitory of Rhizoctonia sp. on PDA (Potatos Dextrose Agar) and PFA (Potatos Fructose Agar) as a solid media and PDB (Potatos Dextrose Broth) and PFB (potatos Fructose Broth) as the liquid medium used for antagonist test. CRD (Completely Randomized Design) in time used for data analysis isolates that were grown on solid media and CRD factorial for isolates were grown in a liquid medium. Duncan test results indicated that the media used did not significantly affect the inhibitory activity of Rhizoctonia sp. by T. harzianum where the inhabitation rate in direct methode on PDA was higher (79.38%) than on PFA (69.10%).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
BOGOR 2014
UJI ANTAGONIS Trichoderma harzianum TERHADAP
Rhizoctonia sp. PENYEBAB PENYAKIT HAWAR DAUN PADA
JABON (Anthocephalus cadamba (Roxb.) Miq.) SECARA IN VITRO
Judul Skripsi : Uji Antagonis Trichoderma harzianum terhadap Rhizoctonia sp. Penyebab Penyakit Hawar Daun pada Jabon (Anthocephalus cadamba (Roxb.) Miq.) secara in Vitro
Nama : Resananda Efrilia
NIM : E44100075
Disetujui oleh
Prof Dr Ir Achmad, MS Pembimbing
Diketahui oleh
Prof Dr Ir Nurheni Wijayanto, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2014 ini ialah patogen antagonis, dengan judul Uji Antagonis Trichoderma harzianum terhadap Rhizoctonia sp. Penyebab Penyakit Hawar Daun pada Jabon (Anthocephalus cadamba (Roxb.) Miq.) secara in Vitro.
Terima kasih penulis ucapkan kepada Prof Dr Ir Achmad, MS selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Prof Dr Oki dari SEAMEO Biotrop, Aji Winara, SHut MSi, Ai Rosah Aisah, SHut MSi, Eti Artiningsih Octaviani, SHut dan Bu Euncah yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ibu, ayah, serta seluruh keluarga dan teman-teman, atas segala doa, semangat dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Waktu dan Tempat 2
Bahan 3
Alat 3
Prosedur Kerja 3
Prosedur Analisis Data 5
HASIL DAN PEMBAHASAN 6
Hasil 6
Pembahasan 13
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 21
DAFTAR TABEL
1Hasil uji Duncan persentase penghambatan Rhizoctonia sp. pada media PDA 9 dan PFA dengan metode uji antagonis langsung
2 Hasil uji Duncan persentase penghambatan Rhizoctonia sp. pada media PDA 10
dan PFA dengan metode uji antagonis tak langsung
3 Hasil uji Duncan pengaruh pengaruh perlakuan filtrat antagonis terha- 11
dap pertumbuhan Rhizoctonia sp.
DAFTAR GAMBAR
1 Metode dual culture Rhizoctonia sp. dengan T. harzianum dalam 4satu cawan uji antagonis berdiameter 9 cm 2 Pertumbuhan koloni miselium Rhizoctonia sp. 7
3 Pengamatan makroskopis Rhizoctonia sp.; (a) media PDA; (b) media 7
PFA 4 Struktur miselium Rhizoctonia sp. 7
5 Pertumbuhan koloni T. harzianum 8
6 Pengamatan T. harzianum; (a) media PDA; (b) media PFA 8
7 Pertumbuhan isolat Rhizoctonia sp. (R) dan T. harzianum (T) dalam 9
cawan uji antagonis; (a) media PDA dan (b) media PFA 8 Persentase penghambatan Rhizoctonia sp. oleh T. harzianum pada media 9
PDA dan PFA 9 Persentase penghambatan Rhizoctonia sp. oleh filtrat T. harzianum 10
10 Perbandingan pertumbuhan isolat Rhizoctonia sp.; (a) kontrol PDA 11
dengan (b) setelah ditambah filtrat T. harzianum pada media PDA; dan (c) kontrol PFA dengan (d) setelah ditambah filtrat T. harzianum pada media PFA 11 Biomassa Rhizoctonia sp. pada perlakuan kontrol dan penambahan filtrat 12
T. harzianum 12 Persentase penghambatan Rhizoctonia sp. oleh filtrat T. harzianum 12
13 Miselium Rhizoctonia sp. pada media PDB dan PFB; (a) kontrol dan 12
PENDAHULUAN
Latar Belakang
Indonesia telah dikenal sebagai negara yang memiliki hutan hujan tropis yang luas. Keanekaragaman pohon hutannya sangat tinggi. Hutan telah memberi banyak manfaat baik secara ekonomi, sosial maupun lingkungan. Secara ekonomi hutan telah memberikan banyak manfaat seperti hasil hutan kayu dan non kayu, sedangkan secara sosial hutan telah memberi nuansa budaya bagi bangsa Indonesia, sementara secara lingkungan keberadaan hutan ikut menjamin keselamatan bumi dari pemanasan global atau biasa dikenal dengan istilah global warming. Pemanfaatan hutan secara ekonomi dilakukan berdasarkan adanya permintaan kayu yang tinggi membuka peluang kepada perusahaan hutan tanaman maupun petani untuk mencari jenis kayu cepat tumbuh (fast growing species) dan merupakan jenis intoleran untuk meningkatkan produktivitasnya menghasilkan kayu yang berkualitas.
Pohon Jabon (Anthocephalus cadamba (Roxb.) Miq.) merupakan jenis pohon cepat tumbuh dan dapat hidup pada ruang terbuka sehingga cocok dikembangkan dalam pembangunan hutan tanaman. Pohon ini tergolong dalam family Rubiaceae (suku kopi-kopian) yang merupakan salah satu komoditas kehutanan unggulan karena dalam waktu 5 tahun diameter kayunya sudah mencapai 30 – 40 cm. Jabon bisa dipanen dalam dua tahap melalui proses penjarangan, yaitu penebangan pada tahun ke-3 dengan diameter kayu 20 – 25 cm, tahap ke-2 disebut panen raya biasanya dilakukan pada tahun ke-5 (Ahdiyat et al. 2012). Menurut Mulyana et al. (2011), Jabon berpotensi untuk dikembangkan dalam pembangunan hutan tanaman, hutan rakyat, maupun tujuan lainnya seperti penghijauan, reklamasi lahan bekas tambang dan pohon peneduh.
Permasalahan yang sering muncul dalam pembangunan hutan tanaman jabon yang umumnya ditanam secara monokultur yaitu adanya serangan hama dan penyakit. Serangan dapat terjadi ketika masih berada di persemaian maupun setelah ditanam di lapangan yang dapat menjadi faktor penghambat peningkatan produksi kayu jabon sebagai bahan baku industri. Salah satu penyakit yang menyerang Jabon adalah hawar daun atau (leaf blight) yang disebabkan oleh fungi yaitu Rhizoctonia sp.. Fungi patogen Rhizoctonia sp. merupakan suatu kelompok besar cendawan yang penting karena diketahui dapat mempunyai tanaman inang yang cukup luas. Fungi patogen ini sering menyebabkan penyakit di persemaian dan di site penanaman. Fungi menyerang tanaman muda yang ada di persemaian dan menyebabkan penyakit lodoh, busuk akar dan juga menimbulkan penyakit hawar daun. Serangan penyakit hawar daun merupakan salah satu penyebab utama
berkurangnya jumlah tanaman yang dapat menurunkan produktivitas. Perkembangan
2
Pengendalian terhadap serangan Rhizoctonia sp. yang menyarang jabon (A. cadamba) penting dilakukan untuk menekan kerugian produksi bibit maupun penurunan produktivitas pohon. Pengendalian yang sering dilakukan yaitu menggunakan fungisida sintetik namun akan memberikan dampak terhadap lingkungan, sehingga pengendalian secara alami sangat dibutuhkan agar kerusakan lingkungan akibat penggunaan fungisida dapat ditekan. Pengendalian hayati menjadi alternatif yang lebih aman terhadap manusia dan juga lingkungan (Sharma et al. 2009). Salah satu bentuk pengendalian hayati adalah dengan menggunakan fungi antagonis yaitu T. harzianum. Beberapa hasil penelitian menunjukkan bahwa beberapa jenis penyakit tanaman dapat dikendalikan secara alami dengan menggunakan T. harzianum. Menurut penelitian Widyastuti (2007) dan Achmad (1997) bahwa T. harzianum berpotensi menghambat patogen.
Perumusan Masalah
Penggunaan fungisida sintetis sebagai pengendali berbagai macam penyakit tanaman akan berdampak pada kerusakan lingkungan dan kesehatan manusia sehingga pengendalian secara alami sangat diperlukan untuk mengurangi dampak tersebut. Penggunaan T. harzianum merupakan salah satu alternatif yang dapat digunakan untuk pengendalian penyakit tanaman yang disebabkan oleh fungi. Oleh karena itu, permasalahan yang dapat dirumuskan berdasarkan latar belakang tersebut adalah berapa besar persentase penghambatan T. harzianum dalam mengendalikan pertumbuhan koloni Rhizoctonia sp. pada jabon (A. Cadamba) secara in vitro.
Tujuan Penelitian
Tujuan dari penelitian ini yaitu untuk mengetahui potensi T. harzianum sebagai agensia pengendali hayati untuk menghambat pertumbuhan Rhizoctonia sp. pada uji antagonis dengan metode langsung dan tak langsung.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan infomasi tentang potensi T. harzianum sebagai alternatif pengendalian penyakit jabon (A. cadamba) khususnya yang disebabkan oleh cendawan patogen Rhizoctonia sp..
METODE
Waktu dan Tempat
3
Bahan
Bahan yang digunakan untuk penelitian ini adalah isolat Rhizoctonia sp. yang diperoleh dari Laboratorium Patologi Hutan Departemen Silvikultur Fakultas Kehutanan IPB, T. harzianum yang diperoleh dari SEAMEO BIOTROP, aquades, media potato dextrose agar (PDA), media potato fructose agar (PFA), media potato dextrose broth (PDB), media potato fructose broth (PFB), chlorampenicol dan alkohol.
Alat
Peralatan yang digunakan dalam penelitian ini adalah kompor, panci, gelas ukur 1000 mL, gelas ukur 10 mL, spatula, cawan petri, labu erlenmeyer, sprayer, autoclave, laminar air flow, cork borer,botol jam, syringe filter, sentrifuse, mikroskop, pisau, alat tulis, kamera, timbangan digital, oven, laptop, dan lampu bunsen. kentang yang telah dipotong dadu dan 500 mL aquades kemudian direbus hingga kentang menjadi empuk. Air ekstrak kentang dipisahkan, setelah itu dituang ke dalam wadah yang berisi dekstros (glukosa) untuk PDA dan Fruktosa untuk PFA sebanyak 20 gram dan agar sebanyak 15 gram. Sebelum larutan dipindahkan ke dalam labu erlenmeyer, ditambahkan chlorampenicol dan diaduk hingga merata. Larutan kemudian ditambahkan aquades sampai larutan menjadi 1 liter dan dipanaskan lagi. Masing-masing media yang sudah dipanaskan dimasukkan ke dalam labu erlenmeyer yang berbeda berdasarkan sumber karbohidrat yang digunakan dan disterilkan menggunakan autoclave pada tekanan 1 atm dengan suhu 121 °C selama 15 menit.
Pembuatan Media PDB (Potato Dextrose Broth) dan PFB (Potato Fructose Broth)
4
Tahap Pelaksanaan
Peremajaan Cendawan Patogen dan Agen Hayati
Isolat Rhizoctonia sp. dan T. harzianum ditumbuhkan pada media PDA dalam cawan petri. Koloni patogen yang sudah tumbuh dimurnikan dan disimpan untuk digunakan sebagai sumber inokulum pada uji antagonis secara in vitro.
Uji Antagonis
Metode yang digunakan adalah metode langsung dan tidak langsung.
Metode Langsung
Uji antagonis menggunakan metode langsung dilakukan dengan uji ganda (dual culture) pada media PDA dan PFA. Koloni fungi patogen dan koloni fungi antagonis yang telah berumur tujuh hari dipindahkan kedalam cawan uji antagonis secara bersamaan. T. harzianum diinokulasikan pada masing-masing media dengan jarak 5 cm dari koloni cendawan patogen Rhizoctonia sp. dan tiap perlakuan dilakukan sebanyak 3 kali ulangan. Pengamatan dilakukan setiap hari dimulai dari 24 jam setelah kedua isolat uji diinokulasikan sampai hari ke- 8 setelah diadu dengan mengamati terbentuknya zona penghambatan. Selain itu, pengamatan dilakukan dengan mengukur jari-jari koloni cendawan patogen yang menjauhi koloni agens antagonis (r1) dan jari-jari koloni cendawan patogen yang mendekati agen antagonis (r2) serta menghitung penghambatan agen antagonis (PP). Persentase penghambatan dihitung berdasarkan teknik yang digunakan dalam Rohana (1998) :
Keterangan :
PP : Persen penghambatan
r1 : Jari-jari koloni patogen menuju tepi cawan petri r2 : Jari-jari koloni patogen menuju koloni antagonis
Gambar 1 Metode dual culture Rhizoctonia sp. dengan T. harzianum dalam satu cawan uji antagonis berdiameter 9 cm
5
Uji Antagonis Metode Tak Langsung
Uji antagonis metode tak langsung dilakukan dengan cara mengamati pengaruh filtrat biakan agen antagonis terhadap pertumbuhan patogen. Proses pertama yang harus dilakukan adalah pembuatan filtrat. Media yang digunakan dalam tahap ini adalah PDB. Tiga potongan koloni agen antagonis (Ø 8 mm) dimasukkan ke dalam 100 mL media PDB dalam labu erlenmeyer 250 mL kemudian diinkubasi selama 7 hari pada suhu kamar. Setelah masa inkubasi berakhir, filtrat dipisahkan dari miselium cendawan melalui penyaringan dengan menggunakan kertas saring steril.
Uji antagonis dengan metode tak langsung dilakukan pada media PDA, PFA, PDB dan PFB. Penambahan filtrat T. harzianum pada media PDA dan PFA yaitu dengan cara filtrat diteteskan diatas media PDA dan PFA yang sudah padat menggunakan syringe filter sebanyak masing-masing 3 mL, setelah itu dibuat merata dengan batang penyebar keseluruh permukaan media. Potongan koloni patogen berdiameter 8 mm ditambahkan ditengah-tengah media dan diinkubasi selama 7 hari. Pengamatan yang dilakukan yaitu mengamati persentase penghambatan setiap 24 jam selama 8 hari. Persentase penghambatan dihitung dengan teknik yang dilakukan oleh Jeyaseelan et al (2012) yaitu:
Keterangan :
PP : Persen penghambatan
D1 : Diameter koloni patogen pada cawan petri kontrol D2 : Diameter koloni patogen pada cawan perlakuan
Pada media PDB dan PFB filtrat T. harzianum diambil sebanyak 3 mL dan ditambahkan 20 mL media PDB dan PFB di dalam botol jam, setelah itu ditambahkan potongan koloni patogen ditanam di dalamnya. Kontrol dibuat dengan mengganti media perlakuan dengan media PDB dan PFB dengan volume yang sama. Botol jam perlakuan maupun kontrol diinkubasi selama 7 hari pada suhu kamar. Miselium patogen disaring lalu ditentukan bobotnya setelah dikeringkan dalam oven 60 °C selama 24 jam. Persentase penghambatan dihitung dengan teknik yang digunakan Achmad (1997):
Keterangan :
PP : Persen penghambatan
B1 : Biomassa koloni kontrol patogen (gram) B2 : Biomassa koloni perlakuan patogen (gram)
Prosedur Analisis Data
6
analisis data menggunakan software SAS 9.1.3. Apabila hasil analisis menunjukkan pengaruh berbeda nyata, maka dilanjutkan dengan uji jarak berganda Duncan. Uji Duncan digunakan untuk membandingkan perlakuan media yang terbaik dalam percobaan.
Uji antagonis in vitro T. harzianum terhadap pertumbuhan koloni Rhizoctonia sp. pada media PDA dan PFA dengan dua perlakuan yaitu uji antagonis secara langsung dan tak langsung, dilakukan dalam pola RAL in time menggunakan model linier sebagai berikut (Mattjik dan Sumertajaya 2000):
Y
ij= μ + τ
i+
(i)k+ W
j+ (τW)
ij+
ijk Keterangan:Yij : Pengamatan pada perlakuan antagonis
μ : Rataan Umum
τi : Pengaruh perlakuan antagonis
(i)k : Pengaruh acak pada perlakuan antagonis
Wj : Pengaruh waktu (cm/hari)
(τW)ij : Interaksi antara perlakuan antagonis dan waktu (cm/hari)
ijk : Pengaruh acak pada perlakuan antagonis, waktu (cm/hari), dan
ulangan
Analisis ragam RAL faktorial digunakan dalam menguji pengaruh macam media pada pertumbuhan isolat Rhizoctonia sp. dan T. harzianum dalam perlakuan kontrol dan menguji pengaruh uji antagonis metode tak langsung pada media PDB dan PFB dalam pola RAL sebagai berikut (Mattjik dan Sumertajaya 2000):
(ijk) : Pengaruh acak dari perlakuan ke-i dan ulangan ke-j
HASIL DAN PEMBAHASAN
Hasil
Pertumbuhan Miselium Rhizoctonia sp.
7 baru mencapai 8.75 cm. Pertumbuhan koloni miselium Rhizoctonia sp. disajikan pada Gambar 2.
Gambar 2 Pertumbuhan koloni miselium Rhizoctonia sp.
Gambar 3 Pengamatan Rhizoctonia sp.; (a) media PDA dan (b) media PFA Rhizoctonia sp. yang ditumbuhkan tunggal pada media PDA dan PFA digunakan sebagai kontrol dari uji antagonis. Pertumbuhan miselium Rhizoctonia sp. pada media PDA lebih tebal dibandingkan pertumbuhan miselium pada media PFA.
Gambar 4 Struktur miselium Rhizoctonia sp. (Aisah 2013)
` Jika diamati secara mikroskopis Rhizoctonia sp. memiliki susunan percabangan hifa yang tegak lurus atau hampir tegak lurus, adanya septa yang berpori (delipore septa) dan tidak ada sambungan apit (clamp connection).
a b
0 2 4 6 8 10
1 2 3 4 5 6 7 8
D
ia
m
et
er
(
cm
)
Hari
ke-PDA
PFA
Percabangan hifa
8
Pengamatan T. harzianum
Inokulum T. harzianum ditanam pada media PDA dan PFA. Koloni T. harzianum mula-mula berwarna putih, kemudian akan mulai tumbuh konidia berwarna hijau pada waktu 60 jam setelah isolasi.
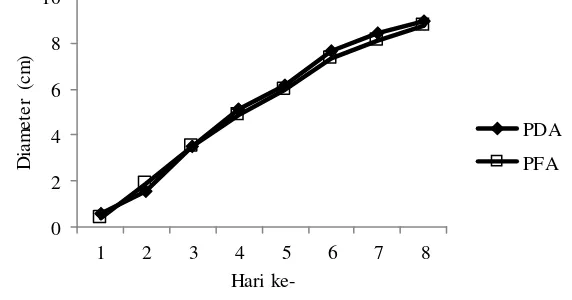
Gambar 5 Pertumbuhan koloni T. Harzianum
Berdasarkan hasil pengamatan, dapat diperoleh bahwa pertumbuhan koloni T. harzianum yang telah ditumbuhkan pada media PDA dan PFA telah memenuhi cawan petri pada waktu 96 jam atau 4 hari setelah isolasi. Seperti yang terlihat pada grafik pertumbuhan koloni T. harzianum yang paling cepat adalah yang ditumbuhkan pada media PDA, karena miselium sudah memenuhi cawan petri selama 72 jam atau 3 hari.
Gambar 6 Pengamatan T. harzianum; (a) media PDA dan (b) media PFA
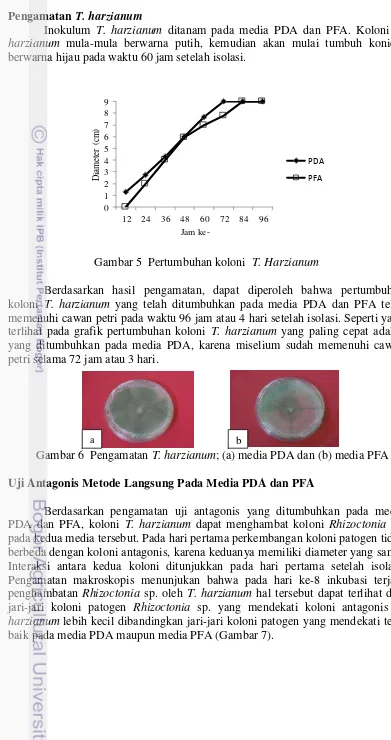
Uji Antagonis Metode Langsung Pada Media PDA dan PFA
Berdasarkan pengamatan uji antagonis yang ditumbuhkan pada media PDA dan PFA, koloni T. harzianum dapat menghambat koloni Rhizoctonia sp. pada kedua media tersebut. Pada hari pertama perkembangan koloni patogen tidak berbeda dengan koloni antagonis, karena keduanya memiliki diameter yang sama. Interaksi antara kedua koloni ditunjukkan pada hari pertama setelah isolasi. Pengamatan makroskopis menunjukan bahwa pada hari ke-8 inkubasi terjadi penghambatan Rhizoctonia sp. oleh T. harzianum hal tersebut dapat terlihat dari jari-jari koloni patogen Rhizoctonia sp. yang mendekati koloni antagonis T. harzianum lebih kecil dibandingkan jari-jari koloni patogen yang mendekati tepi, baik pada media PDA maupun media PFA (Gambar 7).
9
Gambar 7 Pertumbuhan isolat Rhizoctonia sp. (R) dan T. harzianum (T) dalam cawan uji antagonis; (a) media PDA dan (b) media PFA
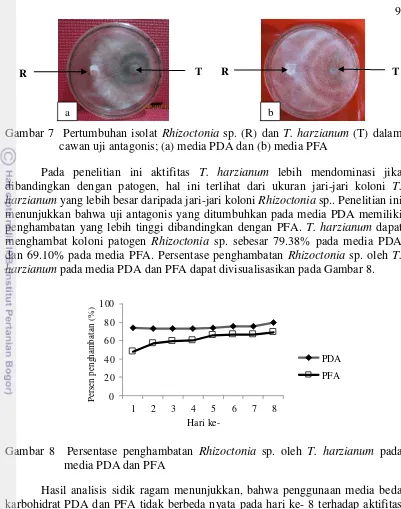
Pada penelitian ini aktifitas T. harzianum lebih mendominasi jika dibandingkan dengan patogen, hal ini terlihat dari ukuran jari-jari koloni T. harzianum yang lebih besar daripada jari-jari koloni Rhizoctonia sp.. Penelitian ini menunjukkan bahwa uji antagonis yang ditumbuhkan pada media PDA memiliki penghambatan yang lebih tinggi dibandingkan dengan PFA. T. harzianum dapat menghambat koloni patogen Rhizoctonia sp. sebesar 79.38% pada media PDA dan 69.10% pada media PFA. Persentase penghambatan Rhizoctonia sp. oleh T. harzianum pada media PDA dan PFA dapat divisualisasikan pada Gambar 8.
Gambar 8 Persentase penghambatan Rhizoctonia sp. oleh T. harzianum pada media PDA dan PFA
Hasil analisis sidik ragam menunjukkan, bahwa penggunaan media beda karbohidrat PDA dan PFA tidak berbeda nyata pada hari ke- 8 terhadap aktifitas penghambatan T. harzianum terhadap pertumbuhan Rhizoctonia sp. terlihat dari persentase penghambatan pada tabel hasil uji Duncan (Tabel 1).
Tabel 1 Hasil uji Duncan persentase penghambatan Rhizoctonia sp. pada media PDAdan PFAdengan metode uji antagonis langsung
Media
10
Uji Antagonis Metode Tak Langsung Pada Media PDB dan PFB
Berdasarkan pengamatan yang dilakukan untuk uji antagonis tak langsung pada media PDA dan PFA, pertumbuhan koloni patogen Rhizoctonia sp. mengalami penghambatan dari hari ke hari dengan penghambatan yang dihasilkan yaitu 60.84% pada media PDA dan 60.62% pada media PFA (Gambar 9).
Gambar 9 Persentase penghambatan Rhizoctonia sp. oleh filtrat T. harzianum Hasil analisis ragam pertumbuhan in vitro diameter koloni Rhizoctonia sp. pada media PDA dan PFA menunjukkan bahwa pemberian filtrat T. harzianum pada media memberikan pengaruh pada respon pertumbuhan diameter. Hasil selengkapnya disajikan pada Tabel 2.
Tabel 2 Hasil uji Duncan persentase penghambatan Rhizoctonia sp. pada media PDAdan PFAdengan metode uji antagonis tak langsung
Media
Pengamatan hari ke-
1 2 3 4 5 6 7 8
Persentase penghambatan (%)
PDA 35.91b 37.50b 43.66ab 51.50ab 57.11a 59.21a 60.84a 60.84a
PFA 33.17c 33.17c
40.84bc 52.52ab 55.45a 58.33a 60.62a 60.62a
Keterangan: Angka yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan perbedaan yang tidak nyata berdasarkan uji jarak berganda Duncan pada selang kepercayaan 95%
11
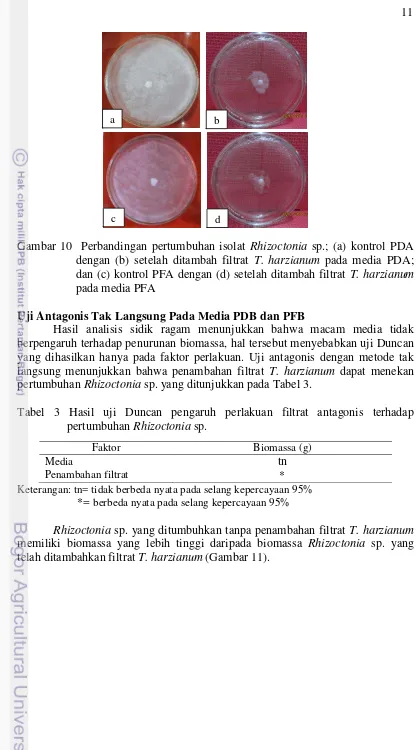
Gambar 10 Perbandingan pertumbuhan isolat Rhizoctonia sp.; (a) kontrol PDA dengan (b) setelah ditambah filtrat T. harzianum pada media PDA; dan (c) kontrol PFA dengan (d) setelah ditambah filtrat T. harzianum pada media PFA
Uji Antagonis Tak Langsung Pada Media PDB dan PFB
Hasil analisis sidik ragam menunjukkan bahwa macam media tidak berpengaruh terhadap penurunan biomassa, hal tersebut menyebabkan uji Duncan yang dihasilkan hanya pada faktor perlakuan. Uji antagonis dengan metode tak langsung menunjukkan bahwa penambahan filtrat T. harzianum dapat menekan pertumbuhan Rhizoctonia sp. yang ditunjukkan pada Tabel 3.
Tabel 3 Hasil uji Duncan pengaruh perlakuan filtrat antagonis terhadap pertumbuhan Rhizoctonia sp.
Keterangan: tn= tidak berbeda nyata pada selang kepercayaan 95%
*= berbeda nyata pada selang kepercayaan 95%
Rhizoctonia sp. yang ditumbuhkan tanpa penambahan filtrat T. harzianum memiliki biomassa yang lebih tinggi daripada biomassa Rhizoctonia sp. yang telah ditambahkan filtrat T. harzianum (Gambar 11).
Faktor Biomassa (g)
Media tn
Penambahan filtrat *
a b
12
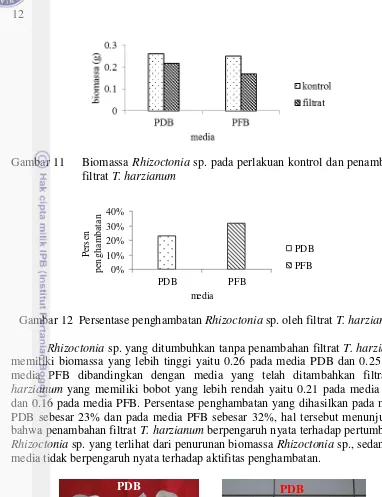
Gambar 11 Biomassa Rhizoctonia sp. pada perlakuan kontrol dan penambahan filtrat T. harzianum
Gambar 12 Persentase penghambatan Rhizoctonia sp. oleh filtrat T. harzianum Rhizoctonia sp. yang ditumbuhkan tanpa penambahan filtrat T. harzianum memiliki biomassa yang lebih tinggi yaitu 0.26 pada media PDB dan 0.25 pada media PFB dibandingkan dengan media yang telah ditambahkan filtrat T. harzianum yang memiliki bobot yang lebih rendah yaitu 0.21 pada media PDB dan 0.16 pada media PFB. Persentase penghambatan yang dihasilkan pada media PDB sebesar 23% dan pada media PFB sebesar 32%, hal tersebut menunjukkan bahwa penambahan filtrat T. harzianum berpengaruh nyata terhadap pertumbuhan Rhizoctonia sp. yang terlihat dari penurunan biomassa Rhizoctonia sp., sedangkan media tidak berpengaruh nyata terhadap aktifitas penghambatan.
Gambar 13 Miselium Rhizoctonia sp. pada media PDB dan PFB; (a) kontrol dan (b) perlakuan penambahan filtrat T. harzianum
13
Pembahasan
Fungi adalah mikroorganisme heterotrof, yakni tidak memiliki kemampuan untuk mengoksidasi senyawa karbon anorganik, atau senyawa yang memiliki satu karbon. Senyawa karbon organik yang dapat dimanfaatkan fungi untuk membuat materi sel baru atau tumbuh berkisar dari molekul sederhana seperti gula sederhana, asam organik, gula terikat alkohol, polimer rantai pendek dan panjang mengandung karbon, hingga kepada senyawa kompleks seperti karbohidrat, protein, lipid dan asam nukleat. Pertumbuhan dalam mikrobiologi adalah pertambahan volume sel karena adanya pertambahan protoplasma dan senyawa asam nukleat yang melibatkan sintesis DNA dan pembelahan mitosis. Pertambahan volume sel tersebut bersifat irreversible yang artinya tidak dapat kembali ke volume semula (Gandjar et al. 2006).
Pertumbuhan yang baik akan diperoleh jika media yang digunakan memenuhi persyaratan seperti mempunyai semua nutrisi yang mudah digunakan oleh organisme, mempunyai tekanan osmosa, tegangan permukaan, tidak mengandung zat-zat yang menghambat pertumbuhan mikroorganisme yang dikehendaki, steril dan terlindung dari kontaminasi (Fardiaz 1987). Fungsi bahan yang digunakan pada medium yakni kentang dan dekstrosa sebagai sumber karbon (karbohidrat), sumber energi dan juga vitamin yang terdapat di dalam kentang. Dalam pertumbuhannya cendawan memerlukan nutrisi, diantaranya dalam bentuk karbon, nitrogen, sulfur, fosfor, kalium, magnesium, natrium, kalsium, nutrien mikro (besi, mangan, zinc, kobalt, molybdenum) dan vitamin (Gandjar et al. 2006). Unsur karbon memiliki peranan sangat penting bagi cendawan karena cendawan membutuhkan unsur karbon dalam jumlah yang besar daripada unsur-unsur esensial yang lain dan karbon merupakan nutrisi yang pokok dan terpenting pada cendawan (Moore 1972).
Karbohidrat merupakan substrat utama untuk metabolisme karbon pada fungi yang digolongkan ke dalam monosakarida, disakarida, oligosakarida dan polisakarida. Banyak fungi dapat memanfaatkan monosakarida, tetapi sedikit fungi yang dapat memanfaatkan di-, oligo- atau polisakarida, karena tidak memiliki kemampuan untuk menghidrolisis molekul-molekul besar tersebut (Gandjar et al. 2006). Jenis karbohidrat yang digunakan dalam penelitian ini adalah glukosa dan fruktosa, dimana keduanya tergolong ke dalam monosakarida yang terdiri dari enam atom C dengan rumus molekul yang sama yaitu C6H12O6.
14
yang dikarakterisasikan oleh sebuah gugus karbonil (C=O) yang terhubung dengan dua atom karbon ataupun senyawa kimia yang mengandung gugus karbonil.
Glukosa Fruktosa
Glukosa, juga dikenal sebagai D-glukosa, dekstrosa, atau gula anggur adalah karbohidrat yang penting dalam biologi, dekstrosa digunakan sebagai sumber utama energi dan perantara metabolik (Sridianti 2014). Glukosa dan dekstrosa tidak berbeda. Glukosa memiliki enansiomer yaitu isomer cermin terhadap dirinya yaitu D-glukosa yang biasa disebut dengan dekstrosa dan L-glukosa. Namun kenyataannya yang ditemukan pada organisme, hanya yang dalam bentuk D-isomer. Dalam bentuk rantai lurus kita dapat dengan mudah membedakan Bentuk D atau L konformasi isomer pada karbon nomor 5 atau pada atom C asimetris. Notasi D berasal dari kata dextro berarti kanan, dan notasi L berarti levo atau kiri, sebagai penanda digunakan gugus hidroksilnya. D-glukosa berotasi terpolarisasi cahaya ke kanan. Faktor yang menjadi penentu dari bentuk glukosa ini adalah posisi gugus hidrogen (-H) dan alkohol (–OH) dalam struktur molekulnya (Komarudin dan Binarahman 2011).
Fruktosa adalah suatu ketoheksosa yang mempunyai sifat memutar cahaya terpolarisasi ke kiri dan karenanya disebut juga levulosa (Winarno 2008). Fruktosa juga dikenal dengan sebutan gula buah. Hasil pengamatan menunjukkan bahwa isolasi yang dilakukan dengan menggunakan media berbahan dasar fruktosa memiliki kecepatan tumbuh yang lebih rendah dari media yang berbahan dasar dekstrosa.
15 dimulai dari proses glikolisis atau pembongkaran glukosa. Dalam Ngili (2009) menyebutkan bahwa fruktosa memiliki jalur alternatif untuk dapat langsung masuk ke dalam jalur glikolisis yang melibatkan konversi menjadi fruktosa 6-fosfat oleh enzim heksokinase. Jalur ini melibatkan konversi fruktosa oleh fruktokinase menjadi fruktosa 1-fosfat aldolase menjadi dihidroksiaseton fosfat dan gliseraldehid. Gliseraldehid kemudian difosforilasi oleh gliseraldehid kinase untuk memberikan gliseraldehid 3-fosfat. Dengan demikian fruktosa menjadi dihidroksiaseton dan gliseraldehid 3-fosfat, yakni 2 intermediet C3 pada jalur
glikolisis.
Pengamatan Rhizoctonia sp. dan Trichoderma harzianum
Rhizoctonia sp. merupakan cendawan yang termasuk ke dalam sub divisi Deuteromycetes (Agrios 1988). Miselium halus bercabang-cabang membentuk jala halus dan bersepta. Miselium Rhizoctonia sp. pada kedua jenis media saat dalam masa pengukuran masih berwarna putih, selang 1 minggu setelah pengukuran selesai, miselium Rhizoctonia sp. yang ditumbuhkan pada media PDA berangsur-angsur berubah warna menjadi coklat. Hal ini sesuai dengan pernyataan Suharti (1973), Rhizoctonia sp. bila ditumbuhkan pada media PDA mula-mula miselianya akan tampak berwarna putih, lama-kelamaan warna miselia berubah menjadi coklat muda sampai tua. Secara mikroskopis sesuai dengan pernyataan Alexopoulus et al. (1996), Rhizoctonia sp. memiliki susunan percabangan hifa yang tegak lurus atau hampir tegak lurus, adanya septa yang berpori (delipore septa) dan tidak ada sambungan apit (clamp connection). Karakteristik yang di kemukakan oleh Barnett dan Hunter (1998), antara lain miseliumnya bening pada beberapa jenis dan gelap pada jenis lainnya, sel-sel miselium biasanya panjang, septa pada cabang terbentuk dari tubuh utama, tidak memiliki konidia dan sel reproduksi lainnya, memiliki sclerotia yang berwarna terang atau coklat sampai hitam. Cendawan ini dikenal dapat menyebabkan busuk akar, busuk batang, dumping off, dan dalam beberapa kasus menyebabkan hawar daun pada Jabon. Cendawan Rhizoctonia sp. merupakan soil-borne pathogen (patogen tular tanah) yang terlindungi oleh kondisi hangat dan kelembaban tanah yang cukup. Cendawan ini mampu bertahan dalam tanah sebagai sclerotia dan basidiospora (Moorman, 2002).
Cendawan Rhizoctonia sp. ditumbuhkan tunggal pada media PDA dan PFA digunakan sebagai kontrol dari uji antagonis. Pada penelitian ini miselium Rhizoctonia sp. memenuhi cawan petri selama 8 hari setelah isolasi, namun dalam penelitian yang dilakukan oleh Pratomo (2006) dan Mulyaningsih (2013) menunjukkan miselium Rhizoctonia sp. dapat memenuhi cawan petri hanya dalam waktu 3 – 4 hari dengan tambahan perlakuan seperti faktor lingkungan yang sesuai dengan pertumbuhan Rhizoctonia sp.. Beberapa faktor lingkungan yang mungkin mempengaruhi pertumbuhan Rhizoctonia sp. seperti nutrisi makanan,
daya tahan hidup (survival), suhu, kelembaban, derajat kemasaman (pH), dan cahaya.
Jika dibandingkan pertumbuhan pada media PDA lebih cepat dan memiliki miselium
yang lebih tebal daripada pada media PFA, hasil yang sama dengan penelitian yang
16
bahwa media PDA merupakan media umum karena mengandung kebutuhan pokok penunjang pertumbuhan semua mikroorganisme dan lazim disebut media kaya. Pembiakan mikroorganisme di laboratorium membutuhkan tersedianya media yang tepat. Dalam hal ini yang dimaksud adalah bahan yang digunakan untuk menumbuhkan mikroorganisme.
Agen antagonis yang digunakan adalah Trichoderma harzianum, pada
awalnya tumbuh miselium berwarna putih, kemudian mulai tumbuh konidia dan
dapat mencapai diameter 9 cm pada pengamatan hari ke- 4. Semakin lama konidia
semakin padat membentuk konidium sehingga warnanya cepat berubah dari hijau kekuningan menjadi hijau tua. Hal ini tidak berbeda jauh dengan pernyataan Widyastuti (2007) yang menyebutkan bahwa koloninya berwarna hijau tua dan dapat mencapai pertumbuhan diameter lebih dari 9 cm dalam waktu 5 hari pada medium oat agar dan malt extract agar. Konidia yang terbentuk di media yang berbahan dasar dekstrosa lebih banyak dibandingkan pada media yang berbahan dasar fruktosa, karena konidia T. harzianum akan tumbuh pada media yang lebih kaya nutrisi (Widyastuti 2007).
Berdasarkan pertumbuhan diameter, Rhizoctonia sp. dan T. harzianum yang ditumbuhkan pada media PDA sedikit lebih besar dibandingkan pada media PFA. Sehingga hasil dari analisis ragam menunjukkan macam media yang tidak berpengaruh nyata, diduga hal ini dapat terjadi karena sumber karbon yang terkandung dalam media tersebut.
Uji AntagonisMetode Langsung
Pengamatan uji antagonis dilakukan dengan masa inkubasi selama 8 hari. Uji antagonis dengan metode langsung yaitu dengan menambahkan potongan isolat antagonis T. harzianum pada cawan petri yang bersamaan dengan potongan isolat patogen Rhizoctonia sp. (dual culture). Dalam penelitian ini, pada metode langsung, media yang digunakan yaitu PDA dan PFA.
Hasil pengamatan menunjukkan bahwa T. harzianum dapat menghambat pertumbuhan dari Rhizoctonia sp.. Pada cawan uji antagonis, pertumbuhan Rhizoctonia sp. dalam waktu 4 hari sudah memenuhi cawan ke arah tepi karena sebagian besar cawan petri sudah didominasi oleh pertumbuhan miselium T. harzianum, sedangkan pada cawan petri perlakuan kontrol Rhizoctonia sp. belum memenuhi cawan petri.
Pada uji antagonis ini tidak terbentuk zona bening di antara patogen dan agen hayati, sehingga mekanisme penghambatan ini dikatakan bersifat mikoparasitisme (Widyastuti 2007). Mikoparasitisme merupakan fenomena suatu fungi yang berbeda taksonomi yang hidup secara parasit dan melibatkan penggabungan fisik (Soesanto 2008). Empat tahap yang dibedakan berdasarkan kerja parasitisme di dalam mikoparasitisme yaitu pertumbuhan kemototrof, pengenalan, pelekatan, dan penguraian dinding sel inang.
17 sepanjang hifa Rhizoctonia sp. atau membelit di sekeliling hifa tersebut dengan atau tanpa penetrasi. Penetrasi dari T. harzianum terbentuk baik dari hifa yang membelit atau dari hifa yang langsung kontak dengan miselium Rhizoctonia sp.. Setelah proses pelekatan, kemudian dilanjutkan tahap terakhir berupa penguraian dinding sel inang. Pada tahapan ini T. harzianum menghasilkan enzim kitinase dan glukanase yang dapat menguraikan dinding sel Rhizoctonia sp.. Cook dalam Ekowati (2000) menyatakan mekanisme antagonis ini terjadi karena jamur antagonis mampu menghasilkan senyawa antifungi. Trichoderma spp. memiliki kemampuan menghasilkan enzim pengurai dinding sel yakni glukanase, selulase dan kitinase. Trichoderma spp. mempunyai aktifitas lisis dan antifungi yang paling kuat dibandingkan tipe enzim kitinase yang lain (Widyastuti 2007). Adanya kitinase yang dihasilkan oleh T. harzianum dapat menguraikan miselium Rhizoctonia sp. pada saat interaksi.
Persentase penghambatan tertinggi dicapai pada hari ke- 8 dalam cawan uji antagonis baik pada media PDA maupun media PFA, hal tersebut diduga karena aktifitas enzim kitinase pada T. harzianum meningkat pada hari ke- 8. Hasil tersebut tidak berbeda jauh dengan penelitian Harjono (2001) yang menunjukkan bahwa produksi dari enzim kitinase yang dihasilkan oleh T. reesei dipanen saat berumur 7 hari. Dalam Achmad et al. (1999) mengatakan bahwa T. harzianum dan T. pseudokoningii mampu menekan pertumbuhan R. solani dan Fusarium oxysporum melalui mekanisme mikoparasitisme dengan memproduksi enzim kitinase. Persentase penghambatan yang dihasilkan T. harzianum terhadap Rhizoctonia sp. yaitu 79.38% pada media PDA dan 69.10 % pada media PFA.
Uji Antagonis Metode Tak Langsung Pada Media PDA dan PFA
Uji antagonis dengan metode tak langsung dilakukan dengan menggunakan media PDA, PFA, PDB dan PFB yang ditambahkan filtrat T. harzianum pada setiap media yang akan ditumbuhkan Rhizoctonia sp.. Pengamatan dilakukan dengan masa inkubasi 7 hari, dengan mengamati persentase penghambatan pada setiap media.
Pertumbuhan Rhizoctonia sp. pada media PDA dan PFA dengan metode tak langsung terjadi sangat lambat, hal tersebut diduga karena adanya penambahan filtrat T. harzianum yang dapat menghambat pertumbuhan Rhizoctonia sp. karena diduga dalam filtrat pada media tersebut T. harzianum terkandung biochemist seperti antibiotik, toksin dan enzim (Soesanto 2008). Penghambatan ditunjukkan oleh tidak terjadinya pertambahan diameter Rhizoctonia sp. pada hari ke- 8. Rhizoctonia sp. yang tumbuh pada kedua media tersebut memiliki miselium yang tipis dengan luasan yang kecil. Persentase penghambatan yang dihasilkan pada media PDA sebesar 60.84% dan 60.62% pada media PFA.
Uji Antagonis Metode Tak Langsung Pada Media PDB dan PFB
18
media padat. Hal tersebut diduga karena biochemist dalam filtrat T. harzianum yang tidak dipisahkan dengan komponen penyusun media, sehingga pada saat penambahan filtrat pada media PDA, PFA, PDB dan PFB biochemist T. harzianum yang terambil lebih sedikit dibandingkan komponen penyusun media yang tercampur oleh filtrat T. harzianum, sehingga mempengaruhi penghambatan yang dihasilkan oleh filtrat T. harzianum terhadap pertumbuhan Rhizoctonia sp..
Hasil analisis ragam yang dilakukan menunjukkan bahwa perlakuan media yang digunakan tidak berpengaruh nyata terhadap pertumbuhan Rhizoctonia sp., hasil tersebut sejalan dengan hasil penelitian Achmad dan Eny (2009) yang menyebutkan bahwa macam media (PDB dan PSB) tidak berpengaruh nyata terhadap pertumbuhan fungi Fusarium oxysporum. Fungi memiliki kemampuan yang berbeda dalam menggunakan sumber karbon yang berbeda.
Miselium yang tumbuh pada media PDB dan PFB pada perlakuan kontrol dan penambahan filtrat T. harzianum yang telah dioven selama 24 jam dengan suhu 60° C dapat dilihat pada Gambar 13. Miselium yang terdapat pada Gambar 13a merupakan hasil dari pertumbuhan Rhizoctonia sp. pada perlakuan kontrol lebih besar dibandingkan dengan miselium Rhizoctonia sp. dengan penambahan filtrat T. harzianum pada Gambar 13b. Lapisan yang ada di bagian atas media berwarna putih tebal dan media cair berwarna lebih keruh.
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian ini menunjukkan bahwa T. harzianum terbukti berpotensi menghambat pertumbuhan Rhizoctonia sp. yang merupakan penyebab penyakit hawar daun pada jabon (A. cadamba). Persentase penghambatan optimal terjadi pada saat keduanya diuji antagonis menggunakan metode langsung dengan besar persentase penghambatan pada media PDA sebesar 79.38% dan 69.10% pada media PFA.
Saran
Penelitian selanjutnya yang diharapkan untuk dilakukan:
1. Uji antagonis T. harzianum terhadap Rhizoctonia sp. yang merupakan penyebab penyakit hawar daun pada jabon (A. cadamba) secara in vivo. 2. Uji antagonis filtrat T. harzianum dengan berbagai konsentrasi terhadap
19
DAFTAR PUSTAKA
Achmad. 1997. Mekanisme serangan patogen dan pertahanan inang serta pengendalian hayati penyakit lodoh pada Pinus merkusii [disertasi]. Bogor (ID):Institut Pertanian Bogor
Achmad et al. 1999. The Potential Use of Two Species of Trichoderma for Biological Control of Damping off on Pinus merkusii. Proc. Inter. Workshop BIO-REFOR
Achmad, Eny PS. 2009. Pengaruh Media Terhadap Pertumbuhan Cendawan Fusarium oxysporum. Buletin RISTRI 1(4):159-168
Agrios GN. 1988. Plant Pathology 3rd ed. New York: Academic Press
Ahdiyat N, Dwi ZJ. 2012. Agribisnis tanaman Jabon. [Internet]. [diunduh 2014 Juni 17]. Tersedia pada: http://kayusatu.wordpress.com
Alexopoulus CJ, Mims CW and Blackwell. 1996. Introductory Mycologi. Eds 4th. John Wiley & Sons.Inc. New York
Barnett HL, Hunter BB. 1998. Ilustrated Genera of Imperfect Fungi. 4th Ed. Minnesota: APS Press
Ekowati N, Ratnaningtyas, Mumpuni. 2000. Aktivitas senyawa antifungi beberapa isolat lokal Gliocladium spp dan Trichoderma spp terhadap Phyptophthora pakmivora penyebab busuk buah kakao. Laporan Penelitian. Purwokerto: UNSOED
Fardiaz S. 1987. Penuntun Praktek Mikrobiologi Pangan. Bogor: Lembaga Sumberdaya Informasi- Institut Pertanian Bogor
Gandjar I, Samson RA, Van K, Oetari A, Santoso I. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Yayasan Pustaka Obor Indonesia
Garraway MO, Evans RC. 1984. Fungal Nutrition and Physiology. New York: John Wiley and Sons
Harjono, Widyastuti SM. 2001. Optimasi Produksi Endokitinase dari Fungi Mikoparasit Trichoderma ressei. Jurnal Perlindungan Hutan Indonesia. 7(1): 55 – 58
Jeyaseelan AC, S Tharmila, K Niranjan. 2012. Antagonistic Activity of Trichoderma spp. and Bacillus spp. against Pythium aphanidermatum isolatd from Tomato Damping off. Scholars Research Library 4(4):1623-1627 Komarudin AN dan Binarahman HF. 2011. Struktur Konformasi Glukosa.
[Internet]. [diunduh 2014 Okt 27]. Tersedia pada: http://agusnurul.blogspot.com
Mattjik AA, Sumertajaya M. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor (ID): Institut Pertanian Bogor Press
Moore E, Landecker. 1972. Fundamentals of The Fungi. New Jersey: Prentice- Hall, Inc
Moorman GW. 2002. Rhizoctonia. [Internet]. [diunduh 2014 Okt 17]. Tersedia pada: http://www.cas.psu.edu/docs/CASDEPT/PLA
Mulyana D, Asmarahman C, Fahmi I. 2010. Bertanam Jabon. Jakarta: Agromedia Pustaka
Mulyaningsih I. 2013. Pengaruh pH, penggoyangan media dan ekstrak daun sirih merah (Piper crocatum linn.) terhadap Rhizoctonia sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor
20
Pratomo R. 2006. Pengaruh macam, pH, dan penggoyangan media terhadap pertumbuhan cendawan Rhizoctonia sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rohana I. 1998. Efektifitas penggunaan Trichoderma harzianum dan fungisida mankozeb untuk pengendalian Rhizoctonia solani penyebab penyakit lodoh pada Acacia mangium [skripsi]. Bogor (ID) : Institut Pertanian Bogor
Sastrohamidjojo H. 2011. Kimia Organik Dasar. Yogyakarta (ID): Gadjah Mada University Press.
Semangun H. 1988. Penyakit-Penyakit Tanaman Perkebunan Indonesia. UGM Press.
Sharma RR, Dinesh S, Rajbir S. 2009. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: A review. Biol Contr. [Internet]. [diunduh 2012 Desember 17];50(2009): 205–221. Tersedia pada: http://www.sciencedirect.com/science/article/pii/S10499644090012-36 Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta
(ID): Raja Grafindo Persada
Suharti M. 1973. Penyebab dan pengaruh lingkungan hidup terhadap timbulnya penyakit “damping off” pada persemaian Pinus merkusii jungh et de vries. Bogor (ID): Lembaga Penelitian Hutan.
Widyastuti SM. 2007. Peran Trichoderma spp. dalam Revitalisasi Kehutanan di Indonesia. Yogyakarta (ID): UGM Press.
21
22
Lampiran 1 Hasil analisis sidik ragam dan uji selang berganda Duncan uji in vitro pengaruh media kultur terhadap pertumbuhan isolat dan uji antagonis metode tak langsung media kultur cair
1. Pertumbuhan isolat Rhizoctonia sp.
General Linier Model Procedure Class Level Information
Class Levels Values Media 2 PDA PFA
Number of Observations in data set= 6
Source DF Sum of Squares Mean Square F Value Pr > F
Model 1 0.04166667 0.04166667 1.00 >0.001
Error 4 0.16666667 0.04166667
Corrected Total 5 0.20833333
R-Square Coeff Var Root MSE Respons Mean 0.200000 2.289243 0.204124 8.916667
Source DF Sum of Square Mean Square F Value Pr>F Perlakuan media 1 0.04166667 0.04166667 1.00 >0.001
2. Pertumbuhan isolat Trichoderma harzianum
General Linier Model Procedure Class Level Information
Class Levels Values Media 2 PDA PFA
Number of Observations in data set= 6
Source DF Sum of Squares Mean Square F Value Pr > F Model 1 0.88166667 0.88166667 4.85 >0.001
Error 4 0.72666667 0.18166667
Corrected Total 5 0.20833333
R-Square Coeff Var Root MSE Respons Mean 0.548187 4.965713 0.426224 8.583333
Source DF Sum of Square Mean Square F Value Pr>F Perlakuan media 1 0.88166667 0.88166667 4.85 >0.001 3. Uji antagonis metode tak langsung media kultur cair
General Linier Model Procedure Class Level Information
Class Levels Values Perlakuan 2 1 2 Media 2 PDB PFB
Number of Observations in data set = 12
Source DF Sum of Squares Mean Square F Value Pr > F Model 1 0.00326667 0.00326667 1.30 <0.005
Error 4 0.01006667 0.00251667
23
R-Square Coeff Var Root MSE Respons Mean 0.245000 26.87485 0.050166 0.186667
Source DF Sum of Square Mean Square F Value Pr>F Perlakuan 1 0.00128133 0.00128133 82.67 <0.001
Media 1 0.00004033 0.00004033 2.60 >0.001
24
RIWAYAT HIDUP
Penulis dilahirkan di Malang pada tanggal 16 April 1992, sebagai anak pertama dari dua bersaudara pasangan Supai Ansyah dan Sri Astutik Utami. Penulis memulai pendidikan formal pada tahun 1997, ketika masuk TK Mardisiwi 01 Punten, dilanjutkan ke SDN Punten 01 pada tahun 1998 dan lulus pada tahun 2004 . Kemudian melanjutkan ke SMPN 2 Batu dan lulus pada tahun 2007. Pada tahun yang sama penulis melanjutkan ke SMAN 1 Batu dan lulus pada tahun 2010. Pada tahun 2010 penulis diterima menjadi mahasiswa Institut Pertanian Bogor melalui Program Undangan Seleksi Masuk IPB (USMI) Departemen Silvikultur, Fakultas Kehutanan. Tahun 2010, penulis memilih sub Progam Patologi Hutan sebagai spesifikasi keilmuannya.
Selama melakukan kegiatan akademik, penulis telah melakukan kegiatan Praktik Pengenalan Ekosistem Hutan (PPEH) pada tahun 2012 yang terdiri dari pengenalan ekosistem hutan di Gunung Sawal, Ciamis dan di Pangandaran. Setelah itu di tahun 2013 penulis juga melakukan kegiatan Praktik Pengelolaan Hutan di Hutan Pendidikan Gunung Walat, Kesatuan Pemangkuan Hutan (KPH) Cianjur, Holcim Educational Forest dan Sindangwangi. Selain itu, penulis juga telah melaksanakan kegiatan Praktek Kerja Profesi (PKP) di PT. Perawang Sukses Perkasa Industri di Riau pada tahun 2014.
Selama melaksanakan pendidikan, penulis aktif mengikuti organisasi kemahasis aan ada tahun sekarang penulis aktif di Organisasi Mahasiswa Daerah Malang dan juga anggota Paduan Suara Mahasiswa Agria Swara, kemudian tahun 2011 penulis menjadi salah satu jurnalis majalah “Forestry Magazine” dan pada tahun yang sama penulis menjadi anggota Public Relation dan juga sekretaris IFSA (International Forestry Student’s Association) hingga tahun 2013, anggota himpunan profesi Tree Grower Community 2013 dan juga aktif dalam berbagai macam kegiatan bertaraf nasional dan internasional lainnya. Selain itu penulis pernah menjadi delegasi IPB dan Indonesia dalam The 4th Asia Regional Meeting di Filipina dan juga salah satu peraih dana Dikti untuk realisasi proposal PKM-K pada tahun 2012.
Sebagai syarat untuk memperoleh gelar Sarjana Kehutanan, penulis melakukan penelitian untuk karya ilmiah dengan judul “Uji Antagonis Trichoderma harzianum terhadap Rhizoctonia sp. Penyebab Penyakit Hawar Daun pada Jabon (Anthocephalus cadamba (Roxb.) Miq.) secara in Vitro”