POTENSI
Trichoderma harzianum
DAN
Gliocladium
sp. UNTUK
PENGENDALIAN
Botryodiplodia
sp. PADA JABON
(
Anthocephalus cadamba
)
ETI ARTININGSIH OCTAVIANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Trichoderma harzianum dan Gliocladium sp. untuk Pengendalian Botryodiplodia sp. pada Jabon (Anthocephalus cadamba) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
iv
RINGKASAN
ETI ARTININGSIH OCTAVIANI. Potensi Trichoderma harzianum dan Gliocladium sp. untuk Pengendalian Botryodiplodia sp. pada Jabon (Anthocephalus cadamba). Dibimbing oleh ACHMAD dan ELIS NINA HERLIYANA.
Botryodiplodia sp. merupakan penyebab penyakit mati pucuk pada semai jabon (Anthocephalus cadamba). Penyakit mati pucuk menyebabkan penurunan kualitas dan nilai ekonomi semai jabon di persemaian. Penelitian tentang pengendalian terhadap penyakit tersebut masih jarang dilakukan. Pengendalian penyakit terbagi atas beberapa cara yaitu kimia, fisik, dan biologi. Penelitian ini menggunakan pengendalian secara biologi. Agens hayati yang digunakan pada penelitian ini yaitu Trichodermaharzianum dan Gliocladium sp..
Hasil uji antagonisme dengan metode langsung menunjukkan bahwa T. harzianum mampu menghambat pertumbuhan Botryodiplodia sp. hingga 99.2% dan 70.4% berturut-turut pada PDA dan Czapex Agar. Gliocladium sp. mampu menghambatannya sebesar 86.4% dan 63.0% berturut-turut pada PDA dan Czapex Agar. Hasil uji antagonis dengan metode tak langsung menunjukkan bahwa filtrat T. harzianum dan Gliocladium sp. memiliki kemampuan menghambat pertumbuhan Botryodiplodia sp. sebesar 13.42% dan 10.25% pada media PDB berbeda nyata dengan kontrol. Pemberian suspensi T. harzianum maupun Gliocladium sp. sebagai tindakan pencegahan mampu menghambat penyakit mati
pucuk oleh Botryodiplodia sp. sebesar 100%. Mekanisme penghambatan T. harzianum dan Gliocladium sp. terhadap Botyodiplodia sp. diduga secara
antibiosis, kompetisi, dan mikoparasitik.
SUMMARY
ETI ARTININGSIH OCTAVIANI. Potency of Biological Agent Trichoderma harzianum and Gliocladium sp. for Controlling Botryodiplodia sp. on Jabon (Anthocephalus cadamba). Supervised by ACHMAD and ELIS NINA HERLIYANA.
Botryodiplodia sp. could causes dieback disease on jabon (Anthocephalus cadamba). Dieback disease causes a decrease in the quality and economic value of jabon seedlings in the nursery. Research on control of jabon disease was still rare. Control of the disease was divided into three ways, namely chemical, physical, and biological. The study was used biological ways. Biological agents are used in this study was Trichoderma harzianum and Gliocladium sp..
The results of in vitro test showed that T. harzianum antagonism with the direct method able to inhibit the growth of Botryodiplodia sp. about 99.2% and 70.4% respectively on PDA and Czapex Agar. Gliocladium sp. able to inhibit the growth of Botryodiplodia sp. about 86.4% and 63.0% respectively on the PDA and Czapex Agar. Results of antagonist test with indirect methods showed that the filtrate of T. harzianum and Gliocladium sp. has the ability to inhibit the growth of Botryodiplodia sp. on PDB respectively 13.42% and 10.25% significantly different from controls. Distribution of T. harzianum and Gliocladium sp. suspension as a prevention could inhibit dieback disease by Botryodiplodia sp. about 100%. Inhibitory mechanism of T. harzianum and Gliocladium sp. are with antibiotic, competition, and micoparasitic.
vi
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
POTENSI
Trichoderma harzianum
DAN
Gliocladium
sp. UNTUK
PENGENDALIAN
Botryodiplodia
sp. PADA JABON
(
Anthocephalus cadamba
)
ETI ARTININGSIH OCTAVIANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Silvikultur Tropika
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
viii
Judul Tesis : Potensi Trichoderma harzianum dan Gliocladium sp. untuk Pengendalian Botryodiplodia sp. pada Jabon (Anthocephalus cadamba)
Nama : Eti Artiningsih Octaviani NIM : E451130256
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Achmad, MS Dr Ir Elis Nina Herliyana, MSi Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Silvikultur Tropika
Prof Dr Ir Sri Wilarso Budi R, MS Dr Ir Dahrul Syah, MScAgr
x
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis dengan judul “Potensi Trichoderma harzianum dan Gliocladium sp. untuk Pengendalian Botryodiplodia sp. pada Jabon (Anthocephalus cadamba)” dapat diselesaikan.
Penghargaan dan terima kasih penulis ucapkan kepada Prof Dr Ir Achmad, MS dan Dr Ir Elis Nina Herliyana, MSi selaku komisi pembimbing atas bimbingan, masukan, arahan, dan nasihat selama proses penelitian sampai penulisan tesis. Selain itu, terima kasih penulis sampaikan kepada Dr Ir Bonny Poernomo Wahyu Soekarno, MS selaku penguji luar komisi atas masukan dan saran dalam penulisan hasil penelitian ini. Ungkapan terima kasih juga disampaikan kepada seluruh staf dan rekan-rekan di Laboratorium Patologi Hutan, Departemen Silvikultur, Fakultas Kehutanan IPB terutama Ai Rosah Aisah SHut, MSi atas segala bantuan, masukan, dan dukungan selama penyelesaian penelitian dan penulisan karya ilmiah ini.
Rasa hormat dan terima kasih yang tulus penulis sampaikan kepada kedua orang tua tercinta atas segala dorongan, doa dan kasih sayang yang diberikan kepada penulis. Terima kasih juga penulis ucapkan kepada teman-teman Silvikultur 46, Silvikultur Tropika, tim Hamas II, tim Hamasah, dan rekan-rekan PPM Al-Iffah yang senantiasa memberi semangat dari awal hingga akhir penelitian.
Semoga tulisan ini dapat memberi manfaat bagi penulis dan yang memerlukan.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA
Jabon (Anthocephalus cadamba Roxb.Miq) 2
Cendawan Botryodiplodia sp. 5
Agens Hayati 7
3 BAHAN DAN METODE
Waktu dan Tempat Penelitian 10
Bahan dan Alat 10
Metode 11
Analisis Data 14
4 HASIL DAN PEMBAHASAN
Hasil 15
Pembahasan 20
5 SIMPULAN DAN SARAN
Simpulan 25
Saran 25
DAFTAR PUSTAKA 26
LAMPIRAN 33
xii
DAFTAR TABEL
1 Beberapa jenis Botryodiplodia dan Lasiodiplodia penyebab mati pucuk pada tanaman kayu
6 2 Penghambatan pertumbuhan in vitro Botryodiplodia sp. Pada
hari ke-5 oleh T. harzianum dan Gliocladium sp. pada media PDA dan Czapex Agar
15
3 Penghambatan filtrat biakan cendawan agens hayati terhadap pertumbuhan miselia Botryodiplodia sp.
17
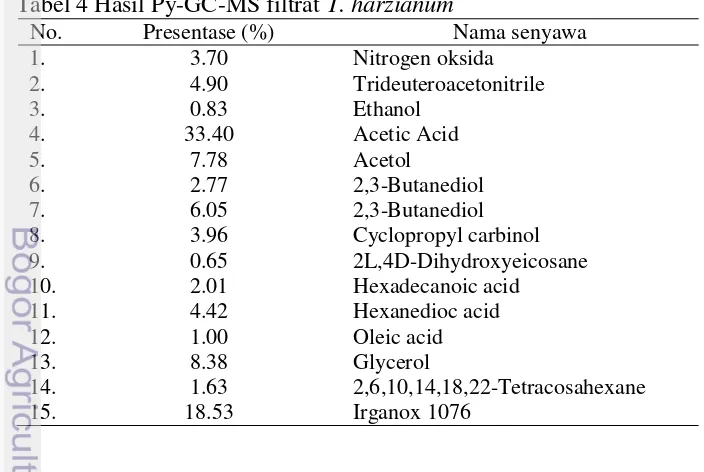
4 Hasil Py-GC-MS filtrat T. harzianum 18
5 Hasil Py-GC-MS filtrat Gliocladium sp. 19
6 Evaluasi pengendalian hayati secara in vivo 19
DAFTAR GAMBAR
1 Profil jabon (sumber: Soerianegara & Lemmens 1993) 3 2 Profil Botryodiplodia sp. (sumber: Barnet & Hunter 1999) 5 3 SEM untuk mikoparasit B. theobromae oleh T. harzianum (Th)
dan G. viride. (1) struktur clamp yang dibentuk isolat Th1 (A) menekan hifa B. theobromae (B). (2) struktur kait (hook) Th2 (A) melakukan penetrasi pada hifa B. theobromae (B). (3) berkurangnya turgor dalam hifa B. theobromae (B) akibat serangan G. virens Gv1 dan Gv2 (A). (sumber: Gupta et al. 1999)
7
4 Fialid dan konidia T. harzianum (sumber: Ellis et al. 2007) 8 5 Konidiospor dan konidia Gliocladium sp. (sumber: Ellis et al.
2007)
9
6 Diagram alir penelitian 10
7 Denah metode uji ganda 11
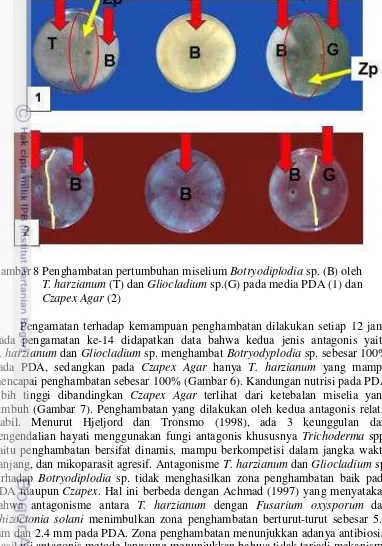
8 Penghambatan pertumbuhan miselium Botryodiplodia sp. (B) oleh T. harzianum (T) dan Gliocladium sp. (G) pada media PDA (1) dan Czapex Agar (2)
16
9 Mekanisme mikoparasit secara mikroskopik antara T. harzianum (T) dan Gliocladium sp. (G) terhadap Botryodiplodia sp. (B) di mana pada 1 dan 2 terjadi penetrasi hifa patogen oleh agens hayati
17
10 Miselia Botryodiplodia sp. (B) setelah 7 hari inkubasi pada
kontrol (K), penambahan filtrat Gliocladium sp. (G) dan penambahan filtrat T. harzianum (T)
17
DAFTAR LAMPIRAN
1 Aplikasi in vivo pada bibit jabon dengan pemberian suspensi miselium Botryodiplodia sp.(B), T. harzianum (T), dan Gliocladium sp.(G).
(K) Kontrol (BG) Pemberian Gliocladium sp. setelah Botryodiplodia sp. (GB) Pemberian Gliocladium sp.sebelum Botryodiplodia sp.
(BT) Pemberian T. harzianum setelah Botryodiplodia sp., (TB) Pemberian T. harzianum sebelum Botryodiplodia sp.
33
2 Hasil kromatografi filtrat Gliocladium sp. yang ditumbuhkan selama 7 hari pada media PDB
33 3 Hasil kromatografi filtrat T. harzianum yang ditumbuhkan selama
7 hari pada media PDB
PENDAHULUAN
Latar Belakang
Hutan rakyat merupakan salah satu solusi dalam menyelesaikan masalah penyediaan kayu untuk berbagai keperluan. Selain itu, hutan rakyat yang dikelola masyarakat mampu membuka peluang usaha baru yang potensial dan berperan dalam pengembalian fungsi hutan. Dewasa ini, salah satu jenis kayu yang dibudidayakan pada hutan rakyat adalah jabon (Anthocephalus cadamba). Jabon menjadi salah satu jenis pohon yang banyak diminati untuk dibudidayakan dan dikembangkan. Jabon termasuk fast growing species (FGS) yang memiliki nilai manfaat secara ekologi dan ekonomi. Jabon memiliki kemudahan dalam pemeliharaan karena dapat mengalami pemangkasan alami serta pemasarannya juga relatif mudah. Menurut Herusansono dan Wahono (2011), harga kayu jabon siap panen bisa mencapai Rp 1.2-1.4 juta/m3. Potensi ekonomi tersebut ini diperkuat dengan penelitian Krisnawati et al. (2011) yaitu tegakan jabon umur 5 tahun yang ada di daerah Kalimantan Selatan dan Jawa, memiliki riap diameter rata-rata 1.2-11.6 cm/tahun dengan riap tinggi rata-rata 0.8-7.9 m/tahun. Data tersebut juga menggambarkan potensi jabon sebagai jenis yang dapat diperuntukkan dalam kegiatan penghijauan maupun reklamasi lahan bekas tambang.
Kebutuhan pasar akan kayu telah mendorong usaha budidaya jabon ini untuk terus ditingkatkan produktivitasnya. Salah satu faktor suksesnya usaha adalah mekanisme penyediaan bibit berkualitas yang dilakukan dalam lingkup persemaian. Bibit jabon memiliki kerentanan terhadap hama dan penyakit yang dapat mempengaruhi kualitas dan kuantitas bibit yang dihasilkan. Penyakit yang menyerang jabon di persemaian di antaranya yang telah dilaporkan adalah penyakit mati pucuk yang disebabkan Rhizoctonia solani (Rahman et al. 1997), penyakit bercak daun yang disebabkan Colletotrichum sp. (Anggraeni 2009) dan penyakit mati pucuk yang disebabkan Botryodiplodia sp. (Aisah 2014).
2
Trichoderma harzianum dan Gliocladium sp. telah dikenal sebagai agens hayati yang potensial (Abadi 1987; Achmad 1997; Gupta et al. 1999; Sinaga et al. 2001; Ellis et al. 2007; Amalia et al. 2008; Retnosari 2011).
Studi tentang identifikasi agen penyebab penyakit dan pengujian patogenisitas serta virulensinya telah dilakukan oleh Aisah (2014) sehingga diperlukan studi lanjut tentang pengendalian penyakit mati pucuk khususnya secara hayati. Oleh sebab itu, dalam penelitian ini dilakukan kegiatan uji antagonis secara in vitro dan aplikasi secara in vivo sebagai salah satu acuan dalam penentuan langkah pengendalian penyakit mati pucuk tersebut secara biologis.
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan agens hayati yang paling efektif di antara Trichoderma harzianum dan Gliocladium sp. dalam menghambat pertumbuhan patogen secara in vitro dan menguji keefektifan kedua agens hayati dalam menghambat pertumbuhan patogen dalam skala in vivo serta menduga mekanisme penghambatan yang dilakukan T. harzianum dan Gliocladium sp. terhadap Botryodiplodia sp..
Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi tentang tindakan pengendalian secara hayati dengan melibatkan agens hayati T. harzianum dan Gliocladium sp. terhadap Botryodiplodia sp. sebagai penyebab penyakit mati pucuk pada bibit jabon khususnya di persemaian.
TINJAUAN PUSTAKA
Jabon (Anthocephalus cadamba (Roxb.) Miq)
Klasifikasi Jabon
Jabon termasuk jenis tanaman pionir yang dapat membentuk kelompok hutan alam murni pada tempat yang bebas persaingan cahaya. Perbanyakan jabon dapat dilakukan melalui biji atau stek. Biji yang digunakan sebagai benih, perlu disemaikan terlebih dahulu dalam bak kecambah. Semai yang telah mencapai ukuran tinggi 3 cm dapat dipindah ke bedeng penyapihan. Setelah mencapai tinggi 20 sampai 30 cm,
semai dapat ditanam di lapangan pada awal musim hujan (Martawijaya et al. 1981).
hanja, kelampeyan, jabon (Jawa); galupai, kelampai, johan (Sumatera); ilan, kelampayan, taloh (Kalimantan); sugi mania, pekaung, pute (Sulawesi); gumpayan, kelapan, mugawe (NTB); dan aparabire, masarambi (Papua) (Martawijaya et al. 1981; Orwa et al. 2009). Berdasarkan sistem klasifikasi, jabon digolongkan sebagai berikut (Gautam et al. 2012; Soerianegara & Lemmens 1993):
Kingdom : Plantae
Sub Kingdom : Tracheobionta
Kelas : Asteridae
Ordo : Rubiales
Famili : Rubiaceae
Genus : Neolamarckia F. Bosser
Spesies : Neolamarckia cadamba (Roxb.) Sinonim : Anthocephalus cadamba (Roxb.) Miq
Anthocephalus indicus A. Rich
Keterangan gambar : 1. Pohon
2. Daun dan buah 3. Bunga
4. Infructescense
Gambar 1 Profil jabon (sumber: Soerianegara & Lemmens 1993)
Jabon di Indonesia saat ini memiliki prospek tinggi sebagai komoditi hutan tanaman industri dan tanaman penghijauan karena pertumbuhannya yang cepat, mampu beradaptasi pada beberapa kondisi tempat tumbuh yang marjinal dan perlakuan silvikulturnya yang relatif mudah (Krisnawati et al. 2011). Jabon memiliki beberapa manfaat antara lain kayu digunakan sebagai bahan baku kayu lapis, konstruksi ringan, pulp dan kertas, langit-langit, kotak, peti, mainan, ukiran, korek api, sumpit, dan pensil (Soerianegara & Lemmens 1993). Jabon bermanfaat pula sebagai obat dan hasil uji farmakologi bersifat sebagai antioksidan dan antimikroba (Umachigi et al. 2007).
Penyakit pada Tanaman Jabon
Penyakit yang mengganggu tanaman jabon yaitu berupa rontoknya sebagian atau seluruh daun dan mati pucuk yang disebabkan oleh Gloeosporium anthocephali (Soerianegara & Lemmens 1993). Sementara itu, penyakit yang ditemukan mengganggu jabon di persemaian yaitu bercak daun yang disebabkan oleh Colletotrichum sp. (Anggraeni 2009) dan mati pucuk yang disebabkan oleh R. solani(Rahman et al. 1997).
4
lemah, maka tanaman tidak hanya mengalami kerontokan daun tetapi mengalami mati pucuk atau bahkan mati total. Adapun kerugian yang ditimbulkan oleh penyakit mati pucuk pada tanaman jabon belum banyak dilaporkan. Akan tetapi, penyakit ini dapat menyebabkan kerusakan pada bibit jabon dengan persentase kematian antara 5-15% (Cahyadi E 27 Maret 2013, komunikasi pribadi dalam Aisah 2014). Penyakit mati pucuk pada bibit jabon yang disebabkan oleh Botryodiplodia sp. dapat menyebabkan kematian bibit hingga 15% khususnya ditemukan pada persemaian di daerah Bogor. Gejala mati pucuk pada bibit jabon diawali dengan nekrosis pada batang hingga pucuk dan batang mengering hingga tidak mampu menopang daun. Gejala mati pucuk pada bibit jabon ditemukan pada bibit jabon dengan rentang umur 2 sampai 6 bulan (Aisah 2014).
Gejala dan Penyebab Penyakit Mati Pucuk
Penyakit mati pucuk memiliki gejala berupa nekrotik ekstensif yang dimulai dari bagian ujung tanaman dan berkembang menuju bagian pangkal. Biasanya terjadi secara tiba-tiba dan kerusakan berupa kematian dapat terjadi pada pucuk serta bagian ujung pertumbuhan. Gejala lain dari penyakit ini adalah terjadi perubahan warna daun dari hijau tua menjadi kuning, pengurangan ukuran daun, pengguguran daun, dan gumosis. Penyakit mati pucuk dapat menyerang tanaman kayu dan semak, dan dapat terjadi di area pertanaman atau persemaian (Agrios 2005; Douglas 2009; Ahmad et al. 2012).
Kerusakan akibat penyakit mati pucuk telah banyak dilaporkan terutama terjadi pada hutan tanaman di wilayah Asia dan Eropa. Beberapa tanaman yang pernah dilaporkan yaitu tanaman shisham (Dalbergia sissoo) di Banglades (Rajput et al. 2008) dan Pakistan (Ahmad et al. 2012), akasia (Acacia mangium Willd.) di Indonesia (Tarigan et al. 2010), dan ash (Fraxinus excelsior L.) di Eropa (Kräutler & Kirisits 2012). Selain itu, penyakit mati pucuk dilaporkan oleh Rahman et al. (1997)mengganggu tanaman karet (Hevea brasiliensis Müll. Arg.), jabon (A. cadamba), dan keora(Sonneratia apetala Buch.-Ham.)pada fase semai. Penyakit mati pucuk dapat mengancam usaha produksi kayu karena berpotensi menyebabkan kematian pada tanaman, baik pada fase semai maupun pohon. Anderson et al. (2002) melaporkan bahwa kejadian penyakit mati pucuk pada tanaman akasia (A. koa) di Mauna Loa, Hawaii berkisar antara 66-86%. Sementara itu, berdasarkan pengamatan pada 4 lokasi persemaian di sekitar kampus IPB Dramaga, yaitu 3 persemaian di Kecamatan Dramaga dan 1 persemaian di Kecamatan Kemang, penyakit mati pucuk dapat menyebabkan kematian terhadap bibit jabon dengan persentase antara 1-15%.
Gejala mati pucuk umumnya disebabkan oleh parasit-parasit lemah. Infeksi patogen sangat dipengaruhi oleh kondisi tanaman inang. Beberapa patogen yang
dilaporkan menyebabkan gejala mati pucuk yaitu Rhizoctonia spp., Fusarium oxysforum, dan Lasiodiplodia theobromae (Semangun 2006;
Muehlbach et al. 2010).
(Khanzada et al. 2004), shisham (Muehlbach et al. 2010), pir (Pyrus sp.) (Shah et al. 2010), karet (Rahman et al. 1997), dan kakao (Mbenoun et al. 2008).
Cendawan Botryodiplodia
Taksonomi dan Morfologi
Taksonomi Botryodiplodia (Alexopoulus et al. 1960) adalah sebagai berikut:
Domain : Eukaryota Kingdom : Fungi
Phylum : Deuteromycota Kelas : Deuteromycetes Ordo : Sphaeropsidales Famili : Sphaeropsidaceae Genus : Botryodiplodia Spesies : Botryodiplodia sp.
Cendawan Botryodiplodia (sinonim Lasiodiplodia) merupakan cendawan yang bereproduksi secara aseksual (anamorf). Cendawan Botryodiplodia memiliki fase seksual atau telemorf yang bergantung pada spesiesnya, seperti fase telemorf jenis Botryodiplodia theobromae adalahcendawan Botryosphaeria rhodina. Jenis Botryodiplodia cukup banyak namun secara taksonomi morfologis cukup membingungkan (Burgess et al. 2006). Berdasarkan penelusuran melalui MycoBank (www.mycobank.org), jumlah jenis Botryodiplodia sebanyak 224 jenis sejak tahun 1884 sedangkan Lasiodiplodia terdata berjumlah 30 jenis. Nama Botryodiplodia pertama kali digunakan sebagai subdivisi dari jenis Diplodia oleh Saccardo tahun 1880 dan pertama kali digunakan sebagai nama jenis oleh Saccardo pada tahun 1884 pada jenis Botryodiplodia juglandicola (Schw.) Sacc. dengan sinonim Sphaeria juglandicola Schw. (Crous & Palm 1999).
Keterangan gambar :
1. Piknidia 2. Konidiofor 3. Konidia muda 4. Konidia matang.
Gambar 2 Profil Botryodiplodia sp. (sumber : Barnet & Hunter 1999) Jenis Botryodiplodia cukup banyak namun secara taksonomi morfologis cukup membingungkan (Burgess et al. 2006). Cendawan Botryodiplodia secara morfologi dicirikan dengan konidia yang khas dan pertumbuhannya yang cepat pada media agar. Jenis B. theobromae merupakan jenis dominan dari genus Botryodiplodia yang menjadi patogen pada beberapa tanaman berkayu khususnya
1 2
3
6
dominan di daerah tropis (Punithalingham 1980 dalam Burgess et al. 2006). Menurut Gandjar et al. (1999), koloni B. theobromae pada media OA (Oatmeal Agar) dan PDA (Potatoes Dextrose Agar) membentuk miselia aerial yang lebat dan berwarna coklat tua dengan piknidia muncul berupa klaster dalam stromata, berbentuk bulat dengan leher panjang dan berwarna gelap hitam kehijauan, sedangkan fialid berbentuk silindris dan berukuran 5 sampai 12 µm x 2 sampai 4 µm serta konidia bersel dua bila tua, berukuran 22 sampai 28 µm x 12 sampai 15 µm, berbentuk elips, berwarna coklat tua dan memiliki garis-garis longitudinal. Pematangan konidia B. theobromae berjalan lambat. Beberapa jenis Botryodiplodia atau Lasiodiplodia dilaporkan menjadi patogen mati pucuk pada beberapa tanaman berkayu (Tabel 1).
Tabel 1 Beberapa jenis Botryodiplodia dan Lasiodiplodia penyebab mati pucuk pada tanaman berkayu
No. Jenis Patogen Jenis Inang Sumber Pustaka 1. B. theobromae Sengon (Albizia
falcataria)
Sharma & Shankaran (1988)
2. B. theobromae Kakao (Theobroma cacao) Semangun (2000); Mbenon et al. (2008); Kannan et al. (2010)
3. B. theobromae Jeruk (Citrus spp.) Alam et al. (2001); Salamiah et al. (2008)
4. B. theobromae Annona squamosa dan Annona cherimola
Haggag & Nofal (2006)
5. B. theobromae Pear (Prunus spp.) Shah et al. (2010) 6. Botryodiplodia sp. Jabon (A. cadamba) Herliyana et al. (2012) 7. L. theobromae Pinus taeda L, pinus
elliotii Elngm
Cillier et al. (1993)
8. L. theobromae Aprikot Jepang, Persik Li et al. (1995) 9. L. theobromae Mangga (Mangifera indica
L)
Khanzada et al. (2004); Ismail et al. (2012)
10. L. theobromae Gravepine (Vitis vinifera L)
Torres et al. (2008); Al-Saadon et al.(2012)
11. L. theobromae Syzygium cordatum Pavlic et al. (2007) 12. L. theobromae Grivellea robusta
Cunn.ex.R.Br
Njugana (2011)
13. L. theobromae Sawo Mamey (Pouteria sapota)
Pedraza et al. (2013)
14. L. pseudotheobromae Mangga (M. indica L) Ismail et al. (2012)
15. L. egyptiacae Mangga (M. indica L) Ismail et al. (2012)
16. B. theobromae Jabon (A. cadamba) Winara (2014) 17. Botryodiplodia sp. Jabon (A. cadamba) Aisah (2014)
(Semangun 2000; Mbenon et al. 2008; Kannan et al. 2010), jeruk (Alam et al. 2001; Salamiah et al. 2008), srikaya (Haggag & Nofal 2006), pir (Shah et al. 2010) dan V. vinifera (Torres et al. 2008; Al-Saadon et al. 2012).
Penelitian tentang pengendalian B. theobromae telah dilakukan oleh Gupta et al. (1999) dengan menggunakan beberapa jenis agens hayati.
Gambar 3 SEM untuk mikoparasit B. theobromae (B) oleh T. harzianum (Th) dan G. viride. (1) struktur clamp yang dibentuk isolat Th1 (A) menekan hifa B. theobromae (B). (2) struktur kait (hook) Th2 (A) melakukan penetrasi pada hifa B. theobromae (B). (3) berkurangnya turgor dalam hifa B. theobromae (B) akibat serangan G. virens Gv1 dan Gv2 (A). (sumber: Gupta et al. 1999)
Kedua isolat T. harzianum yaitu Th1 dan Th2 didapatkan hasil bahwa interaksi yang teramati adalah penetrasi terhadap hifa patogen. Isolat Th1 membentuk struktur seperti appresorium pada ujung hifanya yang mencapai hifa patogen dan membantu proses penetrasi sehingga dapat mendegradasi dinding sel patogen. Th1 terkadang membagi ujung hifanya menjadi dua cabang untuk menekan hifa patogen. Hifa utama dari isolat Th1 menghasilkan bentukan kait seperti cabang yang melakukan penetrasi sehingga terbentuk belitan dan mengakibatkan kerusakan pada miselia patogen (Gupta et al. 1999).
Mekanisme Infeksi Patogen
Patogen tumbuhan umumnya merupakan mikroorganisme yang tidak dapat menggunakan kekuatan sendiri untuk menginfeksi inang. Patogen yang dapat menginfeksi atau memenetrasi tanaman inang secara langsung dapat menggunakan kekuatan mekanik. Mekanisme lain yang digunakan patogen untuk menyebabkan penyakit pada tanaman inang adalah kekuatan kimia seperti enzim, toksin, zat pengatur tumbuh, dan polisakarida (Agrios 2005).
Penetrasi secara langsung terhadap tanaman inang diantaranya dapat dilakukan oleh cendawan patogen. Untuk melewati rintangan fisik pada tanaman inang, cendawan membentuk struktur infeksi yang memungkinkan dia untuk memenetrasi dinding sel. Sekresi enzim atau peningkatan tekanan pada struktur infeksi dapat membantu proses penetrasi (Mendgen et al. 1996).
8
penetrasi untuk menembus kutikula dan dinding sel tanaman. Kebanyakan apresorium dalam proses penetrasi mengandung melanin yang berwarna gelap (Agrios 2005; Huang 2001).
Cendawan patogen dapat juga memiliki beberapa zat kimia yang dapat menyebabkan tumbuhan terserang diantaranya enzim, toksik, dan zat pengatur tumbuh. patogen tumbuhan juga menghasilkan zat pengatur tumbuh. Secara umum, enzim patogenik tumbuhan menghancurkan komponen struktural sel inang, kemudian memecah substansi di dalam sel atau mempengaruhi komponen dari membran dan protoplas. Enzim yang digunakan oleh patogen untuk menginfeksi tanaman inang diantaranya adalah protease, pektinase, selulase, dan ligninase (Semangun 2006; Agrios 2005). Toksin merupakan substansi yang sangat beracun dan berfungsi efektif dalam konsentrasi yang sangat rendah (Agrios 2005). Zat pengatur tumbuh dari patogen tumbuhan dapat menyebabkan sistem hormonal tumbuhan inang menjadi tidak seimbang sehingga menghasilkan pertumbuhan abnormal (Agrios 2005).
Agens Hayati
Penggunaan agens hayati merupakan salah satu alternatif yang dianggap efektif dan dapat memberikan hasil yang memuaskan. Berbagai jenis antagonis telah dilakukan dan dipelajari kemungkinan penggunaannya untuk pengendalian penyakit pada tanaman, seperti Trichoderma sp. dan Gliocladium sp. (Darmono 1997). Menurut Bruehl (1987) dalam Widyastuti (2007), meskipun pengendalian hayati tampaknya tidak seefektif pengendalian secara kimiawi, tetapi hasilnya dapat berjangka panjang bahkan permanen, tidak menyebabkan polusi atau gangguan bagi kesehatan manusia, sehingga secara ekonomi cukup kompetitif terhadap pengendalian yang lain. Hal ini mengindikasikan bahwa pengendalian secara hayati dapat memenuhi kriteria langkah pengendalian penyakit secara keseluruhan aspek yaitu teknis, ekonomi, ekologi dan sosial.
Menurut Agrios (2005), jamur ini dapat diklasifikasikan sebagai berikut: Sub division : Deuteromycotina
Kelas : Hyphomycetes Ordo : Moniliales Famili : Moniliaceae Genus : Trichoderma
Spesies : Trichoderma harzianum Rifai
Trichoderma harzianum termasuk kelas Hypomycetes dan ordo Moniliales (Agrios 2005). Tahun 1969 Rifai mengadakan revisi terhadap spesies yang ada dan menggolongkan Trichoderma ke dalam 9 Species. Diantara spesies tersebut terdapat 5 spesies yang paling banyak digunakan sebagai agen pengendalian hayati dalam pengendalian penyakit tanaman yaitu ; T. hamatum, T. harzianum, T. koningii, T. viridae dan T. pseudokoningii (Papavizas 1985).
Koloni dari genus Trichoderma sp. tergolong kompak. Kekompakan ini berhubungan dengan struktur konidiofornya, sebagian besar koloni membentuk zona mirip cincin yang khas dan jelas. Warna koloni ada yang kekuningan, kuning dan hijau. Pada ujung konidiofor berbentuk seperti botol. Konidia berwarna hijau dan jernih, bentuk konidia sebagian besar bulat (Rifai 1969).
Selain T. harzianum, terdapat beberapa jenis cendawan lain yang banyak digunakan dalam pengendalian hayati. Salah satunya adalah Gliocladium sp. Menurut Alexopoulus danMims (1979), Gliocladium sp. diklasifikasikan:
Kingdom : Mycetaceae Divisio : Amastigomycota Sub Divisi : Deuteromycotina Class : Deuteromycetes Ordo : Hypocreales Famili : Hypocreaceae Genus : Gliocladium Species : Gliocladium spp.
10
studi penelitian telah menunjukkan bahwa pengendalian hayati yang efektif harus mampu melakukan lebih dari satu mekanisme biokontrol (Xu et al. 2011).
Menurut Lewis dan Papavizas (1984), Trichoderma sp. menghasilkan sejumlah besar enzim ekstraseluler β-1.3-glukonase dan kitinase selama tumbuh aktif yang dapat melarutkan dinding sel patogen. Gliocladium sp. merupakan cendawan saprofitik yang dapat berperan sebagai antagonis efektif untuk mengendalikan patogen tanaman, terutama patogen tanah. Beberapa metabolit sekunder yang dihasilkan Gliocladium sp. antara lain gliotoksin, viridian, dan paraquinon yang bersifat fungitoksik terhadap patogen (Roseline 2000). Beberapa laporan menyebutkan bahwa Trichoderma sp. dan Gliocladium sp. mampu menghambat pertumbuhan patogen antara lain Cylindrocladium sp. (Amalia et al. 2008) dan Phytium sp. (Octriana 2011). Beberapa spesies Gliocladium juga memproduksi siklik peptida dengan sifat antibakteri, seperti diketopiperazine (Koolen et al. 2011). Senyawa lain yang memiliki kemampuan menghasilkan antibiotik dari beberapa spesies Gliocladium lainnya termasuk p-terphenyl (Guo et al. 2007) dan poliketida (Kohno et al. 2000). Antibiotik menghambat E. carotovora diproduksi oleh Gliocladium sp. TNC73 lebih cenderung menjadi bentuk diketopiperazine atau bentuk peptida siklik lainnya, terphenyl atau poliketida daripada peptaibol linier.
METODOLOGI
Waktu dan Tempat Penelitian
Percobaan dilaksanakan dari bulan Februari 2014 sampai dengan Mei 2014. Tahap penelitian secara in vitro dilakukan di Laboratorium Patologi Hutan dan tahapan in vivo dilakukan di rumah kaca Bagian Perlindungan Hutan, Departemen Silvikultur, Fakultas Kehutanan, Institut Pertanian Bogor. Analisis komponen kimia melalui Pyrolisis Gas Chromatography Mass Spectrometry (Py-GC-MS) dilakukan di Litbang Hasil Hutan, Pusat Penelitian dan Pengembangan Kehutanan Gunung Batu, Bogor.
Alat dan Bahan Penelitian
Bahan-bahan yang digunakan pada percobaan berupa isolat cendawan antagonis yaitu Trichoderma harzianum dan Gliocladium sp.. Keduanya hasil isolasi dari tanah yang merupakan koleksi SEAMEO Biotrop. Isolat cendawan patogen Botryodiplodia sp. hasil isolasi dari bibit jabon yang terindikasi penyakit mati pucuk pada penelitian Aisah (2014). Bahan penelitian lainnya berupa air steril, media Potato Dextrose Agar (PDA), Potato Dextrose Broth (PDB), Czapex Agar, kertas saring Whattman no.1, kertas saring standar dan syiringe filter 0.2 µm.
Metode Penelitian
Penelitian ini diawali dengan peremajaan isolat cendawan patogen dan agens hayati. Kegiatan utama yang dilakukan terdiri atas 2 tahapan, yaitu: tahap in vitro dan in vivo. Tahapan in vitro terdiri atas uji antagonis dan identifikasi antibiosis. Tahapan in vivo terdiri atas penyiapan bibit jabon dan inokulasi cendawan (patogen dan agens hayati) pada bibit jabon. Tahapan kegiatan ditunjukkan dalam Gambar 6.
Peremajaan Cendawan Patogen dan Agens Hayati
Isolat Botryodiplodia sp., T. harzianum, dan Gliocladium sp. ditumbuhkan pada media PDA dalam cawan petri. Koloni cendawan yang tumbuh dimurnikan pada media PDA yang telah diberi chloramphenicol. Selanjutnya, isolat disimpan untuk digunakan pada uji antagonisme in vitro dan uji keefektifan agens hayati secara in vivo.
Antagonisme In vitro Metode Langsung
Uji antagonisme in vitro dengan metode langsung dilakukan dengan uji ganda (dual culture) (Benhamou & Chet 1993 dalam Purwantisari & Hastuti 2009) pada media PDA dan CzapexAgar. Penggunaan kedua media dikarenakan adanya hipotesis bahwa ekspresi antibiosis berupa zona bening pada antagonisme in vitro dipengaruhi oleh media yang digunakan. Achmad et al. (2010) mempelajari antagonisme pada media padat yang melibatkan T. harzianum, zona penghambatan terbentuk baik pada PDA maupun MEA, akan tetapi zona penghambatan pada antagonisme yang melibatkan T. pseudokoningii hanya terbentuk pada MEA. Agens hayati T. harzianum dan Gliocladium sp. diinokulasikan pada media dengan jarak 3 cm dari koloni cendawan patogen Botryodiplodia sp.. Tiap perlakuan dilakukan sebanyak 3 ulangan. Pengamatan dilakukan dengan mengukur jari-jari koloni cendawan patogen yang menjauhi koloni agens hayati (R1) dan jari-jari koloni cendawan patogen yang mendekati agens hayati (R2), serta menghitung penghambatan agens hayati (H). Pengamatan dimulai 12 jam setelah kedua patogen uji diinokulasikan sampai hari ketujuh setelah perlakuan.
Tahap In vitro
Uji antagonis secara in vitro (metode langsung dan tak langsung)
Identifikasi antibiosis agens hayati
Tahap In vivo
Inokulasi patogen dan agens hayati pada bibit jabon Penyiapan Bibit Jabon
12
Keterangan :
P :Koloni cendawan patogen A :Koloni cendawan agens hayati
R1 :Jari-jari koloni patogen menjauhi koloni agens hayati (mm)
R2 :Jari-jari koloni patogen mendekati koloni agens hayati (mm)
Interaksi agens hayati dengan patogen dalam pengendalian hayati terjadi dalam bentuk antibiosis, kompetisi, dan mikoparasitisme (Baker & Cook 1974). Zona penghambatan yang terbentuk antara koloni patogen dan koloni agens hayati pada pengujian antagonisme in vitro merupakan indikasi bekerjanya mekanisme antibiosis (Fravel 1988). Zona penghambatan tersebut secara visual berupa zona bening. Besarnya pengaruh penghambatan agens hayati terhadap patogen dihitung dengan menggunakan rumus persentase.
H = (R1-R2) x 100% R1
Keterangan :
H : Persentase penghambatan agens antagonis (%)
R1 : Jari-jari koloni patogen yang menjauhi koloni agens antagonis (mm) R2 : Jari-jari koloni patogen yang mendekati koloni agens antagonis (mm) Catatan : bila koloni pertumbuhan patogen sudah tertutup oleh koloni agens hayati, maka dianggap persentase penghambatan agens hayati (H) = 100% Antagonisme Metode Tak Langsung
Uji antagonisme metode tak langsung dilakukan dengan cara mengamati pengaruh filtrat biakan agens hayati terhadap pertumbuhan patogen (Achmad 1997). Media yang digunakan dalam tahap ini adalah PDB. Tiga potong koloni agens hayati (Ø 7 mm) dimasukkan ke dalam 100 mL media PDB dalam labu erlenmeyer 250 mL kemudian diinkubasi selama 7 hari pada suhu kamar. Setelah masa inkubasi berakhir, filtrat dipisahkan dari miselia cendawan melalui penyaringan dengan menggunakan kertas saring steril.
Filtrat agens antagonis diambil sebanyak 3 mL dan ditambahkan 20 mL media PDB di dalam labu erlenmeyer 50 mL. Tiga potong koloni patogen ditanam di dalamnya. Kontrol dibuat dengan mengganti media perlakuan dengan media PDB dengan volume yang sama. Labu perlakuan maupun kontrol diinkubasi selama 7 hari pada suhu kamar. Miselia patogen disaring lalu ditentukan bobotnya setelah dikeringkan dalam oven 60°C selama 24 jam. Persentase penghambatan ditunjukkan oleh selisih bobot miselia perlakuan terhadap bobot miselia kontrol dibagi bobot miselia kontrol.
R1 P R2 A
3cm 3cm
Analisis Komponen Kimia Agens Hayati
Sebelum dilakukan analisis, kultur isolat cendawan disiapkan terlebih dahulu pada media PDB (Potato Dextrose Broth). Satu potong inokulum cendawan (Ø 7 mm), dimasukkan ke dalam 100 mL media PDB dalam labu erlenmeyer volume 250 mL, lalu diinkubasi selama 1 minggu pada suhu ruang. Setelah masa inkubasi, suspensi media PDB dipisahkan dari biomassa isolat dengan menggunakan kertas saring Whattman no. 1. Suspensi media selanjutnya disentrifuse dengan kecepatan 10 000 rpm selama 10 menit untuk mendapatkan supernatan filtrat tersebut. Hasil proses tersebut disaring kembali dengan syringe filter berukuran pori membran sebesar 0.2 μm. Perlakuan tersebut merupakan modifikasi dari Achmad (1997). Selanjutnya hasil saringan akan digunakan dalam antagonis metode tak langsung dan sebagai bahan analisis kualitatif aktivitas metabolit sekunder yang diproduksi oleh cendawan. Kegiatan ini dilakukan dengan metode analisis Py-GC-MS.
Pirolisis kromatografi gas spektrometri massa (Py-GC-MS) adalah metode instrumental yang memungkinkan karakterisasi dan makromolekuler volatil dan kompleks yang ditemukan di hampir semua materi di dalam lingkungan alam. Perbedaan antara Py-GC-MS dengan GC-MS terletak pada jenis contoh yang digunakan dan metode yang diperkenalkan ke sistem GC-MS. Py-GC-MS dilakukan di Laboratorium Hasil Hutan, Puslitbang Kehutanan Bogor dengan menggunakan alat Shimadzu Type GCMS-QP2010. Alat ini bekerja pada suhu pirolisis 280 °C selama 1 jam, suhu injeksi 280 °C, dan suhu awal kolom 50 °C. Identifikasi senyawa dilakukan dengan mencocokkan data waktu retensi, spektrum masa beserta fragmentasi ion suatu senyawa dengan data yang ada dalam pangkalan data WILEY 7th library.
Penyiapan Bibit Jabon
Bibit jabon diperoleh dari persemaian sekitar kampus IPB Darmaga yang memiliki vigor relatif baik dan sehat. Penelitian Aisah (2014) yang bertujuan untuk menguji virulensi patogen pada jabon. Bibit yang digunakan berasal dari pohon yang sama dengan umur dan pertumbuhan yang seragam. Umur bibit jabon yang digunakan dalam penelitian ini adalah 2 bulan. Hal ini dikarenakan gejala penyakit mati pucuk pada bibit jabon muncul pada umur 2-6 bulan (Arshinta 2013; Aisah 2014). Jumlah bibit yang diperlukan 3 buah bibit per perlakuan. Inokulasi Botryodiplodia sp. dan Agens Hayati pada Bibit Jabon
14
yang telah dilukai dan diberi perlakuan ditutup dengan menggunakan alumunium foil dan diinkubasi selama 3 hari. Waktu inkubasi ditentukan berdasarkan waktu yang diperlukan cendawan untuk mencapai penuh cawan dan hasil penelitian pendahuluan yang telah dilakukan. Botryodiplodia sp. dapat menyebabkan gejala awal 3 hari setelah diinokulasi (Aisah 2014; Winara 2014). Evaluasi gejala penyakit dilakukan setiap hari selama 7 hari. Gejala penyakit yang muncul pada bagian yang diinokulasi selanjutnya akan direisolasi, kemudian diidentifikasi dan dibandingkan dengan isolat sebelumnya. Apabila isolat cendawan yang diinokulasikan menghasilkan gejala yang identik dengan gejala mati pucuk dan teridentifikasi sebagai cendawan yang sama dengan isolat sebelumnya.
Efektivitas Penghambatan Patogen oleh Agens Hayati
Evaluasi penghambatan pada tanaman ditentukan berdasarkan tingkat kejadian penyakit (Ahmad et al. 2012). Persentase tingkat kejadian penyakit dihitung sebagai berikut:
KjP = n × 100% N
Keterangan: KjP = Kejadian Penyakit
n = Jumlah tanaman yang sakit N = Jumlah tanaman yang diamati
Analisis Data
Rancangan percobaan yang digunakan pada tahap uji antagonis secara in vitro metode langsung adalah Rancangan Acak Lengkap (RAL) in time sedangkan metode tak langsung menggunakan RAL. Rancangan Lingkungan yang digunakan pada tahap aplikasi secara in vivo adalah Rancangan Acak Lengkap Faktorial (RAL Faktorial). Analisis yang dilakukan menggunakan Uji F (ANOVA), apabila hasil menunjukkan perlakuan berbeda nyata maka dilakukan Uji Perbandingan Berganda Duncan (Duncan's Multiple Range Test). Analisis dilakuakn pada selang kepercayaan 95% (α = 0.05) menggunakan εicrosoft Excel dan software SAS versi 9.1.3.
Rumus umum RAL in time yang digunakan sebagai berikut:
Y
ij= μ + τ
i+
(i)k+ W
j+ (τW)
ij+
ijkKeterangan:
Yij = Pengamatan pada perlakuan agens hayati μ = Rataan Umum
τi = Pengaruh perlakuan agens hayati
(i)k = Pengaruh acak pada perlakuan agens hayati Wj = Pengaruh waktu (cm/hari)
(τW)ij = Interaksi antara perlakuan agens hayati dan waktu (cm/hari) ijk = Pengaruh acak pada perlakuan agens hayati, waktu (cm/hari), dan
Rumus umum RAK Faktorial yang digunakan yaitu:
Y
ij= μ + α
i+ β
j+ (αβ)
ij+
ijKeterangan:
Yij = Pengamatan pada perlakuan pemberian agens hayati μ = Rataan Umum
βj = Pengaruh waktu penyemprotan
αi = Pengaruh perlakuan pemberian agens hayati
(αβ)ij = Interaksi antara faktor waktu dan pemberian agens hayati ij = Pengaruh acak pada perlakuan pemberian agens hayati dan
waktu
HASIL DAN PEMBAHASAN
Hasil
Antagonis In vitro Metode Langsung
Hasil uji antagonis dengan metode langsung menunjukkan bahwa T. harzianum menghambat pertumbuhan Botryodiplodia sp. pada hari ke-5 hingga 99.2% dan 70.4% berturut-turut pada PDA dan Czapex Agar, sedangkan Gliocladium sp. mampu menghambat Botryodiplodia sp. sebesar 86.4% dan 63% berturut-turut pada PDA dan Czapex Agar (Tabel 2).
Tabel 2 Penghambatan pertumbuhan in vitroBotryodiplodia sp. pada hari ke-5 oleh T. harzianum dan Gliocladium sp. pada media PDA dan Czapex Agar
Agens hayati Media Rata-rata Penghambatan (%)
T. harzianum PDA 99.2a
Czapex Agar 70.4b
Gliocladium sp. PDA 86.4b
Czapex Agar 63.0b
Penghambatan yang dilakukan kedua agens hayati terhadap Botryodiplodia sp. lebih tinggi dibandingkan penghambatannya terhadap Cylindrocladium sp. yaitu sebesar 24.2% dan 19.3% berturut-turut oleh Trichoderma sp. dan Gliocladium sp. pada media PDA (Amalia et al. 2008). Menurut Widyastuti et al. (1999), bahwa kemampuan isolat Trichoderma spp. dalam menghambat S. rolfsii
berbeda-beda. Hal ini sangat dimungkinkan terjadi pada kemampuan T. harzianum dan Gliocladium sp. dalam menghambat berbagai patogen
16
Gambar 8 Penghambatan pertumbuhan miselium Botryodiplodia sp. (B) oleh T. harzianum (T) dan Gliocladium sp.(G) pada media PDA (1) dan Czapex Agar (2)
Gambar 9 Mekanisme mikoparasit secara mikroskopik antara T. harzianum (T) dan Gliocladium sp.(G) terhadap Botryodiplodia sp.(B) di mana pada 1 dan 2 terjadi penetrasi hifa patogen oleh agens hayati
Antagonisme dengan Metode Tak Langsung
[image:31.595.176.444.87.208.2]Hasil uji antagonis dengan metode tak langsung menunjukkan bahwa filtrat T. harzianum dan Gliocladium sp. memiliki kemampuan menghambat pertumbuhan Botryodiplodia sp. sebesar 13.42% dan 10.25% pada media PDB. Kemampuan penghambatan ditentukan dengan pengukuran bobot kering miselia Botryodiplodia sp. antara kontrol dibandingkan dengan bobot kering miselia yang diberika perlakuan penambahan filtrat antagonis. Penghambatan Botryodiplodia sp. oleh filtrat T. harzianum dan Gliocladium sp. berbeda nyata terhadap kontrol. Tabel 3 Penghambatan filtrat biakan agens hayati terhadap pertumbuhan miselia
Botryodiplodia sp.
Perlakuan Rataan Bobot Miselia Kering (g) Penghambatan (%)
Kontrol 0.205 0.00b
Filtrat T. harzianum 0.177 13.42a
Filtrat Gliocladium sp. 0.184 10.25a
Gambar 9 Miselia Botryodiplodia sp. (B) setelah 7 hari inkubasi : Kontrol (K), penambahan filtrat Gliocladium sp. (G), penambahan filtrat T. harzianum (T).
Menurut Achmad (1997), persentase penghambatan oleh filtrat T. harzianum pada media cair ME terhadap R. solani dan F. oxysporum
berturut-turut sebesar 86.87% dan 60.87%. Penghambatan yang dilakukan oleh filtrat T. harzianum pada penelitian ini lebih kecil dibandingkan yang telah dilakukan oleh Achmad (1997). Menurut Adiningsih (2014), persen penghambatan yang dihasilkan dalam uji antagonis dengan metode tak langsung pada media kultur cair
yang telah ditambahkan filtrat T. harzianum terhadap pertumbuhan
K G K T
B B B b
B
18
Botryodiplodia sp. yaitu 16 % pada media PDB dan 12 % pada media PFB. Dengan demikian, dapat diduga bahwa nilai penghambatan oleh T. harzianum akan lebih tinggi bila dilakukan di dalam media cair ME dibandingkan PDB maupun PFB. Kemungkinan lain yang terjadi yaitu masa inkubasi mempengaruhi besarnya metabolit yang dikeluarkan. Aktifitas β-1,3-glukanase yang bersifat antipatogen, dipengaruhi oleh waktu tetapi tidak berhubungan dengan pertumbuhan Cendawan itu sendiri (Widyastuti dan Budiarti 2005 dalam Widyastuti 2007). Pengaruh metabolit penghambat pertumbuhan patogen akan ternetralisir bila ditumbuhkan pada media PDA (Achmad 1997). Proses netralisir juga dimungkinkan terjadi pada media PDB, yang memiliki bahan dasar yang sama yaitu Potato Dextrose. Analisis Komponen Kimia Filtrat Agens Hayati
Komponen kimia filtrat T. harzianum dan Gliocladium sp. dianalisis dengan menggunakan Pyrolysis Gass Chromatography Mass Spectrometry (Py-GC-MS). Jumlah senyawa yang terdapat dalam ekstrak ditunjukkan oleh jumlah puncak (peak) pada kromatogram, sedangkan nama/jenis senyawa yang ada diinterpretasikan berdasarkan data spektra dari setiap puncak tersebut dengan menggunakan metode pendekatan pustaka pada database GC-MS (Hendayana 1994).
[image:32.595.104.456.462.698.2]Hasil Py-GC-MS menunjukkan bahwa ada beberapa senyawa dominan yang terdapat pada masing-masing filtrat T. harzianum dan Gliocladium sp. Komponen kimia yang dominan terdapat pada T. harzianum adalah Acetic Acid (33.4%), IRGANOX 1076 (18.53%), dan gliserol (8.38%) (Tabel 4) sedangkan pada filtrat Gliocladium sp. adalah 2,3-Butanediol (25.88%), Acetic Acid (17.92%), dan IRGANOX 1076 (16.81%) (Tabel 5). Pada kedua filtrat agens hayati terdapat komponen IRGANOX 1076.
Tabel 4 Hasil Py-GC-MS filtrat T. harzianum
No. Presentase (%) Nama senyawa 1. 3.70 Nitrogen oksida
2. 4.90 Trideuteroacetonitrile
3. 0.83 Ethanol
4. 33.40 Acetic Acid
5. 7.78 Acetol
6. 2.77 2,3-Butanediol 7. 6.05 2,3-Butanediol 8. 3.96 Cyclopropyl carbinol 9. 0.65 2L,4D-Dihydroxyeicosane 10. 2.01 Hexadecanoic acid
11. 4.42 Hexanedioc acid 12. 1.00 Oleic acid 13. 8.38 Glycerol
Tabel 5 Hasil Py-GC-MS filtrat Gliocladium sp.
No. Presentase (%) Nama senyawa 1. 2.42 Nitrogen oksida
2. 3.44 2-Amino-3-methylpentane 3. 5.11 Carbamic acid
4. 9.65 Ethanol 5. 17.92 Acetic Acid 6. 3.36 Acetol
7. 4.86 2,3-Butanediol 8. 25.88 2,3-Butanediol
9. 0.49 7-Octadeceboic acid, methyl ester 10. 0.42 Hexadecanamide
11. 0.92 Hexadecanoic acid 12. 3.57 Hexanedioc acid 13. 4.30 Glycerol
14. 0.85 2,6,10,14,18,22-Tetracosahexane 15. 16.61 Irganox 1076
Asam asetat adalah senyawa yang sangat berperan sebagai antimikroba. Peranannya semakin meningkat apabila terdapat asam asetat yang disertai senyawa fenol (Darmadji 1995). Irganox 1076 merupakan senyawa yang berperan sebagai antioksidan yang biasa digunakan untuk pengawetan kayu (Mabicka et al. 2005).
Evaluasi Antagonisme secara In vivo
[image:33.595.144.483.90.306.2]Antagonisme secara in vivo dilakukan pada bibit jabon berumur 2 bulan dengan metode inokulasi menggunakan pemberian suspensi cendawan untuk patogen maupun agens hayatinya. Perlakuan yang dilakukan berdasarkan jenis agens hayati dan waktu pemberian suspensi agens hayati. Hasil yang diperoleh bahwa pengendalian yang efektif dilakukan bersifat preventif (pencegahan). Bibit jabon yang telah diberikan perlakuan pemberian suspensi agens hayati baik T. harzianum maupun Gliocladium sp. mampu menghambat penyakit mati pucuk sebesar 100%. Sebagian besar kasus yang ditemukan di lapang bahwa penyakit mati pucuk pada bibit jabon tidak menyebabkan kematian. Hal itu terjadi dengan syarat bagian yang terserang langsung dibuang sehingga bibit jabon dapat pulih dengan cara trubus. Titik kerugian produsen berada pada penurunan kualitas dan nilai ekonomi dari bibit yang telah terserang penyakit mati pucuk tersebut.
Tabel 6 Evaluasi pengendalian hayati secara in vivo
Perlakuan Tingkat Kejadian Penyakit
Kontrol 0 0%
Kontrol 1 (Botryodiplodia sp. tanpa pelukaan)
100%
Kontrol 2 (Botryodiplodia sp. dengan pelukaan)
100%
20
Kontrol 1 dan Kontrol 2, memiliki tingkat kejadian yang sama yaitu 100%. Hal ini menginisiasikan bahwa Botryodiplodia sp. dapat menyerang bibit jabon melalui pelukaan maupun penetrasi langsung senada dengan yang dinyatakan oleh Aisah (2014). Sebelumnya, Botryodiplodia sp. dianggap sebagai patogen lemah (Semangun 2007). Perbedaan ini dimungkinkan akibat perbedaan isolat Botryodiplodia sp. yang digunakan baik dari segi jenis maupun strain cendawan tersebut.
Gejala penyakit pada tanaman merupakan bentuk penyimpangan baik morfologi atau fisiologi sebagai respon dari adanya gangguan patogen (Widyastuti et al. 2005). Respon tanaman terhadap suatu penyakit bergantung pada jenis tanaman inang dan patogennya. Penyakit mati pucuk memiliki gejala yang relatif sama pada beberapa jenis tanaman inang, yaitu berupa matinya bagian ujung tanaman. Sebagai contoh, gejala penyakit mati pucuk pada tanaman mangga yaitu berupa matinya bagian ranting, daun menggulung dan mengering yang diikuti gugur daun (Khanzada et al. 2004), kemudian pada tanaman ash (Fraxinus spp.) berupa nekrosis pada daun yang diikuti layu (Kräutler & Kirisits 2012). Gejala mati pucuk pada bibit jabon juga dapat diawali dengan adanya kerutan pada bagian batang. Menurut Aisah (2014), gejala yang muncul setelah tanaman jabon diinokulasi adalah berupa nekrosis pada titik inokulasi. Nekrosis selanjutnya menyebar ke bagian lain sehingga bagian yang terinfeksi akan terlihat berwarna kecoklatan. Penyakit yang terus berkembang akan menyebabkan bagian atas tanaman terkulai dan kering. Inokulasi isolat Botryodiplodia sp. pada bagian batang menimbulkan gejala nekrosis setelah masa inkubasi 2 sampai 3 hari. Nekrosis yang cepat berkembang ke bagian atas tanaman, menyebabkan batang bagian atas dan daun menjadi berwarna kecoklatan dan selanjutnya mati. Nekrosis yang tidak berkembang umumnya hanya mengalami perubahan warna dari coklat menjadi coklat kehitaman dengan arah penyebaran melintang.
Pembahasan
Antagonis In vitro Metode Langsung
Pertumbuhan Botryodiplodia sp. dan agens hayatinya pada media PDA memiliki dinamika yang teratur daripada media Czapex Agar. Alam et al. (2001) melaporkan bahwa kecepatan pertumbuhan radial miselium B. theobromae menurun seiring dengan bertambahnya kadar glukosa pada media kultur. Pengaruh nutrisi tersebut juga terlihat pada ketebalan miselia cendawan patogen maupun agens hayati (Gambar 8). Miselia yang tumbuh di media PDA lebih tebal dibandingkan miselia yang tumbuh di media Czapex Agar. Achmad (1997) menyatakan bahwa PDA merupakan media kultur yang paling kaya kandungan nutrisinya.
Menurut Baker dan Cook (1974), terdapat tiga pola antagonis yaitu kompetisi, antibiosis, dan mikoparasit. Mekanisme yang terjadi antara kedua jenis antagonis yaitu T. harzianum dan Gliocladium sp. terhadap Botryodiplodia sp. adalah kompetisi dan mikoparasit. Hasil uji antagonis antara kedua antagonis dan Botryodiplodia sp. diduga terdapat mekanisme kompetisi dan mikoparasit.
pertumbuhan yang sama cepatnya. Hal ini menyebabkan adanya persaingan tumbuh sehingga terjadi penghambatan pertumbuhan koloni. Hal ini sama dengan mekanisme penghambatan T. harzianum dan Gliocladium sp. terhadap Cylindrocladium sp. dimana terjadi kompetisi antara agens hayati dan patogen (Amalia et al. 2008). Kompetisi merupakan mekanisme yang terjadi bila terdapat persaingan mendapatkan faktor tumbuh baik berupa ruang dan nutrisi antara patogen dan antagonis. Agens hayati T. harzianum, Gliocladium sp., dan patogen Botryodiplodia sp. memiliki kecepatan tumbuh yang sama yaitu dalam waktu 48-72 jam mampu memenuhi cawan berdiameter 9 cm. Hal ini sangat memungkinkan terjadinya kompetisi. Mekanisme mikoparasit terjadi apabila cendawan mampu memproduksi enzim ektraselular untuk merusak dinding sel cendawan lain yang kemudian digunakan sebagai sumber makanan.
Agens hayati T. harzianum mempunyai kemampuan untuk menghasilkan enzim hidrolitik β-1,3-glukanase, kitinase, dan selulase. Enzim-enzim inilah yang secara aktif merusak sel-sel cendawan lain yang sebagian besar tersusun dari 1,3-glukan (linamirin) dan kitin sehingga dengan mudah T. harzianum dapat melakukan penetrasi ke dalam hifa cendawan inangnya (Elad et al. 1983). Degradasi kitin T. harzianum dilakukan secara bertahap menunjukkan bahwa kitinase dihasilkan secara terus-menerus (Achmad 1997). Hal ini terjadi pula pada antagonisme antara T. reesei terhadap Fusarium sp. (Harjono et al. 2001), T. reeseei dan T. harzianum terhadap R. solani (Widyastuti et al. 2006), Trichoderma spp. terhadap S. rolfsii pada tusam (Widyastuti et al. 2003), Fusarium sp. pada cendana (Widyastuti & Hariani 2006 dalam Widyastuti 2007), Gliocladium sp. terhadap Ganoderma boninense (Hadiwiyono 1996; Sinaga et al. 2001), Cylindrocladium sp. penyebab penyakit lodoh pada bibit Acacia mangium Wild. (Anggraeni et al. 2009), Gliocladium fimbriatum terhadap Marasmius palmivorus Sharples penyebab busuk buah tandan kelapa sawit (Sitompul 2013), dan T. harzianum dan Gliocladium virens terhadap B. theobromae dan Phytophthora citrophthora penyebab busuk pangkal batang jeruk (Retnosari 2011). Selain itu, Gupta et al. (1999) menyatakan bahwa sebagian besar mekanisme antagonis terhadap B. theobromae oleh Trichoderma spp., Gliocladium sp. dan Laetisaria sp. adalah mikoparasit.
22
(Nugroho 2006). Interaksi lain yang terjadi pada mekanisme mikoparasit oleh T. harzianum (Elad et al. 1983) dan T. reeseei (Widyastuti et al. 1998) yaitu kemampuan hifanya untuk membelit dan melubangi hifa cendawan inangnya. Selain itu, pada kontak pertama dengan antagonis mampu menginduksi enzim endokitinase yang dihasilkan Trichoderma spp. (Carsolio 1994).
Antagonisme dengan Metode Tak Langsung
Beberapa mekanisme biokontrol telah diidentifikasi pada pengendalian hayati, yaitu mikoparasitisme yang melibatkan enzim pendegradasi dinding sel, kompetisi nutrisi, produksi metabolit sekunder yang bertindak sebagai antibakteri atau antijamur, dan produksi metabolit yang dapat menginduksi ketahanan tanaman (Punja & Utkhede 2003; Harman 2006; Shoresh et al. 2010 dalam Widyastuti 2007). Pemodelan dan studi penelitian telah menunjukkan bahwa pengendalian hayati yang efektif harus mampu melakukan lebih dari satu mekanisme biokontrol (Xu et al. 2011). Mekanisme mikoparasitisme pada Trichoderma spp. belum diketahui secara lengkap namun ekspresi enzim ekstraseluler pengurai dinding sel terbukti memiliki peranan kunci dalam proses penghambatan patogen. Enzim ekstraseluler yang dikeluarkan dapat berupa enzim-enzim kitinase. Hal tersebut diperkuat dengan pernyataan Achmad et al. (2010) bahwa T. harzianum dan T. pseudokoningii mampu menekan pertumbuhan R. solani dan F. oxysporum melalui mekanisme mikoparasitisme dengan memproduksi enzim kitinase. Menurut Lewis & Papavizas (1984), Trichoderma sp. menghasilkan sejumlah besar enzim ekstraseluler β-1,3-glukonase dan kitinase selama tumbuh aktif yang dapat melarutkan dinding sel patogen. Trichoderma spp. memiliki enzim endokitinase yang merupakan tipe enzim kitinase yang mempunyai aktivitas lisis dan antifungi yang tertinggi (Lorito et al. 1996 dalam Widyastuti 2007). Elad et al. (1983) menyatakan bahwa T. harzianum dan T. hamatum mampu menghasilkan enzim kitinase dan β-1,3-glukanase yang sinergis dalam lisis dinding sel dari S. rolfsii dan R. solani sehingga dapat menghambat pertumbuhan kedua patogen tersebut.
Gliocladium sp. merupakan cendawan saprofitik yang dapat berperan sebagai antagonis efektif untuk mengendalikan patogen tanaman, terutama patogen tanah. Beberapa metabolit sekunder yang dihasilkan Gliocladium sp. antara lain gliotoksin, viridian, dan paraquinon yang bersifat fungitoksik terhadap patogen (Roseline 2000). Beberapa laporan menyebutkan bahwa Trichoderma sp. dan Gliocladium sp. mampu menghambat pertumbuhan patogen antara lain Cylindrocladium sp. (Amalia et al. 2008) dan Phytium sp. (Octriana 2011). Beberapa spesies Gliocladium juga memproduksi siklik peptida dengan sifat antibakteri, seperti diketopiperazine (Koolen et al. 2011). Senyawa lain yang memiliki kemampuan menghasilkan antibiotik dari beberapa spesies Gliocladium lainnya termasuk p-terphenyl (Guo et al. 2007) dan poliketida (Kohno et al. 2000). Antibiotik menghambat Erwinia carotovora diproduksi oleh Gliocladium sp. TNC73 lebih cenderung menjadi bentuk diketopiperazine atau bentuk peptida siklik lainnya, terphenyl atau poliketida, daripada peptaibol linier. Selain itu, Gliocladium sp. memproduksi kitinase dan menghasilkan metabolit sekunder yang memiliki sifat antibakteri terhadap bakteri gram positif Bacillus subtilis dan Staphylococcus aeureus. Eksplorasi kemampuan Gliocladium sp. TNC73 dalam mengelola penyakit tanaman yang disebabkan oleh bakteri dilakukan dengan
mengekstrak etil asetat dari media fermentasi Gliocladium sp. TNC73. Ekstrak tersebut dianalisis kemampuannya untuk menghambat bakteri gram negatif E. carotovora. Patogen E. carotovora merupakan bakteri yang menyebabkan penyakit busuk lunak pada tanaman pangan (Saputra et al. 2013).
Analisis Pyrolisis Gass Chromatography Mass Spectrometry (Py-GC-MS) Filtrat Agens Hayati
Pirolisis kromatografi gas spektrometri digunakan untuk mengetahui karakteristik dari makromolekuler volatil dan kompleks di dalam berbagai materi alam. Contoh yang digunakan untuk analisis Py-GC-MS berupa filtrat antagonis yang sebelumnya dibiakkan di dalam PDB. Asam asetat adalah senyawa yang sangat berperan sebagai antimikroba. Peranannya semakin meningkat apabila terdapat asam asetat yang disertai senyawa fenol (Darmadji 1995). Irganox 1076 merupakan senyawa yang berperan sebagai antioksidan yang biasa digunakan untuk pengawetan kayu (Mabicka et al. 2005).
Selain fenol, senyawa aldehida, aseton dan keton pada produk asap pengarangan kayu juga memiliki daya bakteriostatik dan bakteriosidal. Salah satu komponen kimia yang terkandung dalam cuka kayu yaitu fenol, di mana dalam kehidupan sehari-hari fenol dan turunannya dapat digunakan untuk bahan desinfektan dan inhibitor (Yatagai 2002; Nurhayati 2009). Komponen kimia lainnya adalah asam propionat yang berfungsi sebagai pencegah jamur dan pengawet untuk ikan (Metia 2010). Kandungan asam mudah menguap dalam asap cair akan menurunkan pH, sehingga dapat memperlambat pertumbuhan mikroorganisme (Buckle 1985). Fenol selain bersifat bakteriosidal juga sebagai
antioksidan. Mekanisme pengendalian patogen oleh Trichoderma harzianum
secara alamiah dapat dikelompokan menjadi tiga fenomena dasar yang bekerja simultan dan sekaligus (Suwahyono & Wahyudi 2004). Antibiosis agensia aktif fungisida selain menghasilkan enzim dinding sel jamur juga menghasilkan senyawa antibiotik yang termasuk kelompok furanon yang dapat menghambat pertumbuhan spora dan hifa jamur patogen. Beberapa spesies Gliocladium telah dilaporkan dapat menghasilkan antiamoebin peptaibol (Shenkarev et al. 2013). Peptaibol adalah antibiotik peptida linier yang memiliki sejumlah besar asam amino non-proteinogenic atau asam lipoamino, memiliki N-terminus yang terasilasi, dan C-terminus dengan kelompok alkohol (Kubicek et al. 2007). Peptaibols dapat diekstraksi dalam MeOH atau etil asetat. TLC tes peptaibols memberikan bintik-bintik merah dilihat di bawah cahaya tampak normal ketika disemprot dengan 0.5% p-anisaldehida (Berg et al. 2003; Chutrakul et al. 2008). Dalam penelitian ini, kedua ekstrak A dan B mengandung senyawa yang memberikan titik merah ketika disemprot dengan 0.5% p-anisaldehida, memiliki Rf 0.92 dalam tes TLC. Senyawa ini bisa menjadi peptaibol kandidat. Namun peptaibols menghambat hanya bakteri gram positif (Xiao-Yan et al. 2006), sehingga jika senyawa dengan Rf 0.92 adalah peptaibol, itu tidak akan menjadi antibiotik menghambat E. carotovora. Perlindungan tanaman oleh peptaibols terhadap bakteri gram negatif berasal lebih dari kemampuannya untuk menginduksi respon pertahanan tanaman (Viterbo et al. 2007).
24
siklik dan ekor hidrofobik dilaporkan sebagai inhibitor E. amylovora dan E. carotovora. (Niu et al. 2013)
Evaluasi Antagonisme secara In vivo
Antagonisme secara in vivo menunjukkan kemampuan penghambatan agens hayati terhadap patogen pada tanaman yang menjadi inangnya. Agen hayati T. harzianum menghasilkan penghambatan terbaik pada tahap in vitro. Hal ini dikonfirmasi pada penelitian in vivo dengan menyertakan pula Gliocladium sp.. Ada kemungkinan Gliocladium sp. pada tahap in vivo juga memiliki kemampuan penghambatan yang baik dikarenakan telah berada pada kondisi ekologinya. Penelitian ini mengungkap bahwa penghambatan agens hayati mampu memberikan hasil terbaik bila diinokulasikan terlebih dahulu sebelum patogen. Gliocladium sp. dan T. harzianum memiliki kemampuan yang sama yaitu mampu menghambat Botryodiplodia sp. sebesar 100% apabila diaplikasikan sebagai tindakan pencegahan. Kontrol 1 dan Kontrol 2, memiliki tingkat kejadian yang sama yaitu 100%. Hal ini menginisiasikan bahwa Botryodiplodia sp. dapat menyerang bibit jabon melalui pelukaan maupun penetrasi langsung senada dengan yang dinyatakan oleh Aisah (2014). Sebelumnya, Botryodiplodia sp. dianggap sebagai patogen lemah (Semangun 2007). Perbedaan ini dimungkinkan akibat perbedaan isolat Botryodiplodia sp. yang digunakan baik dari segi jenis maupun strainnya. Mikroorganisme tersebut menghasilkan enzim ekstraseluler selulase yang sangat tinggi yang berguna untuk memisahkan selulosa dari lignoselulosa, kemudiaan dirombak menjadi senyawa sederhana yang larut dalam air (Chanchampee et al. 1999). Chang et al. (1986) melaporkan bahwa T. harzianum dapat merangsang pertumbuhan beberapa tanaman hortikultura. Penelitian Suwahyono (2004) bahwa pemberian T. harzianum mampu meningkatkan jumlah akar dan daun menjadi lebar, serta aplikasi T. harzianum pada tanaman alpukat yang terserang penyakit setelah beberapa minggu muncul pucuk daun yang baru. Adanya T. harzianum dalam kompos aktif merangsang pembentukan akar lateral. Cendawan T. harzianum mengeluarkan zat aktif semacam hormon auksin yang merangsang pembentukan akar lateral (Suwahyono 2004). Cendawan T. harzianum memberikan pengaruh positif terhadap perakaran tanaman, pertumbuhan tanaman, hasil produksi tanaman. Sifat ini menandakan bahwa juga T. harzianum berperan sebagai Plant Growth Enhancer. Hasil
Penelitian Herlina et al. (2003) menunjukkan pemberian kompos aktif T. harzianum berpengaruh terhadap pertumbuhan akar primer, berat kering
SIMPULAN DAN SARAN
Simpulan
Agens hayati T. harzianum dan Gliocladium sp. mampu secara efektif menghambat pertumbuhan Botryodiplodia sp. secara in vitro dengan metode uji ganda pada media PDA berturut-turut 99.2% dan 86.4%. Kemampuan penghambatan secara in vitro yang terbaik ditunjukkan oleh T. harzianum. Cendawan T. harzianum dan Gliocladium sp. menunjukkan penghambatan yang efektif yaitu 100% terhadap Botryodiplodia sp. bila diterapkan sebagai tindakan pencegahan. Mekanisme penghambatan yang dilakukan oleh kedua agens hayati diduga merupakan antibiosis, kompetisi, dan mikoparasit.
Saran
26
DAFTAR PUSTAKA
Abadi AL. 1987. Biologi Ganoderma boninense PAT. pada kelapa sawit (Elaeis guineensis Jacq.) dan pengaruh beberapa mikroba tanah antagonistik terhadap pertumbuhannya [disertasi]. Bogor (ID): Institut Pertanian Bogor. Abdollahzadeh J, Javadi A, Goltapeh EM, Zare R, Phillips AJL. 2010. Phylogeny
and morphology of four new spesies of Lasiodiplodia from Iran. Persoonia [internet]. 25: 1-10. Tersedia pada: http://scolaris.beta. semantico.com/media//data/0a/37/_extracted/Persoonia_2010_Dec_27_25_ 1-10/per-25-1.pdf.DOI: 10.3767/003158510X524150.
Achmad. 1997. Mekanisme serangan patogen dan ketahanan inang serta pengendalian hayati penyakit lodoh pada Pinus merkusii [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Achmad, Hadi, S Harran, E Gumbira Sa’id, B Satiawiharja, MK Kardin. 2010. Aktivitas antagonisme in vitro Trichoderma harzianum dan Trichoderma pseudokoningii terhadap patogen lodoh Pinus merkusii. J Penelitian Hut Tan. 7(5):233-240.
Adiningsih SH. 2014. Uji antagonis Trichoderma harzianum terhadap
Botryodiplodia sp. penyebab penyakit mati pucuk pada abon (Anthocephalus cadamba) secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Agrios GN. 2005. Plant Pathology. 5th Ed. New York (US): Elsevier Academic Pr.
Ahmad I, Khan RA, Siddiqui MT. 2012. Incidence of dieback disease following fungal inoculations of sexually and asexually propagated shisham (Dalbergia sissoo). For Path [internet]. Ters