IDENTIFIKASI DAN PATOGENISITAS CENDAWAN
PENYEBAB PRIMER PENYAKIT MATI PUCUK PADA
BIBIT JABON (Anthocephalus cadamba (Roxb.) Miq)
AI ROSAH AISAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Identifikasi dan Patogenisitas Cendawan Penyebab Primer Penyakit Mati Pucuk pada Bibit Jabon (Anthocephalus cadamba (Roxb.) Miq) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
AI ROSAH AISAH. Identifikasi dan Patogenisitas Cendawan Penyebab Primer Penyakit Mati Pucuk pada Bibit Jabon (Anthocephalus cadamba (Roxb.) Miq). Dibimbing oleh BONNY PW SOEKARNO dan ACHMAD.
Jabon (Anthocephalus cadamba (Roxb.) Miq) merupakan tanaman asli Indonesia yang saat ini banyak diminati masyarakat karena dapat memberi keuntungan, baik secara ekonomi maupun ekologi. Seiring dengan pengembangan dan budidayanya, permintaan pasar terhadap jabon akan mengalami peningkatan. Usaha pembibitan jabon berpotensi menghadapi gangguan penyakit di areal persemaian. Hal ini dikarenakan bibit yang tersedia di areal persemaian berpotensi menjadi inang bagi patogen dan kondisi bibit yang masih sukulen relatif rentan terhadap gangguan penyakit. Gejala penyakit yang sering ditemui di areal pembibitan jabon dan berpotensi menyebabkan kematian bibit adalah mati pucuk. Penelitian dilakukan dengan tujuan mengisolasi dan mengidentifikasi cendawan penyebab mati pucuk pada bibit jabon, menentukan penyebab primer penyakit mati pucuk dan menguji tingkat virulensi isolat patogen penyebab primer tersebut, serta mempelajari mekanisme infeksi patogen terhadap inang dan mekanisme pertahanan inang terhadap infeksi patogen. Penelitian terdiri atas pengamatan gejala dan pengambilan tanaman contoh sakit dari lokasi persemaian, isolasi dan identifikasi cendawan, uji patogenisitas isolat cendawan, analisis aktivitas pektinase dan selulase yang dihasilkan cendawan patogen, dan analisis aktivitas peroksidase pada tanaman jabon.
18.131 sampai 26.083 U ml-1, sedangkan selulase sebesar 0.014 sampai 0.023 U ml-1. Adapun mekanisme pertahanan tanaman jabon terhadap infeksi patogen salah satunya dilakukan dengan cara menghasilkan peroksidase yang berperan dalam proses lignifikasi dan pembentukan senyawa metabolit sekunder. Aktivitas peroksidase yang terdeteksi pada tanaman jabon setelah inokulasi patogen yaitu berkisar 0.0006 sampai 0.0012 UAE g-1.
Cendawan Botryodiplodia spp. diduga sebagai penyebab penyakit mati pucuk pada bibit jabon dan mampu menimbulkan tingkat keparahan penyakit yang berbeda pada bibit jabon bergantung pada tingkat virulensinya. Isolat Botryodiplodia spp. dapat melakukan penetrasi secara aktif dan pasif, dan mekanisme infeksi salah satunya dilakukan melalui sekresi enzim. Adapun mekanisme pertahanan jabon terhadap infeksi patogen ditunjukkan melalui aktivitas peroksidase.
SUMMARY
AI ROSAH AISAH. Identification and Pathogenicity of Primary Fungi Causing Dieback Disease on Jabon Seedlings (Anthocephalus cadamba (Roxb.) Miq). Supervised by BONNY PW SOEKARNO and ACHMAD.
Jabon (Anthocephalus cadamba (Roxb.) Miq) is indigenous plant of Indonesia which is currently attracted by many people due to able provide benefits, both economical and ecological. Along with its development and cultivation, the market demand of jabon will get increase. Propagation of jabon potentially facing diseases disorders in the nursery area. This is because of available seedlings in the nursery area have the potential to be a host for the pathogens and the succulent seedling conditions are relatively vulnerable to disease attacks. The disease symptoms are often found in the jabon nursery areas and potentially leading to death of seedlings are dieback diseases.
This study was conducted with the aim to isolate and identify the fungal pathogen cause of dieback diseases on jabon seedlings, determine the primary cause of dieback diseases and test the virulence levels of those isolates, and to study the mechanisms of pathogen infection and host defense mechanisms to against pathogens. The study consisted of the observation of symptoms and sampling diseased plants from the nursery locations, isolation and identification of fungi, pathogenicity assay of fungal isolates, analysis of pectinase and cellulase activities produced by fungal pathogens, and analysis of peroxidase activity on jabon.
performed by produce peroxidase which plays role of lignification process and secondary metabolite compound formation. Peroxidase activity detectable on the jabon plants after pathogen inoculation was ranging from 0.0006 to 0.0012 UAE g-1.
Botryodiplodia spp. was suspected as the cause of dieback disease on jabon seedlings and able to cause different levels of disease severity on jabon seedlings depend on its virulence level. Botryodiplodia spp. isolates could perform active and passive penetrations, and one of the mechanisms of infection was done through enzyme secretions. As for defense mechanisms of jabon against pathogen infection were demonstrated through peroxidase activity.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
IDENTIFIKASI DAN PATOGENISITAS CENDAWAN
PENYEBAB PRIMER PENYAKIT MATI PUCUK PADA
BIBIT JABON (Anthocephalus cadamba (Roxb.) Miq)
AI ROSAH AISAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi dan Patogenisitas Cendawan Penyebab Primer Penyakit Mati Pucuk pada Bibit Jabon (Anthocephalus cadamba (Roxb.) Miq)
Nama : Ai Rosah Aisah NIM : A352100041
Disetujui oleh Komisi Pembimbing
Dr Ir Bonny PW Soekarno, MS Prof Dr Ir Achmad, MS Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Fitopatolgi
Dr Ir Sri Hendrastuti Hidayat, MSc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis dengan judul “Identifikasi dan Patogenisitas Cendawan Penyebab Primer Penyakit Mati Pucuk pada Bibit Jabon (Anthocephalus cadamba (Roxb.) Miq)” dapat diselesaikan.
Penghargaan dan terima kasih penulis ucapkan kepada Dr Ir Bonny PW Soekarno, MS dan Prof Dr Ir Achmad, MS selaku komisi pembimbing atas bimbingan, masukan, arahan, dan nasihat selama proses penelitian sampai penulisan tesis. Selain itu, terima kasih penulis sampaikan kepada Dr Ir Abdul Munif, MScAgr selaku penguji luar komisi atas masukan dan saran dalam penulisan hasil penelitian ini. Ungkapan terima kasih juga disampaikan kepada seluruh staf dan rekan-rekan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian IPB dan Laboratorium Penyakit Hutan, Departemen Silvikultur, Fakultas Kehutanan IPB atas segala bantuan, masukan, dan dukungan selama penyelesaian penelitian dan penulisan karya ilmiah ini. Ucapan terima kasih tidak lupa penulis ucapkan kepada Mba Pepi dan Pak Eter atas bantuan yang diberikan selama penelitian.
Rasa hormat dan terima kasih yang tulus penulis sampaikan kepada kedua orang tua tercinta atas segala dorongan, doa dan kasih sayang yang diberikan kepada penulis. Terima kasih juga penulis ucapkan kepada teman-teman Fitopatologi angakatan 2010 dan rekan-rekan Wisma Mardiyah yang senantiasa memberi semangat dari awal hingga akhir penelitian.
Semoga tulisan ini dapat memberi manfaat bagi penulis dan yang memerlukan.
DAFTAR ISI
Jabon (Anthocephalus cadamba (Roxb.) Miq) 4
Deskripsi Umum Pohon 4
Mekanisme Pertahanan Inang terhadap Penyakit 8 3 BAHAN DAN METODE
Waktu dan Tempat 10
Bahan dan Metode 10
Pengamatan Gejala dan Pengambilan Tanaman Jabon Contoh 11 Isolasi Cendawan dari Jaringan Tanaman Sakit 11
Identifikasi Isolat Cendawan 11
Postulat Koch 11
Uji Patogenisitas Isolat Cendawan 12
Analisis Mekanisme Infeksi Cendawan Patogen terhadap
Tanaman Inang 14
Analisis Mekanisme Pertahanan Inang terhadap Infeksi 14 Patogen
4 HASIL DAN PEMBAHASAN
Hasil 16
Gejala Penyakit Mati Pucuk pada Tanaman Jabon 16
Isolasi dan Identifikasi Cendawan 17
Postulat Koch 19
Uji Patogenisitas Isolat Cendawan Botryodiplodia spp. 20 Mekanisme Infeksi Cendawan Patogen terhadap Tanaman
Inang 22
Mekanisme Pertahanan Inang terhadap Infeksi Patogen 23
Pembahasan 23
Gejala Penyakit Mati Pucuk pada Tanaman Jabon 23
Identifikasi Cendawan 25
Uji Patogenisitas Isolat Cendawan Botryodiplodia spp. 29 Mekanisme Infeksi Cendawan Patogen terhadap Tanaman
Inang 30
Mekanisme Pertahanan Inang terhadap Infeksi Patogen 32 5 SIMPULAN DAN SARAN
Simpulan 34
Saran 34
DAFTAR PUSTAKA 35
LAMPIRAN 41
DAFTAR TABEL
1 Skor penyakit mati pucuk pada bibit jabon 14 2 Perolehan isolat cendawan berdasarkan lokasi pengambilan tanaman
contoh jabon yang memperlihatkan gejala mati pucuk 18
DAFTAR GAMBAR
1 Tanaman jabon: a) persemaian, b) lapangan 4
2 Peta penyebaran alami dan introduksi jabon (A. cadamba) 5
3 Urutan kegiatan penelitian 10
4 Skoring keparahan gejala penyakit mati pucuk pada bibit jabon; a) 0 = tanaman tidak bergejala, b-c) 1 = tanaman terlihat layu atau ≤ 25% bagian tanaman mengalami nekrosis; d) 2 = 26-50% bagian tanaman mengalami nekrosis;e) 3 = > 50% bagian tanaman mengalami
nekrosis; dan f) 4 = tanaman mati 13
5 Gejala penyakit mati pucuk pada bibit jabon di lokasi persemaian: a) nekrotik pada batang, (b) nekrotik pada daun, dan (c) batang
mengerut 16
6 Bibit jabon yang terserang penyakit mati pucuk pada beberapa tingkatan umur: a) nekrosis pucuk pada bibit ± 2 bulan, b-d) nekrosis batang dan daun pada bibit ± 3, 4, dan 5 bulan secara berturut-turut 17 7 Penampilan koloni isolat cendawan berdasarkan warna koloni: a) warna putih, b) putih kehitaman, c) putih keunguan, dan d) abu-abu
kehitaman 17
8 Konidia isolat cendawan yang diperoleh dari bibit jabon yang memperlihatkan gejala mati pucuk: a) konidia muda dan konidia matang Botryodiplodia spp., b) makrokonidia Fusarium spp., c) konidia Colletotrichum sp., d) konidia Pestalotiopsis sp., dan
e) konidia Curvularia sp. 18
9 Gejala penyakit pada bibit jabon setelah inokulasi pada tahap postulat Koch: a) Botryodiplodia spp., b) Fusarium spp., c) Colletotrichum
sp., dan d) kontrol 19
10 Persentase kejadian dan keparahan penyakit mati pucuk pada bibit jabon setelah diinokulasi 5 isolat cendawan Botryodiplodia spp. 21 11 Gejala nekrosis yang muncul pada bibit jabon setelah inokulasi isolat
Botryodiplodia spp. 22
12 Aktivitas pektinase (A) dan selulase (B) 3 isolat Botryodiplodia spp. setelah 2 minggu masa inkubasi pada media CMS 22 13 Aktivitas peroksidase bibit jabon setelah diinokulasi 5 isolat
Botryodiplodia spp. dan kontrol 23
DAFTAR LAMPIRAN
1 Bibit jabon yang digunakan sebagai tanaman contoh dalam tahap isolasi 42 2 Kondisi penyakit mati pucuk pada tanaman jabon di 5 lokasi persemaian 43 3 Karakter morfologi isolat-isolat cendawan yang diperoleh dari bibit
jabon yang mengalami mati pucuk 44
4 Gejala mati pucuk pada bibit jabon setelah diinokulasi lima isolat Botryodiplodia spp.: a) isolat A1, b) isolat A5, c) isolat E2, d) isolat E4,
e) isolat B2, dan f) kontrol 50
5 Hasil analisis sidik ragam dan uji lanjut Duncan kejadian penyakit mati pucuk pada bibit jabon setelah diinokulasi isolat Botryodiplodia spp. 51 6 Hasil analisis sidik ragam dan uji lanjut Duncan keparahan penyakit mati pucuk pada bibit jabon setelah diinokulasi isolat
Botryodiplodia spp. 52
7 Gejala kehitaman pada bagian dalam batang bibit jabon yang telah
berkayu 53
1
PENDAHULUAN
Latar Belakang
Jabon (Anthocephalus cadamba (Roxb.) Miq) merupakan tanaman asli Indonesia yang saat ini tengah dikembangkan dan dibudidayakan. Tanaman ini mulai diminati masyarakat atau perusahaan karena memiliki banyak keunggulan, seperti penyebaran yang luas, pertumbuhan yang cepat, pemeliharaan mudah, prospek pemasaran cukup tinggi, dan dapat tumbuh pada berbagai tipe tanah. Berdasarkan keunggulan-keunggulan tersebut jabon dapat ditanam sebagai bahan investasi atau usaha konservasi lingkungan.
Jabon sebagai bahan investasi dapat ditanam di areal hutan rakyat untuk memperoleh hasil berupa kayu. Karena jabon termasuk jenis cepat tumbuh, maka daur hidupnya pendek. Sudarmo (1957) dalam Krisnawati et al. (2011) menyatakan bahwa jabon memiliki riap diameter rata-rata 1.2 sampai 11.6 cm tahun-1 dengan riap tinggi rata-rata 0.8 sampai 7.9 m tahun-1. Kondisi tersebut memungkinkan jabon dapat dipanen pada umur 6 tahun. Kayu jabon yang diperoleh dapat digunakan sebagai bahan baku industri, seperti industri pulp dan kertas, korek api, dan kayu lapis. Hal ini menunjukkan bahwa jabon memiliki nilai ekonomi tinggi. Herusansono dan Wahono (2011) menyatakan bahwa harga kayu jabon siap panen bisa mencapai 1.2 sampai 1.4 juta m-3.
Selain dapat dijadikan bahan investasi, jabon juga dapat digunakan untuk konservasi lingkungan, misalnya kegiatan penghijauan atau reklamasi areal bekas tambang. Penanaman jabon di areal bekas tambang telah dicoba, contohnya di pertambangan batubara PT Kaltim Prima Coal yang memiliki persen tumbuh bibit sebesar 85 sampai 100% (Safriati 2012). Kemudian hasil penelitian Setyaningsih (2012) menunjukkan bahwa semai jabon bersifat toleran menengah terhadap logam berat timbal yang terdapat dalam limbah kegiatan pertambangan.
Seiring dengan pengembangan dan budidayanya, permintaan pasar terhadap jabon akan mengalami peningkatan. Oleh sebab itu, usaha pembibitan jabon telah banyak dilakukan, baik dalam skala kecil maupun besar. Sejauh ini, usaha pembibitan jabon belum menghadapi kendala yang berarti. Namun, usaha ini tetap berpotensi menghadapi kendala berupa gangguan penyakit di areal persemaian. Hal ini dapat terjadi karena bibit jabon yang tersedia di areal persemaian berpotensi menjadi inang bagi patogen dan kondisi bibit yang masih sukulen relatif rentan terhadap gangguan penyakit.
2009) dan mati pucuk yang disebabkan Rhizoctonia solani Kuhn. (Rahman et al. 1997).
Penyakit mati pucuk dapat terjadi pada banyak tanaman dan disebabkan oleh satu atau beberapa cendawan patogen. Sebagai contoh, penyakit mati pucuk pada mangga (Mangifera indica L.) disebabkan oleh Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (Khanzada et al. 2004), pada tanaman shisham (Dalbergia sissoo Roxb.) disebabkan oleh Botryodiplodia theobromae Pat., Fusarium solani(Mart.) Sacc., F. oxysporum Schlecht.,R. solani, danCurvularia lunata (Wakker) Boedijn. (Ahmad et al. 2012), dan pada akasia (Acacia koa A. Gray) disebabkan oleh F. oxysporum f. sp. koae (Anderson et al. 2002). Penyakit mati pucuk dapat menyebabkan gugur daun (Ahmad et al. 2012), layu (Muehlbach et al. 2010), dan kematian tanaman (Khanzada et al. 2004).
Penyakit mati pucuk pada bibit jabon berpotensi menimbulkan masalah serius, karena selain dapat menimbulkan kerusakan pada berbagai tingkatan umur bibit jabon, penyakit ini juga berpotensi menyebabkan kematian pada bibit. Karena gangguan penyakit mati pucuk pada bibit jabon belum banyak dilaporkan, maka perlu dilakukan studi lebih lanjut untuk mengidentifikasi dan menguji patogenisitas agen penyebab penyakit. Informasi yang diperoleh dari kegiatan identifikasi dan uji patogenisitas dapat digunakan untuk menentukan tindakan pengendalian. Oleh karena itu, dalam penelitian ini dilakukan pengamatan gejala penyakit mati pucuk, isolasi dan identifikasi patogen, postulat Koch, uji patogenisitas isolat cendawan, dan mempelajari mekanisme infeksi patogen serta mekanisme pertahanan inang.
Perumusan Masalah
Gangguan penyakit di areal persemaian merupakan salah satu kendala yang umum dihadapi dalam usaha regenerasi tanaman hutan. Hal ini dikarenakan gangguan penyakit dapat mengurangi kualitas maupun kuantitas bibit. Contoh penyakit yang umum mengganggu tanaman di areal persemaian adalah layu, rebah kecambah, bercak dan hawar daun, busuk akar, serta mati pucuk. Penyakit tersebut dapat mengganggu pertumbuhan tanaman atau bahkan menyebabkan kematian.
Penyakit mati pucuk pada tanaman jabon dapat menyebabkan kematian terhadap bibit. Kondisi ini berpotensi menghambat usaha penyediaan bibit jabon yang saat ini tengah banyak diminati masyarakat. Penyakit mati pucuk dapat berasosiasi dengan beberapa macam cendawan patogen, sedangkan informasi mengenai serangan penyakit mati pucuk pada bibit jabon belum banyak diketahui. Hal ini dikarenakan tanaman jabon baru dikembangkan dan dibudidayakan secara luas di Indonesia. Karena informasi tersebut masih kurang, maka dalam penelitian ini dilakukan identifikasi dan uji patogenisitas terhadap agen penyebab penyakit mati pucuk pada bibit jabon.
Tujuan Penelitian
1 Mengisolasi dan mengidentifikasi cendawan penyebab penyakit mati pucuk pada bibit jabon
2 Menentukan penyebab primer penyakit mati pucuk pada bibit jabon dengan metode postulat Koch serta menentukan tingkat virulensi isolat tersebut melalui uji patogenisitas
3 Mempelajari mekanisme infeksi patogen terhadap inang dan mekanisme pertahanan inang terhadap infeksi patogen
Manfaat Penelitian
2
TINJAUAN PUSTAKA
Jabon (Anthocephalus cadamba (Roxb.) Miq)
Deskripsi Umum Pohon
Jabon merupakan salah satu jenis tanaman yang memiliki prospek tinggi untuk dikembangkan di hutan tanaman industri dan digunakan sebagai tanaman penghijauan. Hal ini dikarenakan karakteristik yang dimilikinya, yaitu pertumbuhannya cepat, mampu beradaptasi pada berbagai kondisi tempat tumbuh, dan perlakuan silvikultur yang relatif mudah. Jenis ini diharapkan dapat menjadi komoditas penting bagi industri perkayuan di masa yang akan datang, terutama ketika bahan baku kayu dari hutan alam akan semakin berkurang (Krisnawati et al. 2011).
Jabon termasuk jenis tanaman pionir yang dapat membentuk kelompok hutan alam murni pada tempat yang bebas persaingan cahaya. Perbanyakan jabon dapat dilakukan melalui biji atau stek. Biji yang digunakan sebagai benih, perlu disemaikan terlebih dahulu dalam bak kecambah. Semai yang telah mencapai ukuran tinggi 3 cm dapat dipindah ke bedeng penyapihan. Setelah mencapai tinggi 20 sampai 30 cm, semai dapat ditanam di lapangan pada awal musim hujan (Martawijaya et al. 1981).
Secara umum, jabon tumbuh pada tanah aluvial, liat, lempung podsolik coklat, dan tanah tuf halus. Kisaran suhu maksimum untuk pertumbuhan jabon yaitu 32 sampai 42 °C, sedangkan kisaran suhu minimum yaitu 3 sampai 15.5 °C. Jabon dapat tumbuh pada daerah kering dengan curah hujan tahunan paling sedikit 200 mm, sedangkan pada habitat alaminya rata-rata curah hujan tahunan berkisar antara 1500 sampai dengan 5000 mm (Martawijaya et al. 1981; Krisnawati et al. 2011).
Penyebaran Alami
Menurut Orwa et al. (2009), spesies A. cadamba tersebar di beberapa negara, yaitu Australia, India, Cina, Indonesia, Malaysia, Papua Nugini, Filipina, Singapura, dan Vietnam. Jenis ini sudah diintroduksi ke beberapa negara, yaitu seperti Costa Rica, Puerto Rico, Afrika Selatan, Taiwan, dan Venezuela. Adapun sebaran tumbuh di Indonesia menurut Martawijaya et al. (1981), yaitu meliputi seluruh Sumatera, Kalimantan Selatan dan Timur, seluruh Sulawesi, Jawa Timur, Jawa Barat, Nusa Tenggara Barat, dan Papua.
Gambar 2 Peta penyebaran alami dan introduksi jabon (A. cadamba) (Sumber: Orwa et al. 2009)
Klasifikasi Jabon
Tanaman jabon memiliki banyak nama lokal di beberapa negara, di antaranya yaitu common bur-flower (Inggris), kaatoan bangkal (Filipina), kadam (Prancis), kalempayan (Malaysia), jabon (Indonesia), dan takoo (Thailand). Di Indonesia sendiri, jabon memiliki beberapa nama lokal, antara lain hanja, kelampeyan, jabon (Jawa); galupai, kelampai, johan (Sumatera); ilan, kelampayan, taloh (Kalimantan); sugi mania, pekaung, pute (Sulawesi); gumpayan, kelapan, mugawe (NTB); dan aparabire, masarambi (Papua) (Martawijaya et al. 1981; Orwa et al. 2009). Berdasarkan sistem klasifikasi, jabon digolongkan sebagai berikut (Gautam et al. 2012; Soerianegara dan Lemmens 1994):
Kingdom : Plantae
Sub Kingdom : Tracheobionta
Kelas : Asteridae
Ordo : Rubiales
Famili : Rubiaceae
Genus : Neolamarckia F. Bosser
Spesies : Neolamarckia cadamba (Roxb.) Sinonim : Anthocephalus cadamba (Roxb.) Miq
Penyakit pada Tanaman Jabon
Soerianegara dan Lemmens (1994) menyebutkan bahwa penyakit yang mengganggu tanaman jabon yaitu berupa rontoknya sebagian atau seluruh daun dan mati pucuk yang disebabkan oleh Gloeosporium anthocephali. Sementara itu, penyakit yang ditemukan mengganggu jabon di persemaian yaitu bercak daun yang disebabkan oleh Colletotrichum sp. (Anggraeni 2009) dan mati pucuk yang disebabkan oleh Rhizoctonia solani(Rahman et al. 1997).
Anggraeni (2009) menjelaskan bahwa kerusakan akibat penyakit bercak Colletotrichum bergantung pada jenis tanaman inangnya. Apabila tanaman inang rentan, maka tanaman tidak hanya mengalami kerontokan daun tetapi mengalami mati pucuk atau bahkan mati total. Adapun kerugian yang ditimbulkan oleh penyakit mati pucuk pada tanaman jabon belum banyak dilaporkan. Akan tetapi, gangguan penyakit ini pada tanaman lain dapat menurunkan produksi karena tanaman mengalami kematian. Nasution (2010) menyatakan bahwa gangguan penyakit mati pucuk pada tanaman alpukat (Persea americana Mill.) telah menurunkan produksi buah alpukat sebesar 20 sampai 80%.
Gejala dan Penyebab Penyakit Mati Pucuk
Penyakit mati pucuk memiliki gejala berupa nekrotik ekstensif yang dimulai dari bagian ujung tanaman dan berkembang menuju bagian pangkal. Biasanya terjadi secara tiba-tiba dan kerusakan berupa kematian dapat terjadi pada pucuk serta bagian ujung pertumbuhan. Gejala lain dari penyakit ini adalah terjadi perubahan warna daun dari hijau tua menjadi kuning, pengurangan ukuran daun, pengguguran daun, dan gumosis. Penyakit mati pucuk dapat menyerang tanaman kayu dan semak, dan dapat terjadi di area pertanaman atau persemaian (Agrios 2005; Douglas 2009; Ahmad et al. 2012).
Penyakit mati pucuk telah dilaporkan menyebabkan kerusakan terhadap tanaman kayu pada area hutan tanaman di Asia dan Eropa, misalnya tanaman shisham (D. sissoo) di Banglades (Rajput et al. 2008) dan Pakistan (Ahmad et al. 2012), akasia (A. mangium Willd.) di Indonesia (Tarigan et al. 2011), dan ash (Fraxinus excelsior L.) di Eropa (Kräutler dan Kirisits 2012). Sementara itu, penyakit mati pucuk yang menyerang tanaman pada fase semai di antaranya terjadi pada tanaman karet (Hevea brasiliensis Müll. Arg.), jabon (A. cadamba), keora (Sonneratia apetala Buch.-Ham.) (Rahman et al. 1997), dan ash (Kirisits et al. 2012).
Penyakit mati pucuk dapat mengancam usaha produksi kayu karena berpotensi menyebabkan kematian pada tanaman, baik pada fase semai maupun pohon. Anderson et al. (2002) melaporkan bahwa kejadian penyakit mati pucuk pada tanaman akasia (A. koa) di Mauna Loa, Hawaii berkisar antara 66 sampai 86%. Sementara itu, Muehlbach et al. (2010) menyatakan bahwa penyakit mati pucuk pada tanaman shisham sudah dikenal sejak tahun 1993 sebagai ancaman dramatis terhadap hutan dan produksi kayu di India dan sekitarnya.
Gejala mati pucuk umumnya disebabkan oleh parasit-parasit lemah. Infeksi patogen sangat dipengaruhi oleh kondisi tanaman inang. Beberapa patogen
yang dilaporkan menyebabkan gejala mati pucuk yaitu Rhizoctonia spp., F. oxysforum, dan L. theobromae (Semangun 2006; Muehlbach et al. 2010).
umum pada bentuk anamorfnya. Organisme yang termasuk ke dalam spesies kompleks ini umumnya adalah cendawan penghuni tanah dan berisfat patogenik. Cendawan R. solani merupakan spesies yang umum diperoleh dari tanah dan dikenal sebagai patogen tumbuhan yang sangat merusak dan memiliki kisaran inang yang luas (García et al. 2006).
Cendawan R. solani biasanya menginfeksi jaringan tanaman muda sehingga menyebabkan penyakit rebah kecambah. Selain itu, cendawan ini sering menginfeksi bagian daun yang berada di dekat tanah sehingga menyebabkan hawar atau bercak daun. Infeksi Rhizoctonia spp. yang menyebabkan penyakit mati pucuk ditemukan pada tanaman kopi (Coffea sp.) dan jabon (Semangun 2006; Rahman et al. 1997).
Cendawan Fusarium spp. merupakan salah satu patogen yang berasosiasi dengan berbagai gejala penyakit seperti aborsi benih, busuk pada benih, akar, batang dan semai, rebah kecambah, kerdil, layu pembuluh, dan mati pucuk (Bashir dan Tahira 2012). Spesies yang berasosiasi dengan penyakit mati pucuk diantaranya adalah F. solani dan F. oxysporum pada shisham (Ahmad et al. 2012; Muehlbach et al. 2010), dan F. solani dan F. sterilihyphosum Britz, Marasas & MJ Wingf. pada alpukat (Nasution 2010).
Lasiodiplodia sp. merupakan cendawan yang umum, terutama di daerah tropis dan subtropis yang dapat menyebabkan berbagai jenis penyakit pada tanaman. Cendawan L. theobromae merupakan anggota dari Botryosphaeriaceae, dikenal sebagai patogen dengan lebih dari 500 inang (Abdollahzadeh et al. 2010; Ismail et al. 2012). Cendawan ini dilaporkan telah menyebabkan penyakit mati pucuk pada tanaman mangga (Khanzada et al. 2004), shisham (Muehlbach et al. 2010), pir (Prunus sp.) (Shah et al. 2010), karet (Rahman et al. 1997) dan kakao (Theobromae cocoa L.) (Mbenoun et al. 2008).
Mekanisme Infeksi Patogen
Patogen tumbuhan umumnya merupakan mikrooragnisme yang tidak dapat menggunakan kekuatan sendiri untuk menginfeksi inang. Patogen yang dapat menginfeksi atau memenetrasi tanaman inang secara langsung dapat menggunakan kekuatan mekanik. Mekanisme lain yang digunakan patogen untuk menyebabkan penyakit pada tanaman inang adalah kekuatan kimia seperti enzim, toksin, zat pengatur tumbuh, dan polisakarida (Agrios 2005).
Penetrasi secara langsung terhadap tanaman inang di antaranya dapat dilakukan oleh cendawan patogen. Untuk melewati rintangan fisik pada tanaman inang, cendawan membentuk struktur infeksi yang memungkinkan dia untuk memenetrasi dinding sel. Sekresi enzim atau peningkatan tekanan pada struktur infeksi dapat membantu proses penetrasi (Mendgen et al. 1996).
Banyak dari cendawan patogen tumbuhan membentuk apresorium untuk memenetrasi jaringan tanaman. Selama proses penetrasi, apresorium akan menempel dengan kuat pada permukaan inang, kemudian menghasilkan kapak penetrasi untuk menembus kutikula dan dinding sel tanaman. Kebanyakan apresorium dalam proses penetrasi mengandung melanin yang berwarna gelap (Agrios 2005; Huang 2001).
sel dilakukan oleh enzim tertentu. Secara umum, enzim patogenik tumbuhan menghancurkan komponen struktural sel inang, kemudian memecah substansi di dalam sel atau mempengaruhi komponen dari membran dan protoplas. Enzim yang digunakan oleh patogen untuk menginfeksi tanaman inang di antaranya adalah protease, pektinase, selulase, dan ligninase (Semangun 2006; Agrios 2005).
Kebanyak enzim degradatif adalah glikosida hidrolase yang mendegradasi matriks selulosa dan pektat dengan tambahan air untuk memecah ikatan glikosida. Jaringan pektat juga didegradasi oleh polisakarida liase yang memecah ikatan glikosida melalui mekanisme eliminasi ikatan β (Mendgen et al. 1996).
Toksin bertindak langsung dalam protoplas inang hidup dengan cara merusak atau mematikan sel tumbuhan. Toksin dapat bersifat umum atau spesifik. Toksin yang bersifat umum dapat mempengaruhi banyak spesies tumbuhan, sedangkan toksin yang spesifik hanya bersifat toksik terhadap beberapa spesies tumbuhan atau varietas. Toksin merupakan substansi yang sangat beracun dan berfungsi efektif dalam konsentrasi yang sangat rendah (Agrios 2005).
Contoh toksin yang diproduksi oleh cendawan patogen yaitu fusaric acid yang dihasilkan oleh genus Fusarium dan Giberella. Beracunnya fusaric acid terutama karena pengaruhnya terhadap respirasi (Huang 2001).
Zat pengatur tumbuh utama pada tumbuhan yaitu meliputi auksin, giberelin, dan sitokinin. Zat pengatur tumbuh bekerja pada konsentrasi rendah. Selain tumbuhan, patogen tumbuhan juga menghasilkan zat pengatur tumbuh. Patogen ini mungkin menghasilkan zat pengatur tumbuh yang baru dan berbeda. Dengan adanya zat pengatur tumbuh dari patogen, maka sistem hormonal tumbuhan inang menjadi tidak seimbang sehingga menghasilkan pertumbuhan abnormal (Agrios 2005).
Mekanisme Pertahanan Inang terhadap Penyakit
Tumbuhan merupakan objek untuk diinfeksi dan diserang oleh berbagai mikroorganisme patogen dan serangga. Oleh sebab itu, untuk merespon infeksi patogen, tumbuhan mengekspresikan sejumlah mekanisme pertahanan. Tumbuhan secara umum mempertahankan dirinya dari infeksi patogen melalui kombinasi dua sistem pertahanan. Pertama adalah karakteristik struktural yang bertindak sebagai rintangan fisik dan menghambat patogen untuk memasuki jaringan dan menyebar di dalam sel, dan yang ke dua adalah reaksi biokimia yang terjadi di dalam jaringan dan sel tumbuhan, menghasilkan substansi toksik bagi patogen atau menciptakan kondisi yang dapat menghambat pertumbuhan patogen di dalam tanaman (Glazebrook 2005; Agrios 2005).
Bentuk rintangan fisik contohnya adalah kutikula. Struktur ini penting untuk menghambat proses penetrasi patogen yang akan menempel dan mensekresikan enzim pendegradasi kutin. Secara fisik, ketebalan kutikula mungkin dapat mencegah pemunculan sporofor dan mengeluarkan spora. Selain itu, lilin pada kutikula dan daun yang berorientasi vertikal mungkin mencegah terciptanya lapisan yang lembab pada permukaan daun (Guest dan Brown 1997).
dihasilkan patogen menyebabkan tumbuhan inang mengenali patogen. Hal ini akan menginduksi inang untuk menghasilkan ketahanan yang sesuai, atau gen R. Ketahanan yang dimediasi gen R biasanya disertai suatu ledakan oksidatif, yaitu produksi cepat dari spesies oksigen reaktif (Reactive Oxygen Species/ROS). Produski ROS diperlukan untuk respon kematian sel hipersensitif (HR), program kematian sel yang diduga untuk membatasi akses patogen terhadap air dan makanan (Glazebrook 2005).
Menurut Guest dan Brown (1997), kematian sel hipersensitif dalam beberapa kasus dapat mematikan invasi patogen, sedangkan dalam kasus yang lain hanya bersifat fungistatis. Keberhasilan kematian sel hipersensitif sebagai mekanisme pertahanan bergantung pada kebutuhan nutrisi dari patogen, waktu, lokasi, dan besarnya respon inang dalam menghadapi perkembangan patogen.
Tumbuhan inang yang telah terinfeksi akan menghambat patogen untuk berkembang atau menyebar ke jaringan yang lain. Hal ini bisa dilakukan dengan pertahanan histologi seperti membentuk lapisan gabus, lapisan absisi, dan tilose, atau pertahanan biokimia seperti PR (Pathogensis-Related) protein, senyawa fenolik, dan fitoaleksin (Agrios 2005).
PR protein terakumulasi secara lokal di sekeliling jaringan yang terinfeksi dan juga di daerah yang tidak terinfeksi. Produksi PR protein pada bagian tanaman yang tidak terinfeksi dapat mencegah terpengaruhnya tanaman dari infeksi lanjut. Kebanyakan PR protein di dalam sepesies tanaman merupakan asam terlarut, bobot molekul rendah, dan protein tahan protease. PR protein dikatagorikan menjadi 17 famili sesuai sifat dan fungsinya, di antaranya adalah β -1,3- glukanase, kitinase, peroksidase, dan thionin (Ebrahim et al. 2011).
Aktivitas polifenol oksidase, pada umumnya lebih tinggi pada jaringan varietas tahan yang terinfeski dibandingkan dengan jaringan terinfeksi pada tanaman rentan atau tanaman sehat. Pentingnya aktivitas polifenol oksidase dalam ketahanan penyakit memungkinkan batang untuk mengoksidasi senyawa fenolik menjadi quinon yang sering lebih toksik terhadap mikroorganisme daripada fenol original. Enzim pengoksidasi fenol dan peroksidase keduanya mengoksidasi fenolik menjadi quinon dan menghasilkan hidrogen peroksidase (Agrios 2005).
Fitoaleksin harus terakumulasi untuk menghambat perkembangan lanjut dari patogen di tempat infeksi. Struktur kimia fitoaleksin bermacam-macam, tapi dengan satu pengecualian, mereka merupakan senyawa organik kecil yang disintesis dari satu atau tiga jalan senyawa metabolit (acetate mevalonate, acetate-malonate, atau shikimic acid) (Guest dan Brown 1997).
3
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan mulai bulan Desember 2012 sampai Agustus 2013. Kegiatan isolasi dan identifikasi dilakukan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor; kegiatan postulat Koch dan uji patogenisitas dilakukan di rumah paranet Bagian Perlindungan Hutan, Departemen Silvikultur, Fakultas Kehutanan, Institut Pertanian Bogor; dan kegiatan analisis mekanisme infeksi patogen terhadap inang dan mekanisme pertahanan inang terhadap infeksi patogen dilakukan di Laboratorium Rekayasa Bioproses, Pusat Antar Universitas, Institut Pertanian Bogor.
Bahan dan Metode
Penelitian ini terdiri atas 7 kegiatan, yaitu: (1) pengamatan gejala dan pengambilan tanaman jabon contoh yang memperlihatkan gejala mati pucuk dari 5 lokasi persemaian di sekitar kampus IPB Dramaga, (2) isolasi cendawan dari jaringan tanaman yang memperlihatkan gejala sakit, (3) identifikasi berdasarkan karakter morfologi, (4), postulat Koch, (5) uji patogenisitas isolat cendawan, (6) analisis mekanisme infeksi patogen, dan (7) analisis mekanisme pertahanan inang terhadap infeksi patogen. Tahapan kegiatan ditunjukkan dalam Gambar 3.
Gambar 3 Urutan kegiatan penelitian Pengamatan gejala dan pengambilan tanaman jabon
contoh sakit dari lokasi persemaian
Isolasi cendawan dari jaringan tanaman sakit
Postulat Koch
Identifikasi cendawan berdasarkan karakter morfologi
Uji patogenisitas isolat cendawan
Analisis mekanisme infeksi patogen
Pengamatan Gejala dan Pengambilan Tanaman Jabon Contoh
Tanaman jabon contoh adalah bibit jabon yang memperlihatkan gejala mati pucuk dan diambil dari 5 lokasi persemaian, yaitu 2 persemaian berlokasi di daerah Situ Gede (A dan B), 1 persemaian di daerah Jampang (C), 1 persemaian di daerah Cilubang (D), dan 1 persemaian di Fakultas Kehutanan IPB (E). Jumlah tanaman contoh yang diambil dari lokasi persemaian disesuaikan dengan kondisi persemaian (skala produksi dan ketersediaan tanaman sakit). Tanaman jabon contoh yang terinfeksi penyakit mati pucuk (Lampiran 1) kemudian dibawa ke laboratorium sebagai bahan untuk tahapan selanjutnya dalam penelitian.
Isolasi Cendawan dari Jaringan Tanaman Sakit
Isolasi cendawan dari jaringan tanaman dilakukan berdasarkan metode Akrofi dan Amoah (2009) dengan modifikasi pada penggunaan bahan disinfektan untuk sterilisasi permukaan jaringan tanaman. Langkah pertama, jaringan yang memperlihatkan gejala sakit diambil dari tanaman dengan cara dipotong. Potongan jaringan kemudian disterilisasi permukaan dengan cara direndam dalam larutan NaOCl 1% selama ± 2 menit, lalu dicuci dengan air steril sebanyak 3 kali, selanjutnya dikeringkan di atas kertas saring steril yang ada di dalam cawan petri. Jaringan tanaman sakit tersebut kemudian dipotong pada bagian antara yang sehat dan sakit, lalu dimasukkan ke dalam cawan petri berisi media PDA (Potato Dextrose Agar). Potongan jaringan tanaman pada media PDA selanjutnya diinkubasi selama ± 6 hari di bawah pencahayaan NUV (Near Ultra Violet) dengan periode 12 jam terang dan 12 jam gelap pada suhu ruang. Koloni miselium yang tumbuh dari potongan jaringan yang diisolasi kemudian dimurnikan dan diperbanyak pada media PDA. Isolat cendawan yang diperoleh selanjutnya digunakan sebagai bahan untuk identifikasi dan sumber inokulum.
Identifikasi Isolat Cendawan
Identifikasi cendawan dilakukan berdasarkan karakter morfologi secara makroskopis dan mikroskopis, yaitu meliputi warna koloni, tekstur dan topografi koloni, serta ukuran dan bentuk konidia. Identifikasi dilakukan dengan menggunakan buku kunci identifikasi untuk genus imperfect fungi (Barnet dan Hunter 1998) dan untuk cendawan tanah dan benih (Watanabe 1994).
Postulat Koch
Uji postulat Koch bertujuan membuktikan bahwa isolat yang diperoleh merupakan agen penyebab dari gejala penyakit yang diamati. Kegiatan ini terdiri atas inokulasi isolat pada tanaman contoh, reisolasi jaringan tanaman yang memperlihatkan gejala, dan identifikasi isolat hasil reisolasi. Sebelum tahap inokulasi, ada 2 hal yang perlu disiapkan yaitu bibit jabon dan sumber inokulum.
steril. Bagian tanaman yang akan diinokulasi sebelumnya disterilisasi permukaan dengan alkohol 70%.
Penyiapan sumber inokulum dan injeksi suspensi konidia dilakukan berdasarkan metode Ahmad et al. (2012) dengan modifikasi pada masa inkubasi isolat dan kepadatan konidia sebagai sumber inokulum. Sumber inokulum diperoleh dengan cara menambahkan 10 ml akuades steril pada kultur isolat cendawan umur 10 hari. Permukaan kultur isolat selanjutnya dikikis secara perlahan dengan menggunakan spatula gelas (glass rod), setelah itu disaring dengan kertas saring whattman no.1. Suspensi konidia yang diperoleh kemudian, dihitung kepadatannya dengan haemocytometer, lalu sebanyak 0.1 ml suspensi konidia dengan kepadatan ± 1 x 106 konidia ml-1 diinjeksikan pada bagian daun (dilukai dan tidak dilukai) dan batang bagian atas bibit jabon. Sebagai kontrol, bibit jabon diinjeksi dengan akuades steril. Bibit jabon kemudian ditutup dengan plastik dan dibuka setelah muncul gejala. Evaluasi gejala penyakit dilakukan setiap hari selama 14 hari setelah inokulasi.
Penyiapan sumber inokulum dan penempelan blok agar dilakukan berdasarkan metode Ismail et al. (2012) dengan modifikasi pada masa dan tempat inkubasi tanaman. Sumber inokulum diperoleh dengan cara memotong bagian ujung koloni isolat cendawan umur 7 hari dengan cork borer (Ø 7 mm). Setelah itu, potongan agar ditempel pada batang bagian atas (dilukai dan tidak dilukai). Sebagai kontrol, bagian batang ditempeli dengan blok agar tanpa koloni isolat cendawan. Potongan blok agar yang ditempel pada bagian batang selanjutnya ditutup dengan kapas lembab dan alumunium foil selama ± 7 hari atau sampai muncul gejala. Evaluasi gejala penyakit dilakukan dengan cara yang sama seperti metode injeksi suspensi konidia.
Gejala penyakit yang muncul pada titik inokulasi selanjutnya direisolasi, kemudian isolat hasil reisolasi diidentifikasi dan dibandingkan dengan isolat sebelumnya. Apabila isolat cendawan yang diinokulasikan menghasilkan gejala yang identik dengan gejala mati pucuk dan teridentifikasi sebagai cendawan yang identik dengan isolat sebelumnya, maka cendawan tersebut merupakan agen penyebab dari penyakit mati pucuk. Isolat yang diduga sebagai penyebab primer penyakit mati pucuk selanjutnya digunakan untuk uji patogenisitas.
Uji Patogenisitas Isolat Cendawan
KjP = n
N×100% Keterangan: KjP = Kejadian Penyakit
n = Jumlah tanaman yang sakit
N = Jumlah tanaman yang diamati
Keparahan penyakit ditentukan dengan menggunakan skoring dari 0-4 (Gambar 4 dan Tabel 1). Rumus yang digunakan adalah sebagai berikut (Townsend dan Heurberger 1943 dalam Stević et al. 2010):
KpP = n ×v
N ×V ×100% Keterangan: KpP = Keparahan Penyakit
n = Jumlah tanaman yang tergolong ke dalam suatu kategori infeksi
v = Skor pada setiap kategori infeksi N = Jumlah tanaman yang diamati V = Skor untuk kategori infeksi terberat
Gambar 4 Skoring keparahan gejala penyakit mati pucuk pada bibit jabon: a) 0 = tanaman tidak bergejala; b-c) 1 = tanaman terlihat layu atau ≤ 25% bagian tanaman mengalami nekrosis; d) 2 = 26-50% bagian tanaman mengalami nekrosis; e) 3 = > 50% bagian tanaman mengalami nekrosis; dan f) 4 = tanaman mati.
b c
d
e f
Tabel 1 Skor penyakit mati pucuk pada bibit jabon
Penyakit Uraian
0 tanaman tidak bergejala
1 tanaman terlihat layu atau ≤ 25% bagian tanaman mengalami nekrosis
2 26-50% bagian tanaman mengalami nekrosis 3 > 50% bagian tanaman mengalami nekrosis
4 tanaman mati
Analisis Mekanisme Infeksi Cendawan Patogen terhadap Tanaman Inang Mekanisme infeksi patogen terhadap tanaman inang dipelajari melalui inokulasi batang tanpa pelukaan dan pengukuran aktivitas pektinase dan selulase. Inokulasi batang tanpa pelukaan sebelumnya telah dilakukan pada kegiatan postulat Koch. Pengukuran aktivitas enzim diawali dengan mengulturkan isolat cendawan Botryodiplodia spp. pada media CMS (Corn Meal Sand). Hal tersebut dilakukan berdasarkan metode Achmad (1997) dengan modifikasi pada jumlah potongan batang bibit jabon yang ditambahkan pada media CMS dan masa inkubasi isolat. Satu potongan isolat cendawan Botryodiplodia spp. (Ø 7 mm) ditumbuhkan pada media CMS steril yang diberi tambahan 1 g potongan batang bibit jabon (umur ± 4 bulan dari penyapihan). Batang bibit jabon yang digunakan disterilisasi permukaan terlebih dahulu dengan cara direndam dalam NaOCl 1% selama ± 2 menit, kemudian dicuci dengan air steril sebanyak 3 kali. Media CMS terdiri atas campuran pasir, hancuran biji jagung, dan air (96:4:20 g:g:ml). Media CMS yang telah diinokulasi cendawan selanjutnya diinkubasi selama 2 minggu pada suhu ruang, lalu dilakukan ekstraksi enzim.
Ekstraksi dan analisis aktivitas enzim dilakukan di Laboratorium Rekayasa Bioproses, Pusat Antar Universitas, Institut Pertanian Bogor. Adapun aktivitas enzim yang dianalisis adalah pektinase dan selulase.
Analisis Mekanisme Pertahanan Inang terhadap Infeksi Patogen
Mekanisme pertahanan inang terhadap infeksi patogen dipelajari melalui pengukuran aktivitas peroksidase. Kegiatan ini dilakukan di Laboratorium Rekayasa Bioproses, Pusat Antar Universitas, Institut Pertanian Bogor dengan menggunakan metode Simon dan Ross (1970). Kegiatan diawali dengan mempersiapkan bagian tanaman contoh (tanaman telah diinokulasi isolat patogen), yaitu daun sebanyak 0.5 g. Potongan daun selanjutnya dimasukkan ke dalam mortar steril, kemudian ditambah dengan 0.01 M buffer fosfat pH 6.0 dengan perbandingan 1:4 (g:ml) dan digerus. Larutan hasil gerusan disaring dengan kain kasa dan disentrifugasi dengan kecepatan 8000 rpm selama 10 menit pada suhu 4 °C. Supernatan yang dihasilkan selanjutnya diencerkan dengan 0.01 M buffer fosfat pH 6.0 (1:3), kemudian dihomogenkan dan digunakan sebagai sediaan enzim.
spektrofotometer pada panjang gelombang 420 nm. Sebagai blanko, ke dalam kuvet dimasukkan bahan-bahan yang sama kecuali sediaan enzim. Nilai absorbansi diamati setiap 30 detik selama 2.5 menit. Nilai absorban yang diperoleh selanjutnya dikurangi dengan blanko, kemudian rata-rata nilai absorban ditentukan dengan menggunakan persamaan regresi (y = a + bx). Selanjutnya, unit aktivitas enzim dapat ditentukan dengan menggunakan rumus sebagai berikut:
UAE = ∆ OD × sediaan enzim (ml) bobot basah contoh (gram) Keterangan: UAE = unit aktivitas enzim
4
HASIL DAN PEMBAHASAN
Hasil
Gejala Penyakit Mati Pucuk pada Tanaman Jabon
Berdasarkan pengamatan gejala penyakit di lokasi persemaian, bibit jabon yang terinfeksi penyakit mati pucuk memiliki gejala berupa nekrosis pada batang bagian tengah atau atas dan daun. Gejala nekrosis yang berkembang pada bagian batang akan menyebabkan batang mengering dan tidak mampu menopang bagian atas tanaman sehingga tanaman terkulai (Gambar 5a). Sementara itu, gejala nekrosis pada bagian daun akan menyebabkan daun kering dan menggulung (Gambar 5b). Selain nekrosis, penyakit mati pucuk dapat diawali dengan gejala layu dan mengerutnya bagian batang (Gambar 5c). Meskipun batang masih terlihat berwarna hijau, tapi batang menjadi lebih sukulen dari kondisi normal sehingga tidak mampu menopang bagian atas tanaman.
Gambar 5 Gejala penyakit mati pucuk pada bibit jabon di lokasi persemaian: a) nekrosis pada batang, (b) nekrosis pada daun, dan (c) batang mengerut.
Gejala penyakit mati pucuk pada bibit jabon ditemukan mulai dari bibit muda (bentuk sosisan dengan umur ± 2 bulan) sampai dengan bibit siap tanam (umur 5 sampai 6 bulan) (Gambar 6). Bagian atas atau ujung tanaman biasanya lebih cepat mengalami nekrosis jika dibandingkan bagian pangkal tanaman. Gejala penyakit akan terhambat atau berhenti pada bagian batang yang telah mengeras, sehingga bibit yang telah memiliki batang cukup keras terkadang masih bisa bertahan hidup dengan cara menghasilkan tunas baru. Perkiraan persentase tanaman yang terinfeksi penyakit mati pucuk pada bibit jabon di 5 lokasi tempat pengambilan contoh berkisar 1 sampai 15% (Lampiran 2).
Gambar 6 Bibit jabon yang terserang penyakit mati pucuk pada beberapa tingkatan umur: a) nekrosis pucuk pada bibit ± 2 bulan, b-d) nekrosis batang dan daun pada bibit ± 3, 4, dan 5 bulan secara berturut-turut.
Isolasi dan Identifikasi Cendawan
Sebanyak 21 isolat cendawan (Lampiran 3) berhasil diisolasi dari tanaman sakit yang menunjukkan gejala nekrosis pada bagian ujung tanaman. Berdasarkan pengamatan warna koloni pada umur 2 minggu, isolat-isolat tersebut dapat dikelompokkan menjadi 4, yaitu kelompok isolat berwarna putih, putih keabuan, putih keunguan, dan abu-abu kehitaman (Gambar 7). Hasil identifikasi berdasarkan karakter morfologi, isolat-isolat tersebut diketahui sebagai Botryodiplodia spp., Fusarium spp., Colletotrichum sp., Curvularia sp., dan Pestalotiopsis sp.. Isolat Botryodiplodia spp. diperoleh sebanyak 9 isolat dari 4 lokasi, Fusarium spp. diperoleh 9 isolat dari 4 lokasi, Colletotrichum sp. diperoleh 1 isolat dari 1 lokasi, Curvularia sp. dan Pestalotiopsis sp. masing-masing diperoleh 1 isolat dari 1 lokasi yang sama (Tabel 2). Isolat Botryodiplodia dan Fusarium yang diperoleh dalam studi ini diduga lebih dari 1 spesies jika dilihat berdasarkan karakter morfologi koloni.
Gambar 7 Penampilan koloni isolat cendawan berdasarkan warna koloni: a) warna putih, b) putih keabuan, c) putih keunguan, dan d) abu-abu kehitaman.
a b c d
b c d
Tabel 2 Perolehan isolat cendawan berdasarkan lokasi pengambilan tanaman jabon contoh yang memperlihatkan gejala mati pucuk
No Isolat Asal Lokasi Jumlah Isolat 1 Botryodiplodia spp. A, B, D, E 9
2 Fusarium spp. A, C, D, E 9
3 Colletotrichum sp. D 1
4 Curvularia sp. A 1
5 Pestalotiopsis sp. A 1
Keterangan: A, B = persemaian di daerah Situ Gede; C = daerah Jampang; D = daerah Cilubang; dan D = Fakultas Kehutanan IPB
Pengamatan makroskopis menunjukkan koloni isolat cendawan Botryodiplodia spp. memiliki warna putih pada permukaan atas yang selanjutnya berubah menjadi abu-abu atau hijau kehitaman, sedangkan koloni pada bagian bawah media dalam cawan petri memiliki warna abu-abu, hijau kehitaman atau hitam. Morfologi koloni miselium Botryodiplodia spp. memiliki tekstur seperti benang halus (fluffy) dengan miselium udara yang tebal dan koloni menyebar dari bagian tengah dengan alur tidak beraturan (rugose). Isolat memiliki pertumbuhan radial yang cepat, yaitu dapat memenuhi cawan petri (Ø 9 cm) setelah 2 sampai 4 hari masa inkubasi. Sementara itu, berdasarkan pengamatan mikroskopis isolat Botryodiplodia spp. memiliki hifa bersekat, hialin pada hifa muda dan berwarna coklat pada hifa tua. Konidia pada awalnya hialin dan tidak bersekat, kemudian berubah menjadi berwarna kecoklatan dan bersekat 1. Konidia berbentuk ellipsoid atau ovoid dengan ukuran 26 sampai 32 x 13 sampai 17 µ m (Gambar 8a).
Gambar 8 Konidia isolat cendawan yang diperoleh dari bibit jabon yang memperlihatkan gejala mati pucuk: a) konidia muda dan konidia matang Botryodiplodia spp., b) makrokonidia Fusarium spp., c) konidia Colletotrichum sp., d) konidia Pestalotiopsis sp., dan e) konidia Curvularia sp..
Koleksi isolat Fusarium spp. menunjukkan warna putih atau putih keunguan pada permukaan bagian atas dan bawah media dalam cawan petri. Warna ungu yang terlihat pada bagian bawah petri memiliki pola warna yang berbeda, yaitu warna ungu pada bagian tengah koloni miselium dan warna ungu yang diselingi oleh warna putih. Morfologi koloni miselium Fusarium spp. memiliki sedikit miselium udara (velvety), koloni berkerut dengan permukaan kusut (verrucose) atau menyebar dengan alur tidak beraturan. Koloni isolat dapat memenuhi cawan petri setelah 7 sampai 10 hari masa inkubasi. Konidia Fusarium
a b
c
spp. terdiri atas mikrokonidia bersekat dan tidak bersekat serta makrokonidia dengan sekat 1 sampai 4. Mikrokonidia memiliki bentuk yang beragam, yaitu reniform, allantoid, oval, ovoid, dan fusiform dengan ukuran 6 sampai 10 x 2 sampai 3 µ m. Adapun makrokonidia berbebntuk lunate atau filiform dengan ukuran sekitar 16 sampai 43 x 3 sampai 4 µ m (Gambar 8b). Klamidospora hialin, tunggal atau berpasangan, terminal atau interkalar, dan memiliki ukuran sekitar 8 µ m.
Koloni isolat Colletotrichum sp. berwarna putih pada permukaan bagian atas dan putih keabuan pada bagian bawah media dalam cawan petri. Morfologi koloni berupa miselium udara yang tebal dan berkerut dengan permukaan kusut. Koloni memiliki tingkat pertumbuhan radial sedang dengan 6 hari masa inkubasi dapat memenuhi cawan petri. Konidia berbentuk oblong dengan ukuran 14 sampai 16 x 4 sampai 5 µ m (Gambar 8c).
Koloni Pestalotiopsis sp. berwarna putih pada permukaan bagian atas dan putih kekuningan pada bagian bawah media dalam cawan petri. Morfologi koloni isolat memiliki sedikit miselium udara, berkerut dengan permukaan kusut, dan isolat dapat memenuhi cawan petri setelah 13 hari masa inkubasi. Konidia berwarna coklat, bersekat, berbentuk fusiform dengan ukuran 25 sampai 27 x 5 µ m, dan memiliki embelan pada kedua ujung konidia (Gambar 8d).
Isolat Curvularia sp. memiliki koloni berwarna gelap, baik pada bagian permukaan atas maupun bagian bawah media dalam cawan petri. Morfologi koloni isolat memiliki sedikit miselium udara dan bagian tengah koloni mengalami peninggian sehingga berbentuk seperti kancing (umbonate). Koloni isolat dapat memenuhi cawan petri setelah 6 hari masa inkubasi. Konidia berbentuk inequilateral, berwarna coklat, berukuran 26 sampai 30 x 7 sampai 8 µ m, dan bersekat 2 sampai 4 (Gambar 8e).
Postulat Koch
Gejala yang muncul setelah tanaman jabon diinokulasi adalah berupa nekrosis pada titik inokulasi. Nekrosis selanjutnya menyebar ke bagian lain sehingga bagian yang terinfeksi akan terlihat berwarna kecoklatan. Penyakit yang terus berkembang akan menyebabkan bagian atas tanaman terkulai dan kering.
Isolat yang mampu menghasilkan gejala pada tanaman jabon yang diinokulasi adalah Botryodiplodia spp., Fusarium spp., dan Colletotrichum sp. (Gambar 9). Isolat Botryodiplodia spp. secara umum dapat menghasilkan gejala pada bagian yang dilukai dan tidak dilukai, sedangkan isolat Fusarium spp. dan Colletotrichum sp. hanya pada bagian yang dilukai.
Gambar 9 Gejala penyakit pada bibit jabon setelah inokulasi pada tahap postulat Koch: a) Botryodiplodia spp., b) Fusarium spp., c) Colletotrichum sp., dan d) kontrol.
a c d
Inokulasi isolat Botryodiplodia spp. pada bagian batang menimbulkan gejala nekrosis setelah masa inkubasi 2 sampai 3 hari. Nekrosis yang cepat berkembang ke bagian atas tanaman, menyebabkan batang bagian atas dan daun menjadi berwarna kecoklatan dan selanjutnya mati. Nekrosis yang tidak berkembang umumnya hanya mengalami perubahan warna dari coklat menjadi coklat kehitaman dengan arah penyebaran melintang.
Inokulasi suspensi konidia Fusarium spp. pada bagian batang dan daun menimbulkan gejala yang berbeda, yaitu berupa busuk basah pada bagian batang, dan nekrosis atau gugur pada bagian daun. Masa inkubasi untuk menimbulkan gejala pada tanaman jabon, bervariasi antara satu isolat dengan isolat lainnya. Masa inkubasi yang cepat berkisar 3 sampai 4 hari, sedangkan yang relatif lama lebih dari 10 hari. Gejala busuk basah pada batang biasanya lebih cepat terlihat jika dibandingkan dengan gejala nekrosis pada daun. Gejala busuk menyebabkan batang menjadi lunak dan basah sehingga tanaman akan terkulai, sedangkan nekrosis pada daun akan menimbulkan warna kecoklatan pada bagian yang dilukai. Gejala yang muncul lebih dari 10 hari, biasanya diawali dengan kelayuan atau mengerutnya bagian batang, sehingga batang terlihat berwarna pucat dan lama-kelamaan akan menyusut. Gejala yang berkembang ke bagian daun akan menyebabkan daun berwarna pucat dan menggulung.
Gejala yang timbul pada tanaman jabon setelah diinokulasi isolat Colletotrichum sp. berupa nekrosis yang muncul pada bagian tangkai daun yang dilukai, sedangkan inokulasi yang dilakukan pada batang dan helai daun tidak memperlihatkan gejala. Masa inkubasi untuk menimbulkan gejala yaitu sekitar 7 hari. Gejala yang sudah muncul umumnya tidak berkembang sehingga tanaman tidak mengalami mati pucuk.
Inokulasi isolat Pestalotiopsis sp. dan Curvularia sp. tidak menimbulkan gejala. Bagian tanaman dilukai yang dijadikan titik inokulasi mengalami penebalan dan luka akan tertutup kembali. Selain kedua isolat di atas, inokulasi blok agar yang merupakan kontrol juga tidak menimbulkan gejala penyakit (Gambar 9d). Meskipun demikian, hasil reisolasi menunjukkan bahwa cendawan Botryodiplodia sp., Fusarium sp., dan Colletotrichum sp. juga berhasil diperoleh dari jaringan tanaman kontrol yang tidak memperlihatkan gejala sakit.
Hasil reisolasi dari bagian tanaman yang bergejala tidak hanya diperoleh cendawan yang diinokulasikan, akan tetapi juga cendawan lain. Meskipun demikian, isolat-isolat yang diinokulasikan umumnya dapat direisolasi dari tanaman contoh. Walaupun sebagian besar isolat yang diinokulasikan dapat menimbulkan gejala, akan tetapi isolat yang dapat menghasilkan gejala identik dengan gejala alami mati pucuk adalah isolat Botryodiplodia spp.. Oleh karena itu, isolat Botryodiplodia spp. selanjutnya digunakan untuk uji patogenisitas. Uji Patogenisitas Isolat Cendawan Botryodiplodia spp.
nekrosis dan menyusut. Gejala yang terus berkembang menyebabkan bagian atas tanaman mati dan batang menyusut. Perkembangan nekrosis atau menyusutnya batang biasanya menjadi lebih lambat ketika sudah mencapai pangkal batang. Jika batang pada tanaman yang sudah mati dipotong secara membujur atau melintang, maka akan terlihat bahwa bagian dalam batang tersebut berwarna kecoklatan atau justru sudah tidak berisi.
Kejadian penyakit yang ditimbulkan kelima isolat Botryodiplodia spp. cukup beragam. Persentase kejadian penyakit paling tinggi dihasilkan isolat A1 dan B2 (100%), kemudian diikuti isolat A5 (80%), isolat E4 (35%), dan E2 (20%) (Gambar 10). Hasil analisis ragam menunjukkan bahwa perlakuan inokulasi 5 isolat Botryodiplodia spp. berpengaruh nyata terhadap persentase kejadian penyakit (Lampiran 5). Sementara itu, hasil uji lanjut Duncan menunjukkan bahwa isolat E2 berbeda nyata dengan isolat A1, A5, B2 dan kontrol, tetapi tidak berbeda nyata dengan isolat E4. Isolat E4 tidak berbeda nyata dengan isolat E2, tetapi berbeda nyata dengan isolat A1, A5, B2, dan kontrol. Adapun isolat A1, A5, dan B2 ketiganya tidak berbeda nyata, tetapi ketiga isolat tersebut berbeda nyata dengan isolat E2, E4, dan kontrol.
dengan yang lain, namun ketiga isolat tersebut berbeda nyata dengan isolat E2, E4, dan kontrol.
Mekanisme Infeksi Cendawan Patogen terhadap Tanaman Inang
Berdasarkan postulat Koch, isolat Botryodiplodia spp. dapat menimbulkan gejala pada tanaman jabon, baik pada bagian yang dilukai mau pun tidak dilukai (Gambar 11). Munculnya gejala pada bagian yang tidak dilukai menunjukkan bahwa isolat Botryodiplodia spp. dapat melakukan penetrasi langsung pada jaringan inang.
Gambar 11 Gejala nekrosis yang muncul pada batang bibit jabon setelah inokulasi isolat Botryodiplodia spp.
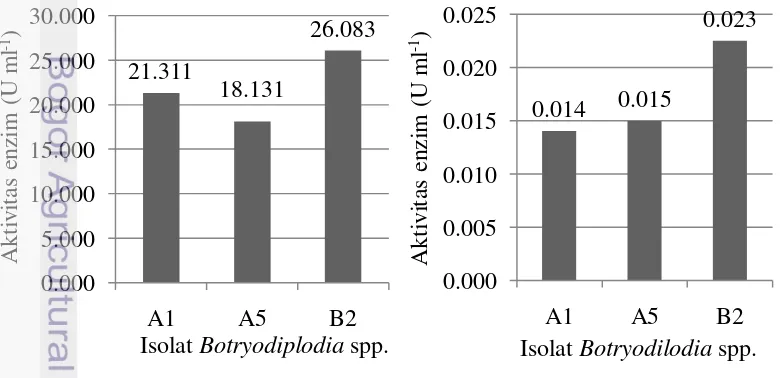
Analisis aktivitas pektinase dan selulase dilakukan untuk mempelajari mekanisme infeksi cendawan terhadap inang melalui kekuatan biokimia. Cendawan yang diuji merupakan 3 isolat Botryodiplodia spp. (A1, A5, dan B2) yang sangat virulen terhadap bibit jabon berdasarkan uji patogenisitas. Hasil analisis enzim menunjukkan bahwa isolat Botryodiplodia spp. yang sangat virulen terhadap bibit jabon, memiliki aktivitas pektinase dan selulase (Gambar 12).
Gambar 12 Aktivitas pektinase (A) dan selulase (B) 3 isolat Botryodiplodia spp. setelah 2 minggu masa inkubasi pada media CMS
Aktivitas pektinase paling tinggi dihasilkan isolat B2, kemudian diikuti isolat A1 dan A5 dengan nilai sebesar 26.083, 21.311 dan 18.131 U ml-1 secara berturut-turut. Sementara itu, aktivitas selulase tertinggi dihasilkan isolat B2, lalu diikuti isolat A5 dan A1 dengan nilai sebesar 0.023, 0.015, dan 0.014 U ml-1 secara berturut-turut.
Mekanisme Pertahanan Inang terhadap Infeksi Patogen
Mekanisme pertahanan inang terhadap infeksi patogen dipelajari melalui analisis aktivitas peroksidase yang dihasilkan tanaman inang. Tanaman yang dijadikan contoh uji untuk analisis aktivitas peroksidase adalah bibit jabon yang diinokulasi cendawan Botryodiplodia spp. (isolat A1, A5, B2, E2, dan E4). Secara umum, tanaman contoh yang diinokulasi dapat menunjukkan aktivitas peroksidase (Gambar 13). Aktivitas peroksidase paling tinggi dihasilkan tanaman jabon yang diinokulasi isolat A1 dan A5 dengan nilai sebesar 0.0012 UAE g-1. Tanaman yang diinokulasi isolat B2 dan E2 memperlihatkan aktivitas peroksidase yang sama dengan kontrol, yaitu sebesar 0.0008 UAE g-1. Sementara itu, tanaman jabon yang diinokulasi isolat E4 memiliki aktivitas peroksidase lebih rendah jika dibandingkan dengan kontrol, yaitu sebesar 0.0006 UAE g-1.
Gambar 13 Aktivitas peroksidase bibit jabon setelah diinokulasi 5 isolat Botryodiplodia spp. dan kontrol
Pembahasan
Gejala Penyakit Mati Pucuk pada Tanaman Jabon
Gejala penyakit pada tanaman merupakan bentuk penyimpangan baik morfologi atau fisiologi sebagai respon dari adanya gangguan patogen (Widyastuti et al. 2005). Respon yang dihasilkan tanaman berbeda-beda, bergantung pada jenis tanaman inang dan patogennya.
ranting, daun menggulung dan mengering yang diikuti gugur daun (Khanzada et al. 2004), kemudian pada tanaman ash (Fraxinus spp.) berupa nekrosis pada daun yang diikuti layu (Kräutler dan Kirisits 2012).
Bibit jabon yang mengalami mati pucuk juga menunjukkan gejala kematian pada bagian ujung tanaman. Kematian jaringan pada ujung tanaman ini diawali dengan adanya nekrosis pada bagian batang atau daun. Gejala nekrosis yang diawali dari bagian batang umumnya akan menyebar ke arah daun dengan menginfeksi bagian tulang daun utama terlebih dahulu. Setelah tulang daun utama terinfeksi, selanjutnya daun akan kering dan menggulung, lalu gugur. Selain menyebar ke bagian daun, nekrosis pada batang juga akan menyebar ke batang bagian bawah. Bagian batang yang mulai terinfeksi, pada awalnya akan terlihat mengerut, kemudian mengering, lalu mati. Gejala pada batang akan terhambat atau terhenti pada bagian yang sudah berkayu. Oleh sebab itu, tanaman masih mampu bertahan hidup. Tanaman dengan kondisi seperti ini biasanya akan mengeluarkan tunas baru sehingga terbentuk percabangan. Bagian batang yang sudah berkayu akan terlihat berwarna kehitaman apabila dipotong secara melintang (Lampiran 7).
Gejala mati pucuk pada bibit jabon juga dapat diawali dengan adanya kerutan pada bagian batang. Tanaman pada umumnya akan terkulai karena bagian batang tidak mampu menopang bagian atas tanaman. Batang yang terinfeksi selanjutnya akan terlihat menyusut, sehingga apabila batang ditekan akan terasa kosong atau hampa. Gejala kerutan yang menyebar ke bagian daun akan mengakibatkan daun berwarna pucat dan layu.
Perkembangan penyakit di areal persemaian dapat dipengaruhi oleh beberapa faktor, di antaranya adalah aktivitas budi daya. Adanya kegiatan pemindahan tanaman secara periodik di areal persemaian dapat menimbulkan luka mekanis pada tanaman. Luka tersebut tidak hanya dapat menyebabkan tanaman stress, tetapi juga dapat menjadi titik masuk bagi patogen untuk menginfeksi jaringan tanaman. Selain itu, penempatan tanaman dengan jarak yang cukup rapat dapat menciptakan kondisi lembab di sekitar tanaman. Oleh karena itu, dengan terciptanya kondisi lingkungan yang lembab, adanya luka mekanis, dan kondisi tanaman yang stress dapat memudahkan patogen untuk menginfeksi inang.
Identifikasi Cendawan
Cendawan yang dapat diisolasi dari tanaman jabon yang menunjukkan gejala mati pucuk adalah Botryodiplodia spp., Fusarium spp., Colletotrichum sp., Curvularia sp., dan Pestalotiopsis sp.. Hal ini sesuai dengan penelitian Muehlbach
et al. (2010) yang berhasil mendeteksi beberapa isolat cendawan seperti L. theobromae, F .oxysporum, C. affinis, dan Bipolaris sp. dari tanaman shisham (D. sissoo) yang memperlihatkan gejala mati pucuk. Selain itu, Rajput et al. (2008) berhasil mengisolasi cendawan F. solani dari tanaman shisham dengan gejala yang sama.
Cendawan yang sering muncul hampir di setiap lokasi pengambilan tanaman contoh adalah Botryodiplodia spp. dan Fusarium spp.. Kedua cendawan ini muncul pada 3 lokasi yang sama (A, D, dan E) dan berhasil diisolasi dari 1 tanaman contoh yang sama. Selain dengan Botryodiplodia spp., Fusarium spp. juga berhasil diisolasi dengan Colletotrichum sp. dari 1 tanaman contoh yang sama di lokasi D. Jika dilihat berdasarkan lokasi pengambilan tanaman contoh, maka lokasi yang memiliki isolat beragam adalah lokasi A. Empat dari 5 macam cendawan berhasil diisolasi dari tanaman jabon contoh yang berasal dari lokasi tersebut. Hal ini diduga karena jenis tanaman yang tersedia di lokasi A lebih banyak dan beragam jika dibandingkan dengan 4 lokasi lain.
Secara umum, setiap persemaian (tempat pengambilan contoh) membudidayakan beberapa jenis tanaman selain jabon, kecuali lokasi D. Jenis tanaman lain yang dibudidayakan di antaranya adalah sengon (Paraserianthes falcataria (L.) Nielsen), jati (Tectona grandis Linn. f.), ekaliptus (Eucalyptus sp.), dan akasia (A. mangium). Tanaman yang berada di persemaian berpotensi menjadi inang bagi patogen. Semakin beragam tanaman yang tersedia di lokasi persemaian, maka diduga akan beragam pula patogen yang dapat menginfeksi.
Selain jenis tanaman, faktor yang diduga mempengaruhi keragaman cendawan di persemaian adalah kultur teknis dan lokasi persemaian. Kultur teknis meliputi metode penyemaian benih, pemupukan, penyiraman, pengaturan jarak antar tanaman, pemilihan jenis tanaman, penggunaan jenis media tanam, dan usaha pengendalian hama dan penyakit. Kegiatan-kegiatan tersebut dapat membantu introduksi dan penyebaran suatu mikroorganisme di lokasi persemaian. Lokasi persemaian dapat mempengaruhi kondisi lingkungan, misalnya suhu udara dan kelembaban. Kondisi lingkungan merupakan salah satu komponen dari segitiga penyakit. Oleh karena itu, apabila kondisi lingkungan mendukung, maka patogen dapat menginfeksi tanaman inang dan menyebabkan penyakit.
Tiga dari 5 persemaian dalam studi ini, memproduksi bibit jabon dengan cara membeli bibit dari produsen lain, sedangkan 2 persemaian lainnya di samping mendatangkan bibit dari produsen lain juga memproduksi bibit sendiri dengan cara menyemai benih. Beberapa kultur teknis yang umum dilakukan di setiap persemaian adalah penggunaan bahan kimia untuk pengendalian hama dan penyakit, serta penggunaan kembali media tanah yang sebelumnya ditumbuhi tanaman sakit. Adapun kondisi fisik dari 5 lokasi persemaian dalm studi ini cukup beragam jika dilihat berdasarkan tingkat ketinggian dan kondisi lingkungan sekitar persemaian.