KEEFEKTIFAN KITOSAN DALAM MENGENDALIKAN
Botryodiplodia theobromae
Pat. PENYEBAB MATI PUCUK
PADA BIBIT JABON (
Anthocephalus
cadamba
(Roxb.) Miq)
DESI NURAFIDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Keefektifan Kitosan dalam Mengendalikan Botryodiplodia theobromae Pat. Penyebab Mati Pucuk pada Bibit Jabon (Anthocephalus cadamba (Roxb.) Miq) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
Desi Nurafida
RINGKASAN
DESI NURAFIDA. Keefektifan Kitosan dalam Mengendalikan Botryodiplodia theobromae Pat. Penyebab Mati Pucuk pada Bibit Jabon (Anthocephaluscadamba
(Roxb.) Miq). Dibimbing oleh ACHMAD dan SYAMSUL FALAH.
Penyakit mati pucuk pada bibit jabon (Anthocephalus cadamba) oleh cendawan Botryodiplodia theobromae menyebabkan terhambatnya regenerasi tanaman ini. Usaha pengendalian yang banyak dilakukan saat ini yaitu dengan menggunakan fungisida sintetis. Tetapi penggunaanya menimbulkan masalah dengan meninggalkan residu bagi lingkungan dan menyebabkan resistensi patogen. Kitosan merupakan senyawa alami yang potensial sebagai alternatif untuk mengendalikan serangan penyakit pada tanaman. Senyawa ini memiliki sifat biologi dan mekanik yang tinggi diantaranya biorenewable, biodegradable, dan
biofunctional sehingga aman untuk lingkungan. Penelitian ini bertujuan untuk menguji efektivitas kitosan dalam mengendalikan B. theobromae penyebab mati pucuk pada bibit jabon dan menguji pengaruh viskositas kitosan dalam mengendalikan mati pucuk pada bibit jabon.
Penelitian ini menggunakan kitosan dari cangkang udang yang di larutkan dengan asam asetat 1.5% dan lakukan uji viskositas menggunakan Viskometer Brookfielt. Uji efektivitas larutan kitosan dalam mengendalikan mati pucuk pada bibit jabon dilakukan secara in-vivo. Rancangan penelitian yang digunakan yaitu rancangan dua faktor dalam rancangan acak lengkap (Faktorial RAL) dengan faktor waktu penyemprotan dan konsentrasi larutan kitosan. Waktu penyemprotan larutan kitosan dilakukan satu hari sebelum inokulasi dan satu hari setelah inokulasi sedangkan konsentrasi larutan kitosan yang digunakan yaitu 0.0%, 0.1%, 0.3%, 0.5%, 0.8%, dan 1.0%.
Hasil penelitian menunjukkan bahwa larutan kitosan dapat mengurangi tingkat keparahan penyakit pada bibit jabon yang diduga karena larutan kitosan memiliki gugus amin bermuatan positif yang dapat berikatan dengan bahan dinding sel yang bermuatan negatif sehingga terjadi kebocoran pada sel patogen. Berbeda pada parameter tingkat kejadian penyakit yang diamati, larutan kitosan tidak memberikan pengaruh nyata karena B. theobromae mampu menimbulkan gejala mati pucuk pada seluruh bibit jabon. Konsentrasi dan waktu penyemprotan larutan kitosan berpengaruh nyata terhadap tingkat keparahan penyakit (P<0.05), tetapi keduanya tidak saling berinteraksi. Perlakuan paling efektif yaitu pemberian larutan kitosan dengan konsentrasi 0.1 % sebelum dilakukan inokulasi dengan tingkat keparahan penyakit sebesar 25 %. Viskositas larutan kitosan juga memberikan pengaruh terhadap keparahan penyakit mati pucuk pada bibit jabon. Viskositas terbaik dalam menekan perkembangan penyakit mati pucuk bibit jabon yaitu 8.80 dengan tingkat keparahan penyakit sebesar 7.90%.
SUMMARY
DESI NURAFIDA. Chitosan’s Effectiveness in Controlling Botryodiplodia theobtomae Pat. Cause of Dieback Disease on Jabon Seeding (Anthocephalus cadamba (Roxb. Miq). Supervised by ACHMAD and SYAMSUL FALAH
Dieback disease by Botryodiplodia theobromae in Jabon seedlings (Anthocephalus cadamba) inhibits the regeneration of Jabon plant. Activity in disease control that is commonly implemented is synthetic fungicides utilization. However, the utilization leads to several problems such as residue on the environment and pathogen resistance. Chitosan is a potential natural compound used as an alternative to control plant disease. This compound has highly biological and mechanical properties including biorenewable, biodegradable, and biofunctional properties which are environmentally friendly. This study aims to examine the effectiveness of chitosan to control B.theobromae as the cause of dieback on Jabon seedlings and to examine the effect of chitosan to control the viscosity of dieback disease on Jabon seedlings.
This study used chitosan that is derived from shrimp shell. It was dissolved in 1.5% of acetic acid and tested with viscometer Brookfielt to examine the viscosity. Chitosan effectiveness test in controlling dieback disease on Jabon seedlings was performed in-vivo. Design of study used was a completely randomized design (CRD) with two factors, such as spraying time and the concentration of chitosan solution. Chitosan spraying time was performed one day before the inoculation and one day after inoculation, while the concentrations of chitosan solution used were 0.0%, 0.1%, 0.3%, 0.5%, 0.8% and 1.0%.
The results showed that the chitosan solution can decrease the severity of disease in Jabon seedlings due to its positive amine group which can bind with the negative cell wall material and leads to the leakage of pathogen cell. However, it was different with the disease incidence rate parameter. Chitosan solution was not significantly affecting the disease, because B. theobromae caused dieback symptoms on jabon seedlings. The concentration and spraying time of chitosan solution were significantly affect the disease severity (P <0.05), but these factors were not associated to one another. The most effective treatment was chitosan solution with a concentration of 0.1% before inoculation with the severity of the disease by 25%. Chitosan solution viscosity was responsible in affecting the percentage of dieback disease in Jabon seeds. The best viscosity to suppress the development of dieback disease on Jabon seedlings was 8.80 with 7.90% attack.
Keywords: Anthocephalus cadamba , Botryodiplodia theobromae, chitosan,
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Silvikultur Tropika
KEEFEKTIFAN KITOSAN DALAM MENGENDALIKAN
Botryodiplodia theobromae
Pat. PENYEBAB MATI PUCUK
PADA BIBIT JABON (
Anthocephalus
cadamba
(Roxb.) Miq)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
Judul Tesis :Keefektifan Kitosan dalam Mengendalikan Botryodiplodia theobromae Pat. Penyebab Mati Pucuk pada Bibit Jabon (Anthocephaluscadamba (Roxb.) Miq)
Nama : Desi Nurafida NIM : E45II40286
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Achmad, MS Ketua
Dr Syamsul Falah, SHut MSi Anggota
Diketahui oleh
Ketua Program Studi Silvikultur Tropika
Prof Dr Ir Sri Wilarso Budi R, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2015 ini ialah Keefektifan Kitosan dalam Mengendalikan Botryodiplodia theobromae Pat. Penyebab Mati Pucuk pada Bibit Jabon (Anthocephaluscadamba (Roxb.) Miq).
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Achmad, MS dan Bapak Dr Syamsul Falah, SHut MSi selaku komisi pembimbing, yang telah banyak memberikan saran. Penghargaan juga penulis sampaikan kepada staf Laboratorium Patologi Hutan Departemen Silvikultur Fakultas Kehutanan IPB yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada Bapak Suryanto dan Ibu Ismiyati, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Tidak lupa pula penulis ucapkan terimakasih kepada keluarga besar Departemen Silvikultur, Silvikultur Tropika 2013, Silvikultur 47, sahabat tercinta (Arie, Hani, Intan, Mira, Mala), keluarga besar RIMPALA khususnya R-XVI, dan Ikatan Keluarga Mahasiswa Magelang (IKMM) atas doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2017
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
TINJAUAN PUSTAKA 3
Kitosan 3
Jabon Putih (Anthocephalus cadamba (Roxb.) Miq.) 5
Botryodiplodia theobromae 6
METODE 8
Waktu dan Lokasi Penelitian 8
Alat dan Bahan 9
Penyiapan Larutan Kitosan 9
Diagram Alir Penelitian 9
Uji Viskositas Kitosan dan Penentuan Bobot Molekul 9
Penyiapan Patogen dan Uji Virulensi 10
Reisolasi 10
Uji Efektivitas Kitosan In-vivo 10
Analisis Data 12
HASIL DAN PEMBAHASAN 13
Hasil 13
Pembahasan 16
SIMPULAN DAN SARAN 21
Simpulan 211
Saran 21
DAFTAR PUSTAKA 211
LAMPIRAN 25
DAFTAR TABEL
1 Nilai numerik dan keparahan penyakit mati pucuk bibit jabon 11 2 Viskositas larutan kitosan dan bobot molekul 14 3 Pengaruh konsentrasi larutan kitosan terhadap keparahan
penyakit B. theobromae pada bibit jabon
15 4 Pengaruh waktu penyemprotan terhadap keparahan penyakit B.
theobromae pada bibit jabon
15 5 Kejadian penyakit dan keparahan penyakit 15
DAFTAR GAMBAR
1 Struktur kitosan 4
2 Profil fungi Botryodiplodia sp. 7
3 Mekanisme serangan patogen ke dalam jaringan inang 8
4 Diagram alir penelitian 9
5 Nilai numerik dan keparahan penyakit mati pucuk pada bibit jabon
12
6 Pengamatan Botryodiplodia sp. 13
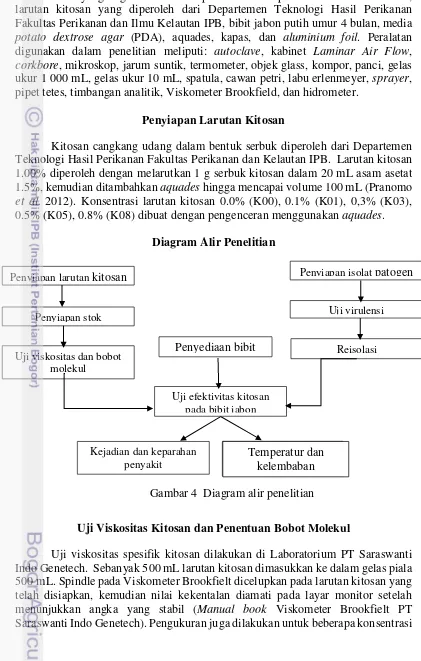
7 Gejala mati pucuk pada bibit jabon 13
8 Virulensi B.theobromae terhadap bibit jabon 14 9 Uji virulensi B. theobromae pada bibit jabon 14
DAFTAR LAMPIRAN
1 Analisis sidik ragam keparahan penyakit pada bibit jabon 26 2 Data temperatur dan kelembaban selama 14 hari pengamatan 27
3 Gambar pengamatan keparahan penyakit 28
PENDAHULUAN
Latar Belakang
Jabon (Anthocephalus cadamba (Roxb.) Miq) merupakan jenis pohon cepat tumbuh yang berasal dari India, Malaysia, dan Indonesia (Warisno dan Dahana 2011). Menurut Mulyana et al. (2010), jabon berpotensi untuk dikembangkan dalam pembangunan hutan tanaman, hutan rakyat, maupun tujuan lainnya seperti: penghijauan, reklamasi lahan bekas tambang, dan pohon peneduh. Kayu jabon baik digunakan untuk pembuatan peti, papan tipis, korek api, pensil, vinir dan kayu lapis serta untuk pulp dan kertas (Wahyudi 2012). Tanaman ini banyak diminati oleh masyarakat dan perusahaan karena memiliki sebaran luas, pertumbuhan cepat, pemeliharaan mudah, pemasaran mudah, dan dapat tumbuh diberbagai tipe tanah (Aisah 2014).
Pada masa yang akan datang, jabon akan memiliki peranan yang begitu penting ketika terjadi penurunan pasokan kayu industri dan pertukangan dari hutan alam (Pratiwi 2003). Oleh sebab itu, usaha pembibitan jabon telah banyak dilakukan, baik dalam skala kecil maupun besar. Usaha ini berpotensi terserang gangguan penyakit di area persemaian. Kondisi bibit yang masih sekulen menjadikan tanaman rentan terhadap gangguan penyakit sehingga bibit jabon di persemaian berpotensi menjadi inang bagi patogen (Aisah et al. 2015).
Gangguan penyakit dapat mengurangi kualitas dan kuantitas bibit sehingga menyebabkan terhambatnya proses regenerasi tanaman hutan. Hasil penelitian Aisah (2014) menyatakan bahwa penyakit yang sering dijumpai pada bibit jabon di lima lokasi persemaian yaitu mati pucuk. Aisah et al. (2015) juga menyatakan bahwa ada beberapa cendawan yang menimbulkan penyakit pada tanaman jabon, seperti Botryodiplodia spp., Fusarium spp., Colletotrichum sp., Curvularia sp., dan
Pestalotiopsis sp. Berdasarkan hasil pengamatan ada sembilan isolat
Botryodiplodia spp. yang ditemukan pada empat lokasi penelitian di persemaian (Aisah 2014). Menurut Anggraeni dan Lelana (2011), Botryodiplodia sp. dapat menyerang tanaman kehutanan di Indonesia antara lain menyebabkan bercak daun pada pulai, merbau, bakau dan makaranga, selain itu juga menyebabkan busuk akar pada meranti dan penyakit batang pada gaharu. Aisah (2014) melaporkan bahwa kejadian penyakit dan keparahan penyakit pada bibit jabon mencapai 100%. Selain itu, Yanti et al. (2015) juga telah melaporkan bahwa kejadian penyakit pada bibit jabon putih dengan perlakuan pelukaan mencapai 100% dengan tingkat keparahan hingga 62%. Gejala mati pucuk pada bibit jabon yang terlihat mula-mula terdapat nekrosis pada bagian tanaman yang diinokulasi. Nekrosis yang cepat kemudian berkembang pada bagian atas tanaman yang menyebabkan batang dan daun berwarna cokelat sampai akhirnya mati, akan tetapi apabila nekrosis tidak berkembang hanya menyebabkan perubahan warna dari cokelat menjadi cokelat kehitaman.
2
Botryodiplodia sp. yang diinokulasikan pada bibit jabon dapat berkembang dengan cepat di dalam jaringan tanaman. Cendawan ini sangat virulen dan dapat menyebabkan batang jabon menjadi menyusut dan kering serta daun menjadi berwarna kecokelatan dan menggulung (Aisah 2014).
Pengendalian terhadap serangan Botryodiplodia sp. yang menyerang jabon penting dilakukan untuk menekan kerugian produksi bibit maupun penurunan produktivitas pohon. Pengendalian yang sering dilakukan yaitu menggunakan fungisida sintetik tetapi akan memberikan dampak terhadap lingkungan serta menimbulkan residu (Sugipriatini 2009), selain itu penggunaan fungisida sintetik juga menyebabkan patogen lebih resisten dan beresiko terhadap kesehatan manusia (Lauzardo et al. 2008), sehingga pengendalian secara alami sangat dibutuhkan agar kerusakan lingkungan akibat penggunaan fungisida dapat ditekan. Pengendalian hayati menjadi alternatif yang lebih aman terhadap manusia dan juga lingkungan (Sharma et al. 2009). Beberapa hasil penelitian menunjukkan bahwa beberapa jenis penyakit tanaman dapat dikendalikan secara alami dengan menggunakan kitosan. Hasri (2010) dan Trisnawati et al. (2013) telah meloporkan bahwa kitosan memiliki sifat biologi dan mekanik yang tinggi diantaranya biorenewable, biodegradable, dan biofunctional sehingga aman untuk lingkungan.
Kitosan adalah poli–(2-amino-2-deoksi-β-(1-4)-D-glukopiranosa) dengan rumus molekul (C6H11NO4)n (Sugita et al. 2009). Kitosan dapat diperoleh dari
destilasi kitin cangkang krustaceae laut yang banyak dimanfaatkan di berbagai bidang seperti medis dan farmasi, kosmetik, dan makanan. Kitosan juga merupakan senyawa alami yang potensial untuk mengendalikan penyakit prapanen dan pascapanen komoditas hortikultura. Kitosan memperoleh banyak perhatian di bidang pertanian karena bentuk dan sifatnya yang khas dalam menghambat pertumbuhan banyak cendawan patogen dan kemampuannya sebagai ketahanan tanaman (El Gaouth et al. 1992). Beberapa hasil penelitian menunjukkan bahwa pelapisan kitosan pada buah apel, kiwi, pir, stroberi, dan raspberry juga efektif mengendalikan busuk pascapanen pada saat penyimpanan (Banos et al. 2004). Meng et al. (2010) telah melaporkan bahwa kitosan efektif dalam mengendalikan
Alternaria kikuchiana dan Physalospora piricola penyebab kerusakan pascapanen buah pir pada konsentrasi 0.1%. Penelitian kitosan dengan konsentrasi 0.1% juga efektif sebagai antifungi Aspergilus niger (Li et al. 2008). Anirban (2013) melaporkan bahwa kitosan efektif dalam mengendalikan persen perkecambahan spora Fusarium solani dengan konsentrasi 0.2%. Selain itu, penyakit busuk buah kakao, kerdil hampa pada padi, busuk akar Fusarium pada tomat, Alfalfa Mosaic Virus, Potato Spindle Tuber Viroid pada daun tomat, dan antraknosa buah pepaya juga dapat dikendalikan dengan kitosan (Nawar 2005). Liu et al. (2006) juga telah menunjukkan bahwa kitosan dapat menghambat perkecambahan spora cendawan patogen penyebab kapang biru pada buah tomat, Penicillium expansum dan Botrytis cinerea secara signifikan.
3
Perumusan Masalah
Gangguan penyakit jabon di persemaian merupakan salah satu kendala yang dihadapi dalam usaha regenerasi tanaman ini. Penyakit mati pucuk merupakan salah satu penyakit yang sering dihadapi sehingga menjadi fokus penelitian ini. Hasil penelitian Aisah (2014), kejadian dan keparahan penyakit mati pucuk pada bibit jabon yang disebabkan oleh Botryodiplodia sp. mencapai 100%. Identifikasi molekuler yang dilakukan oleh Winara (2014), menginformasikan bahwa jenis patogen ini adalah B. theobromae.
Upaya pengendalian penyakit harus dilakukan karena fakta lapangan mengenai penyakit mati pucuk cukup tinggi. Selama ini pengendalian penyakit yang sering dilakukan yaitu dengan menggunakan fungisida sintetik, namun penggunaan fungisida sintetik banyak berdampak terhadap lingkungan dan menghasilkan residu (Sugipriatini 2009). Pengendalian hayati menjadi alternatif yang lebih aman terhadap manusia dan juga lingkungan (Sharma etal. 2009). Indonesia memiliki kekayaan alam yang tinggi dan dapat digunakan sebagai alternatif dalam melakukan pengendalian hayati salah satunya yaitu dengan menggunakan kitosan yang berasal dari cangkang krustacea. Kajian mengenai penggunaan kitosan dalam pengendalian hayati untuk tanaman kehutanan belum banyak dilakukan terutama potensinya dalam pengendalian penyakit mati pucuk pada bibit jabon. Penelitian ini diharapkan menjawab pertanyaan sebagai berikut :
1. Apakah kitosan efektif dalam mengendalikan mati pucuk pada bibit jabon? 2. Berapakan konsentrasi kitosan yang paling efektif dalam mengendalikan
penyakit mati pucuk pada bibit jabon?
Tujuan Penelitian
Tujuan penelitian ini adalah menguji efektivitas kitosan dalam mengendalikan B.theobromae penyebab mati pucuk pada bibit jabon dan menguji pengaruh viskositas kitosan dalam mengendalikan mati pucuk pada bibit jabon.
Manfaat Penelitian
Penelitian ini diharapkan mampu memberikan informasi yang berguna dalam upaya pengendalian penyakit mati pucuk pada bibit jabon. Informasi ini dapat dijadikan sebagai bahan pertimbangan dalam menentukan kebijakan pengelolaan persemaian bibit jabon sehingga dapat mengurangi kejadian dan keparahan penyakit mati pucuk pada tingkat persemaian.
TINJAUAN PUSTAKA
Kitosan
4
Gambar 1 Struktur kitosan
gugus asetilnya sehingga menyisakan gugus amina bebas yang menjadikannya bersifat polikationik dan merupakan rantai linier glukosamin dengan rumus (C6H11NO4)n. Kitosan tidak beracun dan tidak larut pada pH di atas 6.5. Adanya
gugus reaktif amino pada C-2, gugus hidroksil pada C-3 dan C-6 pada kitosan akan sangat berperan dalam aplikasinya antara lain sebagai pengawet dan penyetabil warna, serta sebagai flokulan dan membantu proses reverse osmosis dalam penjernihan air (Yulina 2011).
Kitosan merupakan padatan amorf yang berwarna putih kekuningan yang dapat larut pada beberapa asam organik seperti asam asetat, asam adipat, asam sitrat, asam format, asam laktat, asam maleat, asam malonat, asam oksalat, asam propionat, asam piruvat, asam suksinat, dan asam tartat pada pH sekitar 4.0 tapi tidak larut pada pH di atas 6.5, juga tidak larut dalam pelarut air, alkohol dan aseton (Sugita et al. 2009). Gugus amina kitosan dalam suasana asam bebas akan terprotonasi membentuk gugus amino kationik (Goy et al. 2009). Kitosan dalam bentuk terprotonasi menunjukkan kerapatan muatan tinggi bersifat polielektrolit kationik yang sangat efektif berinteraksi dengan muatan negatif dan biomolekul permukaan. Berikut merupakan struktur kitosan:
sumber: Pranomo et al. 2012
Aktivitas Antimikroba Kitosan
Beberapa penelitian telah dilaporkan bahwa kitosan dapat digunakan sebagai antimikroba, baik sebagai antibakteri maupun antifungi. Aktivitas antimikroba kitosan telah banyak dikembangkan pada berbagai macam bidang, diantaranya kosmetik, pengawet makan, dan pertanian. Sugipriatini (2009) melaporkan bahwa kitosan efektif dalam mengendalikan busuk buah pada buah mangga selama penyimpanan yang disebabkon oleh B. theobromae. Aktivitas antibakteri kitosan juga efektif dalam menghambat pertumbuhan Escherichia coli
dan Staphylococcus aureus (Yuliana 2011).
5
Jabon Putih (Anthocephalus cadamba (Roxb.) Miq.)
Taksonomi dan Botani
Secara taksonomi jabon dapat dideskripsikan sebagai berikut ( Mansur et al. 2010):
Anthocephalus macrophyllus (Roxb.) Havil., Nauclea cadamba (Roxb.), Neolamarkcia cadamba (Roxb.) Bosser,
Sarcocephalus cadamba (Roxb.) Kurz., Anthocephalus indicus A. Rich., dan Anthocephalusmorindaefolius Korth.
Nama daerah : Jabon, jabun, hanja, kelampeyan, kelampaian (Jawa); galupai, harapean, johan, alampain, kelampai, kelempi (Sumatera); ilan, kelampayan, taloh, tawa telan, tuak, tuneh, tuwak (Kalimantan); bance, pute, loeraa, pontua, suge manai, sugi manai, pekaung, toa (Sulawesi); gumpayan, kelapan, mugawe, sencari (Nusa Tenggara); dan aparabire, masarambi (Papua).
Jabon putih merupakan salah satu tanaman yang memiliki prospek tinggi untuk dikembangkan menjadi hutan tanaman. Pohon berukuran besar dengan batang lurus, batang silindris dan memiliki tajuk tinggi, dan sistem percabangan mendatar. Kulit batang muda berwarna abu-abu dan mulus, sedangkan kulit pohon tua kasar dan beralur. Tinggi pohon mencapai 45 m, dengan diameter 100-160 cm, dan kadang-kadang berbanir hingga ketinggian 2 m. Daun menempel pada batang utama, berwarna hijau mengilap, berpasangan, dan berbentuk oval-lonjong ukuran 15-50 cm x 8-25 cm (Soerianegara et al. 1993). Bunga berupa kepala terminal bulat tanpa brakteol, bertangkai, berwarna oranye atau kuning. Bunga bersifat biseksual, terdiri dari lima bagian, kelopak bunga berbentuk corong. Mahkota bunganya berbentuk seperti cawan. Benang sarinya ada lima dan melekat pada tabung mahkota. Buahnya merupakan buah majemuk, berbentuk bulat dan lunak. Buah jabon memiliki biji yang sangat kecil, berbentuk kapsul berdaging, dan berisi sekitar 8.000 biji. Biji berbentuk trigonal, tidak teratur, dan tidak bersayap (Soerianegara et al. 1993).
Penyebaran dan Karakteristik
Jabon tersebar secara alami di berbagai wilayah antara lain Australia, Cina, India, Indonesia, Malaysia, Papua Nugini, Filipina, Singapura, dan Vietnam. Jabon telah disebar ke Kosta Rika, Puerto Riko, Afrika Selatan, Suriname, Taiwan, Venezuela, dan negara-negara subtropis, serta tropis lainnya (Orwa et al. 2009).
6
tumbuh pada tanah aluvial, liat, lempung podsolik, dan tanah tuf halus. Kisaran suhu maksimal untuk pertumbuhan jabon yaitu 32-42 °C, sedangkan kisaran suhu
minimalnya 3-15.5 °C. Jabon dapat tumbuh pada daerah kering dengan curah hujan
tahunan paling sedikit 200 mm (Krisnawati et al. 2011; Martawijaya et al. 1989).
Kegunaan
Menurut Mulyana et al. (2010), jabon berpotensi untuk dikembangkan dalam pembangunan hutan tanaman, hutan rakyat, maupun tujuan lainnya seperti: penghijauan, reklamasi lahan bekas tambang, dan pohon peneduh. Kayu jabon baik digunakan untuk pembuatan peti, papan tipis, korek api, pensil, vinir dan kayu lapis serta untuk pulp dan kertas (Wahyudi 2012).
Kayu jabon juga digunakan sebagai bahan pembuatan sampan dan perkakas rumah sederhana, lapisan inti atau lapisan permukaan vinir (kayu lapis), serta bahan papan partikel, papan semen, dan papan blok. Ekstrak daun jabon digunakan sebagai obat kumur dan daun segarnya sebagai pakan ternak. Kulit kayu kering digunakan sebagai bahan tonik dan obat menurunkan demam. Pewarna kuning dari kulit akar berfungsi sebagai tanin (Soerianegara et al. 1993).
Hama dan Penyakit
Salah satu tantangan dalam pengembangan hutan tanaman jabon adalah serangan hama dan penyakit. Serangan penyakit pada jabon dewasa hanya dilaporkan oleh Soerianegara et al. (1993) bahwa, Gloeosporium anthocephali
menyebabkan defoliasi sebagian atau seluruh daun jabon putih. Beberapa jenis serangga menyerang daun jabon putih. Sementara itu penelitian penyakit jabon pada tingkat bibit telah dilaporkan oleh Arshinta (2013); Aisah (2014); Winara (2014); Yanti (2015) menunjukkan bahwa, Botryodiplodia sp., penyebab penyakit mati pucuk, dapat menyerang bibit jabon putih.
Penyakit mati pucuk pada bibit jabon yang disebabkan oleh Botryodiplodia
sp. dapat menyebabkan kematian bibit hingga 15% yang ditemukan pada persemaian di daerah Bogor. Gejala mati pucuk pada bibit jabon diawali dengan nekrosis pada batang pada pucuk hingga batang mengering dan tidak mampu menopang daun. Gejala mati pucuk pada bibit jabon ditemukan pada bibit umur 2 sampai 6 bulan (Aisah 2014).
Botryodiplodia theobromae
Taksonomi dan Morfologi
Klasifikasi Botryodiplodia sp. menurut Alexopoulos et al. (1996), sebagai berikut :
7 yang khas dan pertumbuhannya yang cepat pada media agar. Menurut Gandjar et al. (1999) bahwa koloni B. theobromae pada media OA (Oatmeal Agar) dan PDA (Potatoes Dextrose Agar), membentuk miselia yang lebat dan berwarna cokelat tua dengan piknidia berbentuk bulat, berleher panjang, dan berwarna hitam kehijauan. Konidia bersel dua saat tua dengan ukuran 22-28 µm x 12-15 µm, berbentuk elips, berwarna cokelat tua, dan memiliki garis longitudinal. Punithalingam (1976) menunjukkan bahwa, miselium B. theobromae berbentuk seperti benang halus atau kapas dan memiliki miselium udara yang banyak. Pertumbuhan piknidia
Botryodiplodia sp. pada media buatan bersifat jarang dan membutuhkan waktu yang lama. Miselium tumbuh cepat dan konstan. Pada awalnya miselium berwarna putih kemudian berubah menjadi hitam setelah 3-4 minggu (Kunz 2007). Piknidia
B. theobromae berbentuk sederhana, bergerombol, beragregat, stromatik, dan
ostiolate. Konidia muda berupa uniseluler, hialin, granulosa, subovoid sampai
ellipsoid, berdinding tebal, dan memotong seperti sekat, sedangkan konidia tua memiliki uniseptate dan berwarna coklat dengan ukuran 20-30 μm x 10-15 μm. Profil fungi B. theobromae disajikan pada Gambar 2 (Barnet dan Hunter 1999).
Gambar 2 Profil fungi Botryodiplodia sp. (1) piknidia, (2) konidiofor, (3) konidia muda, (4) konidia matang
Karakteristik dan Inang
B. theobromae menjadi patogen pada beberapa inang di dunia dengan kisaran inang yang luas. Patogen ini merupakan parasit lemah yang menginfeksi melalui luka-luka mekanis, seperti luka akibat pemangkasan atau serangga (Semangun 2007), namun hasil penelitian Aisah (2014); Yanti (2015) memperlihatkan bahwa B. theobromae dapat menginfeksi batang bibit jabon tanpa adanya pelukaan. Menurut Yanti (2015) penyakit mati pucuk pada bibit jabon putih dapat menyebabkan kematian. Penelitian Arshinta (2013) menunjukkan bahwa, bibit jabon putih dengan umur 3, 4, dan 5 bulan mengalami kejadian penyakit masing-masing sebesar 100%. Keparahan penyakit mati pucuk pada bibit jabon putih umur 5 bulan (54%) lebih rendah dibandingkan dengan bibit jabon putih umur 4 bulan (42%).
Menurut Begoude et al. (2009) Botryosphaeriaceae mempunyai distribusi inang yang sangat luas, yaitu monokotiledon, dikotiledon, gymnospermae, dan angiospermae. Penelitian Anggraeni et al. (2011) menunjukkan bahwa,
Botryodiplodia sp. merupakan patogen yang menyerang beberapa tanaman kehutanan di Indonesia, antara lain menyebabkan bercak daun pada pulai (Alstonia
8
Mekanisme Infeksi Patogen
Fungi merupakan patogen yang menginfeksi tumbuhan melalui luka, lubang-lubang alami, atau menembus secara langsung ke permukaan jaringan tanaman yang utuh. Lubang-lubang alami tersebut berupa stomata dan lentisel. Mekanisme patogen masuk melalui lubang-lubang alami dan luka adalah sebagai berikut, spora jamur menempel pada permukaan epidermis, berkembang, dan membentuk buluh kecambah. Selanjutnya buluh kecambah membesar dan membentuk apresorium berupa tabung penetrasi yang akan masuk ke dalam stomata atau luka. Apresorium membengkak, hifa berkembang membentuk haustorium, dan mengisap makanan sel inang. Mekanisme masuknya fungi pada permukaan jaringan utuh adalah dengan membentuk apresorium dan hifa. Senyawa penyusun kutikula dihancurkan secara biokimia oleh patogen. Selanjutnya, hifa akan menghancurkan sel epidermis yang tersusun oleh selulosa. Selulosa dinding sel akan mengalami pembengkakan. Hifa infeksi akan membuat saluran kecil di dalam bengkakan dan masuk ke dalam sel (Semangun 2007). Pada Gambar 3 menunjukkan mekanisme serangan patogen pada jaringan inang menggunakan senjata fisik mekanik (apresorium) (Semangun 1996).
Gambar 3 Mekanisme serangan patogen ke dalam jaringan inang menggunakan senjata fisik mekanik (apresorium)
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan November 2015 hingga Mei 2016. Penelitian dilakukan di Rumah Kaca Patologi Hutan dengan temperatur rata-rata saat penelitian yaitu 25.6 0C pada pagi hari, 31.1 0C pada siang hari, dan 26.4 0C
9
Alat dan Bahan
Bahan yang digunakan dalam penelitian meliputi isolat B. theobromae, larutan kitosan yang diperoleh dari Departemen Teknologi Hasil Perikanan Fakultas Perikanan dan Ilmu Kelautan IPB, bibit jabon putih umur 4 bulan, media
potato dextrose agar (PDA), aquades, kapas, dan aluminium foil. Peralatan digunakan dalam penelitian meliputi: autoclave, kabinet Laminar Air Flow,
corkbore, mikroskop, jarum suntik, termometer, objek glass, kompor, panci, gelas ukur 1 000 mL, gelas ukur 10 mL, spatula, cawan petri, labu erlenmeyer, sprayer, pipet tetes, timbangan analitik, Viskometer Brookfield, dan hidrometer.
Penyiapan Larutan Kitosan
Kitosan cangkang udang dalam bentuk serbuk diperoleh dari Departemen Teknologi Hasil Perikanan Fakultas Perikanan dan Kelautan IPB. Larutan kitosan 1.00% diperoleh dengan melarutkan 1 g serbuk kitosan dalam 20 mL asam asetat 1.5%, kemudian ditambahkan aquades hingga mencapai volume 100 mL (Pranomo
et al. 2012). Konsentrasi larutan kitosan 0.0% (K00), 0.1% (K01), 0,3% (K03), 0.5% (K05), 0.8% (K08) dibuat dengan pengenceran menggunakan aquades.
Diagram Alir Penelitian
Uji Viskositas Kitosan dan Penentuan Bobot Molekul
10
kitosan lainnya dengan dua kali ulangan. Bobot molekul kitosan dihitung dengan menggunakan persamaan Mark-Houwink (Yuliana 2011):
η = KMα Laboratorium Patologi Hutan Fakultas Kehutanan IPB. Perbanyakan isolat dilakukan dengan menggunakan media PDA. Sebelum isolat digunakan pada uji efektivitas kitosan, terlebih dahulu dilakukan uji virulensi patogen pada bibit jabon berumur 4 bulan dengan metode inokulasi blok agar tempel mengacu pada (Aisah 2014). Sumber inokulum diperoleh dengan cara memotong bagian ujung koloni isolat cendawan umur 7 hari dengan cork borer (Ø 6 mm). Setelah itu, potongan agar ditempel pada batang bagian atas (dilukai). Potongan blok agar yang ditempel pada bagian batang selanjutnya ditutup dengan kapas lembab dan aluminium foil. Gejala penyakit diamati dan dicatat hasilnya.
Reisolasi
Isolasi cendawan dari jaringan tanaman dilakukan berdasarkan metode Akrofi dan Amoah (2009) dalam Aisah (2014) dengan modifikasi pada penggunaan bahan disinfektan untuk sterilisasi permukaan jaringan tanaman. Langkah pertama, jaringan yang memperlihatkan gejala sakit diambil dari tanaman dengan cara dipotong. Potongan jaringan kemudian disterilisasi permukaan dengan cara direndam dalam larutan alkohol 70% selama 1 menit, lalu dicuci dengan air steril sebanyak 3 kali, selanjutnya dikeringkan di atas kertas saring steril yang ada di dalam cawan petri. Jaringan tanaman sakit tersebut kemudian dipotong pada bagian antara yang sehat dan sakit, lalu dimasukkan ke dalam cawan petri berisi media PDA (Potato Dextrose Agar). Potongan jaringan tanaman pada media PDA selanjutnya diinkubasi selama 7 hari. Koloni miselium yang tumbuh dari potongan jaringan yang diisolasi kemudian dimurnikan dan diperbanyak pada media PDA. Isolat cendawan yang diperoleh selanjutnyadigunakan sebagai bahan untuk identifikasi dan sumber inokulum.
Uji Efektivitas Kitosan In-vivo
11 hari setelah inokulasi. Inokulasi dilakukan dengan menggunakan metode penempelan blog agar berdasarkan Yanti(2015) dengan modifikasi. Batang jabon sehat dilukai dengan jarum suntik steril, kemudian potongan agar yang mengandung B. theobromae (diambil menggunakan corkbore berdiameter 6 mm) ditempelkan pada batang yang telah dilukai dan dilapisi dengan kapas lembab. Potongan agar mengandung patogen yang digunakan adalah kultur berumur 7 hari. Kemudian batang ditutup menggunakan aluminium foil untuk menjamin potongan patogen tidak terlepas selama 14 hari pengamatan. Kelembaban kapas dijaga dengan memberikan beberapa tetes aquades steril setiap hari. Tanaman kontrol diinokulasi dengan blok agar tanpa isolat. Parameter yang diamati adalah kejadian dan keparahan penyakit yang disebabkan oleh B. theobromae pada bibit, serta temperatur dan kelembaban udara dalam rumah kaca.
Kejadian penyakit (KjP) pada bibit jabon dihitung menggunakan rumus sebagai berikut (Rahma2013) :
��� =N x � %
Keterangan:
a = Jumlah tanaman yang bergejala N = Jumlah tanaman yang diamati KjP = Kejadian penyakit
Keparahan penyakit (KpP) diukur menggunakan rumus Toensend dan Hoeberger (dalam Rahma2013) sebagai berikut :
KpP =∑ ni x vi
Z x N � %
Keterangan:
ni = Jumlah tanaman yang terinfeksi dalam setiap kategori vi = Nilai numerik masing-masing kategori
N = Jumlah seluruh tanaman yang diamati Z = Nilai numerik kategori serangan tertinggi
Nilai numerik dan keparahan penyakit yang digunakan pada penelitian ini disajikan pada Tabel 1 dan Gambar 5. Kegiatan pengukuran temperatur dan kelembapan dilakukan pada pagi (06.00-07.00 WIB), siang (12.00-13.00 WIB), dan malam (18.00-19.00 WIB).
Tabel 1 Nilai numerik dan keparahan penyakit mati pucuk pada bibit jabon Nilai Numerik Keterangan Keparahan Penyakit
0 Sehat (tidak ada gejala infeksi)
1 ≤ 25% bagian tanaman mengalami nekrosis 2 25.1-50% bagian tanaman mengalami nekrosis 3 > 50% bagian tanaman mengalami nekrosis
4 Tanaman mati
12
Berikut adalah visualisasi nilai numerik dan keparahan penyakit mati pucuk pada bibit jabon yang digunakan mengacu pada metode penelitian Aisah (2014):
Analisis Data
Penelitian ini menggunakan rancangan dua faktor dalam Faktorial Rancangan Acak Lengkap (Faktorial RAL) dengan 5 ulangan. Faktor pertama adalah waktu penyemprotan, yang terdiri atas dua taraf yaitu, sebelum inokulasi (T0) dan setelah inokulasi (T1). Faktor kedua adalah konsentrasi larutan kitosan yang terdiri atas enam taraf 0.0% (K00), 0.1% (K01), 0,3% (K03), 0.5% (K05), 0.8% (K08), dan 1% (K10) (b/v). Sampel ditempatkan di dalam rumah kaca dan dilakukan pengacakan sesuai dengan rancangan.
Model statistik yang digunakan adalah sebagai berikut (Mattjik dan Sumertajaya 2002):
Yijk = + αi+ βj + (αβ)ij + ijk
keterangan:
Yijk = respon dari faktor waktu penyemprotan ke-i, faktor konsentrasi larutan
kitosan ke-j, serta ulangan ke-k µ = rataan umum
αi = pengaruh faktor waktu penyemprotan ke-i
βj = pengaruh faktor konsentrasi larutan kitosan ke-j
αβij = pengaruh interaksi faktor waktu penyemprotan ke-i dan factor
konsentrasi larutan kitosan ke-j
ijk = galat dari faktor waktu penyemprotan ke-i, faktor konsentrasi larutan
kitosan ke-j serta ulangan ke-k
13 Hasil uji efektivitas larutan kitosan dalam menghambat pertumbuhan B.
theobromae dianalisis dengan selang kepercayaan 95% menggunakan software
SAS 9.3.1. Apabila hasil analisis menunjukkan pengaruh nyata, maka dilanjutkan dengan uji jarak berganda Duncan.
HASIL DAN PEMBAHASAN
Hasil
Karakter Makroskopis dan Mikroskopis Isolat B. theobromae
Koloni B. theobromae muda mula-mula berwarna putih kemudian akan berubah warna menjadi abu-abu kehitaman setelah umur 3–4 minggu setelah isolasi (Gambar 6a). Miselia B.theobromae yang diamati memiliki sekat dan berdiameter ±4.7 µm (Gambar 6b), sedangkan konidianya berukuran 20–30 µm. Konidia muda
B. theobromae berwarna hialin dan konidia tuanya berwarna hitam dan memiliki sekat melintang (Gambar 6c).
Sumber Gambar 1(a,b): Nurafida (2014); 1(c): Aisah (2014)
Gambar 6 Pengamatan B. theobromae (a) koloni B. theobromae., (b) miselia B.
theobromae, dan (c) konidia B. theobromae
Gejala Mati Pucuk pada Bibit Jabon Oleh Cendawan B. theobromae
14
Gambar 7 Gejala mati pucuk pada bibit jabon. (a) bibit sehat, (b,c,d) bibit terinfeksi
B. theobromae
Virulensi B.theobromae
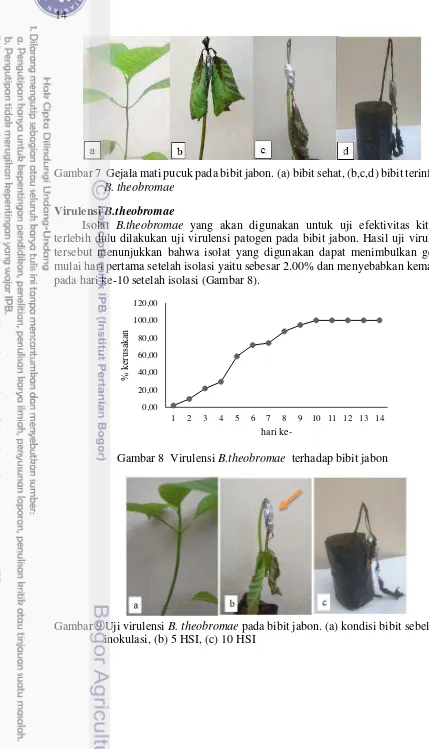
Isolat B.theobromae yang akan digunakan untuk uji efektivitas kitosan terlebih dulu dilakukan uji virulensi patogen pada bibit jabon. Hasil uji virulensi tersebut menunjukkan bahwa isolat yang digunakan dapat menimbulkan gejala mulai hari pertama setelah isolasi yaitu sebesar 2.00% dan menyebabkan kematian pada hari ke-10 setelah isolasi (Gambar 8).
Gambar 8 Virulensi B.theobromae terhadap bibit jabon
Gambar 9 Uji virulensi B. theobromae pada bibit jabon. (a) kondisi bibit sebelum inokulasi, (b) 5 HSI, (c) 10 HSI
0,00 20,00 40,00 60,00 80,00 100,00 120,00
1 2 3 4 5 6 7 8 9 10 11 12 13 14
% k
er
u
sak
an
ke-15
Viskositas dan Bobot Molekul
Pengukuran viskositas larutan kitosan menunjukkan bahwa konsentrasi larutan kitosan berbanding lurus dengan nilai viskositasnya, sehingga semakin pekat larutan kitosan maka viskositasnya semakin tinggi.
Tabel 2 Viskositas larutan kitosan dan bobot molekul
Konsentrasi (%) (b/v) ηr (cP) ηsp BM (kDa)
kemudian di konversi menjadi viskositas spesifik (ηsp) dapat dilihat pada tebel 2.
Bobot molekul kitosan diperoleh dengan persamaan Mark-Houwink menggunakan viskositas intrinsik (η) yang telah diketahui pada sertifikat analisis kitosan yang digunakan. Hasil perhitungan BM disajikan pada tabel 2.
Efektivitas Kitosan terhadap Pengendalian Mati Pucuk Bibit Jabon oleh Cendawan Botryodiplodia sp. secara In-Vivo
Konsentrasi larutan kitosan berpengaruh terhadap keparahan penyakit mati pucuk pada bibit jabon. Konsentrasi terbaik dalam menghambat perkembangan serangan adalah 0.1% dengan keparahan penyakit sebesar 7.90%. Besarnya konsentrasi kitosan tidak selalu berbanding lurus dengan penghambatan serangan
B. theobromae pada bibit jabon (Tabel 3).
Tabel 3 Pengaruh konsentrasi larutan kitosan terhadap besar serangan
B.theobromae pada bibit jabon
Konsentrasi (%) (b/v) ηsp Keparahan penyakit (%)
0.00 1.82 75.20a
Waktu penyemprotan larutan kitosan memiliki pengaruh nyata terhadap besar serangan B.theobromae pada bibit jabon. Waktu pemyemprotan yang efektif yaitu sebelum dilakukan inokulasi B. theobromae pada bibit jabon dengan keparahan penyakit sebesar 31.10% jika dibandingkan dengan waktu penyemprotan larutan kitosan setelah inokulasi sebesar 50.30% (Tabel 4).
Tabel 4 Pengaruh waktu penyemprotan terhadap besar keparahan penyakit
B.theobromae pada bibit jabon
Waktu Penyemprotan Keparahan Penyakit (%)
Sebelum inokulasi 31.10a
16
Tabel 5 Kejadian dan keparahan penyakit
Perlakuan KjP (%) KpP (%)
keterangan: (T0) waktu penyemprotan sebelum inokulasi, (T1) waktu penyemprotan setelah inokulasi, dan (K) konsentrasi larutan kitosan.
Waktu penyemprotan dan konsentrasi larutan kitosan berpengaruh nyata terhadap persen keparahan penyakit, akan tetapi keduaanya tidak memiliki interaksi dalam melakukan penghambatan pertumbuhan B.theobromae dalam menyerang bibit jabon. Berbeda halnya dengan tingkat kejadian penyakit, kedua faktor tidak memiliki pengaruh nyata.
Tingkat keparahan penyakit tertinggi terjadi pada bibit jabon yang tidak diberi larutan kitosan (T0K00 dan T1K00) yaitu sebesar 80%. Perlakuan paling efektif yaitu penyemprotan larutan kitosan sebelum inokulasi dengan konsentrasi 0.1% dan 0.3% dengan tingkat keparahan penyakit sebesar 25%. Hasil pengukuran keparahan penyakit disajikan pada Tabel 5.
Pembahasan
Karakter Makroskopis dan Mikroskopis Isolat B. theobromae
Koloni B. theobromae mula-mula berwarna putih kemudian akan berubah warna menjadi abu-abu kehitaman setelah umur 3–4 minggu setelah isolasi (Gambar 6a). Miselia Botryodiplodia sp. yang diamati memiliki sekat dan berdiameter ±4.7 µm (Gambar 6b), sedangkan konidianya berukuran 20–30 µm. Konidia muda Botryodiplodia sp. berwarna hialin sedangkan konidia tuanya berwarna hitam dan memiliki sekat melintang (Gambar 6c) (Nurafida 2014).
Piknidia B. theobromae tidak ditemukan setelah 1 bulan masa inkubasi (Nurafida 2014 dan Yanti 2014). Menurut Kunz (2007), perkembangan piknidia
Botryodiplodia spp. pada media buatan bersifat jarang dan membutuhkan waktu yang lama. Aisah (2014) berhasil menemukan piknidia berwarna hitam bulat dan dapat dilihat secara langsung yang tumbuh setelah 21 hari inkubasi.
Gejala Mati Pucuk pada Bibit Jabon oleh Cendawan B. theobromae
17 diawali dengan layu dan mengerutnya bagian batang (Aisah 2014). Gejala mati pucuk pada daun juga menimbulkan nekrosis dan daun menggulung. Daun yang terserang lebih lanjut akan mengering secara menyeluruh bahkan beberapa terlepas dari bagian tanaman.
Infeksi yang diawali dari batang akan berkembang menuju bagaian atas hingga ke pucuk selanjutnya berkembang ke bagian bawah hingga ke pangkal. Hal ini terjadi karena batang bagian atas masih sekulen sehingga lebih mudah terserang dibandingkan dengan batang bagian bawah (Aisah 2014). Gejala penyakit akan terhambat atau berhenti pada bagian batang yang telah mengeras, sehingga bibit yang telah memiliki batang cukup keras terkadang masih bisa bertahan hidup dengan cara menghasilkan tunas baru. Bibit jabon yang terinfeksi cendawan B. theobromae
secara berkelanjutan dapat mengalami kematian (Gambar 7d). Kematian bibit jabon terjadi dengan mengering atau membusuknya seluruh bagian tanaman. Pembusukan batang pada bibit jabon putih, menunjukkan bahwa patogen B. theobromae telah merusak pada jaringan epidermis, korteks, dan stele (Yanti 2014).
Virulensi B. theobromae
Uji virulensi dilakukan dengan menginokulasikan cendawan pada bibit jabon. Hasil uji virulensi tersebut menunjukkan bahwa isolat yang digunakan dapat menimbulkan gejala mulai hari pertama setelah inokulasi yaitu sebesar 2.0% dan menyebabkan kematian pada hari ke-10 setelah inokulasi (Gambar 8). Hasil ini menunjukkan bahwa isolat yang digunakan masih cukup virulen atau mampu menimbulkan gejala pada tanaman inang sehingga dapat digunakan untuk penelitian. Selain itu, isolat ini juga belum mengalami penurunan virulensi karena pada mulanya isolat yang diperoleh juga telah dilakukan uji virulensi oleh Winara (2014) dengan hasil yang sama.
Viskositas dan Bobot Molekul
Viskositas suatu fluida merupakan daya hambat yang disebabkan oleh gesekan antara molekul-molekul cairan, yang mampu menahan aliran fluida sehingga dapat dinyatakan sebagai indikator tingkat kekentalannya (Warsito et al. 2010). Semakin besar nilai viskositas suatu fluida maka semakin sulit fluida tersebut untuk mengalir dan bergerak. Nilai viskositas dipengaruhi oleh konsentrasi larutan (Yulina 2011), sehingga secara bersama viskositas dan konsentrasi larutan berpengaruh terhadap daya hambat pertumbuhan penyakit mati pucuk pada bibit jabon.
Hasil pengukuran viskositas larutan kitosan menunjukkan bahwa semakin tinggi konsentrasi larutan kitosan maka nilai viskositasnya meningkat (Tabel 2). Prisma et al. (2014) menyatakan bahwa viskositas larutan berbanding lurus secara eksponensial dengan konsentrasi larutan itu sendiri. Hal ini berarti konsentrasi larutan kitosan rendah lebih encer dan mudah bergerak, sedangkan konsentrasi larutan kitosan tinggi lebih kental dan sulit bergerak.
18
molekul kitosan yang digunakan dalam penelitian tersebut yaitu 50, 140, 200, 800, dan 1 000 kDa. Hasil penelitian tersebut menunjukkan bahwa semakin rendah bobot molekul maka semakin kuat daya hambat terhadap pertumbuhan A. niger.
Kitosan dengan bobot molekul 50 kDa memiliki aktivitas antijamur terbaik dan dapat menghambat pertumbuhan A. niger sebesar 98.24% dalam waktu 72 jam. Penelitian lain mengenai pengaruh BM terhadap aktivitas antijamur telah dilakukan oleh Lauzardo et al. (2008). Hasil penelitiannya menyimpulkan bahwa BM rendah kitosan efektif dalam menghambat pertumbuhan miselia, sedangkan kitosan dengan BM tinggi efektif dalam mengahambat perkecambahan spora.
Hasil perhitungan bobot molekul kitosan yang digunakan dalam penelian ini dengan menggunakan persamaan Mark-Houwink yaitu sebesar 20.6 kDa (Tabel 2). Goy et al. (2009) telah menglasifikasikan kitosan berdasarkan bobot molekul dibedakan menjadi 3, meliputi kitosan dengan BM rendah yaitu ˂50 kDa, BM sedang 50-150 kDa, dan BM tinggi yaitu ˂150 kDa. Berdasar klasifikasi tersebut maka kitosan yang digunakan termasak ke dalam kitosan dengan BM rendah, sehingga diharapkan dapat berpengaruh baik dalam menghambat pertumbuhan B. theobromae.
Younes et al. (2014) melaporkan tidak ada kecenderungan secara umum bahwa aktivitas antifungi kitosan berhubungan dengan meningkat atau menurunnya BM, tetapi tergantung jenis fungi tertentu. Sebagian besar penelitian yang telah dilakukan sejauh ini menyimpulkan bahwa kitosan dengan BM rendah lebih efektif dalam menghambat pertumbuhan jamur maupun bakteri. BM kitosan berpengaruh terhadap ukuran kitosan, oleh karena itu kitosan dengan BM rendah memiliki ukuran yang lebih kecil. Hal ini berpengaruh terhadap kemampuan kitosan BM rendah dalam menembus rongga dinding sel sehingga dapat penghambat metabolisme sel jamur, sedangkan kitosan dengan BM tinggi tidak dapat menembus rongga dinding sel, akibatnya kitosan BM tinggi hanya dapat berinteraksi dengan dinding sel jamur (Li et al. 2008).
Efektivitas Kitosan terhadap Pengendalian Mati Pucuk Bibit Jabon oleh Cendawan B. theobromae
Nurafida (2014) telah melaporkan hasil uji efektivitas kitosan terhadap penghambatan pertumbuhan Botryodiplodia sp. secara in-vitro. Penelitian tersebut menunjukkan bahwa kitosan efektif dalam menghambat pertumbuhan
Botryodiplodia sp. pada media PDA. Perlakuan konsentrasi larutan kitosan memberikan pengaruh nyata terhadap penghambatan pertumbuhan Botryodiplodia
sp. Konsentrasi yang efektif larutan kitosan dalam menghambat pertumbuhan isolat yaitu 1.0% dengan pertumbuhan diameter 15.1 mm atau persen penghambatan sebesar 77.8%.
19 menunjukkan bahwa kitosan dapat meningkatkan pertumbuhan pada tanaman tomat.
Uji efektivitas kitosan dalam mengendalikan mati pucuk pada bibit jabon dilakukan menggunakan dua faktor yaitu waktu penyemprotan kitosan dan konsentrasi larutan kitosan. Seluruh bibit jabon yang telah diinokulasi B. theobromae menunjukkan adanya gejala penyakit mati pucuk sehingga kejadian penyakit pada semua perlakuan sebesar 100%. Hasil pengolahan data menggunakan aplikasi SAS 9.1.3 dengan taraf nyata 95% menunjukkan bahwa faktor waktu penyemprotan dan konsentrasi larutan kitosan berpengaruh nyata terhadap penghambatan perkembangan penyakit mati pucuk pada bibit jabon yang disebabkan oleh cendawan B. theobromae, tetapi kedua faktor tidak saling berinteraksi dalam mengmbat perkembangan penyakit tersebut (Lampiran 1).
Waktu penyemprotan dilakukan satu hari sebelum dan setelah inokulasi. Waktu efektif penyemprotan larutan kitosan dilakukan sebelum inokulasi. Bibit jabon dengan penyemprotan kitosan sebelum inokulasi mengalami keparahan penyakit mati pucuk sebesar 31.10%, sedangkan bibit jabon dengan penyemprotan kitosan setelah inokulasi mengalami keparahan penyakit sebesar 50.30% (Tabel 5). Hasil tersebut sesuai dengan penelitian Simanjuntak (2012) mengenai pengaruh kitosan terhadap penyakit kerdil hampa pada tanaman padi yaitu efektif pada perlakuan penyemprotan sebelum inokulasi mampu menghambat keparahan penyakit hingga 40.74%. Hal ini diduga karena larutan kitosan yang disemprotkan ke permukaan terutama daun mudah diserap oleh jaringan tanaman melalui lubang alami seperti stomata sehingga jalan masuknya patogen ke tanaman terhalang (Suptijah et al. 2010).
Konsentrasi larutan kitosan berpengaruh dalam menghambat pertumbuhan miselia fungi. Selain menghambat pertumbuhan miselia, kitosan sangat efektif dalam menghambat pertumbuhan spora (Lauzardo et al. 2007). Penelitian konsentrasi hambat minimal kitosan sebagai antifungi telah dilaporkan oleh Hadrami et al. (2010) yaitu berkisar antara 0.001-0.500%. Konsentrasi larutan kitosan yang digunakan dalam penelitian ini yaitu 0.00, 0.10, 0.30, 0.50, 0.80, dan 1.00% dengan masing-masing keparahan penyakit mati pucuk pada bibit jabon sebesar 75.20, 7.90, 23.70, 29.10, 51.00, dan 57.30% (Tabel 4). Data tersebut menunjukkan bahwa konsentrasi kitosan yang efektif dalam menghambat perkembangan mati pucuk pada bibit jabon yaitu 0.10% yang hanya menyerang 7.90% bagian bibit, sedangkan pada konsentrasi larutan kitosan lebih tinggi bagian tanaman yang terserang cenderung lebih besar. Perlakuan yang paling efektif yaitu pemberian larutan kitosan konsentrasi 0.1% sebelum dilakukan inokulasi dengan tingkat keparahan penyakit sebesar 25%, sedangkan bibit jabon tanpa penyemprotan larutan kitosan memiliki tingkat keparahan penyakit hingga 80% (Tabel 6).
20
antimikroba. Hal ini diduga terkait dengan viskositas larutan kitosan. Tingginya konsentrasi larutan kitosan menyebabkan tingkat kekentalan larutan yang tinggi sehingga kemampuan mengalirnya lebih rendah dan sulit masuk ke dalam jaringan tanaman. Hal ini sesuai dengan penelitian Rosman et al. (2016) bahwa konsentrasi pupuk daun rendah yang disemprotkan pada panili lebih mudah diserap oleh tanaman. Nurainy et al. (2008) bahwa kosentrasi larutan kitosan yang rendah lebih mudah berdifusi pada media agar.
Hingga saat ini ada tiga kemungkinan mekanisme kitosan sebagai antifungi. Pertama, interaksi kitosan dengan muatan negatif fosfolipid membran sel yang mengakibatkan peningkatan permeabilitas sel dan menyebabkan kebocoran isi sel (Chatterje et al. 2014). Kedua, kitosan berperan dalam mengikat elemen tertentu termasuk penjerapan logam sehingga beberapa nutrisi penting tidak tersedia dan pertumbuhannya menjadi tidak normal. Ketiga, penetrasi kitosan ke dalam dinding sel dan berinteraksi dengan DNA sehingga berpengaruh terhadap produksi protein dan enzim penting (Younes et al. 2014 dan Sugita et al. 2009).
Kitosan mempunyai bentuk spesifik mengandung gugus amino dalam rantai karbonnya. Pada pH asam, gugus amin bebas (-NH2) kitosan menjadi bermuatan
positif untuk membentuk gugus amin kationik (NH3), sehingga dalam keadaan cair
sensitif terhadap kekuatan ion tinggi. Kitosan memiliki gugus fangsional amina (-NH2) bermuatan positif yang sangat reaktif, sehingga mampu berikatan dengan
dinding sel yang bermuatan negatif. Kitosan dapat berinteraksi dengan bahan-bahan yang bermuatan, seperti protein, polisakarida anionik, asam lemak, asam empedu dan fosfolipid karena kitosan memiliki muatan positif pada gugus NH (Killay et al. 2015 dan Trisnawati et al. 2013).
Berbagai hipotesis mengenai mekanisme kitosan sebagai antimikroba masih berkembang yaitu sifat afinitas yang dimiliki oleh kitosan yang sangat kuat dengan DNA mikroba sehingga dapat berikatan dengan DNA yang kemudian mengganggu mRNA dan sintesa protein. Kitosan dapat menginduksi enzim kitisase yang dapat mendegradasi kitin yang merupakan penyusun utama dinding sel cendawan (El Gaouth et al. 1992). Aktivitas antifungi dari kitosan BM rendah telah diteliti menggunakan sebuah chemical genomic screen dengan analisis gene deletion array
(GDA) pada Saccharomyces cerevisiae untuk 1.75 mg ml-1 kitosan dan mendeteksi
21
SIMPULAN DAN SARAN
Simpulan
Pemberian larutan kitosan dapat menekan keparahan penyakit mati pucuk yang disebabkan oleh cendawan B. theobromae pada bibit jabon. Konsentrasi optimum larutan kitosan dalam mengendalikan penyakit mati pucuk pada bibit jabon yaitu 0.1%. Waktu penyemprotan larutan kitosan terbaik dilakukan sebelum inokulasi patogen. Interaksi faktor konsentrasi dan waktu penyemprotan larutan kitosan tidak berpengaruh nyata terhadap keparahan penyakit mati pucuk pada bibit jabon.
Viskositas larutan kitosan berpengaruh dalam menekan perkembangan penyakit mati pucuk pada bibit jabon. Nilai viskositas lebih rendah memberikan afek lebih baik dalam menekan keparahan penyakit. Viskositas larutan kitosan yang efektif dalam menekan keparahan penyakit mati pucuk pada bibit jabon yaitu 3.80.
Saran
Perlu di lakukan penelitian yang lebih mendalam mengenai pengaruh karakteristik kitosan terhadap kemampuannya dalam menghambat pertumbuhan B. theobromae penyebab mati pucuk pada bibit jabon serta mekanismenya sebagai antifungi. Kitosan dapat digunakan sebagai alternatif fungisida sintetik bagi pengelola persemaian sehingga lebih aman untuk lingkungan.
DAFTAR PUSTAKA
Aisah AR. 2014. Identifikasi dan patogenitas cendawan penyebab primer penyakit mati pucuk pada bibit jabon (Anthocephalus cadamba (Roxb.) Miq). [tesis]. Bogor (ID): Institut Pertanian Bogor.
Aisah AR, Soekarno BPW, Achmad. 2015. Isolasi dan identifikasi cendawan yang berasosiasi dengan penyakit mati pucuk pada bibit jabon (Anthocephalus cadamba (Roxb.) Miq). J Penelitian Hutan Tanaman. 12(3):153-163. Alexopoulus CJ. 1996. Introductory Mycology. 5th Ed. New York (US): J Willey. Anggraeni I, Lelana NI. 2011. Diagnosis Penyakit Tanaman Hutan. Haneda NF,
Rahayu S, editor. Bogor (ID): Pusat Litbang Peningkatan Produktivitas Hutan. Anirban. 2013. Fungicidal potencial of chitosan against phytopathogenic
Fusarium solani. J of Experimental Biology and Sciences.
Arshinta P. 2013. Pengaruh pH dan penggoyangan media terhadap pertumbuhan
Botryodiplodia sp. dan uji patogenisitas Botryodiplodia sp. pada bibit jabon [skripsi]. Bogor(ID): Institut Pertanian Bogor.
22
Barnet HL, Hunter BB. 1999. Illustrated Genera of Imperfect Fungi. 4th edition. Minessota (US): APS Press.
Bautista S, Lauzardo H, de Valle V, Lopez H, Barka A, Molina B dan Wilson CL. 2006. Chitosan as a potential natural compound to control pre and post harvest diseases of horticultural commodities. Crop Protection. 25: 108-118. Chatterje S, Chatterje BP, Guha AK. 2014. A study on antyfungal activity of water soluble chitosan against Macrophomina paseolina. International J Biological Macromolecules. 67:452-457. doi:10.1016/j.ijbimac.2004.04.008.
Chen KST, Ku Ya, Lee CH, Lin HR, Chen TM. 2005. Immobilization of chitosan gel with cross-linking reagent on PNIPAAm gel/PP nonwoven comosite survace. Materials Science and Engineering C.25:472-478.
El Gaouth A, Arul J, Asselin A, Benhamou N. 1992. Antifungal activity of chitosan on post-harvest pathogens: induction of morphological and cytological alterations in Rhizopus stolonifer. Mycol Res. 9:769–779. doi:10.1016/S0953-7562(09)80447-4.
Gandjar I, Samson RA, Van K, Oetari A, Santoso I. 1999. Pengenalan Kapang Tropik Umum. Jakarta (ID): Yayasan Pustaka Obor Indonesia.
Goy RC, Douglas B,Odilio BGA. 2009. A review antimicrobial activity of chitosan. J Polymer 19:1-7.
Hadrami AE, Adam LR, Hadrami IE, Daayf. 2010. Chitosan in Plant Protection.
Marine Drugs. 8:968-987. doi:10.3390/md8040968.
Hamdayanty, Yunita R, Amin NN, Damayanti TA. 2012. Pemanfaatan kitosan untuk mengendalikan antraknosa pada pepaya (Colletrotichum gloeosporioides) dan meningkatkan daya simpan buah. J Fitopatol Indones. 8(4):97-102.
Hasri. 2010. Prospek kitosan dan kitosan termodifikasi sebagai biopolimer alami yang menjanjikan. J Chemica. 11(2):1-10.
Killay A, Nurpudji A, Suryani A, Meta M. 2015. Chitosan as antimicrobial agent and fatty acid absorber in smoked skipjack tuna processed using coconut shell. American Journal of Life Sciences. 3(2):93-99. doi: 10.11648/j.ajls.20150302.16
Krisnawati H, Kallio M, Kanninen M. 2011. Anthocephalus cadamba Miq.: Ekologi, Silvikultur dan Produktivitas. Bogor (ID): CIFOR
Kunz R. 2007. Control of Post Harvest Disease (Botryodiplodia sp.) of Rambutan and Annona Species by Using a Bio-Control Agent (Trichoderma sp.). Lauzardo ANH, Banos SB, Valle MGV, Montealvo M, Rifera MMS, Perez LAB.
2008. Antifungal effects of chitosan with different moleculas weight on in vitro development of Rhizopus stolonifer. J Carbohydrate Polymers. 73:541-547. doi:10.2016/j.carbpol.2007.12.020.
Liu J, Tian S, Meng X, Xu Y. 2006. Effects of chitosan on control of postharvest diseases and physiological responses of tomato fruit. Postharv Biol Tech.
44(2007):300-306.
Li XF, Xiao QF, Sheng Y, Ting PW, Zhong XS. 2008. Effects of molecular weight and concentration of chitosan on antifungal activity against Aspergilus niger. Iranian Polymer Journal. 17(11):843-852
23 Marquez IG, Akuaku J, Cruz I, Cheetham J, Gholsani A, Smith ML. 2013.
Disruption of protein syntesis as antifungal mode of action by chitosan. I J of Food Mic. 164:108-112. doi:10.1016/j.ijfoodmicro.2013.03.025.
Martawijaya A, Kartasujana I, Mandang YI, Prawira SA, Kadir K. 1989. Atlas Kayu Indonesia Jilid II. Bogor (ID): Pusat Penelitian dan Pengembangan Hasil Hutan Bogor.
Mattjik AA, Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor (ID): IPB Press.
Megasari D, DamayantiTA, Santoso S. 2014. Pengendalian Aphis craccivora Koch. dengan kitosan dan pengaruhnya terhadap penularan Bean common mizaic virus starin Black eye cowpea (BCMV-BIC) pada kacang panjang. Jurnal Entomologi Indonesia. 11(2):72-80. Doi:10.5994/jei.11.2.72
Meng X, Yang L, Kennedy JF, Tian S. 2010. Effects of chitosan and oligo chitosan on growth of two fungal pathogens and physiological properties in pear fruit.
Elsevier. 81:70-75.doi:10.1016/j.carbpol.2010.01.057.
Mulyana D, Asmarahman C, Fahmi I. 2010. Bertanam Jabon. Jakarta: Agromedia Pustaka.
Nawar LS. 2005. Chitosan and three Trichoderma spp. to control Fusarium crown and root rot of tomato in Jeddah, Kingdom Saudi Arabia. Egypt J Phytopathol. 33(2005): 45-58
Nurafida D. 2014. Keefektifan kitosan dalam mengendalikan Botryodiplodia sp. pada jabon (Anthocephalus cadamba) secara in vitro. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nurainy F, Rizal S, Yudiantoro. 2008. Pengaruh konsentrasi kitosan terhadap aktivitas antibakteri dengan metode difusi agar (sumur). J Teknologi Industri dan Hasil Pertanian. 12(2):117-125.
Orwa C, Mutua A, Kindt R, Jamnadass R, Anthony S. 2009. Agroforestry tree database: a tree species reference and selection guide version 4.0. [diunduh
22 Jun 2014]. Tersedia pada:
http://www.Wordagroforestry.org/treedb2/AFTPDFS/Anthocephalus.cadam ba.pdf.
Pratiwi. 2003. Prospek Pohon Jabon untuk Pengembangan Hutan Tanaman.
Buletin Penelitian dan Pengembangan Kehutanan 4(1):62-66.
Pranomo E, Prabowo PSA, Purnawan C, Wulansari J. 2012. Pembuatan dan karakterisasi kitosan vanilin sebagai membran polimer elektrolit. J Penelitian Kimia. 8(1):70-78.
Prisma AJP, Djoko DJ, Masruroh M. 2014. Pengaruh konsentrasi dan viskositas larutan polistiren terhadap morfologi permukaan dan ketebalan lapisan ZnPc pada permukaan QCM. Phisics Student Jornal. 2(1):1-4.
Punithalingam E. 1976. CMI Descriptions of Pathogenic Fungi and Bacteria. England (GB): Commonwealth Mycological Institute.
Rahma H. 2013. Penyakit layu stewart (Pantoea stewartii subsp. Stewartii) pada jagung dan upaya pengendaliannya [disertasi]. Bogor(ID): Institut Pertanian Bogor.
Rosman R, Soemono S, Suhendra. 2016. Pengaruh konsentrasi dan frekwensi pemberian pupuk daun terhadap pertumbuhan panili di pembibitan.[Internet].
24
http://balittro.litbang.pertanian.go.id/ind/images/publikasi/bul.vol.15.no.2/3-Rosihan-Panili.pdf.
Sharma RR, Dinesh S, Rajbir S. 2009. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists. Biol Contr. 50(2009):205–221. Semangun H. 2007. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Ed
ke-2. Yogyakarta (ID): Gadjah Mada University Pr.
Simanjuntak VTA. 2012. Pengaruh kitosan terhadap penyakit kerdil hampa pada tanaman padi. [tesis]. Bogor(ID): Institut Pertanian Bogor.
Soerianegara I, Lemmens RHMJ. 1993. Plant Resources of South-East Asia: Timber Trees: Major Commercial Timbers. Belanda: Pudoc Scientific Publishers.
Sugipriatini D. 2009. Potensi penggunaan khamir dan kitosan untuk pengendalian busuk buah Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (syn.
Botryodiplodia theobromae Pat.) pada buah mangga selama penyimpanan. [tesis]. Bogor(ID): Institut Pertanian Bogor.
Sugita P, Sjahtiza TWA, Wahyono D. 2009. Kitosan Sumber Biomaterial Masa Depan. Bogor(ID): IPB Press.
Suptijah P, Agoes MJ, Sugara M. 2010. Teknik peranan kitosan dalam meningkatkan pertumbuhan tomat (Lycopersicum esculentum) selama vase vegetatif. J Sumberdaya Perairan. 4(1):24-29.
Trisnawati E, Andesti D, Saleh A. 2013. Pembuatan kitosan dari limbah cangkang kepiting sebagai bahan pengawet buah duku dengan variasi lama pengawetan.
J Teknik Kimia. 2(19):17-26.
Uthairatanakij A, da Silva JAT, Obsuwan K. 2007. Chitosan for improving orchid production and quality. Global Science Books.
Wahyudi. 2012. Analisis pertumbuhan dan hasil tanaman jabon (Anthocephalus cadamba). J Pertanian 8(1):19-24.
Warisno, Dahana K. 2011. Peluang Investasi: J Tanaman Kayu Masa Depan. Jakarta (ID): Gramedia Pustaka Utama.
Warsito, Sri WS, Dyan I. 2010. Desain dan analisis pengukuran viskositas dengan metode bola jatuh. J Natur Indonesia. 14(3): 230-23.
Winara A. 2014. Bioaktivitas ekstrak mahoni dan identifikasi jenis isolat
Botryodiplodia sp. penyebab mati pucuk pada bibit Jabon. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Yanti LA. 2015. Uji resistensi bibit jabon putih dan merah (Anthocephalus spp.) terhadap serangan Botryodiplodiatheobromae penyebab penyakit mati pucuk. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Yanti LA, Achmad, Khumaida N. 2015. Uji resistensi bibit jabon (Anthocephalus
spp.) terhadap Botryodiplodia theobromae (Pat.) penyebab mati pucuk. J.
Silvikultur Tropika. 6(2):83-92.
Younes I, Sellimi S, Rinaudo M, Jellouli K, Moncef N. 2014. Influence of acetilation degree and molecular weight of homogenous chitosans on antibacterial and antifungal activities. International J Food Mic. 1-30. doi:10.2016/j.jifoodmicro.2014.04.029.
25
26
Lampiran 1 Analisis sidik ragam keparahan penyakit pada bibit jabon The General Linier Model Procedure
Class Level Information Class Levels Values Waktu 2 T0 T1
Konsentrasi 6 K01 K03 K05 K08 K10 K00 Ulangan 5 1 2 3 4 5
Number of Observations Read 60 Number of Observations Used 60 Dependent Variable: keparahan penyakit
Source DF Sum of Squares
Mean Square F Value Pr > F
Model 11 38905.40000 3536.85455 5.33 <0.0001 Error 48 31867.20000 663.90000
Corrected Total 59 189875.00
R-Square Coeff Var Root MSE kejadianpenyakit Mean 0.549724 63.30776 25.76626 40.70000
Source DF Type I SS Mean
Square
F Value Pr > F
Waktu penyemprotan 1 5529.60000 5529.60000 8.33 0.0058 Konsentrasi kitosan 5 30713.00000 6142.60000 9.25 <.0001 Waktu*konsentrasi
kitosan
27 Lampiran 2 Data temperatur dan kelembaban selama 14 hari pengamatan
Hari ke- Temperatur (°C) Kelembaban (%)
Pagi Siang Malam Pagi Siang Malam
1 27 31 26 89 72 86
2 26 32 26 91 77 87
3 25 29 27 94 82 85
4 25 31 28 91 83 85
5 27 30 27 91 83 86
6 25 32 26 91 81 86
7 25 31 26 93 81 86
8 27 31 27 89 73 88
9 26 32 26 91 67 87
10 27 32 25 92 75 92
11 23 29 26 88 86 85
12 25 33 27 92 83 88
13 25 32 26 92 81 87
14 26 31 26 91 78 88
28
Lampiran 3 Gambar pengamatan keparahan penyakit
29 Lampiran 4 Karakteristik kitosan yang digunakan
Materi Standar Hasil
Penampilan Putih putih
Ukuran partikel serpihan-serbuk serbuk
DD ≥ 90% 93.80%
Viskositas 10-500 34.40cps
Kadar air ≤ 10% 7.68%
Kadar abu ≤1.5% 0.85%
30
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 25 Desember 1991, di Kabupaten Magelang, sebagai anak pertama dari tiga bersaudara dari pasangan Bapak Suryanto SPd dan Ibu Ismiyati SPd. Penulis memiliki dua saudara, yaitu Dwi Sulistya (18 tahun), dan Delya Nur Aini (12 tahun).