UJI ANTAGONIS Trichoderma harzianum TERHADAP
Botryodiplodia sp. PENYEBAB PENYAKIT MATI PUCUK
PADA JABON (Anthocephalus cadamba)
SECARA IN VITRO
SITI HARDINAH ADININGSIH
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Uji Antagonis Trichoderma harzianum terhadap Botryodiplodia sp. Penyebab Penyakit Mati Pucuk pada Jabon (Anthocephalus cadamba) secara in Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SITI HARDINAH ADININGSIH. Uji Antagonis Trichoderma harzianum terhadap Botryodiplodia sp. Penyebab Penyakit Mati Pucuk pada Jabon (Anthocephalus cadamba) secara in Vitro. Dibimbing oleh ACHMAD.
Permasalahan yang sering muncul dalam pembangunan hutan tanaman jabon (A. cadamba) yaitu adanya serangan Botryodiplodia sp. yang menyebabkan mati pucuk. Pengendalian hayati sangat perlu dilakukan sebagai upaya untuk menghambat pertumbuhan patogen dengan resiko kontaminasi terhadap lingkungan paling sedikit jika dibandingkan dengan pengendalian non hayati. Salah satu bentuk pengendalian hayati yaitu menggunakan agensia pengendali hayati T. harzianum. Penelitian ini bertujuan untuk mengetahui potensi T. harzianum sebagai agensia pengendali hayati untuk Botryodiplodia sp.. Uji antagonis yang dilakukan dalam penelitian ini yaitu dengan metode langsung (dual culture) dan metode tak langsung (filtrat T. harzianum). Rancangan percobaan yang digunakan yaitu menggunakan RAL (rancangan acak lengkap) in time dan RAL faktorial. Hasil penelitian ini menunjukkan bahwa pemberian T. harzianum dalam uji antagonis pada metode langsung dan tak langsung dapat menghambat pertumbuhan Botryodiplodia sp., hal ini menunjukan bahwa T. harzianum memiliki potensi dalam menghambat pertumbuhan Botryodiplodia sp. sehingga dapat digunakan sebagai pengendali hayati penyakit pada jabon (A. cadamba) khususnya yang disebabkan oleh Botryodiplodia sp..
ABSTRACT
SITI HARDINAH ADININGSIH. Trichoderma harzianum Antagonistic Examination Against Botryodiplodia sp. Cause of the Dieback Disease on Jabon (Anthocephalus cadamba) in Vitro Way. Supervised by ACHMAD.
Frenquently issues emerge on jabon (A. cadamba) plantations development is Botryodiplodia sp. aggression that cause dieback desease. Biology control is necessary as effort to hamper pathogen growth with lowest environmental contamination risk compared to non biological control. One of biological control configuration is using biological control agent T. harzianum the research supposed to acquire T. harzianum potency as biological control agent against Botryodiplodia sp.. In this research antagonist examination using direct method (dual culture) and indirect method (filtrate T. harzianum). Experiment model is using completely randomize design and in time completely randomize design. This research result shows that T. harzianum disposal in antagonist examination on direct mothode and indirect method against Botryodiplodia sp. growth. This case shows that T. harzianum has potency to against Botryodiplodia sp. growth. So that could be used as biological desease control on jabon (A. cadamba) especially caused by Botryodiplodia sp..
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
UJI ANTAGONIS Trichoderma harzianum TERHADAP
Botryodiplodia sp. PENYEBAB PENYAKIT MATI PUCUK
PADA JABON (Anthocephalus cadamba)
SECARA IN VITRO
SITI HARDINAH ADININGSIH
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Uji Antagonis Trichoderma harzianum terhadap Botryodiplodia sp. Penyebab Penyakit Mati Pucuk pada Jabon (Anthocephalus cadamba) secara in Vitro
Nama : Siti Hardinah Adiningsih NIM : E44100066
Disetujui oleh
Prof Dr Ir Achmad, MS Pembimbing
Diketahui oleh
Prof Dr Ir Nurheni Wijayanto, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2014 ini ialah uji antagonis, dengan judul Uji Antagonis Trichoderma harzianum terhadap Botryodiplodia sp. Penyebab Penyakit Mati Pucuk pada Jabon (Anthocephalus cadamba) secara in Vitro.
Terima kasih penulis ucapkan kepada Prof Dr Ir Achmad, MS selaku pembimbing, penghargaan penulis sampaikan kepada para staf Laboratorium Patologi Departemen Silvikultur Fakultas Kehutanan IPB, selain itu ungkapan terima kasih juga penulis sampaikan kepada orang tua, serta seluruh keluarga, sahabat-sahabat (anna, faridah, fitria, desi, momo dan nanda), teman-teman Silvikultur 47 dan Fahutan 47 atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Alat 2
Bahan 2
Prosedur Kerja 3
Prosedur Analisis Data 6
HASIL DAN PEMBAHASAN 7
Hasil 7
Pertumbuhan Isolat Botryodiplodia sp. 7
Pertumbuhan Isolat Trichoderma harzianum 7
Efek Penghambatan Trichoderma harzianum dengan Metode Langsung 8 Efek Penghambatan Trichoderma harzianum dengan Metode Tak Langsung
pada Media Kultur Padat 10
Efek Penghambatan Trichoderma harzianum dengan Metode Tak Langsung
pada Media Kultur Cair 11
Pembahasan 13
Peertumbuhan Isolat Botryodiplodia sp. dan Trichoderma harzianum 13 Efek Penghambatan Trichoderma harzianum dengan Metode Langsung 16 Efek Penghambatan Trichoderma harzianum dengan Metode Tak Langsung pada Media Kultur Padat 17 Efek Penghambatan Trichoderma harzianum dengan Metode Tak Langsung pada Media Kultur Cair 18
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
DAFTAR TABEL
1 Hasil uji Duncan pengaruh waktu terhadap persen penghambatan Botryodiplodia sp. pada media PDA dengan metode uji antagonis
langsung 9
2 Hasil uji Duncan pengaruh waktu terhadap persen penghambatan Botryodiplodia sp. pada media PFA dengan metode uji antagonis
langsung 10
3 Hasil uji Duncan pengaruh waktu terhadap persen penghambatan Botryodiplodia sp. pada media PDA dengan metode uji antagonis tak
langsung 10
4 Hasil uji Duncan pengaruh waktu terhadap persen penghambatan Botryodiplodia sp. pada media PFA dengan metode uji antagonis tak
langsung 11
5 Hasil uji Duncan pengaruh media dan teknik perlakuan terhadap bobot
Botryodiplodia sp. 12
DAFTAR GAMBAR
1 Metode biakan ganda Botryodiplodia sp. dengan T. harzianum dalam
satu cawan konfrontasi berdiameter 9 cm 5
2 Pertumbuhan koloni Botryodiplodia sp. 7
3 Pengamatan Botryodiplodia sp. ; (a) media PDA; (b) media PFA; (c)
mikroskopis Botryodiplodia sp. 7
4 Pertumbuhan koloni T. harzianum 8
5 Pertumbuhan makroskopis T. harzianum ; (a) media PDA; (b) media
PFA 8
6 Persen penghambatan Botryodiplodia sp. oleh T. harzianum pada media
PDA dan PFA 8
7 Pertumbuhan isolat Botryodiplodia sp. dan T. harzianum dalam cawan konfrontasi; (a) bagian atas pada media PDA; (b) bagian bawah pada media PDA; (c) bagian atas pada media PFA; (d) bagian bawah pada
media PFA 9
8 Persen penghambatan Botryodiplodia sp. oleh filtrat T. harzianum 10 9 Pertumbuhan koloni patogen Botryodiplodia sp.: (a) kontrol PDA; (b)
dengan filtrat T. harzianum pada media PDA; (c) kontrol PFA; (b)
dengan filtrat T. harzianum pada media PFA 11
10 Persen penghambatan Botryodiplodia sp. oleh filtrat T. harzianum pada
media PDB dan PFB 11
11 Biomassa Botryodiplodia sp. pada perlakuan kontrol dan penambahan
filtrat T. harzianum 12
12 Miselia Botryodiplodia sp. pada media PDB dan PFB; (a) kontrol; (b)
PENDAHULUAN
Latar Belakang
Hutan merupakan suatu kesatuan ekosistem berupa hamparan lahan yang berisi sumberdaya alam hayati yang didominasi oleh pepohonan yang persekutuan alam lingkungannya tidak dapat dipisahkan. Hutan memiliki banyak manfaat bagi kehidupan manusia baik secara langsung maupun tidak langsung. Pemanfaatan hutan yang berlebihan tanpa memperhatikan kelestariannya seiring dengan meningkatnya kebutuhan manusia, dapat menyebabkan terjadinya deforestasi. Deforestasi yang terjadi, telah menyebabkan menurunnya kualitas hutan alam.
Pembangunan hutan tanaman, salah satunya yaitu Hutan Tanaman Industri (HTI) merupakan suatu solusi untuk memperbaiki kualitas hutan alam yang ada di Indonesia dan meningkatkan produktivitas lahan serta kualitas lingkungan hidup. Kriteria jenis pohon yang dikembangkan untuk HTI yaitu cepat tumbuh dan dapat dimanfaatkan untuk industri olahan kayu yang memiliki pasar yang luas, salah satunya jabon (Anthocephalus cadamba).
Jabon (A. cadamba) merupakan tanaman lokal Indonesia jenis fast growing species (cepat tumbuh) selain itu jabon (A. cadamba) memiliki olahan kayu dengan permintaan yang tinggi dan pasar yang luas, namun untuk masa di pembibitan semua bibit ataupun semai rentan terhadap serangan patogen. Serangan patogen dapat menurunkan kualitas pada bibit. Salah satu patogen yang menyerang jabon di pembibitan adalah Botryodiplodia sp. yang menyebabkan mati pucuk (Aisah 2014).
Botryodiplodia sp. merupakan patogen yang memiliki kisaran inang yang luas. Patogen ini merupakan parasit lemah yang melakukan infeksinya melalui luka-luka mekanis seperti akibat pemangkasan atau luka akibat serangga (Semangun 2007). Pada awalnya, daun yang paling dekat dengan ranting yang terserang akan berwarna kuning, kemudian kerusakan akan terus meluas sepanjang cabang dan mencapai batang utama lalu tanaman akan mati dengan cepat. Bagian dalam ranting dan cabang akan mengalami perubahan warna menjadi coklat di bagian pembuluh. B. theobromae dapat menyebabkan mati pucuk, busuk buah, dan kanker batang (Semangun 2000). B. theobromae ditemukan pada pohon karet di Vietnam dan menyebabkan mati pucuk di pembibitan. Patogen terus berkembang dan menyebabkan kerusakan yang serius sehingga menekan produksi perkebunan di Dau Tieng Rubber Company (Pha et al. 2009). Menurut Rustini (2010) di Denpasar, Bali, hampir 53.24% dari buah pisang yang dijual mengalami pembusukan akibat cendawan B. theobromae, hal ini menyebabkan tidak terpenuhinya kebutuhan pasar karena permintaan pisang di Bali cukup tinggi untuk berbagai upacara keagamaan. Sejak akhir 1980 area perkebunan kakao di Kamerun mengalami kejadian penyakit mati pucuk yang luar biasa yang disebabkan oleh B. theobromae. Pada beberapa perkebunan di Kamerun, penyakit ini dapat merugikan tanaman kakao sampai 100%, sehingga menjadi pembatas produksi kakao di Kamerun (Mbenoun et al. 2008).
2
satu pengendalian hayati yang dapat dilakukan yaitu agensia pengendali hayati dengan menggunakan jamur antagonis. Beberapa jenis fungi telah diketahui memiliki kemampuan sebagai agensia pengendalian hayati, di antaranya Trichoderma spp., Gliocladium spp., Pythium sp. (Soesanto 2008). Salah satu spesies Trichoderma yang banyak dilaporkan memiliki kemampuan tersebut adalah T. harzianum (Widyastuti 2007; Jamilah 2008; Soesanto 2008). Penggunaan jamur antagonis dapat mengurangi pengendalian dengan menggunakan bahan kimia.
Perumusan Masalah
Penggunaan fungisida sintetis sebagai pengendali berbagai macam penyakit tanaman akan berdampak pada kerusakan lingkungan dan kesehatan manusia sehingga pengendalian secara alami sangat diperlukan untuk mengurangi dampak tersebut. Penggunaan T. harzianum merupakan salah satu alternatif yang dapat digunakan untuk pengendalian penyakit tanaman yang disebabkan oleh fungi. Oleh karena itu, permasalahan yang dapat dirumuskan berdasarkan latar belakang tersebut adalah berapa besar persen penghambatan T. harzianum dalam mengendalikan pertumbuhan koloni Botryodiplodia sp. pada jabon (A. cadamba) secara in vitro.
Tujuan Penelitian
Tujuan dari penelitian ini yaitu untuk mengetahui potensi T. harzianum sebagai agensia pengendali hayati untuk menghambat pertumbuhan Botryodiplodia sp. pada uji antagonis dengan metode langsung dan tak langsung.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan infomasi tentang potensi T. harzianum sebagai alternatif pengendalian penyakit jabon (A. cadamba) khususnya yang disebabkan oleh patogen Botryodiplodia sp. di pembibitan.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juni Agustus 2014 di Laboratorium Patologi Hutan Departemen Silvikultur Fakultas Kehutanan IPB.
Alat
3 mikroskop, oven, timbangan digital, pisau, sprayer, syringe filter, sentrifuse, batang penyebar, alat tulis, laptop, dan kamera.
Bahan
Penelitian ini memerlukan bahan berupa isolat Botryodiplodia sp. dan isolat T. harzianum yang merupakan koleksi Laboratorium Patologi Hutan Departemen Silvikultur Fakultas Kehutanan IPB. Media kultur PDA (Potato Dextrose Agar) dan media PFA (Potato Fructose Agar), PDB (Potato Dextrose Broth), PFB (Potato Fructose Broth), alkohol 70%, aquades, alumunium foil, wrap plastic, tissue, kapas, kentang, agar putih, chloramphenicol, spirtus, dekstrosa dan fruktosa.
Prosedur Kerja
Tahap Persiapan
Tahap persiapan dimulai dengan pembuatan media kultur dan penyiapan isolat fungi patogen dan fungi antagonis. Pembuatan media kultur padat dan cair menggunakan teknik yang digunakan oleh Nurafida (2014), sebagai berikut :
Pembuatan Media Kultur Padat PDA (Potato Dextrose Agar)
Pembuatan 1 liter PDA memerlukan 200 gram kentang yang telah dipotong dadu dan 500 ml aquades kemudian direbus hingga kentang menjadi empuk. Air ekstrak kentang dipisahkan, setelah itu dituang ke dalam wadah yang berisi dekstrosa (glukosa) 20 gram dan agar sebanyak 15 gram. Sebelum larutan dipindahkan ke dalam labu erlenmeyer, ditambahkan chlorampenicol dan diaduk hingga merata. Larutan kemudian ditambahkan aquades sampai larutan menjadi 1 liter. Media disterilkan menggunakan autoclave pada tekanan 1 atm dengan suhu 121 °C selama 15 menit.
Pembuatan Media Kultur Padat PFA (Potato Fructose Agar)
Pembuatan 1 liter PDA memerlukan 200 gram kentang yang telah dipotong dadu dan 500 ml aquades kemudian direbus hingga kentang menjadi empuk. Air ekstrak kentang dipisahkan, setelah itu dituang ke dalam wadah yang berisi fruktosa 20 gram dan agar sebanyak 15 gram. Sebelum larutan dipindahkan ke dalam labu erlenmeyer, ditambahkan chlorampenicol dan diaduk hingga merata. Larutan kemudian ditambahkan aquades sampai larutan menjadi 1 liter. Media disterilkan menggunakan autoclave pada tekanan 1 atm dengan suhu 121 °C selama 15 menit.
Pembuatan Media Kultur Cair PDB (Potato Dextrose Broth)
4
hingga merata. Media disterilkan menggunakan autoclave pada tekanan 1 atm dengan suhu 121 0C selama 15 menit.
Pembuatan Media Kultur Cair PFB (Potato Fructose Broth)
Satu liter PFB memerlukan 200 gram kentang yang telah dipotong dadu dan 1 liter aquades kemudian direbus hingga lunak. Air ekstrak kentang dipisahkan dan ditambahkan aquades hingga menjadi 1 liter larutan. Larutan dituang ke dalam wadah yang berisi fruktosa 20 gram. Sebelum larutan dipindahkan ke dalam labu erlenmeyer ditambahkan chloramphenicol dan diaduk hingga merata. Media disterilkan menggunakan autoclave pada tekanan 1 atm dengan suhu 121 0C selama 15 menit.
Penyediaan Isolat Fungi Patogen dan Antagonis
Isolat Botryodiplodia sp. diperoleh dari inang jabon (A. cadamba) yang terserang penyakit kemudian diisolasi dan merupakan koleksi dari Laboratorium Patologi Hutan Departemen Silvikultur Fakultas Kehutanan IPB. Isolat T. harzianum merupakan koleksi dari SEAMEO BIOTROP.
Tahap Pelaksanaan
Uji Antagonis Metode Langsung
Uji antagonis metode langsung dilakukan untuk mengetahui efek penghambatan dari potongan isolat T. harzianum terhadap pertumbuhan Botryodiplodia sp. yang ditumbuhkan secara bersamaan dalam cawan petri seperti pada Gambar 1 dengan perlakuan penggunaan media yang berbeda yaitu media kultur padat PDA dan PFA, masing-masing memiliki tiga kali ulangan. Uji antagonis dengan metode langsung menggunakan metode dalam penelitian Jamilah (2008) yaitu metode biakan ganda, dimana koloni fungi patogen dan koloni fungi antagonis yang telah berumur tujuh hari dipindahkan ke dalam cawan konfrontasi secara bersamaan pada sisi yang berlawanan dengan jarak 5 cm. Pertumbuhan jari-jari isolat patogen diukur pertumbuhannya setiap hari sampai hari ke-7 saat kedua isolat tersebut dikonfrontasikan.
Pengamatan dilakukan setiap hari dengan mengamati terbentuknya zona penghambatan dan persentase penghambatan. Zona penghambatan adalah panjang wilayah dalam cawan konfrontasi yang tidak ditumbuhi oleh kedua isolat yang saling antagonis. Pengukuran dilakukan dengan cara mengukur panjang dari zona kosong tersebut (Jamilah 2008). Persen penghambatan dihitung berdasarkan teknik yang digunakan dalam Rohana (1998) :
Keterangan :
PP : Persen penghambatan
5
Gambar 1 Metode biakan ganda Botryodiplodia sp. dengan T. harzianum dalam satu cawan konfrontasi berdiameter 9 cm.
Uji Antagonis Metode Tak Langsung
Uji Antagonis dengan metode tak langsung dilakukan dengan cara mengamati efek penambahan filtrat T. harzianum terhadap pertumbuhan Botryodiplodia sp.. Pembuatan filtrat T. harzianum sesuai dengan teknik yang digunakan dalam Achmad (1997). Media yang digunakan dalam tahap ini adalah PDB dan PFB. Tiga potongan koloni agen antagonis (Ø 8 mm) dimasukkan ke dalam 100 mL media PDB dan PFB dalam labu erlenmeyer 250 mL kemudian diinkubasi selama 7 hari pada suhu kamar. Setelah masa inkubasi berakhir, filtrat dipisahkan dari miselia cendawan melalui penyaringan dengan menggunakan kertas saring steril.
Dalam uji antagonis dengan metode tak langsung dilakukan dengan perlakuan media yang berbeda yaitu pada media kultur padat (PDA, PFA) dan media kultur cair (PDB, PFB). Pada media PDA dan PFA, penambahan filtrat T. harzianum pada media PDA dan PFA yaitu filtrat diteteskan sebanyak 3 mL di atas media PDA dan PFA yang sudah padat, setelah itu dibuat merata dengan batang penyebar keseluruh permukaan media. Potongan koloni patogen berdiameter 8 mm ditambahkan di tengah-tengah media dan diinkubasi selama 7 hari. Pengamatan yang dilakukan yaitu mengamati persen penghambatan setiap 12 jam selama 7 hari. Persen penghambatan dihitung dengan teknik yang dilakukan oleh Jeyaseelan et al. (2012) yaitu :
Keterangan :
PP : Persen penghambatan
D1 : Diameter koloni patogen pada cawan petri kontrol D2 : Diameter koloni patogen pada cawan perlakuan
Pada media PDB dan PFB filtrat T. harzianum diambil sebanyak 3 mL dan ditambahkan 20 mL pada media PDB dan PFB di dalam botol jam, setelah itu ditambahkan potongan koloni patogen ke dalamnya. Kontrol dibuat dengan mengganti media perlakuan dengan media PDB dan PFB dengan volume yang sama. Botol jam perlakuan maupun kontrol diinkubasi selama 7 hari pada suhu kamar. Miselia patogen disaring lalu ditentukan bobotnya setelah dikeringkan dalam oven 60 °C selama 24 jam. Persen penghambatan dihitung dengan teknik yang digunakan oleh Achmad (1997) :
6
Keterangan :
PP : Persen penghambatan
B1 : Biomassa koloni kontrol patogen (gram) B2 : Biomassa koloni perlakuan patogen (gram)
Prosedur Analisis Data
Data hasil pengukuran dianalisis dengan menggunakan analisis ragam, untuk mengetahui pengaruh yang diberikan terhadap peubah yang diamati menggunakan software SAS 9.1.3. Apabila hasil analisis menunjukkan pengaruh nyata, maka dilanjutkan dengan uji jarak berganda Duncan.
Uji antagonis in vitro T. harzianum terhadap pertumbuhan koloni Botryodiplodia sp. pada uji antagonis dengan metode langsung maupun tak langsung pada media kultur padat PDA dan PFA, dilakukan dalam pola RAL in time, tujuan RAL in time adalah untuk mengetahui perubahan respon dari suatu periode waktu ke periode waktu lainnya. RAL in time menggunakan model linier sebagai berikut (Mattjik dan Sumertajaya 2000):
Y
ij= μ + τ
i+
(i)k+ W
j+ (τW)
ij+
ijkKeterangan:
Yij : Pengamatan pada perlakuan antagonis
μ : Rataan Umum
τi : Pengaruh perlakuan antagonis
(i)k : Pengaruh acak pada perlakuan antagonis
Wj : Pengaruh waktu (cm/hari)
(τW)ij : Interaksi antara perlakuan antagonis dan waktu (cm/hari)
ijk : Pengaruh acak pada perlakuan antagonis, waktu (cm/hari), dan
ulangan
Analisis ragam RAL faktorial digunakan dalam menguji pengaruh macam media pada pertumbuhan isolat Botryodiplodia sp. dan T. harzianum dalam perlakuan kontrol dan menguji pengaruh uji antagonis metode tak langsung pada media PDB dan PFB dalam pola RAL sebagai berikut (Mattjik dan Sumertajaya 2000):
Keterangan:
Y ij : Nilai respon biomassa Botryodiplodia sp. pada perlakuan ke-i dan
ulangan ke-j µ : Rataan umum
αi : Pengaruh perlakuan ke-i
7
HASIL DAN PEMBAHASAN
Hasil
Pertumbuhan Botryodiplodia sp.
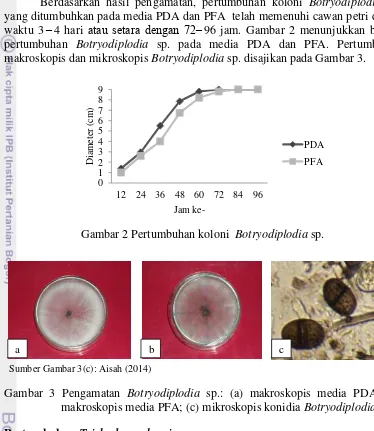
Berdasarkan hasil pengamatan, pertumbuhan koloni Botryodiplodia sp. yang ditumbuhkan pada media PDA dan PFA telah memenuhi cawan petri dalam waktu 3 4 hari 96 jam. Gambar 2 menunjukkan bahwa pertumbuhan Botryodiplodia sp. pada media PDA dan PFA. Pertumbuhan makroskopis dan mikroskopis Botryodiplodia sp. disajikan pada Gambar 3.
Gambar 2 Pertumbuhan koloni Botryodiplodia sp.
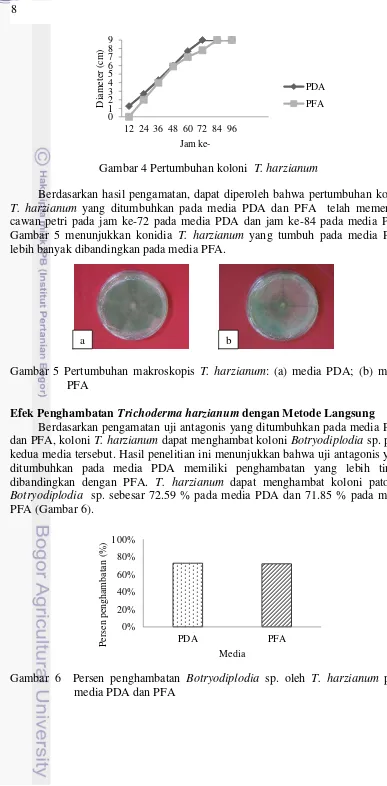
Sumber Gambar 3(c): Aisah (2014)
Gambar 3 Pengamatan Botryodiplodia sp.: (a) makroskopis media PDA; (b) makroskopis media PFA; (c) mikroskopis konidia Botryodiplodia sp.
Pertumbuhan Trichoderma harzianum
T. harzianum yang diisolasi digunakan sebagai kontrol dari uji antagonis, yang ditumbuhkan pada media PDA dan PFA. Pengamatan T. harzianum dilakukan secara makroskopis. Koloni T. harzianum mula-mula berwarna putih, kemudian akan mulai tumbuh konidia berwarna hijau setelah 60 jam setelah
3 hari (Gambar 4 ).
0 1 2 3 4 5 6 7 8 9
12 24 36 48 60 72 84 96
Diam
eter
(
cm
)
Jam ke-
PDA
PFA
8
Gambar 4 Pertumbuhan koloni T. harzianum
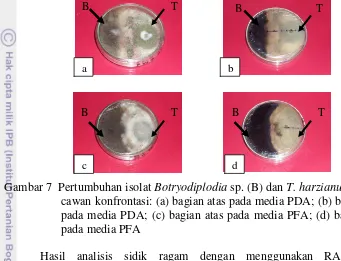
Berdasarkan hasil pengamatan, dapat diperoleh bahwa pertumbuhan koloni T. harzianum yang ditumbuhkan pada media PDA dan PFA telah memenuhi cawan petri pada jam ke-72 pada media PDA dan jam ke-84 pada media PFA. Gambar 5 menunjukkan konidia T. harzianum yang tumbuh pada media PDA lebih banyak dibandingkan pada media PFA.
Gambar 5 Pertumbuhan makroskopis T. harzianum: (a) media PDA; (b) media PFA
Efek Penghambatan Trichoderma harzianum dengan Metode Langsung
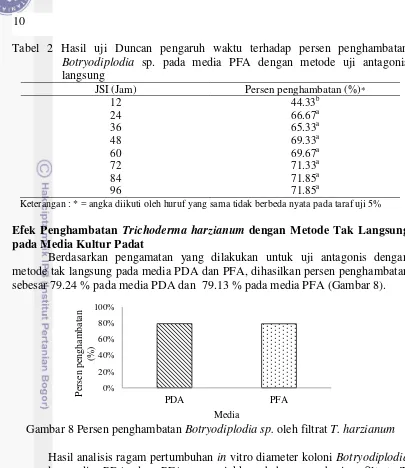
9 Gambar 7 menunjukkan penghambatan T. harzianum terhadap pertumbuhan koloni Botryodiplodia sp. yang dapat terlihat dari jari-jari koloni patogen Botryodiplodia sp. yang mendekati koloni antagonis T. harzianum lebih kecil dibandingkan jari-jari koloni patogen yang mendekati tepi, baik pada media PDA maupun media PFA (Gambar 7).
Gambar 7 Pertumbuhan isolat Botryodiplodia sp. (B) dan T. harzianum (T) dalam cawan konfrontasi: (a) bagian atas pada media PDA; (b) bagian bawah pada media PDA; (c) bagian atas pada media PFA; (d) bagian bawah pada media PFA
Hasil analisis sidik ragam dengan menggunakan RAL in time menunjukkan, bahwa waktu berpengaruh nyata terhadap uji antagonis T. harzianum terhadap pertumbuhan Botryodiplodia sp. terlihat dari persen penghambatan pada tabel hasil uji Duncan (Tabel 1, Tabel 2).
Tabel 1 Hasil uji Duncan pengaruh waktu terhadap persen penghambatan Botryodiplodia sp. pada media PDA dengan metode uji antagonis langsung
JSI (Jam) Persen penghambatan (%)*
12 52.00c
24 62.00b
36 62.00b
48 64.67ba
60 68.33ba
72 69.67ba
84 72.59a
96 72.59a
Keterangan : * = angka diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% JSI = jam setelah isolasi
a b
c d
B T B T
10
Tabel 2 Hasil uji Duncan pengaruh waktu terhadap persen penghambatan Botryodiplodia sp. pada media PFA dengan metode uji antagonis langsung
JSI (Jam) Persen penghambatan (%)*
12 44.33b
Keterangan : * = angka diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%
Efek Penghambatan Trichoderma harzianum dengan Metode Tak Langsung pada Media Kultur Padat
Berdasarkan pengamatan yang dilakukan untuk uji antagonis dengan metode tak langsung pada media PDA dan PFA, dihasilkan persen penghambatan sebesar 79.24 % pada media PDA dan 79.13 % pada media PFA (Gambar 8).
Gambar 8 Persen penghambatan Botryodiplodia sp. oleh filtrat T. harzianum Hasil analisis ragam pertumbuhan in vitro diameter koloni Botryodiplodia sp. pada media PDA dan PFA menunjukkan bahwa pemberian filtrat T. harzianum pada media memberikan pengaruh pada respon pertumbuhan diameter. Hasil selengkapnya disajikan pada Tabel 3 dan Tabel 4.
Tabel 3 Hasil uji Duncan pengaruh waktu terhadap persen penghambatan Botryodiplodia sp. pada media PDA dengan metode uji antagonis tak langsung
JSI (Jam) Persen penghambatan (%)*
12 73.33b
11 Tabel 4 Hasil uji Duncan pengaruh waktu terhadap persen penghambatan Botryodiplodia sp. pada media PFA dengan metode uji antagonis tak langsung
JSI (Jam) Persen penghambatan (%)*
12 63.33ba
Keterangan : * = angka diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%
Pada dua belas jam pertama koloni patogen Botryodiplodia sp. tumbuh pada cawan petri, sampai pada dua belas jam ketiga atau sekitar dua hari diameter koloni patogen mencapai 1.5 cm pada media PDA dan 1.7 cm pada media PFA, namun pada dua belas jam keempat dan seterusnya koloni patogen tidak ada penambahan diameter sampai hari ke-7 inkubasi (Gambar 9). Hal tersebut menandakan bahwa terjadinya penghambatan pada pertumbuhan koloni patogen Botryodiplodia sp. oleh filtrat T. harzianum.
Gambar 9 Pertumbuhan isolat Botryodiplodia sp.: (a) kontrol PDA; (b) dengan filtrat T. harzianum pada media PDA; (c) kontrol PFA; (b) dengan filtrat T. harzianum pada media PFA
Efek Penghambatan Trichoderma harzianum dengan Metode Tak Langsung pada Media Kultur Cair
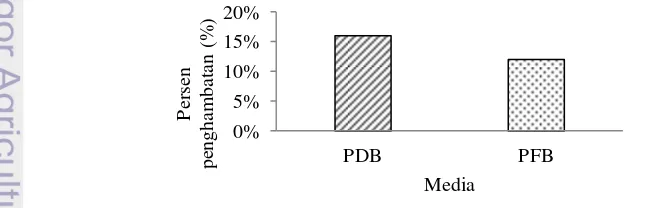
Persen penghambatan yang dihasilkan dalam uji antagonis dengan metode tak langsung pada media kultur cair yang telah ditambahkan filtrat T. harzianum terhadap pertumbuhan Botryodiplodia yaitu 16 % pada media PDB dan 12 % pada media PFB (Gambar 10).
12
Hasil analisis ragam menunjukkan bahwa macam media (PDB dan PFB) tidak berpengaruh nyata terhadap bobot Botryodiplodia sp. (Tabel 5).
Tabel 5 Hasil uji Duncan pengaruh media dan teknik perlakuan terhadap bobot Botryodiplodia sp.
Faktor Bobot Botryodiplodia sp.
Media tn
Perlakuan *
Media*Perlakuan tn
Keterangan : * = berbeda nyata pada taraf uji 5%; tn = tidak berbeda nyata pada taraf uji 5% Botryodiplodia sp. yang ditumbuhkan tanpa penambahan filtrat T. harzianum memiliki biomassa yang lebih tinggi yaitu 0.174 g pada media PDB dan 0.172 g pada media PFB dibandingkan dengan media yang telah ditambahkan filtrat T. harzianum yang memiliki bobot Botryodiplodia sp. yang lebih rendah yaitu 0. 152 g pada media PDB dan 0.154 g pada media PFB, hal tersebut menunjukkan bahwa penambahan filtrat T. harzianum berpengaruh nyata terhadap pertumbuhan Botryodiplodia sp. yang terlihat dari penurunan biomassa Botryodiplodia sp. (Gambar 11).
Gambar 11 Biomassa Botryodiplodia sp. pada perlakuan kontrol dan penambahan filtrat T. harzianum
Pada kertas saring dapat dilihat bahwa miselia Botryodiplodia sp. pada perlakuan kontrol memiliki ukuran yang lebih besar dibandingkan dengan perlakuan penambahan filtrat (Gambar 12). Hal tersebut menunjukkan bahwa terjadi pengurangan biomassa dari isolat Botryodiplodia sp. karena penambahan filtrat T. harzianum pada media kultur cair.
Gambar 12 Miselia Botryodiplodia sp. pada media PDB dan PFB: (a) kontrol; (b) perlakuan penambahan filtrat T. harzianum
13
Pembahasan
Pertumbuhan Botryodiplodia sp. dan Trichoderma harzianum
Pertumbuhan fungi memerlukan nutrisi di antaranya dalam bentuk karbon, unsur hara dan vitamin (Gandjar et al. 2006). Moore (1972) menjelaskan akan pentingnya unsur karbon bagi cendawan karena cendawan membutuhkan unsur karbon dalam jumlah yang besar daripada unsur-unsur esensial yang lain dan karbon merupakan nutrisi yang pokok dan terpenting pada fungi. Metabolisme karbohidrat memiliki peran yang penting yaitu dapat dioksidasi menjadi energi kimia yang tersedia di dalam sel dalam bentuk ATP (Adenosin Trifosfat) dan menyediakan hampir semua karbon yang diperlukan untuk fungi (Ganjdar et al. 2006).
Karbohidrat digolongkan ke dalam monosakarida, disakarida, oligosakarida dan polisakarida. Monosakarida adalah karbohidrat yang tidak dapat terhidrolisis menjadi satuan karbohidrat sederhana (Pratomo 2006). Monosakarida merupakan suatu molekul yang dapat terdiri dari lima atau enam atom C, monosakarida mengandung satu gugus aldehida yang disebut aldosa dan satu gugus keton yang dinamakan ketosa. Penggunaan media kultur fungi dalam penelitian ini memiliki sumber karbon yang berasal dari kelompok monosakarida yaitu fruktosa dan glukosa yang memiliki rumus molekul yang sama yaitu C6H12O6. Hal yang
membedakan yaitu glukosa merupakan monosakarida yang mengandung gugus aldehida sedangkan fruktosa merupakan monosakarida yang mengandung gugus keton.
Menurut Kusnandar (2011) struktur monosakarida bersifat asimetrik atau memiliki pusat kiral, yaitu mengikat gugus yang berbeda. Deret-D melambangkan posisi hidroksil dari gliseraldehida yang terletak di sebelah kanan sedangkan deret-L melambangkan posisi hidroksil gliseraldehida disebelah kiri. Pada umumnya struktur monosakarida di alam memiliki struktur D dan hanya sedikit yang memiliki struktur L. Dalam Winarno (2008) walaupun glukosa dan D-fruktosa sama-sama mempunyai bentuk yang sama yaitu D, tetapi terhadap cahaya yang terpolarisasi D-fruktosa bersifat pemutar kiri atau levo ( ), sedangkan D-glukosa pemutar kanan atau dextro (+). Karena itu untuk menggambarkan lebih
(+)- ( )-fruktosa. Menurut
Kusnandar (2011) dan Fessenden (1986) D-glukosa dapat disebut juga dextrosa, yang tersusun dari kata dextro yang berarti bersifat terpolarisasi ke kanan terhadap cahaya dan –osa merupakan sebutan untuk suatu gula pereduksi.
Secara umum penggunaan glukosa dan fruktosa merupakan jenis karbohidrat yang paling mudah untuk dimanfaatkan oleh fungi sebagai sumber karbon untuk pertumbuhannya. Gandjar et al. (2006) menyebutkan bahwa senyawa karbon organik yang dapat dimanfaatkan oleh fungi untuk membuat materi sel baru berasal dari karbohidrat. Karbohidrat menyediakan hampir semua karbon yang dibutuhkan oleh fungi. Banyak fungi yang memanfaatkan monosakarida, tetapi hanya sedikit yang memanfaatkan disakarida, oligosakarida dan polisakarida karena tidak memiliki kemampuan untuk menghidrolisis molekul-molekul besar tersebut.
14
4 hari setelah isolasi. Berdasarkan pengamatan secara mikroskopis,
Botryodiplodia sp. memiliki hifa bersekat. Hifa muda hialin sedangkan hifa tua berwarna kehitaman dengan ukuran diameter ± 4.7 µm (Gambar 3c). Konidia pada awalnya hialin dan tidak bersekat, kemudian berubah menjadi hitam dan bersekat satu atau bersel dua. Arshinta (2013) menerangkan bahwa Botryodiplodia sp. memiliki konidia yang terpencar secara tunggal dengan ciri-ciri berbentuk jorong dan memiliki sekat.
Botryodiplodia sp. memiliki tekstur miselia seperti benang halus dengan miselium udara yang tebal dan menyebar. Menurut Gandjar et al. (1999) koloni Botryodiplodia sp. tumbuh cepat pada media PDA dengan membentuk miselia aerial yang lebat dan berwarna coklat kehitaman. Gandjar et al. (1999) menerangkan bahwa pematangan konidia berjalan lambat sehingga sangat besar kemungkinan untuk menemukan konidia bersel satu dan berwarna hialin.
Botryodiplodia sp. yang ditumbuhkan tunggal pada media PDA dan PFA digunakan sebagai kontrol dari uji antagonis. Pertumbuhan Botryodiplodia sp. dalam penelitian ini pada media PFA, miselium yang tumbuh dari koloni patogen lebih tipis dibandingkan pada media PDA yang memiliki pertumbuhan miselium yang tebal (Gambar 3 a,b). Koloni Botryodiplodia sp. dalam kontrol pada hari ke-5 menunjukkan kondisi miselium yang sudah berwarna keabu-abuan pada media PFA sedangkan pada media PDA miselium masih berwarna putih. Hal ini menurut penelitian Retnosari (2011) disebabkan pertumbuhan Botryodiplodia sp. pada media yang kurang menguntungkan bagi pertumbuhan Botryodiplodia sp. akan lebih cepat memproduksi massa konidia yang berwarna kehitaman dalam media tersebut.
T. harzianum memiliki konidium yang halus dan lembut dalam pertumbuhannya. Koloninya berwarna hijau tua dan dapat mencapai pertumbuhan diameter lebih dari 9 cm dalam waktu 5 hari pada medium oat agar dan malt extract agar (Widyatusti 2007) . T. harzianum yang ditumbuhkan pada media PDA dan PFA digunakan sebagai kontrol dalam uji antagonis yang dilakukan. Dalam penelitian Widyastuti et al. (2003), konidia Trichoderma spp. tidak dapat berkecambah tanpa adanya nutrisi yang cukup (sumber karbon dan air). Ko dan Lockwood (1967) telah menyimpulkan bahwa ketersediaan nutrisi yang dapat digunakan untuk pertumbuhan Trichoderma spp. merupakan faktor pembatas perkecambahan konidium fungi.
Hasil analisis ragam menunjukkan bahwa, macam media tidak berpengaruh nyata terhadap pertumbuhan Botryodiplodia sp. dan T. harzianum, diduga hal ini dapat terjadi karena sumber karbon yang terkandung dalam media tersebut.
15 (2014) yang menunjukkan bahwa pada media PSB Botryodiplodia sp. memiliki bobot miselia lebih besar dibandingkan pada media PDB, meskipun hasil analisis statistik menunjukkan hasil yang tidak nyata.
Hasil analisis ragam pada penelitian ini menunjukkan bahwa macam media tidak berpengaruh nyata terhadap pertumbuhan T. harzianum meskipun berdasarkan pertumbuhan radial T. harzianum pada media kontrol PDA menunjukkan pertumbuhan yang lebih baik dibandingkan dengan media kontrol PFA. Hal tersebut sejalan Wahyudi et al. (2010) yaitu T. harzianum yang ditumbuhkan pada media yang mengandung glukosa ditambah dengan xilan memiliki pertumbuhan yang lebih cepat dibandingkan dengan xilan. Hal tersebut menunjukkan bahwa media yang mengandung glukosa mendukung pertumbuhan T. harzianum lebih baik dibandingkan dengan media yang tidak mengandung glukosa.
Secara umum, pertumbuhan miselium isolat Botryodiplodia sp. dan T. harzianum pada media kultur padat (PDA dan PFA) dan media kultur cair (PFB dan PDB) menunjukkan bahwa media kultur kentang dekstrosa (Potatos Dextrose Medium) menghasilkan pertumbuhan miselium terbaik dibandingkan media kultur kentang fruktosa (Potatos Fructose Medium) baik pada pertumbuhan radial maupun bobot biomassa. Hal tersebut sejalan dengan penelitian Chang dan Miles (2004) yang menunjukkan bahwa glukosa menjadi sumber karbon utama bagi banyak fungi pada media kultur sehingga pada media kultur kentang dekstrosa (glukosa) pertumbuhan isolat Botryodiplodia sp. dan T. harzianum menjadi yang terbaik.
Berdasarkan hasil analisis sidik ragam yang telah dilakukan menunjukkan bahwa macam media tidak berpengaruh nyata terhadap pertumbuhan isolat Botryodiplodia sp. dan T. harzianum pada media kultur yang mengandung dekstrosa dan fruktosa. Hal tersebut diduga karena sumber karbon yang digunakan masih dalam kelompok yang sama yaitu monosakarida yang merupakan gula sederhana. Pada metabolisme fungi terdapat proses untuk memproduksi energi yang dimulai dari proses pembongkaran glukosa atau biasa disebut proses glikolisis. Proses glikolisis didefinisikan sebagai proses perubahan satu molekul glukosa menjadi dua molekul piruvat. Dalam penelitian ini media yang digunakan memiliki sumber karbon yang berasal dari dekstrosa (glukosa) dan fruktosa. Dalam Ngili (2009) tidak semua kelompok monosakarida memiliki cara pemasukan langsung ke dalam jalur glikolisis seperti galaktosa yang harus diubah terlebih dahulu menjadi glukosa. Tetapi untuk yang lainnya tersedia urutan alternatif reaksi. Suatu jalur alternatif tersedia untuk metabolisme fruktosa, selain dari konversi langsung menjadi fruktosa 6-fosfat oleh enzim heksokinase. Jalur ini melibatkan konversi fruktosa oleh fruktokinase menjadi fruktosa 1-fosfat, yang kemudian dipotong oleh reaksi fruktosa 1-fosfat aldolase menjadi dihidroksiaseton fosfat dan gliseraldehid. Gliseraldehid kemudian di fosforilasi oleh gliseraldehid kinase untuk memberikan gliseraldehid 3-fosfat. Dengan demikian fruktosa diubah menjadi dihidroksiaseton fosfat dan gliseraldehid 3-fosfat, yakni dua intermediet C3 pada jalur glikolisis. Hal tersebut diduga yang
16
Efek Penghambatan Trichoderma harzianum denganMetode Langsung
Pengamatan penghambatan isolat Botryodiplodia sp. dilakukan dengan masa inkubasi 7 hari setelah isolasi. Efek penghambatan T. harzianum dengan metode langsung yaitu dengan menambahkan potongan isolat antagonis T. harzianum pada cawan petri yang berisi potongan isolat patogen Botryodiplodia sp. ( metode biakan ganda) dengan menggunakan media kultur padat yaitu PDA dan PFA.
Hasil analisis ragam menggunakan RAL in time menunjukkan bahwa penghambatan tertinggi yang dihasilkan pada media PDA maupun PFA terjadi pada jam ke-96 setelah isolasi (Tabel 1 dan Tabel 2). Hal tersebut sesuai dengan penelitian Harjono dan Widyastuti (2001) yang menyebutkan bahwa aktivitas enzim glukanase akan terus meningkat sampai hari ke-5 pada Trichoderma reesei. Oleh karena itulah persen penghambatan tertinggi dalam penelitian ini terjadi pada saat T. harzianum memiliki aktivitas enzim glukanase sebagai pengurai dinding sel patogen tertinggi yaitu pada jam ke-96 setelah isolasi (hari ke-4). Enzim glukanase yang memiliki kemampuan anti patogen memiliki substrat yang terdiri dari kitin dan glukan yang merupakan komponen utama penyusun dinding sel fungi patogen, sehingga enzim tersebut sangat berperan dalam menghambat pertumbuhan fungi patogen (Widyastuti 2007).
Hasil pengamatan menunjukkan persen penghambatan yang dihasilkan T. harzianum terhadap Botryodiplodia sp. yaitu 72.59% dalam media PDA dan 71.85% dalam media PFA. Penghambatan Botryodiplodia sp. disebabkan oleh T. harzianum yang tumbuh bersama dalam cawan konfrontasi. Menurut Soesanto (2008) T. harzianum memiliki hifa yang dapat melilit atau membelit jamur patogen tanaman. Komponen penting dinding sel sebagian besar fungi patogen adalah kitin dan glukan (Gandjar et al. 2006). Widyastuti (2007) menyebutkan bahwa Trichoderma spp. memiliki kemampuan dalam menghasilkan enzim pengurai dinding sel yaitu glukanase, selulase dan kitinase. Oleh karena itu, T. harzianum mampu menghambat pertumbuhan Botryodiplodia sp. sebagai fungi patogen melalui mekanisme penguraian dinding sel tersebut.
Persen penghambatan yang lebih besar pada media PDA yang dihasilkan T. harzianum terhadap Botryodiplodia sp., dapat dilihat dari pertumbuhan miselium pada perlakuan kontrol T. harzianum dalam media PDA yang lebih baik jika dibandingkan dengan perlakuan kontrol T. harzianum pada media PFA. Media yang mendukung pertumbuhan fungi antagonis dalam hal ini adalah PDA yang diduga membuat persen penghambatan yang dihasilkan tinggi terhadap fungi patogen. Hal ini sesuai dengan penelitian yang dilakukan oleh Castro et al. (2009) bahwa Trichoderma sp. memiliki pertumbuhan terbaik pada media yang mengandung glukosa.
Soesanto (2008) menyebutkan bahwa nutrisi merupakan salah satu faktor yang memengaruhi mikoparasitisme. Rhizoctonia solani sangat diparasit oleh Talaromyces flavus ketika ditumbuhkan pada media PDA yang mengandung dekstrosa dengan konsentrasi yang relatif tinggi (20 g). Parasitisme tidak ada artinya jika inang yang ditumbuhkan pada media PDA dengan konsentrasi 10 g dekstrosa per liter. Hal ini menunjukkan bahwa semakin tinggi tingkat dekstrosa, semakin naik keberadaan mikoparasit melalui peningkatan kepekaan inangnya.
17 penghambatan bersifat mikoparasitisme dapat dilihat dengan tidak adanya zona jernih (antibiosis) dalam cawan petri pada penghambatan Botryodiplodia sp. dengan metode langsung (dibuktikan pada Gambar 7).
Soesanto (2008) menyebutkan bahwa mikoparasitisme merupakan fenomena suatu fungi memarasit fungi lain pada taksonomi yang berbeda dengan melibatkan mekanisme penggabungan fisik. Empat tahap yang dibedakan berdasarkan kerja parasitisme di dalam mikoparasitisme yaitu pertumbuhan kemototrof, pengenalan, pelekatan, dan penguraian dinding sel inang.
Tahap pertumbuhan kemototrof pada penelitian ini dapat dijelaskan melalui mekanisme rangsangan kimia yang dihasilkan oleh Botryodiplodia sp. terhadap pertumbuhan T. harzianum. Kemudian dilanjutkan pada tahap pengenalan yang pada kebanyakan kasus bersifat spesifik antara satu jenis T. harzianum yang bersifat antagonis terhadap fungi patogen tertentu (Chet dalam Widyastuti 2007) dalam hal ini berarti terhadap fungi Botryodiplodia sp., kemudian pada tahap selanjutnya yaitu pelekatan. Pada tahapan ini hifa T. harzianum dapat tumbuh sepanjang hifa Botryodiplodia sp. atau membelit di sekeliling hifa tersebut dengan atau tanpa penetrasi. Taju penetrasi dari T. harzianum terbentuk baik dari hifa yang membelit atau dari hifa yang langsung kontak dengan miselium Botryodiplodia sp.. Setelah proses pelekatan, kemudian dilanjutkan tahap terakhir berupa penguraian dinding sel inang. Pada tahapan ini T. harzianum menghasilkan enzim kitinase dan glukanase yang dapat menguraikan dinding sel Botryodiplodia sp..
Penelitian yang dilakukan oleh Lorito et al. (1993) menunjukkan bahwa enzim kitinase dan glukanase lah yang mempunyai peran kunci dalam mekanisme mikoparasitisme. Enzim kitinase yang telah dimurnikan menunjukkan aktivitas antifungi yang signifikan terhadap perkembangan fungi patogen.
Efek Penghambatan Trichoderma harzianum dengan Metode Tak Langsung pada Media Kultur Padat
Efek penghambatan dengan metode tak langsung dilakukan dengan menggunakan media kultur padat PDA dan PFA yang ditambahkan filtrat T. harzianum pada setiap media yang akan ditumbuhkan Botryodiplodia sp.. Pengamatan dilakukan dengan masa inkubasi 7 hari, dengan mengamati persen penghambatan pada setiap media.
Penghambatan oleh filtrat T. harzianum semakin meningkat sampai hari ke-4 pada media PDA maupun PFA. Hal ini dibuktikan dari pertumbuhan Botryodiplodia sp. yang tidak menujukkan penambahan diameter untuk memenuhi cawan petri setelah hari ke-4 dimana filtrat T. harzianum ditambahakan. Jika dibandingkan dengan pertumbuhan Botryodiplodia sp. pada media PDA dan PFA dalam kontrol, maka aktivitas serupa ditunjukkan, bahwa setelah hari ke-4 cawan petri telah dipenuhi oleh miselium Botryodiplodia sp. secara radial sehingga tidak ada lagi penambahan diameter. Hal tersebut mengindikasikan bahwa terjadi penghambatan pertumbuhan Botryodiplodia sp. yang dihasilkan karena penambahan filtrat T. harzianum karena diduga dalam filtrat T. harzianum terkandung biochemist seperti antibiotik, toksin dan enzim (Soesanto 2008).
18
yang kecil. Kontrol T. harzianum yang ditumbuhkan pada media yang mengandung dekstrosa memiliki pertumbuhan terbaik dibandingkan dengan media yang mengandung fruktosa. Filtrat T. harzianum yang ditambahkan pada media PDA berasal dari isolat T. harzianum yang ditanamkan pada media PDB, hal tersebut diduga menjadi penyebab tingginya persen penghambatan yang dihasilkan filtrat T. harzianum terhadap Botryodiplodia sp. pada media yang mengandung dekstrosa.
Penelitian yang dilakukan oleh Margino (2008) menunjukkan bahwa antibiotik yang dihasilkan dari beberapa jamur dalam media yang mengandung glukosa dapat meningkatkan produksi antibiotik (antifungi). Menurut Cheeptam (1999) glukosa merupakan substrat penting dalam pertumbuhan dan biosintesis penghasilan metabolit sekunder, termasuk antibiotik.
Mekanisme penghambatan dengan menggunakan filtrat T. harzianum pada patogen disebabkan karena produksi antibiotik (Upadhyay dan Rai dalam Mishra 2010). Dalam mekanisme antibiosis, antibiotik sebagai biochemist yang dikeluarkan oleh T. harzianum lah yang memengaruhi persen penghambatan yang dihasilkan. Widyastuti (2007) menyebutkan bahwa Trichoderma spp. mengandung antibiotik senyawa glioviridin dan trichodermin yang dapat menghambat pertumbuhan fungi patogen. Senyawa lain yang dihasilkan oleh T. harzianum yaitu furanon. Furanon adalah senyawa yang dihasilkan dalam jumlah besar dalam medium tumbuh cair biakan T. harzianum, yang memperlihatkan penghambatannya terhadap Fusarium oxysporum (Soesanto 2008).
Efek Penghambatan Trichoderma harzianum dengan Metode Tak Langsung pada Media Kultur Cair
Filtrat T. harzianum yang ditambahkan pada media PDB dan PFB memberikan pengaruh terhadap pertumbuhan miselia Botryodiplodia sp.. Secara visual hasil miselia yang tumbuh pada media PDB dan PFB pada perlakuan kontrol dan penambahan filtrat T. harzianum yang telah dioven selama 24 jam dengan suhu 60° C dapat dilihat pada Gambar 11. Miselia yang terdapat pada Gambar 11a merupakan hasil dari pertumbuhan Botryodiplodia sp. pada perlakuan kontrol lebih besar dibandingkan dengan miselia Botryodiplodia sp. dengan penambahan filtrat T. harzianum pada Gambar 11b. Menurut Gandjar et al. (2006) menerangkan bahwa pertumbuhan miselia pada media cair biasanya membentuk lapisan yang berada di bagian atas media yang biasanya berwarna putih dan semakin lama menebal, sedangkan di bagian dalam media tumbuh miselia vegetatif seperti akar-akar yang bercabang sehingga mempengaruhi warna media menjadi lebih keruh.
19 Achmad dan Eny (2009) bahwa macam media (PDB dan PSB) tidak berpengaruh nyata terhadap pertumbuhan fungi Diplocarpon mali. Dari semua itu, yang terpenting adalah fungi memiliki kemampuan yang berbeda dalam menggunakan sumber karbon yang berbeda (Achmad dan Eny 2009).
Persen penghambatan yang dihasilkan oleh filtrat T. harzianum terhadap pertumbuhan Botryodiplodia yaitu 16 % pada media PDB dan 12 % pada media PFB (Gambar 12). Persen penghambatan yang dihasilkan oleh filtrat T. harzianum pada media PDB dan PFB tergolong kecil jika dibandingkan dengan efek penghambatan T. harzianum dengan metode tak langsung pada media kultur padat. Hal tersebut dapat diduga karena volume media kultur yang digunakan juga memengaruhi hal tersebut. Dalam media kultur cair volume media yang digunakan lebih besar yaitu 20 mL dalam botol jam, jika dibandingkan volume media kultur padat dalam cawan petri yaitu 10 mL, sehingga dalam efek penghambatan T. harzianum dengan metode tak langsung yang dilakukan, penambahan 3 mL filtrat pada kedua jenis media kultur tersebut menghasilkan penghambatan yang berbeda.
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian ini menunjukkan bahwa T. harzianum berpotensi untuk menghambat pertumbuhan Botryodiplodia sp. dengan metode langsung maupun tak langsung, sehingga dapat digunakan sebagai pengendalian penyakit pada jabon (A. cadamba) khususnya yang disebabkan oleh Botryodiplodia sp.. Mekanisme antagonis yang ditunjukkan oleh T. harzianum dalam penghambatannya yaitu mikoparasitisme dan antibiosis yang diduga melibatkan aktivitas enzim kitinase, glukanase dan antibiotik yang dimiliki T. harzianum untuk meluruhkan dinding sel patogen yang dapat membuat pertumbuhan fungi patogen Botryodiplodia sp. menjadi terhambat. Dalam penelitian ini, pertumbuhan isolat terbaik dan penghambatan tertinggi yang dihasilkan pada masing-masing perlakuan didukung oleh media kultur fungi yang mengandung dextrosa baik pada media kultur padat maupun cair.
Saran
20
DAFTAR PUSTAKA
Achmad. 1997. Mekanisme serangan patogen dan pertahanan inang serta pengendalian hayati penyakit lodoh pada Pinus merkusii [disertasi]. Bogor (ID):Institut Pertanian Bogor.
Achmad, Eny PS. 2009. Pengaruh Media Terhadap Pertumbuhan Cendawan Fusarium oxysporum. Buletin RISTRI 1(4):159-168.
Aisah AR. 2014. Identifikasi dan patogenitas cendawan penyebab primer penyakit mati pucuk pada bibit jabon (Anthocephalus cadamba (Roxb.) Miq) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Arshinta P. 2013. Pengaruh pH dan penggoyangan media terhadap pertumbuhan Botryodiplodia sp. dan uji patogenitas Botryodiplodia sp. pada bibit jabon [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Castro, O. R.H. A., Cornejo, C, L., Rodriguez. M & J. Bucio. L. 2009. The role of microbial signals in plant growth ang development. Plant signaling & Behavior. 4:8, 701 – 712.
Chang ST, Miles PG. 2004. Mushroom: Cultivation, Nutritional Value, Medicinal Effect and Environmental Impact. 2 nd Ed. Florida (US): CRC Press LLC.
Cheeptham N. 1999. Studies of antifungal antibiotic from Ellishiodotis inquinans L1588-A8 [tesis]. Japan (JPN): Hokkaido University.
Fessenden RJ, Fessenden SJ.1986. Kimia Organik. Hadyana AP, penerjemah; Pakpahan M, Harianja B, editor. Jakarta (ID): Penerbit Erlangga. Terjemahan dari: Organic Chemistry. Ed ke-3.
Gandjar I, Samson RA, Van K, Oetari A, Santoso I. 1999. Pengenalan Kapang Tropik Umum. Jakarta (ID): Yayasan Pustaka Obor Indonesia.
Gandjar I, Samson RA, Van K, Oetari A, Santoso I. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Yayasan Pustaka Obor Indonesia.
Hadar Y, Y Henis, I Chet. 1979. Biological Control of Rhizoctonia solani Damping off with Wheat Bran Culture of Trichoderma harzianum. Phytopathol. 68.
Harjono, SM Widyastuti. 2001. Antifungal Activity of Purified Endochitinase Produced by Biocontrol Agent Trichoderma reesie Againts Ganoderma philippii. Pakistan J. Biol. Sc. 4(10):1232-1234.
Jamilah R. 2011. Potensi Trichoderma harzianum (T38) dan Trichoderma pseudokoningii (T39) sebagai antagonis terhadap Ganoderma sp. penyebab penyakit akar pada pohon sengon (Paraserianthes falcataria (L) Nielsen.)[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Jesaseelan AC, S Tharmila, K Niranjan. 2012. Antagonistic Activity of Trichoderma spp. and Bacillus spp. against Pythium aphanidermatum isolated from Tomato Damping off. Scholars Research Library 4(4):1623-1627.
Ko W, JL Lockwood. 1967. Soil Fungistatis: Relation to Fungal Spore Nutrition. Phytopathol. 57: 894-901.
Kusnandar F. 2011. Kimia Pangan Komponen Makro. Bandung (ID): Dian Rakyat.
21 Antifungal Activity of Purified Endochitinase and Chitobiosidase. Phytopathology. 83:302-307.
Margino S. 2008. Produksi Metabolit Sekunder (Antibiotik) oleh Isolat Jamur Endofit Indonesia.Majalah Farmasi Indonesia. 19(2):86-94.
Mattjik AA, Sumertajaya IM. 2000. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor: IPB Press.
Mbenoun M, Momo ZEH, Samuels G, Amougou FN, Nyasse S. 2008. Dieback due to Lasiodiplodia theobromae, a new constraint to cocoa production in Cameroon. Plant Pathology. 57: 381. [internet]. [diacu 2012 Juli 17]. Tersedia dari: hhtp://ddr.nal.usda.gov/bitstream/10113/13435/1/IND440 32848.pdf.
Mishra VK. 2010. In vitro antagonism Trichoderma species against Phythium aphanidermatum. Journal of Phytology 2010, 2(9): 28-35.
Moore E, Landecker. 1972. Fundamentals of The Fungi. New Jersey: Prentice-Hall, Inc.
Ngili Y. 2009. Biokimia Metabolisme dan Bioenergitika. Yogyakarta: Graha Ilmu. Nurafida D. 2014. Keefektifan Kitosan dalam Mengendalikan Botryodiplodia sp.
pada Jabon (Anthocephalus cadamba) secara in Vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Pha TA, Dung PT, Hieu ND, Nghia NA. 2009. Disease caused by Botryodiplodia theobromae Pat. on rubber tree in Vietnam. Rubber Research Institute of Vietnam. [internet]. [diacu 2012 Desember 20]. Tersedia dari: http://www.rriv.org.vn/uploads/userfiles/28-BCMalaysia-Pha.ppt.
Pratomo R. 2006. Pengaruh macam pH dan Penggoyangan Media terhadap Pertumbuhan Cendawan Rhizoctonia sp.[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Retnosari E. 2011. Identifikasi penyebab busuk pangkal batang jeruk (Citrus spp.) serta uji antagonisme in vitro dengan Trichoderma harzianum dan Gliocladium virens [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rohana I. 1998. Efektifitas penggunaan Trichoderma harzianum dan fungisida mankozeb untuk pengendalian Rhizoctonia solani penyebab penyakit lodoh pada Acacia mangium [Skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Rustini NL. 2010. Aktivitas antijamur minyak atsiri rimpang dringo (Acorus calamus l.) Terhadap jamur Botryodiplodia theobromae penyebab busuk buah pisang. Jurnal Kimia 4 (2): 173-179.
Semangun H. 2000. Penyakit-penyakit Tanaman Perkebunan di Indonesia. Yogyakarta (ID): Gadjah Mada University Pr.
Semangun H. 2007 Penyakit-penyakit Tanaman Hortikultura di Indonesia. Ed ke- 2. Yogyakarta (ID): Gadjah Mada University Pr.
Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta (ID): Raja Grafindo Persada.
Wahyudi P, Suwahyono U, Mulyati S. 2010. Pertumbuhan Trichoderma harzianum pada medium yang mengandung xilan. Badan Pengkajian dan Penerapan Teknologi.
22
Widyastuti SM. 2007. Peran Trichoderma spp. dalam Revitalisasi Kehutanan di Indonesia. Yogyakarta (ID): UGM Pr.
Winara A. 2014. Bioaktivitas ekstrak mahoni dan identifikasi jenis isolate Botryodiplodia sp. prnyebab mati pucuk pada bibit jabon (Anthocephalus cadamba) [tesis]. Bogor(ID): Institut Pertanian Bogor.
Winarno FG. 2008. Kimia Pangan dan Gizi. Bogor (ID): MBrio.
23
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 11 Januari 1994 sebagai anak ketiga dari tiga bersaudara pasangan Uteng Sopiandi dan Teti Komarayati. Penulis merupakan lulusan SMA KORNITA Bogor (2010) dan pada tahun yang sama penulis masuk IPB melalui Undangan Seleksi Masuk IPB (USMI) di Departemen Silvikultur, Fakultas Kehutanan.
Selama menuntut ilmu di IPB penulis merupakan anggota dari Project Division Tree Grower ( ) 2013. Penulis melakukan Praktek Pengenalan Ekosistem Hutan (PPEH) di Kamojang dan Sacang Barat Garut, Jawa Barat (2012), Praktek Pengelolaan Hutan (PPH) di Hutan Pendidikan Gunung Walat (2013) dan Praktek Kerja Profesi di PT Restorasi Ekosistem Indonesia, Jambi (2014).
P “Uji Antagonis Trichoderma harzianum