EFEKTIVITAS PEMBERIAN PROBIOTIK CAIR PADA
TARAF BERBEDA TERHADAP FERMENTASI DAN
KECERNAAN
in vitro
RANSUM SAPI POTONG
ABDUL FICHAR MUZAKKI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Efektivitas Pemberian Probiotik Cair pada Taraf Berbeda terhadap Fermentasi dan Kecernaan in vitro
Ransum Sapi Potong adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2014
Abdul Fichar Muzakki
ABSTRAK
ABDUL FICHAR MUZAKKI. Efektivitas Pemberian Probiotik Cair pada Taraf Berbeda terhadap Fermentasi dan Kecernaan in vitro Ransum Sapi Potong. Dibimbing oleh ANITA SARDIANA TJAKRADIDJAJA dan JAJAT JACHJA FA.
Tujuan penelitian ini adalah mempelajari pengaruh suplementasi probiotik cair pada taraf yang berbeda terhadap fermentasi dan kecernaan in vitro ransum sapi potong. Percobaan fermentabilitas menggunakan rancangan acak kelompok berpola faktorial 3x4 dengan empat ulangan. Faktor A adalah ransum sapi potong tanpa atau dengan suplementasi probiotik cair pada berbagai taraf: A1=ransum kontrol, A2=A1 + probiotik cair 0.1% (vb-1), dan A3=A1 + probiotik cair 0.2% (vb-1). Faktor B adalah waktu inkubasi: 0, 1, 2, dan 3 jam. Percobaan kecernaan menggunakan rancangan acak kelompok dengan tiga perlakuan probiotik (A1, A2, A3) dan empat ulangan. Hasil penelitian menunjukkan bahwa suplementasi dengan probiotik cair pada berbagai taraf mempengaruhi konsentrasi NH3, VFA
total, populasi bakteri dan kecernaan. Waktu inkubasi mempengaruhi pH dan peubah tersebut kecuali pada kecernaan, namun perlakuan ini tidak menghasilkan efek signifikan terhadap degradabilitas, protozoa, dan sintesis protein mikroba. Hasil uji ortogonal polinomial menunjukkan bahwa A3 adalah perlakuan yang optimal.
Kata kunci: degradabilitas, fermentabilitas, kecernaan, probiotik cair
ABSTRACT
ABDUL FICHAR MUZAKKI. Effectivity of Liquid Probiotic Supplementation at different levels on in vitro Fermentation and Digestibility of Beef Cattle Ration. Supervised by ANITA SARDIANA TJAKRADIDJAJA and JAJAT JACHJA FA. The aim of this experiment was to study the effect of liquid probiotic supplementation at different levels on in vitro fermentation and digestibility of beef cattle ration. The fermentability experiment used factorial randomized block design 3x4 with four replicates. Factor A was beef cattle ration without or with liquid probiotic supplementation at different levels: A1=control ration, A2=A1 + 0.1% (vw-1) liquid probiotic, and A3=A1 + 0.2% (vw-1) liquid probiotic. Factor B was incubation periods: 0, 1, 2, and 3 hours. The digestibility experiment used randomized block design with three probiotic treatments (A1, A2, A3) and four replications. The result showed that NH3, total VFA concentrations, bacterial
population and digestibility were influenced by liquid probiotic supplementation at different levels. Incubation time influenced pH and those variables except digestibility; however, these treatments did not produce significant effect on degradability, protozoa and microbial protein synthesis. The result of polynomial orthogonal test showed that A3 is the optimal treatment.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada
Departemen Ilmu Nutrisi dan Teknologi Pakan
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
EFEKTIVITAS PEMBERIAN PROBIOTIK CAIR PADA
TARAF BERBEDA TERHADAP FERMENTASI DAN
KECERNAAN
in vitro
RANSUM SAPI POTONG
Judul Skripsi : Efektivitas Pemberian Probiotik Cair pada Taraf Berbeda terhadap Fermentasi dan Kecernaan in vitro Ransum Sapi Potong
Nama : Abdul Fichar Muzakki NIM : D24090080
Disetujui oleh
Ir Anita S Tjakradidjaja, MRurSc Pembimbing I
Dr Ir Jajat Jachja FA, MAgr Pembimbing II
Diketahui oleh
Prof Dr Ir Panca Dewi MHKS, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWTatas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul skripsi ini adalah Efektivitas Pemberian Probiotik Cair pada Taraf Berbeda terhadap Fermentasi dan Kecernaan
in vitro Ransum Sapi Potong. Penelitian ini dilakukan di Laboratorium Biokimia Fisiologi dan Mikrobiologi Nutrisi, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan sejak Juli hingga September 2013.
Probiotik merupakan feed additive (imbuhan pakan) sebagai substrat mikroorganisme, yang diberikan kepada manusia atau ternak lewat pakan dan memberikan efek positif dengan cara memperbaiki keseimbangan mikroorganisme alami di dalam saluran pencernaan sehingga dapat meningkatkan produktivitas sapi potong.
Skripsi ini merupakan salah satu syarat untuk kelulusan dan memperoleh gelar Sarjana Peternakan di Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 2
Lokasi dan Waktu Penelitian 2
Prosedur Percobaan 3
Pengambilan Cairan Rumen dan Pembuatan Larutan McDougall 3
Pencernaan Fermentatif 3
Pengukuran pH 3
Pengukuran NH3 3
Pengukuran VFA 4
Perhitungan Populasi Protozoa 4
Perhitungan Populasi Bakteri Total 5
Analisis Sintesis Protein Mikroba 5
Pengukuran Degradabilitas Bahan Kering dan Bahan Organik 5 Pengukuran Koefisien Cerna Bahan Kering dan Bahan Organik 6
Peubah yang Diamati 6
Analisis Data 6
HASIL DAN PEMBAHASAN 7
Karakteristik Probiotik Padat dan Cair 7
Derajat Keasaman (pH) Rumen 8
Konsentrasi NH3 10
Konsentrasi VFA 12
Populasi Protozoa Total 14
Populasi Bakteri Total 15
Sintesis Protein Mikroba 18
Degradabilitas Bahan Kering (DBK) dan Bahan Organik (DBO) 19 Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik (KCBO) 20
SIMPULAN DAN SARAN 22
Simpulan 23
Saran 23
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Jenis dan jumlah mikroba dalam probiotik padat dan cair 7 2 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan pH 9 3 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan
konsentrasi NH3 10
4 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan
konsentrasi VFA total 13
5 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan
populasi protozoa 15
6 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan
populasi bakteri total 16
7 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan
sintesis protein mikroba 18
8 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan
DBK dan DBO 19
9 Pengaruh penambahan probiotik cair terhadap rataan koefisien cerna
bahan kering (KCBK) dan bahan organik (KCBO) 20
DAFTAR LAMPIRAN
1 Hasil sidik ragam pengaruh perlakuan terhadap derajat keasaman (pH) 27 2 Hasil uji ortogonal polinomial efek waktu inkubasi 27 3 Hasil sidik ragam pengaruh perlakuan terhadap konsentrasi NH3 27
PENDAHULUAN
Kebutuhan masyarakat terhadap hasil ternak mengalami peningkatan setiap tahunnya. Data dari Kementerian Pertanian dari tahun 2008 hingga 2011 menunjukkan konsumsi daging nasional hasil peternakan terus meningkat setiap tahunnya. Pada tahun 2008, konsumsi daging adalah 4.17 kg kapita-1 tahun-1, pada tahun 2010 meningkat menjadi 4.53 kg kapita-1 tahun-1, dan pada tahun 2011 terus meningkat menjadi 4.69 kg kapita-1 tahun-1 (Kementerian Pertanian Republik Indonesia 2012). Permintaan yang terus meningkat ini harus diimbangi dengan produksi yang tinggi pula agar dapat memenuhi permintaan konsumen. Usaha peningkatan produksi ternak seringkali menghadapi kendala dengan semakin menurunnya daya dukung lingkungan untuk menyediakan pasokan pakan yang berkualitas. Ketersediaan pakan yang fluktuatif baik kualitas ataupun kuantitasnya menyebabkan produktivitas ternak belum dapat dicapai secara optimal.
Permasalahan tentang ketersediaan pakan merupakan salah satu faktor penting dalam peternakan. Salah satu pakan sapi potong adalah hijauan, namun di Indonesia ketesediaan hijauan berfluktuasi mengikuti musim sehingga tidak setiap waktu tersedia. Permasalahan ini juga dikemukan oleh Danirih (2004) bahwa ketersediaan bahan pakan sangat fluktuatif sehingga tidak menjamin kesinambungan produksi ternak. Salah satu upaya untuk mengatasi permasalahan tersebut yaitu dengan penggunaan imbuhan pakan yang dapat diberikan dalam pakan. Upaya ini dapat dilakukan untuk meningkatkan nilai guna dari pakan yang dikonsumsi ternak. Penggunaan imbuhan pakan yang mengandung mikroba hidup probiotik dan hasil metabolisnya untuk meningkatkan produksi ternak cenderung terus meningkat. Hal ini terjadi karena meningkatnya permintaan masyarakat terhadap produk peternakan yang lebih alami dan tidak mengandung residu yang berbahaya bagi kesehatan. Adanya residu akan menyebabkan turunnya tingkat kesehatan masyarakat karena dapat menyebabkan resistensi, alergi atau keracunan (Murdiarti 1997). Pemberian imbuhan pakan dapat berupa antibiotik, probiotik, prebiotik, enzim, dan hormon atau suplemen pakan seperti mineral, asam amino, dan vitamin. Pemberian imbuhan pakan selain untuk meningkatkan nilai guna pakan (dapat memacu proses metabolisme dalam tubuh ternak), juga untuk merangsang kekebalan tubuh ternak dan untuk meningkatkan keseimbangan zat makanan (karbohidrat, protein, mineral dan vitamin) (Leeson dan Summers 2001). Penggunaan probiotik untuk memperbaiki produktivitas ternak pada saat ini semakin banyak menarik perhatian para peneliti maupun praktisi peternakan. Probiotik didefinisikan sebagai substrat mikroorganisme, yang diberikan kepada manusia atau ternak lewat pakan dan memberikan efek positif dengan cara memperbaiki keseimbangan mikroorganisme alami di dalam saluran pencernaan. Pemberian probiotik pada ternak dalam periode pertumbuhan juga lebih berdampak nyata (Estrada 1997). Manfaat lain dari probiotik yaitu mampu memperbaiki ekosistem rumen, meningkatkan efisiensi pakan akibat meningkatnya populasi bakteri rumen selulolitik dan meningkatkan status kesehatan ternak dengan terhambatnya bakteri patogen (FAO/WHO 2000).
2
rendah. Nilai nutrisi bahan pakan dinyatakan baik apabila memberikan nilai hayati tinggi yang dapat dilihat dari respon produksi ternak terhadap bahan pakan tersebut. Upaya menciptakan lingkungan rumen yang ideal untuk proses degradasi dan fermentasi mikroba terhadap bahan organik pakan merupakan strategi yang tepat untuk meningkatkan efisiensi pemanfaatan pakan dengan tingkat produktivitas ternak yang lebih tinggi. Kinerja fermentasi rumen dapat ditingkatkan melalui berbagai pendekatan, antara lain dengan pemberian suplemen mikroorganisme (probiotik) dan faktor pertumbuhan mikroba. Namun, sampai saat ini taraf pemberian probiotik dalam pakan belum pasti diketahui dengan jelas walaupun Simon (2005) menjelaskan bahwa konsentrasi yang direkomendasikan untuk hampir semua probiotik yaitu kira-kira 108 cfu kg-1 pakan. Metode in vitro merupakan metode yang menggambarkan model biologis dengan menirukan proses pencernaan in vivo dengan tingkat kompleksitas yang berbeda. Metode ini biasa digunakan untuk mengevaluasi pakan, meneliti mekanisme fermentasi mikroba, dan mempelajari aksi terhadap faktor antinutrisi, suplemen pakan, dan aditif (Lopez 2000).
Oleh karena itu, penelitian ini bertujuan untuk mengetahui efektivitas pemberian probiotik cair pada taraf yang berbeda terhadap fermentasi dan kecernaan in vitro ransum sapi potong.
METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah cairan rumen segar sapi potong, ransum berbasis jerami padi dan konsentrat (rasio 60% : 40%), probiotik cair, plastik kemasan, label, larutan McDougall pH 6.5-6.9, larutan pepsin HCl 0.2%, aquadest, larutan HgCl2 jenuh, larutan Na2CO3 jenuh, larutan H2SO4
0.005N, larutan asam borat berindikator, larutan HCl 0.5N, larutan H2SO4 15%,
larutan NaOH 0.5N, indikator Phenolpthalin (PP) 0.1%, larutan indikator merah metil dan hijau bromo kresol, larutan garam formalin, media brain heart infusion
(BHI), gas CO2, tricloro acetic acid (TCA), dan sulfo salicylic acid (SSA).
Alat
Peralatan yang digunakan adalah seperangkat alat-alat percobaan fermentasi dan kecernaan in vitro yang meliputi timbangan digital, tabung fermentor, tutup karet berventilasi, shaker waterbath, tabung gas CO2, cawan
3
Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan dari bulan Juli 2013 sampai September 2013 di Laboratorium Biokimia, Fisiologi, dan Mikrobiologi Nutrisi, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Prosedur Percobaan
Pengambilan Cairan Rumen dan Pembuatan Larutan McDougall
Pengambilan cairan rumen dilakukan dengan cara termos diisi dengan air panas terlebih dahulu. Isi rumen diambil dari sapi potong jenis BX yang baru dipotong di Rumah Potong Hewan Bubulak Bogor, disaring menggunakan kain penyaring dan dimasukkan ke dalam termos yang air panasnya sudah dibuang. Cairan rumen tersebut lalu dibawa ke Laboratorium Biokimia, Fisiologi, dan Mikrobiologi Nutrisi, Fakultas Peternakan IPB, Bogor.
Sebanyak 1 liter air destilasi dimasukkan ke dalam labu takar, lalu dimasukkan bahan-bahan sebagai berikut: NaHCO3 (9.8 g); Na2HPO4.7H2O
(3.708 g); KCl (0.97 g); NaCl (0.47 g); MgSO4.7H2O (0.12 g); CaCl2.2H2O
(0.053 g). CaCl2.2H2O ditambahkan paling akhir setelah bahan lainnya larut
sempurna. Selanjutnya dialiri dengan gas CO2 perlahan-lahan dengan
melewatkannya untuk menurunkan pH hingga mencapai pH 6.8. Pencernaan Fermentatif
Percobaan fermentasi in vitro dilakukan dengan menggunakan metode Tilley dan Terry (1963) yang dimodifikasi oleh Sutardi (1979). Metode Sutardi (1979) menggunakan fermentor berupa tabung polyetilen 50 ml yang diisi dengan ransum 1 g yang diberi probiotik pada berbagai taraf persentase probiotik, 12 ml larutan buffer McDougall dan 8 ml cairan rumen segar. Tabung dikocok dan dialiri CO2 selama 30 detik dan ditutup dengan karet berventilasi. Tabung
dimasukkan ke dalam shaker waterbath pada suhu 39 ºC untuk menciptakan suasana seperti kondisi di dalam rumen dan diinkubasi selama 24 jam. Pada penelitian ini, waktu inkubasi yang digunakan yaitu 0, 1, 2 dan 3 jam. Proses fermentasi dihentikan dengan meneteskan larutan HgCl2 jenuh sebanyak 2 tetes.
Tabung fermentor disentrifugasi pada kecepatan 3 000 rpm selama 15 menit. Supernatan diambil untuk analisis konsentrasi VFA dan NH3, sedangkan residu
diambil untuk analisis degradasi bahan kering (DBK), dan degradasi bahan organik (DBO).
Pengukuran pH
Pengukuran pH dilakukan pada setiap akhir masa inkubasi dengan menggunakan pH meter. Alat pH meter yang akan digunakan dikalibrasi terlebih dahulu dengan larutan pH standar (buffer), kemudian katoda dimasukkan ke dalam cairan rumen dan dilihat nilainya di layar monitor.
Pengukuran NH3
Pengukuran konsentrasi NH3 menggunakan metode Mikrodifusi Conway
4
Wisconsin 1966). Sebelum digunakan bibir cawan Conway diolesi dengan vaselin. Supernatan yang dihasilkan dari fermentasi diambil 1 ml, kemudian ditempatkan pada salah satu ujung alur cawan Conway, pada ujung satunya dimasukkan 1 ml Na2CO3 jenuh. Antara supernatan dan Na2CO3 tidak boleh
bercampur. Larutan asam borat berindikator merah metil dan hijau bromo kresol sebanyak 1 ml ditempatkan dalam cawan kecil yang terletak di tengah cawan Conway, kemudian cawan Conway langsung ditutup rapat hingga kedap udara. Setelah itu cawan Conway digoyang-goyangkan hingga supernatan dan Na2CO3
tercampur rata, dan dibiarkan dalam suhu ruang selama 24 jam. Setelah 24 jam asam borat berindikator dititrasi dengan H2SO4 0.005 N sampai terjadi perubahan
warna dari biru menjadi merah. Konsentrasi NH3 dihitung berdasarkan rumus:
Pengukuran VFA
Pengukuran konsentrasi VFA dengan menggunakan metode steam destilation (General Laboratory Procedure, Department of Dairy Science, University of Wisconsin 1966). Prosedur pengukuran VFA, pertama dipersiapkan alat destilasi yaitu dengan mendidihkan air dan mengalirkan air ke kondensor atau pendingin. Kemudian 5 ml sampel dan 1 ml H2SO4 15% dimasukkan ke
dalam alat destilasi. VFA yang dihasilkan ditangkap dengan 5 ml NaOH 0.5 N yang dimasukkan ke dalam labu Erlenmeyer. Cairan ditampung hingga mencapai 250-300 ml, setelah itu indikator ditambahkan sebanyak 2-3 tetes dan dititrasi dengan larutan HCl 0.5 N sampai warna titrat berubah dari merah jambu menjadi tidak berwarna. Rumus berikut digunakan untuk menghitung konsentrasi VFA:
Perhitungan populasi protozoa dilaksanakan dengan menggunakan metode Ogimoto dan Imai (1981). Sebanyak 1 ml cairan hasil inkubasi ditambah 1 ml larutan garam formalin (formal saline). Larutan garam formalin 4% dibuat dari larutan formalin yang ditambah dengan larutan NaCl fisiologis 0.9% dalam 100 ml larutan. Sebanyak ± 2 tetes campuran tersebut lalu ditempatkan pada counting chamber dengan ketebalan 0.1 mm, luas kotak terkecil 0.0625 mm2 sebanyak 16 kotak dan jumlah kotak yang dibaca sebanyak 5 kotak. Perhitungan populasi protozoa dilakukan dengan menggunakan mikroskop pada pembesaran 100 kali. Populasi protozoa dapat dihitung dengan rumus:
-
Keterangan
5
Perhitungan Populasi Bakteri Total
Metode Ogimoto dan Imai (1981) digunakan untuk menghitung populasi bakteri total. Medium tumbuh yang digunakan adalah medium BHI, yaitu campuran dari tepung BHI 3.7 g, glukosa 0.05 g, CMC 1% 1 ml, pati (starch) 0.05 g, cystein-HCl 0.05 g, hemin 0.5 ml, resazurin 0.05 ml, dan aquades sampai 100 ml. Campuran medium tersebut dipanaskan perlahan-lahan sambil dialiri gas CO2
sampai terjadi perubahan warna dari kekuningan menjadi merah dan berubah lagi menjadi kuning bening, lalu didinginkan. Selanjutnya medium dimasukkan ke dalam tabung Hungate sebanyak 5 ml yang sebelumnya telah diisi agar Bacto sebanyak 0.15 g. Medium disterilkan dalam autoclave pada suhu 121 ºC selama 15 menit dengan tekanan 1.2 Kgf cm-3. Populasi bakteri dapat dihitung dengan rumus:
-
Keterangan : n = jumlah koloni yang terdapat pada tabung seri pengenceran ke-x. Analisis Sintesis Protein Mikroba
Metode Shultz dan Shultz (1969) digunakan untuk menganalisis sintesis protein mikroba. Perhitungan protein yang berupa non protein nitrogen (NPN) diukur dengan menggunakan TCA dan SSA (campuran dari larutan TCA 20% dan SSA 2% dengan rasio 50% : 50%). Sebanyak 1 ml cairan sampel hasil inkubasi dicampur dengan 5 ml larutan TCA-SSA, kemudian larutan ini dihomogenkan dengan vortex selama 2 menit. Larutan tersebut lalu disentrifugasi dengan kecepatan 3 000 rpm selama 15 menit. Supernatan dibuang dan endapan ditambah dengan aquades (3 ml), kemudian ditambahkan 6 ml campuran TCA-SSA. Campuran ini dihomogenkan lagi dengan vortex selama 2 menit, kemudian disentrifugasi pada kecepatan 3 000 rpm selama 15 menit. Supernatannya dibuang dan endapannya dianalisis dengan metode Kjehldal mikro.
Pengukuran Degradabilitas Bahan Kering dan Bahan Organik
Pengukuran degradabilitas bahan kering dan bahan organik (DBK dan DBO) dilakukan dengan metode Tilley dan Terry (1963) yang dimodifikasi oleh Sutardi (1979). Setelah hasil fermentasi disentrifugasi, residu yang diperoleh masing-masing setelah 0, 1, 2 dan 3 jam waktu inkubasi, dikeringkan di dalam oven 105 ºC selama 24 jam untuk mengetahui bobot bahan kering residu. Setelah ditimbang, sampel residu yang dihasilkan dari pengeringan oven 105 ºC, kemudian diabukan di dalam tanur 600 ºC selama 6 jam. Hal ini dilakukan untuk mendapatkan bobot abu dan bobot bahan organik sampel residu. Degradabilitas bahan kering (DBK) dan bahan organik (DBO) dapat dihitung dengan rumus:
- -
- -
6
Pengukuran Koefisien Cerna Bahan Kering dan Bahan Organik
Menghitung koefisien cerna bahan kering (KCBK) dan bahan organik (KCBO) pada percobaan in vitro dilakukan dengan menggunakan metode Tilley dan Terry (1963) yang dimodifikasi oleh Sutardi (1979). Metode terdiri dari dua tahap, yaitu tahap fermentasi dan tahap kecernaan. Proses fermentasi sebagai tahap awal dilakukan sama seperti prosedur pencernaan fermentatif, hanya waktu inkubasi dilakukan selama 24 jam. Tabung fermentor lalu disentrifugasi pada kecepatan 3 000 rpm (15 menit); supernatan dibuang dan residu digunakan untuk proses kecernaan pada tahap kedua. Pada tahap kedua, residu lalu ditambah dengan larutan pepsin-HCl 0.2% (20 ml). Campuran ini diinkubasi lagi secara aerob selama 24 jam, hasil pencernaan disaring dengan kertas saring Whatman No. 41 (yang sudah diketahui bobotnya) dengan menggunakan pompa vacuum. Residu lalu dimasukkan ke dalam cawan porselen dan dikeringkan di dalam oven 105 °C (24 jam). Setelah mendapatkan bobot kering, sampel lalu diabukan di dalam tanur (600 ºC; 6 jam); pasca pengabuan, bobot abu dan bobot bahan organik dapat diketahui. Untuk menentukan KCBK dan KCBO dapat dihitung dengan rumus :
Peubah yang diamati dalam penelitian ini adalah sebagai berikut : derajat keasaman (pH), konsentrasi NH3 (ammonia) dan VFA, degradabilitas BK (DBK)
dan degradabilitas BO (DBO), populasi bakteri total, populasi protozoa, dan sintesis protein mikroba, serta koefisien cerna BK (KCBK) dan BO (KCBO).
Analisis Data
Rancangan untuk percobaan fermentabilitas adalah rancangan acak kelompok (RAK) pola faktorial 3 x 4 dengan 4 ulangan. Faktor A adalah ransum kontrol dengan penambahan tiga taraf probiotik cair: A1 = ransum kontrol + 0% probiotik cair (vb-1), A2 = ransum kontrol + 0.1% probiotik cair (vb-1), A3 = ransum kontrol + 0.2% probiotik cair (vb-1). Faktor B adalah waktu inkubasi fermentasi in vitro 0; 1; 2; 3 jam. Data yang diperoleh dianalisis menggunakan analisa sidik ragam (ANOVA) dan uji ortogonal polinomial digunakan untuk mengetahui taraf probiotik cair atau waktu inkubasi yang terbaik (Steel dan Torrie 1993). Model matematik dari rancangan yang digunakan adalah:
Yijk μ + τi+ αj + ßk+ αjßk+ εijk
Keterangan :
Yijk = nilai pengamatan pada perlakuan faktor A ke-j dan faktor B ke-k pada
ulangan ke-i µ = rataan umum
τi = pengaruh kelompok (cairan rumen) ke-i
7
ßk = pengaruh faktor B (lama waktu inkubasi) ke-k αjßk = pengaruh interaksi faktor A ke-j dan faktor B ke-k
ijk = galat penelitian untuk kelompok ke-i, faktor A ke-j, dan faktor B
ke-k
Rancangan percobaan yang digunakan untuk percobaan kecernaan adalah rancangan acak kelompok (RAK) dengan 3 perlakuan dan 4 ulangan. Model matematika dari rancangan adalah:
Yij μ + αi + ßj+ εij
Keterangan :
Yij = nilai pengamatan pada perlakuan ke-i dan ulangan ke-j μ = rataan umum
αi = efek perlakuan ke-i ßj = efek kelompok ke-j
εij = eror perlakuan ke-i dan ulangan ke-j
HASIL DAN PEMBAHASAN
Karakteristik Probiotik Padat dan Cair
Lactobacillus (L.) acidophilus, Bifidobacterium sp., Streptococcus (S.)
thermophilus dan Bacillus sp. merupakan jenis Bakteri Asam Laktat (BAL) yang digunakan sebagai probiotik secara komersial dalam bentuk padat dan cair. BAL termasuk kelompok bakteri baik bagi manusia dan umumnya memenuhi status
Generally Recognize as Safe (GRASS), yaitu aman bagi manusia. Kelompok bakteri ini tidak membusukkan protein dan dapat memetabolisme berbagai jenis karbohidrat secara fermentatif menjadi asam laktat sehingga disebut bakteri asam laktat. Klasifikasi terbaru menggolongkan BAL ke dalam 20 genus, namun dari sudut pandang teknologi pangan hanya terdapat 12 genus BAL yang utama, yaitu : Aerococcus, Carnobacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Pediococcus, Streptococcus, Tetragenococcus, Oenococcus, Weisella dan Vagococcus (Axelsson 2004). Ditinjau dari hasil metabolisme glukosa, BAL terbagi menjadi dua golongan, yaitu homofermentatif dan heterofermentatif (Surono 2004). Menurut Salminen et al. (2004), asam organik (asam laktat dan asam asetat) menyebabkan penurunan pH sitoplasma yang dapat menghambat pertumbuhan mikroba patogen. Kandungan BAL yang terdapat pada probiotik yang digunakan disajikan pada Tabel 1.
Tabel 1 Jenis dan jumlah bakteri dalam probiotik padat dan cair
Sumber: Suryahadi dan Tjakradidjaja (2012)
Jenis Hasil Pengujian Probiotik
Padat (cfu g-1) Cair (cfu ml-1)
Total plate count 3.9 x 108 1.5 x 1010
Lactobacillus acidophilus 7.2 x 109 1.1 x 1010
Bifidobacterium sp. 4.9 x 109 7.0 x 105
Streptococcus thermophilus 5.6 x 107 1.0 x 1010
8
Kandungan total bakteri fungsional dari probiotik cair dapat dilihat pada Tabel 1. Total bakteri (Total Plate Count, TPC) sangat tinggi mencapai 3.9 x 108 cfu g-1 probiotik padat dan 1.5 x 1010 cfu ml-1 probiotik cair. Seleksi mikroba khususnya BAL sangat diperlukan untuk mendapatkan strain-strain probiotik yang unggul. Hal tersebut dikarenakan tidak semua BAL berpotensi sebagai probiotik.
L. acidophilus memiliki sifat homofermentatif dan memiliki ketahanan yang kuat terhadap pH rendah mulai dari pH 2 sampai pH 4 dan terhadap garam empedu sampai 14 jam inkubasi. BAL lainnya yang digunakan adalah Bifidobacterium sp.
Menurut Tamime et al. (2005), terdapat interaksi positif antara beberapa strain probiotik seperti Bifidobacterium sp. dan L. acidophilus. Selain itu, Kaplan dan Hutkins (2000) menyatakan bahwa seluruh strain L. acidophilus dan
Bifidobacterium sp. dapat memfermentasi fruktosaoligosakarida (FOS). Bakteri asam laktat lainnya yang digunakan yaitu S. thermophilus memiliki sifat homofermentatif yaitu hanya menghasilkan asam laktat dan dapat menghasilkan asam folat yang tinggi yang merupakan senyawa penting dalam memperbaiki sifat DNA (Cho dan Finocchiaro 2010). Salah satu syarat agar probiotik mampu memberikan efek positif bagi kesehatan inangnya dapat dilihat dari jumlah sel hidup dalam probiotik tersebut. Tamime et al. (2005) menyatakan bahwa organisme probiotik harus terdapat dalam makanan pada konsentrasi minimum 106 cfu g-1 atau konsumsi harian sebaiknya sekitar 109 cfu g-1. Nousiainen et al.
(2004) dalam Salminen et al. (2004) merekomendasikan dosis probiotik berkisar antara 106-107 cfu-1 untuk dapat memberikan efek yang diinginkan. International Dairy Federation (IDF) memberikan standar jumlah minimum probiotik hidup sebagai acuan adalah 106 cfu ml-1 pada produk akhir (Indratingsih et al. 2004). Namun demikian, jumlah ini bukanlah nilai mutlak karena dosis efektif dari probiotik bersifat spesifik tergantung pada kemampuan probiotik untuk bertahan dan berpenetrasi pada saluran pencernaan inang (Nousiainen et al. 2004 di dalam Salminen et al. 2004). Tabel 1 menunjukkan bahwa jumlah sel hidup lebih dari 107-1010 cfu ml-1 sehingga probiotik ini memenuhi syarat sebagai produk probiotik. Jenis bakteri pada probiotik padat maupun cair hampir sama, akan tetapi jumlahnya saja yang berbeda. Adapun pemberian probiotik cair yaitu 0.1% dan 0.2% (vb-1) agar kisaran populasi bakteri total sekitar 1.5 x 107 – 3 x 107 cfu g-1.
Derajat Keasaman (pH) Rumen
9
pH tetap 6.8 (Arora 1995). Tabel 2 memperlihatkan taraf penambahan probiotik cair dan waktu inkubasi terhadap kondisi pH rumen.
Tabel 2 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan derajat keasaman (pH)
Keterangan : Signifikansi : * (P<0.01) (Uji Ortogonal Polinomial)
Uji ragam menunjukkan pH rumen tidak dipengaruhi oleh taraf probiotik cair dan kelompok (cairan rumen), tetapi dipengaruhi oleh waktu inkubasi (P<0.01). Angka keasaman yang dicapai oleh perlakuan taraf penambahan probiotik cair, menunjukkan kedua taraf probiotik cair yaitu 0.1% dan 0.2% mempunyai efek yang sama, yaitu dapat sedikit menurunkan pH rumen dibandingkan tanpa pemberian probiotik. Hal tersebut menunjukkan bahwa pemberian BAL dapat menghasilkan asam yang dapat menurunkan pH rumen.
Hasil uji ortogonal polinomial pada waktu inkubasi memperlihatkan bahwa waktu inkubasi berpengaruh sangat nyata (P<0.01) terhadap nilai pH yang mengikuti persamaan linear y = -0.0535x + 6.5932 (y merupakan besar nilai pH, x merupakan waktu inkubasi). Dari persamaan pada Gambar 1 dapat ditunjukkan semakin lama waktu inkubasi maka pH akan semakin menurun. Menurunnya pH tersebut sebagai akibat dari produksi asam yang dihasilkan dari proses fermentasi oleh mikroba rumen. Nilai pH pada penelitian ini termasuk dalam kategori yang baik untuk aktivitas mikroba rumen, karena rataan pH rumen yang normal berada pada kisaran antara 6-7 (Yokohama dan Johnson 1988; France dan Siddon 1993). Kisaran pH yang diperoleh pada percobaan ini masih dapat menunjang pH ideal untuk pencernaan selulosa, 6.4-6.8 (Erdman 1988) dan pelekatan bakteri selulolitik pada pencernaan selulosa (Grand dan Weidner 1992) serta pertumbuhan mikroba (Pelczar dan Chan 1988).
Gambar 1 Hubungan antara perlakuan waktu inkubasi (jam) dengan rata-rata nilai derajat keasaman (pH)
y = -0.0535x + 6.5932
Taraf Penambahan Probiotik Cair ke dalam Ransum
10
Konsentrasi NH3
Amonia merupakan salah satu produksi protein di dalam rumen yang digunakan sebagai sumber nitrogen utama untuk perkembangbiakan mikroba atau bakteri rumen. Amonia (NH3) rumen berfungsi sebagai pusat utama metabolisme
nitrogen di rumen. Amonia (NH3) merupakan nitrogen hasil akhir dari fermentasi
protein. Amonia (NH3) juga merupakan titik tolak awal sintesis asam amino
bakteri dan protein mikroba (Cheeke dan Ellen 2010). Amonia (NH3) merupakan
produk utama hasil fermentasi protein pakan di dalam rumen oleh mikroba rumen, dimana semakin tinggi konsentrasi NH3 maka semakin tinggi protein pakan
mengalami fermentasi di dalam rumen. Tabel 3 menunjukkan bahwa konsentrasi NH3 berkisar antara 4.24 sampai 5.91 mM, yang masih berada dalam kisaran
kebutuhan NH3 untuk sintesis protein mikroba yaitu 4-12 mM (Sutardi 1979).
Tabel 3 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan konsentrasi NH3
Keterangan : Signifikansi : * (P<0.01) (Uji Ortogonal Polinomial)
Konsentrasi NH3 dipengaruhi oleh taraf penambahan probiotik cair
(P<0.01) dan waktu inkubasi (P<0.01) serta kelompok (cairan rumen, P<0.01), tetapi tidak dipengaruhi oleh interaksi antara taraf probiotik cair dan waktu inkubasi. Uji ortogonal polinomial memperlihatkan bahwa taraf probiotik cair berpengaruh sangat nyata (P<0.01) terhadap konsentrasi NH3 yang mengikuti
persamaan secara linear y = 8.3589x + 4.2814 (y merupakan konsentrasi NH3
(mM), x merupakan taraf probiotik cair (%)). Gambar 2 menunjukkan bahwa dengan meningkatnya taraf probiotik cair akan meningkatkan konsentrasi NH3.
Konsentrasi NH3 tertinggi terdapat pada perlakuan ransum ditambah dengan 0.2%
probiotik cair yang sangat berbeda nyata (P<0.01) dengan perlakuan lainnya.
Waktu Inkubasi
Taraf Penambahan Probiotik Cair ke dalam Ransum
11
Gambar 2 Hubungan antara perlakuan taraf probiotik cair (%) dengan konsentrasi NH3 (mM)
Berdasarkan uji ortogonal polinomial, waktu inkubasi berpengaruh sangat nyata (P<0.01) terhadap konsentrasi NH3 yang mengikuti persamaan linear y =
1.0372x + 3.5615 dan R2 = 0.7274 (y merupakan konsentrasi NH3 (mM), x
merupakan waktu inkubasi (jam), R2 adalah korelasi antara x dan y). Gambar 3 menunjukkan bahwa dengan semakin lama waktu inkubasi akan meningkatkan konsentrasi NH3.
Gambar 3 Hubungan antara waktu inkubasi (jam) dengan konsentrasi NH3 (mM)
Ransum tanpa penambahan probiotik cair menghasilkan rataan konsentrasi NH3 yang paling rendah dibandingkan dengan rataan konsentrasi NH3 ransum
yang ditambahkan probiotik cair. Hasil tersebut menunjukkan bahwa penggunaan probiotik dapat menghasilkan konsentrasi NH3 yang semakin meningkat dengan
semakin bertambahnya taraf probiotik. Hal ini sesuai dengan pendapat Hau et al. (2005) yang menyatakan bahwa pemberian probiotik dapat meningkatkan konsentrasi NH3.Kristina (2013) juga menambahkan bahwa penggunaan probiotik
12
juga sesuai dengan pernyataan Ulya (2007), bahwa peningkatan populasi bakteri proteolitik berkorelasi positif dengan konsentrasi NH3 yang dihasilkan.
Pemberian probiotik cair dan dalam taraf yang ditingkatkan dapat langsung dimanfaatkan di dalam rumen karena bakteri probiotik alam lebih mudah beradaptasi untuk beraktivitas di dalam cairan rumen (Kristina 2013). Faktor lain yang mempengaruhi peningkatan NH3 adalah ketersediaan vitamin B12
(kobalamin) yang merupakan kofaktor penting untuk metabolisme asam amino, karbohidrat, asam lemak, dan asam nukleat (Quesada-Chanto et al. 1994). Mikroorganisme Bifidobacterium sp. dan L. acidhopilus yang digunakan sebagai bakteri probiotik dalam penelitian ini memiliki kemampuan untuk memproduksi vitamin B12 (kobalamin) (Pompei et al. 2007; Taranto et al. 2003).
Konsentrasi NH3 juga semakin meningkat dipengaruhi oleh meningkatnya
waktu inkubasi (Gambar 3), dan konsentrasi tertinggi dicapai pada waktu inkubasi 3 jam. Hasil tersebut sesuai dengan dengan hasil yang didapat oleh Nuraeni (1993). Meningkatnya konsentrasi NH3 dengan semakin lamanya waktu inkubasi
disebabkan oleh meningkatnya populasi dan aktivitas enzim bakteri proteolitik (Ulya 2007).
Konsentrasi VFA (Vollatile Fatty Acid)
Volatile Fatty Acid (VFA) yang biasa disebut asam lemak terbang merupakan salah satu produk fermentasi karbohidrat di dalam rumen yang menjadi sumber energi utama bagi ternak ruminansia dan dapat menyumbang 55% sampai 60% dari kebutuhan energi ternak (Parakkasi 1999). Pada sistem rumen, karbohidrat dihidrolisis menjadi disakarida dan monosakarida, kemudian difermentasi menjadi produk VFA terutama asetat, propionat dan butirat serta gas yang berupa gas metan (CH4), H2 dan CO2. Perbandingan VFA di dalam rumen
berkisar pada 50% sampai 70% asetat, 17% sampai 21% propionat, 14% sampai 20% butirat, valerat dan format hanya terdapat dalam jumlah kecil (Schlegel 1994). Konsentrasi VFA total hasil percobaan ditampilkan di dalam Tabel 4.
13
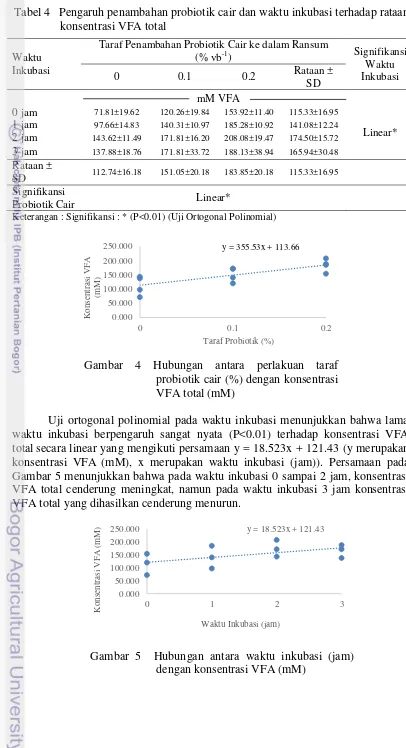
Tabel 4 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan konsentrasi VFA total
Keterangan : Signifikansi : * (P<0.01) (Uji Ortogonal Polinomial)
Gambar 4 Hubungan antara perlakuan taraf probiotik cair (%) dengan konsentrasi VFA total(mM)
Uji ortogonal polinomial pada waktu inkubasi menunjukkan bahwa lama waktu inkubasi berpengaruh sangat nyata (P<0.01) terhadap konsentrasi VFA totalsecara linear yang mengikuti persamaan y = 18.523x + 121.43 (y merupakan konsentrasi VFA (mM), x merupakan waktu inkubasi (jam)). Persamaan pada Gambar 5 menunjukkan bahwa pada waktu inkubasi 0 sampai 2 jam, konsentrasi VFA total cenderung meningkat, namun pada waktu inkubasi 3 jam konsentrasi VFA total yang dihasilkan cenderung menurun.
Gambar 5 Hubungan antara waktu inkubasi (jam)
Taraf Penambahan Probiotik Cair ke dalam Ransum
(% vb-1) Signifikansi
0 jam 71.81±19.62 120.26±19.84 153.92±11.40 115.33±16.95
Linear*
1 jam 97.66±14.83 140.31±10.97 185.28±10.92 141.08±12.24
2 jam 143.62±11.49 171.81±16.20 208.08±19.47 174.50±15.72
3 jam 137.88±18.76 171.81±33.72 188.13±38.94 165.94±30.48
Rataan ±
SD 112.74±16.18 151.05±20.18 183.85±20.18 115.33±16.95
14
Penambahan probiotik cair ke dalam ransum perlakuan lebih cepat menstimulasi pertumbuhan mikroba sehingga dapat meningkatkan konsentrasi VFA total melalui stimulasi yang ditujukan pada mikroba yang memfermentasi karbohidrat berupa peningkatan populasi dan aktivitas enzim yang memfermentasi karbohidrat. Bakteri yang digunakan dalam probiotik cair adalah bakteri asam laktat (BAL) yang dapat menghasilkan asam laktat di dalam rumen sehingga pH rumen akan menurun, pH yang rendah ini menyebabkan pertumbuhan bakteri patogen akan terhambat bahkan mati. Menurut McDonald et al. (2002), asam laktat merupakan prekursor pembentukan propionat sehingga produk propionat meningkat. Propionat merupakan salah satu produk VFA, oleh karena itu VFA juga meningkat. BAL menghasilkan zat antimikroba yang dapat menghambat pertumbuhan dan membunuh bakteri patogen, Lee dan Salminen (2009) menyatakan bahwa bakteri asam laktat menghasilkan zat antimikroba seperti asam organik, hidrogen peroksida, dan bakteriosin. Menurunnya bakteri patogen akan menyebabkan bakteri-bakteri menguntungkan di dalam rumen menjadi lebih optimal untuk beraktivitas dalam mencerna zat makanan terutama karbohidrat dan protein.
Konsentrasi VFA total semakin meningkat dan tertinggi pada waktu inkubasi 2 jam kemudian menurun di waktu inkubasi 3 jam. Hal ini sesuai dengan pernyataan Hungate (1966) bahwa VFA akan naik sampai waktu inkubasi optimal kemudian menurun lagi hingga mencapai jumlah yang sama dengan ketika berada pada awal fermentasi. Danirih (2004) menyatakan bahwa suplementasi ke dalam ransum dapat memproduksi VFA total optimum pada waktu inkubasi 2 sampai 4 jam. Kedua hasil penelitian tersebut saling mendukung penelitian ini, bahwa diduga waktu inkubasi optimal untuk memproduksi VFA pada penelitian ini adalah saat waktu inkubasi 2 jam, kemudian menurun pada waktu inkubasi selanjutnya. Rahmawati (2001) menambahkan semakin lamanya waktu inkubasi menyebabkan konsentrasi VFA menurun karena telah digunakan oleh mikroba rumen untuk membentuk protein mikroba. Menurut McDonald et al. (2002), total konsentrasi VFA sangat bervariasi bergantung kepada pakan dan lama waktu setelah makan dengan konsentrasi VFA, normalnya yaitu 70-150 mM. Adapun konsentrasi rata-rata VFA total dari seluruh perlakuan adalah 112.74-183.85 mM. Konsentrasi ini termasuk ke dalam kisaran normal VFA yang dinyatakan oleh McDonald et al. (2002) dan France dan Dijkstra (2005), namun pada perlakuan ransum dengan penambahan taraf probiotik cair 0.2% rata-rata konsentrasi VFA total lebih tinggi melebihi konsentrasi VFA total normal. Hasil percobaan menunjukkan bahwa penambahan probiotik dengan taraf yang semakin meningkat dapat menstimulasi aktivitas mikroba rumen untuk memfermentasi karbohidrat dari ransum berbasis jerami padi dan konsentrat.
Populasi Protozoa Total
Protozoa merupakan mikroorganisme di dalam rumen dengan jumlah lebih sedikit jika dibandingkan dengan bakteri yaitu sekitar 1 x 106 sel ml-1 (McDonald
15
Tabel 5 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan populasi protozoa
Uji ragam menunjukkan populasi protozoa total tidak dipengaruhi oleh taraf probiotik cair, waktu inkubasi maupun interaksi kedua faktor serta kelompok (cairan rumen). Terdapat dua pendapat tentang keberadaan protozoa di dalam rumen, protozoa diperlukan untuk membantu proses pencernaan nutrien di dalam rumen, namun di sisi lain protozoa harus dikurangi jumlahnya di dalam rumen. Hal merugikan tersebut karena ketidakmampuan protozoa dalam memenuhi kebutuhan nutriennya, khususnya protein, membuat protozoa umumnya memangsa bakteri dan juga bersifat proteolisis (Hobson dan Stewart 2003). Populasi protozoa total rumen antara 105-106 ml-1 (Theodorou et al. 2005), sedangkan menurut Kamra (2005) adalah 104-106 sel ml-1 cairan rumen. Populasi protozoa dalam penelitian ini sesuai dengan kisaran menurut Kamra (2005) yaitu 4 log sel ml-1 cairan rumen atau 104 sel-1 cairan rumen. Taraf penambahan probiotik cair tidak meningkatkan populasi protozoa sehingga memberi kesempatan bakteri untuk hidup dan tumbuh lebih baik pada 0 sampai 3 jam waktu inkubasi. Hal ini sesuai dengan data hasil penelitian bakteri total, bahwa bakteri total meningkat akibat taraf penambahan probiotik cair dan waktu inkubasi. Apabila populasi protozoa yang ada di dalam rumen ditekan jumlahnya, maka akan terjadi perubahan komposisi mikroba rumen yang mengarah pada dominasi bakteri rumen yang mendegradasi serat sehingga kecernaan serat dan pemanfaatan pakan akan meningkat dan selanjutnya pertumbuhan ternak dapat ditingkatkan. Dampak positif dengan berkurangnya jumlah protozoa di dalam cairan rumen adalah penurunan aktivitas proteolisis dan aktivitas metanogenesis, peningkatan jumlah bakteri yang dapat mengambil alih fungsi protozoa, dan peningkatan efisiensi konversi ransum yang mengandung serat tinggi (Kamra 2005).
Populasi Bakteri Total
Bakteri merupakan biomassa terbesar di dalam rumen, terdapat sekitar 50% dari total bakteri hidup bebas dalam cairan rumen dan sekitar 30% sampai 40% menempel pada partikel makanan (Dehority dan Tirabasso 2004). Bakteri total yang terdapat dalam cairan rumen berdasarkan jenis bahan yang difermentasi dan hasil akhirnya terdiri bakteri pemanfaat selulosa, bakteri pemanfaat hemiselulosa, bakteri pemanfaat pati, bakteri penghasil metan, bakteri pemanfaat
Waktu Inkubasi
Taraf Penambahan Probiotik Cair ke dalam Ransum
16
gula, bakteri pemanfaat asam, dan bakteri pemanfaat lipid (Dehority dan Burk 2003). Data rataan populasi bakteri total ditampilkan pada Tabel 6.
Tabel 6 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan populasi bakteri total
Keterangan: Signifikansi: *(P<0.01) (Uji Ortogonal Polinomial)
Populasi bakteri total dipengaruhi oleh faktor taraf penambahan probiotik cair (P<0.01), waktu inkubasi (P<0.01), dan kelompok (cairan rumen, P<0.01) berdasarkan uji ragam, tetapi tidak dipengaruhi oleh interaksi antara taraf penambahan probiotik cair dan waktu inkubasi. Hasil uji ortogonal polinomial pada taraf probiotik cair menunjukkan bahwa dengan meningkatnya taraf probiotik cair akan meningkatkan dengan sangat nyata (P<0.01) populasi bakteri totalyang mengikuti persamaan pada Gambar 6 secara linear y = 1.297x + 8.6507 dan R2 = 0.6641 (y merupakan populasi bakteri total dalam log cfu bakteri ml-1 cairan rumen, x merupakan level probiotik cair (%), R2 adalah korelasi antara x dan y).
Gambar 6 Hubungan antara taraf probiotik cair (%) dengan rataan populasi bakteri total
Berdasarkan hasil uji ortogonal polinomial pada waktu inkubasi, meningkatnya waktu inkubasi akan meningkatkan populasi bakteri total dengan sangat nyata (P<0.01), yang mengikuti persamaan linear y = 0.0472x + 8.7097 (y merupakan populasi bakteri total dalam log sel bakteri ml-1 cairan rumen, x
Taraf Penambahan Probiotik Cair ke dalam Ransum
17
merupakan waktu inkubasi (jam)). Gambar 7 menunjukkan bahwa semakin lama waktu inkubasi akan meningkatkan populasi bakteri total.
Gambar 7 Hubungan antara waktu inkubasi (jam) dengan rataan populasi bakteri total
Perlakuan taraf penambahan probiotik cair mampu meningkatkan populasi bakteri total. Salah satu faktor yang mempengaruhi peningkatan populasi bakteri total diduga karena kandungan BAL yang terkandung dalam probiotik cair. Menurut Gomes dan Malcata (1999), BAL yang bersifat positif untuk mikroflora normal usus, terdiri atas Bifidobacterium sp. dan L.acidophilus. Kedua bakteri ini digunakan dalam probiotik cair yang ditambahkan pada ransum penelitian. Selain itu L. acidophilus mampu menghasilkan vitamin B (niasin, piridoksin dan asam folat), dan asam enzim laktase yang berfungsi memecah laktosa menjadi asam laktat sehingga lebih mudah dicerna (Manin 2010), sedangkan Bifidobacterium sp. dapat menghasilkan beberapa vitamin B lainnya (folat, kobalamin, riboflavin dan tiamin) dan vitamin K2 (Tamime et al. 2005). Beberapa vitamin B ini
dibutuhkan oleh bakteri rumen terutama bakteri selulolitik, untuk tumbuh dan berkembang biak, hal ini yang menyebabkan bakteri probiotik mampu menstimulasi pertumbuhan bakteri, terutama bakteri selulolitik. Lee dan Salminen (2009) menambahkan faktor lainnya yaitu terhambatnya pertumbuhan bakteri patogen akibat pembentukan asam laktat yang menyebabkan pH menurun dan bahan antimikroba dari bakteri probiotik yang berupa hidrogen peroksida dan bakteriosin sebagai inhibitor yang potensial dalam menghambat mikroorganisme lain. Perubahan pH secara signifikan dapat menghambat mikroba yang tidak tahan terhadap kondisi pH yang rendah. Populasi bakteri total paling tinggi pada penelitian ini terdapat pada perlakuan ransum dengan taraf penambahan probiotik cair 0.2% yaitu sebanyak 8.88 log cfu bakteri ml-1 dibandingkan dengan taraf penambahan probiotik cair lainnya. Hal ini diduga karena jumlah BAL yang ditambahkan lebih banyak dibandingkan taraf penambahan probiotik cair 0% dan 0.1%. Jumlah BAL yang lebih banyak ini lebih optimal dalam menstimulasi pertumbuhan bakteri total sehingga lebih mampu meningkatkan efektivitas dalam mendegradasi dan mencerna zat makanan serta meningkatkan jumlah konsentrasi NH3 dan VFA total yang dapat dimanfaatkan oleh mikroba (Tabel 3 dan 4) dan
ternak.
Populasi bakteri total semakin meningkat dipengaruhi oleh meningkatnya waktu inkubasi. Berdasarkan hasil penelitian, pertumbuhan optimal bakteri total terjadi pada waktu inkubasi 3 jam yaitu sebanyak 8.86 log cfu bakteri ml-1. Bakteri yang paling banyak tumbuh diduga merupakan jenis bakteri amilolitik karena fase
18
pertumbuhan bakteri amilolitik lebih cepat dibandingkan jenis bakteri lainnya. Selain bakteri amilolitik terdapat bakteri proteolitik yang diduga meningkat pada waktu inkubasi 2 jam. Ulya (2007) menyatakan peningkatan populasi bakteri proteolitik sejalan dengan lama waktu inkubasi. Yuliana (2008) melaporkan pada waktu inkubasi 0-3 jam pertama terdapat perbedaan masa adaptasi dari bakteri asam laktat, hal ini mempengaruhi produksi NH3 dan VFA total. Middelbeck et
al. (1992) menambahkan panjang atau pendeknya fase adaptasi ditentukan oleh jumlah sel yang diinokulasikan, kondisi fisiologis, dan media yang dibutuhkan. Pada penelitian ini pada waktu inkubasi 0-3 jam bakteri total mengalami peningkatan yang diduga merupakan fase logaritmik yaitu fase pertumbuhan yang sangat cepat. Pada penelitian ini tidak terlihat fase stasioner dan fase penurunan karena penelitian dilakukan sampai waktu 3 jam saja.
Sintesis Protein Mikroba
Sintesis protein mikroba (SPM) sangat dipengaruhi oleh ketersediaan prekursor NH3 dan ketersediaan energi hasil fermentasi. Kinetika degradasi
karbohidrat harus sesuai dengan kecepatan degradasi protein yang juga sangat mempengaruhi efisiensi sintesis protein mikroba (Widyobroto 1992). Sintesis protein di dalam rumen dipengaruhi oleh beberapa faktor penting seperti suplai nutrien (Widyobroto 1992), populasi mikroba dan kondisi lingkungan rumen. Pathak (2008) menambahkan juga, faktor utama yang mempengaruhi sintesis protein mikroba dalam rumen adalah konsumsi bahan kering, suplai senyawa nitrogen, suplai energi terfermentasi, rasio hijauan dan konsentrat, lingkungan rumen, sinkronisasi nitrogen dan energi, vitamin dan mineral. Penambahan taraf probiotik cair dan waktu inkubasi terhadap SPM dapat dilihat pada Tabel 7.
Tabel 7 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan sintesis protein mikroba
Uji ragam menunjukkan SPM tidak dipengaruhi oleh taraf penambahan probiotik cair, waktu inkubasi maupun interaksi kedua faktor serta kelompok (cairan rumen). Data pada Tabel 7 memperlihatkan rataan sintesis protein mikroba tertinggi terdapat pada perlakuan ransum tanpa tambahan taraf probiotik cair (431.73 mg N g-1 BO), kemudian menurun pada perlakuan ransum dengan penambahan taraf probiotik cair 0.1% (368.21 mg N g-1 BO), dan menurun
Waktu Inkubasi
Taraf Penambahan Probiotik Cair ke dalam Ransum
(% vb-1) Rataan ± SD
0 0.1 0.2
mg N g-1 BOTC
0 jam 525.38±109.25 389.52±51.04 343.72±153.47 419.54±104.59
1 jam 520.68±223.45 356.76±104.72 345.09±32.84 407.51±120.34
2 jam 324.90±133.18 274.11±114.37 256.68±53.39 285.23±100.31
3 jam 355.95±38.63 452.47±281.37 320.68±123.42 376.37±147.81
Rataan ±
19
kembali pada perlakuan ransum dengan taraf penambahan probiotik cair 0.2% (316.54 mg N g-1 BO).
Populasi bakteri total dalam penelitian ini meningkat dengan penambahan taraf probiotik cair dan meningkat selama waktu inkubasi 0-3 jam. Hal ini juga diikuti dengan kondisi lingkungan rumen dengan meningkatnya konsentrasi NH3
dan VFA total. Hubungan antara NH3 dan SPM sangat erat karena NH3
merupakan sumber nitrogen utama dan penting untuk pertumbuhan mikroba rumen dalam mensintesis protein selnya (Sutardi 1980). Pemanfaatan sumber nitrogen bukan protein untuk mensintesis protein mikroba akan terjadi jika sumber energi yang mudah terfermentasi tersedia. Jumlah dan kecepatan degradasi karbohidrat dengan protein yang sinergis dan cocok dengan ekologi dalam rumen akan meningkatkan efisiensi SPM (Khampa dan Wanapat 2006).
Untuk mendapatkan SPM yang optimal dibutuhkan NH3 dan VFA yang
tersedia dalam konsentrasi yang seimbang (Kalbande dan Thomas 2001), karena apabila ketersediaan NH3 lebih cepat daripada fermentasi karbohidrat maka NH3
untuk pembentukan protein mikroba tidak efisien digunakan (Nuswantara et al. 2001).
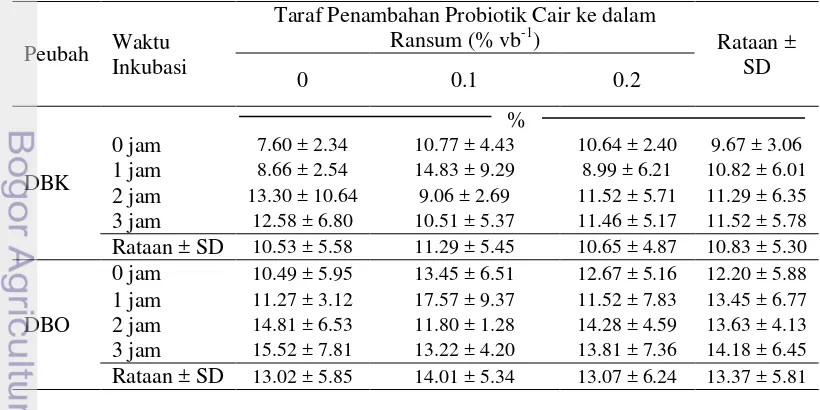
Degradabilitas Bahan Kering (DBK) dan Bahan Organik (DBO)
Bahan kering terdiri dari abu dan bahan organik yaitu protein kasar, lemak kasar, dan karbohidrat. Tingkat kecernaan zat-zat makanan dari suatu pakan menunjukkan kualitas dari pakan tersebut, dengan demikian DBK dan DBO dapat dijadikan salah satu indikator untuk menentukan kualitas pakan. Nilai dari DBK dan DBO menunjukkan seberapa besar zat makanan dalam pakan dapat didegradasi atau difermentasi dan dimanfaatkan oleh mikroba rumen (Sutardi 1979). Tabel 8 memperlihatkan rataan DBK dan DBO hasil penelitian.
Tabel 8 Pengaruh penambahan probiotik cair dan waktu inkubasi terhadap rataan DBK dan DBO
Uji ragam menunjukkan DBK dan DBO tidak dipengaruhi oleh taraf probiotik cair, waktu inkubasi maupun interaksi kedua faktor serta kelompok
Peubah Waktu
Inkubasi
Taraf Penambahan Probiotik Cair ke dalam
20
(cairan rumen). Fermentasi yang terjadi semakin lama maka aktivitas mikroba rumen dalam mendegradasi pakan semakin meningkat. Kondisi ini sesuai dengan Lubis (1992) yang menyatakan pengukuran degradasi dalam rumen sangat ditentukan oleh faktor kelarutan bahan pakan dan waktu inkubasi.
Pengukuran DBO dilakukan karena peran bahan organik dalam memenuhi kebutuhan ternak untuk hidup pokok maupun produksi (Rahmawati 2001). Menurut Sutardi (1981), laju DBO berhubungan erat dengan laju DBK, karena sebagian besar bahan kering terdiri atas bahan organik. Perbedaan diantara keduanya adalah pada kandungan abu masing-masing bahan. Nilai DBK dan DBO yang dihasilkan dalam penelitian ini tergolong rendah, karena ransum yang digunakan berbasis jerami padi yang mempunyai nilai kecernaan rendah. Jerami padi memiliki komponen serat kasar (SK) yang tinggi, SK biasanya kaya akan lignin dan selulosa (Sutardi 1980). Jerami padi terdiri atas 37.7% selulosa, 22.0% hemiselulosa dan 16.6% lignin (Dewi 2002). Komponen serat tersebut dapat menurunkan DBK dan DBO.
Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik (KCBO)
Definisi daya cerna (digestibility) adalah bagian nutrien pakan yang tidak diekskresikan dalam feses. Daya cerna didasarkan atas suatu asumsi bahwa nutrien yang tidak terdapat di dalam feses adalah habis dicerna dan diabsorpsi. Biasanya daya cerna dinyatakan dalam bahan kering dan apabila dinyatakan dalam persentase disebut koefisien cerna. Suatu percobaan pencernaan dikerjakan dengan mencatat jumlah pakan yang dikonsumi dan feses yang dikeluarkan dalam suatu hari (Tillman et al. 1991). Rataan KCBK dan KCBO dilihat pada Tabel 9. Tabel 9 Pengaruh penambahan probiotik cair terhadap rataan koefisien cerna
bahan kering (KCBK) dan bahan organik (KCBO)
Keterangan: Signifikansi: *(P<0.01) (Uji Ortogonal Polinomial)
Uji ragam menunjukkan KCBK dan KCBO dipengaruhi oleh taraf probiotik cair (P<0.01). KCBK dan KCBO terendah terdapat pada perlakuan ransum tanpa taraf penambahan probiotik cair (31.56% dan 30.03%). Pada perlakuan ransum dengan taraf penambahan probiotik cair 0.1%, KCBK dan KCBO meningkat (33.17% dan 32.41%), dan semakin meningkat dengan meningkatnya penambahan probiotik cair menjadi 0.2% (36.60% dan 35.14%). Nilai KCBK dan KCBO penelitian lebih rendah dibandingkan dengan hasil penelitian Kristina (2013) yang menguji ransum berbasis jerami padi (P1 = 60% jerami padi + 40% konsentrat (kontrol)), (P2 = 60% jerami padi + 40% konsentrat + probiotik padat 0.25% (bb-1)), dan (P3 = 60% jerami padi + 40% konsentrat +
Peubah
Tingkat Penambahan Taraf Probiotik Cair ke dalam
21
probiotik cair 0.1% (vb-1)) menghasilkan KCBK antara 49.55% – 58.53% dan menghasilkan KCBO antara 48.02% – 57.32%. Rendahnya kecernaan pada perlakuan ransum yang berbasis jerami padi dikarenakan komponen serat kasar yang tinggi pada jerami padi, serat kasar tersebut mengandung lignin dan selulosa (Sutardi 1980). Faktor lain yang mempengaruhi rendahnya kecernaan adalah perbedaan kondisi percobaan di antara kedua penelitian, antara lain cairan rumen yang digunakan.
Hasil uji ortogonal polinomial pada taraf probiotik cair menunjukkan bahwa dengan meningkatnya taraf probiotik cair secara sangat nyata (P<0.01) akan meningkatkan KCBK, yang mengikuti persamaan linear y = 2.6945x + 28.502 dan R2 = 0.9492 (y merupakan % KCBK, x merupakan taraf probiotik cair (%), R2 adalah korelasi antara x dan y). Gambar 8 memperlihatkan semakin tinggi taraf penambahan probiotik cair, KCBK semakin meningkat.
Gambar 8 Hubungan antara perlakuan taraf probiotik cair dengan rata-rata KCBK
Hasil uji ortogonal polinomial pada taraf probiotik cair menunjukkan bahwa dengan meningkatnya taraf probiotik cair akan meningkatkan KCBO secara nyata (P<0.01), yang mengikuti persamaan linear y = 2.5554x + 27.419 dan R2 = 0.9984 (y merupakan % KCBO, x merupakan taraf probiotik cair (%), R2 adalah korelasi antara x dan y). Gambar 9 menunjukkan semakin tinggi taraf penambahan probiotik cair, KCBO semakin meningkat.
22
Rinduwati dan Ismartoyo (2002) menyatakan bahwa rendahnya daya cerna disebabkan oleh kandungan lignin yang dapat membatasi pemanfaatan selulosa, hemiselulosa dan isi sel sehingga sangat sulit untuk dicerna dalam rumen. Lignin merupakan faktor pembatas kecernaan. Lignin sangat tahan terhadap asam kuat dan degradasi mikroba sehingga tidak dapat dicerna (Van Soest 1994). Selain itu, Sarnklong et al. (2010) menyatakan kadar silika yang tinggi juga merupakan faktor penghambat kecernaan jerami padi. Tingkat kecernaan bahan kering dapat dipengaruhi oleh konsumsi ransum perlakuan dan komposisi kimia ransum perlakuan. Hal ini sesuai dengan pendapat Anggorodi (1979), faktor yang berpengaruh terhadap daya cerna diantaranya adalah bentuk fisik pakan, komposisi ransum, suhu, laju perjalanan melalui alat pencernaan dan pengaruh terhadap perbandingan nutrien lainnya. Penambahan probiotik cair hingga taraf 0.2% (vb-1) yang meningkatkan KCBK dan KCBO dikarenakan efek probiotik yang dapat menstimulasi peningkatan populasi bakteri, terutama bakteri selulolitik dan bakteri pendegradasi lignin dan aktivitas endogen.
Probiotik cair yang digunakan dalam penelitian ini mengandung bakteri
Bifidobacterium sp. dan Lactobacillus sp. yang mampu menghasilkan vitamin B yang dibutuhkan untuk pertumbuhan bakteri selulolitik yang bekerja menguraikan komponen serat kasar yang tinggi pada ransum berbasis jerami padi sehingga dapat meningkatkan KCBK dan KCBO. Surung (2008) menambahkan,
Lactobacillus sp. memberi pengaruh yang menguntungkan melalui produksi asam organik sehingga menghambat kerja bakteri patogen. Menurunnya aktivitas bakteri patogen di rumen akan memaksimalkan perkembangan dan aktivitas mikroba rumen. Dengan meningkatnya jumlah mikroba rumen, maka dapat meningkatkan aktivitas degradasi bahan organik secara fermentatif menjadi senyawa sederhana yang mudah larut, dan akan meningkatkan kecernaan BK dan BO pada organ setelah rumen.
SIMPULAN DAN SARAN
Simpulan
Penambahan probiotik cair 0.1% dan 0.2% ke dalam ransum berbasis jerami padi dan konsentrat (60:40) efektif dalam meningkatkan konsentrasi NH3,
konsentrasi VFA total, populasi bakteri, koefisien cerna bahan kering, dan koefisien cerna bahan organik.Waktu inkubasi 0 sampai 3 jam yang diterapkan dalam penelitian mempengaruhi nilai derajat keasaman (pH) di dalam rumen, konsentrasi NH3, konsentrasi VFA total, dan populasi bakteri. Berdasarkan hasil
23
Saran
Hasil penelitian menunjukkan perlu dilakukan penelitian lebih lanjut untuk mengujikan taraf probiotik cair ke ransum lain, penambahan waktu inkubasi yang lebih lama, pengukuran VFA parsial untuk mengetahui perubahan persentase komponen VFA, analisis spesifikasi jenis bakteri rumen dan aktivitas enzim mikroba di dalam rumen.
DAFTAR PUSTAKA
Anggorodi. 1979. Ilmu Makanan Ternak Umum. Jakarta (ID): Gramedia Pr. Arora SP. 1995. Pencernaan Mikroba pada Ruminansia. Murwani R, penerjemah;
Srigandono B, editor. Yogyakarta (ID): UGM Pr. Terjemahan dari:
Microbial Digestion in Ruminant. Ed ke-2.
Axelsson LT. 2004. Lactic acid bacteria classification and physiology. Di dalam: Salminen S, Wright AV, Ouwehand A, editor. Lactic Acid Bacteria: Microbiology and Functional Aspect. New York (US): Marcell Dekker. Cheeke PR, Ellen SD. 2010. Comparative Animal Nutrition and Metabolism. berdasarkan metabolisme dan populasi mikroba rumen [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Dehority BA, Burk A. 2003. Rumen Microbiology. Nottingham (GB): Nottingham Univ Pr. reviews. J Dairy Sci. 71:3246-3266.
Estrada A. 1997. Advances in Feed Products Through Probiotics. Canada (CAN): University of Saskatchevan.
[FAO/WHO]. Food and Agriculture Organization/World Health Organization. 2002. Guidelines for the evaluation of probiotics in food. Report of a Joint FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food. London, Ontario, Canada: FAO/WHO.
France J, Dijkstra J. 2005. Volatille fatty acid production. Di dalam: Dijkstra J, Forbes JM, France J, editor. Quantitative Aspect for Ruminant Digestion and Metabolism. Ed ke-2. London (GB): CABI.
24
General Laboratory Procedure. 1966. Department of Dairy Science. Madison (US): University of Wisconsin.
Gomes AMP, Malcata FX. 1999. Bifidobacterium spp. and L. acidophilus: biological, technological and therapeutical properties relevant for use as probiotics. Trends Food Sci Tech 10:139-157.
Grand RJ, Weidner SJ. 1992. Digestion kinetics of fiber: influence of in vitro
buffer pH varied within observed physiology range. J Dairy Sci 75:1060-1068.
Hau DK, Nenobasis M, Nulik J, Katipana NGF. 2005. Pengaruh probiotik terhadap kemampuan cerna mikroba rumen sapi bali. Seminar Nasional Teknologi Peternakan dan Veteriner. Kupang (ID): Universitas Nusa Cendana.
Hobson PN, Stewart CS. 2003. The Rumen Microbial Ecosystem. London (UK): Blackie Academic and Professional.
Hungate RE. 1966. The Rumen and Its Microbes. London (UK): Academic Pr. Indratingsih WS, Salasia S, Wahyuni E. 2004. Produksi yoghurt shiitake
(Yohsitake) sebagai pangan kesehatan berbasis susu. J Teknol dan Industri Pangan. 15 (1):54-60.
Kalbande VH, Thomas CT. 2001. Effect of feeding bypass on rumen fermentation profile of crossbred cows. Asian Aust J Anim Sci. 14:974-978.
Kamra DN. 2005. Rumen microbial ecosystem. IVRI. 89(1):124–135.
Kaplan H, Hutkins RW. 2000. Fermentation of fructooligosac-charides by lactic acid bacteria and bifidobacteria. Microbiol Indones. 66(6):2682-2684. [Kementan] Kementerian Pertanian Republik Indonesia. 2012. Konsumsi
Rata-rata per Kapita Setahun Beberapa Bahan Makanan di Indonesia Tahun 2008-2011 [Internet]. [diunduh 2013 Februari 27]. Tersedia pada: http://www.deptan.go.id/Indikator/tabe-15b-konsumsi-rata.pdf.
Khampa S, Wanapat M. 2006. Supplementation levels of concentrate containing high levels of cassava chip on rumen ecology and microbial protein synthesis in cattle. Pak J Nutr.5:501‐506.
Kristina, D. 2013. Kinetika fermentasi dan kecernaan in vitro ransum sapi potong yang disuplementasi probiotik padat atau cair [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Lesson S, Summers JD. 2001. Broiler Breeder Production. Ontario (CAN): University Books Guelph Canada.
Lee YK, Salminen S. 2009. Handbook of Probiotics and Prebiotics. Ed ke-2. New Jersey (US): John Wiley and Sons.
Lopez J. 2000. Probiotic in animal nutrition. J Anim Sci. 13:12-26.
Lubis MH. 1992. Laju degradasi bahan kering dan bahan organik Setaria splendida, rumput lapang, dan alang-alang (Imperta cylindrica) dengan teknik in situ. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Manin F. 2010. Potensi Lactobacillus acidophilus dan Lactobacillus fermentum
dari saluran pencernaan ayam buras asal lahan gambut sebagai sumber probiotik. J Ilmiah Ilmu-Ilmu Peternakan. 13(5):221-228.
25
Middelbeck EJ, Jenkins RO, Drijver JS-de Haas. 1992. Growth in Batch culture. Di dalam: Cartledge TG, editor. In vitro Cultivation of Microorganisms.
Oxford (GB): Butterworth-Heinemann.
Murdiarti TB. 1997. Pemakaian antibiotika dalam usaha peternakan. Wartazoa. 6(1):18-22.
Nousiainen J, Javanainen P, Setala J. 2004. Lactic acid bacteria as animal probiotics. Di dalam: Salminen S, Wright AV, dan Ouwehand A, editor.
Lactic Acid Bacteria Microbiological and Functional Aspects. Ed ke-3. New York (US): Marcel Dekker.
Nuraeni S. 1993. Perlindungan protein ampas tahu dengan gambir dari degradasi dalam rumen dan efek perpaduannya dengan beberapa sumber energi [skripsi]. Fakultas Peternakan. Bogor (ID): Institut Pertanian Bogor. Nuswantara LK, Soejono M, Widyobroto BP. 2001. Sintesis protein mikroba pada
sapi peranakan ongole dan kerbau yang diberi pakan tunggal glirisida, jerami jagung dan kaliandra. J Agrosains. 14:165-176.
Ogimoto K, Imai S. 1981. Atlas of Rumen Microbiology. Tokyo (JP): Japan Scientific Societies Pr.
Parakkasi A. 1999. Ilmu Nutrisi dan Makanan Ternak Ruminansia. Jakarta (ID): Universitas Indonesia.
Pathak AK. 2008. Various factors affecting microbial protein synthesis in the rumen. Vet World. 1(6):186-189.
Pelczar MJ, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID): UI- Pr. Terjemahan dari: Elements of Microbiology.
Pompei A, Cordisco L, Amaretti A, Zanoni S, Matteuzzi D, Rossi M. 2007. Folate production by bifidobacteria as a potential probiotic property. Appl Microbiol Biotech. 73:179-85.
Quesada-Chanto A, Afschar AS, Wagner F. 1994. Microbial production of propionic acid and vitamin B12 using molasses or sugar. Appl Microbiol
Biotech. 41:378-383.
Rahmawati IGAWD. 2001. Evaluasi in vitro kombinasi lamtoro merah (Acacia villosa) dan gamal (Gliricidia maculata) untuk meningkatkan kualitas pakan pada ternak domba [skripsi]. Bogor (ID): Institut Pertanian Bogor. Rinduwati, Ismartoyo. 2002. Karakteristik degradasi beberapa jenis pakan (in
sacco) dalam rumen ternak kambing. Bul Nutrisi dan Makanan Ternak. 31:1-14.
Salminen S, Wright AV, Ouwehand A. 2004. Lactic Acid Bacteria: Microbiology and Functional Aspects. Ed ke-2. New York (US): Marcel Dekker.
Sarnklong C, Cone JW, Pellikaan W, Hendriks WH. 2010. Utilization of rice straw and different treatments to improve its feed value for ruminants.
Asian Aust J Anim Sci. 53:781-784.
Schlegel HG. 1994. Mikrobiologi Umum. Yogyakarta (ID): Gadjah Mada Pr. Shultz TA, Shults E. 1969. Estimation of rumen microbial nitrogen by three
analytical methods. J Dairy Sci. 53:781-784.
Simon O. 2005. Micro-organism as feed additives-probiotics. Advanc Pork Prod.
26
Steel RGD, Torrie JH. 1993. Prinsip dan Prosedur Statistika (Pendekatan Biometrik). Penerjemah B. Sumantri. Jakarta (ID): Gramedia Pustaka Utama.
Surono IS. 2004. Probiotik Susu Fermentasi dan Kesehatan. Jakarta (ID): PT Tri Cipta Karya Pr.
Surung MY. 2008. Pengaruh dosis EM4 (effective microorganisms-4) dalam air minum terhadap berat badan ayam buras. J Agrisitem 4:2-12.
Suryahadi, Tjakradidjaja A. 2012. Pengujian Mutu dan Efikasi Probiotik Biofeed dan Turrimavita. Bogor (ID): Cv. Sinar Aras.
Sutardi T. 1979. Ketahanan protein bahan makanan terhadap degradasi oleh mikroba rumen dan manfaatnya bagi produktivitas ternak. Proceeding Seminar dan Penunjang Peternakan. [Waktu dan tempat pertemuan tidak diketahui]. Bogor (ID): Lembaga Penelitian Peternakan.
Sutardi T. 1980. Landasan Ilmu Nutrisi. Jilid I. Departemen Ilmu Makanan Ternak. Bogor (ID): IPB Pr.
Sutardi T. 1981. Peningkatan mutu hasil limbah lignoselulosa sebagai makanan ternak. Bogor (ID): IPB.
Tamime AY, Saarela M, Sondergaard AK, Mistry VV, Shah NP. 2005.
Production and Maintenance of Viability of Probiotic Microorganisms in Dairy Products. Oxford (GB): Blackwell Publishing.
Taranto MP, Vera JL, Hugenholtz J, de Valdez GF, Sesma F. 2003. Lactobacillus reuteri CRL1098 produces cobalamin. J Bact. 185:5643-5647.
Theodorou MK, Boever DE, Haines MJ, Brooks A. 2005. The effect of fungal probiotic on intake and performance of early weaned calves. JAnim Prod.
53:577-585.
Tillman, AD, Hartadi H, Reksohadiprodjo S, Prawirokusumo S, Lebdosoekojo S. 1997. Ilmu Makanan Ternak Dasar. Yogyakarta (ID): UGM Pr.
Tilley JMA, Terry RA. 1963. A two stage technique for the in vitro digestion of forage crops. J British Grassland Soc. 18:104-111.
Ulya A. 2007. Kajian in vitro mikroba rumen berbagai ternak ruminansia dalam fermentasi bungkil biji jarak pagar (Jatropha curcas L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Van Soest PJ. 1994. Nutritional Ecology of The Ruminant. Ed ke-2. Cornel Ithaca and London (GB): University Pr.
Widyobroto BP. 1992. Pengaruh aras konsentrat dalam ransum terhadap kecernaan dan sintesis N mikrobia di dalam rumen pada sapi perah produksi tinggi. Bul Petern. Edisi Khusus. hlm: 241-249.