STRUKTUR KOMUNITAS CACING PARASITIK PADA
IKAN KEMBUNG (
Rastrelliger brachysoma
dan
R. kanagurta)
DI PERAIRAN TELUK BANTEN DAN PELABUHAN RATU
FORCEP RIO INDARYANTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Struktur Komunitas Cacing Parasitik pada Ikan Kembung (Rastrelliger brachysomadanR. kanagurta) di Perairan Teluk Banten dan Pelabuhan Ratu adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
RINGKASAN
FORCEP RIO INDARYANTO. Struktur Komunitas Cacing Parasitik pada Ikan Kembung (Rastrelliger brachysoma dan R. kanagurta) di Perairan Teluk Banten dan Pelabuhan Ratu. Dibimbing oleh YUSLI WARDIATNO dan RISA TIURIA.
Ikan kembung (Rastrelliger Spp.) merupakan salah satu ikan pelagis kecil yang sangat disukai oleh masyarakat Indonesia. Parasitisme memiliki peran penting dalam biologi perikanan. Parasitisme merupakan kejadian yang biasa terjadi dalam lingkungan perairan laut dan memungkinkan semua ikan laut terinfeksi cacing parasitik.
Tujuan penelitian ini adalah mengidentifikasi karakteristik struktur komunitas cacing parasitik pada ikan R. brachysoma dan R. kanagurta di perairanTeluk Banten dan Pelabuhan Ratu dan juga mempelajari interaksi tiga komponen utama penyebab penyakit yaitu ikan sebagai inang, lingkungan perairan dan cacing parasitik.
Hasil penelitian menunjukan bahwa cacing parasitik yang terdapat pada ikan kembung adalah Lechitocladium angustiovum (Digenea: Hemiuridae), Lecitochirium sp. (Digenea: Hemiuridae), Prodistomum orientalis (Digenea: Lepocreadiidae) dan Anisakis typica (Nematodes: Anisakidae), dengan nilai prevalensi 90,12%. Cacing L. Angustiovum sangat dominan. Species Anisakis yang ditemukan bukan termasuk spesies zoonotic. Lambung dan usus merupakan mikrohabitat bagi cacing parasitik. Secara statistik, jumlah parasit yang terdapat pada ikanR. kanagurtadan R. Brachysomatidak berbeda karena keduanya masih memiliki kekerabatan yang dekat. Jumlah cacing parasitik pada daerah Teluk Banten dan Pelabuhan Ratu tidak berbeda, karena masih perada dalam kawasan perairan tropis dan secara genetik ikan kembung pada kedua daerah masih merupakan satu stok populasi. Faktor yang mempengaruhi jumlah infeksi cacing parasitik pada saluran pencernaanRastrelliger spp. adalah panjang, GSI, pH dan suhu perairan.
SUMMARY
FORCEP RIO INDARYANTO. Community Structure of Helminth Parasites of Mackerel Species (Rastrelliger brachysomaandR. kanagurta) from Teluk Banten dan Pelabuhan Ratu. Supervised by YUSLI WARDIATNO and RISA TIURIA.
TheRastrelligerSpp. is the most commercially important small pelagic fish in Indonesia. Parasitism plays a central role in fish biology. Parasitism is a ubiquitous phenomenon in the marine environment and it is probable that all marine fishes are infected with parasites.
The main aim of this study was to identification a community structure of helminth parasites of Rastrelliger brachysoma and R. kanagurta from Teluk Banten dan Pelabuhan Ratu and to study an interaction tree component of fish healthy management.
Helminth parasitic of Rastrelliger spp. are Lechitocladium angustiovum (Digenea: Hemiuridae), Lecitochirium sp. (Digenea: Hemiuridae), Prodistomum orientalis (Digenea: Lepocreadiidae) and Anisakis typica (Nematodes: Anisakidae), with 90.12% of prevalence. Anisakis species is not zoonotic parasite kategories. The fish digestion was a microhabitat for helminth parasitik because they have much foodstuff. They are not significant different of helminth parasitic abundance from R. kanagurta and R. brachysoma, but significant in helminth species richness. L. angustonum are dominances. The different location was’t have significant different of helminth parasitic abundance because Indonesian in the tropical zone. Fish body length, Gonads somatic index, water pH and water temperature are the importance factor of mackerel parasites abundances.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pengelolaan Sumberdaya Perairan
STRUKTUR KOMUNITAS CACING PARASITIK PADA
IKAN KEMBUNG (
Rastrelliger brachysoma
dan
R. kanagurta)
DI PERAIRAN TELUK BANTEN DAN PELABUHANRATU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Struktur Komunitas Cacing Parasitik pada Ikan Kembung (Rastrelliger brachysomadanR. kanagurta) di Perairan Teluk Banten dan Pelabuhan Ratu
Nama : Forcep Rio Indaryanto
NIM : C251110071
Disetujui oleh
Komisi Pembimbing
Dr. Ir. Yusli Wardiatno, M.Sc Ketua
drh. Risa Tiuria, MS, Ph.D Anggota
Diketahui oleh
Ketua Program Studi Pengelolaan Sumberdaya Perairan
Dr. Ir. Sigid Hariyadi, M.Sc.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2012 ini dengan judul Struktur Komunitas Cacing Parasitik pada Ikan Kembung (Rastrelliger brachysoma dan R. Kanagurta) di Perairan Teluk Banten dan Pelabuhan ratu. Tesis ini tidak mungkin dapat tersusun tanpa bantuan dan dukungan moral dari keluarga tercinta: ayah, ibu, istri, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Terima kasih penulis ucapkan kepada Bapak kepada Dr. Ir. Yusli Wardiatno, M.Sc dan drh. Risa Tiuria, MS, Ph.D selaku pembimbing yang dengan penuh kesabaran dan dedikasi memberikan pengarahan dan masukan yang sangat berarti dalam penelitian ini. Ungkapan terima kasih karena telah banyak membantu di Laboratorium kepada Endang Juniardi dan mahasiswa Untirta di Laboratorium budidaya Untirta, pak Eman dan Bibi (almarhum) di Laboratorium Helmintologi IPB, staf Laboratorium Sumberdaya Air Provinsi Banten, juga kepada Dr. Makoto TSUCHIYA, Dr. Hideyuki Imai dan Muhamad Fadry Abdullah atas ilmu dan pengalamannya di University of the Ryukyus, Okinawa – Japan. Penghargaan yang besar penulis sampaikan kepada Pak Agus beserta nelayan Pelabuhan Ratu juga Pak Warca beserta nelayan Karangantu –Teluk Banten yang juga telah memberikan bantuan berupa informasi dan juga pendampingan selama penulis melakukan pengambilan sampel.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
Hipotesis Penelitian 3
2 TINJAUAN PUSTAKA 3
Ikan Kembung (Rastrelligerspp.) 3
Infeksi Parasit 5
Lingkungan Perairan 7
Interaksi Komponen Kesehatan Ikan 8
3 METODE 9
Metode Pengambilan Sampel 9
Prosedur Pengukuran dan Pemeriksaan 10
Prosedur Analisis Data 12
4 HASIL DAN PEMBAHASAN 14
Hasil 14
Pembahasan 24
5 KESIMPULAN DAN SARAN 30
Kesimpulan 30
Saran 30
DAFTAR PUSTAKA 31
LAMPIRAN 36
DAFTAR TABEL
1 Klasifikasi tingkat kematangan gonad ikan kembung betina
menurut Burnahuddinet al.(1984) 11
2 Kategori nilai prevalensi menurut Williams dan Williams (1996) 12 3 Kategori nilai intensitas menurut Williams dan Williams (1996) 13 4 Amova population pairwise (FST) padaR. brachysoma 15 5 Karakteristik biologi R. kanagurta dan R. brachysoma dari perairan
Teluk Banten dan Pelabuhan Ratu 15
6 Karakteristik biologi reproduksi R. kanagurta dan R. brachysoma dari
perairan Teluk Banten dan Pelabuhan Ratu 15
7 Salinitas, suhu, turbidity, pH, DO dan curah hujan dari permukaan dan kedalaman 10 meter perairan Teluk Banten dan Pelabuhan Ratu 16 8 Komunitas cacing parasitik pada R. kanagurta danR. brachysoma dari
perairan Teluk Banten dan Pelabuhan Ratu 22
9 Distribusi cacing parasitik pada organ lambung dan usus dari Rastrelligerspp. Jumlah (A), intensity rata-rata (MI) and prevalensi (P) 22 10 Hubungan antara panjang (cm) dengan jumlah (A), intensitas rata-rata
(MI) dan prevalensi (P%) cacing parasitik 23
11 Inventaris cacing parasitik padaR. kanagurtadari berbagai negara 24 12 Daerah penyebaran, inang dan ukuran dari L. angustiovum dan L.
excisummenurut Gibson dan Bray (1986) 24
DAFTAR GAMBAR
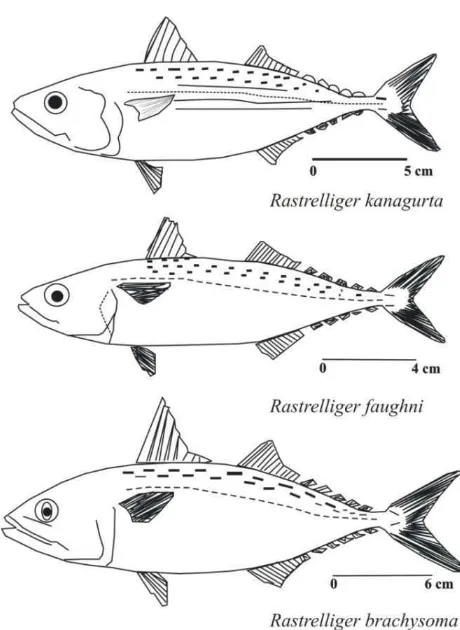
1 Morphologi spesies-spesies ikan kembung 4
2 Lokasi pengambilan Rastrelliger sp. (1) Teluk Banten, dan (2)
Pelabuhan Ratu 9
3 Foto dan sketsaR. brachysomadanR. Kanagurtadari Pelabuhan Ratu 14 4 Phylogenetic Tree (NJ dengan model kimura 2) dari DNA
L. angustiovumyang dibandingkan Family Hemiuridae lainnya 17 5 Anatomi specimen segar L. angustiovum perbesaran 100x (A) dan
specimen awetan L. angustiovum perbesaran 100x (B) dari R. brachysoma di Pelabuhan Ratu. L. angustiovum dalam cawan petri dengan diameter 5 cm dari R. kanagurta di Pelabuhan Ratu (C). Keterangan: 1) oral sucker; 2) faring; 3) ventral sucker; 4) testis; 5)
ovarian; 6) uterus; dan 7) lubang ekskresi 18
6 Anatomi specimen segar Lecitochirium sp. perbesaran 100x dariR.
kanagurtadi Pelabuhan Ratu 19
7 Anatomi specimen segar Prodistomum sp. perbesaran 100x (A) dan dalam cawan petri diameter 5 cm (B) dari R. kanagurta di Pelabuhan Ratu. Keterangan: 1) oral sucker; 2) ventral sucker 20 8 Anatomi specimen segar Anisakis typica. Keterangan: a) A. typica
9 Distribusi cacing parasitik pada lambung dan usus R. kanagurta dan
R. brachysoma 25
10 Nilai intensitas dan prevalensi cacing parasitik pada R. kanagurta dan
R. brachysoma 26
11 Komposisi makanan pada berbagai kelompok umur R. kanagurta
menurut Yohannan (1995) 28
12 Tingkatan komponen karakteristik habitat infeksi cacing parasitik 29
DAFTAR LAMPIRAN
1 Data biologi ikan dan jumlah cacing parasitik pada R. kanagurta dan R. brachysomapada perairan Teluk Banten dan Pelabuhan Ratu 36 2 Morphometrik cacing parasitik pada saluran pencernaan R. kanagurta
dan R. brachysoma pada perairan Teluk Banten (Tb) dan Pelabuhan
1 PENDAHULUAN
Latar Belakang
Sumberdaya ikan pelagis kecil merupakan salah satu sumberdaya perikanan yang cukup melimpah dan banyak ditangkap untuk dijadikan konsumsi masyarakat di Indonesia maupun dunia. Salah satu sumberdaya ikan pelagis kecil yang banyak disukai adalah ikan kembung (Rastrelliger spp.). Genus Rastrelliger terdiri dari tiga spesies yaitu R. brachysoma, R. kanagurta dan R. faughni, namun di Indonesia R. faughni tidak komersil seperti R. kanagurta dan R. brachysoma (Burnahuddin et al. 1984; Chee 2000).Volume produksi R. brachysomapada tahun 2011 sebesar 291.863 ton. Ikan ini merupakan komoditas dengan volume produksi tertinggi ke-3 dibawah ikan layang (Scad) 405.808 ton dan ikan Cakalang (Skipjack tuna) 372.211 ton. Kenaikan rata-rata volume produksi dari tahun 2001 hingga 2011 mencapai 3,38% (KKP 2012). Filipina merupakan negara dengan volume produksi R. brachysoma tertinggi di dunia, yaitu 347.163 ton (FAO 2012). Volume produksi R. kanagurta tahun 2011 hanya 19.688 ton (KKP 2012).
Ikan kembung disukai karena bergizi tinggi, dagingnya lembut, mudah diperoleh, harga terjangkau dan tidak menimbulkan alergi (Santoso et al. 1997). Tingkat kesukaan ikan kembung di Pulau Jawa adalah 7,87% dan 5,1% untuk ikan asin peda (olahan ikan kembung) (DPPHP 2010), sedangkan di kota Serang – Provinsi Banten adalah sebesar 12,7% (Indaryanto dan Saifullah 2011). Tingginya kesukaan terhadap ikan kembung ini disatu sisi patut mendapat apresiasi karena nelayan mendapat kepastian konsumen hasil tangkapannya namun disisi lain, ikan mengandung cacing parasitik. Cacing merupakan salah satu kelompok parasit yang banyak ditemukan pada tubuh suatu organisme, salah satunya adalah pada ikan (Chandra 2006). Cacing parasit dari kelompok digenea dan nematoda lebih banyak ditemukan pada bagian dalam tubuh (endoparasit) pada ikan-ikan bertulang belakang sedangkan kelompok monogenea terdapat pada bagian luar tubuh ikan (ektoparasit) (Chamberset al.2001; Cribbet al.2002).
Cacing parasitik dapat menimbulkan kerugian secara ekologis, biologis maupun ekonomis. Parasit yang terdapat pada ikan jika dalam jumlah sedikit tidak menyebabkan kerusakan yang berarti. Namun jika terdapat dalam jumlah banyak, parasit dapat menyebabkan kematian pada ikan. Selain mengakibatkan kematian, infeksi parasit juga menyebabkan menurunkan bobot tubuh, menurunkan ketahanan tubuh, penurunan tingkat fekunditas.
Cacing parasitik pada ikan juga dapat berbahaya bagi manusia atau disebut dengan Zoonosis. Cacing parasitik dari kelas Trematoda (Clonorchis sp. dan Opisthorchis sp.) yang dapat menyebabkan kerusakan hati atau bahkan menjadi kanker hati, cacing ini banyak ditemukan pada hasil perikanan air tawar di daerah tropis dan subtropis. Kelas Cestoda (Diphylobothrium sp.) dapat menimbulkan sakit perut dan diare. Kelas Nematoda (Anisakis sp. dan Pseudoterranova sp.) dapat menimbulkan reaksi alergi, mual dan sakit perut akut (Jahncke dan Schwarz 2002).
cepat. Bangsa-bangsa lain yang datang ke Indonesia tentu saja juga membawa kebiasaan dan kebudayaanya, termasuk kebiasaan dan budaya makan. Pada saat ini di Indonesia semakin banyak restoran-restoran asing yang menghidangkan daging ikan mentah atau setengah matang yang cepat atau lambat akan berpeluang timbulnya kasus penyakit parasiter khususnyaAnisakissp. pada manusia (Jahncke dan Schwarz 2002).
Pemantauan penyakit pada ikan liar merupakan hal yang penting karena beberapa ikan liar dapat menjadi inang ataupun pembawa berbagai jenis penyakit terutama bila ikan tersebut memiliki pola migrasi (Duff 2003). Cacing parasitik menunjukkan distribusi yang sama dengan distribusi inangnya (Madhavi dan Lakshmi 2011). Infeksi cacing parasitik pada ikan terjadi akibat ketidakserasian antara tiga komponen utama penyebab penyakit yaitu ikan sebagai inang, lingkungan perairan dan cacing parasitik itu sendiri. Studi ekologi cacing parasitik pada ikan menunjukkan adanya interaksi dari faktor ekstrinsik (habitat host) seperti karakteristik lingkungan inang dan faktor-faktor intrinsik (biologi host) seperti ukuran tubuh atau jenis kelamin, memainkan peran yang penting (Chandraet al.2011;. Hamann 2012). Jumlah, ukuran, perilaku setiap cacing parasitik terhadap inang ditentukan oleh umur, ukuran tubuh inang, daya tahan inang, iklim, musim dan lokasi geografik (Noble dan Noble 1982).
Perbedaan karakteristik habitat inangnya akan menyebabkan perbedaan jumlah, intensitas maupun prevalensi investasi spesies cacing parasitik terhadap inangnya pada suatu daerah (Yamaguti 1953; Bray 1990; Arthur and Lumanlan 1997; Hariyadi 2006; Awiket al.2010; Liuet al.2010; Madhavi and Lakshmi 2011). Perairan Teluk Banten dan Pelabuhan Ratu adalah dua perairan yang memiliki karakteristik berbeda. Perairan Teluk Banten berada di sebelah utara Jawa Barat yang berhadapan dengan Laut Jawa sehingga memiliki karakteristik perairan dangkal dan tenang sedangkan perairan Pelabuhan Ratu berada di sebelah selatan Jawa Barat yang berhadapan dengan Samudra Hindia memiliki karakteristik perairan samudra.
Perumusan Masalah
Berdasarkan latar belakang yang dikemukakan diatas, maka perumusan masalah dalam penelitian ini adalah :
Apakah jenis cacing parasitik yang terdapat pada ikan kembung? Spesies cacing parasitik apakah yang dominan?
Adakah perbedaan jenis dan jumlah cacing parasitik yang terdapat pada R. brachysomadanR. kanagurta?
Bagaimanakah penyebaran cacing parasitik di dalam organ?
Apakah jumlah cacing parasitik berpengaruh terhadap jenis kelamin ikan? Apakah jumlah cacing parasitik berpengaruh terhadap perkembangan gonad? Apakah jumlah cacing parasitik berpengaruh terhadap panjang tubuh ikan? Apakah jumlah cacing parasitik berpengaruh terhadap parameter kualitas air Adakah perbedaan jenis dan jumlah cacing parasitik ikan kembung dari Teluk
Banten dan Pelabuhan Ratu?
Tujuan Penelitian
Berdasarkan latar belakang yang dikemukakan diatas, maka tujuan penelitian ini adalah :
Mempelajari interaksi tiga komponen utama penyebab penyakit yaitu ikan sebagai inang, lingkungan perairan dan cacing parasitik
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat dimanfaatkan dalam hal pengembangan ilmu pengetahuan dan penerapan di masyarakat serta sebagai bahan pertimbangan bagi pengambil kebijakan
1. Sebagai bahan informasi untuk membuat peta distribusi cacing parasitik 2. Sebagai bahan informasi keamanan pangan untuk kesehatan manusia 3. Sebagai bahan informasi untuk managemen kesehatan ikan budidaya
4. Sebagai bahan pembuatan kebijakan karantina dan lalulintas perdagangan ikan
Hipotesis Penelitian
Cacing parasitik yang menginfeksi Ikan kembung dominan olehL. angustonum Terdapat perbedaan jumlah cacing parasitik padaR. brachysomadanR. kanagurta Cacing parasitik banyak terdapat di lambung
Jumlah cacing parasitik berpengaruh terhadap jenis kelamin ikan, perkembangan gonad, panjang tubuh ikan, lokasi perairan dan suhu perairan
2
TINJAUAN PUSTAKA
Ikan Kembung(Rastrelligerspp.)
Sistematika morphologi
Ikan kembung tergolong ke dalam genus Rastrelliger, famili Scombridae. Klasifikasi ilmiah dari ikan kembung adalah :
Filum : Chordata Kelas : Actinopterygii Ordo : Perciformes Famili : Scombridae Genus : Rastrelliger
Spesies : Rastrelliger kanagurta(Cuvier 1817) Rastrelliger brachysoma(Bleeker 1851)
Gambar 1. Morfologi spesies-spesies ikan kembung
Kunci identifikasi jenis Rastrelligerspp. (Burnahuddin et al. 1984; Sudjastani 1976; Jamaluddin 2010, lihat Gambar 1) adalah sebagai berikut :
1. Saringan insang sangat pendek, tidak terlihat bila mulut dibuka
a. Tubuhnya ramping dan bulat. Panjang baku 4,8-5,0 kali tinggi tubuh pada bagian ujung tutup insang. Saringan insang berjumlah20-25 buah. Panjang usus 1,0-1,2 kali panjang baku ...R. faughniMATSUI 2. Saringan insang sangat panjang, terlihat bila mulut dibuka
a. Tubuhnya panjang, sedikit bulat dan sedikit pipih. Panjang baku 3,8-4,5 kali tinggi tubuh pada bagian ujung tutup insang. Panjang baku 3,3-3,7 kali panjang kepala. Tubuhnya terdapat empat buah garis berwarna hijau. Terdapat bercak hitam di sekitar punggung. Di belakang sirip punggung kedua dan sirip dubur terdapat 5 sampai 6 sirip tambahan yang disebut finlet. Formula sirip D1 XI (IX-XI); D2 12 (12-13) + 5 ( 5 - 6 ) ; A 13 + 5 (5-6); P1 19 (19-20); P2 1.5
...R. kanagurtaCUVIER b. Bentuk tubuh pipih. Panjang baku 3,1-3,7 kali tinggi tubuh pada bagian ujung
tutup insang. Panjang baku 3,1-3,8 kali panjang kepala. Warna tubuh biru kehijauan di bagian punggung dengan titik gelap atau hitam di atas garis rusuk sedangkan bagian bawah tubuh berwarna putih perak. Sirip ekor berwarna kekuningan. Di belakang sirip punggung kedua dan sirip dubur terdapat 5 sampai 6 sirip tambahan yang disebut finlet. Formula sirip D1 XI (IX-XI); D2 12 (12-13) + 5 ( 5 - 6 ) ; A 13 + 5 (5-6); P1 19 (19-20); P2 1.5. ...
Reproduksi
Jenis kelamin ikan kembung tidak dapat dibedakan hanya dengan melihat bentuk morfologi luar. Pada umumnya gonad ikan kembung terdiri dari dua bagian yang tidak sama besar. Tidak semua ikan kembung dapat ditentukan jenis kelaminnya, penentuan jenis kelamin ikan muda dilakukan dengan menggunakan mikroskop. Bentuk gonad ikan jantan berbentuk pipih dan berwarna putih, sedangkan ikan betina berbentuk bulat panjang dan berwarna merah atau kuning (Burnahuddinet al.1984).
R. kanagurta di Laut Jawa mempunyai dua musim pemijahan yaitu pada musim barat atau bulan Oktober–Februari dan musim timur atau bulan Juni– September. Musim pemijahanR. brachysomaberlangsung mulai bulan Maret–Oktober (Burnahuddinet al.1984).
R. kanagurta di Laut Jawa pertama kali matang kelamin pada ukuran 19 (18-20,5) cm atau pada umur tujuh bulan. R. brachysoma pertama kali matang kelamin pada ukuran 17,3 (17,0-17,5) cm atau pada umur 7,5 bulan (Sudjastani 1974). Ukuran ikan saat pertama kali gonadnya menjadi masak berhubungan dengan pertumbuhan ikan itu sendiri dan faktor-faktor yang mempengaruhinya (Effendi 1979).
Pertumbuhan dan umur
Effendi (1979) menyatakan pertumbuhan suatu individu merupakan pertambahan bobot atau panjang dalam satuan waktu, sedangkan pertumbuhan dalam suatu populasi dinyatakan dengan penambahan jumlah individu. populasi dinyatakan dengan penambahan jumlah individu. Ada beberapa metode yang umum digunakan untuk menduga parameter-parameter pertumbuhan (K=koefisien pertumbuhan; L∞ = panjang asimtotik; t0 = umur ikan ketika panjangnya sama dengan nol). Studi tentang pertumbuhan pada dasarnya merupakan penentuan ukuran badan sebagai suatu fungsi umur. Umur secara teoritis ikan pada saat panjang sama dengan nol, dapat diduga secara terpisah menggunakan persamaan empiris (Burnahuddinet al.1984).
Makanan
Pada perairan tropis, makanan merupakan faktor pertumbuhan yang lebih penting daripada suhu perairan (Effendi 1979). Ikan kembung termasuk ikan pemakan plankton. Kebiasaan makanan ikan kembung yaitu memangsa plankton, copepoda, atau krustacea (Ganga 2010). Penyebaran ikan kembung dapat dibagi menjadi dua bagian, yaitu penyebaran secara vertikal dan horisontal. Penyebaran secara vertikal dipengaruhi oleh suhu dan gerakan harian plankton sedangkan penyebaran secara horizontal dipengaruhi oleh arus laut (Baladin 2007).
Infeksi Parasit
Parasit berasal dari kata Parasitos yang berarti organisme yang mengambil makanan, jadi parasit adalah organisme yang hidupnya tergantung pada beberapa faktor metabolik esensial dari organisme lain. Parasitisme adalah suatu persekutuan obligat antara dua atau lebih organisme yang berbeda spesies karena ketergantungan faktor metabolik esensial dalam pertukaran zat antar kedua belah pihak dimana salah satu organisme mendapat keuntungan sedangkan organisme lainnya menderita kerugian yang bersifat sementara atau selamanya (Noble dan Noble 1982). Kelompok parasit dibagi menjadi dua yaituendoparasitdanektoparasit(Soulsby 1982).
(Chandra 2006). Keberadaannya di dalam tubuh inangnya tidak tumpang tindih. Kelompok cacing cestoda adalah endohelminths dominan pada ikan elasmobranchs. Cacing parasit pada bagian luar tubuh ikan bertulang belakang (ektoparasit) adalah monogenea dan digenea juga nematoda merupakan cacing dominan pada bagian dalamnya atauendoparasit(Chamberset al.2001; Cribbet al.2002).
Trematoda(digenea)
Prevalensi kecacingan trematoda pada ikan cukup tinggi. Dalam jumlah yang banyak, infeksitrematodaparasitik dapat mengakibatkan infeksi sekunder pada organ terinfeksi dan dapat mengakibatkan penurunan metabolisme. Ciri khas cacing ini adalah berbentuk pipih (Noble dan Noble 1982), dan disebut juga cacing hisap atau flukes karena memiliki alat penghisap, atau juga disebut dengan cacing daun karena bentuk tubuhnya pipih seperti daun (Natadisastra dan Agoes 2005). Tubuhnya dilapisi kutikula untuk menjaga agar tubuhnya tidak tercerna oleh inangnya dan mempunyai alat pengisap dan alat kait untuk melekatkan diri pada inangnya (Hoffman 1967).
Cacing digenea pada umumnya bersifat endoparasit yang dapat ditemukan pada organ dalam ikan seperti usus, pembuluh darah. Parasit ini memiliki dua buah batil isap muskuler berbentuk mangkok pada bagian mulut (oral sucker) dan ventral (ventral sucker), biasanya tanpa kait atau organ-organ tambahan lain untuk berpegangan, dengan lubang-lubang genital yang biasanya bermuara di permukaan ventral antara batil- batil isap serta sebuah lubang ekskretoris posterior (Noble dan Noble 1982).
Digenea merupakan parasit yang bersifat hermaprodit. Kelamin betina terdiri dari ovarium tunggal, oviduk, ootipe, vitelaria, uterus, dan lubang kelamin. Kelamin jantan terdiri dari testes yang kebanyakan sepasang, vas deferens, saluran ejakulasi, dan penis. Siklus hidup digenea sangat kompleks dan biasanya melibatkan dua inang antara dan satu inang definitif. Menurut Grabda (1991) stadium perkembangan digenea adalah telur, mirasidium, sporokista, redia, serkaria, metaserkaria dan dewasa.
Nematoda
Nematoda artinya berbadan panjang, silindris, tipis tidak bersegmen yang umumnya dilapisi lapisan kutikula (Buchmann dan Bresciani 2001). Kutikula menyelubungi permukaan luar dan juga melapisi rongga bukal, esofagus, vagina, lubang sekretoris. Kutikula ini berguna sebagai selubung pelindung yang halus dan lentur yang resisten terhadap enzim pencernaan inang terutama cacing dewasa yang hanya dapat ditembus oleh air dan ion-ion kecil (Noble dan Noble 1982). Nematoda memiliki mulut, usus dan anus yang berkembang, alat kelamin yang terpisah, berperan sebagai endoparasit serta siklus hidupnya luas melibatkan inang invertebrata (Buchmann dan Bresciani 2001).
Lingkungan Perairan
Lingkungan perairan merupakan habitat dari berbagai jenis biota akuatik, salah satunya adalah ikan. Perubahan lingkungan hingga melewati batas normal akan menimbulkan penyakit pada ikan. Parameter yang penting adalah suhu, intensitas dan waktu mendapat sinar, susunan kimia air, kandungan benda-benda biologis, tersedianya ruangan dan makanan, serta hal-hal yang dapat membuat ikan stres.
Teluk Banten
Perairan Teluk Banten terletak pada posisi 5°53’07”-6°01’49”LS dan 106°04’30”-106°16’39”BT. Teluk ini mempunyai luas ± 150 km2 dan tersebar beberapa pulau di dalamnya. Kedalaman teluk berkisar antara 1 – 10 meter dari muara hingga mendekati ujung teluk, sedangkan kedalaman ujung teluk hingga pulau Tunda dapat mencapai 40 – 60 meter. Sedimen Teluk Banten terdiri dari lumpur dan pasir. Musim penghujan berlangsung antara November hingga Maret dan musim kemarau antara April – Oktober (Green and Short 2003).
Gelombang maksimum di Teluk Banten mencapai ketinggian 1 meter. Tipe pasang surut yang terjadi di Teluk Banten adalah tipe pasut campuran cenderung ke diurnal dengan elevasi maksimum sebesar 8,5 meter. Suhu perairan di Teluk Banten berkisar antara 29,2 – 29,6 °C. Berdasarkan pengukuran suhu secara vertikal pola suhu menurun terhadap kedalaman, semakin dalam perairan maka suhu akan semakin kecil. Salinitas di Teluk Banten berkisar antara 31,6 – 32 PSU. Secara vertikal pola salinitas meningkat terhadap kedalaman, semakin dalam perairan maka salinitas semakin tinggi (Purbani 2010).
Populasi fitoplankton didominasi oleh satu marga, yaitu Chaetoceros. Kelimpahan fitoplankton di bagian timur Teluk Banten mencapai nilai tertinggi yaitu 9 juta sel/m3, sedangkan bagian baratnya mencapai nilai terendah yaitu 67 ribu sel/m3. Kelimpahan zooplankton memiliki pola yang sama dengan fitoplankton. Kelimpahan di bagian timur Teluk Banten yaitu 457.000 individu/103/m3 dan di bagian barat 35.000 individu/103/m3. Beberapa individu zooplankton antara lain Calanoid, Cirripedia, Caridea, Brachyura, Luciferidae, Chaetognatha dan Larvacea (Adnan et al.1998).
Teluk Pelabuhan Ratu
Kawasan Teluk Pelabuhan Ratu memiliki luas perairan sekitar 210 km2 berada pada wilayah Kabupaten Sukabumi – Jawa Barat yang secara astronomi berada pada posisi 6057’ – 7025’ Lintang Selatan dan 106049’ – 107000' Bujur Timur. Kawasan ini berhadapan langsung dengan Samudera Indonesia (Samudera Hindia), sehingga memiliki ciri berombak besar, batimetri laut dalam dan tinggi gelombang dapat mencapai lebih dari 3 meter (PKSPL IPB 2003a).
Kisaran suhu permukaan 28,5 – 29,2 ºC, salinitas 32 – 35 PSU dan pH 8,30 – 8,31 pada musim barat memperlihatkan adanya perbedaan dibandingkan dengan musim timur dimana tercatat kisaran suhu permukaan 25 – 27 ºC, salinitas 29 – 32 PSU dan pH 7,00 – 7,50. Pengaruh laut terbuka yang lebih dominan, pada musim barat kualitas perairan teluk lebih menunjukkan keadaan perairan laut lepas dibandingkan pada musim timur. Pada kedua musim menunjukkan bahwa secara vertikal suhu permukaan tercatat lebih tinggi (sebesar 0,1 – 0,7 ºC) dibandingkan pada kedalaman 25 m, dan suhu perairan teluk pada musim barat relatif lebih tinggi dibandingkan pada musim timur. Adanya perbedaan suhu tersebut selain disebabkan oleh faktor penyinaran juga disebabkan percampuran dan pengadukan massa air (Sanusi 2004).
Organisme fitoplankton terdiri dari 3 kelas, yaitu Bacillariophyceae, Cyanophyceae dan Dynophyceae. Organisme fitoplankton didominasi oleh kelas Bacillariophyceae. Komunitas zooplankton dominan terdiri dari kelas Crustacea (14 taksa). Kelimpahan zooplankton di perairan permukaan lebih besar daripada yang terukur pada kedalaman 25 m. Organisme tersebut hidup baik pada habitat dengan tekstur dominan pasir maupun fraksi debu dan liat (Sanusi 2004).
Interaksi Komponen Kesehatan Ikan
Ikan dikenal sangat rentan terinfeksi parasit cacing. Beberapa ekor cacing dan beberapa spesies sering menghuni satu tubuh ikan. Hubungan antara parasit dengan inangnya merupakan suatu hubungan simbiosis yang keduanya hidup bersama dan harus saling bertoleransi dalam pertukaran zat metabolik untuk dapat saling menguntungkan. Inang yang tidak sehat berarti lingkungan yang sehat bagi parasit (Noble dan Noble 1982). Organisme parasit secara normal hidup pada berbagai jenis organisme perairan dan hanya menyebabkan penyakit bila daya tahan tubuh inangnya menurun (Untergasser 1989). Inang adalah organisme yang merupakan habitat untuk hidup, tumbuh dan berkembangbiak. Penyebaran parasit ikan di laut dipengaruhi oleh banyak faktor yang diantaranya komposisi kimia air laut, keberadaan inang antara, zoonasi laut, salinitas dan suhu (Noble dan Noble 1982).
Zoonosis adalah penyakit atau infeksi yang secara alamiah dapat berpindah antara hewan dengan manusia. Sedangkan anthroponosisadalah penyakit atau infeksi yang secara alamiah dapat berpindah antara manusia dengan hewan. Konsep zoonosis secara keseluruhan adalah rumit, karena melibatkan manusia, parasit itu sendiri, inang, vektor dan lingkungan yang membentuk keutuhan biologis (Noble dan Noble 1982). Organisme parasit yang bersifatzoonosismerupakan indikator dapat terjadinya infeksi parasit tersebut terhadap manusia di kemudian hari. Vektor adalah suatu organisme yang di dalam tubuhnya mengandung parasit, berkembangan dan menularkan kepada manusia atau hewan (Natadisastra 2005).
Menurut Untergasser (1989), faktor biotik yang mempengaruhi kehidupan cacing parasitik antara lain: keberadaan inang, umur dan ukuran panjang inang, kondisi inang, sifat patogenitas cacing parasitik. Faktor abiotik yang mempengaruhi kehidupan cacing parasitik antara lain: suhu, salinitas, oksigen, ammonia, pH, cahaya, kedalaman atau tekanan air, dan tingkat pencemaran. Penelitian Awik et al. (2010), menunjukan bahwa perbedaan lokasi menyebabkan perbedaan inventaris spesies yang ditemukan karena adanya perbedaanfeeding habit.
Penelitian Bunga (2008), menunjukan bahwa perbedaan ukuran ikan menyebabkan perbedaan intensitas parasit. Ikan berukuran kecil (rata-rata panjang 12,00 cm dan berat 34,2 gram) dengan ikan berukuran besar (rata-rata panjang 14,75 cm dan berat 123,4 gram) memiliki intensitas yang berbeda yaitu 58,8 individu/ikan kecil dan 36,3 individu/ikan besar. Hal ini disebabkan karena respon imun ikan kecil belum terbentuk sempurna sehingga daya tahan tubuhnya lebih lemah dan lebih rentan terhadap parasit jika dibandingkan dengan ikan yang berukuran besar.
3 METODE
Metode Pengambilan Sampel
Penelitian dilakukan dengan dua bagian, yaitu penelitian pendahuluan dilaksanakan pada bulan Juli–Desember 2012 dengan tujuan untuk melakukan identifikasi genetik R. brachysoma dan genetik parasit dominan (Lechitocladiumsp.), dan penelitian utama dilaksanakan bulan Februari–Juni 2013. Pengambilan ikan pada penelitian utama dilakukan dengan menggunakan jaring insang (gill net) sebanyak 20-30 ekor ikan di perairan Teluk Banten dan Pelabuhan Ratu (Gambar 2).
Identifikasi morfologi ikan dan cacing dilakukan di Laboratorium Helmintologi FKH–Institut Pertanian Bogor dan Laboratorium Budidaya Perairan FAPERTA– Universitas Sultan Ageng Tirtayasa, identifikasi genetik ikan dan cacing dominan dilakukan di Laboratorium Biologi Laut Universitas Ryukyus-Jepang, dan analisis kualitas air dilakukan di Laboratorium Sumberdaya Air Provinsi Banten. Data curah hujan diperoleh dari BMKG Provinsi Banten dan BMKG Pelabuhan Ratu.
Prosedur Pengukuran dan Pemeriksaan
Pemeriksaan Infeksi Cacing Parasitik
Pembedahan tubuh ikan dilakukan dengan menggunting bagian bawah abdomen ikan, mulai dari anus hingga ke bawah sirip dada. Insang dan saluran pencernaan dipindahkan ke dalam cawan petri yang berisi NaCl fisiologis 0,85%. Kemudian dilakukan pengamatan cacing parasitik yang terdapat dalam insang. Bagian usus dan lambung dibuka dengan menggunting secara memanjang dan isi usus dikeluarkan secara perlahan ke dalam cawan petri lain yang juga berisi NaCl fisiologis 0,85% kemudian lakukan pengamatan dan diambil gambar/fotonya. Pengambilan gambar/foto dan pengukuran parasit menggunakan aplikasi mikroskop merk Leica (Leica application suite/LAS EZ) version 1.8.0.
Identifikasi jenis cacing parasitik dilakukan dengan merujuk pada Madhavi dan Lakshmi (2011), Williams dan Williams (1996), Noga (1995), Untergasser (1989), Kabata (1985), Noble dan Noble (1982), Hoffman (1967) dan Yamaguti (1953). Pemeriksaan morfologi cacing trematoda dan cestoda menggunakan metoda pewarnaan permanen yaitu pewarnaan Semichon Acetocarmine (Lasee 2004). Pemeriksaan morfologi cacingnematodadipakai bahan pewarna minyak cengkeh.
Panjang-Berat Ikan
Menurut Effendi (1979), panjang ikan yang diukur adalah panjang total atau total lenght(TL) yaitu diukur mulai dari bagian terdepan moncong/bibir (premaxillae) hingga ujung ekor dengan satuan centimeter (cm). Berat ikan adalah ditimbang seluruh tubuh ikan ataubody weigh (BW) dengan menggunakan timbangan elektonik dengan satuan gram (gr).
Umur
Pertumbuhan pada tingkat individu, secara sederhana adalah pertambahan ukuran panjang atau bobot tubuh ikan selama waktu tertentu. Model yang paling umum digunakan dalam mempelajari tentang pertumbuhan ikan di daerah tropis adalah dengan pendekatan frekuensi panjang, karena jika menggunakan lingkaran tahun, ikan di perairan tropis batas lingkaran tahunnya tidak jelas, lain halnya dengan di perairan dingin. Dari frekuensi panjang ikan maka dapat diperoleh model pertumbuhan dan hubungan umur-panjang dengan persamaan pertumbuhan Von Bertanlanffy. Menurut Ahmad (2000) dan Sudjastani (1974), persamaan pertumbuhan Von Bertanlanffy ikan kembung di perairan Laut Jawa adalah:
= 1/ − (1− /L) +
dengan : t = umur (bulan)
k = Koefisien pertumbuhan
L = Panjang maksimum (asymptotic length)
R. kanagurta (23,8886) dan R. brachysoma (22,9170) t0 = umur teoritis
R. kanagurta (0,5186) dan R. brachysoma (0,7638)
Jenis kelamin, Tingkat Kematangan Gonad (TKG) dan Indeks Gonad (GSI) Ikan kembung jantan memiliki gonad berbentuk pipih dan berwarna putih, sedangkan ikan betina memiliki bentuk gonad bulat panjang dan berwarna merah atau kuning (Burnahuddin et al. 1984). Pengamatan tingkat kematangan gonad (Tabel 1) hanya dilakukan pada ikan kembung betina sedangkan pada ikan jantan hanya terbatas pada penentuan jenis kelamin.
Tabel 1. Klasifikasi tingkat kematangan gonad ikan kembung betina menurut Burnahuddinet al.(1984)
Klasifikasi Uraian
Tingkat I Panjang gonad kurang dari 1/2 rongga tubuh, berwarna jernih Kisaran panjang gonad 10 – 15 mm dan Lebar 1 – 3 mm Tingkat II Gonad berwarna kemerahan seperti buah anggur
Kisaran panjang gonad 20 – 25 mm dan Lebar 2 – 4 mm
Tingkat III Panjang gonad 2/3 rongga tubuh, berwarna kekuningan dan butir telur telah terlihat. Kisaran panjang 24 – 32 mm dan Lebar 5 – 10 mm
Tingkat IV Panjang gonad lebih dari 2/3 rongga tubuh. Warna butir telur keputihan, warna gonad kuning disertai adanya pembuluh darah. Kisaran panjang gonad 30 – 35 mm dan Lebar 10 – 14 mm
Tingkat V Hampir seluruh rongga tubuh dipenuhi gonad. Pembuluh darah pada dinding gonad terlihat jelas. Kisaran panjang gonad 42 – 47 mm dan Lebar 9 – 19 mm
Tingkat VI Hampir seluruh rongga tubuh dipenuhi gonad
Terdapat gelembung minyak berukuran 0,20 – 0,25 mm Kisaran panjang gonad 43 – 62 mm dan Lebar 12 – 24 mm Tingkat VII Kisaran panjang gonad 50 – 65 mm dan Lebar 15 – 30 mm
Ovarium sebagian atau seluruhnya kosong
Gonado somatic index(GSI) atau Indeks Gonad adalah indeks kuantitatif yang menunjukan kondisi kematangan seksual ikan. Menurut Zamroni et. al (2008), indeks gonad dapat dihitung dengan menggunakan rumus:
= 100%
dengan : Wg = berat gonad (gram) Bw = berat tubuh ikan (gram)
Pengukuran Kekeruhan (Turbidity)
Pengukuran Salinitas
Menggunakan metode alat Refraktometer. Mengukur konsentrasi bahan terlarut dengan memanfaatkan refraksi cahaya secara in situ. Sebuah benda yang di masukan ke dalam cairan akan terlihat membengkok, semakin tinggi konsentrasi bahan terlarut maka pembengkokannya semakin besar, maka sudut refraksi dari prisma ke sampel akan kecil sehingga cahaya akan jatuh pada skala yang besar dan begitupula sebaliknya.
Pengukuran pH
Menggunakan metode pH meter secara in situ berdasarkan pengukuran aktivitas ion hidrogen secara potensiometrik/ elektrometrik.
Pengukuran Oksigen (DO)
Menggunakan modifikasi metode Winkler (APHA 1989). Pengikatan oksigen (O2) oleh pereduksi Mn(OH)2 sehingga terbentuk endapan coklat. Endapan ini membebaskan I2 dari KI. Jumlah I2 yang dibebaskan setara dengan jumlah oksigen dalam air. I2 yang bebas ditentukan jumlahnya dengan cara titrasi menggunakan Na-thiosulfat. Nilai DO didapat dengan menggunakan rumus :
mg l O2 =
( − ℎ ) ( − ℎ ) 8 1000
ml sampel x
Prosedur Analisis Data
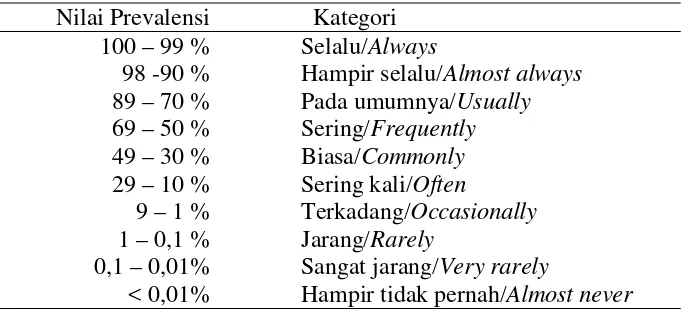
Intensitas dan Prevalensi
Parasit yang ditemukan baik dari ikan dihitung nilai intensitas dan prevalensi. Menurut Bush et al. (1997), prevalensi adalah persentase (%) jumlah ikan mengandung inventaris parasit (spesies ataupun kelompok) dibandingkan dengan jumlah ikan yang diperiksa, atau dapat dirumuskan sebagai berikut:
Prevelensi = n
N x 100%
dengan : n = Jumlah sampel ikan yang terinventaris parasit (ekor) N = Jumlah seluruh sampel ikan yang diamati (ekor)
Tabel 2. Kategori nilai prevalensi menurut Williams dan Williams (1996)
Nilai Prevalensi Kategori 100 – 99 % Selalu/Always
98 -90 % Hampir selalu/Almost always 89 – 70 % Pada umumnya/Usually 69 – 50 % Sering/Frequently
49 – 30 % Biasa/Commonly
29 – 10 % Sering kali/Often
9 – 1 % Terkadang/Occasionally 1 – 0,1 % Jarang/Rarely
0,1 – 0,01% Sangat jarang/Very rarely
Sedangkan intensitas menurut Bushet al. (1997) adalah jumlah individu parasit yang terinventaris dalam tubuh ikan, atau dapat dirumuskan sebagai berikut:
Intensitas = ∑P n
dengan : n = Jumlah sampel ikan yang terinfeksi parasit (ekor) ΣP = Jumlah total infeksi parasit (individu)
Tabel 3. Kategori nilai intensitas menurut Williams dan Williams (1996)
Nilai intensitas Kategori
< 1 individu parasit/ikan Infeksi parasit sangat ringan 1 – 5 individu parasit/ikan Infeksi parasit ringan 6 – 50 individu parasit/ikan Infeksi parasit sedang 51 – 100 individu parasit/ikan Infeksi parasit berat
100+ individu parasit/ikan Infeksi parasit sangat berat 1000+ individu parasit/ikan Super infeksi parasit
Analisis dominansi cacing parasitik
Untuk mengetahui dominansi infeksi cacing parasitik digunakan indeks dominansi Berger-Parker (d) (Hamann et al. 2012). Selain itu dihitung juga kekayaan spesies (richness/R).
Analisis ekstrinsik dan intrinsik
Uji perbedaan Mann-Whitney U (U), digunakan untuk mengetahui perbedaan antara dua kelompok pada data tidak terdistribusi normal, yaitu :
1. Jumlah cacing parasitik pada saluran pencernaanR. brachysomadanR. kanagurta 2. Jumlah cacing parasitik pada perairan Teluk Banten dan Pelabuhan Ratu
Uji perbedaan Independent Samples T-Tes (t),digunakan untuk mengetahui perbedaan antara dua kelompok pada data terdistribusi normal, yaitu:
1. Ukuran cacingL. angustiovumpadaR. brachysomadanR. kanagurta
2. Ukuran cacingL. angustiovumpada perairan Teluk Banten dan Pelabuhan Ratu Uji perbedaan One-Way ANOVA (F), digunakan untuk mengetahui perbedaan antara tiga kelompok atau lebih, yaitu :
1. Jumlah cacing parasitik pada jenis kelamin ikan kembung (Jantan, Betina dan yang belum teridentifikasi jenis kelaminnya)
Uji non-parametrik Spearman’s rank test (rs), digunakan untuk mengetahui korelasi antara dua kelompok pada data tidak terdistribusi normal, yaitu:
1. Jumlah parasit dengan Gonado Somatik Indeks (GSI)
2. Jumlah parasit dengan pertumbuhan panjang tubuh ikan kembung 3. Jumlah parasit dengan parameter kualitas air
4 HASIL DAN PEMBAHASAN
5 HASIL
Identifikasi spesiesRastrelligerspp.
Identifikasi spesies ikan kembung dapat dilakukan dengan dua cara, yaitu identifikasi berdasarkan morphologi tubuh ikan dan berdasarkan genetik. Di perairan laut Jawa hanya terdapat dua spesies yaituR. brachysoma danR. kanagurta(Sujastani 1976). Keduanya memiliki karakteristik morphologi yang relative mirip. Mereka dapat dibedakan dari rasio panjang-tinggi tubuhnya dan keberadaan garis-garis di sisi tubuhnya, garis tersebut akan memudar jika kesegaran ikan sudah mulai menurun (Gambar 3).
Gambar 3. Foto dan sketsaR. brachysomadanR. kanagurtadari Pelabuhan Ratu
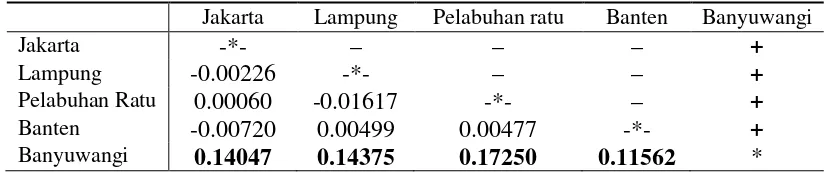
Hasil uji genetik R. brachysoma dan R. kanagurta, diketahui bahwa mereka memiliki segmen DNA sekitar 445 base pairs (bp) dengan komposisi basa nukleotida 29,1% A; 32,9% T; 22,8% G; dan 15,2% C. Ikan kembung yang memiliki rasio panjang dengan tinggi tubuh lebih kecil dari empat termasuk dalam spesies R. brachysoma, sedangkan jika rasionya lebih besar dari empat termasuk dalam spesies R. kanagurta. R. brachysoma memiliki keragaman genetik yang rendah yaitu 0.009-0.013, hal ini menunjukan bahwa ikan ini memiliki daerah penyebaran yang luas (Indaryanto et al. 2014). Umumnya ikan laut memiliki keragaman genetik yang rendah yaitu kurang dari 0,5 (Hobbset al.2013).
Table 4. Amova population pairwise (FST) padaR. brachysoma
Jakarta Lampung Pelabuhan ratu Banten Banyuwangi
Jakarta -*- – – – +
Lampung -0.00226 -*- – – +
Pelabuhan Ratu 0.00060 -0.01617 -*- – +
Banten -0.00720 0.00499 0.00477 -*- +
Banyuwangi 0.14047 0.14375 0.17250 0.11562 *
Keterangan: - = tidak berbeda populasi secara genetik, + = berbeda populasi secara genetik
Karakteristik biologi
Identifikasi spesies berdasarkan rasio ukuran Panjang-Tinggi tubuh ikan (Indaryantoet al.2014).Karakteristik biologi dan biologi reproduksiR. kanagurtadan R. brachysomahasil penelitian dapat dilihat pada Tabel 5 dan 6.
Tabel 5. Karakteristik biologi R. kanagurta dan R. brachysoma dari perairan Teluk Banten dan Pelabuhan Ratu
Karakteristik Total R. brachysoma R. kanagurta
Banten P.Ratu Banten P.Ratu Banten P.Ratu
Panjang 15,5-25 10-24,6 15,5-20,1 15-24,6 15,9-25 10-24,6
Tinggi 3,9-5,7 2,0-6,3 4,0-5,2 3,9-6,3 3,9-5,7 2,0-6,0
Rasio P-T 3,4-4,5 3,6-5.8 3,4-4,0 3,6-4,0 4,0-4,5 4,1-5,8
Berat 46-185 9.3-208 46-102 45,6-208 46-185 46-185
Umur 4,8-24,3 2,7-29,9 6,0-9,6 5,7-29,9 4,8-24,3 2,7-17,4 GSI 0,01-6,9 0,00-4,7 0,01-6,9 0,00-4,7 0,01-2,0 0,00-2,2
TKG 1-7 1-6 1-7 1-6 1-5 1-2
Tabel 6. Karakteristik biologi reproduksi R. kanagurta dan R. brachysoma dari perairan Teluk Banten dan Pelabuhan Ratu
Karakteristik Belum teridentifikasi Jantan Betina
Rb Rk Rb Rk Rb Rk
Panjang 15,1-16,5 10,0-17,8 15,0-24,6 14,5-24,6 15,5-22,0 15,0-25,0 Rasio P-T 3,7-3,9 4,6-5,7 3,4-3,9 4,0-5,3 3,3-3,9 4,0-5,2 Umur 5,7-6,6 2,7-5,8 5,7-29,9 4,2-17,4 6,0-12,5 4,4-24,3
GSI --- --- 0,1-6,9 0,01-2,2 0,01-4,8 0,02-2,0
TKG 1 Keterangan: Rb =R. brachysomadan Rk =R. kanagurta
17,3 (17,0-17,5) cm atau pada umur 7,5 bulan (Sudjastani 1974). R. brachysoma berada pada musim pemijahan karena sebagian berada pada TKG 6, sedangkan R. kanagurtatidak berada pada musim pemijahan karena seluruhnya berada pada TKG 1, hal ini sesuai dengan Burnahuddinet al.(1984).
Kondisi Perairan Teluk Banten dan Pelabuhan Ratu
Lingkungan perairan merupakan habitat dari berbagai jenis biota akuatik dan memiliki parameter-parameter yang mempengaruhi homeostatis yang sangat diperlukan untuk pertumbuhan dan reproduksi ikan. Bila lingkungan berubah dari batas normal akan dapat menimbulkan penyakit.
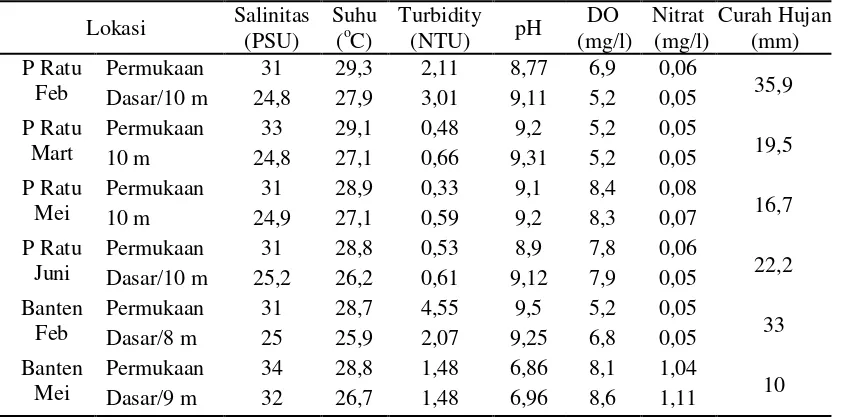
Perairan Teluk Banten memiliki karakteristik perairan berombak tenang dengan dasar berpasir, sedangkan Pelabuhan Ratu berombak besar dengan dasar perairan berlumpur. Curah hujan yang tinggi (10 – 35,9 mm) merupakan salah satu ciri musim penghujan. Curah hujan yang tinggi menyebabkan gerak arus yang menyebarkan padatan tersuspensi terutama yang bersumber dari sungai – sungai disekitarnya dan meningkatnya kekeruhan.
Parameter lingkungan seperti salinitas, suhu, turbidity, pH dan kandungan oksigen (DO) pada kedua perairan masih berada dalam kisaran yang baik bagi kehidupan biota perairan sesuai dengan kriteria KLH 2004 (Tabel 7), sehingga faktor lingkungan tidak menyebabkan ikan stres. Inang yang tidak sehat berarti lingkungan yang sehat bagi parasit (Noble dan Noble 1982).
Tabel 7. Salinitas, suhu, turbidity, pH, DO dan curah hujan dari permukaan dan kedalaman 10 meter perairan Teluk Banten dan Pelabuhan Ratu
Lokasi Salinitas
Permukaan 31 29,3 2,11 8,77 6,9 0,06
35,9
Dasar/10 m 24,8 27,9 3,01 9,11 5,2 0,05
P Ratu Mart
Permukaan 33 29,1 0,48 9,2 5,2 0,05
19,5
10 m 24,8 27,1 0,66 9,31 5,2 0,05
P Ratu Mei
Permukaan 31 28,9 0,33 9,1 8,4 0,08
16,7
10 m 24,9 27,1 0,59 9,2 8,3 0,07
P Ratu Juni
Permukaan 31 28,8 0,53 8,9 7,8 0,06
22,2
Dasar/10 m 25,2 26,2 0,61 9,12 7,9 0,05
Banten Feb
Permukaan 31 28,7 4,55 9,5 5,2 0,05
33
Dasar/8 m 25 25,9 2,07 9,25 6,8 0,05
Banten Mei
Permukaan 34 28,8 1,48 6,86 8,1 1,04
10
Dasar/9 m 32 26,7 1,48 6,96 8,6 1,11
Identifikasi Jenis Cacing Parasitik
Lechitocladium angustonumYamaguti 1953 Sub-class : Digenea
Order : Strigeida Super-family: Hemiuroidea Family : Hemiuridae Sub-family : Elytrophallinae Genus : Lecithocladium
Species :Lecithocladium angustiovumYamaguti 1953
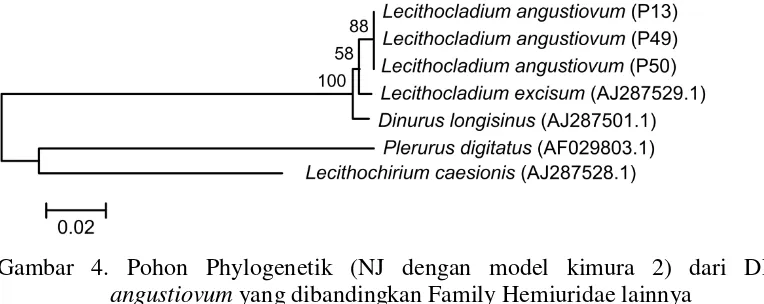
Informasi genetik hasil sequencing DNA diperoleh 354 base pairs (bp) DNA segment dengan komposisi basa (%) yaitu 17,7 A; 35,7 T; 29,6 G; dan 17,1 C, hasil ini kemudian dibandingkan dengan beberapa DNA Family Hemiuridae yang diperoleh dari GenBank, diantaranyaLecithocladium excisumAJ287529;Dinurus longisinus AJ287501;Plerurus digitatusAF029803; danLecithochirium caesionisAJ287528 (Olsonet.al 2003). Pohon phylogenetik Neighbor-joining (NJ dengan model kimura2) digambarkan dalam Gambar 4 (Indaryantoet al.2014).
Gambar 4. Pohon Phylogenetik (NJ dengan model kimura 2) dari DNA L. angustiovumyang dibandingkan Family Hemiuridae lainnya
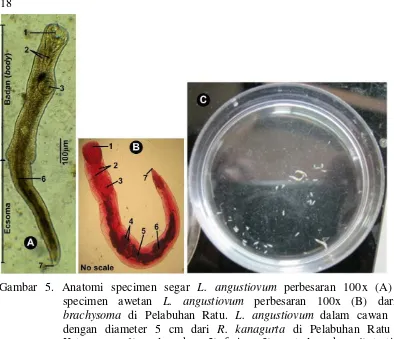
L. angustiovum memiliki tubuh memanjang dan dapat mengulur, dengan rata-rata panjang total 2,897 (1,389 – 5,490) mm dan rata-rata-rata-rata maksimum lebar 0,332 (0,169 – 0,655) mm yang terletak pada pertengahan tubuh. Rata-rata panjang badan 1,622 (0,704 – 4,050) mm dan rata-rata ecsoma 1,274 (0,423 – 2,492) mm. Bagian ecsoma meruncing kearah posterior, terkadang memanjang, memendek dan juga membulat. Panjang badan adalah 56,0% sedangkan ecsoma 44,0% dari total panjang tubuh. Oral sucker lebih besar dibandingkan ventral sucker. Oral sacker berukuran 0,207 (0,111 – 0,379) mm and ventral sucker 0,184 (0,078 – 0,95) mm dengan rasio 1:0,88. Jarak antara anterior ke ventral sucker 0,558 (0,298 – 1,140) mm atau terletak pada 19,30% dari panjang total (Gambar 5).
Gambar 5. Anatomi specimen segar L. angustiovum perbesaran 100x (A) dan specimen awetan L. angustiovum perbesaran 100x (B) dari R. brachysoma di Pelabuhan Ratu. L. angustiovum dalam cawan petri dengan diameter 5 cm dari R. kanagurta di Pelabuhan Ratu (C). Keterangan: 1) oral sucker; 2) faring; 3) ventral sucker; 4) testis; 5) ovarian; 6) uterus; dan 7) lubang ekskresi
Madhavi dan Lakshmi (2011) mengatakan bahwaL. angustiovummerupakan spesies yang paling dominan terdapat di saluran pencernaan ikan-ikan kelompok Scombridae, yang salah satunya padaR. kanagurtayaitu dengan nilai prevalensi 88,5%.L. angustiovumterdapat di beberapa negara seperti India, Indonesia,
Philippines, Chinese and Indian (Bray 1990; Yamaguti 1953; Arthur dan Lumanlan 1997; Liuet al.2010; Madhavi and Lakshmi 2011). Bray (1990), mengatakan bahwa L. angustiovummenginfeksi lima famili Perciform di Indo-West Pacific yaitu families Carangidae (47%) and Scombridae (44%), dengan infeksi terbesar padaR. kanagurta yaitu (37%) dari seluruhnya. Di Ghana, parasit ini menginfeksi ikanUpeneus
prayensis(Mullidae),Trachinotus glaucusandT. goreensis(Fischthal dan Thomas 1971).L. angustiovumjuga pernah ditemukan padaR. kanagurtadi Palawan dan Luzon Filiphina (Arthur dan Lumanlan 1997).L. angustiovumdilaporkan oleh Yamaguti tahun 1953 terdapat di pulau Sulawesi Indonesia (Yamaguti 1953).
Lecitochiriumsp.Luhe 1901 Sub-class : Digenea Order : Strigeida Super-family: Hemiuroidea Family : Hemiuridae Sub-family : Lecithochiriinae
Lecitochirium sp. memiliki tubuh memanjang, dengan rata-rata panjang total 1003,76 (410,77 – 1855,51) µm dan rata-rata lebar maksimum 194,62 (71,040 – 401,82) µm yang terletak pada posterior tubuh. Tidak memiliki ecsoma. Oral sucker berbentuk corong terletak di anterior tubuh. Oral sucker lebih besar dibandingkan ventral sucker. Oral sacker berukuran 89,28 (23,97 – 208,41) µm and ventral sucker 67,98 (10,34 – 145,93) µm dengan rasio 1:0,76. Jarak antara anterior ke ventral sucker 286,65 (108,89 – 534,58) µm atau terletak pada 28,6% dari panjang total (Gambar 6).
Lecitochirium sp. termasuk kedalam Famili Hemiuridae dan merupakan jenis cacing parasitik dengan daerah penyebaran yang luas dan dengan inang beragam. Parasit ini memiliki lebih dari 100 spesies dengan morphologi yang kompleks. Faktor ekologi, fisiologi dan adaptasi parasit menyebabkan variasi morfologi yang kompleks (Shihet al.2004).L. imocavumpernah ditemukan di teluk Tonkin Vietnam pada tahun 1970 dan L. Magnaporum, L. Microstomum dan L. Monticelli di laut Cina Selatan (Arthur dan Te 2006). Pernah juga ditemukan cacing L. magnaporum pada ikan tongkol oleh Fischthal dan Kuntz tahun 1964 di Palawan Filiphina (Arthur dan Lumanlan 1997). Di Indonesia, ditemukan pada ikan Caranx sp. oleh Yamaguti di Makassar pada tahun 1952 dengan namaL. lobatum(Yamaguti 1953).
Gambar 6. Anatomi specimen segar Lecitochiriumsp. perbesaran 100x dariR. kanagurtadi Pelabuhan Ratu
Prodistomum orientalisLayman 1930 Sub-class : Digenea
Order : Plagiorchiida Super-family: Lepocreadioidea Family : Lepocreadiidae Genus : Prodistomum
Prodistomum orientalis memiliki tubuh bulat memanjang, dengan rata-rata panjang total 861,52 (702,97 – 1065,28) µm dan rata-rata lebar maksimum 248,516 (183,980 – 291,56) µm yang terletak dekat dengan posterior tubuh. Oral sucker berbentuk bulat terletak di anterior tubuh. Oral sucker lebih kecil dibandingkan ventral sucker. Oral sucker berukuran 44,853 (29,41 – 59,82) µm and ventral sucker 86,958 (71,00 – 117,07) µm dengan rasio 1:1,938. Jarak antara anterior ke ventral sucker 290,25 (139,59 – 415,06) µm atau terletak pada 33,7% dari panjang total. (Lihat Gambar 7).
Gambar 7. Anatomi specimen segarProdistomum sp. perbesaran 100x (A) dan dalam cawan petri diameter 5 cm (B) dari R. kanagurta di Pelabuhan Ratu. Keterangan: 1) oral sucker; 2) ventral sucker
Pada awalnya cacing ini dikelompokan dalam genus Opechona namun kemudian menjadi genus tersendiri karena tidak memiliki uroproct (Madhavi dan Lakshmi 2011; Bray dan Gibson 1990), berukuran lebih kecil, penghisap oral kecil dan memiliki dua lengan ekskretoris lateralis. Prodistomum orientalis dominan didapatkan pada ikan kelompok Scombrid dengan nilai prevalensi yang tinggi diantaranya pada Rastrelliger kanagurta, Scomber japonicus, dan S. australasicus. Prodistomum orientalis dewasa terdapat di pyloric caeca (Bray dan Gibson 1990). Cacing ini memiliki daerah penyebaran yang sangat luas. Pernah ditemukan oleh Yamaguti tahun 1953 di pulau Sulawesi Indonesia (Yamaguti 1953).
Anisakis typica
Class : Nematoda
Sub-class : Secernentea Order : Ascaridida Family : Anisakidae Genus : Anisakis
Species :Anisakis typicaDiesing 1860
Anisakis typica memiliki tubuh memanjang, dengan rata-rata panjang total 984,99 µm dan rata-rata lebar maksimum 64,88 µm yang terletak di bagian tengah tubuh, lihat Gambar 8.
(a) (b) (c)
Gambar 8. Anatomi specimen segar Anisakis typica. Keterangan: a) A. typica perbesaran 100x diperoleh dari R. brachysoma di Teluk Banten, b) A. typica pada cawan petri tanpa mikroskop dan c) A. typicaperbesaran 40x dari TPI karangantu-Banten (penelitian pendahuluan)
Anisakis sp. di Indonesia terdapat pada R. kanagurta di pulau panggang kepulauan seribu pada tahun 1974 – 1975 dengan nilai prevalensi yang bervariasi yaitu 4,0 – 87,7% dan intensitas 1,5 – 13 individu/ikan (Hutomoet al.1978). Selain itu juga pada ikan kembung (Rastrelliger sp.) dari Muara Angke dengan prevalensi sebesar 58,7% dan intensitas 3 larva/ikan (Baladin 2007). Pengamatan pada ikan di beberapa perairan Indonesia menunjukkan prevalensi larva Anisakidae pada ikan Ekor Kuning di Selat Sunda (67%), Laut Bali (67%) dan Laut NTT (17%), ikan Tuna di Laut Bali (67%) dan Laut NTT (17%) dan ikan Kerapu di Selat Sunda (25%), Laut Bali (43%) dan Laut NTT (17%) (Hariyadi 2006).
Jumlah, Intensitas dan Prevalensi Cacing Parasitik
Nilai prevalensi infeksi cacing parasitik seluruhnya adalah 90,12% (142 dari 162 ikan yang diperiksa) atau menurut kategori Williams dan Williams (1996) tergolong hampir selalu/Almost always ada cacing parasitik pada saluran pencernaan ikan genus Rastrelliger. Ikan yang terinfeksi, 78 ekor ikan (53,42%) terdapat satu spesies cacing parasitik dalam saluran pencernaannya, 61 ekor ikan (41,78%) terdapat dua spesies dan 7 ekor ikan (4,79%) terdapat tiga spesies cacing parasitik.
Tabel 8. Komunitas cacing parasitik pada R. kanagurta dan R. brachysoma dari perairan Teluk Banten dan Pelabuhan Ratu
Cacing Parasitik
Penyebaran cacing parasitik dalam organ (Microhabitat)
Distribusi cacing parasitik pada organ pencernaan Rastrelliger spp. banyak terdapat pada usus dan lambung (Yamaguti 1953; Fischthal dan Thomas 1971; Bray 1990). Cacing parasitik pada lambung adalah sebanyak 84,8% sedangkan usus sebanyak 15,2% (lihat Tabel 9).
Table 9. Distribusi cacing parasitik pada organ lambung dan usus dari Rastrelliger spp. Jumlah (A), intensity rata-rata (MI) and prevalensi (P)
Cacing Parasitik
Usus Lambung
A MI P A MI P
Lecithocladium 206 4.48 28.4 1182 8.56 85.19
Lecithochirium 11 1.57 4.32 186 2.55 45.06
Prodistomum 2 1 1.23 27 3 5.56
Interaksi antara cacing parasit dengan biologi inang (Intrinsik)
Melalui uji perbedaan Mann-Whitney U, terbukti tidak ada perbedaan jumlah cacing parasitik yang terdapat saluran pencernaan R. kanagurta dan R. brachysoma (U = 2,460E3; p > 0,05).
Berdasarkan jenis kelamin ikan, terbagi atas 80 ekor ikan jantan, 66 ekor ikan betina dan 16 ekor ikan yang belum teridentifikasi jenis kelaminnya. Tidak semua ikan kembung dapat ditentukan jenis kelaminnya terutama jenis kelamin ikan muda (Burnahuddin et al. 1984). Menurut uji perbedaan One-Way ANOVA, tidak ada perbedaan jumlah cacing parasitik yang signifikan berdasarkan jenis kelamin ikan (F(2,159) = 1,136; p > 0,05).
Pada Tabel 5 terlihat bahwa R. brachysoma betina berada pada musim pemijahan karena sebagian berada pada TKG 6, sedangkan pada R. kanagurta tidak berada pada musim pemijahan karena seluruhnya berada pada TKG 1. Berdasarkan hasil korelasi Spearman’s, jumlah cacing parasitik berkorelasi dengan nilai Gonado Somatic Index(GSI) padaR. brachysoma(rs = -0,382; p < 0,01), akan tetapi tidak ada korelasi padaR. kanagurta(rs = -0,086; p > 0,05).
Berdasarkan hasil korelasi Spearman’s, jumlah cacing parasitik berkorelasi terhadap pertumbuhan panjang ikan (rs = -0,403; p < 0,01), berdasarkan hasil uji distribusi frekuensi terhadap panjang disajikan dalam Tabel 10.
Tabel 10. Hubungan antara panjang (cm) dengan jumlah (A), intensitas rata-rata (MI) dan prevalensi (P%) cacing parasitik
R. brachysoma R. kanagurta
Ukuran A MI P (%) Ukuran A MI P (%)
<16 400 13,79 96,7 <14 40 6,67 100
16,1-18,5 421 12,38 91,9 14,1-16,9 134 11,17 85,7
18,6-21,0 185 9,73 82,6 17,0-19,9 182 7,00 92,9
21,1-23,5 71 5,46 81,3 20,0-22,9 12 2,40 100
>23,6 3 3,00 100 >23,0 3 3,00 50
Melalui uji perbedaan independent samples T-Test, terbukti ada perbedaan ukuran cacingL. angustonumantara R. brachysomadanR. kanagurtat(30) = 2,898; p < 0,05). Ukuran cacing L. angustonum pada R. kanagurta (M = 3,319; SD = 1,090) lebih panjang daripada ukuran cacingL. angustonumpadaR. brachysoma(M = 2,474; SD = 0,712)
Interaksi antara jumlah cacing parasitik dengan habitat inang (Ekstrinsik)
6 PEMBAHASAN
Komunitas cacing parasitik
Hasil penelitian ini menunjukan bahwa pada saluran pencernaan ikan kembung hampir selalu dapat ditemukan cacing parasitik dengan kategori infeksi parasit sedang. Jenis-jenis cacing parasitik yang ditemukan pada saluran pencernaan R. kanagurta berbeda-beda pada setiap negara (Tabel 11). Cacing yang paling sering terdapat pada saluran pencernaan genus Rastrelliger adalah Famili Hemiuridae (diantaranya adalah Dinurinae. sp., Aponurus sp., Lecithocladium sp. dan Lecitochirium sp.), Opechona bacillaris,Prodistomumspp. dan Renodidymocystis yamaguti (Madhavi dan Lakshmi 2011). Hal ini berhubungan dengan ketersediaan zooplankton terutama copepoda sebagai makanan utama genusRastrelliger(Madhavi dan Lakshmi 2011). Sivadas dan Bhaskaran (2009) mengatakan bahwa copepoda mencapai 75% dari seluruh komponen makananRastrelligerspp.
Table 11. Inventaris cacing parasitik padaR. kanagurtadari berbagai negara
Bangladesha Philipinab Viet Namc Chinad Indiane
Digenea Digenea Digenea Digenea Digenea
Dinurinae. Anisakidae Nybelinia sp. L. parviovum
Nematoda
Anisakis sp. Contracaecum sp. Porrocaecum sp.
Sumber : a = Arthur dan Ahmed (2002); b = Arthur dan Lumanlan (1997); c = Arthur dan Te (2006); d = Liuet al.(2010); e = Madhavi dan Lakshmi (2011)
Table 12. Daerah penyebaran, inang dan ukuran dariL. angustiovumdanL. excisum menurut Gibson dan Bray (1986)
Group species Daerah
±3-8 mm ukuran sucker sama atau oral sucker
± 4 mm Oral sucker lebih besar dari ventral sucker
penyebaran L. angustiovum adalah perairan Indo-Malaysian. L. excisum memiliki bentuk yang hampir sama dengan L. angustiovum namun mereka memiliki daerah distribusi, inang, dan ukuran yang berbeda (Tabel 12).
Anisakis sp. dalam penelitian ini memiliki nilai intensitas (1 parasit per ekor ikan) dan prevalensi (2,2%) yang terendah dan bukan termasuk cacing parasitik yang bersifat zoonosis. R. kanagurta merupakan karnivor tingkat pertama dengan nilai tropic level 3,20 – 3,40 (Bijukumar dan Deepthi 2009; Vivekanandan et al. 2009). Siklus hidup Anisakis sp. melibatkan krustasea sebagai inang antara, beberapa ikan laut sebagai inang pembawa dan mamalia laut sebagai inang akhir. Ikan tuna, ekor kuning dan kerapu juga merupakan inang pembawa Anisakis sp. (Hariyadi 2006). Menurut nelayan setempat, daerah Teluk Banten dan Pelabuhan Ratu sering terlihat sekawanan Lumba-lumba dan pesut.
Penyebaran cacing parasitik dalam organ
Saluran pencernaan merupakan mikrohabitat bagi cacing parasitik karena merupakan sumber bahan organik yang juga merupakan makanan yang siap diserap oleh tubuh cacing parasitik. Cacing parasitik digenea dan nematoda tidak dapat merombak bahan organik yang belum disederhanakan. Tubuhnya dilapisi dengan kutikula untuk menjaga agar tubuhnya tidak tercerna oleh inangnya dan mempunyai alat pengisap dan alat kait untuk melekatkan diri pada inangnya (Hoffman 1967).
Penyebaran cacing parasitik pada lambung banyak ditemukan pada bagian posterior hingga bagian tengah lambung dan pada usus cacing parasitik tersebar pada seluruh bagian usus (Gambar 9). Cacing parasitik famili Hemiuridae umumnya menginfeksi pada bagian anterior system pencernaan seperti lambung. Infeksi cacing parasitikGenarchopsis dasus(Digenea: Hemiuridae) padaChanna punctatusdi wilayah Mymensingh-India 72,8% terdapat pada lambung, 6,6% pada anterior usus, 9,0% pada pertengahan usus dan 11,6% pada posterior usus (Chandraet al.2011). Cacing parasitikdigeneaterakumulasi di dalam lambung dan akan berpindah ke usus bila sudah dewasa (Chowdhury 1992). Cacing parasitikdigeneaumumnya memiliki dua inang dalam melengkapi siklus hidupnya (Chandraet al.2011). Reproduksi seksual dari digenea akan menghasilkan telur-telur cacing yang akan keluar bersamaan dengan feses ikan dan hidup bebas di perairan hingga menemukan inang antara (Cribb et al.2003).
Semua digenea mempunyai alat penghisaporal(anterior) di sekitar mulut dan terdapat alat penghisapventraldi tengah atauposterior. Alat penghisap tersebut berfungsi sebagai alat penempel pada tubuh inang, bukan untuk menghisap makanan (Suwignyoet al.2005). Infeksi cacing parasitik dari kelompok Digenea hanya sedikit atau bahkan cenderung tidak menimbulkan kerusakan berat pada system pencernaan ikan (Kabata 1985; Blair 1977). Hal ini dikarenakan cacing parasitik Digenea berukuran kecil (dengan panjang sekitar 1-2 mm), bergerak dan tidak menimbulkan bekas luka, tidak menempel terlalu dalam pada tubuh inang (Chamberset al.2001). PadaAnisakissp. biasanya terdapat pada rongga tubuh ikan khususnya gonad dan hati (Strømnes dan Andersen 2003). Penelitian Baladin (2007), infeksi larva Anisakidae pada ikan kembung dari pelabuhan rakyat Muara Angke terdapat di organ pencernaan dan di sekitar rongga abdomen yaitu pada mesenterium dan permukaan organ viseral (47,6%), hati (29,8%), rongga abdomen (15,7%), dan usus (6,9%). Pada penelitian ini cacing parasitikAnisakis typicahanya ditemukan pada usus ikan
kembung, hal ini menunjukan bahwa ikan kembung hanya sebagai inang pembawa bagi cacing parasitikAnisakis typica.
Perbedaan jumlah cacing parasitik padaR. brachysomadanR. kanagurta
R. brachysoma dan R. kanagurtamerupakan ikan dari genus yang sama yaitu Rastrelliger. Secara ekologi kedua spesies hidup pada perairan pantai, namun daerah penyebaranR. kanagurtalebih oceanik. Perbedaan pola hidup ini tidak berpengaruh terhadap jumlah cacing parasitik yang terdapat dalam saluran pencernaannya.
Gambar 10. Nilai intensitas dan prevalensi cacing parasitik pada R. kanagurta dan R. brachysoma
R. brachysoma hidup pada perairan dekat pantai dengan kondisi lingkungan daerah penyebaran yang cenderung sama sehingga memberi kesempatan cacing parasitik L. angustonum untuk mendominasi dengan nilai intensitas yang tinggi sehingga hanya 1-2 spesies cacing parasitik saja yang terdapat di dalam tubuh inangnya (rata-rata 1,2 spesies/ikan).Ketika spesies cacing parasitik hidup bersama dalam satu organ maka mikrohabitat mereka dibatasi oleh keberadaan parasit lain sehingga mereka akan mengeluarkan feronom untuk berusaha mencegah parasit lain untuk
10,72
tinggal (Noble dan Noble 1982), sehingga dengan adanya cacing parasitik yang mendominasi maka keragaman jenis lainnya akan berkurang. Dalam hal ini, cacing L. angustonum diduga melakukan perkembangbiakan aseksual secara intensif sehingga ukuran tubuhnya lebih kecil jika dibandingkan dengan yang terdapat pada saluran pencernaanR. kanagurta.
Pada R. kanagurta yang penyebarannya lebih oceanik, cacing parasitik L. angustonum tidak memiliki kesempatan untuk mendominasi dan bahkan berkesempatan membawa cacing parasitik spesies lainnya dari daerah tertentu sehingga menyebabkan jenis cacing parasitiknya mencapai 2-3 spesies/ikan (rata-rata 1,6 spesies/ikan) (lihat Gambar 10).
Pengaruh jumlah parasit terhadap jenis kelamin dan perkembangan gonad Komposisi makanan, kebutuhan energy dan intensitas makan antara ikan jantan dan betina pada R. kanagurta tidak berbeda (Sivadas and Bhaskaran 2009; Ganga 2010), sehingga jenis kelamin tidak berpengaruh terhadap jumlah cacing parasitik yang ada di dalam tubuhnya.R. brachysomasedang dalam musim pemijahan sehingga nilai GSI berpengaruh terhadap jumlah cacing parasitik dalam tubuhnya. Ketika mendekati masa matang kelamin maka energi banyak digunakan untuk perkembangan gonad sehingga akan menurunkan intensitas makannya (Lambert and Dutil 1998).
Pengaruh pertumbuhan ikan terhadap jumlah parasit
Pertumbuhan merupakan proses biologis yang rumit, pada tingkat individu secara sederhana adalah pertambahan ukuran panjang atau bobot tubuh ikan selama waktu tertentu. Pada perairan tropis, makanan merupakan faktor pertumbuhan yang lebih penting daripada suhu perairan (Effendi 1979).
Pengaruh jumlah cacing parasitik terhadap pertumbuhan panjang ikan berdasarkan hasil uji distribusi frekuensi menunjukan bahwa dengan bertambahnya panjang atau umur ikan maka jumlah cacing parasitik yang ada dalam tubuhnya cenderung rendah lalu meningkat secara fluktuatif dan kemudian akan menurun secara berfluktuasi, sedangkan nilai prevalensinya cenderung stabil. Hal tersebut diatas berkaitan dengan perkembangan system imum dan juga kebiasaan makan. Madhavi dan Lakshmi (2012) juga menyatakan bahwa panjang tubuh R. kanagurta tidak berpengaruh nyata terhadap jumlah cacing parasitik namun cenderung menurun seiring dengan bertambahnya panjang ikan.
Noble dan Noble (1982) menyatakan bahwa pada beberapa spesies ikan, semakin meningkat umur ikan maka intensitas parasitnya cenderung semakin berkurang, hal ini karena system imun pada ikan semakin berkembang dengan baik seiring pertumbuhan tubuhnya. Namun semakin tua ikan maka nilai prevalensinya cenderung meningkat, hal ini karena semakin tua ikan berarti semakin lama waktu yang dimiliki ikan untuk kontak dengan parasit (Alifuddinet al. 2002).
menurunkan intensitas makannya (Lambert and Dutil 1998). Intensitas makan akan menurun pada ukuran ikan >23,1 cm yaitu pada proses penyesuaian diri pada penurunan pertumbuhan atau sudah mencapai ukuran maksimal (asymptotic age/length) (Yohannan 1979).
Gambar 11. Komposisi makanan pada berbagai kelompok umurR. kanagurta menurut Yohannan (1995)
Analisis perbedaan jumlah parasit pada Teluk Banten dan Pelabuhan Ratu Jumlah cacing parasitik pada ikan kembung yang berasal dari Teluk Banten dan Pelabuhan Ratu tidak berbeda. Hal ini karena kedua daerah tersebut masih dalam daerah geografis yang hampir sama, selain itu secara genetik ikan kembung terutama R. brachysomamasih merupakan satu stok populasi yang sama.
Ikan bersifat ektoterm atau poikiloterm yaitu hewan yang suhu tubuhnya bergantung pada suhu lingkungan tempat hidupnya atau biasa disebut juga dengan hewan berdarah dingin. Suhu dan pH perairan sangat berpengaruh terhadap pola sebaran cacing parasit pada ikan karena kedua faktor ini mempengaruhi kecepatan metabolisme dan respirasi organisme air sebagai inang parasit (Rohlenovaet al. 2011). Demikian pula halnya dengan sistem imun, penyembuhan penyakit dan pencernaan makanan sangat tergantung pada suhu dan pH tempat hidupnya.
Pada suhu perairan yang tinggi akan menyebabkan ikan membutuhkan energi yang lebih besar sehingga asupan makanan akan bertambah, bahan makanan dalam tubuh ikan tersebut lebih banyak dimanfaatkan oleh cacing parasitik untuk tumbuh dan berkembang dibandingkan untuk kebutuhan ikan itu sendiri (Johnson et al. 2010). Pertumbuhan parasit akan dapat meningkat dengan pesat walaupun hanya dengan adanya peningkatan suhu yang sedikit (Macnab dan Barber 2011).
Analisis Karakteristik Habitat
Habitat infeksi cacing parasitik terbagi menjadi mikrohabitat atau habitat dimana cacing parasitik tersebut hidup dan makrohabitat atau habitat tempat dimana inangnya hidup. Terdapat tiga komponen utama dalam terjadinya infeksi cacing parasitik, yaitu ikan, lingkungan dan cacing itu sendiri.
Menurut Untergasser (1989), faktor biotik yang mempengaruhi kehidupan cacing parasitik antara lain: keberadaan inang, umur dan ukuran panjang inang, kondisi inang, sifat patogenitas cacing parasitik. Faktor abiotik yang mempengaruhi kehidupan cacing parasitik antara lain: suhu, salinitas, oksigen, ammonia, pH, cahaya, kedalaman atau tekanan air, dan tingkat pencemaran. Interaksi antara cacing parasitik dengan faktor-faktor tersebut diatas telah dijelaskan sebelumnya. Interaksi tersebut dapat dilihat dalam Gambar 12.