RESPONS FISIOLOGI BENIH UDANG GALAH TERHADAP PENAMBAHAN GARAM YANG BERBEDA, MINYAK CENGKEH, ZEOLIT DAN KARBON AKTIF PADA TRANSPORTASI TERTUTUP
HUMAIRANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Respons Fisiologi Benih Udang Galah terhadap Penambahan Garam yang Berbeda, Minyak Cengkeh, Zeolit dan Karbon Aktif pada Transportasi Tertutup” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015
RINGKASAN
HUMAIRANI. Respons Fisiologi Benih Udang Galah terhadap Penambahan Garam yang Berbeda, Minyak Cengkeh, Zeolit dan Karbon Aktif pada Transportasi Tertutup. Dibimbing oleh EDDY SUPRIYONO dan KUKUH NIRMALA.
Udang galah merupakan spesies yang siklus hidupnya melalui lingkungan perairan payau atau bersifat euryhaline. Udang galah dewasa bermigrasi ke air payau untuk melakukan proses pemijahan. Udang galah hidup di air payau saat stadia telur hingga larva. Kemudian saat stadia juvenil sampai dewasa hidup di air tawar. Saat ini kegiatan pembenihan udang galah di Indonesia terkonsentrasi di pulau Jawa, sedangkan kegiatan pembesarannya tersebar di pulau Jawa, Sumatera dan Kalimantan. Karena adanya jarak antara tempat pembenihan dan pembesaran, maka transportasi benih udang galah dibutuhkan untuk menunjang kegiatan produksi.
Pengangkutan benih hidup jarak jauh umumnya menggunakan sistem tertutup. Akan tetapi masalah yang sering dihadapi oleh pembudidaya Indonesia dalam pengiriman benih udang galah adalah tingkat kelangsungan hidup yang rendah akibat udang stres dan perubahan kualitas air selama transportasi. Oleh karena itu dibutuhkan teknologi yang tepat sehingga dapat mengangkut udang dalam waktu yang lama, tingkat kelangsungan hidup yang tinggi, serta kondisi fisiologi udang pascatransportasi tetap baik. Penelitian ini bertujuan untuk menentukan pengaruh pemberian garam, minyak cengkeh, zeolit dan karbon aktif dalam mempertahankan kualitas air pada transportasi benih udang dengan kepadatan tinggi selama 24 jam. sehingga dapat menjaga agar tingkat kelangsungan hidup benih udang tetap tinggi hingga ke tempat tujuan.
Penelitian dilakukan selama lima bulan terhitung dari bulan Januari 2015 hingga Mei 2015 di Laboratorium Lingkungan Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Udang uji yang digunakan pada percobaan ini adalah benih udang galah dengan bobot 0,45±0,18 g yang diperoleh dari Balai Benih Air Tawar Sukabumi. Penelitian dilaksanakan melalui tiga tahap, yaitu penelitian pendahuluan, penelitian transportasi dan penelitian pemeliharaan pascatransportasi selama 30 hari. Pada penelitian pendahuluan dilakukan penentuan kemampuan udang puasa, tingkat konsumsi oksigen, laju eksresi amoniak, penentuan kapasitas zeolit dan karbon aktif dalam penyerapan TAN. Penelitian transportasi adalah tranportasi sistem tertutup selama 24 jam. Transportasi benih udang galah dengan kepadatan 100 ekor/L dengan setiap perlakuan ditambahkan 4,67 µL/L minyak cengkeh, 20 g zeolit, 10 g karbon aktif dan garam masing-masing perlakuan K+ (tanpa garam), 4,7 g garam/L, 9,4 g garam/L, 14,1 g garam/L, dan K- (tanpa garam, minyak cengkeh, zeolit dan karbon aktif). Pada saat transportasi benih udang galah selama 24 jam diamati tingkat kelangsungan hidup (TKH), kualitas air, fisiologi udang dan penentuan dosis optimum. Sedangkan penelitian pemeliharaan 30 hari pascatransportasi dilakukan pengamatan TKH, laju pertumbuhan harian (LPH), kualitas air dan fisiologi udang.
pemberokan menunjukkan pemberokan selama 48 jam memiliki laju ekskresi TAN sebesar 0,011±0,001 mgTAN/g/jam, TKO benih udang galah sebesar 0,96±0,1 mgO2/g/jam, TKH transportasi sebesar 88±2,0% dan TKH
pascatransportasi sebesar 83±4,2%.
Hasil penelitian utama menunjukkan pemberian 9,4 g garam/L, minyak cengkeh 4,67 µ L/L, zeolit 20 g dan karbon aktif 10 g dalam transportasi sistem tertutup selama 24 jam memberikan hasil terbaik. Sehingga dapat mengangkut benih udang dalam waktu yang lama, tingkat kelangsungan hidup yang tinggi, serta kondisi fisiologi udang pascatransportasi tetap baik. Pengamatan LPH pada akhir masa pemeliharaan pascatransportasi menunjukkan tidak terdapat perbedaan yang nyata antar perlakuan.
SUMMARY
HUMAIRANI. Physiologycal Responses of Juvenile Giant Prawn of Adding Different Salt, Clove Oil, Zeolit and Activated Carbon in Closed Transportation System. Supervised by EDDY SUPRIYONO and KUKUH NIRMALA
Giant prawns is shrimp species which has life cycle through the brackish water environments or euryhaline. The Mature prawns migrates into brackish water for spawning process. Giant prawns live in brackish water at the form of egg until reach larva stage. After that the juvenile stage live in freshwater until adult. Nowadays, giant prawn hatcheries in Indonesia are concentrated in Java, while the rearing activities focused in Java, Sumatra and Borneo. The distance that exist between the breeding and rearing place, there should be transporting juvenile giant prawn to support the production activity.
Transportation of juvenile in long distance usually used closed system. The problems that often faced by Indonesian fisher in juvenile giant prawns transportation is the low survival rate due to shrimp stress and changes in water quality during transport. Therefore, it needs proper technology that can transport the prawn for long time, high value of survival rate, and the physiology condition of prawn in post transport remains good. This study was to determine the effect of given salt, clove oil, zeolites and activated carbon for maintaining water quality in juvenile giant prawn transport with high density for during 24 hours. So that the juvenile giant prawn survival rate remains high and safely to the destination.
The study was conducted during five months from January 2015 to May 2015 at the Environment Aquaculture Laboratory, Department of Aquaculture, Faculty of Fisheries and Marine Sciences, Bogor Agricultural University. Shrimp samples that used in this experiments were juvenile giant prawn with initial weight of 0.45±0.18 g obtained from the Balai Benih Air Tawar Sukabumi. The research was conducted in three stages: a preliminary research, transportation and post-transport rearing for 30 days. The preliminary research conducted to determine the prawn fasting ability, level of oxygen consumption, ammonia excretion rate, zeolites capacity and activated carbon in the absorption of TAN. Meanwhile, the main research was transporting shrimp with closed system for 24 hours. The transportation of juvenile giant prawn use density of 100 individuals/L while each treatment was added with 4.67 µ L/L clove oil, 20 g of zeolite, 10 g of activated carbon and salt for each treatment where K+ (without salt), 4.7 g salt/L, 9.4 g salt/L, 14.1 g salt/L, and K- (without salt, clove oil, zeolites and activated carbon). While transporting juvenile giant prawn for 24 hours the parameters that observed such as survival rate, water quality, shrimp physiology and determination of the optimum dose. While in the rearing for 30 days of transportation, the parameters that observed such as post survival rate, specific growth rate, water quality and shrimp physiology.
Preliminary research results indicate the shrimp can survive for seven days without given feed. Shrimp that starving for 48 hours showed oxygen consumption rates at 0.96±0.1 mgO2/g/hour, TAN excretion rate of 0.011±0.001
mgTAN/g/hour, survival rate transportation at 88±2.0% and after transportation rearing period at 83±4.2%.
transportation for long time showed high survival rate and post transport physiology condition remains good. There was no significant difference in growth rate for all treatment at the end of the rearing period.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
RESPONS FISIOLOGI BENIH UDANG GALAH TERHADAP PENAMBAHAN GARAM YANG BERBEDA, MINYAK CENGKEH, ZEOLIT DAN KARBON AKTIF PADA TRANSPORTASI TERTUTUP
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
ii
iii
Judul Tesis : Respons Fisiologi Benih Udang Galah terhadap Penambahan Garam yang Berbeda, Minyak Cengkeh, Zeolit dan Karbon Aktif pada Transportasi Tertutup
Nama : Humairani
NIM : C151130531
Disetujui oleh
Komisi Pembimbing
Dr Ir Eddy Supriyono, MSc Ketua
Dr Ir Kukuh Nirmala, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
iv
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini bisa diselesaikan. Penelitian dilaksanakan sejak bulan Januari 2015 sampai dengan bulan Mei 2015 di Laboratorium Lingkungan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor, dengan judul “Respons Fisiologi Benih Udang Galah terhadap Penambahan Garam yang Berbeda, Minyak Cengkeh, Zeolit dan Karbon Aktif pada Transportasi Tertutup”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan ini, terutama kepada suamiku tercinta Rama Kurniawan, anakku tersayang Muhammad Azka Al-tharizz, ayahanda Nalhandani Yahdin dan ibunda Hartini atas doa dan kasih sayangnya. Bapak Dr Ir Eddy Supriyono, MSc dan Dr Ir Kukuh Nirmala, MSc selaku pembimbing yang telah memberikan pengarahan dan bimbingan selama penelitian dan penyusunan tesis. Penulis juga menyampaikan rasa terimakasih pada Prof Dr lr Daniel Djokosetiyanto, DEA sebagai penguji luar komisi dan Dr Ir Mia Setiawati, MSi
sebagai perwakilan dari Program Studi Ilmu Akuakultur yang memberikan saran dan semangat selama ujian tesis.
Terima kasih disampaikan pada Direktorat Jenderal Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPP-DN) tahun 2013 sehingga penulis dapat melanjutkan studi di Sekolah Pascasarjana, Institut Pertanian Bogor.
Penulis juga menyampaikan terima kasih pada Rudiansyah, Aisyah Lukmini, Wahyu dan Suhaiba yang ikut membantu selama penelitian, serta semua pihak yang telah membantu hingga penelitian selesai.
Penyusunan tesis ini masih jauh dari kesempurnaan, maka dari itu penyusun memohon saran yang berguna dan membangun untuk menyempurnakan penyusunannya. Penulis berharap semoga tesis ini bermanfaat.
Bogor, Desember 2015
v
DAFTAR ISI
DAFTAR ISI v
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
METODE PENELITIAN 3
Waktu dan Tempat Penelitian 3
Udang Uji 3
Rancangan Penelitian 3
Penelitian Pendahuluan 4
Penelitian Transportasi 5
Penelitian Pascatransportasi 5
Parameter yang Diamati 5
Analisa Data 7
HASIL DAN PEMBAHASAN 8
Penelitian Pendahuluan 8
Penelitian Transportasi 10
Penelitian Pascatransportasi 13
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 20
RIWAYAT HIDUP 32
LAMPIRAN 13
vi
DAFTAR TABEL
1. Tingkat kelangsungan hidup (TKH) benih udang galah selama
pengujian kemampuan puasa 8
2. Ekskresi TAN benih udang galah setiap 12 jam 9
3. Parameter kualitas air selama pemeliharaan pascatransportasi benih
udang galah 18
DAFTAR GAMBAR
1. Kondisi (a) oksigen terlarut dan (b) TKO benih udang galah 9 2. Kadar amoniak media yang diberikan (a) zeolit dan (b) karbon aktif
terhadap amoniak setiap menit 10
3. Parameter kualitas air selama transportasi benih udang galah (a) oksigen terlarut; (b) suhu; (c) konsentrasi NH3; (d) konsentrasi CO2 11
4. Tingkat kelangsungan hidup benih udang galah saat transportasi. 12 5. Gradien osmotik benih udang galah dari semua perlakuan
pascatransportasi. 14
6. Respons glukosa hemolymph benih udang galah dari semua perlakuan
pascatransportasi. 15
7. Jaringan insang benih udang galah pada awal pemeliharaan
pascatransportasi. (H) hiperplasia. 16
8. Jaringan insang benih udang galah pada akhir pemeliharaan
pascatransportasi. (H) hiperplasia 17
9. Laju pertumbuhan harian benih udang galah saat pemeliharaan 30 hari
pascatransportasi. 19
10. Tingkat kelangsungan hidup benih udang galah pemeliharaan
pascatransportasi. 20
DAFTAR LAMPIRAN
1. Prosedur histologi 23
2. Hasil analisis ragam TKH benih udang galah 24
3. Hasil analisis ragam LPH benih udang galah 27
PENDAHULUAN
Latar Belakang
Udang galah (Macrobrachium rosenbergii) merupakan salah satu komoditas perikanan yang bernilai ekonomis tinggi baik untuk konsumsi dalam negeri maupun ekspor. Permintaan pasarnya pun semakin meningkat, sedangkan penangkapan udang galah di alam semakin sulit. Sehingga perlu dikembangkan usaha pembudidayaannya. Untuk memenuhi kebutuhan tersebut diperlukan ketersediaan benih dalam jumlah yang cukup dan kualitas yang baik. Salah satu upaya yang dapat dilakukan adalah dengan melakukan kegiatan pembenihan. Udang galah merupakan spesies yang siklus hidupnya melalui lingkungan perairan payau dan bersifat euryhaline (Himawan & Khasani 2010). Udang galah hidup di air payau saat stadia telur hingga larva. Kemudian saat stadia juvenil sampai dewasa hidup di air tawar. Saat ini kegiatan pembenihan udang galah di Indonesia terkonsentrasi di Pulau Jawa, sedangkan kegiatan pembesarannya tersebar di Pulau Jawa, Sumatera dan Kalimantan. Karena adanya jarak antara tempat pembenihan dan pembesaran, maka transportasi benih udang galah dibutuhkan untuk menunjang kegiatan produksi.
Permasalahan yang sering dihadapi oleh pembudidaya udang dalam pengiriman benih udang galah adalah tingkat kelangsungan hidup yang rendah akibat udang stres dan perubahan kualitas air selama transportasi, seperti oksigen dalam media air yang menurundan peningkatan total amoniak nitrogen (TAN) (Anandasari et al. 2015). Berdasarkan permasalahan tersebut, maka diperlukan penelitian untuk mempertahankan kualitas air selama transportasi dan meminimalir stres, sehingga dapat meningkatkan tingkat kelangsungan hidup. Oleh karena itu diperlukan teknologi yang sesuai dan tepat dengan tuntutan komoditi dan kondisi wilayah menggunakan sumberdaya lokal dan perbaikan teknologi (Suparno et al. 1994). Karena tingkat stres udang yang tinggi dan kondisi media air transportasi yang menurun, maka dibutuhkan penambahan bahan penenang dan bahan yang dapat menstabilkan kondisi kualitas air selama transportasi (Charoendat et al. 2009). Oleh karena itu dalam penelitian ini digunakan garam, minyak cengkeh, zeolit dan karbon aktif. Garam ditambahkan untuk menurunkan ketidakseimbangan tekanan osmotik yang disebabkan perbedaan konsentrasi antara air dan cairan tubuh udang (Swann 1993). Minyak cengkeh mengandung bahan aktif eugenol yang dapat memperlambat laju metabolisme (Inoue et al. 2005), sehingga akan menurunkan tingkat keaktifan udang yang akhirnya dapat menurunkan laju metabolisme udang. Pemberian zeolit dan karbon aktif untuk menyerap amoniak dan melakukan penukaran ion (Zhang & Perschbarcher 2003).
2
karena transportasi udang terutama untuk benih udang biasanya dilakukan dengan menggunakan kepadatan yang tinggi.
Penelitian tentang transportasi ikan baik ikan konsumsi atau ikan hias sudah sering dilakukan, akan tetapi penelitian tentang transportasi benih udang galah belum banyak dilakukan. Penelitian ini didasarkan pada penelitian sebelumnya yaitu transportasi benih udang galah dengan bobot 0,40±0,02 g/ekor dengan lama transportasi 24 jam dengan dosis 20 g zeolit, 10 g karbon aktif dan 4,67 µ L/L minyak cengkeh dengan kepadatan benih udang galah 100 ekor/L menghasilkan tingkat kelangsungan hidup 73% (Anandasari et al. 2015). Hamzah (2004) melakukan penelitan pertumbuhan juvenil udang galah dengan salinitas media terbaik yaitu 3,39-4,52 g garam/L. Oleh karena itu perlu diteliti lebih lanjut untuk transportasi benih udang galah dengan memberikan material tambahan seperti garam pada media yang telah diberi minyak cengkeh, zeolit dan karbon. Diharapkan material ini dapat memperbaiki dan mempertahankan kualitas air selama proses transportasi. Sehingga dapat meningkatkan efisiensi transportasi dan meminimalisir tingkat kematian udang.
Rumusan Masalah
Pengangkutan benih hidup jarak jauh umumnya menggunakan sistem tertutup. Akan tetapi masalah yang dihadapi dalam transportasi sistem tertutup benih udang galah yaitu kualitas air yang memburuk dan tingginya kematian benih. Permasalahan ini dapat diatasi dengan beberapa cara, diantaranya dengan penambahan oksigen murni pada kantung pengepakan dengan memperhatikan tingkat konsumsi oksigen udang yang akan diangkut, penambahan es batu ke dalam kotak pengangkutan sebagai penstabil suhu, pemberian garam untuk menurunkan ketidakseimbangan tekanan osmotik yang disebabkan perbedaan konsentrasi mineral antara air dan cairan tubuh udang, pemberian minyak cengkeh untuk mengurangi tingkat stress pada udang yang dapat digunakan sebagai penenang, sehingga akan menurunkan tingkat keaktifan udang yang akhirnya dapat menurunkan laju metabolisme udang, dan pemberian zeolit dan karbon aktif untuk menyerap amoniak dan melakukan penukaran ion.
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan efektifitas penambahan garam pada media yang telah diberi minyak cengkeh, zeolit dan karbon aktif dalam mempertahankan kualitas air pada pengangkutan tertutup sehingga dapat meminimalisir stres dan tingkat kematian benih udang galah yang diangkut selama 24 jam dan pertumbuhan pascatransportasi.
Hipotesis
3
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari 2015 sampai Mei 2015. Tempat packing, pemeliharaan benih pascatransportasi dan uji kualitas air dilakukan di Laboratorium Lingkungan, Departemen Budidaya Perairan (BDP), Fakultas Perikanan dan Ilmu Kelautan (FPIK), Institut Pertanian Bogor (IPB). Uji fisiologi udang dilakukan di Laboratorium Fisiologi Fakultas Kedokteran Hewan (FKH) IPB, Uji osmolaritas di Laboratorium Embriologi FKH IPB, Uji histologi dilakukan di Laboratorium Kesehatan Ikan FPIK IPB.
Udang Uji
Udang uji yang digunakan pada percobaan ini adalah benih udang galah dengan bobot rata-rata 0,45±0,18 g yang diperoleh dari Balai Pengembangan Budidaya Air Tawar Sukamandi. Benih udang galah dipelihara terlebih dahulu agar dapat mengurangi stres pascatransportasi dari balai. Sebelum benih diuji dilakukan pemuasaan selama 24 jam agar dapat mengurangi konsentrasi amoniak pada saat percobaan.
Rancangan Penelitian
Penelitian ini terdiri dari tiga tahap, yaitu penelitian pendahuluan dan penelitian transportasi udang dan pemeliharaan pascatransportasi selama 30 hari. Pada penelitian pendahuluan dilakukan penentuan kemampuan puasa udang, tingkat konsumsi oksigen, laju eksresi amoniak, penentuan kapasitas zeolit dan karbon aktif dalam penyerapan TAN. Pada saat transportasi benih udang galah selama 24 jam diamati tingkat kelangsungan hidup (TKH), kualitas air dan penentuan dosis optimum. Sedangkan pemeliharaan pascatransportasi dilakukan pengamatan TKH, laju pertumbuhan harian (LPH), kualitas air dan fisiologi udang.
Rancangan percobaan yang digunakan pada penelitian ini adalah Rancangan Acak Lengkap (RAL), setiap perlakuan dilakukan pengulangan sebanyak 3 kali. Perlakuan yang diujikan yaitu penambahan garam pada media yang telah diberi minyak cengkeh, zeolit dan karbon aktif. Zeolit yang digunakan pada penelitian ini berukuran -40/+60 mesh. Ukuran karbon aktif yang digunakan untuk penelitian ini adalah -40/+60 mesh. Zeolit dan karbon aktif telah diaktivasi menggunakan NaOH 1% (Ghozali 2010). Minyak cengkeh yang digunakan adalah minyak cengkeh komersil dengan kandungan eugenol 40,09%. Garam yang digunakan adalah garam krosok. Dosis garam yang digunakan diperoleh dari LC50
24 jam (18,8 g garam) dikalikan 0%, 25%, 50% dan 75%. Perlakuan yang digunakan dalam penelitian ini adalah perlakuan tanpa bahan tambahan (K-), perlakuan yang telah ditambahkan 4,67 µL minyak cengkeh/L, 20 g zeolit dan 10 g karbon aktif dengan penambahan garam 0% (K+), 25% (4,7 g garam/L), 50% (9,4 g garam/L) dan 75% (14,1 g garam /L).
4
Penelitian Pendahuluan
Prosedur Kemampuan Puasa Udang
Penentuan puasa udang dilakukan dengan tujuan mengetahui tingkat kelangsungan hidup benih udang galah tanpa diberi pakan. Hal ini berguna pada saat pengangkutan dilakukan, apabila terjadi kematiaan bukan karena kelaparan. Penentuan puasa udang dilakukan dengan cara menyiapkan 3 buah akuarium berukuran 50x40x40 cm yang telah dibersihkan dan dikeringkan selama 1 hari kemudian diisi air dengan tinggi air 30 cm yang diaerasi selama 2 hari, lalu dimasukkan udang uji sebanyak 20 ekor/akuarium. Pergantian air sebanyak 5-20% dilakukan setiap hari, kemudian mengamati dan mencacat tingkah laku benih udang uji setiap hari. Selama pemuasan dilakukan pengamatan kualitas air yaitu suhu, pH dan Dissolved Oxygen (DO).
Prosedur Tingkat Konsumsi Oksigen
Pengukuran tingkat konsumsi oksigen (TKO) dilakukan dengan pengukuran bobot benih udang galah. Benih udang galah dimasukkan ke dalam toples 3 L yang sebelumnya telah diisi air hingga penuh, kemudian toples ditutup rapat. Benih udang galah dengan bobot rata-rata 0,45±0,18 g dimasukkan sebanyak 6 ekor. Pengujian dilakukan dengan tiga ulangan. Jumlah oksigen terlarut dalam toples diukur setiap satu jam selama 6 jam menggunakan DO meter. Tingkat konsumsi oksigen dihitung dengan menggunakan rumus Liao & Huang (1975).
TKO = {(DOawal – DOakhir)/W x t} x V Keterangan :
TKO = Tingkat konsumsi oksigen (mg O2/g tubuh/jam)
DO awal = Oksigen terlarut pada awal pengamatan (mg/L) DO akhir = Oksigen terlarut pada akhir pengamatan (mg/L)
W = Berat udang uji (g)
t = Periode pengamatan (jam)
V = Volume air (L)
Prosedur Laju Eksresi Amoniak
Penentuan laju eksresi amoniak udang bertujuan untuk menghitung jumlah amoniak yang dieksresikan udang tiap satuan waktu, sehingga dapat diketahui jumlah akumulasi amoniak pada waktu tertentu. Percobaan ini dilakukan dengan menyiapkan 3 toples bervolume 3 liter yang telah dibersihkan dan dikeringkan selama 2 hari, kemudian diisi air hingga penuh. Benih udang galah dengan ukuran bobot rata-rata 0,45±0,18 g dimasukkan ke dalam wadah masing-masing 6 ekor/toples. Kemudian dilakukan pengambilan sampel air sebanyak 30 ml setiap 12 jam selama 48 jam untuk mengukur suhu, pH, dan konsentrasi amoniak (NH3).
Prosedur Kapasitas Serap Zeolit dan Karbon Aktif terhadap Amoniak
Pengukuran kemampuan serap zeolit dan karbon aktif pada NH3 dapat
5
dengan zeolit dan karbon aktif masing-masing sebanyak 20 gram. Larutan TAN dengan konsentrasi 10 mg/L dialirkan ke dalam botol yang berisi karbon aktif dan zeolit. Pengambilan sampel air sebanyak 30 ml dilakukan pada setiap menit selama 8 menit, kemudian dilakukan pengukuran TAN, nilai pH, dan suhu pengujian ini dilakukan masing-masing 3 ulangan.
Penelitian Transportasi
Penentuan Dosis Optimum pada Pengangkutan Tertutup Benih UdangGalah
Benih udang galah dengan bobot rata-rata 0,45±0,18 g dipuasakan selama 1 hari, kemudian disiapkan 30 lembar kantong plastik dan karet pengikat, salah satu ujung plastik dipasang keran untuk mengambil sampel air dan ujung yang lain dipasang kemasan zeolit dan karbon aktif. Selanjutnya kantong plastik diisi dengan air masing-masing 1,5 L, kemudian setiap perlakuan ditambahkan minyak cengkeh dan garam sesuai dosis, benih udang galah dengan bobot rata-rata 0,45±0,18 g dimasukkan ke dalam kantong plastik dengan kepadatan 100 ekor/L. Setiap kantong diisi oksigen dengan perbandingan 1:3 dan diikat dengan karet gelang dan dimasukkan ke dalam kotak styrofoam. Selanjutnya dimasukkan es batu ke dalam kotak styrofoam agar suhu stabil sekitar 20oC , kemudian ditutup.
Proses transportasi dilakukan secara simulasi di laboratorium, yaitu disimpan di kotak styrofoam yang diguncangkan di atas permukaan air. TKH dan uji kualitas air diamati setiap 4 jam.
Penelitian Pascatransportasi
Pemeliharaan Benih Udang Galah Pascatransportasi
Pemeliharaan benih udang galah dilakukan selama 30 hari setelah packing dibongkar. Benih udang galah dipelihara sebanyak 50 ekor di dalam akuarium dengan dimensi 75x50x40 cm yang telah dicuci dan dikeringkan selama 3 hari. Sumber air yang digunakan yaitu berasal dari air tandon laboratorium lingkungan dan diberi perlakuan dengan menggunakan filter fisik melalui sistem pengendapan. Akuarium diisi air dengan ketinggian 30 cm dan diaerasi.
Benih udang galah dipelihara dengan pemberian pakan berupa pelet at satiation. Kelangsungan hidup udang selama pemeliharaan diamati setiap hari dengan mengamati kondisi udang sedangkan uji kualitas air dan fisiologi udang dilakukan pada hari ke-0, hari ke-1 dan setiap 10 hari sampai akhir pemeliharaan. Pengukuran laju pertumbuhan harian dilakukan setiap 10 hari sampai akhir pemeliharaan.
Parameter yang Diamati
Pengukuran gradien osmotik dilakukan pada udang normal, pascatransportasi (0 dan 3 jam) dan akhir pemeliharaan (30 hari). Konsentrasi glukosa dilakukan pada udang normal, pascatransportasi (0 dan 24 jam), kemudian dilakukan setiap 10 hari sampai akhir pemeliharaan. Histologi insang udang galah dilakukan pada udang normal, pascatransportasi (0 jam) dan akhir pemeliharaan (30 hari). TKH dan uji kualitas air diamati saat transportasi (setiap 4 jam) dan pemeliharaan (hari ke-0, ke-1 dan setiap 10 hari). Pertumbuhan bobot harian pada saat pemeliharaan dilakukan setiap 10 hari.
6
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup (TKH) adalah perbandingan jumlah udang yang hidup dihitung (Nt) dan jumlah udang pada awal tebar dicatat. Perhitungan TKH digunakan rumus dari Huisman (1987):
100
TKH = Tingkat kelangsungan hidup (%) Nt = Jumlah udang akhir (ekor) N0 = Jumlah udang awal (ekor)
Laju Pertumbuhan Harian Bobot Harian
Laju pertumbuhan bobot harian ditentukan berdasarkan selisih bobot rata-rata akhir (Wt) dengan bobot rata-rata-rata-rata awal (W0) pemeliharaan kemudian dibandingkan dengan waktu pemeliharaan (t) dengan rumus dari Huisman (1987):
100
LPH = Laju pertumbuhan harian (%)
Wt = Berat rata-rata pada akhir pemeliharaan (g) W0 = Berat rata-rata pada awal pemeliharaan (g) t = Periode penelitian (hari)
Parameter Kualitas Air
Pengukuran suhu pada media air menggunakan termometer air raksa (Hg) dengan satuan °C. Oksigen terlarut adalah jumlah mg/L gas oksigen yang terlarut dalam air. Kadar oksigen dalam air dapat ditentukan dengan menggunakan DO-meter. Nilai pH di lingkungan dipengaruhi oleh kadar CO2 terlarut dan alkalinitas.
Alat yang digunakan adalah pH-meter dengan metode membran elektro.
Amoniak bebas tak terionisasi bersifat toksik terhadap organisme akuatik. Metode yang digunakan dalam pengukuran amoniak adalah metode Indophenol. Nilai TAN yang terukur bergantung pada nilai pH dan suhu pada saat pengukuran. Pengukuran dilakukan dengan metode titrasi. Alkalinitas adalah gambaran kapasitas air untuk menetralkan asam (Effendi 2003). Pengukuran alkalinitas menggunakan metode acidimetric.
Gradien Osmotik (GO)
Data gradien osmotik didapatkan dengan cara mengukur osmolaritas media dan plasma hemolymph. Gradien osmotik dihitung berdasarkan formula yang digunakan oleh Anggoro (1992):
7 Konsentrasi Glukosa
Konsentrasi glukosa diukur dengan metode Wedemeyer & Yasutake (1977). Sampel hemolymph disentrifuse selama 10 menit dengan kecepatan putaran 1000 rpm untuk memisahkan plasma hemolymph. Selanjutnya plasma hemolymph sebanyak 0,5 µ L ditambahkan ke dalam 3,5 mL reagen warna ortho-toluidin dalam asam asetat glasial. Campuran tersebut dimasukkan dalam air mendidih selama 10 menit. Setelah didinginkan dalam suhu ruang, konsentrasi glukosa hemolymph diukur dengan spektrofotometer pada panjang gelombang 635 nm. Selanjutnya nilai absorbansinya dikonversi menjadi kadar glukosa hemolymph dalam mg/100 mL. Kadar glukosa hemolymph dihitung berdasarkan persamaan yang dikemukakan oleh Wedemeyer & Yasutake (1977) yaitu:
xGSt AbsSt
AbsSp
GD
Keterangan:
GD = Konsentrasi glukosa hemolymph (mg/dL) AbsSp = Absorbansi sampel
AbsSt = Absorbansi standar
GSt = Konsentrasi glukosa standar (mg/dL)
Histologi
Histologi adalah ilmu yang mempelajari anatomi secara mikroskopis yaitu dengan menggunakan mikroskopis untuk mengamatinya. Histologi juga mempelajari suatu organ atau bagian tubuh ikan secara cermat, terinci hingga ke selnya. Insang merupakan organ respirasi pada ikan. Organ ini mempunyai peranan yang sangat penting karena berfungsi untuk mengambil oksigen dari perairan. Tetapi organ ini juga merupakan bagian tubuh yang sangat rentan terhadap berbagai macam gangguan, baik parasit, mikroorganisme patogen maupun perubahan lingkungan karena insang ini langsung bersentuhan dengan air. Prosedur histologi dapat dilihat di lampiran 1.
Analisa Data
8
HASIL DAN PEMBAHASAN
Penelitian Pendahuluan
Hasil penelitian pendahuluan terdiri dari pengujian kemampuan puasa benih udang galah, tingkat konsumsi oksigen benih udang galah, laju ekskresi TAN benih udang galah dan kapasitas serap zeolit dan karbon aktif terhadap amoniak.
Kemampuan Puasa Udang Galah
Hasil pengamatan kemampuan puasa menunjukkan benih udang galah dapat bertahan hidup tanpa diberi pakan hingga akhir pengujian selama 7 hari (Tabel 1). Nilai kualitas air media pemeliharaan dalam kisaraan baik untuk pemeliharaan udang galah. Benih udang galah masih berenang aktif sampai hari ke-7. Nilai TKH pada akhir pengujian sebesar 98,3%. Sehingga apabila terjadi kematiaan pada saat tranportasi selama 24 jam, maka bukan karena udang kelaparan
.
Tabel 1. Tingkat kelangsungan hidup (TKH) benih udang galah selama pengujian kemampuan puasa
Tingkat Konsumsi Oksigen Benih Udang Galah
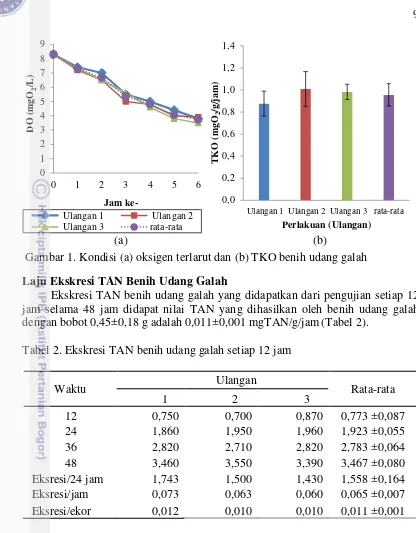
Tingkat Konsumsi Oksigen (TKO) merupakan kemampuan satu individu dalam menyerap oksigen untuk mendukung proses kehidupannya. Hasil penelitian ini menyatakan bahwa terjadi penurunan oksigen terlarut dari 8,3±0 mgO2/L pada
awal perlakuan menjadi 3,73±0,21 mgO2/L pada jam ke-6 (Gambar 1a). Nilai
9
(a) (b)
Gambar 1. Kondisi (a) oksigen terlarut dan (b) TKO benih udang galah
Laju Ekskresi TAN Benih Udang Galah
Ekskresi TAN benih udang galah yang didapatkan dari pengujian setiap 12 jam selama 48 jam didapat nilai TAN yang dihasilkan oleh benih udang galah dengan bobot 0,45±0,18 g adalah 0,011±0,001 mgTAN/g/jam(Tabel 2).
Tabel 2. Ekskresi TAN benih udang galah setiap 12 jam
Waktu Ulangan Rata-rata
1 2 3
Kapasitas Serap Zeolit dan Karbon Aktif terhadap Amoniak
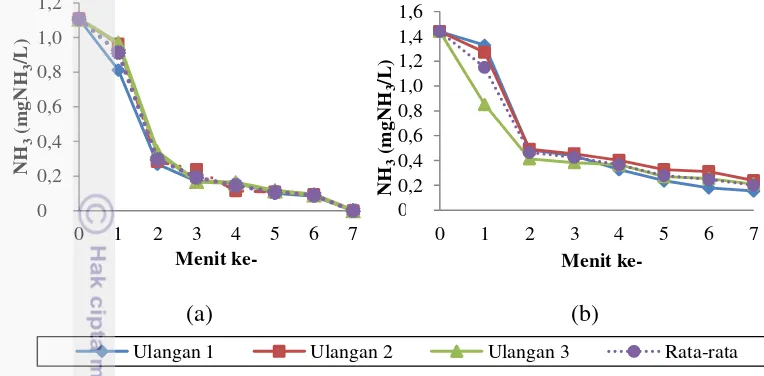
Kapasitas serap zeolit dan karbon aktif terhadap amonia menurun setiap menitnya. Hasil penelitian ini menyatakan bahwa zeolit dapat menurunkan amonia dari 1,107±0 mgNH3/L pada awal perlakuan menjadi 0 mgNH3/L pada
menit ke-7 (Gambar 2a). Berdasarkan data tersebut, zeolit dapat menyerap amoniak sebesar 1,107 mgNH3/L. Sedangkan karbon aktif dapat menurunkan
amonia dari 1,439±0 mgNH3/L pada awal perlakuan menjadi 0,201±0,04
mgNH3/L (Gambar 2b). Berdasarkan data tersebut, karbon aktif pada menit ke-7
dapat menyerap amoniak sebesar 1,231±0 mgNH3/L. Menurut Supriyono et al.
(2007) bahwa salah satu cara untuk mengurangi konsentrasi amoniak adalah menggunakan zeolit dan karbon aktif, karena material ini mampu mengadsorbsi sejumlah amoniak dalam waktu tertentu. Dalam waktu satu jam zeolit berukuran
-0
Ulangan 1 Ulangan 2 Ulangan 3 rata-rata
10
Ulangan 1 Ulangan 2 Ulangan 3 Rata-rata
40/60 mesh dengan berat 10 gram mampu menurunkan kandungan amonia sampai 1,2 mgNH3/L.
(a) (b)
Gambar 2. Kadar amoniak media yang diberikan (a) zeolit dan (b) karbon aktif terhadap amoniak setiap menit
Penelitian Transportasi
Hasil penelitian saat transportasi terdiri dari perubahan parameter kualitas air saat transportasi dan TKH transportasi.
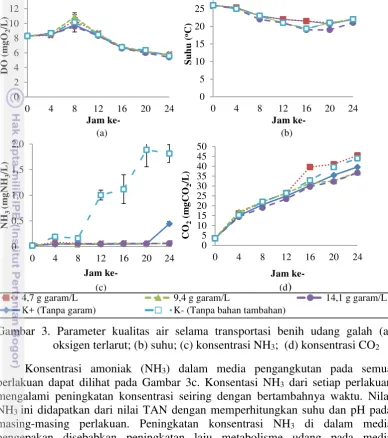
Parameter Kualitas Air Transportasi
Pengamatan parameter kualitas air menunjukkan transportasi menyebabkan perubahan kualitas air (Gambar 3). Konsentrasi oksigen terlarut pada Gambar 4a menunjukkan DO semakin menurun seiring bertambahnya waktu, akan tetapi pada jam ke-8 terjadi kenaikan DO. Hal ini dikarenakan kerasnya goncangan yang mengakibatkan terjadinya difusi oksigen antara air dan udara di dalam packing. Konsentrasi DO Pada jam ke-24 tidak memiliki perbedaan yang signifikan antara perlakuan, hal ini dapat dilihat pada Gambar 3a bahwa perlakuan 4,7 g garam/L memiliki konsentrasi DO tertinggi sebesar 5,8±0,15 mgO2/L, diikuti oleh
perlakuan K+ dan 9,4 g garam/L sebesar 5,7±0,1 mgO2/L, perlakuan K- sebesar
5,6±0,15 mgO2/L, sedangkan konsentrasi DO terkecil terdapat pada perlakuan
14,1 g garam/L sebesar 5,4±0,1 mgO2/L. Konsentrasi DO yang terlalu rendah
menimbulkan pengaruh yang buruk terhadap kesehatan ikan seperti anoreksia, stres pernafasan, hipoksia jaringan, ketidaksadaran, bahkan kematian (Wedemeyer 1996).
11
satu jam, sedangkan selama proses pengangkutan fluktuasi suhu hanya sebesar 1-2oC selama 4 jam.
(a) (b)
(c) (d)
Gambar 3. Parameter kualitas air selama transportasi benih udang galah (a) oksigen terlarut; (b) suhu; (c) konsentrasi NH3; (d) konsentrasi CO2
Konsentrasi amoniak (NH3) dalam media pengangkutan pada semua
perlakuan dapat dilihat pada Gambar 3c. Konsentasi NH3 dari setiap perlakuan
mengalami peningkatan konsentrasi seiring dengan bertambahnya waktu. Nilai NH3 ini didapatkan dari nilai TAN dengan memperhitungkan suhu dan pH pada
masing-masing perlakuan. Peningkatan konsentrasi NH3 di dalam media
pengepakan disebabkan peningkatan laju metabolisme udang pada media pengepakan. Hal ini dikarenakan laju metabolisme di dalam wadah pengepakan meningkat tiga kali lipat dari metabolisme rutin (Frose 1985). Konsentrasi NH3
terendah pada jam ke-24 terdapat pada perlakuan 9,4 g garam/L sebesar 0,061±0,005 mgNH3/L, diikuti oleh perlakuan 4,7 g garam/L sebesar 0,062±0,003
mgNH3/L, perlakuan 14,1 g garam/L sebesar 0,064±0,003 mgNH3/L, perlakuan
K+ sebesar 0,446±0,044 mgNH3/L dan perlakuan K- memiliki konsentrasi NH3
tertinggi yaitu sebesar 1,815±0,173 mgNH3/L. Perbedaan konsentrasi NH3 pada
setiap perlakuan disebabkan oleh pengaruh garam, zeolit dan karbon aktif yang diberikan, perlakuan K+ yang tidak diberikan garam memiliki nilai NH3 yang
cukup tinggi dan perlakuan K- yang tidak diberikan garam, zeolit dan karbon aktif memiliki nilai NH3 yang sangat tinggi. Salah satu cara untuk mengurangi
konsentrasi amoniak adalah menggunakan zeolit dan karbon aktif, di mana zeolit
0
12
dan karbon aktif ini mampu mengadsorbsi sejumlah amoniak dalam waktu tertentu (Supriyono et al. 2007). Selama satu jam zeolit berukuran -40/60 mesh dengan berat 10 g mampu menurunkan kandungan amoniak sampai 1,2 mgNH3/L.
Sedangkan garam dapat menurunkan gradien osmotic, karena udang dapat menyerap sejumlah garam dan melepaskan garam tersebut ke aliran darah. Udang memiliki pompa ion di bagian ginjal yang akan menangkap garam dari air serta melepaskan amonia dan hasil buangan lainnya (Lantu 2010).
Konsentrasi CO2 dalam media air pengangkutan terus mengalami
peningkatan dari jam ke-0 hingga jam ke-24. Pada jam ke-24 konsentrasi CO2
tertinggi terdapat pada perlakuan 4,7 g garam/L sebesar 45,57±0,07 mgCO2/L,
kemudian diikuti perlakuan K- sebesar 44±0,05 mgCO2/L, perlakuan K+ sebesar
39,6±0 mgCO2/L, perlakuan 9,4 g garam/L sebesar 36,67±0,02 mgCO2/L dan
konsentrasi CO2 terendah terdapat pada perlakuan 14,1 g garam/L sebesar
36,67±0,02 mgCO2/L (Gambar 3d). Hal ini disebabkan pada saat udang berada
pada media pengepakan, udang masih melakukan aktivitas untuk bergerak sehingga oksigen yang ada pada media pengepakan digunakan oleh udang (Supriyono et al. 2010). Menurut Boyd (2012), udang dapat merasakan perbedaan kecil konsentrasi CO2 dan mencoba untuk menghindari daerah memiliki
konsentrasi CO2 tinggi.
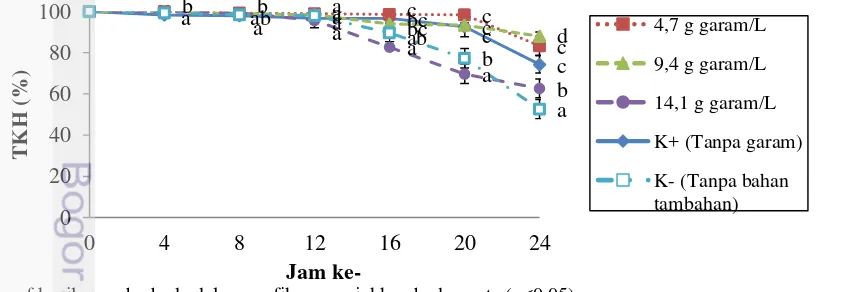
Tingkat Kelangsungan Hidup (TKH) Transportasi
Tingkat kelangsungan hidup saat transportasi dapat dilihat pada Gambar 4, pada jam ke-4 terdapat kematian pada perlakuan K+ dan K-, sedangkan perlakuan dengan pemberian garam tidak terdapat kematian. Pengamatan pada jam ke-16 sampai jam ke-24 sudah mulai terjadi kematian yang tinggi pada setiap perlakuan. Perlakuan 9,4 g garam/L pada jam ke-24 memiliki TKH tertinggi dibandingkan dengan TKH perlakuan lainnya yaitu sebesar 88±2%, sedangkan TKH terendah terdapat pada perlakuan K- sebesar 52,67±4,62%. Berdasarkan penelitian Anandasari et al. (2015), bahwa transportasi benih udang galah dengan kepadatan 100 ekor/L selama 24 jam dengan tanpa diberikan bahan tambahan memiliki TKH sebesar 41%, sedangkan setelah diberikan bahan tambahan 4,67 µ L/L minyak cengkeh, 20 g zeolit dan 10 g karbon aktif memiliki TKH sebesar 73%. Penambahan bahan tambahan yang optimum pada saat transportasi dapat memberikan TKH yang lebih tinggi.
Gambar 4. Tingkat kelangsungan hidup benih udang galah saat transportasi.
a a a bc c
13
Kematian benih udang pada media air transportasi diakibatkan karena tingginya konsentrasi NH3 dan CO2. Perlakuan K- memiliki TKH yang rendah
dibandingakan dengan perlakuan lainnya. Hal ini dikarenakan perlakuan K- memiliki konsentrasi amoniak yang tinggi yaitu 1,815±0,173 mgNH3/L. Menurut
Boyd & Zimmermann (2000), konsentrasi amoniak yang baik untuk udang galah yaitu kurang dari 0,5 mgNH3/L. Konsentrasi amoniak yang tinggi dapat
menurunkan kapasitas hemolymph untuk membawa oksigen sehingga jaringan akan kekurangan oksigen yang dapat mengakibatkan kematian pada benih udang.
Penelitian Pascatransportasi
Hasil dari penelitian pascatransportasi selama 30 hari terdiri dari gradien osmotik, konsentrasi glukosa, histologi, kualitas air, TKH dan LPH.
Gradien Osmotik (GO)
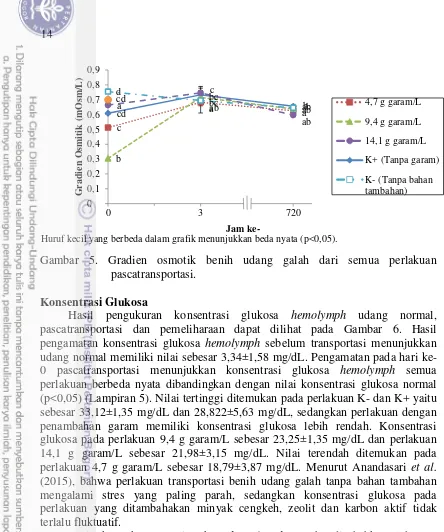
Gradien osmotik merupakan selisih dari osmolaritas media dan plasma hemolymph. Hasil pengukuran gradien osmotik (GO) udang normal, pascatransportasi dan pemeliharaan dapat dilihat pada Gambar 5. Hasil pengukuran GO sebelum transportasi menunjukkan udang normal memiliki nilai GO sebesar 0,7±0,007 mOsm/L. Pengamatan pada jam ke-0 pascatransportasi menunjukkan beberapa GO perlakuan mengalami penurunan yang berbeda nyata dibandingkan dengan GO normal (Lampiran 4). Nilai GO tertinggi ditemukan pada perlakuan K- sebesar 0,754±0,004, sedangkan perlakuan 14,1 g garam/L memiliki nilai GO terendah sebesar 0,304±0,023 mOsm/L, diikuti perlakuan 9,4 g garam/L dengan nilai GO sebesar 0,511±0,023 mOsm/L, perlakuan 4,7 g garam/L dengan nilai GO sebesar 0,609±0,004 mOsm/L dan perlakuan K+ dengan nilai GO sebesar 0,664±0,004 mOsm/L. Perlakuan 9,4 g garam/L dan 14,1 g garam/L merupakan kondisi mendekati isoosmotik. Gradien osmotik yang semakin rendah menyebabkan semakin sedikitnya energi yang digunakan untuk osmoregulasi sehingga porsi energi untuk meningkatkan kelangsungan hidup dan pertumbuhan semakin besar (Setiyoningsih 2014).
14
Gambar 5. Gradien osmotik benih udang galah dari semua perlakuan pascatransportasi.
Konsentrasi Glukosa
Hasil pengukuran konsentrasi glukosa hemolymph udang normal, pascatransportasi dan pemeliharaan dapat dilihat pada Gambar 6. Hasil pengamatan konsentrasi glukosa hemolymph sebelum transportasi menunjukkan udang normal memiliki nilai sebesar 3,34±1,58 mg/dL. Pengamatan pada hari ke-0 pascatransportasi menunjukkan konsentrasi glukosa hemolymph semua perlakuan berbeda nyata dibandingkan dengan nilai konsentrasi glukosa normal (p<0,05) (Lampiran 5). Nilai tertinggi ditemukan pada perlakuan K- dan K+ yaitu sebesar 33,12±1,35 mg/dL dan 28,822±5,63 mg/dL, sedangkan perlakuan dengan penambahan garam memiliki konsentrasi glukosa lebih rendah. Konsentrasi glukosa pada perlakuan 9,4 g garam/L sebesar 23,25±1,35 mg/dL dan perlakuan 14,1 g garam/L sebesar 21,98±3,15 mg/dL. Nilai terendah ditemukan pada perlakuan 4,7 g garam/L sebesar 18,79±3,87 mg/dL. Menurut Anandasari et al. (2015), bahwa perlakuan transportasi benih udang galah tanpa bahan tambahan mengalami stres yang paling parah, sedangkan konsentrasi glukosa pada perlakuan yang ditambahakan minyak cengkeh, zeolit dan karbon aktif tidak terlalu fluktuatif.
Peningkatan konsentrasi glukosa hemolymph tersebut disebabkan oleh stres akibat perlakuan yang diberikan (Adiyana et al. 2014). Semakin tinggi konsentrasi glukosa mengindikasikan meningkatnya level stres. Hiperglisemia merupakan indikator terjadinya stres awal, karena tingkat glukosa sangat sensitif terhadap hormon stres (Saydmohammed & Pal 2009). Andrenalin berfungsi memobilisasi energi secara cepat untuk menfasilitasi respons awal terhadap stres dan selanjutnya menstimulasi pemecahan glikogen (glycogenlisys) di hati (Bonga 2011). Peningkatan glukosa merupakan respon sekunder stres udang. Glukosa berfungsi sebagai sumber energi untuk membantu udang bertahan hidup pada kondisi lingkungan stres (Gomes et al. 2003).
cd
15
Gambar 6. Respons glukosa hemolymph benih udang galah dari semua perlakuan pascatransportasi.
Konsentrasi glukosa hemolymph pascastres memperlihatkan tren menurun dari hari ke-1 sampai ke-30. Menurut Anandasari et al. (2015), bahwa pada jam ke-12 glukosa mulai stabil seperti kondisi normal, hal ini menandakan homeostasi udang sudah mendekati normal. Penurunan glukosa pascastres ini terjadi karena kinerja insulin yang berfungsi mengangkut glukosa untuk masuk ke dalam sel. Pengamatan pada hari ke-10 sampai ke-30 menunjukkan konsentrasi glukosa hemolymph semua perlakuan mendekati nilai konsentrasi glukosa normal. Konsentrasi glukosa dipertahankan homeostasinya oleh organ hati melalui metabolisme glukosa. Beberapa mekanisme yang berperan dalam mempertahankan homeostasi glukosa adalah glikogenolisis, glukoneogenesis, lipolisis, glikogenesis dan lipogenesis (Hastuti et al. 2003).
Homeostasis glukosa dipertahankan oleh beberapa hormon. Insulin merupakan salah satu hormon yang berperan menurunkan konsentrasi glukosa (Hastuti et al. 2003). Mekanisme terjadinya perubahan performa glukosa selama stres yaitu adanya perubahan lingkungan yang akan diterima oleh organ reseptor. Informasi tersebut disampaikan ke otak bagian hipotalamus melalui sistem syaraf, dan selanjutnya sel kromaffin menerima perintah melalui serabut syaraf symphatik untuk mensekresikan hormon katekolamin. Hormon ini akan mengaktivasi enzim-enzim yang telibat dalam katabolisme simpanan glikogen hati dan otot serta menekan sekresi hormon insulin, sehingga glukosa mengalami peningkatan. Selanjutnya pada saat yang bersamaan hipothalamus otak mensekresikan CRF (corticoid releasing facktor) yang meregulasi kelenjar pituitary untuk mensekresikan ACTH (Adeno-cortico-tropik hormone), MSH (Melanophore-Stimulating hormone) dan p-End (p-endorphin). Hormon tersebut akan meregulasi sekresi hormon kortisol dari sel internal. Diketahui bahwa kortisol akan menggertak enzim-enzim yang terlibat dalam glukoneogenesis yang menghasilkan peningkatan glukosa yang bersumber dari non karbohidrat. Terjadinya katabolisme protein untuk membentuk glukosa juga menghasilkan asam amino, sehingga asam amino mengalami peningkatan. Meningkatnya asam
cd
16
amino akan mengaktivasi insulin kembali sehingga mampu melakukan transport glukosa, sehingga glukosa akan menurun kembali (Wendelaar 1997).
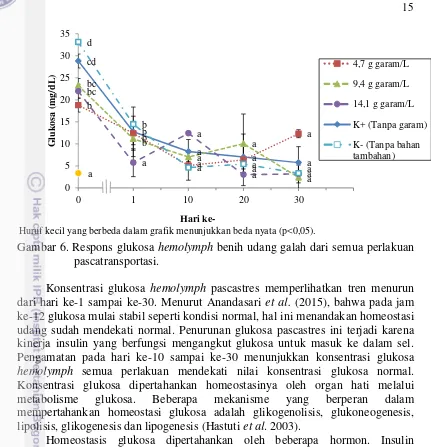
Histologi Insang
Histologi adalah metode yang sensitif dan secara biologis bernilai untuk mengukur efek stres hewan (jaringan) terhadap lingkungan. Perubahan histopatologi sebagai indikator penting faktor stres lingkungan yang dialami sebelumnya dimana perubahannnya secara biokimia dan fisiologi (Supriyono et al. 2010). Insang merupakan organ osmoregulasi yaitu melakukan berbagai fungsi fisiologis, meliputi peredaran gas, regulasi ion, mempertahankan keseimbangan asam basa dan ekskresi bahan buangan senyawa nitrogen, selain itu insang terus menerus berhadapan polutan di lingkungan medium (Hinton & Laurtn 1990).
Udang normal Perlakuan 4,7 g garam/L
Perlakuan 9,4 g garam/L Perlakuan 14,1 g garam/L
Perlakuan K+ (Tanpa garam) Perlakuan K- (Tanpa bahan tambahan)
17
Perlakuan 4,7 g garam/L Perlakuan 9,4 g garam/L
Perlakuan 14,1 g garam/L Perlakuan K+ (Tanpa garam)
Perlakuan K- (Tanpa bahan tambahan)
Gambar 8. Jaringan insang benih udang galah pada akhir pemeliharaan pascatransportasi. (H) hiperplasia
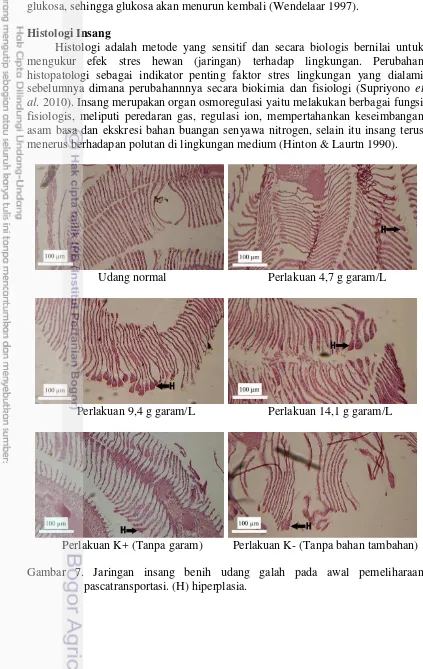
Hasil histologi menunjukkan bahwa terjadi abnormalitas insang pada awal pemeliharaan pascatransportasi (Gambar 7). Histologi pada semua perlakuan pada saat transportasi ditemukan hiperplasia. Hiperplasia merupakan penebalan lamela primer karena adanya peningkatan sel-sel mukus yang berfungsi melapisi permukaan insang. Mukus merupakan glikogen basa yang berfungsi sebagai pelindung. Gangguan kimia berupa perubahan pH lingkungan, penumpukan CO2,
amoniak dan zat-zat atau gas lain sisa metabolisme udang itu sendiri maka terjadi proliferasi sel-sel penghasil mukus sebagai bentuk reaksi pertahanan, selain itu juga karena adanya respons dalam osmoregulasi (Robert 2001). Hasil histologi insang udang pada akhir pemeliharaan pascatransportasi menunjukkan insang kembali normal, kecuali insang perlakuan 14,1 g garam/L dan K- yang masih teradapat hiperplasia (Gambar 8).
18
dapat menjadi jalan masuk bagi patogen-patogen atau secara langsung dapat mengakibatkan kematian.
Parameter Kualitas Air Pascatransportasi
Parameter kualitas air media pemeliharaan pascatransportasi dapat dilihat pada Tabel 3.
Tabel 3. Parameter kualitas air selama pemeliharaan pascatransportasi benih udang galah
Parameter Kisaran Nilai Tinjauan Pustaka
DO (7,4-8,5) mgO2/L > 5 mgO2/L (Boyd 2012)
suhu (29,5-30) oC (28-31) oC (Zeng & Cheng 2012)
pH 8,3-8,5 7,5-8,5 (Boyd 2012)
CO2 (3,53-6,16) mgCO2/L <5 mgCO2/L (Boyd 1982)
Alkalinitas (14,4-34,4) mgCaCO3/L >50 mgCaCO3/L (Boyd 2012)
NH3 (0,165-0,288) mgNH3/L <0,5 mgNH3/L (Boyd &
Zimmermann 2000)
Kualitas air pada media pemeliharaan masih dalam kisaran baik untuk budidaya udang galah, kecuali konsentrasi alkalinitas yang memiliki konsentrasi yang kurang dari konsentrasi alkalinitas yang dianjurkan untuk pemeliharaan udang galah. Alkalinitas berfungsi sebagai senyawa penyangga (buffer) untuk menjaga perubahan pH air secara tiba-tiba. Nilai alkalinitas >50 mgCaCO3/L
mampu menjaga kestabilan pH air dengan baik (Boyd 2012). Alkalinitas pada saat pemeliharaan berkisar antara 14,4-34,4 mgCaCO3/L (Tabel 3). Menurut Boyd
(2012), krustasea membutuhkan alkalinitas 75-100 mgCaCO3/L saat molting.
Oleh karena itu, ketika benih udang galah molting, benih udang galah memiliki waktu yang lama untuk membentuk karapas yang baru, sehingga beresiko dimakan oleh udang galah yang lain.
Laju Pertumbuhan Harian (LPH)
Laju pertumbuhan harian benih udang galah pemeliharaan selama 30 hari pascatransportasi dapat dilihat pada Gambar 5. Hasil analisis statistik menunjukkan laju pertumbuhan harian pada setiap perlakuan tidak berbeda nyata (p>0,05) (Lampiran 3). LPH tertinggi terdapat pada perlakuan K- sebesar 5,41±1,31 bobot tubuh/hari, kemudian secara berturut-turut diikuti oleh perlakuan K+, 9,4 g garam/L, 14,1 g garam/L dan 4,7 g garam/L sebesar 5,29±0,90 bobot tubuh/hari, 5±0,62 bobot tubuh/hari, 4,96±1,01 bobot tubuh/hari dan 4,19±0,53 bobot tubuh/hari. Nilai laju pertumbuhan ini berhubungan dengan jumlah kepadatan benih udang di akuarium, molting, konsumsi pakan dan kondisi benih udang pascatransportasi.
19
kelancaran proses molting. Pertumbuhan panjang dan bobot tubuh krustasea terjadi secara berkala setelah molting (Bianchini & Ragonese 2007).
Gambar 9. Laju pertumbuhan harian benih udang galah saat pemeliharaan 30 hari pascatransportasi.
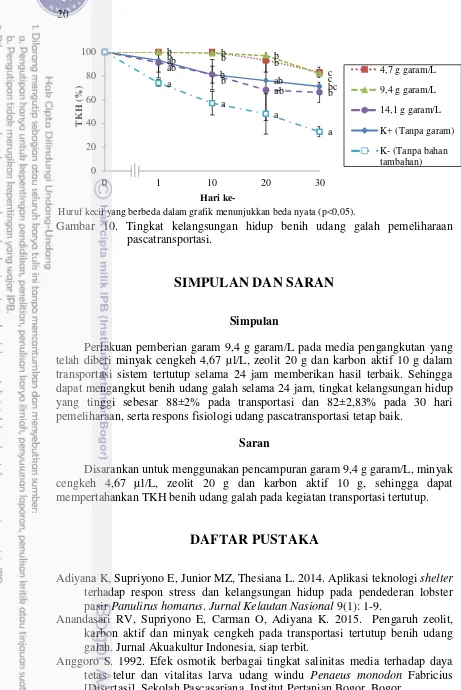
Tingkat Kelangsungan Hidup (TKH) Pascatransportasi
Tingkat kelangsungan hidup pemeliharaan benih udang galah selama 30 hari dapat dilihat pada Gambar 10. Hari pertama pemeliharaan terdapat kematian yang tinggi pada perlakuan K- dengan TKH sebesar 74±2,82%. Tingginya kematian pada perlakuan K- ini diakibatkan tingginya stres karena konsentrasi glukosa yang tinggi pascatransportasi dan molting pada beberapa benih udang galah. Menurut Fingerman et al. (1997) bahwa stres dapat membantu kelancaran proses molting, sehingga banyak benih udang galah yang molting, sedangkan alkalinitas pada saat pemeliharaan berkisar antara 14,4-34,4 mgCaCO3/L (Tabel 3). Menurut Boyd
(2012), krustasea membutuhkan alkalinitas 75-100 mgCaCO3/L saat molting.
Oleh karena itu, ketika benih udang galah molting, benih udang galah memiliki waktu yang lama untuk membentuk karapas yang baru, sehingga beresiko dimakan oleh udang galah yang lain.
TKH tertinggi pada pemeliharaan selama 30 hari yaitu perlakuan 4,7 g garam/L dan 9,4 g garam/L sebesar 83±4,24% dan 82±2,83%, sedangkan TKH terendah pada perlakuan K- sebesar 33±4,24%. Hasil analisis statistik menunjukkan TKH pada perlakuan 4,7 g garam/L tidak berbeda nyata dengan perlakuan yaitu 9,4 g garam/L (p>0,05) (Lampiran 2). Menurut Anandasari et al. (2015), bahwa TKH benih udang galah pemeliharaan pascatransportasi selama 10 hari dengan penambahan 4,67 µL/L minyak cengkeh, 20 g zeolit dan 10 g karbon aktif memiliki TKH tertinggi yaitu 82%. Menurut Fotedar et al. (2006) stres dapat menyebabkan kemampuan imunologi menurun terhadap penyakit, sehingga mengalami gangguan pertumbuhan, kinerja reproduksi yang buruk dan kelangsungan hidup lebih rendah.
20
Gambar 10. Tingkat kelangsungan hidup benih udang galah pemeliharaan pascatransportasi.
SIMPULAN DAN SARAN
Simpulan
Perlakuan pemberian garam 9,4 g garam/L pada media pengangkutan yang telah diberi minyak cengkeh 4,67 µl/L, zeolit 20 g dan karbon aktif 10 g dalam transportasi sistem tertutup selama 24 jam memberikan hasil terbaik. Sehingga dapat mengangkut benih udang galah selama 24 jam, tingkat kelangsungan hidup yang tinggi sebesar 88±2% pada transportasi dan 82±2,83% pada 30 hari pemeliharaan, serta respons fisiologi udang pascatransportasi tetap baik.
Saran
Disarankan untuk menggunakan pencampuran garam 9,4 g garam/L, minyak cengkeh 4,67 µl/L, zeolit 20 g dan karbon aktif 10 g, sehingga dapat mempertahankan TKH benih udang galah pada kegiatan transportasi tertutup.
DAFTAR PUSTAKA
Adiyana K, Supriyono E, Junior MZ, Thesiana L. 2014. Aplikasi teknologi shelter terhadap respon stress dan kelangsungan hidup pada pendederan lobster pasir Panulirus homarus. Jurnal Kelautan Nasional 9(1): 1-9.
Anandasari RV, Supriyono E, Carman O, Adiyana K. 2015. Pengaruh zeolit, karbon aktif dan minyak cengkeh pada transportasi tertutup benih udang galah. Jurnal Akuakultur Indonesia, siap terbit.
Anggoro S. 1992. Efek osmotik berbagai tingkat salinitas media terhadap daya tetas telur dan vitalitas larva udang windu Penaeus monodon Fabricius [Disertasi]. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor.
ab
21
Bianchini ML, Ragonese S. 2007. Gowth of Slipper Lobsters of the Genus Scyllarides. In: The Biology and Fisheries of the Slipper Lobster. Crustacean issues 17. Boca Raton (US): CRC Press. p 199-219.
Bonga SW. 2011. Hormone response to stress. Farrell AP, editor. Encyclopedia of Fish Physiology: From Genome to Environment. London (UK): Academic Press. p 1515-1523.
Boyd CE. 2012. Water quality. In: Lucas JS, Southgate PC (Ed). Aquaculture: Farming Aquatic Animal and Plants, 2nd Edition. Wiley-Blackwell. p 52-83. Boyd CE, Zimmermann S. 2000. Grow out system: water quality and soil
management of feshwater prawn culture: the farming of Macrobranchium rosenbergii, Blackwell Publishing Ltd 12:221-238.
Charoendat U, Areechon N, Srisapoome P. 2009. Efficacy of synthetic eugenol as an anesthetic for nile tilapia (Oreochromis niloticus Linn.). Kasetsart J. 43:132–140.
Evans DH. 2008. Teleost fish osmoregulation: what have we learned since august krogh, homer smith, and ancel keys. Am J Physiol Regul Integr Comp Physiol 295:704-713.
Fingerman M, Nagabhusanam, Thompson MF. 1997. Recent Advances in Marine Biotechnology. Volume 1. USA: Science Publishers Ins.
Fotedar S, Evans L, Jones B. 2006. Effect of holding duration on the immune system of western rock lobster Panulirus cygnus. Jousrnal of Comparative Biochemistry and Physiology. Part A 143:479–487.
Frose R. 1985. Improved Fish Transport in Plastic Bag. ICLARM Newsletter 8 (4).p 8-9.
Gomes LC, Roubach R, Araujo‐Lima CA, Chippari‐Gomes AR, Lopes NP, Urbinati EC. 2003. Effect of fish density during transportation on stress and mortality of juvenile tambaqui Colossoma macropomum. JWorldAquacSoc..34(1):76-84.
Hamzah M. 2004. Kelangsungan hidup dan pertumbuhan juvenil udang galah (Macrobrachium ronbergii de Man) pada berbagai tingkat salinitas media [Tesis]. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor.
Hastuti S, Supriyono E, Mokoginta I, Subandiyono. 2003. Respon glukosa darah ikan gurami (Osphronemus gouramy, LAC.) terhadap stres perubahan suhu lingkungan. Jurnal Akuakultur Indonesia 2(2):73-77.
Himawan Y, Khasani I. 2010. Pengaruh salinitas media terhadap lama waktu inkubasi dan daya tetas telur udang galah (Macrobrachium rosenbergii). Prosiding Forum Inovasi Teknologi Akuakultur. 43-48.
Hinton DE, Laurtn DJ. 1990. Integrative histopathological approaches to detecting effect of enviromental stressors on fishes. American Fisheries Society Symposium. 8:51-56.
Huisman EA. 1987. Principles of Fish Culture and Fisheries. Netherlands: Wageningen Agiculture University.
Inoue LAKA, Afonsom LOB, Iwama GK, Moraes G.2005. Effects of clove oil on the stress response of matrinxa (Brycon cephalus) subjected to transport. Acta Amazinica. 35(2):289-295.
22
Liao IC, Huang HJ. 1975. Studies on the respiration of economic prawns in taiwan. I. Oxygen of egg up to young prawns of Penaeus monodon fab. Fish Social Taiwan. 4(1):33-50.
Robert RJ. 2001. Fish Pathology. USA: W. B. Saunders.
Saydmohammed M, Pal AK. 2009. Anesthetic effect of eugenol and menthol on handling stress in Macrobrachium rosenbergii. Aquaculture 298:162–167. Setiyoningsih PR. 2014. Respon gelondongan ikan bandeng (Chanos Chanos)
akibat perubahan salinitas dengan penambahan kalsium klorida (CaCl2)
pada durasi yang berbeda. Jurnal Penelitian UNISLA. 5(2):6-17.
Stickney RR. 1979. Principles of Warmwater Aquaculture. New York: A Willey-Interscience Publication, John Willey and Sons.
Suparno J, Basmal I, Muljanah. 1994. Pengaruh suhu dan waktu pembiusan dengan pendinginan bertahap terhadap ketahanan hidup udang windu tambak (Penaeus monodon) dalam transportasi sistem kering. Jurnal Penelitian Pasca Panen Perikanan. 79:73-78.
Supriyono E, Supendi A, Nirmala K. 2007. Pemanfaatan zeolit dan karbon aktif pada sistem pengepakan tertutup ikan Corydoras Corydoras aenus. Jurnal Akuakultur Indonesia. 6(2):135-145.
Supriyono E, Syahputra R, Ghozali MF, Wahjuningrum D, Nirmala K, Kristanto AH. 2010. Evektifitas pemberian zeolit, karbon aktif dan minyak cengkeh hormon kortisol dan gambaran darah benih ikan patin Pangasionodon hyppopthalamus pada pengangkutan dengan kepadatan tinggi. Ilmu Kelautan. 15(2):103-112.
Swann. 1993. Transportation of fish in bags north central regional. Aquaculture Center Purdue University, in cooperation with USDA.
Tort L. 2011. Impact stress in health and reproduction. Farrell AP, editor. Encyclopedia of Fish Physiology: From Genome to Environment. London (UK): Academic Press. p 1541–1552.
Wedemeyer GA, 1996. Physiology of Fish in Intensive Culture Systems. New York: Champman and Hall.
Wedemeyer GA, Yasutake WT. 1977. Clinical Methods for the Assessment of the Effects of Environmental Stres on Fish Health. Volume ke-89. Washington DC (US) Department of the Interior Fish and Wildlife Service.
Wendelaar BSE. 1997. The stress response in fish. Physiol. Rev.77:591-625. Wibowo. 1993. Penerapan Teknik Penanganan dan Transportasi Ikan Hidup di
Indonesia. Jakarta: Sub. BPPL. Slipi.
Zeng C, Cheng Y. 2012. Other Decapod Crustaceans. In: Lucas JS, Southgate PC (Ed). Aquaculture: Farming Aquatic Animal and Plants, 2nd Edition.
Wiley-Blackwell. 522-540.
23
Lampiran 1. Prosedur histologi
24
Lampiran 2. Hasil analisis ragam TKH benih udang galah
TKH saat transportasi
I. Analisis ragam TKH transportasi
Analisis ragam
JK DB KT F Sig.
TKH jam ke-4 Antar Perlakuan 6,400 4 1,600 12,000 0,001
Dalam Perlakuan 1,333 10 0,133
Total 7,733 14
TKH jam ke-8 Antar Perlakuan 4,400 4 1,100 2,750 0,089 Dalam Perlakuan 4,000 10 0,400
Total 8,400 14
TKH jam ke-12 Antar Perlakuan 21,733 4 5,433 1,358 0,315 Dalam Perlakuan 40,000 10 4,000
Total 61,733 14
TKH jam ke-16 Antar Perlakuan 486,667 4 121,667 6,810 0,007
Dalam Perlakuan 178,667 10 17,867 Total 665,333 14
TKH jam ke-20 Antar Perlakuan 1775,600 4 443,900 30,129 0,000 Dalam Perlakuan 147,333 10 14,733
Total 1922,933 14
TKH jam ke-24 Antar Perlakuan 2551,733 4 637,933 37,822 0,000 Dalam Perlakuan 168,667 10 16,867
Total 2720,400 14
II. Uji lanjut Duncan
TKH jam ke-4
Perlakuan N Alpha= 0,05
1 2
K+ 3 98,33
K- 3 99,33
4,7 g garam/L 3 100 9,4 g garam/L 3 100 14,1 g garam/L 3 100
25 TKH jam ke-8
Perlakuan N Alpha= 0,05
1 2
K+ 3 98
K- 3 98,33 98,33
9,4 g garam/L 3 99 99 4,7 g garam/L 3 99,33 14,1 g garam/L 3 99,33
Sig. 0,094 0,101
TKH jam ke-12
Perlakuan N Alpha= 0,05 1
14,1 g garam/L 3 95,67
K+ 3 96,67
K- 3 98,00
9,4 g garam/L 3 98,33 4,7 g garam/L 3 99,00
Sig. 0,090
TKH jam ke-16
Perlakuan N Alpha= 0,05
1 2 3
14,1 g garam/L 3 82,67
K- 3 89,67 89,67
9,4 g garam/L 3 94 94
K+ 3 96,67 96,67
4,7 g garam/L 3 98,67
Sig. 0,070 0,081 0,226
TKH jam ke-20
Perlakuan N Alpha= 0,05
1 2 3
14,1 g garam/L 3 69,67
K- 3 77,33
K+ 3 92,67
9,4 g garam/L 3 93,33
26
TKH jam ke-24
Perlakuan N Alpha= 0,05
1 2 3 4
K- 3 52,67
14,1 g garam/L 3 62,67
K+ 3 74,33
4,7 g garam/L 3 83,33
9,4 g garam/L 3 88
Sig. 1,000 1,000 1,000 0,194
TKH saat pascatransportasi
I. Analisis ragam TKH pascatransportasi
Analisis ragam
JK DB KT F Sig.
TKH hari ke-1 Antar Perlakuan 906,400 4 226,600 4,228 0,073
Dalam Perlakuan 268,000 5 53,600
Total 1174,400 9
TKH hari ke-10 Antar Perlakuan 2454,400 4 613,600 9,833 0,014 Dalam Perlakuan 312,000 5 62,400
Total 2766,400 9
TKH hari ke-20 Antar Perlakuan 3154,400 4 788,600 3,748 0,090 Dalam Perlakuan 1052,000 5 210,400
Total 4206,400 9
TKH hari ke-30 Antar Perlakuan 3308,000 4 827,000 35,042 0,001 Dalam Perlakuan 118,000 5 23,600
Total 3426,000 9
II. Uji lanjut Duncan
TKH hari ke-1
Perlakuan N Alpha= 0,05
1 2
K- 2 74
14,1 g garam/L 2 91 91
K+ 2 93 93
4,7 g garam/L 2 100 9,4 g garam/L 2 100
27 TKH hari ke-10
Perlakuan N Alpha= 0,05
1 2
K- 2 57,00
K+ 2 81
14,1 g garam/L 2 81 9,4 g garam/L 2 99 4,7 g garam/L 2 100
Sig. 1,000 0,069
TKH hari ke-20
Perlakuan N Alpha= 0,05
1 2
K- 2 48
14,1 g garam/L 2 68 68
K+ 2 76 76
4,7 g garam/L 2 93 9,4 g garam/L 2 97
Sig. 0,119 0,112
TKH hari ke-30
Perlakuan N
Alpha= 0,05
1 2 3
K- 2 33,00
14,1 g garam/L 2 66
K+ 2 71 71
9,4 g garam/L 2 82
4,7 g garam/L 2 83
Sig. 1,000 0,351 0,062
Lampiran 3. Hasil analisis ragam LPH benih udang galah I. Analisis ragam LPH
Analisis ragam
JK DB KT F Sig.
Antar Perlakuan 1,871 4 0,468 1,585 0,310 Dalam Perlakuan 1,475 5 0,295
28
II. Uji lanjut Duncan
Laju Pertumbuan Harian
Perlakuan N Alpha= 0,05 1
4,7 g garam/L 2 4,1500 14,1 g garam/L 2 4,9550 9,4 g garam/L 2 4,9850
K+ 2 5,2450
K- 2 5,4050
Sig. 0,078
Lampiran 4. Hasil analisis ragam gradien osmotik (Go) benih udang galah I. Analisis ragam GO
Analisis ragam
JK DB KT F Sig.
GO jam ke-0 Antar Perlakuan 26,558 5 5,312 40,591 0,000
Dalam Perlakuan 0,785 6 0,131
Total 27,343 11
GO jam ke-3 Antar Perlakuan 0,548 4 0,137 5,328 0,048
Dalam Perlakuan 0,129 5 0,026 Total 0,677 9
GO jam ke-720 Antar Perlakuan 0,432 4 0,108 2,927 0,135 Dalam Perlakuan 0,185 5 0,037
Total 0,617 9
II. Uji lanjut Duncan
GO jam ke-0
Perlakuan N Alpha= 0,05
1 2 3 4
14,1 g garam/L 2 3,040
9,4 g garam/L 2 5,115
4,7 g garam/L 2 6,090
K+ 2 6,640 6,640
Udang normal 2 7,000 7,000
K- 2 7,540
29
GO jam ke-3
Perlakuan N Alpha= 0,05
1 2 3
9,4 g garam/L 2 6,825
K- 2 6,945 6,945
14,1 g garam/L 2 7,155 7,155 7,155 4,7 g garam/L 2 7,325 7,325
K+ 2 7,460
Sig. 0,102 0,070 0,124
GO jam ke-720
Perlakuan N Alpha= 0,05
1 2
K+ 2 5,955
9,4 g garam/L 2 6,260 6,260 14,1 g garam/L 2 6,380 6,380
K- 2 6,455 6,455
4,7 g garam/L 2 6,560
Sig. 0,055 0,192
Lampiran 5. Hasil analisis ragam glukosa hemolymph benih udang galah I. Analisis ragam glukosa hemolymph
Analisis ragam
JK DB KT F Sig.
Glukosa hari ke-0 Antar Perlakuan 1057,822 5 211,564 20,220 0,001
Dalam Perlakuan 62,779 6 10,463
Total 1120,601 11
Glukosa hari ke-1 Antar Perlakuan 89,052 4 22,263 5,637 0,043 Dalam Perlakuan 19,746 5 3,949
Total 108,798 9
Glukosa hari ke-10 Antar Perlakuan 78,300 4 19,575 1,071 0,458 Dalam Perlakuan 91,370 5 18,274
Total 169,670 9
Glukosa hari ke-20 Antar Perlakuan 51,823 4 12,956 1,769 0,272 Dalam Perlakuan 36,615 5 7,323
Total 88,437 9
Glukosa hari ke-30 Antar Perlakuan 132,121 4 33,030 2,392 0,182 Dalam Perlakuan 69,045 5 13,809
30
II. Uji lanjut Duncan
Glukosa hari ke-0
Perlakuan N Alpha= 0,05
1 2 3 4
Udang normal 2 3,3440
4,7 g garam/L 2 18,7900
14,1 g garam/L 2 21,9745 21,9745 9,4 g garam/L 2 23,2485 23,2485
K+ 2 28,8220 28,8220
K- 2 33,1210
Sig. 1,000 0,231 0,087 0,232
Glukosa hari ke-1
Perlakuan N Alpha= 0,05
1 2
14,1 g garam/L 2 5,7325
9,4 g garam/L 2 11,1465 4,7 g garam/L 2 12,4205
K+ 2 12,7390
K- 2 14,4905
Sig. 1,000 0,165
Glukosa hari ke-10
Perlakuan N Alpha= 0,05 1
K- 2 4,6180
4,7 g garam/L 2 5,0955 9,4 g garam/L 2 7,0060
K+ 2 8,2800
14,1 g garam/L 2 12,4205
Sig. 0,139
Glukosa hari ke-20
Perlakuan N Alpha= 0,05 1
14,1 g garam/L 2 3,0255
K- 2 5,4140
4,7 g garam/L 2 6,3690
K+ 2 7,0065
9,4 g garam/L 2 10,0315
31 Glukosa hari ke-30
Perlakuan N Alpha= 0,05 1
9,4 g garam/L 2 2,3885 14,1 g garam/L 2 3,1850
K- 2 3,3440
K+ 2 5,7615
4,7 g garam/L 2 12,3085
32
RIWAYAT HIDUP
Penulis dilahirkan di Palembang tanggal 03 Mei 1990 dari ayah Nalhandani Yahdin dan ibu Hartini. Penulis merupakan anak ketiga dari tiga bersaudara. Pendidikan sarjana ditempuh di Progam Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Menyelesaikan studi pada tahun 2012. Tahun 2013, penulis mendapatkan beasiswa dari DIKTI pada program BPPDN untuk melanjutkan studi di program Magister Sekolah Pascasarjana IPB pada Mayor Ilmu Akuakultur.