SUPLEMENTASI MIKROKAPSUL PROBIOTIK MELALUI
PAKAN SEBAGAI PENCEGAH INFEKSI
Streptococcosis
PADA
IKAN NILA (
Oreochromis niloticus
)
FIRMA FIKA RAHMAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Suplementasi Mikrokapsul Probiotik melalui Pakan sebagai Pencegah Infeksi Streptococcosis
pada Ikan Nila (Oreochromis niloticus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Firma Fika Rahmawati
RINGKASAN
FIRMA FIKA RAHMAWATI. Suplementasi Mikrokapsul Probiotik melalui Pakan sebagai Pencegah Infeksi Streptococcosis pada Ikan Nila (Oreochromis niloticus). Dibimbing oleh MUNTI YUHANA dan MIA SETIAWATI.
Intensifikasi budidaya ikan nila memunculkan beberapa permasalahan, salah satunya adalah meningkatnya kerentanan ikan terhadap penyakit.
Streptococcosis adalah penyakit yang sering menyerang ikan nila yang disebabkan oleh bakteri Streptococcus agalactiae. Bakteri S. agalactiae dapat menyebabkan kematian yang tinggi dan kerugian ekonomi yang cukup besar dalam budidaya ikan nila. Optimalisasi pencegahan penyakit Streptococcosis dapat dilakukan dengan aplikasi probiotik sebagai biokontrol. Seringkali, pemberian probiotik masih dalam bentuk kultur segar. Hal ini dinilai kurang efektif karena selain tidak praktis, penyediaaan kultur segar probiotik hanya mampu bertahan dalam waktu penyimpanan yang pendek. Salah satu teknologi yang dapat diterapkan dalam upaya mempertahankan daya simpan probiotik adalah teknik mikroenkapsulasi. Teknik ini, mampu menyediakan lapisan sebagai barier fisik pada sel probiotik untuk menghindari pengaruh kondisi lingkungan yang merusaknya. Penelitian ini bertujuan untuk menentukan bahan penyalut serta dosis pemberian mikrokapsul probiotik yang terbaik melalui pakan untuk pencegahan penyakit Streptococcosis
pada ikan nila.
Teknik mikroenkapsulasi yang digunakan adalah spray drying yang merupakan metode paling umum digunakan dalam proses mikroenkapsulasi, yang tergolong murah dibandingkan dengan metode lainnya. Dalam teknik mikroenkapsulasi ini dicobakan beberapa bahan penyalut antara lain: protein whey,
maltodekstrin, serta gabungan keduanya. Perbandingan bahan inti dan bahan penyalut adalah 1:1 (w/v). Protein whey dipilih sebagai sebagai bahan penyalut karena diketahui memiliki sifat permeabilitas oksigen yang relatif rendah sedangkan maltodekstrin dipilih karena bahan tersebut memiliki karakteristik tidak higroskopis, mampu meningkatkan viskositas produk, memiliki kemampuan daya rekat yang baik. Alat spray dryer dalam proses mikroenkapsulasi ini adalah BUCHI mini dengan suhu inlet 131-133 oC dan suhu outlet 65-70 oC.
Pengamatan viabilitas sel mikrokapsul dilakukan dengan metode TPC (Total Plate Count) dari produk yang disimpan pada suhu 4 °C dan suhu 27 °C serta dilakukan secara aerob dan anaerob. Koloni yang terbentuk dihitung dengan satuan Colony Forming Unit (CFU).
respons imun meliputi kadar hematoktit, kadar hemoglobin, total eritrosit, diferensial leukosit, dan indeks fagositik.
Hasil penelitian menunjukkan bahwa mikrokapsul probiotik yang terbaik adalah dengan penambahan bahan penyalut gabungan antara whey dan maltodekstrin pada penyimpanan aerob dengan suhu 4 oC. Mikrokapsul probiotik ini mampu mempertahankan kondisi fisik berupa serbuk dan viabilitas selnya hingga 108 CFU/g. Analisis proksimat pakan dari penambahan mikrokapsul probiotik menunjukkan pengaruh terhadap peningkatan kandungan protein pada masing-masing perlakuan dosis 0.5%, 1%, dan 2% sebesar 32.56%, 32.64%, dan 32,71% lebih tinggi dibandingkan dengan kontrol tanpa penambahan mikrokapsul probiotik yang hanya sebesar 30.87%. Hal ini mengindikasikan adanya pengaruh terhadap keberadaan sel hidup probiotik yang mampu memberikan pengaruh peningkatan kadar protein pakan.
Hasil pengamatan pengaruh penambahan mikrokapsul probiotik dengan dosis 0.5%, 1%, dan 2% mampu meningkatkan laju pertumbuhan sebesar 3.07%, 3.10%, dan 3.40% berbeda nyata (p<0.05) dengan kontrol sebesar 2.40%. Pada pengamatan FCR, penambahan 1% dan 2% mikrokapsul probiotik menunjukkan besaran nilai 1.27%, dan 1.25% berbeda nyata (p<0.05) dengan penambahan 05% mikrokapsul probiotik dan kontrol sebesar 1.36% dan 1.97% pada waktu pemeliharaan selama 30 hari. Hal ini mengindikasikan bahwa penambahan 1% dan 2% mikrokapsul probiotik mampu meningkatkan nilai efisiensi pakan sehingga nutrien mampu dioptimalkan untuk peningkatan pertumbuhan dibandingkan penambahan 0.5% mikrokapsul probiotik dan tanpa penambahan mikrokapsul probiotik.
Hasil pengamatan parameter sistem imun dari penambahan dosis 2% mikrokapsul probiotik, kadar hematokrit menunjukkan nilai tertinggi pada hari ke-12 sebesar 29.27% berbeda nyata (p<0.05) dengan perlakuan lainnya, namun sama dengan kontrol negatif. Kadar hemoglobin pada penambahan 2% mikrokapsul probiotik, mulai hari ke-9 pascauji tantang menunjukkan nilai tertinggi berbeda nyata (p<0.05) dengan perlakuan lainnya. Kadar eritrosit, mulai hari ke-3 menunjukkan peningkatan jumlah sel darah merah, dan berbeda nyata (p<0.05) dengan kontrol. Pengamatan leukosit hari ke-9 menunjukkan peningkatan sel darah putih pada perlakuan penambahan 2% mikrokapsul probiotik dan berbeda nyata (p<0.05) dengan kontrol. Diferensial leukosit meliputi limfosit, monosit, dan neutrofil. Secara umum, pada penambahan mikrokapsul probiotik pascauji tantang mulai hari ke-3 menunjukkan peningkatan dibandingkan dengan kontrol. Peningkatan indeks fagositik terjadi pada hari ke-9 penambahan 2% mikrokapsul probiotik sebesar 40.67% berbeda nyata (p<0.05) dengan kontrol sebesar 28.33%.
SUMMARY
FIRMA FIKA RAHMAWATI. Microencapsulated Probiotic Feed Supplementation for The Prevention of Streptococcosis in Tilapia (Oreochromis niloticus). Supervised by MUNTI YUHANA and MIA SETIAWATI.
Intensification of tilapia farming raises several problems, one of which is increasing the fish susceptibility to disease. Streptococcosis is a disease that often affects tilapia, that is caused by the bacteria Streptococcus agalactiae. This bacteria can cause high mortality and cause considerable economic losses in tilapia fish farming. Optimizing Streptococcosis disease prevention can be done with the application of probiotics as biocontrol. Often, administration of probiotics is still in the form of fresh probiotic cells. It is considered less effective because besides it is not practical, provision of fresh cells cultures can only viable in the short time. One of the technology that can be applied in order to preserve the shelf life of probiotics is the microencapsulation technique. This technique is capable of providing a physical barrier layer on probiotic cells to avoid the damaging effect of destructing environmental conditions. This study aimed to select the coating material and the best dosage of probiotics microcapsules supplementation in feed for the prevention of Streptococcosis disease.
Microencapsulation technique applied in this study was spray drying which is the most common method used in the microencapsulation process. This method is relatively cheap compared to others. In this microencapsulation techniques we applied several coating materials included: whey protein, maltodextrin, and a combination of both. Comparison of core material and the coating material was 1:1 (w/v). Whey protein was chosen as the coating material because it is known to have properties that is relatively low oxygen permeability. The instrument used for spray dryer in the microencapsulation process was BUCHI mini with inlet temperature ranged from 131 to 133 °C and an outlet temperature ranged of 65 to 70 °C.
Observation of cell viability of microcapsules product was conducted using TPC (Total Plate Count). The products were stored at various conditions such as at temperatures ranging from 4 °C up to 27 °C and were stored aerobically and anaerobically. Colonies number of viable cells was calculated by Colony Forming Units (CFU).
The results showed that the best coating material of probiotic microencapsulation showed by the addition of combination of whey and maltodextrin: whereas the best cells viability was shown in aerobically storage condition at temperature of 4 °C. The microcapsulated probiotic was able to maintain the powdery condition and kept the cell viability up to 108 CFU/g. The observation of proximate analysis of feed mixed with 0.5%, 1% and 2% microencapsulated probiotics showed increase in protein contents of 32.56%, 32.64%, and 32.71%, respectively higher than the control which no addition of addition of 1% and 2% microencapsulated probiotic indicated feed efficiency value that optimalisation of grow performent compared with no addition of probiotic microcapsules.
The observation of the immune system parameters showed that the addition of 2% dose, resulted in the highest value of hematocrite on day 12 at 29.27% respectively significantly different (p<0.05) to that all other treatment, same as negative control. The hemoglobin of addition 2% microencapsulated probiotic at 9 days observation showed the highest value significantly different (p<0.05) with all other treatment. Erythrocyte levels, at 3 days observation showed the highest value of red blood cells, and significantly different (p<0.05) with the control. Observations of leukocytes at day 9 showed the highest value of white blood cells of addition 2% microencapsulated probiotic and significantly different (p<0.05) to control. Differential leukocytes observed including lymphocytes, monosit, and neutrophils. Usually, the addition microencapsulated probiotic post-challenge test at 3 days showed the highest value than control. Increased phagocytic indeks of addition 2% microencapsulated probiotic was 40.67% significantly different (p<0.05) to control was 28.33%.
Based on observations on the profile of the immune system parameters, it was showed that the supplementation of 2% microencapsulated probiotics cells dosage capable of providing a positive effect on the immune system enhancement at tilapia. The improvement of fish health was indicated by an increased in the phagocytic indeks in the presence of monocytes and macrophages who play an important roles in the process of phagocytosis as a resistance mechanisms against the pathogenic cells, thus providing a positive effect on the survival of tilapia post challenge test, i.e as much as 80.00% significantly different (p<0.05) to positive control which only 50.00% survival, whereas the negative control treatment without challenged was 100% survival.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SUPLEMENTASI MIKROKAPSUL PROBIOTIK MELALUI
PAKAN SEBAGAI PENCEGAH INFEKSI
Streptococcosis
PADA
IKAN NILA (
Oreochromis niloticus
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah Mikrokapsul Probiotik yang dilaksanakan sejak bulan September 2013, bertempat di Laboratorium Kesahatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Jawa Barat dengan judul Suplementasi Mikrokapsul Probiotik melalui Pakan sebagai Pencegah Infeksi Streptococcosis pada Ikan Nila (Oreochromis niloticus).
Terima kasih penulis ucapkan kepada Pihak DIKTI, Pascasarjana IPB, UNIKAL yang telah memberikan kesempatan kepada penulis untuk bisa melanjutkan studi melalui Program Beasiswa Unggulan Tahun 2012, Ibu Dr Munti Yuhana, SPi MSi selaku Pembimbing I dan dan Ibu Dr Ir Mia Setiawati, MSi selaku Pembimbing II, yang telah memberi arahan dan bimbingan kepada penulis sampai terselesaikannya tesis ini, serta Ibu Dr Sri Nuryati, S Pi, M Si selaku dosen penguji luar komisi pada ujian tesis atas segala saran yang diberikan sehingga tesis ini lebih berkualitas.
Penulis juga mengucapkan terima kasih dan rasa hormat kepada Orang tua tercinta Bapak Mathori, Ibu Ramijah, Mba Reni Irma Irawati serta orang terkasih Bayu Ardiansyah yang senantiasa memberikan do’a, dukungan dan semangat kepada penulis.
Ungkapan terima kasih juga disampaikan kepada sahabat terbaik satu bimbingan Mba Anis, Mba Salma, Mba Una, Mba Nur, Septi, teman-teman
LKI’ers serta seluruh keluarga besar AKU Pascasarjana IPB 2012 serta Mba Wulan, Kristin dan segenap keluarga Gardenia yang banyak membantu memberi saran, bantuan, motivasi dan semangat kepada penulis.
Penelitian dan penyusunan tesis ini dapat terlaksana atas bantuan dana dari Program Beasiswa Unggulan DIKTI Tahun 2012 dan orang tua penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 METODE PENELITIAN 3
Waktu dan Tempat Pelaksanaan 3
Perlakuan dan Rancangan Penelitian 3
Penyiapan probiotik 5
Mikroenkapsulasi probiotik 6
Uji mikrokapsul probiotik secara in vitro 7
Uji mikrokapsul probiotik secara in vivo 7
Persiapan pakan dan pemberian pakan 9
Infeksi bakteri Streptococcus agalactiae 9
Parameter Pengamatan 9
Analisis Data 10
3 HASIL DAN PEMBAHASAN 11
Hasil Uji Mikrokapsul Probiotik secara In vitro 11 Hasil Uji Mikrokapsul Probiotik secara In vivo 12
Efektifitas pemberian mikrokapsul probiotik sebelum uji tantang 12
Pengamatan respons imun 14
Efektifitas pemberian mikrokapsul probiotik pascauji tantang 16 Hasil pengamatan survival rate (SR) pascauji tantang 21
Pembahasan umum 22
4 SIMPULAN DAN SARAN 25
Simpulan 25
Saran 25
DAFTAR PUSTAKA 25
LAMPIRAN 29
DAFTAR TABEL
1 Perlakuan pemberian pakan mikrokapsul probiotik 4
2 Satuan dan alat ukur parameter kualitas air 10
3 Fisik mikrokapsul probiotik selama 30 hari 12
4 Feed conversion rasio (FCR), spesific grow rate (SGR) dan survival rate (SR) dari pemberian mikrokapsul probiotik dengan dosis yang
berbeda pada ikan nila 13
5 Gambaran darah dari pemberian mikrokapsul probiotik dengan dosis yang berbedapada ikan nila selama pemeliharaan 30 hari 14
DAFTAR GAMBAR
1 Skema pelaksanaan penelitian evaluasi mikrokapsul probiotik melalui pakan sebagai pencegah infeksi Streptococcosis pada ikan nila 4 2 Alur kegiatan penelitian meliputi perlakuan dan aktivitas sampling 5 3 Viabilitas mikrokapsul probiotik L1k selama 30 hari dengan metode
pengamatan Total Plate Count. PD: mikrokapsul probiotik dengan bahan penyalut maltodekstrin, PW: mikrokapsul probiotik dengan bahan penyalut whey, PDW: mikrokapsul probiotik dengan bahan penyalut gabungan (maltodekstrin dan whey), ae: penyimpanan secara aerob, an: penyimpanan secara anaerob, SR: suhu penyimpanan 27 oC
dan RF: suhu penyimpanan 4 ºC 11
4 Hematokrit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0,5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan
mikrokapsul probiotik 2% 16
5 Hemoglobin ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0,5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan
mikrokapsul probiotik 2% 17
6 Kadar eritrosit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan
mikrokapsul probiotik 2% 17
7 Total leukosit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan
DAFTAR GAMBAR (Lanjutan)
8 Limfosit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K- : kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan
mikrokapsul probiotik 2% 19
9 Monosit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan
mikrokapsul probiotik 2% 19
10 Neutrofil ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan
mikrokapsul probiotik 2% 19
11 Indeks fagositik ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( ) A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C:
penambahan mikrokapsul probiotik 2% 20
12 Survival rate (SR) ikan nila pascauji tantang pada perlakuan mikrokapsul probiotik dengan dosis berbeda. K(-): kontrol negatif, K(+): kontrol positif, A: penambahan mikrokapsul probiotik 0.5% pada pakan, B: penambahan mikrokapsul probiotik 1% pada pakan, dan C: penambahan mikrokapsul probiotik 2% pada pakan. ( ) pengamatan
SR setelah uji tantang 21
13 Perubahan gejala klinis pada organ mata dan tubuh ikan nila; a. Normal; b. (1) Ikan hidup yang mengalami necrosis pada ekor, (2) Garis vertikal menghitam, (3) Lateral exopthalmi, c. Warna tubuh memucat dan perut membesar dan mengeluarkan cairan kuning; d. (1) Mata mengkerut (2) Clear operculum (penjernihan operculum); e.
Bilateral exopthalmi (penonjolan dua buah mata) dan mata berkabut (opacity); f. whirling; g. Ketidak seimbangan berenang; h. (1) Ikan mati yang mengalami necrosis pada ekor, (2) perut membesar; i. Sirip
DAFTAR LAMPIRAN
1 Konfirmasi bakteri probiotik L1k 30
2 Konfirmasi bakteri S. agalactiae NK1 30
3 LD50 isolat NK1 (S. agalactiae tipe non-hemolitik) 30
4 Analisa proksimat pakan 30
5 Metode perhitungan kelangsungan hidup survival rate (SR) 31
6 Metode perhitungaan laju pertumbuhan harian 31
7 Metode perhitungan rasio konversi pakan 31
8 Prosedur pewarnaan Gram 32
9 Perbedaan hasil pengamatan pewarnaan Gram 33
10 Metode pengukuran gambaran darah 33
11 Prosedur analisis proksimat 33
12 Gambar penelitian 39
13 Analisis usaha kegiatan pembenihan ikan nila dengan penambahan
1
PENDAHULUAN
Latar Belakang
Intensifikasi budidaya ikan nila yang kurang memperhatikan kondisi lingkungan dapat menimbulkan berbagai dampak negatif antara lain timbulnya penyakit. Salah satu masalah utama pada budidaya ikan nila saat ini yaitu wabah penyakit Streptococcosis yang disebabkan oleh bakteri Streptococcus agalactiae. Penyakit Streptococcosis pertama kali dilaporkan terjadi pada budidaya ikan
rainbow trout (Oncorhynchus mykiss) di Jepang dan di beberapa negara seperti Amerika Serikat, Israel, Kuwait, Thailand dan Brasil (Evans et al. 2006). Beberapa tahun terakhir, penyakit streptococcosis dilaporkan terjadi di beberapa wilayah Indonesia yaitu wilayah Sumatra, Jawa Barat, Jawa Tengah, Sulawesi, dan Nusa Tenggara (Hardi 2011). Lusiastuti et al. (2009) melaporkan bahwa kasus Streptococcosis di Waduk Cirata Jawa Barat disebabkan oleh S. agalactiae. Taukhid dan Purwaningsih (2011) menyatakan bahwa kasus Streptococcosis
dibeberapa sentra budidaya ikan nila di Jawa Barat dan Jawa Tengah umumnya disebabkan oleh infeksi S. agalactiae (85%) dan S. iniae (15%).
Bakteri S. agalactiae menyebabkan 90% kematian ikan 6 hari setelah injeksi (Evans et al. 2006). Infeksi bersifat septicemia dan koloninya menyebar di beberapa organ dalam seperti pada otak, mata dan ginjal (Sheehan. 2009). Infeksi bakteri S. agalactiae lebih virulen pada kondisi lingkungan dengan suhu 24-29 oC (Conroy 2009). Indonesia umumnya berada pada kisaran tersebut, maka penyebaran infeksi dapat meningkat bila tidak segera ditanggulangi.
Berbagai upaya optimalisasi pencegahan penyakit Streptococcosis telah dikembangkan, salah satunya dengan penggunaan probiotik sebagai biokontrol. Pengaruh probiotik menjadi solusi untuk menghasilkan pertumbuhan dan efisiensi pakan yang optimal, mengurangi biaya produksi dan pada akhirnya dapat mengurangi beban lingkungan karena akumulasi limbah di perairan (Iribarren et al. 2012). Budidaya beberapa jenis ikan yang telah sukses mengambil keuntungan pada peningkatan performa pertumbuhan, efisiensi pakan, kecernaan nutrisi, efektivitas enzim-enzim pencernaan, mendukung dominasi organisme menguntungkan, menghambat patogen berbahaya dan meningkatkan sistem imun dengan mengaplikasikan probiotik antara lain: udang windu (Penaeus monodon) (Boonthai et al. 2011); ikan mas (Cyprinus carpio) (Gopalakannan dan Arul 2011); udang galah (Macrobrachium rosenbergii) (Keysami et al. 2007; Keysami
et al. 2012); ikan mas labeo (Labeo rohita) (Mohapatra et al. 2008; Kumar et al. 2012); ikan rainbow trout (Oncorhynchus mykiss) (Merrifield et al. 2010); ikan beronang (Siganus rivulatus) (El-Dakar et al. 2007) dan ikan grass carp (Ctenopharygodon idella) (Wang et al. 2008).
2
tersebut, perlu adanya suatu teknologi untuk menghasilkan barier fisik pada probiotik untuk menghindari pengaruh kondisi lingkungan yang berpengaruh terhadap keberlangsungan hidup probiotik. Salah satu metode yang dapat diterapkan adalah metode mikroenkapsulasi.
Mikroenkapsulasi merupakan teknik penyalutan suatu bahan sehingga bahan tersebut dapat dilindungi dari pengaruh lingkungan yang tidak menguntungkan seperti panas dan bahan kimia (Victor & Heldman. 2001). Metode yang dapat diterapkan antara lain; spray drying, penyalutan dengan suspensi udara, extrusion, spray cooling, coacervation, inklusi molekul (Arshady 1993).Pada penelitian ini digunakan metode spray drying karena merupakan metode yang paling umum digunakan untuk mikroenkapsulasi. Menurut Jyothi et al. (2010) spray drying
merupakan metode mikroenkapsulasi yang tergolong murah dibandingkan dengan metode lainya. Pada penelitian ini digunakan teknik mikroenkapsulasi spray drying dengan berbagai bahan penyalut antara lain: protein whey (Weinbreck et al. 2010), maltodekstrin (Munoz-Celaya et al. 2012, Wang et al. 2013), dan gabungan keduanya. Protein whey dipilih sebagai bahan penyalut karena diketahui memiliki sifat permeabilitas oksigen yang relatif rendah (Weinbreck et al. 2010). Maltodekstrin dipilih karena bahan tersebut memiliki karakteristik tidak higroskopis, mampu meningkatkan viskositas produk, memiliki kemampuan daya rekat yang baik (Koswara 2009). Penggunaan berbagai bahan penyalut tersebut bertujuan untuk menghasilkan barier fisik bagi probiotik, kriteria yang diterapkan adalah melihat sejauh mana kemampuannya dalam menghasilkan mikrokapsul probiotik yang secara fisik berbentuk powder dan mampu mempertahankan viabilitas dari probiotik selama penyimpanan pada suhu 27 oC dan 4 oCbaik aerob dan anaerob. Hasil mikrokapsul probiotik dengan penyalut terbaik akan diaplikasikan melalui berbagai dosis pakan pada ikan nila. Penerapan berbagai dosis tersebut diharapkan mampu menggambarkan efisiensi pemberiannya selama pemeliharaan sehingga mampu membangkitkan respons imun non spesifik guna pencegahan infeksi yang disebabkan oleh S.agalactiae pada ikan nila.
Perumusan Masalah
Intensifikasi budidaya ikan nila yang kurang memperhatikan kondisi lingkungan dapat menimbulkan berbagai dampak negatif antara lain timbulnya penyakit. Salah satu masalah utama pada budidaya ikan nila saat ini yaitu wabah penyakit Streptococcosis yang disebabkan oleh bakteri Streptococcus agalactiae. Bakteri S. agalactiae dapat menyebabkan kematian yang tinggi dan kerugian ekonomi yang cukup besar dalam budidaya ikan nila. Upaya pencegahan penyakit
Streptococcosis, salah satunya dengan penggunaan probiotik sebagai biokontrol. Bakteri probiotik harus mampu bertahan selama proses pencernaan. Salah satu metode yang dapat diterapkan adalah mikroenkapsulasi untuk menghasilkan perlindungan bakteri terhadap pengaruh kondisi lingkungan. Namun belum ada informasi terkait dengan bahan penyalut yang terbaik untuk mikroenkapsulasi probiotik serta dosis aplikasinya dalam pakan untuk pencegahan penyakit
3
Tujuan Penelitian
Penelitian bertujuan mendapatkan mikrokapsul probiotik dengan bahan penyalut terbaik dari penggunaan berbagai bahan penyalut berupa whey, maltodekstrin dan gabungan keduanya serta dosis terbaik dari pemberian mikrokapsul probiotik dengan dosis 0.5%, 1% dan 2% (w/w) dalam pakan guna membangkitkan respons imun non spesifik dalam upaya pencegahan penyakit
Streptococcosis.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi terkait dengan penggunaan bahan penyalut terbaik yang menghasilkan barier ketahanan viabilitas fisik mikrokapsul probiotik dan efisiensi pemberian dosis mikrokapsul probiotik melalui pakan untuk membangkitkan respons imun non spesifik dalam upaya pencegahan penyakit Streptococcosis.
Hipotesis
Hipotesis penelitian ini adalah pemberian mikrokapsul probiotik dengan bahan penyalut yang tepat dan dosis yang optimal melalui pakan dapat membangkitkan respons imun non spesifik dalam upaya pencegahan penyakit
Streptococcosis.
2
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan pada bulan September-Oktober 2013 & Maret-April 2014 bertempat di: (1) Laboratorium Kesahatan Ikan, Departemen Budidaya Peraiaran, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, (2) Laboratorium Biokimia, Institut Pertanian Bogor (3) Laboratorium SEAFAST Center, Institut Pertanian Bogor, (4) Laboratorium Teaching Farm, Institut Pertanian Bogor.
Perlakuan dan Rancangan Penelitian
4
Tabel 1 Perlakuan pemberian pakan mikrokapsul probiotik
Perlakuan Keterangan
K+ Pemberian pakan komersil dengan uji tantang K- Pemberian pakan komersil tanpa uji tantang
A Pemberian pakan & penambahan dosis 0.5% mikrokapsul probiotik (w/w) setiap hari dengan uji tantang
B Pemberian pakan & penambahan dosis 1% mikrokapsul probiotik (w/w) setiap hari dengan uji tantang
C Pemberian pakan dan penambahan dosis 2% mikrokapsul probiotik (w/w) setiap hari dengan uji tantang
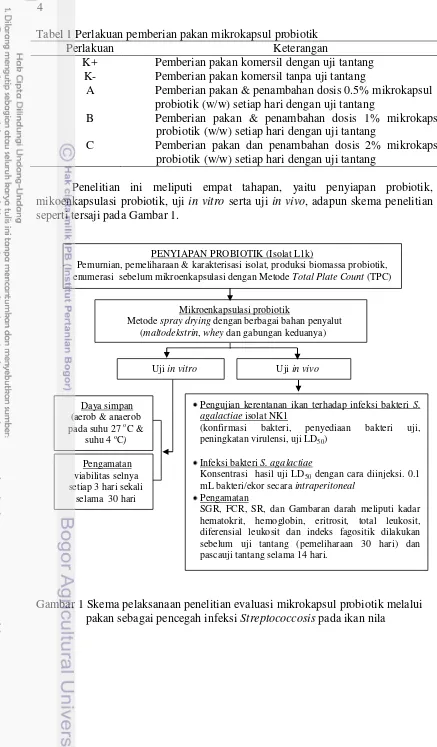
Penelitian ini meliputi empat tahapan, yaitu penyiapan probiotik, mikoenkapsulasi probiotik, uji in vitro serta uji in vivo, adapun skema penelitian seperti tersaji pada Gambar 1.
Gambar 1 Skema pelaksanaan penelitian evaluasi mikrokapsul probiotik melalui pakan sebagai pencegah infeksi Streptococcosis pada ikan nila
PENYIAPAN PROBIOTIK (Isolat L1k)
Pemurnian, pemeliharaan & karakterisasi isolat, produksi biomassa probiotik, enumerasi sebelum mikroenkapsulasi dengan Metode Total Plate Count (TPC)
Mikroenkapsulasi probiotik
Metode spray drying dengan berbagai bahan penyalut (maltodekstrin, whey dan gabungan keduanya)
Uji in vitro Uji in vivo
Pengujian kerentanan ikan terhadap infeksi bakteri S. agalactiae isolat NK1
(konfirmasi bakteri, penyediaan bakteri uji, peningkatan virulensi, uji LD50)
Infeksi bakteri S. agalactiae
Konsentrasi hasil uji LD50 dengan cara diinjeksi. 0.1
mL bakteri/ekor secara intraperitoneal
Pengamatan
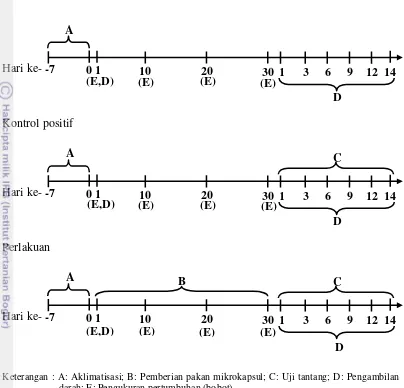
5 Berikut adalah alur kegiatan penelitian yang dilakukan, seperti tersaji pada Gambar 2.
Hari ke-
Kontrol positif
Hari ke-
Perlakuan
Hari ke-
-7 0 1 10 20 30 1 3 6 9 12 14
A
D
-7 0 1 10 20 30 1 3 6 9 12 14
A
D C
-7 0 1 10 20 30 1 3 6 9 12 14
A B
D C
(E,D) (E) (E) (E)
(E,D) (E) (E) (E)
(E,D) (E) (E) (E)
Keterangan : A: Aklimatisasi; B: Pemberian pakan mikrokapsul; C: Uji tantang; D: Pengambilan darah; E: Pengukuran pertumbuhan (bobot)
Gambar 2 Alur kegiatan penelitian meliputi perlakuan dan aktivitas sampling
Penyiapan probiotik
a) Isolat bakteri
Isolat bakteri L1k merupakan kandidat probiotik hasil dari penelitian Firdaus (2012) yang teridentifikasi sebagai bakteri Staphylococcus sp. Media pertumbuhan yang digunakan adalah Trypticase soy agar (TSA) dengan komposisi per-Liternya: 30 gram Trypticase soy broth (TSB), 17 gram Bacto agar
dan akuades. Medium disterilisasi di dalam autoklaf pada suhu 121 °C selama 15 menit.
b) Konfirmasi isolat
6
Gram positif dengan morfologi sel coccus (bulat) serta penataan koloni sel
diplococcus. Hasil uji biokimia menunjukkan bahwa uji fermentatif positif, katalase positif, oksidase negatif dan bersifat non-motil (Lampiran 1). Isolat L1k merupakan bakteri proteolitik hasil isolasi pada usus ikan lele yang berasal dari Parung Kabupaten Bogor (Firdaus 2012).
c) Produksi biomassa probiotik
Pembuatan biomassa, biakan murni ditumbuhkan ke dalam 10 mL medium TSB dan diinkubasi pada suhu 37 °C dalam waktu 24 jam. Kemudian sebanyak 10 mL kultur tersebut ditumbuhkan pada 100 mL TSB selanjutnya dikultur kembali dalam 1000 mL TSB dalam kondisi dan waktu pertumbuhan yang sama. Pemanenan biomassa dilakukan dengan cara sentrifugasi selama 20 menit dengan kecepatan 5000 rpm pada suhu 4 °C untuk memisahkan padatan sel bakteri, dan selanjutnya dicuci sebanyak dua kali dengan larutan PBS (Phosphat Buffer Saline). Biomassa yang diperoleh, diresuspensikan dengan akuades steril dan bahan penyalut berupa dekstrin 10% dan protein whey, serta gabungan keduanya. Perbandingan biomassa dan bahan penyalut yang digunakan adalah 1:1 (b/v) (Zubaidah 2014).
d) Enumerasi probiotik sebelum mikroenkapsulasi
Enumerasi bakteri sebelum mikroenkapsulasi dihitung pada starter dan pada campuran biomassa dengan bahan penyalut. Enumerasi bakteri dilakukan dengan menggunakan metode Total Plate Count (TPC). Suspensi 1 mL diencerkan secara serial dalam akuades steril 9 mL dan dihomogenkan dengan
vorteks. Deret pengenceran dipersiapkan hingga 10-9. Selanjutnya sebanyak 0,1 mL dari masing-masing pengenceran kemudian disebarkan ke atas permukaan medium TSA dalam cawan petri dan diratakan dengan batang penyebar yang telah disterilkan. Proses tersebut dilakukan dengan dua pengulangan. Biakan kemudian diinkubasi selama 36-48 jam pada suhu 37 °C.
Mikroenkapsulasi probiotik
Bahan penyalut yang digunakan pada mikroenkapsulasi probiotik ini adalah protein whey, maltodekstrin, serta gabungan keduanya. Proses mikroenkapsulasi dilakukan dengan metode spray drying. Metode ini melibatkan dispersi bahan inti ke dalam larutan polimer, membentuk emulsi atau dispersi, diikuti dengan homogenisasi cairan, kemudian atomisasi campuran ke dalam
drying chamber (Jackson & Lee 1991).
Mikroenkapsulasi dilakukan melalui kultur probiotik dalam bentuk biomassa. Biomassa yang telah diperoleh, diresuspensikan dengan akuades steril dan dienkapsulasi dengan bahan penyalut berupa dekstrin 10%, protein whey dan gabungan keduanya. Perbandingan biomassa dan bahan penyalut adalah 1:1 (w/v) (Zubaidah 2014). Berbagai macam formulasi dihomogenasikan dengan mixer lalu dimikroenkapsulasi dengan BUCHI mini spray dryer dengan suhu inlet 131-133 o
7
Uji mikrokapsul probiotik secara in vitro
Mikrokapsul probiotik diuji daya simpannya secara aerob dan anaerob pada suhu 27 oC dan suhu 4 oC, selanjutnya akan diamati viabilitas selnya setiap 3 hari sekali selama 30 hari dengan cara plating. Viabilitas probiotik sebelum masa penyimpanan ditentukan dengan membandingkan jumlah sel hidup setelah mikroenkapsulasi dengan jumlah sel hidup sebelum mikroenkapsulasi.
Bakteri dihitung menggunakan metode Total Plate Count (TPC). Sebanyak 0,1 g mikrokapsul diencerkan secara serial dalam larutan PBS hingga 10-7 dan dihomogenkan dengan vorteks. Sebanyak 0,1 mL dari masing-masing pengenceran disebarkan ke atas permukaan medium TSA dalam cawan petri dan diratakan dengan batang penyebar steril. Proses tersebut dilakukan dengan dua pengulangan. Biakan diinkubasi selama 36-48 jam pada suhu 37 oC. Koloni yang terbentuk dihitung dengan satuan Colony Forming Unit (CFU). Perhitungan viabilitas probiotik setelah penyimpanan (enumerasi bakteri) dilakukan dengan menggunakan metode Total Plate Count (TPC).
Uji mikrokapsul probiotik secara in vivo
Persiapan hewan uji dan wadah penelitian
Ikan uji yang digunakan adalah ikan nila (Oreochromis niloticus) dengan strain nila Best (Bogor enhanced strain tilapia) sebanyak 10 ekor/akuarium dengan rerata bobot 10 g. Tempat pemeliharaan berupa akuarium berukuran 60x35x30 cm3 dengan volume air 30 liter. Sebelum diterapkan perlakuan, ikan nila diadaptasikan terlebih dahulu selama 10 hari.
Pengujian kerentanan ikan terhadap infeksi bakteri S. agalactiae
Isolat bakteri yang digunakan adalah isolat NK1 yang merupakan bakteri S. agalactiae yang diperoleh dari Laboratorium Kesahatan Ikan, Departemen Budidaya Peraiaran, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Isolat bakteri NK1 diisolasi dari otak ikan nila dari Kabupaten Klaten Jawa Tengah dan bersifat non-hemolitik (Hardi 2011). Pengujian kerentanan ikan terhadap infeksi bakteri S. agalactiae tipe non-hemolitik dilakukan dengan menggunakan metode LD50. Pengujian ini bertujuan untuk mengetahui jumlah bakteri yang dapat menyebabkan kematian ikan nila sebanyak 50% dari populasi dalam waktu 14 hari setelah infeksi. Adapun tahapan yang dilakukan pada uji LD50 ini, antara lain :
1) Konfirmasi bakteri uji
Isolat bakteri S. agalactiae tipe non-hemolitik terlebih dahulu diamati morfologi koloni, karakteristik biokimia dan sifat gram mengacu pada metode SNI 754.3 : 2009. Karakterisasi bakteri dilakukan untuk mengkonfirmasi isolat bakteri yang digunakan melalui beberapa uji yang diterapkan meliputi pewarnaan Gram, sifat biokimia, fisiologi bakteri.
Bakteri S. agalactiae merupakan spesies Streptococcal yang hanya pembawa antigen grup B atau grup B Streptococcus (GBS). Bakteri ini
8
fermentatif positif, katalase negatif, oksidase negatif dan bersifat non-motil serta pada uji hemolitik menunjukan non-hemolitik (Lampiran 3).
2) Penyediaan bakteri uji
Isolat stok bakteri S. agalactiae pada BHIA di agar miring diremajakan (fasase) dengan mengkultur isolat pada media agar miring yang dilakukan sebanyak 2 kali. Penyiapan inokulum S. agalactiae dilakukan dengan mengkultur dalam media cair (BHIB). Satu ose penuh biakan bakteri dari agar miring (BHIA) dikultur dalam 10 mL BHIB kemudian diinkubasi dalam water bath shaker pada 150 rpm pada suhu 29-30 oC selama 24 jam. Biakan yang diinkubasi 24 jam tersebut kemudian diambil 1 mL dimasukkan ke dalam 9 mL medium BHIB, diinkubasi dalam water bath shaker pada 150 rpm pada suhu 29-30 oC selama 24 jam setelah itu bakteri dipanen.
3) Peningkatan virulensi bakteri uji menunjukkan gejala klinis dan kematian. Kemudian ikan diisolasi untuk diambil satu ose dari organ ginjal, mata dan otak. Diinokulasikan dengan metode penggoresan pada media BHIA. Koloni yang tumbuh, diamati morfologi, karakteristik biokimia dan sifat Gram guna memastikan bakteri tersebut adalah spesies bakteri patogen yang diinfeksikan pada postulat Koch
kemudian bakteri tersebut digoreskan pada agar miring dan dilakukan kultur cair untuk dilakukan postulat Koch kembali untuk kedua kalinya.
4) Uji LD50
Uji LD50 dilakukan untuk mengetahui tingkat kepadatan bakteri yang menyebabkan kematian sebanyak 50% populasi ikan dalam waktu 14 hari setelah penginfeksian. Ikan nila dengan rerata bobot 10 g sebanyak 10 ekor/akuarium diinjeksi bakteri dengan volume 0,1 mL/ekor secara
9
Persiapan pakan dan pemberian pakan
Pakan yang digunakan pada penelitian ini berupa pellet terapung (F999) dengan kadar protein 38%. Pellet tersebut dicampur dengan mikrokapsul probiotik sesuai dengan dosis perlakuan dan diberi putih telur 2% sebagai binder, setelah itu pakan dikering anginkan. Pakan uji yang digunakan dianalisis proksimat (Lampiran 5). Hasil analisa proksimat pakan menunjukkan bahwa pada masing-masing perlakuan dengan penambahan mikrokapsul probiotik L1k menunjukkan adanya peningkatan kandungan protein dibandingkan dengan kontrol. Pemberian pakan dilakukan sebanyak 3 kali sehari pada pukul 08.00, 12.00, 16.00 WIB. Pemberian pakan perlakuan dilakukan selama 30 hari secara at satiation sebelum uji tantang, setelah uji tantang ikan uji diberi pakan komersil dan dilakukan pengamatan selama 14 hari.
Infeksi bakteri Streptococcus agalactiae
Setelah 30 hari ikan nila diberi pakan perlakuan, pada hari ke-31 dipuasakan dan selanjutnya pada hari ke-32 diuji tantang dengan bakteri S. agalactiae dengan konsentrasi hasil uji LD50 dengan diinjeksi secara
intraperitoneal sebanyak 0,1 mL suspensi sel/ekor. Ikan yang telah diinfeksi dipelihara selama 14 hari dan dilakukan pengamatan.
Parameter Pengamatan
Tingkat kelangsungan hidup
Tingkat kelangsungan hidup atau Survival rate (SR) ikan uji dapat diketahui dengan perhitungan rumus (Effendie 1997). Pengamatan dilakukan selama 14 hari setelah ikan nila diinfeksi oleh bakteri S.agalactiae.
Laju pertumbuhan spesifik
Laju pertumbuhan harian atau Specific grow rate (SGR) dihitung dengan menggunakan rumus (Huisman 1987). Pengukuran parameter ini dilakukan setiap sepuluh hari sekali selama masa pemeliharaan.
Rasio konversi pakan
Rasio konversi pakan atau Feed conversion rasio (FCR). Pengukuran parameter ini dilakukan setiap sepuluh hari sekali selama masa pemeliharaan.
Gambaran darah
Pengamatan dilakukan 4 kali yaitu pada pra perlakuan, pascapemberian pakan perlakuan, pascauji tantang dan pada akhir pengamatan. Kegiatan ini dilakukan dengan mengambil sampel uji sebanyak 1 ekor/perlakuan untuk melihat kadar hematokrit, kadar hemoglobin, total eritrosit, total leukosit, diferensial leukosit dan indeks fagositik.
10
untuk mengetahui kondisi kesehatan ikan dengan cara menghitung total eritrosit dalam darah (Syawal et al. 2008). Pemeriksaan total leukosit juga bertujuan untuk melihat status kesehatan ikan (Syawal et al. 2008). Pengamatan diferensial leukosit dilakukan untuk menentukan persentase tiap jenis leukosit yang ada di dalam darah (Mones 2008). Pengamatan ini menggunakan metode ThemL et al. (2004). Pengamatan dan penghitungan masing-masing jenis sel dilakukan hingga jumlah semua jenis sel mencapai 100, dan hasilnya dinyatakan dalam %. Perhitungan indeks fagositik mengacu pada metode Anderson dan Siwicki (1993). indeks fagositik diukur berdasarkan persentase sel-sel fagosit yang menunjukkan proses fagositosis dari 100 sel fagositik yang teramati.
Kualitas Air
Parameter kualitas air yang diukur adalah suhu, oksigen terlarut (DO), pH, pada setiap harinya dan TAN diukur setiap 10 hari selama pemeliharaan. Satuan dan alat pengukuran disajikan pada Tabel berikut ini :
Tabel 2 Satuan dan alat ukur parameter kualitas air
Parameter Satuan Alat Ukur
Suhu Faktor lingkungan seperti kualitas air merupakan hal penting dalam keberlangsungan kegiatan budidaya dan tidak dapat terpisahkan dengan keberadaan penyakit ketika kualitas air memburuk. Setiap organisme memiliki kisaran toleransi parameter kualitas air yang berbeda-beda. Hal ini dipengaruhi oleh jenis ikan, umur, jenis kelamin dan habitat ikan. Kondisi kualitas air selama penelitian dikontrol dalam kisaran normal untuk ikan nila yaitu suhu 26-27 oC, pH 6.48-6.59, DO 4.3-5.6 ppm dan TAN 0.12-0.35 mg L-1.
Analisis Data
Data yang diperoleh dari penelitian ini yang meliputi survival rate (SR), laju pertumbuhan harian dan parameter imun dianalisis menggunakan program Microsoft exel 2007, Minitab 16 lebih lanjut akan dilakukan uji lanjut Duncan, sedangkan untuk kualitas air akan dianalisis secara deskriptif.
Analisis Ekonomi
11
Hasil Uji Mikrokapsul Probiotik secara In Vitro
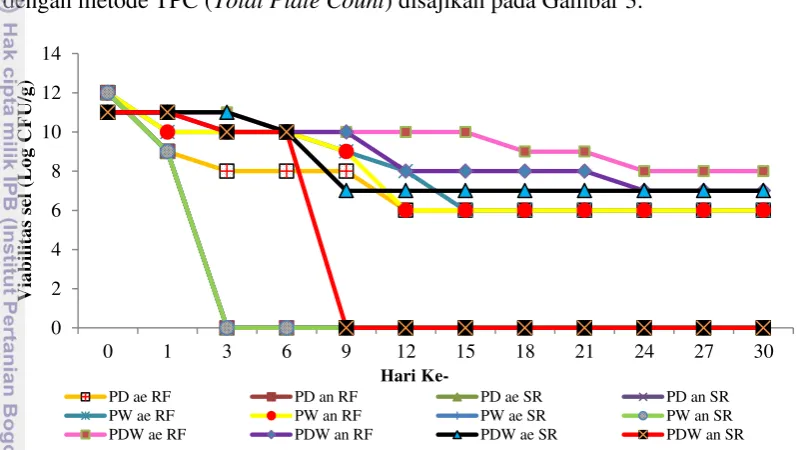
Hasil pengujian viabilitas mikrokapsul probiotik secara in vitro dengan berbagai bahan penyalut berupa maltodekstrin, whey dan gabungan keduanya dengan metode TPC (Total Plate Count) disajikan pada Gambar 3.
Gambar 3 Viabilitas mikrokapsul probiotik Viabilitas mikrokapsul probiotik L1k selama 30 hari dengan metode pengamatan Total Plate Count. PD: mikrokapsul probiotik dengan bahan penyalut maltodekstrin, PW: mikrokapsul probiotik dengan bahan penyalut whey, PDW: mikrokapsul probiotik dengan bahan penyalut gabungan (maltodekstrin dan whey), ae: penyimpanan secara aerob, an: penyimpanan secara anaerob, SR: suhu penyimpanan 27 oC dan RF: suhu penyimpanan 4 ºC Viabilitas sel pada awal pengamatan berkisar antara 1011-1012 CFU/g dan mengalami penurunan setelah mikroenkapsulasi berkisar antara 109-1011 CFU/g. Hal ini diduga akibat penggunaan suhu yang tinggi dalam proses mikroenkapsulasi yaitu penerapan suhu inlet 131-133 oC dan suhu outlet 65-70 °C. Bakteri setelah melalui proses mikroenkapsulasi akan mengalami penurunan viabilitas sel dalam waktu dua minggu (Weinbreck et al. 2010). Pada pengamatan sel hari ke-3 hingga hari ke-30, terjadi penurunan secara drastis pada sebagian perlakuan. Pada hari ke-12 hingga hari ke-30 perlakuan yang masih bertahan menujukan viabilitas berkisar antara 106-1010 CFU/g yaitu perlakuan dengan penggunaan penyalut whey saja dan gabungan maltodekstrin dan whey.
12
dikonsumsi adalah sebanyak 108-109 CFU/g (Kailasapathy 2002). Hasil mikrokapsul probiotik tidak hanya ditunjukkan dari tingkat viabilitas saja namun juga bentuk fisik, yang disajikan pada Tabel 3.
Tabel 3 Fisik mikrokapsul probiotik selama 30 hari
Bahan Penyalut Penyimpanan Bentuk Fisik (Tekstur) Maltodekstrin (PD)
aerob suhu 27 oC menggumpal lengket aerob suhu 4 oC serbuk agak lengket anaerob suhu 27 oC menggumpal lengket anaerob suhu 4 oC serbuk agak lengket Maltodekstrin dan
whey (PDW)
aerob suhu 27 oC serbuk agak menggumpal aerob suhu 4 oC serbuk
anaerob suhu 27 oC serbuk agak menggumpal anaerob suhu 4 oC serbuk
Hasil pengamatan struktur fisik menunjukkan bahwa penggunaan maltodekstrin maupun whey saja belum mampu mempertahankan tekstur mikrokapsul yang berupa serbuk. Bahan penyalut gabungan whey dan maltodekstrin (PWD) mampu mempertahankan struktur fisik mikrokapsul probiotik berupa serbuk hingga pengamatan 30 hari. Mikrokapsul probiotik berupa serbuk akan lebih mudah dalam aplikasi karena tidak meninggalkan sisa yang berarti pada wadah yang digunakan serta hasilnya pun lebih merata (homogen).
Salah satu faktor pendukung dari penggunaan maltodekstrin dan protein
whey sebagai bahan penyalut terbaik dalam proses mikroenkapsulasi. Maltodekstrin merupakan salah satu produk hasil hidrolisis pati dengan menggunakan asam maupun enzim, yang terdiri dari campuran glukosa, maltosa, oligosakarida, dan dekstrin (Deman 1993). Maltodekstrin mempunyai karakteristik yaitu tidak higroskopis, meningkatkan viskositas produk, mempunyai daya rekat, dan dapat larut dalam air (Koswara 2009). Protein whey
merupakan bahan pangan yang memiliki permeabilitas oksigen yang rendah serta memiliki sifat penghalang dan ketahanan terhadap pH rendah seperti di dalam lambung. Berdasarkan faktor pendukung dari keduanya serta hasil pengamatan selama 30 hari tersebut maka dihasilkan produk mikrokapsul probiotik terbaik dengan bahan penyalut gabungan antara maltodektrin dan protein whey untuk dapat digunakan pada uji in vivo dalam upaya pencegahan penyakit
Streptococcosis pada ikan nila melalui pakan (Alting et al.2009).
Hasil uji mikrokapsul probiotik secara in vivo
Efektifitas pemberian mikrokapsul probiotik sebelum uji tantang
Hasil pengamatan survival rate (SR), feed conversion rasio (FCR) dan
13 Tabel 4 Feed conversion rasio (FCR), specific grow rate (SGR), dan survival rate
(SR) dari pemberian mikrokapsul probiotik dengan dosis yang berbeda pada ikan nila selama pemeliharaan 30 hari
Pengamatan Perlakuan dosis mikrokapsul probiotik
K- K+ A (0.5%) B (1%) C (2%)
SGR (%) 2.37±0.03a 2.40±0.03 a 3.07±0.04b 3.10±0.09 b 3.40±0.04 b
FCR (%) 1.99±0.03c 1.97±0.08c 1.36±0.09b 1.27±0.04a 1.25±0.03a
SR (%) 100.00±0.00a 100.00±0.00a 100.00±0.00a 100.00±0.00a 100.00±0.00a Keterangan : huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (p<0,05) dan
dibaca dalam baris yang sama
Hasil pengamatan penambahan 0.5%, 1%, dan 2% mikrokapsul probiotik selama pemeliharaan 30 hari mampu meningkatkan SGR sebesar 3.07±0.26%, 3.10±0.29% dan 3.40±0.18% dan berbeda nyata (p<0.05) terhadap perlakuan kontrol tanpa penambahan mikrokapsul probiotik yang hanya sebesar 2.40±0.03%. Hasil tersebut menunjukkan bahwa penambahan mikrokapsul probiotik mampu memberikan pengaruh menguntungkan terhadap peningkatan pertumbuhan ikan nila. Semakin tinggi dosis yang digunakan, maka laju pertumbuhan semakin meningkat. Akbar (2013), menyatakan bahwa pemberian Probiotik L1k (tanpa mikroenkapsulasi untuk pengendalian Streptococcosis pada ikan nila dengan dengan dosis yang berbeda mampu meningkatkan laju pertumbuhan sebesar 1.68 berbeda nyata dengan kontrol (p<0.05) yang hanya sebesar 0.95. Hal ini disebabkan karena isolat bakteri L1k merupakan jenis bakteri proteolitik (Firdaus 2012). Probiotik dengan aktivitas proteolitik menjadi nilai lebih karena bermanfaat dalam proses perombakan makronutrien.
Peningkatan nilai nutrisi pakan probiotik memiliki mekanisme dalam menghasilkan beberapa enzim exogenous pencernaan pakan seperti amilase,
protease, lipase dan selulose. Enzim exogenous tersebut akan membantu enzim
endogenous di inang untuk menghidrolisis pakan (Wang et al. 2008). Aktivitas proteolitik enzim ini terjadi pada segmen usus yang umumnya menurun dari bagian depan ke arah belakang dan enzim ini resisten terhadap autolisis di dalam usus. Keberadaan bakteri proteolitik yang berperan sebagai probiotik mampu meningkatkan kandungan protein dalam pakan uji sehingga berdampak terhadap laju pertumbuhan spesifik ikan nila selama pemeliharaan. Hal tersebut akan meningkatkan ketersediaan nutrien yang siap diserap dari saluran pencernaan untuk masuk ke dalam pembuluh darah, dan akan diedarkan ke seluruh tubuh dan jaringan yang membutuhkan dalam proses metabolisme selanjutnya (Aslamsyah 2006). Semakin tinggi nutrien pakan yang tercerna, semakin besar pula nutrien tersebut dimanfaatkan oleh ikan untuk pertumbuhan dan menurunkan porsi nutrien yang terbuang ke lingkungan (Putra 2010).
14
menunjukkan bahwa dengan adanya penambahan mikrokapsul probiotik dalam pakan mampu memanfaatkan nutrien dalam pakan dengan optimal dan menggunakannya untuk pertumbuhan. Pemberian probiotik L1k (tanpa mikroenkapsulasi untuk pengendalian Streptococcosis pada ikan nila dengan dosis yang berbeda memberikan rasio konversi pakan sebesar 1.55 berbeda nyata (p<0.05) kontrol sebesar 2.49 (Akbar 2013).
Hasil pengamatan SR ikan nila setelah pemberian mikrokapsul probiotik sebelum uji tantang menunjukkan nilai sebesar 100±0.00% untuk semua perlakuan dan tidak berbeda nyata (p>0.05) dengan perlakuan kontrol. Berdasarkan hasil pengamatan tersebut memberi dugaan bahwa penambahan mikrokapsul probiotik sebelum uji tantang tidak berpengaruh terhadap tingkat kelangsungan hidup ikan karena tidak adanya perlawanan terhadap paparan antigen (uji tantang) yang merupakan wujud respons imun ikan.
Pengamatan respons imun
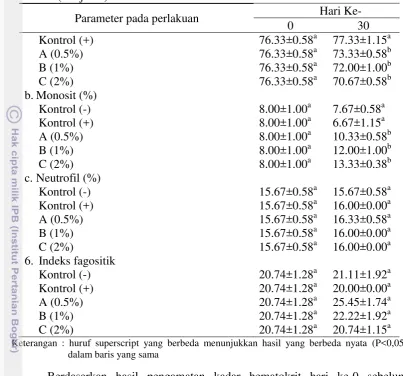
Hasil pengamatan gambaran darah ikan nila selama 30 hari pemberian mikrokapsul probiotik dengan dosis yang berbeda disajikan pada Tabel 5.
Tabel 5 Gambaran darah dari pemberian mikrokapsul probiotik dengan dosis yang berbedapada ikan nila selama pemeliharaan 30 hari
Parameter pada perlakuan Hari Ke-
0 30
Kontrol (-) 8.07±0.12a 8.40±0.35a
Kontrol (+) 8.07±0.12a 8.40±0.35a
A (0.5%) 8.07±0.12a 9.53±0.12b
B (1%) 8.07±0.12a 10.07±0.12b
C (2%) 8.07±0.12a 10.33±0.31c
3. Eritrosit (x 106 Sel/mm3)
Kontrol (-) 3.10±0.09a 3.17±0.01a
Kontrol (+) 3.10±0.09a 3.16±0.02a
A (0.5%) 3.10±0.09a 3.38±0.01b
B (1%) 3.10±0.09a 3.47±0.01b
C (2%) 3.10±0.09a 3.54±0.00c
4. Total leukosit (x 105 Sel/mm3)
Kontrol (-) 8.73±0.21a 9.27±0.25a
Kontrol (+) 8.73±0.21a 9.43±0.12a
A (0.5%) 8.73±0.21a 9.67±0.06a
B (1%) 8.73±0.21a 9.70±0.10a
C (2%) 8.73±0.21a 10.07±0.25b
5. Diferensial Leukosit a. Limfosit (%)
15 Tabel 5 (Lanjutan)
Parameter pada perlakuan Hari Ke-
0 30
Kontrol (+) 76.33±0.58a 77.33±1.15a
A (0.5%) 76.33±0.58a 73.33±0.58b
B (1%) 76.33±0.58a 72.00±1.00b
C (2%) 76.33±0.58a 70.67±0.58b
b.Monosit (%)
Kontrol (-) 8.00±1.00a 7.67±0.58a
Kontrol (+) 8.00±1.00a 6.67±1.15a
A (0.5%) 8.00±1.00a 10.33±0.58b
B (1%) 8.00±1.00a 12.00±1.00b
C (2%) 8.00±1.00a 13.33±0.38b
c.Neutrofil (%)
Kontrol (-) 15.67±0.58a 15.67±0.58a
Kontrol (+) 15.67±0.58a 16.00±0.00a
A (0.5%) 15.67±0.58a 16.33±0.58a
B (1%) 15.67±0.58a 16.00±0.00a
C (2%) 15.67±0.58a 16.00±0.00a
6. Indeks fagositik
Kontrol (-) 20.74±1.28a 21.11±1.92a
Kontrol (+) 20.74±1.28a 20.00±0.00a
A (0.5%) 20.74±1.28a 25.45±1.74a
B (1%) 20.74±1.28a 22.22±1.92a
C (2%) 20.74±1.28a 20.74±1.15a
Keterangan : huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05) dalam baris yang sama
Berdasarkan hasil pengamatan kadar hematokrit hari ke-0 sebelum pemberian suplementasi pakan dan hari ke-30 setelah suplementasi pakan menunjukkan nilai yang tidak berbeda nyata (p>0.05) dengan perlakuan kontrol. Hasil pengamatan hemoglobin pada hari ke-30 setelah pemberian pakan perlakuan menunjukan nilai yang berbeda nyata (p<0.05) dengan perlakuan kontrol. Peningkatan hemoglobin tertinggi ditunjukkan oleh penambahan 2% mikrokapsul probiotik sebesar 10.33±0.31%.
Hal ini mengindikasikan bahwa pemberian mikrokapsul probiotik berpengaruh positif terhadap peningkatan kadar hemoglobin ikan uji. Peningkatan juga terjadi pada pengamatan eritrosit pada penambahan 2% mikrokapsul probiotik sebesar 3.54±0.00x106 sel/mm3. Hemoglobin merupakan protein di dalam eritrosit yang tersusun atas protein globin yang tidak berwarna dan pigmen heme (Lagler et al. 1977). Ada indikasi keterkaitan kadar eritrosit dengan kandungan hemoglobin dan hematokrit (Fujaya 2004).
Pengamatan total leukosit hari ke-30 setelah pemberian pakan perlakuan pada penambahan 2% mikrokapsul probiotik menunjukan nilai yang berbeda nyata (p<0.05) dengan perlakuan kontrol. Hasil tersebut merupakan nilai tertinggi dibandingkan perlakuan lainnya yaitu sebesar 10.07±0.25(x 105 sel/mm3).
16
hari ke-0 sebelum pemberian pakan perlakuan dan hari ke-30 setelah pemberian pakan perlakuan dengan penambahan dosis mikrokapsul probiotik menunjukan peningkatan limfosit dan monosit tidak berbeda nyata (p>0.05) dengan perlakuan kontrol. Namun, hasil pengamatan indeks fagositik pada hari ke-30 setelah pemberian pakan perlakuan dengan penambahan dosis mikrokapsul probiotik menunjukan nilai yang tidak berbeda nyata (p>0.05) dengan perlakuan kontrol. Berdasarkan hasil pengamatan tersebut memberi dugaan bahwa penambahan mikrokapsul probiotik sebelum uji tantang tidak berpengaruh terhadap tingkat kelangsungan hidup ikan karena tidak adanya perlawanan terhadap paparan antigen (uji tantang) yang merupakan wujud respons imun ikan.
Efektifitas pemberian mikrokapsul probiotik pascauji tantang
Hasil pengamatan respons imun
Pengaruh penambahan mikrokapsul probiotik pada pakan terhadap kadar hematokrit ikan nila pascauji tantang pada pemeliharaan 14 hari disajikan pada Gambar 4.
Gambar 4 Hematokrit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0,5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan mikrokapsul probiotik 2%
Berdasarkan hasil pengamatan dapat dilihat bahwa pada pengamatan hematokrit sebelum uji tantang menunjukan nilai yang tidak berbeda nyata (p>0.05). Namun, pascauji tantang nilai tertinggi kadar hematokrit ditunjukkan oleh penambahan 2% mikrokapsul probiotik pada hari ke-12 sebesar 29.85±2.42% berbeda nyata (p<0.05) dengan kontrol yang hanya sebesar 15.53±0.46% dan perlakuan lainya yaitu penambahan 0.5% dan 1% mikrokapsul probiotik sebesar 22.78±2.55% dan 23.08±0.00%. Hal ini mengindikasikan bahwa ada pengaruh penambahan mikrokapsul probiotik terhadap peningkatan kadar hematokrit ikan nila. Kadar hematokrit berkorelasi dengan kadar hemoglobin melalui proses pengangkutan oksigen dalam darah sebagai pengedar nutrien untuk menghasilkan energi dan membawa hormon atau enzim ke seluruh jaringan sel tubuh.
Pengamatan kadar hemoglobin setelah uji tantang dengan S. agalactiae pada pemeliharaan 14 hari disajikan pada Gambar 5.
17
Gambar 5 Kadar hemoglobin ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan mikrokapsul probiotik 2%
Berdasarkan Gambar 5 dapat dilihat bahwa pada pengamatan sebelum uji tantang, yaitu setelah pemberian pakan dengan penambahan mikrokapsul probiotik selama 30 hari. Nilai tertinggi kadar hemoglobin ditunjukkan oleh penambahan 2% mikrokapsul probiotik. Setelah dilakukan uji tantang, pada pengamatan hari ke-3 pascainfeksi, menunjukkan adanya peningkatan kadar hemoglobin dari penambahan 2% mikrokapsul probiotik dan berbeda nyata (p<0.05) dengan kontrol positif yang hanya sebesar 6.60±0.53 g/%.
Pada makhluk hidup, kondisi anemia sangat berkaitan dengan adanya hemoglobin (Hb). Kadar hemoglobin memiliki fungsi untuk mengikat oksigen yang akan digunakan dalam proses katabolisme yang menghasilkan energi. Hemoglobin merupakan protein di dalam eritrosit yang tersusun atas protein
globin yang tidak berwarna dan pigmen heme. Kadar hemoglobin dalam darah menentukan kemampuan darah dalam pengangkutan oksigen (Lagler et al. 1977).
Pengamatan kadar eritrosit setelah uji tantang dengan S. agalactiae pada pemeliharaan 14 hari disajikan pada Gambar 6.
18
Berdasarkan hasil pengamatan Gambar 6 dari penambahan 0.5%, 1%, dan 2% mikrokapsul probiotik setelah uji tantang selama 14 hari mampu meningkatkan kadar eritrosit dan berbeda nyata (p<0.05) dengan kontrol.
Pada umumnya darah berfungsi sebagai media pengedar nutrien yang berasal dari pencernaan makanan ke sel-sel tubuh, pengangkut oksigen, membawa hormon dan enzim ke organ tubuh yang memerlukannya (Larger et al. 1977). Pada perlakuan kontrol positif cenderung kadar eritrosit mengalami penurunan setelah diuji tantang, rendahnya nilai tersebut mengidikasikan infeksi yang disebabkan oleh bakteri S. agalactiae mampu menyebabkan kerusakan pada organ ginjal. Ginjal merupakan organ penghasil eritrosit sehingga bila terjadi kerusakan atau gangguan pada organ ginjal maka akan berpengaruh terhadap produksi eritrosit yang menurun.
Pada masing-masing perlakuan pascapemberian pakan mikrokapsul probiotik terlihat adanya peningkatan nilai eritrosit. Hal tersebut mengindikasikan bahwa pemberian mikrokapsul probiotik L1k berpengaruh terhadap peningkatan leukosit. Akbar (2013), menyatakan bahwa pemberian probiotik L1k (tanpa mikroenkapsulasi untuk pengendalian Streptococcosis pada ikan nila dengan dengan dosis yang berbeda) memberikan efek peningkatan nilai eritrosit pascapemberian pakan perlakuan yaitu sebesar 2.99 x106 Sel/mm3 berbeda nyata (p<0.05) dengan kontrol positif yang hanya sebesar 2.81 x106 Sel/mm3.
Pascauji tantang peningkatan nilai leukosit juga masih terjadi, hal ini mengindikasikan bahwa infeksi S. agalactiae berdampak pada pengiriman sel leukosit lebih banyak ke area infeksi sebagai upaya pertahanan. Sel-sel leukosit tersebut bekerja untuk memfagosit bakteri agar tidak dapat berkembang dan menyebarkan virulensi dalam tubuh inang setelah uji tantang (Hardi 2011). Respons ikan terhadap stresor tergantung pada jenis stres yang dialami ikan berupa peningkatan sel leukosit (sel darah putih) akan menurunkan kadar hematokrit dan meningkatkan neutrofil (Martin et al. 2004).
Pengamatan kadar leukosit setelah uji tantang dengan S. agalactiae pada pemeliharaan 14 hari disajikan pada Gambar 7.
Gambar 7 Total leukosit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan mikrokapsul probiotik 2%
Hasil pengamatan setelah uji tantang menunjukan nilai yang berbeda nyata (p<0.05). Mulai hari ke-9 penambahan 0.5%, 15, dan 2% mikrokapsul probiotik menunjukkan nilai lebih tertinggi sebesar 9.23x105 Sel/mm3 hingga 11.00x105 Sel/mm3 berbeda nyata (p<0.05) dengan kontrol sebesar 6.93 x105 Sel/mm3.
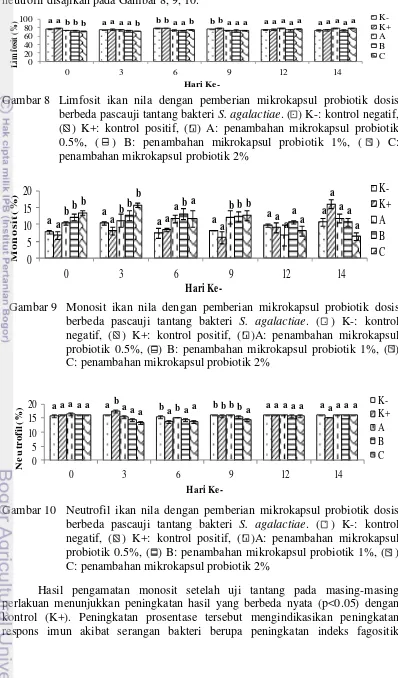
19 Hasil pengamatan diferensial leukosit berupa limfosit, monosit, dan neutrofil disajikan pada Gambar 8, 9, 10.
Gambar 8 Limfosit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( ) A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan mikrokapsul probiotik 2%
Gambar 9 Monosit ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan mikrokapsul probiotik 2%
Gambar 10 Neutrofil ikan nila dengan pemberian mikrokapsul probiotik dosis berbeda pascauji tantang bakteri S. agalactiae. ( ) K-: kontrol negatif, ( ) K+: kontrol positif, ( )A: penambahan mikrokapsul probiotik 0.5%, ( ) B: penambahan mikrokapsul probiotik 1%, ( ) C: penambahan mikrokapsul probiotik 2%
Hasil pengamatan monosit setelah uji tantang pada masing-masing perlakuan menunjukkan peningkatan hasil yang berbeda nyata (p<0.05) dengan kontrol (K+). Peningkatan prosentase tersebut mengindikasikan peningkatan respons imun akibat serangan bakteri berupa peningkatan indeks fagositik
20
meliputi sel monosit yang merupakan salah satu sel fagosit sebagai sistem pertahanan non spesifik. Sel monosit ikan berbentuk bulat (oval), inti terletak di tengah sel dengan sitoplasmanya yang tidak berglanular (Takashima dan Hibiya 1995).
Sel monosit memiliki kemampuan yang lebih kuat dalam memfagosit antigen dibandingkan sel neutrofil (Fujaya 2004). Cara kerja sel monosit dalam membunuh (melisis) sel bakteri, proses tersebut terdapat pada fase kemotaksis, fase penempelan, penangkapan, pemakanan dan pembunuhan bakteri (Amrullah 2004). Sel monosit dapat menyediakan diri dengan cepat pada daerah inflamasi, memakan agen penyebab luka apabila terjadi serangan suatu penyakit (Mulyani 2006).
Monosit merupakan salah satu sel fagosit peran penting dalam upaya menghancurkan patogen serta berperan pula sebagai antigen presenting cells
(APC) yang berfungsi menyajikan antigen kepada sel limfosit (Kollner et al. 2002). Monosit berasal dari sel progenitor umum dalam sumsum tulang. Setelah berpoliferasi dan matang, sel ini akan masuk ke dalam peredaran darah. Sel ini tidak hanya menyerang mikroba dan sel kanker namun juga berperan dalam memproduksi sitokin sebagai bentuk pertahanan dan dalam remodeling serta perbaikan jaringan bahkan sumber beberapa komplemen penting (Baratawidjaja 2006).
Hasil pengamatan neutrofil menunjukkan bahwa pemberian pakan mikrokapsul probiotik sebelum infeksi S. agalactiae pada masing-masing perlakuan menunjukan nilai yang tidak berbeda nyata (p>0.05) dengan kontrol (K+), namun setelah uji tantang menunjukkan penurunan hasil yang berbeda nyata (p<0.05) dengan kontrol (K+). Hal tersebut disebabkan oleh adanya infeksi setelah uji tantang sebagai respons perlawanan terhadap patogen pascauji tantang dari pengaruh penambahan mikrokapsul probiotik melalui pakan pada ikan nila terhadap jumlah neutrofil ikan. Sel neutrofil berfungsi untuk melawan penyakit bersama-sama dengan eosinofil dalam melawan bakteri dan virus (Chinabut et al. 1991).
Pengamatan pengaruh penambahan mikrokapsul probiotik pada pakan terhadap indeks fagositik disajikan pada Gambar 11.
21 Hasil pengamatan menunjukkan bahwa peningkatan indeks fagositik setelah uji tantang dari penambahan 0.5%, 1%, dan 2% mikrokapsul probiotik. Peningkatan tertinggi terjadi pada penambahan 2% mikrokapsul probiotik hari ke-9 dan berbeda nyata (p<0.05) dengan kontrol positif. Peningkatan nilai indeks fagositik diindikasikan karena selama uji tantang, proses fagositosis meningkat untuk melawan antigen (bakteri patogen) yang masuk ke dalam tubuh ikan, hal tersebut merupakan reaksi sistem imun non spesifik yang diperoleh dari pemberian pakan mikrokapsul probiotik. Ikan memiliki sistem kekebalan untuk mengantisipasi infeksi mikroorganisme melalui populasi sel B dan sel T sangat berperan dalam respons imun baik selular maupun humoral (Alifuddin 2002).
Respons selular merupakan respons yang bersifat non spesifik yang dilakukan oleh cell mediated immunity sedangkan respons imun humoral bersifat spesifik terkait dengan adanya produksi antibodi (immunoglobulin Ig) (Anderson 1974 dalam La sennung 2012). Respons imun non spesifik jumlahnya dapat meningkat karena infeksi oleh patogen yaitu meningkatnya jumlah leukosit selama fase akut pada infeksi penyakit, seperti diketahui bahwa sistem ini merupakan pertahanan terdepan dalam menghadapi infeksi serangan oleh patogen (Baratawidjaja 2006).
Hasil pengamatan survival rate (SR)pascauji tantang
Survival rate (SR) atau tingkat kelangsungan hidup ikan nila pascauji tantang dengan bakteri S. agalactiae tipe non-hemolitik (103 CFU/mL) secara
intraperitoneal. Data hasil pengamatan disajikan pada Gambar 12.
Gambar 12 Survival rate (SR) ikan nila pascauji tantang pada perlakuan mikrokapsul probiotik dengan dosis berbeda. K(-): kontrol negatif, K(+): kontrol positif, A: penambahan mikrokapsul probiotik 0.5% pada pakan, B: penambahan mikrokapsul probiotik 1% pada pakan, dan C: penambahan mikrokapsul probiotik 2% pada pakan. ( ) pengamatan SR setelah uji tantang
Survival rate (SR) ikan nila sebelum uji tantang untuk semua perlakuan adalah 100±0.00%. Pada pascauji tantang dengan pengamatan selama 14 hari, SR tertinggi terdapat pada penambahan 2% mikrokapsul probiotik sebesar 80.00±0.00% berbeda nyata (p<0.05) terhadap kontrol positif sebesar 50.00±0.00%. Pascainfeksi bakteri S. agalactiae NK1 juga menunjukan adanya perubahan gejala klinis.
Tingkat kelangsungan hidup tertinggi tersebut mengindikasikan bahwa pemberian mikrokapsul probiotik memberikan efek positif untuk peningkatan resistensi ikan nila terhadap infeksi S. agalactiae tipe non-hemolitik. Selain itu, adanya penambahan probiotik Staphylococcus sp L1k pada usus ikan secara nyata