MASKULINISASI BELUT SAWAH (Monopterus albus)
MELALUI INDUKSI AROMATASE Inhibitor DAN SUHU
HAFIF SYAHPUTRA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Maskulinisasi Belut Sawah (Monopterus albus) Melalui Induksi Aromatase Inhibitor dan Suhu adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Hafif Syahputra
RINGKASAN
HAFIF SYAHPUTRA. Maskulinisasi Belut Sawah (Monopterus albus) Melalui Induksi Aromatase Inhibitordan Suhu. Dibimbing oleh AGUS OMAN SUDRAJAT dan DINAR TRI SOELISTYOWATI.
Belut Sawah (Monopterus albus) tergolong ikan hermaprodit protogini yang pada awal hidupnya berjenis kelamin betina kemudian melalui fase interseks berubah menjadi jantan. Masa diferensiasi menjadi jantan belum diketahui secara pasti sehingga menjadi kendala ketersediaan sinkronisasi kelamin jantan dan betina yang matang untuk proses reproduksi. Penelitian ini bertujuan untuk memaskulinisasi belut sawah menjadi jantan dengan mengevaluasi mekanisme sex reversal. Materi uji yang digunakan adalah belut sawah sebanyak 120 ekor dengan ukuran panjang tubuh 24±2 cm asal Bogor. Penelitian ini menggunakan rancangan acak lengkap (RAL) dengan 5 perlakuan. Ikan yang digunakan sebanyak 24 ekor per perlakuan. Induksi pengarahan kelamin jantan dilakukan dengan penyuntikan aromatase inhibitor (AI) menggunakan imidazole pada dosis berbeda (0,001; 0,01; 0,1 mg/kg bobot ikan) dibandingkan dengan perlakuan suhu 32ºC dan NaCl 0,95% sebagai Kontrol. Penyuntikkan AI dilakukan setiap minggu selama empat minggu. Sedangkan perlakuan suhu 32ºC diberikan selama enam minggu. Ikan dipelihara dalam akuarium yang berukuran 80x40x40 cm per perlakuan selama enam minggu. Belut sawah yang diberi perlakuan NaCl dan AI dipelihara pada suhu 28ºC.
Hasil penelitian menunjukkan bahwa aromatase inhibitor meningkatkan konsentrasi testosteron plasma. Perlakuan AI 0,1 mg/kg bobot ikan meningkatkan konsentrasi testosteron yang tertinggi yaitu 1,89 ng/ml pada minggu ke-6 atau tiga kali lipat dibandingkan dengan Kontrol (0,49 ng/ml). Sebaliknya, konsentrasi estradiol tertekan pada perlakuan AI 0,01 dan 0,1 mg/kg bobot ikan pada minggu ke-6. Pengarahan kelamin jantan dengan aromatase inhibitor 0,1 mg/kg bobot ikan menghasilkan 40% jantan dan 60% interseks dalam waktu enam minggu. Pada perlakuan AI 0,001 dan 0,01 mg/kg bobot ikan dihasilkan individu interseks 50%-85,72% dan betina 14,28%-50%, sedangkan dengan induksi suhu 32ºC menghasilkan 83,33% interseks dan 16,66% betina.
Pemberian aromatase inhibitor pada belut dengan dosis 0.1 mg/kg ikan telah menyebabkan biosintesis estradiol dari testosterone terhambat, sehingga konsentrasi estradiol plasma rendah, sementara konsentrasi testosteron meningkat secara signifikan. Hal tersebut menginduksi maskulinisasi belut ukuran 24±2cm. Sedangkan perlakuan suhu 32ºC belum efektif dalam menginduksi maskulinisasi dan menghasilkan individu interseks. Peningkatan dosis AI diduga dapat meningkatkan efektivitas maskulinisasi pada belut.
Aromatase inhibitor mampu memaskulinisasi belut sawah pada ukuran 24±2 cm melalui mekanisme peningkatan konsentrasi testosteron plasma endogenous dan penurunan konsentrasi estradiol plasma endogenous dalam waktu enam minggu.
SUMMARY
HAFIF SYAHPUTRA. Masculinization of the Ricefield Eel (Monopterus albus)
By Induction of Aromatase Inhibitor and Temperature. Supervised by AGUS OMAN SUDRAJAT and DINAR TRI SOELISTYOWATI.
Ricefield eel (Monopterus albus) is hermaphrodite protoginy fish that in their early life belong to female sex and through a phase of intersex then they differenciate into male sex. The period of differentiation from females to males is not clear, so that the synchronization the availability of matured male and female constrainted for the reproductive processes. This study aimed to masculinisize ricefield eel to the male sex. The masculinization was performed by induction the different doses of aromatase inhibitor (AI) applying imidazole of 0,001; 0,01; 0,1 mg/kg of fish weight in comparison to the temperature at 32°C and NaCl 0.95% as control. The experiment was conducted using 24 fish each treatment which were collected from Bogor with a total length of 24±2 cm. The AI was injected every week for four weeks. All of fish groups of treatment were cultured for 6 weeks of rearing period in aquarium sized 80x40x40 cm. The AI and NaCl 0.95% treated-fishes were cultured in 28°C water temperature.
The results showed that aromatase inhibitor increased the concentration of plasma testosterone. The dose of AI 0.1mg/kg body weight accelerated the concentration of plasma testosterone at six week the highest (1.89 ng/ml) or increased three fold in comparison with the controls (0.49 ng/ml). In contrast, the doses of AI 0.01 and 0.1mg/kg body weight depressed estradiol concentrations. The masculinization applying with aromatase inhibior 0.1mg/kg body weight resulted 40% of males and 60% intersexes within sixweeks, while the induction of temperature at 32ºC produced 83.33% intersexes and 16.66% females. Whereas, the treatment of AI 0.001 and 0.01mg/kg body weight produced 50%-85.72% intersexes and 14.28% -50% females.
Implementation the dose of aromatase inhibitor 0.1 mg/kg of fish has led to the biosynthesis of estradiol from testosterone inhibited. So that the plasma estradiol concentrations was lower when the concentrations of testosterone increased significant in the ricefield eel. The AI induced masculinization of ricefield eel at size of 24±2 cm. While the treatment of temperature 32ºC was not effective in masculinization but it just induced to intersexes. Increasing the AI doses might accelerate the effectiveness of masculinization of the ricefield eel.
Aromatase inhibitors are able to induce the masculinization of ricefield eel through the mechanism of increasing plasma testosterone concentrations and decreasing plasma estradiol concentrations within six weeks.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
MASKULINISASI BELUT SAWAH (Monopterus albus)
MELALUI INDUKSI AROMATASE INHIBITOR DAN SUHU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Maskulinisasi Belut Sawah (Monopterus albus) Melalui Induksi Aromatase Inhibitordan Suhu
Nama : Hafif Syahputra NIM : C151114021
Disetujui oleh Komisi Pembimbing
Dr Ir Agus Oman Sudrajat, MSc Ketua
Dr Ir Dinar Tri Soelistyowati, DEA Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia-Nya sehingga penulis dapat menunaikan tugas akhir pendidikan pascasarjana pada program studi Ilmu Akuakultur, Institut Pertanian Bogor. Dengan menyelesaikan penelitian yang berjudul “Maskulinisasi Belut Sawah
(Monopterus albus) Melalui Induksi Aromatase Inhibitor dan Suhu” yang telah dilaksanakan pada bulan September-Desember 2013 yang bertempat di Kolam Percobaan Babakan, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. Analisis hormon testosteron dan estradiol dilakukan di Laboratorium Unit Reproduksi dan Rehabilitasi Fakultas Kedokteran Hewan dan histologi gonad dilakukan di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan Institut Pertanian Bogor.
Penulis mengucapkan terimakasih kepada Bapak Dr Ir Agus Oman Sudrajat MSc dan Ibu Dr Ir Dinar Tri Soelistiyowati DEA selaku dosen pembimbing yang telah banyak memberikan saran, arahan dan bimbingan selama penulis melakukan penelitian. Penulis mengucapkan terimakasih kepada Ayah dan Ibu yang tidak lelah untuk mendidik dan selalu memberi dukungan baik moral maupun materi. Terimakasih kepada kak Melati, Bang Fanda, Dila, Mizan, Dani, Rafli dan Bila yang selalu memberi semangat. Terimakasih kepada teman-teman Akuakultur Bang Rodi, Bang Muhar, Bang Ial, Mas Nurdin, Alex, Ega, Vina, Lia, Azis dan Nurhayati yang selalu memberi dukungan moral.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN vi
1 Pendahuluan 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan dan Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Morfologi Belut Sawah 3
Reproduksi Belut Sawah 4
Enzim Aromatase dan Aromatase Inhibitor 5
3 METODE 6
Bahan dan Materi Uji 6
Rancangan Penelitian 6
Prosedur Penelitian 6
Analisis Data 8
4 HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 14
5 KESIMPULAN DAN SARAN 16
Kesimpulan 16
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 22
DAFTAR TABEL
1 Kualitas air media penelitian belut sawah 7
2 Konsentrasi estradiol pada maskulinisasi belut sawah menggunakan AI
dan suhu 32ºC 10
3 Konsentrasi testosteron pada maskulinisasi belut sawah menggunakan
AI dan suhu 32ºC 11
4 Persentase jenis kelamin dan rata-rata ukuran panjang tubuh belut
sawah pada minggu ke-6 14
DAFTAR GAMBAR
1 Bentuk tubuh belut sawah (Monopterus albus) 4
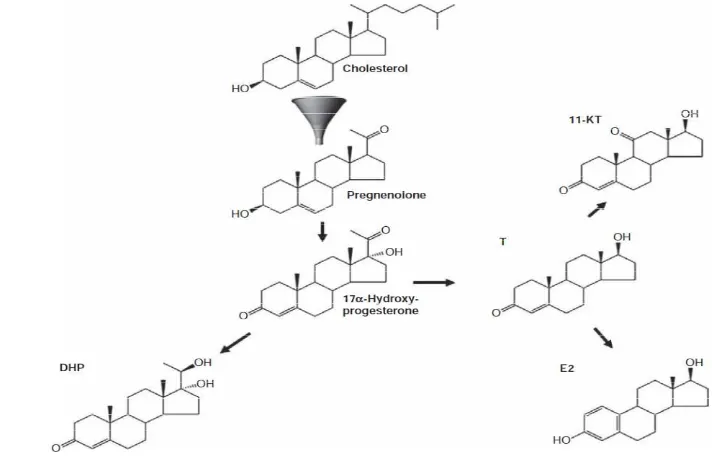
2 Proses steroidogenesis pada ikan 5
3 Gonad belut sawah minggu ke-0 pada perlakuan A (Kontrol), B (AI maskulinisasi belut sawah menggunakan AI dan suhu 32°C. 10 6 Indeks kematangan gonad belut sawah yang diinduksi dengan AI dan
suhu 11
7 Histologi gonad belut sawah yang diinduksi dengan AI dan suhu 32oC
minggu ke 0-6 12
8 Pertumbuhan bobot dan panjang belut sawah pada minggu ke 0-6 14
DAFTAR LAMPIRAN
9 Prosedur pengambilan sampel darah Belut Sawah 22 10 Prosedur analisis testosteron dan estradiol plasma menggunakan teknik
ELISA dengan Vidas ELISA Kit 22
11 Prosedur histologi gonad 22
12 Kandungan oksigen terlarut (mg/L) pada minggu ke-0 sampai minggu
ke-6 23
13 pH (1-14) air pada minggu ke-0 sampai minggu ke-6 24 14 Suhu air (oC) pada minggu ke-0 sampai minggu ke-6 24 15 Indeks kematangan gonad belut sawah minggu ke-6 24 16 Pertumbuhan bobot tubuh belut sawah pada minggu ke-0 sampai
minggu ke-6 24
17 Pertumbuhan panjang tubuh belut sawah minggu ke-0 sampai minggu
1 Pendahuluan
Latar Belakang
Belut sawah (Monopterus albus) merupakan salah satu spesies belut asli perairan Indonesia yang memiliki prospek pasar cukup baik. Dua spesies belut lainnya adalah belut rawa (Synbranchus bengalensis) dan belut laut (Macrotema caligans Cant). Pada tahun 2011 ekspor belut sawah hidup mencapai 2.068.680 kg atau meningkat 400% dibanding tahun 2007 (Direktorat Jenderal Pengolahan dan Pemasaran Hasil Perikanan 2012). Tingginya permintaan belut sawah dipenuhi dari hasil tangkapan atau menangkap benih dari alam yang kemudian dibesarkan pada media lumpur. Penangkapan yang terjadi secara terus menerus di alam akan memberikan dampak negatif terhadap ketersediaan benih, induk betina dan terutama induk jantan di alam semakin langka yang ditandai dengan ukuran belut yang tertangkap semakin kecil (Bahri 2000). Belut sawah yang berukuran kecil umumnya berjenis kelamin betina, karena belut sawah secara biologi tergolong ikan hermaprodit protogini yaitu diawal hidupnya berjenis kelamin betina kemudian melalui fase interseks akan berubah menjadi jantan. Beberapa penelitian menyebutkan bahwa perubahan kelamin menjadi jantan pada belut sawah secara alami dimulai dari ukuran panjang tubuh 30-45 cm (Chan dan Phillips 1969; Affandi et al. 2003). Dalam proses reproduksi diperlukan ketersediaan induk berjenis kelamin jantan dan betina yang matang secara seksual sehingga proses reproduksi dapat berlangsung.
Perubahan kelamin belut sawah betina menjadi jantan dapat diarahkan secara buatan dengan rekayasa proses steroidogenesis, sehingga didapatkan kepastian calon induk berjenis kelamin jantan untuk mendukung upaya reproduksi baik secara alami, semi alami maupun buatan dan diharapkan budidaya belut sawah dapat berkembang sehingga penangkapan belut sawah di alam dapat berkurang.
Hormon steroid kelamin berperan penting dalam proses diferensiasi kelamin baik pada ikan gonokoristik maupun ikan hermafrodit protogini dan protandri. Hal ini terbukti dari pemberian hormon estrogen ataupun androgen eksogen pada berbagai jenis ikan yang masing-masing menghasilkan ikan berjenis kelamin betina atau jantan. Pada ikan hermaprodit, terjadi perubahan pola hormon steroid kelamin selama proses perubahan kelamin kearah jantan (Guiguen et al.
2010). Hormon steroid kelamin dimodulasi oleh hormon pituitari dan otak yang memainkan peran penting pada saat penyebaran, perawatan dan maturasi pada perkembangan kelamin jantan ataupun betina serta sangat penting untuk inisiasi perubahan kelamin pada ikan hermafrodit (Bhandari et al. 2003).
betina dan mempertahankan diferensiasi ovarium, maka rekayasa proses steroidogenesis dengan manghambat kerja enzim aromatase dapat memaskulinisasi ikan hermaprodit protogini (Guiguen et al. 2010). Penghambatan kerja enzim aromatase dapat dilakukan dengan induksi fisik seperti suhu (Athauda
et al. 2012) maupun senyawa kimia steroid dan non steroid (Seralini dan Moslemi 2001), sehingga rasio testosteron terhadap estradiol meningkat dan mampu untuk memicu perubahan kelamin belut sawah kearah jantan.
Efektivitas aromatase inhibitor diantaranya pernah diteliti pada ikan gonokoristik pada dosis 100 µg/g pakan mampu memaskulinisasi ikan atlantik halibut (Babiak et al. 2011), ikan european sea bass (Navarro-Martin et al. 2008). Pada ikan hermaprodit protogini, aromatase inhibitor mampu memaskulinisasi ikan Epinephelus marginatus pada minggu kesembilan (Garcia et al. 2013), pada ikan Coryphopterus nicholsii (Kroon dan Liley 2000) dalam waktu tujuh minggu dan pada ikan Halichoeres trimaculatus dalam waktu lima hari(Nozu et al. 2009). Ikan hermaprodit protandri Acanthopagrus schlegeli yang diberi aromatase inhibitor 0,1 µg/g bobot tubuh selama 4 minggu dapat mempertahankan pada kondisi jantan (Dufour et al 2004). Menurut Arfah et al. (2005) bahwa induk ikan gapi yang dipelihara pada suhu 30oC menghasilkan keturunan jantan lebih banyak dibanding suhu 27oC. Selim et al. (2009) melaporkan bahwa larva ikan medaka yang dipelihara pada suhu 32oC menghasilkan persentase jantan lebih banyak dibanding suhu 27oC. Kemudian pada ikan hermaprodit protandri Lates calcarifer
yang dipelihara pada suhu 31ºC dan 34ºC menghasilkan individu interseks lebih sedikit dibanding suhu 25ºC dan 28ºC (Athauda et al. 2012). Penggunaan aromatase inhibitor dan suhu 32ºC pada belut sawah dalam penelitian ini diharapkan mampu untuk mengarahkan kelamin belut sawah kearah jantan dengan mengevaluasi regulasi hormon steroid kelamin yaitu testosteron dan estradiol pada perkembangan fungsi reproduksinya.
Rumusan Masalah
Diferensiasi kelamin belut sawah dari betina menjadi jantan belum diketahui secara pasti sehingga menimbulkan masalah dalam sinkronisasi ketersediaan antara induk berjenis kelamin jantan dan betina yang matang gonad pada ukuran yang seragam untuk proses reproduksi, baik secara alamiah maupun buatan. Aromatase merupakan enzim yang berperan dalam biosintesis estradiol dari testosterone. Penghambatan biosintesis estradiol telah diketahui dapat berdampak maskulinisasi pada ikan. Penghambatan aktivitas enzim aromatase menggunakan aromatase inhibitor diharapkan dapat meningkatkan konsentrasi testosteron plasma pada ikan, sehingga memicu pengarahan kelamin belut sawah betina menjadi jantan (maskulinisasi). Dengan demikian pada belut yang memiliki ukuran yang sama dimungkinkan terdapat jantan dan betina matang secara seksual, sehingga memudahkan proses reproduksi.
Tujuan dan Manfaat
induksi fisik menggunakan suhu 32ºC. Manfaat dari penelitian ini adalah mendapatkan metode pengarahan kelamin jantan belut sawah untuk penyediaan calon induk jantan yang seragam, tepat waktu dan kontinyu sehingga proses reproduksi dapat dilakukan dan budidaya belut sawah dapat berkembang.
2 Tinjauan Pustaka
Morfologi Belut Sawah (Monopterus albus)
Menurut Prihatman (2000) terdapat tiga spesies belut di dunia yaitu belut rawa (Synbranchus bengalensis), belut laut/belut kali (Synbranchus caligans
Cant) dan belut sawah (Monopterus albus). Pada umumnya belut yang ditemui di pasar-pasar tradisional di Indonesia adalah belut sawah dan merupakan salah satu spesies asli perairan Indonesia. Penyebaran belut sawah di Indonesia meliputi daerah Jawa, Sumatera, Sulawesi, Kalimantan, NTT, dan NTB. Menurut Saanin (1968) dalamBahri (2000), klasifikasi belut sawah adalah sebagai berikut :
Kindom : Animalia
Gambar 1 Bentuk tubuh belut sawah (Monopterus albus) M (mulut), K (kepala), P (perut), E (ekor)
Belut betina pada umumnya berukuran panjang 10-29 cm dengan warna kulit lebih cerah atau lebih muda (hijau muda pada punggung dan putih kuning pada perutnya) dibanding belut jantan, bentuk kepala runcing dan usianya selalu dibawah sembilan bulan. Sedangkan belut jantan mempunyai panjang tubuh lebih dari 30 cm, dengan warna lebih gelap, bentuk kepala tumpul dan umur diatas sembilan bulan (Sarwono 1999 dalamBahri 2000).
Reproduksi Belut Sawah (Monopterus albus)
Belut sawah digolongkan ikan hermaprodit protogini, dimana perkembangan awal dari kelaminnya adalah sebagai betina dan pada usia tertentu berubah menjadi jantan fungsional (Liu 1944 dalam Tao et al. 1993). Selanjutnya Chan dan Phillips (1969) menambahkan bahwa terdapat korelasi antara panjang tubuh dengan status kelamin dari belut sawah, belut sawah yang berukuran kecil umumnya adalah betina sedangkan yang ukuran besar umumnya adalah jantan. Perubahan seksual pada ikan hermaprodit salah satu tujuannya adalah untuk memperpanjang masa reproduksi (Liem 1963). Pada belut sawah sex reversal
alami dimulai setelah periode pemijahan pada ukuran 30-45 cm (Chan dan Phillips 1969; Affandi et al. 2003). Secara alami belut sawah bereproduksi setahun sekali yaitu dimulai dari musim penghujan sampai dengan awal musim kemarau dan pada umumnya terjadi pada malam hari (Sarwono 1999 dalam Bahri 2000).
Hormon steroid seks memainkan beberapa peran penting dalam proses sex reversal pada belut sawah. Menurut Chan dan Phillips (1969) steroid yang diproduksi oleh gonad belut sawah pada berbagai fase seksual berbeda; steroid seks utama menunjukkan adanya pergeseran selama sex reversal sehingga estrogen lebih banyak diproduksi pada fase betina dan ketika transformasi struktural dari ovarium ke testis dimulai maka produksi androgen meningkat tajam. Peningkatan produksi androgen tampaknya berkaitan dengan perkembangan sel-sel interstisial selama proses perubahan kelamin kearah jantan (Chan dan Phillips 1969). Perubahan kadar plasma steroid seks pada belut sawah terkait dengan pematangan jaringan kelamin betina dan jantan serta siklus reproduksi musiman (Yeung dan Chan 1987).
Sex reversal pada belut sawah dikontrol oleh dua mekanisme utama yaitu hereditas dan faktor lingkungan (Gong et al. 2011; Baroiller et al. 1999). Sex reversal terutama dikontrol oleh hereditas, namun fenomena dialam secara signifikan dipengaruhi oleh faktor lingkungan (Tao et al. 1993; Shi 2005), termasuk perubahan suhu, polusi kimia dan food additives. Faktor lingkungan, bahan kimia atau hormon eksogen dilaporkan berpengaruh terhadap perkembangan sel interstisial, gonad dan diferensiasi gamet melalui perubahan sekresi steroid (Tang et al. 1974; Shi 2005; Singh 2013).
E
Enzim Aromatase dan Aromatase Inhibitor
Enzim aromatase adalah enzim sitokrom P-450 yang mengkatalis perubahan dari androgen menjadi estrogen. Enzim aromatase terekspresi pada banyak jaringan seperti pada gonad, otak dan jaringan adipos (D’Cottae et al. 2001). Aktivitas enzim aromatase terbatas pada daerah dengan target estradiol dan berfungsi untuk mengatur jenis kelamin, reproduksi dan tingkah laku (Callard et al. 2001). Enzim aromatase menunjukkan aktivitas yang paling tinggi pada ikan dan burung dewasa dibanding dengan hewan vertebrata lainnya (D’Cottae et al. 2001). Guiguen et al. (2010) menambahkan bahwa estrogen dan enzim aromatase memainkan peran penting untuk mengontrol ovarium dan diferensiasi testis, baik pada ikan gonokoristik maupun ikan hermaprodit. Regulasi enzim aromatase dibutuhkan tidak hanya untuk memicu tetapi juga untuk mempertahankan diferensiasi ovarium, maka dengan menurukan regulasi enzim aromatase adalah salah satu cara yang dapat dilakukan untuk memaskulinisasi ikan hermaprodit protogini (Guiguen et al. 2010). Aktivitas enzim aromase diotak lebih tinggi dibanding dengan aktivitas aromatase digonad, hal ini menunjukkan kemungkinan bahwa enzim aromatase terlebih dahulu diproduksi oleh otak kemudian ditransfer ke gonad karena otak adalah organ utama yang merespon kondisi lingkungan (Athauda et al. 2012).
Penghambatan aromatase dapat dikarenakan oleh faktor fisika seperti suhu (Watts et al. 2004; Selim et al. 2009; Athauda et al. 2012), senyawa kimia steroid dan non steroid yang telah mencapai tingkat tertentu dalam keberhasilan sex reversal ikan (Seralini dan Moslemi 2001). Apabila kerja enzim aromatase dihambat, maka testosteron tidak lagi diubah menjadi estradiol sehingga rasio testosteron terhadap estradiol meningkat yang diharapkan mampu untuk memicu ikan hermaprodit ataupun gonokoristik untuk melakukan diferensiasi kearah jantan atau maskulinisasi.
3 METODE
Bahan dan Materi Uji
Dalam penelitian ini digunakan belut sawah sebanyak 120 ekor dengan panjang 24±2 cm yang berasal dari Bogor. Bahan yang digunakan untuk pengarahan kelamin jantan belut sawah adalah aromatase inhibitor (AI) jenis
imidazole. Pakan yang digunakan selama penelitian adalah cacing tanah. Rancangan Penelitian
Penelitian ini dirancang menggunakan rancangan acak lengkap (RAL) 5 dengan 5 perlakuan. Setiap perlakuan digunakan ikan sebanyak 24 ekor.
Perlakuan A : NaCl 0,95% (Kontrol)
Perlakuan B : Aromatase inhibitor 0,001 mg/kg bobot ikan Perlakuan C : Aromatase inhibitor 0,01 mg/kg bobot ikan Perlakuan D : Aromatase inhibitor 0,1 mg/kg bobot ikan Perlakuan E : Suhu 32oC tanpa penyuntikan
Prosedur Penelitian
Persiapan Ikan Uji
Wadah penelitian menggunakan akuarium sebanyak 5 unit dengan ukuran 80x40x40 cm3. Akuarium dibersihkan dengan air hingga bersih dan kemudian dijemur. Setelah itu diisi air setinggi 10 cm dan kemudian diberi larutan PK. Kemudian air dibuang dan dibilas kembali hingga bersih. Selanjutnya akuarium diisi kembali dengan air bersih kira-kira 10 cm kemudian diberi aerasi, heater dan pipa paralon pada posisi horizontal didasar akuarium dengan panjang 25 cm dan diameter 2-3 inci untuk tempat bernaung belut sawah.
Perlakuan Maskulinisasi
Induksi aromatase inhibitor diberikan dengan cara penyuntikkan. Sebelum ikan disuntik, ikan dibius terlebih dahulu dengan menggunakan stabilizer dengan dosis 1 ml/L. Kemudian bobot ikan ditimbang menggunakan timbangan digital dengan tingkat ketelitian dua digit dibelakang koma satuan gram (g). Setelah itu panjang tubuh belut sawah diukur menggunakan penggaris 30 cm. Selanjutnya ikan disuntik secara intramaskular sesuai dengan perlakuan yaitu garam fisiologis (Kontrol) dan aromatase inhibitor. Ikan disuntik sebanyak 1 kali dalam seminggu yaitu pada minggu ke-0, 1, 2, 3 dan 4. Setelah disuntik, ikan diletakkan kembali kedalam akuarium dengan aerasi yang kuat untuk disadarkan kembali. Kemudian untuk perlakuan suhu digunakan heater dengan suhu 32ºC untuk menjaga suhu air agar tetap konstan.
Pemeliharaan Belut Sawah
Belut sawah dipelihara selama enam minggu dan diberi pakan cacing tanah secara at satiation sebanyak dua kali sehari sebanyak 3% dari bobot total belut sawah. Untuk perlakuan Kontrol (NaCl 0,95%) dan AI dipelihara pada kisaran suhu 27,7-27,9ºC; pH 5,96-6,24 dan kandungan oksigen terlarut 5,48-5,71 mg/L (Tabel 1). Cacing tanah yang diberikan sebanyak 3% dari bobot tubuh belut sawah. Akuarium disipon satu kali sehari yaitu pada waktu pagi hari sebanyak 5%, kemudian dilakukan pergantian air.
Tabel 1 Kualitas air media penelitian belut sawah Perlakuan Parameter Kualitas Air
Keterangan: * : mg/kg bobot ikan
Parameter Penelitian
Konsentrasi dan Estradiol
Konsentrasi testosteron dan estradiol dalam darah plasma belut sawah diukur dengan menggunakan teknik ELISA (Lampiran 2) dengan Vidas Elisa Kit (EIA 2693 untuk estradiol dan EIA 1559 untuk testosteron). Sampel darah (Lampiran 1) dikoleksi dari 3 ekor individu setiap perlakuan yang dilakukan pada minggu ke 0, 2, 4 dan 6.
Indeks Kematangan Gonad (IKG)
IKG =
− 100%
Ket:
IKG : Indeks Kematangan Gonad (%) Wg : Bobot Gonad (g)
W : Bobot Tubuh (g) Histologi Gonad dan Status Kelamin
Histologi gonad mengacu pada metode Gunaro (1989). Histologi gonad dilakukan pada minggu ke-0, 2, 4 dan 6. Kemudian pada minggu ke-6 semua ikan uji yang tersisa dibedah untuk mengevaluasi persentase jenis kelamin belut sawah (betina, interseks ataupun jantan) dengan mengamati hasil histologi.
Pertumbuhan Panjang dan Bobot Tubuh
Pengukuran pertumbuhan panjang dan bobot tubuh dilakukan setiap minggu (enam minggu) selama penelitian. Panjang tubuh diukur dengan menggunakan penggaris 30 cm. Sedangkan bobot tubuh diukur dengan menggunakan timbangan digital dengan ketelitian 0,01 satuan gram (g).
Analisis Data
Seluruh data hasil pengamatan parameter penelitian dianalisis ANOVA dengan taraf kepercayaan 95% menggunakan perangkat lunak minitab 14. Apabila berbeda nyata dilanjutkan dengan uji Duncan, sedangkan pengamatan histologi gonad untuk penentuan jenis kelamin dianalisis secara deskriptif.
4 Hasil dan Pembahasan
Hasil
Morfologi Gonad Belut Sawah
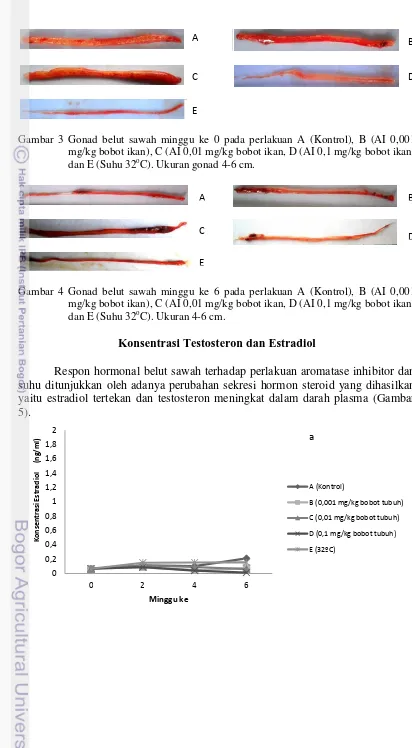
Gambar 3 Gonad belut sawah minggu ke 0 pada perlakuan A (Kontrol), B (AI 0,001 mg/kg bobot ikan), C (AI 0,01 mg/kg bobot ikan, D (AI 0,1 mg/kg bobot ikan) dan E (Suhu 32oC). Ukuran gonad 4-6 cm.
Gambar 4 Gonad belut sawah minggu ke 6 pada perlakuan A (Kontrol), B (AI 0,001 mg/kg bobot ikan), C (AI 0,01 mg/kg bobot ikan, D (AI 0,1 mg/kg bobot ikan) dan E (Suhu 32oC). Ukuran 4-6 cm.
Konsentrasi Testosteron dan Estradiol
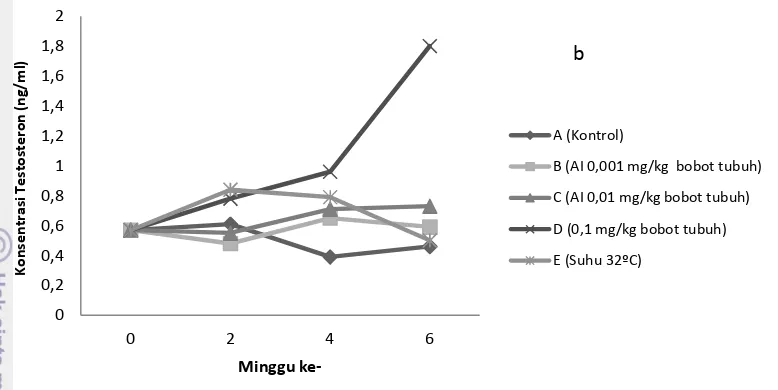
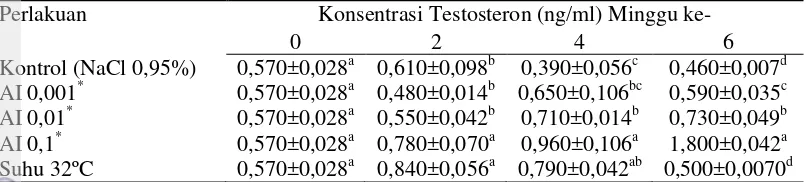
Gambar 5 Konsentrasi estradiol (a) dan testosteron (b) minggu ke 0-6 pada maskulinisasi belut sawah menggunakan aromatase inhibitor dan suhu 32°C
Secara umum konsentrasi estradiol pada minggu ke-2 meningkat dan stabil pada kisaran 0,15 ng/ml pada perlakuan suhu 32°C sampai minggu ke-6 (Gambar 5 a). Kelompok Kontrol menunjukkan peningkatan tertinggi pada minggu ke-6 dibanding perlakuan lainnya yang terus tertekan terutama pada perlakuan AI 0,01 dan 0,1 mg/kg bobot ikan. Konsentrasi estradiol minggu ke-6 pada semua perlakuan lebih rendah dan secara statistik menunjukkan perbedaan nyata (P<0,05) dibanding Kontrol (Tabel 2). Sebaliknya, konsentrasi testosteron pada perlakuan AI 0,1 mg/kg bobot ikan meningkat sampai tiga kali lipat pada minggu ke-6 dibanding dengan Kontrol (Gambar 5 b). Peningkatan konsentrasi testosteron pada minggu ke-2 lebih tinggi dan secara statistik berbeda nyata (P<0,05) yaitu pada perlakuan AI 0,1 mg/kg bobot ikan dan suhu 32ºC dibanding Kontrol (Tabel 3). Pada minggu ke-4 konsentrasi testosteron pada semua perlakuan lebih tinggi dan secara statistik berbeda nyata (P<0,05) dibanding Kontrol (Tabel 3). Pada minggu ke-6 konsentrasi testosteron semua perlakuan berbeda nyata (P<0,05) dibanding Kontrol, kecuali pada perlakuan suhu 32oC (P>0,05) yang mengalami penurunan (Tabel 3).
Tabel 2 Konsentrasi estradiol pada maskulinisasi belut sawah menggunakan aromatase inhibitor dan Suhu 32ºC
Perlakuan Konsentrasi Estradiol (ng/ml) Minggu ke-
0 2 4 6
Kontrol (NaCl 0,95%) 0,068±0,012a 0,116±0,004b 0,104±0,007b 0,212±0,001a
AI 0,001* 0,068±0,012a 0,090±0,008c 0,048±0,001c 0,076±0,007c
AI 0,01* 0,068±0,012a 0,110±0,015b 0,091±0,012b 0,063±0,002c
AI 0,1* 0,068±0,012a 0,090±0,005c 0,042±0,003c 0,015±0,000d
Suhu 32ºC 0,068±0,012a 0,153±0,012a 0,155±0,009a 0,157±0,013b
Keterangan: Huruf yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang
berbeda nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.*: mg/kg
bobot ikan
B (AI 0,001 mg/kg bobot tubuh)
C (AI 0,01 mg/kg bobot tubuh)
D (0,1 mg/kg bobot tubuh)
E (Suhu 32ºC)
Tabel 3 Konsentrasi testosteron pada maskulinisasi belut sawah menggunakan aromatase inhibitor dan suhu 32ºC
Perlakuan Konsentrasi Testosteron (ng/ml) Minggu ke-
0 2 4 6
Kontrol (NaCl 0,95%) 0,570±0,028a 0,610±0,098b 0,390±0,056c 0,460±0,007d
AI 0,001* 0,570±0,028a 0,480±0,014b 0,650±0,106bc 0,590±0,035c
AI 0,01* 0,570±0,028a 0,550±0,042b 0,710±0,014b 0,730±0,049b
AI 0,1* 0,570±0,028a 0,780±0,070a 0,960±0,106a 1,800±0,042a
Suhu 32ºC 0,570±0,028a 0,840±0,056a 0,790±0,042ab 0,500±0,0070d
Keterangan: Huruf yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku. *: mg/kg bobot ikan
Indeks Kematangan Gonad
Nilai indeks kematangan gonad (IKG) pada minggu ke-0 yaitu 2,18%, kemudian pada minggu ke-2 sampai minggu ke-4 secara umum nilai IKG seluruh perlakuan menurun yang diduga karena proses atresia sehingga bobot gonad menjadi lebih kecil (Gambar 6). Nilai IKG mulai meningkat kembali pada seluruh perlakuan pada minggu ke-6 kecuali pada perlakuan AI 0,001 mg/kg bobot ikan (B), dan perlakuan Kontrol menunjukkan kenaikan nilai IKG yang tertinggi. Nilai IKG pada Kontrol minggu ke-6 lebih besar dibanding kelompok perlakuan (P<0,05), secara statistik menunjukkan perbedaan nyata (Lampiran 7). Penurunan nilai IKG pada perlakuan AI dan suhu 32oC didukung dengan hasil histologi (Gambar 7) yang menunjukkan adanya atresia pada telur.
Gambar 6 Indeks kematangan gonad belut sawah yang diinduksi dengan aromatase inhibitor
Histologi Gonad
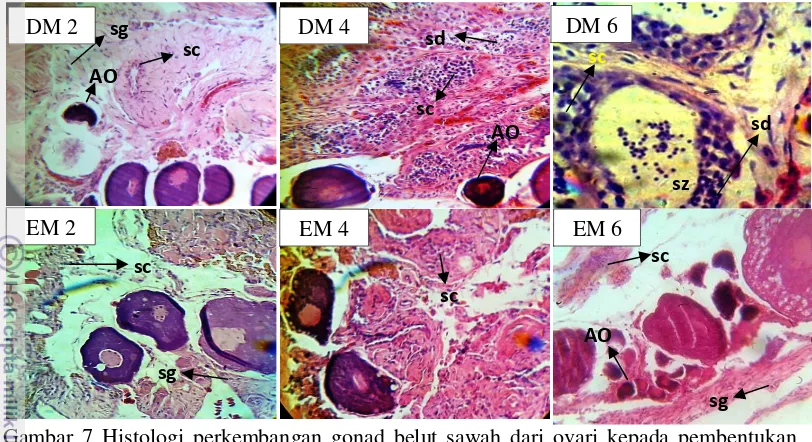
Analisis histologi perkembangan gonad belut sawah pada pengamatan minggu ke 0-6 dari masing-masing kelompok perlakuan disajikan pada Gambar 7 (Pembesaran empat puluh kali). Pada minggu ke-0 (M0) histologi gonad memperlihatkan telur dengan beberapa tahap perkembangan serta terlihat beberapa telur yang sudah matang. Pada minggu ke-2 sampai minggu ke-6 tidak
terjadi inisiasi perubahan kelamin pada belut sawah pada Kontrol (AM 2 - AM 6) karena tidak ditemukan adanya spermatogonia dan spermatosit.
Pada perlakuan AI 0,001 mg/kg bobot ikan, inisiasi perubahan kelamin mulai terjadi pada minggu ke-6 (BM 6) dengan ditemukannya spermatogonia dan spermatosit serta telur yang mengalami atresia. Minggu ke-2 dan ke-4 pada perlakuan AI 0,01 mg/kg bobot ikan (CM 2 dan CM 4), AI 0,1 mg/kg bobot ikan (DM 2 dan DM 4) dan suhu 32ºC (EM 2 dan EM 4) telah terdeteksi individu belut sawah yang mengalami interseks yang ditandai dengan adanya spermatogonia ataupun spermatosit berada diantara telur yang mengalami atresia. Minggu ke-6 pada perlakuan AI 0,1 mg/kg bobot ikan (DM 6) ditemukan individu berjenis kelamin jantan karena dari hasil histologi tidak ditemukan adanya telur pada gonad belut sawah, bahkan terlihat adanya sperma yang telah matang. Perlakuan AI (0,001; 0,01 mg/kg berat ikan) dan suhu 32oC pada minggu ke-6 hanya menghasilkan individu interseks yang ditandai dengan adanya telur dan sperma pada gonad belut sawah.
AO sg
sc
sg sc
AO sg
sc
AO
sc sd
M 0
AM 4
AM 2 AM 6
BM 2
CM 6 CM 4
CM 2
Gambar 7 Histologi perkembangan gonad belut sawah dari ovari kepada pembentukan testis yang diinduksi dengan aromatase inhibitor dan suhu 32oC minggu ke-0, 2, 4 dan 6. M (minggu); AO (oosit atresia); sg (spermatogonia); sc (spermatosit); sd (spermatid); sz (spermatozoa)
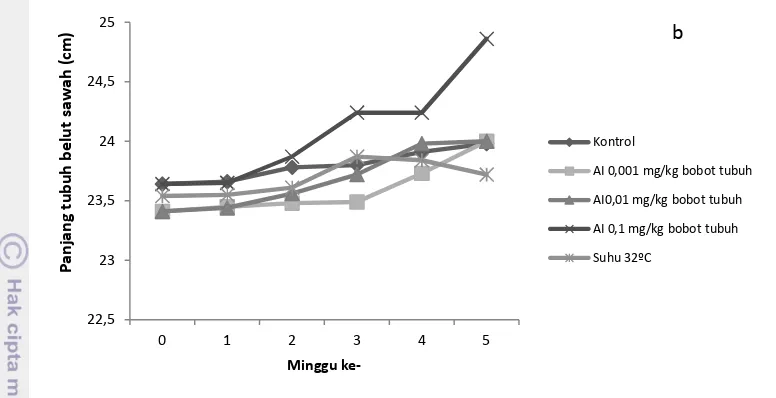
Pertumbuhan Bobot dan Panjang tubuh
Pertumbuhan bobot tubuh belut sawah lebih tinggi dibanding pertumbuhan panjang tubuh (Gambar 8). Pertumbuhan bobot (A) dan panjang (B) tubuh belut sawah pada perlakuan maskulinisasi dengan aromatase inhibitor dan suhu 32ºC secara statistik tidak menunjukkan perbedaan yang nyata (P>0,05) dibandingkan dengan Kontrol (Lampiran 8 dan 9).
Gambar 8 Pertumbuhan bobot (A) dan panjang (B) tubuh belut sawah minggu ke 0-6 pada perlakuan aromatase inhibitor dan suhu 32ºC
Persentase jenis kelamin belut sawah
Setelah mencapai minggu ke-6 hanya pada perlakuan AI 0,1 mg/kg bobot ikan (D) ditemukan individu berjenis kelamin jantan sebesar 40% dengan ukuran panjang tubuh 24±0,7 cm; sedangkan pada perlakuan dosis AI lainnya dan suhu 32ºC ditemukan individu interseks diatas 50% serta pada perlakuan Kontrol dihasilkan 100% betina (Tabel 4).
Tabel 4 Persentase jenis kelamin dan rata-rata ukuran panjang tubuh belut sawah pada Minggu ke-6
Perlakuan Betina Interseks Jantan (%) Panjang
Keterangan: * : mg/kg bobot ikan
Pembahasan
Selama penelitian terlihat adanya pergeseran sekresi testosteron dan estradiol pada semua perlakuan, yaitu terjadi peningkatan konsentrasi testosteron plasma dan penurunan konsentrasi estradiol plasma. Peningkatan konsentrasi testosteron karena penghambatan enzim aromatase oleh aromatase inhibitor sehingga produksi estradiol menurun dan berakibat pada meningkatnya jumlah testosteron (Server et al. 1999). Penelitian lain menyebutkan bahwa aromatase
inhibitor bersaing dengan substrat alami (testosteron) yang menyebabkan aktivitas aromatase tidak berjalan (Eny 2012 dalam Brodie 1991). Beberapa penelitian menyebutkan bahwa mekanisme peningkatan testosteron juga terjadi secara alami pada ikan hermaprodit selama pergantian kelamin. Chan dan Phillips (1969) menyatakan bahwa secara alami pada belut sawah, sekresi estradiol lebih banyak diproduksi pada fase betina dan testosteron lebih banyak diproduksi pada fase jantan. Pola hormon steroid seks yang sama juga ditunjukkan oleh ikan hermaprodit protogini lain selama perubahan kelamin secara alami seperti ikan
Epinephelus merra (Alam et al. 2006) dan ikan Coryphopterus nicholsii (Kroon dan Liley 2000).
Pada perlakuan suhu, konsentrasi testosteron plasma tertinggi terjadi pada minggu ke-2 dan kemudian menurun sampai minggu ke-6, sedangkan konsentrasi estradiol plasma pada minggu ke-2 meningkat dan stabil sampai minggu ke-6. Diduga suhu 32ºC belum mampu untuk menghambat aktivitas enzim aromatase, sehingga testosteron yang diproduksi masih diubah oleh enzim aromatase menjadi estradiol. Hasil yang sama juga ditunjukkan pada ikan Lates calcarifer yang dipelihara pada suhu 31oC dan 34oC, namun rasio ikan yang mengalami interseks lebih banyak pada ikan yang dipelihara pada suhu 25ºC dan 28ºC (Athauda et al.
2012). Pada perlakuan suhu 32oC mampu membuat belut sawah mencapai fase interseks tanpa menurunkan konsentrasi estradiol (Gambar 7). Pada studi lain Watts et al. (2004) menyatakan bahwa induk ikan betina atlantik salmon yang dipelihara pada suhu 22oC dapat menurunkan plasma vitelogenin dan estradiol, sedangkan plasma testosteron meningkat. Pada suhu 22º sintesis estradiol terhambat dibanding suhu 18ºC, hal ini menunjukkan penurunan aktivitas sintesis enzim aromatase.
Peningkatan rasio testosteron terhadap estradiol menjadi penyebab perubahan kelamin belut sawah kearah jantan. Perubahan kelamin pada ikan hermaprodit protogini dikontrol oleh hormon gonadotropin melalui poros hipotalamus-pituitari-gonad (Tao et al. 1993; Garcia et al. 2013). Mekanisme kerja aromatase inhibitor dimulai dengan terhambatnya kerja enzim aromatase di otak, kemudian pituitari dan gonad sehingga meningkatkan konsentrasi testosteron (Zhang et al. 2008). Selanjutnya otak merilis GnRH yang menginduksi hipofisis untuk mensekresikan FSH yang bekerja pada sel sertoli selama proses spermatogenesis dan LH yang bekerja pada sel interstisial untuk proses spermiasi (Tang et al. 1974; Tao et al. 1993, Garcia et al. 2013). Namun pada ikan jantan, baik gonokoristik ataupun hermafrodit tetap terdapat estradiol meskipun dengan konsentrasi yang sangat kecil. Estradiol pada ikan jantan berfungsi pada awal spermatogenesis yang berperan dalam pembaharuan sel spermatogonia dan untuk memicu perkembangan sel-sel germinal (Miura dan Miura 2003). Chen et al.
(2011) melaporkan bahwa estrogen memainkan peran khusus selama perubahan kelamin pada ikan hermafrodit protogini, namun peran ini masih belum diketahui secara pasti. Pada ikan Epinephelus coides yang diimplan dengan metiltestosteron menunjukkan ekspresi reseptor estrogen (ER) pada testis selama penyebaran spermatogonia dan secara bertahap meningkat selama perubahan kelamin (Chen et al. 2011).
maskulinisasi pada musim pemijahan membutuhkan waktu yang lebih singkat dibanding diluar musim pemijahan. Hal ini disebabkan proses steroidogenesis terjadi sangat tinggi pada musim pemijahan. Musim pemijahan pada belut sawah belum diketahui secara pasti, namun diduga musim pemijahan belut sawah dimulai dari awal musim penghujan sampai diawal musim kemarau (Bahri 2000). Pada minggu ke-0, gonad belut sawah yang diamati berisi telur yang telah matang. Temuan gonad betina yang telah matang masih belum diketahui terkait dengan musim pemijahan atau tidak. Namun diduga karena pakan yang diberikan adalah cacing tanah, sehingga kebutuhan nutrisi belut sawah terpenuhi untuk perkembangan telur. Hal ini didasarkan pada penelitian Bahri (2000) yang melaporkan bahwa pada habitat alami isi perut belut sawah yang telah matang gonad tersebut didominasi oleh cacing tanah dan ikan-ikan kecil.
Indeks Kematangan Gonad pada semua perlakuan menurun, terutama pada kelompok perlakuan. Penurunan nilai IKG dikarenakan faktor atresia yang terjadi pada telur (Gambar 6). Hasil ini selaras dengan beberapa penelitian yang menyebutkan bahwa degenerasi gonad dari ovarium yang mengarah pada perkembangan testis mengakibatkan penurunan bobot gonad dan mengarah pada penurunan IKG (Tao et al. 1993; Nozu et al. 2009; Gong et al. 2011; Garcia et al.
2013). Pada ikan hermaprodit protogini degenerasi oosit saat memulai diferensiasi kelamin kearah jantan distimulasi oleh hormon androgen yang diproduksi dari sekitar selaput ovari dan pembuluh darah (Alam et al. 2006). Keberhasilan induksi perubahan kelamin secara artifisial dipengaruhi oleh banyak faktor diantaranya adalah dosis, waktu penelitian, jenis bahan induksi yang diberikan, lama waktu perlakuan dan metode pemberian sesuai dengan spesies ikan (Garcia et al 2013).
5 KESIMPULAN DAN SARAN
Kesimpulan
Aromatase inhibitor mampu memaskulinisasi belut sawah pada ukuran 24±2 cm melalui mekanisme peningkatan konsentrasi testosteron dan penurunan konsentrasi estradiol plasma. Pemberian AI 0,1 mg/kg bobot ikan menyebabkan peningkatan konsentrasi testosteron plasma hingga tiga kali lipat dibanding kontrol, yang menghasilkan 40% jantan dan 60% interseks dalam waktu 6 minggu.
Saran
DAFTAR PUSTAKA
Affandi R, Yunizar E, Setyo W. 2003. Studi Bio-Ekologi Belut Sawah
(Monopterus albus) Pada Berbagai Ketinggian Tempat Di Kabupaten Subang, Jawa Barat. Jurnal Iktiologi Indonesia. 3: 49-55.
Alam MA, Bhandari RK, Kobayashi Y, Soyano K, Nakamura S, Soyano K, Nakamura M. 2006. Changes in Androgen-producing Cell Size and Circulating 11-Ketotestosterone Level During Female–Male Sex Change of Honeycomb Grouper Epinephelus merra. Moleculer Reproduction Dev. 73: 206–214.
Arfah H, Mariam S, Alimuddin. 2005. Pengaruh Suhu Terhadap Reproduksi dan Nisbah Kelamin Ikan Gapi (Poecilia reticulata Peters). Jurnal Akuakultur Indonesia. 4: 1-4.
Athauda S, Trevor A, Rockyde N. 2012. Effect of Rearing Water Temperature on Protandrous Sex Inversion in Cultured Asian Seabass (Lates calcarifer). General and Comparative Endocrinology. 176: 416-423.
Babiak J, Igor B, Solveig van N, Torstein H, Trine H, Birgitta N. 2011. Induced Sex Reversal using an Aromatase Inhibitor, Fadrozole, in Atlantic Halibut (Hippoglossus hippoglossus L). Aquaculture Journal. 324: 276-280.
Bahri F. 2000. Studi Mengenai Aspek Biologi Ikan Belut Sawah (Monopterus albus) di Kecamatan Parung Kabupaten Bogor Jawa Barat. Skripsi. Institut Pertanian Bogor.
Baroiller JF, Guiguen Y, Fostier A. 1999. Endocrine and Environmental Aspect of Sex Differentiation in Fish. CMLS Cell. Molecular Life Science. 55: 910-931.
Beullens K, Eding EH, Gilson P, Ollevier F, Komen J, Richter CJJ. 1997. Gonadal differentiation, intersexuality and sex ratios of European eel (Anguilla anguilla L.) maintained in captivity. Aquaculture Journal. 153: 135–150.
Bhandari RK, Higa M, Nakamura S, Nakamura M. 2003. Sex Inversion of Sexually Immature Honeycomb Grouper (Epinephelus merra) By Aromatase Inhibitor. Zoology Science. 21: 305-310.
Chan STH, Phillips JG. 1969. The Biosynthesis of Steroids by the Gonads of the Ricefield Eel Monopterus albus at Various Phases During Natural Sexreversal. General and Comparative Endocrinology. 12: 619–636. Chen H, Yang Z, Li S, Lin M, Shi Y, Sang Q, Liu M, Zhang H, Lu D, Meng X,
Lin H. 2011. Molecular Cloning , Characterization and Expression Profiles of Three Estrogen Receptor in Protogynous Hermaphroditic Orange-spoutted Grouper (E. coides). Aquaculture journal. 287 : 152-157.
D’cottae H, Fostier A, Guiguen Y, Govoroun A. 2001. Aromatase Plays a Key Role During Normal and Temperature-induced Sex Differentiation of Tilapia (Oreochromis niloticus). Molecullar Reproduction Development. 276: 265-276.
Direktorat Jenderal Pengolahan dan Pemasaran Hasil Perikanan. 2012. Statistik Ekspor Hasil Perikanan 2011. Kementerian Kelautan dan Perikanan, Jakarta.
Dufour S, Sun TL, Crishtoper HK, Cheng K, Lin H, Jacquez B. 2004. Effects Induction of Sex Steroid, Aromatase Inhibitors and Antiestrogens in Protandrous Black Porgy Acanthopagrus schlegeli Bleeker. Zoology Study. 29: 173-179.
Garcia CEO, Bruno CA, Paulo HM, Amanda MN, Jandir ARF, Andreone TM, Ricardo AZ, Lucile MFW, Renata GM. 2013. Involvement of Pituitary Gonadotropins, Gonadal Steroids and Breeding Season in Sex Change of Protogynous Dusky Grouper, Epinephelus marginatus (Teleostei: Serranidae), Induced by a Non-Steroidal Aromatase Inhibitor. General and Comparative Endocrinology. 192: 170-180.
Gong S, Guobin Z, Lei Z, Yongchao Y, Hanwen Y. 2011. Effects of Estradiol Valerate on Steroid Hormones and Sex Reversal of Female Rice Field Eel, Monopterus albus (Zuiew). Journal of The World Aquaculture
Gunarso W. 1989. Mikroteknik. PAU Ilmu Hayat. Institut Pertanian Bogor. Bogor. Eny H. 2012. Sex Reversak Ikan Nila Menggunakan Madu dan Analisis Ekspresi
Gen Aromatase. Tesis. Institut Pertanian Bogor.
Function in The Air-Breathing Swamp Eel (Monopterus albus). Molecular and Integrative Physiology. 164: 171-180.
Kroon FJ, Liley NR. 2000. The Role of Steroid Hormones in Protogynous Sex Change in The Blackeye Goby, Coryphopterus nicholsii. General and Comparative Endocrinology. 118: 273–283.
Liem KF. 1963. Sex Reversal as Natural Process in the Synbranchiform Fish (Monopterus albus). Copeia. American Society of Ichthyologists and Herpetologists.
Miura T, Miura CI. 2003. Molecular Control Mechanisms of Fish Spermatogenesis. Fish Physiology Biochemistry. 28: 181–186.
Navarro-Martin L, Mercedes B, Francecs P. 2008. Masculinization of the European Sea Bass (Dicentrarchus labrax) by Treatment with an Androgen or Aromatase Inhibitor Involves Different Gene Expression and has Distinct lasting Effects on Maturation. General and Comparative Endocrinology. 168: 3-11.
Nozu R, Kojima Y, Nakamura M. 2009. Short Term Treatment with Aromatase inhibitor Induces Sex Change in The Protogynous Wrasse, Halichoeres trimaculatus. General Comparative Endocrinology. 161: 360–364. Prihatman. 2000. Budidaya Ikan Belut (Synbranchus). Proyek Pengembangan
Ekonomi Masyarakat Pedesaan. BAPPENAS.
Schulz RW, Nobrega RH. 2011. Anatomy and Histology of Testis. Elsevier. Utrecht University. Netherland.
Shi Q. 2005. Melatonin is involved in sex change of the rice-field eel, Monopterus albus Zuiew. Fish Biology and Fisheries. 15: 23–36.
Singh AK. 2013. Introduction of Modern Endocrine Techniques for The Production of Monosex Population of Fishes. General Comparative Endocrinology. 181: 146-155.
Selim MK, Ai Shinomiya, Hiroyuki O, Satoshi H, Mitsuru S. 2009. Effect of High Temperature on Sex Differentiation and Germ Cell Population in Medaka, Oryzias latipes. Aquaculture Journal. 289: 340-349.
Seralini GE, Moslemi S. 2001. Aromatase Inhibitors: Past, Present and Future.
Molecular and Cellular Endocrinology. 178: 117-131.
Server DM, Halliday T, Waight V, Brown J, Davies HA, Moriarty E.C. 1999. Sperm Storage in Female of The Smoth New (Triturus vulgaris L.): Ultrastructure of The Spemathecal During The Breeding Season.
Tang F, Chan STH and Lofts B. 1974. Effect of Steroid hormones on the Process of Natural Sex Reversal in the Rice-Field eel, Monopterus albus
(Zuiew). General and Comparative Endocrinology. 24: 227–241. Tao Ya-Xiong, Hao-Ren L, Glen VDK, Richard EP. 1993. Hormonal Induction of
Precocious Sex Reversal in The Ricefield Eel, Monopterus albus.
Aquaculture. 118: 131-140.
Watts M, Ned WP, Henry RK. 2004. Maintenance of Atlantic Salmon (Salmo salar) at Elevated Temperature Inhibits Cytochrome P450 Aromatase Activity in Isolated Ovarian Follicles. General and Comparative Endocrinology. 135: 381-390.
Yeung WSB, Chan STH. 1987. The Plasma Sex Steroid Profiles in The Freshwater, Sex Reversing Teleostei fish, Monopterus albus Zuiew.
General and Comparative Endocrinology. 65: 233-242.
Lampiran 1 Prosedur pengambilan sampel darah Belut Sawah
1. Ikan dibius dengan menggunakan stabilizer dengan dosis 1 ml/L air selama 10 menit.
2. Setelah pingsan, darah diambil dari arah caudal tepat dibawah anus sebanyak 0,7-1,0 ml dengan menggunakan siring ukuran 1 ml yang telah diberi antikoagulan (larutan citrate-phospate-dextrose, produk Laboratorium Kesehatan ikan), kemudian dimasukkan kedalam tube. 3. Darah yang terdapat didalam tube selanjutnya disetrifuge dengan
kecepatan 5000 rpm selama 5 menit sampai 10 menit.
4. Supernatan yang terbentuk diambil dan dimasukkan kedalam tube baru. Kemudian disimpan dalam freezer pada suhu -4oC hingga akan dilakukan analisis.
Lampiran 2 Prosedur analisis testosteron dan estradiol plasma menggunakan teknik ELISA dengan Vidas ELISA Kit (EIA 2693 untuk estradiol dan EIA 1559 untuk untuk testosteron)
1. Semua reagen harus dibiarkan pada suhu kamar (18-25 °C) sebelum digunakan. Selanjutnya, dipersiapkan terlebih dahulu larutan standar dengan kosentrasi 12,5;25;50;100;250;1000;2000 pg/ml dan larutan QC (quality control).
2. Larutan standar, QC dan sampel dimasukkan kedalam sumur plate
(microplate) masing-masing sebanyak 25 µl.
3. Selanjutnya ditambahkan 200 l enzim konjugat ke dalam setiap sumur, kemudian dikocok perlahan selama kurang lebih 10 detik. Kemudian diinkubasi pada suhu kamar selama 2 jam untuk estradiol dan 60 menit untuk testosteron.
4. Larutan pada pelat dibuang dan dicuci dengan larutan pencuci (washing solution) dengan volume 100 l pada masing-masing sumur. Pencucian dilakukan sebanyak 4 kali menggunakan alat Microplate Strip Washer Elx50TM. Setelah pencucian selesai, keringkan dengan cara dibanting secara perlahan pada kertas penyerap. Lalu ditambahkan 100 l (untuk estradiol) dan 200 µl (untuk testosteron) larutan substrat (TBM Substrate) pada masing-masing sumur pelat.
5. Inkubasi selama 20 menit pada suhu ruang. Setelah inkubasi dengan larutan substrat, reaksi enzimatis dihentikan dengan menambahkan 50 l (untuk estradiol) dan 100 µl (untuk testosteron) larutan penghenti (Stop Solution, H2SO4 0,5 M) ke dalam setiap sumur pelat.
6. Kemudian masukkan mikro plate kedalam elisa Elisa Spectrophotometer. 7. Setelah itu, absorbans dibaca pada panjang gelombang 450 nm
menggunakan ELISA reader (absorbance microplate reader Elx808TM) yang telah dilengkapi dengan program Gen 5 (BioTek® Instruments, Inc.). Pembacaan dilakukan tidak lebih dari 10 menit setelah penambahan larutan penghenti reaksi.
Lampiran 3 Prosedur histologi gonad mengacu pada metode Gunarso (1989) 1. Ikan dibedah dan diambil jaringan gonadnya, kemudian dicuci dengan
2. Pindahkan kedalam larutan alkohol 70% beberapa kali selang 1 jam sampai kuning telur menghilang.
3. Setelah itu dehidrasi dilakukan dengan merendam organ sampel dalam larutan alkohol bertingkat (80%, 85%, 90% dan 95%) masing-masing selama dua jam, kemudian dipindahkan kedalam alkohol 100% sebanyak empat kali masing-masing selama satu jam.
4. Berikutnya clearing yaitu dengan merendam sampel organ dalam alkohol 100%+xylol dengan perbandingan 1:1 selama 45 menit.
5. Infitrasi yaitu dengan merendam organ sampel dalam xylol+parafin (1:1) selama 45 menit pada suhu 60oC. Kemudian direndam dalam parafin I, II dan III masing-masing selama 45 menit dalam suhu 63oC.
6. Setelah itu organ ditanam dalam blok parafin cair pada suhu 60oC sampai parafin mengeras selama 24 jam.
7. Kemudian spesimen dipotong setebal 6-7 µm, kemudian ditempel pada glas objek yang telah ditetesi ewid, renggangkan diatas alat pemanas dan keringkan selama 24 jam pada suhu 45oC.
8. Lalu dilakukan deparafinasi yaitu dengan merendam preparat secara berturut-turut xylol I, II, alkohol 100% I, alkohol 100% II, 95%, 90%, 85%, 80%, 70% dan 50% masing-masing selama 1 menit dan dicuci sampai warna putih.
9. Untuk pewarnaan, preparat direndam dalam larutan haemotoxylin selama dua menit, kemudian dicuci dengan air mengalir, setelah itu direndam dalam larutan eosin selama dua menit, kemudian dicuci kembali dengan air mengalir.
10.Selanjutnya dilakukan dehidarasi dengan cara merendam preparat dalam alkohol 70%, 80%, 85%, 90% I, 95% II, 100% I dan 100% II masing-masing selama satu menit.
11.Setelah itu preparat direndam dalam xylol I dan II masing-masing selama satu menit.
12.Kemudian preparat diberi zat perekat dan ditutup dengan cover glass,
dikeringkan selama 10 menit. Berikutnya preparat diberi label sehingga didapatkan preparat permanen histologi gonad yang dapat diamati dibawah mikroskop.
Lampiran 4 Kandungan oksigen terlarut pada perlakuan aromatase inhibitor dan suhu 32oC minggu ke 0-6
Perlakuan Oksigen Terlarut (DO) mg/L
M-1 M-2 M-3 M-4 M-5 M-6
Lampiran 5 pH air pada perlakuan aromatase inhibitor dan suhu 32oC minggu ke
Keterangan: * : mg/kg bobot ikan
Lampiran 6 Suhu air pada perlakuan aromatase inhibitor dan suhu 32oC minggu ke 0-6
Keterangan: * : mg/kg bobot ikan
Lampiran 7 Indeks kematangan gonad belut sawah minggu ke-6
Ulangan ke- GSI (%)
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05). * : mg/kg bobot ikan
Lampiran 8 Pertumbuhan bobot tubuh belut sawah pada minggu ke-0 sampai minggu ke-6
Lampiran 9 Pertumbuhan panjang tubuh belut sawah minggu ke-0 sampai minggu ke-6
Minggu ke- Perlakuan
Kontrol AI 0,001* 0,01* AI 0,1* Suhu 32oC
1 0,01 0,04 0 0,01 0
2 0,12 0,03 0,13 0,21 0,06
3 0,01 0 0,16 0,37 0,26
4 0,11 0,24 0,25 0 0
5 0,07 0,27 0,02 0,62 0
6 0,16 0 0,23 0,49 0
Jumlah 0,48 0,58 0,79 1,7 0,32
Rerata 0,14a 0,10a 0,13a 0,28a 0,05a
Stdev 0,06 0,12 0,10 0,25 0,10
RIWAYAT HIDUP
Penulis memiliki nama lengkap Hafif Syahputra, S.Pi merupakan anak ke dua dari tujuh bersaudara dari pasangan Drs. Hifni dan Zulinda. Penulis dilahirkan dikota Medan pada tanggal 17 Maret 1989. Penulis menyelesaikan pendidikan dasar di SD Negeri 060877 Medan pada tahun 2001. Pada tahun 2004 penulis berhasil menyelesaikan pendidikan lanjutan pertama di SLTP Taman Harapan Medan. Pada tahun 2007 penulis berhasil menyelesaikan pendidikan menengah atas di Madrasah Aliyah Negeri 1 Medan. Pendidikan sarjana ditempuh pada tahun 2007 di Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan Universitas Riau, Pekanbaru dan lulus pada tahun 2011.
Pada tahun 2011 genap penulis mendapat kesempatan untuk melanjutkan pendidikan Magister Sains pada Sekolah Pascasarjana Institut Pertanian Bogor. Penelitian yang dilakukan penulis untuk menyelesaikan studi Magister Sains berjudul “Maskulinisasi Belut Sawah (Monopterus albus) Melalui Induksi Aromatase Inhibitordan Suhu”.