MORFOLOGI, FISIOLOGI, PRESERVASI SEL SPERMA
IKAN BETOK
Anabas testudineus
BLOCH. DAN
KETAHANANNYA TERHADAP KEJUT LISTRIK
FAJAR MAULANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Morfologi, f
isiologi,
preservasi sel sperma ikan betok Anabas testudineus Bloch. dan
ketahanannya terhadap kejut listrik”
adalah benar karya saya dengan arahan dari
komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan
tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang
diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut
Pertanian Bogor.
Bogor, Agustus 2014
Fajar Maulana
RINGKASAN
FAJAR MAULANA. Morfologi, fisiologi, preservasi sel sperma ikan betok
Anabas testudineus Bloch. dan ketahanannya terhadap kejut listrik.
Dibimbing oleh ALIMUDDIN dan MUHAMMAD ZAIRIN JUNIOR.
Ikan betok (Anabas testudineus Bloch) merupakan ikan air tawar asli perairan Indonesia yang memiliki potensi untuk dikembangkan serta termasuk ke dalam jenis ikan ekonomis tinggi untuk daerah Kalimantan. Pengembangan budidayanya terkendala oleh tingkat keseragaman ukuran ikan hasil panen yang sangat rendah, hal ini disebabkan oleh sifat dimorfisme seksual. Faktor lain yang harus segera dikembangkan adalah peningkatan pertumbuhan ikan betok agar waktu yang diperlukan untuk mencapai ukuran konsumsi menjadi lebih pendek.
Perbaikan pertumbuhan melalui metode rekayasa genetik dapat dilakukan menggunakan metode seleksi, transgenesis, dan poliploidisasi. Syarat utama rekayasa genetika pada ikan meliputi penguasaan metode pemijahan buatan yang terkontrol, proses preservasi sperma yang baik, serta pengetahuan terkait sel gamet ikan uji. Kualitas sperma yang baik dan dalam keadaan inaktif selama proses elektroporasi sangat menentukan keberhasilan transgenesis. Pada penelitian ini dilakukan pengamatan morfologi dan fisiologi sperma, penentuan larutan fisiologis pada proses preservasi jangka pendek, serta evaluasi efek voltase dan jumlah kejutan listrik berbeda terhadap motilitas dan viabilitas sperma ikan betok.
Penelitian dibagi ke dalam tiga tahap. Pada tahap I, studi morfologi sperma ikan betok dilakukan dibawah mikroskop dengan perbesaran 1000 kali, selanjutnya dilakukan pengukuran panjang dan lebar bagian sperma. Pada tahap ini juga dilakukan studi fisiologi sperma ikan betok yaitu: pengukuran tingkat osmolaritas tubuh ikan betok yang dilakukan pada bagian tubuh ikan total dan gonad; pengukuran volume cairan sperma, pengukuran spermatokrit, kepadatan sperma serta pengukuran pH sperma. Selanjutnya adalah pengujian fisiologis sel sperma ikan betok yang dilakukan dengan melarutkan sperma ikan betok pada larutan fisiologis (NaCl), lama penyimpanan dan suhu udara yang berbeda. Selanjutnya larutan fisiologis yang efektif digunakan untuk preservasi sperma ikan betok pada penelitian tahap I, yaitu larutan NaCl 13 g/L diujikan pada penelitian tahap II dengan melakukan pemijahan ikan betok menggunakan metode berbeda, yaitu: pemijahan semi-alami, pemijahan buatan dengan pengalinan induk, dan metode pemijahan buatan menggunakan sperma hasil preservasi. Setiap metode pemijahan dicobakan menggunakan satu set induk ikan betok (1 ekor betina: 3 ekor jantan) dengan tiga kali ulangan. Sebanyak 500 butir telur hasil pemijahan ikan betok pada masing-masing metode dikoleksi dan ditempatkan pada wadah plastik bervolume 0.5 L untuk ditetaskan dan dipelihara hingga berumur 10 hari. Penelitian tahap III bertujuan mengevaluasi efektivitas kejutan listrik terhadap viabilitas sel sperma ikan betok yang dilakukan dalam dua tahap. Tahap pertama adalah penentuan batas voltase maksimum yang diberikan pada sperma, dan proses kedua adalah penentuan jumlah kejutan listrik yang diberikan pada sperma.
berturut-turut 35.54±4.66 µm; 1.83±0.20 µm; 0.93±0.23 µm; dan 33.05±1.40 µm, serta lebar kepala sperma sebesar 1.48±0.21 µm. Total estimasi durasi pergerakan sperma dalam air adalah selama 116±34 detik. Induksi ovaprim meningkatkan volume sperma, pH, kepadatan dan total sperma (p<0.05). Tingkat osmolaritas tubuh dan testis ikan betok berkisar antara 390-405 mOsmol/kg, setara dengan osmolaritas larutan NaCl 13 g/L (407 mOsmol/kg). Penyimpanan sperma yang diencerkan dengan larutan fisiologis NaCl 13 g/Lhanya dapat bertahan maksimum selama 60 menit pada suhu ruang (27 °C) dan suhu dingin (4 °C), sedangkan tanpa pengenceran dapat bertahan selama 360 menit. Preservasi testis cacah untuk pemijahan buatan ikan betok tidak berbeda dengan metode konvensional (semi-alami) terkait derajat pembuahan, dan kelangsungan hidup larva hingga 10 hari pascatetas. Proses elektroporasi pada sperma ikan betok dengan pengencer larutan NaCl 13 g/L berhasil dilakukan menggunakan program dengan lama kejut 0.5 milidetik, jeda antar kejut 0.1 detik, dan pengujian voltase 50, 125, 250, dan 500 volt serta jumlah kejut 1, 3 dan 5 kali. Peningkatan voltase dan jumlah kejut yang diberikan saling berinteraksi menurunkan motilitas dan viabilitas sperma (p<0.05). Perlakuan voltase 50 volt dan jumlah kejut 1 kali tidak memberikan perbedaan yang signifikan terhadap perlakuan kontrol pada parameter motilitas dan viabilitas sperma. Metode kejut tersebut berpotensi digunakan sebagai metode kejut listrik terhadap sperma ikan betok untuk memperoleh ikan transgenik melalui metode elektroporasi.
SUMMARY
FAJAR MAULANA. Physiology, morphology, preservation of climbing perch sperm and the endurance to electric shock. Supervised by ALIMUDDIN and MUHAMMAD ZAIRIN JUNIOR.
Climbing perch (Anabas testudineus Bloch) is a native freshwater fish in Indonesia, which has potential to be developed and one of fish spesies with high economical values in Borneo. Development of culture is constrained by the low level of uniformity of fish size, due to the nature of sexual dimorphism. Another factor that should be developed is growth improvement of damselfish, so the time required to reach consumption size becomes shorter.
Growth improvement through genetic engineering methods can be performed using the method of selection, transgenesis, and poliploidisation. The main requirement on fish genetic engineering methods includes mastery of controlled artificial spawning, sperm preservation process and knowledge of fish gamete cells. Good sperm quality and inactive state during the electroporation process will determine the success of transgenesis. The aims of study were to observe the physiology and morphology of sperm, determin physiological solution, and evaluate the effects of different voltage and number of electric shocks on sperm motility and viability of climbing perch.
This study is divided into three stages. In the first stage, sperm morphology of climbing perch observed under a microscope with 1000 times magnification, then measured the length and width of the sperm. At this stage also carried out studies of sperm physiology of climbing perch: measurement of body osmolarity of climbing perch were observed on the total body and gonads; sperm volume, spermatokrit, sperm density and sperm pH. Sperm physiological testing observed by dissolving climbing perch sperm in physiological solution (NaCl) with different storage time and temperatures. An effective physiological solution used for the preservation of fish sperm on the first phase is NaCl 13 g/L wich used in stage two for fish spawning with using different methods, semi-natural spawning, artificial spawning and artificial spawning with preserved sperm. Each method of spawning used a set of climbing perch broodstock (1 females: 3 males) with three replications. A total of 500 eggs on the results of each method were collected and placed on a 0.5 L plastic containers to be incubated and reared until 10 days Post hatch. Stage III was done to evaluate the effectiveness of electric shock on viability of climbing perch sperm cells conducted in two stages. The first stage is the determination of the maximum voltage limits and the second is the determination of the amount of electric shocks given to the sperm.
mOsmol kg-1). Sperm in physiological solution (13 g/L NaCl) could be stored for a
maximum of 60 minutes at room temperature (27 °C) and cold temperature (4 °C), while without physiological solution storage could be 360 minutes. Preserved testicular climbing perch for artificial spawning was similar to the conventional method (semi-artificial spawning) in terms of fertilization and survival rate of larvae up to 10 days after hatching. Electroporation of climbing perch sperm diluted in 13 g/L physiological solution was successfully performed using a program with a long shock of 0.5 milliseconds, the interval shock 0.1 seconds, and the voltage 50, 125, 250, and 500 volts, and the amount of shock 1, 3, and 5 times. Increasing the voltage and number of shock was given lower levels of sperm motility and viability (p<0.05). The use of 50 volts and single shock treatments provided similar sperm performance to the control. This shock method could potentially used as a method of electric shock on climbing perch sperm to obtain transgenic fish through electroporation method.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
MORFOLOGI, FISIOLOGI, PRESERVASI SEL SPERMA
IKAN BETOK
Anabas testudineus
BLOCH. DAN
KETAHANANNYA TERHADAP KEJUT LISTRIK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Morfologi, fisiologi, preservasi sel sperma ikan betok Anabas testudineus Bloch. dan ketahanannya terhadap kejut listrik
Nama : Fajar Maulana NIM : C151120491
Disetujui oleh Komisi Pembimbing
Dr Alimuddin, SPi, MSc Ketua
Prof Dr Ir M. Zairin Junior, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 20 Agustus 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang
dipilih dalam penelitian ini adalah “
Morfologi, f
isiologi, preservasi selsperma ikan betok Anabas testudineus Bloch. dan ketahanannya terhadap kejut listrik”. Penelitian ini dilaksanakan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan; Laboratorium Embriologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor; dan Laboratorium Genetika Ikan, Balai Besar Pengembangan Budidaya Air Tawar, Sukabumi. Waktu pelaksanaan penelitian adalah bulan Februari 2014 s.d April 2014.
Penulis menyadari bahwa selesainya tesis ini tidak lepas dari segala bantuan dan dukungan berbagai pihak, baik ide, pemikiran, tenaga, moril maupun material. Oleh karena itu penulis ingin menyampaikan rasa terima kasih kepada Bapak Dr. Alimuddin S.Pi, M.Sc dan Bapak Prof. Dr. Ir. Muhammad Zairin Junior M.Sc selaku komisi pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian, hingga penulisan tesis. Penulis juga menyampaikan rasa terima kasih kepada Prof. Dr. Ir. Ridwan Affandi DEA sebagai dosen penguji tamu dan Dr. Dinamella Wahjuningrum S.Si, M.Si sebagai wakil ketua program studi Ilmu Akuakultur SPS IPB yang telah memberikan saran dan semangatnya dalam ujian sidang tesis ini.
Terima kasih disampaikan kepada Direktorat Jendral Pendidikan Tinggi (DIKTI) Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) sehingga penulis dapat memperdalam ilmu di Sekolah Pascasarjana Institut Pertanian Bogor.
Terima kasih dan penghargaan yang tinggi penulis haturkan kepada ayahanda H Ahmad Kamaludin S.Ag dan Ibunda Dra Hj Siti Fatonah atas do’a, bantuan, dukungan dan semangatnya. Terima kasih kepada seluruh rekan-rekan S2 Ilmu Akuakultur angkatan 2012 atas kebersamaannya dalam menempuh studi. Kepada rekan-rekan Laboratorium Fisiologi Reproduksi Ikan: Darmawan Setia Budi S.Pi, M.Si; Deny Wahyudi S.Pi; Rahmat Hidayat S.Pi; Fariduddin At-thar S.Pi, M.Si, Rangga Garnama S.Pi; Anna Octavera S.Pi, MSi; Dr. Ir. Suci Antoro M.Sc; Dr. Ir. Muhammad M.Si; kang Dedi, Pak Aam dan teknisi kolam percobaan lainnya, serta adik-adik S1 Budidaya perairan atas kebersamaan dan kerjasamanya selama penelitian.
Akhir kata, semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan umumnya dan perikanan khususnya.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 4
Ikan Betok 4
Preservasi Sperma 4
Transgenesis 4
Elektroporasi 5
3 METODE 6
Penelitian tahap pertama: Studi morfologi dan fisiologis sperma ikan
betok 6
Penelitian tahap kedua: Pengujian pemijahan ikan betok menggunakan
metode berbeda 7
Penelitian tahap ketiga: Evaluasi efektivitas kejutan listrik terhadap
viabilitas sperma ikan betok 7
Parameter uji 8
Analisis statistik 9
4 HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 13
5 KESIMPULAN DAN SARAN 18
Kesimpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 24
DAFTAR TABEL
1 Pengujian fisiologis sperma ikan betok 7
2 Program pengujian kejut listrik terhadap sperma ikan betok 8 3 Bobot induk dan karakteristik sifat fisiologis cairan sperma ikan betok 11 4 Motilitas dan kualitas sperma yang diencerkan dengan larutan
fisiologis berbeda 11
5 Kualitas sperma (motilitas) pasca penyimpanan menggunakan larutan
NaCl 13 g/L 12
DAFTAR GAMBAR
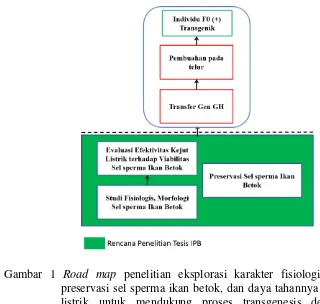
1 Road map penelitian eksplorasi karakter morfologi, fisiologis, preservasi, sel sperma ikan betok dan ketahanannya terhadap kejut listrik untuk mendukung proses transgenesis dengan metode elektroporasi 3
2 Sperma ikan betok 10
3 Derajat pembuahan dan kelangsungan hidup larva ikan betok
menggunakan sperma dengan cara koleksi berbeda 12 4 Viabilitas sperma ikan betok setelah diberi kejut listrik dengan voltase
dan jumlah kejutan berbeda 13
DAFTAR LAMPIRAN
1 Unit peralatan untuk pelaksanaan elektroporasi pada sperma 23
2 Kriteria penilaian motilitas spermatozoa 24
3 Grafik hubungan tingkat salinitas NaCl analitik (g/L) dan osmolaritas
1
PENDAHULUAN
Latar Belakang
Ikan betok (Anabas testudineus Bloch) merupakan ikan air tawar asli perairan Indonesia yang memiliki potensi untuk dikembangkan serta termasuk ke dalam jenis ikan ekonomis tinggi untuk daerah Kalimantan, khususnya Kalimantan Selatan dan Kalimantan Tengah. Harga ikan ini dapat mencapai Rp60.000 per kg pada perdagangan normal pasar tradisional Kalimantan Selatan dan meningkat hingga Rp130.000 per kg pada saat musim penghujan.
Dalam rangka pemenuhan permintaan ikan betok melalui kegiatan budidaya, metode pembenihannya telah dikembangkan oleh Widodo et al. (2007), tetapi proses budidayanya terkendala oleh hasil panen yang memiliki tingkat keseragaman yang sangat rendah, hal ini disebabkan oleh sifat dimorfisme seksual ikan betok. ikan betok betina memiliki pertumbuhan yang lebih cepat bila dibandingkan dengan ikan betok jantan, sehingga keseragaman ukuran ikan pada saat panen menjadi sangat beragam. Faktor lain yang harus segera dikembangkan adalah peningkatan pertumbuhan ikan betok agar waktu yang diperlukan untuk mencapai ukuran konsumsi menjadi lebih pendek. Faktor pertumbuhan sangat dipengaruhi oleh faktor internal (genetika) dan faktor eksternal (lingkungan). Perbaikan pertumbuhan melalui metode rekayasa genetik dapat dilakukan menggunakan metode seleksi, transgenesis, dan poliploidisasi. Syarat utama rekayasa genetika pada ikan meliputi penguasaan metode pemijahan buatan yang terkontrol, proses preservasi sperma yang baik, serta pengetahuan terkait sel gamet ikan uji. Informasi terkait tingkat sensitivitas sperma pada proses penyimpanan jangka pendek sperma sangat penting diketahui untuk program manajemen induk. Hal ini dapat didapatkan dengan melakukan studi aktivasi, motilitas dan fertilitas sperma yang diawetkan (Billard & Cosson 1992; Billard et al. 1995).
Rekayasa transgenesis memiliki beberapa kelebihan dibandingkan dengan metode lainnya, di antaranya adalah dapat menghasilkan perbaikan genetik atau karakter yang diinginkan lebih cepat dapat diwariskan pada generasi selanjutnya (Yaskowiak et al. 2006), dan tingkat perbaikan kualitas genetik lebih tinggi daripada metode pemuliaan lainnya. Transfer gen dapat dilakukan menggunakan metode elektroporasi pada telur dan sperma ( Lu et al. 2002). Faktor utama penentu keberhasilan introduksi DNA eksogen ke dalam sel sperma adalah keberhasilan mempertahankan sperma dalam keadaan inaktif, dan mampu membuahi telur. Sperma ikan betok dapat dikeluarkan dari tubuh induk jantan melalui pengalinan (stripping), tetapi dalam praktiknya sperma yang dikeluarkan pada proses pengalinan telah aktif karena cairan urin keluar bersamaan dengan sperma. Penggunaan larutan fisiologis yang sesuai akan mendukung keberhasilan transgenesis pada ikan betok. Oleh karena itu, kesesuaian antara larutan bufer DNA dan larutan fisiologis ikan merupakan suatu parameter yang harus diketahui terlebih dahulu sebelum melakukan elektroporasi.
2
dengan voltase 9 kV. Symonds et al.(1994) juga mengemukakan bahwa aktivitas sperma ikan chinook salmon menurun dari 82% menjadi 2% setelah sperma dielektroporasi dengan voltase yang meningkat dimulai dari 625 V/cm sampai 1000 V/cm. Dengan demikian voltase yang sesuai untuk sperma ikan yang akan dibuat menjadi transgenik perlu diketahui agar pembuahan dan persentase ikan transgenik yang dihasilkan menjadi tinggi.
Perumusan Masalah
Waktu yang diperlukan ikan betok untuk mencapai ukuran konsumsi (bobot tubuh 100 g) berkisar antara 6-7 bulan pada pemeliharaan di kolam tanah dengan kepadatan rendah (10-50 ekor/m2), ukuran benih yang digunakan adalah umur 1 bulan (panjang total 3-5 cm) dengan tingkat pemberian pakan sebesar 5-10% biomassa per hari (RSNI 2014). Peningkatan laju pertumbuhan ikan betok melalui transgenesis diharapkan dapat memperpendek lama waktu budidaya.
Metode transfer gen yang umum digunakan adalah mikroinjeksi pada embrio. Namun demikian ukuran telur ikan betok relatif kecil dan telurnya relatif mudah pecah. Metode alternatif yang dapat dilakukan adalah transfer gen dengan metode elektroporasi, dengan syarat dikuasainya proses pemijahan buatan. Dengan demikian metode transfer gen menggunakan metode elektroporasi berpeluang dilakukan pada ikan betok karena proses pemijahan buatannya telah sudah dikuasai dengan baik.
Proses koleksi sperma untuk menunjang metode elektroporasi yaitu sebagai media utama pembawa gen penting dilakukan. Sperma ikan betok dapat dikeluarkan dari tubuh induk jantan melalui pengalinan, tetapi dalam praktiknya sperma yang dikeluarkan pada proses pengalinan telah aktif karena cairan urin keluar bersamaan dengan sperma. Sehingga proses koleksi sperma serta penanganannya perlu diketahui. Penggunaan larutan fisiologis yang sesuai pada proses preservasi akan mendukung keberhasilan transgenesis pada ikan betok.
Motilitas sperma pascaelektroporasi dipengaruhi oleh kuat medan listrik, lama kejutan, jumlah kejutan, dan kekuatan ionik bufer (Symonds et al. 1994). Berdasarkan penelitian Cheng et al. (2002), motilitas sperma ikan ayu menurun hingga 50% setelah 120 detik pasca diberi kejutan dengan voltase 9 kV. Symonds
et al. (1994) juga mengemukakan bahwa aktivitas sperma ikan chinook salmon
menurun dari 82% menjadi 2% setelah sperma dielektroporasi dengan voltase yang meningkat dimulai dari 625 V/cm menjadi 1000 V/cm. Oleh karena itu perlu diketahui batas ketahanan sperma terhadap kuat medan listrik kejutan, serta jumlah kejutan yang diberikan dengan tujuan mengetahui metode elektroporasi yang sesuai agar proses pemasukan DNA eksogen ke dalam sperma berhasil.
Tujuan Penelitian
3 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat berperan sebagai model penerapan transgenesis melalui metode elektroporasi terhadap sperma ikan betok dalam mendukung upaya pengembangan budidaya ikan betok, khususnya sebagai solusi peningkatan pertumbuhan ikan betok dalam sistem budidaya, dan dimanfaatkan sebagai sumber protein pangan masyarakat.
Ruang Lingkup Penelitian
Road map penelitian ini diuraikan pada Gambar 1. Penelitian ini mencakup proses identifikasi, proses penanganan, proses preservasi sel sperma serta pengujian ketahanannya terhadap kejutan listrik pada proses elektroporasi guna mendukung keberhasilan proses transfer gen.
4
2
TINJAUAN PUSTAKA
Ikan Betok
Ikan betok (Anabas testudineus Bloch.) termasuk ke dalam jenis ikan
blackfish, yaitu ikan yang memiliki ketahanan serta dapat bertahan hidup pada kondisi lingkungan yang buruk (de Graaf 2003) seperti rendahnya oksigen terlarut, tingginya kadar amoniak, tingginya kekeruhan dan pH yang rendah. Kegiatan pembenihan serta pemeliharaan larva ikan betok telah dilakukan oleh beberapa peneliti sebelumnya, dan dilaporkan bahwa pemijahan ikan betok pada kondisi terkontrol di laboratorium dapat dilakukan sepanjang tahun. Widodo et al. (2007) melakukan pemijahan ikan betok dengan terlebih dahulu melakukan perangsangan pemijahan menggunakan ovaprim dengan dosis 0.5 mL/kg ikan. Penelitian tersebut mengungkapkan bahwa dengan menggunakan pakan yang dihaluskan, tingkat kelangsungan hidup larva yang ditebar di kolam hingga berumur 1 bulan yakni sebesar 10-30% dengan ukuran ikan sebesar 1-3 cm. Sedangkan pemeliharaan larva ikan betok di dalam wadah akuarium yang terkontrol dengan pemberian pakan alami yang sesuai denga stadia hidup larva dapat mempertahankan tingkat kelangsungan hidup larva mencapai 80% pada umur 1 bulan (Maulana 2012).
Preservasi Sperma
Preservasi sperma adalah kegiatan penyimpanan sperma dalam waktu tertentu. Komposisi bahan pengencer semen harus dapat memenuhi kebutuhan dan dapat mempertahankan fungsi fisiologis spermatozoa selama penyimpanan. Bahan pengencer sperma, larutan yang digunakan haruslah memenuhi beberapa persyaratan, yaitu (1) tidak beracun; (2) mempertahankan dan tidak membatasi daya fertilisasi spermatozoa; (3) murah, sederhana dan praktis dibuat, tetapi sperma yang diencerkan mempunyai daya membuahi yang tinggi; (4) menjamin kehidupan spermatozoa dalam waktu lama; (5) memberikan kemungkinan pengujian atau penilaian spermatozoa setelah pengenceran; dan (6) dapat memelihara kehidupan sperma, tetapi tidak menyebabkan sperma aktif selama penyimpanan (Hoar et al. 1971).
Spermatokrit merupakan nilai perbandingan antara padatan yang berupa spermatozoa dengan total semen pascapengendapan menggunakan sentrifugasi. Pada beberapa spesies ikan nilai spermatokrit dapat menjadi indikator tingkat kepadatan sperma dan penentu tahap pemijahan pada ikan jantan pada ikan Atlantic cod (Gadus morhua) (Rakitin et al. 1999).
Transgenesis
5 Tujuan dari transgenesis ini antara lain dapat meningkatkan daya tahan terhadap penyakit (Dunham 2004) dan mengefisienkan laju konsumsi oksigen pada ikan (Cook et al. 2000). Ikan transgenik bisa juga digunakan sebagai bioreaktor untuk memproduksi bahan-bahan yang bersifat komersial dan yang bermanfaat bagi kesehatan manusia (Fletcher & Davies 1991; Collas et al. 2000).
Elektroporasi
Pembuktian pertama kali terkait kemampuan sel membawa DNA eksogen yang dilakukan pada sperma dilakukan oleh Brackett et al. (1971). Percobaan tersebut dilakukan pada sperma kelinci, dan DNA terlokalisasi dalam kepala sperma. Sel sperma bulu babi (Arezzo 1989) dan tikus (Lavitrano et al. 1989) juga dapat digunakan sebagai vektor untuk transfer gen. Sin et al. (2000) menyatakan bahwa sperm-mediated gene transfer (SMGT) merupakan metode yang ideal untuk transfer gen secara massal pada organisme dengan fertilisasi telur secara eksternal seperti pada ikan salmon.
6
3
METODE
Penelitian Tahap Pertama:
Studi morfologi dan fisiologis sperma ikan betook
Pengamatan morfologi sel sperma ikan betok dilakukan menggunakan mikroskop pada perbesaran 400 dan 1000 kali. Sampel sperma yang digunakan berasal dari 4 ekor ikan betok jantan (panjang total 10±2 cm; bobot tubuh 20±5 gram). Sperma dikoleksi dengan cara melakukan pengalinan pada bagian perut ikan, kemudian sperma diencerkan menggunakan larutan eosin 2 g/L sebanyak 10 kali pengenceran. Panjang dan lebar bagian sperma diukur dengan bantuan mikroskop Olympus CX31 tersambung dengan kamera Sony (Color Video Camera) dan komputer yang dilengkapi dengan software OptiLab image raster versi 1.3.2.
Pengukuran tingkat osmolaritas tubuh ikan betok dilakukan pada bagian tubuh ikan total dan gonad. Penggunaan gonad yang dicacah bertujuan untuk mendapatkan sperma semaksimal mungkin, dikarenakan proses pengalinan induk hanya menghasilkan sperma dalam jumlah sedikit. Proses pengujian tingkat osmolaritas dilakukan dengan cara: ikan uji yang digunakan dicacah sampai halus, lalu diambil hasil cacahan sebanyak 1 gram, dan dicampur dengan larutan Na-sitrat (38 g/L) sebanyak 3 mL. Campuran tersebut diambil sebanyak 1.5 mL, dimasukkan ke dalam tabung mikrodan disentrifugasi selama 5 menit dengan kecepatan 6000 rpm. Supernatan yang terbentuk diambil sebanyak 1 mL kemudian diencerkan dengan akuabides sebanyak 15 mL, lalu nilai osmolaritasnya diukur menggunakan
Osmometer (Osmotat 030, Gonotec, Germany). Nilai osmolaritas tubuh dan gonad dihitung berdasarkan rumus pengenceran, yaitu:
V1 x N1 = V2 x N2
Keterangan: V1 = Volume larutan daging dengan Na Sitrat 38 g/L (ml), N1 = Konsentrasi cairan tubuh ikan yang dinyatakan dalam DHL (milidetik/cm), V2 = Volume larutan campuran supernatant dengan akuabides (ml), N2 = Konsentrasi cairan tubuh atau gonad ikan serta pelarut antikoagulan dan akuabides yang dinyatakan dalam Osmolaritas (mOsmol/kg).
7 dipaparkan ke atas kertas pH tersebut, selanjutnya kertas pH disandingkan pada gambar pH indikator.
Analisis fisiologis dilakukan dengan melarutkan sperma ikan betok pada larutan fisiologis (NaCl), lama penyimpanan dan suhu udara yang berbeda (Tabel 1). Induk ikan jantan yang telah matang gonad disuntik dengan ovaprim (Ovaprim, Syntex USA) dengan dosis 0.5 mL/kg bobot ikan pada bagian intramuskuler (Widodo et al. 2007), sekitar 10-12 jam sebelum ikan dibedah untuk koleksi sperma. Hal tersebut dilakukan agar kematangan induk menjadi seragam. Semen dibagi ke masing-masing tabung mikro dan ditambahkan larutan fisiologis yang telah ditentukan. Selang beberapa saat kemudian, dilakukan pengujian motilitas sperma di bawah mikroskop dengan perbesaran 400 kali. Guna memastikan bahwa sperma belum aktif, maka sperma kemudian dicampurkan dengan air untuk aktivasi sperma. Penilaian motilitas sperma didasarkan pada banyaknya sperma yang aktif bergerak maju (progresif) dengan skoring berdasarkan Guest et al. (1976) yang ditampilkan pada Lampiran 2.
Penelitian tahap kedua:
Pengujian pemijahan ikan betok menggunakan metode berbeda
Pemijahan ikan betok dilakukan mengunakan tiga metode berbeda, yaitu pemijahan semi-alami, pemijahan buatan dengan pengalinan induk, dan metode pemijahan buatan menggunakan sperma hasil preservasi. Setiap metode pemijahan dicobakan menggunakan satu set induk ikan betok (1 ekor betina: 3 ekor jantan) dengan tiga kali ulangan.
Sebanyak 500 butir telur hasil pemijahan ikan betok pada masing-masing metode dikoleksi dan ditempatkan pada wadah plastik bervolume 0.5 L. Pengamatan derajat pembuahan dilakukan setelah 12 jam pascapembuahan. Pengamatan derajat penetasan dilakukan setelah 30 jam pascapembuahan. Larva yang berhasil menetas kemudian dipindahkan ke dalam akuarium yang berisi air dengan volume 10 L, larva dipelihara selama 10 hari setelah menetas. Derajat kelangsungan hidup dihitung pada hari terakhir pemeliharaan.
Penelitian tahap ketiga:
Evaluasi efektivitas kejutan listrik terhadap viabilitas sel sperma ikan
Elektroporasi merupakan metode tranfer gen yang menggunakan kejut listrik untuk membantu memasukkan DNA ke dalam sel. Elektroporasi dilakukan dengan menggunakan Gene Pulser II (Biorad, USA) yang ditampilkan pada Lampiran 1, dengan tipe kejutan square wave. Tipe kejutan square wave diketahui lebih baik dan lebih efisien dibandingkan dengan tipe exponential (Takahashi 1991).
8
Pemberian kejutan listrik untuk menguji viabilitas sel sperma ikan betok dilakukan dalam dua tahap. Tahap pertama adalah penentuan batas voltase maksimum yang diberikan pada sperma, dan proses kedua adalah penentuan jumlah kejutan listrik yang diberikan pada sperma.
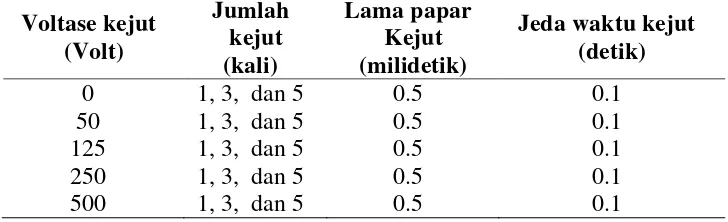
Proses pengujian pertama dilakukan dengan lima program guna mengevaluasi efek dan batasan voltase listrik yang dapat diterima sperma ikan betok (Tabel 2). Pengujian tahap II dilakukan untuk menentukan jumlah kejut listrik yang diberikan pada sperma ikan betok. Pengujian dilakukan dengan memberikan jumlah kejut sebanyak satu, tiga, dan lima kali kejutan listrik pada masing-masing voltase yang terpilih pada tahap pertama dengan lama kejut 0.5 milidetik, dan jeda waktu antar kejutan 0.1 detik.
Pengamatan sperma dilakukan seperti pada penelitian pertama dan dilanjutkan dengan perhitungan derajat kelangsungan hidup sperma hasil elektroporasi dengan metode pewarnaan eosin 0.2 g/L (Hafez 1987). Satu tetes sperma diteteskan dengan menggunakan mikropipet di atas gelas objek dan ditambahkan pewarna eosin dengan perbandingan 1:1, kemudian keduanya dicampurkan secara merata. Penilaian viabilitas sperma didasarkan pada perbedaan kriteria kepala sperma yang berwarna transparan dan aktif bergerak (hidup), sedangkan untuk sperma yang mati akan berwarna merah muda buram dan tidak bergerak serta mengembang (Hafez 1987).
Parameter uji
Motilitas Sperma
Pengamatan motilitas sperma (MS) dilakukan di bawah mikroskop dengan perbesaran 40x10 dan dihitung berdasarkan persentase gerakan sperma yang aktif dengan sperma total.
� = ��
Keterangan : MS = Persentase sperma motil, SM = Jumlah sperma motil, TS = Jumlah sperma total
Viabilitas Sperma
Pengamatan viabilitas sperma (Vs) dilakukan di bawah mikroskop dengan perbesaran 40x10 dan dihitung berdasarkan persentase sperma yang hidup dengan sperma total.
9 � = ℎ�
Keterangan : Vs = Persentase sperma hidup, Sh = Jumlah sperma hidup, TS = Jumlah sperma total
Spermatokrit
Perbandingan antara padatan yang berupa spermatozoa dengan cairan semen pasca proses sentrifugasi.
= �
Keterangan : St = Persentase spermatokrit, S = panjang bagian spermatozoa, TF = Volume cairan semen.
Derajat Pembuahan
Derajat pembuahan (DP) telur adalah nilai yang menunjukkan persentase embrio yang terbuahi sperma, hidup dan mengalami perkembangan hingga fase bintik mata. Perhitungan derajat kelangsungan hidup embrio ini dilakukan pada fase gastrula.
�� = ��
Keterangan : DP = Persentase telur terbuahi, Tb = Jumlah telur terbuahi, JT = Jumlah telur diamati.
Derajat Penetasan
Derajat penetasan (DT) telur adalah nilai yang menunjukkan persentase telur yang berhasil menetas terhadap total telur yang diamati.
� = �
Keterangan : DT = Persentase telur berhasil menetas, Tm = Jumlah telur menetas, JT= Jumlah telur diamati.
Kelangsungan Hidup Larva (Khl)
Persentase jumlah ikan yang mampu bertahan hidup hingga akhir pengamatan pada waktu tertentu.
ℎ = ℎ� �
Keterangan : Khi = Persentase ikan hidup, Jh = Jumlah ikan hidup pada waktu tertentu, Ti = Jumlah total larva pada awal pemeliharaan.
Analisis Statistik
Data dianalisis menggunakan statistik non-parametrik dengan membandingkan nilai rataan pada parameter morfologi sperma, MS, dan nilai osmolaritas tubuh ikan diolah dengan bantuan program Microsoft Excel 2013. Paremeter volume sperma, spermatokrit, kepadatan sperma, jumlah total sperma, DP, DT, Khl, viabilitas sperma hasil elektroporasi dianalisis menggunakan analisis sidik ragam (ANOVA), dan jika terdapat pengaruh nyata dilanjutkan dengan uji
10
4
HASIL DAN PEMBAHASAN
Hasil
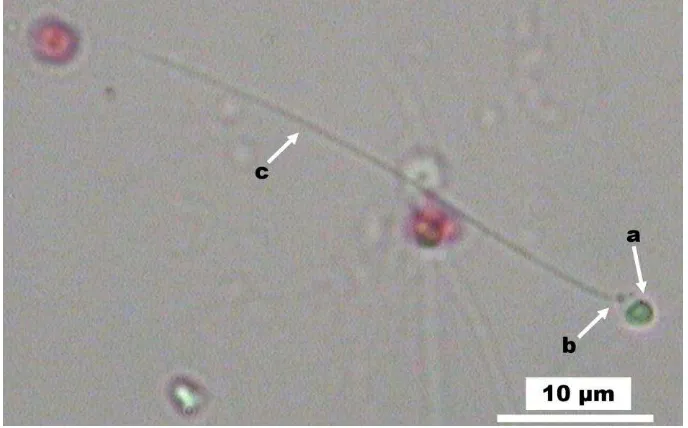
Morfologi Sperma
Morfologi sperma ikan betok ditunjukkan pada Gambar 2. Sperma ikan betok terdiri atas tiga bagian utama, yaitu kepala (Gambar 2a), bagian tengah (Gambar 2b), dan bagian ekor (Gambar 2c). Kepala sperma ikan betok berbentuk oval (Gambar 2). Ukuran panjang total, panjang kepala, panjang bagian tengah, dan panjang ekor adalah berturut-turut 35.54±4.66 µm; 1.83±0.20 µm; 0.93±0.23 µm; dan 33.05±1.40 µm, sedangkan lebar kepala sebesar 1.48±0.21 µm. Total estimasi durasi pergerakan sperma dalam air adalah selama 116±34 detik.
Fisiologi Sperma
Hasil percobaan induksi menggunakan ovaprim terhadap karakter fisiologis ikan betok disajikan pada Tabel 3. Penyuntikan induk jantan ikan betok menggunakan ovaprim secara signifikan (p<0.05) memberikan peningkatan terhadap volume, pH, dan kepadatan sperma (Tabel 3).
Tingkat osmolaritas tubuh ikan betok pada penelitian ini berkisar antara 390-405 mOsmol/kg. Osmolaritas cairan sperma didekati dari nilai osmolaritas gonad, hal ini dikarenakan proses pengalinan induk hanya menghasilkan sperma dalam jumlah sedikit. Osmolaritas gonad yang diamati dari tiga ekor ikan jantan menunjukkan hasil yang sama, yaitu sebesar 390 mOsmol/kg.
11
Hasil yang diperoleh dari proses pengujian larutan fisiologis terhadap sperma ikan betok disajikan pada Tabel 4. Berdasarkan motilitas sebelum dan setelah aktivasi didapatkan bahwa larutan fisiologis dengan konsentrasi NaCl 13 g/L adalah yang terbaik sebagai media pelarut dalam proses penyimpanan sperma. Hasil pengujian osmolaritas yang dilakukan terhadap larutan fisiologis NaCl 13 g/ L menunjukkan nilai yang hampir sama dengan nilai osmolaritas tubuh ikan, yaitu 407 mOsmol/kg. Larutan yang bersifat hiperosmotik terhadap cairan tubuh dan cairan sperma yaitu pada NaCL konsentrasi 14 g/L dan 15 g/L berakibat menurunnya tingkat motilitas sperma. Pengkategorian tingkat osmotik larutan NaCl terhadap tubuh berdasarkan grafik hubungan tingkat salinitas dan osmolaritas larutan yang disajikan pada Lampiran 3.
Preservasi Sperma
Terkait waktu penyiapan proses transfr gen dengan elektroporasi, maka diperlukan informasi lama waktu penyimpanan sperma dengan kualitas tetap tinggi. Proses penentuan metode preservasi menggunakan larutan NaCl 13 g/L sebagai pengencer, dilakukan pada suhu ruang 27 °C dan suhu dingin 4 °C. Hasil penelitian disajikan pada Tabel 5.
Tabel 3 Bobot induk dan karakteristik fisiologis cairan sperma ikan betok jantan
Parameter Non-induksi Induksi
Bobot Induk (gram) 20.67±7.34a 19.08±7.39a Volume Sperma (µL) 9.33±2.21a 101.87±39.53b
pH Sperma 7-8 9-10
Spermatokrit (%) 53.42±12.17a 47.38±12.02a Kepadatan Sperma (x109 mL-1) 16.95±9.71a 27.31±9.76b Total Sperma (x106 sel) 146.65±76.65a 2747.99±1532.59b Keterangan: Induksi hormonal dilakukan menggunakan Ovaprim 0.5 ml/kg induk. Huruf
superskrip berbeda pada baris yang sama menunjukkan nilai yang berbeda nyata (p<0.05).
Tabel 4 Motilitas dan kualitas sperma sebelum dan setelah pengaktifasian menggunakan aquadest
0 5 (Aktif bergerak) Hipo-osmotik 5 (Aktif bergerak) 9 3 (Banyak bergerak) Hipo-osmotik 5 (Aktif bergerak) 10 3 (Banyak bergerak) Hipo-osmotik 5 (Aktif bergerak) 11 1 (Bergetar sedikit) Hipo-osmotik 5 (Aktif bergerak) 12 1 (Bergetar sedikit) Hipo-osmotik 5 (Aktif bergerak)
13 0 (Diam) Iso-osmotik 5 (Aktif bergerak)
12
Seperti disajikan pada Tabel 5, penyimpanan sperma pada suhu ruang lebih baik bila dibandingkan dengan penyimpanan suhu dingin. Penyimpanan sperma dengan pengencer NaCl 13 g/L pada suhu dingin (4 °C) mengakibatkan penurunan kualitas sperma yang lebih cepat bila dibandingkan dengan suhu ruang (27 °C), sedangkan sperma yang disimpan tanpa pengencer dapat bertahan hingga 360 menit dengan skor 5. Sperma disimpan tanpa pengencer mengalami kematian antara menit 360 hingga menit 720. Selanjutnya, preservasi sperma menggunakan NaCl 13 g/L dapat mempertahankan kualitas sperma pada kondisi skor 5 dalam waktu 60 menit, baik pada suhu dingin maupun suhu ruang.
Uji Pembuahan Telur
Hasil pengujian berbagai metode pembuahan telur oleh sperma menggunakan tiga metode berbeda disajikan pada Gambar 3. Derajat pembuahan menggunakan metode semi-alami lebih tinggi bila dibandingkan metode lainnya. Derajat penetasan telur (DT) pada metode pemijahan semi-alami juga lebih tinggi (p<0.05) daripada metode lainnya, sedangkan DT menggunakan metode pengalinan sperma sama dengan cara dicacah (p<0.05). Sementara itu, kelangsungan hidup larva hingga umur 10 hari tidak menunjukkan hasil yang berbeda antar setiap metode yang digunakan.
Hasil dari pengujian ini memberikan pengaruh yang nyata (p<0.05) pada nilai parameter derajat pembuahan menggunakan metode pemijahan semi-alami dan menggunakan sperma yang dikoleksi dari gonad dengan cara dicacah terhadap Tabel 5 Kualitas sperma pasca penyimpanan menggunakan larutan NaCl 13g/L
Penyimpanan Lama waktu penyimpanan (menit)
0 3 5 10 15 30 45 60 120 150 180 240 360 720 Suhu 27°C 5 5 5 5 5 5 5 5 4 1 0.5 0.5 0.5 0
Suhu 4°C 5 5 5 5 5 5 5 5 4 3 1 0.5 0 0
Kontrol 5 5 5 5 5 5 5 5 5 5 5 5 5 0
Keterangan: Kontrol merupakan sperma tanpa pengenceran yang ditempatkan pada suhu ruang 27 °C. Skoring dilakukan berdasarkan Guest (1976).
Gambar 3 Derajat pembuahan dan kelangsungan hidup larva ikan betok menggunakan berbagai sperma dengan cara koleksi berbeda. DP: derajat pembuahan telur oleh sperma, DT: daya tetas telur, Khl: tingkat kelangsungan hidup larva pada 10 hari pascatetas.
13 penggunaan sperma dari hasil proses pengalinan induk, penggunaan sperma hasil pengalinan menurunkan nilai derajat pembuahan telur. Nilai dari parameter derajat penetasan pada metode pemijahan semi-alami menunjukkan perbedaan yang signifikan terhadap metode pemijahan menggunakan metode pengalinan sperma dan sperma yang dikoleksi dari gonad dengan cara dicacah (p<0.05), diketahui bahwa nilai derajat pembuahan menggunakan metode semi-alami lebih tinggi bila dibandingkan metode lainnya. Selanjutnya tingkat kelangsungan hidup larva yang berumur 10 hari, tidak menunjukkan hasil yang berbeda nyata antar setiap metode yang digunakan.
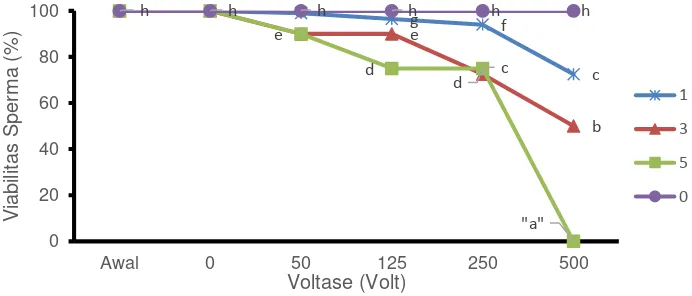
Daya Tahan Terhadap Kejut Listrik
Motilitas dan viabilitas sperma pascakejut listrik ditunjukkan pada Gambar 4. Nilai motilitas dan viabilitas sperma menurun seiring dengan meningkatnya voltase dan jumlah kejut listrik yang diberikan. Faktor voltase dan jumlah kejut berpengaruh nyata terhadap viabilitas sperma (p<0.05), dan terdapat interaksi antara faktor voltase dan jumlah kejut terhadap viabilitas (p<0.05). Viabilitas sperma tertinggi didapat pada perlakuan kontrol, selanjutnya menurun pada setiap perlakuan yang diberikan.
Pembahasan
Sperma ikan betok terdiri atas tiga bagian utama, yaitu kepala, bagian tengah, dan bagian ekor (Gambar 2), sama halnya dengan sperma ikan pada umumnya yang terdiri atas ketiga bagian tersebut (Mattei 1991), tetapi berbeda bila dibandingkan dengan kerabatnya pada subordo Anabantoidei yaitu ikan gurami (Osphronemus goramy) yang hanya memiliki dua bagian sperma yaitu kepala dan ekor sperma (Hardita 2010). Bagian kepala merupakan letak dari inti sel yang mengandung material DNA, sedangkan energi untuk pergerakan sperma bersumber dari mitokondria yang berada pada bagian tengah sperma, dan ekor berfungsi sebagai alat pergerakan sperma (Lahnsteiner & Patzner 2007).
Gambar 4 Viabilitas sperma ikan betok setelah diberi kejut listrik dengan voltase (0, 50, 125, 250 dan 500 volt), dan jumlah kejutan berbeda (0 tanpa kejut, 1, 3, dan 5). Huruf berbeda pada titik dengan perlakuan voltase yang berbeda menunjukkan nilai yang berbeda nyata (p<0.05).
14
Kepala sperma ikan betok berbentuk oval (Gambar 2) dengan ukuran panjang dan lebar berturut-turut 1.83±0.20 µm dan 1.48±0.21 µm. Bentuk kepala sperma ini berbeda serta berukuran lebih kecil dibandingkan sperma ikan gurami yang berbentuk bulat berdiameter 4.8±1.53 µm (Hardita 2010). Ukuran kepala sperma ikan betok juga lebih kecil daripada ikan mas (Cyprinus carpio) sebesar 15.97±6.57 µm (Japet 2011), tetapi lebih besar dibandingkan dengan sperma ikan tawes (Barbonymus gonionotus) sebesar 0.85±0.03 µm (Akbar 2014). Ukuran kepala sperma ikan betok lebih mirip dengan ikan European perch (Perca fluviatilis) yang berbentuk oval dengan panjang kepala 1.87 dan lebar kepala 1.78 (Lahnsteiner 1995), ikan Barbus barbuda (Teleostei: Cyprinidae) yang memiliki panjang kepala sperma sebesar 1.80±0.06 µm (Alavi et al. 2008), ikan Atlantic halibut
(Hippoglossus hippoglossus) dengan panjang kepala 1.43±0.01 µm dan lebar kepala 1.55±0.01 µm (Alavi et al. 2011).
Panjang bagian tengah dan ekor sperma ikan betok berturut-turut adalah 0.93±0.23; 33.05±1.40 µm. Nilai tersebut mendekati ukuran panjang bagian tengah ikan European perch sebesar 0.87 µm dan panjang ekor 30-35 µm. Ukuran panjang total sperma ikan European perch sebesar 30.4-32.4 µm (Lahnsteiner 1995) juga hampir sama dengan panjang total sperma ikan betok (35.54±4.66 µm). Ukuran panjang bagian tengah dan ekor sperma ikan betok juga mendekati ukuran sperma ikan Northern pike (Exos lucius L.) yang memiliki panjang berturut-turut 1.04±0.32 µm, dan 30.12±4.08 µm (Alavi et al. 2009). Panjang ekor sperma ikan betok lebih pendek daripada ikan gurami (42.8±5.60 µm), ikan Southern Hawke (Merluccius australia) yang memiliki panjang bagian tengah 2.99±0.17 µm, panjang ekor kecepatan dan lama waktu pergerakan sperma. Total estimasi durasi pergerakan sperma ikan betok pada penelitian ini adalah selama 116±34 detik, lebih lama daripada lama pergerakan sperma ikan gurami (103.67±2.52 detik), dan sperma ikan Northern pike (90 detik). Perbedaan lama waktu pergerakan sperma diduga terkait dengan perbedaan jumlah mitokondria dan panjang ekor. Hal tersebut sejalan dengan pernyataan Baccetti et al. (1984) bahwa lama waktu pergerakan sperma dapat dikaitkan dengan panjang ekor serta jumlah mitokondria yang berada pada bagian tengah sperma. Jumlah mitokondria ikan berordo Perciformes dari jenis famili Anabantoidei sebanyak 2 buah (Mattei 1991). Dengan ukuran sperma yang hampir sama, sperma ikan betok dan ikan gurami memiliki lama waktu pergerakan yang lebih panjang bila dibandingkan dengan sperma ikan Northern pike. Jumlah mitokondria ikan Northern pike adalah 1 buah (Alavi et al. 2009).
Volume cairan sperma ikan betok pada penelitian diketahui meningkat secara signifikan (p<0.05) akibat induksi ovaprim yang diberikan. Volume sperma ikan tanpa induksi ovaprim adalah sebesar 9.33±2.21 µL dan meningkat sekitar 10 kali lipat, menjadi 101.87±39.53 µL pasca 12 jam induksi ovaprim. Hal yang sama telah dilaporkan oleh Kowalski et al. (2012) pada ikan European smelt bahwa volume semen dan kepadatan sel sperma meningkat sangat drastis pascapenyuntikan
ovaprim, yaitu sebesar 13 kali lipat. Penyuntikan induk ikan gurami menggunakan
15 sperma dari 0.013±0.01 menjadi 0.184±0.13 mL/kg bobot tubuh, atau meningkat sebesar 14 kali lipat (Hardita 2010). Induksi ovaprim pada ikan mas yang dipelihara pada wadah terkontrol serta di alam bebas memberikan peningkatan sebesar 12 kali lipat dan 10 kali lipat terhadap perlakuan kontrol (Seifi et al. 2011). Peningkatan volume cairan sperma tersebut merupakan akibat induksi hormon yang merangsang spermiogenesis. Hal tersebut sejalan dengan pernyataan Nagahama (1994) bahwa hormon gonadotropin akan merangsang sintesis testosteron dan 11-ketotestosteron yang mengakibatkan spermatogenesis dan spermiogenesis. Selain itu, Sukumasavin (2007) mengemukakan bahwa 17a-20ß-dihidroprogesteron yang berasal dari rangsangan LH, menyebabkan sperma dihidrasi oleh larutan seminal yang menghasilkan larutan sperma yang disebut cairan semen, sehingga volume cairan sperma meningkat.
Peningkatan pH yang terjadi pada penelitian ini adalah sebesar 2 satuan. pH cairan sperma ikan tanpa induksi adalah sebesar 7-8, dan meningkat menjadi 9-10 pascainduksi. Peningkatan pH diduga terjadi akibat perubahan regulasi hormon di dalam testis. Hasil yang sama juga dilaporkan oleh Alavi dan Cosson (2005) yang menyatakan bahwa pH sperma ikan salmon meningkat dari 7.5 menjadi 8.0 saat ditransportasikan dari testis menuju saluran sperma yang diakibatkan oleh pengaruh hormonal. Peningkatan pH yang signifikan (p<0.01) juga terjadi pada ikan mas pascainduksi dengan ovaprim dan ekstrak pituitari (Seifi et al. 2011).
Induksi ovaprim yang diberikan pada induk ikan betok tidak mempengaruhi perubahan nilai spermatokrit ikan uji (Tabel 3). Hal yang sama juga ditemukan pada ikan gurami pascainduksi ovaprim (Hardita 2010) dan ikan Atlantic halibut yang diberi perakuan implantasi GnRH(a) Ovaplant (Tvedt et al. 2001). Nilai spermatokrit ikan gurami (6%) lebih rendah bila dibandingkan dengan nilai spermatokrit ikan betok. Hal yang sebaliknya terjadi pada ikan Brycon Amazonicus
yang menunjukkan penurunan nilai spermatokrit pascainduksi ekstrak pituitari ikan mas dan hormon sintesis (GnRH-a) (Pardo-Carrasco et al. 2006).
Tingkat kepadatan dan jumlah total sperma ikan betok meningkat 1.6 dan 1.8 kali lipat dibandingkan dengan ikan tanpa induksi ovaprim. Peningkatan kepadatan dan jumlah total sperma juga terjadi pada ikan gurami akibat induksi ovaprim yang diberikan, yaitu sebesar 1.2 kali lipat (Hardita 2010). Hal serupa juga telah dilaporkan pada ikan Greenback flounder (Rhomboselea tapirina) (Lim et al. 2004), ikan European sea bass (Dicentrarchus labrax) (Schiavone et al. 2006) dan ikan bawal air tawar Colossoma macropomum (Maria et al. 2010).
Tingkat osmolaritas tubuh ikan betok pada penelitian ini berkisar antara 390-405 mOsmol/kg. Osmolaritas gonad yang diamati dari tiga ekor ikan jantan menunjukkan hasil yang sama, sebesar 390 mOsmol/kg. Osmolaritas cairan sperma ikan betok lebih tinggi dibandingkan dengan osmolaritas ikan air tawar pada umumnya, seperti halnya pada ikan mas koki Carassius auratus (317±11 mOsmol/kg), ikan mas (254±16.7 mOsmol/kg) (Morisawa 1985), ikan Tinca tinca
16
ini sejalan sejalan dengan Billard et al. (1995) dan Alavi et al. (2007). Secara umum komposisi ion-ion di dalam cairan sperma meliputi Na+, Ca2+, K+, Cl- dan lainnya, dengan tingkat osmolaritas sebesar 300-350 mOsmol/ kg (Asturiano et al. 2004; Morisawa 2001, 2008; Perez et al. 2003).
Tingkat osmolaritas yang tepat untuk mempertahankan sperma ikan betok dalam keadaan diam seperti di dalam gonad adalah pada larutan fisiologis NaCl 13 g/L atau setara pada tingkat osmolaritas 407 mOsmol/kg (Tabel 4). Pada penelitian ini diketahui bahwa tingkat osmolaritas tersebut mendekati tingkat osmolaritas tubuh dan gonad ikan betok, sehingga sperma terbukti dapat dipertahankan dalam keadaan diam atau tidak aktif. Hal ini seperti yang diungkapkan oleh Cosson (2004) bahwa sperma ikan pada umumnya bersifat tidak aktif atau diam saat berada di dalam testis dan cairan sperma pada banyak spesies. Penggunaan larutan fisiologis dengan konsentrasi NaCl lebih rendah dari 13 g/L menyebakan sperma masih aktif dan bergerak, hal ini menunjukkan bahwa larutan tersebut bersifat hipo-osmotik terhadap cairan sperma dan merangsang sperma untuk aktif dan bergerak.
Penggunaan larut fisiologis dengan konsentrasi yang lebih tinggi, yaitu 14, dan 15 g/L atau bersifat hiper-osmotik dapat mempertahankan sperma dalam keadaan diam atau tidak aktif. Namun demikian, pada konsentrasi NaCl tersebut berdampak pada penurunan tingkat motilitas sperma ikan betok (Tabel 4). Hal ini dapat diakibatkan oleh rusaknya sperma ikan betok karena pemaparan sperma pada larutan NaCl yang melebihi tingkat osmolaritas tubuh. Dampaknya adalah sperma terangsang untuk mengembang atau terjadi pembengkakan, gangguan ini terjadi pada membran plasma diakibatkan oleh perubahan osmotik yang sangat tinggi. Tingkat osmolaritas pada kadar NaCl 14 g/L (425 mOsmol/kg), dan 15 g/L (445 mOsmol/kg) lebih tinggi dari osmolaritas tubuh dan gonad ikan betok. Hal yang sama juga ditemukan pada sperma ikan air tawar lainnya. Sperma bergerak dalam waktu singkat atau bahkan mati saat terpapar larutan dengan osmolaritas melebihi 450 mOsmol/kg(Cosson 2004). Alasan lain adalah karena ion Na+ dan Cl- yang
bersifat toksik pada sperma, sehingga berakibat pada sistem biologis sperma. Salinitas merupakan salah satu parameter kimia air yang keberadaannya dapat bersifat mematikan (lethal factor) jika nilainya berada di luar batas toleransi (masking factor) (Affandi & Tang 2002).
17 dilakukan pada penelitian ini dapat mempertahankan sperma ikan betok dengan kualitas yang sama pada suhu ruang hingga 360 menit. Hal ini sudah cukup lama untuk mendukung pemijahan buatan pada ikan betok.
Hasil yang didapat pada pemijahan ikan betok menggunakan metode pengalinan sperma menunjukkan perbedaan yang signifikan (p<0.05) terhadap metode pemijahan semi-alami dan sperma yang dikoleksi dari gonad dengan cara dicacah (Gambar 3). DP telur pada penelitian ini adalah sebesar 91.13±0.43% dengan metode pemijahan semi-alami, 84.60±0.68% dengan metode pemijahan buatan menggunakan sperma hasil pengalinan, dan 93.07±0.11% dengan metode pemijahan buatan menggunakan sperma hasil preservasi gonad cacah. Nilai DP yang rendah pada metode pengalinan sperma diakibatkan oleh menurunnya kualitas sperma (tingkat motilitasnya) sebelum mencapai telur, sehingga jumlah telur yang berhasil dibuahi menjadi rendah. Hal tersebut berkaitan dengan aktivasi sperma oleh cairan urin yang keluar bersamaan dengan sperma, akibatnya kemampuan jelajah dan waktu hidup sperma menjadi lebih rendah. Hal ini sesuai dengan pernyataan Trippel (2003) bahwa kemampuan fertilisasi induk jantan terhadap telur sangat dipengaruhi oleh kualitas sperma. Nilai kelangsungan hidup yang didapat dalam penelitian ini (37.21-51.96%) lebih tinggi dibandingkan hasil penelitian Sembiring (2011) sebesar 28.47% pada umur pengamatan 13 hari. Tingkat kelangsungan hidup yang rendah pada penelitian ini dapat diakibatkan oleh faktor eksternal, yaitu ketersediaan pakan bagi larva, kualitas air dan lingkungan, serta kualitas telur yang digunakan.
Viabilitas sperma tertinggi didapat pada perlakuan kontrol, selanjutnya menurun pada setiap perlakuan yang diberikan. Efek voltase dan jumlah kejut listrik yang diberikan memberikan pengaruh yang sejalan terhadap viabilitas sperma ikan betok. Peningkatan voltase dan jumlah kejut yang diberikan saling berinteraksi menurunkan tingkat motilitas dan viabilitas sperma (p<0.05). Hal tersebut serupa dengan pernyataan Sin (2000) yang menyatakan bahwa motilitas sperma ikan merupakan ukuran dari kelangsungan hidup sperma akibat elektroporasi, semakin tinggi tegangan dan lama waktu papar kejutan akan menurunkan motilitas sperma. Pada penelitian ini perlakuan voltase 50 volt dan jumlah kejut 1 kali tidak memberikan perbedaan yang signifikan terhadap perlakuan kontrol pada parameter motilitas dengan nilai skor 5 dan viabilitas sperma sebesar 99.00±0.00%. Keberhasilan fertilisasi sperma pascaelektroporasi sangat dipengaruhi oleh kemampuan motilitas sperma tersebut, terdapat korelasi positif terkait kemampuan DNA asing masuk dan berintegrasi dengan inti sperma dengan kualitas semen dan tingkat motilitas sperma. Untuk itu diperlukan progresivitas sperma paling tidak 80% dan tidak boleh lebih kecil dari 65% (Livitrano et al. 2006). Selain itu sperma dalam kondisi motil akan lebih mampu mengikat DNA asing yang ditransfer hingga mencapai 30% dari keseluruhan sperma (Sin et al. 2000).
18
5
KESIMPULAN DAN SARAN
Kesimpulan
Penelitian ini telah berhasil mengidentifikasi karakter morfologi dan fisiologi sperma ikan betok. Sperma ikan betok terdiri dari tiga bagian utama yaitu kepala, bagian tengah dan ekor sperma. Ukuran panjang total, panjang kepala, panjang bagian tengah, dan panjang ekor adalah berturut-turut 35.54±4.66 µm; 1.83±0.20 µm; 0.93±0.23 µm; dan 33.05±1.40 µm, sedangkan lebar kepala sebesar 1.48±0.21 µm. Total estimasi durasi pergerakan sperma dalam air adalah selama 116±34 detik. Tingkat osmolaritas tubuh dan testis ikan betok berkisar antara 390-405 mOsmol/kg, setara dengan osmolaritas larutan NaCl 13 g/L (407 mOsmol/kg). Larutan fisiologis NaCl 13 g/L efektif dalam preservasi sperma jangka pendek (maks 60 menit) pada suhu ruang (26°C) dan suhu dingin (4 °C), sedangkan penyimpanan yang dilakukan tanpa pengenceran dapat bertahan selama 360 menit pada suhu ruang (26 °C). Viabilitas dan motilitas sperma ikan betok sangat dipengaruhi oleh tingginya tegangan kejut serta jumlah kejut listrik yang diberikan, kedua faktor saling berinteraksi (p<0.05). Voltase 50 volt dan jumlah kejut 1 kali tidak memberikan perbedaan yang signifikan terhadap perlakuan kontrol (p<0,05). Metode kejut tersebut berpotensi digunakan sebagai metode kejut listrik terhadap sperma ikan betok untuk memperoleh ikan transgenik melalui metode elektroporasi.
Saran
19
DAFTAR PUSTAKA
[RSNI] Badan Standarisasi Nasional. 2014. Produksi ikan papuyu/betok Anabas testudineus, Bloch. 1792 ukuran konsumsi di kolam. RSNI3 8002:2014.
Affandi R, Tang UM. 2002. Fisiologi hewan air. Riau (ID): UNRI press.
Akbar UF. 2014. Kajian kualitas spermatozoa ikan tawes Barbonymus gonionotus, Bleeker 1849) yang berasal dari dua kolam budidaya berbeda. [Skripsi]. Departemen Manajemen Sumberdaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Alavi SMH, Cosson J. 2005. Sperm motility in fishes. I. Effects of temperature and pH: A review. Cell Biology International, 29: 101-110.
Alavi SMH, Linhart O, Coward K, Rodina M. 2007. Fish spermatology: implications for aquaculture management. In Fish spermatology. Edited by
Alavi SMH, Cosson JJ, Coward K, Rafiee G. Oxford: Alpha Science Ltd.; p. 397–460.
Alavi SMH, Psenicka M, Policar T, and Linhart O. 2008. Morphology and fine structure of Barbus barbus Teleostei: Cyprinidae spermatozoa. Journal of Applied Ichthyology, 24: 378–381.
Alavi SMH, Rodina M, Viveiros ATM, Cosson J, Gela D, Boryshpolets S, Linhart O. 2009. Effects of osmolality on sperm morphology, motility and flagellar wave parameter in Northern pike Esox lucius L.; Theriogenology, 72(1): 32–43. Alavi SMH, Butts IAE, Hatef A, Mommens M, Trippel EA, Litvak MK, Babiak I.
2011. Sperm morphology, ATP content, and analysis of motility in Atlantic halibut Hippoglossus hippoglossus. Canadian Journal of Zoology, 89: 219-228. Arezzo F. 1989. Sea urchin sperm as vector for foreign genetic information. Cell
Biology International Reports, 13: 391-404.
Asturiano JF, Pérez L, Garzón DL, Marco-Jiménez F, Peñaranda DS, Vicente JS, Jover M. 2004. Physio-chemical characteristics of seminal plasma and development of media and methods for the cryopreservation of European eel sperm. Fish Physiology and Biochemistry, 30: 283–293.
Bacceiti B, Burrini AG, Callaini G, Gibertini G, Mazzini M, Zerunian S. 1984. Fish germinal cells. I. Comparative spermatology of seven cyprinid species. Gamete Research, 10: 373-396.
Billard R, Cosson J, Crim LW, Suquet M. 1995. Sperm physiology and quality. In
Brood stock management and egg and larval quality. Edited by Bromage NR, Roberts RJ. Amsterdam: Blackwell Science, p. 25–52.
Billard R, Cosson MP. 1992. Some problems related to the assessment of sperm motility in fresh-water fish. Journal of Experimental Zoology, 261(2): 122–131. Bobe J, Labbe C. 2010. Egg and sperm quality in fish. General and Comparative
Endocrinology, 165: 535–548.
Brackett BG, Baranaska W, Sawiicki W, Koprosky. 1971. Uptake of heterologous genome by mammalian spermatozoa and its transfer to ova through fertilization.
Proceedings of the National Academy of Sciences, USA 68: 353-357.
20
Collas P, Husebeye H, Alestrom P. 2000. Transferring foreign genes into zebrafish eggs by microinjection. Transgenic Animal: Generation and Use. p. 119-122. Cook JT, McNiven MA, Sutterlin AM. 2000. Metabolic rate of pre-smolt
growth-enhanced transgenic Atlantic salmon Salmo salar. Aquaculture 188: 33-45. Cosson J. 2004. The ionic and osmotic factors controlling motility of fish
spermatozoa. Aquaculture International, 12: 69-85.
de Graaf GJ. 2003. Water management and the rift of larval fish in the flood plains of Bangladesh. Practical Experiences of the Compartment Alization Pilot Project
with “Fish Friendly” Regulators. Ecological Research, 36: 100-106.
Devlin RH, Yesaki TY, Donaldson EM, Du SJ, Hew CL. 1995. Production of germline transgenic Pacific salmonids with dramatically increased growth performance. Canadian Journal of Fisheries Aquatic Sciences, 52: 1376-1384. Dunham RA. 2004. Aquaculture and Fisheries Biotechnology: Genetic Approaches.
CABI Publishing. Cambridge, MA, USA.
Effer B, Figueroa E, Augsburger A, Valdebenitbbo I. 2013. Sperm biology of
Merluccius australis: Sperm structure, semen characteristics and effects of pH, temperature and osmolality on sperm motility. Aquaculture, 408–409: 147–151. Faqih AR. 2011. Studi Rekayasa Genetik Melalui Elektroporasi DNA pada Sperma dalam Pembuatan Ikan Transgenik Air Tawar. [Disertasi]. Program Studi Ilmu-Ilmu Pertanian. Minat Bioteknologi. Program Pascasarjana. Universitas Brawijaya, Malang.
Faridah N. 2012. Introduksi dan Ekspresi Gen Hormon Pertumbuhan pada Ikan Mas Transgenik. [Tesis]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Fletcher GL, Davies PL. 1991. Transgenic fish for aquaculture. Genetic Engineering, 13: 331-371.
Guest WC, Avault JW, Rousel JA. 1976. Spermatogeny study of channel catfish
Ictalurus punctatus. Transactions of the American Fisheries Society, 105: 463-468.
Hafez ESE. 1987. Semen Evaluation. In Hafez ESE (Ed.). Reproduction in Farm Animals. Lea and Febiger. Philadelphia.
Hardita AG. 2010. Evaluasi kualitas dan kuantitas sperma ikan gurame
Osphronemus gouramy dengan penyuntikan ovaprim pada tingkatan dosis yang berbeda. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Hinits Y, Moav B. 1999. Growth performance studies in transgenic Cyprinus carpio. Aquaculture, 173: 285-296.
Hoar WSDJ, Randal, Donalsoan EM. 1971. Fish Physiology. Volume IX. PartB. Academic Press Inc. London.
Japet N. 2011. Karakteristik semen ikan ekonomis budidaya: mas Cyprinus carpio, dan patin Pangasius hypophthalmus. [Skripsi]. Departemen Manajemen Sumberdaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Kang KH, Shao MY, Kho KH, Zhag ZF. 2004 Short-term storage and cryopreservation of Urechis unicinctus (Echlua: Urechidae) sperm. Aquaculture Research, 35: 1195-1201.
over-21 expressing growth hormone show reduced ammonia excretion. Aquaculture, 270: 427-435.
Kowalski RK, Hliwa P, Cejko BI, Krol J, Stabinski R, Ciereszko A. 2012. Quality and quantity of smelt Osmerus eperlanus L. sperm in relation to time after hormonal stimulation. Society for Biology of Reproduction, 12(2): 231-246. Labbe C, Crowe LM, Crowe JH. 1997. Stability of the lipid component of trout
sperm plasma membrane during freeze–thawing. Cryobiology, 34: 176–182. Lahnsteiner F, Berger B, Weismann T, Patzner RA. 1995. Fine structure and
motility of spermatozoa and composition of the seminal plasma in the perch.
Journal of Fish Biology, 47: 492–508.
Lahnsteiner F. Patzner RA. 2007. Sperm morphology and ultrastructure in fish. In
Fish spermatology. Edited by Alavi SMH, Cosson J, Coward K, Rafiee G. Alpha Science International Ltd, Oxford. p. 1–61.
Lavitrano M, Camaioni A, Faizo V, Dolci S, Farace MG, Spadafora C. 1989. Sperm cells as vectors of foreign DNA: genetic transformation of mice. Cell, 57: 717-723.
Livitrano M, Marcho B, Maria GC, Roberto G, Stefano M, Alessia. 2006. Sperm mediated gene transfer, reproduction, fertility and development. CSIRO Publising. 18: 19-23.
Lim HK, Pankhurst NW, Fitzgibbon QP. 2004. Effects of slow release gonadotropin releasing hormone analog on milt characteristics and plasma levels of gonadal steroids in greenback flounder Rhombosolea tapirina. Aquaculture, 240: 505-516.
Linhart O, Walford J, Sivaloganathan B, Lam TJ. 1999. Effects of osmolarity and ions on the motility of stripped and testicular sperm of freshwater and sea-water-acclimated tilapia Oreochromis mossambicus. Journal of Fish Biology, 55: 1344-1358.
Litvak MK, Trippel EA. 1998. Sperm motility patterns of Atlantic cod Gadus morhua in relation to salinity: effects of ovarian and egg presence.
CanadianJournal of Fisheries and Aquatic Sciences, 55: 1871-1877.
Lu JK, Fu BH, Wu JL, Chen TT. 2002. Production of transgenic silver sea bream
Sparus sarba by different gene transfer methods. Marine Biotechnology, 4: 328-337.
Maria AN, Azevedo HC, Santos JP, Carneiro PCF. 2010. Hormonal induction and semen characteristics of tambaqui Colossoma macropomum. Zygote, Cambridge University Press. p. 1-5.
Mattei X. 1991. Spermatozoon ultrastructure and it’s systematic implication in fishes. Canadian Journal of Zoology, 69: 3038-3055.
Maulana F. 2012. Pertumbuhan dan kelangsungan hidup benih ikan betok (Anabas testudineus Bloch.) yang diberi hormon pertumbuhan rekombinan (rHP) melalui rotifera air tawar Brachionus sp.; [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Morisawa M. 1985. Initiation mechanism of sperm motility at spawning in teleosts.
Zoological Science, 2: 605–615.
Morisawa S. 2001. Ultrastructural studies of late-stage spermatids and mature
spermatozoa of the pufferfish Takifugu niphobles (tetraodontiformes) and the
22
Nagahama Y. 1994. Endocrine regulation of gametogenesis in fish. International Journal ofDevelopmental Biology, 38: 217-229.
Nam YK, Noh JK, Cho YS, Cho KN, Kim CG, Kim DS. 2001. Dramatically accelerated growth and extraordinary gigantism of transgenic mud loach
Misgurmus mizolepis. Transgenic Research, 10: 353-362.
Pardo-Carrasco SC, Zaniboni-Filho E, Arias-Castellanos J, Suarez-Mahecha H, Atencio-Garcia VJ, Cruz-Casallas PE. 2006. Evaluation of milt quality of the yamu Brycon amazonicus under hormonal induction. Revista Colombiana de Ciencias Pecuarias, 19: (2) 134-139.
Pérez L, Asturiano JF, Martínez S, Tomás A, Olivares L, Mocé E, Lavara R, Vicente JS, Jover M. 2003. Ionic composition and physio-chemical parameters of the European eel Anguilla anguilla seminal plasma. Fish Physiology and Biochemistry, 28: 221–222.
Psenicka M, Rodina M, Nebesarova J, Linhart O. 2006. Ultrastructure of spermatozoa of tech Tinca tinca observed by means of scanning and transmission electron microscopy. Theriogenology, 66: 1355–1363.
Rakitin A, Ferguson MM, Trippel EA. 1999. Spermatocrit and spermatozoa density in Atlantic cod Gadus morhua: correlation and variation during the spawning season. Aquaculture, 170: 349-358.
Schiavonea R, Zillia L, Vilellaa S, Fauvelb C. 2006. Human chorionic gonadotropin induces spermatogenesis and spermiation in 1-year-old European sea bass
Dicentrarchus labrax: Assessment of sperm quality. Aquaculture, 255(1-4): 522-531.
Seifi T, Imanpoor MR, Golpour A. 2011. The effect of diferent hormonal treatment on semen quality parameter in cultured and wild carp. Turkish Journal of Fisheries and Aquatic Sciences, 11: 595-602.
Sembiring APV. 2011. Pertumbuhan dan kelangsungan hidup larva ikan betok
Anabas testudineus pada pH 4, 5, 6, dan 7. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Sin FYT, Walker SP, Symonds JE, Mukherjee UK, Khoo JGI, Sin IL. 2000.
Electroporation of salmon sperm for gene transfer: efficiency, reliability, and fate of transgene. Molecular ReproductionandDevelopment, 56: 285-288. Steel RGD, Torrie JH. 1993. Prinsip dan Prosedur Statistika (Pendekatan
Biometrik) Penerjemah Sumantri B. Gramedia Pustaka Utama, Jakarta.
Subyakto S. 2010. Efektifitas dan efisiensi transfeksi, mikroinjeksi, dan elektroporasi untuk transfer gen hormon pertumbuhan pada ikan kerapu tikus
Chromileptes altivelis. [Disertasi]. Program Studi Ilmu-Ilmu Pertanian. Minat Lingkungan Pesisir dan Kelautan. Program Pascasarjana. Universitas Brawijaya, Malang. 110hal
Sukumasavin N. 2007. Fish reproduction. Advanced Freshwater Aquaculture: Fish Reproduction, 132-159.
Symonds JE, Walker SP, Sin FYT. 1994. Development of mass gene transfer method in chinook salmon: optimization of gene transfer by electroporated sperm. Molecular Marine Biology and Biotechnology, 3: 104-111.
23 Trippel EA. 2003. Estimation of male reproductive success of marine fishes.
Journal of Northwest Atlantic Fishery Science, 33: 81–113.
Tvedt HB. Benfey TJ. Martin-Robichaud DJ. Power J. 2001. The relationship between sperm density, spermatocrit, sperm motility and fertilization success in halibut Hippoglossus hippoglossus. Aquaculture, 194: 192-200.
Widodo P, Bunasir, Fauzan G, Syafrudin. 2007. Kaji terap pembesaran ikan papuyu
Anabas testudineus Bloch. dengan pemberian kombinasi pakan pelet dan keong mas dalam jaring tancap di perairan rawa. Pp 1-26. Balai Budidaya Air Tawar Mandiangin. Banjarmasin: Direktorat Jenderal Perikanan Budidaya. Departemen Kelautan dan Perikanan.
24
25 Lampiran 2 Kriteria penilaian motilitas spermatozoa (Guest et al. 1976)
Kriteria Skor
>70% spermatozoa bergerak cepat dengan arah maju dengan pergerakan ekor bervariasi
5,0 55-70% spermatozoa bergerak maju dan beberapa menunjukkan
gerakan cepat
4,0 40-55% spermatozoa bergerak maju dan beberapa menunjukkan
gerakan cepat
3,0 25-40% spermatozoa menunjukkan gerakan arah maju 2,0 10-25% spermatozoa menunjukkan gerakan arah maju 1,0 1-10% spermatozoa bergerak maju, kebanyakan spermatozoa tidak
bergerak
0,5
26
Lampiran 3 Grafik hubungan tingkat salinitas NaCl analitik (g/L) dan osmolaritas larutan
y = 30,045x + 4,5779 R² = 0.999
0 100 200 300 400 500 600 700
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
Osm
o
lari
ta
s
(m
Osm
o
l/K
g
)